Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ОМЕПРАЗОЛА
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к твердой фармацевтической композиции для перорального введения, содержащей таблетки омепразола.
УРОВЕНЬ ТЕХНИКИ
Омепразол или 5-метокси-2-(4-метокси-3,5-диметилпиридин-2-илметилсульфинил)-1Н-бензимидазол (продаваемый в Европе под товарным знаком Losec®) является замещенным бензимидазолом, который ингибирует секрецию желудочной кислоты. Эмпирическая формула омепразола - С17Н19N3O3S, и соединение имеет молекулярную массу 345,41. Структурная формула омепразола (I)
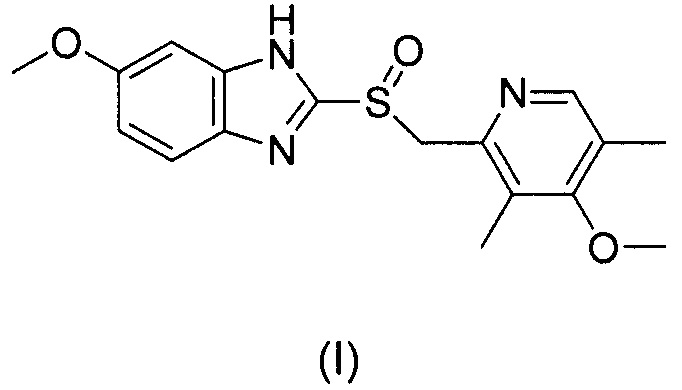
Омепразол представляет собой кристаллический порошок белого или почти белого цвета, который плавится с разложением при около 155°С. Это слабое основание легко растворимое в этаноле и метаноле и слабо растворимое в ацетоне и изопропаноле и очень слабо растворимое в воде. Стабильность омепразола является функцией рН, он быстро разлагается в кислой среде, но приемлемо устойчив в щелочных условиях.
Омепразол принадлежит к классу антисекреторных соединений, называемых ингибиторами протонного насоса ("PPIs"), которые назначают, наряду с прочим, для краткосрочного лечения активных язв двенадцатиперстной кишки, желудочных язв, гастро-эзофагальной рефлюксной болезни (ГЭРБ), тяжелого эрозийного эзофагита, плохо поддающегося лечению систематического ГЭРБ и патологических гиперсекреторных состояний, таких как синдром Золлингера-Эллисона.
PPIs, однако подвержены разложению/превращению в кислой и нейтральной среде. Разложение катализируется кислотными соединениями и стабилизируется в смесях с щелочными соединениями. На стабильность активных веществ влияет также влага, тепло, органические растворители и до некоторой степени свет.
Что касается свойств стабильности активных веществ, известно, что оральная дозированная форма должна быть защищена от контакта с кислым желудочным соком или должна содержать подходящие компоненты для нейтрализации кислого желудочного сока с тем, чтобы активное вещество могло быть перенесено в исходном состоянии в ту часть желудочно-кишечного тракта, где рН близок к нейтральному и где может происходить быстрая абсорбция.
Таким образом, в фармацевтической оральной дозированной форме омепразол наилучшим образом защищен от контакта с кислым желудочным соком, когда указанная дозированная форма содержит слой растворимого в кишечнике покрытия. Широко применяемые твердые дозированные формы для перорального введения представляют собой капсулы и таблетки, содержащие множество пеллетов активного ингредиента с растворимым в кишечнике покрытием. Например, ЕР 1086694 А2 раскрывает твердый фармацевтический состав модифицированного высвобождения, содержащий множество пеллетов, которые содержат в качестве активного ингредиента нестойкое к кислоте соединение бензимидазола и один или несколько промежуточных слоев, которые содержат по меньшей мере систему замедленного высвобождения, и внешнее растворимое в кишечнике покрытие. Массовая относительная доля соединения бензимидазола (или особенно омепразола), используемого в оральных твердых фармацевтических композициях ЕР 1086694 А2, по большей части равна от около 6 до около 9% по массе пеллеты.
Несмотря на эти данные, было бы очень желательно предоставить новые содержащие омепразол дозированные формы, в которых омепразол был бы представлен в высокой концентрации, в частности оральные твердые фармацевтические композиции, содержащие пеллеты концентрата омепразола. Такая разновидность фармацевтической композиции выгодна, так как для нее требуется меньшее число пеллет и/или более мелкие пеллеты, что позволяет уменьшить количество наполнителей, а также состава в более мелких дозированных формах (таких как капсулы ограниченного размера). Предпочтительно, все это имело бы результатом как экономические (более дешевая стоимость состава, упаковки, хранения, транспортировки и т.п.), так и практические преимущества (больше гибкости в приготовлении состава или облегчение его приготовления, усовершенствование производственных мощностей. К тому же, такая фармацевтическая композиция будет иметь преимущество для пациентов с трудностями глотания, таких как пожилые люди и дети, улучшая соблюдение лечения или приемлемость для указанных пациентов. Конечно, такие новые формы должны обладать также подходящей стойкостью в желудке.
Следовательно, все еще есть потребность в дополнительных дозированных формах омепразола, показывающих высокую концентрацию этого активного ингредиента, проявляющих в то же время хорошую физико-химическую стойкость.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы данного изобретения неожиданно разработали пеллеты концентрата омепразола, дающие возможность получать оральную твердую фармацевтическую композицию, которая является химически и физически стойкой, имеет хорошую скорость растворения in vitro и требует капсул меньшего размера, чем продукт сравнения (Losec®).
В частности, один аспект данного изобретения относится к пеллете (также называемой здесь просто как пеллета по изобретению), которая содержит:
а) сердцевину, содержащую омепразол или его фармацевтически приемлемую соль,
b) по меньшей мере промежуточный слой и
с) слой растворимого в кишечнике покрытия, содержащий растворимый в кишечнике полимер,
и характеризуется тем, что массовая доля слоя растворимого в кишечнике покрытия находится между 5% (мас./мас.) и 40% (мас./мас.) по отношению к общей массе пеллеты, и где сердцевина (а) содержит инертное ядро, имеющее средний размер диаметра, лежащий между около 0,3 мм и 0,9 мм.
В более конкретном варианте осуществления данное изобретение относится к пеллете, которая содержит:
а) сердцевину, содержащую омепразол или его фармацевтически приемлемую соль,
b) по меньшей мере промежуточный слой и
с) слой растворимого в кишечнике покрытия, содержащий растворимый в кишечнике полимер,
и характеризуется тем, что массовая доля слоя растворимого в кишечнике покрытия находится между 20% (мас./мас.) и 40% (мас./мас.) по отношению к общей массе пеллеты, и где сердцевина (а) содержит инертное ядро, имеющее средний размер диаметра, лежащий между около 0,3 мм и 0,9 мм.
Преимущественно, пеллета по изобретению дает возможность получать фармацевтические композиции, в которых массовая относительная доля омепразола находится между 10% (мас./мас.) и 25% (мас./мас.) по отношению к общей массе пеллет, содержащихся в фармацевтической композиции.
В дополнительном аспекте данное изобретение относится к способу производства пеллеты, которая содержит:
а) приготовление сердцевины, содержащей омепразол или его фармацевтически приемлемую соль,
b) покрытие указанной сердцевины по меньшей мере промежуточным слоем и
с) покрытие указанного промежуточного слоя (слоев) слоем растворимого в кишечнике покрытия, содержащим растворимый в кишечнике полимер, в котором массовая доля слоя растворимого в кишечнике покрытия находится между 5% (мас./мас.) и 40% (мас./мас.) по отношению к общей массе пеллеты,
и где сердцевина содержит инертное ядро, имеющее средний размер диаметра, лежащий между около 0,3 мм и 0,9 мм.
Согласно другому аспекту изобретение относится к оральной твердой фармацевтической композиции (также называемой здесь просто как композиция по изобретению), содержащей пеллеты омепразола, которым дано определение в данном описании. Предпочтительно, пеллетами заполняют капсулу, в частности желатиновую капсулу.
В дополнительном аспекте данное изобретение относится к фармацевтической композиции, определение которой приведено в данном описании, для применения для лечения и/или профилактики желудочно-кишечного расстройства.
В дополнительном аспекте данное изобретение относится к применению фармацевтической композиции, определение которой приведено в данном описании, для получения медикамента для лечения и/или профилактики желудочно-кишечного расстройства.
Другой аспект данного изобретения относится к способу лечения и/или профилактики желудочно-кишечного расстройства, который (способ) содержит введение субъекту, нуждающемуся в таком лечении и/или профилактике, терапевтически эффективного количества фармацевтической композиции, описанной здесь.
В одном варианте осуществления фармацевтическая композиция по данному изобретению показана для лечения и/или профилактики язв желудка и двенадцатиперстной кишки и NSAID-индуцированных язв, гастро-эзофагальной рефлюксной болезни (ГЭРБ) (известной также как болезнь кислого рефлюкса), тяжелого эрозийного эзофагита, плохо поддающегося лечению систематического ГЭРБ и патологических гиперсекреторных состояний, таких как синдром Золлингера-Эллисона, и дополнительного лечения инфекции Helicobacter pylori наряду с антибиотиками или сочетаний каких-либо из указанных расстройств.
Указанные аспекты и предпочтительные варианты их осуществления также дополнительно охарактеризованы здесь далее в подробном описании, а также в формуле изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Техническая проблема данного изобретения заключается в том, чтобы предоставить альтернативную оральную твердую фармацевтическую композицию, содержащую пеллеты концентрата омепразола, которая является химически и физически стойкой, имеет хорошую скорость растворения in vitro, которая проявляет хорошую биодоступность и имеет результатом биоэквивалентность между испытуемым продуктом и продуктом сравнения.
Авторы изобретения неожиданно обнаружили, что оральная твердая фармацевтическая композиция, содержащая пеллеты концентрата омепразола и инертное ядро, имеющее средний размер диаметра, лежащий между около 0,3 мм и 0,9 мм, обеспечивает концентрированную оральную твердую фармацевтическую композицию пеллет омепразола, так что требуется меньшее число пеллет и/или более мелкие пеллеты, допуская таким образом состав в меньших дозированных формах. В дополнение к оптимальному профилю растворения состав по изобретению предоставляет преимущество проявления превосходной стабильности при хранении.
Авторы изобретения обнаружили, что при уменьшении размера и количества пеллет, которые должны быть использованы, и увеличении количества омепразола растворимое в кишечнике покрытие должно быть скорректировано, чтобы сохранять защитные свойства и профиль растворения. Согласно данному изобретению количество растворимого в кишечнике покрытия корректируют, и оно присутствует в пеллете по изобретению в количестве, лежащем между около 5% и 40%, предпочтительно между около 20% и 40% по массе пеллеты.
Кроме того, оральная фармацевтическая композиция по данному изобретению предоставляет преимущество в том, что она является рентабельной, так как требует меньшего числа пеллет и/или более мелких пеллет, таким образом делая возможным уменьшение количества наполнителей, а также состав в более мелких дозированных формах (таких как капсулы ограниченного размера) и также более дешевую стоимость упаковки.
В контексте данного изобретения следующие термины имеют значения, подробно изложенные ниже.
"Фармацевтически приемлемый", как, например, в выражениях "фармацевтически приемлемая соль" или "фармацевтически приемлемый наполнитель", означает в данном описании материал, который не является нежелательным ни биологически, ни иным образом, то есть материал может быть включен в фармацевтическую композицию, вводимую пациенту, не вызывая каких-либо нежелательных биологических эффектов или взаимодействия опасным образом с каким-либо из других компонентов композиции, в которой он содержится.
Термин "фармацевтически приемлемые соли" в контексте данного изобретения означает любую соль, которая является физиологически толерантной (обычно означая, что она не токсична, особенно, из-за противоиона), когда ее используют соответствующим образом для лечения, особенно, людей и/или млекопитающих. Примеры фармацевтически приемлемых солей омепразола включают соль с неорганическим основанием, соль с органическим основанием, соль с аминокислотой основного характера и тому подобное. Предпочтительные примеры соли с неорганическим основанием включают соли щелочных металлов, такие как соль натрия и соль калия, соли щелочноземельных металлов, такие как соль кальция и соль магния, соль аммония и тому подобное. Более предпочтительным примером является, в частности, соль магния.
Под термином "эквивалентность" или "биоэквивалентность" следует понимать следующее: два медицинских продукта, содержащие одно и то же активное вещество, считаются биоэквивалентными, если они являются фармацевтически эквивалентными или фармацевтическими альтернативами и их биодоступности (степень или пределы) после введения в одной и той же молярной дозе лежат в приемлемых предопределенных пределах (с интервалом 90-процентной достоверности отношения геометрического среднего между испытанием и сравнением в пределах 80,00 и 125,00 процентов). Указанные пределы установлены для гарантии сопоставимости характеристик in vivo, то есть подобия в смысле безопасности и эффективности. Смотри Guideline on the Investigation of Bioequivalence European Medicines Agency. Doc.Ref.:CPMP/QWP/EWP/1401/98 Rev.1.
Термин "более мелкая дозированная форма" в контексте данного изобретения означает более мелкий размер капсулы, чем тот, который мог бы получить специалист в этой области, применяя технологии существующего уровня техники, чтобы получить оральную твердую фармацевтическую композицию, имеющую более высокую концентрацию омепразола. Данное изобретение делает возможным состав в капсуле меньшего размера, в частности, данное изобретение делает возможным более мелкий размер капсул, чем продукт сравнения на рынке (Losec®).
Используемый в данном описании термин "около" означает небольшое изменение оговоренной величины, предпочтительно в пределах 10 процентов оговоренной величины. Тем не менее, термин "около" может означать более высокий допуск отклонения в зависимости от, например, применяемой экспериментальной методики. Указанные отклонения оговоренной величины понятны специалисту и находятся в контексте данного изобретения. Кроме того, для лаконичности описания некоторые количественные выражения, приведенные здесь, не определены термином "около". Понятно, что применяют ли термин "около" в явном виде или нет, каждое приведенное в данном описании количество означает, что относится к действительной данной величине, и также означает, что относится к аппроксимации к такой данной величине, которая обоснованно могла бы быть сделана на основе существующей практики, включая эквиваленты и аппроксимации, благодаря экспериментальным и/или измерительным условиям для такой данной величины.
Если не указано иное, все количества выражены в данном описании в процентах по массе. Массу пеллет следует понимать как сухую массу.
Пеллета - фармацевтическая композиция
Пеллеты по изобретению содержат омепразол или его фармацевтически приемлемую соль в качестве активного ингредиента и преимущественно изготовлены в многослойной форме, имеющей структуру сердцевина-оболочка, как известно из уровня техники. Так, предложенные пеллеты по существу содержат: а) сердцевину, b) один или несколько промежуточных слоев, расположенных поверх указанной сердцевины, и с) слой растворимого в кишечнике покрытия, расположенный поверх указанных промежуточных слоев.
Предпочтительно, ядро пеллет может быть сделано из инертной бусины, которую покрывают слоем, содержащим активный ингредиент и необязательно фармацевтически приемлемые наполнители. Ядро является инертным как по отношению к омепразолу, так и к другим наполнителям в пеллете, и по отношению к пациенту, который будет глотать пеллету. Такую инертную бусину обычно используют в фармацевтических технологиях. Бусина может быть получена из таких материалов, как, например, крахмал, сахароза, микрокристаллическая целлюлоза и тому подобное. Как отмечено выше, цель данного изобретения - получить мелкие дозированные формы омепразола, такие как капсулы. В этом контексте, с целью уменьшения размера капсулы, количество и размер инертных бусин должны быть определены, чтобы оценить общую поверхность, на которой слой омепразола формируют так, чтобы после добавления изолирующего слоя и растворимого в кишечнике слоя полученные пеллеты имели бы оптимальный размер для обычной дозировки капсулы. Средний размер диаметра, лежащий между около 0,3 мм и 0,9 мм, предпочтительно между около 0,5 мм и 0,9 мм, более предпочтительно между около 0,7 мм и 0,9 мм, еще более предпочтительно около 0,8 мм, был найден подходящим для инертных бусин по данному изобретению. В конкретном варианте осуществления инертная бусина (или ядро) присутствует в пеллете по изобретению в количестве, лежащем между около 20% и 50%, предпочтительно между 20% и 45%, по массе пеллеты. В некоторых предпочтительных вариантах осуществления инертная бусина присутствует в количестве, лежащем между около 20% и 35%, предпочтительно около 31%, по массе пеллеты. В других предпочтительных вариантах осуществления инертная бусина присутствует в количестве, лежащем между около 35% и 45%, предпочтительно около 40%, по массе пеллеты.
Количество активного ингредиента (то есть омепразола или его соли) может изменяться, например, от 10% до 25% по отношению к массе пеллеты. В особенности, как было обнаружено, предпочтительны количества от около 12% до 17% (мас./мас.). Слой, содержащий активный ингредиент (упоминаемый в данном описании как активный слой, пленочное покрытие 1 в примерах), может содержать наполнители, обычно используемые в фармацевтических составах, которые не взаимодействуют неблагоприятно с омепразолом и его солями. В предпочтительном варианте осуществления, сердцевина пеллет содержит инертную бусину, и указанная инертная бусина покрыта активным слоем, содержащим омепразол или его фармацевтически приемлемую соль и фармацевтически приемлемые наполнители, такие как по меньшей мере связующее. Примеры связующих включают, но без ограничения, гидроксипропилцеллюлозу (или НРС), гидроксипропилметилцеллюлозу (или НРМС или гипромеллозу), гидроксиэтилцеллюлозу, сахара (такие как сахароза, глюкоза и декстроза) или их сочетания. В дополнение к вышеупомянутому, активный слой может дополнительно содержать другие наполнители, такие как дезинтегрирующие добавки, агенты против прилипания, стабилизирующие агенты и тому подобное. Следующее является примерами применимых дезинтегрирующих добавок: крахмалы, такие как кукурузный или картофельный крахмал, модифицированные крахмалы (такие как натрий крахмал гликолят) и частично предварительно клейстеризованные крахмалы (такие как крахмал 1500), поливинилпирролидоны, включая модифицированные поливинилпирролидоны (такие как кросповидон, полимеризованный в условиях, которые промотируют поперечную сшивку), целлюлозы, такие как микрокристаллическая целлюлоза, модифицированные целлюлозы (такие как гидроксипропилцеллюлоза с низкой степенью замещения, кроскармеллоза натрий и кальций карбоксиметилцеллюлоза). В качестве стабилизирующих агентов могут быть использованы щелочные соединения, такие как дигидрат динатрий фосфата, карбонат магния или карбонат натрия. Примером агента против прилипания является тальк.
В более предпочтительном варианте осуществления, пеллета по изобретению содержит сердцевину, содержащую омепразол или его фармацевтически приемлемую соль, связующее, стабилизирующий агент и агент против прилипания.
В еще более предпочтительном варианте осуществления, пеллета по изобретению содержит сердцевину, содержащую омепразол или его фармацевтически приемлемую соль, гидроксипропилметилцеллюлозу, дигидрат динатрий фосфата и тальк.
Пеллеты по отдельности покрыты одним или несколькими растворимыми в кишечнике слоями. Перед нанесением слоя (слоев) растворимого в кишечнике покрытия указанные пеллеты покрывают одним или, необязательно, несколькими промежуточными слоями, содержащими фармацевтические наполнители. Этот (эти) промежуточный слой (слои) отделяет сердцевину, содержащую активный слой омепразола, от внешнего слоя (слоев), который является слоем (слоями) растворимого в кишечнике покрытия.
Промежуточный слой (слои) может быть нанесен на активный слой путем процедур покрытия или наслаивания в подходящем оборудовании, таком как глазировочный аппарат, глазировочный гранулятор, или в аппарате с псевдоожиженным слоем с использованием воды и/или органических растворителей для процесса покрытия. В качестве альтернативы, разделяющий слой (слои) может быть нанесен на активный слой с применением технологии порошкового покрытия. Материалами для разделяющих слоев являются фармацевтически приемлемые наполнители, такие как, например, связующие (например, гидроксипропилцеллюлоза или НРС, гидроксипропилметилцеллюлоза или НРМС или гипромеллоза, гидроксиэтилцеллюлоза), сахара (такие как сахароза, глюкоза и декстроза), дезинтегрирующие добавки (например, кукурузный или картофельный крахмал, натрий крахмал гликолят, поливинилпирролидоны, включая модифицированные поливинилпирролидоны, такие как кросповидон, полимеризованный в условиях, которые промотируют поперечную сшивку, целлюлозы, такие как микрокристаллическая целлюлоза, модифицированные целлюлозы, такие как гидроксипропилцеллюлоза с низкой степенью замещения, кроскармеллоза натрий и кальций карбоксиметилцеллюлоза, поверхностно-активные вещества (например, полисорбаты, натрий лаурилсульфат), пластификаторы (полиэтиленгликоль, ацетилированный моноглицерид, триацетин, касторовое масло и тому подобное), смазки (например, натрий стеарилфумарат, стеарат магния, гидрогенизированное растительное масло, стеариновая кислота, стеарат кальция, глицерил бегенат, натрий луарил сульфат), агенты против прилипания (например, тальк), красители (например, диоксид титана), используемые по отдельности или в смесях.
Промежуточный слой (слои) может улучшать химическую стойкость активного ингредиента и/или физические свойства фармацевтической композиции. Согласно конкретным вариантам осуществления, пеллеты по изобретению содержат один из следующих промежуточных слоев или оба:
- промежуточный слой, содержащий по меньшей мере связующее. Предпочтительно, эта разновидность промежуточного слоя содержит гидроксипропилметилцеллюлозу, тальк и диоксид титана, и/или
- промежуточный слой, содержащий нещелочной нерастворимый в воде полимер, такой как этилцеллюлоза (например, Surelease E-7-7050). Промежуточный слой предпочтительно дополнительно содержит инертный нещелочной растворимый в воде полимер, такой как гидроксипропилметилцеллюлоза (упоминаемая также как НРМС или гипромеллоза), для того чтобы сформировать систему модифицированного высвобождения.
Если присутствуют оба указанных промежуточных слоя, предпочтительно, чтобы промежуточный слой, содержащий нещелочной нерастворимый в воде полимер, располагался поверх (снаружи) другого промежуточного слоя. Однако порядок расположения указанных промежуточных слоев не ограничивается указанным размещением, и, следовательно, данное изобретение охватывает также пеллеты, имеющие промежуточный слой, содержащий по меньшей мере связующее, расположенный поверх промежуточного слоя, содержащего нещелочной нерастворимый в воде полимер.
Один или несколько слоев растворимого в кишечнике покрытия наносят на активный слой, покрытый промежуточным слоем (слоями), используя подходящую технологию покрытия. Материал слоя растворимого в кишечнике покрытия может быть диспергирован или растворен или в воде, или в подходящих органических растворителях. В качестве полимеров слоя растворимого в кишечнике покрытия может быть использовано одно или несколько из следующего, отдельно или в сочетании: например растворы или дисперсии сополимеров метакриловой кислоты, полисорбаты, ацетат фталат целлюлозы, фталат гидроксипропилметилцеллюлозы, ацетат сукцинат гидроксипропилметилцеллюлозы, поливинил ацетат фталат, ацетат тримеллитат целлюлозы, карбоксиметилэтилцеллюлоза, шеллак или другой подходящий полимер(ы) слоя растворимого в кишечнике покрытия. Покрытия на основе метакрилата предпочтительны, и некоторые применимые продукты коммерчески доступны от Rohm GmbH & Co., Darmstadt, Germany под товарным знаком EUDRAGIT. EUDRAGIT L30D-55 является особенно предпочтительным. EUDRAGIT L30D-55 представляет собой водную дисперсию рН-зависимого полимера, растворимого при рН 5,5 или выше, для направленной доставки в двенадцатиперстную кишку. Сополимер метакриловой кислоты EUDRAGIT L30D-55 является сополимером метакриловой кислоты и этилакрилата в соотношении 1:1 и имеет формулу (С5Н2О2⋅С4Н6О2)х.
Слои растворимого в кишечнике покрытия могут дополнительно содержать фармацевтически приемлемые пластификаторы для достижения желательных механических свойств, таких как гибкость и твердость, слоев растворимого в кишечнике покрытия. Такими пластификаторами являются, например, но без ограничения, триацетин, сложные эфиры лимонной кислоты, сложные эфиры фталевой кислоты, дибутил себакат, цетиловый спирт, полиэтиленгликоли, полисорбаты или другие пластификаторы. Агенты против прилипания, такие как, например, стеарат магния, диоксид титана, тальк и другие добавки, также могут быть включены в состав слоя (слоев) растворимого в кишечнике покрытия, диоксид титана и/или тальк предпочтительны.
Как указано выше, нерешенной проблемой PPls является то, как избежать переноса протонов из внешней среды при рН кислоты к сердцевине, которая содержит нестойкое к кислоте соединение.
Так, чтобы обеспечить подходящий состав нестойких к кислоте соединений, существует необходимость исключить перенос протонов из внешней среды к сердцевине, так как эта миграция будет отрицательно влиять на стабильность API's. В этом смысле, ЕР 1086694 А2 раскрывает пеллеты бензимидазола, имеющие растворимое в кишечнике покрытие в количестве в пределах 10-15%. Однако авторы изобретения обнаружили, что при уменьшении размера и количества пеллет, которые должны быть использованы, и увеличении количества омепразола растворимое в кишечнике покрытие должно быть скорректировано, чтобы сохранять защитные свойства и профиль растворения. Согласно данному изобретению, количество растворимого в кишечнике покрытия корректируют, и оно присутствует в пеллете по изобретению в количестве, лежащем между около 5% и 40% по массе пеллеты. В конкретном варианте осуществления нижнее количество растворимого в кишечнике покрытия в указанных пределах может быть предпочтительно выбрано из 6%, 7%, 8%, 9% или 10%, таким образом более предпочтительные пределы выбирают из диапазона между около 6% до 40%, 7% до 40%, 8% до 40%, 9% до 40% или 10% до 40% по массе пеллеты. В частности, количества от около 20% до 40% (мас./мас.) были найдены предпочтительными в некоторых вариантах осуществления, и более предпочтительно количество растворимого в кишечнике покрытия находится между около 25% и 35% по массе пеллеты, например около 31%. В других предпочтительных вариантах осуществления, количество растворимого в кишечнике покрытия находится между около 5% и 20% по массе пеллеты и более предпочтительно количество растворимого в кишечнике покрытия находится между около 7% и 17% по массе пеллеты, например около 10%, около 13% или около 16%.
В конкретном варианте осуществления растворимое в кишечнике покрытие содержит (i) растворимый в кишечнике полимер, такой как сополимер метакрилата, (ii) пластификатор, такой как триэтил цитрат, и (iii) агент против прилипания, такой как тальк. В более предпочтительном варианте осуществления, пеллета по изобретению содержит сополимер метакриловой кислоты (EUDRAGIT L30D-55), триэтил цитрат и тальк.
В более предпочтительном варианте осуществления, пеллета по изобретению содержит:
а) сердцевину, содержащую омепразол или его фармацевтически приемлемую соль, гидроксипропилметилцеллюлозу, дигидрат динатрий фосфата и тальк,
b) промежуточный слой, содержащий гидроксипропилметилцеллюлозу, тальк и диоксид титана,
с) необязательно другой промежуточный слой, содержащий этилцеллюлозу и гидроксипропилметилцеллюлозу, и
d) слой растворимого в кишечнике покрытия, содержащий сополимер метакриловой кислоты (например EUDRAGIT L30D-55), триэтил цитрат и тальк.
Дополнительно фармацевтическая композиция по изобретению может быть в виде прессованной дозированной формы, такой как таблетка или, в качестве варианта, пеллеты могут быть помещены в капсулы или саше. Предпочтительно, фармацевтическую композицию по изобретению предоставляют в форме капсул, например мягких или твердых желатиновых или нежелатиновых капсул. Нежелатиновыми капсулами являются, например, капсулы, изготовленные из растительных полисахаридов или их производных (типа карагенанов и модифицированных форм крахмала и целлюлозы).
В предпочтительном варианте осуществления, капсула дополнительно содержит смазку, которая предпочтительно выбрана из стеарилфумарата натрия, стеарата магния, гидрогенизированного растительного масла, стеариновой кислоты, стеарата кальция, глицерил бегената, натрий лаурил сульфата и талька, последний предпочтителен. Может быть также использовано сочетание указанных смазок. Обычно смазка (смазки) присутствует в количестве менее чем 1% по массе по отношению к сумме масс пеллет и смазки (смазок).
В дополнительном предпочтительном варианте осуществления, преимущества, указанные выше для компонентов пеллет, объединяют. Данное изобретение относится также к таким сочетаниям предпочтительных компонентов в пеллете.
Способ
Способ получения пеллеты является дополнительным аспектом изобретения. Указанные составы следует получать, используя стандартные методы, такие как описанные или упомянутые в Фармакопеях Европы и США и подобной справочной информации. Фармацевтические способы предпочтительно могут быть полностью на водной основе, и их различные описания приведены ниже в прилагаемых примерах.
В конкретном варианте осуществления, способ получения пеллеты по изобретению содержит стадии:
а) приготовление сердцевины, содержащей омепразол или его фармацевтически приемлемую соль.
b) покрытие указанной сердцевины по меньшей мере промежуточным слоем и
с) покрытие указанного промежуточного слоя слоем растворимого в кишечнике покрытия, содержащим растворимый в кишечнике полимер.
Как было предварительно описано, по меньшей мере промежуточный слой может быть выбран соответственно конкретному варианту осуществления из промежуточного слоя, содержащего по меньшей мере связующее, промежуточного слоя, содержащего нещелочной нерастворимый в воде полимер и обоих слоев в любом расположении.
Применение фармацевтической композиции
Фармацевтическая композиция по изобретению особенно полезна для снижения секреции желудочной кислоты.
В дополнительном аспекте данное изобретение относится к способу лечения желудочно-кишечного расстройства. Способ предусматривает стадию введения пациенту при необходимости такого лечения (особенно человеку) терапевтически эффективного количества фармацевтической композиции, раскрытой в данном описании. Желудочно-кишечные расстройства, которые можно лечить с применением раскрытого в данном описании способа, включают, но без ограничения указанным, язвы желудка и двенадцатиперстной кишки и NSAID-индуцированные язвы, гастро-эзофагальной рефлюксной болезни (ГЭРБ) (известной также как болезнь кислого рефлюкса), тяжелый эрозийный эзофагит, плохо поддающийся лечению систематический ГЭРБ, патологические гиперсекреторные состояния, таких как синдром Золлингера-Эллисона, и дополнительное лечение инфекции Helicobacter pylori наряду с антибиотиками или сочетания каких-либо из указанных расстройств.
В одном варианте осуществления, фармацевтическая композиция по изобретению особенно показана для краткосрочного лечения активной язвы двенадцатиперстной кишки, уничтожения H. pylori для снижения риска повторения язвы двенадцатиперстной кишки, поддержания излеченных язв двенадцатиперстной кишки, для краткосрочного лечения активной доброкачественной желудочной язвы, излечения связанной с NSAID желудочной язвы, снижения риска связанной с NSAID желудочной язвы, для краткосрочного лечения гастро-эзофагальной рефлюксной болезни (ГЭРБ), поддержания излечения эрозийного эзофагита (ЕЕ), для долгосрочного лечения патологических гиперсекреторных состояний, включая синдром Золлингера-Эллисона (ZES).
Как правило, эффективное вводимое количество омепразола будет зависеть от тяжести расстройства, подвергаемого лечению, и массы пациента. Однако фармацевтическую композицию по изобретению обычно следует вводить один или несколько раз в сутки, например 1, 2, 3 или 4 раза в сутки с обычными суммарными суточными дозами омепразола в пределах от 10 до 200 мг, например 10, 20 или 40 мг.
Следующие примеры являются только пояснением конкретных вариантов осуществления изобретения и не должны рассматриваться как ограничение в той или иной форме.
Примеры
Пеллеты примеров 1-8 получали, следуя процедуре, описанной ниже.
1. FC 1 (пленочное покрытие № 1) получали следующим образом: необходимое количество омепразола, гипромеллозы, дигидрата динатрий фосфата и талька диспергировали в очищенной воде при постоянном перемешивании. Суспензию гомогенизировали и поддерживали при постоянном перемешивании, пока требовалось.
2. Инертные бусины покрывали распылением суспензии FC 1 в сушильном грануляторе с псевдоожиженным слоем. После напыления и перед нанесением второго слоя полученные сферы сушили.
3. FC 2 (пленочное покрытие № 2) получали диспергированием гипромеллозы, талька и диоксида титана в очищенной воде при постоянном перемешивании.
4. Покрытые FC 1 бусины дополнительно покрывали распылением суспензии FC 2. После напыления и перед нанесением следующего слоя полученные сферы сушили.
5. Необязательно, другой слой покрытия (FC 3 или пленочное покрытие № 3) после FC 2 получали, используя Surelease E-7-7050 (этилцеллюлоза), гипромеллозу и воду, указанное FC 3 последовательно напыляли на сферы перед нанесением растворимого в кишечнике пленочного покрытия.
6. Растворимое в кишечнике пленочное покрытие получали диспергированием сополимера метакриловой кислоты (Eudragit L30D-55), триэтилцитрата (Е-1505) и талька в очищенной воде при постоянном перемешивании. Суспензию гомогенизировали и поддерживали при постоянном перемешивании, пока это было необходимо.
7. Пеллеты стадии 4 или 5 покрывали распылением суспензии растворимого в кишечнике пленочного покрытия с помощью сушильного гранулятора с псевдоожиженным слоем.
8. И наконец, пеллеты сушили и просеивали.
ПРИМЕР 1
Пеллеты с замедленным высвобождением омепразола, содержащие растворимый в кишечнике слой сополимера метакриловой кислоты и промежуточный слой. Суспензию каждого пленочного покрытия (FC) получали и напыляли поверх предшествующего слоя в аппарате с псевдоожиженным слоем в соответствии со следующими компонентами:
|
ПРИМЕР 2
Пеллеты с замедленным высвобождением омепразола, содержащие растворимый в кишечнике слой сополимера метакриловой кислоты и промежуточный слой. Суспензию каждого пленочного покрытия (FC) получали и напыляли поверх предшествующего слоя в аппарате с псевдоожиженным слоем в соответствии со следующими компонентами:
|
ПРИМЕР 3
Пеллеты с замедленным высвобождением омепразола, содержащие растворимый в кишечнике слой сополимера метакриловой кислоты и промежуточный слой и другое покрытие, содержащее Surelease. Суспензию каждого пленочного покрытия (FC) получали и напыляли поверх предшествующего слоя в аппарате с псевдоожиженным слоем в соответствии со следующими компонентами:
|
ПРИМЕР 4
Пеллеты с замедленным высвобождением омепразола, содержащие растворимый в кишечнике слой сополимера метакриловой кислоты и промежуточный слой и другое покрытие, содержащее Surelease. Суспензию каждого пленочного покрытия (FC) получали и напыляли поверх предшествующего слоя в аппарате с псевдоожиженным слоем в соответствии со следующими компонентами:
|
ПРИМЕР 5
Пеллеты с замедленным высвобождением омепразола, содержащие растворимый в кишечнике слой сополимера метакриловой кислоты и промежуточный слой. Суспензию каждого пленочного покрытия (FC) получали и напыляли поверх предшествующего слоя в аппарате с псевдоожиженным слоем в соответствии со следующими компонентами:
|
ПРИМЕР 6
Пеллеты с замедленным высвобождением омепразола, содержащие растворимый в кишечнике слой сополимера метакриловой кислоты и промежуточный слой. Суспензию каждого пленочного покрытия (FC) получали и напыляли поверх предшествующего слоя в аппарате с псевдоожиженным слоем в соответствии со следующими компонентами:
|
ПРИМЕР 7
Пеллеты с замедленным высвобождением омепразола, содержащие растворимый в кишечнике слой сополимера метакриловой кислоты и промежуточный слой. Суспензию каждого пленочного покрытия (FC) получали и напыляли поверх предшествующего слоя в аппарате с псевдоожиженным слоем в соответствии со следующими компонентами:
|
ПРИМЕР 8
Пеллеты с замедленным высвобождением омепразола, содержащие растворимый в кишечнике слой сополимера метакриловой кислоты и промежуточный слой. Суспензию каждого пленочного покрытия (FC) получали и напыляли поверх предшествующего слоя в аппарате с псевдоожиженным слоем в соответствии со следующими компонентами:
|
ПРИМЕР 9 - Данные стабильности состава из примера 1 и 2
Цель была - измерить стабильность фармацевтических композиций по данному изобретению (полученных в примерах 1 и 2 и сравнить со стабильностью оральных фармацевтических композиций из ЕР 1086694 А2.
Цель исследования - провести сравнительное испытание стабильности:
- Концентрированных фармацевтических композиций омепразола 40 мг - пример 1
- Концентрированных фармацевтических композиций омепразола 40 мг - пример 2
- Капсул с замедленным высвобождением омепразола 40 мг (ЕР 1086694 А2).
Образцы составов упаковывали в 100 мл HDPE бутылки и хранили в течение 3 месяцев при 40°С/75%RH. Количество капсул и количество силикагеля в крышке бутылки приведены в таблице 2. Испытуемыми параметрами были цвет пеллетов и общие примеси.
Хроматографические условия: колонка: симметрия С8 15×0,46 см 5 мкм; обнаружение: УФ 280 нм; расход: 1,5 мл/мин; температура колонки: 40°С. Подвижная фаза: органическая фаза (А) 50% (0,05 М КН2РО4 при рН 6,5), 50% AСN. Водная фаза (В) 95% (0,05 М КН2РО4 при рН 6,5), 5% AСN. Градиент:
|
Растворитель (для образцов и стандарта): Готовят 0,025 М раствор трехосновного фосфата натрия. Добавляют 0,5 г гидроксида натрия на литр и перемешивают до растворения. Растворяют 1 часть ацетонитрила в 3 частях буфера и смешивают.
Отдельные примеси рассчитывают следующим образом:
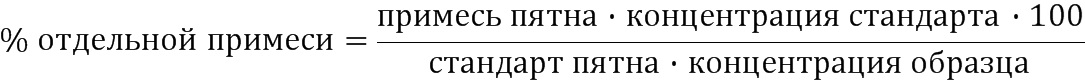
Общие примеси = Σ % отдельной примеси (≥0,05%)
Результаты
Результаты испытания в ускоренных условиях суммированы в следующей таблице:
|
Выводы
Фармацевтические композиции омепразола, полученные в примерах 1 и 2 по данному изобретению, являются более стабильными, чем фармацевтическая композиция капсул с замедленным высвобождением омепразола по ЕР 1086694 А2. Даже с наименьшим количеством диоксида кремния на капсулу фармацевтические композиции из примеров 1 и 2 имеют меньшее количество общего числа примесей, чем состав сравнения. Более того, цвет пеллетов в фармацевтических композициях по данному изобретению не изменяется, тогда как цвет пеллетов из капсул омепразола прежнего уровня техники превращается в розовый в результате частичного разложения продукта.

