Результат интеллектуальной деятельности: УЛУЧШЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ 2-АМИНО-5,8-ДИАЛКОКСИ[1,2,4]ТРИАЗОЛО[1,5-с]ПИРИМИДИНА ИЗ 4-АМИНО-2,5-ДИАЛКОКСИПИРИМИДИНА
Вид РИД
Изобретение
Уровень техники, к которому относится изобретение
Настоящее изобретение предлагает улучшенный способ получения 2-амино-5,8-диалкокси[1,2,4]триазоло[1,5-c]пиримидина из 4-амино-2,5-диалкоксипиримидина.
Патент США № 8143395 B2 описывает способ, который позволяет получать определенные 2-амино-5,8-диалкокси[1,2,4]триазоло[1,5-c]пиримидины и не использовать гидразин и галогенциан. Согласно этому способу 4-амино-2,5-диалкоксипиримидин реагирует, например, с этоксикарбонилизотиоцианатом (S=C=N-CO2Et) в полярном апротонном растворителе, в результате чего образуется этил[(2,5-диалкоксипиримидин-4-ил)амино]карбонотиоилкарбамат, который, в свою очередь, реагирует с солью гидроксиламина в присутствии основания, в результате чего образуется этил[(2,5-диалкоксипиримидин-4-ил)амино](гидроксиимино)метилкарбамат. При нагревании это промежуточное соединение образует цикл в результате ряда реакций, и получаются желаемые 2-амино-5,8-диалкокси[1,2,4]триазоло[1,5-c]-пиримидины. Хотя способ, описанный в патенте США №8143395 B2, исключает необходимость гидразина и галогенциана, он создает новые проблемы, связанные с образованием нескольких эквивалентов газообразных побочных продуктов. Была бы желательной разработка более рационализированного и безопасного способа, который позволяет получать 2-амино-5,8-диалкокси[1,2,4]-триазоло[1,5-c]пиримидины.
Сущность изобретения
Настоящее изобретение предлагает улучшенный способ получения 2-амино-5,8-диалкокси[1,2,4]триазоло[1,5-c]пиримидина из 4-амино-2,5-диалкоксипиримидина. Согласно некоторым вариантам осуществления 2-амино-5,8-диалкокси[1,2,4]триазоло[1,5-c]пиримидины формулы (I):
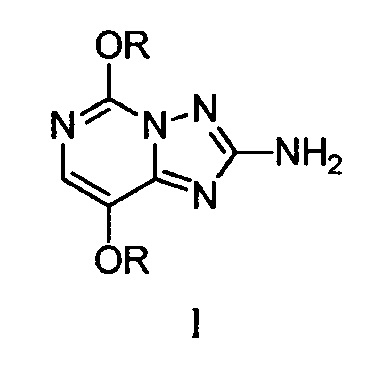
в которой R представляет собой C1-C4-алкил,
получают способом, который включает:
i) введение в контакт 4-амино-2,5-диалкоксипиримидина формулы:
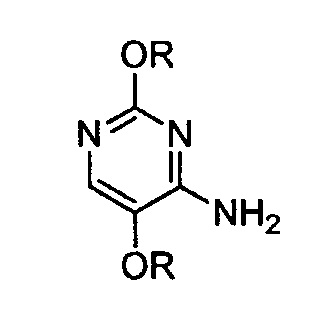
в которой R является таким, как определено выше,
с C1-C4-алкоксикарбонилизотиоцианатом формулы:
S=C=N-C(O)OR,
в которой R является таким, как определено выше,
в полярном или неполярном апротонном растворителе при температуре, составляющей от приблизительно 60°C до приблизительно 110°C, в результате чего образуется [(2,5-диалкоксипиримидин-4-ил)амино]карбонотиоилкарбамат формулы:
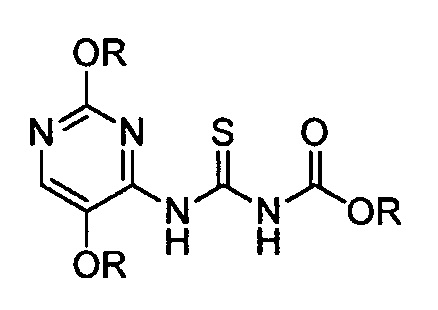
в которой R является таким, как определено выше; и
ii) непрерывное добавление водного раствора гидроксиламина в раствор [(2,5-диалкоксипиримидин-4-ил)амино]карбонотиоилкарбамата в полярном или неполярном апротонном растворителе при температуре, составляющей от приблизительно 60°C до приблизительно 110°C, в результате чего образуется 2-амино-5,8-диалкокси[1,2,4]триазоло[1,5-c]пиримидин.
Подробное описание
Термин «алкил» и производные термины, такие как «алкокси», которые используются в настоящем документе, означают группы, имеющие неразветвленные или разветвленные цепи. Типичные алкильные группы представляют собой метил, этил, пропил, 1-метилэтил, бутил, 1,1-диметилэтил и 1-метилпропил. Метил и этил часто оказываются предпочтительными.
Настоящее изобретение предлагает улучшенный способ получения 2-амино-5,8-диалкокси[1,2,4]триазоло[1,5-c]пиримидина из 4-амино-2,5-диалкоксипиримидина. Его можно использовать, в частности, чтобы получать 2-амино-5,8-диметокси[1,2,4]триазоло[1,5-c]-пиримидин из 4-амино-2,5-диметоксипиримидина:
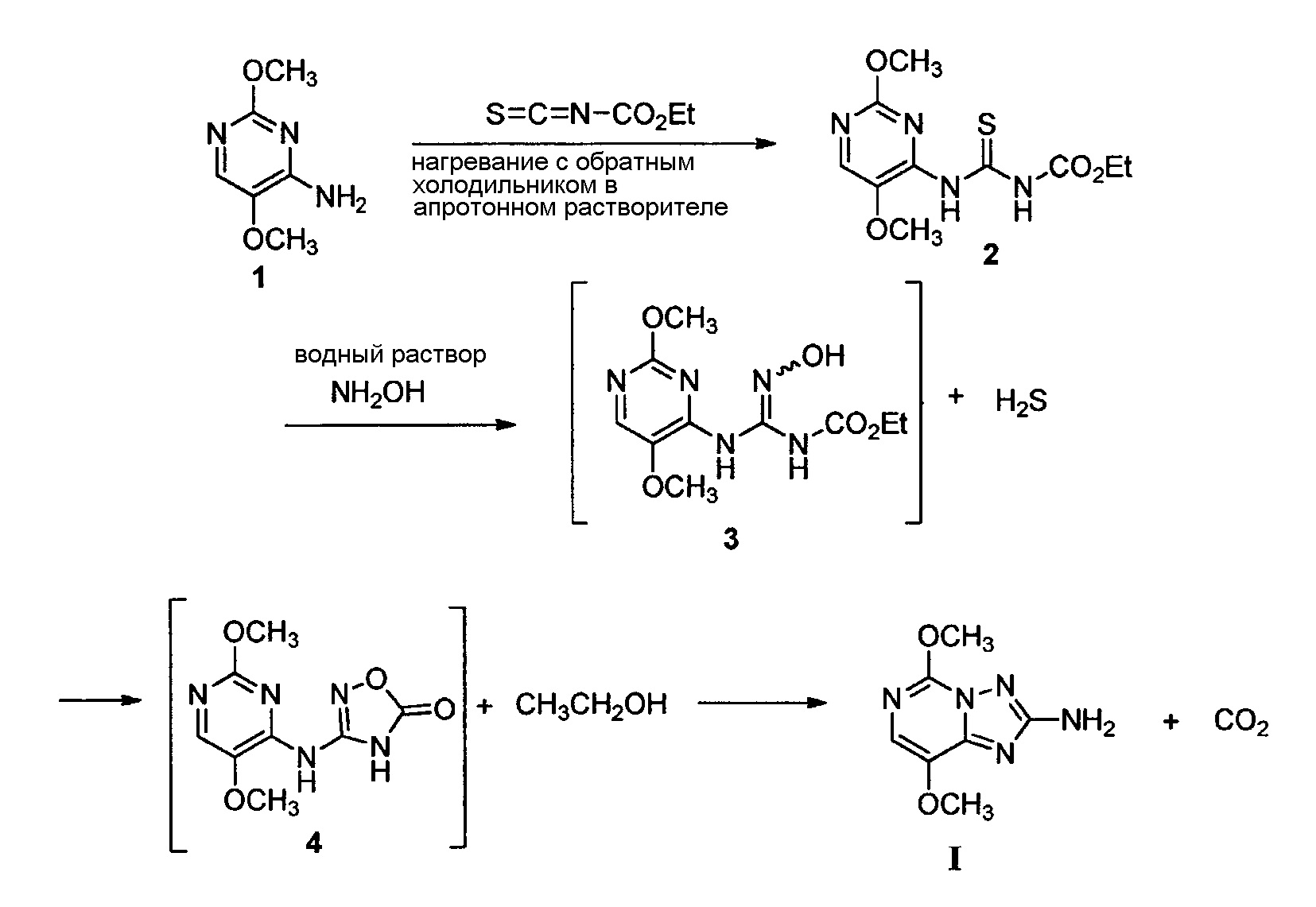
Как описывает патент США №8143395 B2, на первой стадии реакции алкоксикарбонилизотиоцианат следует добавлять в раствор 4-амино-2,5-диалкоксипиримидина в полярном апротонном растворителе, предпочтительно используя ацетонитрил или этилацетат, при температуре, составляющей от 0°C до комнатной температуры. В настоящее время обнаружено, что реакцию алкоксикарбонилизотиоцианата не обязательно проводить при комнатной или более низкой температуре, и что неполярные апротонные растворители, такие как толуол, можно использовать с таким же успехом, как полярные апротонные растворители, реализуя их преимущества в отношении регенерации и повторного применения.
Кроме того, в патенте США №8143395 B2 рекомендуется использование, по меньшей мере, эквивалентного количества гидроксиламина, предпочтительно в форме соли, с основанием (нередко вплоть до 4 эквивалентов каждого соединения, включая соль и основание гидроксиламина) при температуре, составляющей от 0°C до 35°C и предпочтительно при комнатной температуре. Использование гидроксиламина в форме соли с основанием представляет собой вариант исходной загрузки всего количества гидроксиламинового реагента. Низкие температуры оказываются необходимыми для регулирования высвобождения газообразных побочных продуктов, которые образуются в ходе последовательных реакций циклизации. Непрерывно добавляя водный раствор гидроксиламина как свободное основание, можно безопасно использовать повышенные температуры, составляющие от приблизительно 60°C до приблизительно 110°C, и сдерживать высвобождение газообразных побочных продуктов посредством регулируемого добавления гидроксиламина.
Полярные или неполярные апротонные растворители включают ароматические и алифатические углеводороды, а также галогенированные углеводороды, сложные эфиры, нитрилы и амиды.
В способе согласно настоящему изобретению первая стадия (i) представляет собой превращение 4-амино-2,5-диалкоксипиримидина в [(2,5-диалкоксипиримидин-4-ил)амино]карбонотиоилкарбамат. Это превращение осуществляют, используя по меньшей мере один эквивалент и предпочтительно небольшой избыток C1-C4-алкоксикарбонилизотиоцианата в полярном или неполярном апротонном растворителе. Согласно определенным вариантам осуществления полярный или неполярный апротонный растворитель представляет собой ацетонитрил, этилацетат или толуол. Алкоксикарбонилизотиоцианат добавляют при температуре, составляющей от приблизительно комнатной температуры до приблизительно 110°C; смесь затем нагревают при температуре, составляющей от приблизительно 60°C до приблизительно 110°C. Согласно определенным вариантам осуществлени, реакционную смесь нагревают до температуры дефлегмации растворителя (растворителей). Согласно определенным вариантам осуществления температура составляет по меньшей мере 60°C, по меньшей мере 70°C, по меньшей мере 80°C, по меньшей мере 90°C или по меньшей мере 100°C. Продукт можно выделять, используя традиционные способы, в том числе фильтрование осажденного или закристаллизованного материала, но, как правило, его не выделяют для использования на следующей стадии.
Согласно определенным вариантам осуществления 4-амино-2,5-диалкоксипиримидин растворяют или суспендируют в полярном или неполярном апротонном растворителе, а затем обрабатывают соответствующим количеством C1-C4-алкоксикарбонилизотиоцианата. После нагревания с обратным холодильником реакционную смесь можно охлаждать для хранения или немедленно использовать для стадии (ii).
В способе согласно настоящему изобретению вторая стадия (ii) представляет собой превращение [(2,5-диалкоксипиримидин-4-ил)амино]карбонотиоилкарбамата в 2-амино-5,8-диметокси[1,2,4]-триазоло[1,5-c]пиримидин. Это превращение осуществляют, используя по меньшей мере один эквивалент, и согласно определенным вариантам осуществления небольшой избыток гидроксиламина как свободное основание. Водный раствор гидроксиламина непрерывно добавляют в раствор, содержащий полученный на стадии (i) (2,5-диалкоксипиримидин-4-ил)амино]карбонотиоилкарбамат в полярном или неполярном апротонном растворителе, при температуре, составляющей от приблизительно 60°C до приблизительно 110°C, с достаточно медленной скоростью, чтобы регулировать высвобождение газообразных побочных продуктов, образующихся в ходе последовательных реакций циклизации, и в результате получается 2-амино-5,8-диалкокси[1,2,4]триазоло[1,5-c]пиримидин. Согласно определенным вариантам осуществления температура составляет по меньшей мере 60°C, по меньшей мере 70°C, по меньшей мере 80°C, по меньшей мере 90°C или по меньшей мере 100°C. Реакционную смесь охлаждают, после чего ее можно необязательно обрабатывать, используя сульфит натрия как дезодорирующее вещество. Согласно некоторым вариантам осуществления продукт выделяют, используя традиционные способы, такие как фильтрование и высушивание.
Описанные варианты осуществления и следующие примеры представлены для иллюстративных целей и не предназначены для ограничения объема формулы настоящего изобретения. Для обычного специалиста в данной области техники должны быть очевидными другие модификации, приложения или сочетания в отношении составов, описанных в данном документе, которые не отклоняются от идеи и не выходят за пределы объема заявленного предмета настоящего изобретения.
Примеры
Все описанные реагенты представляют собой товарные продукты, которые были использованы без дополнительной очистки.
Пример 1. Получение 2-амино-5,8-диметокси[1,2,4]триазоло[1,5-c]пиримидина (Ia)
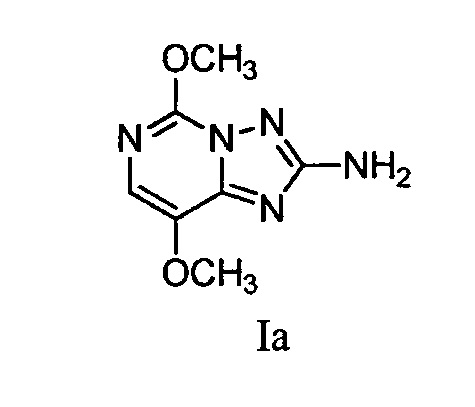
В колбу объемом 700 миллилитров (мл), снабженную рубашкой, механической мешалкой, двойным датчиком pH и температуры, впуском азота и обратным холодильником, последовательно добавляли 19,4 г (0,125 моль) 4-амино-2,5-диметоксипиримидина, а затем 151 г (1,717 моль) этилацетата. Реакционную смесь нагревали до температуры дефлегмации (приблизительно 80°C), а затем непрерывно добавляли 18,7 г (0,143 моль) этоксикарбонилизотиоцианата, используя капельную воронку, в течение периода, составляющего 22 минуты (мин). Капельную воронку промывали, используя 1,8 г этилацетата, и затем реакционную смесь нагревали с обратным холодильником в течение 9 часов (ч). Реакционную смесь охлаждали до 25°C и выдерживали в течение ночи. Смесь нагревали до 60°C, а затем в смесь добавляли 100 г (5,500 моль) деионизированной воды. После нагревания до температуры дефлегмации (приблизительно 71°C) в течение одночасового периода непрерывно добавляли 9,4 г (0,142 моль) водного раствора, содержащего 50 массовых процентов (мас. %) гидроксиламина. В процессе добавления амина значение pH реакционной смеси увеличивалось от 4,00 до 6,60. Реакционную смесь затем продолжали нагревать в течение 3 ч, и при этом значение pH реакционной смеси естественно снижалось до 6,30. В эту реакционную смесь добавляли раствор 4,5 г (0,036 моль) сульфита натрия в 20 г (1,110 моль) деионизированной воды в течение периода, составляющего 8 мин. Значение pH реакционной смеси увеличивалось от 6,30 до 7,44 в процессе добавления сульфита натрия. Реакционную смесь затем охлаждали до комнатной температуры и выдерживали в течение ночи. Реакционную смесь подвергали вакуумному фильтрованию, используя воронку со среднепористой стеклянной пластинкой (продолжительность фильтрования составляла менее чем 2,0 мин), а затем реакционную колбу промывали, используя 150 г деионизированной воды, и эту промывную воду использовали для промывания выделенного продукта на фильтре. Осуществляли конечное вытеснительное промывание, используя 30 г свежей деионизированной воды, и продукт частично высушивали в вакууме в течение 3,5 ч, получая 18,01 г 2-амино-5,8-диметокси[1,2,4]триазоло[1,5-c]пиримидина как влажный отфильтрованный осадок светло-кремового цвета. Анализ методом ЯМР (с использованием бензилацетата в качестве внутреннего стандарта) показал чистоту 91,6%, чему соответствовал выход 67,5%. Спектр ЯМР 1H (DMSO-d6, 400 МГц) δ 3,89 (с, 3H), 4,06 (с, 3H), 6,27 (ушир. с, 2H), 7,47 (с, 1H); спектр ЯМР 13C (DMSO-d6, 100 МГц) δ 55,37, 57,03, 123,06, 138,59, 143,72, 148,49, 166,01.
Пример 2. Получение 2-амино-5,8-диметокси[1,2,4]триазоло[1,5-c]пиримидина (Ia)
В колбу объемом 700 мл, снабженную рубашкой, механической мешалкой, двойным датчиком pH и температуры, впуском азота и обратным холодильником, последовательно добавляли 19,4 г (0,125 моль) 4-амино-2,5-диметоксипиримидина, а затем 151 г (1,717 моль) этилацетата. Реакционную смесь нагревали до температуры дефлегмации (приблизительно 80°C) и затем 18,7 г (0,143 моль) этоксикарбонилизотиоцианата непрерывно добавляли через капельную воронку в течение периода, составляющего 8 мин. Капельную воронку промывали, используя 1,8 г этилацетата, а затем реакционную смесь нагревали с обратным холодильником в течение 9 ч. Реакционную смесь охлаждали до 25°C и выдерживали в течение ночи. Смесь нагревали до 60°C, а затем в смесь добавляли 100 г (5,500 моль) деионизированной воды. После нагревания до температуры дефлегмации (приблизительно 71°C), непрерывно добавляли 9,4 г (0,142 моль) 50 мас.% водного раствора гидроксиламина в течение периода, составляющего 46 мин. В процессе добавления амина значение pH реакционной смеси увеличивалось от 4,20 до 6,35. Реакционную смесь затем продолжали нагревать в течение 3 ч, и при этом значение pH реакционной смеси естественно снижалось до 6,30. В эту реакционную смесь добавляли раствор 4,5 г (0,036 моль) сульфита натрия в 20 г (1,110 моль) деионизированной воды в течение шестиминутного периода. Значение pH реакционной смеси увеличивалось от 6,35 до 7,51 в процессе добавления сульфита натрия. Реакционную смесь затем охлаждали до 18°C, и перемешивание продолжали в течение 30 мин при этой температуре. Реакционную смесь подвергали вакуумному фильтрованию, используя воронку со среднепористой стеклянной пластинкой (продолжительность фильтрования составляла менее чем 2,0 мин), и затем реакционную колбу промывали, используя 30 г деионизированной воды, и эту промывную воду использовали для промывания выделенного продукта на фильтре. Осуществляли конечное вытеснительное промывание, используя 30 г свежей деионизированной воды, и продукт частично высушивали в вакууме в течение 30 мин и затем выдерживали для высушивания в течение ночи в слабом токе азота, получая 19,1 г 2-амино-5,8-диметокси[1,2,4]триазоло[1,5-c]пиримидина как влажный отфильтрованный осадок светло-кремового цвета. Анализ методом ЯМР (с использованием бензилацетата в качестве внутреннего стандарта) показал чистоту 88,25% активного 2-амино-5,8-диметокси[1,2,4]триазоло[1,5-c]пиримидина, чему соответствовал выход 69,1%.
Пример 3. Получение 2-амино-5,8-диметокси[1,2,4]триазоло[1,5-c]пиримидина (Ia)
В колбу объемом 700 мл, снабженную рубашкой, механической мешалкой, двойным датчиком pH и температуры, впуском азота и обратным холодильником, последовательно добавляли 19,4 г (0,125 моль) 4-амино-2,5-диметоксипиримидина, а затем 151 г (1,639 моль) толуола. Реакционную смесь нагревали до температуры умеренной дефлегмации (приблизительно 80°C), а затем добавляли 19,24 г (0,144 моль) 98% этоксикарбонилизотиоцианата, и реакционную смесь нагревали при умеренной дефлегмации (89°C) в течение 7 ч. Реакционную смесь охлаждали до 26°C и выдерживали в течение ночи. Смесь нагревали до 60°C, и затем в смесь добавляли 100 г (5,500 моль) деионизированной воды. После нагревание до температуры дефлегмации (приблизительно 69°C) 9,6 г (0,145 моль) водный раствор 50 мас.% гидроксиламина непрерывно добавляли в течение одночасового периода. В процессе добавления амина значение pH реакционной смеси увеличивалось от 4,00 до 6,67. После завершения добавления гидроксиламина реакционную смесь нагревали до 77°C, а затем продолжали перемешивание в течение 3 ч, и при этом значение pH реакционной смеси естественно повышалось до 7,42. В эту реакционную смесь добавляли раствор 4,5 г (0,036 моль) сульфита натрия в 20 г (1,110 моль) деионизированной воды в течение одноминутного периода. Значение pH реакционной смеси увеличивалось от 7,34 до 7,81 в процессе добавления сульфита натрия. Реакционную смесь продолжали перемешивать в течение 1 ч при 77°C, а затем охлаждали до комнатной температуры и выдерживали в течение ночи. Реакционную смесь подвергали вакуумному фильтрованию, используя воронку со среднепористой стеклянной пластинкой (продолжительность фильтрования составляла 43 мин), а затем реакционную колбу промывали, используя 30 г деионизированной воды, и эту промывную воду использовали для промывания выделенного продукта на фильтре. Осуществляли конечное вытеснительное промывание, используя 30 г свежей деионизированной воды, и продукт высушивали, получая 19,62 г 2-амино-5,8-диметокси[1,2,4]триазоло[1,5-c]пиримидина как твердое вещество светло-кремового цвета. Анализ методом ЯМР (с использованием бензилацетата в качестве внутреннего стандарта) показал чистоту 83,3% активного 2-амино-5,8-диметокси[1,2,4]триазоло[1,5-c]пиримидина, чему соответствовал выход 67,0%.
Пример 4. Получение 2-амино-5,8-диметокси[1,2,4]триазоло[1,5-c]пиримидина (Ia)
В колбу объемом 700 мл, снабженную рубашкой, механической мешалкой, двойным датчиком pH и температуры, впуском азота и обратным холодильником, последовательно добавляли 27,9 г (0,180 моль) 4-амино-2,5-диметоксипиримидина, а затем 165,4 г (0,207 моль) раствора 16,4 мас. % этоксикарбонилизотиоцианата в толуоле. Реакционную смесь нагревали при температуре умеренной дефлегмации (87°C) в течение 7 ч, и после этого анализ методом жидкостной хроматографии (ЖХ) показал превращение приблизительно 95% исходного 4-амино-2,5-диметоксипиримидина. Реакционную смесь охлаждали до 27°C и выдерживали в течение ночи. Смесь нагревали до 40°C и затем в смесь добавляли 114,2 г (6,34 моль) деионизированной воды добавляли. После нагревания до температуры дефлегмации (приблизительно 68°C), непрерывно добавляли 14,3 г (0,217 моль) водного 50 мас.% раствора гидроксиламина в течение периода, составляющего 2 ч 15 мин, используя перистальтический насос. В процессе добавления амина значение pH реакционной смеси увеличивалось от 4,44 до 6,95. После завершения добавления гидроксиламина насосную линию промывали, используя 4,8 г (0,266 моль) деионизированной воды, реакционную смесь нагревали до 81°C, а затем продолжали перемешивание в течение 3 ч, и при этом значение pH реакционной смеси естественно увеличивалось до 7,40. Реакционную смесь охлаждали до комнатной температуры (26°C). Реакционную смесь затем переносили всасыванием в промежуточный сосуд для хранения. Реакционную колбу промывали, используя две порции по 30 г воды. Эту промывную воду объединяли с реакционной смесью. Объединенную смесь подвергали вакуумному фильтрованию, используя воронку Бюхнера (Büchner) с крупнопористым фильтром (продолжительность фильтрования составляла приблизительно 30 сек), и фильтрат собирали и фильтровали повторно через осадок на фильтре. Конечное вытеснительное промывание отфильтрованного осадка осуществляли, используя приблизительно 40 г метанола, и продукт высушивали при 60°C в вакууме (приблизительно до 10 мм рт. ст. или 1333 Па), получая 25,37 г 2-амино-5,8-диметокси[1,2,4]триазоло[1,5-c]пиримидина как твердое вещество светло-кремового цвета. Анализ методом ЯМР (с использованием бензилацетата в качестве внутреннего стандарта) показал чистоту 97,3% активного 2-амино-5,8-диметокси[1,2,4]триазоло[1,5-c]пиримидина, чему соответствовал выход 70,4%.
![УЛУЧШЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ 2-АМИНО-5,8-ДИАЛКОКСИ[1,2,4]ТРИАЗОЛО[1,5-с]ПИРИМИДИНА ИЗ 4-АМИНО-2,5-ДИАЛКОКСИПИРИМИДИНА](https://fips.edrid.ru/images/rid/cb/e8/7c/cad5e08d71bffa27568281e2793931f7.jpg)
![УЛУЧШЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ 2-АМИНО-5,8-ДИАЛКОКСИ[1,2,4]ТРИАЗОЛО[1,5-с]ПИРИМИДИНА ИЗ 4-АМИНО-2,5-ДИАЛКОКСИПИРИМИДИНА](https://fips.edrid.ru/images/rid/cb/e8/7c/ea3cafd8040cdd050dd1832adff9d7c4.jpg)
![УЛУЧШЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ 2-АМИНО-5,8-ДИАЛКОКСИ[1,2,4]ТРИАЗОЛО[1,5-с]ПИРИМИДИНА ИЗ 4-АМИНО-2,5-ДИАЛКОКСИПИРИМИДИНА](https://fips.edrid.ru/images/rid/cb/e8/7c/eefa05a008b32a2b442a5a947a4cc980.jpg)
![УЛУЧШЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ 2-АМИНО-5,8-ДИАЛКОКСИ[1,2,4]ТРИАЗОЛО[1,5-с]ПИРИМИДИНА ИЗ 4-АМИНО-2,5-ДИАЛКОКСИПИРИМИДИНА](https://fips.edrid.ru/images/rid/cb/e8/7c/b4d6a7a595c254a0fc5099740b4b3095.jpg)
![УЛУЧШЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ 2-АМИНО-5,8-ДИАЛКОКСИ[1,2,4]ТРИАЗОЛО[1,5-с]ПИРИМИДИНА ИЗ 4-АМИНО-2,5-ДИАЛКОКСИПИРИМИДИНА](https://fips.edrid.ru/images/rid/cb/e8/7c/3ae97c11acba1d0ebc8e11b10bd4362e.jpg)
![УЛУЧШЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ 2-АМИНО-5,8-ДИАЛКОКСИ[1,2,4]ТРИАЗОЛО[1,5-с]ПИРИМИДИНА ИЗ 4-АМИНО-2,5-ДИАЛКОКСИПИРИМИДИНА](https://fips.edrid.ru/images/rid/cb/e8/7c/f9508dc78166436667c622ba73be8122.jpg)
![УЛУЧШЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ 2-АМИНО-5,8-ДИАЛКОКСИ[1,2,4]ТРИАЗОЛО[1,5-с]ПИРИМИДИНА ИЗ 4-АМИНО-2,5-ДИАЛКОКСИПИРИМИДИНА](https://fips.edrid.ru/images/rid/cb/e8/7c/34f0cff7abc1b042f46bd296be32abb4.jpg)
![УЛУЧШЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ 2-АМИНО-5,8-ДИАЛКОКСИ[1,2,4]ТРИАЗОЛО[1,5-с]ПИРИМИДИНА ИЗ 4-АМИНО-2,5-ДИАЛКОКСИПИРИМИДИНА](https://fips.edrid.ru/images/rid/cb/e8/7c/8c936783991bc7590d37bcc05d80ba42.jpg)

