Результат интеллектуальной деятельности: Способ хранения почки поросенка для получения монослоя первичнотрипсинизированных клеток и использования его в вирусологических исследованиях
Вид РИД
Изобретение
Изобретение относится к области биотехнологии, а именно к способу хранения почки поросенка, предназначенной для дальнейшего получения монослоя первичнотрипсинизированных клеток, используемого в научно-практических работах по определению авирулентности вакцин, для постановки реакции нейтрализации и титрования вирусов.
Основные исследования и изобретения в медицинской трансплантологии касаются создания консервирующих растворов и сред, которые способствуют поддержанию необходимого уровня сохранения органов. Важная роль принадлежит гепарину (антикоагулянт), буферным компонентам (соли) и глюкозе, для обеспечения минимального энергетического обмена [12-14]. Предлагаемые методы консервации печени крыс с использованием перфузатов и контейнеров, выдерживающих высокое давление во избежание экстра и интракристаллизации растворов и тканей, довольно громоздки и пока применимы только в лабораторных условиях [15]. Во всех предлагаемых изобретениях исключается процесс кристаллизации органов [16].
Консервация органов животных для применения их в клеточных технологиях обходит некоторые проблемы, связанные с агрегацией (процесс тромбообразования) эритроцитов и лейкоцитов, а также полноценности физиологического состояния. В данном случае важно, после хранения при субнормальных температурах, получить жизнеспособные клетки после трипсинизации, которые могут адгезироваться, делиться и расти.
Нами был выяснен такой вариант, как хранение замороженных почек поросят при температуре от минус 4°C до минус 2°C (с кристаллизацией органа). Была проведена трипсинизация почки поросенка после оттаивания кристаллической фазы системы среда + почка (т.е. почка была во льду и, вероятно, сама была частично кристаллизована). Трипсинизация органа прошла стандартным вариантом, полученная суспензия клеток была «посеяна» в пенициллиновые флаконы и пластиковые «матрасы» площадью 25 см2. Неокрашенные трипановой синью клетки (концентрация 200000 кл/мл) при посеве не адгезировались и не формировали монослой, трипсинизированные клетки оказались на стадии апоптоза. Окончательно было сделано заключение, что любое замораживание с фазой кристаллизации без криопротекторов, отрицательно сказывается на выживаемости клеток и тканей органов, в которых около 90% воды [1, 8].
В медицинской практике и ветеринарной вирусологии не найдено сведений по применению хранившихся при пониженных температурах (около 0°C) изолированных почек для получения клеточных культур. В 1982 году был предложен метод криоконсервирования первичных клеточных культур и тканей для вирусологических целей. После применения этого метода жизнеспособность клеток снижалась до 60% [11]. Метод требует длительной подготовки и восстановления после криоконсервирования. Но есть преимущество, хранение может быть длительным, до нескольких месяцев.
Основная цель разработки способа более длительного хранения почек (больше 2-4 часов) - это рационализация технологического процесса получения первичных клеток, когда период трипсинизации необходимо пролонгировать во времени для получения полноценных, не переросших культур клеток, пригодных для вирусологических исследований.
Вторая цель - это изучение сохранности органов при субнормальных температурах в лабораторных условиях для дальнейшего применения полученных данных в полевых условиях с возможностью последующего получения полноценных первичных клеток и субкультур. При получении из трипсинизированных органов полноценного монослоя первичных клеток необходимо также изучить их пригодность для вирусологических исследований.
Первичная культура клеток, полученная из почки поросенка (СП), применяется не только при работе с вирусом ящура, но и при выделении вирусов, поражающих свиней, в том числе африканской чумы свиней (АЧС).
Авторами был разработан способ хранения почки поросенка, способный сохранять должным образом исходное состояние органа, пригодного для вирусологических исследований в течение более длительного времени, чем другими известными способами.
Наши исследования позволяют заполнить пробел в области более длительного использования донорских органов для вирусологических целей.
Для осуществления поставленных целей проводили опыты с использованием среды 199, которая пригодна для сохранения жизнеспособности и специфических функций клеток. Эта среда так же используется как основной компонент для хранения трансплантационных почек человека. В эту среду входят 62 компонента веществ, включая соли, аминокислоты, витамины, нуклеозиды и глюкозу. Относительно невысокая концентрация веществ обеспечивает незначительный обмен веществ и минимальное накопление метаболитов при хранении [9]. Температурный режим хранения варьировал от 0°C до 4°C в течение 2-7 суток.
Изолированные почки от 3-5-недельных поросят помещали во флакон с широким горлом с питательной средой 199, в которую, кроме 100 ед. пенициллина и 100 ед. стрептомицина, добавляли 50 мкг/мл гентамицина. Соотношение среды и газовой фазы составляло 2:1. Флакон накрывали стерильной чашкой Петри и помещали в бытовой холодильник. При хранении выбирали температурный режим, исключающий кристаллизацию среды и органа.
Нами выявлено, что хранение почек в стерильных условиях при температуре, от 0°C до 4°C, не приводит к их кристаллизации, в то же время сохраняется жизнеспособность гистотипических клеток, которые после трипсинизации и получения полноценного монослоя чувствительны к различным вирусам, в том числе к вирусу ящура.
Применение метода визуализации контроля предлагаемого изобретения (фотографирование и описание выращенных в культуральных флаконах полученных трипсинизированных клеток) позволяет объективно оценивать и использовать полученные культуры.
Сущность предлагаемого изобретения пояснена на графических материалах:
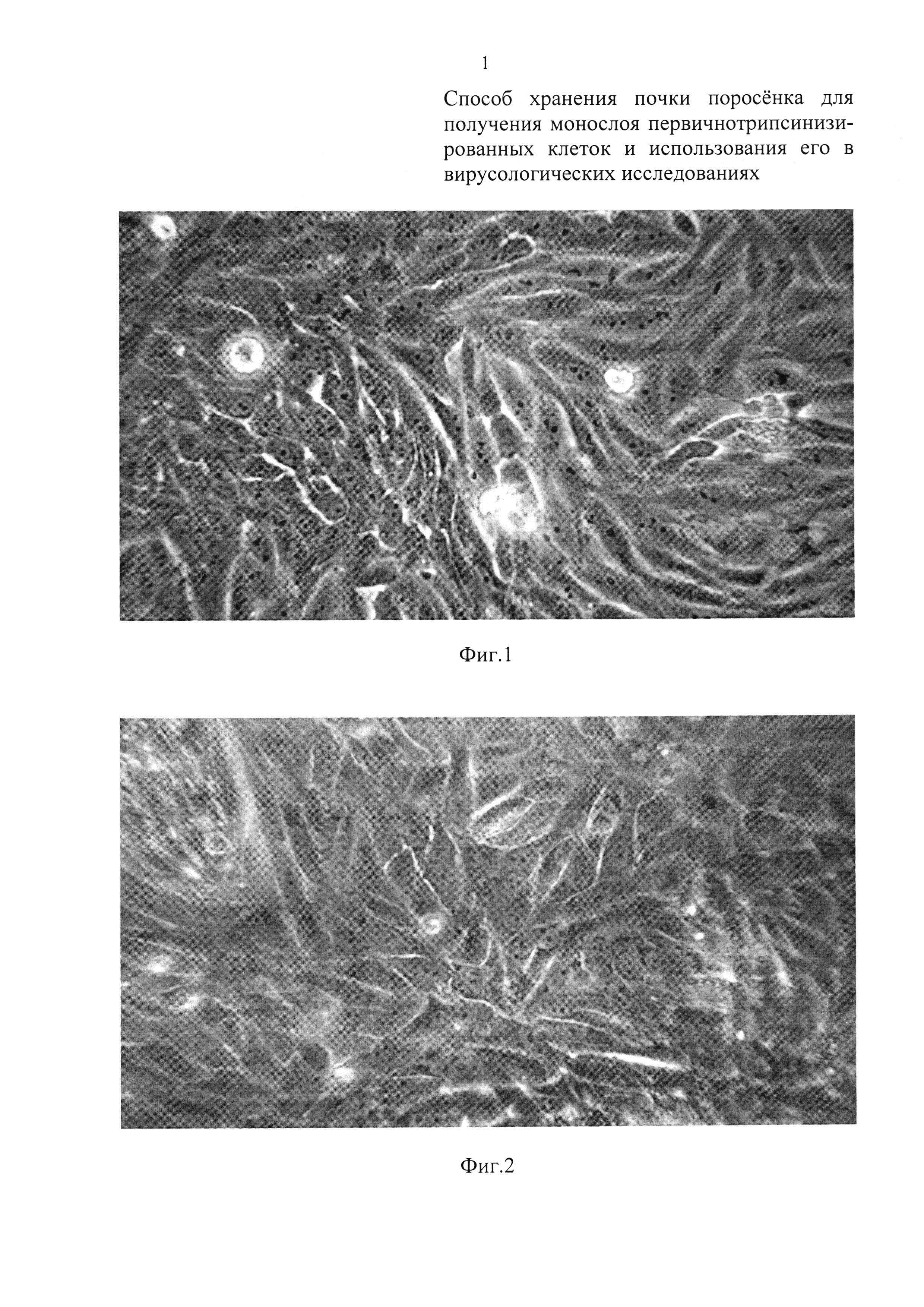
Фиг. 1 - монослой первичной культуры СП полученный на 5-е сутки после трипсинизации «свежей» почки (0 часов хранения);
Фиг. 2 - монослой первичной культуры СП полученный на 5-е сутки после трипсинизации 3-суточной почки (72 часа хранения);
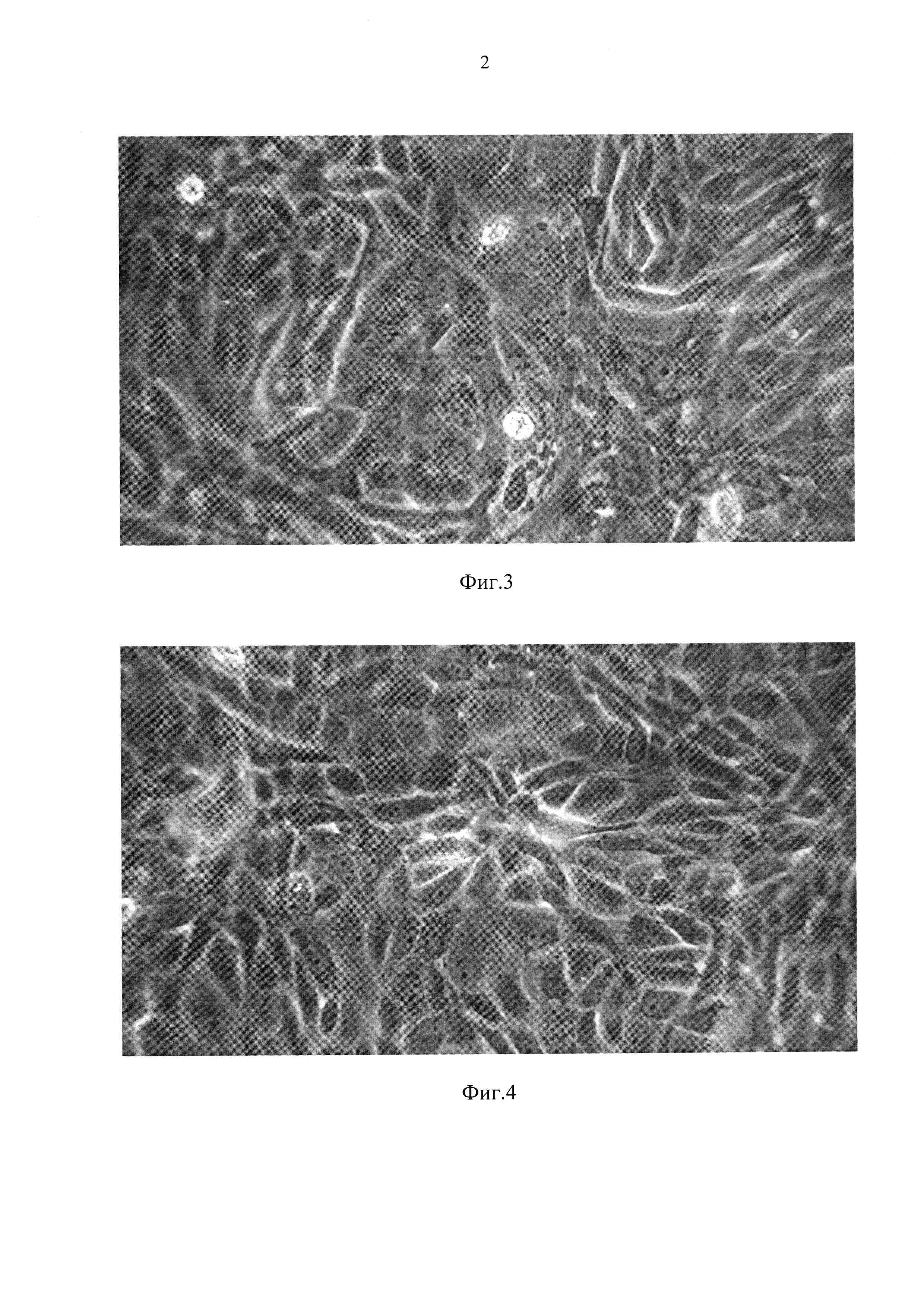
Фиг. 3 - монослой первичной культуры СП полученный на 5-е сутки после трипсинизации 4-суточной почки (96 часов хранения);
Фиг. 4 - монослой первичной культуры СП полученный на 5-е сутки после трипсинизации 6-суточной почки (144 часов хранения);
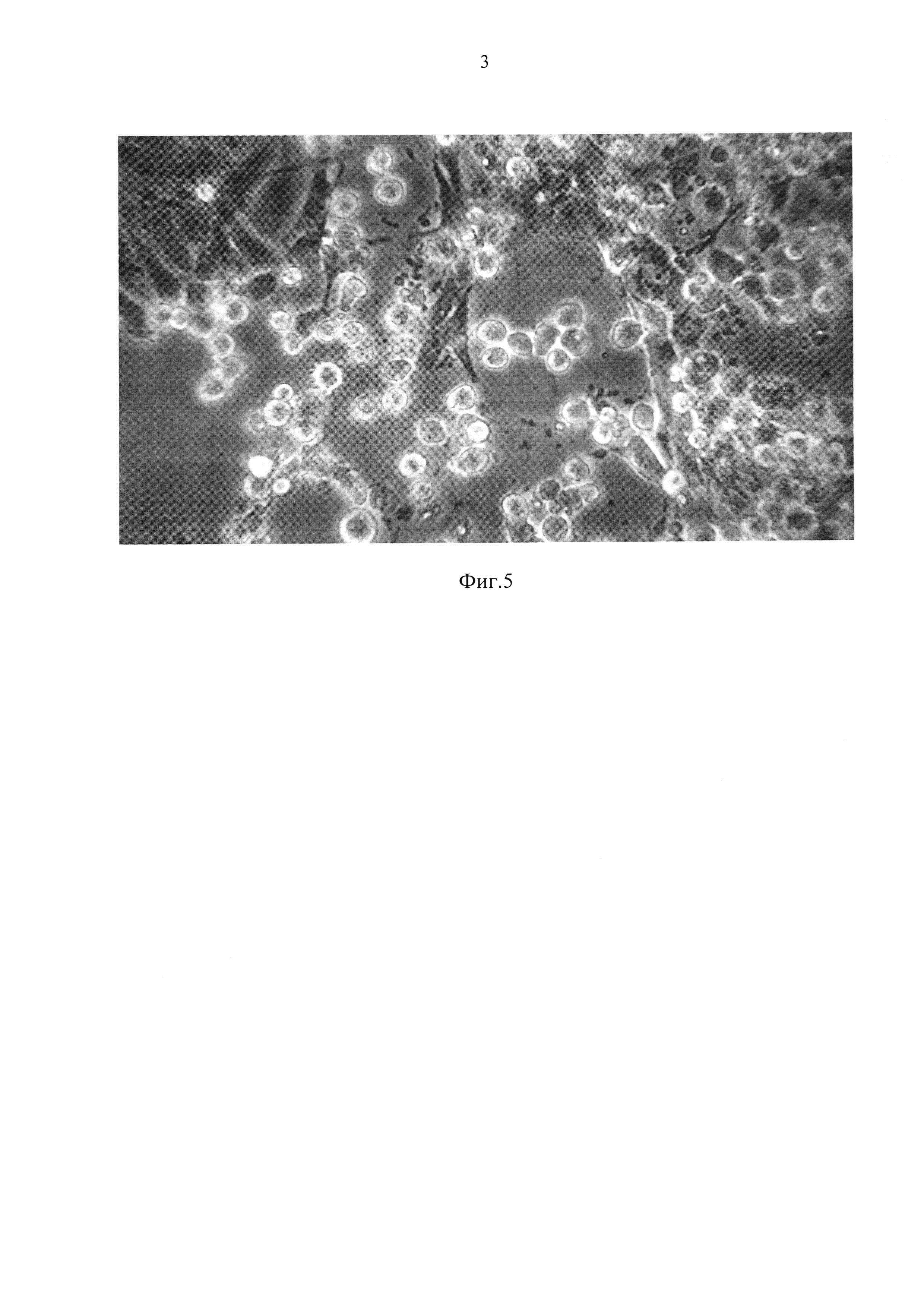
Фиг. 5 - дегенерация монослоя первичных клеток СП (полученной из почки хранившейся 6 суток) при взаимодействии с вирусом ящура.
Подробное описание изобретения
Способы консервации органов человека при субнормальных температурах (0÷4°C) уже несколько десятилетий применяются в трансплантационной хирургии [7]. Благодаря фундаментальным исследованиям, проведенным с органами животных, было выявлено, что паренхиматозные органы (печень, почки) и сердце можно пересаживать в течение суток после изъятия от донора, роговицу глаз в течение 3-х суток хранения [4, 7, 8]. После этого срока наступают необратимые биохимические и морфологические изменения в тканях, которые приводят к отторжению органа реципиентом [1, 6]. В большинстве случаев необратимые изменения наступают в сосудистых системах (образуются тромбы) и в стромальных тканях, которые обеспечивают приживаемость органов.
В ветеринарной вирусологии, несмотря на рекомендуемые 2-4 часа хранения при 0÷4°C внутренних органов и тканей [3], длительное сохранение более 2 суток так же имеет научно-прикладное значение. В литературных источниках, включая патенты, нами не было обнаружено сведений, касающихся этой проблемы в ветеринарной вирусологии.
Первичнотрипсинизированную культуру СП получали из почек поросят 3-5-недельного возраста с использованием общепринятых методик получения первичных клеточных культур [2, 4]. Хранение изолированных почек осуществляли при температуре от 0° до 4°C в среде 199 с добавлением 100 ед. пенициллина, 100 ед. стрепномицина и 50 мкг/мл гентамицина без сыворотки. Трипсинизацию почек проводили через 1-7 суток хранения. В результате нами была проведена работа по изучению адгезивной способности отдельных клеток и их агрегаций, морфологии седиментированных клеток, сроков формирования монослоя и чувствительности к вирусу ящура [2, 3]. Для выращивания первичных клеток почек поросенка (СП) нами были использованы питательная среда DMEM/F-12 с 0,1% ГЛА (гидролизат лактальбумина) фирмы Sigma и фетальная сыворотка КРС фирмы Bioclot. Культивирование клеток осуществляли в пенициллиновых флаконах площадью 3 см2 и пластиковых флаконах площадью 25 см2.
Анализ морфологии клеток и монослоя проводили с помощью фазовоконтрастного микроскопа Olimpus CKX-41. Также осуществлялся подсчет продуктивности первичных клеток после образования монослоя на 5-7 сутки.
Чувствительность первичной культуры клеток СП оценивали по результатам титрования рабочей дозы вируса при постановке реакции нейтрализации. Одно и то же разведение культурального вируса ящура (КВЯ) титровали на монослое первичной культуры клеток СП, выращенной сразу после трипсинизации. Через 2-3 суток повторяли контроль инфекционности вируса на культуре клеток СП, выращенной после хранения суспензии клеток или цельных почек поросенка в течение 2-7 суток при температуре от 0°C до 4°C.
После забора почек от 3-5-недельных поросят органы помещали во флакон с широким горлом с питательной средой 199, в которую, кроме 100 ед. пенициллина и 100 ед. стрепномицина, добавляли 50 мкг/мл гентамицина. Соотношение среды и газовой фазы 2:1. Флакон накрывали стерильной чашкой Петри и помещали в бытовой холодильник. В холодильнике поддерживали температуру, близкую к нулю, не допуская кристаллизации органа и среды. Флакон со средой, в который была помещена почка поросенка, не был герметизирован пробкой для того, чтобы происходил пассивный газообмен с окружающим воздухом. Такое условие хранения было выполнено для того, чтобы избежать закисления среды, так как даже в охлажденных органах идет гликолиз [4]. При хранении почки поросенка (в 100 мл среды 199) при температуре, близкой к нулю, в течение 96 ч, значение pH среды повысилось с 7,0 до 7,1-7,2. Во флаконе со средой 199, где не было органа, значение pH повысилось до 7,6. Стабилизация pH среды, где находится почка, свидетельствует о том, что ткани органа «дышат», утилизируя глюкозу и выделяя углекислый газ и метаболиты.
Хранившиеся 2-7 суток при температуре от 0°C до 4°C почки поросенка не изменяли свою консистенцию и цвет. Корковый слой стандартно измельчали стальными ножницами, так же стандартно диспергировали теплым раствором трипсина. Из 1 грамма почечной ткани получали до 30 млн клеток, не окрашенных трипановой синью. Как было выявлено в предыдущих работах, трипсинизированные клетки были полиморфны и принадлежали к разным гистотипическим тканям. Не все клетки дают колонии [2, 3].
В нашем случае клетки, полученные из хранившихся при температуре от 0°C до 4°C в течение 2-7 суток почек, также были полиморфны и в дальнейшем имели стандартную динамику седиментации, адгезии и пролиферации. Первый показатель сохранности клеток после трипсинизации - это количество жизнеспособных клеток, полученных из 1 г почечной ткани, и тестирование окрашиванием трипановой синью. Количество клеток, полученных из 1 г почек, во всех случаях равнялось в среднем 15-20 млн.
В процессе проведения опытов по хранению почек предложенным способом при температурах, близких к нулю, были уточнены морфологические характеристики первичных клеток в зависимости от «возраста» монослоя.
Как видно из графических материалов, сформированный монослой во всех случаях представлен полиморфными клетками с минимальным количеством внеклеточного матрикса. После хранения почек данным способом до трех суток при температуре, близкой к нулю, и после последующей трипсинизации тканей коркового слоя (при оптимальной посевной концентрации клеток), монослой формируется за 5 суток (Фиг. 1, таблица 2); при хранении почек до 5 суток полноценный монослой образуется за 6 суток (Фиг. 3). При 6-дневном хранении почек монослой сформировался за 7 суток с преобладанием нормальных полиморфных клеток без внеклеточного матрикса (Фиг. 4).
По нашим наблюдениям, почки поросят при температуре хранения, близкой к нулю, не меняют цвет, также не наблюдается явных признаков некроза, диспергирование трипсином происходит в стандартном режиме. Но после 5-дневного хранения почек пролиферативная активность выживших после трипсинизации клеток ниже на 15-20%. Динамика формирования монослоя запаздывает в среднем на 1 сутки. Во всех опытах мы не наблюдали контаминации банальной микрофлорой и получали первичную культуру стерильной.
При проведении вирусологических работ, все варианты полученного клеточного материала были пригодны для определения авирулентности полуфабрикатов биопрепаратов, для проведения реакции нейтрализации и для выделения вируса ящура.
Чувствительность клеток к вирусу ящура была сравнима с контролем. В наших исследованиях чувствительность к вирусу ящура первичных клеток, полученных из хранившихся почек предложенным способом, была на 7% выше, чем в контроле (таблица 3).
Цитопатическое действие вируса ящура на клетках, полученных после хранения органа до 6 суток, было типичным и интенсивным (Фиг. 5).
В процессе постановки вирусологических реакций, нам удалось проанализировать динамику и специфику цитопатического действия ВЯ на первичные клетки. В первую очередь поражаются эпителиоподобные клетки монослоя. Они становятся сферическими, процесс деадгезирования сопровождается появлением множества цитоплазматических выростов, через некоторое время поверхность клеток становится гладкой, затем зернистой, и далее происходит фрагментация, т.е. разрушение монслоя до детрита. По нашему мнению, эпителиоподобные клетки выросшего монослоя являются предшественниками эпителиальных тканей, выстилающих поверхность бауменовых капсул, которые первыми принимают на себя контакт с вирусами, циркулирующими в организме поросенка. «Потомки» стромальных тканей сосудов и органов - фибробластоподобные клетки, в последнюю очередь поражаются вирусной инфекцией.
В литературных источниках мы не нашли данных об условиях хранения почек животных для получения первичных клеточных культур. Наши исследования позволяют заполнить пробел в области более длительного использования донорских органов. Нами выявлено, что хранение почек в стерильных условиях при температуре 0°C до 4°C не приводит к кристаллизации органов, в то же время сохраняется жизнеспособность гистотипических клеток, которые после трипсинизации и получения полноценного монослоя чувствительны к вирусу ящура.
Было определено, что кристаллизация среды и почек во время хранения при температуре от минус 4°C до минус 2°C ведет к необратимым изменениям в трипсинизированных клетках, которые после инокуляции в культуральные сосуды не адгезируются и не дают колоний.
В результате проведенных опытов было показано, что при хранении первично трипсинизированных клеточных суспензий в холодильнике двое суток при температуре 4÷6°C (таблица 2), происходит частичная гибель эпителиальных клеток, наиболее чувствительных к вирусу ящура. В то же время, хранение почек при субнормальных температурах (0÷4°C) от 2 до 7 суток позволяет получать после трипсинизации нормальные популяции первичных клеток с высокой чувствительностью к вирусу.
Предложенный нами способ хранения почек поросят позволяет более рационально использовать донорские органы для получения первичных культур, используемых в вирусологии. В то же время можно предложить этот способ хранения органов для консервирования и транспортировки органов, полученных в полевых условиях от домашних и диких животных.
Сущность изобретения пояснена примерами его реализации и использования.
Пример 1. При выбранных физических параметрах хранения почек и при свободном газообмене, pH среды сохраняется на уровне физиологических значений - 7,1-7,2, что свидетельствует о функциональной активности органа и пригодности для трипсинизации. В контрольной среде (без почки) значение pH повышалось до 7,6.
Пример 2. Получение первичнотрипсинизированной культуры СП из почек, хранившихся разное количество дней, проиллюстрирован таблицей 1. Монослой выросших клеточных культур, полученных из хранившихся почек, сохраняет пролиферативную активность, но сроки формирования конфлюэнтного слоя увеличиваются на 1-2 дня. Полиморфизм первичных клеток сохраняется (Фиг. 1-4).
Пример 3. В процессе постановки вирусологических реакций, нам удалось проанализировать динамику и специфику цитопатического действия ВЯ на первичные клетки. В первую очередь вирусом поражаются эпителиоподобные клетки монослоя (Фиг. 5). Чувствительность к вирусу первичных клеток, полученных из хранившихся почек, была на 7% выше, чем в контроле (таблица 3).
Пример 4. Клетки, полученные из хранившихся при 0÷4°C в течение 2-7 суток почек, были полиморфны и в дальнейшем имели стандартную динамику седиментации, адгезии и пролиферации. Первый показатель сохранности клеток после трипсинизации - это количество жизнеспособных клеток, полученных из 1 г почечной ткани и тестировании окрашиванием трипановой синью. Количество клеток, полученных из 1 г почек, во всех случаях равнялось в среднем 15-20 млн.
Пример 5. В процессе длительного хранения почек, после трипсинизации, в суспензии преобладают эпителиоподобные клетки, которые в первую очередь поражаются вирусом ящура. Цитопатическое действие проявляется в деадгезировании клеток, трансформации их в сферические структуры с проницаемой оболочкой и дальнейшем лизисе монослоя.
Предложенный способ хранения почек поросят при 0÷4°C в течение 2-7 суток обеспечивает получение полноценного клеточного препарата для проведение научно-исследовательских работ: определения авирулентности биопрепаратов, постановки реакции нейтрализации и выделения вируса ящура.
Источники информации
1. Кирпатовский В.И. Кудрявцев Ю.В. Криоконсервация почки крысы и кролика. // II международная конференция «Успехи современной криобиологии». - Харьков, 1992. - с. 82-83.
2. Манин Б.Л., Коропова Н.В. Влияние артефактов биологического статуса поросят на культивирование первичной культуры, полученной из почки // Тр. Федерального центра охраны здоровья животных. - Владимир, 2012. - Т. 10. - С. 238-245.
3. Ночевный В.Т. Комплексная стандартизация получения первичных культур клеток. «Цитология», М.; 1999 Т. 41, с. 298-299.
4. Трошина В.П. Функциональное состояние изолированных тканей при температуре близкой к нулю. Вест. ЛГУ, 1957, 3, сер. Биол., 1, с. 111-121.
5. Фрешни Р.Я. Культура животных клеток. Изд-во «Бином. Лаборатория знаний», М., 2011, 691 с.
6. Юрченко Т.Н., Жуликова Е.П., Говоруха Т.П. Структурно-функциональные показатели клеток печени на этапах подготовки к криоконсервации. // Проблемы криобиологии. - 1991. - №1. - С. 8-16.
7. Янгсон Р.-М.. Хирургия. Что и зачем делает хирург? Минск «Попури» 1997 - 592 с.
8. Jeske А.Н., Fontebs A.M., Karow A.M. Functional preservation of the mammalian kidney. III. Ultrastructural effects of perfusion with DMSO / - Cryobiology, 1974, 11, №2, p. 170-181.
9. Методы культивирования клеток: Сборник научных трудов, под ред. Г.П. Пинаева - Л.: Наука, 1988. - 313 с.
10. Методы культивирования клеток / под ред.: Г.П. Пинаева, М.С Богдановой. - СПб.: Изд-во Политехн. Ун-та, 2008. - 278 с.
11. Стегний Б.Т. Криоконсервирование первичных клеточных культур и тканей для вирусологических исследований. Автореферат канд. вет. Наук, Владимир, 1982.
12. Авторское свидетельство №938873, A01N 1/00, 30.06.82.
13. Патент РФ №2140152, A01N 1/02, 27.10.99.
14. Патент РФ №2140153, A01N 1/02, 27.10.99.
15. Патент РФ №2362299, A01N 1/02, 27.07.2009.
16. Патент РФ №2479999, A01N 1/02, 27.04.2013.