Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ ПИРАЗОЛА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ LPAR5 АНТАГОНИСТОВ
Вид РИД
Изобретение
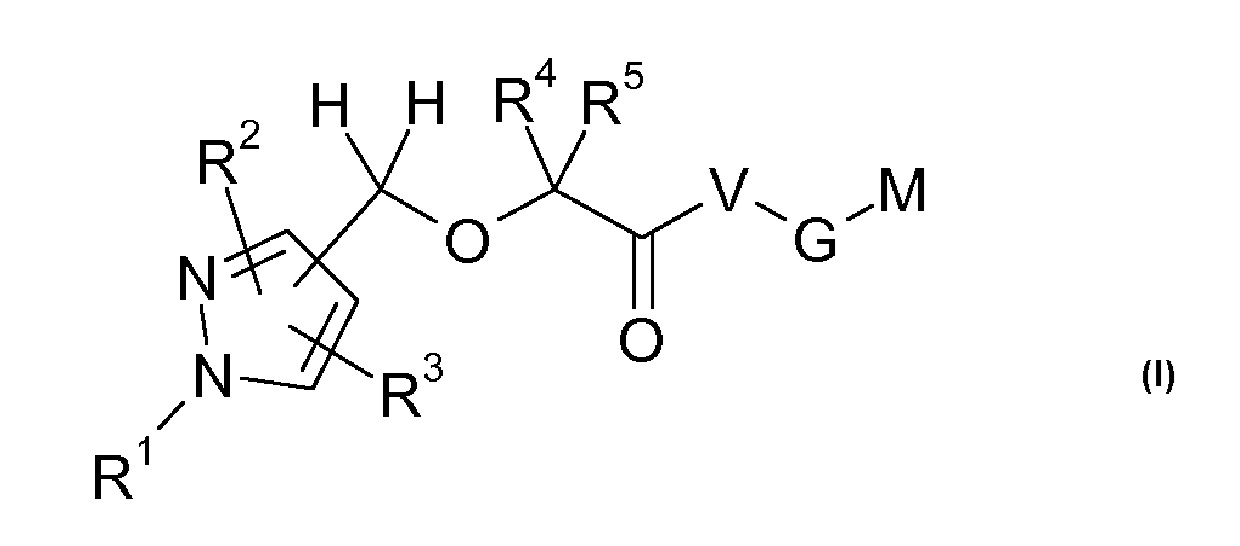
Настоящее изобретение относится к производным пиразола формулы I:
где остатки R1-R5, V, G и M имеют значения, указанные ниже. Соединения формулы I представляют собой ценные фармакологически активные соединения для применения в лечении различных нарушений. Соединения формулы I обладают сильным антиагрегационным действием на тромбоциты и, таким образом, антитромботическим воздействием, и являются пригодными, например, при лечении и профилактике сердечно-сосудистых нарушений, подобно тромбоэмболическим заболеваниям или рестенозу. Кроме того, соединения формулы I ингибируют опосредованную LPA активацию тучных клеток и клеток микроглии. Соединения настоящего изобретения представляют собой антагонисты LPA рецепторов LPAR5 тромбоцитов (GPR92) и их можно, как правило, применять при состояниях, в которых имеется нежелательная активация LPA рецептора LPAR5 тромбоцитов, LPA рецептора LPAR5 тучных клеток или LPA рецептора LPAR5 клеток микроглии или для лечения или предотвращения которых предполагается ингибирование LPA рецептора LPAR5 тромбоцитов, тучных клеток или клеток микроглии. Кроме того, настоящее изобретение относится к способам получения соединений формулы I, их применению, в частности, в качестве активных ингредиентов в лекарственных средствах, и содержащим их фармацевтическим композициям.
В промышленно развитых странах тромботические осложнения представляют собой одну из основных причин смерти. Примеры состояний, связанных с патологическим тромбообразованием, включают тромбоз глубоких вен, венозную и артериальную тромбоэмболию, тромбофлебиты, коронарный и церебральный артериальный тромбоз, эмболию мозга, эмболию почек, легочную эмболию, синдром диссеминированной внутрисосудистой коагуляции, транзиторные ишемические атаки, инсульты, острый инфаркт миокарда, нестабильную стенокардию, хроническую стабильную стенокардию, заболевание периферических сосудов, преэклампсию/эклампсию и тромботическую цитопеническую пурпуру. Также в ходе или после инвазивных процедур, включая встраивание эндоваскулярных устройств и протезов, эндартерэктомию, ангиопластику, CABG (аортокоронарный трансплантат), пересадку сосудистого трансплантата и установку стента, могут возникать тромботические и рестенозные осложнения.
Агрегация тромбоцитов играет решающую роль в данных внутрисосудистых тромботических осложнениях. Тромбоциты можно активировать медиаторами, высвобождаемыми из клеток, циркулирующих в периферической крови, и поврежденных эндотиальных клеток, выстилающих сосуды, или поверхностными субэндотелиальными матриксными молекулами, такими как коллаген, лизофосфатидиловая кислота или тромбин, который образуется в коагулирующей системе. После активации тромбоциты, которые обычно свободно циркулируют в сосудистой системе, и другие клетки накапливаются в месте повреждения сосуда, образуя тромб, и привлекают большее количество тромбоцитов к растущему тромбу. В течение данного процесса, тромбы могут вырастать до достаточного размера, чтобы частично или полностью блокировать сосуды с артериальной кровью. В венах тромбы могут образовываться в застойных областях или областях медленного тока крови. Данные венозные тромбы могут создавать эмболы, которые перемещаются по системе кровообращения, поскольку они могут легко разделяться на свои части. Такие перемещающиеся эмболы могут блокировать другие сосуды, такие как легочные или коронарные артерии, что может приводить в результате к указанным выше патологическим следствиям, таким как эмболия легких или коронарных артерий. Таким образом, что касается венозных тромбов, болезненность и смертность возникают в первую очередь после эмболизации или удаленной блокады сосудов, тогда как артериальные тромбы вызывают серьезные патологические состояния местной блокадой.
Лизофосфатидиловая кислота (LPA) представляет собой важный биоактивный фосфолипид с широким диапазоном клеточных функций. Концентрация LPA строго регулируется посредством ее синтеза, контролируемого двумя различными путями. Первый состоит из активности фосфолипазы D (PLD) и фосфолипазы A2 (PLA2), второй состоит из активности PLA2 и лизофосфолипазы D (lysoPLD). Чаще всего используемой в лабораторной практике LPA является 18:1 LPA (1-ацил-2-гидрокси-sn-глицеро-3-фосфат). Однако в организме существуют многие другие формы LPA с различной длиной жирных кислот, различными степенями насыщения и связывающими цепь жирной кислоты с цепью глицерина, то есть сочетанием через сложноэфирную или эфирную связь (Choi et al., Ann Rev Pharmacol Toxicol (2010), 50, 157-186). Ключевым ферментом для синтеза LPA является аутотоксин (ATX), Enpp2 у мышей. Было показано, что ATX обладает lysoPLD активностью и что Εnpp2-/+ мыши погибают внутриутробно на 9,5 день. Εnpp2-/+ мыши показывают пониженные концентрации LPA в плазме (van Meeteren et al., Mol Cell Biol (2006), 26, 5015-5022). LPA проявляет свои внеклеточные биологические эффекты посредством связывания с сопряженными с G белком рецепторами. К настоящему времени было обнаружено пять различных рецепторов LPA, LPAR1 (EDG2), LPAR2 (EDG4), LPAR3 (EDG7), LPAR4 (GPR23) и LPAR5 (GPR92). Все описанные LPA рецепторы принадлежат к классу A (родопсиноподобному классу) сопряженных с G белком рецепторов (GPCR).
LPAR5 обнаружен в дорсальных корешковых ганглиях мышей и людей, и ослабленное восприятие боли наблюдали у LPAR5-/- мышей (Oh et al., J Biol Chem (2008), 283, 21054-21064; Kinloch et al., Expert Opin Ther Targets (2005), 9, 685-698). Взаимодействие LPAR с различными субъединицами G белка в различных типах клеток вместе с различающейся экспрессией различных рецепторов LPA на одной клетке является основной причиной огромного разнообразия биологических эффектов LPA. Влияние LPA на активацию тромбоцитов человека описано в начале 1980-ых годов. Было обнаружено, что 1-O-алкил-sn-глицеро-3-фосфат (алкил-LPA) является более эффективным активатором тромбоцитов по сравнению с олеоил-LPA (Simon et al., Biochem Biophys Res Commun (1982), 108, 1743-1750). Последующие исследования отмечали, что так называемый рецептор алкил-LPA не является рецептором LPA ни EDG-типа, ни GPR23-типа (Tokumura et al., Biochem J (2002), 365, 617-628; Noguchi et al., J Biol Chem (2003), 278, 25600-25606; Khandoga et al., J Thromb Haemost (2007), Supplement 2: P-M-246 (ISTH 2007)). При временной экспрессии в клеточной линии гепатомы крыс RH7777, LPAR5 может активироваться более сильно алкил-LPA, чем ацил-LPA (Williams et al., J Biol Chem (2009), 284, 14558-14571). Настоящие данные соответствовали опосредованной LPA активации, наблюдаемой для тромбоцитов человека, в которых функциональный эффект алкил-LPA с точки зрения стимулирования агрегации тромбоцитов был более четко выражен, чем эффект ацил-LPA. Кроме того, LPA-рецепторы LPAR4 и LPAR5 в значительной степени экспрессируются тромбоцитами человека (Amisten et al., Thromb Res (2008), 122, 47-57). В отличие от LPAR5, который сопряжен с Gq, LPAR4 сопряжен с Gs и может, следовательно, быть исключен из участия в опосредованной LPA активации тромбоцитов человека. Вследствие этого LPAR5 рассматривается как центральный LPA-рецептор, ответственный за опосредованную LPA активацию в тромбоцитах человека (Khandoga et al., Platelets (2008), 19, 415-427). Высокая экспрессия LPAR5 в линиях тучных клеток человека продемонстрирована, например, Lundequist (Lundequist, J Allergy Clin Immunol (2008), 121, Suppl 1, Abstr 518) и последующими анализами.
Тучные клетки представляют собой часть иммунной системы и генерируются в виде клеток, являющихся предшественниками, в костном мозге, дифференцируясь до зрелых тучных клеток в «домашней» ткани. Тучные клетки принимают участие в ряде патофизиологических процессов, которые изменяются от противомикробной защиты до анафилаксии и воспалительного артрита и они рассматриваются, таким образом, как связанные с аллергическими реакциями. При активации, тучные клетки дегранулируют и высвобождают огромное количество медиаторов (цитокинов, таких как TNFα, MCP-1, цитокин А5) в интерстициальную ткань. Это указывает на непосредственный вклад тучных клеток в невропатическую боль высвобождением алгогенных медиаторов после дегрануляции.
Атеросклероз стимулируется тучными клетками не только за счет высвобождения провоспалительных цитокинов, дефицит тучных клеток ослабляет атеросклероз у мышей с недостатком аполипроеина E, и инфильтраты активированных тучных клеток можно наблюдать в месте коронарного атероматозного изъязвления или разрыва при инфаркте миокарда (Sun et al., Nat Med (2007), 13, 719-724; Smith et al., FASEB J (2008), 22, 1065,32; Kovanen et al., Circulation (1995), 92, 1084-1088). Настоящие данные обеспечивают убедительные доказательства центральной роли тучных клеток в развитии и прогрессировании атеросклеротических бляшек. В атеросклеротической бляшке тучные клетки способствуют росту бляшки и нестабильности посредством высвобождения хранимых и недавно синтезированных медиаторов, таких как (a) воспалительные цитокины, которые приводят к повышенной инвазии моноцитов и их дифференциации до макрофагов, (b) ангиогенные цитокины, такие как VEGF, которые могут вызывать ангиогенез в бляшке, с кровоизлиянием в бляшке, приводящим к повышенному риску разрыва бляшки, и (c) гистамин, вазоактивный компонент, о котором известно, что он увеличивает проницаемость сосудов с потенциальным риском повышенного притока LDL, пригодного для образования ксантомных клеток. Хотя абсолютное количество тучных клеток в атеросклеротических бляшках уступает количеству других воспалительных клеток в той же области, LPA в качестве первичного активирующего лиганда тучных клеток присутствует в высокой концентрации в атеросклеротических бляшках (Rother et al., Circulation (2003), 108, 741-747).
Помимо обсуждаемой выше роли тучных клеток в атеросклерозе, широкий спектр функций тучных клеток объясняет, почему тучные клетки участвуют в ряде патологий, помимо аллергических реакций, связанных с патологиями с воспалительным компонентом. Данные заболевания включают гипералгезию, астму, рассеянный склероз и ангиогенез, называя только некоторые из них (Zuo et al., Pain (2003), 105, 467-479; Toews et al., Biochim Biophys Acta (2002), 1582, 240-250; Norby, APMIS (2002), 110, 355-371). Обработка клеточной линии тучных клеток человека LAD2 короткой шпилечной РНК, мишенью которой является LPAR5, подавляет экспрессию LPAR5 и ослабляет ΜΙΡ-1β после активации LPA (Lundequist, J Allergy Clin Immunol (2008), 121, Suppl 1, Abstr 518).
Анализы рецепторного профиля LPA в линии клеток микроглии мышей BV-2 подтвердили высокую экспрессию LPAR5 в клетках микроглии, которые представляют собой популяцию клеток, подобно тучным клеткам воспалительной системы. Обнаружение того, что LPAR5 значительно экспрессируется не только в тучных клетках, но также в клетках микроглии, подчеркивает центральную роль LPAR5 в развитии и прогрессировании воспалительных заболеваний, таких как гипералгезия, астма, рассеянный склероз, ангиогенез и другие.
Дальнейшие эксперименты подтвердили, что в тромбоцитах человека и в тучных клетках человека и клетках микроглии LPAR5 представляет собой ключевой LPA рецептор, ответственный за опосредованную LPA активацию. Принимая во внимание важность LPAR5 для различных заболеваний, существует необходимость в соединениях, которые эффективно ингибируют LPAR5 и, например, вследствие этого, ингибируют активацию тучных клеток, например, в атеросклеротических бляшках, или активацию тромбоцитов в патологическом окружении, и в обеспечении новых возможных способов лечения заболеваний. Таким образом, задачей настоящего изобретения является предоставление LPAR5 антагонистов, которые порождают антагонизм влиянию эндогенной LPA на ее LPAR5 рецептор, и которые обладают дополнительными полезными свойствами, например стабильностью в плазме и печени и селективностью относительно других рецепторов, чей агонизм или антагонизм не предполагается. Данная задача достигается, согласно настоящему изобретению, предоставлением производных пиразола формулы I, которые обладают превосходной LPAR5 антагонистической активностью и представляют собой полезные агенты с высокой биодоступностью и которые можно применять для ингибирования агрегации тромбоцитов и лечения, например, тромбоэмболических заболеваний.
В WO 2011/015501, WO 2009/109613, WO 2009/109616, WO 2009/109618 и EP 0382276 описаны специфические производные 1-бензилиндазола для лечения заболеваний, связанных с экспрессией MCP-1, CX3CR1 и p40. GuoGang Tu et al, Journal of Enzyme Inhibition и Medicinal Chemistry, 2011, 26(2), 222-230 описывают некоторые соединения, полученные из 1,5-диарилпиразольного остова, с активностью, ингибирующей CB1 рецептор. Self C.R. et al, Journal of Medicinal Chemistry, 1991, 34, 772-777 описывает потенциальные, модифицирующие заболевание противоревматические лекарственные средства, включая определенные 1-фенилпроизводные пиразола.
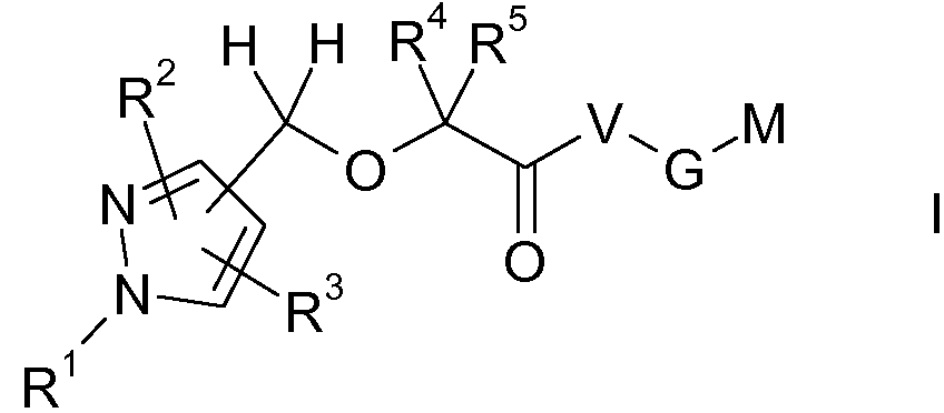
Объектом настоящего изобретения являются соединения формулы I, в любой из их стереоизомерных форм или в виде смеси стереоизомерных форм в любом соотношении, и их фармацевтически приемлемая соль
где
R1 выбран из группы, состоящей из водорода, (C1-C6)алкила, (C3-C7)циклоалкила, (C3-C7)циклоалкил-(C1-C4)алкила-, Ar и Ar(C1-C4)алкила-;
R2 и R3, каждый независимо друг от друга, выбран из группы, состоящей из водорода, галогена, (C1-C4)алкила, (C3-C7)циклоалкила, (C3-C7)циклоалкил-(C1-C4)алкила-, Ar, Ar(C1-C4)алкила-, (C1-C4)алкил-O-, (C3-C7)циклоалкил-O-, (C3-C7)циклоалкил-(C1-C4)алкил-O-, Ar-O- и Ar(C1-C4)алкил-O-,
R4 и R5, каждый независимо друг от друга, выбран из группы, состоящей из водорода, фтора и (C1-C6)алкила,
или группы R4 и R5 вместе с атомом углерода, несущим их, образуют (C3-C7)циклоалкановое кольцо, которое может быть незамещенным или замещено одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из фтора и (C1-C4)алкила;
R11, R12, R13 и R14, каждый независимо друг от друга, выбран из группы, состоящей из водорода и (C1-C4)алкила;
Ar выбран из группы, состоящей из фенила, нафтила и ароматического, 5-членного или 6-членного моноциклического гетероцикла, который содержит один или два одинаковых или различных гетероатома, выбранных из группы, состоящей из N, O и S, все из которых являются незамещенными или замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила, (C3-C7)циклоалкила, (C3-C7)циклоалкил-(C1-C4)алкила-, циано и (C1-C4)алкил-O-;
V выбран из группы, состоящей из R12-N(R13)-, и в данном случае G и M отсутствуют,
или
V выбран из группы, состоящей из -N(R14)-, -N(R14)-(C1-C4)алкила-, -O- и -O-(C1-C4)алкила-, и в данном случае
G выбран из группы, состоящей из прямой связи и фенилена, который может быть незамещенным или замещен одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила, циано и (C1-C4)алкил-O-, при условии, что G не является прямой связью, если V представляет собой -N(R14)- или -O-, и
M выбран из группы, состоящей из R11-O-C(O)- и R12-N(R13)-C(O)-;
где все алкильные группы являются незамещенными или замещены одним или более фторсодержащими заместителями, и все циклоалкильные группы являются незамещенными или замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из фтора и (C1-C4)алкила.
В одном из вариантов осуществления настоящее изобретение относится к соединениям формулы I, где
R1 выбран из группы, состоящей из водорода, (C1-C6)алкила, (C3-C7)циклоалкила, Ar и Ar(C1-C4)алкила-;
R2 и R3, каждый независимо друг от друга, выбран из группы, состоящей из водорода, (C1-C4)алкила, (C3-C7)циклоалкила, (C3-C7)циклоалкил-(C1-C4)алкила-, Ar, Ar(C1-C4)алкила-, (C1-C4)алкил-O-, (C3-C7)циклоалкил-O-, (C3-C7)циклоалкил-(C1-C4)алкил-O-, Ar-O- и Ar(C1-C4)алкил-O-,
R4 и R5, каждый независимо друг от друга, выбран из группы, состоящей из водорода и (C1-C6)алкила,
или группы R4 и R5, вместе с несущим их атомом углерода, образуют (C3-C7)циклоалкановое кольцо, которое может быть незамещенным или замещено одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из фтора и (C1-C4)алкила;
R11, R12, R13 и R14, независимо друг от друга, выбраны из группы, состоящей из водорода и (C1-C4)алкила;
Ar выбран из группы, состоящей из фенила, нафтила и ароматического 5-членного или 6-членного моноциклического гетероцикла, который содержит один или два одинаковых или различных гетероатома, выбранных из группы, состоящей из N, O и S, все из которых являются незамещенными или замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила, (C3-C7)циклоалкила, (C3-C7)циклоалкил-(C1-C4)алкила-, циано и (C1-C4)алкил-O-;
V выбран из группы, состоящей из -N(R14)-, -N(R14)-(C1-C4)алкила- и -O-(С1-C4)алкила-, и
G выбран из группы, состоящей из прямой связи и фенилена, который может быть незамещенным или замещен одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила, циано и (C1-C4)алкил-O-, при условии, что G не является прямой связью, если V представляет собой -N(R14)-, и
M выбран из группы, состоящей из R11-O-C(O)- и R12-N(R13)-C(O)-;
где все алкильные группы являются незамещенными или замещены одним или более фторсодержащими заместителями, и все циклоалкильные группы являются незамещенными или замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из фтора и (C1-C4)алкила;
и ко всем их стереоизомерным формам и смесям стереоизомерных форм в любом соотношении, и их фармацевтически приемлемым солям.
В другом варианте осуществления настоящее изобретение относится к соединениям формулы I, где
R1 выбран из группы, состоящей из (C1-C6)алкила, (C3-C7)циклоалкила, Ar и Ar(C1-C4)алкила-;
R2 и R3, каждый независимо друг от друга, выбран из группы, состоящей из водорода, (C1-C4)алкила, Ar, Ar(C1-C4)алкила-, (C1-C4)алкил-O-, (C3-C7)циклоалкил-O-, Ar-O- и Ar(C1-C4)алкил-O-,
R4 и R5, каждый независимо друг от друга, выбран из группы, состоящей из водорода и (C1-C6)алкила,
или группы R4 и R5, вместе с несущим их атомом углерода, образуют (C3-C7)циклоалкановое кольцо, которое может быть незамещенным или замещено одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из фтора и (C1-C4)алкила;
R11, R12, R13 и R14, независимо друг от друга, выбраны из группы, состоящей из водорода и (C1-C4)алкила;
Ar выбран из группы, состоящей из фенила, нафтила и ароматического, 5-членного или 6-членного моноциклического гетероцикла, который содержит один или два одинаковых или различных гетероатома, выбранных из группы, состоящей из N, O и S, все из которых являются незамещенными или замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила, (C3-C7)циклоалкила и (C1-C4)алкил-O-;
V выбран из группы, состоящей из -N(R14)- и -N(R14)-(C1-C4)алкила-, и
G выбран из группы, состоящей из прямой связи и фенилена, который может быть незамещенным или замещен одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила и (C1-C4)алкил-O-, при условии, что G не является прямой связью, если V представляет собой -N(R14)-, и
M выбран из группы, состоящей из R11-O-C(O)- и R12-N(R13)-C(O)-;
где все алкильные группы являются незамещенными или замещены одним или более фторсодержащими заместителями, и все циклоалкильные группы являются незамещенными или замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из фтора и (C1-C4)алкила;
и ко всем стереоизомерным формам и смесям стереоизомерных форм в любом соотношении, и их фармацевтически приемлемым солям.
В другом варианте осуществления настоящее изобретение относится к соединениям формулы I, где
R1 выбран из группы, состоящей из (C1-C4)алкила, Ar и Ar(C1-C4)алкила-;
R2 и R3, каждый независимо друг от друга, выбран из группы, состоящей из водорода, (C1-C4)алкила, Ar, Ar(C1-C4)алкила- и Ar-O-,
R4 и R5, каждый независимо друг от друга, выбран из группы, состоящей из водорода и (C1-C6)алкила,
или группы R4 и R5, вместе с несущим их атомом углерода, образуют (C3-C7)циклоалкановое кольцо, которое может быть незамещенным или замещено одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из фтора и (C1-C4)алкила;
R11 и R14, каждый независимо друг от друга, выбран из группы, состоящей из водорода и (C1-C4)алкила;
Ar выбран из группы, состоящей из фенила, нафтила и ароматического, 5-членного или 6-членного моноциклического гетероцикла, который содержит один или два одинаковых или различных гетероатома, выбранных из группы, состоящей из N, O и S, все из которых являются незамещенными или замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила, (C3-C7)циклоалкила и (C1-C4)алкил-O-;
V выбран из группы, состоящей из -N(R14)- и -N(R14)-(C1-C4)алкила-, и
G выбран из группы, состоящей из прямой связи и фенилена, который может быть незамещенным или замещен одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила и (C1-C4)алкил-O-, при условии, что G не является прямой связью, если V представляет собой -N(R14), и
M представляет собой R11-O-C(O)-;
где все алкильные группы являются незамещенными или замещены одним или более фторсодержащими заместителями, и все циклоалкильные группы являются незамещенными или замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из фтора и (C1-C4)алкила;
и ко всем стереоизомерным формам и смесям стереоизомерных форм в любом соотношении, и их фармацевтически приемлемым солям.
В другом варианте осуществления настоящее изобретение относится к соединениям формулы I, где
R1 выбран из группы, состоящей из (C1-C4)алкила, Ar и Ar(C1-C4)алкила-;
R2 и R3, каждый независимо друг от друга, выбран из группы, состоящей из водорода, (C1-C4)алкила, Ar- и Ar-O-,
R4 и R5, каждый независимо друг от друга, выбран из группы, состоящей из водорода и (C1-C6)алкила,
или группы R4 и R5, вместе с несущим их атомом углерода, образуют (C3-C7)циклоалкановое кольцо, которое может быть незамещенным или замещено одним или более фторсодержащими заместителями;
R11 и R14, каждый независимо друг от друга, выбран из группы, состоящей из водорода и (C1-C4)алкила;
Ar выбран из группы, состоящей из фенила, нафтила и ароматического, 5-членного или 6-членного моноциклического гетероцикла, который содержит один или два одинаковых или различных гетероатома, выбранных из группы, состоящей из N, O и S, все из которых являются незамещенными или замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила, (C3-C7)циклоалкила и (C1-C4)алкил-O-;
V выбран из группы, состоящей из -N(R14)- и -N(R14)-(C1-C4)алкила-, и
G выбран из группы, состоящей из прямой связи и фенилена, который может быть незамещенным или замещен одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила и (C1-C4)алкил-O-, при условии, что G не является прямой связью, если V представляет собой -N(R14), и
M представляет собой R11-O-C(O)-;
где все алкильные группы являются незамещенными или замещены одним или более фторсодержащими заместителями;
и ко всем стереоизомерным формам и смесям стереоизомерных форм в любом соотношении, и их фармацевтически приемлемым солям.
В одном из вариантов осуществления соединения формулы I определены, как указано выше, и R1 выбран из группы, состоящей из (C1-C6)алкила, (C3-C7)циклоалкила, (C3-C7)циклоалкил-(C1-C4)алкила-, Ar и Ar(C1-C4)алкила-, в другом варианте осуществления из группы, состоящей из (C1-C6)алкила, Ar и Ar(C1-C4)алкила-, в другом варианте осуществления из группы, состоящей из (C1-C4)алкила, Ar и Ar(C1-C4)алкила-, в другом варианте осуществления из группы, состоящей из (C1-C6)алкила и Ar, в другом варианте осуществления из группы, состоящей из (C1-C4)алкила и Ar, в другом варианте осуществления из группы, состоящей из Ar и Ar(C1-C4)алкила-, в другом варианте осуществления R1 представляет собой Ar, где все Ar группы являются незамещенными или замещены, как указано выше. В одном из вариантов осуществления Ar(C1-C4)алкильная группа, представляющая R1, представляет собой Ar(C1-C2)алкильную группу, в другом варианте осуществления группу Ar-CH2-. В одном из вариантов осуществления группа Ar, представляющая R1, представляет собой фенильную группу, которая может быть незамещенной или замещена, как указано выше. В одном из вариантов осуществления замещенная Ar группа или фенильная группа, представляющая R1, замещена одним, двумя или тремя, в другом варианте осуществления одним или двумя, в другом варианте осуществления одним, одинаковыми или различными заместителями, где в одном из вариантов осуществления заместители выбраны из группы, состоящей из галогена, (C1-C4)алкила, циано и (C1-C4)алкил-O-, в другом варианте осуществления из группы, состоящей из галогена, (C1-C4)алкила и циано, в другом варианте осуществления из группы, состоящей из галогена, (C1-C4)алкила и (C1-C4)алкил-O-, в другом варианте осуществления из группы, состоящей из галогена и (C1-C4)алкила, и в другом варианте осуществления они представляют собой одинаковые или различные галогеновые заместители, например хлор.
В одном из вариантов осуществления соединения формулы I определены, как указано выше, и R2 и R3, каждый независимо друг от друга, выбран из группы, состоящей из водорода, галогена, (C1-C4)алкила, Ar, Ar(C1-C4)алкила-, (C1-C4)алкил-O-, Ar-O- и Ar(C1-C4)алкил-O-, в другом варианте осуществления из группы, состоящей из водорода, (C1-C4)алкила, Ar, Ar(C1-C4)алкила-, (C1-C4)алкил-O-, Ar-O- и Ar(C1-C4)алкил-O-, в другом варианте осуществления из группы, состоящей из водорода, (C1-C4)алкила, Ar, Ar(C1-C4)алкила- и Ar-O-, в другом варианте осуществления из группы, состоящей из (C1-C4)алкила, Ar, Ar(C1-C4)алкила- и Ar-O-, в другом варианте осуществления из группы, состоящей из водорода, (C1-C4)алкила, Ar и Ar-O-, в другом варианте осуществления из группы, состоящей из (C1-C4)алкила, Ar и Ar-O-, в другом варианте осуществления из группы, состоящей из водорода, (C1-C4)алкила и Ar, в другом варианте осуществления из группы, состоящей из (C1-C4)алкила и Ar, где все группы Ar, встречающиеся в R2 и R3, являются незамещенными или замещены, как указано выше.
В одном из вариантов осуществления одна из групп R2 и R3 представляет собой группу Ar или содержит группу Ar, и вторая из групп R2 и R3 выбрана из группы, состоящей из водорода, (C1-C4)алкила и Ar, в другом варианте осуществления из группы, состоящей из (C1-C4)алкила и Ar, в другом варианте осуществления из группы, состоящей из водорода и (C1-C4)алкила. В одном из вариантов осуществления, группа Ar, встречающиеся в R2 или R3, выбрана из группы, состоящей из фенила, нафтила и ароматического, 5-членного или 6-членного моноциклического гетероцикла, который содержит один гетероатом кольца, выбранный из группы, состоящей из N, O и S, в другом варианте осуществления из группы, состоящей из фенила и ароматического, 5-членного или 6-членного моноциклического гетероцикла, который содержит один гетероатом кольца, выбранный из группы, состоящей из N, O и S, в другом варианте осуществления из группы, состоящей из фенила, нафтила и тиенила, в другом варианте осуществления из группы, состоящей из фенила и тиенила, в другом варианте осуществления из группы, состоящей из фенила и нафтила, и в другом варианте осуществления она представляет собой фенильную группу, все из которых являются незамещенными или замещены, как указано выше. В одном из вариантов осуществления количество заместителей в замещенной группе Ar, встречающейся в R2 или R3, равно одному, двум или трем, в другом варианте осуществления оно равно одному или двум, в другом варианте осуществления оно равно одному. В одном из вариантов осуществления заместители в замещенной группе Ar, встречающейся в R2 или R3, выбраны из группы, состоящей из галогена, (C1-C4)алкила, (C3-C7)циклоалкила, циано и (C1-C4)алкил-O-, в другом варианте осуществления из группы, состоящей из галогена, (C1-C4)алкила, (C3-C7)циклоалкила и (C1-C4)алкил-O-, в другом варианте осуществления из группы, состоящей из галогена и (C1-C4)алкила, где (C1-C4)алкильные заместители являются незамещенными или замещены одним или более фторсодержащими заместителями. В одном из вариантов осуществления (C1-C4)алкильный заместитель присутствует в группе Ar, встречающейся в R2 или R3, представляет собой перфторалкильную группу, например трифторметильную группу CF3. В одном из вариантов осуществления галогеновые заместители присутствуют в группе Ar, встречающейся в R2 или R3, представляют собой фторсодержащие и/или хлорсодержащие заместители.
В одном из вариантов осуществления соединения формулы I определены, как указано выше, и R4 и R5, каждый независимо друг от друга, выбран из группы, состоящей из водорода, фтора и (C1-C4)алкила, в другом варианте осуществления из группы, состоящей из водорода и (C1-C4)алкила, в другом варианте осуществления из группы, состоящей из водорода и (C1-C3)алкила, в другом варианте осуществления из группы, состоящей из водорода, метила, этила, н-пропила и изопропила, в другом варианте осуществления из группы, состоящей из водорода и метила, и в другом варианте осуществления по меньшей мере одна из групп R4 и R5 является отличной от водорода, или группы R4 и R5, вместе с несущим их атомом углерода, образуют (C3-C7)циклоалкановое кольцо, в одном из вариантов осуществления (C4-C6)циклоалкановое кольцо, в другом варианте осуществления (C5-C6)циклоалкановое кольцо, где все циклоалкановые кольца являются незамещенными или замещены, как указано выше.
В другом варианте осуществления соединений R4 и R5, каждый независимо друг от друга, выбран из группы, состоящей из водорода, фтора и (C1-C4)алкила, в другом варианте осуществления из группы, состоящей из водорода и (C1-C4)алкила, в другом варианте осуществления из группы, состоящей из водорода и (C1-C3)алкила, в другом варианте осуществления из группы, состоящей из водорода, метила, этила, н-пропила и изопропила, в другом варианте осуществления из группы, состоящей из водорода и метила. В одном из вариантов осуществления одна из групп R4 и R5 представляет собой водород, и другая является такой, как определено выше, в другом варианте осуществления обе группы R4 и R5 представляют собой водород, в другом варианте осуществления по меньшей мере одна из групп R4 и R5 является отличной от водорода, в другом варианте осуществления обе группы R4 и R5 представляют собой (C1-C4)алкил, в другом варианте осуществления обе группы R4 и R5 представляют собой (C1-C3)алкил, и в другом варианте осуществления обе группы R4 и R5 выбраны из группы, состоящей из метила, этила, н-пропила и изопропила. В одном из вариантов осуществления группы R4 и R5 являются одинаковыми.
В другом варианте осуществления R4 и R5 образуют, вместе с несущим их атомом углерода, (C3-C7)циклоалкановое кольцо, в другом варианте осуществления (C4-C6)циклоалкановое кольцо, в другом варианте осуществления (C5-C6)циклоалкановое кольцо, где все циклоалкановые кольца являются незамещенными или замещены, как указано выше. Как правило, количество заместителей в замещенном циклоалкановом кольце, образованном R4 и R5, вместе с несущим их атомом углерода, в одном из вариантов осуществления настоящего изобретения равно одному, двум, трем или четырем, в другом варианте осуществления одному, двум или трем, в другом варианте осуществления одному или двум, и в другом варианте осуществления циклоалкановое кольцо, образованное R4 и R5, вместе с несущим их атомом углерода, является незамещенным.
В одном из вариантов осуществления соединения формулы I определены, как указано выше, и R11, R12, R13 и R14, независимо друг от друга, выбраны из группы, состоящей из водорода, метила и этила, в другом варианте осуществления из группы, состоящей из водорода и метила, и в другом варианте осуществления они представляют собой водород.
В одном из вариантов осуществления соединения формулы I определены, как указано выше, и Ar выбран из группы, состоящей из фенила и нафтила, в другом варианте осуществления из группы, состоящей из фенила и ароматического, 5-членного или 6-членного моноциклического гетероцикла, который содержит один или два одинаковых или различных гетероатома, выбранных из группы, состоящей из N, O и S, в другом варианте осуществления один гетероатом кольца выбран из группы, состоящей из N, O и S, и в другом варианте осуществления Ar представляет собой фенил, все из которых являются незамещенными или замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила, (C3-C7)циклоалкила, (C3-C7)циклоалкил-(C1-C4)алкила-, циано и (C1-C4)алкил-O-, в другом варианте осуществления из группы, состоящей из галогена, (C1-C4)алкила, (C3-C7)циклоалкила, циано и (C1-C4)алкил-O-, в другом варианте осуществления из группы, состоящей из галогена, (C1-C4)алкила, (C3-C7)циклоалкила и (C1-C4)алкил-O-, в другом варианте осуществления из группы, состоящей из галогена, (C1-C4)алкила и (C1-C4)алкил-O-, в другом варианте осуществления из группы, состоящей из галогена, (C1-C4)алкила и (C3-C7)циклоалкила, в другом варианте осуществления из группы, состоящей из галогена и (C1-C4)алкила, где алкильные заместители могут быть незамещенными или замещены одним или более фторсодержащими заместителями. В одном из вариантов осуществления замещенная группа Ar содержит один, два или три одинаковых или различных заместителя, в другом варианте осуществления один или два одинаковых или различных заместителя, в другом варианте осуществления один заместитель, где все группы Ar являются независимыми друг от друга.
Если двухвалентная группа V представляет собой группу -N(R14)-(C1-C4)алкил- или группу -O-(C1-C4)алкил-, группа G присоединена к ее (C1-C4)алкильной группе. В одном из вариантов осуществления соединения формулы I определены, как указано выше, и V выбран из группы, состоящей из -N(R14)- и -N(R14)-(C1-C4)алкила-, и в данном случае, G выбран из группы, состоящей из прямой связи и фенилена, и в другом варианте осуществления представляет собой фенилен, где все фениленовые группы являются незамещенными или замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила, циано и (C1-C4)алкил-O-, при условии, что G не является прямой связью, если V представляет собой -N(R14)-, и M представляет собой R11-O-C(O)-, в другом варианте осуществления HO-C(O)-.
В другом варианте осуществления соединения формулы I определены, как указано выше, и V выбран из группы, состоящей из R12-N(R13)-, и в данном случае, G и M отсутствуют.
В другом варианте осуществления V выбран из группы, состоящей из -N(R14)-, -N(R14)-(C1-C4)алкила-, -O- и -O-(C1-C4)алкила-, в другом варианте осуществления из группы, состоящей из -N(R14)- и -N(R14)-(C1-C4)алкила-, в другом варианте осуществления из группы, состоящей из -N(R14)- и -N(R14)-(C1-C3)алкила-, и в данном случае, G выбран из группы, состоящей из прямой связи и фенилена, и в одном из вариантов осуществления представляет собой фенилен, где все фениленовые группы являются незамещенными или замещены, как указано выше, при условии, что G не является прямой связью, если V представляет собой -N(R14)- или -O-, и M представляет собой R11-O-C(O)- или R12-N(R13)-C(O)-, в другом варианте осуществления R11-O-C(O)-, в другом варианте осуществления HO-C(O)-.
В одном из вариантов осуществления, G представляет собой прямую связь, в другом варианте осуществления G представляет собой фенилен, который является незамещенным или замещен, как указано выше. В одном из вариантов осуществления, замещенная фениленовая группа, представляющая G, содержит один или два одинаковых или различных заместителя, в другом варианте осуществления она содержит один заместитель, который выбран из группы, состоящей из галогена и (C1-C4)алкила, и в другом варианте осуществления представляет собой галоген. В одном из вариантов осуществления фениленовая группа, представляющая G, является незамещенной. В одном из вариантов осуществления фениленовая группа, представляющая G, выбрана из группы, состоящей из 1,3-фенилена и 1,4-фенилена, в другом варианте осуществления она представляет собой 1,4-фенилен.
Группа M-G-V-C(O)-C(R4)(R5)-O-CH2- в соединениях формулы I может быть соединена с любым из атомов углерода кольца 1H-пиразольного кольца, изображенного в формуле I, т.е. в положении 3, в положении 4 или в положении 5 1H-пиразольного кольца, как обозначено свободной связью в CH2 группе указанной группы, где связь не направлена к конкретному кольцевому атому углерода. В одном из вариантов осуществления настоящего изобретения группа M-G-V-C(O)-C(R4)(R5)-O-CH2- присоединена в положении 3 пиразольного кольца, и соединение формулы I, таким образом, представляет собой соединение формулы Ia, в другом варианте осуществления указанная группа присоединена в положении 4 пиразольного кольца, и соединение формулы I, таким образом, представляет собой соединение формулы Ib, и в другом варианте осуществления указанная группа присоединена в положении 5 пиразольного кольца, и соединение формулы I, таким образом, представляет собой соединение формулы Ic, в другом варианте осуществления указанная группа присоединена в положении 3 или положении 4, в другом варианте осуществления указанная группа присоединена в положении 3 или положении 5, и в другом варианте осуществления указанная группа присоединена в положении 4 или положении 5.
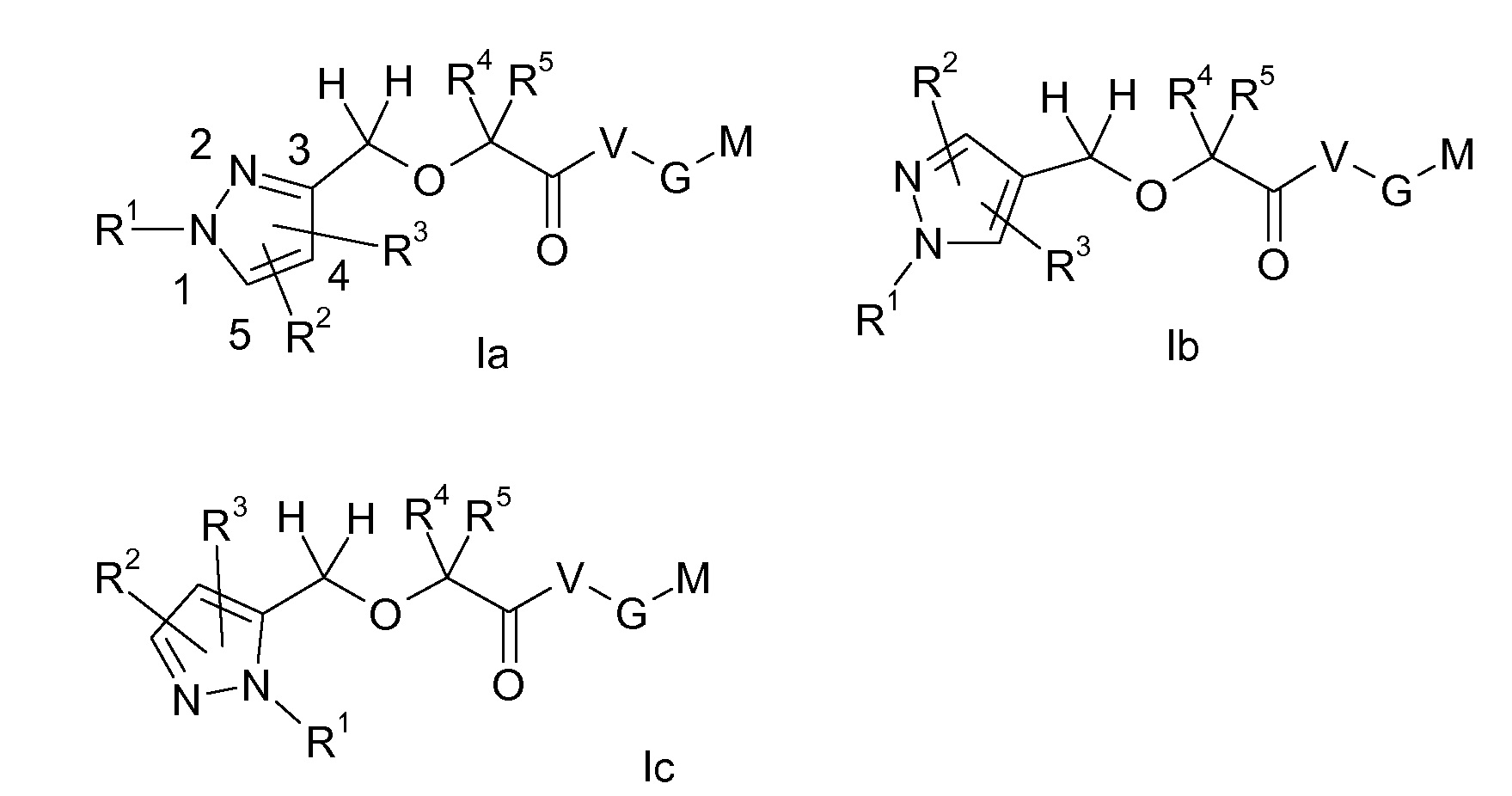
Аналогично, группы R2 и R3 в соединениях формулы I, а также в соединениях формул Ia, Ib и Ic могут быть присоединены к любому кольцевому атому углерода пиразольного кольца, изображенного в формуле I, который не занят группой M-G-V-C(O)-C(R4)(R5)-O-CH2-, т.е. в положениях 3 и 4, в положениях 3 и 5 или в положениях 4 и 5 пиразольного кольца. Группы R1-R5, V, G и M в соединениях формулы Ia, Ib и Ic определены, как в соединениях формулы I.
В одном из вариантов осуществления настоящего изобретения соединение формулы I выбрано из группы, состоящей из
4-({2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]-2-метилпропиониламино}метил)бензойной кислоты,
4-({2-[1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]-2-метилпропиониламино}метил)бензойной кислоты,
4-({2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]ацетиламино}метил)бензойной кислоты,
4-({2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]бутириламино}метил)бензойной кислоты,
4-({2-[1-(2-хлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]-2-метилпропиониламино}метил)бензойной кислоты,
4-({2-[1-(4-хлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]-2-метилпропиониламино}метил)бензойной кислоты,
4-({2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]пропиониламино}метил)бензойной кислоты,
4-{2-[1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]пропиониламино}бензойной кислоты,
4-{2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]-3-метилбутириламино}бензойной кислоты,
4-{2-[1-(4-хлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]пропиониламино}бензойной кислоты,
4-[2-(3-нафталин-2-ил-1-фенил-1H-пиразол-4-илметокси)пропиониламино]бензойной кислоты,
4-{2-[1-(2-хлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]пропиониламино}бензойной кислоты,
4-[2-(3,5-диметил-1-фенил-1H-пиразол-4-илметокси)пропиониламино]бензойной кислоты,
4-[2-(1,3-дифенил-1H-пиразол-4-илметокси)пропиониламино]бензойной кислоты,
4-{2-[1-бензил-3-(3-метоксифенил)-1H-пиразол-4-илметокси]пропиониламино}бензойной кислоты,
4-{2-[5-(4-фторфенокси)-1-метил-3-фенил-1H-пиразол-4-илметокси]пропиониламино}бензойной кислоты,
4-{2-[3-(4-циклогексилфенил)-1-фенил-1H-пиразол-4-илметокси]пропиониламино}бензойной кислоты,
4-[2-(1-фенил-3-тиофен-2-ил-1H-пиразол-4-илметокси)пропиониламино]бензойной кислоты и
4-[2-(1,5-дифенил-1H-пиразол-3-илметокси)пропиониламино]бензойной кислоты,
и всех их стереоизомерных форм и смесей стереоизомерных форм в любом соотношении, и их фармацевтически приемлемых солей.
Если структурные элементы, такие как группы или заместители, например, алкильная, циклоалкильная или Ar группы, могут встречаться несколько раз в соединениях формулы I, все они являются независимыми друг от друга и могут в каждом случае иметь указанные значения, и они могут в каждом случае быть одинаковыми или отличаться от любого другого данного элемента.
Термин алкил следует понимать как обозначающий остаток насыщенного ациклического углеводорода, который может быть линейным, то есть с нормальной цепью, или разветвленным. Если не определено иначе, алкил содержит 1-6 атомов углерода или 1-4 атома углерода. Примеры (C1-C6)алкила и (C1-C4)алкила представляют собой алкильные остатки, содержащие 1, 2, 3, 4, 5 или 6 атомов углерода или 1, 2, 3 или 4 атома углерода, соответственно, включая метил, этил, пропил, бутил, пентил и гексил, н-изомеры данных остатков, изопропил, изобутил, 1-метилбутил, изопентил, неопентил, 2,2-лиметилбутил, 2-метилпентил, 3-метилпентил, изогексил, втор-бутил, трет-бутил и трет-пентил. Все данные утверждения также применимы, если алкильная группа замещена или встречается в виде заместителя в другом остатке, например, в алкил-O- остатке (алкилокси остаток, алкокси остаток), алкил-O-C(O)- остатке (алкилоксикарбонильный остаток) или арилалкильном остатке.
Алкильные группы могут, как правило, независимо от любых других заместителей, которые содержат алкильные группы, быть незамещенными или замещены одним или более фторсодержащими заместителями, например, одним, двумя, тремя, четырьмя или пятью фторсодержащими заместителями, или одним, двумя или тремя фторсодержащими заместителями. Такая замещенная фтором алкильная группа может также представлять собой перфторалкильные группы, т.е. алкильные группы, в которых все атомы водорода заменены атомами фтора. Примерами замещенных фтором алкильных групп являются -CF3, -CHF2, -CH2F и -CF2-CF3, из которых -CF3 и -CF2-CF3 представляют собой примеры перфторалкильных групп. В одном из вариантов осуществления алкильная группа при любом появлении, независимо от других появлений и независимо от любых других заместителей, которые содержат алкильные группы, не замещена фтором, в другом варианте осуществления она замещена фтором.
Термин (C3-C7)циклоалкил следует понимать как обозначающий остаток насыщенного циклического углеводородного кольца, содержащего 3-7 атомов углерода кольца в моноциклическом кольце. Примерами (C3-C7)циклоалкила являются циклоалкильные остатки, содержащие 3, 4, 5, 6 или 7 атомов углерода кольца, подобно циклопропилу, циклобутилу, циклопентилу, циклогексилу или циклогептилу. Все циклоалкильные группы могут быть незамещенными или замещены одним или более, например, одним, двумя, тремя или четырьмя одинаковыми или различными заместителями, выбранными из группы, состоящей из фтора и (C1-C4)алкила. В одном из вариантов осуществления циклоалкильная группа не замещена фтором и/или алкилом.
Термин (C3-C7)циклоалкан, который относится к группе, которая может быть образована R4 и R5, вместе с несущим их атомом углерода, следует понимать как обозначающий циклопропановое, циклобутановое, циклопентановое, циклогексановое или циклогептановое кольцо, один кольцевой атом углерода которого, изображенный в формуле I, содержит группы R4 и R5, соединен с соседним атомом кислорода и C(O) группой, изображенной в формуле I.
Термин Ar следует понимать как обозначающий фенил, нафтил или остаток ароматического, 5-членного или 6-членного моноциклического углеводородного кольца, где в указанном углеводородном кольце один или два атома углерода кольца заменены одинаковыми или различными гетероатомами кольца, выбранными из группы, состоящей из N, O и S, такой как фуранильный, пиридинильный, оксазолильный, изоксазолильный, тиазолильный, изотиазолильный, имидазолильный, пиразинильный, пиридазинильный, пиримидинильный, пирролильный, пиразолильный и тиенильный остатки, все из которых могут быть незамещенными или замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила, (C3-C7)циклоалкила, (C3-C7)циклоалкил-(C1-C4)алкила-, циано и (C1-C4)алкил-O-. Нафтил может представлять собой 1-нафтил и 2-нафтил.
Галоген представляет собой фтор, хлор, бром или йод. В одном из вариантов осуществления галоген при любом из его появлений, независимо от других появлений, выбран из группы, состоящей из фтора, хлора и брома, в другом варианте осуществления из группы, состоящей из фтора и хлора.
Оптически активные атомы углерода, присутствующие в соединениях формулы I, могут независимо друг от друга иметь R конфигурацию или S конфигурацию. Соединения формулы I могут присутствовать в виде чистых энантиомеров или чистых диастереомеров, или в виде смеси энантиомеров и/или диастереомеров в любом соотношении, например, в виде рацематов. Настоящее изобретение относится к чистым энантиомерам и смесям энантиомеров, а также чистым диастереомерам и смесям диастереомеров. Настоящее изобретение включает смеси двух или более чем двух стереоизомеров формулы I, и оно включает все соотношения стереоизомеров в смеси. В случае, когда соединения формулы I могут присутствовать в виде E изомеров или Z изомеров (или цис-изомеров, или транс-изомеров), настоящее изобретение относится как к чистым E изомерам, так и чистым Z изомерам и к E/Z смесям во всех соотношениях. Настоящее изобретение также включает все таутомерные формы соединений формулы I.
Диастереомеры, включая E/Z изомеры, можно разделить на отдельные изомеры, например хроматографией. Рацематы можно разделить на энантиомеры общепринятыми способами, например хроматографией на хиральных фазах, или разделением, например кристаллизацией диастереомерных солей, полученных с оптически активными кислотами или основаниями. Стереохимически однородные соединения формулы I можно также получить, используя стереохимически однородные исходные соединения или применяя стереоселективные реакции.
Под фармацевтически приемлемыми солями соединений формулы I следует понимать нетоксичные соли, которые являются физиологически приемлемыми и фармацевтически пригодными солями. Такие соли соединений формулы I, содержащие кислотные группы, например, карбоксильную группу COOH, представляют собой, например, соли щелочных металлов или соли щелочноземельных металлов, такие как натриевые соли, калиевые соли, магниевые соли и кальциевые соли, а также соли с фармацевтически приемлемыми четвертичными аммониевыми ионами, таким как тетраметиламмоний или тетраэтиламмоний, и кислотно-аддитивные соли с аммиаком и фармацевтически приемлемыми органическими аминами, такими как метиламин, диметиламин, триметиламин, этиламин, триэтиламин, этаноламин или трис(2-гидроксиэтил)амин. Основные группы, содержащиеся в соединениях формулы I, образуют кислотно-аддитивные соли, например, с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота или фосфорная кислота, или с органическими карбоновыми кислотами и сульфокислотами, такими как муравьиная кислота, уксусная кислота, щавелевая кислота, лимонная кислота, молочная кислота, яблочная кислота, янтарная кислота, малоновая кислота, бензойная кислота, малеиновая кислота, фумаровая кислота, винная кислота, метансульфоновая кислота или п-толуолсульфоновая кислота.
Соединения формулы I, которые одновременно содержат основную группу и кислотную группу, могут также присутствовать в виде цвиттерионов (бетаинов), которые, аналогично, включены в настоящее изобретение.
Соли соединений формулы I можно получить общепринятыми способами, известными специалисту в данной области техники, напримерсмешением соединения формулы I с неорганической или органической кислотой или основанием в растворителе или диспергаторе, или из других солей катионным обменом или анионным обменом. Настоящее изобретение также включает все соли соединений формулы I, которые, из-за низкой физиологической переносимости, не являются непосредственно приемлемыми для применения в фармацевтических средствах, но являются подходящими, например, в качестве промежуточных соединений для проведения последующих химических модификаций соединений формулы I или в качестве исходных соединений для получения фармацевтически приемлемых солей.
Настоящее изобретение также включает сольваты, производные и модификации соединений формулы I, например, пролекарства, защищенные формы и другие фармацевтически приемлемые производные. Настоящее изобретение относится, в частности, к пролекарствам и защищенным формам соединений формулы I, которые можно преобразовать в соединения формулы I в физиологических условиях. Подходящие пролекарства для соединений формулы I, т.е. химически модифицированные производные соединений формулы I, обладающие свойствами, которые улучшены требуемым способом, например, что касается растворимости, биодоступности или продолжительности действия, являются известными специалисту в данной области техники. Более подробная информация, относящаяся к пролекарствам, находится в стандартной литературе, подобно, например, Design of Prodrugs, H. Bundgaard (ed.), Elsevier, 1985; Fleisher et al., Advanced Drug Delivery Reviews 19 (1996) 115-130; H. Bundgaard, Drugs of the Future 16 (1991) 443; Hydrolysis in Drug and Prodrug Metabolism, B. Testa, J. M. Mayer, Wiley-VCH, 2003.
Подходящие пролекарства для соединений формулы I представляют собой особенно ацильные пролекарства и карбаматные пролекарства ацилируемых содержащих азот групп, таких как аминогруппы, и эфирные пролекарства и амидные пролекарства карбоксильных групп, которые могут присутствовать в соединениях формулы I. В ацильных пролекарствах и карбаматных пролекарствах атомы водорода при атоме азота в данных группах заменены ацильной группой или эфирной группой, например (C1-C6)алкил-O-C(O)-группой. Подходящие ацильные группы и эфирные группы для ацильных пролекарств и карбаматных пролекарств представляют собой, например группы Rp1-CO- и Rp2O-CO-, где Rp1 может представлять собой водород, (C1-C6)алкил, (C3-C7)циклоалкил, (C3-C7)циклоалкил-(C1-C4)алкил-, Ar, (C6-C14)арил, (C6-C14)арил-(C1-C4)алкил- или Ar(C1-C4)алкил-, и где Rp2 имеет значения, указанные для Rp1, за исключением водорода. Термин (C6-C14)арил следует понимать, как обозначающий остаток моноциклического, бициклического или трициклического ароматического углеводорода, содержащего 6-14 атомов углерода кольца, например 6, 7, 8, 9, 10, 11, 12, 13 или 14 атомов углерода кольца. Примерами являются фенил, нафтил, например, 1-нафтил и 2-нафтил или бифенилил.
Также, относительно всех вариантов осуществления настоящего изобретения, приведенных в настоящем описании, включенные соединения формулы I относятся к настоящему изобретению во всех своих стереоизомерных формах и смесях стереоизомерных форм в любом соотношении, и в виде их фармацевтически приемлемых солей, а также в виде их пролекарств.
Настоящее изобретение также относится к способам получения соединений формулы I, которыми можно получить соединения и которые представляют собой другой объект настоящего изобретения.
Соединения формулы I можно получить, применяя способы и технологии, которые являются хорошо известными per se и известными специалисту в данной области техники. Исходные соединения или компоненты для использования в общих синтетических способах, которые можно применять в получении соединений формулы I, являются легкодоступными специалисту в данной области техники. Во многих случаях они коммерчески доступны или описаны в литературе. С другой стороны, они могут быть получены из легкодоступных соединений, являющихся предшественниками, аналогично способам, описанным в литературе, или способами или аналогично способам, описанным в настоящем описании.
Как правило, соединения формулы I можно получить, например, в рамках конвергентного синтеза, соединением двух или более фрагментов, которые можно получить ретросинтетически из формулы I. Более конкретно, подходящим образом замещенные исходные производные пиразола используют в качестве компонентов в получении соединений формулы I. Если они не являются коммерчески доступными, данные производные пиразола можно получить согласно хорошо известным стандартным способам получения пиразольных кольцевых систем. Выбрав подходящие молекулы, являющиеся предшественниками, получение данных пиразолов позволяет вводить ряд заместителей в различные части пиразольной системы, которые можно химически модифицировать для того, чтобы в конце получить молекулу формулы, I имеющую требуемый набор заместителей. В качестве одного из современных обзоров, в котором приведены многочисленные подробности и литературные ссылки на химию пиразола и на способы их получения, можно привести J. Eiguero в Comprehensive Heterocyclic Chemistry II, Eds. A. Katritzky, Ch. Rees, E. Scriven, Elsevier 1996, Vol. 3; K. Kirschke в Houben-Weyl, Methoden der Organischen Chemie (Methods of Organic Chemistry), Georg Thieme Verlag, Stuttgart, Germany, 1994, Vol. E8b Hetarene; T. Nagai et al. Org. Prep. Proced. Int. (1993), 25, 403; M. Elnagdi et al. Heterocycles (1985) 23, 3121; K. Makino et al. J. Heterocycl. Chem. (1998) 35, 489; K. Makino et al. J. Heterocycl. Chem. (1999) 36, 321. Если исходные производные пиразола не являются коммерчески доступными и их требуется получить, это можно осуществить, например, согласно хорошо известным способам получения пиразолов, приведенным выше. В зависимости от заместителей в исходных соединениях, в определенных способах получения пиразолов можно получить смеси изомеров положения, которые, однако можно также разделить современными способами разделения, подобно, например, препаративной ВЭЖХ.
В дальнейшем перечислены и даны краткие ссылки на некоторые представляющие интерес методики синтеза соединений настоящего изобретения. Они иллюстрируют некоторые из возможных путей получения подходящих производных пиразола, и они представляют собой стандартные способы, всесторонне обсуждаемые в литературе и являющиеся известными специалисту в данной области техники.
1) N. Kudo et al. Chem. Pharm. Bull. (1999) 47, 857.
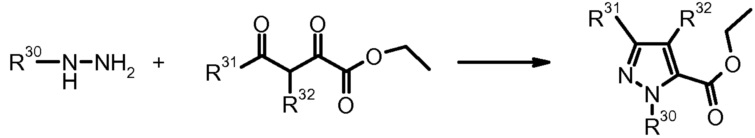
2) A. Padwa, J. Heterocycl. Chem. (1987) 24, 1225.
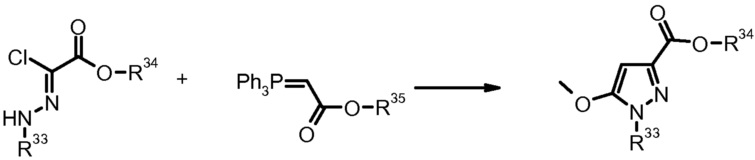
3) N.K. Markova et al., Zh. Org. Khim. (1983) 19, 2281.
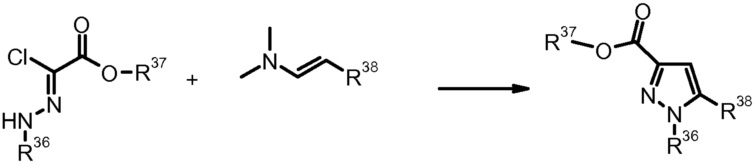
4) P. Bravo et al., Tetrahedron (1994) 50, 8827.
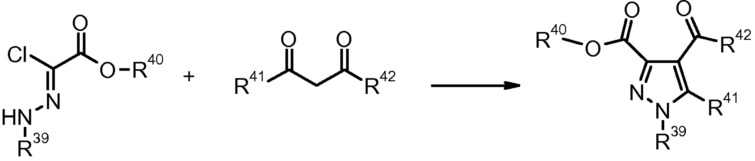
5) M.A. Martins et al., Synthesis (1995), 1491.
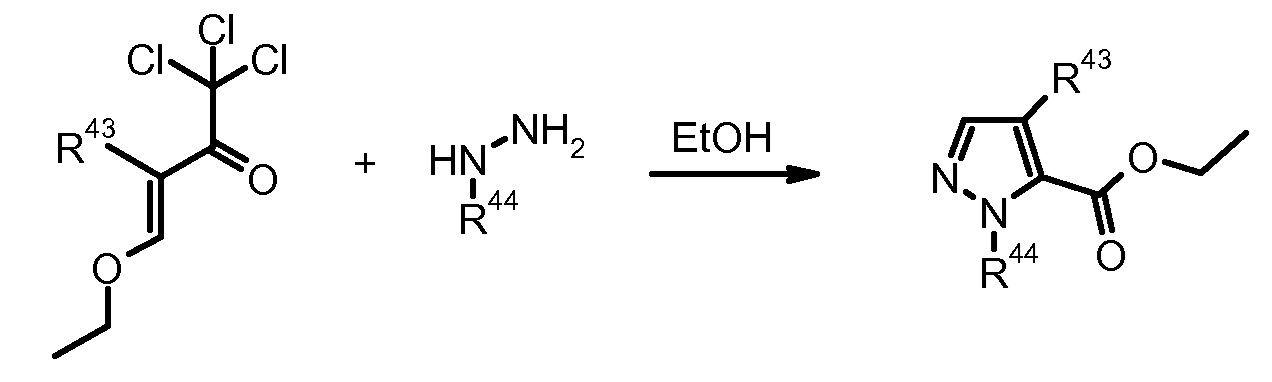
6) R.G. Jones et al., J. Org. Chem. (1955) 20, 1342.
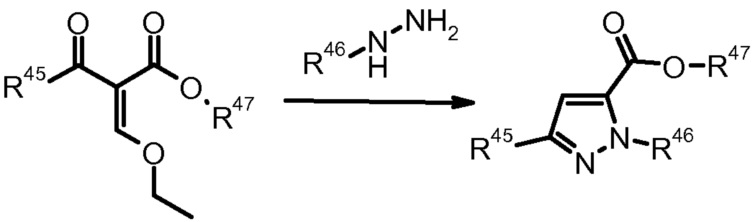
7) W.T. Ashton et al., J. Heterocycl. Chem. (1993) 30, 307.
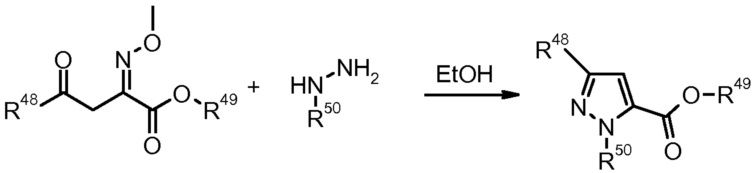
8) K.I. Bookermilburn, Synlett (1992) 327.
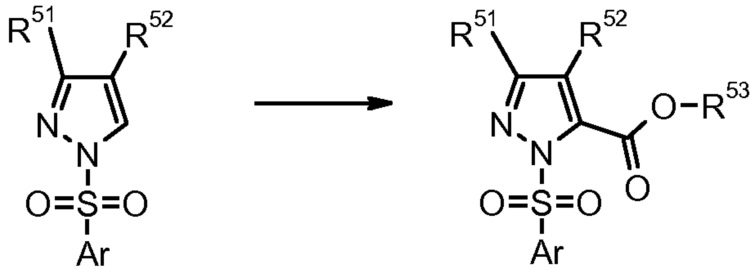
9) F. Farina et al., Heterocycles (1989) 29, 967.
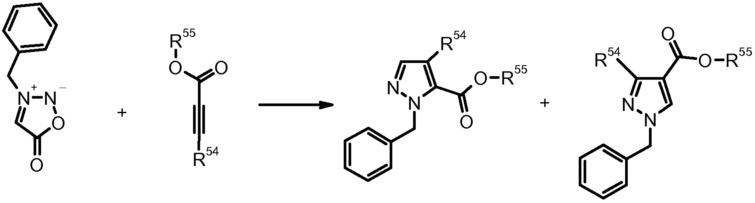
10) T. Hague et al., J. Med. Chem. (2002) 4669.
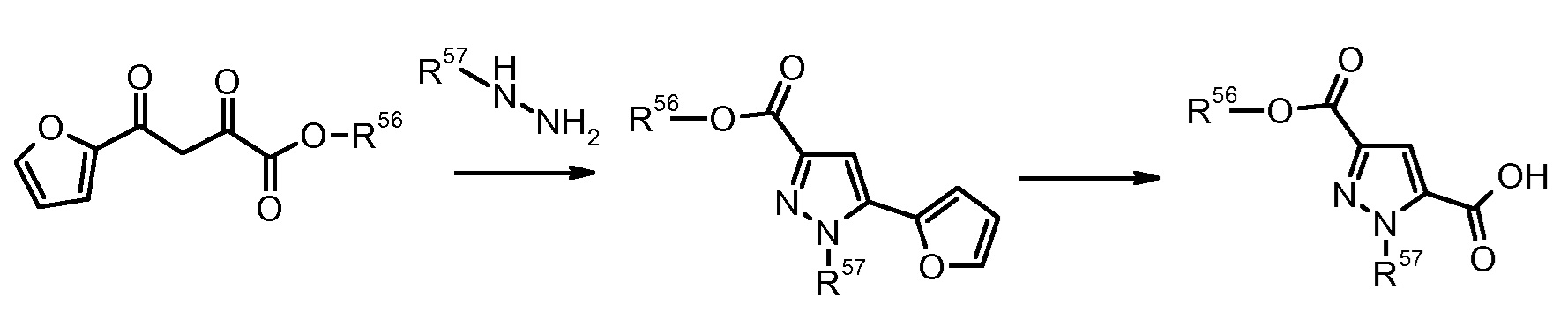
11) H.V. Patel, Synth. Commun. (1991) 21, 1583.
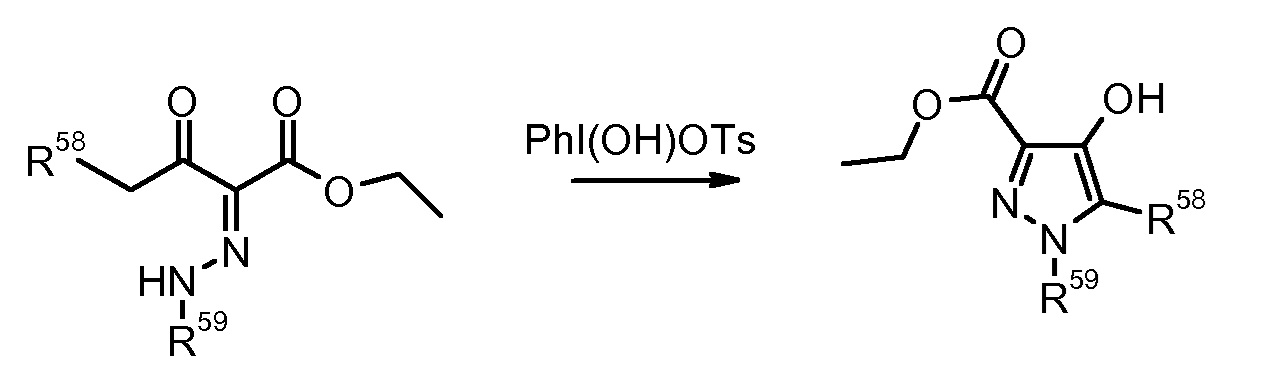
12) F. Farina et al., Heterocycles (1989) 29, 967.
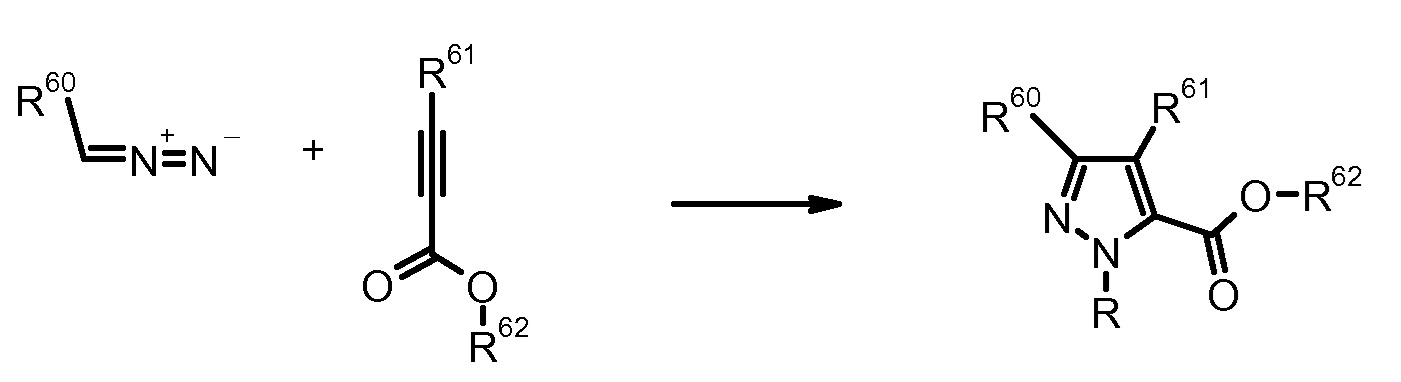
13) R. Huisgen et al., J. Am. Chem. Soc. (1979) 101, 3647.
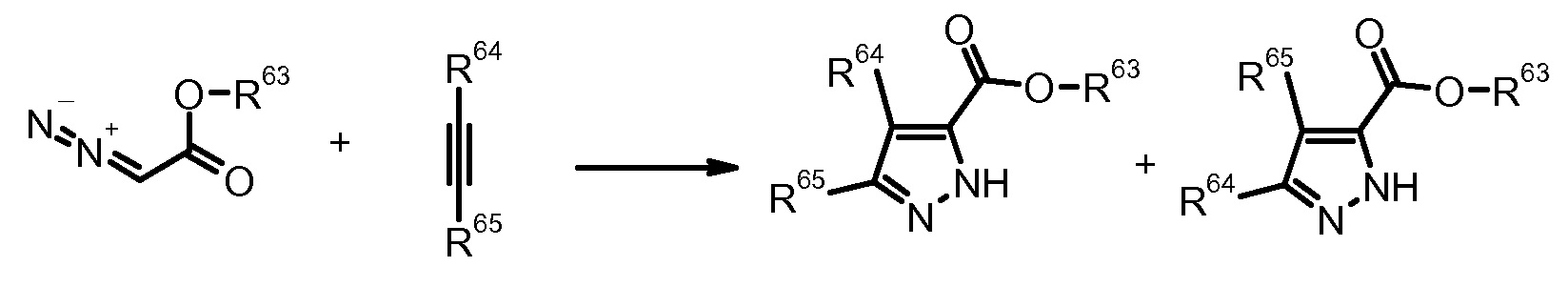
14) W. Sucrow et al., Angew. Chem., Int. Ed. (1975) 14, 560.
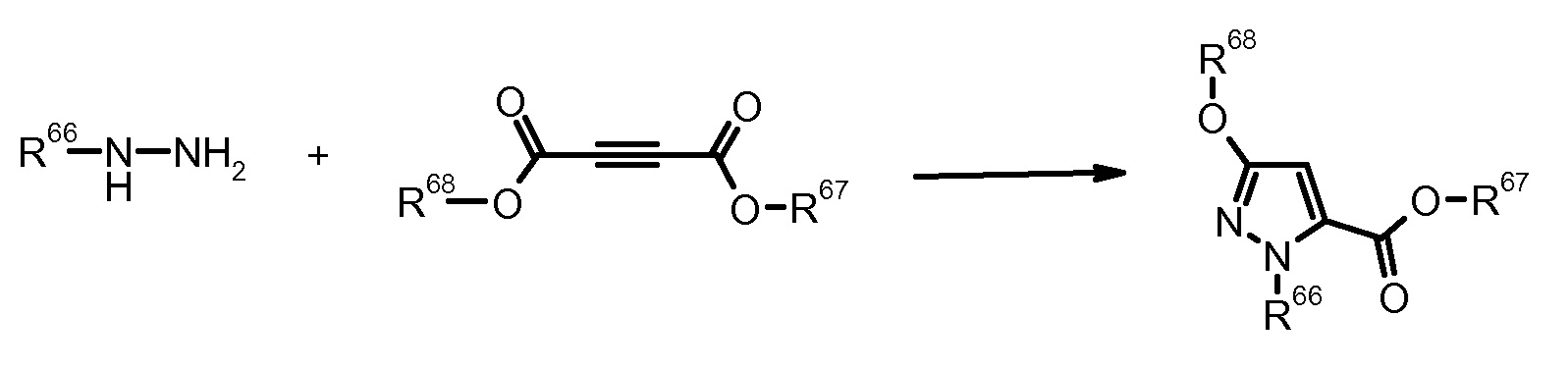
15) C. Baldoli et al., J. Heterocycl. Chem. (1989) 26, 241.
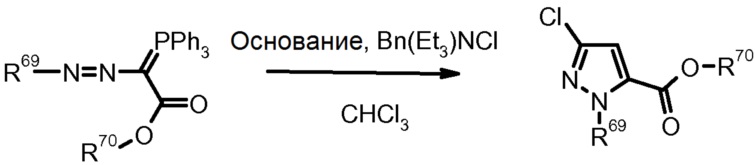
16) G.M. Pilling et al., Tetrahedron Lett. (1988) 29, 1341.
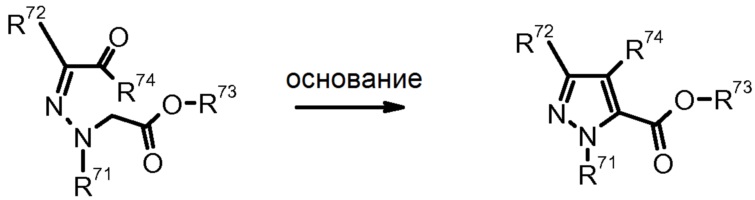
17) D. Sauer et al., J. Org. Chem. (1990) 55, 5535.
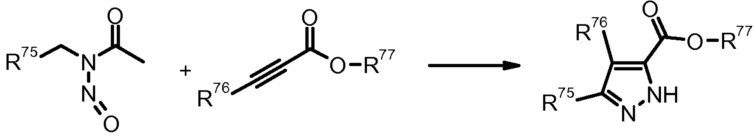
18) K. Washizuka et al., Tetrahedron Lett. (1999) 40, 8849.
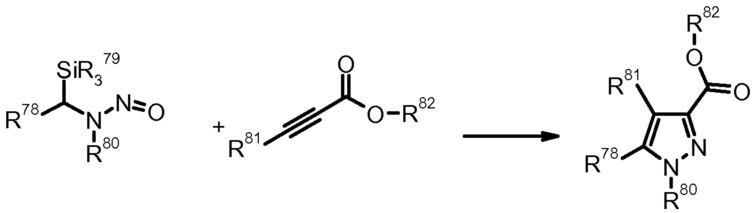
19) F. Foti et al., Tetrahedron Lett. (1999) 40, 2605.
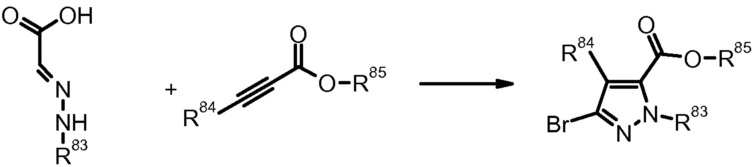
20) M. Martins et al., Synthesis (2003) 15, 2353.
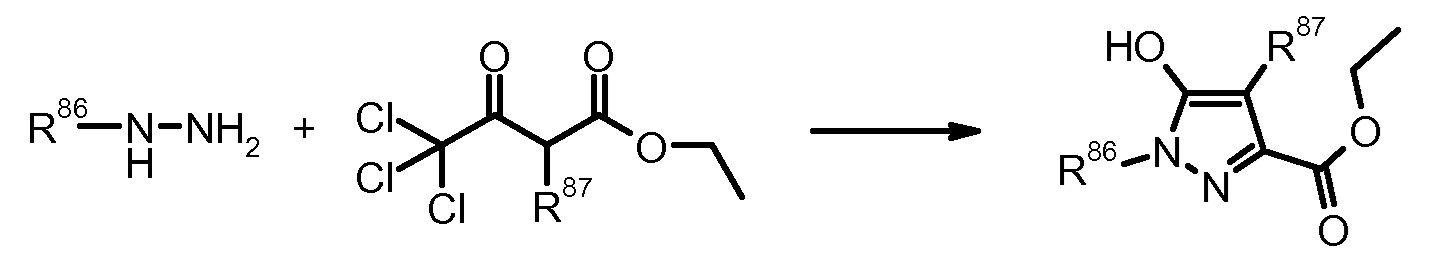
21) J. Nef, Liebigs Ann. Chem. (1893) 276, 231.
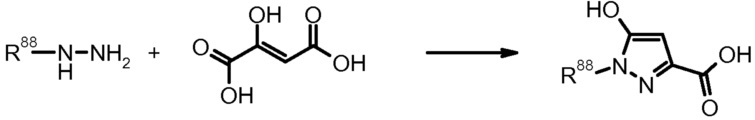
22) Leighton, J. Am. Chem. Soc. (1898) 20, 677.
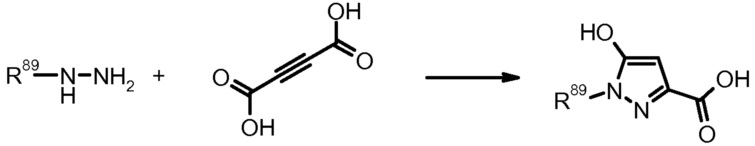
23) H. Ochi et al., Chem. Pham. Bull. (1983) 31, 1228.
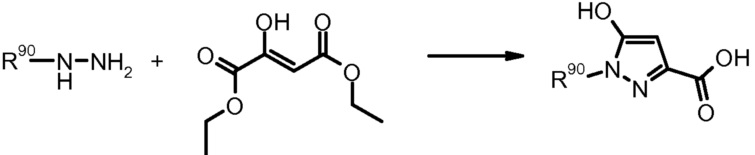
Хотя и не всегда показано явно, в определенных случаях изомеры положения будут появляться также в процессе получения приведенными реакциями. Данные смеси изомеров положения можно разделить современными способами разделения, подобно, например, препаративной ВЭЖХ.
Кроме того, для того чтобы получить требуемые заместители в пиразольной кольцевой системе в формуле I, функциональные группы, вводимые в кольцевую систему в процессе получения пиразолов, можно химически модифицировать. В частности, заместители, присутствующие в пиразольной кольцевой системе, можно модифицировать рядом реакций и, таким образом, можно получить требуемые остатки. Например, пиразол, содержащий атом водорода в определенном положении, таком как положение 4, можно также получить омылением и последующим декарбоксилированием пиразола, содержащего эфирную группу в подходящем положении. Атомы галогена можно ввести, например, согласно способам, подобно следующим способам, описанным в литературе. Для фторирования пиразолов можно использовать трифлат N-фтор-2,4,6-триметилпиридиния (T. Umemoto, S. Fukami, G. Tomizawa, K. Harasawa, K. Kawada, K. Tomita, J. Am. Chem. Soc. (1990) 112, 8563; см. также K. Manko et al., J. Fluorine Chem. (1988) 39, 435; R. Storer et al. Nucleosides Nucleotides (1999) 18; 203). Другие подходящие фторирующие реагенты можно также использовать при необходимости. Хлорирование, бромирование или йодирование пиразолов можно осуществлять взаимодействием с элементарными галогенами или используя N-галогенсукцинимиды, подобные NCS, NBS или NIS, и многие другие реагенты, хорошо известные специалисту в данной области техники. Кроме того, подходящие способы описаны, например, M. Rodriguez-Franco et al., Tetrahedron Lett. (2001) 42, 863; J. Pawlas et al., J. Org. Chem. (2000) 65, 9001; Y. Huang et al., Org Lett (2000) 2, 2833; W. Holzer et al., J. Heterocycl. Chem. (1995) 32, 1351; N. Kudo et al., Chem. Pharm. Bull. (1999) 47, 857; G. Auzzi et al., Farmaco, Ed Sci. (1979) 34, 743; K. Morimoto et al., J. Heterocycl. Chem. (1997) 34, 537; D. Jeon et al., Synth. Commun. (1998) 28, 2159. В зависимости от условий реакции, реагента, стехиометрии и порядка замещения, галоген вводят в положение 3, и/или положение 4, и/или положение 5. Селективным обменом галоген/металл или металлированием селективным обменом водород/металл и последующим взаимодействием с большим спектром электрофилов в гетероциклическое ядро можно ввести различные заместители (M. R. Grimmett, Heterocycles (1994) 37, 2087; V.D. Gardner et al., J. Heterocycl. Chem. (1984), 21, 121; D. Butler et al., J. Org. Chem. (1971) 36, 2542). Среди других, соответствующие пиразолоны могут представлять собой подходящие предшественники для введения атомов галогена. Например, 1H-пиразол-3-ол можно преобразовать в 5-хлор-1H-пиразол, используя, например, оксихлорид фосфора. 5-бром-1H-пиразол можно получить из 1H-пиразол-3-ола аналогичными стандартными способами, используя оксибромид фосфора, трибромид фосфора или пентабромид фосфора.
Галогены, гидроксигруппы (через трифлат или нонафлат) или первичные амины (через диазониевые соли) или после взаимопреобразования в соответствующие станнаны и бороновые кислоты, присутствующие в пиразольной структуре, можно преобразовать в ряд других функциональных групп, подобно, например, -CN, -CF3, -C2F5, эфирам, кислотам, амидам, аминам, алкильным или арильным группам, посредством переходных металлов, таких как палладиевые или никелевые катализаторы или соли меди и реагенты, например, как приведено ниже (F. Diederich, P. Stang, Metal-catalyzed Cross-coupling Reactions, Wiley-VCH, 1998; M. Beller, C. Bolm, Transition Metals for Organic Synthesis, Wiley-VCH, 1998; J. Tsuji, Palladium Reagents and Catalysts, Wiley, 1996; J. Hartwig, Angew. Chem. 1998, 110, 2154; B. Yang, S. Buchwald, J. Organomet. Chem. 1999, 576, 125; T. Sakamoto, K. Ohsawa, J. Chem. Soc. Perkin Trans I, 1999, 2323; D. Nichols, S. Frescas, D. Marona-Lewicka, X. Huang, B. Roth, G. Gudelsky, J. Nash, J. Med. Chem, 1994, 37, 4347; P. Lam, C. Clark, S. Saubern, J. Adams, M. Winters, D. Chan, A. Combs, Tetrahedron Lett., 1998, 39, 2941; D. Chan, K. Monaco, R. Wang, M. Winters, Tetrahedron Lett. 1998, 39, 2933; V. Farina, V. Krishnamurthy, W. Scott, The Stille Reaction, Wiley, 1994; F. Qing et al. J. Chem. Soc. Perkin Trans. I 1997, 3053; S. Buchwald et al. J. Am. Chem. Soc. 2001, 123, 7727; S. Kang et al. Synlett 2002, 3, 427; S. Buchwald et al. Organic Lett. 2002, 4, 581; T. Fuchikami et al. Tetrahedron Lett. 1991, 32, 91; Q. Chen et al. Tetrahedron Lett. 1991, 32, 7689; M. R. Netherton, G. C. Fu, Topics in Organometallic Chemistry 2005, 14, 85-108; A. F. Littke, G. F. Fu, Angew. Chem. Int. Ed. 2002, 41, 4176-4211; A. R. Muci, S. L. Buchwald, Topics in Current Chemistry 2002, 219, 131-209).
Сложноэфирные группы, присутствующие в пиразольном ядре, можно гидролизовать до соответствующих карбоновых кислот, которые затем, после активации, могут быть подвергнуты взаимодействию с аминами или спиртами в стандартных условиях. Кроме того, такие эфирные или кислотные группы можно восстановить до соответствующих спиртов многими стандартными способами. Эфирные группы, присутствующие в пиразоле, например бензилоксигруппы или другие легко отщепляемые группы, можно отщеплять, с получением гидроксигрупп, которые затем могут быть подвергнуты взаимодействию с рядом реагентов, например агентами для этерификации или активирующими агентами, обеспечивающими замену гидроксигрупп другими группами. Содержащие серу группы могут реагировать аналогично.
В процессе получения для модификации групп, присоединенных к пиразольной кольцевой системе, применение подхода параллельного получения, помимо ряда реакций, могут быть крайне пригодными палладиевые, никелевые или медные катализаторы. Данные реакции описаны, например, в F. Diederich, P. Stang, Metal-catalyzed Cross-coupling Reactions, Wiley-VCH, 1998; M. Beller, C. Bolm, Transition Metals for Organic Synthesis, Wiley-VCH, 1998; J. Tsuji, Palladium Reagents and Catalysts, Wiley, 1996; J. Hartwig, Angew. Chem. 1998, 110, 2154; B. Yang, S. Buchwald, J. Organomet. Chem. 1999, 576, 125; P. Lam, C. Clark, S. Saubern, J. Adams, M. Winters, D. Chan, A. Combs, Tetrahedron Lett. 1998, 39, 2941; D. Chan, K. Monaco, R. Wang, M. Winters, Tetrahedron Lett. 1998, 39, 2933; J. Wolfe, H. Tomori, J.Sadight, J. Yin, S. Buchwald, J. Org. Chem. 2000, 65, 1158; V. Farina, V. Krishnamurthy, W. Scott, The Stille Reaction, Wiley, 1994; S. Buchwald et al., J. Am. Chem Soc. 2001, 123, 7727; S. Kang et al., Synlett 2002, 3, 427; S. Buchwald et al., Org. Lett. 2002, 4, 581.
Кроме того, приведенные выше реакции для преобразования функциональных групп, в основном, подробно описаны в руководствах по органической химии, подобно M. Smith, J. March, March's Advanced Organic Chemistry, Wiley-VCH, 2001, и в руководствах, подобных Houben-Weyl, Methoden der Organischen Chemie (Methods of Organic Chemistry), Georg Thieme Verlag, Stuttgart, Germany; или Organic Reactions, John Wiley & Sons, New York; R. C. Larock, Comprehensive Organic Transformations, Wiley-VCH, 2nd ed., 1999; B. Trost, I. Fleming (eds.), Comprehensive Organic Synthesis, Pergamon, 1991; A. Katritzky, C. Rees, E. Scriven, Comprehensive Heterocyclic Chemistry II, Elsevier Science, 1996, в которых можно найти подробности, касающиеся реакций и первичных литературных источников. Ввиду того, что в настоящем случае функциональные группы присоединены к пиразольному кольцу, в некоторых случаях может быть необходимо специально приспосабливать условия реакции или выбирать специальные из ряда реагентов, которые можно в принципе применять в реакции преобразования или иначе принимать конкретные меры для достижения требуемого преобразования, например применять методы защиты функциональных групп. Однако нахождение подходящих реакционных переменных и условий реакции в данных случаях не вызывает каких-либо проблем у специалиста в данной области техники. Структурные элементы, присоединенные к пиразольному кольцу в соединениях формулы I, можно также ввести в исходное производное пиразола, применяя способы, изложенные в настоящем описании, последовательными реакционными стадиями с использованием методов параллельного синтеза, которые являются хорошо известными специалисту в данной области техники per se.
Настоящее изобретение также относится к способу получения соединения формулы I, который приведен на следующей схеме:
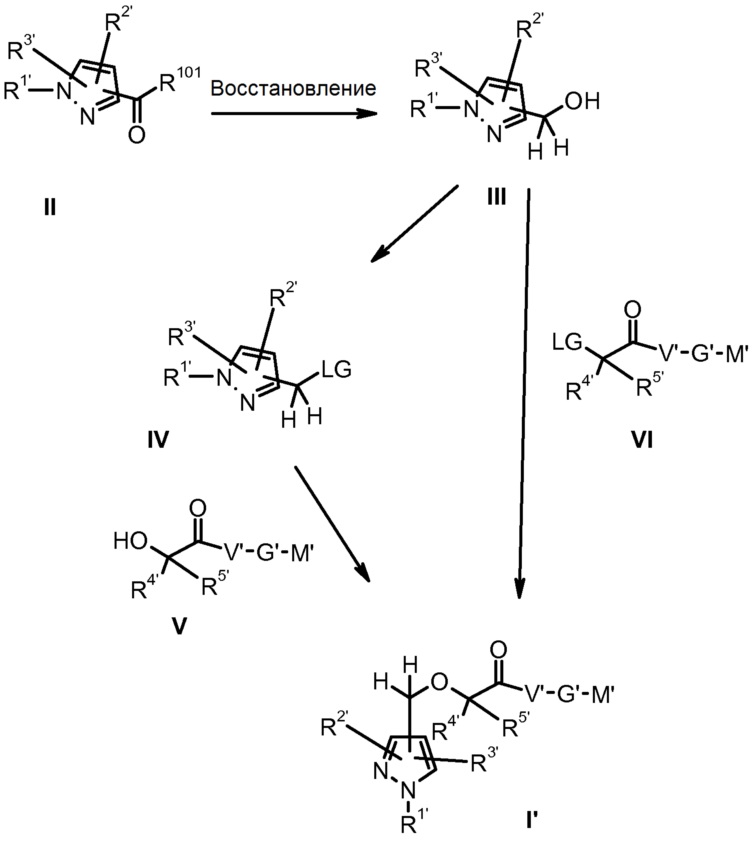
и который включает
A) восстановление соответствующей карбоновой кислоты или эфира карбоновой кислоты производного пиразола формулы II до производного пиразола формулы III, содержащего гидроксиметиленовую группу,
B1) активацию гидроксиметиленовой группы в полученном производном пиразола формулы III преобразованием в уходящую группу LG, с получением производного пиразола формулы IV, и последующей этерификацией последнего соединения с гидроксисоединением формулы V, с получением производного пиразола формулы I', которое уже может представлять собой конечное соединение формулы I,
или
B2) взаимодействие полученного производного пиразола формулы III с алкилирующим соединением формулы VI, где LG представляет собой уходящую группу, с получением производного пиразола формулы I', которое уже может представлять собой конечное соединение формулы I,
C) необязательно модификацию полученного соединения формулы I' преобразованием и/или введением любых групп, с получением конечного соединения формулы I, и/или преобразованием соединения в его фармацевтически приемлемую соль,
D) выделение конечного соединения формулы I или его фармацевтически приемлемой соли;
где
в соединениях формул II, III, IV, V, VI и I' остатки R1, R2, R3, R4, R5, V, G' и M' определены, как в соединении формулы I, и, кроме того, функциональные группы могут присутствовать в защищенной форме или в виде групп, являющихся предшественниками, которые впоследствии преобразовывают в конечные группы, присутствующие в соединении формулы I;
LG представляет собой уходящую группу, например, такую как галоген, подобный хлору или брому, сульфонилоксигруппу, подобную метансульфонилокси или 4-метилбензолсульфонилокси, азидную группу или диазониевую группу; и
R101 представляет собой, например, (C1-C6)алкил-O- или HO-.
Соединения формулы III можно получить, например, восстановлением соответствующей карбоновой кислоты или эфира карбоновой кислоты формулы II, применяя хорошо известные способы и реагенты, подобные, например, BH3, NaBH4 или LiAlH4.
Если структурные элементы, присутствующие в производных пиразола формулы I, которые содержатся в соединениях формулы V или формулы VI, еще не введены в ходе предшествующей стадии, например, при получении пиразольного ядра, соответствующие группы можно, например, ввести в пиразольную систему стандартными способами алкилирования, хорошо известными специалисту в данной области техники. Исходное производное пиразола III, которое будут использовать в данной реакции, содержит гидроксиметиленовую группу. Алкилирование приведенной выше группы можно, например, осуществлять в стандартных условиях, предпочтительно в присутствии основания, подобного K2CO3, Cs2CO3, NaH или KO-трет-Bu, используя алкилирующее соединение формулы VI, где LG представляет собой уходящую группу, такую как, например, галоген, подобно хлору, брому или йоду, или сульфонилоксигруппу, подобную тозилокси, мезилокси или трифторметилсульфонилокси. Альтернативно, гидроксиметиленовую группу производного пиразола формулы III можно активировать преобразованием в уходящую группу LG, преобразованием в галогенметиленовую группу или сульфонилоксиметиленовую группу, подобную тозилоксиметилену, мезилоксиметилену или трифторметилсульфонилоксиметилену, с получением производных пиразола формулы IV. Затем данные производные пиразола формулы IV можно этерифицировать, например, в стандартных условиях, предпочтительно в присутствии основания, подобно K2CO3, Cs2CO3, NaH или KO-трет-Bu, используя гидроксипроизводное формулы V. Данные стандартные способы описаны, например, в руководствах, подобно M. Smith, J. March, March's Advanced Organic Chemistry, Wiley-VCH, 2001; Houben-Weyl, Methoden der Organischen Chemie (Methods of Organic Chemistry), Georg Thieme Verlag, Stuttgart, Germany; Organic Reactions, John Wiley & Sons, New York; R. C. Larock, Comprehensive Organic Transformations, Wiley-VCH, 2nd ed., 1999; B. Trost, I. Fleming (eds.), Comprehensive Organic Synthesis, Pergamon, 1991.
Группа LG может, например, также представлять собой гидроксигруппу, которую, для осуществления реакции алкилирования, можно активировать в хорошо известных условиях реакции Мицунобу (O. Mitsunobu, Synthesis 1981, 1) или последующими способами модификации (A. Tunoori, D. Dutta, г. Gunda, Tetrahedron Lett. 39 (1998) 8751; J. Pelletier, S. Kincaid, Tetrahedron Lett. 41 (2000) 797; D. L.Hughes, R. A.Reamer, J. J.Bergan, E. J. J.Grabowski, J. Am. Chem. Soc. 1 10 (1998) 6487; D. J. Camp, I. D. Jenkins, J. Org. Chem. 54 (1989) 3045; D. Crich, H. Dyker, R. J. Harris, J. Org. Chem. 54 (1989) 257).
Соединения формул II, III, IV, V, VI и I', полученные согласно реакциям, описанным в настоящем описании, могут уже содержать конечные группы, т.е. R1', R2', R3', R4', R5', V, G' и M', могут представлять собой группы R1, R2, R3, R4, R5, V, G и M, как определено в формуле I, или необязательно в соединениях формул II, III, IV, V, VI и I' остатки R1', R2', R3', R4', R5', V, G' и M' впоследствии преобразовывают в остатки R1, R2, R3, R4, R5, V, G и M, с получением требуемого соединения формулы I. Таким образом, остатки R1', R2', R3', R4', R5', V, G' и M', содержащиеся в соединениях формул II, III, IV, V, VI и I', могут иметь значения остатков в соединениях формулы I, или кроме того, они могут также присутствовать в виде групп, которые впоследствии преобразовывают в конечные группы формулы I, и, например, функциональные группы могут присутствовать в виде групп, являющихся предшественниками, или производных или в защищенной форме. В процессе получения соединений формулы I может быть обычно полезно или необходимо вводить функциональные группы, которые ослабляют или предотвращают нежелательные реакции или побочные реакции на последовательных стадиях получения, в виде групп, являющихся предшественниками, которые позднее можно преобразовать в требуемые функциональные группы или временно блокировать функциональные группы способом введения защитных групп, подходящим для решения проблемы получения. Данные подходы являются хорошо известными специалисту в данной области техники (см., например, Greene и Wuts, Protective Groups in Organic Synthesis, Wiley, 1991; или P. Kocienski, Protecting Groups, Thieme, 1994). Примеры групп, являющихся предшественниками, представляют собой цианогруппы и нитрогруппы. Цианогруппу можно на последней стадии преобразовать в производное карбоновой кислоты или восстановить до аминометильных групп. Нитрогруппы можно преобразовать восстановлением, подобно каталитическому гидрированию, в аминогруппы. Защитные группы могут также представлять собой твердую фазу, и отщепление от твердой фазы обозначает удаление защитной группы. Применение данных способов известно специалисту в данной области техники (Burgess K (Ed.) Solid Phase Organic Synthesis, New York, Wiley, 2000). Например, фенольная гидроксигруппа может быть присоединена к тритилполистирольной смоле, которая служит в качестве защитной группы, и молекула отщеплена от смолы обработкой трифторуксусной кислотой (ТФУК) или другими кислотами на последней стадии получения.
Остаток -V'-G'-M' в соединениях формул V, VI и I', который может быть одинаковым или отличным, может представлять собой, например, гидрокси или (C1-C4)алкокси, т.е. группы -C(O)-V'-G'-M', присутствующие в соединениях формул V, VI и I', могут представлять собой, например, свободные карбоновые кислоты или их эфиры, подобно алкиловым эфирам. Группы могут также представлять собой любое другое активированное производное карбоновой кислоты, которое обеспечивает образование амида или эфира с соединением формулы H-V'-G'-M'. Активированное производное может представлять собой, например, хлорангидрид карбоновой кислоты, активированный эфир, подобно замещенному фениловому эфиру или тиоэфиру, азолид, подобный имидазолиду, азид или смешанный ангидрид, например смешанный ангидрид с эфиром карбоновой кислоты или с сульфокислотой. Все из данных производных можно получить из карбоновой кислоты стандартными способами, и они могут быть подвергнуты взаимодействию с амином или спиртом формулы H-V'-G'-M' в стандартных условиях. Карбоксильную группу -COOH, представляющую -C(O)-V'-G'-M' в соединении формул V и VI, можно получить, например, стандартными способами гидролиза, из эфирной группы, введенной в пиразольную систему в ходе получения пиразола.
Соединения формулы I, в которых группа -C(O)-V'-G'-M' представляет собой амидную группу, можно получить из аминов, и соединение представляет собой карбоксильную группу или ее эфир или тиоэфир, стандартными реакциями амидирования. В частности, для получения амидов соединения, содержащие карбоксильную группу, можно конденсировать в стандартных условиях с соединениями формулы H-V'-G'-M', которые представляют собой амины, с использованием стандартных реагентов сочетания, применяемых в пептидном синтезе. Данные реагенты сочетания представляют собой, например, карбодиимиды, подобно дициклогексилкарбодиимиду (DCC) или диизопропилкарбодиимиду, карбонилдиазолы, подобно карбонилдиимидазолу (CDI), и аналогичные реагенты, пропилфосфиновый ангидрид, тетрафторборат O-((циано(этоксикарбонил)метилен)амино)-N,N,N',N'-тетраметилурония (TOTU), диэтилфосфорилцианид (DEPC), бис(2-оксо-3-оксазолидинил)фосфорилхлорид (BOP-Cl), гексафторфосфат O-(бензотриазол-1-ил)-1,1,3,3-тетраметилурония (HBTU), гексафторфосфат O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония (HATU), гексафторфосфат бром-трис-пирролидинофосфония (Pybrop) и многие другие.
Активацию карбоксильной функции можно также удобно осуществлять, например, преобразованием карбоксильной группы в пентафторфениловый эфир, используя дициклогексилкарбодиимид и пентафторфенол или используя реагенты, подобные пентафторфенилтрифторацетату, трет-бутилпентафторфенилкарбонату, бис(пентафторфенил)карбонату, 4-метилбензолсульфонату пентафторфенила, гексафторфосфату пентафторфенилтетраметилурония, октафторацетофенону. Активация карбоксильной функции преобразованием в другие фениловые эфиры, подобно, например, 4-нитрофениловым эфирам или 2-нитрофениловым эфирам, может также быть эффективной. Активацию и последующее взаимодействие с группой формулы H-V'-G'-M' обычно осуществляют в присутствии инертного растворителя или разбавителя, например дихлорметана, хлороформа, тетрагидрофурана (ТГФ), диэтилового эфира, н-гептана, н-гексана, н-пентана, циклогексана, диизопропилового эфира, метил-трет-бутилового эфира, ацетонитрила, Ν,Ν-диметилформамида (ДМФА), N,N-диметилацетамида (DMA), N-метилпирролидин-2-она (NMP), диметилсульфоксида, диоксана, толуола, бензола, этилацетата или смеси данных растворителей, при необходимости с добавлением основания, такого как, например, трет-бутоксид калия или трибутиламин, или триэтиламин, или диизопропилэтиламин, или N-этилморфолин.
Остатки R1', R2', R3', R4', R5', присутствующие в пиразоле формул II, III, IV, V, VI и I', или остаток, в котором функциональные группы в остатке присутствуют в защищенной форме или в виде группы, являющейся предшественником, можно, например, ввести в пиразольную систему общепринятыми литературными способами для алкилирования, арилирования, аминирования, этерификации или тиоэтерификации пиразолов, хорошо известными специалисту в данной области техники. Подходящим образом замещенный пиразол, пригодный для данных реакций, содержит уходящую группу, подобно, например, галогену, трифлату, нонафлату, тозилату, азиду или диазониевой соли. Предпочтительно реакцию осуществляют в присутствии основания, подобно K2CO3, Cs2CO3, NaH или KO-трет-Bu. Требуемое преобразование можно также осуществлять с галогенами, гидроксигруппами (через трифлат или нонафлат) или первичными аминами (через диазониевые соли) или после преобразования в соответствующий станнан или бороновую кислоту - присутствующими в пиразольной структуре - их можно преобразовать в ряд других функциональных групп, подобно, например, -CN, -CF3, -C2F5, эфирам, кислотам, амидам, аминам, алкильным или арильным группам, посредством переходных металлов, таких как палладиевые или никелевые катализаторы, или солей меди и реагентов, например, приводимых ниже (F. Diederich, P. Stang, Metal-catalyzed Cross-coupling Reactions, Wiley-VCH, 1998; M. Beller, C. Bolm, Transition Metals for Organic Synthesis, Wiley-VCH, 1998; J. Tsuji, Palladium Reagents and Catalysts, Wiley, 1996; J. Hartwig, Angew. Chem. 1998, 1 10, 2154; B. Yang, S. Buchwald, J. Organomet. Chem. 1999, 576, 125; T. Sakamoto, K. Ohsawa, J. Chem. Soc. Perkin Trans I, 1999, 2323; D. Nichols, S. Frescas, D. Marona-Lewicka, X. Huang, B. Roth, G. Gudelsky, J. Nash, J. Med. Chem, 1994, 37, 4347; P. Lam, C. Clark, S. Saubern, J. Adams, M. Winters, D. Chan, A. Combs, Tetrahedron Lett., 1998, 39, 2941 ; D. Chan, K. Monaco, R. Wang, M. Winters, Tetrahedron Lett. 1998, 39, 2933; V. Farina, V. Krishnamurthy, W. Scott, The Stille Reaction, Wiley, 1994; F. Qing et al. J. Chem. Soc. Perkin Trans. I 1997, 3053; S. Buchwald et al. J. Am. Chem. Soc. 2001, 123, 7727; S. Kang et al. Synlett 2002, 3, 427; S. Buchwald et al. Organic Lett. 2002, 4, 581; T. Fuchikami et al. Tetrahedron Lett. 1991, 32, 91; Q. Chen et al. Tetrahedron Lett. 1991, 32, 7689; M. R. Netherton, г. C. Fu, Topics in Organometallic Chemistry 2005, 14, 85-108; A. F. Littke, G. F. Fu, Angew. Chem. Int. Ed. 2002, 41, 4176-4211; A. R. Muci, S. L. Buchwald, Topics in Current Chemistry 2002, 219, 131-209).
Соединения формулы I являются эффективными LPAR5 антагонистами, которые проявляют антагонизм эффекту эндогенной LPA на ее рецептор LPAR5. В частности, соединения формулы I являются эффективными антагонистами LPA рецепторов LPAR5 тромбоцитов, тучных клеток и клеток микроглии. Соединения настоящего изобретения проявляют антагонизм эффекту агрегации тромбоцитов активации LPA рецептора LPAR5 тромбоцитов, опосредованной LPA активации тучных клеток человека и опосредованной LPA активации клеток микроглии. Кроме того, соединения формулы I настоящего изобретения также обладают дополнительными полезными свойствами, например стабильностью в плазме и печени и селективностью относительно других рецепторов, чей агонизм или антагонизм не предполагается. Такая хорошая селективность, например, делает возможным ослабление потенциальных побочных эффектов, возникающих при применении молекул, имеющих недостаточную селективность.
Настоящее изобретение также относится к соединениям формулы I и/или их фармацевтически приемлемым солям, и/или их пролекарству для применения в качестве лекарственного средства или в качестве фармацевтического средства, и фармацевтическим композициям, содержащим эффективное количество по меньшей мере одного соединения формулы I и/или его фармацевтически приемлемой соли, и/или его пролекарства и фармацевтически приемлемый носитель, т.е. одно или более фармацевтически приемлемых веществ, являющихся носителями или эксципиентами и/или вспомогательными материалами или добавками, и их можно применять на людях, в ветеринарии или для фитозащитного применения.
Активность соединений формулы I можно определить, например, в анализах, описанных ниже или в других in vitro или ex vivo анализах, известных специалисту в данной области техники. Способность соединений ингибировать вызванную LPA агрегацию тромбоцитов можно измерить способами, аналогично способам, описанным в литературе (например, Holub и Waston в Platelets: A Practical Approach, pp 236-239, Oxford University Press 1996), и способами, описанными ниже. Результаты данных анализов ясно показывают, что соединения настоящего изобретения являются функциональными антагонистами LPA рецептора LPAR5 тромбоцитов и, следовательно, являются пригодными для ингибирования агрегации тромбоцитов и образованию тромбов. Способность соединений ингибировать вызванную LPA активацию тучных клеток или клеток микроглии можно также измерить, применяя систему FLIPR.
В качестве антагонистов LPA рецептора LPAR5, соединения формулы I и/или их фармацевтически приемлемые соли, и/или их пролекарства являются обычно пригодными для лечения, включая терапию и профилактику, заболеваний, при которых активность рецептора LPAR5 играет определенную роль или имеет нежелательную степень, или на которые можно благоприятно влиять ингибированием рецепторов LPAR5 или снижением активности, или для предотвращения, облегчения или вылечивания которых может требоваться лечащим врачом ингибирование LPA рецептора LPAR5 или снижение активности.
Таким образом, настоящее изобретение также относится к соединениям формулы I и/или их фармацевтически приемлемым солям, и/или их пролекарству для применения в лечении, включая терапию и профилактику, заболевания или болезненного состояния, чувствительного к ингибированию LPA рецептора LPAR5, и/или ослаблению или ингибированию агрегации тромбоцитов или образованию тромба, и/или ослаблению или ингибированию активации тучных клеток, и/или ослаблению или ингибированию активации клеток микроглии.
Настоящее изобретение также относится к применению соединения формулы I и/или его фармацевтически приемлемых солей и/или его пролекарства для получения лекарственного средства для лечения, включая терапию и профилактику, заболевания или болезненного состояния, чувствительного к ингибированию LPA рецептора LPAR5 и/или ослаблению или ингибированию агрегации тромбоцитов или образованию тромба, и/или ослаблению или ингибированию активации тучных клеток, и/или ослаблению или ингибированию активации клеток микроглии.
Поскольку ингибирование LPA рецептора LPAR5 влияет на активацию тромбоцитов и агрегацию тромбоцитов, соединения формулы I и/или их фармацевтически приемлемые соли и/или их пролекарства являются в общем пригодными для ослабления образования тромба или для лечения, включая терапию и профилактику, заболеваний и состояний, при которых активность агрегации тромбоцитов играет определенную роль или имеет нежелательную степень, или на которые можно благоприятно влиять ослаблением образования тромба, или для предотвращения, облегчения или вылечивания которых требуется лечащим врачом пониженная активность системы агрегации тромбоцитов. Таким образом, настоящее изобретение также относится к ослаблению или ингибированию нежелательного образования тромба, в частности у индивида, путем введения эффективного количества соединения формулы I и/или его фармацевтически приемлемой соли и/или пролекарства, а также, ввиду этого, фармацевтических композиций.
Поскольку ингибирование LPA рецептора LPAR5 влияет на активацию тучных клеток, соединения формулы I и/или их фармацевтически приемлемые соли, и/или их пролекарства являются в общем пригодными для ослабления активации тучных клеток или для лечения, включая терапию и профилактику, заболеваний и состояний, при которых активность тучных клеток играет определенную роль или имеет нежелательную степень, или на которые можно благоприятно влиять ослаблением активации тучных клеток, или для предотвращения, облегчения или вылечивания которых требуется лечащим врачом пониженная активность системы тучных клеток. Таким образом, конкретно, настоящее изобретение также относится к ослаблению или ингибированию нежелательной активации тучных клеток, в частности у индивида, введением эффективного количества соединения формулы I и/или его фармацевтически приемлемой соли и/или пролекарства, а также, ввиду этого, фармацевтических композиций.
Поскольку ингибирование LPA рецептора LPAR5 влияет на активацию клеток микроглии соединения формулы I и/или их фармацевтически приемлемые соли, и/или их пролекарства являются в общем пригодными для ослабления активации клеток микроглии, или для лечения, включая терапию и профилактику, заболеваний, при которых активность клеток микроглии играет определенную роль или имеет нежелательную степень, или на которые можно благоприятно влиять ослабление активации клеток микроглии, или для предотвращения, облегчения или вылечивания которого пониженная активность системы клеток микроглии требуется лечащим врачом. Таким образом, конкретно, настоящее изобретение также относится к ослаблению или ингибированию нежелательной активации клеток микроглии, в частности у индивида, путем введения эффективного количества соединения формулы I и/или его фармацевтически приемлемой соли и/или пролекарства, а также, ввиду этого, фармацевтических композиций.
Настоящее изобретение также относится к соединениям формулы I и/или их фармацевтически приемлемым солям, и/или их пролекарствам для применения в лечении, включая терапию и профилактику тромбоэмболических заболеваний, таких как тромбоз глубоких вен, венозная и артериальная тромбоэмболия, тромбофлебит, ишемический и церебральный артериальный тромбоз, эмболия мозга, эмболия почек, легочная эмболия, генерализованный тромбогеморрагический синдром, сердечно-сосудистые заболевания, такие как преходящие нарушения мозгового кровообращения, инсульты, острый инфаркт миокарда, нестабильная стенокардия, хроническая стабильная стенокардия, заболевание периферических сосудов, преэклампсия/эклампсия и тромботическая цитопеническая пурпура, и развитие и прогрессирование воспалительных заболеваний, таких как астма, гипералгезия, рассеянный склероз, воспалительная боль, ангиогенез, атеротромбоз или аллергические реакции, или рестеноз.
Настоящее изобретение также относится к применению соединений формулы I и/или их фармацевтически приемлемых солей, и/или их пролекарств в получении фармацевтических композиций или лекарственных средств для ингибирования LPA рецептора LPAR5 или для влияния на активацию тромбоцитов, агрегацию тромбоцитов и дегрануляцию тромбоцитов и стимулирования дизагрегации тромбоцитов, воспалительного ответа и/или для лечения, включая терапию и профилактику заболеваний, приведенных выше или ниже, например, для получения лекарственных средств для лечения, включая терапию и профилактику, сердечно-сосудистых заболеваний, тромбоэмболических заболеваний или рестеноза, для лечения тромбоза глубоких вен, венозной и артериальной тромбоэмболии, тромбофлебита, ишемического и церебрального артериального тромбоза, эмболии мозга, эмболии почек, легочной эмболии, генерализованного тромбогеморрагического синдрома, преходящих нарушений мозгового кровообращения, инсультов, острого инфаркта миокарда, нестабильной стенокардии, хронической стабильной стенокардии, заболевания периферических сосудов, преэклампсии/эклампсии и тромботической цитопенической пурпуры, и развитие и прогрессирование воспалительных заболеваний, таких как астма, гипералгезия, рассеянный склероз, воспалительная боль, ангиогенез, атеротромбоз или аллергические реакции, и других.
Настоящее изобретение также относится к соединениям формулы I и/или их фармацевтически приемлемым солям и/или их пролекарствам для применения в лечении, включая терапию и профилактику, заболеваний, приведенных выше или ниже, например, для применения в лечении сердечно-сосудистых заболеваний, тромбоэмболических заболеваний, атеротромбоза или рестеноза, и к способам лечения, направленным на данные цели, включая способы указанной терапии и профилактики.
Из-за центральной роли LPA рецептора LPAR5 тромбоцитов в опосредованной LPA активации тромбоцитов, настоящее изобретение также относится к соединениям формулы I и/или их фармацевтически приемлемым солям для применения в лечении, включая терапию и профилактику, заболеваний, таких как патологическое образование тромба, острый инфаркт миокарда, нестабильная стенокардия, тромбоэмболия, острая закупорка сосудов, связанная с тромболитической терапией, или чрескожная транслюминальная коронарная ангиопластика (PTCA), транзиторная ишемическая атака, инсульт, динамическое нарушение кровообращения или обходное шунтирование коронарных или периферических артерий, сужение просвета сосудов, рестеноз после коронарной или венозной ангиопластики, поддержание сосудистого доступа у пациентов с периодическим гемодиализом, патологическое образование тромба, наблюдающееся в венах нижних конечностей после хирургической операции брюшной полости, коленей или бедер, риск легочной тромбоэмболии или диссеминированная системная внутривенная коагулопатия, возникающая в сосудистой системе при септическом шоке, определенные вирусные инфекции или рак. Настоящее изобретение также относится к применению соединения формулы I и/или его фармацевтически приемлемых солей для получения лекарственного средства для лечения, включая терапию и профилактику, указанных заболеваний.
Из-за центральной роли LPA рецептора LPAR5 в опосредованной LPA активации тучных клеток и/или клеток микроглии настоящее изобретение также относится к соединениям формулы I и/или их фармацевтически приемлемым солям для применения в лечении, включая терапию и профилактику, заболеваний, таких как воспалительная боль, астма, ангиогенез, демиелинизирующие заболевания (a) центральной нервной системы, такие как множественный склероз, поперечный миелит, неврит зрительного нерва, болезнь Девика и (b) периферической нервной системы, такие как синдром Гийена-Барре или хроническая воспалительная демиелинизирующая полинейропатия, а также к применению соединения формулы I и/или его фармацевтически приемлемых солей в получении лекарственного средства для лечения, включая терапию и профилактику, указанных заболеваний.
Соединения формулы I и их фармацевтически приемлемые соли и их пролекарства можно вводить животным, предпочтительно млекопитающим, и, в частности, людям в виде фармацевтических средств для терапии или профилактики. Их можно вводить отдельно или в смеси друг с другом, или в виде фармацевтических композиций, которые обеспечивают энтеральное или парентеральное введение.
Фармацевтические композиции согласно настоящему изобретению можно вводить перорально, например, в виде пилюль, таблеток, таблеток, покрытых глазурью, таблеток с покрытием, драже, гранул, твердых и мягких желатиновых капсул, растворов, сиропов, эмульсий, суспензий или аэрозольных смесей. Введение можно также осуществлять ректально, например, в виде суппозиториев, или парентерально, например, внутривенно, внутримышечно или подкожно, в виде растворов для инъекции или растворов для вливания, микрокапсул, имплантатов или стержней, или чрескожно или местно, например, в виде мазей, растворов или настоек, или другими способами, например, в виде аэрозолей или назальных спреев.
Фармацевтические композиции согласно настоящему изобретению получают способом, известным per se и известным специалисту в данной области техники, причем применяют фармацевтически приемлемые инертные неорганические и/или органические вещества, являющиеся носителями, и/или вспомогательные вещества в добавление к одному или более соединениям формулы I и/или их фармацевтически приемлемым солям и/или их пролекарствам. Что касается получения пилюль, таблеток, таблеток с покрытием и твердых желатиновых капсул, можно применять, например, лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли и т.д. Вещества, являющиеся носителями для мягких желатиновых капсул и суппозиториев, представляют собой, например, жиры, воски, полутвердые и жидкие полиолы, природные или отвержденные масла и т.д. Подходящие вещества, являющиеся носителями для получения растворов, например растворов для инъекции, или эмульсий или сиропов, представляют собой, например, воду, физиологический раствор, спирты, глицерин, полиолы, сахарозу, инвертный сахар, глюкозу, растительные масла и т.д. Подходящие вещества, являющиеся носителями для микрокапсул, имплантатов или стержней, представляют собой, например, сополимеры гликолевой кислоты и молочной кислоты. Фармацевтические композиции обычно содержат приблизительно от 0,5% до приблизительно 90 мас.% соединений формулы I и/или их фармацевтически приемлемых солей и/или их пролекарств. Количество активного ингредиента формулы I и/или его фармацевтически приемлемых солей и/или его пролекарства в фармацевтических композициях обычно составляет приблизительно от 0,5 мг до приблизительно 1000 мг, предпочтительно приблизительно от 1 мг до приблизительно 500 мг.
В добавление к активным ингредиентам формулы I и/или их фармацевтически приемлемым солям и/или пролекарствам и к веществам, являющимся носителями или вспомогательными веществами, фармацевтические композиции могут содержать вспомогательные вещества или добавки, такие как, например, наполнители, разрыхлители, связующие вещества, лубриканты, смачивающие агенты, стабилизаторы, эмульгаторы, консерванты, подсластители, красители, ароматизаторы, ароматизирующие вещества, загустители, разбавители, буферные вещества, растворители, солюбилизаторы, агенты для достижения эффекта депо, соли для изменения осмотического давления, покрывающие агенты или антиоксиданты. Они могут также содержать два или более соединений формулы I и/или их фармацевтически приемлемых солей и/или их пролекарств. В случае, когда фармацевтическая композиция содержит два и более соединений формулы I, выбор отдельных соединений может быть нацелен на конкретный общий фармакологический профиль фармацевтической композиции. Например, очень эффективное соединение с более короткой продолжительностью действия можно комбинировать с менее эффективным соединением с более длительной активностью. Гибкость, обеспечиваемая относительно выбора заместителей в соединениях формулы I, обеспечивает хороший контроль биологических и физико-химических свойств соединений и, таким образом, обеспечивает выбор данных требуемых соединений. Кроме того, в добавление по меньшей мере к одному соединению формулы I и/или его фармацевтически приемлемой соли и/или пролекарству, фармацевтические композиции могут также содержать один или более других фармацевтически, терапевтически и/или профилактически активных ингредиентов.
При применении соединений формулы I доза может изменяться в широких пределах и, как принято и известно лечащему врачу, должна подходить к индивидуальным условиям в каждом отдельном случае. Она зависит, например, от конкретного применяемого соединения, от природы и тяжести заболевания, которое лечат, от способа и режима введения, или от того, лечат острое или хроническое заболевание или осуществляют профилактику. Подходящую дозу можно установить, применяя клинические подходы, хорошо известные в медицинской области техники. Как правило, дневная доза для получения требуемых результатов у взрослого, весящего приблизительно 75 кг, составляет от 0,01 до 100 мг/кг, предпочтительно от 0,1 до 50 мг/кг, в частности от 0,1 до 10 мг/кг (в каждом случае в мг на кг массы тела). Дневную дозу можно разделить, в частности, в случае введения относительно больших количеств, на несколько, например 2, 3 или 4, частичных введения. Обычно, в зависимости от индивидуальных свойств, ее может быть необходимо изменять в большую или меньшую сторону относительно указанной дневной дозы.
Соединения настоящего изобретения также являются пригодными в качестве стандартных или эталонных соединений, например в качестве стандарта качества или контроля, в испытаниях или анализах, включающих ингибирование LPA рецептора LPAR5. Такие соединения можно обеспечивать в виде коммерческого набора, например, для применения в фармацевтических исследованиях, включающих LPA рецептор LPAR5. Например, соединение настоящего изобретения можно применять в качестве эталона в анализе для сравнения его известной активности с соединением с неизвестной активностью. Это будет гарантировать экспериментатору, что анализ проводился правильно и обеспечена основа для сравнения, особенно если тестируемое соединение было производным эталонного соединения. При разработке новых анализов или протоколов соединения согласно настоящему изобретению можно применять для испытания на их эффективность.
Соединение формулы I можно также предпочтительно применять в качестве антиагреганта вне индивида. Например, эффективное количество соединения настоящего изобретения может быть подвергнуто контакту со свежеотобранным образцом крови, предотвращая агрегацию образца крови. Кроме того, соединение формулы I или его соли можно применять для диагностических целей, например, в in vitro диагностике, и в качестве вспомогательного вещества в биохимических исследованиях. Например, соединение формулы I можно применять в анализе на обнаружение присутствия LPA рецептора LPAR5 или для выделения ткани, содержащей LPA рецептор LPAR5, по существу в чистой форме. Соединение настоящего изобретения можно метить, например, радиоизотопом, и затем меченое соединение, связанное с LPA рецептором LPAR5, детектируют, применяя стандартный способ, подходящий для обнаружения конкретной метки. Таким образом, соединение формулы I или его соль можно применять в качестве зонда для обнаружения расположения или величины активности LPAR5 in vivo, in vitro или ex vivo.
Кроме того, соединения формулы I можно применять в качестве промежуточных соединений для получения других соединений, в частности других фармацевтических активных ингредиентов, которые можно получить из соединений формулы I, например, введением заместителей или модификацией функциональных групп.
Общие последовательности для получения соединений, пригодных в настоящем изобретении, изложены подробно в примерах, приведенных ниже, которые предполагаются только для иллюстрации настоящего изобретения и не ограничивают его сущность или объем. Специалисту в данной области техники будет ясно, что известные переменные условий и способов, описанных в примерах, можно применять для получения соединений настоящего изобретения.
Кроме того, следующие пункты (1)-(12) описаны в настоящем описании, которые включают дополнительные соединения, помимо соединений, которые включены формулой изобретения. Дополнительные соединения можно получить теми же способами, как описано в настоящем описании для получения соединений настоящего изобретения.
(1) Соединение формулы I:
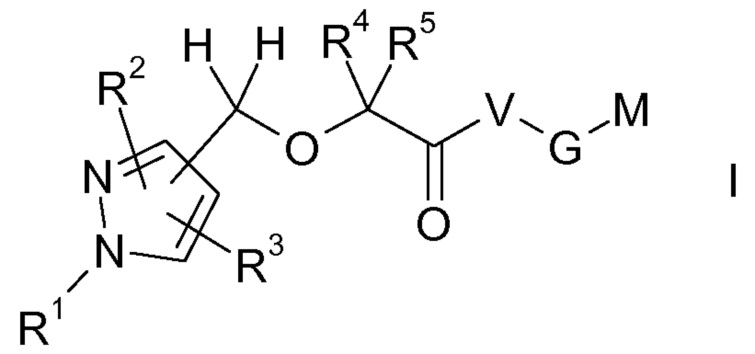
где
R1 выбран из группы, состоящей из водорода, (C1-C6)алкила, (C3-C7)циклоалкила, (C3-C7)циклоалкил-(C1-C4)алкила-, Ar и Ar(C1-C4)алкила-;
R2 и R3, каждый независимо друг от друга, выбран из группы, состоящей из водорода, галогена, (C1-C4)алкила, (C3-C7)циклоалкила, (C3-C7)циклоалкил-(C1-C4)алкила-, Ar, Ar(C1-C4)алкила-, (C1-C4)алкил-O-, (C3-C7)циклоалкил-O-, (C3-C7)циклоалкил-(C1-C4)алкил-O-, Ar-O- и Ar(C1-C4)алкил-O-,
или группы R2 и R3, в случае, когда они связаны с соседними атомами углерода кольца, вместе с несущими их атомами углерода, образуют бензольное кольцо, которое может быть незамещенным или замещено одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила, циано и (C1-C4)алкил-O-;
R4 и R5, каждый независимо друг от друга, выбран из группы, состоящей из водорода, фтора и (C1-C6)алкила,
или группы R4 и R5, вместе с несущим их атомом углерода, образуют (C3-C7)циклоалкановое кольцо, которое может быть незамещенным или замещено одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из фтора и (C1-C4)алкила;
R11, R12, R13 и R14, каждый независимо друг от друга, выбран из группы, состоящей из водорода и (C1-C4)алкила;
Ar выбран из группы, состоящей из фенила, нафтила и ароматического, 5-членного или 6-членного моноциклического гетероцикла, который содержит один или два одинаковых или различных гетероатома, выбранных из группы, состоящей из N, O и S, все из которых являются незамещенными или замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила, (C3-C7)циклоалкила, (C3-C7)циклоалкил-(C1-C4)алкила-, циано и (C1-C4)алкил-O-;
V выбран из группы, состоящей из R11-O- и R12-N(R13)-, и в данном случае G и M отсутствуют,
или
V выбран из группы, состоящей из -N(R14)-, -N(R14)-(C1-C4)алкила-, -O- и -O-(C1-C4)алкила-, и в данном случае
G выбран из группы, состоящей из прямой связи и фенилена, который может быть незамещенным или замещен одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила, циано и (C1-C4)алкил-O-, при условии, что G не является прямой связью, если V представляет собой -N(R14)- или -O-, и
M выбран из группы, состоящей из R11-O-C(O)- и R12-N(R13)-C(O)-;
где все алкильные группы являются незамещенными или замещены одним или более фторсодержащими заместителями и все циклоалкильные группы являются незамещенными или замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из фтора и (C1-C4)алкила;
в любой из его стереоизомерных форм или в виде смеси стереоизомерных форм в любом соотношении, или их фармацевтически приемлемая соль.
(2) Соединение формулы I по пункту (1), в котором
R1 выбран из группы, состоящей из водорода, (C1-C6)алкила, (C3-C7)циклоалкила, Ar и Ar(C1-C4)алкила-;
R2 и R3, каждый независимо друг от друга, выбран из группы, состоящей из водорода, (C1-C4)алкила, (C3-C7)циклоалкила, (C3-C7)циклоалкил-(C1-C4)алкила-, Ar, Ar(C1-C4)алкила-, (C1-C4)алкил-O-, (C3-C7)циклоалкил-O-, (C3-C7)циклоалкил-(C1-C4)алкил-O-, Ar-O- и Ar(C1-C4)алкил-O-,
или группы R2 и R3, в случае, когда они связаны с соседними атомами углерода кольца, вместе с несущими их атомами углерода, образуют бензольное кольцо, которое может быть незамещенным или замещено одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила, циано и (C1-C4)алкил-O-;
R4 и R5, каждый независимо друг от друга, выбран из группы, состоящей из водорода и (C1-C6)алкила,
или группы R4 и R5, вместе с несущим их атомом углерода, образуют (C3-C7)циклоалкановое кольцо, которое может быть незамещенным или замещено одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из фтора и (C1-C4)алкила;
R11, R12, R13 и R14, каждый независимо друг от друга, выбран из группы, состоящей из водорода и (C1-C4)алкила;
Ar выбран из группы, состоящей из фенила, нафтила и ароматического, 5-членного или 6-членного моноциклического гетероцикла, который содержит один или два одинаковых или различных гетероатома, выбранных из группы, состоящей из N, O и S, все из которых являются незамещенными или замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила, (C3-C7)циклоалкила, (C3-C7)циклоалкил-(C1-C4)алкила-, циано и (C1-C4)алкил-O-;
V представляет собой R11-O-, и в данном случае G и M отсутствуют,
или
V выбран из группы, состоящей из -N(R14)-, -N(R14)-(C1-C4)алкила- и -O-(C1-C4)алкила-, и в данном случае
G выбран из группы, состоящей из прямой связи и фенилена, который может быть незамещенным или замещен одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила, циано и (C1-C4)алкил-O-, при условии, что G не является прямой связью, если V представляет собой -N(R14)-, и
M выбран из группы, состоящей из R11-O-C(O)- и R12-N(R13)-C(O)-;
где все алкильные группы являются незамещенными или замещены одним или более фторсодержащими заместителями и все циклоалкильные группы являются незамещенными или замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из фтора и (C1-C4)алкила;
в любой из его стереоизомерных форм или в виде смеси стереоизомерных форм в любом соотношении, или их фармацевтически приемлемая соль.
(3) Соединение формулы I по любому из пунктов (1) и (2), в котором
R1 выбран из группы, состоящей из (C1-C6)алкила, (C3-C7)циклоалкила, Ar и Ar(C1-C4)алкила-;
R2 и R3, каждый независимо друг от друга, выбран из группы, состоящей из водорода, (C1-C4)алкила, Ar, Ar(C1-C4)алкила-, (C1-C4)алкил-O-, (C3-C7)циклоалкил-O-, Ar-O- и Ar(C1-C4)алкил-O-,
или группы R2 и R3, в случае, когда они связаны с соседними атомами углерода кольца, вместе с несущими их атомами углерода, образуют бензольное кольцо, которое может быть незамещенным или замещено одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила, циано и (C1-C4)алкил-O-;
R4 и R5, каждый независимо друг от друга, выбран из группы, состоящей из водорода и (C1-C6)алкила,
или группы R4 и R5, вместе с несущим их атомом углерода, образуют (C3-C7)циклоалкановое кольцо, которое может быть незамещенным или замещено одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из фтора и (C1-C4)алкила;
R11, R12, R13 и R14, каждый независимо друг от друга, выбран из группы, состоящей из водорода и (C1-C4)алкила;
Ar выбран из группы, состоящей из фенила, нафтила и ароматического, 5-членного или 6-членного моноциклического гетероцикла, который содержит один или два одинаковых или различных гетероатома, выбранных из группы, состоящей из N, O и S, все из которых являются незамещенными или замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила, (C3-C7)циклоалкила и (C1-C4)алкил-O-;
V представляет собой R11-O-, и в данном случае G и M отсутствуют,
или
V выбран из группы, состоящей из -N(R14)- и -N(R14)-(C1-C4)алкила-, и в данном случае
G выбран из группы, состоящей из прямой связи и фенилена, который может быть незамещенным или замещен одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила и (C1-C4)алкил-O-, при условии, что G не является прямой связью, если V представляет собой -N(R14)-, и
M выбран из группы, состоящей из R11-O-C(O)- и R12-N(R13)-C(O)-;
где все алкильные группы являются незамещенными или замещены одним или более фторсодержащими заместителями и все циклоалкильные группы являются незамещенными или замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из фтора и (C1-C4)алкила;
в любой из его стереоизомерных форм или в виде смеси стереоизомерных форм в любом соотношении, или их фармацевтически приемлемая соль.
(4) Соединение формулы I по любому из пунктов (1)-(3), в котором
R1 выбран из группы, состоящей из (C1-C4)алкила, Ar и Ar(C1-C4)алкила-;
R2 и R3, каждый независимо друг от друга, выбран из группы, состоящей из водорода, (C1-C4)алкила, Ar, Ar(C1-C4)алкила- и Ar-O-,
или группы R2 и R3, в случае, когда они связаны с соседними атомами углерода кольца, вместе с несущими их атомами углерода, образуют бензольное кольцо, которое может быть незамещенным или замещено одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила и (C1-C4)алкил-O-;
R4 и R5, каждый независимо друг от друга, выбран из группы, состоящей из водорода и (C1-C6)алкила,
или группы R4 и R5, вместе с несущим их атомом углерода, образуют (C3-C7)циклоалкановое кольцо, которое может быть незамещенным или замещено одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из фтора и (C1-C4)алкила;
R11 и R14, каждый независимо друг от друга, выбран из группы, состоящей из водорода и (C1-C4)алкила;
Ar выбран из группы, состоящей из фенила, нафтила и ароматического, 5-членного или 6-членного моноциклического гетероцикла, который содержит один или два одинаковых или различных гетероатома, выбранных из группы, состоящей из N, O и S, все из которых являются незамещенными или замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила, (C3-C7)циклоалкила и (C1-C4)алкил-O-;
V представляет собой R11-O-, и в данном случае G и M отсутствуют,
или
V выбран из группы, состоящей из -N(R14)- и -N(R14)-(C1-C4)алкила-, и в данном случае
G выбран из группы, состоящей из прямой связи и фенилена, который может быть незамещенным или замещен одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила и (C1-C4)алкил-O-, при условии, что G не является прямой связью, если V представляет собой -N(R14), и
M представляет собой R11-O-C(O)-;
где все алкильные группы являются незамещенными или замещены одним или более фторсодержащими заместителями и все циклоалкильные группы являются незамещенными или замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из фтора и (C1-C4)алкила;
в любой из его стереоизомерных форм или в виде смеси стереоизомерных форм в любом соотношении, или их фармацевтически приемлемая соль.
(5) Соединение формулы I по любому из пунктов (1)-(4), в котором
R1 выбран из группы, состоящей из (C1-C4)алкила, Ar и Ar(C1-C4)алкила-;
R2 и R3, каждый независимо друг от друга, выбран из группы, состоящей из водорода, (C1-C4)алкила, Ar- и Ar-O-,
или группы R2 и R3, в случае, когда они связаны с соседними атомами углерода кольца, вместе с несущими их атомами углерода, образуют бензольное кольцо, которое может быть незамещенным или замещено одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена и (C1-C4)алкила-;
R4 и R5, каждый независимо друг от друга, выбран из группы, состоящей из водорода и (C1-C6)алкила,
или группы R4 и R5, вместе с несущим их атомом углерода, образуют (C3-C7)циклоалкановое кольцо, которое может быть незамещенным или замещено одним или более фторсодержащими заместителями;
R11 и R14, каждый независимо друг от друга, выбран из группы, состоящей из водорода и (C1-C4)алкила;
Ar выбран из группы, состоящей из фенила, нафтила и ароматического, 5-членного или 6-членного моноциклического гетероцикла, который содержит один или два одинаковых или различных гетероатома, выбранных из группы, состоящей из N, O и S, все из которых являются незамещенными или замещены одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила, (C3-C7)циклоалкила и (C1-C4)алкил-O-;
V представляет собой R11-O-, и в данном случае G и M отсутствуют,
или
V выбран из группы, состоящей из -N(R14)- и -N(R14)-(C1-C4)алкила-, и в данном случае
G выбран из группы, состоящей из прямой связи и фенилена, который может быть незамещенным или замещен одним или более одинаковыми или различными заместителями, выбранными из группы, состоящей из галогена, (C1-C4)алкила и (C1-C4)алкил-O-, при условии, что G не является прямой связью, если V представляет собой -N(R14), и
M представляет собой R11-O-C(O)-;
где все алкильные группы являются незамещенными или замещены одним или более фторсодержащими заместителями;
в любой из его стереоизомерных форм или в виде смеси стереоизомерных форм в любом соотношении, или их фармацевтически приемлемая соль.
(6) Соединение формулы I по любому из пунктов (1)-(5), которое выбрано из группы, состоящей из
2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]-2-метилпропионовой кислоты,
[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]уксусной кислоты,
1-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]циклопентанкарбоновой кислоты,
2-[1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]-2-метилпропионовой кислоты,
2-[1-(2-хлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]-2-метилпропионовой кислоты,
2-[1-(4-хлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]-2-метилпропионовой кислоты,
2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]масляной кислоты,
2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]пропионовой кислоты,
4-({2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]-2-метилпропиониламино}метил)бензойной кислоты,
4-({2-[1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-илметокси]-2-метилпропиониламино}метил)бензойной кислоты,
4-({2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]ацетиламино}метил)бензойной кислоты,
4-({2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]бутириламино}метил)бензойной кислоты,
4-({2-[1-(2-хлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]-2-метилпропиониламино}метил)бензойной кислоты,
4-({2-[1-(4-хлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]-2-метилпропиониламино}метил)бензойной кислоты,
4-({2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]пропиониламино}метил)бензойной кислоты,
4-{2-[1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]пропиониламино}бензойной кислоты,
4-{2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]-3-метилбутириламино}бензойной кислоты,
4-{2-[1-(4-хлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]пропиониламино}бензойной кислоты,
4-[2-(3-нафталин-2-ил-1-фенил-1H-пиразол-4-илметокси)пропиониламино]бензойной кислоты,
4-{2-[1-(2-хлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]пропиониламино}бензойной кислоты,
4-[2-(3,5-диметил-1-фенил-1H-пиразол-4-илметокси)пропиониламино]бензойной кислоты,
4-[2-(1,3-дифенил-1H-пиразол-4-илметокси)пропиониламино]бензойной кислоты,
4-{2-[1-бензил-3-(3-метоксифенил)-1H-пиразол-4-илметокси]пропиониламино}бензойной кислоты,
4-{2-[5-(4-фторфенокси)-1-метил-3-фенил-1H-пиразол-4-илметокси]пропиониламино}бензойной кислоты,
4-[2-(2-метил-2H-индазол-3-илметокси)пропиониламино]бензойной кислоты,
4-{2-[3-(4-циклогексил-фенил)-1-фенил-1H-пиразол-4-илметокси]пропиониламино}бензойной кислоты,
4-[2-(1-фенил-3-тиофен-2-ил-1H-пиразол-4-илметокси)пропиониламино]бензойной кислоты и
4-[2-(1,5-дифенил-1H-пиразол-3-илметокси)пропиониламино]бензойной кислоты,
в любой из его стереоизомерных форм или в виде смеси стереоизомерных форм в любом соотношении, или их фармацевтически приемлемая соль.
(7) Соединение формулы I или его фармацевтически приемлемая соль по любому из пунктов (1)-(6) для применения в качестве лекарственного средства.
(8) Соединение формулы I или его фармацевтически приемлемая соль по любому из пунктов (1)-(6) для применения в лечении заболевания, чувствительного к ингибированию LPA рецептора LPAR5, или ослабления или ингибирования агрегации тромбоцитов или образования тромба, или ослабления или ингибирования активации тучных клеток, или ослабления или ингибирования активации клеток микроглии.
(9) Соединение формулы I или его фармацевтически приемлемая соль по любому из пунктов (1)-(6) для применения в лечении тромбоэмболических заболеваний, тромбоза глубоких вен, венозной и артериальной тромбоэмболии, тромбофлебита, ишемического и церебрального артериального тромбоза, эмболии мозга, эмболии почек, легочной эмболии, генерализованного тромбогеморрагического синдрома, сердечно-сосудистых заболеваний, преходящего нарушения мозгового кровообращения, инсульта, острого инфаркта миокарда, нестабильной стенокардии, хронической стабильной стенокардии, заболевания периферических сосудов, преэклампсии/эклампсии и тромботической цитопенической пурпуры, воспалительных заболеваний, гипералгезии, рассеянного склероза, воспалительной боли, ангиогенеза, атеротромбоза, аллергических реакций или рестеноза.
(10) Соединение формулы I или его фармацевтически приемлемая соль по любому из пунктов (1)-(6) для применения в лечении патологического образования тромба, острого инфаркта миокарда, нестабильной стенокардии, тромбоэмболии, острой закупорки сосудов, связанной с тромболитической терапией или чрескожной транслюминальной коронарной ангиопластикой (PTCA), транзиторной ишемической атаки, инсульта, динамического нарушения кровообращения, обходного шунтирования коронарных или периферических артерий, сужения просвета сосудов, рестеноза после коронарной венозной ангиопластики, поддержания сосудистого доступа у пациентов с периодическим гемодиализом, патологического образования тромба, возникающего в венах нижних конечностей после хирургической операции брюшной полости, коленей или бедер, риска легочной тромбоэмболии или диссеминированной системной внутривенной коагулопатии, возникающей в сосудистой системе при септическом шоке, вирусных инфекций или рака.
(11) Соединение формулы I или его фармацевтически приемлемая соль по любому из пунктов (1)-(6) для применения в лечении воспалительной боли, астмы, ангиогенеза, демиелинизирующих заболеваний центральной нервной системы или периферической нервной системы, множественного склероза, поперечного миелита, неврита зрительного нерва, болезни Дэвика, синдрома Гийена-Барре или хронической воспалительной демиелинизирующей полинейропатии.
(12) Фармацевтическая композиция, содержащая соединение формулы I или его фармацевтически приемлемую соль по любому из пунктов (1)-(6) и фармацевтически приемлемый носитель.
Примеры
Когда на конечной стадии получения соединения использовали кислоту, такую как трифторуксусная кислота или уксусная кислота, например, когда трифторуксусную кислоту применяли на кислотолабильной защитной группе, например трет-Bu группе, или когда соединение очищали хроматографией, используя элюент, который содержал данную кислоту, в некоторых случаях, в зависимости от способа обработки, например условий способа лиофилизации, соединение получали частично или полностью в виде соли используемой кислоты, например, в виде соли уксусной кислоты, соли муравьиной кислоты или соли трифторуксусной кислоты или соли хлористоводородной кислоты. Аналогично, исходные соединения или промежуточные соединения, содержащие основный центр, подобный, например, основному азоту, получали и использовали или в виде свободного основания, или в виде солевой формы, подобно, например, соли трифторуксусной кислоты, соли бромистоводородной кислоты, соли серной кислоты или соли хлористоводородной кислоты. Комнатная температура означает температуру приблизительно 20-25°C
|
Пример 1: 2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]-2-метилпропионовая кислота
(i) [5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метанол
К раствору 5 г 5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-карбоновой кислоты в 130 мл ТГФ добавляли по каплям 40 мл 1M раствора борана в ТГФ при комнатной температуре. Затем реакционную смесь кипятили с обратным холодильником в течение 10 часов. Реакционную смесь охлаждали до комнатной температуры и аккуратно добавляли 20 мл метанола. Растворители удаляли при пониженном давлении, и остаток растворяли в этилацетате. Органический слой промывали 1M хлористоводородной кислотой, насыщенным раствором хлорида натрия и насыщенным раствором бикарбоната натрия. Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Продукт получали в виде белого твердого вещества и использовали без дополнительной очистки.
Выход: 4,6 г.
(ii) этиловый эфир 2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]-2-метилпропионовой кислоты
К раствору 1,6 г [5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метанола в 15 мл ДМФА добавляли 870 мг гидрида натрия (60% в минеральном масле) при комнатной температуре. Через 15 минут добавляли 1,6 г тетрабутиламмониййодида и 3,4 г этилового эфира 2-бром-2-метилпропионовой кислоты, и реакционную смесь перемешивали в течение 16 часов при комнатной температуре. После разбавления насыщенным водным раствором бикарбоната натрия реакционную смесь фильтровали через chem elut® картридж, элюируя этилацетатом. Растворители удаляли при пониженном давлении, и неочищенный продукт очищали хроматографией на силикагеле, элюируя в градиенте н-гептан/этилацетат. Фракции, содержащие продукт, объединяли, и растворитель упаривали при пониженном давлении. Выход: 1,3 г.
(iii) 2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]-2-метилпропионовая кислота
К раствору 735 мг этилового эфира 2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]-2-метилпропионовой кислоты в 10 мл ТГФ добавляли раствор 51 мг LiOH в 1 мл воды при комнатной температуре. Через 16 часов смесь доводили до pH 2 добавлением 1M хлористоводородной кислоты. Реакционную смесь концентрировали при пониженном давлении, и водный слой экстрагировали дихлорметаном. Объединенные органические фазы сушили над MgSO4, и растворители удаляли при пониженном давлении. Остаток очищали препаративной ВЭЖХ (C18 колонка с обращенной фазой, элюирование градиентом вода/MeCN с 0,1% ТФУК). Фракции, содержащие продукт, упаривали и лиофилизировали, с получением белого твердого вещества. Выход: 677 мг.
МС (ES-): m/e=451, спектрограмма хлора.
Пример 2: [5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]уксусная кислота
Указанное в заголовке соединение получали аналогично описанному в примере 1.
МС (ES-): m/e=423, спектрограмма хлора.
Пример 3: 1-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]циклопентанкарбоновая кислота
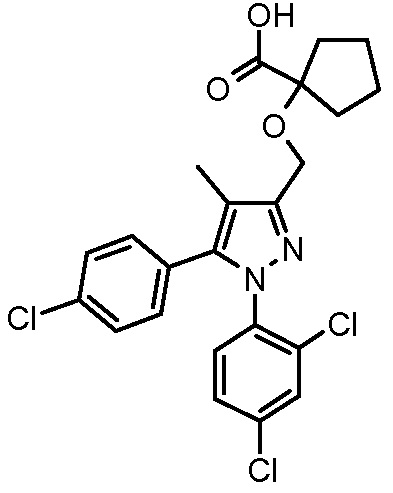
Указанное в заголовке соединение получали аналогично описанному в примере 1.
МС (ES-): m/e=477, спектрограмма хлора.
Пример 4: 2-[1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]-2-метилпропионовая кислота
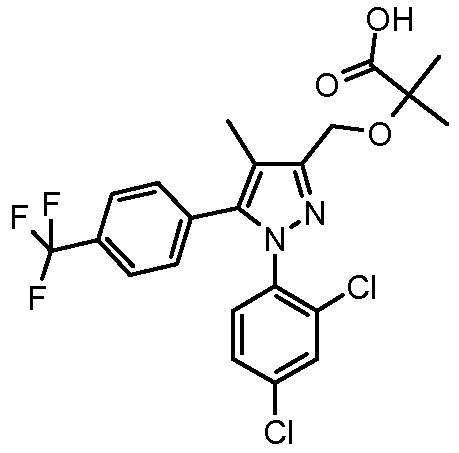
(i) 3-этоксикарбонил-2-метил-3-оксо-1-(4-трифторметилфенил)пропан-1-олат лития
К раствору 118 мл бис(триметилсилил)амида лития (гексаметилдисилазид лития; 0,9M в метилциклогексане) добавляли по каплям в течение 15 минут 20 г 1-(4-трифторметилфенил)пропан-1-он в 51 мл метилциклогексана, поддерживая реакционную смесь при 15-25°C. После перемешивания в течение 2 часов добавляли по каплям 15 мл диэтилоксалата в течение 30 минут, и реакционную смесь перемешивали в течение 16 часов. Затем выпавший в осадок продукт собирали фильтрованием и промывали н-гептаном. Выделенный неочищенный продукт использовали на следующей стадии после сушки в вакууме. Выход: 19 г.
(ii) 1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-карбоновая кислота
Раствор 10 г 3-этоксикарбонил-2-метил-3-оксо-1-(4-трифторметилфенил)пропан-1-олата лития, 6,9 г гидрохлорида (2,4-дихлорфенил)гидразина и 74 мл серной кислоты (50%) в 184 мл этанола кипятили с обратным холодильником в течение 7 часов. После охлаждения до комнатной температуры органические растворители удаляли при пониженном давлении, и остаток разбавляли 100 мл воды и экстрагировали этилацетатом. Объединенные органические слои сушили над MgSO4, и растворитель удаляли при пониженном давлении. Остаток растворяли в 100 мл ТГФ и добавляли при комнатной температуре раствор 1,4 г LiOH в 20 мл воды. Реакционную смесь нагревали при 60°C в течение 7 часов. Затем после охлаждения до комнатной температуры смесь подкисляли до pH 1 добавлением полуконцентрированной хлористоводородной кислоты. Выпавший в осадок продукт собирали фильтрованием и промывали водой. Остаток упаривали совместно дважды с дихлорметаном и дважды с толуолом. Выделенный неочищенный продукт использовали на следующей стадии. Выход: 13 г.
(iii) [1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-ил]метанол
К раствору 4,5 г 1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-карбоновой кислоты в 30 мл ТГФ добавляли по каплям 43 мл 1M раствора борана в ТГФ при комнатной температуре. Затем реакционную смесь кипятили с обратным холодильником в течение 10 часов. Реакционную смесь охлаждали до комнатной температуры и аккуратно добавляли 20 мл метанола. Растворители удаляли при пониженном давлении, и остаток растворяли в этилацетате. Органический слой промывали 1M хлористоводородной кислотой, насыщенным раствором хлорида натрия и насыщенным раствором бикарбоната натрия. Органические слои объединяли и сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Продукт получали в виде белого твердого вещества и использовали без дополнительной очистки.
Выход: 4,3 г.
(iv) этиловый эфир 2-[1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]-2-метилпропионовой кислоты
К раствору 2 г [1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-ил]метанола в 15 мл ДМФА добавляли 997 мг гидрида натрия (60% в минеральном масле) при комнатной температуре. Через 15 минут добавляли 1,8 г тетрабутиламмониййодида и 2,9 г этилового эфира 2-бром-2-метилпропионовой кислоты, и реакционную смесь перемешивали в течение 16 часов при комнатной температуре. После разбавления насыщенным водным раствором бикарбоната натрия реакционную смесь фильтровали через chem elut® картридж, элюируя этилацетатом. Растворители удаляли при пониженном давлении, и неочищенный продукт очищали хроматографией на силикагеле, элюируя в градиенте н-гептан/этилацетат. Фракции, содержащие продукт, объединяли, и растворитель упаривали при пониженном давлении. Выход: 1,3 г.
(v) 2-[1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]-2-метилпропионовая кислота
К раствору 1 г этилового эфира 2-[1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]-2-метилпропионовой кислоты в 6 мл ТГФ добавляли раствор 232 мг LiOH в 1 мл воды при комнатной температуре. Через 16 часов смесь доводили до pH 2 добавлением 1M хлористоводородной кислоты. Реакционную смесь концентрировали при пониженном давлении, и водный слой экстрагировали дихлорметаном. Объединенные органические фазы сушили над MgSO4, и растворители удаляли при пониженном давлении. Остаток очищали препаративной ВЭЖХ (C18 колонка с обращенной фазой, элюирование градиентом вода/MeCN с 0,1% ТФУК). Фракции, содержащие продукт, упаривали и лиофилизировали, с получением твердого желтого вещества. Выход: 634 мг.
МС (ES-): m/e=485, спектрограмма хлора.
Пример 5: 2-[1-(2-хлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]-2-метилпропионовая кислота
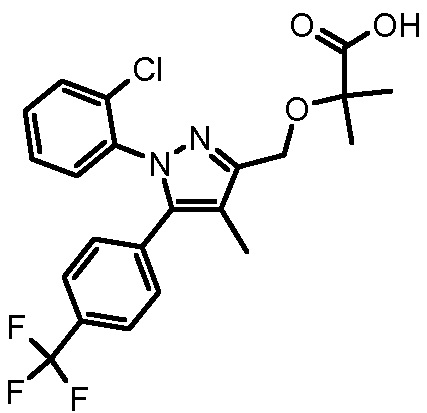
Указанное в заголовке соединение получали аналогично описанному в примере 5.
МС (ES-): m/e=451, спектрограмма хлора.
Пример 6: 2-[1-(4-хлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]-2-метилпропионовая кислота
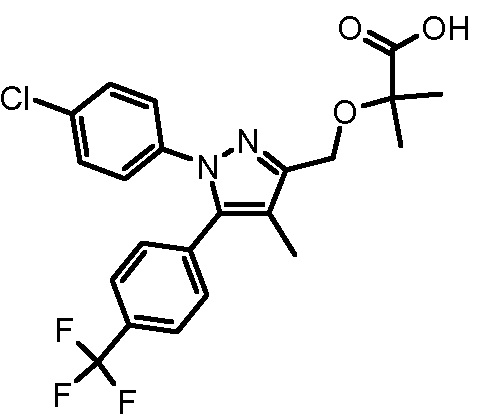
Указанное в заголовке соединение получали аналогично описанному в примере 5.
МС (ES-): m/e=451, спектрограмма хлора.
Пример 7: 2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]масляная кислота
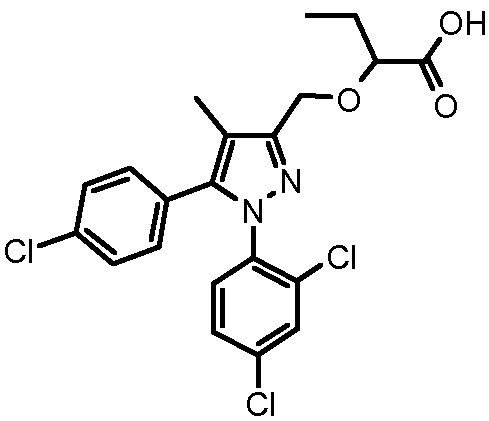
Указанное в заголовке соединение получали аналогично описанному в примере 5.
МС (ES-): m/e=452, спектрограмма хлора.
Пример 8: 2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]пропионовая кислота
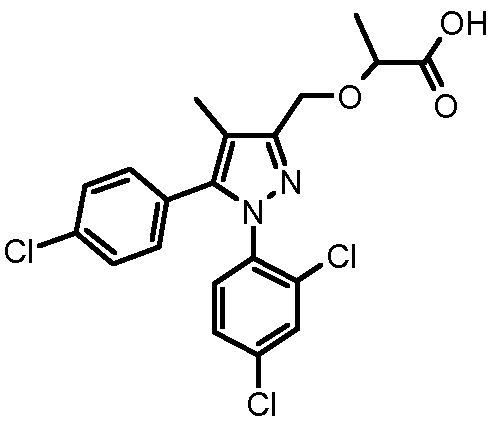
Указанное в заголовке соединение получали аналогично описанному в примере 5.
МС (ES-): m/e=439, спектрограмма хлора.
Пример 9: 4-({2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]-2-метилпропиониламино}метил)бензойная кислота
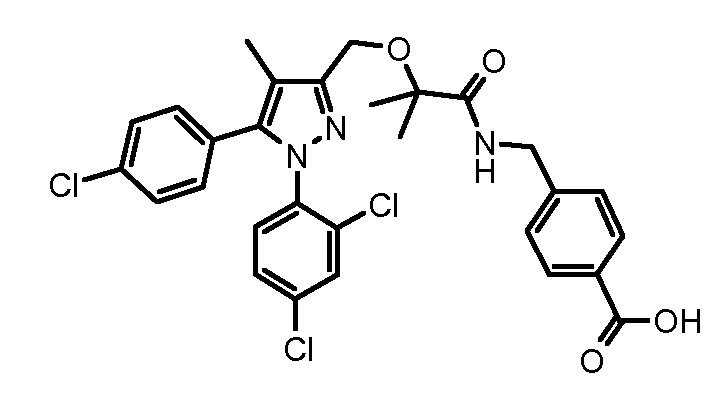
(i) [5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метанол
К раствору 5 г 5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-карбоновой кислоты в 130 мл ТГФ добавляли по каплям 40 мл 1M раствора борана в ТГФ при комнатной температуре. Затем реакционную смесь кипятили с обратным холодильником в течение 10 часов. Реакционную смесь охлаждали до комнатной температуры, и аккуратно добавляли 20 мл метанола. Растворители удаляли при пониженном давлении, и остаток растворяли в этилацетате. Органический слой промывали 1M хлористоводородной кислотой, насыщенным раствором хлорида натрия и насыщенным раствором бикарбоната натрия. Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Продукт получали в виде белого твердого вещества и использовали без дополнительной очистки. Выход: 4,6 г.
(ii) Этиловый эфир 2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]-2-метилпропионовой кислоты
К раствору 1,6 г [5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-ил]метанола в 15 мл ДМФА добавляли 870 мг гидрида натрия (60% в минеральном масле) при комнатной температуре. Через 15 минут добавляли 1,6 г тетрабутиламмониййодида и 3,4 г этилового эфира 2-бром-2-метилпропионовой кислоты, и реакционную смесь перемешивали в течение 16 часов при комнатной температуре. После разбавления насыщенным водным раствором бикарбоната натрия реакционную смесь фильтровали через chem elut® картридж, элюируя этилацетатом. Растворители удаляли при пониженном давлении, и неочищенный продукт очищали хроматографией на силикагеле, элюируя в градиенте н-гептан/этилацетат. Фракции, содержащие продукт, объединяли, и растворитель упаривали при пониженном давлении. Выход: 1,3 г.
(iii) 2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]-2-метилпропионовая кислота
К раствору 1,3 г этилового эфира 2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]-2-метилпропионовой кислоты в 10 мл ТГФ добавляли раствор 130 мг LiOH в 3 мл воды при комнатной температуре. Через 5 часов смесь доводили до pH 2 добавлением 1M хлористоводородной кислоты. Реакционную смесь концентрировали при пониженном давлении, и водный слой экстрагировали дихлорметаном. Объединенные органические фазы сушили над MgSO4, и растворители удаляли при пониженном давлении. Выделенный неочищенный продукт использовали на следующей стадии. Выход: 1,5 г.
(iv) 4-({2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]-2-метилпропиониламино}метил)бензойная кислота
К раствору 710 мг 2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]-2-метилпропионовой кислоты в 5 мл ДМФА добавляли 360 мг гидрохлорида N-(3-диметиламинопропил)-N'-этилкарбодиимида (EDC), 345 мг пентафторфенола и 392 мг NEM, и реакционную смесь перемешивали в течение 3 часов при комнатной температуре. Затем добавляли 353 мг 4-аминометилбензойной кислоты и 540 мг NEM в 5 мл ДМФА. Через 16 часов реакционную смесь разбавляли водой и фильтровали через chem elut® картридж, элюируя этилацетатом. Растворители удаляли при пониженном давлении, и остаток очищали препаративной ВЭЖХ (C18 колонка с обращенной фазой, элюирование градиентом вода/MeCN с 0,1% ТФУК). Фракции, содержащие продукт, упаривали и лиофилизировали, с получением белого твердого вещества. Выход: 288 мг.
МС (ES-): m/e=586, спектрограмма хлора.
Пример 10: 4-({2-[1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]-2-метилпропиониламино}метил)бензойная кислота
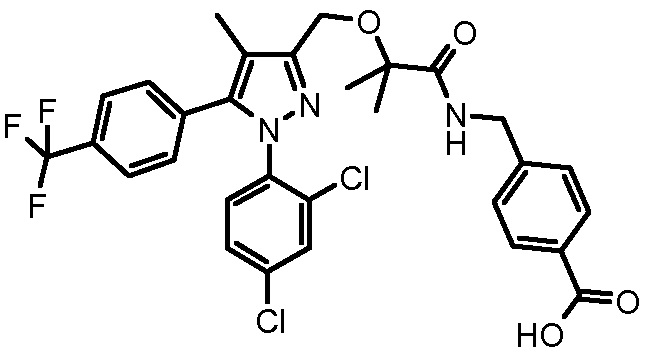
(i) 3-этоксикарбонил-2-метил-3-оксо-1-(4-трифторметилфенил)пропан-1-олат лития
К раствору 118 мл бис(триметилсилил)амида лития (гексаметилдисилазид лития; 0,9M в метилциклогексане) добавляли по каплям в течение 15 минут 20 г 1-(4-трифторметилфенил)-пропан-1-она в 51 мл метилциклогексана, поддерживая реакционную смесь при 15-25°C. После перемешивания в течение 2 часов добавляли по каплям 15 мл диэтилоксалата в течение 30 минут, и реакционную смесь перемешивали в течение 16 часов. Затем выпавший в осадок продукт собирали фильтрованием и промывали н-гептаном. Выделенный неочищенный продукт использовали на следующей стадии после сушки в вакууме. Выход: 19 г.
(ii) 1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-карбоновая кислота
Раствор 10 г 3-этоксикарбонил-2-метил-3-оксо-1-(4-трифторметилфенил)пропан-1-олата лития, 6,9 г гидрохлорида (2,4-дихлорфенил)гидразина и 74 мл серной кислоты (50%) в 184 мл этанола кипятили с обратным холодильником в течение 7 часов. После охлаждения до комнатной температуры органические растворители удаляли при пониженном давлении, остаток разбавляли 100 мл воды и экстрагировали этилацетатом. Объединенные органические слои сушили над MgSO4, и растворитель удаляли при пониженном давлении. Остаток растворяли в 100 мл ТГФ, и добавляли раствор 1,4 г LiOH в 20 мл воды при комнатной температуре. Реакционную смесь нагревали при 60°C в течение 7 часов. Затем после охлаждения до комнатной температуры смесь подкисляли до pH 1 добавлением полуконцентрированной хлористоводородной кислоты.
Выпавший в осадок продукт собирали фильтрованием и промывали водой. Остаток упаривали совместно дважды с дихлорметаном и дважды с толуолом. Выделенный неочищенный продукт использовали на следующей стадии. Выход: 13 г.
(iii) [1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-ил]метанол
К раствору 4,5 г 1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-карбоновой кислоты в 30 мл ТГФ добавляли по каплям 43 мл 1M раствора борана в ТГФ при комнатной температуре. Затем реакционную смесь кипятили с обратным холодильником в течение 10 часов. Реакционную смесь охлаждали до комнатной температуры и аккуратно добавляли 20 мл метанола. Растворители удаляли при пониженном давлении, и остаток растворяли в этилацетате. Органический слой промывали 1M хлористоводородной кислотой, насыщенным раствором хлорида натрия и насыщенным раствором бикарбоната натрия. Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Продукт получали в виде белого твердого вещества и использовали без дополнительной очистки. Выход: 4,3 г.
(iv) этиловый эфир 2-[1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]-2-метилпропионовой кислоты
К раствору 2 г [1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-ил]метанола в 12 мл ДМФА добавляли 997 мг гидрида натрия (60% в минеральном масле) при комнатной температуре. Через 15 минут добавляли 1,8 г тетрабутиламмониййодида и 2,9 г этилового эфира 2-бром-2-метилпропионовой кислоты, и реакционную смесь перемешивали в течение 16 часов при комнатной температуре. После разбавления насыщенным водным раствором бикарбоната натрия реакционную смесь фильтровали через chem elut® картридж, элюируя этилацетатом. Растворители удаляли при пониженном давлении, и неочищенный продукт очищали хроматографией на силикагеле, элюируя в градиенте н-гептан/этилацетат. Фракции, содержащие продукт, объединяли, и растворитель упаривали при пониженном давлении. Выход: 735 мг.
(v) 2-[1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]-2-метилпропионовая кислота
К раствору 735 мг этилового эфира 2-[1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]-2-метилпропионовой кислоты в 5 мл ТГФ добавляли раствор 51 мг LiOH в 1 мл воды при комнатной температуре. Через 5 часов смесь доводили до pH 2 добавлением 1M хлористоводородной кислоты. Реакционную смесь концентрировали при пониженном давлении, и водный слой экстрагировали дихлорметаном. Объединенные органические фазы сушили над MgSO4, и растворители удаляли при пониженном давлении. Выделенный неочищенный продукт использовали на следующей стадии. Выход: 677 мг.
(vi) 4-({2-[1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]-2-метилпропиониламино}метил)бензойная кислота
К раствору 600 мг 2-[1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]-2-метилпропионовой кислоты в 9 мл ДМФА добавляли 283 мг гидрохлорида N-(3-диметиламинопропил)-N'-этилкарбодиимида (EDC), 271 мг пентафторфенола и 300 мг NEM, и реакционную смесь перемешивали в течение 3 часов при комнатной температуре. Затем добавляли 278 мг 4-аминометилбензойной кислоты и 424 мг NEM в 10 мл ДМФА. Через 16 часов реакционную смесь разбавляли водой и фильтровали через chem elut® картридж, элюируя этилацетатом. Растворители удаляли при пониженном давлении, и остаток очищали препаративной ВЭЖХ (C18 колонка с обращенной фазой, элюирование градиентом вода/MeCN с 0,1% ТФУК). Фракции, содержащие продукт, упаривали и лиофилизировали, с получением белого твердого вещества. Выход: 204 мг.
МС (ES-): m/e=618, спектрограмма хлора.
Пример 11: 4-({2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]ацетиламино}метил)бензойная кислота
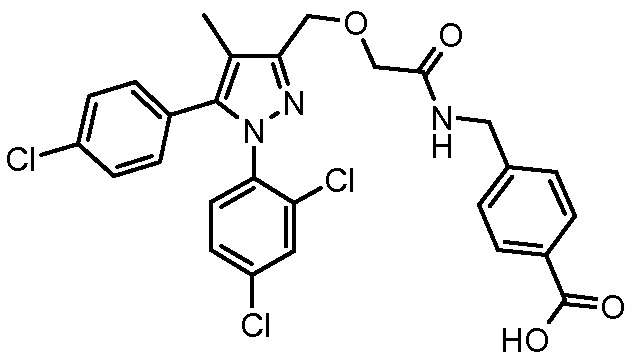
Указанное в заголовке соединение получали аналогично описанному в примере 11.
МС (ES-): m/e=556, спектрограмма хлора.
Пример 12: 4-({2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]бутириламино}метил)бензойная кислота
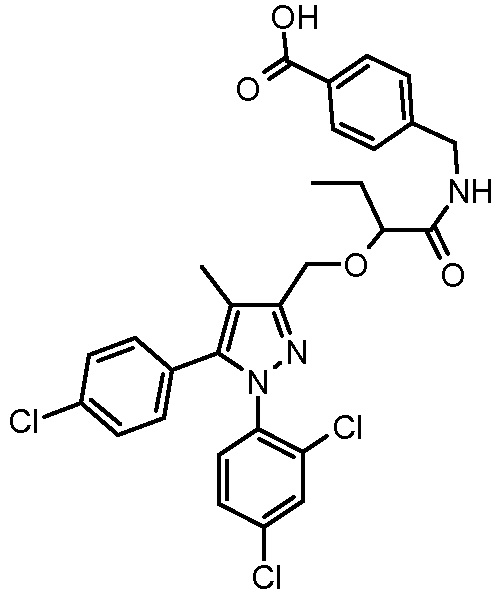
Указанное в заголовке соединение получали аналогично описанному в примере 11.
МС (ES-): m/e=586, спектрограмма хлора.
Пример 13: 4-({2-[1-(2-хлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]-2-метилпропиониламино}метил)бензойная кислота
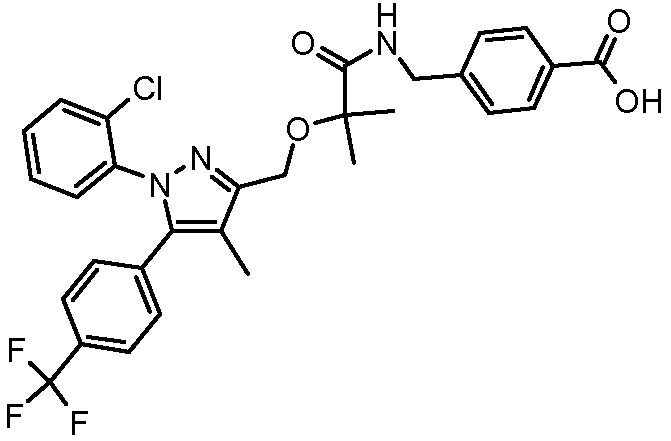
Указанное в заголовке соединение получали аналогично описанному в примере 11.
МС (ES-): m/e=584, спектрограмма хлора.
Пример 14: 4-({2-[1-(4-хлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]-2-метилпропиониламино}метил)бензойная кислота
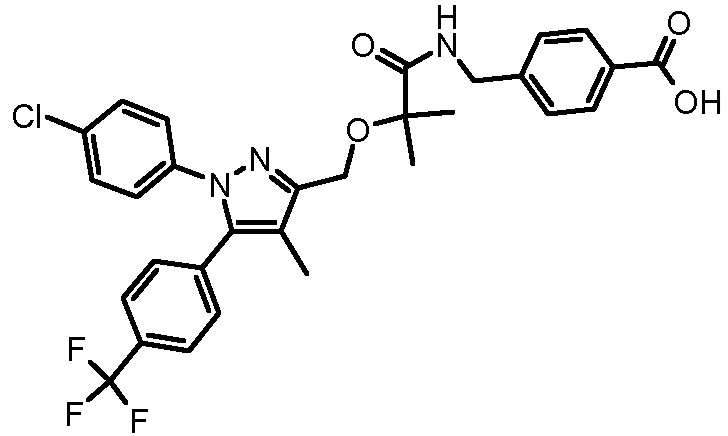
Указанное в заголовке соединение получали аналогично описанному в примере 11.
МС (ES-): m/e=584, спектрограмма хлора.
Пример 15: 4-({2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]пропиониламино}метил)бензойная кислота
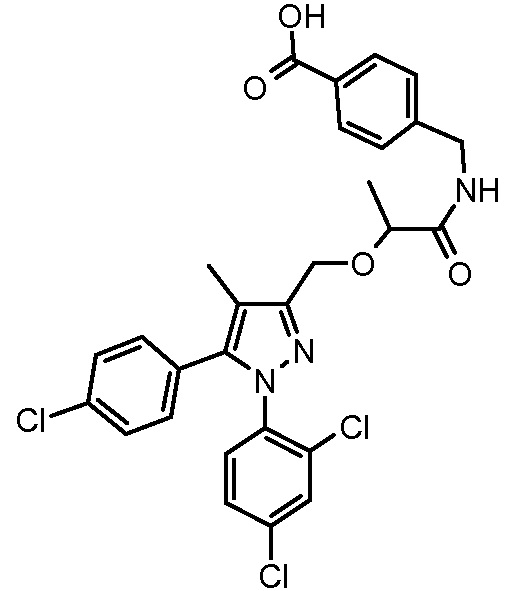
Указанное в заголовке соединение получали аналогично описанному в примере 11.
МС (ES-): m/e=570, спектрограмма хлора.
Пример 16: 4-{2-[1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]пропиониламино}бензойная кислота
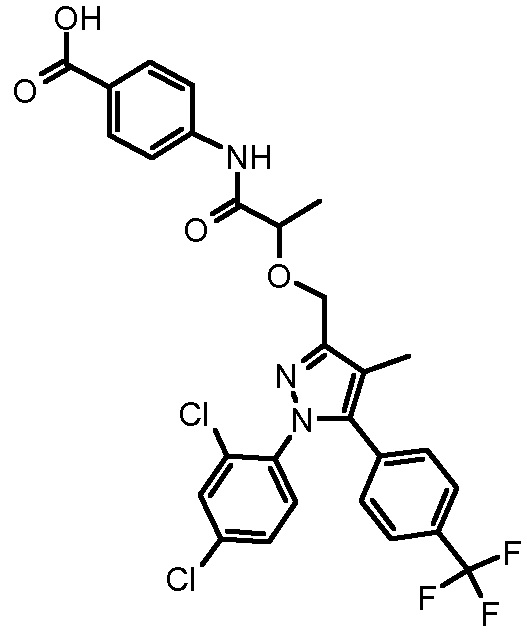
(i) метиловый эфир 4-(2-бромпропиониламино)бензойной кислоты
К раствору 1,1 г метилового эфира 4-аминобензойной кислоты в 17 мл толуола добавляли 2,2 мл пиридина и 1,5 г 2-бромпропионилбромида при комнатной температуре. Через 16 часов реакционную смесь разбавляли водой и фильтровали через chem elut® картридж, элюируя этилацетатом. Растворители удаляли при пониженном давлении, и неочищенный продукт очищали хроматографией на силикагеле, элюируя в градиенте н-гептан/этилацетат. Фракции, содержащие продукт, объединяли, и растворитель упаривали при пониженном давлении. Выход: 2 г.
(ii) 4-{2-[1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]пропиониламино}бензойная кислота
К раствору 100 мг [1-(2,4-дихлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-ил]метанола в 3 мл ДМФА добавляли 54 мг гидрида натрия (60% в минеральном масле) при комнатной температуре. Через 15 минут добавляли 100 мг тетрабутиламмониййодида и 117 мг метилового эфира 4-(2-бром-пропиониламино)бензойной кислоты, и реакционную смесь нагревали при 80°C в течение 8 часов. После охлаждения до комнатной температуры и разбавления 1M водной хлористоводородной кислотой реакционную смесь фильтровали через chem elut® картридж, элюируя этилацетатом. Растворители удаляли при пониженном давлении, и остаток очищали препаративной ВЭЖХ (C18 колонка с обращенной фазой, элюирование в градиенте вода/MeCN с 0,1% ТФУК). Фракции, содержащие продукт, упаривали и лиофилизировали, с получением белого твердого вещества. Выход: 24 мг.
МС (ES-): m/e=590, спектрограмма хлора.
Пример 17: 4-{2-[5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-илметокси]-3-метилбутириламино}бензойная кислота
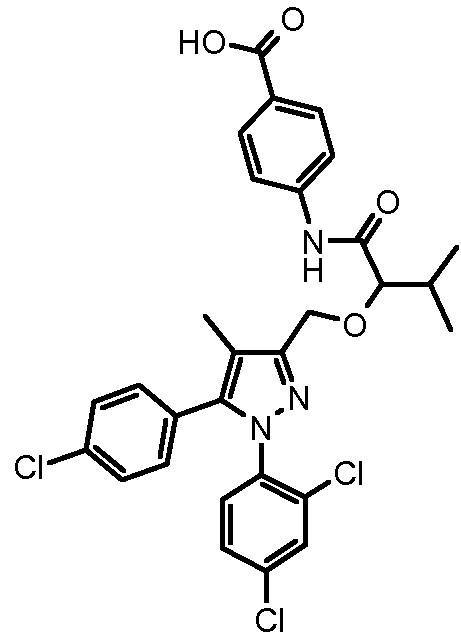
Указанное в заголовке соединение получали аналогично описанному в примере 16.
МС (ES-): m/e=584, спектрограмма хлора.
Пример 18: 4-{2-[1-(4-хлорфенил)-4-метил-5-(4-трифторметилфенил)пиразол-3-илметокси]пропиониламино}бензойная кислота
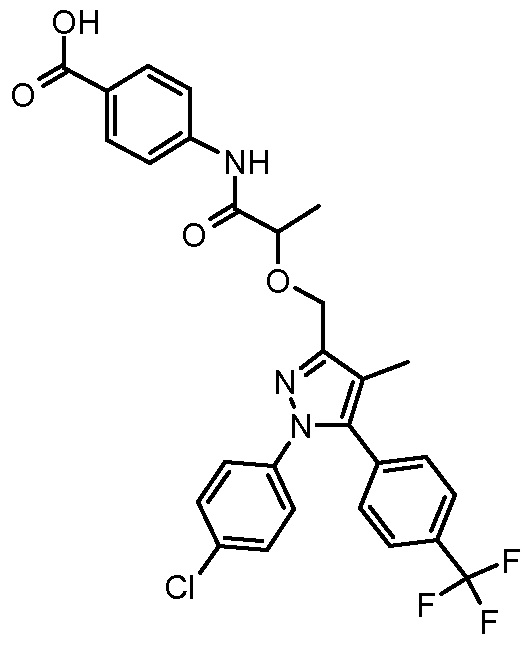
Указанное в заголовке соединение получали аналогично описанному в примере 16.
МС (ES-): m/e=556, спектрограмма хлора.
Пример 19: 4-[2-(3-нафталин-2-ил-1-фенил-1H-пиразол-4-илметокси)пропиониламино]бензойная кислота
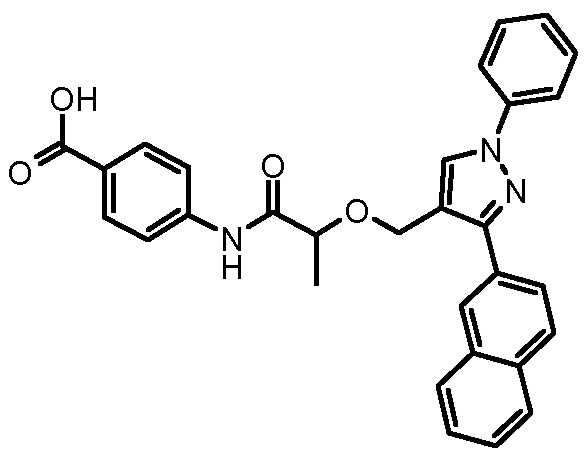
Указанное в заголовке соединение получали аналогично описанному в примере 16.
МС (ES-): m/e=590.
Пример 20: 4-{2-[1-(2-хлорфенил)-4-метил-5-(4-трифторметилфенил)-1H-пиразол-3-илметокси]пропиониламино}бензойная кислота
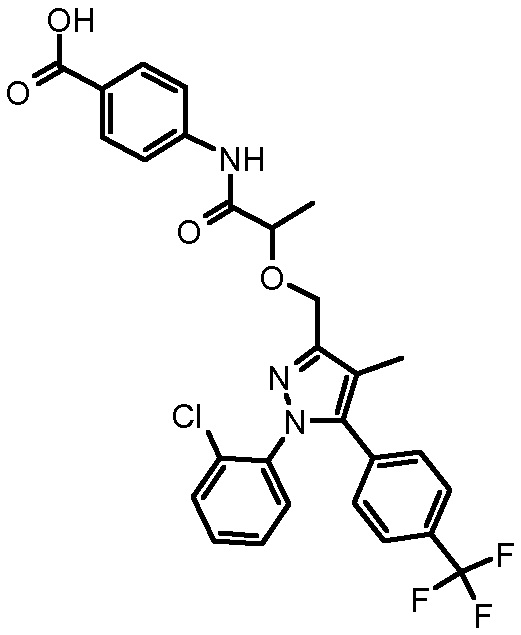
Указанное в заголовке соединение получали аналогично описанному в примере 16.
МС (ES-): m/e=556, спектрограмма хлора.
Пример 21: 4-[2-(3,5-диметил-1-фенил-1H-пиразол-4-илметокси)пропиониламино]бензойная кислота
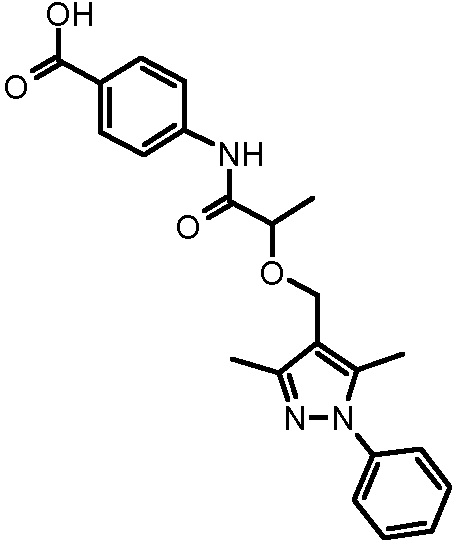
Указанное в заголовке соединение получали аналогично описанному в примере 16.
МС (ES-): m/e=392.
Пример 22: 4-[2-(1,3-дифенил-1H-пиразол-4-илметокси)пропиониламино]бензойная кислота
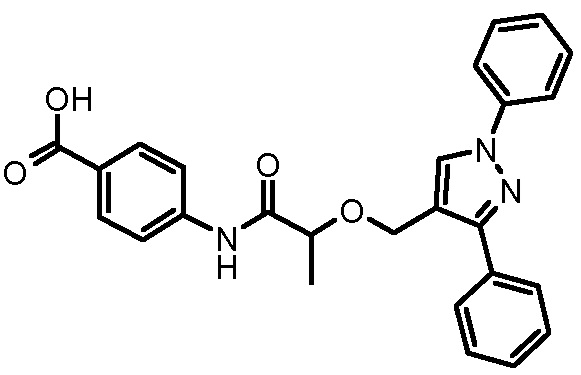
Указанное в заголовке соединение получали аналогично описанному в примере 16.
МС (ES-): m/e=440.
Пример 23: 4-{2-[1-бензил-3-(3-метоксифенил)-1H-пиразол-4-илметокси]пропиониламино}бензойная кислота
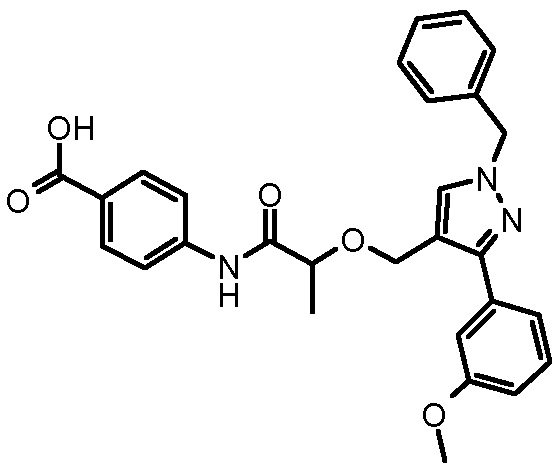
Указанное в заголовке соединение получали аналогично описанному в примере 16.
МС (ES-): m/e=484.
Пример 24: 4-{2-[5-(4-фторфенокси)-1-метил-3-фенил-1H-пиразол-4-илметокси]пропиониламино}бензойная кислота
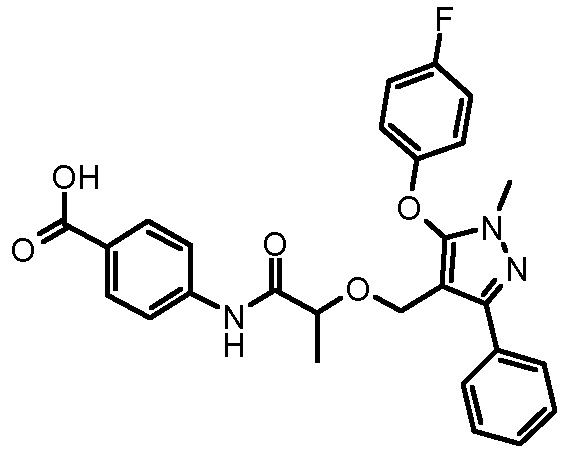
Указанное в заголовке соединение получали аналогично описанному в примере 16.
МС (ES-): m/e=488.
Пример 25: 4-[2-(2-метил-2H-индазол-3-илметокси)пропиониламино]бензойная кислота
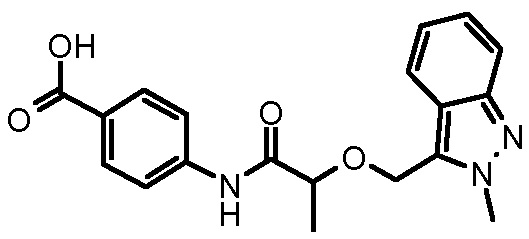
Указанное в заголовке соединение получали аналогично описанному в примере 16.
МС (ES-): m/e=352.
Пример 26: 4-{2-[3-(4-циклогексилфенил)-1-фенил-1H-пиразол-4-илметокси]пропиониламино}бензойная кислота
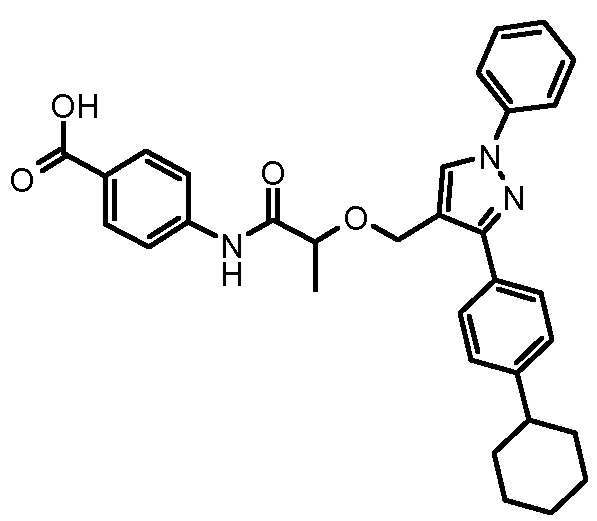
Указанное в заголовке соединение получали аналогично описанному в примере 16.
МС (ES-): m/e=522.
Пример 27: 4-[2-(1-фенил-3-тиофен-2-ил-1H-пиразол-4-илметокси)пропиониламино]бензойная кислота
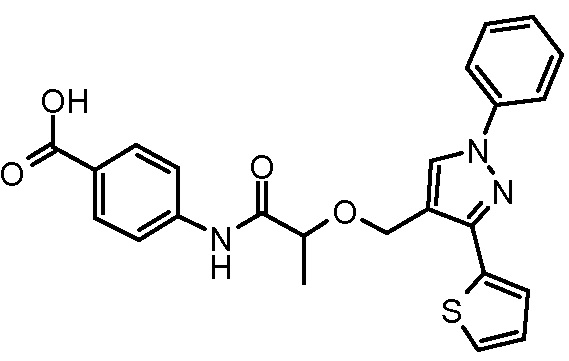
Указанное в заголовке соединение получали аналогично описанному в примере 16.
МС (ES-): m/e=446.
Пример 28: 4-[2-(1,5-дифенил-1H-пиразол-3-илметокси)пропиониламино]бензойная кислота
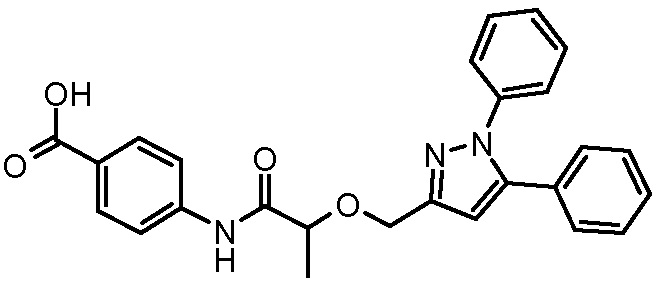
Указанное в заголовке соединение получали аналогично описанному в примере 16.
МС (ES-): m/e=440.
Фармакологические испытания
Способность соединений формулы I ингибировать или связываться с LPA рецептором LPAR5 можно оценить определением влияния на клеточное функционирование. Данную способность таких соединений оценивали в анализе на агрегацию тромбоцитов, таком как способ Борна, используя одноразовые кюветы, и для тучных клеток и клеток микроглии в анализе с использованием планшет-ридера для визуализации флуоресценции (FLIPR) Molecular Devices Inc.
A) Анализ агрегации для промытых тромбоцитов человека (тромбоцитов)
Цельную кровь собирали у здоровых добровольцев, используя 3×20 мл шприцы, каждый из которых содержал 1/10 объема буферного цитрата. Антикоагулированную цельную кровь переносили в 50 мл полипропиленовые конические пробирки (30 мл для одной пробирки). Пробирки центрифугировали в течение 10 минут при 150×g при комнатной температуре, не применяя тормоз центрифуги. Данный способ приводит в результате к нижней фазе клеточных компонентов и супернатанту (верхняя фаза) плазмы, обогащенной тромбоцитами (PRP). PRP фазу собирали из каждой пробирки и объединяли для каждого донора. Для избегания переноса клеточных компонентов после первого центрифугирования приблизительно 5 мл PRP оставляли в пробирке. Концентрацию тромбоцитов определяли, используя ABX Micros 60 счетчик. PRP фазу переносили в новую 50 мл пробирку. После 10-минутного выдерживания при комнатной температуре 1 мкл PGI2 (1 мМ в Tris-HCl/pH 8,8) и 180 мкл ACD/A добавляли на мл PRP. Затем PRP переносили в новую 10 мл пробирку и центрифугировали в течение 10 минут при 500×g. После центрифугирования клеточный осадок был виден на дне пробирки. Супернатант аккуратно удаляли, и затем клеточный осадок, состоящий из тромбоцитов человека, растворяли в 10 мл буфера T (состав буфера T: 145 мМ NaCl, 5 мМ KCl, 0,1 мМ MgCl2×6H2O, 15 мМ HEPES, 5,5 мМ глюкоза, pH 7,4). Определяли концентрацию тромбоцитов в данном растворе и добавляли буфер T, с получением конечной концентрации 3,5×105 тромбоцитов на мл.
Через 10 минут при комнатной температуре добавляли 1 мкл PG на мл раствора тромбоцитов и распределяли в новых 10 мл пробирках. После стадии центрифугирования, 10 минут при 500×g, супернатант удаляли, и тромбоциты повторно суспендировали в буфере T до конечной концентрации 3,5×105 тромбоцитов на мл буфера T. Перед применением, содержащий тромбоциты буфер приводили в равновесие в течение 30 минут при комнатной температуре. Анализ агрегации тромбоцитов человека проводили в одноразовых кюветах, используя Platelet Aggregation Profiler® (PAP-4 или -8E, BIO/DATA Corporation). Для каждого эксперимента 320 мкл раствора тромбоцитов переносили в кювету для анализа, добавляли 20 мкл раствора цитрата кальция (10 мМ в H2O) и 20 мкл раствора фибриногена (20 мг/мл H2O). Анализ на агрегацию проводили в кювете для анализа при 37°C и при перемешивании при 1200 об/мин. Для определения EC50 восемь кювет для анализа загружали, как описано выше, различными концентрациями LPA. Агрегацию измеряли в течение 6 минут при 37°C при перемешивании при 1200 об/мин (оборотов в минуту). Результаты анализа выражены в виде % активации и рассчитаны с применением максимальной агрегации (Tmax) или площади под кривой (AUC) поглощения в течение 6 минут. Ингибирующий эффект (IC50) тестируемых соединений определяли в виде уменьшения максимальной агрегации. Тестируемое соединение добавляли перед началом эксперимента со временем выдерживания тестируемого соединения 5 минут при 37°C при перемешивании при 1200 об/мин. Данные IC50 описанного выше анализа на агрегацию тромбоцитов с применением промытых тромбоцитов человека для примеров соединений настоящего изобретения показаны в таблице 1.
|
B) Применение анализа с использованием планшет-ридера для визуализации флуоресценции (FLIPR) для определения высвобождения внутриклеточного Ca2+ в линии тучных клеток человека HMC-1 и линии мышиных клеток микроглии BV-2
Способность соединений формулы I ингибировать или связываться с LPA рецептором LPAR5 можно определить по высвобождению внутриклеточного Ca2+ на клетках людей или животных. Для анализа активирующего потенциала LPA и ингибирующих эффектов соединений формулы I применяли две клеточные линии с высокой экспрессией LPAR5, линию тучных клеток человека HMC-1 и линию мышиных клеток микроглии BV-2 (фигуры 1 и 2). Для анализа FLIPR с использованием тучных клеток человека в 96-луночном формате собирали суспензию клеток HMC-1 из культуры, выращенной в колбе, повторно суспендировали и считали. 14×106 HMC-1 клеток переносили в новую 50 мл пробирку, центрифугировали в течение 3 минут при 540×g. Полученную в результате клеточную массу на дне пробирки повторно суспендировали в 15 мл загрузочного буфера (загрузочный буфер содержал HBSS буфер (pH 7,4), 0,1% BSA (бычий сывороточный альбумин), 2 мкМ FLUO-4 краситель; HBSS буфер (pH 7,4) содержал 1×HBSS, 20 мМ HEPES, 0,01% плюроника F-127, 2,5 мМ пробенецида).
Клетки в загрузочном буфере выдерживали в течение 45-60 минут при 37°C. После выдерживания клетки центрифугировали в течение 3 минут при 540×g и повторно суспендировали в 21 мл HBSS буфера (pH 7,4). Каждую лунку 96-луночного планшета с поли-D-лизиновым покрытием заполняли 150 мкл клеточного раствора, эквивалент 100000 клеток/лунка. 96-луночный планшет центрифугировали в течение 2 минут при 100×g (без торможения) перед восстановительным периодом 30 минут при 37°C. После данной процедуры клетки стимулировали LPA (в HBSS pH 7,4 и 0,1% BSA), определяя EC50 LPA в HMC-1 клетках. Для определения ингибирующего эффекта соединений формулы I тестируемые соединения добавляли к клеткам в 96-луночных планшетах за 10 минут до добавления LPA. Результаты анализа выражены в виде % активации и рассчитаны с применением максимального пика активации (Amax). Данные IC50 описанного выше анализа FLIPR с использованием линии тучных клеток человека HMC-1 для примеров соединений настоящего изобретения показаны в таблице 2. Прилипшие BV-2 клетки высевали в 96-луночные планшеты с поли-D-лизиновым покрытием (100000 клеток/лунка) за день до проведения FLIPR анализа. Плотность клеток в 96-луночном планшете в день FLIPR анализа должна составлять 90%. После отсасывания культуральной среды BV-2 клетки выдерживали в течение 30 минут при 37°C с загрузочным буфером и восстанавливали в 150 мкл HBSS буфера в течение 30 минут при 37°C. После данной процедуры клетки стимулировали LPA (в HBSS pH 7,4 и 0,1% BSA), определяя EC50 LPA в BV-2 клетках. Для определения ингибирующего эффекта соединений формулы I тестируемые соединения добавляли к клеткам в 96-луночном планшете за 10 минут перед добавлением LPA. Данные IC50 описанного выше анализа FLIPR с применением линии мышиных клеток микроглии BV-2 для примеров соединений настоящего изобретения показаны в таблице 3.
|
|