Результат интеллектуальной деятельности: СПОСОБ ДИАГНОСТИКИ РЕПРОДУКТИВНОГО РЕСПИРАТОРНОГО СИНДРОМА СВИНЕЙ НЕПРЯМЫМ ИММУНОГИСТОХИМИЧЕСКИМ АНАЛИЗОМ НА ОСНОВАНИИ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ
Вид РИД
Изобретение
Предлагаемое изобретение относится к области ветеринарной вирусологии, в частности к способу диагностики репродуктивного респираторного синдрома свиней (РРСС) путем выявления специфического антигена вышеуказанного возбудителя в цитоплазме инфицированных альвеолярных макрофагов и свободных макрофагов лимфоузлов при иммуногистохимическом анализе (ИГХА) парафиновых срезов легких и лимфоузлов, на основе моноклональных антител, и может быть использован в научно-исследовательских институтах и ветеринарных лабораториях.
Для диагностики РРСС применяют методы молекулярной биологии, направленные на выделение вируса; выявление его антигенов, а также антител к вирусу. Для данных целей используют полимеразную цепную реакцию в режиме реального времени (РТ ПЦР), стандартную полимеразную цепную реакцию (ПЦР) [4]; in-situ гибридизацию [5]; иммуноферментный анализ (ИФА) сывороток крови на наличие специфических антител против вируса репродуктивного респираторного синдрома свиней (ВРРСС) с применением стандартных диагностических наборов [2; 3]; авидин-биотиновый комплекс при иммуногистохимическом исследовании (ИГХИ) и иммунофлюоресцентную метку [6; 7]. Также, для выполнения ИГХИ, используют автоматические иммуностейнеры [8].
При ИГХИ органов свиней зарубежные авторы опираются на разработанный в 1994 году способ, который описал Patrick G. Halbur с соавторами [9]. Суть их способа заключается в следующем. При вскрытии трупов поросят отбирают образцы легких и помещают их в 10% забуференный нейтральный формалин, жидкость Буэна или раствор, содержащий 4% формальдегида и 1% глутарового альдегида. Затем ткань фиксируют в течение 24 часов. После фиксации ткани в жидкости Буэна, ее выдерживали в 5 сменах 70%-ного этилового спирта. После этого формировали парафиновые блоки и нарезали на микротоме толщиной 3 микрона. Полученные срезы приклеивали на предметные стекла с поли-L-лизиновым покрытием, депарафинировали в 2 порциях ксилола и далее проводили по спиртам в возрастающей концентрации. Для удаления эндогенной пероксидазы срезы выдерживали в 3% растворе перекиси водорода 3 раза по 10 минут. Далее срезы промывали в 0,05М TRIS буфере (рН 6,7) - 5 минут. В качестве блокирующего раствора использовали 5% нормальную сыворотку крови козы. В качестве первичных антител использовали моноклональные антитела SDOW-17, разведенные в смеси 1 часть TRIS буфера и 9 частей фосфатного буфера (PBS рН 7,2) в соотношении 1:000. Далее срезы с антителами инкубировали при 4°С 16 часов во влажной камере. После инкубации срезы споласкивали TRIS буфером 5 минут, и еще 5 минут выдерживали в 1% растворе сыворотки козы на TRIS буфере. Затем срезы помещали в биотинилированую козью антимышиную антисыворотку на 30 минут. Затем отмывали в 3 порциях TRIS буфера. После этого срезы выдерживали в пероксидазном конъюгате в разведении 1:200 (в TRIS/PBS буфере), 40 минут. Отмывали в течение 5 минут в TRIS буфере. Далее срезы инкубировали в свежеприготовленном растворе 3,3'-диаминобензидин тетрахлориде от 8 до 10 минут при комнатной температуре. Реакцию останавливали промыванием в дистиллированной воде 5 минут. Окрашивали гематоксилином, промывали в растворе (10 г MgS4 и 2 г NaHCO3 в 1 литре ультрачистой воды). Полоскали в дистиллированной воде, дегидрировали, покрывали покровным стеклом при помощи монтирующей среды.
В России, для диагностики вышеуказанного заболевания, применяют полимеразную цепную реакцию, РТ ПЦР, иммуноферментный анализ и иммуноцитохимическая диагностика на культуре клеток МАРК-145 непрямым гистохимическим вариантом ИФА с применением моноклональных антител [1].
В задачу наших исследований входило: разработать эффективный способ диагностики репродуктивного респираторного синдрома свиней, обеспечивающий специфическое выявление вируса в органах свиней, поскольку не требует дорогостоящего, специфического оборудования, прост в исполнении и выполним в любой гистологической лаборатории.
Предложенный способ заключается в следующем.
Получение моноклональных антител (МКА), к белку rN вируса РРСС
Для иммунизации использовали самок мышей линии BALB/c. Мышей иммунизировали 3-4-кратно с интервалом 2 недели. В качестве антигенов использовали рекомбинантный белок rN РРСС, полученный в прокариотической системе экспрессии в E.coli. Для слияния была выбрана перевиваемая клеточная линия мышиной миеломы Sp2/0, дефектная по гену HGPT, не продуцирующая собственные иммуноглобулины. В качестве ростовой среды для культивирования миеломных и гибридомных клеток использовали среду RPMI-1640 (Sigma), содержащую 20% эмбриональной телячьей сыворотки, 4,5 г/л глюкозы, 3 мМ глутамина, 0,2 ед/мл инсулина, 60 мкг/мл гентамицина.
После введения бустерной дозы антигена получали суспензию клеток селезенки мыши стандартным методом в охлажденной ростовой среде без сыворотки.
Для слияния использовали PEG/DMSO Solution (Sigma, США). Гибридизацию проводили по методу Kohler G., Milstain С. Суспензию клеток селезенки и миеломные клетки смешивали в соотношении 3:1 (5:1 - 2-е слияние rN), соответственно. После слияния клетки ресуспендировали в селективной среде HAT, вносили в 96-луночные панели в концентрации 1,5×105 клеток в лунку в объеме 0,1 мл. Панели с клетками инкубировали при 37°С в атмосфере 5% СО2. Первичный просмотр панелей проводили через 5 дней после слияния.
"Подкармливание" гибридомных клонов проводили каждые 2-3 дня, используя в течение 9-10 дней после слияния среду с HAT. Культуральные жидкости тестировали на наличие противовирусной активности в реакции ИФА, когда клоны гибридных клеток занимали не менее 50% площади лунки. Клоны, обнаружившие специфическую активность, реклонировали путем лимитирующих разведений в 96-луночных панелях с фидерным слоем из перитонеальных макрофагов мышей. Супернатанты из лунок, содержащих реклонированные гибридомы, снова тестировали на наличие антител и их специфичность. Позитивные реклонированные гибридомы наращивали в культуральных флаконах увеличивающихся размеров.
Выполнение ИГХИ с полученными МКА к белку rN вируса РРСС
Для выявления вируса репродуктивного респираторного синдрома брали лимфоузлы, легкое. Для определения тропности вируса дополнительно брали миндалины, селезенка, почка, печень, миокард. Объекты помещали в 10% раствор забуференного нейтрального формалина. Размеры исследуемой ткани 1,0×1,0×0,5 см. Далее выдерживаются при комнатной температуре 48-72 часа, затем проходят гистологическую проводку через изопропиловый спирт и ксилол в смеси с парафином. После обработки ткани выполняется пропитывание ее парафином, для формирования парафиновых блоков. После этого блоки нарезаются толщиной 3-5 микрон, срезы наклеиваются на предметные стекла, покрытые глицериновым альбумином по Малори и высушиваются. После просушки стекол срезы депарафинируются в течение 20 мин, дегидрируются - 10 мин. Далее срезы отмывали в 2 порциях дистиллированной воды по 5 минут в каждой. Для удаления эндогенной пероксидазы, срезы помещали в 3% раствор перекиси водорода в термостат при 37°С на 40 минут. Далее отмывка в PBS буфере рН 7,7 трижды с экспозицией 10 минут, при комнатной температуре. После отмывки срезов готовили блокирующий 5% раствор сухого молока на PBS буфере рН 7,7 и инкубировали в термостате при 37°С, 40 минут. Затем промывали трижды PBS буфером рН 7,7 с экспозицией 10 минут при комнатной температуре. Далее на срезы органов наносили моноклональные антитела 4h7 в разведении 1:1500 на PBS буфере и инкубировали во влажной камере в термостате при 37°С - 80 минут, отмывали в PBS буфере дважды по 5 минут при комнатной температуре. Затем наносили антимышиные антитела конъюгированные с пероксидазой хрена в разведении 1:200 в 5% растворе сухого молока на PBS буфере рН 7,7, инкубировали во влажной камере в термостате при 37°С - 40 минут. Отмывали в PBS с твином дважды, по 5 минут при комнатной температуре. Непосредственно перед использованием, готовили субстрат пероксидазы: 3-амино-9-этилкарбазол на диметилформамиде в 0,02 М Na-фосфатном буфере рН 5,0 с добавлением перекиси водорода. Затем споласкивали в трех порциях дистиллированной воды и окрашивали Гематоксилином Майера. После окраски срезы споласкивали в дистиллированной воде и покрывали монтирующей средой под покровное стекло.
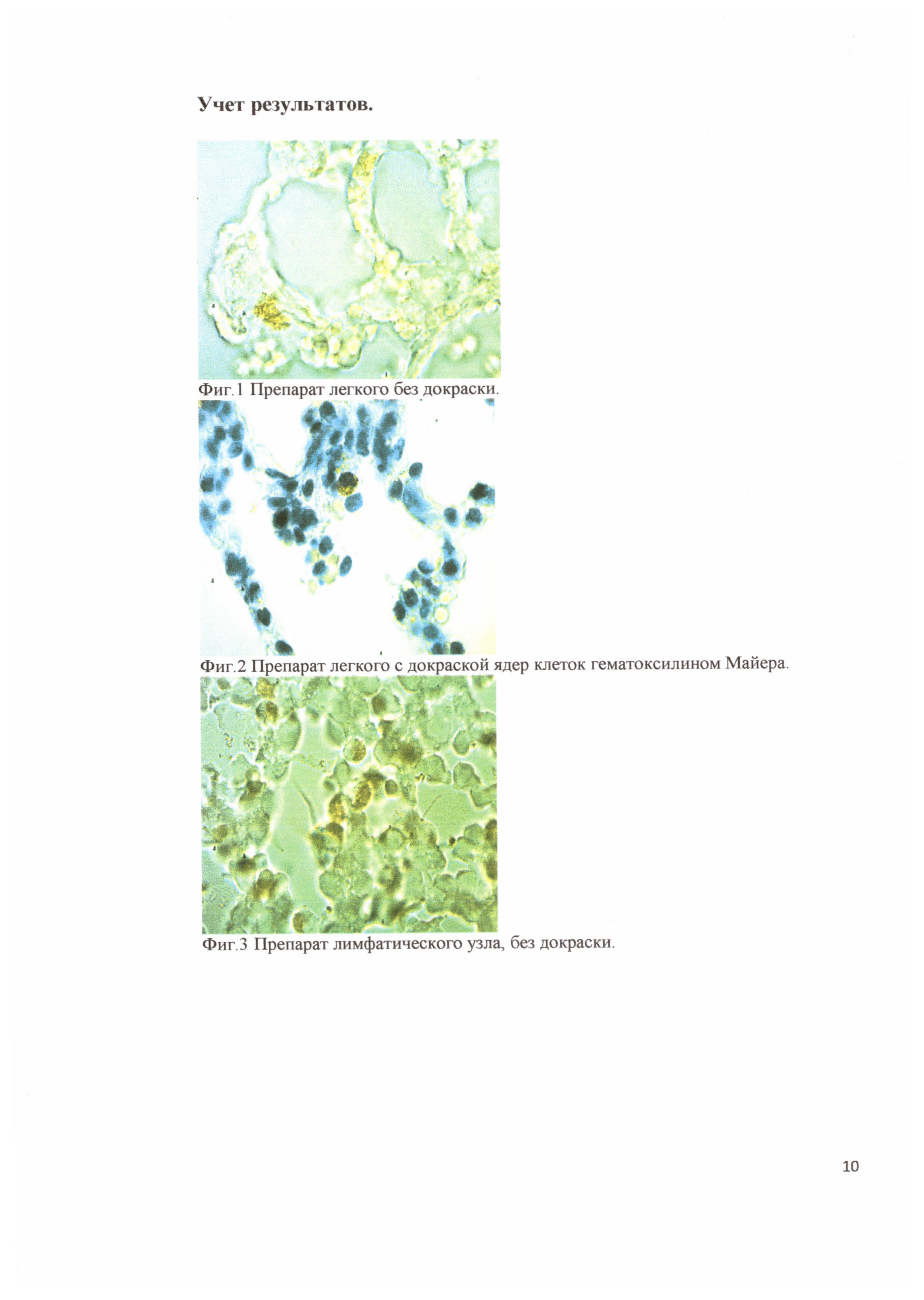
Предложенный способ предусматривает проведение иммуногистохимического анализа парафиновых срезов легких и лимфоузлов с использованием пероксидазного конъюгата на основе моноклональных антител клона а_мышь* и моноклональных антител к капсидному белку вируса репродуктивного респираторного синдрома свиней клона 4h7h9. При этом обнаружение антигена вируса репродуктивного респираторного синдрома свиней осуществляется на цитоплазме инфицированных альвеолярных макрофагов и свободных макрофагов лимфоузлов с окрашенной пероксидазной меткой в виде конгломератов коричневого цвета хорошо заметных на препаратах без докраски ядер клеток гематоксилином Майера (фиг. 1, 3). Для дифференциации клеток при проведении ИГХИ возможно дополнительное окрашивание срезов гематоксилином Майера, что улучшает визуализацию ядер клеток альвеолярных макрофагов легкого и свободных макрофагов лимфоузлов. В данном случае при положительной реакции на РРСС хорошо просматриваются ядра клеток синего цвета и конгломераты антиген - антитело (пероксидазная метка антител) коричневого цвета (фиг. 2, 4).
Предложенный способ чувствителен, специфичен, позволяет достоверно обнаружить антигены вируса репродуктивного респираторного синдрома свиней и дифференцировать их от возбудителей болезней, протекающих с клинически схожей картиной.
Предложенный способ апробирован нами в 2015-2016 гг, в секторе патоморфологии ФГБНУ ВИЭВ им. Я.Р. Коваленко и на опытной базе о. Лисий, Выпшеволотского филиала ФГБНУ ВИЭВ при проведении острых опытов по заражению поросят ВРРСС.
Предлагаемый способ найдет применение в научно-исследовательских институтах и ветеринарных лабораториях.
Список литературы:
1. Вишняков И.Ф., Куриннов В.В., Балашов Е.А., Лыска В.М., Суханова О.В., Зуев В.В. Патент RU 2115929 С1, патентообладатель - Всероссийский научно-исследовательский институт ветеринарной вирусологии и микробиологии. (Прототип).
2. Орлянкин Б.Г., Гребенникова Т.В., Алипер Т.И., Мишин А.М. Специфическая профилактика репродуктивного респираторного синдрома свиней // Свиноводство. 2010. №3. С. 67-69.
3. Сидорчук А.А., Зеленуха Е.А. // Причины респираторной патологии свиней в ряде промышленных комплексов России. Ветеринария, 2014, №1, стр. 17-24.
4. Livak KJ, Schmittgen TD // Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta DeltaC(T)). Methods 25, 2001, p. 402-408.
5. Trang NT, Hirai T, Ngan PH, Lan NT, Fuke N, Toyama K, Yamamoto T, Yamaguchi R Enhanced detection of Porcine reproductive and respiratory syndrome virus in fixed tissues by in situ hybridization following tyramide signal amplification. //J Vet Diagn Invest. 2015 May; 27(3): 326-31. Epub 2015 Apr 8.
6. Obdulio 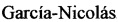 ,
, 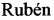 S Rosales, Francisco J
S Rosales, Francisco J  , David Risco, Juan J Quereda, Simon P Graham, Jean-Pierre Frossard, Sophie В Morgan, Falko Steinbach, Trevor W Drew, Tony S Strickland and Francisco J Salguero//Comparative analysis of cytokine transcript profiles within mediastinal lymph node compartments of pigs after infection with porcine reproductive and respiratory syndrome genotype 1 strains differing in pathogenicity Veterinary Research 2015 46: 34.
, David Risco, Juan J Quereda, Simon P Graham, Jean-Pierre Frossard, Sophie В Morgan, Falko Steinbach, Trevor W Drew, Tony S Strickland and Francisco J Salguero//Comparative analysis of cytokine transcript profiles within mediastinal lymph node compartments of pigs after infection with porcine reproductive and respiratory syndrome genotype 1 strains differing in pathogenicity Veterinary Research 2015 46: 34.
7. Barranco I,  J,
J,  IM, Quereda JJ, Salguero FJ, Pallares FJ, Carrasco L // Immunohistochemical expression of IL-12, IL-10, IFN-α and IFN-γ in lymphoid organs of porcine reproductive and respiratory syndrome virus-infected pigs. Vet Immunol Immunopathol 149, 2012, p. 262-271.
IM, Quereda JJ, Salguero FJ, Pallares FJ, Carrasco L // Immunohistochemical expression of IL-12, IL-10, IFN-α and IFN-γ in lymphoid organs of porcine reproductive and respiratory syndrome virus-infected pigs. Vet Immunol Immunopathol 149, 2012, p. 262-271.
8. James E. Benson, Michael J. Yaeger, Jane Christopher-Hennings, Kelly Lager, Kyoung-Jin Yoon//A comparison of virus isolation, immunohistochemistry, fetal serology, and reverse-transcription polymerase chain reaction assay for the identification of porcine reproductive and respiratory syndrome virus transplacental infection in the fetus. J Vet Diagn Invest 14: 8-14 (2002), p. 8-14.
9. Patrick G. Halbur Development of a streptavidin-biotin immunoperoxidase procedure for the detection of porcine reproductive and respiratory syndrome virus antigen in porcine lung//Patrick G. Halbur, John J. Andrews, Elise L. Huffman, Prem S. Paul, Xiang-Jin Meng, Yosiya Niyo. J Vet Diagn Invest 6: 254-257 (1994) p. 254-257.
Учет результатов прилагается.
Способ диагностики репродуктивного респираторного синдрома свиней непрямым иммуногистохимическим анализом на основании моноклональных антител, отличающийся тем, что в качестве патологического материала используют органы свиней, далее выявляют вирус непрямым иммуногистохимическим способом, в качестве моноклональных антител берут моноклон 4h7h9 для идентификации антигена rN вируса репродуктивного респираторного синдрома свиней и антитела с меткой пероксидазы хрена с последующей специфической окраской, и учетом результатов по выявлению конгломератов красно-кирпичного цвета.