Результат интеллектуальной деятельности: СПОСОБ КОРРЕКЦИИ МИТОХОНДРИАЛЬНОЙ ДИСФУНКЦИИ С ПОМОЩЬЮ ГЕНЕТИЧЕСКОЙ КОНСТРУКЦИИ
Вид РИД
Изобретение
Область техники
Изобретение относится к области биотехнологии и молекулярной биологии, а также может использоваться для персонифицированной генной терапии. Наличие способа коррекции дисфункций клеток, вызванных мутациями в митохондриальном геноме, позволяет производить модификацию геномов митохондрий, изменять степень гетероплазмии, что, в конечном итоге, может приводить к нормализации функции митохондрий и снижению проявлений, опосредованных изменениями в митохондриальном геноме заболеваний. Помимо этого возможность коррекции изменений в геномах митохондрий представляет собой мощный инструмент для фундаментальных исследований молекулярно-биологических процессов в этих органеллах.
Уровень техники
Митохондрии являются обязательными органеллами всех эукариотических клеток, осуществляющими получение энергии за счет комплекса реакций окислительного фосфорилирования. Митохондрии имеют свой собственный аппарат хранения, реализации и передачи генетической информации, закодированной в митохондриальной ДНК (мтДНК). Накопление мутаций в митохондриальном геноме происходит с существенно большей частотой, нежели в ядерном, в силу повышенной концентрации активных форм кислорода в митохондриальном матриксе [Vega RB, Horton JL, Kelly DP. Maintaining ancient organelles: mitochondrial biogenesis and maturation. // Circ Res. 2015. V. 116(11). P. 1820-1834]. Накопление мутаций в мтДНК человека ведет к развитию целого ряда заболеваний, в частности, мышечных дистрофий и нейродегенеративных расстройств, например NARP (невропатия, атаксия и пигментная ретинопатия)/MILS (синдром Лея), LHON (наследственная оптическая нейропатия Лебера), MERRF (миоклональная эпилепсия и рваные красные мышечные волокна), MELAS (митохондриальная энцефалопатия с инсультоподобными эпизодами и лактатацидозом) и KSS (синдром Кернса-Сейра) [Patrushev М., Kamenski P., Mazunin I. Mutations in mitochondrial DNA and approaches for their correction//Biochemistry (Moscow). - 2014. - Vol. 79, no. 11. - P. 1151-1160]. В настоящее время во многих лабораториях мира разрабатываются подходы к коррекции митохондриальных дисфункций, опосредованных мутациями в мтДНК. Однако подобные исследования и разработки ограничены недостаточной развитостью систем доставки нуклеиновых кислот в митохондрии, а также малоизученностью процессов хранения и реализации генетической информации в этих органеллах клеток.
Основным походом к коррекции мутаций в митохондриальной ДНК является модификация ядерного генома с целью экспрессии с помощью ядерного и цитоплазматического аппаратов транскрипции и трансляции, поврежденных митохондриальных генов с последующей доставкой их белковых продуктов в митохондрии с использованием природной системы импорта полипептидов в митохондрии [Patrushev М., Kamenski P., Mazunin I. Mutations in mitochondrial DNA and approaches for their correction//Biochemistry (Moscow). - 2014. - Vol. 79, no. 11. - P. 1151-1160]. Однако подобный метод коррекции сопряжен с высокой вероятностью неспецифического повреждения различных участков ядерного генома, а также ограничен невозможностью полноценного импорта некоторых белков, закодированных в митохондриях. Более перспективным подходом является направленная модификация митохондриального генома, позволяющая, если не полностью элиминировать мутантные варианты ДНК, то снизить уровень гетероплазмии до степени восстановления нормального функционирования органелл.
Известно, что митохондрии эволюционно произошли от прокариотического предшественника [Poole AM, Gribaldo S. Eukaryotic origins: How and when was the mitochondrion acquired? // Cold Spring Harb Perspect Biol. 2014. V. 6(12). P. a015990] и сохранили некоторую часть прокариотических биологических свойств. Одним из них является так называемая «природная компетентность», то есть способность изолированных митохондрий поглощать экзогенную ДНК. Такая способность продемонстрирована для митохондрий дрожжей, растений и человека, однако этот процесс проходит медленно и крайне неэффективно [Weber-Lotfi F, Koulintchenko MV, Ibrahim N, Hammann P, Mileshina DV, Konstantinov YM, Dietrich A. Nucleic acid import into mitochondria: New insights into the translocation pathways. // Biochim Biophys Acta. 2015. V. 1853(12). P. 3165-3181]. Помимо этого известно, что предварительная конденсация трансформирующей митохондрии ДНК особым ДНК-связывающим белком, имеющим в своем составе сигнал митохондриальной локализации, существенно повышает эффективность проникновения нуклеиновой кислоты в матрикс органелл [Binding of dna with abf2p increases efficiency of dna uptake by isolated mitochondria / E.O. Samoilova, I.A. Krasheninnikov, E.N. Vinogradova et al. //Biochemistry (Moscow). - 2016. - Vol. 81, no. 7. - P. 723-730].
Раскрытие изобретения.
В связи с этим задачей настоящего изобретения является разработка способа коррекции мутации в митохондриальном геноме клеток человека, приводящей к развитию синдрома Кернса-Сейра (KSS), имеющей наименование "основная делеция".
Поставленная задача решается набором олигонуклеотидов для синтеза генетической конструкции, предназначенной для коррекции митохондриальной дисфункции, вызванной «основной делецией», содержащей участок митохондриальной ДНК, отсутствующий в мутантной ДНК, где набор состоит из двух олигонуклеотидов SEQ ID №1 и SEQ ID №2, обеспечивающих синтез отсутствующего в мутантной ДНК фрагмента, а также краевых последовательностей для их размещения на концевых участках конструкции, имеющихся в мутантной ДНК и необходимых для встраивания конструкции.
Также поставленная задача решается генетической конструкцией для коррекции митохондриальной дисфункции, вызванной «основной делецией», представляющей собой участок митохондриальной ДНК, отсутствующий в мутантной ДНК, содержащий на концах последовательности нуклеотидов, комплементарные олигонуклеотидам SEQ ID №1 и SEQ ID №2 из набора по п. 1.
Участок митохондриальной ДНК, отсутствующий в мутантной ДНК, включает гены АТР8, АТР6, СОIII, ND3, ND4L, ND4, ND5, а также следующие гены митохондриальных тРНК: лейциновую, сериновую, гистидиновую, аргининовую и глициновую.
Поставленная задача также решается способом доставки заявляемой генетической конструкции в митохондрии клеток человека, характеризующимся тем, что для доставки заявляемую генетическую конструкцию предварительно смешивают с рекомбинантным белком Abf2p в количестве, достаточном для связывания с упомянутой генетической конструкцией, с последующим введением в клетки человека.
Предпочтительно использовать белок Abf2p в количестве 90-110 мкмоль на 1 мкмоль ДНК.
Таким образом, получена генетическая конструкция (синтетическая ДНК), соответствующая неповрежденному участку, отсутствующему в мутантной митохондриальной ДНК. Генетическая конструкция обрабатывается рекомбинантным ДНК-связывающим белком Abf2p, имеющим в своем составе сигнал импорта в митохондрии, вводится в клетки человека, митохондриальный геном которых несет мутацию «основная делеция» (делеция составляет 4977 пар нуклеотидов, кодирующих гены цитохрома b, четыре субъединицы NADH-дегидрогеназы и две субъединицы АТФ-синтазы).
Техническим результатом заявляемой группы изобретений является то, что фланговые участки олигонуклеотидов обеспечивают лучшее взаимодействие с мутантной ДНК и, как следствие, генетическая конструкция встраивается с большей эффективностью, выше эффект коррекции. Использование заявляемого способа доставки, заключающегося в предварительной обработке генетической конструкции рекомбинантным белком Abf2p, имеющим в своем составе сигнал импорта в митохондрии, снижает вероятность попадания гетерологичной ДНК в ядро, как следствие, снижается вероятность изменений в ядерном геноме.
После трансфекции уровень гетероплазмии в клетках снизился до максимум 49%, а скорость поглощения кислорода возросла до максимум 370%
Генетическая конструкция обеспечивает коррекцию патогенной мутации «основная делеция» в ДНК митохондрий человека специфически, без сопутствующих изменений других участках митохондриального генома. Восстановление митохондриальной ДНК до нативного, недефектного уровня достигается путем гомологичной рекомбинации. Данный процесс протекает в культуре клеток человека. Процесс рекомбинации затрагивает участок митохондриального генома размером 5042 п.н. (8483-13549). При этом в ряде молекул митохондриальной ДНК клеток восстанавливается отсутствовавший участок, необходимый для биосинтеза белков комплексов окислительного фосфорилирования. Восстановление происходит без внесения каких-либо изменений в природную последовательность митохондриальной ДНК, то есть восстановленная последовательность полностью соответствует таковой в клетках с недефектными митохондриями.
В предлагаемом техническом решении используется рекомбинантный белок Saccharomyces cerevisiae Abf2p (аминокислотная последовательность белка [ABF2 / YMR072W // URL: http://www.yeastgenome.org/locus/S000004676/overview (дата обращения: 03.11.2015). Saccharomyces genome database [Электронный ресурс]]). В N-концевой части полипептида имеется аминокислотная последовательность, направляющая импорт синтезированного в цитоплазме белка в матрикс митохондрий. Кроме того, в своем составе белок содержит два ДНК-связывающих домена, обеспечивающих эффективное связывание и конденсацию ДНК. Аминокислотная последовательность белка Abf2p соответствует SEQ ID №7. Рекомбинантный белок Abf2p получается описанным нами ранее способом [Binding of dna with abf2p increases efficiency of dna uptake by isolated mitochondria / E.O. Samoilova, I.A. Krasheninnikov, E.N. Vinogradova et al. 11 Biochemistry (Moscow). - 2016. - Vol. 81, no. 7. - P. 723-730].
Также используется нуклеотидная последовательность митохондриальной ДНК человека (нуклеотиды 8483-13549) [Homo sapiens mitochondrion, complete genome / NCBI Reference Sequence: NC 012920.1 // URL: https://www.ncbi.nlm.nih.gov/nuccore/251831106 (дата обращения: 08.12.2016). Gene Bank [Электронный ресурс]], выступающая в роли корректирующей "основную делецию" генетической конструкции. Нуклеотидная последовательность генетической конструкции соответствует SEQ ID №8.
Краткое описание чертежей
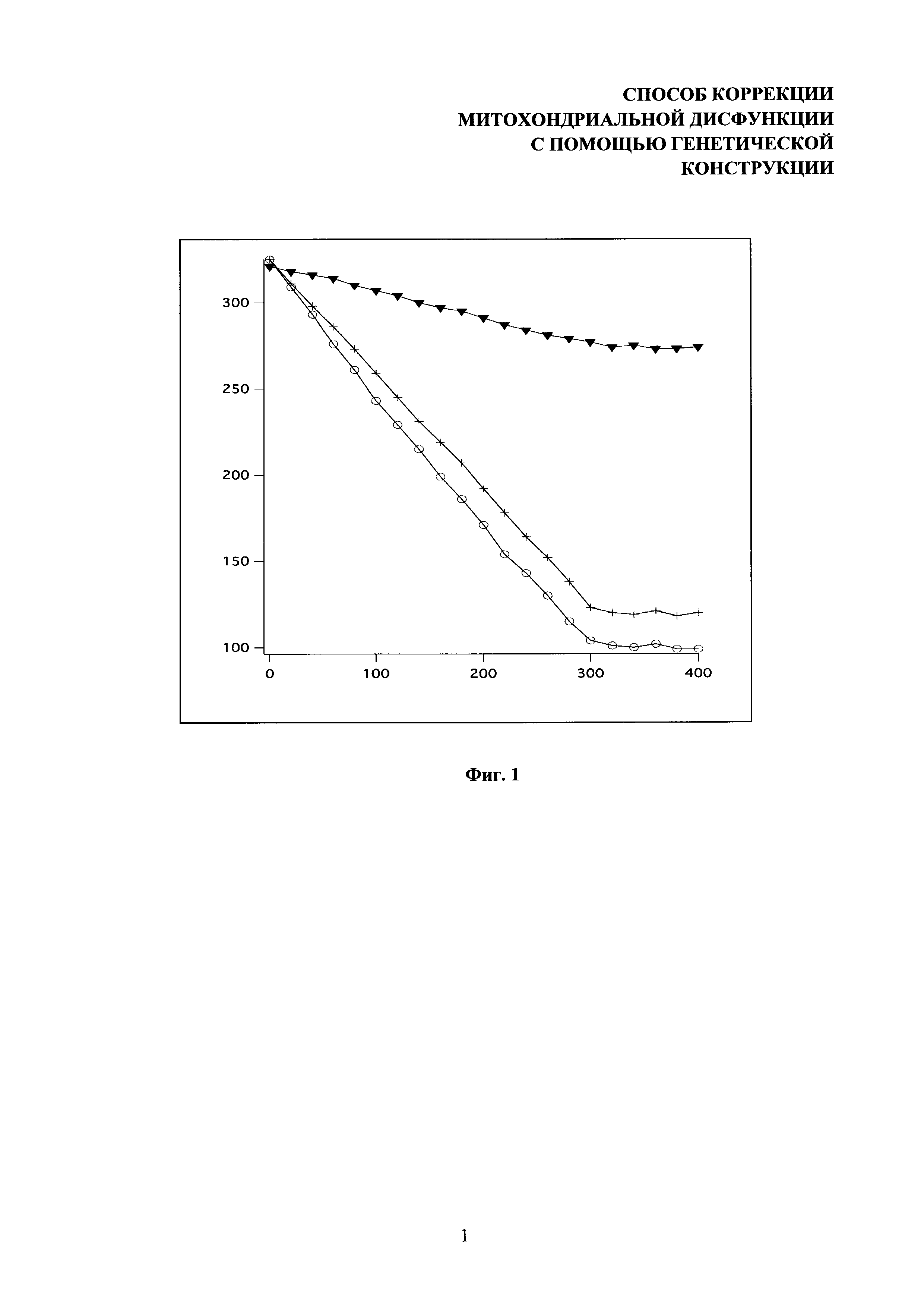
На фиг. 1 представлены характеристические кривые поглощения кислорода клетками человека. Показаны результаты эксперимента на 4-й день после трансфекции. Кривая для клеток HeLa отмечена кружками, для клеток KSS- - треугольниками, для клеток KSS+ - крестиками. По оси абсцисс отложено время эксперимента (в секундах), по оси ординат - концентрация кислорода в измерительной ячейке (в нмоль/мл).
Осуществление изобретения
Основная делеция размером 4977 п.н. (8483-13459) в англоязычной литературе носит название «common deletion» и представлена примерно у 30% пациентов с делециями мтДНК [A direct repeat is a hotspot for large(scale deletion of human mitochondrial DNA / Schon E.A., Rizzuto R., Moraes C.T., et al. // Science. 1989. V. 244. P. 346-349]. Она считается наиболее частой причиной синдрома Кернса-Сейра (англ. аббревиатура KSS, OMIM # 530000), при котором наблюдаются прогрессирующая наружная офтальмоплегия, пигментная ретинопатия и ранняя манифестация [The clinical diagnosis and molecular genetics of Kearns-Sayre syndrome: a complex mitochondrial encephalomyopathy / Maceluch J.A., Niedziela, M. // Pediatr. Endocrinol. Rev. 2006. N. 4. P. 117-137]. В настоящее время методов лечения синдрома Кернса-Сейра не существует. Основная делеция также является частым атрибутом нормального старения клеток человека [Mitochondrial DNA deletions in human brain: regional variability and increase with advanced age / Corral-Debrinski M., Horton Т., Lott M.T., et al. / Nature Genet. 1992. N. 2. P. 324-329]. Одним из перспективных подходов к коррекции функционального проявления «основной делеции» является направленная модификация мутантных митохондриальных ДНК с помощью таргетированных в митохондрии генетических конструкций.
Генетическая конструкция синтезируется с помощью ПЦР-амплификации соответствующего участка митохондриальной ДНК человека. Основная часть генетической конструкции несет в себе те гены, которые удаляются из митохондриальной ДНК в результате «основной делеции», а именно АТР8, АТР6, COIII, ND3, ND4L, ND4, ND5 (частично остается в составе митохондриальной ДНК после «основной делеции», но нефункционален), а также пять генов различных митохондриальных тРНК.
Данный участок генетической конструкции с обеих сторон окружен последовательностями длиной 31 нуклеотид каждая, в точности соответствующими последовательностям олигонуклеотидов, использующихся для проведения ПЦР (ТАААСАСАААСТАССАССТАССТСССТСАСС (SEQ ID №1) и GGAAAGGTATTCCTGCTAATGCTAGGCTGCC (SEQ ID №2). Эти последовательности имеются в составе митохондриальной ДНК после «основной делеции», однако в генетической конструкции они необходимы для успешного прохождения гомологической рекомбинации с молекулами митохондриальной ДНК, несущих «основную делеция». Постановка ПЦР осуществляется по следующему протоколу.
1. В пробирке объемом 0,2 мл смешивается: плазмида pMito, представляющая собой нормальную мтДНК без мутаций, - 0,5 мкл, буфер для ПЦР (пр-во Fermentas) - 5 мкл, смесь четырех дезоксирибонуклеозидтрифосфатов: дезоксиаденозинтрифосфат, дезоксигуанозинтрифосфат, дезоксицитозинтрифосфат, дезокситимидинтрифосфат (по 0, 2 мМ каждого) -5 мкл, Taq-полимераза (пр-во Fermentas) - 0,5 мкл, Vent-полимеразу (пр-во Fermentas) - 0,5 мкл. Доводится водой до 50 мкл.
2. Пробирка помещается в прибор для проведения ПЦР (С 1000, пр-во BioRad).
Используется следующий температурный режим ПЦР:
92 градуса Цельсия - 1 минута,
30 циклов: 92 градуса Цельсия - 30 секунд, 60 градусов Цельсия - 30 секунд,
72 градуса Цельсия - 5 минут,
72 градуса Цельсия - 1 минута.
После проведения ПЦР генетическая конструкция подвергается очистке от низкомолекулярных компонентов и белков при помощи фирменного набора QiaQuik PCR Purification Kit (пр-во Qiagen) в соответствии с инструкцией производителя.
Для достижения поставленной цели после получения генетической конструкции и спектрофотометрической оценки ее концентрации, генетическая конструкция обрабатывается рекомбинантным белком Abf2p в соотношении 90-110 мкмоль белка на 1 мкмоль ДНК (ориентировочно 1 молекула белка на 4 сайта его связывания на ДНК). Затем конденсированная белком генетическая конструкция трансфицируется в клетки человека с мутацией KSS с использованием реагента Lipofectamine 3000 (пр-во ThermoFisher) согласно инструкции производителя.
Через временные промежутки 24 часа, 48 часов, 72 часа, 96 часов, 120 часов, 144 часа и 168 часов после трансфекции проводится оценка способности трансфицированной генетической конструкции влиять на функциональность митохондрий после проведения гомологичной рекомбинации в митохондриальном геноме с ее помощью. Оценка проводится двумя независимыми способами - А и Б.
А) Оценка уровня гетероплазмии в клетках человека с мутацией KSS
1. Клетки человека с мутацией KSS культивируются на среде DMEM.
2. Около 100000000 клеток ресуспендируются в 0,5 мл буфера, содержащего 10 мМ Трис-HCl, рН 7,5, 10 мМ NaCl, 25 мМ натриевой соли ЭДТА и 1% SDS.
3. К суспензии добавляется 10 мл 20 мг/мл раствора протеиназы К.
4. Суспензия инкубируется в течение двух часов при +50 градусах Цельсия.
5. К суспензии добавляется 50 мл 5 М раствора NaCl.
6. К суспензии добавляется равный объем изопропанола, смесь инкубируется 15 минут при комнатной температуре и центрифугируется в настольной центрифуге в течение 15 минут на максимальной скорости при +4 градусах Цельсия.
7. Осадок ДНК растворяется в 10-50 мкл очищенной воды.
8. Приготавливается смесь для проведения ПЦР с использованием системы SYBR Green (iCycler, MyiQ Real-Time Detection System, BioRad) в соответствии с рекомендациями производителя.
В качестве матрицы используется выделенная в пункте 7 ДНК в концентрации, оптимальной в соответствии с рекомендациями производителя, или очищенная вода (отрицательный контроль).
В качестве праймеров используются нижеуказанные пары олигонуклеотидов:
TAGCCCTAAACCTCAACAGT (SEQ ID №3) и TGCGCTTACTTTGTAGCCTTCAT (SEQ ID №4) - для амплификации гена 12 S рРНК, не затрагиваемого «основной делецией» («тотальная мтДНК», теоретический размер продукта 210 п.н.),
CATTGCATACTCTTCAATCAGC (SEQ ID №5) и CGACTGTGAGTGCGTT (SEQ ID №6) - для амплификации участка внутри «основной делеции» («нормальная мтДНК», теоретический размер продукта 164 п.н.).
9. Каждая отдельная реакция проводится в объеме 20 мкл в трех независимых повторностях.
10. С использованием прибора для проведения ПЦР в реальном времени CFX-96 (BioRad) проводятся реакции ПЦР в реальном времени в следующем температурном режиме:
- 95 градусов Цельсия 10 минут,
- 40 циклов: 95 градусов Цельсия 30 секунд, 60 градусов Цельсия 30 секунд, 72 градуса Цельсия 30 секунд.
11. При помощи встроенного в прибор для проведения ПЦР в реальном времени программного обеспечения оценивается количество продукта каждой реакции. Эксперимент признается достоверным при условии, что продукт в реакции отрицательного контроля не детектируется.
12. Уровень гетероплазмии мтДНК рассчитывается по формуле:
Гетероплазмия =1 - (нормальная мтДНК/тотальная мтДНК)*100%.
Расчет признается достоверным том в случае, если стандартное отклонение по результатам трех независимых повторностей одного и того же эксперимента не превышает 10%.
Проводятся три независимых эксперимента по анализу гетероплазмии. В каждом эксперименте используются следующие линии клеток человека: HeLa (положительный контроль), KSS с трансфекцией плазмидой pUC118 (отрицательный контроль), KSS с трансфекцией генетической конструкцией. Уровень гетероплазмии определяется раз в сутки в течение 7 суток культивирования. Результаты представлены в Таблице №1.

Из данных Таблицы 1 следует, что уровень гетероплазмии действительно снижается в результате применения генетической конструкции. Максимальное снижение наблюдается на 4-й день после трансфекции и составляет 49%.
Б) оценка скорости поглощения кислорода клетками человека с мутацией KSS
Из тех же клеточных суспензий после трансфекции с теми же временными интервалами, что и в пункте А, отбираются образцы для измерения скорости поглощения кислорода. Этот параметр измерялся по следующей методике.
1. Клетки человека с мутацией KSS выращиваются на среде DMEM.
2. Около 1000000 клеток ресуспендируются в 1 мл буфера, содержащего 10 мМ HEPES-KOH (рН 7,4), 120 мМ KCl, 1 мМ ЭГТА, 100 мг/мл дигитонина, 10 мМ сукцината и 50 мМ ротенона.
3. Суспензия помещается в измерительную камеру прибора Oxygraph (Hansatech Instruments) и термостатируется при температуре +37 градусов Цельсия.
4. Измерения концентрации кислорода в суспензии проводятся непрерывно в течение 10 минут при помощи интегрированного в прибор кислородного электрода Кларка.
5. По прошествии 10 минут измерения в суспензию добавляется 800 нМ миксотиазола, и измерение продолжается еще две минуты для оценки немитохондриального дыхания.
6. Скорость поглощения клетками кислорода рассчитывается автоматически при помощи встроенного в прибор программного обеспечения.
7. Скорость истинного митохондриального дыхания рассчитывается по формуле: Скорость дыхания = (тотальное дыхание) - (немитохондриальное дыхание) = (скорость поглощения кислорода до добавления миксотиазола) - (скорость поглощения кислорода после добавления миксотиазола).
Результаты измерений приводятся в Таблице №2 и на фиг 1.
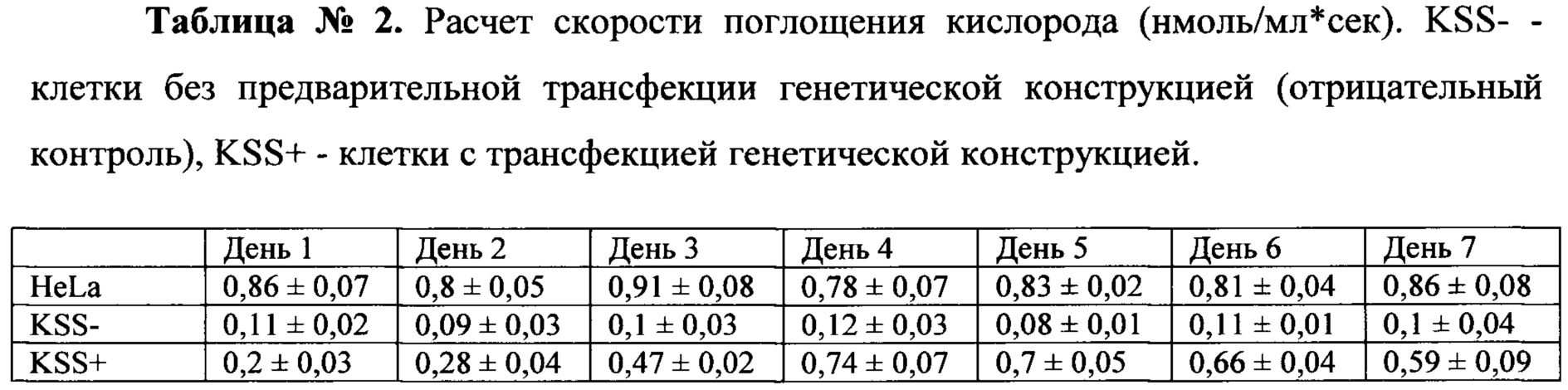
Таким образом, скорость поглощения кислорода клетками KSS после трансфекции генетической конструкцией также увеличивается и достигает практически нормальных значений на 4-й день после трансфекции, далее падая довольно медленно. Максимальное увеличение данного параметра вследствие использования генетической конструкции составляет 370%. Генетическая конструкция обеспечивает восстановление следующих параметров митохондриальных функций: уровень гетероплазмии, скорость поглощения кислорода. Восстановление происходит более чем на 20%.