Результат интеллектуальной деятельности: Способ детекции множества последовательностей нуклеотидов в одном образце методом кодирования ампликонов при проведении полимеразной цепной реакции
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к области биотехнологии, а именно к способу одновременной детекции нескольких специфических нуклеотидных последовательностей и нуклеотидных замен с помощью мультиплексной полимеразной цепной реакции (ПЦР), и может быть использовано при выявлении различных возбудителей заболеваний, генотипировании человека и животных, обнаружении генетически модифицированных организмов и т.п.
Уровень техники
Известны несколько способов детекции нескольких нуклеотидных последовательностей в одном образце. Наиболее широко используемой на сегодняшний день является хМАР (Reslova N., Michna V., Kasny М., Mikel P. and Kralik P. (2017) xMAP Technology: Applications in Detection of Pathogens. Front. Microbiol. 8:55. doi: 10.3389/fmicb.2017.00055). Ее сущность состоит в следующем. Продукт реакции ПЦР кодируется с помощью цвета носителя, к которому он прикрепляется. В качестве носителя (твердой фазы) используют полистироловые микросферы d=5,6 мкм. В состав микросфер интегрированы два флуорофора в различной концентрации. Определенное соотношение концентраций флуорофоров создает 100 возможных типов частиц, каждая из которых будет иметь свою собственную уникальную спектральную характеристику. Спектр частицы является ее индивидуальным «номером» и определяет ее тип (вариант). Тип частицы распознается прибором (например, Luminex 100/200) в процессе измерения. На поверхности полистирола могут быть зафиксированы различного рода биологические молекулы, в том числе фрагменты олигонуклеотидных последовательностей, комплементарные выявляемым в образце. Перед гибридизацией с зафиксированными на полистироле олигонуклеотидами выявляемые последовательности метят флуоресцентными метками. Распознав микросферу и определив флуоресценцию прикрепившейся к ней последовательности, можно понять, какая последовательность нуклеотидов обнаружена в образце. К недостаткам данного метода можно отнести необходимость производства специальных микросфер для проведения анализа и использования индивидуальных меченых олигонуклеотидов для каждой детектируемой последовательности.
В работе (Huang Q, Zheng L, Zhu Y, Zhang J, Wen H, et al. (2011) Multicolor Combinatorial Probe Coding for Real-Time PCR. PLoS ONE 6(1): e16033. doi:10.1371/journal.pone.0016033) предложен метод кодирования продуктов ПЦР в реальном времени с помощью комбинаций замещающих зондов разного цвета для одной целевой последовательности, комплементарных одной общей последовательности с тушителем. При обнаружении в реакционной смеси детектируемой последовательности регистрируется комбинация цветового сигнала, по которой и определяется результат реакции. Однако недостатками этой технологии следует признать невысокую мультиплексируемость (до 15 вариантов, по мнению авторов) и необходимость синтеза нескольких меченых олигонуклеотидов для одной детектируемой последовательности.
Существуют технологии введения в состав ампликонов последовательностей нуклеотидов, позволяющих пометить разные ампликоны одним видом меченых олигонуклеотидов (Whitcombe D., Brownie J., Gillard H., McKechnie D., Theaker J., Newton C. and Little S. (1998) A homogeneous fluorescence assay for PCR amplicons: its application to real-time, single-tube genotyping Clinical Chemistry 44:5, p. 918-923; Zhang Y., Zhang D., Li W., Chen J., Peng Y. and Cao W. (2003) A novel real-time quantitative PCR method using attached universal template probe Nucleic Acids Research, 31:20, e. 123.; Rickert A., Lehrach H. and Sperling S. (2004) Multiplexed Real-Time PCR Using Universal Reporters. Clinical Chemistry 50:9, p. 1680-1683). Как правило, это последовательности нуклеотидов, используемые в качестве зондов TaqMan для ПЦР в реальном времени. Использование этих методов для мультиплексирования ПЦР ограничено количеством возможных каналов детекции флуоресцентных меток, которое на сегодняшний день не превышает шести.
Таким образом, разработка новых методов раздельного определения множества нуклеотидных последовательностей в одном образце является актуальной для молекулярной биологии. Особенно важно это для генотипирования, когда требуется в одном образце выявить наличие множества мутаций в виде однонуклеотидных замен, делеций, инсерций и т.д.
Раскрытие изобретения
Задачей предлагаемого изобретения является разработка нового метода индивидуальной идентификации амплифицируемых в ходе мультиплексной ПЦР последовательностей нуклеотидов, позволяющего существенно увеличить количество выявляемых при выполнении одной реакции последовательностей, что в свою очередь существенно сократит время выполнения исследования и уменьшит его стоимость. Применение предложенного способа расширит сферу использования методов генотипирования человека и животных как в научно-исследовательских, так и в диагностических целях.
Технический результат изобретения достигается тем, что предложен новый способ составления реакционной смеси при проведении ПЦР, использование которого позволяет получить с одной детектируемой последовательности нуклеотидов несколько вариантов ампликонов в заданном соотношении, которые затем можно обнаружить путем концентрации на отдельном участке поверхности и по соотношению определить, какая последовательность нуклеотидов амплифицировалась в ходе реакции.
Краткое описание чертежей и их материалов
На фиг. 1 приведены олигонуклеотиды, использованные в примере 1 для детекции одной последовательности.
На фиг. 2 приведены результаты оценки флюоресценции красителей в разном соотношении.
На фиг. 3 приведены олигонуклеотиды, использованные в примере 2 для детекции однонуклеотидной замены в последовательности нуклеотидов.
На фиг. 4 приведены результаты оценки флюоресценции красителей, своим соотношением характеризующие амплифицируемую последовательность нуклеотидов.
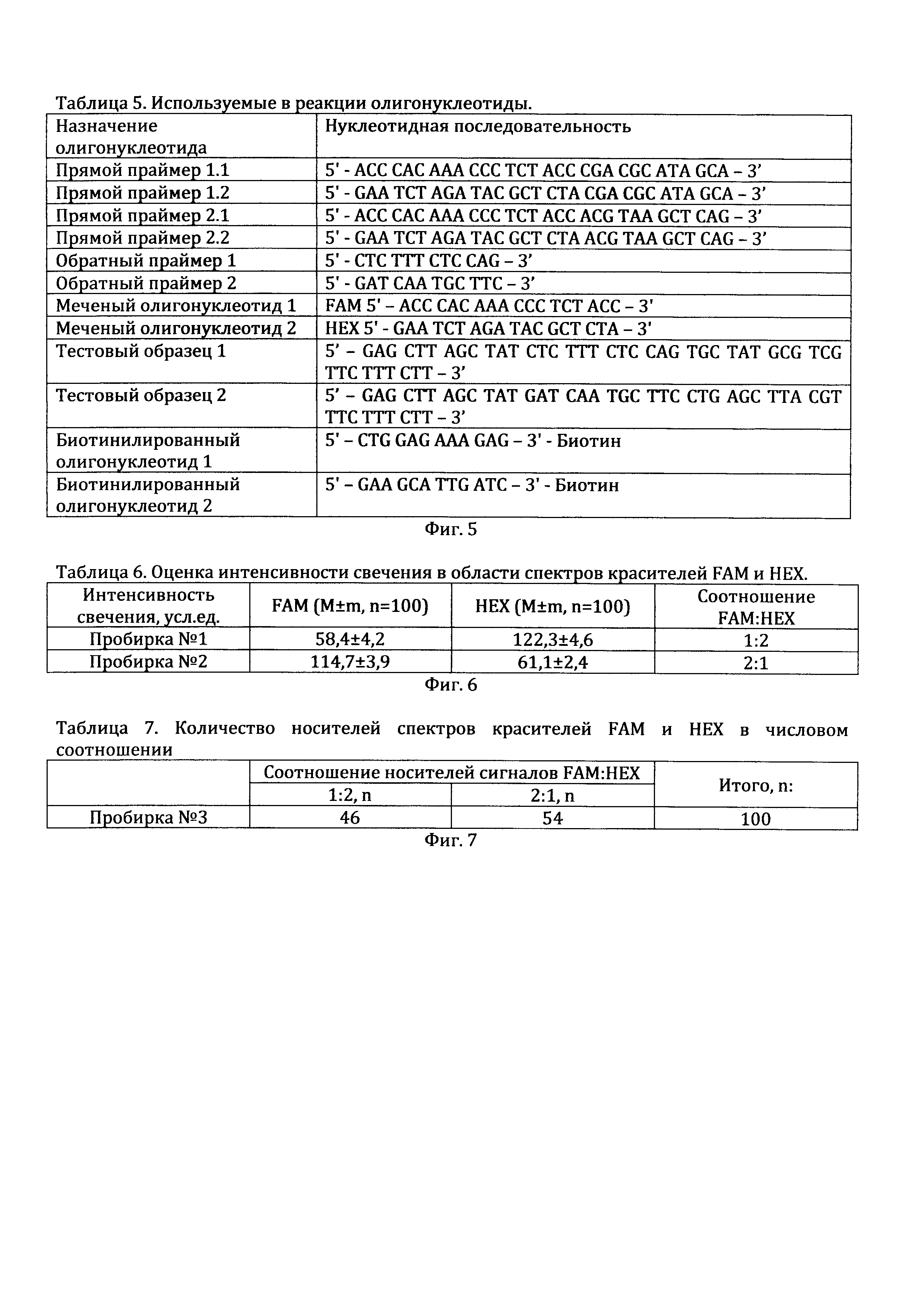
На фиг. 5 приведены олигонуклеотиды, использованные в примере 3 для независимой детекции двух последовательностей нуклеотидов в одном образце.
На фиг. 6, приведены результаты оценки флюоресценции красителей, когда в образце находилась одна из детектируемых последовательностей.
На фиг. 7 приведены результаты оценки флюоресценции красителей, когда в образце находились обе последовательности нуклеотидов.
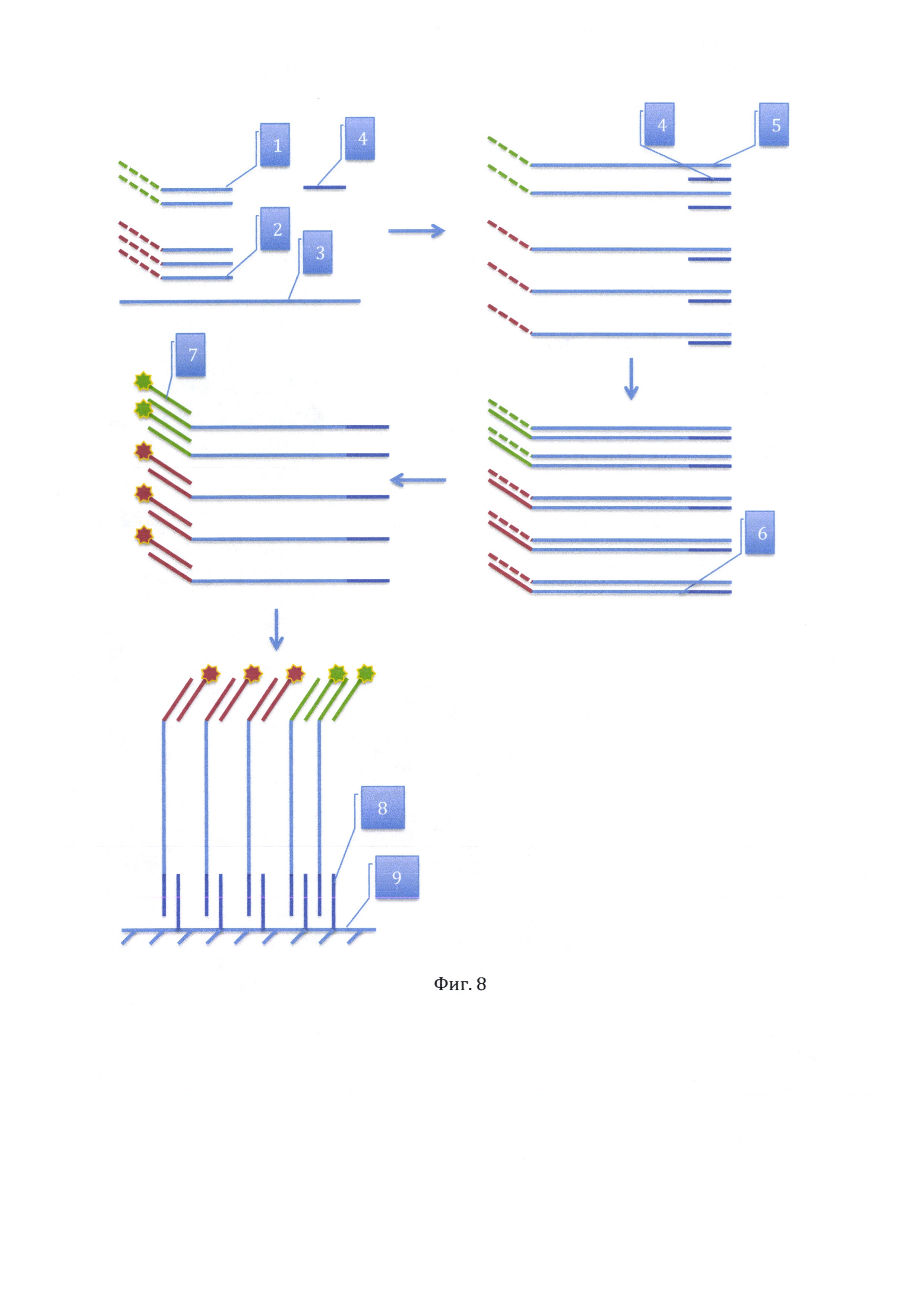
На фиг. 8 дан чертеж способа кодирования продуктов ПЦР путем присоединения к ним меток в заданном соотношении.
Сущность способа состоит в том, что при проведении ПЦР каждая детектируемая последовательность нуклеотидов в случае ее наличия в образце кодируется определенным образом. Это позволяет потом по этому коду определить ее наличие в образце независимо от присутствия других последовательностей нуклеотидов.
Кодирование определяемой методом ПЦР в образце последовательности нуклеотидов осуществляется путем получения определенного соотношения продуктов амплификации, отличающихся разными метками или участками для гибридизации меченных разными метками олигонуклеотидов.
Сущность метода иллюстрирует фигура 8. Получение определенного соотношения продуктов амплификации осуществляется на этапе амплификации введением в реакционную смесь нескольких прямых праймеров (1, 2) в этом же соотношении. Прямые праймеры содержат два участка. Один участок, расположенный на 3' конце праймера, одинаков для всех прямых праймеров и комплементарен (или частично комплементарен) целевой последовательности олигонуклеотидов в образце (3). Второй участок, расположенный на 5' конце праймера, отличается у каждого вида прямых праймеров. Этот участок не комплементарен (или частично комплементарен) целевой последовательности в образце, имеет идентифицируемую метку или содержит шаблон для последовательности олигонуклеотидов, комплементарной одному из меченых олигонуклеотидов. Соотношение количества прямых праймеров, несущих шаблоны для последовательности, комплементарной одному из меченых олигонуклеотидов, после завершения процесса циклической амплификации будет точно определять соотношение количества полученных ампликонов с мечеными участками или комплементарными к олигонуклеотидам, меченным различными метками.
В процессе кодирования продукта амплификации используется один обратный праймер (4), комплементарный (или частично комплементарный) участку цепи нуклеотидов на исследуемом образце, расположенному на небольшом удалении от участка прикрепления прямого праймера (5).
После выполнения амплификации проводится гибридизация продуктов амплификации (6) с меченными различными метками олигонуклеотидами (7), если в составе прямых праймеров не было меток.
Для распознавания кода определяемой методом ПЦР в образце последовательности нуклеотидов используется гибридизация меченых продуктов амплификации с олигонуклеотидами (8), комплементарными последовательности нуклеотидов в продуктах амплификации и закрепленными на какой-либо поверхности (9) на минимальном расстоянии друг от друга.
В результате получается участок поверхности с прикрепленным к нему комплексом олигонуклеотидов с разными метками в соотношении, определенном соотношением введенных в реакционную смесь прямых праймеров. Гибридизация с закрепленными олигонуклеотидами может проводиться после гибридизация продуктов амплификации с меченными различными метками олигонуклеотидами, во время гибридизации продуктов амплификации с меченными различными метками олигонуклеотидами или после гибридизации продуктов амплификации с меченными различными метками олигонуклеотидами. Возможно проведение гибридизации с полностью или частично комплементарными ампликонам олигонуклеотидами перед закреплением их на участке поверхности, после чего закрепляется уже комплекс олигонуклеотидов.
Оценка соотношения наличия разных меток на олигонуклеотидах позволяет определить соотношение прямых праймеров в реакционной смеси на этапе амплификации и идентифицировать закодированную соотношением количества продуктов амплификации последовательность нуклеотидов.
Для выявления двух и более последовательностей нуклеотидов в одном образце каждая из них кодируется по описанному выше методу. Для распознавания кода олигонуклеотиды, комплементарные (или частично комплементарные) разным ампликонам, закрепляются на разных непересекающихся участках поверхности. Оценка наличия и количества меток проводится на каждом таком участке индивидуально. Разное соотношение количества разных меток на олигонуклеотидах на разных участках позволит точно определить наличие или отсутствие продуктов амплификации участка цепи нуклеотидов в исследуемом образце.
Используемые для идентификации олигонуклеотидов метки, предпочтительно определяемые в оптическом диапазоне электромагнитных волн. Возможно использование любых других меток, идентифицируемых с помощью их электромагнитных, химических или любых других свойств.
Осуществление изобретения
Была оценена общая эффективность предлагаемого метода детекции множества нуклеотидных последовательностей в ходе одной ПЦР. Примеры конкретного выполнения способа детекции при выявлении разных последовательностей нуклеотидов и однонуклеотидных замен.
Пример 1
Способ осуществляется следующим образом для выявления наличия определенной последовательности нуклеотидов в образце:
1. Синтезируется набор праймеров, меченых олигонуклеотидов, биотинилированных олигонуклеотидов, тестовых образцов олигонуклеотидов (таблица 1). Использовались олигонуклеотиды, синтезированные компаниями «Синтол» и «Бигль». Очищены электрофорезом в полиакриламидном геле. Поставлялись в лиофилизированном виде, перед использованием разводились согласно прилагаемым инструкциям.
2. Приготавливается реакционная смесь для ПЦР, в которую добавляются прямые праймеры (общее количество 1 мкМ) в соотношении (Прямой праймер 1) : (Прямой праймер 2) равном 1:2 и обратный праймер (1 мкМ). Смесь готовится в двух пробирка, в одну из которых (№1) добавляют тестовый образец (0.1 мкМ).
3. Выполняется амплификация на амплификаторе «Терцик» в следующем режиме:
1. Инициация денатурации 94°С - 1 минута.
2. Денатурация 94°С - 30 сек.
3. Отжиг праймеров 37°С - 30 сек.
4. Элонгация 72°С - 30 сек.
5. Повторение пунктов 2-4 30 раз.
6. Денатурация 94°С - 2 минуты.
7. Охлаждение до комнатной температуры.
4. Проводится гибридизация продуктов амплификации с мечеными олигонуклеотидами 1 и 2. Для этого в реакционную смесь добавляли меченые олигонуклеотиды 1 и 2 в количестве 2 мкМ, проводили цикл денатурации при 94°С в течение 30 секунд и медленное охлаждение до комнатной температуры в течение 30 минут.
5. На покрытые стрептавидином магнитные шарики (5×105 штук) производится прикрепление биотинилированных олигонуклеотидов (2 мкМ) при температуре 37°С в течение 30 минут. После этого шарики трижды отмываются фосфатным буфером с использованием магнитного штатива.
6. Выполняется гибридизация ампликонов с олигонуклеотидами на магнитных шариках (5×105 штук) в течение 1 часа при комнатной температуре при непрерывном перемешивании. После этого шарики трижды отмываются фосфатным буфером для удаления непрореагировавших компонентов с использованием магнитного штатива.
7. Шарики суспендируются в буферном растворе, помещаются в камеру Горяева и фотографируются с использованием флуоресцентного микроскопа Olympus ВХ-41 (Япония). Флуоресценция возбуждается с использованием куба флуоресцентного фильтрового для возбуждения голубым светом BP470-490/DM500/BA515. Выполняется 10 фотографий случайных полей зрения. Используется объектив x100 План полу Апохромат N, NA=1,3, WD=0,2, СС=0,17. Для иммерсии применяется нефлуоресцирующее масло. Съемка производится на фотокамеру Olympus Е-330 (Япония) в разрешении 7,5 мегапикселей. Формат изображения JPEG.
8. На каждой фотографии с помощью компьютерной микротелефотометрии в программе ВидеоТест Морфо 5.0 (Россия) определяется интенсивность свечения в спектрах красителей FAM и HEX случайно выбранных шариков в количестве 10 штук (итого количество измерений в каждом спектре составляет 100). Результаты приведены в таблице 2.
9. Таким образом, в результате применения способа кодирования продукта реакции амплификации установлено, что соотношение интенсивности свечения красителей на меченых олигонуклеотидах, закрепленных на магнитном шарике соответствует соотношению прямых праймеров, введенных в реакционную смесь.
Пример 2
Способ осуществляется следующим образом для выявления наличия одной однонуклеотидной замены в образце:
1. Синтезируется набор праймеров, меченых олигонуклеотидов, биотинилированных олигонуклеотидов, тестовых образцов олигонуклеотидов (таблица 3). Использовались олигонуклеотиды, синтезированные компаниями «Синтол» и «Бигль». Очищены в полиакриламидном геле. Поставлялись в лиофилизированном виде, перед использованием разводились согласно прилагаемым инструкциям. Праймеры 1.1 и 1.2 имеют на 3' конце одно некомплементарное основание (С) и одно комлементарное основание (А). Праймеры 2.1 и 2.2 имеют два некомплементарных основания на 3' конце (СС). Праймеры 1.1 и 1.2 имеют возможность для амплификации (последнее основание комплементарно образцу), праймеры 2.1 и 2.2 не имеют возможности для амплификации при наличии замены (T>G) (последние основания некомплементарны образцу). При отсутствии замены (в образце 2 основание G) амплификация второй группой прямых праймеров возможна.
2. Приготавливается три пробирки с реакционной смесью для ПЦР, в которую добавляются прямые праймеры (общее количество 1 мкМ) в соотношении (Прямой праймер 1.1) : (Прямой праймер 1.2) равном 1:2, прямые праймеры (общее количество 1 мкМ) в соотношении (Прямой праймер 2.1) : (Прямой праймер 2.2) равном 2:1 и обратный праймер (1 мкМ). В пробирку №1 вносится тестовый образец 1 (0.1 мкМ), в пробирку №2 вносится тестовый образец 2 (0.1 мкМ), в пробирку №3 вносятся тестовые образцы 1 и 2 (по 0.1 мкМ).
3. Выполняется амплификация на амплификаторе «Терцик» по следующему протоколу:
1. Инициация денатурации 94°С - 1 минута.
2. Денатурация 94°С - 30 сек.
3. Отжиг праймеров 37°С - 30 сек.
4. Элонгация 72°С - 30 сек.
5. Повторение пунктов 2-4 30 раз.
6. Денатурация 94°С - 2 минуты.
7. Охлаждение до комнатной температуры.
4. Проводится гибридизация продуктов амплификации с мечеными олигонуклеотидами 1 и 2. Для этого в реакционную смесь добавляли меченые олигонуклеотиды 1 и 2 в количестве 2 мкМ, проводили цикл денатурации при 94°С в течение 30 секунд и медленное охлаждение до комнатной температуры в течение 30 минут.
5. На покрытые стрептавидином магнитные шарики (15×105 штук) производится прикрепление биотинилированных олигонуклеотидов (6 мкМ) при температуре 37°С в течение 30 минут. После этого шарики трижды отмываются фосфатным буфером с использованием магнитного штатива.
6. Выполняется гибридизация ампликонов с олигонуклеотидами на магнитных шариках (5×105 штук) в течение 1 часа при комнатной температуре при непрерывном перемешивании. После этого шарики трижды отмываются фосфатным буфером для удаления непрореагировавших компонентов с использованием магнитного штатива.
7. Шарики суспендируются в буферном растворе, помещаются в камеру Горяева и фотографируются с использованием флуоресцентного микроскопа Olympus ВХ-41 (Япония). Флуоресценция возбуждается с использованием куба флуоресцентного фильтрового для возбуждения голубым светом BP470-490/DM500/BA515. Выполняется 10 фотографий случайных полей зрения. Используется объектив x100 План полу Апохромат N, NA=1,3, WD=0,2, СС=0,17. Для иммерсии применяется нефлуоресцирующее масло. Съемка производится на фотокамеру Olympus Е-330 (Япония) в разрешении 7,5 мегапикселей. Формат изображения JPEG.
8. На каждой фотографии с помощью компьютерной микротелефотометрии в программе ВидеоТест Морфо 5.0 (Россия) определяется интенсивность свечения в спектрах красителей FAM и HEX случайно выбранных шариков в количестве 10 штук (итого количество измерений в каждом спектре составляет 100). Учитываются только шарики, имеющие свечение. Результаты приведены в таблице 4.
9. Таким образом, в результате применения способа кодирования продукта реакции амплификации для выявления однонуклеотидных замен установлено, что соотношение интенсивности свечения красителей на меченых олигонуклеотидах, закрепленных на магнитном шарике, соответствует соотношению прямых праймеров, введенных в реакционную смесь. В случае наличия в образце обоих вариантов замены (условная гетерозигота) происходит суммация сигнала с обоих групп праймеров, что подтверждает возможность использования предлагаемого метода кодирования для генотипирования по однонуклеотидным заменам.
Пример 3
Способ осуществляется следующим образом для выявления наличия двух разных последовательностей в образце:
1. Синтезируется набор праймеров, меченых олигонуклеотидов, биотинилированных олигонуклеотидов, тестовых образцов олигонуклеотидов (таблица 5). Использовались олигонуклеотиды, синтезированные компаниями «Синтол» и «Бигль». Очищены в полиакриламидном геле. Поставлялись в лиофилизированном виде, перед использованием разводились согласно прилагаемым инструкциям. Праймеры 1.1 и 1.2 используются для детекции последовательности тестового образца 1. Праймеры 2.1 и 2.2 используются для детекции последовательности тестового образца 2.
2. Приготавливается три пробирки с реакционной смесью для ПЦР, в которую добавляются прямые праймеры (общее количество 1 мкМ) в соотношении (Прямой праймер 1.1) : (Прямой праймер 1.2) равном 1:2, прямые праймеры (общее количество 1 мкМ) в соотношении (Прямой праймер 2.1) : (Прямой праймер 2.2) равном 2:1 и обратные праймеры 1 и 2 (по 1 мкМ). В пробирку №1 вносится тестовый образец 1 (0.1 мкМ), в пробирку №2 вносится тестовый образец 2 (0.1 мкМ), в пробирку №3 вносятся тестовые образцы 1 и 2 (по 0.1 мкМ).
3. Выполняется амплификация на амплификаторе «Терцик» по следующему протоколу:
1. Инициация денатурации 94°С - 1 минута.
2. Денатурация 94°С - 30 сек.
3. Отжиг праймеров 37°С - 30 сек.
4. Элонгация 72°С - 30 сек.
5. Повторение пунктов 2-4 30 раз.
6. Денатурация 94°С - 2 минуты.
7. Охлаждение до комнатной температуры.
4. Проводится гибридизация продуктов амплификации с мечеными олигонуклеотидами 1 и 2. Для этого в реакционную смесь добавляли меченые олигонуклеотиды 1 и 2 в количестве 2 мкМ, проводили цикл денатурации при 94°С в течение 30 секунд и медленное охлаждение до комнатной температуры в течение 30 минут.
5. На покрытые стрептавидином магнитные шарики по 15×105 штук в двух пробирках #1 и #2 производится прикрепление биотинилированных олигонуклеотидов 1 (в пробирке #1) и 2 (в пробирке #2) по 6 мкМ при температуре 37 С в течение 30 минут. После этого шарики трижды отмываются фосфатным буфером с использованием магнитного штатива.
6. В каждую пробирку с продуктами амплификации добавляется по 5×105 штук магнитных шариков с биотинилированными олигонуклеотидами из пробирок #1 и #2. Выполняется гибридизация ампликонов с олигонуклеотидами на магнитных шариках в течение 1 часа при комнатной температуре при непрерывном перемешивании. После этого шарики трижды отмываются фосфатным буфером для удаления непрореагировавших компонентов с использованием магнитного штатива.
7. Шарики суспендируются в буферном растворе, помещаются в камеру Горяева и фотографируются с использованием флуоресцентного микроскопа Olympus ВХ-41 (Япония). Флуоресценция возбуждается с использованием куба флуоресцентного фильтрового для возбуждения голубым светом BP470-490/DM500/BA515. Выполняется 10 фотографий случайных полей зрения. Используется объектив ×100 План полу Апохромат N, NA=1,3, WD=0,2, СС=0,17. Для иммерсии применяется нефлуоресцирующее масло. Съемка производится на фотокамеру Olympus Е-330 (Япония) в разрешении 7,5 мегапикселей. Формат изображения JPEG.
8. На каждой фотографии с помощью компьютерной микротелефотометрии в программе ВидеоТест Морфо 5.0 (Россия) определяется интенсивность свечения в спектрах красителей FAM и HEX случайно выбранных шариков в количестве 10 штук (итого количество измерений в каждом спектре составляет 100). Учитываются только шарики, имеющие свечение. Результаты приведены в таблице 6.
9. В пробирке №3 было обнаружено наличие свечения шариков двух типов. Первый тип включал в себя сигналы FAM и HEX в соотношении 1:2, второй тип 2:1. Нами было посчитано количество шариков двух типов свечения в группе из 100 случайно выбранных шариков, результаты представлены в таблице 7.
10. Таким образом, в результате применения способа кодирования продукта реакции амплификации для выявления двух разных последовательностей установлено, что соотношение интенсивности свечения красителей на меченых олигонуклеотидах, закрепленных на магнитном шарике, соответствует соотношению прямых праймеров, введенных в реакционную смесь. В случае наличия в образце обоих вариантов последовательностей появление в совокупности детектирующих носителей (шариков) отдельных носителей с разным цветовым кодом, по которому можно определить, какая из последовательностей присутствует в образце.