Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ПЕНТАФТОРЙОДЭТАНА
Вид РИД
Изобретение
Изобретение относится к фторорганической химии, а именно к получению перфторалкилйодидов, конкретно пентафторйодэтана.
Перфторалкилйодиды, и особенно пентафторйодэтан, являются базовыми синтонами в химии органических соединений фтора. Пентафторйодэтан широко применяется для введения пентафторэтильной группы в соединения различных классов путем присоединения его по двойной углерод-углеродной связи непредельных соединений [N.O. Brace, J. Org. Chem., 1962, 27 (9), 3033-3038; 27 (12), 4491-4498], являясь таким образом ключевым интермедиатом для получения частично фторированных спиртов, эфиров, кислот, силанов и других функциональных производных, используемых в синтезе медицинских препаратов, поверностно-активных веществ и др. Так, пентафтопентанол, получаемый в промышленных масштабах присоединением пентафторйодэтана к аллиловому спирту с последующим восстановлением связи C-I водородом на катализаторе [патент США US 6002053, 1999], является полупродуктом в синтезе сложных биологически активных соединений, преимущественно стероидных препаратов, применяемых для лечения онкологических заболеваний [патент США US 5502046, 1996; международная заявка WO 2005077968 и др.].
Присоединение пентафторйодэтана по кетогруппе представляет собой еще один метод введения пентафторэтильного фрагмента в различные сложные молекулы [патентная заявка США US 2012190660].
Пентафторйодэтан используют также в качестве телогена в реакции с тетрафторэтиленом для получения высших перфторалкилйодидов [G. Sosnovsky. Free Radical Reactions in Preparative Organic Chemistry. London: Macmillan, 1964].
Известен способ получения пентафторйодэтана реакцией тетрафторэтилена (ТФЭ) с пентафторидом йода [патент США US 2614131, 1949]. Недостатком способа является взрывоопасность ТФЭ, что затрудняет его транспортировку и делает этот способ доступным только для производителей тетрафторэтилена.
Другой известный способ получения пентафторйодэтана - разложение серебряной соли пентафторпропионовой кислоты в присутствии йода [J. Banus, J. Chem. Soc., 1953, 3755-3761]. Недостаток этого способа - дороговизна исходных материалов.
Задачей настоящего изобретения является разработка способа получения пентафторйодэтана из доступного сырья без использования взрывоопасного тетрафторэтилена.
Эта задача решается заявляемым способом получения пентафторйодэтана из перфторпропена. Предлагаемый способ получения пентафторйодэтана включает:
(а) взаимодействие перфторпропена с источником йода, в качестве которого используют или йодгалогенид, такой как I-I, I-Br, I-Cl, в присутствии неорганического фторида, предпочтительно KF, или перфторизопропилйодид, и метилатом натрия в полярном апротонном растворителе, таком как диметилформамид, диглим или ацетонитрил, при температуре от -20 до 15°C, в результате которого образуется 1,1,1,2,3,3-гексафтор-2-йод-3-метоксипропан;
(б) деметилирование полученного продукта при кипячении в присутствии каталитического количества пятихлористой сурьмы, приводящее к образованию 2,3,3,3-тетрафтор-2-йодпропионилфторида;
(в) декарбонилирование полученного на стадии (б) продукта под действием пятифтористой сурьмы при нагревании, предпочтительно при 39-41°C, с образованием пентафторйодэтана.
a) 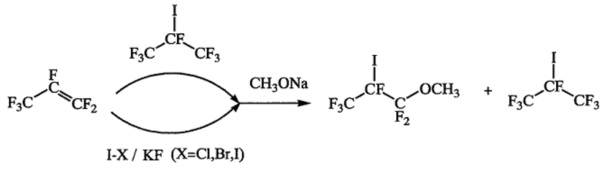
б) 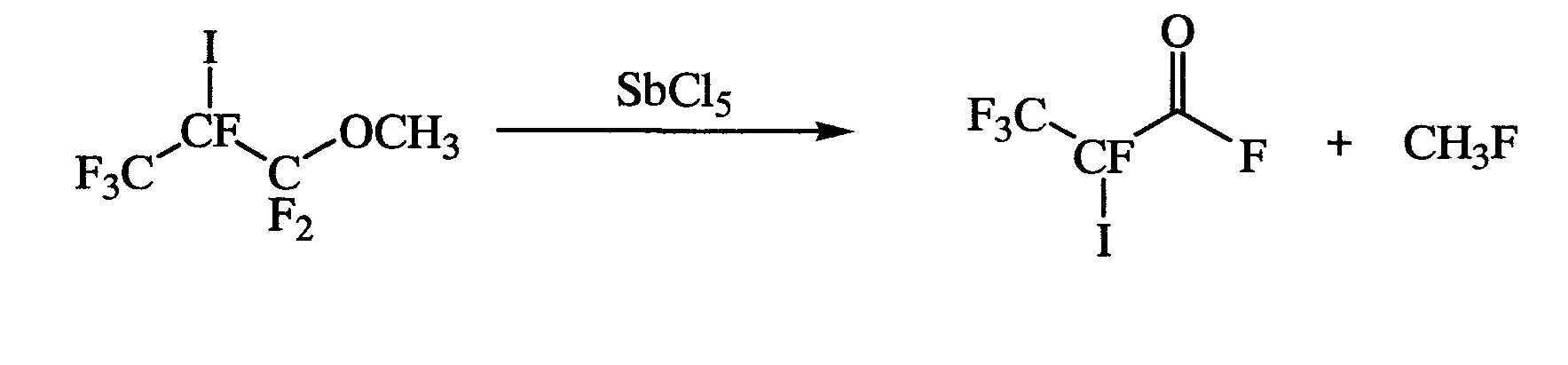
в) 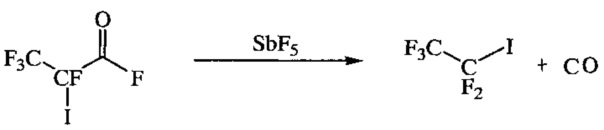
Исходное соединение для предложенного способа является одним из основных продуктов промышленной фторорганической химии. Перфторпропен широко применяется в промышленности для получения фторполимеров в качестве мономера, а также для синтеза перфторизопропилйодида, окиси перфторпропилена и гексафторацетона.
Все стадии получения пентафторйодэтана проводят в открытой системе, без применения сосудов под давлением.
На стадии (а) перфторпропен пропускают либо в раствор перфторизопропилйодида и метилата натрия в полярном апротонном растворителе, либо в раствор йодгалогенида (йода, бромистого йода или хлористого йода), метилата натрия и фторида щелочного металла, предпочтительно фтористого калия, в полярном апротонном растворителе. В качестве полярного апротонного растворителя могут быть использованы диметилформамид, диглим или ацетонитрил. Реакцию проводят при охлаждении - в температурном интервале от -20 до 15°C. 1,1,1,2,3,3-Гексафтор-2-йод-3-метоксипропан получают с выходом 36-40% в случае использования йодгалогенидов в присутствии неорганических фторидов и 93% - в случае использования перфторизопропилйодида.
Бромистый йод нестабилен при комнатной температуре, поэтому его получают непосредственно в реакционной колбе, добавляя йод к брому в растворителе при охлаждении (11°C).
Если в качестве источника йода используют перфторизопропилйодид, то добавления неорганического фторида не требуется.
На стадии (б) из 1,1,1,2,3,3-гексафтор-2-йод-3-метоксипропана при нагревании в присутствии каталитического количества пятихлористой сурьмы получают 2,3,3,3-тетрафтор-2-йодпропионилфторид. Реакцию деметилирования проводят, добавляя пятихлористую сурьму к 1,1,1,2,3,3-гексафтор-2-йод-3-метоксипропану, с последующим кипячением до прекращения выделения метилфторида. 2,3,3,3-Тетрафтор-2-йодпропионилфторид выделяют перегонкой с выходом 90%.
На стадии (в) декарбонилированием 2,3,3,3-тетрафтор-2-йодпропионилфторида под действием пятифтористой сурьмы при нагревании (39-41°C) получают пентафторйодэтан с выходом 90%. Пятифтористую сурьму по каплям прибавляют к 2,3,3,3-тетрафтор-2-йодпропионилфториду, образующийся при этом газообразный пентафторйодэтан улавливают в диметилформамид, а затем выделяют в чистом виде, добавляя полученный раствор в диметилформамиде в разбавленную соляную кислоту и отгоняя CF3CF2I в охлаждаемый приемник.
Общий выход целевого пентафторйодэтана составляет 29-32% при использовании в качестве источника йода йодгалогенидов и 75% - при использовании перфторизопропилйодида.
Технический результат настоящего изобретения заключается в разработке способа получения пентафторйодэтана из доступного исходного сырья - перфторпропена, не требующего использования взрывоопасного ТФЭ и специальной аппаратуры для работы под давлением.
Осуществление способа иллюстрируется следующими примерами.
Пример 1
Получение 1,1,1,2,3,3-гексафтор-2-йод-3-метоксипропана (стадия а)
В колбу объемом 350 мл помещают 150 г абс. ДМФА и 296 г (1,0 моль) перфторизопропилйодида, затем при температуре -10°C порциями прибавляют 21 г (0,39 моль) метилата натрия, после чего барботируют 50 г (0,33 моль) перфторпропена. После окончания барботирования реакционную смесь перемешивают еще час, затем раствор декантируют с осадка в 150 мл 15%-ной соляной кислоты. Органический слой отделяют, промывают сначала 5%-ным водным раствором NaHSO3 до обесцвечивания, затем равным объемом воды, охлажденной до 5°C, сушат над CaCl2 и перегоняют. Получают 95 г (93%) 1,1,1,2,3,3-гексафтор-2-йод-3-метоксипропана в виде бесцветной жидкости с т. кип. 98-102°C. Возвращают 148 г перфторизопропилйодида (т. кип. 40-42°C).
19F ЯМР-спектр (CFCl3), δ, м.д.: -76,3 (м, 3F, CF3), -87,9, -82,6 (АВкв, 2F, JFF=141 Гц, CF2OMe), -147,2 (м, 1F, CFI).
1Н ЯМР-спектр (ТМС), δ, м.д.: 5,0 (с, 3Н, СН3).
Масс-спектр, m/z: 308 [М]+, 289 [M-F]+, 277 [М-СН3O]+, 258 [M-(CH3O+F)]+, 239 [M-CF3]+, 227 [M-CF2OCH3]+, 208 [M-(CF3+OCH3)]+, 181 [M-I]+, 177 [CF2I]+, 162 [M-(I+F)]+, 150 [C3F6]+, 131 [C3F5]+, 128 [HI]+, 119 [C2F5]+, 100 [C2F4]+, 81 [CF2OCH3]+(100%), 69 [CF3]+, 47 [COF]+.
Пример 2
Получение 1,1,1,2,3,3-гексафтор-2-йод-3-метоксипропана (стадия а)
К 1500 г абс. ДМФА при температуре 11°C и интенсивном перемешивании прибавляют 273 г (1,71 моль) брома, затем 577 г (2,27 моль) йода, после чего порциями присыпают 295 г (5,09 моль) прокаленного KF и барботируют из баллона 590 г (3,94 моль) гексафторпропена с такой скоростью, чтобы не наблюдалось проскока газа на выходе из реактора. Полученную смесь перемешивают в течение 2 ч, потом охлаждают до 0°C и при интенсивном перемешивании порциями присыпают 193 г (3,58 моль) метилата натрия, после чего перемешивают в течение 2 ч.
Получившийся раствор декантируют с осадка и при перемешивании вливают в 1500 мл 15%-ной соляной кислоты. Нижний органический слой отделяют, промывают водным раствором NaHSO3 (или Na2S2O3) до обесцвечивания, затем равным объемом воды, охлажденной до 5°C. Получают 1266 г сырца, содержащего, по данным ГХ, 46,7% перфторизопропилйодида, 37,3% 1,1,1,2,3,3-гексафтор-2-йод-3-метоксипропана, 6,1% ДМФА, 7,6% 1,2,3,3,3-пентафтор-1-метоксипроп-1-ена и приблизительно 2% неустановленных примесей. Сырец сушат над СаСl2, фильтруют и на водяной бане отгоняют 480 г перфторизопропилйодида с т.кип. 40-42°C, который может быть использован в следующей загрузке. Остаток перегоняют в вакууме и получают 420 г (40%) 1,1,1,2,3,3-гексафтор-2-йод-3-метоксипропана с т.кип. 50-60°C/10-15 мм рт.ст. 90%-ной чистоты (ГХ), который без дополнительной очистки используют в следующей стадии.
Пример 3
Получение 1,1,1,2,3,3-гексафтор-2-йод-3-метоксипропана (стадия а)
К 1500 г абс. диглима при температуре 10°C и интенсивном перемешивании прибавляют 600 г (3,70 моль) хлористого йода, затем порциями присыпают 295 г (5,09 моль) прокаленного KF и барботируют из баллона 590 г (3,94 моль) гексафторпропена, после чего перемешивают в течение 2 ч. Далее реакционную массу охлаждают до 0°C, при интенсивном перемешивании порциями присыпают 193 г (3,58 моль) метилата натрия и перемешивают еще 2 ч.
Получившийся раствор декантируют с осадка и при перемешивании вливают в 1500 мл 15%-ной соляной кислоты. Нижний слой отделяют, промывают водным раствором NaHSO3 (или Na2S2O3) до обесцвечивания, затем равным объемом воды, охлажденной до 5°C. Получают 1272 г сырца, содержащего, по данным ГХ, 44,8% перфторизопропилйодида, 36,5% 1,1,1,2,3,3-гексафтор-2-йод-3-метоксипропана, 8,3% диглима, 7,8% 1,2,3,3,3-пентафтор-1-метоксипроп-1-ена и приблизительно 2% неустановленных примесей. Сырец сушат над CaCl2, фильтруют и на водяной бане отгоняют 420 г перфторизопропилйодида с т.кип. 40-42°C, который может быть использован в следующей загрузке. Остаток перегоняют в вакууме и получают 405 г (37%) 1,1,1,2,3,3-гексафтор-2-йод-3-метоксипропана с т.кип. 50-60°C/10-15 мм рт.ст. 90%-ной чистоты (ГХ), который без дополнительной очистки используют в следующей стадии.
Пример 4
Получение 2-йодперфторпропионилфторида (стадия б)
К 50 г (0,162 моль) 1,1,1,2,3,3-гексафтор-2-йод-3-метоксипропана прибавляют по каплям 4,4 г (0,0162 моль) пятихлористой сурьмы с такой скоростью, чтобы наблюдалось умеренное газовыделение. После добавления всего количества SbCl5 реакционную массу кипятят в течение 0,5 ч до прекращения газовыделения. Затем перегоняют, заменив обратный холодильник дефлегматором с прямым холодильником, алонжем и приемной колбой, соединенной на выходе со склянкой Тищенко с конц. H2SO4. Получают 40 г (90%) 2-йодперфторпропионилфторида с т.кип. 58-59°C.
19F ЯМР-спектр (CFCl3), δ, м.д.: 20,5 (IF, 2COF), -76,3 (3F, CF3), -143,3 (IF, CFI), что согласуется с литературными данными для этого соединения [Т. Abe, A. Kumar, S.K. Pandey. Synthesis and Reactivity in Inorganic, Metal-Organic, and Nano-Metal Chemistry, 2006, 35 (5), 365-368].
Пример 5
Получение пентафторйодэтана (стадия в)
К 40 г (0,146 моль) 2,3,3,3-тетрафтор-2-йодпропионилфторида при перемешивании при (40±1)°C по каплям прибавляют 34,8 г (0,161 моль) пятифтористой сурьмы с такой скоростью, чтобы наблюдалось умеренное газовыделение, с одновременной отгонкой пентафторйодэтана, который барботируют в ДМФА. Раствор пентафторйодэтана в ДМФА по каплям прибавляют в 30%-ную соляную кислоту с одновременной отгонкой пентафторйодэтана в приемную колбу, охлаждаемую смесью сухого льда и ацетона. Получают 32,3 г (90%) пентафторйодэтана. Т. кип. 12-13°C.
19F ЯМР-спектр (CFCl3), δ, м.д.: -85,4 (м, 3F, CF3), -65,2 (м, 2F, CF2I), что согласуется с литературными данными для этого соединения [Е. Pitcher, A.D. Buckingham, F.G.A. Stone, J. Chem. Phys., 1962, 36 (1), 124-129; C.G. Krespan, J. Org. Chem., 1962, 27 (5), 1813-1814].

