Результат интеллектуальной деятельности: Способ стабилизации щелочного раствора пероксида водорода
Вид РИД
Изобретение
Изобретение относится к способам стабилизации щелочных растворов пероксида водорода (выбор ингибиторов процесса разложения перекисных продуктов жидкой фазы тройной системы МеОН-H2O2-H2O), используемых при синтезе из пероксида водорода и соответствующих гидроксидов пероксидных соединений щелочных металлов или их композитных смесей, применяемых затем как основа продуктов для регенерации воздуха в изолирующих средствах защиты органов дыхания человека от поражающих факторов химической и биологической природы.
Способы получения пероксидных соединений щелочных металлов или их композитных смесей из пероксида водорода и соответствующих гидроксидов заключаются во взаимодействии раствора пероксида водорода и соответствующего гидроксида (или смеси гидроксидов) с последующей дегидратацией полученного раствора или суспензии.
Необходимо отметить, что взаимодействие пероксида водорода и гидроксидов щелочных металлов при нормальных условиях - ярко выраженный экзотермический процесс, сопровождающийся каталитическим разложением пероксидных продуктов под воздействием гидроксид-анионов [У. Шамб, Ч. Сеттерфилд, Р. Вентворс. Перекись водорода. - М.: Иностранная литература. - 1958. - 578 с.] и выделением атомарного кислорода. Это не только приводит к снижению содержания пероксидных соединений в продукте синтеза, но и создает дополнительную угрозу возникновения «кислородного» пожара, локализовать который практически невозможно. Поэтому для предотвращения разложения пероксидных соединений в процессе синтеза и хранения полученного щелочного раствора пероксида водорода надо или охлаждать зону реакции до требуемых температур (как правило, не выше 10°С) и поддерживать полученный раствор в течение производственного цикла при этой же температуре, что связано с дополнительными затратами, или использовать вещества, выступающие в качестве стабилизаторов (ингибиторов) реакции. Под стабильностью различных растворов пероксидных соединений понимается их способность сохранять свой активный кислород (уменьшение абсолютного содержания активного кислорода в системе менее 1,0% массовых) в течение длительного времени, т.е. максимальная неизменность химического состава жидкой фазы.
До настоящего времени не существует строго научных основ для выбора стабилизаторов различных растворов пероксидных соединений, препятствующих их разложению [Г.А. Серышев. Химия и технология перекиси водорода. - Л.: Химия. - 1984. - С. 182]. Поэтому их выбор проводят преимущественно эмпирическим путем в зависимости от состава конкретного раствора и его последующего применения. Так как щелочной раствор пероксида водорода в дальнейшем используется для синтеза пероксидных соединений щелочных металлов и далее на их основе регенеративных продуктов для средств защиты органов дыхания человека от поражающих факторов химической и биологической природы, на применяемые в качестве стабилизаторов вещества накладывается ряд ограничений (по токсичности, химической устойчивости к воздействию атомарного кислорода и др.).
Известен способ стабилизации щелочных растворов пероксида водорода [патент РФ №2352522, МПК С01B 15/037, 2009 г.], включающий поэтапное добавление к водному раствору пероксида водорода стабилизаторов. В качестве стабилизаторов используют сульфат магния (MgSO4) и моногидрат пероксида лития (Li2O2⋅H2O). На первом этапе осуществляют введение в раствор пероксида водорода сульфата магния. После его полного растворения осуществляют добавление части гидроксида. При достижении значения pH раствора, равного примерно 10, в него вводят моногидрат пероксида лития. Затем добавляют оставшееся количество гидроксида. Стабилизаторы вводятся в следующих количествах, моль вещества/моль пероксида водорода: сульфат магния (MgSO4) 0,0001÷0,017; моногидрат пероксида лития (Li2O2⋅H2O)0,0001÷0,028.
Однако такой способ является технологически сложным. Это обусловлено, во-первых, многостадийностью процесса, заключающегося в последовательном введении в раствор пероксида водорода сначала одного стабилизатора (сульфата магния), затем добавления гидроксида до достижения строго фиксированного значения pH, затем введении второго стабилизатора и только после этого добавлении оставшегося количества гидроксида.
При этом существенное значение имеют постоянный контроль pH щелочного раствора пероксида водорода, поскольку при отклонении данного параметра от заявленного в изобретении значения может быть нарушен механизм стабилизации, что в конечном счете негативно скажется на протекании процесса получения пероксидных соединений щелочных металлов.
Наиболее близкими к заявляемому способу стабилизации щелочных растворов пероксида водорода является способ [патент РФ №2538836, МПК C01B 15/037, 2015 г.], включающий поэтапное добавление к водному раствору пероксида водорода стабилизаторов. В качестве стабилизаторов используют тетраборат натрия (Na2B4O7) и сульфат магния (MgSO4). На первом этапе осуществляют введение в раствор пероксида водорода тетрабората натрия. После его полного растворения добавляют сульфат магния. При этом стабилизаторы вводят в раствор пероксида водорода в следующих количествах (моль вещества/моль пероксида водорода) : тетраборат натрия (Na2B4O7) - 0,001÷0,004; сульфат магния (MgSO4) - 0,001÷0,004. Затем добавляют гидроксиды щелочных металлов небольшими порциями таким образом, чтобы температура в зоне реакции не превышала 25°C.
Данный способ стабилизации щелочного раствора пероксида водорода позволяет существенно упростить технологический процесс, однако время его стабильности недостаточно велико.
Задачей изобретения является увеличение времени стабильности щелочного раствора пероксида водорода при использовании меньших количеств стабилизатора.
Задача решается тем, что в способе стабилизации щелочного раствора пероксида водорода, заключающегося в последовательном добавлении в раствор пероксида водорода стабилизаторов, в качестве стабилизаторов используют сульфат магния и ортоборную кислоту. При этом сульфат магния и ортоборную кислоту вводят в раствор пероксида водорода в следующих количествах, моль вещества/моль пероксида водорода:
|
Такой прием обеспечивает стабильность щелочного раствора пероксида водорода в течение длительного времени. Это позволяет снизить расход исходных компонентов, повысить содержание основного вещества (перекисного соединения металла) в конечном продукте и снизить вероятность возникновения пожароопасной ситуации на производстве.
Как уже отмечалось выше, механизм стабилизации различных растворов пероксида водорода неизвестен. Поэтому сложно однозначно оценить влияние того или иного иона или их ассоциатов, содержащихся в многокомпонентном растворе, на стабильность системы в целом. Нахождение стабилизатора для конкретной цели - задача, которая решается только эмпирическим путем. Но было отмечено, что гидроксид щелочного металла следует добавлять в раствор пероксида водорода только после полного растворения стабилизаторов, а ортоборную кислоту предпочтительно вводить в пероксид водорода после растворения в нем сульфата магния. При этом гидроксид щелочного металла следует вводить двумя порциями, причем вторую порцию вводят в образовавшуюся жидкую фазу не менее чем через 20 минут после добавления первой порции. Такой прием обусловлен тем, что при нейтрализации ортоборной кислоты щелочами в водных растворах не образуются ортобораты, содержащие ион (ВО3)3-, поскольку ортобораты практически полностью гидролизуются вследствие слишком малой константы образования [В(ОН)4]-. Е растворе образуются тетрабораты, метабораты и соли других полиборных кислот (nB2O2⋅mH2O), не существующие в свободном состоянии (и которые по этой причине невозможно ввести в жидкую фазу в виде исходных соединений), что хорошо известно из курса неорганической химии [Карапетьянц М.X., Дракин С.И. Общая и неорганическая химия. М.: Химия, 1994].
Способ стабилизации щелочных растворов пероксида водорода осуществляют следующим образом. В водный раствор пероксида водорода любой концентрации при непрерывном перемешивании вводят сульфат магния. После того как кристаллы сульфата магния полностью растворятся, добавляют необходимое количество ортоборной кислоты. При этом стабилизаторы вводят в раствор пероксида водорода в следующих количествах (моль вещества/моль пероксида водорода): сульфат магния (MgSO4) - 0,0008÷0,0035; ортоборная кислота (H3BO3) - 0,0008÷0,0035. Затем двумя порциями с интервалом не менее 20 минут добавляют гидроксиды щелочных металлов таким образом, чтобы температура в зоне реакции не превышала 25°C. Такой режим позволяет максимально нивелировать влияние температурного фактора на разложение пероксидных продуктов. Полученный щелочной раствор пероксида водорода может быть использован для дальнейшего получения пероксидных соединений щелочных металлов или их композитных смесей различными способами. Содержание в получаемых щелочных растворах пероксида водорода активного кислорода можно определять любыми пригодными для этого методами химического или физико-химического анализа.
Примеры, представленные ниже, описывают случай приготовления щелочного раствора пероксида водорода для последующего синтеза надпероксида калия как случай, в котором содержание сильной щелочи в исследуемом растворе максимально (pH раствора больше 13 и каталитическое воздействие анионов OH- на пероксидные продукты так же максимально).
Пример 1
К 1000 мл водного 50% раствора пероксида водорода при непрерывном перемешивании добавляют 1,69 г сульфата магния (мольное соотношение MgSO4/H2O2=0,0008). После его полного растворения добавляют 3,81 г ортоборной кислоты (мольное соотношение Н3BO3/H2O2=0,0035). Затем в полученный раствор вводят двумя порциями с интервалом в 25 минут твердый 85% гидроксид калия (КОН) в количестве 690 г. Первая порция гидроксида калия составляет 112 г. Добавление КОН осуществляют таким образом, чтобы температура в зоне реакции не превышала 25°C. Полученный щелочной раствор пероксида водорода помещают при температуре 25°C в темное место и через определенные интервалы времени проводят анализы по определению активного кислорода в жидкой фазе, т.е. определяют потерю системой активного кислорода. Время стабильности полученного щелочного раствора пероксида водорода с использованием в указанных количествах в качестве стабилизатора сульфата магния и ортоборной кислоты составило 1484 минуты. Потеря системой активного кислорода за 24 часа составила 5,8 л.
Пример 2
К 1000 мл водного 50% раствора пероксида водорода при непрерывном перемешивании добавляют 7,38 г сульфата магния (мольное соотношение MgSO4/H2O2=0,0035). После его полного растворения добавляют 0,87 г ортоборной кислоты (мольное соотношение Н3ВО3/Н2О2=0,0008). Затем в полученный раствор вводят двумя порциями с интервалом в 20 минут твердый 85% гидроксид калия (КОН) в количестве 690 г. Первая порция гидроксида калия составляет 112 г. Добавление КОН осуществляют таким образом, чтобы температура в зоне реакции не превышала 25°C. Далее как в примере 1. Время стабильности полученного щелочного раствора пероксида водорода с использованием в указанных количествах в качестве стабилизатора сульфата магния и ортоборной кислоты составило 1247 минут. Потеря системой активного кислорода за 24 часа составила 12,4 л.
Пример 3
К 1000 мл водного 50% раствора пероксида водорода при непрерывном перемешивании добавляют 4,22 г сульфата магния (мольное соотношение MgSO4/H2O2=0,002). После его полного растворения добавляют 2,18 г ортоборной кислоты (мольное соотношение Н3BO3/H2O2=0,002). Затем в полученный раствор вводят двумя порциями с интервалом в 22 минуты твердый 85% гидроксид калия (КОН) в количестве 690 г. Первая порция гидроксида калия составляет 112 г. Добавление КОН осуществляют таким образом, чтобы температура в зоне реакции не превышала 25°C. Далее как в примере 1. Время стабильности полученного щелочного раствора пероксида водорода с использованием в указанных количествах в качестве стабилизатора сульфата магния и ортоборной кислоты составило 1672 минуты. Потеря системой активного кислорода за 24 часа составила 5,3 л.
Пример 4
К 1000 мл водного 50% раствора пероксида водорода при непрерывном перемешивании добавляют 1,69 г сульфата магния (мольное соотношение MgSO4/H2O2=0,0008). После его полного растворения добавляют 0,87 г ортоборной кислоты (мольное соотношение H3BO3/H2O2=0,0008). Затем в полученный раствор вводят двумя порциями с интервалом в 20 минут твердый 85% гидроксид калия (КОН) в количестве 690 г. Первая порция гидроксида калия составляет 112 г. Добавление КОН осуществляют таким образом, чтобы температура в зоне реакции не превышала 25°. Далее как в примере 1. Время стабильности полученного щелочного раствора пероксида водорода с использованием в указанных количествах в качестве стабилизатора сульфата магния и ортоборной кислоты составило 792 минуты. Потеря системой активного кислорода за 24 часа составила 17,2 л.
Пример 5
К 1000 мл водного 50% раствора пероксида водорода при непрерывном перемешивании добавляют 7,38 г сульфата магния (мольное соотношение MgSO4/H2O2=0,0035). После его полного растворения добавляют 3,81 г ортоборной кислоты (мольное соотношение Н3ВO3/Н2O2=0,0035). Затем в полученный раствор вводят двумя порциями с интервалом в 25 минут твердый 85% гидроксид калия (КОН) в количестве 690 г. Первая порция гидроксида калия составляет 112 г. Добавление КОН осуществляют таким образом, чтобы температура в зоне реакции не превышала 25°C. Далее как в примере 1. Время стабильности полученного щелочного раствора пероксида водорода с использованием в указанных количествах в качестве стабилизатора сульфата магния и ортоборной кислоты составило 1778 минут. Потеря системой активного кислорода за 24 часа составила 5,0 л.
Пример 6
К 1000 мл водного 50% раствора пероксида водорода при непрерывном перемешивании добавляют 6,33 г сульфата магния (мольное соотношение MgSO4/H2O2=0,003). После его полного растворения добавляют 3,27 г ортоборной кислоты (мольное соотношение H3BO3/H2O2=0,003). Затем в полученный раствор вводят двумя порциями с интервалом в 25 минут твердый 85% гидроксид калия (КОН) в количестве 690 г. Первая порция гидроксида калия составляет 112 г. Добавление КОН осуществляют таким образом, чтобы температура в зоне реакции не превышала 25°C. Далее как в примере 1. Время стабильности полученного щелочного раствора пероксида водорода с использованием в указанных количествах в качестве стабилизатора сульфата магния и ортоборной кислоты составило 1921 минуту. Потеря системой активного кислорода за 24 часа составила 4,4 л.
Пример 7 (сравнительный)
Щелочной раствор пероксида водорода готовили, соблюдая технологические операции и мольное соотношение исходных компонентов, изложенные в Примере 2 патента №2538836, МПК C01B 15/037, 2015 г. Время стабильности полученного щелочного раствора пероксида водорода при использовании в качестве стабилизаторов суммарно 13,43 г тетрабората натрия и сульфата магния составило 552 минуты. Потеря системой активного кислорода за 24 часа составила 41,6 л.
Данные о времени стабильности щелочного раствора пероксида водорода, потере системой активного кислорода за 24 часа и массе используемых стабилизаторов на 1 л H2O2 по примерам 1-7 представлены в таблице.
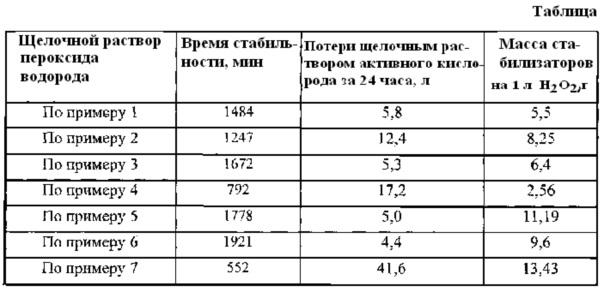
Как видно из представленных в таблице данных, предложенный способ стабилизации щелочного раствора пероксида водорода, используемого для последующего синтеза пероксидных соединений щелочных металлов и их композитных смесей, позволяет увеличить время стабильности раствора до 1921 минуты. При этом потеря системой активного кислорода за 24 часа не превышает 17,2 л (минимальная потеря щелочным раствором пероксида водорода за 24 часов при применении предложенного способа составляет 4,4 л), а максимальная суммарная масса стабилизаторов, обеспечивающая достижение этих параметров, не превышает 11,19 г на 1 литр Н2O2.

