Результат интеллектуальной деятельности: Пробиотический штамм Lactobacillus gasseri и его композиция с лактоферрином для профилактики диареи, некротизирующего энтероколита и сепсиса, вызываемых штаммами Escherichia coli у преждевременно рожденных детей
Вид РИД
Изобретение
Изобретение относится к биотехнологии и медицинской промышленности и может быть использовано в производстве бактериальных препаратов, предназначенных для профилактики диареи, некротизирующего энтероколита и сепсиса, вызываемых штаммами Escherichia coli у преждевременно рожденных детей.
У женщин репродуктивного возраста одной из основных причин невынашивания беременности и преждевременных родов являются урогенитальные инфекционные заболевания. Эти заболевания связаны с нарушениями микробиоценоза репродуктивной системы женщины. Они характеризуются снижением уровня вагинальных лактобацилл, контролирующих видовой состав данного биотопа и повышением уровня условно-патогенных микроорганизмов [Анкирская А., 1995; Reis А., 1997; Reid G., 2008; Кузьмин В., 2011; Прилепская В., Байрамова Г., 2011; Petrova М., 2015]. Поэтому преждевременно рождающийся ребенок при прохождении через родовые пути не получает необходимой для него микрофлоры, содержащейся обычно в репродуктивной системе здоровой матери. Это ведет к нарушению первого этапа вертикальной физиологической передачи микроорганизмов от матери к ребенку в микроэкологической системе мать-дитя. В норме при срочных родах ребенка сразу же прикладывают к груди матери. Установлено, что при срочных родах в грудных сосках матери накапливаются лактобациллы, которые при попадании в ротовую полость новорожденного в дальнейшем участвуют в формировании здорового микробиоценоза его пищеварительной системы (второй этап вертикальной передачи микроорганизмов от матери к ребенку в микроэкологической системе мать-дитя), в частности, стимулируют рост бифидобактерий и ускоряют процесс колонизации кишечника этими микроорганизмами, а также ингибируют процесс колонизации кишечника Escherichia coli [Martin R., et al., 2003]. При преждевременных родах в сосках матери отсутствует накопление лактобацилл, предназначенных для передачи ребенку, что свидетельствует о нарушении второго этапа вертикальной передачи микроорганизмов от матери к ребенку в микроэкологической системе мать-дитя. При срочных родах незамедлительное прикладывание ребенка к материнской груди стимулирует у матери процесс лактации и наполнение груди первоначальным молоком-молозивом. Молозиво содержит полифункциональный белок семейства трансферринов лактоферрин (ЛФ) в максимальной концентрации - 7 мг/мл [Masson P., Heremans J., 1971]. К моменту рождения ребенок еще не имеет собственной защиты от кишечных инфекций. Переданные от матери лактобациллы стимулируют созревание слизистой кишечника и формирование врожденного иммунитета новорожденного. ЛФ также стимулирует созревание слизистой ЖКТ, выполняет иммунологическую защиту и участвует в обеспечении гомеостаза ионов железа в тонком кишечнике. Основной механизм транспорта железа в тонком кишечнике осуществляется системой ДМТ-1 (транспортер 1 двухвалентных металлов), которая функционирует без участия ЛФ [AndrewsN, 2000; Fleming М., et al., 1997; Gunshin H., et al., 1997]. Избыток ионов железа в кишечнике новорожденного очень вреден, так как приводит к активации роста условно-патогенных и патогенных микроорганизмов, а также к разрушению интестинальных эпителиоцитов под воздействием окислительного стресса, индуцируемого свободными радикалами. ЛФ контролирует уровень ионов железа в кишечнике. Повышенная концентрация ЛФ в молозиве, а также значительное его содержание в грудном зрелом молоке (1 мг/мл) [Masson P., Heremans J., 1971] свидетельствуют о том, что этот белок относится к молекулярным факторам врожденного иммунитета и выполняет функции первой линии защиты слизистой поверхности различных органов, особенно ЖКТ новорожденного, от различных бактериальных, грибковых, вирусных патогенов. ЛФ защищает также интестинальные эпителиоциты от повреждений, вызываемых свободными радикалами [Hanson L., et al., 2002; Bellamy W., et al., 1993; Valenti P., Antonini G., 2005; Sanchez L., et al., 1992; Bullen J., 1972; Buldwin D., et al., 1984]. Первичная экспрессия гена ЛФ наблюдается на стадии 2-4 клеток раннего периода эмбрионального развития млекопитающих и продолжается до окончания стадии формирования бластоцисты. Дальнейшая экспрессия гена ЛФ прекращается вплоть до поздней стадии развития плода, когда этот белок начинает синтезироваться в эпителиальных клетках пищеварительной и дыхательной систем, а также в нейтрофилах крови [Ward P., et al., 1999]. Во взрослом организме животного ген ЛФ экспрессируется эпителиальными клетками внутренних желез с последующей секрецией белка в слизистую и в различные биологические жидкости. Экспрессия ЛФ в молочной железе контролируется гормоном пролактином, в репродуктивных органах - эстрогеном [Teng С., 2002]. Защита слизистой кишечника обеспечивается бактериостатическими свойствами ЛФ, которые обусловлены его способностью ограничивать потребление ионов железа патогеннымии и условно-патогенными микроорганизмами [SanchezL., et al., 1992]. ЛФ проявляет также прямую бактерицидную активность. Он связывается непосредственно с внешней мембраной грам-отрицательных бактерий, что приводит к быстрому освобождению микробного липополисахарида, последующему разрушению мембраны и гибели бактериальной клетки [Ellison R., et al., 1988]. ЛФ может проявлять антимикробные свойства посредством своей протеолитической активности. ЛФ гидролизует микробные белки-адгезины, которые играют ключевую роль при бактериальной колонизации кишечника энтеропатогенными штаммами Е. coli; Shigella flexneri; Haemophilus influenzae [Plant A., et al., 2003; Ochoa Т., et al., 2003; Gomez H., et al., 2003; Qiu J., et al., 1998].
Таким образом, ребенок, родившийся преждевременно, не получает от матери функциональной композиции, состоящей из лактобацилл и ЛФ, которая контролирует формирование нормальной микробиоты в его желудочно-кишечном тракте и оказывает профилактическое действие в отношении диареи, некротизирующего энтероколита и сепсиса, вызываемых штаммами Е. coli. Известен патент WO 2009118771 A2, в котором запатентован ЛФ человека, а также композиция, содержащая ЛФ человека и пробиотик Lactobacillus rhamnosus АТСС 53103(LGG), для производства лекарственного препарата в качестве средства профилактики диареи, некротизирующего энтероколита и сепсиса в комплексной терапии преждевременно рожденных детей. Недостатком вышеуказанного лекарственного препарата является отсутствие стимулирующего действия ЛФ на рост клеток L.rhamnosus АТСС 53103(LGG) в тонком кишечнике, что установлено в экспериментах на животных [ShermanM., et al., 2004].
Известен патент WO 2011051482 А1, в котором запатентованы композиции, содержащие человеческий или бычий ЛФ, пробиотики, пребиотики, комплекс витаминов и микроэлементов для производства лекарственных препаратов в качестве средств профилактики диареи, некротизирующего энтероколита и сепсиса в комплексной терапии преждевременно рожденных младенцев и детей, рожденных в срок. В запатентованных композициях в качестве пробиотических компонентов заявлены Lactobacillus rhamnosus CGMCC 1.3724, Bifidobacterium lactis CNCM 1-3446 (sold inter alia by the Christian Hansen company of Denmark), Bifidobacterium longum АТСС BAA-999 sold by Morinaga Milk Industry Co. Ltd. of Japan, Lactobacillus paracasei CNCM 1-2116, Lactobacillus johnsonii CNCM 1-1225, Lactobacillus fermentum VRI 003 sold by Probiomics (Australia), Bifidobacterium longum CNCM 1-2170, Bifidobacterium longum CNCM 1-2618, Bifidobacterium breve sold by Danisco (Denmark), Bifidobacterium breve sold by Morinaga (Japan) and the strain of Bifidobacterium breve sold by Institut Rosell (Lallemand), Lactobacillus paracasei CNCM 1-1292, Lactobacillus rhamnosus ATCC 53103 obtainable inter alia from Valio Oy of Finland, Enterococcus faecium SF 68. Предпочтительными для включения в лекарственные композиции заявлены штаммы Lactobacillus rhamnosus CGMCC 1.3724, а также штаммы Lactobacillus reuteri АТСС 55730, АТСС РТА 6475, АТСС РТА 4659 и АТСС РТА 5289, L. reuteri DSM 17938 company Biogaia АВ (Kungsbroplan 3А Stockholm, Sweden).
В приведенных выше патентах не включены в состав запатентованных препаратов штаммы лактобацилл, относящиеся к виду Lactobacillus gasseri. Штаммы этого вида обнаруживаются значительно чаще штаммов лактобацилл других видов в грудном молоке, в вагинальной микробиоте здоровых женщин репродуктивного возраста и в микроэкологической системе мать-дитя [Ravel. J., et al., 2011; Martin R., et al., 2003; Jeurin J.V., et al., 2013], что свидетельствует об эволюционной адаптации данного вида лактобацилл к естественному формированию композиции L. gasseri + ЛФ в грудном молоке матери. В связи с этим для совершенствования пробиотических лекарственных препаратов и питательных смесей, предназначенных для профилактики диареи, некротизирующего энтероколита и сепсиса у преждевременно рожденных детей, целесообразно также применять совместно с ЛФ штаммы L. gasseri, обладающие пробиотическими свойствами.
Задачей настоящего изобретения является расширение ассортимента пробиотических лекарственных препаратов для профилактики диареи, некротизирующего энтероколита и сепсиса, вызываемых штаммами Е. coli у преждевременно рожденных детей.
Поставленная задача решена тем, что получен пробиотический штамм L. gasseri ВКМ В-2918D, а также включающая его композиция L. gasseri ВКМ B-2918D + ЛФ для изготовления бактериальных препаратов, используемых для профилактики диареи, некротизирующего энтероколита и сепсиса, индуцируемых штаммами Е. coli у преждевременно рожденных детей. Штамм L. gasseri ВКМ B-2918D выделен из кала здорового ребенка в возрасте 10 дней при изучении видового спектра лактобацилл, циркулирующих в микроэкологической системе мать-дитя. Этот штамм высевался также из грудного молока и вагинального отделяемого матери. Штамм L. gasseri ВКМ B-2918D был идентифицирован методом секвенирования гена 16S rRNA и депонирован во Всероссийской коллекции микроорганизмов Института биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН, (Московская обл., г. Пущино).
Штамм Lactobacillus gasseri ВКМ B-2918D характеризуется следующими признаками.
Культурально-морфологические признаки.
При выращивании на поверхности агаризованной среды МРС рН-6,5 (Himedia, Индия) методом истощающего штриха в термостате при 37°C в течение 24-48 часов штамм L. gasseri ВКМ B-2918D образует колонии мелкие, бледно-белые, круглые, плоские с ровным краем.
При выращивании на жидкой среде МРС рН-6,5 (Himedia, Индия) или молоке при 37°C в течение 24-48 часов клетки штамма L. gasseri ВКМ B-2918D представляют собой грамположительные палочки размером ~5-6 мкм, образуют цепочки.
Физиолого-биологические признаки.
Штамм L. gasseri ВКМ B-2918D является факультативным анаэробом, температурный оптимум 37±2°C, растет при 42°C, слабый рост при 30°C. Оптимальное значение pH среды 5,5-6,2.
Биохимические свойства.
Способность штамма L. gasseri ВКМ B-2918D ферментировать углеводы оценивают в API-тесте в соответствии с инструкцией фирмы производителя (BioMerieux, Франция).
Штамм L. gasseri ВКМ B-2918D усваивает D-глюкозу, D-фруктозу, N-ацетилглюкозамин, D-сахарозу, D-трегалозу, подвергает гидролизу эскулин.
Чувствительность к антибиотикам.
Штамм L. gasseri ВКМ B-2918D чувствителен к гентамицину, хлорамфениколу, офлоксацину, тетрациклину и устойчив к ванкомицину.
Способ, условия и состав питательных сред для размножения штамма Lactobacillus gasseri ВКМ B-2918D.
Штамм L. gasseri ВКМ B-2918D выращивают при 37±2°C на жидкой среде МРС или в обезжиренном молоке (0,01-0,03% жира).
Коммерчески приобретенное обезжиренное молоко (0,01-0,03% жира) стерилизуют 20 минут автоклавированием при давлении 0.5 атм и температуре 110°C.
Для выращивания изолированных колоний штамма L. gasseri ВКМ B-2918D используют агаризованную среду МРС, содержащую 1,4% агара (Difco, США).
Способ, условия и состав сред для хранения штамма Lactobacillus gasseri ВКМ В-2918D.
Штамм L. gasseri ВКМ B-2918D может храниться:
- в стерильном обезжиренном молоке при 4°C с периодическим пересевом 1 раз в 15-20 дней;
- в лиофилизированном состоянии в запаянных ампулах (защитная среда при высушивании - сахароза 10%, pH 7,0 или стерильное обезжиренное молоко) в течение 2-х лет при температуре 4°C.
Заявленное решение иллюстрируется следующими фигурами:
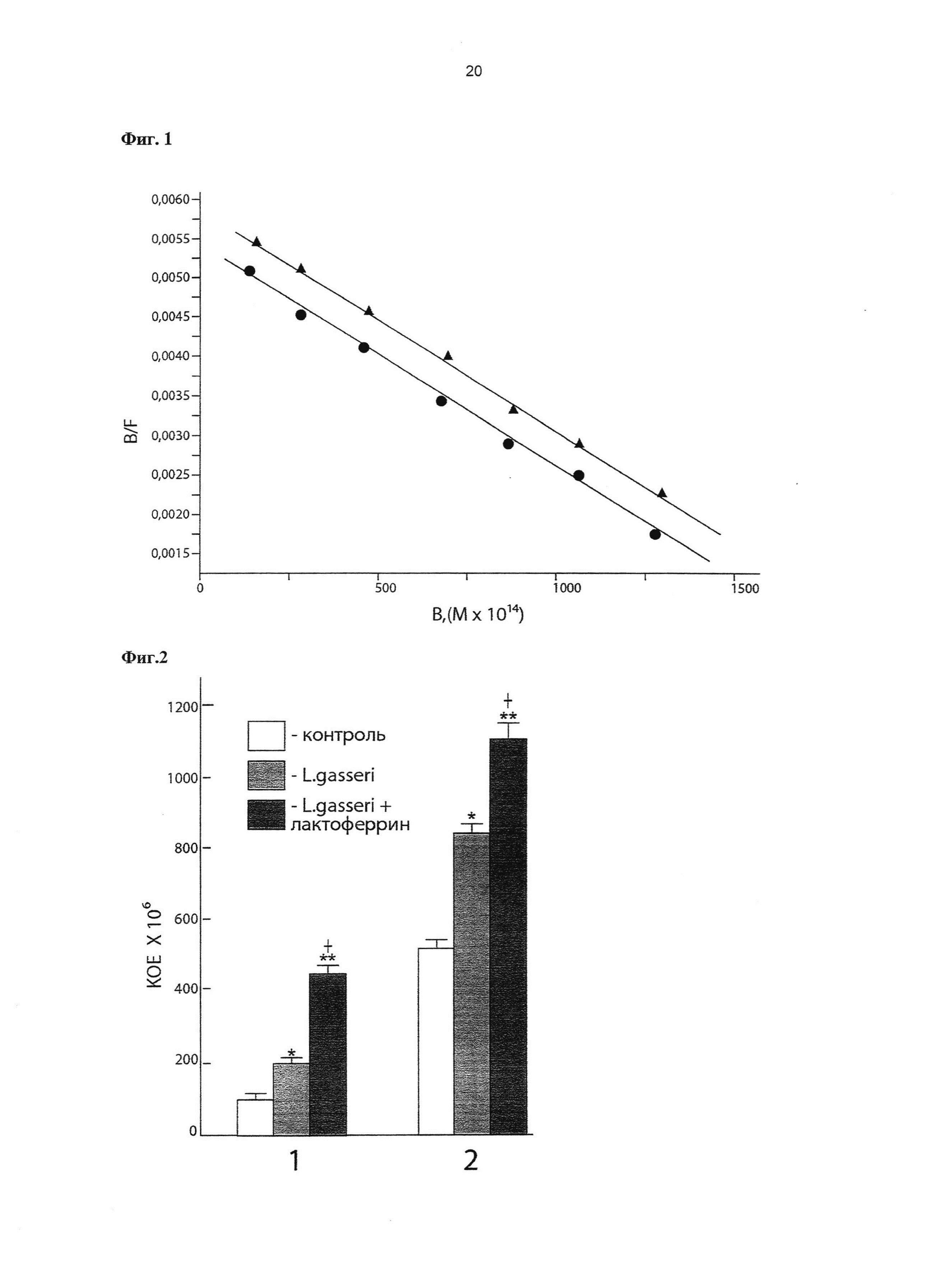
Фиг. 1. Анализ в координатах Скэтчарда специфического связывание 125I-ЛФ с эпителиальными клетками Сасо-2.
По оси абсцисс: количество связавшегося меченого ЛФ с клетками (в молях). По оси ординат: отношение концентрации связавшегося и свободного меченого ЛФ. • - интактные клетки Сасо-2 (выращенные в среде ДМЕМ, контроль),  - активированные клетки Сасо-2 (выращенные в среде ДМЕМ с добавкой культуральной жидкости штамма Lactobacillus gasseri ВКМ B-2918D).
- активированные клетки Сасо-2 (выращенные в среде ДМЕМ с добавкой культуральной жидкости штамма Lactobacillus gasseri ВКМ B-2918D).
Примечание: в опытах использован ЛФ человека (Sigma, США).
Фиг. 2. Влияние Lactobacillus gasseri ВКМ B-2918D и композиции, содержащей Lactobacillus gasseri ВКМ B-2918D + ЛФ на рост молочнокислых бактерий в различных отделах тонкого кишечника новорожденных крысят.
1 - проксимальный отдел (тощая кишка), 2 - дистальный отдел (подвздошная кишка). По оси ординат - рост молочнокислых бактерий из гомогенатов различных отделов тонкого кишечника, выраженный в КОЕ в пересчете на грамм отдела кишечника / см длины отдела кишечника. Контроль - интактные крысята. * - p<0,05 достоверность различий между интактной группой и группой крысят, получавших штамм L. gasseri ВКМ В-2918D; ** - p<0,01 достоверность различий между контрольной группой и крысятами получавшими композицию, содержащую L. gasseri ВКМ B-2918D + ЛФ;  - p<0,05 достоверность различий между группами крысят, получавшими штамм L. gasseri ВКМ В-2918D и получавшими композицию, содержащую L. gasseri ВКМ B-2918D + ЛФ.
- p<0,05 достоверность различий между группами крысят, получавшими штамм L. gasseri ВКМ В-2918D и получавшими композицию, содержащую L. gasseri ВКМ B-2918D + ЛФ.
Примечание: в опытах использован ЛФ человека (Sigma, США).
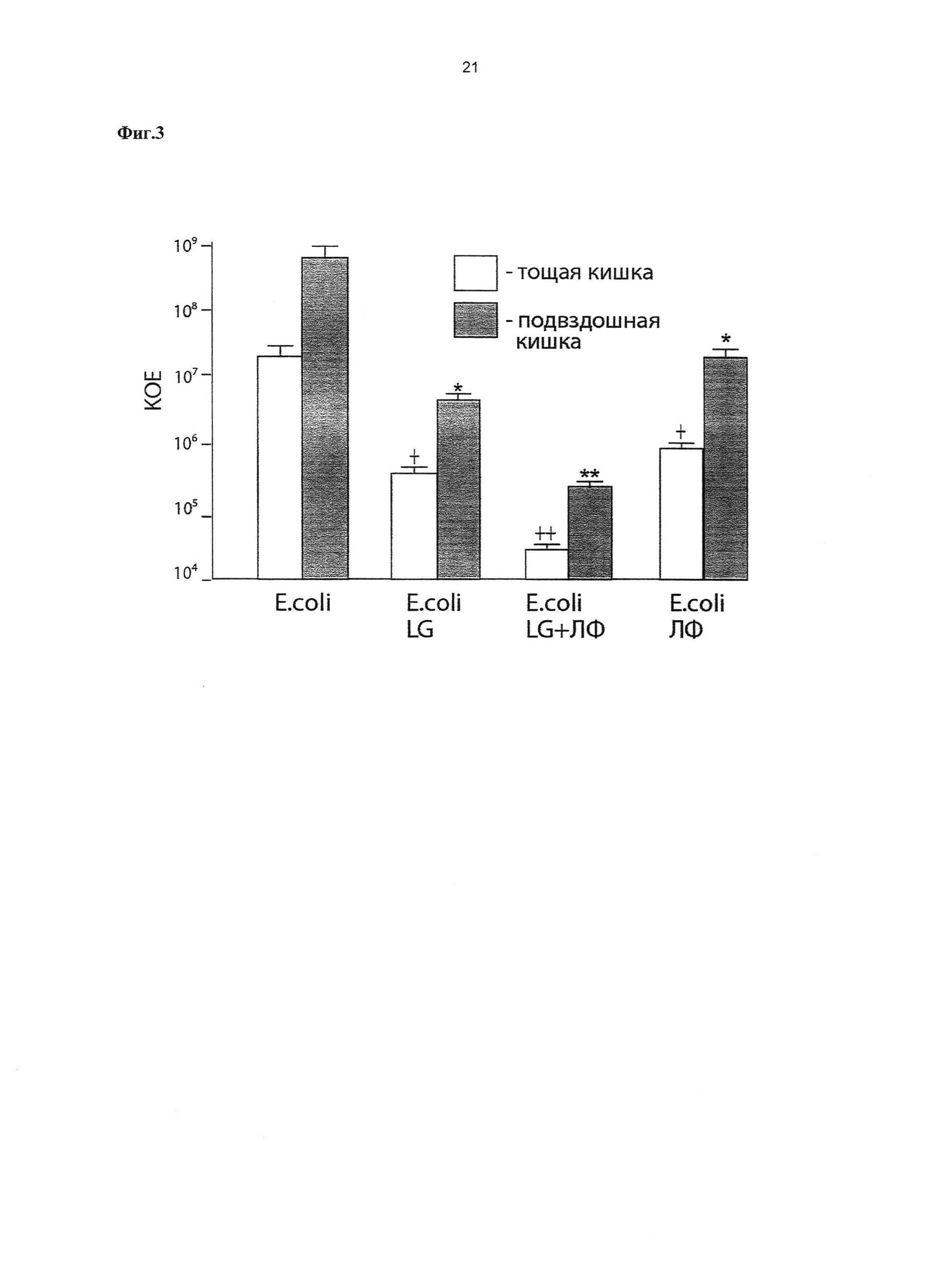
Фиг. 3. Эффективность ингибирования роста Escherichia coli в различных отделах тонкого кишечника крысят, получивших интрагастрально Lactobacillus gasseri ВКМ В-2918D, композицию, содержащую Lactobacillus gasseri ВКМ B-2918D + ЛФ, препарат ЛФ.
По оси ординат - рост Е. coli из гомогенатов различных отделов тонкого кишечника, выраженный в КОЕ в пересчете на грамм отдела кишечника/см длины отдела кишечника.
 - p<0,05 достоверность различий между уровнем Е. coli в тощей кишке в контроле и у крысят, получивших профилактическую дозу штамма L. gasseri ВКМ B-2918D (LG) или профилактическую дозу препарата ЛФ;
- p<0,05 достоверность различий между уровнем Е. coli в тощей кишке в контроле и у крысят, получивших профилактическую дозу штамма L. gasseri ВКМ B-2918D (LG) или профилактическую дозу препарата ЛФ; 
 - p<0,01 достоверность различий между уровнем Е. coli в тощей кишке в контроле и у крысят, получивших профилактическую дозу композиции, содержащей Lactobacillus gasseri ВКМ B-2918D + ЛФ; * - p<0,05 достоверность различий между уровнем Е. coli в подвздошной кишке в контроле и у крысят, получивших профилактическую дозу штамма L. gasseri ВКМ B-2918D (LG) или профилактическую дозу препарата ЛФ; ** - p<0,01 достоверность различий между уровнем Е. coli в подвздошной кишке в контроле и у крысят, получивших профилактическую дозу композиции, содержащей Lactobacillus gasseri ВКМ B-2918D + ЛФ.
- p<0,01 достоверность различий между уровнем Е. coli в тощей кишке в контроле и у крысят, получивших профилактическую дозу композиции, содержащей Lactobacillus gasseri ВКМ B-2918D + ЛФ; * - p<0,05 достоверность различий между уровнем Е. coli в подвздошной кишке в контроле и у крысят, получивших профилактическую дозу штамма L. gasseri ВКМ B-2918D (LG) или профилактическую дозу препарата ЛФ; ** - p<0,01 достоверность различий между уровнем Е. coli в подвздошной кишке в контроле и у крысят, получивших профилактическую дозу композиции, содержащей Lactobacillus gasseri ВКМ B-2918D + ЛФ.
Примечание: в опытах использован ЛФ человека (Sigma, США).
Изобретение поясняется следующими примерами.
Пример 1. Культивирование штамма Lactobacillus gasseri ВКМ B-2918D в лабораторных условиях.
Для получения посевного материала в ампулу, содержащую 10 мг лиофилизированной культуры штамма L. gasseri ВКМ B-2918D, добавляют 0,5 мл стерильного раствора натрия хлорида 0,9% и выращивают культуру на поверхности агаризованной среды МРС методом истощающего штриха в термостате при 37°C в течение 18 часов. Затем изолированную колонию помещают в бактериологическую пробирку, содержащую 7 мл жидкой среды МРС, и выращивают в термостате при 37°C в течение 15 часов.
Полученный посевной материал в количестве 1% вносят во флаконы, содержащие 500 мл жидкой среды МРС, и выращивают при 37°C в течение 18 часов. Получают культуру с титром 0,5×109 КОЕ/мл. Путем доведения концентрации клеток до 1,0×109 КОЕ/мл получают стандартизованную стартовую биомассу штамма L. gasseri ВКМ B-2918D.
Для длительного хранения клетки освобождают от компонентов среды выращивания путем центрифугирования, переводят в среду высушивания (защитная среда при высушивании - стерильное обезжиренное молоко), расфасовывают по 1 мл в пенициллиновые флаконы и лиофилизируют. В лиофильно высушенном состоянии стартовая биомасса может храниться в течение двух лет при температуре 4°C.
Пример 2. Исследование устойчивости штамма Lactobacillus gasseri ВКМ B-2918D к желудочному и кишечному стрессам (способность расти в среде с низким значением pH или в среде, содержащей желчь).
При исследовании используют следующие методики.
Имитация желудочного стресса in vitro
Композиция искусственного желудочного сока:
|
1 мл искусственного желудочного сока добавляют к 100 мкл культуры в стационарной фазе (1/11 разведение). Культуру инкубируют в течение 10 минут, 30 минут и 60 минут при 37°C, 10% CO2. В качестве контроля вместо искусственного желудочного сока используют 1 мл МРС. Измерения выполняют в двух повторах.
После инкубаций культуру (каждую повторность и контроль) разводят от 102 до 1010 в МРС, разведения высевают на чашках с МРС-агаром и инкубируют в течение 24-48 часов при 37°C, 10% CO2). Определяют титр культуры в условиях стресса и без стресса путем подсчета количества колоний для разведений.
Имитация кишечного стресса in vitro
Композиция искусственного кишечного сока:
желчные соли (желчь свиньи Sigma В8631) 3,3 г/л (конечная концентрация: 0.3%),
карбонатный буфер NaHCO3 (Sigma S8875) 16.5 г/л (конечная концентрация: 1.5%) pH: 6.3.
1 мл искусственного кишечного сока добавляют к 100 мкл культуры в стационарной фазе (1/11 разведение). Культуру инкубируют в течение 5 часов при 37°C, 10% CO2. В качестве контроля используют 1 мл МРС. Измерения выполняют в двух повторах.
Культуру и контроль разводят от 102 до 1010 в МРС, разведения высевают на чашках с МРС-агаром и инкубируют в течение 24-48 часов при 37°C, 10% CO2. Определяют титр в условиях стресса и без стресса путем подсчета количества колоний для разведений.
Подсчет микроорганизмов в миллилитре культуры КОЕ осуществляют по формуле:
ΣC/(n1+0.1 n2)d
где: ΣС - сумма всех характерных колоний, подсчитанных на всех чашках, содержащих от 15 до 300 колоний;
n1 - количество чашек, в самом низком разведении (2 чашки на разведение);
n2 - количество чашек, в самом высоком разведении (2 чашки на разведение);
d - величина первого разведения (низкое разведение), взятого для подсчета.
Для определения устойчивости лактобацилл к желудочному и кишечному стрессам используют культуры в стационарной фазе роста, выращенные на жидкой среде МРС, рН-6,5 в течение 18 часов при 37°C, 10% CO2.
Результаты, приведенные в табл. 1 показывают, что штамм L. gasseri ВКМ B-2918D является устойчивыми к желудочному и кишечному стрессам.

Пример 3. Исследование антагонистической активности штамма Lactobacillus gasseri ВКМ B-2918D в отношении энтеропатогенных штаммов Escherichia coli.
Исследование антагонистической активности проводят методом двухслойного агара [Ермоленко Е. и соавт., 2004] с использованием индикаторных культур E. coli.
Антагонистическую активность лактобацилл определяют по зоне задержки роста индикаторных штаммов вокруг колоний отдельных штаммов лактобацилл.
Результаты исследований приведены в таблице 2.
Полученные результаты свидетельствуют о том, что заявляемый штамм L. gasseri ВКМ B-2918D проявляет выраженную антагонистическую активность по отношению к штаммам E. coli.

Пример 4. Исследование адгезии Lactobacillus gasseri ВКМ B-2918D на эпителиальных клетках Сасо-2 тонкого кишечника человека.
Адгезивность пробиотических лактобацилл рассматривается как положительный признак, позволяющий обеспечить защиту ЖКТ от патогенных и условно-патогенных микроорганизмов. Пробиотические лактобациллы, предназначенные для профилактики и комплексного лечения кишечных инфекционных заболеваний должны обладать адгезивностью к энтероцитам человека.
Оценку способности лактобацилл к адгезии на перевиваемой линии клеток Сасо-2 тонкого кишечника человека проводят по методу, описанному в работе [Coconnier et al., 1993].
Сасо-2 выращивают в среде ДМЕМ, содержащей добавки (10% фетальная сыворотка теленка, 1% пенициллин-стрептомицин, 0,2 мМ Hepes, 2 мМ L-глутамин) при 37°C в CO2-инкубаторе. Клетки Сасо-2 в концентрации 3,0×105 кл/мл высевают на 24-луночные планшеты и культивируют при 37°C в CO2-инкубаторе. По достижении 70-80% монослоя клетки промывают 3-х кратно средой ДМЕМ без добавок, затем к ним добавляют среду ДМЕМ с L-глутамином и используют их для оценки адгезивных свойств лактобацилл. Лактобациллы L. gasseri ВКМ B-2918D (опыт) и L. rhamnosus АТСС 53103 (LGG), использованный в качестве препарата сравнения, выращивают (каждый штамм в двух пробирках) в МРС среде при при 37°C в течение 16 часов. Затем в одну из пробирок каждого штамма вносят ЛФ до конечной концентрации 0,25 мг/мл и продолжают культивирование еще 2 часа. Затем лактобациллы дважды промывают PBS pH 7,2 путем центрифугирования при 5000 об/мин в течение 15 минут и ресуспендируют в среде ДМЕМ с L-глутамином. Концентрацию лактобацилл определяют по оптической плотности (ODλ=590 нм) и контролируют высевом на агаризованную среду МРС. Множественность инфицирования (MOI) составляет 100 бактерий/клетка. Клетки Сасо-2 с внесенными к ним лактобациллами инкубируют еще 5 часов при 37°C в CO2-инкубаторе. После инкубации клетки Сасо-2 промывают 3-кратно PBS pH 7,2, затем фиксируют в холодном этаноле (3 мин) и окрашивают красителем Романовского-Гимза в течение 30 мин. Далее планшеты промывают дистиллированной водой, высушивают при комнатной температуре и исследуют микроскопически. Адгезию лактобацилл на эпителиальных клетках Сасо-2 оценивают по двум показателям.
1. Активность адгезии - количество эпителиоцитов с адгезированными лактобациллами из 100 посчитанных эпителиоцитов, %.
2. Адгезивное число - среднее количество лактобацилл, адгезированных на одной эпителиальной клетке, усл. ед.
Результаты исследований по оценке способности L. gasseri ВКМ B-2918D и L. rhamnosus АТСС 53103 (LGG) к адгезии на поверхности эпителиальных клеток Сасо-2 суммированы в Таблице 3. Внесение ЛФ в культуральную среду МРС в процессе культивирования L. gasseri ВКМ B-2918D достоверно повышает способность лактобацилл этого штамма к адгезии на поверхности эпителиальных клеток Сасо-2 и не влияет на показатели адгезии штамма L. rhamnosus АТСС 53103 (LGG). Полученные результаты in vitro позволяют предположить, что в системе in vivo ЛФ будет стимулировать адгезию клеток штамма L. gasseri ВКМ B-2918D на поверхности эпителиоцитов тонкого кишечника.


Пример 5. Оценка специфического взаимодействия 125I-ЛФ с рецепторами на поверхности перевиваемых эпителиальных клеток Сасо-2 тонкого кишечника человека. Для определения параметров специфического связывания 125I-ЛФ с эпителиальными клетками Сасо-2 строят график зависимости отношения молярной концентрации связанного меченого 125I-ЛФ и свободного меченого 125I-ЛФ (B/F) от молярной концентрации связанного меченого 125I-ЛФ (В) [Ткачук В.А., 1983]. Специфическое связывание 125I-ЛФ с клетками Сасо-2 оценивают по разности между его «общим» связыванием (меченый 125I-ЛФ + клетки Сасо-2) и «неспецифическим» связыванием (меченый 125I-ЛФ + клетки Сасо-2 + немеченый ЛФ). Для получения 125I-ЛФ используют радиоактивную метку 30Na125I (Amersham) и реагент для ввода метки в белок Iodo-Gen (Picrce, Rockford, IL). Меченый белок отделяют от свободной метки с помощью хроматографии на Sephadex G-25.
Клетки Сасо-2 (интактные клетки, контроль) выращивают в среде DMEM, содержащей добавки (10% фетальной сыворотка теленка, 1% пенициллин-стрептомицин, 0,2 мМ Hepes, 2 мМ L-глутамин) при 37°C в CO2-инкубаторе в течение 24 часов. В планшеты, содержащие клетки Сасо-2 опытной группы, через 18 часов выращивания вносят 50 мкл культуральной жидкости штамма L. gasseri ВКМ B-2918D и продолжают их выращивать в CO2 инкубаторе еще 4 часа. Общее время выращивания клеток Сасо-2 опытной и контрольной групп составляет 24 часа. Клетки опытной и контрольной групп 3-кратно промывают стерильным 50 mM трис-буфером, содержащим 0,15 М NaCl, pH 7,5 и используют для изучения рецепции 125I-ЛФ. Реакцию связывания меченого 125I-ЛФ с клетками Сасо-2 проводят при 4°C в течение 30 минут в 50 mМ трис- буфере, содержащем 0,15 М NaCl, pH 7,5. Результаты оценки специфического связывания представлены на Фиг. 1. Специфическое взаимодействие 125I-ЛФ с высокоаффинными рецепторами на поверхности клеток Сасо-2 характеризуется Kd=(1,7±0,5)×10-9 М. Добавление культуральной жидкости штамма L. gasseri ВКМ B-2918D к клеткам Сасо-2 опытной группы 2 в процессе их выращивания увеличивает количество сайтов специфического связывания 125I-ЛФ. Эти данные свидетельствуют о том, что штамм L. gasseri ВКМ B-2918D способен повышать колонизационную резистентность эпителиоцитов тонкого кишечника человека путем стимуляции экранирования их поверхности с помощью молекулярного фактора врожденного иммунитета - ЛФ.
Пример 6. Оценка способности штамма Lactobacillus gasseri ВКМ B-2918D и композиции содержащей штамм Lactobacillus gasseri ВКМ B-2918D + ЛФ колонизовать различные отделы тонкого кишечника новорожденных крысят.
В опытах используют крыс самок линии Вистар и крысят в двухдневном возрасте.
Крысиную модель применяют в связи с тем, что в молоке крысы не содержится ЛФ [Masson P.L., Heremans J.F., 1971]. Крысят разделяют на три группы по 6 животных в каждой. Первой группе крысят вводят интрагастрально культуру штамма L. gasseri ВКМ B-2918D в дозе 107 КОЕ/кг на третий и четвертый день от рождения. Второй группе крысят вводят интрагастрально на третий и четвертый день от рождения композицию, содержащую 107 КОЕ/кг L. gasseri ВКМ B-2918D + ЛФ (500 мг/кг/день) (Sigma, CШA). Третья группа крысят служит интактным контролем. На пятый день крысятам проводят эвтаназию, выделяют тонкий кишечник и разделяют его на проксимальный отдел (тощая кишка) и дистальный отдел (подвздошная кишка). Обе части тонкой кишки промывают стерильным физиологическим раствором и гомогенизируют в 1 мл физиологического раствора. Гомогенаты проксимального и дистального отделов тонкой кишки высевают на МРС агар, Himedia, Индия. Культивирование проводят в CO2 инкубаторе в атмосфере 5% CO2 при 37°C в течение 72 часов. Содержание молочнокислых бактерий в гомогенатах различных отделов тонкого кишечника выражают в КОЕ в пересчете на грамм отдела кишечника/см длины отдела кишечника. Результаты исследований приведены на Фиг. 2. В опытных группах крысят после проведенной энтеральной терапии с помощью L. gasseri ВКМ B-2918D или композиции, содержащей штамм L. gasseri ВКМ B-2918D + ЛФ достоверно увеличивалось содержание молочнокислых бактерий на пятый день жизни по сравнению с контрольной группой животных. ЛФ стимулировал рост молочнокислых бактерий в различных отделах тонкого кишечника. В группе контрольных животных на пятый день жизни в гомогенатах тонкого кишечника обнаруживались молочнокислые бактерии, идентифицированные методом секвенирования гена 16 SrRNA как Lactococcus. В опытных группах животных в гомогенатах проксимального и дистального отделов тонкого кишечника обнаруживался штамм L. gasseri. В гомогенатах тонкого кишечника крысят контрольной группы штамм L. gasseri не обнаруживался.
Пример 7. Оценка способности штамма Lactobacillus gasseri ВКМ B-2918D и композиции, содержащей штамм Lactobacillus gasseri ВКМ B-2918D + ЛФ ингибировать рост Escherichia coli АТСС 25922 в тонком кишечнике новорожденных крысят.
В опытах используют крыс самок линии Вистар и крысят в двухдневном возрасте. Крысят разделяют на четыре группы по 6 животных в каждой. Крысятам первой опытной группы на третий и четвертый день вводят интрагастрально культуру штамма L. gasseri ВКМ В-2918D в дозе 107 КОЕ/кг. Крысятам второй опытной группы на третий и четвертый день вводят интрагастрально композицию, содержащую 107 КОЕ/кг L. gasseri ВКМ B-2918D + ЛФ (500 мг/кг/день) (Sigma, CШA). Крысятам третьей опытной группы на третий и четвертый день вводят интрагастрально ЛФ (500 мг/кг/день) (Sigma, CШA). Крысята четвертой группы служат интактным контролем. На пятый день всех крысят инфицируют путем интрагастрального введения Е. coli АТСС 25922 в дозе 1012 КОЕ/кг. Через 16 часов после инфицирования крысятам проводят эвтаназию, выделяют проксимальный и дистальный отделы тонкого кишечника, промывают стерильным физиологическим раствором и готовят гомогенаты в 1 мл физиологического раствора. Гомогенаты высевают на агаризованную селективную среду и культивируют в термостате 48 ч при 37°C. Содержание Е. coli выражают в КОЕ в пересчете на грамм отдела кишечника/см длины отдела кишечника. Результаты исследований приведены на Фиг. 3. В гомогенатах различных отделов тонкого кишечника опытных групп крысят, получивших интрагастрально профилактическую дозу штамма L. gasseri ВКМ B-2918D, профилактическую дозу композиции, содержащей штамм L. gasseri ВКМ B-2918D + ЛФ или профилактическую дозу ЛФ было обнаружено достоверное снижение числа Е. coli по сравнению с контрольной группой. Наиболее эффективное ингибирование роста Е. coli в тонком кишечнике отмечалось в группе крысят, получивших интрагастрально профилактическую дозу композиции, содержащей штамм L. gasseri BКM B-2918D + ЛФ. Результаты исследований свидетельствуют о перспективности использования штамма L. gasseri ВКМ B-2918D и композиции, содержащей штамм L. gasseri ВКМ B-2918D + ЛФ в качестве основы с целью создания пробиотических препаратов для профилактики диареи, некротизирующего колита и сепсиса, вызываемых штаммами E. coli у преждевременно рожденных детей.
Литература.
1. Анкирская А.С. Бактериальные вагинозы. Акушерство и гинекология, 1995. №6, 13-16.
2. Ries A.J. Treatment of vaginal infections: candidiasis, bacterial vaginosis, and trichomoniasis. J Am Pharm Assoc (Wash). 1997 Sep-Oct; NS37 (5): 563-9.
3. Reid G. Probiotic Lactobacilli for urogenital health in women. J. Clin. Gastroenterol. 2008. Sep; 42 Suppl 3 Pt 2: S234-6.2008.
4. Кузьмин В. Фетоплацентарная недостаточность: проблема современного акушерства. Лечащий врач, 2011, 3, 2-9.
5. Прилепская В., Байрамова Г. Вульвовагинальный кандидоз: клиника, диагностика, принципы терапии. М.: Из-во «ГЭОТАР-Медиа», 2010, 80 с.
6. Petrova MI, Lievens Е, Malik S, Imholz N and Lebeer S. 2015. Lactobacillus species as biomarkers and agents that can promote various aspects of vaginal health. Front. Physiol. 6:81. doi: 10.3389/fphys.2015.00081.
7. Martin R, Langa S, Revirieqo C, Jiminez E, Marin ML, Xaus J, Fernandez L, Rodriguez JM. Human milk is a source of lactic acid bacteria for the infant gut. J Pediatr. 2003 Dec; 143 (6); 754-8.
8. Masson P.L. and Heremans J.F. Lactoferrin in milk from different species. Comp Biochem Physiol 39B: 119-129, 1971.
9. Andrews N.C. (2000) Iron homeostasis: insights from genetics and animal models. Nat. Rev. Genet. 1: 208-217.
10. Fleming M.D., Trenor С.C. 3rd, Su M.A., Foernzler D., Beier D.R., Dietrich W.F. et al. (1997) Microcytic anaemia mice have a mutation in Nramp2, a candidate iron transporter gene. Nat. Genet. 16: 383-386.
11. Gunshin H., Mackenzie В., Berger U.V., Gunshin Y., Romero M.F., Boron W.F. et al. (1997) Cloning and characterization of a mammalian proton-coupled metal-ion transporter. Nature 388: 482-488.
12. Hanson, L.A.; Korotkova, M. The role of breastfeeding in prevention of neonatal infection. Semin. Neonatol., 2002, 7, 275-281.
13. Bellamy, W.; Wakabayashi, H.; Takase, M.; Kawase, K.; Shimamura, S.; Tomita, M. Killing of Candida albicans by lactoferricin B, a potent antimicrobial peptide derived from the N-terminal region of bovine lactoferrin. Med Microbiol. Immunol, 1993, 182, 97-105.
14. Valenti, P.; Antonini, G. Lactoferrin: an important host defence against microbial and viral attack. Cell Mol. Life Sci., 2005, 62, 2576-2587.
15. Sanchez L., Calvo M. and Brock J. H. Biological role of lactoferrin. Arch. Dis. Child. 1992, 67: 657-661.
16. Bullen J.J. Iron-binding proteins in milk and resistance to Escherichia coli infection in infants. Proc. R. Soc. Med. 1972, 65: 1086.
17. Baldwin D.A., Jenny E.R., Aisen P. The effect of human serum transferrin and milk lactoferrin on hydroxyl radical formation from superoxide and hydrogen peroxide. J. Biol. Chem. 1984, 259: 13391-13394.
18. Ward P.P., Mendoza-Meneses M., Mulac-Jericevic В., Cunningham G.A., Saucedo-Cardenas O., Teng С.T. et al. Restricted spatiotemporal expression of lactoferrin during murine embryonic development. Endocrinology. 1999, 140: 1852-1860.
19. Teng С.T. Lactoferrin gene expression and regulation: an overview. Biochem. Cell Biol. 2002, 80: 7-16.
20. Ellison R.T. 3rd, Giehl T. J. and LaForce F.M. Damage of the outer membrane of enteric gram-negative bacteria by lactoferrin and transferrin. Infect. Immun. 1988, 56: 2774-2781.
21. Plaut A.G., Qiu J. and St Geme J. W. 3rd. Human lactoferrin proteolytic activity: analysis of the cleaved region in the IgA protease of Haemophilus infl uenzae. Vaccine. 2000, 19 Suppl. 1: S148-152.
22. Gomez H.F., Ochoa T.J., Carlin L.G. and Cleary T.G. Human lactoferrin impairs virulence of Shigella fl exneri. J. Infect. Dis. 2003, 187: 87-95.
23. Ochoa T.J., Noguera-Obenza M., Ebel F., Guzman C.A., Gomez H.F. and Cleary T.G. Lactoferrin impairs type III secretory system function in enteropathogenic Escherichia coli. Infect Immun. 2003, 71: 5149-5155.
24. Qiu J., Hendrixson D.R., Baker E.N., Murphy T.F., St Geme J.W. 3rd and Plaut A.G. Human milk lactoferrin inactivates two putative colonization factors expressed by Haemophilus infl uenzae. Proc. Natl. Acad. Sci. USA. 1998, 95: 12641-12646.
25. Patent WO 2009118771 A2.
26. Sherman, M.P., Bennett, S.H., Hwang, F.F. et al. Neonatal small bowel epithelia: enhancing anti-bacterial defense with lactoferrin and Lactobacillus GG. Biometals. 2004, 17: 285. doi:10.1023/B:BIOM.0000027706.51112.62.
27. Patent WO 2011051482 A1.
28. Ravel J., Gajer P., Abdo Z., Schneider G.M., et al. Vaginal microbiome of reproductive-age women. PNAS. March 15, 2011, 108, suppl. 1, 4680-4687.
29. Jeurink P.V., J. van Bergenhenegouwen, E. Jimenez, L.M.J. Knippels, L. Fernandez, J. Garssen, J. Knol, J.M. Rodriguez and R. Martin. Human milk: a source of more life than we imagine. Beneficial Microbes, March 2013: 4 (1): 17-30.
30. Ермоленко Е.И., Исаков B.A., Ждан-Пушкина С.X., Тец В.В. Количественная оценка антагонистической активности лактобацилл. // Журн. микробиол., эпидем., иммунобиол. - 2004. - 5. - С. 94-98.
31. Coconnier М.-Н., Bernet M.-F., Kerneis S., Chauviere G., J. Fourniat J., A.L. Servin A.L. Inhibition of adhesion of enteroinvasive pathogens to human intestinal Caco-2 cells by Lactobacillus acidophilus strain LB decreases bacterial invasion. FEMS Microbiology Letters, 1993. vol. 110, no. 3, pp. 299-305.
32. Ткачук В.А. Введение в молекулярную эндокринологию. - М.: МГУб, 1983г. 256 с.