Результат интеллектуальной деятельности: Способ прогнозирования прогрессирования рака пищевода
Вид РИД
Изобретение
Изобретение относится к медицине, а именно к онкологии, и может быть использовано при лечении рака пищевода для прогнозирования развития его прогрессирования.
Из литературных источников известно, что иммунологическое микроокружение злокачественных опухолей неодинаково при различной локализации, гистологической характеристике (см. О.И. Кит, Е.Ю. Златник, Е.А. Никипелова, И.А. Новикова, Ю.А. Геворкян. Влияние гистологического строения и органного окружения на факторы локального иммунитета при раке желудка и толстой кишки // Международный журнал экспериментального образования. Медицинские науки. 2014. №1. С. 76-79), стадии и плоидности опухоли (см. О.И. Кит, Е.Ю. Златник, Е.А. Никипелова, И.А. Новикова, А.В. Бахтин, О.Н. Селютина. Взаимоотношения плоидности и параметров локального иммунитета при опухолях толстой кишки. Молекулярная медицина. 2016. №1. С. 26-30; см. O.I. Kit, Е.А. Nikipelova, E. Yu. Zlatnik, A.V. Shaposhnikov, LA. Novikova, R.E. Tolmakh. Local cell-mediated immunity in stage III and IV colon cancer // 2014 ASCO Annual Meeting May 30-June 3 2014 - published on Meeting Library (http://meetinglibrary.asco.org) e 22097) и других факторах, определяющих прогноз заболевания, что позволяет рассматривать особенности тканевого субпопуляционного состава лимфоцитов в прогностическом аспекте.
По данным литературы рак пищевода характеризуется усилением инфильтрации опухоли Т-регуляторными лимфоцитами (Т regs) при более распространенных стадиях заболевания (см. Kono K, Kawaida Н, Takahashi A, et al. CD4+CD25high regulatory T cells increase with tumour stage in patients with gastric and oesophageal cancers. Cancer Immunol Immunother, 2006; 55: 1064-71); снижением количества CD4+ лимфоцитов в микроокружении опухоли при снижении степени ее дифференцировки (см. А.Ю. Максимов, Е.Ю. Златник, И.А. Новикова, Г.И. Закора, О.И. Кит, Е.Н. Колесников, B.C. Трифанов, О.Н. Селютина, А.Л. Базаев. Факторы локального иммунитета при раке пищевода разной степени дифференцировки. Современные проблемы науки и образования. - 2015. - №6; URL: http://www.science-education.ru/128-22552), однако остается неясным наличие или отсутствие вклада особенностей локального иммунитета в развитие клинического эффекта при раке пищевода (см. Yoshioka Т, Miyamoto М, Cho Y, et al. Infiltrating regulatory T cell numbers is not a factor to predict patient's survival in oesophageal squamous cell cancer. Br J Cancer, 2008; 98: 1258-63; см. Cho Y., Miyamoto M., Kato K., et al. CD4+ and CD8+ T cells cooperate to improve prognosis of patients with oesophageal squamous cell carcinoma. Cancer Res, 2003; 63: 1555-9).
Тем не менее, такой вклад описан при других злокачественных опухолях: раке поджелудочной и молочной желез (см. Liyanage U.K., Moore Т.Т, Joo H.G. et al. Prevalence of regulatory T cells is increased in peripheral blood and tumor microenvironment of patients with pancreas or breast adenocarcinoma. J Immunol, 2002; 169: 2756-61; см. Bates G.J., Fox S.B., Han C. et al. Quantification of regulatory T cells enables the identification of high-risk breast cancer patients and those at risk of late relapse. J Clin Oncol 2006; 24: 5373-80; см. De Kruijf E.M., Van Nes J.G., Sajet A. et al. The predictive value of HLA class I tumor cell expression and presence of intratumoral Tregs for chemotherapy in patients with early breast cancer. Clin Cancer Res, 2010; 16 (4): 1272-80; см. И.А. Новикова, Ю.С. Шатова, Е.Ю. Златник, Ю.В. Пржедецкий, Е.П. Ульянова, Е.Н. Черникова. Пролиферативные и иммунологические характеристики молекулярно-биологических подтипов рака молочной железы // Междунар. журн. прикл. и фундам. исслед. (РАЕ). 2014. №11 (часть 1). С.116-119); толстой кишки (см. Galon J, Costes A, Sanchez-Cabo F, et al. Type, density, and location of immune cells within human colorectal tumours predict clinical out- come. Science, 2006; 313: 1960-4; см. Grabenbauer G.G., Lahmer G., Distel L., Niedobitek G. Tumour-infiltrating cytotoxic T cells but not regulatory T cells predict outcome in anal squamous cell carcinoma. Clin Cancer Res 2006; 12: 3355-60); опухолях головы и шеи (см. Badoual С, Hans S, Rodriguez J, et al. Prognostic value of tumour-infiltrating CD4+ T-cell subpopulations in head and neck cancers. Clin Cancer Res, 2006; 12: 465-72), раке яичника (см. Curiel TJ, Coukos G, Zou L, et al. Specific recruitment of regulatory T cells in ovarian carcinoma fosters immune privilege and predicts reduced survival. Nat Med, 2004; 10: 942-9; см. Zhang L., Conejo-Gracia J.R., Katsaros D., et al. Intratumoral T cells, recurrence, and survival in epithelial ovarian cancer. N Engl J Med, 2003; 348: 203-13; см. Sato E, Olson SH, Ahn J, et al. Intraepithelial CD8+ tumour-infiltrating lymphocytes and a high CD8/regulatory T cell ratio are associated with favourable prognosis in ovarian cancer. Proc. Natl. Acad. Sci., 2005; 102: 18538-43), раке вульвы (см. Неродо Г.А., Новикова И.А., Златник Е.Ю., Закора Г.И., Ульянова Е.П., Иванова В.А., Неродо Е.А. Экспрессия лимфоцитарно-макрофагальных маркеров в ткани плоскоклеточной карциномы вульвы, Материалы IX съезда онкологов и радиологов стран СНГ и Евразии, 15-17.06.16, Минск, Республика Беларусь, 2016. С. 463).
Известны результаты ИГХ-исследования состава внутриопухолевых лимфоцитов у больных с различным клиническим эффектом хирургического лечения рака пищевода (см. U. Zingg, М. Montani, D.M. Frey, S. Dirnhofer, A.J. Esterman, P. Went, D. Oertli. Tumour-infiltrating lymphocytes and survival in patients with adenocarcinoma of the oesophagus // EJSO 36 (2010) 670e677 Journal of clinical surgery P. 670-677). Авторы изучали процентное содержание лимфоцитов различных субпопуляций в центре и на периферии опухоли и выявили, что уровни лимфоцитов, экспрессирующих CD8+, FoxP3+ (но не CD25+) и CD3+ на периферии опухоли были выше, чем в центре. При этом они не обнаружили разнонаправленности уровней Т regs (CD4+CD25+FoxP3+) и CD3+CD8+клеток, не получили статистически значимых различий в зависимости от клинического течения заболевания и сделали заключение, что соотношение количества исследованных клеток не является предиктивным фактором при раке пищевода.
Однако авторами не были исследованы неизмененные ткани: перитуморальная зона и линия резекции, а использованные ими соотношения характеризовали не различные участки опухоли и прилежащих тканей, а количество различных субпопуляций лимфоцитов в одном образце ткани. Кроме того, ИГХ является полуколичественным методом, позволяющим оценить только те лимфоциты, которые попали в срез, тогда как с помощью 6-цветной проточной цитофлюориметрии представляется возможной оценка многих тысяч лимфоцитов, содержащихся в исследуемом образце. Точность полученных результатов оценки клеточных факторов локального иммунитета затруднена тем, что уровень лимфоцитарной инфильтрации у разных больных может колебаться в широких пределах, кроме того, результаты зависят от размера и техники взятия тканевых образцов. Поэтому определение процентной доли лимфоцитарных субпопуляций не всегда представляется статистически достоверным.
В связи с этим нами предлагается расчет коэффициентов К1, К2 и К3 на основании соотношения процента лимфоцитов указанных субпопуляций, определенного методом проточной цитофлюориметрии в гомогенатах взятых образцов тканей: опухоли, перитуморальной зоны и линии резекции.
Коэффициенты вычисляют следующим образом:
- К1 (ПЗ/ОП) - соотношение процента лимфоцитов определенной субпопуляции в ткани перитуморальной зоны к аналогичному показателю в опухолевой ткани, где ПЗ - перитуморальная зона, ОП - опухолевая ткань;
- К2 (ПЗ/ЛР) - соотношение процента лимфоцитов определенной субпопуляции в ткани перитуморальной зоны к аналогичному показателю в ткани линии резекции, где ЛР - линия резекции;
- К3 (ЛР/ОП) - соотношение процента лимфоцитов определенной субпопуляции в ткани линии резекции к аналогичному показателю в опухолевой ткани.
Техническим результатом предлагаемого нами изобретения является повышение точности и информативности прогноза прогрессирования рака пищевода.
Технический результат достигают тем, что в гомогенатах образцов ткани опухоли и визуально неизмененной ткани (перитуморальной зоне и линии резекции), взятых при операции по поводу первично выявленного рака пищевода, методом проточной цитофлюориметрии определяют процентное содержание лимфоцитов субпопуляций CD3+CD4+, CD3+CD8+, Tregs (CD4+CD25+CD127dim), рассчитывают коэффициенты К1=ПЗ/ОП, К2=ПЗ/ЛР и К3=ЛР/ОП, где ПЗ - перитуморальная зона, ОП - опухолевая ткань, ЛР - линия резекции, и при значениях К1 для Т regs выше 0,343, К2 для Т regs выше 2,37 и К3 для CD3+CD8+ клеток ниже 1,198 прогнозируют прогрессирование рака пищевода.
Выбор лимфоцитарных субпопуляций обусловлен их влиянием на развитие противоопухолевых иммунных реакций. Так, Т regs клетки обладают супрессорным действием, угнетая все звенья иммунной системы (антиген-презентирующее, антиген-распознающее, эффекторное (см. Chen W. Dendritic cells and (CD4+) CD25+ T regulatory cells: crosstalk between two professionals in immunity versus tolerance. Front. Biosci. 2006; 11: 1360-1370; см. Azuma Т., Takahashi Т., Kunisato A. et al. Human CD4+CD25+ regulatory T cells suppress NKT cell functions. Cancer Res 2003; 63: 4516-4520; см. Lim H.W., Hillsamer P., Banham A.H. et al. Cutting edge: direct suppression of В cells by CD4+CD25+ regulatory T cells. J Immunol 2005; 175: 4180-3; см. Trzonkowski P., Szmit E., Mysliwska J. et al. CD4+CD25+ T regulatory cells inhibit cytotoxic activity of T CD8+ and NK lymphocytes in the direct cell-to-cell interaction. Clin Immunol 2004; 112: 258-267). Несмотря на разнонаправленные функции, по фенотипу Т regs являются частью хелперно-индукторной Т-лимфоцитарной субпопуляции (CD3+CD4+), играющей ключевую роль в распознавании антигенов, представленных в комплексе с МНС II, продукции цитокинов, включении в иммунный ответ эффекторных звеньев (см. Romagnani С., Delia Chiesa M., Kohler S. et al. Activation of human NK cells by plasmacytoid dendritic cells and its modulation by CD4+ T helper cells and CD4+CD25hi T regulatory cells. Eur J Immunol 2005; 35: 2452-8; см. Ossendorp F, Toes RE, Offringa R, van der Burg SH, Melief CJ. Importance of CD4+T helper responses in tumour immunity. Immunol. Lett 2000; 15: 75-9).
CD3+CD8+ лимфоциты являются Т-цитотоксическими клетками, ответственными за реализацию иммунного ответа при презентации антигена в комплексе с МНС I, что имеет большое значение в противоопухолевом иммунитете (см. Grabenbauer G.G., Larimer G., Distel L., Niedobitek G. Tumour-infiltrating cytotoxic T cells but not regulatory T cells predict outcome in anal squamous cell carcinoma. Clin. Cancer Res. 2006; 12: 3355-60; см. Sato E, Olson SH, Ahn J, et al. Intraepithelial CD8+ tumour-infiltrating lymphocytes and a high CD8/regulatory T cell ratio are associated with favourable prognosis in ovarian cancer. Proc. Natl. Acad. Sci. 2005; 102: 18538-43).
Данный набор лимфоцитарных субпопуляций позволяет оценить противоопухолевые аспекты локального иммунитета и с учетом их особенностей провести анализ клинической динамики у больных, прооперированных по поводу рака пищевода, часть из которых получала адъювантную химиотерапию.
Проводили сравнение показателей локального иммунитета у больных раком пищевода с короткой и длительной бессобытийной выживаемостью. Наблюдалось раннее прогрессирование заболевания (период наблюдения составил 18 месяцев). Расценивались короткая бессобытийная выживаемость, отсутствие прогрессирования за этот период - длительная.
Рассчитывали отношение процента лимфоцитов с различным иммунофенотипом, содержащихся в тканевых образцах: опухоли, перитуморальной зоны и линии резекции, взятых при операции по поводу первично выявленного рака пищевода. После окончания хирургического этапа части больных по показаниям проводили 2-6 курсов химиотерапии 100 мг цисплатина, 5000 мг 5-фторурацила на курс. На основании наличия или отсутствия прогрессирования заболевания в течение вышеуказанного периода наблюдения были выделены 2 группы больных. Результаты определения К1, К2 и К3 представлены в табл. 1.
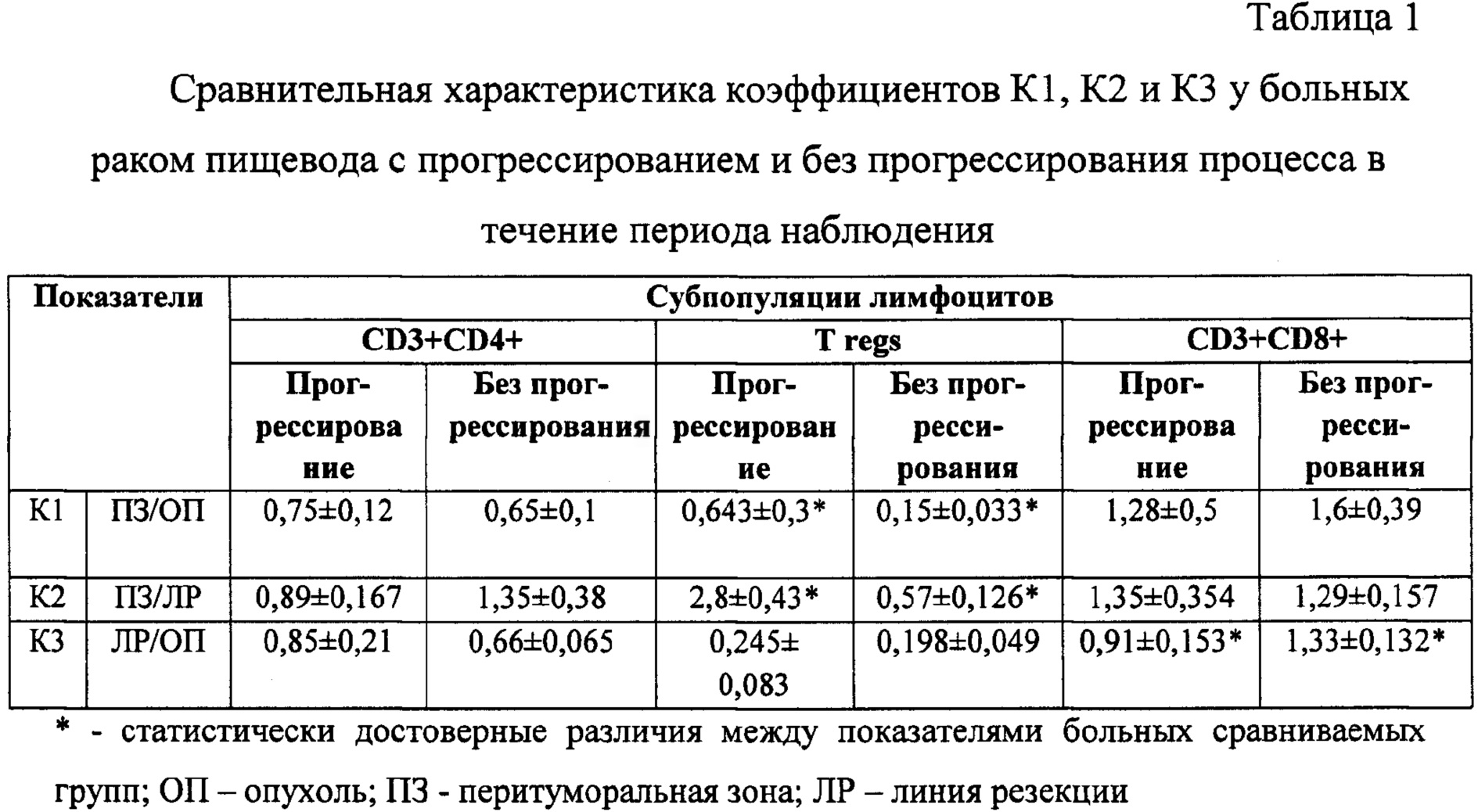
Как видно из табл. 1, значения К1 (ПЗ/ОП) и К2 (ПЗ/ЛР) в случаях развившегося прогрессирования заболевания, статистически достоверно выше для Т regs по сравнению с показателями больных, у которых в период наблюдения прогрессирования не отмечено, а различий величин К3 (ЛР/ОП) не выявлено. Напротив, для CD3+CD8+ лимфоцитов оказался статистически значимым именно К3, который при течении без прогрессирования был выше, чем при развитии прогрессирования заболевания в течение периода наблюдения; при этом К1 и К2 вне зависимости от времени прогрессирования заболевания были аналогичны.
По нашему мнению, полученные данные свидетельствуют о значимости линии резекции для CD3+CD8+ и перитуморальной зоны для Tregs. Данные коэффициенты, вычисленные для CD3+CD4+ клеток, оказались неинформативными, хотя Т regs фенотипически являются частью этой субпопуляции. К1 и К2, характеризующие иммунологические взаимоотношения перитуморальной зоны с опухолью и линией резекции, для CD3+CD4+ клеток имеют даже обратные тенденции, чем для Т regs.
Более высокое значение любого из представленных коэффициентов может достигаться за счет либо высокого значения числителя, либо - низкого значения знаменателя. Поскольку в опухолевой ткани содержание Т regs было высоким практически у всех больных, то при расчете К1 его значение было тем выше, чем больше уровень Т regs в ткани перитуморальной зоны. Таким образом, высокий К1 у больных с прогрессированием процесса, по-видимому, характеризует участие в нем Т regs, содержащихся в перитуморальной зоне. Более высокое значение К2 у больных с прогрессированием опухоли в течение периода наблюдения также свидетельствует о возможной роли Т regs перитуморальной зоны.
Что касается К3, то он описывает соотношение CD3+CD8+ в опухоли и линии резекции. Низкие значения К3 говорят о снижении числителя и/или возрастании знаменателя, т.е. об обеднении ЛР этими клетками, являющимися предшественниками цитотоксических Т-лимфоцитов, что имеет место при наблюдаемом прогрессировании опухоли. Напротив, высокие значения К3 обнаружены при превышении содержания CD3+CD8+ в линии резекции по сравнению с тканью опухоли, что соответствует более благоприятной клинической динамике у таких больных.
Ниже приводим клинические примеры.
Пример 1
Больная Г., 47 лет. Диагноз: Рак н/3 пищевода St II, T3N0M0, дисфагия, кл.гр. 2.
Гистологический анализ №93240-1/15 G3 плоскоклеточный рак с инвазией глубоких мышечных слоев. Данные проточной цитофлюориметрии: Т regs в опухоли 17,6%, в перитуморальной зоне 37,6%, в линии резекции 11,6%, К1=2,2, К2=3,24; CD3+CD8+ в линии резекции 22,2%, в опухоли 56,2%, К3=0,395. Данные значения расцениваются как прогностически неблагоприятные.
12.11.2015 г операция Льюиса, затем 6 курсов химиотерапии (цисплатин+5-фторурацил).
При контрольном обследовании 26.05.2016 г (на СРКТ) выявлено прогрессирование процесса с метастатическим поражением внутригрудных лимфоузлов с прорастанием в главный бронх, перикард, перемещенный желудок, гидроперикард. Бессобытийная выживаемость составила 196 дней (6,5 мес).
Пример 2
Больной С., 54 года. Диагноз: Рак с/3 пищевода St II, T3N0M0, дисфагия 2 ст., кл.гр. 2. Гистологический анализ №28153-4/15 G3 плоскоклеточный рак с ороговением, с инвазией клетчатки.
14.04.2015 г. операция Льюиса, затем 6 курсов химиотерапии (цисплатин+5-фторурацил).
Гистологический анализ №28155-6/15 - в проксимальной линии резекции плоскоклеточный рак.
Данные проточной цитофлюориметрии: Т regs в опухоли 36,8%, в перитуморальной зоне 9,6%, в линии резекции 14,5%, К1=0,26, К2=0,66; CD3+CD8+ в линии резекции 27,2%; в опухоли 15,2%, К3=1,79. Данные значения расцениваются как прогностически благоприятные.
При контрольном обследовании в РНИОИ (СРКТ ОГК, ОБП и МТ) от 06.04.2016 г. данных за прогрессирование и рецидив не выявлено. Продолжительность жизни без прогрессирования заболевания 20 мес.
Пример 3
Больная К., 50 лет. Диагноз: Рак с/3 пищевода Still, T3N1M0, дисфагия 2 ст., кл.гр. 2.
08.12.2015 г. операция Льюиса. Больной рекомендовано 6 курсов адьювантной химиотерапии (цисплатин+5-фторурацил), однако пациентка отказалась.
Гистологический анализ №101742-743/15 - умеренно дифференцированный плоскоклеточный рак с ороговением, G2, с изъязвлением, воспалением, с ростом в мышечный слой до серозной оболочки, с инвазией в периневральные пространства и лимфатические капилляры.
Данные проточной цитофлюориметрии: Т regs в опухоли 16,5%, в перитуморальной зоне 18,4%, в линии резекции 2,4%, К1=1,15, К2=7,7; CD3+CD8+ в линии резекции 28,1%; в опухоли 36,8%, К3=0,77. Данные значения расцениваются как прогностически неблагоприятные.
В апреле 2016 г. (на СРКТ) выявлено образование в мягких тканях передне-боковой области грудной клетки. При обследовании выявлено: метастатическое поражение внутригрудных лимфоузлов, печени, легких, плевры, гидроторакс. Бессобытийная выживаемость составила 135 дней (4,5 мес). Больная умерла в апреле 2016 г.
Пример 4
Больной М., 68 лет. Диагноз: Рак н/3 пищевода Still, T3N1M0, дисфагия 2 ст., кл.гр. 2.
11.03.2015 г операция Льюиса. Больному рекомендовано 6 курсов адъювантной химиотерапии (цисплатин+5-фторурацил), однако пациент отказался.
Гистологический анализ №17219-220/15 G2 плоскоклеточный рак с ороговением, с изъязвлением, с прорастанием всех слоев стенки пищевода.
№17223-224 (в кардиальном отделе желудка) в лимфоузлах метастаз плоскоклеточного рака.
Данные проточной цитофлюориметрии: Т regs в опухоли 37,3%, в перитуморальной зоне 6,2%, в линии резекции 5,7%, К1=0,166, К2=1,09; CD3+CD8+ в линии резекции 48,2%; в опухоли 31,9%, К3=1,5. Данные значения расцениваются как прогностически благоприятные.
При контрольном обследовании по месту жительства (СРКТ ОБП) от 20.10.2015 г. данных за прогрессирование не выявлено. При ФГДС от 20.10.2015 г. - на передней губе анастомоза выявлена язва до 0,5 см, покрытая фибрином. Больной находится под динамическим наблюдением по месту жительства; по данным от сентября 2016 г. прогрессирования не выявлено.
Продолжительность жизни без прогрессирования заболевания 19 мес.
Данным способом был рассчитан прогноз 20 больным. Способ позволяет повысить точность и информативность прогноза прогрессирования рака пищевода.
Способ прогнозирования прогрессирования рака пищевода, включающий оценку локального клеточного иммунитета, отличающийся тем, что в гомогенатах образцов ткани опухоли и визуально неизмененной ткани (перитуморальной зоне и линии резекции), взятых при операции по поводу первично выявленного рака пищевода, методом проточной цитофлюориметрии определяют процентное содержание лимфоцитов субпопуляций CD3+CD8+, T regs (CD4+CD25+CD127dim), рассчитывают коэффициенты К1=ПЗ/ОП, К2=ПЗ/ЛР и К3=ЛР/ОП, где ПЗ - перитуморальная зона, ОП - опухолевая ткань, ЛР - линия резекции, и при значениях К1 для Т regs выше 0,343, К2 для Т regs выше 2,37 и К3 для CD3+CD8+ клеток ниже 1,198 прогнозируют прогрессирование рака пищевода.
