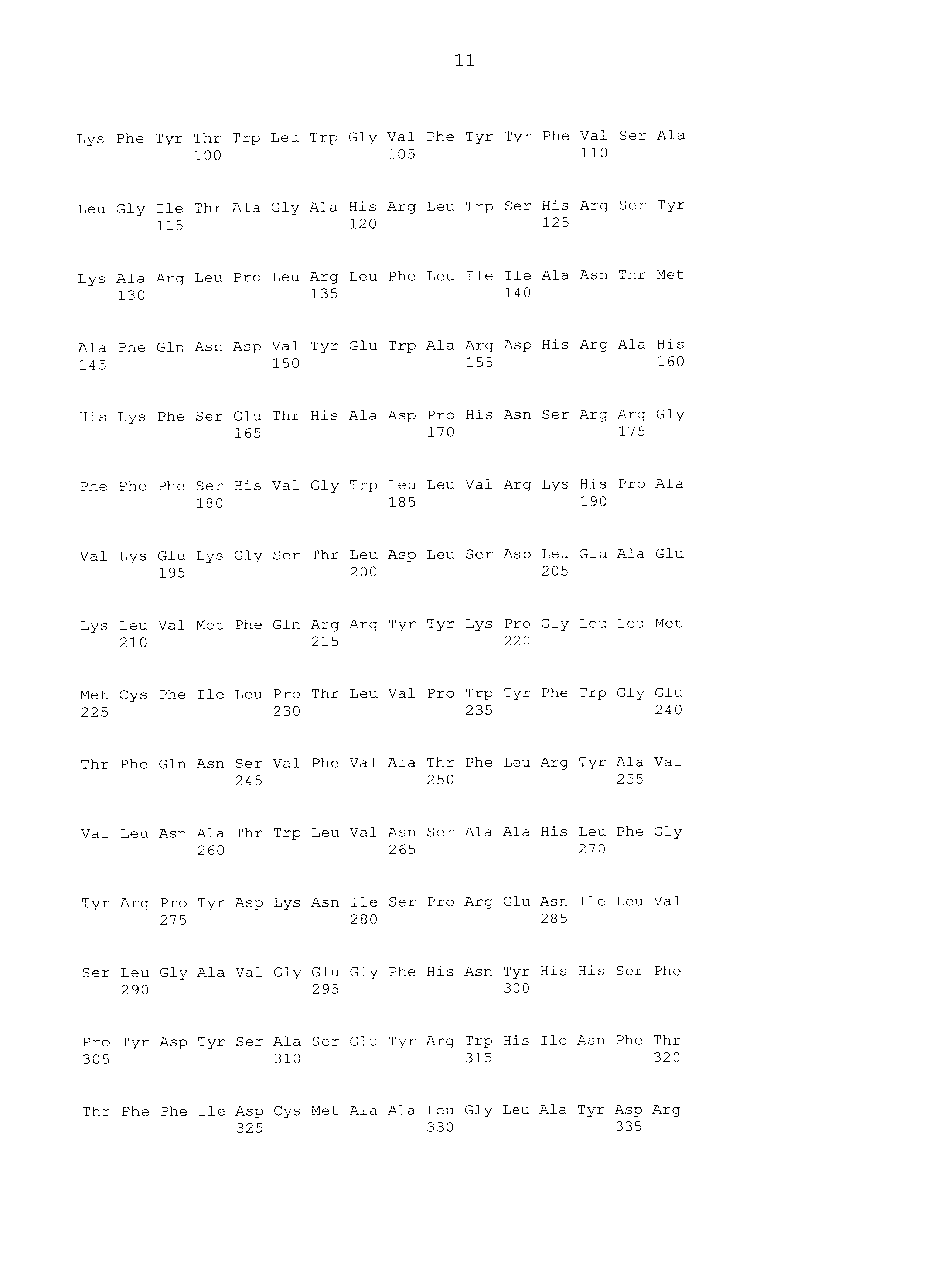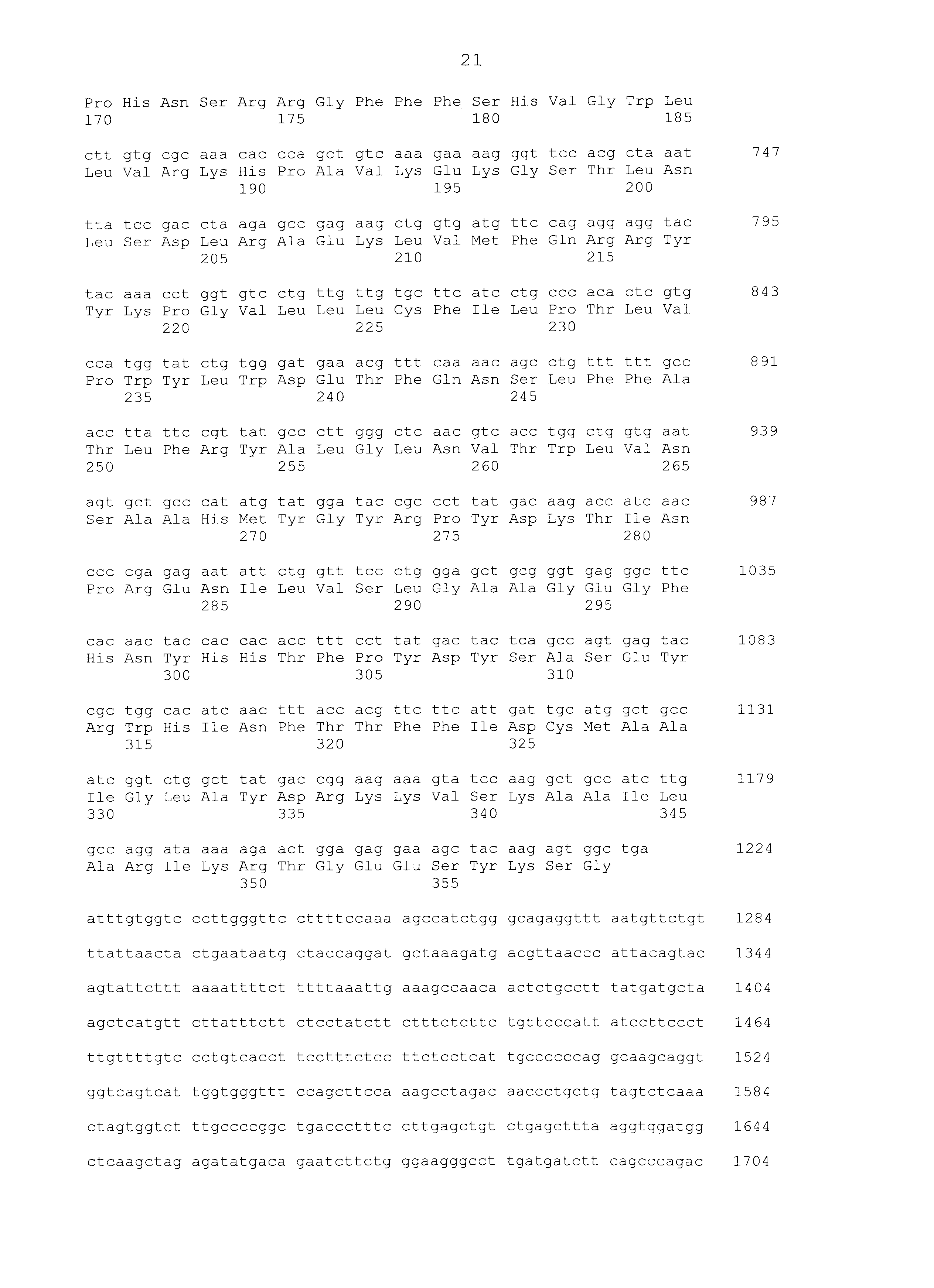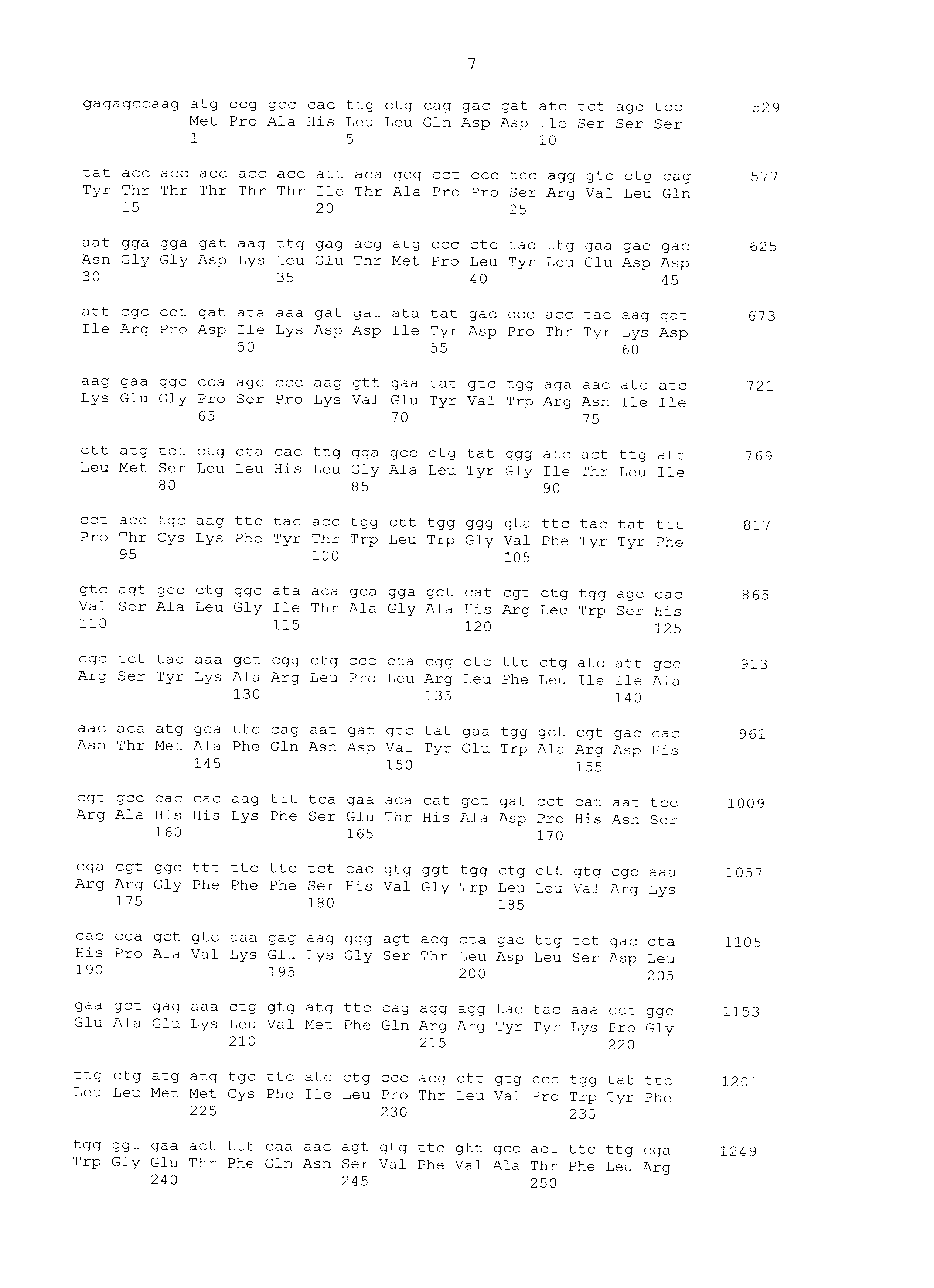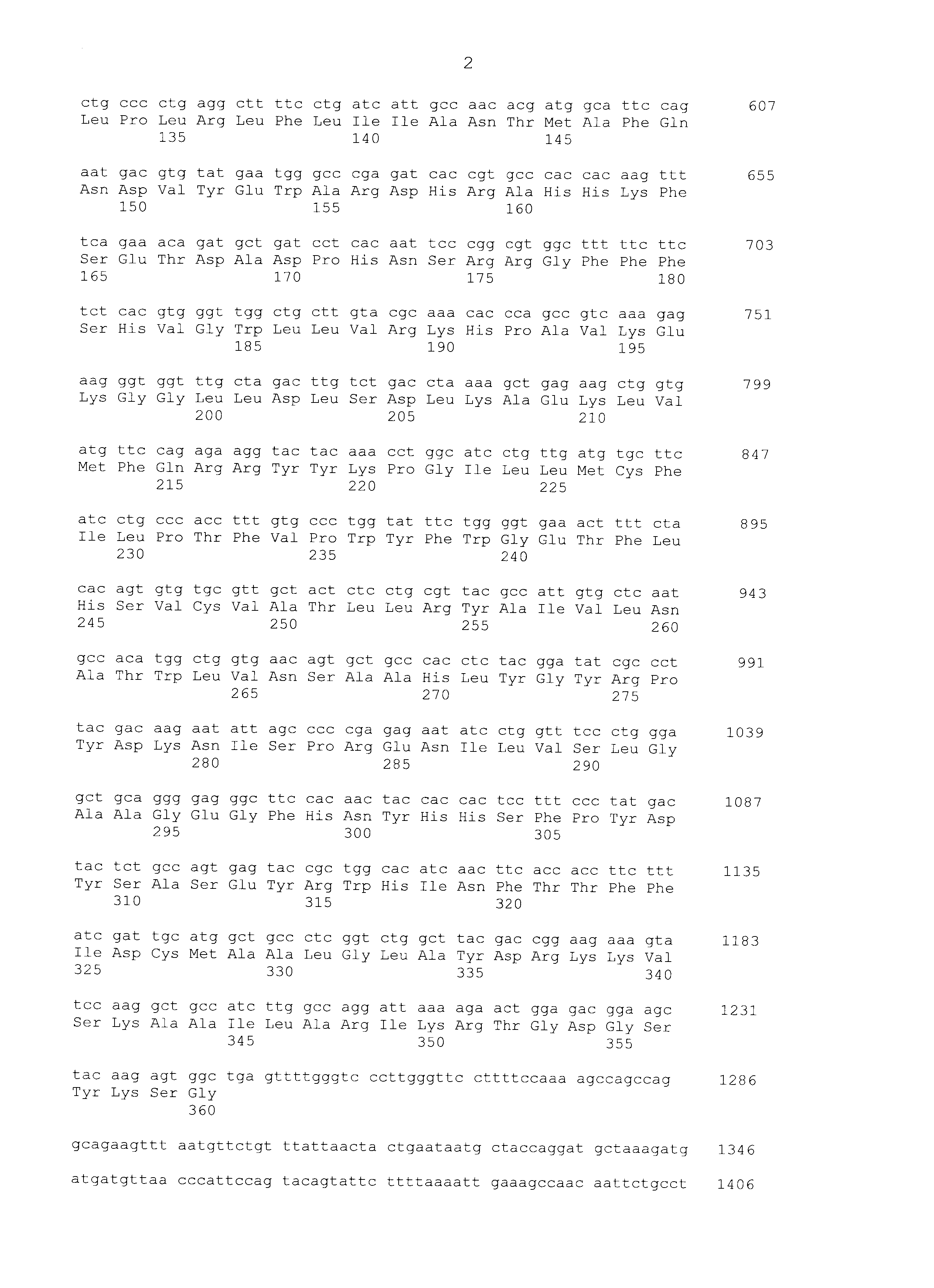Результат интеллектуальной деятельности: АГЕНТ, ИНДУЦИРУЮЩИЙ ИММУНИТЕТ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новому агенту, индуцирующему иммунитет, используемому в качестве терапевтического и/или профилактического средства для лечения злокачественного новообразования.
УРОВЕНЬ ТЕХНИКИ
Рак является наиболее общеизвестной причиной смерти среди всех причин смертей, и лечение, осуществляемое в настоящее время, представляет собой, главным образом, хирургическое вмешательство, которое может осуществляться в сочетании с лучевой терапией и/или химиотерапией. Несмотря на разработку новых хирургических методов и открытие новых противораковых агентов в последние годы, результаты лечения злокачественных новообразований еще не были значительно улучшены, за исключением некоторых видов злокачественных новообразований. В последние годы, благодаря достижениям молекулярной биологии и иммунологии злокачественных новообразований, были идентифицированы раковые антигены, которые распознаются цитотоксическими Т-клетками, реактивными к злокачественному новообразованию, а также гены, кодирующие раковые антигены, и возросли ожидания от антиген-специфической иммунотерапии.
В иммунотерапии, с целью уменьшения побочных эффектов, пептид или белок, признанный в качестве антигена, должен почти не присутствовать в нормальных клетках, но особенно присутствовать в раковых клетках. В 1991 году Boon et al., из института Ludwig Institute в Бельгии, выделили антиген меланомы человека MAGE 1, распознаваемый CD8-позитивными Т-клетками, путем метода клонирования кДНК-экспрессии с использованием аутологичной линии опухолевых клеток и опухолереактивных Т-клеток (непатентный документ 1). Затем сообщалось о методе SEREX (серологические идентификации антигенов путем клонирования рекомбинантной экспрессии), где опухолевые антигены, распознаваемые антителами, продуцированными в организме больного раком в ответ на собственный рак пациента, идентифицируются путем использования метода клонирования экспрессии гена (патентный документ 1, непатентный документ 2), и этим методом были выделены некоторые раковые антигены. Используя в качестве мишеней часть раковых антигенов, были начаты клинические испытания иммунотерапии злокачественных новообразований.
С другой стороны, как и у людей, ряд опухолей, таких как опухоль молочной железы и плоскоклеточная карцинома, также известны у собак и кошек, и они занимают высокое место в статистике болезней собак и кошек. Однако в настоящее время не существуют терапевтического агента, профилактического агента или диагностического агента, эффективных при злокачественных новообразованиях у собак и кошек. Поскольку большинство опухолей у собак и кошек распознается их владельцами только после того, как опухоли вырастают уже крупными из-за их прогрессирования, визит в лечебницу происходит уже слишком поздно, и даже если они подвергаются хирургической операции или им вводят лекарство для человека (например, противораковое средство или тому подобное), часто они умирают вскоре после лечения. В таких обстоятельствах, если терапевтические агенты и профилактические агенты при злокачественном новообразовании, эффективные для собак и кошек, становятся доступными, ожидается, что будет разрабатываться их применение при лечении злокачественных новообразований у собак.
Стеароил-CoA десатураза 1 (SCD1) вводит двойную связь в положение С9-С10 насыщенной жирной кислоты. Предпочтительными субстратами для фермента являются пальмитоил-СоА (16:0) и стеароил-СоА (18:0), и они преобразуются в пальмитолеоил-СоА (16:1) и олеоил-СоА (18:1), соответственно. Полученная мононенасыщенная жирная кислота затем может быть использована in vivo для получения фосфолипидов, триглицеридов и сложных эфиров холестерина. Кроме того, различные виды злокачественных новообразований, такие как рак печени, рак пищевода и рак толстой кишки, демонстрируют увеличенную экспрессию SCD1, и сообщалось, что ингибирование функции SCD1 с помощью миРНК или низкомолекулярного соединения вызывает супрессию роста клеток или индукцию апоптоза (непатентные документы 3, 4 и 5). Однако нет сообщений, подтверждающих, что белок SCD1 обладает иммунитет-индуцирующей активностью в отношении раковых клеток, и, следовательно, что указанный белок может быть использован для лечения и профилактики злокачественного новообразования.
ДОКУМЕНТЫ УРОВНЯ ТЕХНИКИ
Патентные документы
[Патентный документ 1] US 5698396 B
Непатентные документы
[Непатентный документ 1] Bruggen P. et al., Science, 254:1643-1647 (1991)
[Непатентный документ 2] Proc. Natl. Acad. Sci. USA, 92:11810-11813 (1995)
[Непатентный документ 3] Scaglia N. et al., PLoS One 4: e6812 (2009)
[Непатентный документ 4] Morgan-Lappe SE et al., Cancer Res 67: 4390-4398 (2007)
[Непатентный документ 5] Scaglia N. et al., Biochim Biophys Acta 1687: 141-151 (2005)
[Непатентный документ 6] Ariyama H. et al., J Biol Chem (2010)
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ЗАДАЧИ, РЕШАЕМЫЕ ИЗОБРЕТЕНИЕМ
Целью настоящего изобретения является выявление нового полипептида, который может использоваться в качестве лечебного и/или профилактического агента для лечения злокачественного новообразования, и касается полипептида для использования в качестве агента, индуцирующего иммунитет.
СРЕДСТВА ДЛЯ РЕШЕНИЯ ЗАДАЧ
По методу SEREX с использованием библиотеки кДНК, полученной из семенника собаки, и сыворотки, полученной из организма собаки, пораженного опухолью, авторы настоящего изобретения провели интенсивные исследования с целью получению белка, кодирующего кДНК, который связывается с антителами, присутствующими в сыворотке, полученной из пораженного опухолью живого организма, и на основе этой кДНК был получен полипептид стеароил-СоА десатуразы 1 собаки (в дальнейшем именуемый SCD1), имеющий аминокислотную последовательность SEQ ID NO:2. Кроме того, на основе гомологичных человеческого и мышиного генов полученного гена, были получены SCD1 человека и мыши, имеющие аминокислотную последовательность SEQ ID NO:4 и 6. Далее, авторы настоящего изобретения обнаружили, что указанные полипептиды SCD1 специфически экспрессируются в тканях или клетках рака молочной железы, рака мозга, рака толстой кишки, перианальной аденокарциномы, мастоцитому, нейробластомы, рака почки, рака печени, рака легких, рака предстательной железы или лейкемии. Авторы настоящего изобретения обнаружили, кроме того, что введение SCD1 в живой организм способно индуцировать иммунные клетки против SCD1 в живом организме и вызывать регрессию опухоли, экспрессирующую SCD1 в живом организме. Кроме того, авторы настоящего изобретения обнаружили, что рекомбинантный вектор, который может экспрессировать полинуклеотид, кодирующий полипептид SCD1 или его фрагмент, индуцирует противоопухолевый эффект против злокачественного новообразования, экспрессирующего SCD1 в живом организме.
Далее, авторы настоящего изобретения обнаружили, что полипептид SCD1 обладает способностью, которая представлена антиген-презентирующими клетками, вызывать активацию и рост цитотоксических Т-клеток, специфичных к пептиду (иммунитет-индуцирующая активность), и, таким образом, полипептид может быть использован для терапии и/или профилактики злокачественного новообразования. Кроме того, авторы настоящего изобретения обнаружили, что антиген-презентирующие клетки, контактировавшие с полипептидом, и Т-клетки, контактировавшие с антиген-презентирующими клетками, могут быть использованы для терапии и/или профилактики злокачественного новообразования, и, в результате этого, создали данное изобретение.
Таким образом, настоящее изобретение характеризуется следующим.
(1) Иммунитет-индуцирующий агент, содержащий в качестве эффективного(ых) ингредиента(ов) по меньшей мере один полипептид, обладающий иммунитет-индуцирующей активностью, выбранный из полипептидов (а)-(с), указанных далее, и рекомбинантного(ых) вектора(ов), который(ые) содержит(ат) полинуклеотид(ы), кодирующий(ие) по меньшей мере один полипептид, где рекомбинантный(ые) вектор(ы) способен(ны) экспрессировать полипептид(ы) in vivo:
(a) полипептид, состоящий из не менее 7 последовательных аминокислот с любыми аминокислотными последовательностями SEQ ID NO:4, 2, 22 и 24 из ПЕРЕЧНЯ ПОСЛЕДОВАТЕЛЬНОСТЕЙ.
(b) полипептид, содержащий последовательность, идентичную не менее чем на 85% полипептиду (а), и состоящий из не менее 7 аминокислот; и
(c) полипептид, содержащий полипептид (a) или (b) в качестве своей частичной последовательности.
(2) Иммунитет-индуцирующий агент в соответствии с (1), где полипептид, обладающий иммунитет-индуцирующей активностью, представляет собой полипептид, имеющий аминокислотную последовательность SEQ ID NO:4, 2, 22 или 24 из ПЕРЕЧНЯ ПОСЛЕДОВАТЕЛЬНОСТЕЙ.
(3) Иммунитет-индуцирующий агент в соответствии с (1) или (2), который представляет собой агент для обработки антиген-презентирующих клеток.
(4) Иммунитет-индуцирующий агент в соответствии с (1) или (2), который представляет собой терапевтический и/или профилактический агент для лечения злокачественного(ых) новообразования(ий).
(5) Иммунитет-индуцирующий агент в соответствии с (4), где злокачественным(ми) новообразованием(ями) является(ются) злокачественное(ые) новообразование(я), экспрессирующее(ие) SCD1.
(6) Иммунитет-индуцирующий агент в соответствии с (4) или (5), где злокачественное(ые) новообразование(я) представляет(ют) собой рак молочной железы, рак мозга, рак толстой кишки, перианальную аденокарциному, опухоль тучных клеток, нейробластому, рак почки, рак печени, рак легких, рак предстательной железы и/или лейкоз.
(7) Иммунитет-индуцирующий агент по любому из (1)-(6), дополнительно содержащий иммуностимулятор.
(8) Иммунитет-индуцирующий агент в соответствии с (7), где иммуностимулятором является по меньшей мере один, выбранный из группы, состоящей из неполного адъюванта Фрейнда; монтанида; поли-I:C и его производных; олигонуклеотидов CpG; интерлейкина-12; интерлейкина-18; интерферона-α; интерферона-β; интерферона-ω; интерферона-γ; и лиганда Flt3.
ЭФФЕКТ ИЗОБРЕТЕНИЯ
В соответствии с настоящим изобретением, предложен новый иммунитет-индуцирующий агент, который может использоваться для терапии, профилактики и/или тому подобного в случае злокачественного новообразования. Как подробно показано в приведенных далее примерах, введение в живой организм полипептида, используемого в настоящем изобретении, способно индуцировать иммунные клетки в живом организме, и вызывать уменьшение или регрессию уже имеющегося злокачественного новообразования. Таким образом, полипептид может быть использован для терапии и/или профилактики злокачественного новообразования.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
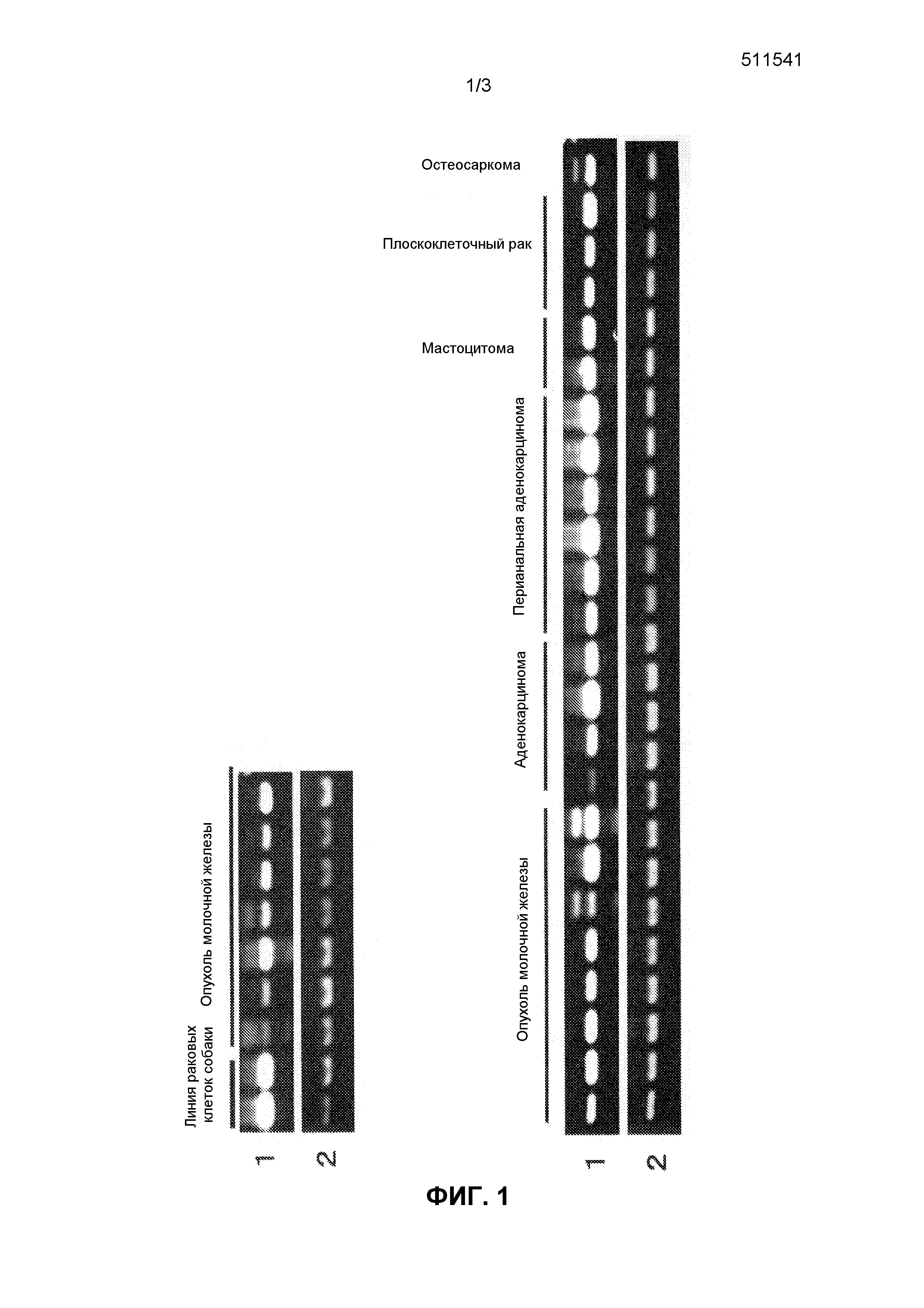
На фиг.1 показаны паттерны экспрессии идентифицированного гена SCD1 в нормальных тканях, тканях опухолей и в линиях раковых клеток собак. Ссылочный номер 1, паттерны экспрессии гена SCD1 собак в различных тканях и клеточных линиях собак; ссылочный номер 2, паттерны экспрессии гена GAPDH собак в различных тканях и клеточных линиях собак.
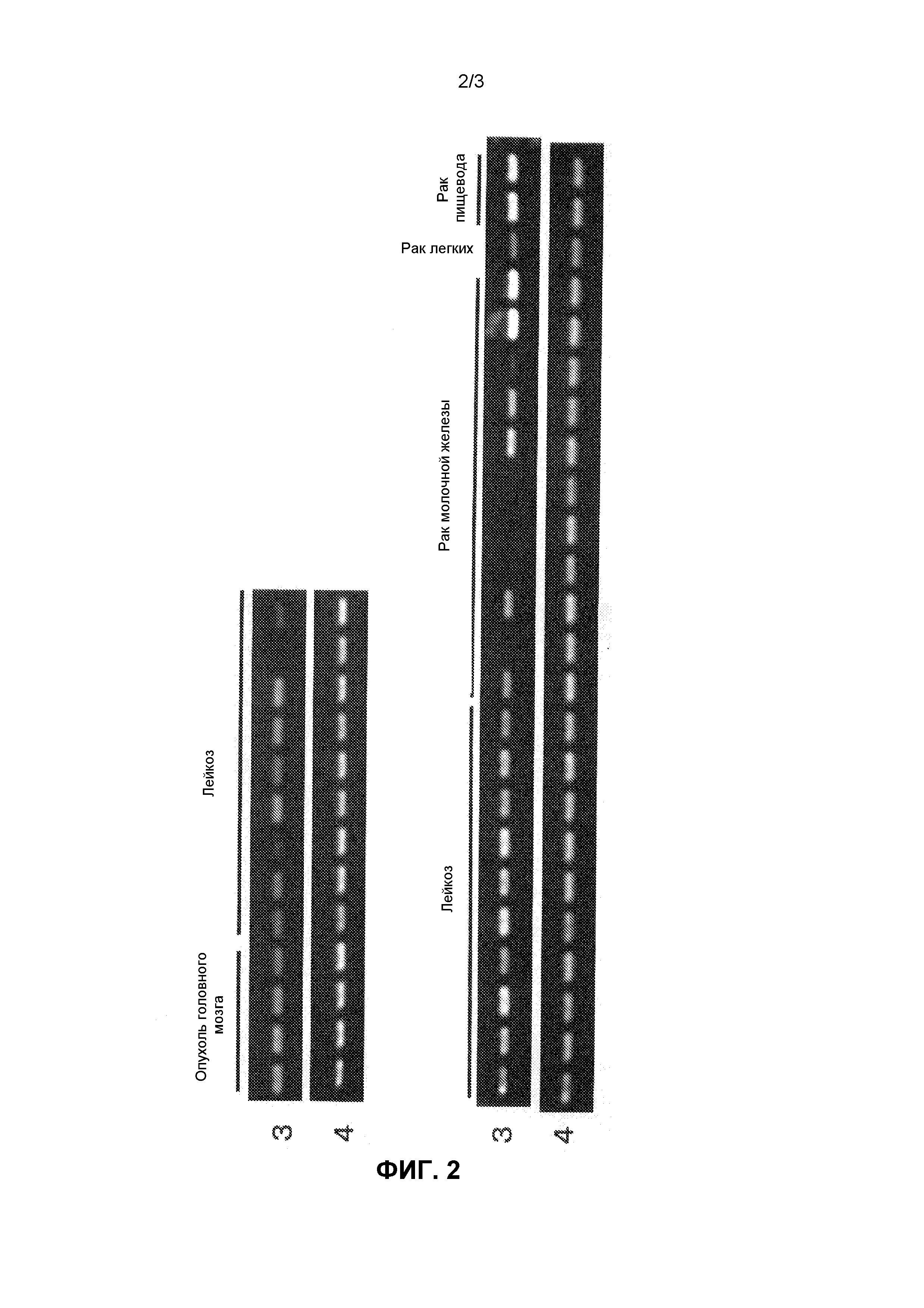
На фиг.2 показаны паттерны экспрессии идентифицированного гена SCD1 в нормальных тканях, тканях опухолей и в линиях раковых клеток человека. Ссылочный номер 3, паттерны экспрессии гена SCD1 человека в различных тканях и клеточных линиях человека; ссылочный номер 4, паттерны экспрессии гена GAPDH человека в различных тканях и клеточных линиях человека.
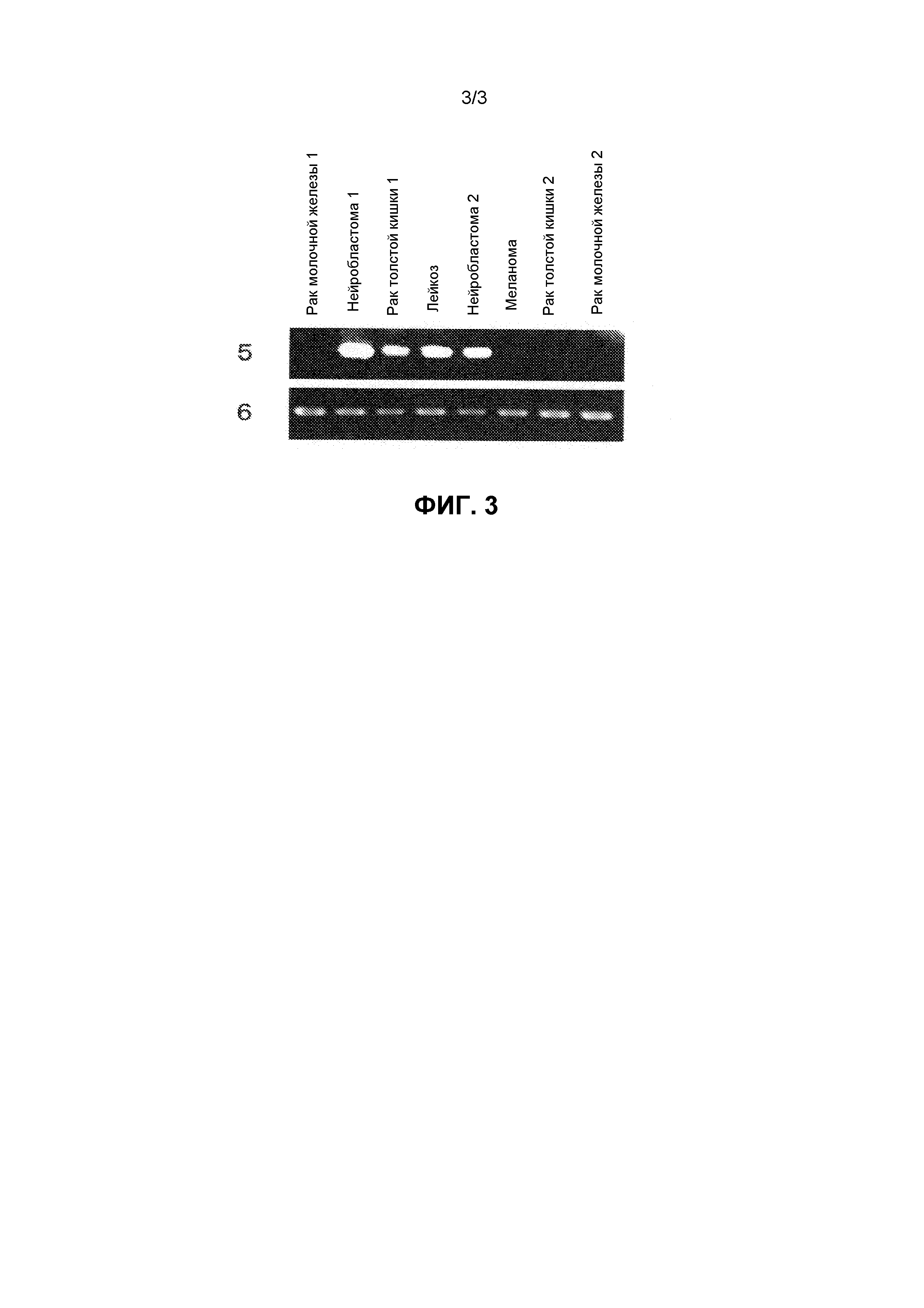
На фиг.3 показаны паттерны экспрессии идентифицированного гена SCD1 в нормальных тканях, тканях опухолей и в линиях раковых клеток мышей. Ссылочный номер 5, паттерны экспрессии гена SCD1 мышей в различных тканях и клеточных линиях мышей; ссылочный номер 6, паттерны экспрессии гена GAPDH мышей в различных тканях и клеточных линиях мышей.
ЛУЧШИЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Примеры полипептида, содержащегося в качестве активного ингредиента в иммунитет-индуцирующем агенте по настоящему изобретению, включают следующие. В настоящем изобретении термин "полипептид" обозначает молекулу, образованную множеством аминокислот, связанных пептидными связями, и включает не только полипептидные молекулы, состоящие из большого числа аминокислот, но также молекулы с небольшой молекулярной массой, содержащие небольшое число аминокислот (олигопептиды), и полноразмерные белки. Настоящее изобретение включает также полноразмерные белки SCD1, имеющие аминокислотную последовательность SEQ ID NO:4, 2, 22 или 24.
(a) Полипептид, состоящий из не менее 7 последовательных аминокислот в полипептиде, имеющий аминокислотную последовательность SEQ ID NO:4, 2, 22 или 24 из ПЕРЕЧНЯ ПОСЛЕДОВАТЕЛЬНОСТЕЙ, и обладающий иммунитет-индуцирующей активностью.
(b) Полипептид, состоящий из не менее 7 последовательных аминокислот, где полипептид имеет идентичность последовательности не менее 85% по отношению к полипептиду (а), и обладает иммунитет-индуцирующей активностью.
(c) Полипептид, который содержит полипептид (a) или (b) в качестве своей частичной последовательности и обладает иммунитет-индуцирующей активностью.
В настоящем изобретении выражение "имеющий аминокислотную последовательность" означает, что аминокислотные остатки расположены в таком порядке. Таким образом, например, "полипептид, имеющий аминокислотную последовательность SEQ ID NO:2", означает полипептид, имеющий аминокислотную последовательность Met Pro Ala His…(остаток)…Tyr Lys Ser Gly, показанную в SEQ ID NO:2, где полипептид имеет размер из 360 аминокислотных остатков. Кроме того, например, "полипептид, имеющий аминокислотную последовательность SEQ ID NO:2", может быть кратко указан как "полипептид с SEQ ID NO:2". То же самое относится к термину "имеющий последовательность оснований". В этом случае термин "содержащий" может быть заменен термином "состоящий из".
Используемый в настоящем документе термин "иммунитет-индуцирующая активность" означает способность индуцировать иммуноциты, которые в живом организме секретируют цитокины, такие как интерферон.
Обладает ли полипептид иммунитет-индуцирующей активностью или нет, может быть установлено с использованием, например, известного анализа ELISPOT. Более конкретно, например, как описано в приведенных далее примерах, клетки, такие как мононуклеарные клетки периферической крови, получают из живого организма, подвергнутого введению полипептида, иммунитет-индуцирующая активность которого должна быть оценена, и полученные клетки затем совместно культивируют с полипептидом, затем измеряют количество(а) цитокина(ов), продуцируемого(ых) клетками, с использованием специфического(их) антитела/антител, тем самым делая возможным измерение количества иммуноцитов среди клеток. Благодаря этому возможна оценка иммунитет-индуцирующей активности.
Альтернативно, как описано в приведенных далее примерах, введение рекомбинантного полипептида из числа любых, описанных выше от (а) до (с), животному, пораженному опухолью, обеспечивает регрессию опухоли благодаря его иммунитет-индуцирующей активности. Таким образом, вышеуказанная иммунитет-индуцирующая активность может быть оценена также как способность подавлять рост раковых клеток или вызывать уменьшение или исчезновение опухолевой ткани (опухоли) (далее именуемой как "противоопухолевая активность"). Противоопухолевая активность полипептида может быть подтверждена, например, как более конкретно описано в приведенных далее примерах, путем наблюдения того, уменьшается ли опухоль или нет после фактического введения полипептида в живой организм, пораженный опухолью.
Альтернативно, противоопухолевая активность полипептида может также быть оценена путем наблюдения того, показывают или не показывают Т-клетки, стимулированные полипептидом (то есть, Т-клетки приводят в контакт с антиген-презентирующими клетками, презентирующими полипептид), цитотоксическую активность в отношении опухолевых клеток in vitro. Контакт между Т-клетками и антиген-презентирующими клетками может быть осуществлен путем их совместного культивирования в жидкой среде, как описано далее. Измерение цитотоксической активности может быть осуществлено, например, известным способом, называемым анализом высвобождения 51Cr, описанным в работе Int. J. Cancer, 58: p 317, 1994. В случаях, когда полипептид предназначается для терапии и/или профилактики злокачественного новообразования, оценку иммунитет-индуцирующей активности предпочтительно осуществляют с использованием противоопухолевой активности в качестве индекса, хотя индекс этим не ограничивается.
Каждая из аминокислотных последовательностей SEQ ID NO:2, 4, 22 и 24 из СПИСКА ПОСЛЕДОВАТЕЛЬНОСТЕЙ, представленная в настоящем изобретении, является аминокислотной последовательностью SCD1, которую выделили методом SEREX с использованием библиотеки кДНК, полученной из семенников собаки, и сыворотки собаки, пораженной опухолью, в виде полипептида, который специфически связывается с антителом, присутствующим в сыворотке собаки, пораженной опухолью, или гомологичного фактора полипептида у человека, коровы или лошади (см. пример 1). SCD1 человека, который является человеческим гомологическим фактором SCD1 собаки, имеет идентичность последовательности, составляющую 89% в отношении последовательности оснований и 90% в отношении аминокислотной последовательности; SCD1 быка, который является бычьим гомологическим фактором, имеет идентичность последовательности, составляющую 88% в отношении последовательности оснований и 87% в отношении аминокислотной последовательности; и SCD1 лошади, который является гомологическим лошадиным фактором, имеет идентичность последовательности, составляющую 90% в отношении последовательности оснований и 87% в отношении аминокислотной последовательности.
Полипептид (а) представляет собой полипептид, состоящий из не менее 7-ми последовательных, предпочтительно 8, 9, или не менее 10-ти последовательных аминокислот в полипептиде, имеющем аминокислотную последовательность SEQ ID NO:2, 4, 22 или 24, и обладающий иммунитет-индуцирующей активностью. Более предпочтительно, полипептид представляет собой полипептид, состоящий из аминокислотной последовательности, имеющей идентичность последовательности не менее 85% в отношении аминокислотной последовательности SEQ ID NO:4, и, особенно предпочтительно, полипептид имеет аминокислотную последовательность SEQ ID NO:2, 4, 22 или 24. Как известно в данной области техники, полипептид, имеющий не менее 7 аминокислотных остатков, может проявлять свою антигенность и иммуногенность. Таким образом, полипептид, имеющий не менее 7 последовательных аминокислотных остатков в аминокислотной последовательности SEQ ID NO:2, 4, 22 или 24, может обладать иммунитет-индуцирующей активностью, и, соответственно, полипептид может быть использован для получения иммунитет-индуцирующего агента по настоящему изобретению.
В основе иммунной индукции посредством введения полипептида, обладающего свойствами ракового антигена, лежит следующий известный процесс: полипептид включается в антиген-презентирующую клетку, и затем в клетке с помощью пептидаз он распадается на более мелкие фрагменты, с последующим проявлением на поверхности клетки. Далее фрагменты распознаются цитотоксическими Т-клетками или тому подобными, которые избирательно убивают клетки, презентирующие антиген. Размер полипептида, представленного на поверхности антиген-презентирующей клетки, является относительно небольшим и составляет около 7-30 аминокислот. Таким образом, с точки зрения презентирования полипептида на поверхности антиген-презентирующей клетки, один предпочтительный вариант описанного выше полипептида (а) представляет собой полипептид, состоящий из приблизительно 7-30 последовательных аминокислот в аминокислотной последовательности SEQ ID NO:2, 4, 22 или 24, и, более предпочтительно, полипептид, состоящий из приблизительно 8-30 или приблизительно 9-30 аминокислот, является удовлетворительным в качестве полипептида (а). В некоторых случаях эти относительно небольшие полипептиды представлены непосредственно на поверхности антиген-презентирующих клеток, не будучи включенными в антиген-презентирующие клетки.
Кроме того, полипептид, включенный в антиген-презентирующую клетку, расщепляется в клетке с помощью пептидаз на случайные участки с образованием различных полипептидных фрагментов, которые затем презентируются на поверхности антиген-презентирующей клетки. Таким образом, введение большого полипептида, например, как полноразмерная область SEQ ID NO:2, 4, 22 или 24, неизбежно вызывает продуцирование полипептидных фрагментов путем распада в антиген-презентирующей клетке, и эти фрагменты являются эффективными для иммунной индукции посредством антиген-презентирующей клетки. Соответственно, для иммунной индукции посредством антиген-презентирующей клетки также можно предпочтительно использовать большой полипептид, и полипептид может состоять не менее чем из 30, предпочтительно не менее чем из 100, более предпочтительно не менее чем из 200, еще более предпочтительно не менее чем из 250 аминокислот. Еще более предпочтительно, полипептид может состоять из полноразмерной области SEQ ID NO:2, 4, 22 или 24.
Полипептид (b) представляет собой полипептид, аналогичный полипептиду (а), за исключением того, что небольшое количество (предпочтительно, один или несколько) аминокислотных остатков замещены, удалены и/или встроены, который имеет идентичность последовательности не менее 90%, предпочтительно не менее 95%, более предпочтительно не менее 98%, еще более предпочтительно не менее 99% или не менее 99,5%, относительно исходной последовательности, и он обладает иммунитет-индуцирующей активностью. В данной области техники хорошо известно, что обычно возможны случаи, когда белковый антиген сохраняет почти такую же антигенность, как и оригинальный белок, даже если аминокислотная последовательность белка модифицирована таким образом, что небольшое число аминокислотных остатков замещено, удалено и/или встроено. Таким образом, поскольку полипептид (b) также может демонстрировать иммунитет-индуцирующую активность, он может быть использован для приготовления иммунитет-индуцирующего агента по настоящему изобретению. Кроме того, полипептид (b) также предпочтительно представляет собой полипептид, имеющий такую же аминокислотную последовательность, как и аминокислотная последовательность SEQ ID NO:2, 4, 22 или 24, за исключением того, что один или несколько аминокислотных остатков замещены, удалены и/или встроены. Используемый в настоящем документе термин "несколько" означает целое число от 2 до 10, предпочтительно целое число от 2 до 6, более предпочтительно целое число от 2 до 4.
Используемый в настоящем документе термин "идентичность последовательностей" аминокислотных последовательностей или последовательностей оснований означает значение, рассчитанное путем выравнивания для сравнения двух аминокислотных последовательностей (или последовательностей оснований) таким образом, чтобы число равноценных аминокислотных остатков (или оснований) было максимальным между аминокислотными последовательностями (или последовательностями оснований), и затем делением числа равноценных аминокислотных остатков (или количества соответствующих оснований) на общее количество аминокислотных остатков (или общее количество оснований), и это значение выражают в виде процентов. Когда осуществляют выравнивание, то один или несколько гэпов, по мере необходимости, встраивают в одну или обе из двух сравниваемых последовательностей. Такое выравнивание последовательностей может быть осуществлено с использованием хорошо известной программы, такой как BLAST, FASTA или CLUSTAL W. В случае, когда вставлены один или несколько гэпов, описанное выше общее число аминокислотных остатков представляет собой число остатков, вычисленных путем подсчета одного гэпа в качестве одного аминокислотного остатка. Когда подсчитанное таким образом общее количество аминокислотных остатков отличается между двумя сравниваемыми последовательностями, идентичность последовательности (%) рассчитывают путем деления числа совпадающих аминокислотных остатков на общее количество аминокислотных остатков в более длинной последовательности.
20 видов аминокислот, составляющих природные белки, могут быть классифицированы на группы, в каждой из которых сходные свойства являются объединяющими, например, на нейтральные аминокислоты с боковыми цепями, имеющими низкую полярность (Gly, Ile, Val, Leu, Ala, Met, Pro), нейтральные аминокислоты, имеющие гидрофильные боковые цепи (Asn, Gln, Thr, Ser, Tyr, Cys), кислотные аминокислоты (Asp, Glu), основные аминокислоты (Arg, Lys, His) и ароматические аминокислоты (Phe, Tyr, Trp). Известно, что во многих случаях замещение аминокислоты в пределах одной группы не изменяет свойств полипептида. Таким образом, в тех случаях, когда аминокислотный остаток в полипептиде (а) по настоящему изобретению является замещенным, вероятность того, что иммунитет-индуцирующая активность может быть сохранена, возможно увеличить осуществлением замещения в пределах одной группы, что является предпочтительным.
Полипептид (с) представляет собой полипептид, содержащий полипептид (а) или (b) в качестве части последовательности, и он обладает иммунитет-индуцирующей активностью. То есть, полипептид (с) представляет собой полипептид, в котором одна или несколько аминокислот и/или один или несколько полипептидов добавлены на одном или обоих концах полипептида (а) или (b), и он обладает иммунитет-индуцирующей активностью. Такой полипептид может также быть использован при получении иммунитет-индуцирующего агента по настоящему изобретению.
Вышеописанные полипептиды могут быть синтезированы, например, методом химического синтеза, таким как Fmoc-способ (флуоренилметилоксикарбонильный способ) или tBOC-способ (трет-бутилоксикарбонильный способ). Кроме того, они могут быть синтезированы обычными способами с использованием различных видов коммерчески доступных синтезаторов пептидов. Помимо этого, представляющий интерес полипептид может быть получен с использованием известных методов генной инженерии, путем получения полинуклеотида, кодирующего полипептид, и включения полинуклеотида в вектор экспрессии, с последующим введением полученного вектора в клетку-хозяина, и давая клетке-хозяину продуцировать в ней полипептид.
Полинуклеотид, кодирующий вышеуказанный полипептид, может быть легко получен известными методами генной инженерии или обычным способом с использованием коммерчески доступного синтезатора нуклеиновых кислот. Например, ДНК, имеющая последовательность оснований SEQ ID NO:1, может быть получена путем проведения ПЦР с использованием хромосомной ДНК собаки или библиотеки кДНК в качестве матрицы, и пары праймеров, сконструированных таким образом, чтобы последовательность оснований SEQ ID NO:1 могла бы быть амплифицирована с их помощью. ДНК, имеющая последовательность оснований SEQ ID NO:3, может быть аналогичным образом получена с использованием человеческой хромосомной ДНК или библиотеки кДНК в качестве матрицы. Реакционные условия для ПЦР могут быть подобраны соответствующим образом, и примеры реакционных условий включают, но этим не ограничиваются, повторение процесса реакции при 94°С в течение 30 секунд (денатурация), при 55°С в течение от 30 секунд до 1 минуты (отжиг) и при 72°С в течение 2 минут (элонгация), путем, например, 30 циклов, с последующим взаимодействием при 72°С в течение 7 минут. Кроме того, желаемая ДНК может быть выделена путем получения соответствующего зонда или праймера на основе данных о последовательности оснований или аминокислотной последовательности SEQ ID NO:1 или 3 из СПИСКА ПОСЛЕДОВАТЕЛЬНОСТЕЙ настоящего описания, и скрининга библиотеки кДНК собаки, человека или т.п., с использованием зонда или праймера. Библиотеку кДНК предпочтительно получают из клеток, органа или ткани, экспрессирующих белок SEQ ID NO:2 или 4. Вышеописанные операции, такие как получение зонда или праймера, составление библиотеки кДНК, скрининг библиотеки кДНК и клонирование представляющего интерес гена известны специалистам в данной области и могут быть выполнены в соответствии с методами, описанными в обзоре Molecular Cloning, Second Edition; Current Protocols in Molecular Biology, и/или тому подобными методами. Из полученной таким образом ДНК может быть получена ДНК, кодирующая полипептид (a). Кроме того, поскольку кодоны, кодирующие каждую аминокислоту, являются известными, может быть легко определена последовательность оснований полинуклеотида, кодирующего специфическую аминокислотную последовательность. Таким образом, поскольку может быть также легко определена последовательность оснований полинуклеотида, кодирующего полипептид (b) или полипептид (с), такой полинуклеотид также может быть легко синтезирован обычным способом с использованием коммерчески доступного синтезатора нуклеиновых кислот.
Клетки-хозяева не ограничены в тех рамках, в которых клетки могут экспрессировать описанный выше полипептид, и примеры клеток включают, но этим не ограничиваются, прокариотические клетки, такие как E.coli; и эукариотические клетки, такие как культивируемые клетки млекопитающих, включая клетки почек обезьяны COS1 и клетки яичников китайского хомячка СНО; почкующиеся дрожжи; делящиеся дрожжи; клетки шелкопряда; и яйцеклетки Xenopus laevis.
В тех случаях, когда в качестве клеток-хозяев используются прокариотические клетки, используют вектор экспрессии, содержащий ориджин, который обеспечивает репликацию вектора в прокариотической клетке, промоторе, участке связывания рибосомы, сайте клонирования ДНК, терминаторе и/или тому подобное. Примеры вектора экспрессии для E.coli включают систему pUC, pBluescriptII, систему экспрессии pET и систему экспрессии pGEX. Путем введения ДНК, кодирующей вышеуказанный полипептид, в такой вектор экспрессии и трансформации прокариотических клеток-хозяев с этим вектором и последующим культивированием полученных трансформантов, полипептид, кодируемый ДНК, может быть экспрессирован в прокариотических клетках-хозяевах. В таком случае полипептид может быть также экспрессирован в виде слитого белка с другим белком.
В тех случаях, когда в качестве клеток-хозяев используют эукариотические клетки, в качестве вектора экспрессии используют вектор экспрессии для эукариотических клеток, состоящий из промотора, сплайсинга, поли(А)-аддитивного сайта и/или тому подобного. Примеры такого вектора экспрессии включают pKA1, pCDM8, pSVK3, pMSG, pSVL, pBK-CMV, pBK-RSV, вектор EBV, pRS, pcDNA3, pMSG и pYES2. Как и в предыдущем случае, путем введения ДНК, кодирующей вышеуказанный полипептид, в такой вектор экспрессии, и трансформации эукариотических клеток-хозяев с вектором и последующим культивированием полученных трансформантов, полипептид, кодируемый ДНК, может быть экспрессирован в эукариотических клетках-хозяевах. В случаях, когда в качестве вектора экспрессии pIND/V5-His, pFLAG-CMV-2, pEGFP-N1, pEGFP-C1 или тому подобное, указанный полипептид может быть экспрессирован в виде слитого белка, содержащего тег, такой как His-тег (гистидиновый тег), FLAG-тег, myc-тег, HA-тег (гемагглютинин-тег) или GFP (зеленый флуоресцентный белок).
Для введения вектора экспрессии в клетку-хозяина может быть использован хорошо известный метод, такой как электропорация, метод трансфекции фосфатом кальция, метод с применением липосом или метод трансфекции, опосредованной DEAE (диэтиламиноэтил)-декстраном.
Выделение и очистка представляющего интерес полипептида из клеток-хозяев могут быть выполнены посредством комбинирования известных способов выделения. Примеры известных способов выделения включают, но ими не ограничиваются, обработку денатурантом, таким как мочевина или поверхностно-активное вещество, обработку ультразвуком; ферментативное сбраживание; высаливание или фракционное осаждение растворителем; диализ; центрифугирование; ультрафильтрацию; гель-фильтрацию; SDS-PAGE; изоэлектрофокусирование; ионообменную хроматографию; гидрофобную хроматографию; аффинную хроматографию; и хроматографию с обращенными фазами.
Полипептиды, полученные вышеописанными способами, включают также, как указано выше, полипептиды в виде слитого белка с другим произвольным белком. Примеры таких полипептидов включают слитые белки с глутатион S-трансферазой (GST) и слитые белки с His-тегом. Такой полипептид в виде слитого белка также включен в объем настоящего изобретения в качестве описанного выше полипептида (с). Кроме того, в некоторых случаях полипептид, экспрессированный в трансформированной клетке, в клетке после трансляции был модифицирован различными способами. Такой пост-трансляционно модифицированный полипептид также включен в объем настоящего изобретения, поскольку он обладает иммунитет-индуцирующей активностью. Примеры такой пост-трансляционной модификации включают: удаление N-концевого метионина; N-концевое ацетилирование; гликозилирование; ограниченное расщепление с помощью внутриклеточной протеазы; миристоилирование; изопренилирование и фосфорилирование.
Как описано более конкретно в приведенных далее примерах, введение полипептида, обладающего иммунитет-индуцирующей активностью, в живой организм, пораженный опухолью, обеспечивает регрессию уже существующей опухоли. Таким образом, иммунитет-индуцирующий агент по настоящему изобретению может быть использован в качестве терапевтического и/или профилактического средства для лечения злокачественного новообразования. Кроме того, полипептид, обладающий иммунитет-индуцирующей активностью, может быть использован в способе терапии и/или профилактики злокачественного новообразования посредством индукции иммунного ответа.
Используемые в настоящем изобретении термины "опухоль" и "рак" означают злокачественные новообразования и используются взаимозаменяемо.
В этом случае, рак, подлежащий лечению, не является ограниченным в тех рамках, в каких происходит экспрессия SCD1 в злокачественном новообразовании, и злокачественное новообразование, предпочтительно, представляет собой рак молочной железы, опухоль головного мозга, рак толстой кишки, перианальную аденокарциному, мастоцитому, нейробластому, рак почки, рак печени, рак легких, рак предстательной железы или лейкоз.
Субъектом-животным предпочтительно является млекопитающее, более предпочтительно, такое млекопитающее, как примат, “ручное” животное, домашнее животное или животное для участия в спортивных соревнованиях, в частности, предпочтительно, это может быть человек, собака или кошка.
Путь введения иммунитет-индуцирующего агента по настоящему изобретению в живой организм может представлять собой пероральное введение или парентеральное введение, и, предпочтительно, парентеральное введение, такое как внутримышечное введение, подкожное введение, внутривенное введение или внутриартериальное введение. В тех случаях, когда иммунитет-индуцирующий агент используют для терапии злокачественного новообразования, он может быть введен в региональный лимфатический узел в непосредственной близости от опухоли, подлежащей лечению, как описано в приведенных ниже примерах, с тем, чтобы повысить его противоопухолевую активность. Доза может быть любой, при условии, что доза является эффективной для индукции иммунного ответа, и, например, в случаях, когда агент используют для терапии и/или профилактики злокачественного новообразования, доза может быть эффективной для терапии и/или профилактики злокачественного новообразования. Дозу, эффективную для терапии и/или профилактики злокачественного новообразования, соответствующим образом выбирают в зависимости от размера, симптомов и т.п. опухоли, и эффективная доза, как правило, составляет от 0,0001 мкг до 1000 мкг, предпочтительно, от 0,001 мкг до 1000 мкг на субъект-животное в сутки. Агент может быть введен однократно, или раздельно несколько раз. Агент, предпочтительно, вводят раздельно несколько раз, в течение от каждых нескольких дней до нескольких месяцев. Как конкретно показано в приведенных далее примерах, иммунитет-индуцирующий агент по настоящему изобретению может вызывать регрессию уже существующей опухоли. Таким образом, поскольку агент может проявлять свою противораковую активность также против небольшого количества раковых клеток на ранней стадии, развитие или рецидив злокачественного новообразования можно предотвратить с помощью агента до развития злокачественного новообразования или после терапии раковой опухоли. То есть, иммунитет-индуцирующий агент по настоящему изобретению эффективен как для лечения, так и профилактики раковой опухоли.
Иммунитет-индуцирующий агент по настоящему изобретению может содержать только лишь полипептид или может быть получен смешиванием, в зависимости от ситуации, с добавкой, такой как фармацевтически приемлемый носитель, разбавитель или наполнитель, соответствующей каждому способу введения. Способы получения и добавки, которые могут быть использованы, хорошо известны в области разработки лекарственных средств, и могут быть использованы любые способы и добавки. Конкретные примеры добавок включают, но этим не ограничиваются, разбавители, такие как физиологические буферные растворы; носители, такие как сахар, лактоза, кукурузный крахмал, фосфат кальция, сорбит и глицин; связующие, такие как сироп, желатин, аравийская камедь, сорбит, поливинилхлорид и трагакант; и лубриканты, такие как стеарат магния, полиэтиленгликоль, тальк и диоксид кремния. Примеры композиции включают пероральные препараты, такие как таблетки, капсулы, гранулы, порошки и сиропы, и препараты для парентерального введения, такие как препарат для ингаляции, инъекционные растворы, свечи и растворы. Эти композиции могут быть получены общеизвестными технологическими способами.
Иммунитет-индуцирующий агент по настоящему изобретению может быть использован в сочетании с усилителями иммунитета, способными усилить иммунный ответ в живом организме. Усилитель иммунитета может содержаться в иммунитет-индуцирующем агенте по настоящему изобретению или вводиться в виде отдельной композиции пациенту в сочетании с иммунитет-индуцирующим агентом по настоящему изобретению.
Примеры усилителя иммунитета включают вспомогательные вещества. Вспомогательные вещества могут усиливать иммунный ответ путем обеспечения резервуара для антигена (внеклеточный или внутри макрофагов), активируя макрофаги и стимулируя определенные группы лимфоцитов, тем самым повышая иммунный ответ и, соответственно, противораковое действие. Таким образом, особенно в тех случаях, когда иммунитет-индуцирующий агент по настоящему изобретению используют для терапии и/или профилактики злокачественного новообразования, иммунитет-индуцирующий агент, предпочтительно, содержит вспомогательное вещество, в дополнение к вышеописанному полипептиду, используемому в качестве эффективного ингредиента. Многие типы вспомогательных веществ хорошо известны в данной области, и может быть использовано любое из этих вспомогательных веществ. Конкретные примеры вспомогательных веществ включают MPL (SmithKline Beecham), гомологи липополисахарида Salmonella Minnesota Re 595, полученного после очистки и кислотного гидролиза липополисахарида; QS21 (SmithKline Beecham), очищенный сапонин QA-21, выделенный из экстракта Quillja saponaria; DQS21, описанный в заявке PCT WO 96/33739 (SmithKline Beecham); QS-7, QS-17, QS-18 и QS-L1 (So and 10 colleagues, "Molecules and cells", 1997, Vol. 7, p. 178-186); неполный адъювант Фрейнда; полный адъювант Фрейнда; витамин E; монтанид; квасцы; CpG олигонуклеотиды (см., например, Kreig and 7 colleagues, Nature, Vol. 374, p. 546-549); поли-I:C и его производные (например, поли ICLC); и различные эмульсии по типу вода-в-масле, полученные из биоразлагаемых масел, например, сквален и/или токоферол. В их числе, неполный адъювант Фрейнда; монтанид; поли-I:C и его производные; и CpG олигонуклеотиды являются предпочтительными. Соотношение в смеси между вышеописанными вспомогательным веществом и полипептидом обычно составляет около 1:10 - 10:1, предпочтительно примерно 1:5 - 5:1, более предпочтительно около 1:1. Однако вспомогательное вещество не ограничивается вышеописанными примерами, и вспомогательные вещества, известные в данной области, помимо описанных выше, могут также быть использованы в том случае, когда вводят иммунитет-индуцирующий агент по настоящему изобретению (см., например, Goding, "Monoclonal Antibodies: Principles and Practice, 2nd edition", 1986). Способы получения смесей или эмульсий полипептида и вспомогательного вещества хорошо известны специалистам в области вакцинации.
Кроме того, в дополнение к вышеописанным вспомогательным веществам, в качестве описанного выше усилителя иммунитета могут быть использованы факторы, которые стимулируют иммунный ответ у субъекта. Например, в качестве усилителя иммунитета в сочетании с иммунитет-индуцирующим агентом по настоящему изобретению могут быть использованы различные цитокины, обладающие свойством стимулировать лимфоциты и/или антиген-презентирующие клетки. Такие цитокины, способные усиливать иммунный ответ, известны специалистам в данной области, и примеры цитокинов включают, но этим не ограничиваются, интерлейкин-12 (IL-12), GM-CSF, IL-18, интерферон-α, интерферон-β и интерферон-ω, интерферон-γ и Flt3-лиганд, который, как было показано, повышает профилактическое действия вакцин. Такие факторы могут также быть использованы в качестве описанного выше усилителя иммунитета, и могут содержаться в иммунитет-индуцирующем агенте по настоящему изобретению, или могут быть получены в виде отдельной композиции для введения пациенту в сочетании с иммунитет-индуцирующим агентом по настоящему изобретению.
Путем приведения описанного выше полипептида в контакт с антиген-презентирующими клетками in vitro, для представления полипептида могут быть получены антиген-презентирующие клетки. То есть, описанные выше полипептиды (а)-(с) могут быть использованы в качестве агентов для обработки антиген-презентирующих клеток. Примеры антиген-презентирующих клеток, которые могут быть предпочтительно использованы, включают дендритные клетки и В-клетки, имеющие молекулы MHC класса I. Различные молекулы MHC класса I были идентифицированы и хорошо известны. У человека молекулы МНС называются HLA. Примеры молекул HLA класса I включают HLA-A, HLA-B и HLA-C, более конкретно, HLA-A1, HLA-A0201, HLA-A0204, HLA-A0205, HLA-A0206, HLA-A0207, HLA-A11, HLA-A24, HLA-A31, HLA-A6801, HLA-B7, HLA-B8, HLA-B2705, HLA-B37, HLA-Cw0401 и HLA-Cw0602.
Дендритные клетки или В-клетки, имеющие молекулы МНС класса I могут быть получены из периферической крови с помощью хорошо известного метода. Например, опухоль-специфичные дендритные клетки могут быть индуцированы путем индукции дендритных клеток из костного мозга, пуповинной крови или периферической крови пациента посредством гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) и IL-3 (или IL-4), с последующим добавлением опухоль-связанного пептида к культуре клеток.
Путем введения эффективного количества таких дендритных клеток может быть вызван желаемый ответ для терапии злокачественного новообразования. В качестве источника клеток может быть использован костный мозг или пуповинная кровь, взятые у здорового человека, или костный мозг, периферическая кровь и т.п. пациента. В случае использования аутологичных клеток пациента, как ожидается, может быть достигнута высокая безопасность и устранение серьезные побочных эффектов. Периферическая кровь или костный мозг могут быть любым свежим образцом, образцом, хранящимся в холодильнике, и замороженным образцом. Что касается периферической крови, культивировать можно всю кровь, или разделять и культивировать только компоненты крови - лейкоциты, и последнее является более эффективным, и, соответственно, предпочтительным. Кроме того, в числе компонентов крови - лейкоцитов, могут быть отделены мононуклеарные клетки. В случаях, когда клетки получают из костного мозга или пуповинной крови, можно культивировать все клетки, образующие костный мозг, или отделить и культивировать одноядерные клетки. Периферическая кровь, ее компоненты - лейкоциты и клетки костного мозга содержат мононуклеарные клетки, гемопоэтические стволовые клетки и незрелые дендритные клетки, из которых возникают дендритные клетки, а также CD4-позитивные клетки и тому подобное. Способ продуцирования цитокинов не является ограниченным, и могут быть использованы природные или рекомбинантные цитокины и т.п., в тех рамках, в каких были подтверждены их безопасность и физиологическая активность. Предпочтительно, препарат с гарантированным качеством для применения в медицинских целях используется в минимально необходимом количестве. Концентрация добавляемого(мых) цитокина(ов) не ограничивается в тех рамках, в каких дендритные клетки индуцируются при данной концентрации, и, как правило, общая концентрация цитокина(ов), предпочтительно, составляет приблизительно от 10 до 1000 нг/мл, более предпочтительно, приблизительно от 20 до 500 нг/мл. Культивирование может быть осуществлено с использованием хорошо известной среды, обычно используемой для культивирования лейкоцитов. Температура культивирования не ограничивается в тех рамках, в каких возможна пролиферация лейкоцитов при данной температуре, и температура, равная около 37°C, которая соответствует температуре тела человека, является наиболее предпочтительной. Окружающие атмосферные условия в процессе культивирования не ограничиваются в тех рамках, в которых возможна пролиферация лейкоцитов в условиях данной окружающей среды, и культивирование, предпочтительно, осуществляют в токе 5% CO2. Период культивирования не ограничивают в тех рамках, в каких индуцируется необходимое количество клеток, и обычно период составляет от 3 дней до 2 недель. В отношении устройств, используемых для разделения и культивирования клеток, предпочтительно, могут быть использованы соответствующие аппараты, безопасность которых при их использовании в медицинских целях была подтверждена, а эксплуатация является стабильной и простой. В частности, примеры аппаратов для культивирования клеток включают не только обычно используемые сосуды, такие как чашки Петри, колбы и бутылки, но и сосуды слойного типа, многокамерные сосуды, роллер-сосуды, центрифужные сосуды, сосуды для культивирования мешочного типа и колонки с пористым волокном.
Способом, как таковым, который будет использоваться для приведения описанного выше полипептида в контакт с антиген-презентирующими клетками in vitro, может быть способ, хорошо известный в данной области техники. Например, антиген-презентирующие клетки можно культивировать в культуральной среде, содержащей вышеописанный полипептид. Концентрация пептида в среде не ограничивается, и обычно составляет приблизительно от 1 до 100 мкг/мл, предпочтительно от 5 до 20 мкг/мл. Плотность клеток в культуре не ограничивается, и обычно составляет около 103-107 клеток/мл, предпочтительно, приблизительно 5×104 - 5×106 клеток/мл. Культивирование, предпочтительно, осуществляют в соответствии с обычным способом при температуре 37°С в атмосфере 5% CO2. Максимальная длина пептида, который может быть представлен на поверхности антиген-презентирующих клеток, обычно составляет около 30 аминокислотных остатков. Таким образом, в тех случаях, когда антиген-презентирующие клетки вступают в контакт с полипептидом in vitro, полипептид может быть получен таким образом, что его длина составляет не более приблизительно 30 аминокислотных остатков, хотя длину не ограничивают.
При культивировании антиген-презентирующих клеток в сосуществовании с описанным выше полипептидом, полипептид включается в молекулы МНС антиген-презентирующих клеток и презентируется на поверхности антиген-презентирующих клеток. Соответственно, используя вышеописанный полипептид, могут быть получены выделенные антиген-презентирующие клетки, содержащие комплекс между полипептидом и молекулой МНС. Такие антиген-презентирующие клетки могут презентировать полипептид против Т-клеток in vivo или in vitro, чтобы индуцировать и обеспечить пролиферацию цитотоксических Т-клеток, специфичных к полипептиду.
Приведением полученных таким образом антиген-презентирующих клеток, имеющих комплекс между описанным выше полипептидом и молекулой МНС, в контакт с Т-клетками in vitro, цитотоксические Т-клетки, специфичные к полипептиду, могут быть индуцированы и может быть обеспечена их пролиферация. Это может быть осуществлено путем совместного культивирования вышеописанных антиген-презентирующих клеток и Т-клеток в жидкой среде. Например, антиген-презентирующие клетки могут быть суспендированы в жидкой среде и помещены в сосуд, например, в лунку микропланшета, с последующим добавлением Т-клеток в лунку, и затем проведением культивирования. Соотношение антиген-презентирующих клеток и Т-клеток в смеси при совместном культивировании не ограничивается, и обычно составляет приблизительно от 1:1 до 1:100, предпочтительно приблизительно от 1:5 до 1:20, исходя из количества клеток. Плотность суспендируемых в жидкой среде антиген-презентирующих клеток не ограничивается, и обычно составляет приблизительно от 100 до 10000000 клеток/мл, предпочтительно от около 10000 до 1000000 клеток/мл. Совместное культивирование, предпочтительно, осуществляют обычным способом при температуре 37°С в атмосфере 5% CO2. Период культивирования не ограничивается, и обычно составляет от 2 дней до 3 недель, предпочтительно, приблизительно от 4 дней до 2 недель. Совместное культивирование, предпочтительно, проводят в присутствии одного или нескольких интерлейкинов, таких как IL-2, IL-6, IL-7 и/или IL-12. В таких случаях концентрация IL-2 или IL-7, как правило, составляет приблизительно от 5 до 20 Ед/мл, концентрация IL-6, как правило, составляет приблизительно от 500 до 2000 Ед/мл, а концентрация IL-12, как правило, составляет приблизительно от 5 до 20 нг/мл, и концентрации интерлейкинов не ограничиваются. Описанное выше совместное культивирование может быть повторно выполнено один или несколько раз с добавлением свежих антиген-презентирующих клеток. Например, процесс удаления культурального супернатанта после совместного культивирования и добавления свежей суспензии антиген-презентирующих клеток для дальнейшего выполнения совместного культивирования может быть повторно выполнен один или несколько раз. Условия для каждого совместного культивирования могут быть такими же, как описано выше.
При выполнении описанного выше совместного культивирования, цитотоксические Т-клетки, специфичные к полипептиду, индуцируются, и обеспечивается их пролиферация. Таким образом, используя вышеописанный полипептид, могут быть получены выделенные Т-клетки, которые избирательно связываются с комплексом между полипептидом и молекулой МНС.
Как описано в приведенных ниже примерах, ген SCD1 специфически экспрессирован в клетках рака молочной железы, тканях рака молочной железы, клетках опухоли головного мозга, тканях опухоли головного мозга, клетках рака толстой кишки, тканях рака толстой кишки, тканях перианальной аденокарциномы, клетках перианальной аденокарциномы, тканях мастоцитомы, клетках мастоцитомы, клетках нейробластомы, клетках рака почки, тканях рака почки, клетках рака печени, тканях рака печени, клетках рака легких, тканях рака легких, клетках рака предстательной железы, тканях рака предстательной железы и лейкозных клетках. Таким образом, полагают, что в этих образцах злокачественных новообразований присутствует значительно большее количество SCD1, чем в нормальных клетках. Когда полученные таким образом цитотоксические Т-клетки вводят в живой организм, и при этом часть полипептида SCD1, присутствующего в раковых клетках, представлена молекулами МНС на поверхности раковых клеток, цитотоксические Т-клетки могут повредить раковые клетки с помощью презентированного полипептида в качестве маркера. Поскольку антиген-презентирующие клетки, презентируя часть описанного выше полипептида SCD1, могут индуцировать и обеспечивать пролиферацию цитотоксических Т-клеток, специфичных к полипептиду также in vivo, раковые клетки могут быть повреждены также путем введения антиген-презентирующих клеток в живой организм. То есть, цитотоксические Т-клетки и антиген-презентирующие клетки, полученные с использованием полипептида, также эффективны в качестве агентов для терапии и/или профилактики злокачественного новообразования, аналогично иммунитет-индуцирующему агенту по настоящему изобретению.
В тех случаях, когда вышеописанные выделенные антиген-презентирующие клетки или выделенные Т-клетки, вводят в живой организм, их предпочтительно получают обработкой антиген-презентирующих клеток или Т-клеток, полученных от подлежащего лечению пациента, с использованием полипептида (а), (b) или (c), как описано выше, во избежание иммунного ответа в живом организме, который атакуют эти клетки как инородные тела.
Терапевтический и/или профилактический агент для злокачественного новообразования, включающий в качестве эффективного ингредиента антиген-презентирующие клетки или Т-клетки, предпочтительно, вводят парентеральным способом, например, путем внутривенного или внутриартериального способа введения. Дозу соответствующим образом выбирают в зависимости от симптомов, цели введения и т.п., и она обычно составляет от 1 клетки до 10000000000000 клеток, предпочтительно, от 1000000 клеток до 1000000000 клеток, и дозу, предпочтительно, вводят с частотой от одного раза каждые несколько дней до одного раза в несколько месяцев. Композиция может представлять собой, например, клетки, суспендированные в физиологическом солевом буфере, и композиция может быть использована в сочетании с другим(ми) противораковым(ми) препаратом(ами) и/или цитокином(ами). Кроме того, также могут быть добавлены одна или несколько добавок, хорошо известные в области получения фармацевтических препаратов.
Кроме того, при экспрессии полинуклеотида, кодирующего любой из полипептидов (а)-(с) в организме животного-субъекта, может быть индуцирована выработка антител и цитотоксических Т-клеток в живом организме, и может быть получен эффект, сравнимый с эффектом, получаемым в случае введения полипептида. То есть, иммунитет-индуцирующий агент по настоящему изобретению может быть агентом, содержащим в качестве эффективного ингредиента рекомбинантный вектор, имеющий полинуклеотид, кодирующий любой из полинуклеотидов (а)-(с), рекомбинантный вектор, который способен экспрессировать полипептид в живом организме. Такой рекомбинантный вектор, способный экспрессировать антигенный полипептид, как показано в приведенных далее примерах, также называется генной вакциной.
Вектор, используемый для продуцирования генной вакцины, не является ограниченным в тех рамках, в каких он представляет собой вектор, способный экспрессировать полипептид в клетке субъекта-животного (предпочтительно, в клетке млекопитающего), и он может представлять собой или плазмидный вектор, или вирусный вектор, и может быть использован любой известный вектор в области генных вакцин. Полинуклеотид, такой как ДНК или РНК, кодирующий вышеописанный полипептид, может быть легко получен, как указано выше, обычным способом. Встраивание полинуклеотида в вектор может быть осуществлено с использованием способа, хорошо известного специалистам в данной области.
Способ введения генной вакцины, предпочтительно, представляет собой парентеральный способ введения, такой как внутримышечный, подкожный, внутривенный или внутриартериальный способы введения. Доза может быть выбрана соответствующим образом в зависимости от типа антигена и тому подобное, и, как правило, составляет от около 0,1 мкг до 100 мг, предпочтительно, от около 1 мкг до 10 мг в единицах массы генной вакцины на кг веса тела.
Примеры способа с использованием вирусного вектора включают способы, в которых полинуклеотид, кодирующий описанный выше полипептид, встраивают в РНК-вирус или ДНК-вирус, такой как ретровирус, аденовирус, аденоассоциированный вирус, вирус герпеса, вирус коровьей оспы, поксвирус, полиовирус или вирус Синдбис, а затем животное-субъект инфицируют полученным вирусом. В числе этих способов, особенно предпочтительными являются способы, использующие ретровирус, аденовирус, аденоассоциированный вирус, вирус коровьей оспы или т.п.
Примеры других способов включают способ, в котором плазмиду для экспрессии непосредственно вводят внутримышечно (метод ДНК-вакцин), и липосомный способ, способ с использованием липофектина, способ микроинъекции, кальций-фосфатный способ и способ электропорации. Особенно предпочтительными являются способ ДНК-вакцин и липосомный способ.
Способы получения гена, кодирующего вышеописанный полипептид, используемый в настоящем изобретении, фактически действующего в качестве фармацевтического средства, включают in vivo способы, в которых ген непосредственно вводят в организм, и ex vivo способы, в которых определенный вид клеток получают от субъекта-животного, и далее ген вводят в клетки ex vivo, с последующим возвратом клеток в организм (Nikkei Science, 1994, April, p. 20-45; The Pharmaceutical Monthly, 1994, Vol. 36, No. 1, p. 23-48; Experimental Medicine, Extra Edition, 1994, Vol.12, No. 15; и ссылки, указанные в этой литературе, и тому подобное). Более предпочтительными являются in vivo способы.
В случаях, когда ген вводят способом in vivo, ген может быть введен подходящим способом введения, в зависимости от заболевания, подлежащего лечению, симптомов и тому подобного. Ген может быть введен, например, внутривенным, внутриартериальным, подкожным или внутримышечным способом введения. В случаях, когда ген вводят способом in vivo, ген может быть получен в виде препарата, такого как раствор, и, обычно, его получают в виде инъекционного раствора или тому подобного, содержащего ДНК, кодирующую вышеописанный пептид по настоящему изобретению в качестве эффективного ингредиента. При необходимости также может быть добавлен обычно используемый носитель. В случаях липосомы или липосомы, слитой с мембраной (вирус Сендай (HVJ)-липосома или тому подобное), содержащей ДНК, липосома может быть получена в виде липосомного препарата, такого как суспензия, замороженный препарат или концентрированный центрифугированием замороженный препарат.
В настоящем изобретении "последовательность оснований SEQ ID NO:1" включает не только фактическую последовательность оснований SEQ ID NO:1, но также и комплементарную ей последовательность. Таким образом, "полинуклеотид, имеющий последовательность оснований SEQ ID NO:1", включает одноцепочечный полинуклеотид, имеющий фактическую последовательность оснований SEQ ID NO:1, одноцепочечный полинуклеотид, имеющий комплементарную ей последовательность оснований, двухцепочечный полинуклеотид, состоящий из этих одноцепочечных полинуклеотидов. В случае, когда получают полинуклеотид, кодирующий используемый в настоящем изобретении полипептид, соответствующим образом выбирается любая из этих последовательностей оснований, и специалист в данной области может легко осуществить этот выбор.
ПРИМЕРЫ
Настоящее изобретение описано далее более подробно с помощью примеров.
Пример 1: Получение нового белка - ракового антигена методом SEREX:
(1) Получение библиотеки кДНК
Тотальную РНК экстрагировали из семенников собак методом кислота-гуанидий-фенол-хлороформной экстракции, и поли(А)РНК очищали, используя набор для очистки мРНК Oligotex-dT30 (производства Takara Shuzo Co., Ltd.) в соответствии с инструкцией, прилагаемой к набору.
Используя полученную мРНК (5 мкг), синтезировали фаговую библиотеку кДНК. Для получения фаговой библиотеки кДНК использовали набор для синтеза кДНК, набор для синтеза кДНК Zap, набор для клонирования ZAP-cDNA Gigapack III Gold Cloning Kit (производства STRATAGENE) в соответствии с инструкциями, прилагаемыми к наборам. Размер полученной фаговой библиотеки кДНК составлял 1×106 БОЕ/мл.
(2) Скрининг библиотеки кДНК с помощью сыворотки
Используя полученную таким образом фаговую библиотеку кДНК, осуществляли иммуноскрининг. Более конкретно, массу E. coli (XL1-Blue MRF') инфицировали библиотекой, такой как 2340 клонов, проявляющихся на агарозной пластине NZY размером 90 мм диам. × 15 мм и культивированных при 42°C в течение 3-4 часов, чтобы дать фагу образовать бляшки. Пластину покрывали нитроцеллюлозной мембраной (Hybond C Extra: производства GE Healthecare Bio- Sciece), пропитанной IPTG (изопропил-β-D-тиогалактозид) при 37°C в течение 4 часов для индукции и экспрессии белков, и белки переносили на мембрану. Затем мембрану снимали и отмачивали в TBS (10 мМ Трис-HCl, 150 мМ NaCl; рН 7,5) с добавленным 0,5%-ным обезжиренным сухим молоком. Мембрану встряхивали при 4°C в течение ночи для подавления неспецифических взаимодействий. Затем фильтр оставляли взаимодействовать с разведенной в 500 раз сывороткой собаки-пациента при комнатной температуре в течение от 2 до 3 часов.
В качестве вышеуказанной сыворотки собаки-пациента использовали сыворотку, полученную от собаки-пациента с перианальной опухолью. Сыворотку хранили при -80°C и предварительно обрабатывали непосредственно перед использованием. Способ предварительной обработки сыворотки был следующим. Так, массу E. coli (XL1-Blue MRF') инфицировали фагом λ ZAP Express, не имеющим встроенного чужеродного гена, и затем культивировали в среде NZY на планшете при 37°C в течение ночи. Затем на планшет помещали буфер 0,2М NaHCO3 (рН 8,3), содержащий 0,5М NaCl, и планшет оставляли стоять в течение 15 часов при 4°C, далее собрали супернатант в виде экстракта E. coli/фаг. После этого собранный экстракт E. coli/фаг пропускали через NHS-колонку (производства GE Healthecare Bio-Science) для последующей иммобилизации белков, полученных из E. Coli/фага. Сыворотку от собаки-пациента пропускали, давая взаимодействовать, через эту колонку с иммобилизированными белками для удаления антител, которые адсорбируются на E. Coli и/или фаге. Фракцию сыворотки, которую пропускали через колонку, 500-кратно разводили TBS, содержащим 0,5% обезжиренного сухого молока, и полученный продукт разведения использовали в качестве материала для иммуноскрининга.
Мембрану, которая была загрязнена обработанной таким образом сывороткой и вышеописанным пептидилированным белком, промывали 4 раза TBS-T (0,05% Tween20/TBS), и подвергали взаимодействию с анти-собачьими IgG (козьи анти-собачьи IgG-h+I HRP конъюгированные: производства BETHYL Laboratories), разводили 5000-кратно TBS, содержащим 0,5% обезжиренного сухого молока, в качестве второго антитела при комнатной температуре в течение 1 часа, затем определяли с помощью реакции окрашивания ферментов, используя реакционный раствор NBT/BCIP (производства Roche). Колонии в положениях, соответствующих участкам положительной реакции окрашивания, собирали с агарозного планшета NZY, имеющего размер 90 мм диам. × 15 мм и разводили в 500 мкл буфера SM (100 мМ NaCl, 10 мМ MgClSO4, 50 мМ Трис-HCl, 0,01% желатин; рН 7,5). Повторяли скрининг как второй, так и третий раз таким же образом, как описано выше, до получения отдельной колонии с положительной реакцией окрашивания. Выделение отдельной колонии с положительной реакцией окрашивания достигалось после скрининга клонов фага 9110 с IgG в сыворотке.
(3) Поиск гомологии последовательностей выделенного гена антигена
Чтобы подвергнуть отдельный положительный клон, выделенный вышеописанным способом, анализу последовательности оснований, проводили операцию преобразования вектора фага в плазмидный вектор. Более конкретно, 200 мкл раствора, приготовленного таким образом, что массу E. Coli (XL1-Blue MRF') с оптической плотностью OD600, равной 1, смешивали со 100 мкл очищенного раствора фага и затем с 1 мкл хелперного фага ExAssist (производства STRATAGENE), и давали взаимодействию протекать при 37°C в течение 15 минут. Затем следовало добавление в реакционную смесь 3 мл среды LB, и культура производилась с полученной смесью при 37°C в течение от 2,5 до 3 часов. Полученную культуру сразу инкубировали при 70°C в течение 20 минут на водяной бане. Культуру затем центрифугировали при 4°C, в течение 15 минут при 1000×g, и отбирали супернатант в виде раствора фагемида. Далее, 200 мкл раствора, приготовленного таким образом, чтобы фагемидная масса E. Coli (SOLR) имела оптическую плотность OD600, равную 1, смешивали с 10 мкл очищенного раствора фага, и реакции давали протекать при 37°C в течение 15 мин. Затем 50 мкл реакционной смеси помещали на планшет в среду агара LB с ампициллином (конечная концентрация 50 мкг/мл), и культивировали при 37°C в течение ночи. Отдельную колонию трансформированной SOLR отделяли и культивировали в среде LB с ампициллином (конечная концентрация 50 мкг/мл) при 37°C, затем очищали плазмидную ДНК, содержащей интересующую вставку, с использованием набора реагентов для выделения плазмидной ДНК QIAGEN Plasmide Miniprep Kit (производства Qiagen).
Используя праймер T3 последовательности SEQ ID NO:7 и праймер T7 последовательности SEQ ID NO:8, очищенную плазмиду подвергали анализу всей длины последовательности вставки по методу праймерной «прогулки». С помощью этого анализа последовательности получали последовательность гена SEQ ID NO:1. Используя последовательность оснований и аминокислотную последовательность этого гена, проводили поиск гомологии против известных генов с использованием программы BLAST по поиску гомологии последовательностей (http://www.ncbi.nlm.nih.gov/BLAST/). В результате было обнаружено, что полученный ген представляет собой ген SCD1. SCD1 человека, который представляет собой человеческий гомологичный фактор SCD1 собаки, имел идентичность последовательности на 89% в терминах последовательности оснований и 90% в терминах последовательности аминокислот; SCD1 мышей, который представляет собой мышиный гомологичный фактор, имел идентичность последовательности на 84% в терминах последовательности оснований и 84% в терминах последовательности аминокислот. Последовательность оснований и последовательность аминокислот SCD1 человека показаны в SEQ ID NO:3 и SEQ ID NO:4, соответственно, и последовательность оснований и последовательность аминокислот SCD1 мышей показаны в SEQ ID NO:5 и SEQ ID NO:6, соответственно.
(4) Анализ экспрессии в различных тканях
Экспрессию генов, полученных вышеуказанным способом, в нормальных тканях собаки, человека и мыши и различных клеточных линиях исследовали методом ОТ-ПЦР (ПЦР с обратной транскрипцией). Реакцию обратной транскрипции проводили следующим образом. Так, из от 50 до 100 мг каждой ткани или от 5×106 до 10×106 клеток каждой линии клеток экстрагировали всю РНК с помощью реагента TRIZOL (производства Invitrogen) в соответствии с протоколом, описанным в прилагаемой инструкции. Используя эту всю РНК, синтезировали кДНК с помощью системы синтеза Superscript First-Stand Synthesis System для ОТ-ПЦР (производства Invitrogen) в соответствии с протоколом, описанным в прилагаемой инструкции. В качестве кДНК нормальных тканей человека (мозг, гиппокамп, семенники, толстая кишка, плацента) использовали генный пул кДНК (производства Invitrogen), QUICK-Clone кДНК (производства CLONTECH) и библиотеку кДНК с большими вставками (производства CLONTECH). Реакцию ПЦР проводили с использованием праймеров, специфичных к полученному гену (праймеры собаки показаны в SEQ ID NO:9 и 10, праймеры человека показаны в SEQ ID NO:11 и 12, праймеры мыши показаны в SEQ ID NO:13 и 14), как описано выше. Так, реагенты и прилагаемый буфер смешивали таким образом, чтобы в полученной смеси в конечном объеме в 25 мкл содержалось 0,25 мкл образца, полученного реакцией обратной транскрипции, 2 мкМ каждого из вышеуказанных праймеров, 0,2 мМ каждого из dNTP и 0,65 Ед. ExTaq-полимеразы (производства Takara Shuzo Co, Ltd), и реакцию проводили 30 циклами при 94°C в течение 30 секунд, при 55°C в течение 30 секунд и при 72°C в течение 1 минуты, используя термоциклер Termal Cycler (производства BIO RAD). В качестве контроля для сравнения в то же время были использованы праймеры, специфичные к GAPDH (праймеры GAPDH собаки и человека показаны в SEQ ID NO:15 и 16, праймеры GAPDH мыши показаны в SEQ ID NO:17 и 18). В результате, как показано на фиг.1, ген SCD1 собаки не экспрессировал в большинстве тканей здоровой собаки, тогда как этот ген сильно экспрессировал в опухолевой ткани собаки. Что касается генов SCD1 человека и мыши, экспрессия не наблюдалась в большинстве нормальных тканей человека и мыши, тогда как экспрессия определялась в большинстве линий раковых клеток (фиг. 2 и 3), как и в случае гена SCD1 собаки.
(5) Количественный анализ экспрессии в различных тканях
Ген, полученный по описанному выше способу, был исследован на экспрессию в нормальных тканях человека с помощью количественного метода ОТ-ПЦР (ПЦР с обратной транскрипцией). В качестве кДНК нормальных тканей человека и раковых тканей использовали сканирование ткани в реальном времени Tissue scan Real Time cancer survey Panel I (производства ORIGENE). Количественную оценку ОТ-ПЦР проводили с использованием системы CFX96 Real Time Cystem - C1000 Thermal Cycler, производства Bio-Rad Laboratories, Inc. Реакции ПЦР проводили следующим образом, используя праймеры, специфичные к полученному гену (показано в SEQ ID NO:11 и 12). То есть, 5 мкл образца, 2 мкМ каждого праймера и реагенты и буфер, содержащиеся в 2×SYBR Premix Ex TaqII полимераза (производства Takara Shuzo Co, Ltd) смешивали вместе до получения конечного объема в 20 мкл, и реакцию проводили 30 циклами при 94°C в течение 30 секунд, при 55°C в течение 30 секунд и при 72°C в течение 1 минуты. В результате уровень экспрессии гена SCD1 в каждом случае рака молочной железы, рака толстой кишки, рака почки, рака печени, рака простаты и рака легких был не менее чем в 4 раза выше, чем уровень экспрессии в соответствующей нормальной ткани. На основе этих результатов можно было бы ожидать отсутствие оснований для беспокойства о проявлении каких-либо побочных эффектов противоопухолевыми агентами, которые нацелены на SCD1 человека в нормальных тканях, и что польза от фармакологического действия агентов будет значительно превосходить риск их побочных эффектов.
Пример 2: Анализ раковой антигенности SCD1 in vivo
(1) Получение рекомбинантного вектора, экспрессирующего SCD1 in vivo
На основании нуклеотидной последовательности SEQ ID NO:5, был получен рекомбинантный вектор, экспрессирующий SCD1 in vivo. ПЦР получали из линии раковых клеток N2a мышей (получены от АТСС), которые показали экспрессию в примере 1. Реагенты и добавленный буфер смешивали таким образом, чтобы в полученной смеси с конечным объемом 50 мкл содержалось 1 мкл кДНК, 0,4 мкМ каждого из двух видов праймеров, имеющих сайты рестрикции HindIII и XbaI (показаны в SEQ ID NO:19 и 20), 0,2 мМ dNTP и 1,25 Ед. PrimeStar HS полимеразы (производства Takara Shuzo Co., Ltd), и ПЦР осуществляли 30 циклами при 98°C в течение 10 секунд, при 55°C в течение 15 секунд и при 72°C в течение 4 минут, используя термоциклер Termal Cycler (производства BIO RAD). Описанными выше двумя типами праймеров были такие, которые пригодны для амплификации области, кодирующей всю аминокислотную последовательность SEQ ID NO:5. После ПЦР амплифицированную ДНК подвергали электрофорезу, используя 1%-ный агарозный гель, и фрагмент ДНК с примерно 1000 п.о. очищали с помощью набора QIAquick Gel Extraction Kit (производства QIAGEN).
Очищенный фрагмент ДНК лигировали в клонирующий вектор PCR-Blunt (производства Invitrogen). E. coli трансформировались с получением продукта лигирования, и затем выделяли плазмиду. Последовательность фрагмента амплифицированного гена была подтверждена секвенированием как соответствующая представляющей интерес последовательности. Плазмиду, имеющую интересующую последовательность, обрабатывали ферментами рестрикции HindIII и XbaI и очищали, используя набор QIAquick Gel Extraction Kit, затем встраивали интересующую последовательность гена в вектор экспрессии млекопитающего pcDNA3.1 (производства Invitrogen), который затем обрабатывали ферментами рестрикции HindIII и XbaI. Использование данного вектор позволяло вырабатывать белок SCD1 в клетках млекопитающих.
К 100 мкг полученной таким образом плазмиды ДНК было добавлено 50 мкг золотых частиц (производства Bio Rad), 100 мкл спермидина (производства SIGMA) и 100 мкл 1М CaCl2 (производства SIGMA), и полученную смесь перемешивали путем встряхивания, затем оставляли смесь стоять в течение 10 минут при комнатной температуре (полученные частицы далее указываются в данном документе как золото-ДНК частицы). Затем смесь центрифугировали при 3000 об/мин в течение 1 минуты, и супернатант отбрасывали, затем осадок промывали 3 раза 100%-ным этанолом (производства WAKO). Добавляли золото-ДНК частицы, 6 мл 100%-ного этанола, и полученную смесь тщательно перемешивали встряхиванием, затем выливали золото-ДНК частицы в трубки Tefzel (производства Bio Rad), и оставляли частицы осаждаться на поверхности стенок. Этанол удаляли из трубки Tefzel, в которой были осаждены золото-ДНК частицы, высушиванием на воздухе, и трубку разрезали на кусочки, имеющие длину, подходящую для генной пушки.
(2) Противоопухолевый эффект SCD1 с помощью метода ДНК-вакцины
Приготовленную выше трубку фиксировали в генной пушке, и ДНК-вакцину вводили трансдермально, путем нанесения под давлением 400 фунт/кв.дюйм, используя чистый газ гелий, всего 3 раза с интервалом в 7 дней, в абдоминальную полость каждой из 10 особей мышей A/J (возраст 7 недель, самцы, получены от фирмы Japan SLC), и мышей Balb/c (возраст 7 недель, самцы, получены от фирмы Japan SLC), шерсть которых была выбрита (это соответствует инокуляции 2 мкг/особь плазмиды ДНК). Затем клеточную линию нейробластомы мышей N2a или клеточную линию рака толстой кишки СТ26 трансплантировали каждой мыши в количестве 1×106 клеток для оценки противоопухолевого действия (профилактическая модель). В качестве контроля, для каждой модели вводили каждой из 10 особей мышей плазмиду ДНК, не содержащую SCD1.
Противоопухолевый эффект оценивали по размеру опухоли (длинный диаметр × короткий диаметр2/2) и проценту выживших мышей. Как результат этого исследования, в профилактической модели, используя линию клеток нейробластомы, на 43 день размер опухоли становился 2966 мм3 и 759 мм3 в контрольной группе и в группе с введенной плазмидой SCD1, соответственно. Таким образом, в группе с введенной плазмидой SCD1 наблюдалась значительная регрессия опухоли. Кроме того, в результате наблюдения процесса выживания в профилактической модели с использованием клеточной линии нейробластомы, было обнаружено, что в контрольной группе все особи умерли до 74 дня после введения, тогда как в группе с введенной плазмидой SCD1 выжило 60% мышей. Эти результаты указывают на значительное противоопухолевое действие в группе с введенной плазмидой SCD1 по сравнению с контрольной группой. Аналогичным образом, в профилактической модели с использованием клеточной линии рака толстой кишки, на 33 день размер опухоли становился 2518 мм3 и 604 мм3 в контрольной группе и в группе с введенной плазмидой SCD1, соответственно. Таким образом, в группе с введенной плазмидой SCD1 наблюдалась значительная регрессия опухоли. Кроме того, в результате наблюдения процесса выживания было обнаружено, что в контрольной группе все особи умерли до 54 дня после введения, тогда как в группе с введенной плазмидой SCD1 выжило 50% мышей. Эти результаты указывают на значительное противоопухолевое действие в группе с введенной плазмидой SCD1 по сравнению с контрольной группой.
Пример 3: Получение рекомбинантного белка SCD1 человека и оценка иммунитет-индуцирующей способности
(1) Получение рекомбинантного белка SCD1 человека
На основе последовательности SEQ ID NO:3 был получен рекомбинантный белок SCD1 человека. Реагенты и добавленный буфер смешивали таким образом, чтобы в полученной смеси с конечным объемом 50 мкл содержалось 1 мкл кДНК, полученный в примере 1, экспрессия которого подтверждалась для ДНК из различных тканей и клеток ОТ-ПЦР методом, 0,4 мкМ каждого из двух видов праймеров, имеющих сайты рестрикции EcoRI и XhoI (показаны в SEQ ID NO:25 и 26), 0,2 мМ dNTP и 1,25 Ед. PrimeStar HS полимеразы (производства Takara Shuzo Co., Ltd), и ПЦР осуществляли 30 циклами при 98°C в течение 10 секунд, при 55°C в течение 15 секунд и при 72°C в течение 4 минут, используя термоциклер Termal Cycler (производства BIO RAD). Описанные выше два типа праймеров были такими, которые амплифицируют область, кодирующую всю аминокислотную последовательность SEQ ID NO:4. После ПЦР амплифицированную ДНК подвергали электрофорезу, используя 1%-ный агарозный гель, и фрагмент ДНК с примерно 1000 п.о. очищали с помощью набора QIAquick Gel Extraction Kit (производства QIAGEN).
Очищенный фрагмент ДНК лигировали в клонирующий вектор pCR-Blunt (производства Invitrogen). E. coli трансформировались с получением продукта лигирования, и затем выделяли плазмиду. Последовательность фрагмента амплифицированного гена была подтверждена секвенированием как соответствующая представляющей интерес последовательности. Плазмиду, имеющую интересующую последовательность, обрабатывали ферментами рестрикции EcoRI и XhoI и очищали, используя набор QIAquick Gel Extraction Kit, затем встраивали интересующую последовательность гена в вектор экспрессии для E. Coli, pET30a (производства Novagen), который затем обрабатывали ферментами рестрикции EcoRI и XhoI. Использование данного вектора позволяло вырабатывать рекомбинантный тег-слитый белок His. E. Coli для экспрессии, BL21 (DE3) был трансформирован с этой плазмидой, и экспрессия была индуцирована с 1 мМ IPTG, давая экспрессию интересующего белка в E. Coli.
(2) Очистка рекомбинантного белка SCD1
Полученный таким образом рекомбинантный E. Coli, который экспрессирует SEQ ID NO:4, был культивирован в среде LB, дополненной 100 мкг/мл ампициллином, при 37°C до поглощения при 600 нм, достигаемого примерно 0,7, и затем в культуру был добавлен изопропил-β-D-1-тиогалактопиранозид до конечной концентрации 1 мМ, затем инкубировали E. Coli при 37°C в течение 4 час. Далее бактериальные клетки собирали центрифугированием при 4800 об/мин в течение 10 минут. Осадок бактериальных клеток в пробирке после центрифугирования суспендировали в фосфатно-солевом буфере и затем подвергали центрифугированию при 4800 об/мин в течение 10 минут для промывки бактериальных клеток.
Бактериальные клетки суспендировали в буфере 50 мМ Трис-HCl (рН 8,0) и подвергали воздействию ультразвуком на льду. Жидкость, полученную при воздействии ультразвука, содержащую E. Coli, центрифугировали при 6000 об/мин в течение 20 минут с получением супернатанта в виде растворимой фракции и осадка в виде нерастворимой фракции.
Нерастворимую фракцию суспендировали в буфере 50 мМ Трис-HCl (рН 8,0) и затем центрифугировали при 6000 об/мин в течение 15 минут. Эту операцию повторяли дважды для удаления протеаз.
Остаток суспендировали в буфере 50 мМ Трис-HCl (рН 8,0), дополненный 6М гидрохлоридом гуанидина и 0,15М NaCl, и оставляли стоять при температуре 4°C в течение 20 часов. Затем суспензию центрифугировали при 6000 об/мин в течение 30 минут, и полученную растворимую фракцию помещали на никелевую хелатную колонку, приготовленную обычным способом (носитель Chelating Sepharose (торговая марка) Fast Flow (GE Health Care); объем колонки 5 мл, уравновешивающий буфер: 50 мМ буфер Трис-HCl (рН 8,0), дополненный 6М гидрохлоридом гуанидина и 0,15М хлоридом натрия), затем оставляли при температуре 4°C на ночь для адсорбции на никель-хелатном носителе. Носитель колонки центрифугировали при 1500 об/мин в течение 5 минут, и полученный супернатант собирали. Носитель колонки затем суспендировали в фосфатно-солевом буфере и вновь помещали на колонку.
Неадсорбированную на колонке фракцию промывали 10 объемами колонки 0,1М ацетатного буфера (рН 4,0), дополненного 0,5М хлоридом натрия, и сразу затем осуществляли элюирование 0,1М ацетатным буфером (рН 3,0), дополненным 0,5М хлоридом натрия, с получением очищенной фракции, которую использовали далее в качестве материала для теста введения. Присутствие интересующего белка в каждой элюированной фракции подтверждали с помощью окрашивания Кумасси, осуществляемого общеизвестным способом.
Буфер очищенного продукта, полученного по способу, описанному выше, был заменен на реакционный буфер (50 мМ Трис-HCl, 100 мМ NaCl, 5 мМ CaCl2 (рН 8,0)), и полученный образец подвергали расщеплению His тега с помощью протеазы фактора Xa и очистке интересующего белка, используя набор Factor Xa Cleavage Capture Kit (производства Novagen) в соответствии с прилагаемой к набору инструкцией. Затем 12 мл буфера с очищенным препаратом, полученным по вышеуказанному способу, заменяли на физиологический фосфатный буфер (производства Nissui Pharmaceutical), используя ультрафильтрацию NANOSEP 10K OMEGA (производства PALL), и полученный образец подвергали асептической фильтрации через 0,22 мкм HT Tafurin Acrodisc (производства PALL) и использовали в эксперименте.
(3) Индукция CD8-позитивных цитотоксических Т-клеток, реагирующих на рекомбинантный белок SCD1 человека
У здорового индивидуума отбирали периферическую кровь, и периферическую кровь помещали в разделительную среду лимфоцитов (OrganonpTeknika, Durham, NC), затем центрифугировали полученное вещество при 1500 об/мин при комнатной температуре в течение 20 минут. Фракции, содержащие мононуклеарные клетки периферической крови (PBMC), выделяли и промывали 3 раза (или более) холодным фосфатным буфером, чтобы получить РВМС. Полученную РВМС суспендировали в 20 мл среды AIM-V (Life Technololgies, Inc, Grand Island, NY, USA) и клеткам давали адгезироваться в культуральной колбе (Falcon) при 37°C в условиях 5% СО2 в течение 2 часов. Неадгезивные клетки использовали для получения T-клеток, а адгезивные клетки использовали для получения дендритных клеток.
С другой стороны, адгезивные клетки культивировали в среде AIM-V в присутствии IL-4 (1000 Ед./мл) и GM-CSF (1000 Ед./мл). Неадгезивные клетки, полученные через 6 дней, собирали, и рекомбинантный белок SCD1 человека добавляли к клеткам при концентрации 10 мкг/мл, затем клетки культивировали при 37°C в условиях 5% CO2 в течение 4 часов. Далее среду заменяли на среду AIM-V, дополненную IL-4 (1000 Ед./мл), GM-CSF (1000 Ед./мл), IL-6 (1000 Ед./мл, Genzyme, Cambridge, MA), IL-1β (10 нг/мл, Genzyme, Cambridge, MA) и TNF-α (10 нг/мл, Genzyme, Cambridge, MA), и культивирование проводили еще в течение 2 дней с получением популяции неадгезивных клеток для использования в качестве дендритных клеток.
Полученные дендритные клетки суспендировали в среде AIM-V при плотности клеток 1×106 клеток/мл, и рекомбинантный белок SCD1 человека был опять добавлен в суспензию при концентрации 10 мкг/мл. Используя 96-луночный планшет, клетки культивировали при 37°C в условиях 5% CO2 в течение 4 часов. После культивирования облучали рентгеновскими лучами (3000 рад), и клетки промывали средой AIM-V, затем суспендировали в среде AIM-V, дополненной 10%-ной сывороткой человека АВ (Nabi, Miami, FL), IL-6 (1000 Ед./мл) и IL-12 (10 нг/мл, Genzyme, Cambridge, MA). Клетки помещали на 24-луночный планшет в количестве 1×105 клеток/лунку. Затем полученную Т-клеточную популяцию добавляли в каждую лунку в количестве 1×106 клеток на лунку и культивировали при 37°C в условиях 5% CO2. Каждый супернатант культуры отбрасывали спустя 7 дней, и дендритные клетки, полученные таким же способом, как описано выше, путем обработки белком SCD1 человека и последующим облучением рентгеновскими лучами, суспендировали в среде AIM-V, дополненной 10%-ной сывороткой человека АВ (Nabi, Miami, FL), IL-7 (10 нг/мл, Genzyme, Cambridge, MA) и IL-2 (10 нг/мл, Genzyme, Cambridge, MA) (плотность клеток 1×105 клеток/мл). Полученную суспензию помещали на 24-луночный планшет в количестве 1×105 клеток/лунку, и клетки затем культивировали. После повторения той же операции от 4 до 6 раз с интервалом в 7 дней стимулированные T-клетки выделяли, и индукцию CD8-позитивных Т-клеток подтверждали с помощью проточной цитометрии.
В качестве отрицательного контроля был использован белок, имеющий последовательность, которая выходит за рамки объема настоящего изобретения (SEQ ID NO:27).
Далее было исследовано, могут или нет CD8-позитивные Т-клетки, стимулированные настоящим полипептидом, повреждать экспрессирующие SCD1 опухолевые клетки.
В центрифужной пробирке объемом 50 мл собирали 105 клеток клеточной линии глиомы человека U-87MG (полученной от АТСС), в которой была подтверждена экспрессия SCD1, и к клеткам добавляли 100 мкCi хрома 51, затем инкубировали полученную смесь при 37°C в течение 2 часов. Далее клетки промывали 3 раза средой AIM-V, дополненной 10% человеческой сыворотки АВ, и помещали на 96-луночный с V-образным дном планшет в количестве 103 клеток на лунку. Последовательно добавляли 105, 5×104, 2,5×104 или 1,25×104 CD8-позитивных Т-клеток, которые были стимулированы рекомбинантным белком SCD1 человека и суспендированы в среде AIM-V, дополненной 10%-ной сывороткой человека АВ, добавляли в каждую клетку и получали культуру при 37°C в 5% CO2 в течение 4 часов. Затем измеряли количество хрома 51, высвобождаемого из пораженных опухолевых клеток в супернатант культуры с помощью гамма-счетчика для расчета цитотоксической активности CD8-позитивных Т-клеток, стимулированных рекомбинантным белком SCD1 человека.
В результате было обнаружено, что CD8-позитивные Т-клетки, стимулированные рекомбинантным белком SCD1 человека, обладают цитотоксической активностью в отношении U-87MG. С другой стороны, CD8-позитивные Т-клетки, индуцированные с использованием негативного контрольного белка (SEQ ID NO:27), не показали цитотоксической активности. Таким образом, было обнаружено, что рекомбинантный белок SCD1 человека способен индуцировать CD8-позитивные цитотоксические Т-клетки, которые могут повреждать опухолевые клетки.
Цитотоксическая активность обозначает цитотоксическую активность CD8-позитивных Т-клеток против T98G CD, определяемую: путем смешивания 105 CD8-позитивных Т-клеток, стимулированных и индуцированных как описано выше, с 103 линии клеток злокачественной опухоли головного мозга U-87MG, в которую был включен хром 51; культивирование полученной смеси в течение 4 часов; измерение количества хрома 51, высвобождаемого в среду после культивирования; и далее осуществление расчетов в соответствии с уравнением 1.
Уравнение 1: Цитотоксическая активность (%) = количество хрома 51, высвобождаемого из U-87MG после добавления CD8-позитивных Т-клеток (cpm)/количество хрома 51, высвобождаемого из клеток-мишеней после добавления 1н соляной кислоты (cpm)×100.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Настоящее изобретение может быть использовано для терапии и/или профилактики злокачественного новообразования, поскольку в настоящем изобретении предложен иммунитет-индуцирующий агент, содержащий полипептид, который проявляет противоопухолевую активность в отношении различных злокачественных новообразований.