Результат интеллектуальной деятельности: СПОСОБ ИЗМЕРЕНИЯ АНТИТЕЛА ПРОТИВ WT1
Вид РИД
Изобретение
[Область техники, к которой относится изобретение]
[0001]
Настоящее изобретение относится к способу измерения антитела против WT1 в образце с использованием фрагмента WT1.
[Уровень техники]
[0002]
Ген WT1 (ген опухоли Вильмса) является фактором транскрипции с цинковыми пальцами, выделенным в качестве гена опухоли Вильмса. Затем патологически высокая экспрессия гена WT1 была подтверждена при остром миелоидном лейкозе, а также при различных формах солидного рака (непатентные документы 1-3), и была попытка использования белка WT1 в качестве пептидной вакцины.
[0003]
В последние годы было обнаружено, что белок WT1 имеет структуру, включающую домен репрессии, домен активации и домен цинковых пальцев, который является ДНК-связывающим доменом и регулирует экспрессию гена путем связывания с областью белка 1, отвечающего за ранний рост (EGR-1). Также известно о функции гена супрессора опухоли (непатентные документы 4 и 5).
[0004] Кроме того, было обнаружено присутствие аутоантител против белка WT1. Сообщалось, что титр аутоантител против белка WT1 является особенно высоким в крови пациентов с раком крови или раком легких (мелкоклеточным раком) (непатентные документы 6-8). Более высокая экспрессия мРНК WT1 является плохим прогнозом. В противоположность этому, сообщалось, что более высокий уровень антитела против WT1 в крови является хорошим прогнозом (непатентный документ 7). Таким образом, считается, что точное измерение антитела против WT1 в крови пациента является эффективным для выбора способа лечения или контроля за прогрессом лечения. Например, было описано измерение антитела против WT1 с использованием белка WT1, содержащего домен репрессии и домен активации, но лишенного цинкового пальца, в качестве антигена (патентные документы 1 и 2).
[0005]
Однако механизм, при помощи которого in vivo белок становится распознаваемым как чужеродное вещество и индуцирует продукцию аутоантитела к нему, по-прежнему остается неясным. Кроме того, концентрация антитела является очень низкой, и способ детектирования аутоантитела с высокой селективностью не был создан. Что касается антитела против WT1, то существует проблема, заключающаяся в том, что известный способ, в котором используется антиген белка WT1, не может с необходимой точностью оценивать антитело из-за узкого распределения титра детектируемого антитела.
[Перечень цитируемых документов]
[Патентный документ]
[0006]
[Патентный документ] JP-A-2002-48793
[Патентный документ] JP-A-2006-267124
[Непатентный документ]
[0007]
[Непатентный документ 1] Inoue K, Sugiyama H, Ogawa H, et al., WT1 as a new prognostic factor and new marker for the detection of minimal residual disease in acute leukemia, Blood 1994, 84: 3071-9
[Непатентный документ 2] Oji Y, Miyoshi S, Maeda H, et al., Overexpression of the Wilms' tumor gene WT1 in de novo lung cancers, Int J Cancer 2002, 100: 297-303
[Непатентный документ 3] Miyoshi Y, Ando A, Egawa C, et al., High expression of Wilms' tumor suppressor gene predicts poor prognosis in breast cancer patients, Clin Cancer Res 2002, 8: 1167-71
[Непатентный документ 4] Haber DA, Sohn RL, Buckler AJ, et al., Alternative splicing and genomic structure of the Wilms' tumor gene WTl, Proc Natl Acad Sci USA 1991, 88: 9618
[Непатентный документ 5] Madden SL, Cook DM, Morris JF, et al., Transcriptional repression mediated by the WTI Wilms tumor gene product, Science 1991, 253: 1550
[Непатентный документ 6] Olga AEl, Oka Y, Tsuboi A, et al., Humoral immune responses against Wilms tumor gene WT1 product in patients with hematopoietic malignancies, Blood 2002, 99: 3272-3279
[Непатентный документ 7] Oji Y, Kitamura Y, Kamino K, et al., WT1 IgG antibody for early detection of nonsmall cell lung cancer and as its prognostic factor, Int J Cancer 2009, 125: 381-7
[Непатентный документ 8] Tamura H, Dan K, Yokose N, et al., Prognostic significance of WT1 mRNA and anti-WT1 antibody levels in peripheral blood in patients with myelodysplastic syndromes, Leukemia Res 2010, 34: 986-990.
[Сущность изобретения]
[Задачи, решаемые изобретением]
[0008]
Задачей настоящего изобретения является способ измерения антитела против WT1, который обеспечивает более точное измерение и оценку антитела против WT1 у пациента с WT1-связанным заболеванием, и применения этого способа.
[Средства для решения задач]
[0009]
Авторы настоящего изобретения исследовали детекцию антитела против WT1 в крови пациентов с WT1-связанным заболеванием и обнаружили, что in vivo аутоантитело против антигена продуцируется, если антиген, распознаваемый аутоантителом, является конформационно модифицированным так, что экспонирует эпитопный сайт на поверхности и, таким образом, распознается как чужеродное вещество. Авторы изобретения также обнаружили, что главными эпитопами WT1 являются центральная область (номера аминокислот: 181-324) и С-концевая область (номера аминокислот: 294-449) аминокислотной последовательности (SEQ ID NO:1), составляющей белок WT1 человека, и что титр антитела против WT1 при измерении антитела против WT1 с использованием полипептидного фрагмента, соответствующего С-концевой области (области с цинковыми пальцами), ДНК-связывающему домену WT1, в качестве антигена, показывает особенно высокую корреляцию с ними при измерении с использованием полноразмерного WT1 в качестве антигена. Авторы изобретения также обнаружили, что при сравнении титра распределения антител у здоровых индивидов и титра распределения антител у больных раком, титр распределения антител у больных раком, более широкий, чем титр распределения у здоровых пациентов, и показывает значимую разницу, которая обеспечивает точное и чувствительное определение группы высокого титра антитела против WT1, например, у больных раком.
[0010]
Таким образом, настоящее изобретение относится к следующим аспектам 1)-9):
1) Способ измерения антитела против WT1 в образце, где способ включает использование полипептида с антигенностью в отношении антитела против WT1, выбранного из полипептида, содержащего последовательность с аминокислотами в положениях 294-449 последовательности SEQ ID NO:1, частичного полипептида этого полипептида и полипептида, включающего аминокислотную последовательность с делецией, заменой или добавлением от одной до нескольких аминокислот в аминокислотной последовательности, состоящей в каждом случае из этих полипептидов и/или полипептида с антигенностью в отношении антитела против WT1, выбранного из полипептида, содержащего последовательность с аминокислотами в положениях 181-324 последовательности SEQ ID NO:1, частичного полипептида этого полипептида и полипептида, включающего аминокислотную последовательность с делецией, заменой или добавлением от одной до нескольких аминокислот в аминокислотной последовательности, состоящей из каждого из этих полипептидов;
2) Способ по 1)-му аспекту, где концентрацию антитела измеряют путем иммобилизации по меньшей мере одного из полипептидов на твердую фазу и путем детектирования продукта реакции между иммобилизованным полипептидом или полипептидами и антителом против WT1, присутствующим в образце;
3) Способ диагностики WT1-связанного заболевания, где способ включает использование полипептида с антигенностью в отношении антитела против WT1, выбранного из полипептида, содержащего последовательность с аминокислотами в положениях 294-449 последовательности SEQ ID NO:1, частичного полипептида этого полипептида и полипептида, включающего аминокислотную последовательность с делецией, заменой или добавлением от одной до нескольких аминокислот в аминокислотной последовательности, состоящей из каждого из этих полипептидов и/или полипептида с антигенностью в отношении антитела против WT1, выбранного из полипептида, содержащего последовательность с аминокислотами в положениях 181-324 последовательности SEQ ID NO:1, частичного полипептида этого полипептида и полипептида, включающего аминокислотную последовательность с делецией, заменой или добавлением от одной до нескольких аминокислот в аминокислотной последовательности, состоящей из каждого из этих полипептидов;
4) Способ по аспекту 3), в котором прогнозируют тяжесть лейкоза;
5) Способ прогнозирования ответа у пациента на терапию рака вакциной против WT1 или способ терапевтического мониторинга терапии рака вакциной против WT1, где способ включает использование полипептида с антигенностью в отношении антитела против WT1, выбранного из полипептида, содержащего последовательность с аминокислотами в положениях 294-449 последовательности SEQ ID NO:1, частичного полипептида этого полипептида и полипептида, включающего аминокислотную последовательность с делецией, заменой или добавлением от одной до нескольких аминокислот в этой аминокислотной последовательности, состоящей из каждого из этих полипептидов и/или полипептида с антигенностью в отношении антитела против WT1, выбранного из полипептида, содержащего последовательность с аминокислотами в положениях 181-324 последовательности SEQ ID NO:1, частичного полипептида этого полипептида и полипептида, включающего аминокислотную последовательность с делецией, заменой или добавлением от одной до нескольких аминокислот в аминокислотной последовательности, состоящей из каждого из этих полипептидов;
6) Способ по аспекту 5), где раком является опухоль головного мозга или рак ободочной кишки;
7) Реагент для измерения антитела против WT1 в образце, где реагент содержит полипептид с антигенностью в отношении антитела против WT1, выбранный из полипептида, содержащего последовательность с аминокислотами в положениях 294-449 последовательности SEQ ID NO:1, частичного полипептида этого полипептида и полипептида, включающего аминокислотную последовательность с делецией, заменой или добавлением от одной до нескольких аминокислот в аминокислотной последовательности, состоящей из каждого из этих полипептидов и/или полипептида с антигенностью в отношении антитела против WT1, выбранного из полипептида, содержащего последовательность с аминокислотами в положениях 181-324 последовательности SEQ ID NO:1, частичного полипептида этого полипептида и полипептида, включающего аминокислотную последовательность с делецией, заменой или добавлением от одной до нескольких аминокислот в аминокислотной последовательности, состоящей из каждого из этих полипептидов;
8) Реагент для оценки WT1-связанного заболевания, где реагент содержит полипептид с антигенностью в отношении антитела против WT1, выбранный из полипептида, содержащего последовательность с аминокислотами в положениях 294-449 последовательности SEQ ID NO:1, частичного полипептида этого полипептида и полипептида, включающего аминокислотную последовательность с делецией, заменой или добавлением от одной до нескольких аминокислот в аминокислотной последовательности, состоящей из каждого из этих полипептидов и/или полипептида, с антигенностью в отношении антитела против WT1, выбранного из полипептида, содержащего последовательность с аминокислотами в положениях 181-324 последовательности SEQ ID NO:1, частичного полипептида этого полипептида и полипептида, включающего аминокислотную последовательность с делецией, заменой или добавлением от одной до нескольких аминокислот в аминокислотной последовательности, состоящей из каждого из этих полипептидов; и
9) Способ детекции аутоантитела, где способ включает модификацию in vivo белка таким образом, чтобы эпитопный сайт экспонировался на поверхности, и использование модифицированного белка в качестве антигена, распознаваемого аутоантителом.
[Эффекты изобретения]
[0011]
Способ измерения антитела против WT1 по настоящему изобретению может точно и чувствительно измерять антитело против WT1 у пациентов с WT1-связанным заболеванием и, следовательно, обеспечивает удовлетворительную детекцию вариации в титре антител против WT1. Таким образом, можно легко и с высокой чувствительностью осуществлять, например, диагностику WT1-связанных заболеваний, контроль терапевтических эффектов, прогнозировать течение и ответ пациента перед проведением вакцинной терапии и осуществлять мониторинг ответа на вакцинную терапию после терапии.
[Краткое описание фигур]
[0012]
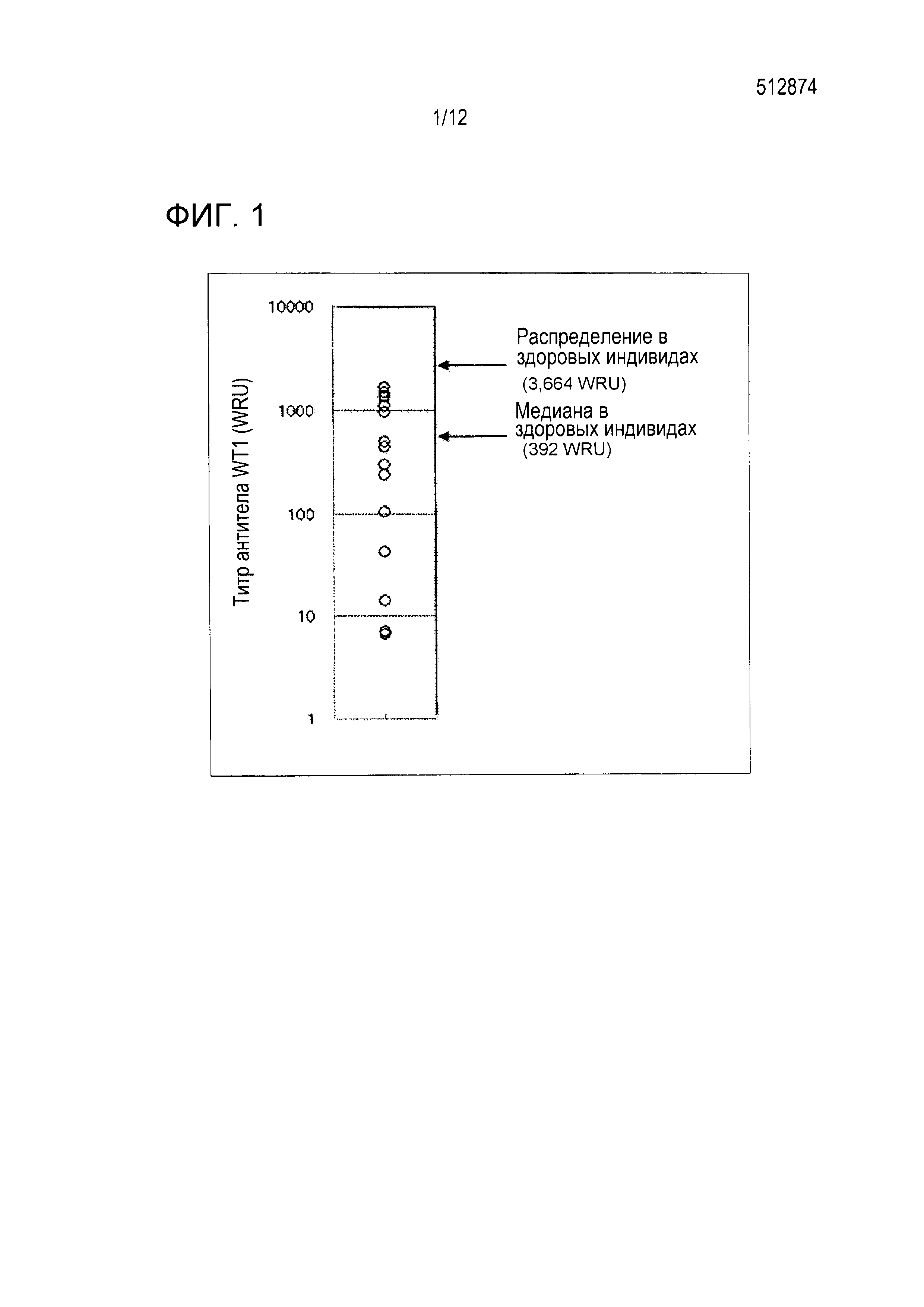
[Фигура 1] Фигура 1 является диаграммой, на которой показаны титры антитела против полноразмерного WT1-антигена в крови у больных раком.
[Фигура 2] Фигура 2 включает графики, на которых показано сравнение между титром антитела против полноразмерного WT1-антигена и титрами антитела, против частичных WT1-антигенов, т.е. результаты сравнения титра антитела против полноразмерного WT1-антигена с титром антитела против антигена Fr. 1 (а), антигена Fr. 2 (b) и антигена Fr. 1 (с), с вертикальной осью, показывающей титр (единицы) антитела против частичного WT1-аантигена, а горизонтальной осью, показывающей титр (WRU) антитела против полноразмерного WT1-антигена.
[Фигура 3] Фигура 3 является графиком, на котором показано сравнение между титром антитела против антигена Fr. 2 и титром антитела против антигена Fr.3, с вертикальной осью, показывающей титр (единицу) антитела против антигена Fr. 3, и горизонтальной осью, показывающей титр (WRU) антитела против антигена Fr.2.
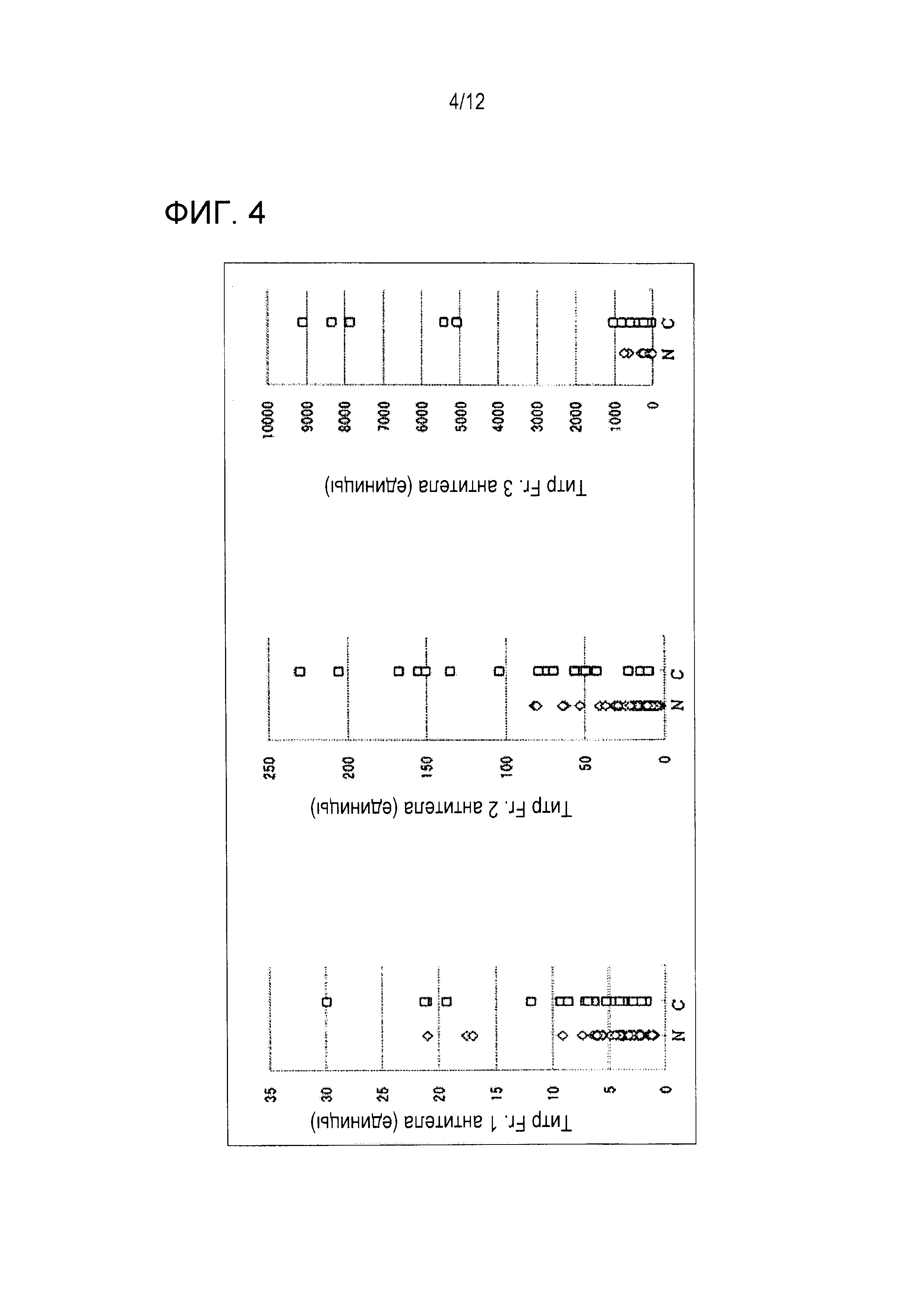
[Фигура 4] Фигура 4 является графиком, на котором показано распределение титров антител против частичных WT1-антигенов, т.е. распределение титров антител против частичных WT1-антигенов у здоровых индивидов и больных раком, где N и С, соответственно, показывают распределение у 54 здоровых индивидов и распределение у 20 больных раком против антигена Fr. 1 (а), антигена Fr. 2 (b) и антигена Fr. 3 (с).
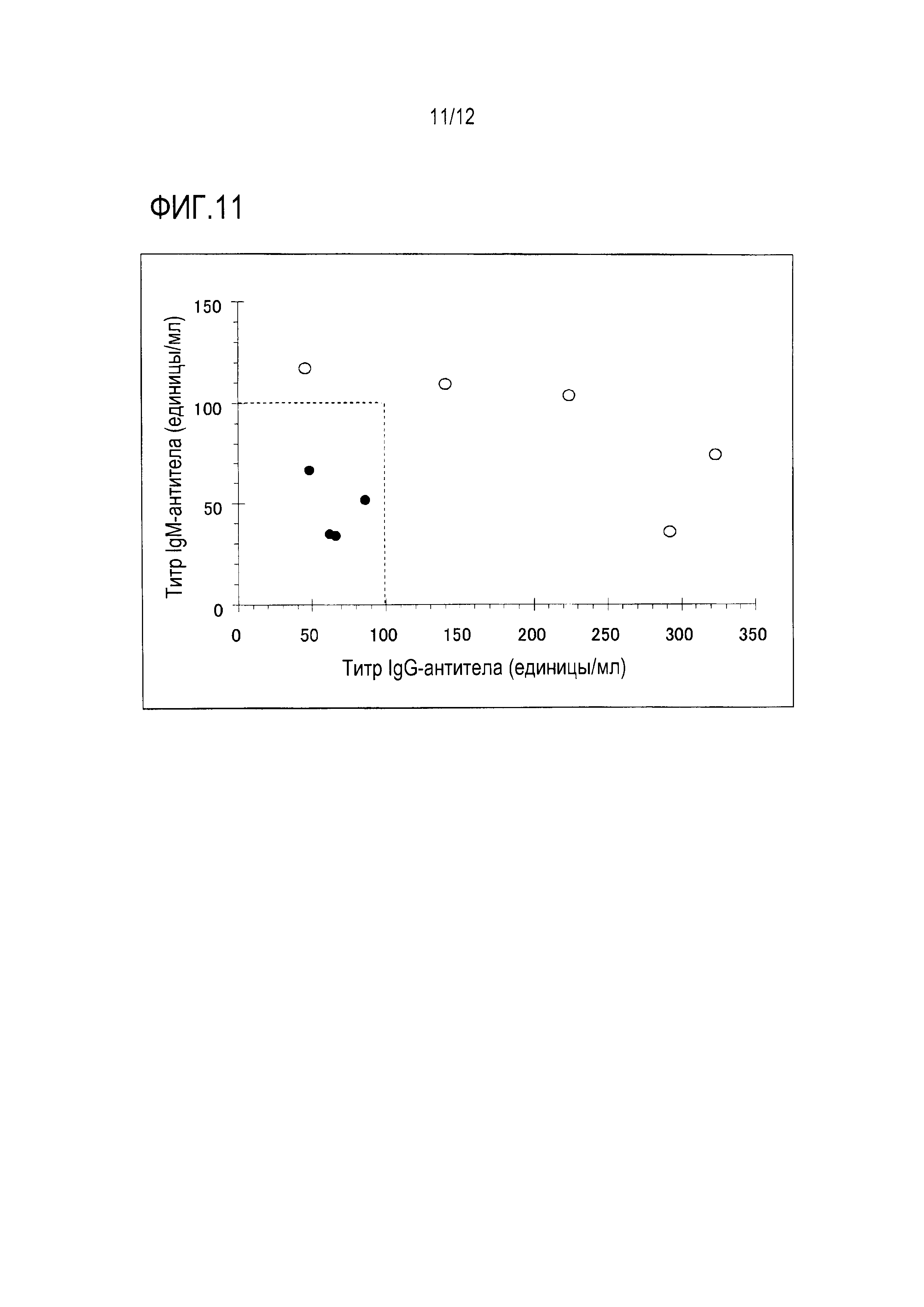
[Фигура 5] Фигура 5 является графиком, на котором показан результат теста ингибирования антитела против антигена Fr. 3, т.е. результаты, в которых реактивность антитела против Fr. 3 ингибируется Fr. 1 и Fr. 2, где С-19 является поликлональным антителом против антигена Fr. 3, No. 3, No. 7 и No. 9 являются сывороткой пациента, обнаруживающей низкие титры антител против Fr. 1 и Fr. 2 и высокие титры антитела против Fr, 3, белые столбцы показывают результаты в присутствии антигена Fr. 1 и черные столбцы показывают результаты в присутствии антигена Fr. 2.
[Фигура 6] Фигура 6 включает графики, показывающие изменения в титре IgG-антитела против каждого антигена, где черные столбцы показывают изменения в титре этого антитела против Fr. 1, белые столбцы показывают изменения в титре антитела против Fr. 2, горизонтальные линии-стержни показывают изменения в титре этого антитела против Fr. 3, наклонные линии-стержни показывают изменения в титре этого антитела против полноразмерного WT1-антигена и черные кружки показывают вариации в размерах опухолей, измеренных при помощи MRI.
[Фигура 7] Фигура 7 включает графики, на которых показаны результаты сравнения титра IgG-антитела перед вакцинацией.
[Фигура 8] Фигура 8 включает графики, на которых показаны результаты сравнения титра IgG-антитела после вакцинации.
[Фигура 9] Фигура 9 включает графики, на которых показаны титры IgM-антитела перед вакцинацией, где А показывает титры IgM-антитела против Fr. 2 и В показывает титры IgM-антитела против Fr. 3.
[Фигура 10] Фигура 10 включает графики, на которых показаны титры IgM- и IgG-антител перед вакцинацией.
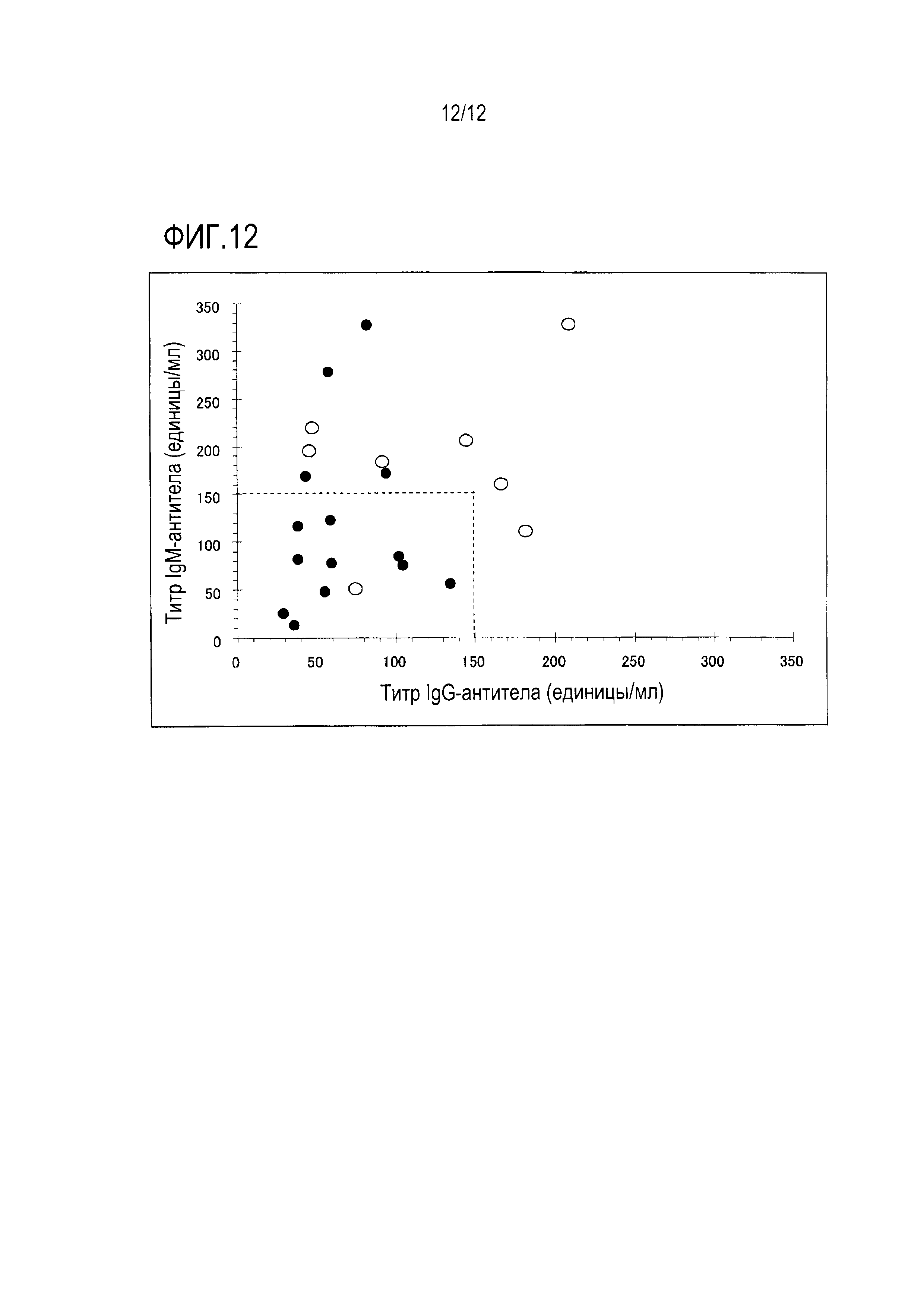
[Фигура 11] Фигура 11 является графиком, на котором показаны титры IgM- и IgG-антител у пациентов с опухолью головного мозга, где вертикальная ось показывает титры IgM-антитела, горизонтальная ось показывает титры IgG-антитела, открытые кружки показывают результаты SD-пациентов, черные кружки показывают результаты PD-пациентов и пунктирная линия показывает предварительные ссылочные величины.
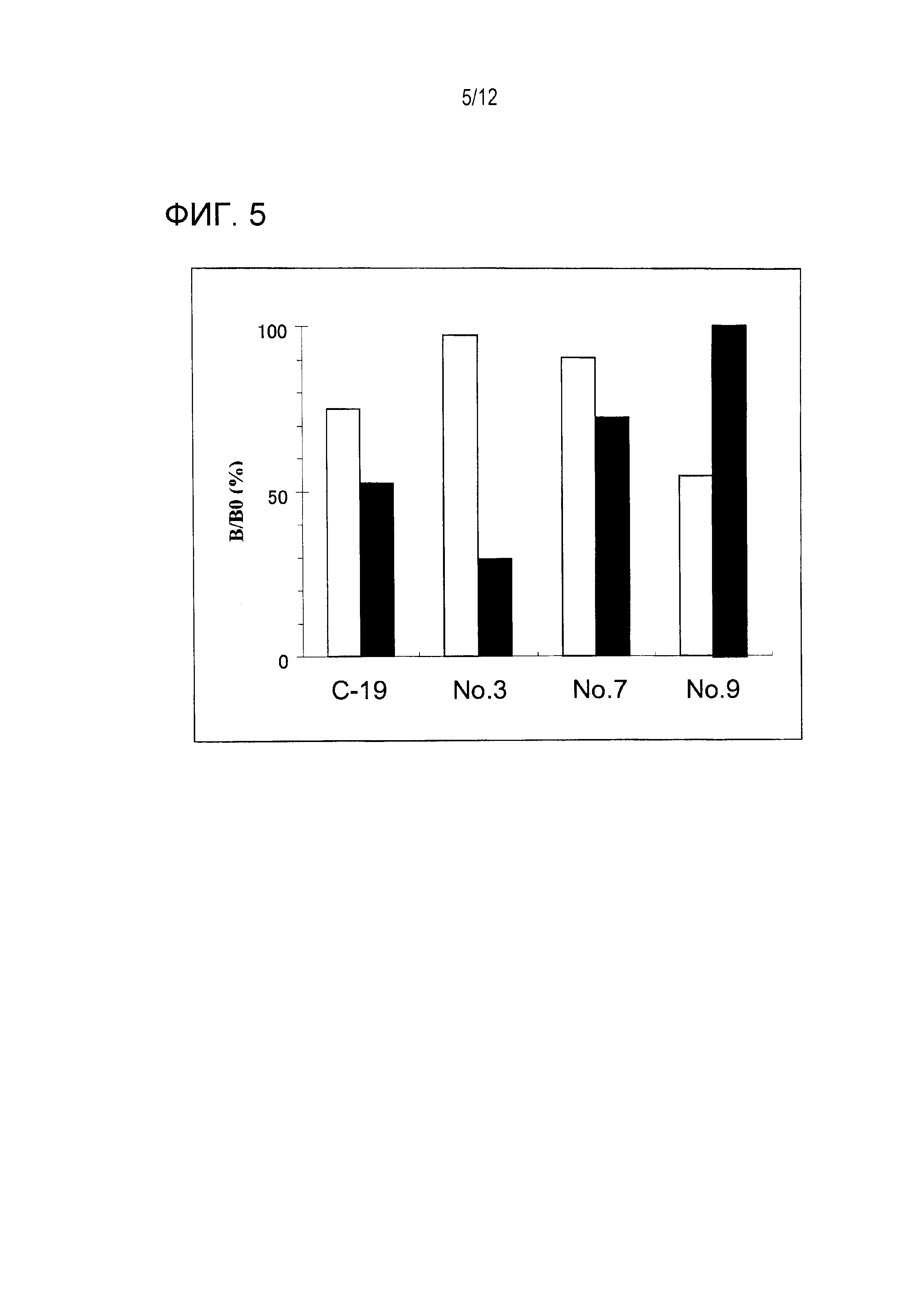
[Фигура 12] Фигура 12 является графиком, на котором показаны титры IgM- и IgG-антител у пациентов с раком ободочной кишки, где вертикальная ось показывает титры IgM антител, горизонтальная ось показывает титры IgG-антител, открытые кружки показывают результаты SD-пациентов, черные кружки показывают результаты PD-пациентов и пунктирная линия показывает предварительные ссылочные величины.
[Описание вариантов осуществления изобретения]
[0013] В настоящем изобретении антителом против WT1 называют антитела против продукта гена фактора транскрипции WT1 с цинковыми пальцами, выделенного в виде отвечающего гена опухоли Вильмса (гена опухоли Вильмса), конкретно, белка WT1 человека (SEQ ID NO:1), состоящего из 449 аминокислот. Такие антитела включают различные иммуноглобулины, такие как IgG-антитело, IgA-антитело и IgM-антитело, и эти антитела, все они включены в настоящее изобретение.
[0014]
Белки in vivo первоначально не распознаются как чужеродные вещества иммунной системой и поэтому они, как правило, не индуцируют продукцию антител. Авторы настоящего изобретения предположили, что аутоантитело против антигена продуцируется, если антиген, распознаваемый аутоантителом, конформационно модифицирован так, что экспонирует эпитоп на поверхности и, таким образом, распознается в качестве чужеродного вещества. Таким образом, полагают, что для получения антигена, предназначенного для распознавания аутоантителом, эпитопный сайт, спрятанный в этой молекуле, должен быть экспонирован на поверхность путем модификации белка, например, посредством генетического конструирования для экспрессии протеина с частичной делецией этого поверхностного сайта, расщепления пептидной связи протеазой, обработкой кислотой, щелочью или поверхностно-активным веществом, тепловой денатурацией или обработкой хаотропным реагентом, таким как мочевина или гидрохлорид гуанидина.
Авторы настоящего изобретения, как показано в примерах ниже, исследовали молекулы белка WT1, которые могут быть антигеном, распознаваемым аутоантителом, и было обнаружено, что основными эпитопами являются центральная область (номера аминокислот: 181-324) и С-концевая область (номера аминокислот: 294-449) аминокислотной последовательности (SEQ ID NO:1), состоящая из белка WT1 человека, и что использование пептида в С-концевой области в качестве антитело-детектирующего антигена может особенно эффективно повышать чувствительность детектирования антитела, чтобы она была более высокой, чем при использовании полноразмерного антигена WT1 (Пример 1), и что реактивность антитела с С-концевой областью ингибируется антигенами N-концевой области (номера аминокислот: 1-182) и центральной области (Пример 2), что было подтверждено соответствующими данными.
[0015]
Полипептид с антигенностью в отношении антитела против WT1, используемый в способе измерения антитела против WT1 по изобретению, выбран из полипептида, содержащего последовательность с аминокислотами в положениях 294-449 последовательности SEQ ID NO:1, полипептида, содержащего последовательность с аминокислотами в положениях 181-324 последовательности SEQ ID NO:1, полипептида, включающего аминокислотную последовательность с делецией, заменой или добавлением от одной до нескольких аминокислот в этой аминокислотной последовательности, состоящей из каждого из этих полипептидов, и частичных полипептидов этих полипептидов.
[0016] Полипептид, содержащий последовательность с аминокислотами в положениях 294-449 последовательности SEQ ID NO:1, соответствует домену цинковых пальцев, который является ДНК-связывающим доменом, в белке WT1 и также называется С-концевой областью по настоящему изобретению.
Полипептид, содержащий последовательность с аминокислотами в положениях 181-324 последовательности SEQ ID NO:1, соответствует области между N-концевой областью (номерам аминокислот: 1-182) и С-концевой областью в белке WT1 и также называемым центральной областью.
[0017]
Антигенный полипептид является, предпочтительно, полипептидом, содержащим последовательность с аминокислотами в положениях 294-449, или полипептидом, содержащим последовательность с аминокислотами в положениях 181-324 последовательности SEQ ID NO:1, но может быть частичным полипептидом этих полипептидов или полипептидом, включающим аминокислотную последовательность с делецией, заменой или добавлением от одной до нескольких аминокислот в аминокислотной последовательности, состоящей из каждого из этих полипептидов, пока этот антигенный полипептид имеет антигенность в отношении антитела против WT1 и может детектировать это антитело против WT1.
Примеры частичного полипептида этих полипептидов включают пептиды, каждый их которых содержит 6-8, предпочтительно, 10-20 последовательных аминокислот последовательности с аминокислотами в положениях 294-449 или последовательности с аминокислотами в положениях 181-324 последовательности SEQ ID NO: 1. Конкретные примеры частичного полипептида включают полипептиды, содержащие последовательность с аминокислотами в положениях 294-449 последовательности SEQ ID NO:1, полипептид, содержащий последовательность с аминокислотами в положениях 348-449 последовательности SEQ ID NO:1, и полипептид, содержащий последовательность с аминокислотами в положениях 181-324 последовательности SEQ ID NO: 1.
[0019]
Полипептид, содержащий последовательность с аминокислотами в положениях 294-449, и полипептид, содержащий последовательность с аминокислотами в положениях 181-324 последовательности SEQ ID NO: 1, и их частичные полипептиды могут в каждом случае иметь делецию, замену или добавление от одной до нескольких аминокислот в их аминокислотной последовательности, пока этот полипептид имеет антигенность в отношении антитела против WT1.
Во всем описании, некоторое число аминокислот, которые могут быть делетированы, добавлены или заменены, является одним или несколькими и не ограничивается особенно и является числом аминокислот, которые могут быть делетированы, добавлены или заменены известным способом, таким как сайт-специфический мутагенез, и является, например, одним-несколькими десятками, предпочтительно, одним-двадцатью, более предпочтительно, одним-десятью и, даже более предпочтительно, одним-пятью.
Во всем описании, делеция, добавление или замена одного или нескольких аминокислотных остатков в аминокислотной последовательности означает, что один или несколько аминокислотных остатков делетированы, добавлены или заменены в произвольно выбранных одном или нескольких положениях в одной и той же аминокислотной последовательности. Делеция, добавление или замена могут осуществляться одновременно, и аминокислотные остатки, которые являются делетированными, добавленными или замененными, могут быть природными или неприродными аминокислотами.
[0020]
Термин “антигенность в отношении антитела против WT1” относится к антигенности в отношении антитела, распознающего WT1-белок. Поскольку эти аутоантитела у пациентов с WT1-связанным заболеванием являются поликлональными антителами, сам этот антигенный полипептид по настоящему изобретению может иметь множество реакционных сайтов (эпитопов).
[0021]
Полипептид, используемый в способе по настоящему изобретению, является по меньшей мере одним полипептидом, выбранным из вышеупомянутых полипептидов. Для усиления специфичности и чувствительности измерения может быть использована комбинация множества полипептидов.
[0022]
Эти полипептиды могут быть получены известными способами генной инженерии с использованием гена WT1, например, способом, описанным в примере ниже, или соответствующим ему способом, или могут быть также получены химическим синтезом.
Получение полипептида способами генной инженерии с использованием гена WT1 может осуществляться обычной генетической рекомбинацией, известной в качестве стандартной. Более конкретно, получают рекомбинантную ДНК, способную экспрессировать желаемый ген WT1 в клетке-хозяине, эту рекомбинантную ДНК вводят в клетки-хозяева для трансформации и этот трансформант культивируют. Этот трансформант может продуцировать желаемый полипептид внутриклеточно или внеклеточно в виде продукта экспрессии этого трансформанта.
[0023]
Каждая операция, используемая в данном случае, например, химический синтез частичных генов, обработка ферментом для расщепления, делеции, добавления или образования связей, выделение, очистка, селекция (отбор) и другая обработка их, введение рекомбинантной ДНК в клетку-хозяина и культивирование этого трансформанта, может осуществляться в соответствии с обычными способами (см., например, "Bunshi Idengaku Jikken-ho (Molecular Genetics Experimental Method)", Kyoritsu Shuppan Co., Ltd., published in 1993; "PCR Technology", Takara Shuzo Co., Ltd., published in 1990; Science, 224, 1431 (1984); Biochem. Biophys. Res. Comm., 130, 692 (1985); Proc. Natl. Acad. Sci. USA., 80, 5990 (1983); Molecular Cloning, by T. Maniatis et al., Cold Spring Harbor Laboratory (1982)).
[0024]
Полипептид может быть также необязательно выделен и очищен из продукта экспрессии различными процедурами выделения, использующими физические и химические свойства этого полипептида (см., например, "Biochemistry Data Book II", pp. 1175-1259, First edition, First printing, June 23, 1980, published by Tokyo Kagaku Dojin, Co., Ltd.).
[0025]
Образцом в настоящем изобретении является образец, полученный у пациента с WT1-связанным заболеванием или у пациента с WT1-связанным заболеванием после лечения, и неограниченные примеры их включают биологические жидкости, такие как кровь и моча, о которых известно, что они обычно содержат антитела.
[0026]
Примеры WT1-связанного заболевания включают различные заболевания, известные как WT1-связанные заболевания, такие как лейкоз, солидные раки и миелодиспластический синдром, а также включают WT1-связанные заболевания, которые могут быть обнаружены в будущем.
[0027]
В способе измерения антитела против WT1 по настоящему изобретению, измерение этого антитела против WT1 (концентрации этого антитела) может осуществляться посредством иммуноанализа с использованием вышеупомянутого полипептида. Иммуноанализ может быть любым известным иммуноанализом, и его примеры включают радиоиммуноанализ (RIA), ферментный иммуноанализ (EIA или ELISA), иммунофлуоресцентный анализ (FIA), непрямой флуоресцентный анализ, люминесцентный иммуноанализ, физико-химические анализы (TIA, LAPIA и PCIA) и Вестерн-блоттинг. Предпочтительно, используется ELISA.
ELISA является способом, выполняемым реакцией антитела с антигеном, иммобилизованным на твердой фазе, дополнительно реакцией вторичного антитела, меченого ферментом, таким как пероксидаза или щелочная фосфатаза, с этим антителом, связанным с этим антигеном, и затем измерением уровня фермента посредством подходящего процесса. Примеры ELISA включают конкурентный способ и сэндвич-метод. Особенно предпочтительным является сэндвич-метод (твердофазный сэндвич-метод).
[0028]
Твердофазный сэндвич-способ выполняют, например, следующим образом: полипептид по настоящему изобретению иммобилизуют на твердой фазе и добавляют к ним подлежащий измерению образец. В результате, в этом образце осуществляется реакция антиген-антитело между иммобилизованным с твердой фазой антигеном и антителом в этом образце, и посредством этого антитело против WT1, присутствующее в этом образце, связывается с этим твердофазным антигеном. Затем это связанное антитело детектируют с детектирующим антитело реагентом для измерения антитела против WT1, присутствующего в этом образце.
[0029]
Альтернативно, детектирующий антитело реагент может быть иммобилизован на твердой фазе. Затем рассматриваемое антитело против WT1, присутствующее в образце, может быть детектировано или измерено захватыванием антител в образце, с добавлением затем полипептида по настоящему изобретению к реагенту для связывания с этим антителом против WT1 среди захваченных антител, и дополнительного связывания меченого специфического антитела с этим антигеном.
[0030]
Выбор каждого процесса и его модификации в этих способах измерения хорошо известны квалифицированным в данной области специалистам и не ограничиваются конкретно в настоящем изобретении, и может быть использован любой способ (см., например, “Rinsho Kensa-ho Teiyo (Clinical Examination Handbook)”, Kanehara & Co., Ltd., 1995).
[0031]
Например, твердой фазой, используемой в твердофазном способе, может быть нерастворимый неактивный носитель, который обычно широко используется. Примеры этого носителя включают палочки, бусины, микропланшеты и тест-пробирки, изготовленные из различных материалов, таких как стекло, целлюлозный порошок, сефадекс, сефароза, полистирол, фильтровальная бумага, карбоксиметилцеллюлоза, ионообменные смолы, декстран, пластиковые пленки, пластиковые пробирки, найлон, стеклянные бусины, шелк, сополимеры полиамин-метилвинилового эфира-малеиновой кислоты, сополимеры аминокислот и сополимеры этилена-малеиновой кислоты.
[0032] Иммобилизация антигена или антитела особо не ограничивается и может быть образованием физической связи или химической связи. Типичные примеры этой иммобилизации включают способы химического связывания, такие как способы ковалентного связывания, например, диазоспособы, пептидные способы (способ производных амидов кислот, способ карбоксилхлоридной смолы, способ карбодиимидной смолы, способ производного малеинового ангидрида, способ производного изоцианата, способ активированного бромцианом полисахарида, способ карбонатного производного целлюлозы, способ реагента конденсации и т.д.), способ алкилирования, способ сочетания со сшивающим реагентом (использующего, например, глютаральдегид или гексаметиленизоцианат в качестве сшивающего реагента), и сопряженный с реакцией Ugi способ; способы ионного связывания, использующие подложки, такие как ионообменные смолы; и способы физической адсорбции, использующие носители из пористого стекла, такие как стеклянные бусины.
[0033] Метящий реагент в каждой системе измерения не ограничивается особо, и может быть использован любой обычный и предполагаемый для использования в будущем реагент. Конкретно, метящие реагенты, обычно используемые в иммуноанализах, могут быть использованы без какого-либо ограничения, и их примеры включают радиоизотопы; ферменты, такие как щелочная фосфатаза (ALP) и пероксидаза (POX); флуоресцентные вещества, такие как флуоресцеинизотиоцианат (FITC) и тетраметилродамин-изотиоцианат (RITC), и 1N-(2,2,6,6-тетраметил-1-оксил-4-пиперидил)-5N-(аспартат)-2,4-динитробензол (TOPA).
[0034]
Примеры метящего ферментом материала для мечения ферментом включают, наряду с материалами, описанными выше, микропероксидазу, химотрипсиноген, прокарбоксипептидазу, глицеральдегид-3-фосфатдегидрогеназу, амилазу, фосфорилазу, D-Nase и P-Nase. Мечение с использованием этих метящих материалов может осуществляться в соответствии с известным способом (см., например, "Monoclonal antibody", Tatsuo Iwasaki, et al., Kodansya Scientific, 1984; "Enzyme Immunoassay", 2nd edition, Eiji Ishikawa, et al., Igaku Shoin, 1982).
[0035]
Активность фермента может быть измерена известным способом в зависимости от типа используемого фермента. Например, в случае использования пероксидазы в качестве метящего фермента, ABTSJ, (2,2’-азино-бис(3’-этилбензтиазолинсульфоновую кислоту) используют в качестве субстрата; в случае использования щелочной фосфатазы, п-нитрофенилфосфат используют в качестве субстрата и расщепление каждого субстрата измеряют, например, при помощи спектрофотометра (См., например, “Enzyme Immunoassay”, 2nd edition, Eiji Ishikawa, et al., Igaku Shoin, 1982).
[0036]
При использовании радиоизотопа или флуоресцентного материала вместо ферментной метки в качестве маркера этот маркер может быть также измерен известным способом.
[0037]
В этой системе измерения, может быть использован любой растворитель, который обычно используется и не влияет вредным образом на эту реакцию. Конкретно, может быть, предпочтительно, использован буферный раствор с рН около 5-9, такой как цитратный буферный раствор, фосфатный буферный раствор, буферный раствор Tris-хлористоводородной кислоты или ацетатный буферный раствор.
[0038]
Условия иммунной реакции (связывания) особо не ограничиваются и используются обычные условия, которые используются в этих анализах. Обычно реакция может осуществляться при температуре 45°С или менее, предпочтительно, около 4-40°С, в течение, например, 1-40 часов.
[0039]
Таким образом, в этом способе, использующем полипептид по настоящему изобретению в качестве антигена, антитело против WT1 у пациента с WT1-связанным заболеванием может быть точно и с большой чувствительностью измерено, и вариация в титре антитела против WT1 может быть удовлетворительно детектирована.
[0040]
Концентрации антитела против WT1 у пациентов с WT1-связанным заболеванием значимо увеличиваются в сравнении с концентрациями у здоровых индивидов и уменьшаются лечением этих пациентов. Таким образом, можно определить присутствие, прогресс лечения и прогноз WT1-связанного заболевания с использованием концентрации антитела против WT1, предпочтительно, изменения концентрации со временем, в виде клинического индекса. Например, антитело против WT1 исчезает, когда WT1-связанное заболевание, такое как лейкоз, является полностью ослабленным. Сохранение этой полной ремиссии может быть подтверждено исследованием исчезновения этого антитела на протяжении времени.
[0041]
Детектирование антитела против WT1 у пациента с WT1-связанным заболеванием, т.е. идентификация анти-WT1-антитело-положительного пациента, означает, что гуморальная иммунная реакция на WT1 вызвана у этого пациента. Таким образом, само детектирование антитела против WT1 применимо для определения или диагностики способности иммунной реакции этого пациента в WT1-связанном заболевании. Пациенты, обнаруживающие иммунную реакцию на WT1, могут иметь лучший прогноз вследствие этой высокой иммунной реакции в сравнении с пациентами, не обнаруживающими иммунной реакции. Такое определение или диагностика могут быть индексом для определения прогноза WT1-связанного заболевания.
[0042]
Таким образом, этот способ измерения антитела против WT1 по изобретению является полезным для определения присутствия, прогресса лечения и прогноза WT1-связанного заболевания, в частности, для исследования или диагностики способности иммунной реакции (на рак) различных больных раком.
[0043]
Способ измерения антитела против WT1 по настоящему изобретению может быть применен для прогнозирования ответа у пациента на терапию рака вакциной против WT1 перед терапией или для мониторинга реакции на эту терапию после этой терапии. Например, можно ожидать, что больной раком, таким как опухоль головного мозга или рак ободочной кишки, имеющий высокий титр IgG-антитела или IgM-антитела против пептида в С-концевой области (например, полипептида, содержащего последовательность с аминокислотами в положениях 294-449 последовательности SEQ ID NO:1) или высокий титр IgM-антитела против пептида в центральной области (например, полипептида, содержащего последовательность с аминокислотами в положениях 181-324 последовательности SEQ ID NO:1) перед введением вакцины против WT1, получит высокий терапевтический эффект посредством этой вакцины против WT1. Кроме того, у пациента, титр IgG-антитела к пептиду центральной области увеличивается после введения вакцины против WT1, и тенденция слабого увеличения в титре IgG-антитела к пептиду С-концевой области также распознается. Эти результаты демонстрируют, что терапевтическая реакция может быть подвергнута мониторингу с использованием изменения в титре IgG-антитела для пептида центральной области или С-концевой области, в качестве индекса.
[0044]
Этот способ измерения антитела против WT1 по настоящему изобретению или различные тесты, использующие этот способ, могут легко осуществляться с использованием полипептида по настоящему изобретению в качестве измерительного реагента. Настоящее изобретение также обеспечивает такой измерительный реагент. Этот измерительный реагент может быть использован в качестве тест-реагента (набора) для определения присутствия, прогресса лечения и прогнозирования WT1-связанного заболевания.
[0045]
Измерительный реагент или тест-реагент по настоящему изобретению содержит антигенный полипептид по настоящему изобретению в качестве активного ингредиента. Измерительный реагент или тест-реагент может дополнительно содержать произвольные реагенты, такие как детектирующий антитело реагент, используемый в этой системе измерения, и реагенты, необходимые для выполнения этого измерения, например, раствор для разведения антитела, раствор для разведения реакции, буферный раствор, промывочный раствор и определяющий маркер реагент.
[ПРИМЕРЫ]
[0046]
Теперь будут описаны примеры настоящего изобретения, но настоящее изобретение не ограничивается ими.
Пример 1
1. Материал и способ
1-1. Образец сыворотки
Использовали двадцать образцов больных раком в Osaka University и коммерчески доступные 54 образца сыворотки здоровых индивидов. Сыворотку пациентов, обработанную вакциной против WT1, собирали перед введением и в нескольких временных точках после введения в Osaka University.
[0047]
1-2. Измерение титра антитела против полноразмерного WT1-антигена
Титр антитела к полноразмерному WT1-антигену сыворотки у больного раком измеряли при помощи ELISA, установленного Oji, et al. (непатентный документ 7; Oji Y, Kitamura Y, Kamino K, et al., WT1 IgG antibody for early detection nonsmall cell lung cancer and as its prognostic factor, Int J Cancer 2009, 125: 381-7).
[0048]
1-3. Конструирование вектора экспрессии частичного WT1-антигена
Полноразмерную кДНК WT1 разделяли на N-концевую область положений 1-182 (Fr. 1), центральную область положений 181-324 (Fr. 2) и С-концевую область положений 294-448 (Fr. 3) WT1 (SEQ ID NO: 1). Эти области амплифицировали при помощи ПЦР с использованием праймеров амплификации Fr. 1 (SEQ ID NO:2 и SEQ ID NO: 3), праймеров амплификации Fr. 2 (SEQ ID NO: 4 и SEQ ID NO: 5) и праймеров амплификации Fr. 3 (SEQ ID NO: 6 м SEQ ID NO: 7). Каждый из Fr. 1 и Fr. 2 клонировали в вектор экспрессии pET-42a (+) (Merck KGaA) и Fr. 3 клонировали в вектор экспрессии pQE-80L (QIAGEN N.V.).
SEQ ID NO:2: ATGCGCGGTACCATGGGCTCCGACGTGCGGGACCTG
SEQ ID NO:3: ATGCGCGCGGCCGCCATGGGATCCTCATGCTTGAAT
SEQ ID NO:4: ATGCGCGGTACCCCCATGGGCCAGCAGGGCTCGC
SEQ ID NO:5: ATGCGCGCGGCCGCCATGAAGGGGCGTTTCTCACTGG
SEQ ID NO:6: ATGCGCGGATCCTTCAGAGGCATTCAGGATGTGC
SEQ ID NO:7: ATGCGCAAGCTTCAAAGCGCCAGCTGGAGTTTGGTC
[0049]
1-4. Получение антигена Fr. 1
Вектор экспрессии Fr. 1 трансформировали в E. coli BL21 (DE3) и экспрессию рекомбинантного hWT1 Fr. 1 индуцировали в 1 мМ IPTG при 16°С в течение 16 часов. Эти клетки собирали центрифугированием, затем суспендировали в D-PBC(-), содержащем 0,2% Тритон Х-100, и подвергали действию ультразвука, с последующим центрифугированием для сбора растворимой фракции. Растворимую фракцию разбавляли в два раза D-PBC(-), связывали с колонкой GST-белка для очистки (Glutathione Sepharose HP, GE Healthcare, Inc.), уравновешивали раствором буфера для уравновешивания В1-1 (D-PBS(-), содержащим 0,1% Тритон Х-100), промывали раствором буфера для уравновешивания и затем элюировали буферным раствором для элюции В1-1 (50 мМ Трис-HCl, 0,2% Тритон Х-1001, 10 мМ восстановленный глутатион, рН 8,0). Элюат дополнительно разбавляли в три раза раствором буфера для уравновешивания В1-2 (20 мМ NaPi, 0,5 М NaCl, 0,2% Тритон Х-100, рН 7,4), связывали с His-tag колонкой для очистки (Ni Sepharose HP, GE Healthcare, Inc.), уравновешивали буферным раствором для уравновешивания В1-2, промывали промывочным буферным раствором для уравновешивания В1-2 и промывочным буферным раствором В1-2 (20 мМ NaPi, 0,5 М NaCl, 0,2% Тритон Х-100, 250 мМ имидазол, рН 7,4) последовательно и затем элюировали буферным раствором для элюции 1-2 (20 мМ NaPi, 0,5 М NaCl, 0,2% Тритон Х-100, 500 мМ имидазол, рН 7,4). Этот очищенный антиген Fr. 1 подвергали определению белка при помощи метода Бредфорда.
[0050]
1-5. Получение антигена Fr. 2
Вектор экспрессии hWT1 Fr. 2 трансформировали в E. coli BL21 (DE3) и экспрессию антигена Fr. 2 индуцировали в 1 мМ IPTG при 37°С в течение 3 часов. Клетки собирали центрифугированием, затем суспендировали в D-PBS(-), содержащем 0,2% Тритон Х-100, и подвергали действию ультразвука, с последующим центрифугированием для сбора нерастворимой фракции. Эту нерастворимую фракцию дополнительно суспендировали в D-PBS(-) и собирали центрифугированием. Эту процедуру повторяли дважды для промывания. Промытую нерастворимую фракцию суспендировали в D-PBS(-), содержащем 2 М мочевину, и инкубировали при 4°С в течение 16 часов. Эту нерастворимую фракцию собирали центрифугированием и дополнительно суспендировали в D-PBS(-), содержащем 6 М мочевину, с последующим инкубированием при 4°С в течение 16 часов с получением растворимой фракции. Эту растворимую фракцию разбавляли в три раза буферным раствором для уравновешивания В2 (20 мМ NaPi, 0,5 М NaCl, 6 М мочевина, 5 мМ 2-меркаптоэтанол, рН 7,4), связывали с His-tag-колонкой для очистки (Ni Sepharose HP, GE Healthcare, Inc.), уравновешивали буферным раствором для уравновешивания В2, промывали буферным раствором для уравновешивания В2 и промывочным буферным раствором В2 (20 мМ NaPi, 0,5 М NaCl, 6 М мочевина, 5 мМ 2-меркаптоэтанол, 200 мМ имидазол, рН 7,4) последовательно, и затем элюировали буферным раствором для элюции В2 (20 мМ NaPi, 0,5 М NaCl, 6 М мочевина, 5 мМ 2-меркаптоэтанол, 500 мМ Имидазол, рН 7,4). Этот очищенный антиген Fr. 2 подвергали определению белка при помощи метода Бредфорда.
[0051]
1-6. Получение антигена Fr. 3
Вектор экспрессии Fr. 3 трансформировали в E. coli BL21 (DE3) и экспрессию антигена Fr. 3 индуцировали в 1 мМ IPTG при 16°С в течение 16 часов. Эти клетки собирали центрифугированием, затем суспендировали в D-PBS(-), содержащем 30 мкМ ZnCl2 и 0,2% Тритон Х-100, и подвергали действию ультразвука, с последующим центрифугированием для сбора растворимой фракции. Эту растворимую фракцию разбавляли в 2 раза буферным раствором для уравновешивания В5 (20 мМ Трис-HCl, 1 М NaCl, 0,1% Тритон Х-100, 30 мкМ ZnCl2, рН 8,0), связывали с His-tag-колонкой для очистки (TALON superflow, Clontech, Inc.), уравновешенной буферным раствором для уравновешивания, промывали буферным раствором 5 для уравновешивания и промывочным буферным раствором В5 (10 мМ Трис-HCl, 1 М NaCl, 30 мкМ ZnCl2, 0,1% Тритон Х-100, 25 мМ имидазол, рН 8,0) последовательно, и затем элюировали буферным раствором В для элюции (10 мМ Трис-HCl, 0,72 М NaCl, 30 мкМ ZnCl2, 0,1% Тритон Х-100, 200 мМ имидазол, рН 8,0). Этот очищенный антиген Fr. 3 подвергали определению белка при помощи метода Бредфорда.
[0052]
1-7. Получение твердофазного планшета с иммобилизованным антигеном
Очищенные антиген Fr. 1, антиген Fr. 2 или антиген Fr. 3 доводили до концентрации 10 мкг/мл с использованием D-PBS(-) и 100 мкл из них добавляли в 96-луночный микротитрационный планшет (96-Well EIA/RIA Stripwel Plate, CORNING, Inc.) с последующим инкубированием при 4°С в течение 16 часов для иммобилизации с твердой фазой.
Планшет промывали промывочным раствором (D-PBS(-), содержащим 0,05% Твин 20) один раз и 300 мкл блокирующего планшет раствора (D-PBS(-), содержащего 1% бычий сывороточный альбумин (BSA)), добавляли в этот планшет, с последующим инкубированием при 4°С в течение 16 часов для блокирования. Этот блокирующий раствор удаляли и этот планшет сушили в 25°С-термостате и затем хранили при 4°С до использования.
[0053]
1-8. Измерение IgG при помощи ELISA с использованием антигена Fr. 1
Твердофазный планшет с иммобилизованным антигеном промывали промывочным раствором один раз и 100 мкл коммерчески доступного антитела (hWT1 H-290, SANTA CRUZ Biotechnology, Inc.) или сыворотки, подходящим образом серийно разведенной раствором 1 для разведения образцов (20 мМ NaPi, 0,65 М NaCl, 0,05% Твин 20, 0,05% ProClin 300, 1% BSA, рН 8,0) добавляли в твердофазный планшет с иммобилизованным антигеном, с последующей реакцией со встряхиванием при 25°С в течение 1 часа. Затем этот планшет промывали промывочным раствором три раза и 100 мкл конъюгированного с пероксидазой хрена (HRP) Белка G (Acris Antibodies Inc.), разведенного в 50000 раз вторичным раствором для разведения реакции (D-PBS(-), содержащим 0,05% Твин 20, 0,05% ProClin 300 и 0,5% BSA), добавляли в этот планшет, с последующей реакцией со встряхиванием при 25°С в течение 1 часа. Наконец, этот планшет промывали промывочным раствором три раза и 100 мкл 3,3’,5,5’-тетраметилбензидина (TMB) добавляли в этот планшет для окрашивания при комнатной температуре в течение 10 минут. Эту реакцию останавливали 100 мкл 1 н серной кислоты. Оптическую плотность при 450 нм (ссылочная длина волны: 650 нм) измеряли с использованием микропланшет-ридера.
[0054]
1-9. Измерение IgG при помощи ELISA с использованием антигена Fr. 2
GST-экспрессирующий экстракт E. coli добавляли к коммерчески доступному антителу (hWT1 H-290) или сыворотке, подходящим образом серийно разведенной раствором 1 для разведения образцов, с получением концентрации 5°С в течение 1 часа с получением раствора образца Fr. 2. Твердофазный планшет с иммобилизованным антигеном промывали промывочным раствором один раз и 100 мкл раствора образца Fr. 2 добавляли в этот планшет, с последующей реакцией со встряхиванием при 25°С в течение 1 часа. Затем этот планшет промывали промывочным раствором три раза и 100 мкл HRP-конъюгированного Белка G, разбавленного в 50000 раз вторичным раствором для разведения реакции, добавляли в этот планшет, с последующей реакцией со встряхиванием при 25°С в течение 1 часа. Наконец, этот планшет промывали промывочным раствором три раза и 100 мкл TMB добавляли в этот планшет для окрашивания при комнатной температуре в течение 10 минут. Реакцию останавливали 100 мкл 1 н серной кислоты. Оптическую плотность при 450 нм (ссылочная длина волны: 650 нм) измеряли с использованием микропланшет-ридера.
[0055]
1-10. Измерение IgG при помощи ELISA с использованием антигена Fr. 3
Твердофазный планшет с иммобилизованным антигеном промывали промывочным раствором один раз и 100 мкл коммерчески доступного антитела (hWT1 H-290) или сыворотки, подходящим образом серийно разведенной раствором 2 для разведения образцов (20 мМ NaPi, 0,05% Твин 20, 0,05% ProClin 300, 1% BSA, рН 8,0) добавляли в этот планшет, с последующей реакцией со встряхиванием при 25°С в течение 1 часа. Затем этот планшет промывали промывочным раствором три раза и 100 мкл HRP-конъюгированного Белка G, разбавленного в 50000 раз вторичным раствором для разведения реакции, добавляли в этот планшет, с последующей реакцией со встряхиванием при 25°С в течение 1 часа. Наконец, этот планшет промывали промывочным раствором три раза и 100 мкл TMB добавляли в этот планшет для окрашивания при комнатной температуре в течение 10 минут. Реакцию останавливали 100 мкл 1 н серной кислоты. Оптическую плотность при 450 нм (ссылочная длина волны: 650 нм) измеряли с использованием микропланшет-ридера.
[0056]
1-11. Измерение IgM при помощи ELISA с использованием каждого антигена
IgM-антитело измеряли, как в измерении IgG-антитела. Детектирование выполняли посредством реакции разведенного в 50000 раз HRP-конъюгированного анти-IgM человека специфического антитела.
[0057]
2. Результаты
2-1. Титр антитела для полноразмерного антигена WT1
Таблица 1 и Фигура 1 показывают титры антитела против WT1 в крови сывороточных образцов больного раком, измеренные по способу Oij, et al. Согласно сообщению Oij, et al., распределение титров антител против полноразмерного антигена WT1 у здоровых индивидов равен 10-3664 WRU и их медиана равна 392 WRU (непатентный документ 7). Распределение титра антител в 20 сывороточных образцах больных раком, используемых в этом тесте, было равно 7-1682 WRU. Таким образом, эти образцы находились в пределах диапазона здоровых индивидов.
[0058]
|
[0059]
2-2. Титр антитела к частичному антигену WT1 у больных раком
Титры антител в крови измеряли при помощи ELISA с использованием частичных антигенов WT1. Титры антител крови рассчитывали из калибровочной кривой оптической плотности против концентрации, сконструированной с использованием серийно разведенного коммерчески доступного антитела в качестве стандарта. Эти титры антител против каждого антигена крови у больных раком показаны в Таблице 1.
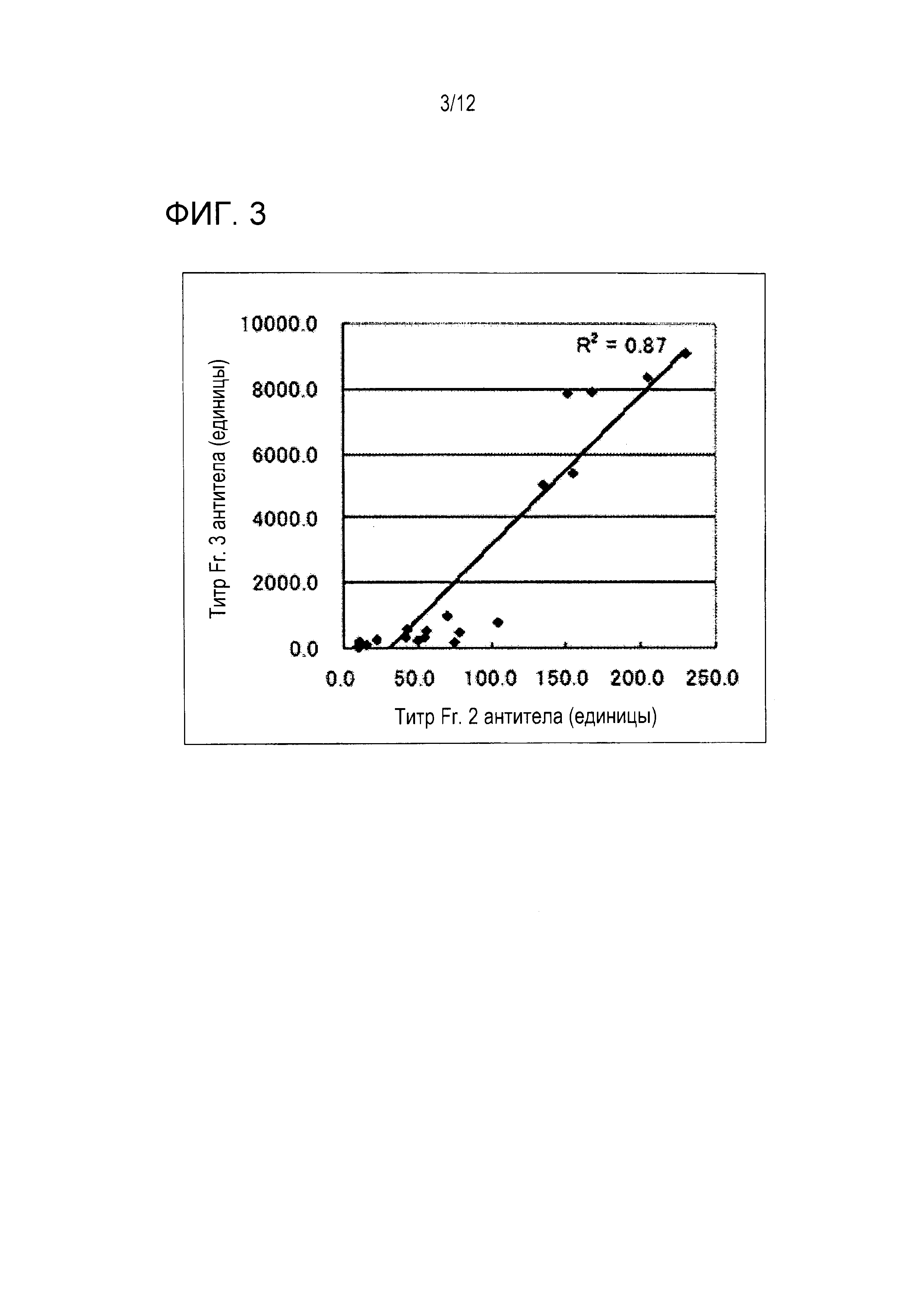
Фигура 2 показывает результаты сравнения между титрами антител против каждого частичного антигена WT1 и полноразмерного антигена WT1. Титры антител против антигена Fr. 2 и антигена Fr. 3 показывали высокие корреляции с титром антитела против полноразмерного антигена WT1. Корреляция между титром антитела против антигена Fr. 2 и титром антитела против антигена Fr. 3 была также высокой (фигура 3).
Эти результаты предполагают, что титр антитела против полноразмерного антигена WT1 отражает титр антитела против Fr. 3 и что Fr. 3 включает основной эпитоп для этого антитела в крови.
[0060]
2-3. Распределение титра антитела против частичного антигена WT1
Фигура 4 показывает результаты сравнения между распределением титра антител против частичных антигенов WT1 у 54 здоровых индивидов (N) и распределением титра антител против частичных антигенов WT1 у 20 больных раком (С). Распределение титров антител против антигена Fr. 2 и антигена Fr. 3 у больных раком были более высокими, чем распределения этих титров у здоровых индивидов, тогда как распределения титров антител против антигена Fr. 1 были по существу одинаковыми у больных раком и у здоровых индивидов. В частности, распределение титра антител против антигена Fr. 3 было наиболее широким, и титры антител образцов шести больных раком были в пять или более раз более высокими, чем титры распределения здоровых индивидов.
Приведенные выше результаты демонстрируют, что антиген Fr. 3 может классифицировать группу высокого титра более ясно, чем в случае использования титра антител против полноразмерного антигена WT1.
[0061]
Пример 2: Тест ингибирования антигена
Для исследования феномена, заключающегося в том, что титр антитела против антигена Fr. 3 детектируется с высокой чувствительностью в сравнении с титром антитела против полноразмерного антигена WT1, исследовали, маскируется ли эпитоп антитела антигена Fr. 3 реакцией антигена Fr. 1 или антигена Fr. 2 с антигеном Fr. 3. В качестве этих образцов использовали поликлональное антитело (PoAb) против Fr. 3 и сыворотку трех пациентов (Номера образцов 3, 7 и 9), имеющих высокие титры антитела против Fr. 3.
[0062]
1. Способ
Твердофазный планшет с иммобилизованным антигеном Fr. 3 промывали промывочным раствором один раз и 100 мкл антигена Fr. 1 или антигена Fr. 2, разведенных вторичным раствором для разведения реакции, добавляли в этот планшет с последующей реакцией со встряхиванием при 25°С в течение 1 часа. Затем, 100 мкл коммерчески доступного антитела (hWT1 H-19, SANTA CRUZ Biotechnology, Inc.) или сыворотки, разведенной раствором 1 для разведения образцов, добавляли в этот планшет с последующей реакцией со встряхиванием при 25°С в течение 1 часа. Кроме того, этот планшет промывали промывочным раствором три раза и затем в этот планшет добавляли 100 мкл HRP-конъюгированного Белка G, разведенного в 50000 раз вторичным раствором для разведения реакции с последующей реакцией со встряхиванием при 25°С в течение 1 часа. Наконец, этот планшет промывали промывочным раствором три раза и 100 мкл TMB добавляли в этот планшет для окрашивания при комнатной температуре в течение 10 минут. Эту реакцию останавливали 100 мкл 1 н серной кислоты. Оптическую плотность при 450 нм (ссылочная длина волны: 650 нм) измеряли с использованием микропланшет-ридера, и степень ингибирования реакции (В/В0) рассчитывали, принимая величину в отсутствие этого антигена за 100%.
[0063]
2. Результаты
Эти результаты показаны на фигуре 5.
Fr. 1 и Fr. 2 ингибировали реактивность PoAb относительно Fr. 3 на 25% и 50%, соответственно. Подобным образом, Fr. 1 или Fr. 2 ингибировали титр антитела каждого образца сыворотки относительно Fr. 3. В образце № 3, эта реакция не ингибировалась Fr. 1, но 70% ее ингибировалось Fr. 2. В образце № 9 эта реакция не ингибировалась Fr. 2, но 40% ее ингибировалось Fr. 1. В образце № 7, хотя степени были низкими, эта реакция ингибировалась как Fr. 1, так и Fr. 2 на 10% и 20%, соответственно.
Приведенные выше результаты предполагают, что Fr. 1 и Fr. 2 были способны связываться с Fr. 3 и что это связывание маскирует эпитоп Fr. 3 антитела.
[0064]
Пример 3: Оценка титра антител у пациента с опухолью головного мозга, которому вводили вакциной против WT1.
Оценивали титры IgG- и IgM-антител против антигена Fr. 1, антигена Fr. 2 и антигена Fr. 3 пациентов, которым вводили модифицированную пептидную вакцину WT1 235 (аминокислотная последовательность (YTWNQMNL)). В качестве образцов пациентов использовали пять образцов группы стабильного заболевания (SD) и четыре образца группы прогрессирующего заболевания (PD). Онкологические ткани оценивали при помощи MRI.
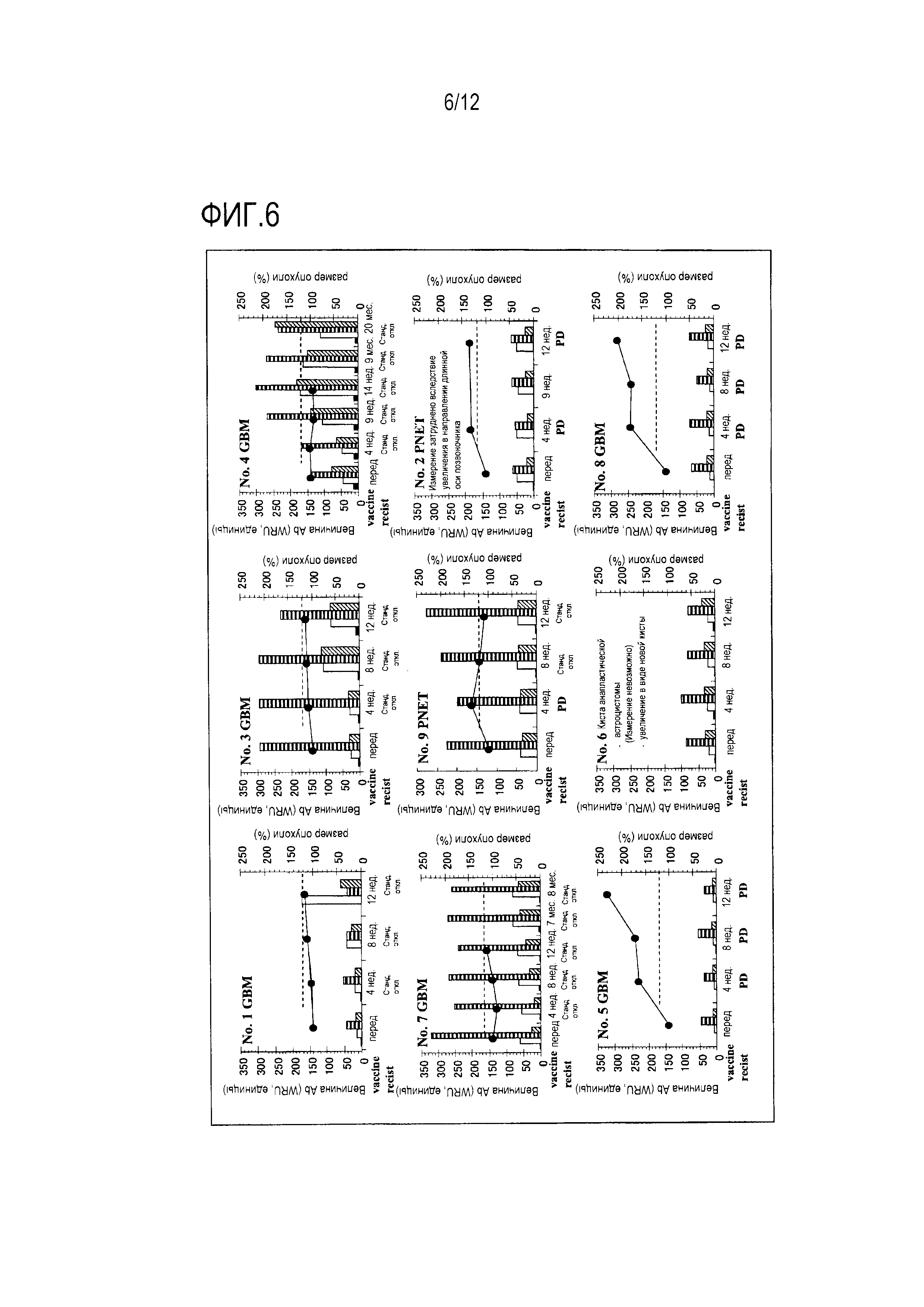
Фигура 6 суммирует изменения в титре IgG-антитела пациентов, которым вводили пептид WT1 235.
Титр антитела IgG против Fr. 1 едва детектировался у всех пациентов. Титры антитела против Fr. 3 явно классифицировались в группу высокой величины и группу низкой величины и едва изменялись перед введением и после введения. Кроме того, эти титры антител по существу не обнаруживали корреляции с полноразмерным WT1-антигеном. Однако титр антитела против Fr. 2 увеличивался со временем после вакцинации у некоторых пациентов. Было подтверждено, что этот титр антитела имеет высокую корреляцию с титром антитела против полноразмерного антигена WT1.
[0065]
Фигура 7 суммирует результаты сравнения титра IgG-антитела против каждого антигена перед вакцинацией и терапевтической реакцией.
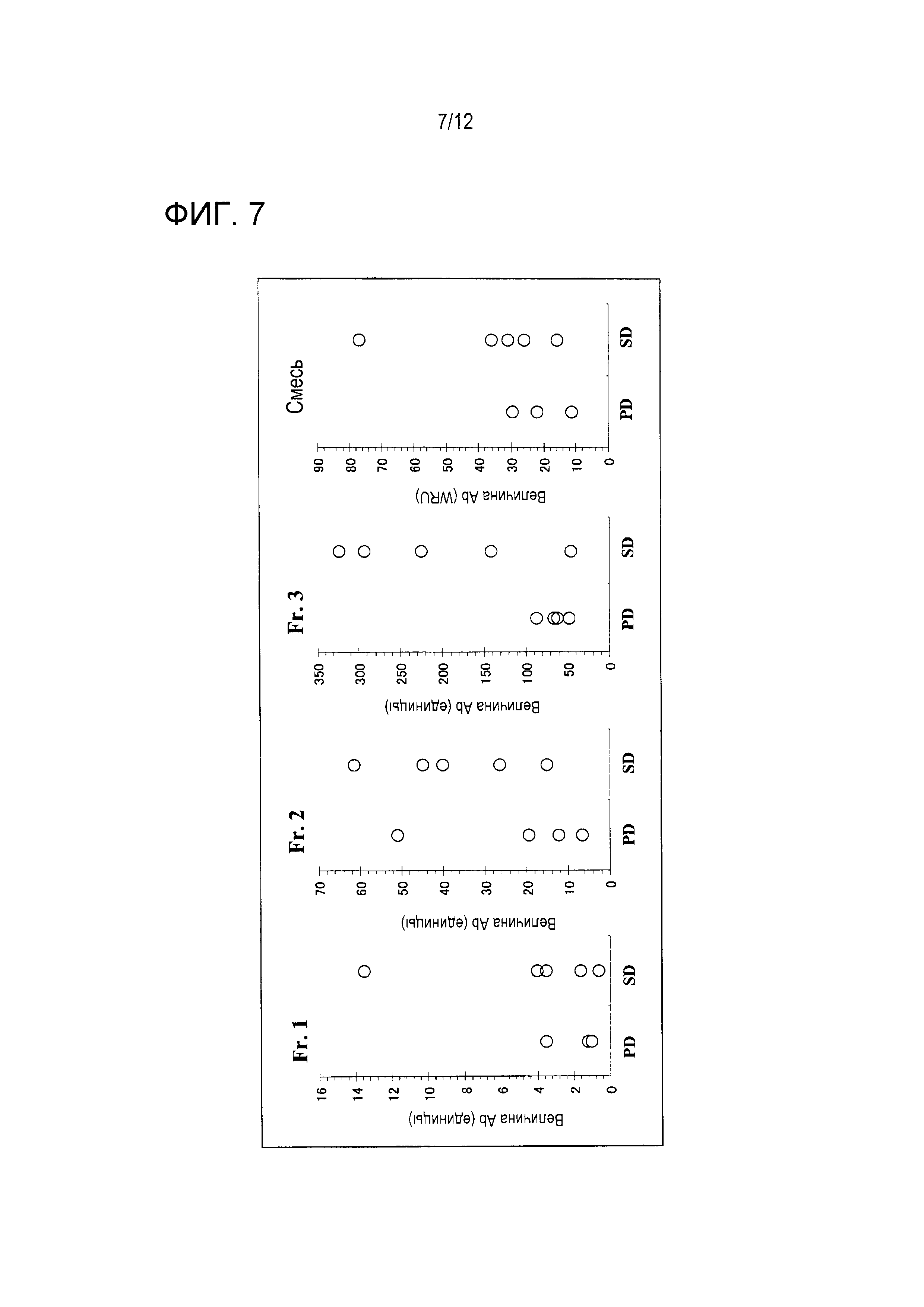
Эти результаты показывают, что титры антител против Fr. 3 были равны 100 единицам или более в четырех из пяти образцов группы SD и что эти титры антител были меньше чем 100 единиц во всех четырех группах группы PD. Такие тенденции не распознавались в титрах антител против других антигенов. Приведенные выше результаты показывают, что пациенты, имеющие высокие титры IgG-антитела против Fr. 3 перед вакцинацией, являются пациентами, которые отвечают на эту вакцинную терапию.
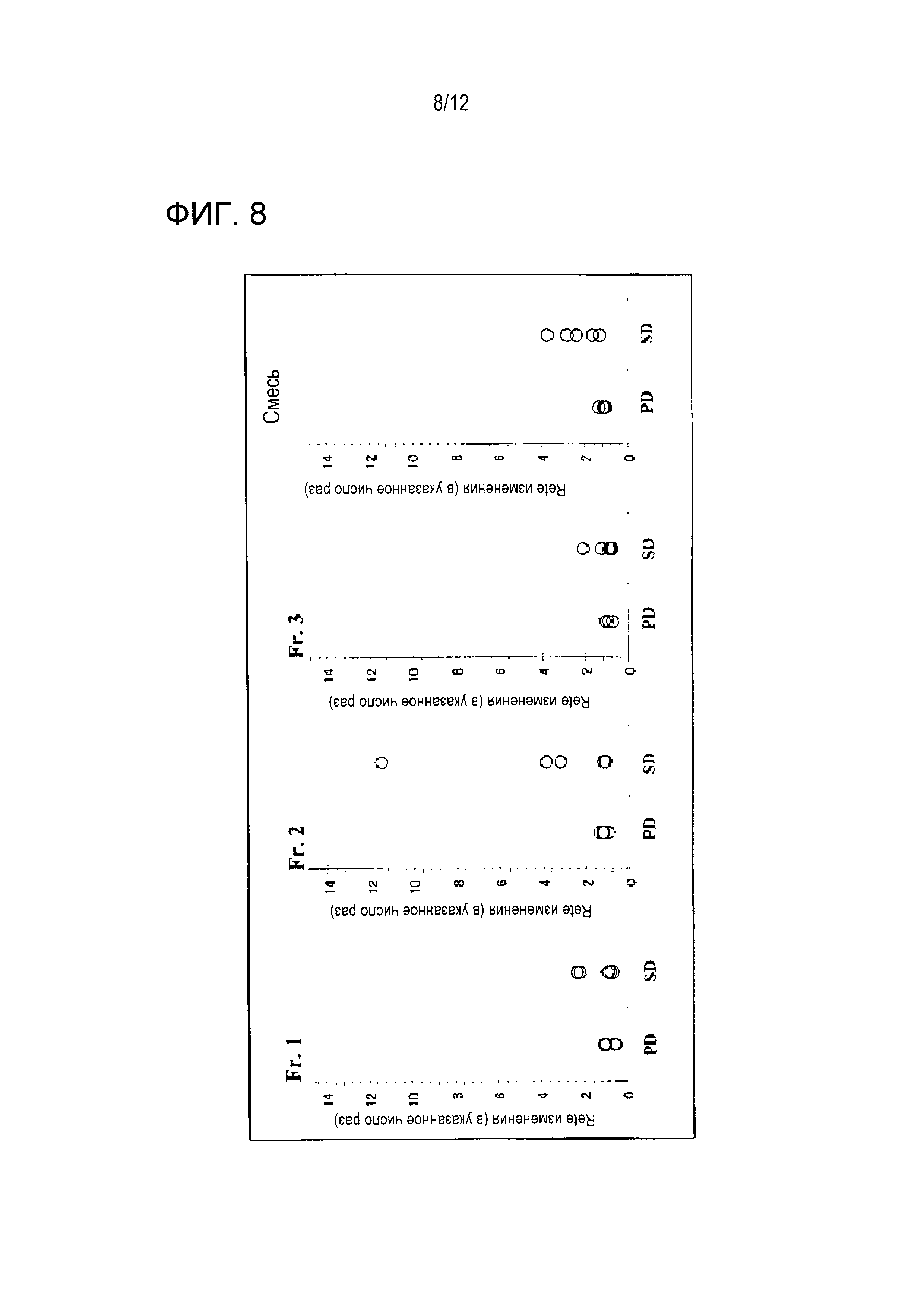
Фигура 8 суммирует результаты сравнения титра IgG-антитела против каждого антигена после вакцинации и терапевтической реакции. Эти результаты показывают, что титры антител против Fr. 2 и полноразмерного антигена WT1 при трех месяцах после вакцинации были в два раза или более высокими, чем эти титры перед вакцинацией в трех из пяти образцов группы SD, тогда как титры этих антител во всех четырех образцах группы PD едва увеличивались. Приведенные выше результаты показывают, что пациенты, имеющие увеличенные титры IgG-антитела против Fr. 2 после вакцинации, являются пациентами, которые отвечают на эту вакцинную терапию.
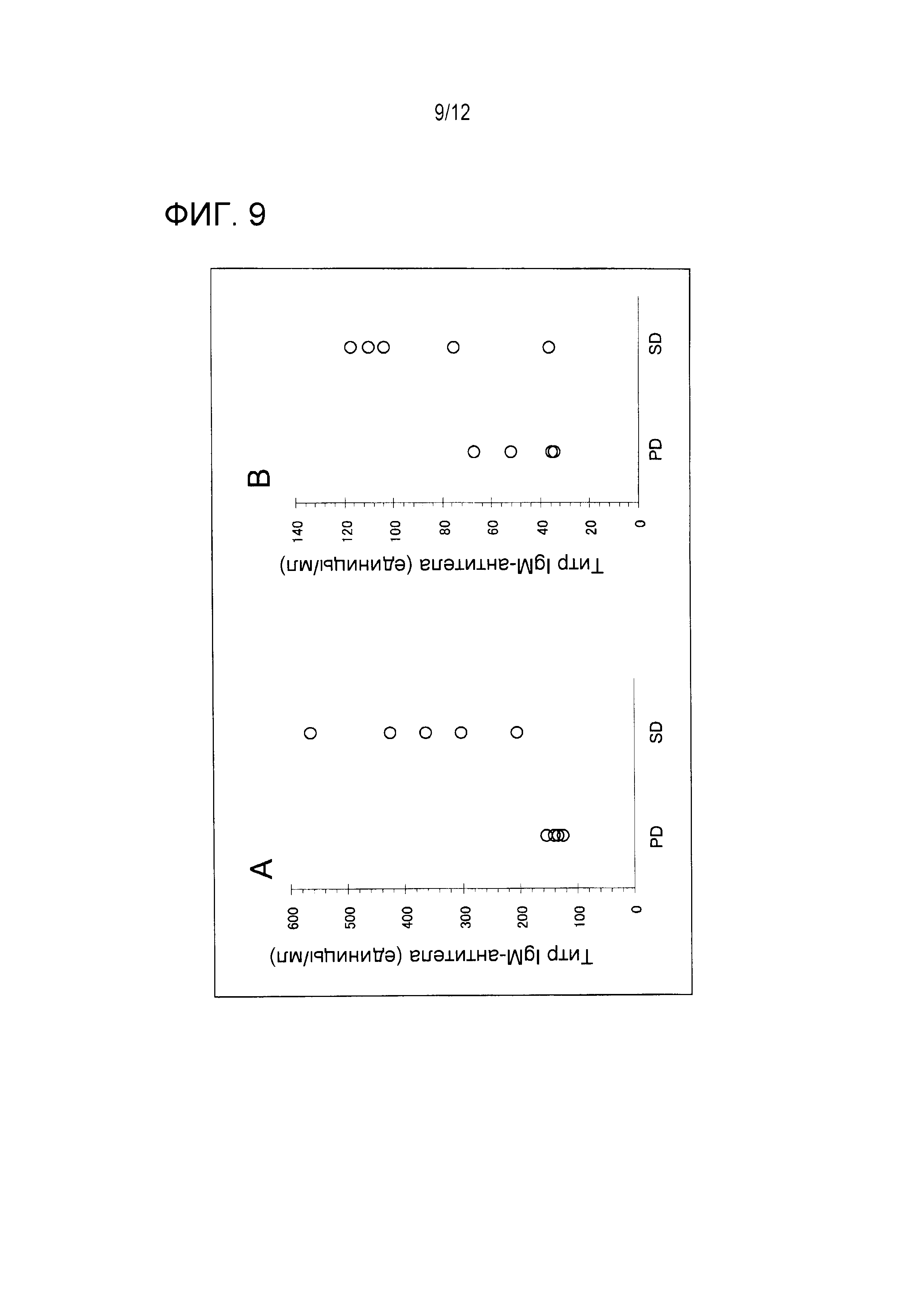
Титры IgM-антител против Fr. 2 и Fr. 3 оценивали с использованием образцов перед вакцинацией. Фигура 9 суммирует результаты сравнения титра IgM-антитела и терапевтической реакции. Эти результаты показывают, что эти титры антитела против Fr. 2 были равны 200 единицам или более во всех пяти образцах группы SD и что эти титры антител были меньшими, чем 200 единиц, во всех четырех образцах группы PD. Кроме того, титры антитела против Fr. 3 были равны 80 единицам или более в трех из пяти образцов группы SD и титры антитела были меньшими, чем 80 единиц во всех четырех образцах группы PD. Приведенные выше результаты показывают, что пациенты, имеющие высокие титры IgM-антител против Fr. 2 и Fr. 3 перед вакцинацией, являются пациентами, которые отвечают на эту вакцинную терапию.
[0066]
Пример 4: Оценка титра антител у пациента с раком ободочной кишки, которому вводили вакциной против WT1.
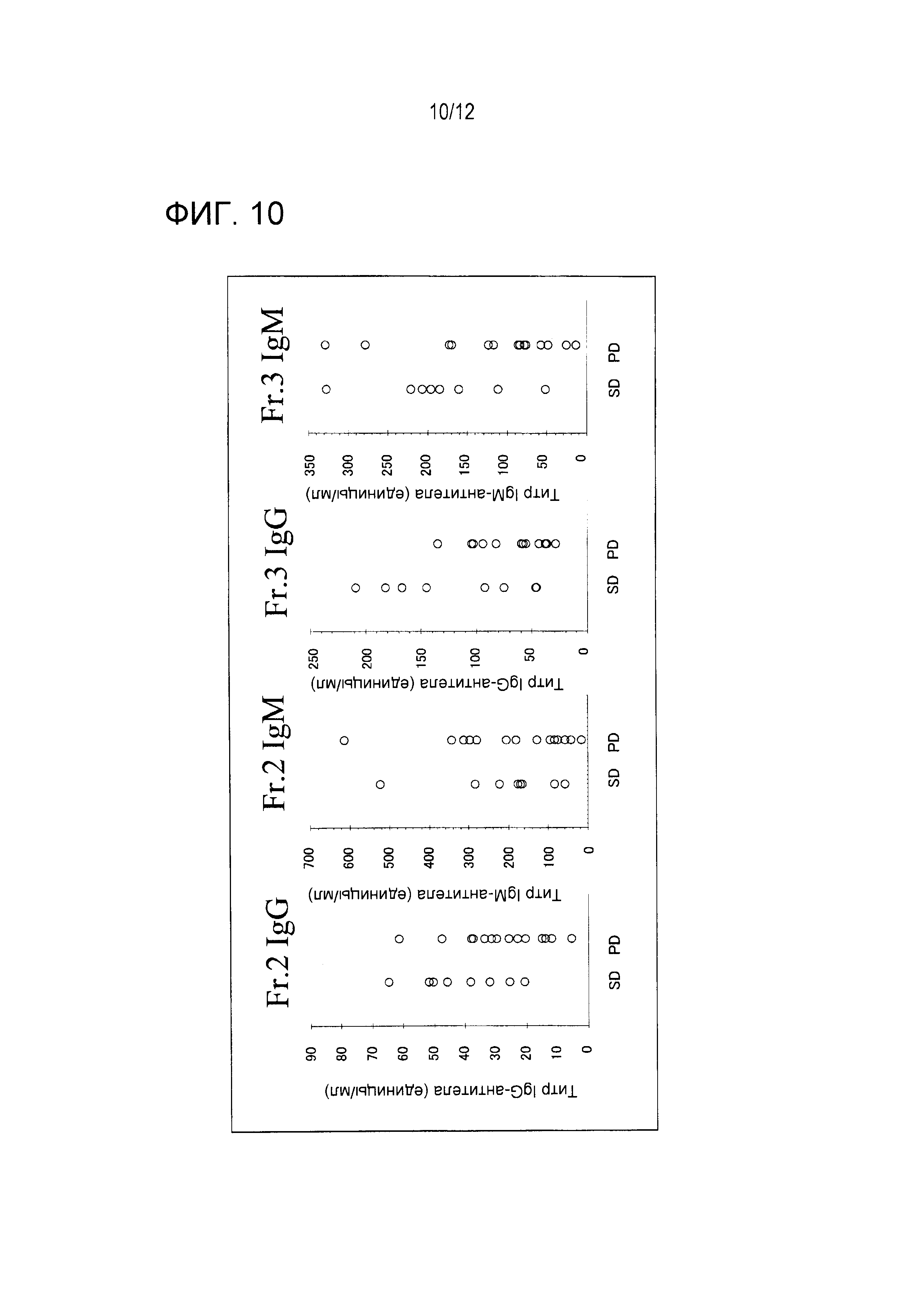
Титры IgG- и IgM-антител против каждого антигена у пациентов, которым вводили пептид WT1 235, оценивали с использованием восьми образцов группы SD и 14 образцов группы PD в качестве образцов пациентов. Титры антител против Fr. 2 и Fr. 3 оценивали с использованием образцов перед вакцинацией. Эти результаты суммированы на Фигуре 10.
Титры IgG- и IgM-антител против Fr. 3 в группе SD были явно более высокими, чем эти титры в группе PD. Титры антитела против Fr. 3 были равны 140 единицам или более в четырех из восьми образцов группы SD, тогда как титр антитела был равен 140 единицам или менее во всех 14 образцах группы PD. Эти титры IgM-антитела против Fr. 3 были равны 140 единицам или более в шести из восьми образцов группы SD, тогда как титры антитела были равны 140 единицам или менее в 10 из 14 образцов группы PD. Приведенные выше результаты показывают, что пациенты, имеющие высокие титры IgM- и IgG-антител против Fr. 3 перед вакцинацией, являются пациентами, которые отвечают на эту вакцинную терапию.
[0067]
Пример 5: Стратификация (расслоение) пациентов в отношении терапии вакциной против WT1 перед терапией
Результаты оценки титров IgM- и IgG-антител против каждого антигена показывают, что титр антитела против Fr.3 перед вакцинацией связан с терапевтической реакцией как у пациентов с опухолью головного мозга, так и у пациентов с раком ободочной кишки. Таким образом, титры IgM- и IgG-антител против Fr. 3 перед вакцинацией суммировали у пациентов с опухолью головного мозга и у пациентов с раком ободочной кишки. Эти результаты пациентов с опухолью головного мозга показаны на Фигуре 11.
У пациентов с опухолью головного мозга, когда прописывали 100 единиц в качестве стандартных величин титра IgG-антитела и титра IgM-антитела, либо титр IgM,- либо титр IgG был равным или более высоким, чем эта стандартная величина во всех образцах группы SD, тогда как титры как IgM-, так и IgG-антитела были равными или более низкими, чем стандартные величины во всех образцах группы PD, что позволяет расслоение. То есть, чувствительность и специфичность в отборе пациентов перед вакцинацией равны (в каждом случае) 100%. Результаты пациентов с раком ободочной кишки показаны на Фигуре 12. Когда прописывали 150 единиц в качестве стандартных величин титра IgG-антитела и титра IGM-антитела, либо титр IgM-антитела, либо титр IgG-антитела был равным или более высоким, чем эта стандартная величина, в семи из восьми образцов группы SD, тогда как титры как IgM-, так и IgG-антитела были равными или более низкими, чем стандартные величины в 10 из 14 образцов группы PD, что позволяет расслоение. То есть, чувствительность и специфичность в отборе пациентов перед вакцинацией равны 85% и 71%, соответственно.
Приведенные выше результаты демонстрируют, что расслоение перед терапией пациентов на эту терапию является возможным даже в различных типах раков посредством измерения титров IgM- и IgG-антител против Fr. 3 перед вакцинацией.