Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДА
Вид РИД
Изобретение
В настоящей заявке описан способ культивирования прокариотических клеток при высокой плотности, таких как штамм Escherichia coli, в среде с определенным химическим составом для получения полипептида, способ, при котором аминокислоты подают в концентрированном щелочном растворе, который одновременно регулирует рН культуральной средой и выступает в качестве источника азота.
Предпосылки к созданию изобретения
В последние годы производство белков неуклонно растет, и вполне вероятно, что в ближайшем будущем белки будут представлять собой самую большую группу терапевтических средств для лечения различных заболеваний. Значение белков обусловлено их специфичностью, например, специфичным распознаванием мишени и связывающей способностью.
В ферментативных процессах для производства веществ, в частности белков, применяют клеточные культуры. Различают процессы, при которых культуры клеток генетически не модифицированы и продуцируют свои собственные продукты обмена веществ, и процессы, при которых организмы генетически модифицированы, таким образом, что они либо производят большее количество своих собственных веществ, таких как белки, или производят чужеродные вещества. Организмы, продуцирующие вещества, поставляются с питательной средой, которая гарантирует выживание организмов и позволяет производить желаемое целевое соединение. Известны многие питательные среды для таких целей, которые позволяют оптимально культивировать конкретные клетки-хозяева.
Культивирование Escherichia coli при высокой плотности клеток описано Рейзенбергом (Riesenberg, D., et al., Curr. Opin. Biotechnol. 2 (1991) 380-384) и Хорном (Horn, U., et al., Appl. Microbiol. Biotechnol. 46 (1996) 524-532). В работе Рейзенберга и Гутке (Riesenberg, D. and Guthke, R. Appl. Microbiol. Biotechnol. 51 (1999) 422-430) описано культивирование микроорганизмов при высокой плотности клеток. Выращивание E.coli до высокой плотности клеток рассмотрено в работе Шилоаха и Фасса (Shiloach, J. and Fass, R. Biotechnol. Advances 23 (2005) 345-357).
В международной публикации WO 91/10721 описан процесс ферментации при высокой плотности клеток Escherichia coli в котле-ферментере. Метод производства и очистки плазмидной ДНК описан в WO 97/29190. Регулирование роста аэробной взвешенной культуры микроорганизмов путем контроля концентрации растворенного кислорода и скорости переноса кислорода описано в DD 295867. Способ получения рекомбинантных белков в E.coli путем культивирования при высокой плотности описан в ЕР 0866876.
В международной публикации WO 03/048374 описан процесс производства метаболитов ароматических аминокислот или их производных. Способ получения рекомбинантных белков в E.coli путем ферментации при высокой плотности клеток описан в международной публикации WO 97/21829.
Краткое описание изобретения
Было установлено, что прокариотические клетки, в частности ауксотрофный по аминокислоте штамм E.coli K12, можно выращивать в среде с определенным химическим составом при высокой плотности клеток, в культуральную среду добавлять аминокислоты в щелочном растворе.
Один аспект, описанный в настоящей заявке, представляет собой способ культивирования бактериальных клеток, в частности, клеток Е.coli, при высокой плотности клеток, способ, в котором клетка экспрессирует рекомбинантный полипептид, где культивирование включает добавление в ходе культивирования щелочного раствора аминокислоты, выбранной из аспартата, аспарагиновой кислоты, глутамина, глутаминовой кислоты, глицина, гистидин, изолейцина, лейцина, лизина, метионина, фенилаланина, триптофана и тирозина,
где концентрация аминокислоты в щелочном растворе выше, чем ее растворимость в воде при 20°С и при нейтральном рН, и
где сухой вес клеток культивируемых бактериальных клеток в определенный момент культивирования составляет не менее 20 г/л.
Один аспект, описанный в настоящей заявке, представляет собой способ получения полипептида, включающий этапы:
а) обеспечение бактериальной клетки, в частности клетки Е.coli, содержащей нуклеиновую кислоту, кодирующую полипептид,
б) культивирование указанной клетки,
в) регулирование значение рН во время культивирования с помощью щелочного раствора, содержащего аминокислоту, выбранную из аспартата, аспарагиновой кислоты, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, триптофана и тирозина,
г) выделение полипептида из клетки или культуральной среды и таким образом, получение полипептида.
Другой аспект, описанный в настоящей заявке, представляет собой применение щелочного раствора, содержащего аминокислоту, для регулирования значения рН во время культивирования бактериальных клеток.
Также аспект, описанный в настоящей заявке, представляет собой применение щелочного раствора аминокислоты в качестве подпитки при выращивании бактериальной клетки, при этом аминокислота выбрана из аспартата, аспарагиновой кислоты, глутамина, глутаминовой кислоты, глицины, гистидины, изолейцины, лейцины, лизины, метионины, фенилаланины, триптофаны и тирозины, и культивирование осуществляют до достижения сухого веса клеток 20 г/л и более.
Ниже приведены конкретные варианты реализации всех аспектов, как описано ранее.
В одном варианте аминокислота представляет собой малорастворимую в воде аминокислоту. В одном варианте реализации бактериальная клетка представляет собой клетку, ауксотрофную по аминокислоте, и ауксотрофия наблюдается в отношении аминокислоты, выбранной из аспартата, аспарагиновой кислоты, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, триптофана и тирозина. В другом варианте реализации бактериальная клетка представляет собой клетку Escherichia coli или ее мутантный вариант. В еще одном варианте реализации аминокислота имеет растворимость в воде при 20°С 50 г/л или менее. В еще одном варианте реализации аминокислота имеет растворимость в воде при 20°С до 40 г/л или менее. В другом варианте реализации аминокислота выбрана из аспартата, аспарагиновой кислоты, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, триптофана и тирозина. В другом варианте реализации аминокислота выбрана из аспартата, аспарагиновой кислоты, глутамина, глутаминовой кислоты, гистидина, лейцина, триптофана и тирозина. В одном варианте реализации аминокислота представляет собой лейцин. В еще одном варианте реализации аминокислота имеет концентрацию в щелочном растворе выше, чем ее растворимость в воде при 20°С. В одном варианте реализации растворимость в два раза выше, в другом варианте - в три раза выше, чем растворимость в воде при 20°С. В другом варианте реализации растворимость выше, чем растворимость в воде при 20°С и при значении рН от 6 до 8. В одном варианте реализации аминокислота имеет концентрацию 25 г/л и более в щелочном растворе, или в другом варианте реализации - 30 г/л или более, или в еще одном варианте реализации - 35 г/л и более. В одном варианте реализации аминокислота имеет концентрацию в щелочном растворе 45 г/л и более. В одном варианте реализации аминокислота имеет концентрацию в щелочном растворе около 50 г/л. В еще одном варианте реализации щелочной раствор имеет рН 9 или больше, в другом варианте реализации - 10 или более, и еще в другом варианте реализации - 10,5 или более. В одном варианте реализации щелочной раствор представляет собой раствор аммиака более чем 5% (вес/объем) или 10% (вес/объем) или более, или 15% (вес/объем) или более. В одном варианте реализации щелочной раствор представляет собой раствор аммиака около 12,5% (вес/объем) в воде. Также в другом варианте реализации полипептид представляет собой аполипопротеин А1 человека или его производное. В еще одном варианте реализации аполипопротеин А1 имеет аминокислотную последовательность, выбранную из последовательностей с SEQ ID NO:01 по SEQ ID NO:35. В одном варианте реализации полипептид имеет последовательность аминокислот, выбранную из SEQ ID NO:01, SEQ ID NO:02, SEQ ID NO:34 или SEQ ID NO:35.
Подробное описание изобретения
В настоящей заявке описан способ культивирования прокариотической клетки, например, бактериальной клетки, ауксотрофной по аминокислоте, в котором по меньшей мере одну аминокислоту, например, ту аминокислоту, в отношении которой клетка является ауксотрофной, добавляют в щелочном растворе.
Было обнаружено, что клетки прокариот, например штамм E.coli K12, ауксотрофный по аминокислоте, можно выращивать при высокой плотности клеток, если подпитка, содержащая по меньшей мере одну аминокислоту, например, ту, в отношении которой клетка является ауксотрофной, добавляют в среду для культивирования в щелочном растворе. Это подход имеет особые преимущества, когда аминокислота мало растворима в воде и растворимость может быть увеличена путем растворения аминокислоты в щелочном растворе. В то же время щелочной раствор можно применять для регулирования рН культуральной среды. Путем объединения аминокислотного раствора и раствора для корректировки рН в высококонцентрированном растворе для одной подпитки добавляемый раствор можно снизить, что, таким образом, делает возможным культивирование прокариотических клеток при высокой плотности клеток. Кроме того, было обнаружено, что концентрация по меньшей мере 45 г/л аминокислоты в щелочном растворе для подпитки приводит к увеличению производства рекомбинантного полипептида.
В одном из вариантов реализации способ культивирования прокариотических клеток включает в себя следующие этапы
а) обеспечение прокариотической клетки,
б) культивирование прокариотической клетки,
в) регулирование значения рН во ходе культивирования прокариотических клеток с помощью щелочного раствора, содержащего аминокислоту, выбранную из аспартата, аспарагиновой кислоты, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, триптофана и тирозина.
«Прокариотическая клетка, ауксотрофная по аминокислоте» представляет собой прокариотическую клетку, которая не может синтезировать незаменимую аминокислоту, например, из-за мутации или делеции в генном локусе, содержащем структурный ген, кодирующий белок соответствующего пути биосинтеза. Без добавления соответствующей аминокислоты в среду для культивирования клетка не может размножаться. Ауксотрофия может быть в отношении любой аминокислотой. Прокариотическая клетка также может быть ауксотрофной более, чем по одной аминокислоте. Таким образом, в одном варианте реализации Прокариотическая клетка, ауксотрофная по аминокислоте, является ауксотрофной по меньшей мере по одной аминокислоте. В другом варианте реализации Прокариотическая клетка, ауксотрофная по аминокислоте, ауксотрофна, по меньшей мере, по одной, по меньшей мере, по двум, по меньшей мере, по трем, по меньшей мере, по четырем, по меньшей мере, по пяти аминокислотам. В еще одном варианте реализации Прокариотическая клетка, ауксотрофная по аминокислоте, ауксотрофна в отношении до 5 или до 10, или до 15 аминокислот. В другом варианте реализации Прокариотическая клетка, ауксотрофная по аминокислоте, ауксотрофна в отношении от одной до пяти аминокислот, или в отношении от одной до трех аминокислот, или в отношении от одной до двух аминокислот, или в отношении одной аминокислоте, или двух аминокислот, или в трех аминокислот, или четырех аминокислот. Прокариотическая клетка, ауксотрофная по аминокислоте, в одном варианте реализации представляет собой бактериальную клетку.
В одном варианте реализации клетка представляет собой клетку Escherichia или клетку Bacillus, или клетку Lactobacillus, или клетку Corynebacterium, или клетку дрожжей (Saccharomyces, Candida или Pichia). В еще одном варианте реализации клетка представляет собой клетку Escherichia coli или клетку Bacillus subtilis, или клетку Lactobacillus acidophilus, или клетку Corynebacterium glutamicum, или клетку дрожжей Pichia pastoris.
Термин «регулирование значения» означает, что соответствующее значение поддерживается на определенном уровне в ходе культивирования, т.е. значение проверяется непрерывно или через заданные постоянные интервалы времени и изменяется при добавлении корректирующей жидкости, если значение выходит за заданный диапазон приемлемых значений. Например, термин «регулирование значения рН» означает, что значение рН культуральной среды определяется периодически в фиксированные моменты времени, то есть с фиксированным временным интервалом, и если определяемое значение рН находится за пределами диапазона приемлемых значений, например, отличается на 0,1 единицу рН или 0,15 единицу рН или 0,2 единицу рН, то значение рН вновь подводят до заданной величины рН путем добавления корректирующей жидкости, такой как кислота или щелочь.
Методы культивирования прокариотических клеток, а также культивирования прокариотических клеток, ауксотрофных по аминокислоте, известны специалистам в данной области (см., например, Riesenberg, D., et al., Curr. Opin. Biotechnol. 2 (1991) 380-384). Культивирование может осуществляться с помощью любого способа. В одном из вариантов реализации культивирование представляет собой периодическое культивирование, периодическое культивирование с подпиткой, культивирование с перфузией, полунепрерывное культивирование или культивирование с полным или частичным сохранением клеток. Единственное требование в отношении культивирования состоит в том, что необходимо добавлять щелочной раствор. Такая добавка может представлять собой единственный раствор для подпитки или может представлять собой комбинацию подпитки и раствора для подведения рН.
Культуральная среда, применяемая в начале культивирования клеток может представлять собой любую среду, известную специалистам в данной области, при условии, что концентрация аминокислоты, которую вводят в подпитке, составляет в среде менее 5 г/л или менее 7,5 г/л или менее 10 г/л. Следует отметить, что концентрация соответствующих соединений должна быть выбрана таким образом, чтобы не ожидалось какого-либо отрицательного воздействия на рост клеток. В одном из вариантов реализации среда представляет собой среда с заданным составом глюкозы - минеральных солей.
В одном из вариантов реализации культивирование представляет собой культивирование при высокой плотности клеток. Термин « культивирование при высокой плотности» обозначает способ культивирования, при котором сухой вес клеток культивируемых прокариотических клеток в определенный момент времени культивирования составляет по меньшей мере 10 г/л. В одном варианте реализации сухая масса клеток в определенный момент времени культивирования составляет по меньшей мере 20 г/л, или по меньшей мере 50 г/л, или по меньшей мере 100 г/л, или более 100 г/л. Для того, чтобы достичь такого высокой плотности клеток объем подпитки и/или корректирующих растворов, добавляемых во время культивирования, должен быть как можно меньше. Способы определения сухого веса клеток описаны, например, в работе Riesenberg, D., et al., Appl. Microbiol. Biotechnol. 34 (1990) 77-82.
Питательные вещества в имеющейся среде метаболизируются во время культивирования, и их необходимо пополнять во избежание их недостатка. Если аминокислота имеет низкую растворимость, то возможно приготовить и добавлять раствор такой аминокислоты для подпитки лишь с небольшой ее концентрацией. Для обеспечения необходимого количества аминокислоты требуется добавление большого объема исходного раствора. Это приводит к увеличению общего объема среды для культивации, разведению культуральной жидкости и, таким образом, является невыгодным для процессов, при которых необходима высокая плотность клеток.
Растворимость 20 природных аминокислот приведена в следующей таблице 1.
|
|
Растворимость аминокислот аспартата, аспарагиновой кислоты, глутамина, глутаминовой кислоты, гистидина, изолейцина, лейцина, метионина, фенилаланина, триптофана и тирозина ниже 50 г/л и, таким образом, эти аминокислоты имеют низкую растворимость в воде.
Например, аминокислота лейцин имеет растворимость в воде при 20°С, равную 24 г/л и, таким образом, она слаборастворима. В щелочном растворе, содержащем 12,5% (вес/объем) аммиака растворимость увеличивается до 76 г/л и, таким образом, более чем в три раза превышает растворимость в воде. В то же время необходимый объем подпитки сокращается более чем на 60%. Если в то же время такой щелочной раствор также используется для регулирования значения рН культуральной среды, то добавляемый объем может быть уменьшен еще в большей степени. Например, аминокислота тирозина имеет растворимость в воде при 20°С, равную 0,4 г/л и, таким образом, она слаборастворима. В щелочном растворе, содержащем 12,5% (вес/объем) аммиака растворимость увеличивается до 39 г/л и, таким образом, примерно в сто раз превышает растворимость в воде.
В одном варианте реализации аминокислота представляет собой аспартат, аспарагиновую кислоту, глутамин, глутаминовую кислоту, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, триптофан и/или тирозин. Также в другом варианте реализации аминокислота представляет собой аспартат, аспарагиновую кислоту, глутамин, глутаминовую кислоту, гистидин, лейцин, триптофан и/или тирозин. В одном варианте реализации аминокислота представляет собой лейцин. В одном варианте реализации аминокислота представляет собой аминокислоту, которая слаборастворима в воде при рН около 7 при 20°С. Также в другом варианте реализации аминокислота представляет собой лейцин и пролин, или аминокислота представляет собой лейцин, пролин и триптофан. В еще одном варианте реализации аминокислота имеет растворимость в щелочном растворе, превышающую растворимость в воде при 20°С. В еще одном варианте реализации растворимость в щелочном растворе превышает от двух до десяти раз растворимость в воде при 20°С. В одном варианте реализации аминокислота имеет растворимость в воде 40 г/л или менее. В другом варианте реализации аминокислота имеет растворимость в воде 30 г/л или менее. Также в другом варианте реализации аминокислота имеет растворимость в щелочном растворе 25 г/л и более. В еще одном варианте аминокислота имеет концентрацию в щелочном растворе 30 г/л и более. В другом варианте аминокислота имеет концентрацию в щелочном растворе 35 г/л и более. Также в другом варианте реализации аминокислота имеет растворимость в щелочном растворе 50 г/л и более.
В следующей таблице 2 приведены результаты по культивированию в культуральном сосуде, содержащем 10 л рабочего объема клеток E.coli, ауксотрофных по лейцину и пролину, полученные при различных режимах подпитки.
|
Видно, что в экспериментах 1 и 2, в которых обе аминокислоты добавляют в культуральную среду в виде отдельных питательных растворов, общая биомасса, полученная в конце культивирования и выход рекомбинантного белка ниже, чем в экспериментах 3 и 4, в которых аминокислоты добавляют в качестве комбинированной щелочной подпитки, которая в то же время используется для регулирования значения рН культуральной среды. Кроме того, конечный объем культуры в экспериментах 3 и 4 не превышает рабочий объем культурального сосуда, как в экспериментах 1 и 2.
В одном варианте щелочной раствор представляет собой 12,5% (вес/объем) раствор аммиака в воде и содержит по меньшей мере одну аминокислоту в концентрации около 50 г/л и более. В одном варианте щелочной раствор содержит лейцин и пролин в концентрации около 50 г/л.
Прокариотические клетки, которые можно применять в способе, описанном в настоящей заявке, могут характеризоваться ауксотрофией по одной или более аминокислоте. Например, клетки E.coli, дефектные по биосинтезу лейцина могут быть выбраны из клеток, дефектных по LeuB6, включающих 13-6, χ148, χ156, χ2224, χ462, χ463, χ474, χ478, χ515, χ65, χ697, χ760, 2000k MSE248, 342-167, 342MG, 679-680, A586, A592, A593, AA100, AA7852, AA787, AB1102, AB1111, AB1115, AB1122, AB1129, AB113, AB1132, AB1133, AB114, AB1157, AB1157-D, AB1314, AB1330, AB1331, AB1881, AB1884, AB1885, AB188, CP78, CP79, CR34 Thy-, CR34 Thy- SR, CR34/308, CR34/313, CR34/399, CR34/43, CR34/454, CR34/500, CR34/7a, CS130, CS312, CS419, CS425, CS426, CS460, CS471, CS472, CS50, CS81, CS85, CSR06, CSR603, CSR603/pDR1996, CT28-3b, DA10, DA11, DB1161, DB1257, DE1878, DE1882, DE2345, DF225, DF41, JRG94, JS10 C600r-m-, T6R, P678SSR pro-, PA20SR, PA200 SR, PA201 SR, PA214SRT6R, PA265 SR, PA309, PDE70, PA340, РА340/T6, PA360, PA414, PAM161, PAM162, PAM163, PAM164, РАМ660, РАТ84, PB349, PB69, PC1, PC2, PC3, PC5, PC6, PC8, PJ1, PJ2, PJ3, PJ4, PJ5, PJ C600 (=CRSR), W208 SR AzR, W2660, LAM-, W945his, WA2127, WA2379, WA2548, WA2552, WA2574, WA2899, WA921, WA946, WA960, Y10, Y46, Y53, Y70, YYC100.
В одном варианте реализации прокариотическая клетка представляет собой клетку E.coli K12 или клетку E.coli В.
В одном варианте реализации щелочной раствор представляет собой высокощелочной раствор. В другом варианте реализации щелочной раствор имеет значение рН 9 или более, или рН 10 или более, или рН 10,5 и более. В еще одном варианте реализации растворимость аминокислоты в щелочном растворе, по меньшей мере в два раза превышает растворимость такой аминокислоты в воде.
В одном варианте реализации способ получения полипептида, описанный в настоящей заявке, включает следующие стадии:
а) обеспечение ауксотрофной по аминокислоте бактериальной клетки, содержащей нуклеиновую кислоту, кодирующую полипептид,
б) культивирование указанной клетки,
в) регулирование значения рН во время культивирования с помощью щелочного раствора, содержащего аминокислоту, в отношении которой бактериальная клетка является ауксотрофной,
г) выделение полипептида из клетки или культуральной среды, и таким образом, получение полипептида.
Конкретные варианты реализации изобретения
1. Способ культивирования клеток Escherichia coli, экспрессирующих полипептид, отличающийся тем, что культивирование включает в себя добавление щелочного раствора аминокислоты, выбранной из аспартата, аспарагиновой кислоты, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, триптофана и тирозина, в течение культивирования,
в котором концентрация аминокислоты в щелочном растворе выше, чем растворимость данной аминокислоты в воде при 20°С и при нейтральном рН, так что концентрация аминокислоты составляет 30 г/л или более, и
в котором щелочной раствор представляет собой 10% (вес/объем) или более раствор аммиака, и
в котором сухой вес клеток культивируемых бактерий в определенный момент культивирования составляет по меньшей мере 20 г/л.
2. Способ получения полипептида, включающий стадии
а) культивирования клеток Escherichia coli, содержащих нуклеиновую кислоту, кодирующую полипептид,
б) регулирования значения рН во время культивирования с помощью щелочного раствора, содержащего аминокислоту, выбранную из аспартата, аспарагиновой кислоты, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, триптофана и тирозина,
в) выделения полипептида из клеток или культуральной среды и, таким образом, получение полипептида,
в котором концентрация аминокислоты в щелочном растворе составляет 30 г/л или более, и
в котором щелочной раствор представляет собой 10% (вес/объем) или более раствор аммиака.
3. Способ по любому из предшествующих вариантов реализации, отличающийся тем, что бактериальная клетка является ауксотрофной по аминокислоте и ауксотрофия относится к аминокислоте, выбранной из аспартата, аспарагиновой кислоты, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, триптофана и тирозина.
4. Способ по любому из предшествующих вариантов реализации, отличающийся тем, что щелочной раствор имеет рН 9 или более.
5. Способ по любому из предшествующих вариантов реализации, отличающийся тем, что полипептид представляет собой аполипопротеин А1 человека или его производное.
6. Способ по варианту реализации 5, отличающийся тем, что аполипопротеин А1 имеет аминокислотную последовательность, выбранную из SEQ ID NO: от 01-35.
7. Способ по варианту реализации 6, отличающийся тем, что аполипопротеин А1 имеет аминокислотную последовательность, выбранную из SEQ ID NO:01, 02, 34 и 35.
8. Способ по любому из предшествующих вариантов реализации, отличающийся тем, что концентрация аминокислоты составляет около 50 г/л.
9. Способ по любому из предшествующих вариантов реализации, отличающийся тем, что щелочной раствор представляет собой приблизительно 12,5% (вес/объем) водный раствор аммиака.
10. Способ по любому из предшествующих вариантов реализации, отличающийся тем, что аминокислота представляет собой лейцин.
11. Способ по любому из предшествующих вариантов реализации, отличающийся тем, что щелочной раствор содержит лейцин и пролин.
12. Способ по любому из предшествующих вариантов реализации, отличающийся тем, что щелочной раствор представляет собой примерно 12,5% (вес/объем) водный раствор аммиака и содержит аминокислоты лейцин и пролин, каждую в концентрации около 50 г/л.
13. Применение щелочного раствора аминокислоты в качестве подпитки при культивировании бактериальной клетки, в котором аминокислота выбрана из аспартата, аспарагиновой кислоты, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, триптофана и тирозина, и выращивание бактериальной культуры до достижения сухого веса клеток 20 г/л и более, и концентрация аминокислоты в щелочном растворе составляет 30 г/л и более, и щелочной раствор представляет собой 10% (вес/объем) или более раствор аммиака.
14. Применение по варианту реализации 13, отличающееся тем, что бактериальная клетка является ауксотрофной по аминокислоте и ауксотрофия относится к аминокислоте, выбранной из аспартата, аспарагиновой кислоты, глутамина, глутаминовой кислоты, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, триптофана и тирозина.
15. Способ по любому из вариантов реализации 2-12, отличающийся тем, что клетка Escherichia coli представляет собой ауксотрофную по аминокислоте клетку Escherichia coli.
Следующие примеры, перечень последовательностей и фигуры приведены для облегчения понимания настоящего изобретения, истинный объем которого изложен в формуле изобретения. Очевидно, что могут быть осуществлены модификации описанных процедур, без отступления от сущности изобретения.
Описание Фигур
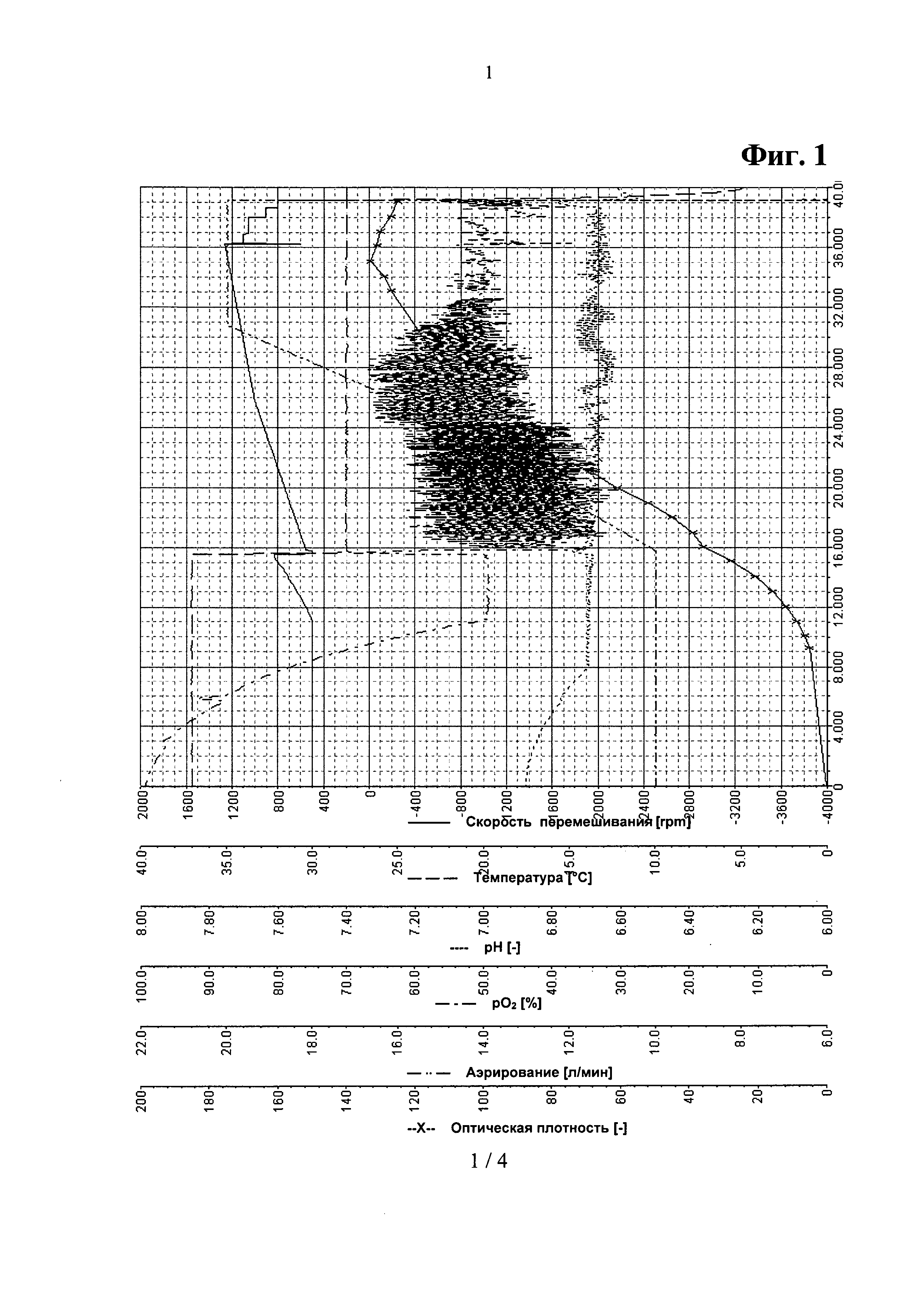
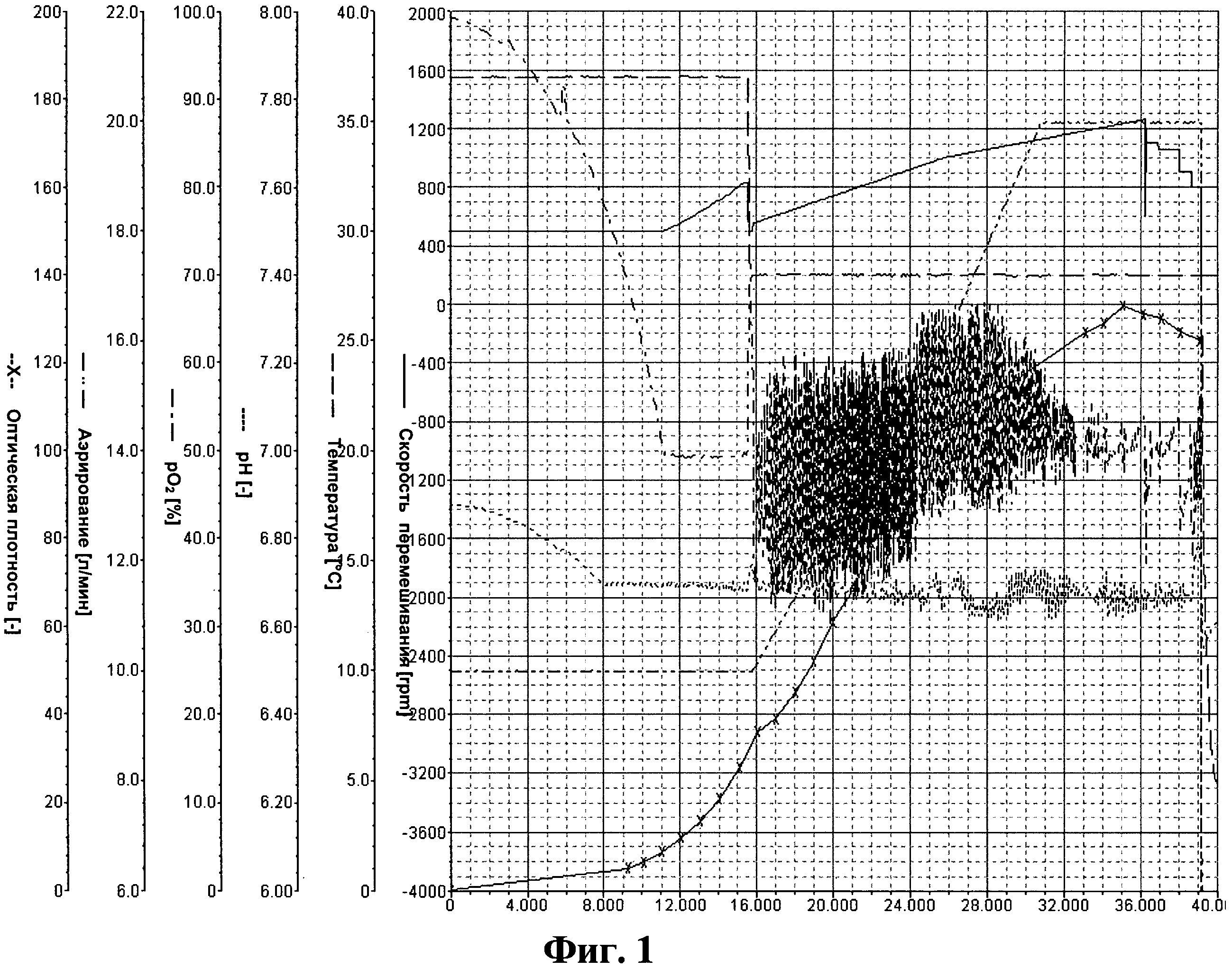
Фигура 1. Параметрические зависимости из Примера 3 - отдельная аминокислотная подпитка.
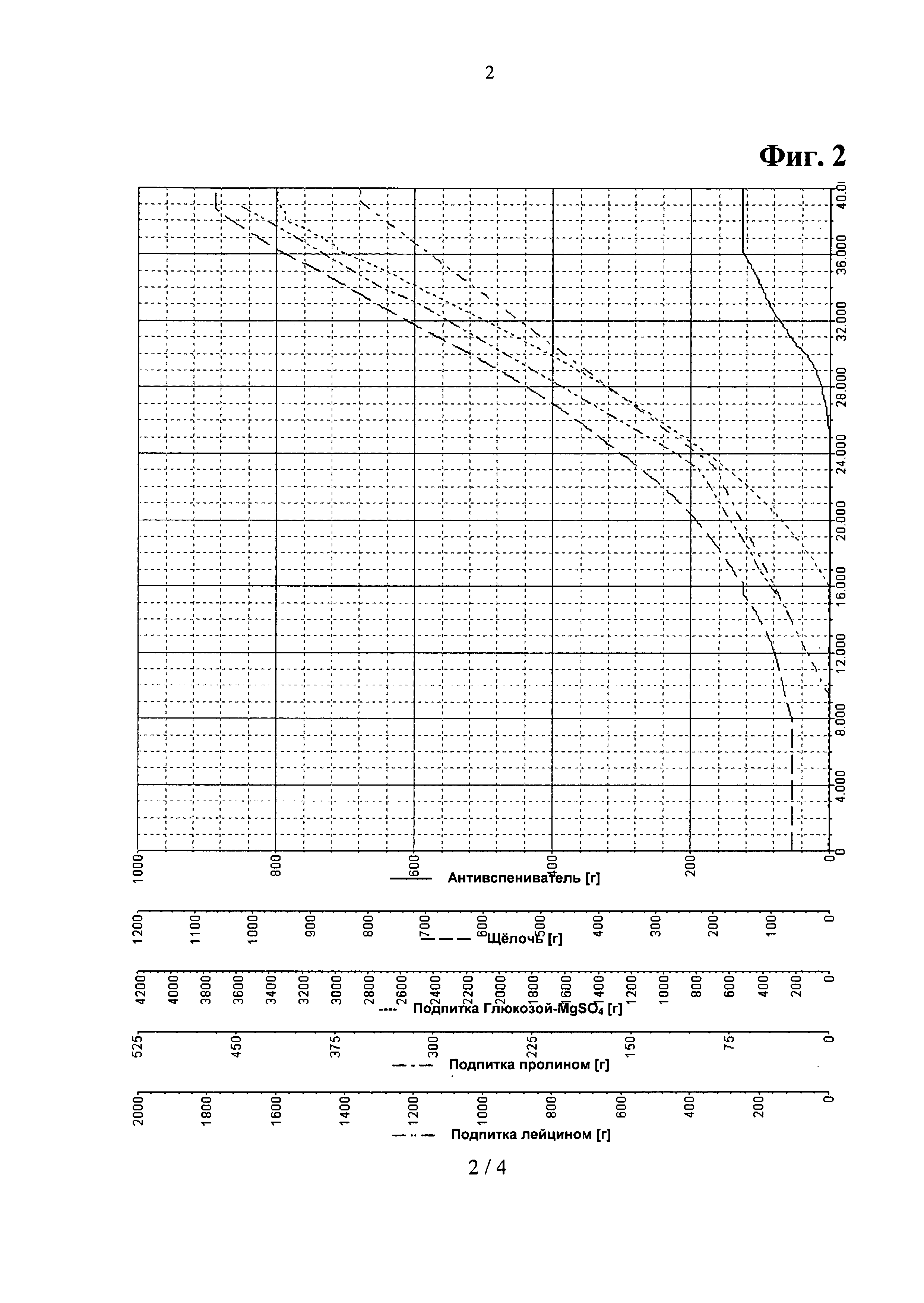
Фигура 2. Параметрические зависимости из Примера 3 - отдельная аминокислотная подпитка.
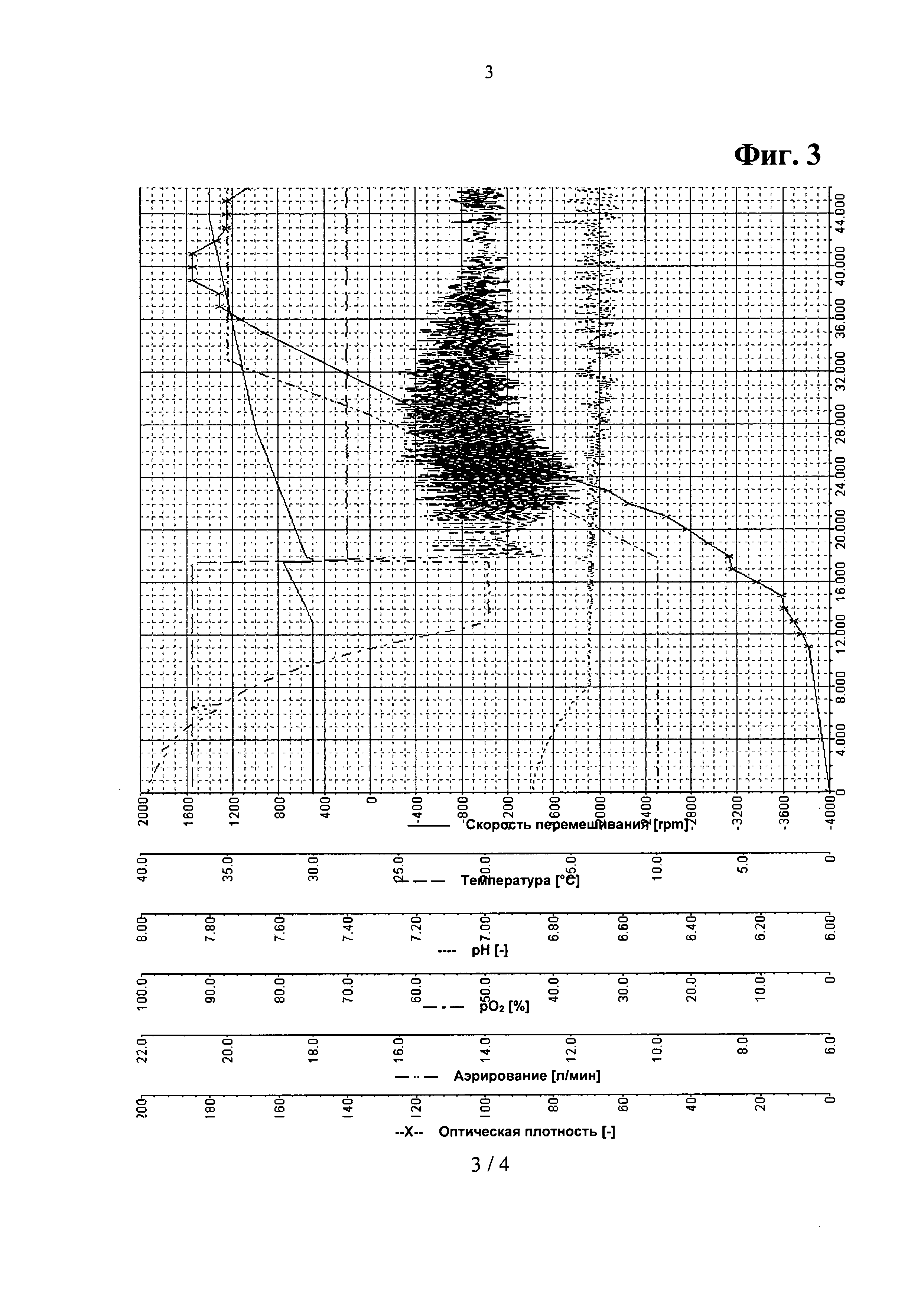
Фигура 3. Параметрические зависимости из Примера 4 - комбинированная аминокислотная подпитка.
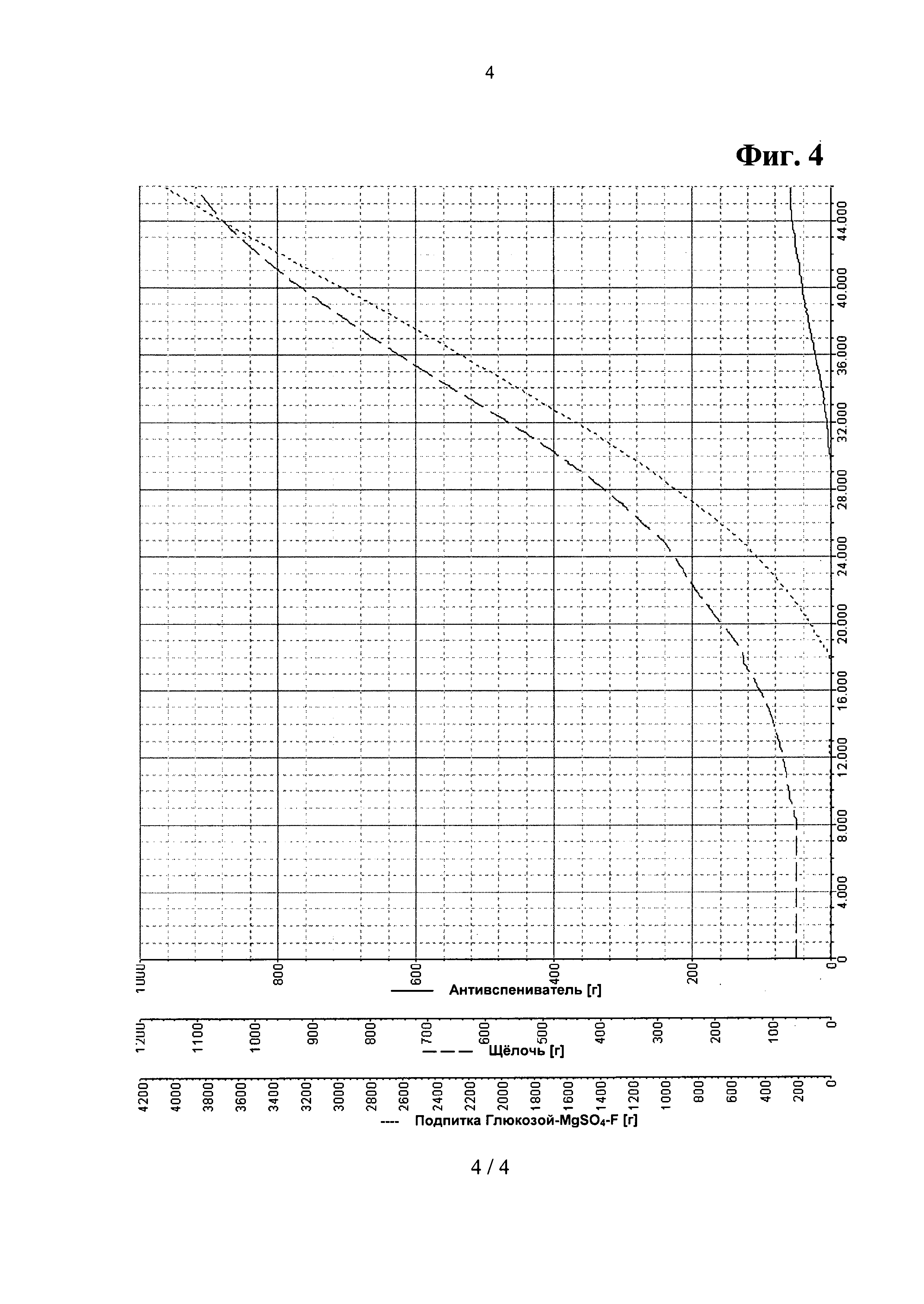
Фигура 4. Параметрические зависимости из Примера 4 - комбинированная аминокислотная подпитка.
Материалы и методы
Оптическую плотность культур измеряли на фотометре DR2800 (Hach-Lange, Dusseldorf, Germany) при длине волны 578 нм.
Концентрацию белков определяли денситометрически путем сравнения объема полосы стандарта белка с объемом полосы полученного белка в образцах из ферментации на ДСН-ПААГ геле.
Пример 1
Определение растворимости лейцина в растворе аммиака
Заданное количество лейцина помещали в 500 мл колбу. Добавляли 250 мл деионизированной воды и стерилизовали автоклавированием. Затем добавляли 250 мл 25% (вес/объем) раствора аммиака и определяли, растворился ли лейцин. Окончательный объем раствора определяли после добавления лейцина. Если окончательный объем значительно отличался от 500 мл, раствор готовили снова с меньшим объемом воды (см. Таблицу 3).
|
Пример 2
Конструирование и описание экспрессионных плазмид Е.coli.
Гибридный полипептид тетранектин-аполипопротеин А-1 получали методом генной инженерии. Аминокислотная последовательность экспрессированного слитого полипептида от N- к C-концу является следующей:
- аминокислота метионин (М),
- фрагмент последовательности интерферона CDLPQTHSL (SEQ ID NO:36),
- линкер GS,
- гекса-гистидиновая метка последовательности НННННН (SEQ ID NO:37),
- линкер GS,
- сайт расщепления для IgA-протеазы VVAPPAP (SEQ ID NO:38), и
- тетранектин-аполипопротеин А-I с последовательностью SEQ ID NO:02.
Гибридные (слитые) полипептиды тетранектин-аполипопротеин А-I, описанные выше, представляют собой полипептиды-предшественники, из которых получали гибридные полипептиды тетранектин-аполипопротеин А-I путем ферментативной обработки in vitro IgA протеазой.
Ген, кодирующий слитый полипетид-предшественник, собирали с применением известных методов и подходов генной инженерии путем соединения подходящих фрагментов нуклеиновых кислот. Последовательности нуклеиновых кислот, полученных путем химического синтеза, были проверены секвенированием. Экспрессионная плазмида для продукции тетранектин-аполипопротеина А-I была получена следующим образом.
Конструирование экспрессионной плазмиды E.coli
Плазмида 4980 (4980-pBRori-URA3-LACI-SAC) представляет собой экспрессионную плазмиду для экспрессии «корового» стрептавидина в E.coli. Плазмида 4980 была получена путем лигирования фрагмента вектора размером в 3142 п.о., полученного путем обработки рестриктазами EcoRI, и CelII плазмиды 1966 (1966-pBRori-URA3-LACI-T-повтор; приведена в ЕР-В 1 422237), с фрагментом размером в 435 п.о., кодирующим «коровый» стрептавидин, имеющим липкие концы EcoRI и CelII.
Плазмида для экспрессии «корового» стрептавидина в E.coli состоит из следующих элементов:
- ориджин репликации из вектора pBR322 для репликации в Е.coli (соответствие позициям 2517-3160 п.о., по: Sutcliffe, J.G., et al., Quant. Biol. 43(1979)77-90),
- ген URA3 Saccharomyces cerevisiae, кодирующий оротидин-5’-фосфатдекарбоксилазу (Rose, M., et al., Gene 29 (1984) 113-124), который позволяет производить отбор по комплементации с мутантным штаммом E.coli pyrF (ауксотрофия по урацилу),
- кассета для экспрессии корового стрептавидина, состоящая из
- Т5 гибридного промотора (T5-PN25/03/04 гибридный промотор, по: Bujard, H., et al., Methods. Enzymol. 155 (1987) 416-433 и Stueber, D., et al., Immunol. Methods IV (1990) 121-152), включая синтетический сайт связывания с рибосомой по: Stueber, D., et al., (см. выше),
- гена корового стрептавидина,
- двух терминаторов транскрипции из бактериофагов, терминатора λ-Т0 (Schwarz, E., et al., Nature 272 (1978) 410-414) и fd-терминатора (Beck, E., and Zink, В., Gene 1-3 (1981) 35-58),
- репрессорного гена lacI из E.coli (Farabaugh, P.J., Nature 274 (1978) 765-769).
Окончательная экспрессионная плазмида для экспрессии предшественника полипептида тетранектин-аполипопротеина A-I была получена путем вырезания гена, кодирующего «коровый» стрептавидин, из вектора 4980 по единичным фланкирующим сайтам эндонуклеаз рестрикции EcoRI и CelII и лигирования фрагмента нуклеиновой кислоты, кодирующего полипептид-предшественник и фланкированного концами EcoRI/CelII, с фрагментом вектора 4980 размером 3142 п.о., также имеющего концы EcoRI/CelII.
Пример 3
Подпитка лейцином и пролином в виде отдельных растворов
В данном примере осуществляли культивирование ауксотрофного штамма E.coli по методу клеточной культуры с высокой плотностью согласно Riesenberg, et al., (1991, см. выше) в комбинации с отдельными растворами для подпитки аминокислотами L-лейцином и L-пролином.
Использовали штамм E.coli K12 CSPZ-2 (leuB, proC, trpE, th-1, ΔpyrF). Штамм был трансформирован экспрессионной плазмидой для продукции терапевтического белка, клетки хранили при -80°С в качестве первичного фонда штаммов в ампулах, содержащих 1 мл штамма, выращенного в прекультуральной среде определенного состава до значения оптической плотности около 1 (определяли при длине волны 578 нм), и 1 мл 85% глицерина (об./об.).
Прекультуральная среда определенного состава представляла собой среду М9 согласно Sambrook, J., et al., Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989), с добавлением
1,0 г/л L-лейцина,
1,0 г/л L-пролина, и
1,0 мг/л тиамина-HCl,
Для ферментации использовали среду согласно Riesenberg, et al,, (1991, см, выше):
27,6 г/л глюкоза,
13,3 г/л KH2PO4,
4,0 г/л (NH4)2HPO4,
1,7 г/л цитрат,
1,2 г/л MgSO4*7H2O,
60 мг/л цитрат железа(III),
2,5 мг/л CoCl2*6H2O,
15 мг/л MnCl2*4H2O,
1,5 мг/л CuCl2*2H2O,
3 мг/л Н3ВО3,
2,5 мг/л Na2MoO4*2H2O,
8 мг/л Zn(СН3СОО)2*2H2O,
8,4 мг/л титриплекса III, и
1,3 мл/л 10% антивспенивателя Synperonic,
В культуральную среду добавляли
5,4 мг/л тиамина-HCl, и
1,2 г/л l-лейцина и l-пролина, соответственно,
Раствор 1 для подпитки содержал
700 г/л глюкозы, и
19,7 г/л MgSO4*7H2O,
Раствор 2 для подпитки содержал
20 г/л l-лейцина,
Раствор 3 для подпитки содержал
100 г/л l-пролина,
Растворы для подпитки номер 2 и 3 готовили путем приготовления навески аминокислоты, растворения аминокислот в воде и автоклавирования раствора. После этого доводили значения рН: для раствора 2 - примерно до 6,15, для раствора 3 - примерно до 6,43.
В качестве щелочного раствора, используемого для доведения рН, применяли 12,5% (вес/объем) NH3 (аммиака).
Все компоненты растворяли в деионизированной воде.
Для получения посевного материала 300 мл среды М9 в колбе на 1000 мл с тремя перегородками инокулировали содержимым ампулы (2 мл) из первичного фонда штаммов. Выращивание культуры проводили на ротационном шейкере в течение 13 часов при температуре 37°С до оптической плотности (определяли при длине волны 578 нм) 1-3.
Основную стадию ферментации осуществляли в ферментере на 10 л Biostat С DCU (Sartorius, Melsungen, Германия). Начиная с инокуляции 6,4 л стерильной культуральной среды 300 мл посевного материала, периодическую ферментацию проводили при 37°С, рН 6.9±0.2, давлении 500 мбар и скорости аэрирования 10 л/мин. После того, как содержание глюкозы в среде истощалось, температуру снижали до 28°С, а ферментирование входило в режим периодической культуры с подпиткой, растворимый кислород (pO2) поддерживали на уровне 50% (DO-режим, см., например, Shay, L.K., et al., (1987, см. ниже)) и добавляли раствор для подпитки 1 в сочетании с постоянно увеличивающейся скоростью перемешивания (с 550 об/мин до 1000 об/мин в течение 10 часов и с 1000 об/мин до 1400 об/мин за 16 часов) и уровнем аэрирования (от 10 л/мин до 16 л/мин в течение 10 часов и с 16 л/мин до 20 л/мин в течение 5 часов). Дополнительную подпитку аминокислотами начинали, когда рН среды достигал нижнего предела регулирования, значения рН 6.70, путем добавления подпитки 2 (начиная с 33.8 мл/ч в течение 14 часов, и затем увеличивая до 97.6 мл/ч) и подпитки 3 (начиная с 6.8 мл/ч в течение 14 часов, и затем увеличивая до 19.5 мл/ч). Расход вещества подсчитывали, исходя из хода отдельной ферментации (см. Пример 4), чтобы соответственно вносить точно такое же количество аминокислот к культурам, независимо от стратегии подпитки. Продукцию рекомбинантного терапевтического белка индуцировали путем добавления 1 мМ IPTG при значении оптической плотности 70.
Параметрические зависимости для такой ферментации показаны на Фигурах 1 и 2.
После инокуляции, за которой следовала короткая лаг-фаза, клетки выращивали при максимальной удельной скорости роста μmax=0.30 л/ч. После 8 часов культивации, когда культура достигала нижнего предела регулирования рН, рН поддерживали на уровне 6.70 путем добавления 12.5% раствора NH4OH. Одновременно начинали подпитку аминокислотами путем добавления подпитки 2 и подпитки 3. После 16 часов культивации глюкоза в среде была израсходована, о чем свидетельствовал крутой подъем pO2-параметра. В это время температуру культивации снижали с 37°С до 28°С. После дополнительных 15 минут начинали контролировать уровень pO2, pO2 поддерживали на уровне 50% путем добавления подпитки 1 при постоянном повышении уровней перемешивания и аэрирования до значений 1400 об/мин и 20 л/мин, соответственно. Скорость роста постоянно снижалась с 0.15 до приблизительно 0.05 л/ч. Также после 36 часов культивации постепенно снижали скорость перемешивания. После того, как оптическая плотность переставала возрастать, ферментацию останавливали, перед сбором клеток культуру бактерий охлаждали до 4°С в течение 16-18 часов.
В конце ферментации общая биомасса составила 49.4 г/л (сухая масса). В процессе ферментации соли уксусной кислоты практически не выделялись, но к концу ферментации концентрация солей уксусной кислоты постепенно возросла до 7 г/л. Выход рекомбинантного белка составил 9.96 г/л. Объем бактериальной культуры превысил рабочий объем камеры биореактора и составил 11.8 л.
Во второй повторности ферментации оптическая плотность к концу ферментации составила 130, конечная биомасса - 50.6 г/л, выход рекомбинатного белка - 9.0 г/л, конечный объем бактериальной культуры - 12.2 л.
Пример 4
Подпитка щелочными растворами лейцина и пролина для регулирования рН
В этой ферментации применяли подпитку аминокислотами в щелочном растворе для регулирования рН. В основе этой ферментации была такая же клеточная культура с высокой плотностью клеток согласно Riesenberg, et al., (1991, см. выше), как и в Примере 3. Аминокислоты L-лейцин и L-пролин растворяли в 12,5% водном растворе NH3 и добавляли с щелочными компонентами в культуру клеток во время регулирования рН.
Использовали штамм E.coli K12 CSPZ-2 (leuB, proC, trpE, th-1, ΔpyrF). Штамм содержал экспрессионную плазмиду для выработки терапевтического белка, клетки хранили при -80°С в качестве первичного фонда штаммов в ампулах, содержащих 1 мл штамма, выращенного на прекультуральной среде определенного состава до приблизительного значения оптической плотности 1 (определяли при длине волны 578 нм), и 1 мл 85% глицерина (об/об).
Прекультуральной средой определенного состава являлась среда М9 согласно Sambrook, J., et al., Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989), дополненная
1,0 г/л L-лейцина,
1,0 г/л L-пролина, и
1,0 мг/л тиамина-HCl,
Для периодической ферментации использовали среду согласно Riesenberg, et al., (1991, см, выше):
27,6 г/л глюкоза,
13,3 г/л KH2PO4,
4,0 г/л (NH4)2HPO4,
1,7 г/л цитрат,
1,2 г/л MgSO4*7H2O,
60 мг/л цитрат железа(III),
2,5 мг/л CoCl2*6H2O,
15 мг/л MnCl2*4H2O,
1,5 мг/л CuCl2*2H2O,
3 мг/л Н3ВО3,
2,5 мг/л Na2MoO4*2H2O,
8 мг/л Zn(СН3СОО)2*2H2O,
8,4 мг/л титриплекса III, и
1,3 мл/л 10% антивспенивателя Synperonic,
В культуральную среду добавляли
5,4 мг/л тиамина-HCl, и
1,2 г/л l-лейцина и l-пролина, соответственно,
Раствор 1 для подпитки содержал
700 г/л глюкозы, и
19,7 г/л MgSO4*7H2O,
Щелочным раствором, при помощи которого регулировали рН, был водный 12,5% (вес/объем) раствор NH3, дополненный 50 г/л L-лейцина и 50 г/л L-пролина, соответственно.
Все компоненты растворяли в деионизированной воде.
Основную стадию ферментации осуществляли в биореакторе на 10 л Biostat С DCU3 (Sartorius, Melsungen, Германия). Начиная с инокуляции 6,4 л стерильной культуральной среды 300 мл посевного материала, периодическую ферментацию проводили при 37°С, рН 6.9±0.2, давлении 500 мбар и скорости аэрирования 10 л/мин. После того, как содержание глюкозы в среде истощалось, температуру снижали до 28°С, а ферментирование входило в режим периодической культуры с подпиткой, растворимый кислород (pO2) поддерживали на уровне 50% (DO-режим, см., например, Shay, L.K., et al., (1987, см. ниже)) и добавляли раствор для подпитки 1 в сочетании с постоянно увеличивающейся скоростью перемешивания (с 550 об/мин до 1000 об/мин в течение 10 часов и с 1000 об/мин до 1400 об/мин в течение 16 часов) и уровнем аэрирования (от 10 л/мин до 16 л/мин в течение 10 часов и с 16 л/мин до 20 л/мин в течение 5 часов). Дополнительную подпитку аминокислотами, возникшую в результате добавления щелочи, начинали, когда рН среды достигал нижнего предела регулирования, значения рН 6.70. Начиная со времени добавления щелочи, подсчитывали уровни расхода вещества для подпитки 2 и 3 в Примере 2, чтобы, соответственно, вносить точно такое же количество аминокислот к культурам, независимо от стратегии подпитки. Продукцию рекомбинантного терапевтического белка индуцировали путем добавления 1 мМ IPTG при значении оптической плотности 70.
Типичные параметрические зависимости для такой ферментации показаны на Фигурах 3 и 4.
После инокуляции, за которой следовала короткая лаг-фаза, клетки выращивали при максимальной удельной скорости роста μmax=0.30 л/ч. После 8 часов культивации, когда культура достигала нижнего предела регулирования рН, рН поддерживали на уровне 6.70 путем добавления 12.5% раствора NH3, дополненного 50 г/л L-лейцина и 50 г/л L-пролина, соответственно. Одновременно начинали подпитку аминокислотами. После 16 часов культивации глюкоза в среде была израсходована. В это время температуру культивации снижали с 37°С до 28°С. После дополнительных 15 минут начинали контроль уровня pO2, pO2 поддерживали на уровне 50% путем добавления подпитки 1 при постоянном повышении уровней перемешивания и аэрирования до значений 1400 об/мин и 20 л/мин, соответственно. Скорость роста постоянно снижалась с 0.15 до приблизительно 0.05 л/ч. После того, как оптическая плотность переставала возрастать, ферментацию останавливали, перед сбором клеток культуру бактерий охлаждали до 4°С в течение 16-18 часов.
К концу ферментации оптическая плотность составила 169, а общая биомасса - 75,7 г/л (сухая масса). В процессе ферментации соли уксусной кислоты практически не выделялись, но к концу ферментации концентрация солей уксусной кислоты возросла до 1 г/л. Выход рекомбинантного белка составил 16,5 г/л. Объем бактериальной культуры составил 10.2 л.
Во второй повторности ферментации использовали другую концентрацию аминокислот, растворенных в щелочном растворе (33 г/л L-лейцина and L-пролина). Количество аминокислот, используемых для подпитки, было меньше, оптическая плотность к концу ферментации составила 145, конечная биомасса - 56.5 г/л, выход рекомбинантного белка - 9,0 г/л, конечный объем бактериальной культуры - 9,3 л.