Результат интеллектуальной деятельности: СПОСОБ ОПРЕДЕЛЕНИЯ БАКТЕРИАЛЬНОЙ КОНТАМИНАЦИИ БИОМАТЕРИАЛОВ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к области медицины, ветеринарии и фармацевтической промышленности, а именно к технологиям контроля качества клеточных препаратов, и может быть использовано для быстрого выявления бактериальной контаминации культур клеток человека, а также лекарственных средств и биоматериалов на их основе.
Уровень техники
Испытание на стерильность обязательно для лекарственных средств, которые в соответствии с нормативной документацией должны быть стерильными. Согласно требованиям Государственной фармакопеи Российской Федерации испытание на стерильность проводят двумя методами: методом прямого посева или методом мембранной фильтрации [Государственная фармакопея Российской Федерации, XIII издание Москва 2015. Available from: http://femb.ru/feml]. Однако время, необходимое для идентификации бактерий посредством этих методов, составляет от 1 до 8 дней, что зачастую значительно превышает допустимое время хранения лекарственных средств и биоматериалов на основе культур клеток человека.
Из уровня техники известны технические решения, позволяющие выявлять контаминацию любыми бактериальными патогенами в различных биологических образцах методом полимеразной цепной реакции (ПЦР). Впервые амплификация гена 16s РНК в качестве метода идентификации различных бактерий, в том числе встречающихся в образцах спинномозговой жидкости пациентов неврологических стационаров, была предложена Greisen и соавт. в 1994 г. [Greisen K, Loeffelholz М, Purohit A, Leong D. PCR primers and probes for the 16S rRNA gene of most species of pathogenic bacteria, including bacteria found in cerebrospinal fluid. Journal of clinical microbiology. 1994; 32(2): 335-51. PubMed PMID: 7512093; PubMed Central PMCID: PMC263034]. Использование универсальных для всех бактерий олигонуклеотидных праймеров к гену 16s РНК позволяет выявить бактериальное загрязнение в течение 3-4 часов с очень высокой чувствительностью (единичные колониеобразующие единицы (КОЕ)).
Однако высокая чувствительность ПЦР приводит к большому количеству ложноположительных результатов. Это может происходить из-за загрязнения реакционных смесей бактериальными клетками, находящимися на частицах пыли в лаборатории, но главная причина ложноположительных результатов - контаминация реактивов для ПЦР фрагментами ДНК бактерий, используемых при производстве, в частности, Taq-полимеразы [Corless СЕ, Guiver М, Borrow R, Edwards-Jones V, Kaczmarski ЕВ, Fox AJ. Contamination and sensitivity issues with a real-time universal 16S rRNA PCR. Journal of clinical microbiology. 2000; 38(5): 1747-52. PubMed PMID: 10790092; PubMed Central PMCID: PMC86577]. Из уровня техники известны различные способы борьбы с контаминацией исходных реагентов: обработка ДНКазой I [Heininger A, Binder М, Ellinger A, Botzenhart K, Unertl K, Doring G. DNase pretreatment of master mix reagents improves the validity of universal 16S rRNA gene PCR results. Journal of clinical microbiology. 2003; 41(4): 1763-5. PubMed PMID: 12682181; PubMed Central PMCID: PMC153871], обработка эндонуклеазами рестрикции [Mohammadi T, Reesink HW, Vandenbroucke-Grauls CM, Savelkoul PH. Optimization of real-time PCR assay for rapid and sensitive detection of eubacterial 16S ribosomal DNA in platelet concentrates. Journal of clinical microbiology. 2003; 41(10): 4796-8. PubMed PMID: 14532224; PubMed Central PMCID: PMC254335], ультрафильтрация [Yang S, Lin S, Kelen GD, Quinn TC, Dick JD, Gaydos CA, et al. Quantitative multiprobe PCR assay for simultaneous detection and identification to species level of bacterial pathogens. Journal of clinical microbiology. 2002; 40(9): 3449-54. PubMed PMID: 12202592; PubMed Central PMCID: PMC130696], обработка этидиум-моноазидом [Rueckert A, Morgan HW. Removal of contaminating DNA from polymerase chain reaction using ethidium monoazide. Journal of microbiological methods. 2007; 68(3): 596-600. doi: 10.1016/j.mimet.2006.11.006. PubMed PMID: 17187883], облучение ультрафиолетом в сочетании с обработкой 8-метоксипсораленом [Meier A, Persing DH, Finken М, Bottger ЕС.Elimination of contaminating DNA within polymerase chain reaction reagents: implications for a general approach to detection of uncultured pathogens. Journal of clinical microbiology. 1993; 31(3): 646-52. PubMed PMID: 8458958; PubMed Central PMCID: PMC262835]. Также предлагается использование специальных Taq-полимераз высокой степени очистки [Muhl H, Kochem AJ, Disque C, Sakka SG. Activity and DNA contamination of commercial polymerase chain reaction reagents for the universal 16S rDNA real-time polymerase chain reaction detection of bacterial pathogens in blood. Diagnostic microbiology and infectious disease. 2010; 66(1): 41-9. doi: 10.1016/j.diagmicrobio.2008.07.011. PubMed PMID: 18722072]. Все эти способы, однако, не обеспечивают полной защиты от контаминации единичными бактериальными клетками в ходе сборки реакции и добавления ДНК, а также предусматривают дополнительные, иногда достаточно длительные, этапы и требуют работы в стерильных условиях, например в ламинарном боксе.
Из уровня техники известны технические решения, позволяющие исключить ложноположительные результаты за счет параллельной амплификации другой ДНК-мишени, в избытке присутствующей в образце. Эта мишень также может служить внутренним контролем, позволяющим отличить истинно отрицательный результат от ложноотрицательных результатов, возникающих из-за различных ошибок и сбоев при проведении ПЦР.
Наиболее близким к заявляемому является способ определения бактериальной контаминации крови с использованием праймеров на общую для всех бактерий нуклеотидную последовательность в присутствии внутреннего стандарта конкурентного типа [Черкасов Е.Г., Круглов А.Н., Елов А.А., Федоров Н.А., Федоров Е.Н., Суханов Ю.С. Способ определения бактериальной контаминации крови patent RU 2208645. 2002] и его аналог, использующий ПЦР в реальном времени [Qinglin М, Yong L, Jingjing T, Shuangshi W, Hongmei W, Shengbao D, et al. Universal type fluorescent quantitative PCR method for detecting platelet bacterial pollution, patent CN 104372072. 2015]. В этих способах авторы вводят в реакционную смесь искусственно синтезированный стандарт, с которым связываются универсальные бактериальные праймеры, однако при этом используются специфичные флюоресцентные зонды или образуются ПЦР-продукты разной длины, что позволяет различать сигнал от стандарта и бактериальной ДНК. ПЦР-амплификация стандарта конкурирует с ПЦР-амплификацией бактериальной ДНК, и при небольшом количестве последней подавляет ложноположительный сигнал.
Однако в результате частичного подавления амплификации бактериальной ДНК происходит снижение чувствительности метода. Черкасов и соавт. заявляют о надежном обнаружении Treponema palludum при ее концентрации 200 КОЕ/мл, однако существуют исследования, показывающие, что для предотвращения 100% случаев осложнений, связанных с переливанием зараженных компонентов крови, необходимы методы, позволяющие обнаружить бактерии в концентрации менее 100 КОЕ/мл [Jacobs MR, Good СЕ, Lazarus НМ, Yomtovian RA. Relationship between bacterial load, species virulence, and transfusion reaction with transfusion of bacterially contaminated platelets. Clinical infectious diseases: an official publication of the Infectious Diseases Society of America. 2008; 46(8): 1214-20. doi: 10.1086/529143. PubMed PMID: 18444858]. Для препаратов, получаемых на основе культур клеток человека, такие данные пока отсутствуют, порог чувствительности для них может быть как ниже, так и выше. Кроме того, в наиболее близких к настоящему изобретению способах используется искусственно синтезированный внутренний контроль, который вводится на этапе подготовки ПЦР-реакции и не позволяет контролировать этап выделения ДНК.
Раскрытие изобретения
Задачей настоящего изобретения является создание способа, обеспечивающего в срок до 3 часов выявление бактериальной контаминации культур клеток человека, а также лекарственных средств и биоматериалов на их основе, обладающего высокой чувствительностью с возможностью ее регулировки и исключающего возникновение ошибочных результатов.
Техническим результатом изобретения является исключение влияния на результат анализа следовых загрязнений реагентов бактериальной ДНК за счет возможности регулировки чувствительности метода в зависимости от клинических и производственных задач, а также контроля качества не только на этапе прохождения ПЦР, но и на этапе выделения ДНК из образцов. Способ позволяет определить наличие бактериальной контаминации в биоматериале с чувствительностью от 1 до 1000 КОЕ/мл.
Поставленная задача решается тем, что способ определения бактериальной контаминации биоматериалов (культур клеток человека, а также лекарственных средств и других биоматериалов на их основе) включает следующие этапы:
- выделение тотальной ДНК из исследуемого биоматериала;
- проведение ПЦР-амплификации с использованием специфичных для всех видов бактерий универсальных праймеров к гену бактериальной 16s РНК и контрольных праймеров, специфичных к гену человеческого бета-актина, в соотношении 1:2 с допустимой величиной погрешности до 3%, при этом в процессе ПЦР-амплификации стадию отжига-элонгации проводят при температуре 54±0,5°C или 55±0,5°C в течение 40-50 сек;
- детекцию результатов при помощи разделения смеси продуктов амплификации методом электрофореза в агарозном геле; при наличии продукта длиной 466 пар оснований при проведении стадии отжига-элонгации при температуре 54±0,5°C с обеспечением чувствительности способа от 10 до 1000 КОЕ/мл или температуре 55±0,5°C с обеспечением чувствительности от 1 до 10 КОЕ/мл делают вывод о присутствии бактерий в исследуемом биоматериале.
Предпочтительно в качестве праймеров, специфичных к гену бактериальной 16s РНК, использовать праймеры с последовательностями 5'-ТСС ТАС GGG AGG CAG CAG Т-3' и 5'-GGA CTA CCA GGG TAT CTA ATC CTG TT-3'.
Предпочтительно в качестве праймеров, специфичных к гену человеческого бета-актина, использовать праймеры с последовательностями 5'-GCG CCG TTC CGA AAG TT-3' и 5'-CGG CGG ATC GGC AAA-3'.
Для получения чувствительности метода на уровне 103 КОЕ/мл следует использовать температуру отжига-элонгации 54±0,5°C, а для увеличения чувствительности до 1-10 КОЕ/мл следует использовать температуру отжига-элонгации 55±0,5°C.
При указанных температурах отжига-элонгации работа праймеров к гену бета-актина приводит к появлению как специфического, так и ряда неспецифических продуктов, что позволяет эффективно подавлять амплификацию малых количеств бактериальной ДНК. Подавление имеет разную эффективность в зависимости от температуры: при использовании более низких температур понижается чувствительность метода и, следовательно, вероятность возникновения ложноотрицательных результатов. Наличие бактериальной контаминации определяют при наличии полосы, соответствующей продукту длиной 466 пар оснований (п.о.), о правильном выделении ДНК и прохождении ПЦР свидетельствует наличие полосы, соответствующей продукту длиной 136 п.о.
Краткое описание фигур
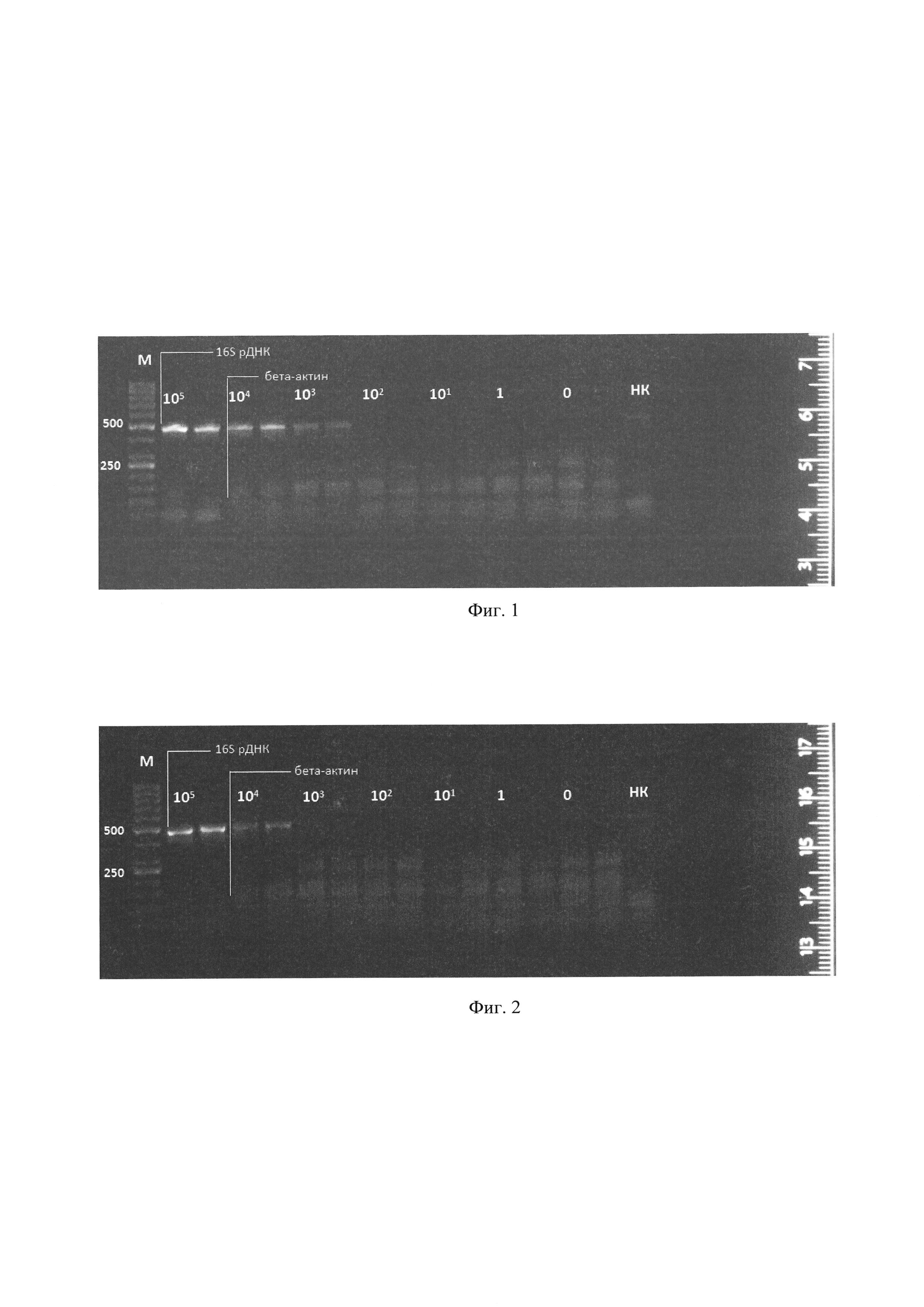
Фиг. 1. Электрофорез в агарозном геле ПЦР-продукта, полученного при температуре отжига-элонгации 54°C. Полоса 466 п.о. соответствует гену, кодирующему 16S рРНК; полоса 136 п.о. - гену бета-актина. Сверху обозначены количества бактерий в образцах, из которых была выделена ДНК, 0 - образец, не содержащий бактериальной ДНК, но содержащий ДНК мезенхимных стромальных клеток (МСК) жировой ткани человека, НК - отрицательный контроль. М - маркер длин ДНК (обозначены длины в п.н.). Каждый образец представлен в двух повторах. Также наблюдаются неспецифические полосы, возникающие из-за использования температур отжига-элонгации, не оптимальных для работы праймеров к гену бета-актина.
Фиг. 2. Электрофорез в агарозном геле ПЦР-продукта, полученного при температуре отжига-элонгации 55°C. Полоса 466 п.н. соответствует гену, кодирующему 16S рРНК; полоса 136 п.н. - гену бета-актина. Сверху обозначены количества бактерий в образцах, из которых была выделена ДНК, 0 - образец, не содержащий бактериальной ДНК, но содержащий ДНК МСК жировой ткани человека. НК - отрицательный контроль. М - маркер длин ДНК (обозначены длины в п.н.). Каждый образец представлен в двух повторах. Также наблюдаются неспецифические полосы, возникающие из-за использования температур отжига-элонгации, не оптимальных для работы праймеров к гену бета-актина.
Осуществление изобретения
Термин «биоматериалы» включает в себя культуры клеток человека (например, мезенхимных стромальных клеток жировой ткани), а также лекарственные средства и биоматериалы на их основе (например, клеточные пласты или кондиционированная среда мезенхимных стромальных клеток жировой ткани).
В общем виде способ определения бактериальной контаминации биоматериала, включает следующие этапы:
- осаждение ДНК-содержащего материала из исходного препарата (клеточной суспензии, кондиционированной среды или другого препарата) при помощи центрифугирования с ускорением 2000-3000 g в течение 20 минут;
- ресуспендирование осадка в небольшом количестве надосадочной жидкости и перенос его в пробирку меньшего объема для дальнейшего центрифугирования с ускорением 5000-6000 g в течение 10 минут;
- выделение ДНК из полученного осадка при помощи наборов QIAmp DNA Mini Kit (Qiagen);
- сборку ПЦР-реакции с включением в ее состав известных из уровня техники универсальных праймеров к гену бактериальной 16s РНК (5'-TCC TAC GGG AGG CAG CAG T-3' и 5'-GGA CTA CCA GGG TAT CTA ATC CTG TT-3') [Nadkarni MA, Martin FE, Jacques NA, Hunter N. Determination of bacterial load by real-time PCR using a broad-range (universal) probe and primers set. Microbiology. 2002; 148(Pt 1): 257-66. doi: 10.1099/00221287-148-1-257. PubMed PMID: 11782518], а также контрольных праймеров к гену человеческого бета-актина (5'-GCG CCG TTC CGA AAG TT-3' и 5'-CGG CGG ATC GGC AAA-3') [Chan КС, Ding C, Gerovassili A, Yeung SW, Chiu RW, Leung TN, et al. Hypermethylated RASSF1A in maternal plasma: A universal fetal DNA marker that improves the reliability of noninvasive prenatal diagnosis. Clinical chemistry. 2006; 52(12): 2211-8. doi: 10.1373/clinchem.2006.074997. PubMed PMID: 17068167] в соотношении 1:2 с допустимой величиной отклонения до 3%;
- проведение ПЦР с использованием температуры отжига-элонгации в диапазоне 54-55°C в зависимости от требуемой чувствительности: при использовании более низких температур понижается чувствительность метода и вероятность возникновения ложноотрицательных результатов;
- детекцию продуктов реакции при помощи агарозного гель-электрофореза.
Материалы и методы
1. Выделение ДНК
Для исследования используется ДНК, выделенная из образцов, содержащих клетки человека, или из препаратов, полученных на основе клеток человека (включая клеточные пласты и кондиционированные среды). Клеточный материал получают любым известным из уровня техники способом. Все образцы обрабатывают в стерильных условиях. Клеточную суспензию, кондиционированную среду или иной препарат в объеме 10 мл помещают в пробирку объемом 15 мл и центрифугируют в течение 20 мин при ускорении 2500 g. Надосадочную жидкость отбирают, оставляя 1 мл. Осадок ресуспендируют и переносят в пробирку объемом 2 мл, после чего центрифугируют в течение 10 мин. при ускорении 5000 g. Полностью удаляют надосадочную жидкость, осадок ресуспендируют в 180 мкл буфера следующего состава: 20 мг/мл лизоцима, 20 мМ Трис HCl (pH 8,0), 2 мМ ЭДТА, 1,2% Тритона X100, после чего инкубируют в течение 30 мин при 37°C. Далее образцы помещают в автоматическую станцию QIACube (QIAGEN) и выделяют ДНК при помощи набора QIAmp DNA Mini Kit (Qiagen) с использованием запрограммированного в станции протокола. Возможно выделение ДНК при помощи набора QIAmp DNA Mini Kit согласно рекомендациям производителя. Концентрацию ДНК определяют спектрофотометрически при помощи спектрофотометра NanoDrop 1000 (Thermo) и хранят при температуре -20°C.
2. Проведение ПЦР-амплификации
Выявление бактериальной контаминации клеточных культур осуществляют с помощью ПЦР-амплификации образцов, содержащих выделенную ДНК. Используется двухстадийная ПЦР с объединением стадий отжига и элонгации для более эффективной амплификации гена бета-актина. Для проведения реакции были подобраны следующие концентрации реагентов: 5 мкл 5x окрашенной готовой реакционной смеси для ПЦР PCR ScreenMix (Евроген, Россия), в состав которой входят Taq-полимераза, смесь нуклеотидтрифосфатов, Mg2+, реакционный буфер, а также красители для нанесения на гель при проведении электрофоретического анализа; по 0,4 мкМ прямого (5'-TCC TAC GGG AGG CAG CAG T-3') и обратного (5'-GGA CTA CCA GGG TAT CTA ATC CTG TT-3') праймеров, комплементарных консервативной последовательности ДНК в составе гена, кодирующего бактериальную 16S рРНК; по 0,8 мкМ прямого (5'-GCG CCG TTC CGA AAG TT-3') и обратного (5'-CGG CGG ATC GGC AAA-3') праймеров, комплементарных последовательности гена человеческого бета-актина; 2 мкл образца, содержащего выделенную ДНК в концентрации 30-50 нг/мкл. Для увеличения точности одновременно исследуют по две пробы каждого образца. В отрицательный контроль вместо образца добавляют 2 мкл деионизованной воды, предварительно подвергшейся стерилизации УФ-излучением. Конечный объем реакционной смеси в каждой пробирке составил 25 мкл.
ПЦР проводят в термоциклере Applied Biosystems Veriti при следующих условиях: удерживание температуры 96°C в течение 5 минут, далее 50 двухшаговых циклов: первый шаг - плавление при температуре 96°C в течение 10 секунд, второй шаг - отжиг-элонгация при заданной температуре в течение времени, оптимального для амплификации продуктов необходимой длины (40-50 c). Так как температура отжига-элонгации является параметром, определяющим чувствительность метода, она отличается для разных экспериментов: для получения чувствительности на уровне 103 КОЕ/мл следует использовать 54°C, для увеличения чувствительности до 103 КОЕ/мл следует использовать 55°C.
3. Анализ полученных ПЦР-продуктов
Для анализа результатов проведенной ПЦР используют электрофорез в 2% агарозном геле с добавлением бромистого этидия в концентрации 0,5 мкг/мл. Для приготовления геля в 180 мл трис-ацетатного буферного раствора (ТАЕ) растворяют 3,6 г агарозы с последующим ее расплавлением в микроволновой печи и охлаждением до 50-60°C, после чего добавляют 9 мкл раствора бромистого этидия с концентрацией 10 мг/мл. Электрофорез проводят в камере, заполненной трис-ацетатным буферным раствором при напряженности поля 6 B/см в течение 40 минут. Для определения длины полученных ПЦР-продуктов используют маркер длин ДНК. Визуализацию и документирование результатов гель-электрофореза осуществляют с помощью системы гель-документации Vilber Lourmat Quantum ST5.
Примеры
Пример 1. Определение чувствительности метода при температуре отжига-элонгации 54°C.
Получение ДНК из клеточных препаратов, искусственно обсемененных бактериями
В качестве клеточного препарата используют мезенхимные стромальные клетки (МСК) человека. МСК выделяют из подкожного жирового отложения здоровых доноров обоих полов. Клетки выделяют из материала, полученного при проведении малого хирургического вмешательства под местной анестезией или в ходе плановых хирургических операций. Хирургический материал (15 г жировой ткани, взятой из околопупочной области или другой области локализации подкожного жира) помещают в одноразовую пробирку с буфером HBSS (HyClone), содержащим 5-ти кратную концентрацию антибиотика 500 ед./мл (HyClone).
В стерильных условиях культурального бокса биоптат фрагментируют до однородной массы, используя стерильные инструменты, после чего подвергают его ферментативной обработке в растворе, содержащем среду AdvanceSTEM (HyClone), 500 ед/мл антибиотика (HyClone), 200 ед./мл коллагеназы I типа и диспазы (40 ед./мл) (Worthington Biochemical) (соотношение объема ферментов и жира должно быть 1:1:1), при 37°C в течение 30-45 минут при постоянном помешивании. По окончании инкубации к образцу добавляют равный объем среды с сывороткой и фильтруют через нейлоновые мембраны с размером пор 100 мкм (BD). Профильтрованную суспензию центрифугируют в течение 5 мин при 200 g, после чего супернатант полностью удаляют. Осадок клеток подвергают обработке буфером для лизиса эритроцитов (BD) до покраснения раствора, после чего центрифугируют в течение 5 мин при 200 g. Супернатант полностью удаляют, а осажденные клетки ресуспендируют в среде роста МСК. Для культивирования мезенхимных клеток используют среду AdvanceSTEM (HyClone) в сочетании с добавлением 10% раствора добавок AdvanceSTEM Stem Cell Growth Supplement (HyClone) и 100 ед/мл антибиотика (HyClone). Эта среда была разработана фирмой-производителем (HyClone) для культивирования недифференцированных МСК, в частности клеток, происходящих из жировой ткани, без добавления сыворотки (http://www.thermo.com).
Выделенные МСК высевают в концентрации 200 тыс. в мл в чашках Петри и культивируют в среде роста в инкубаторе при 37°C и при 5%-ной концентрации CO2. Для получения клеточной суспензии клетки снимают с поверхности культурального пластика. Перед снятием с поверхности культурального пластика клетки трехкратно промывают раствором Версена. Затем наносят в каждую чашку по 1 мл реагента для диссоциации клеток HyQTase (HyClone). При приобретении клетками округлой формы и откреплении их от подложки в каждую культуральную емкость вносят по 9 мл среды роста и интенсивно пипетируют клеточную суспензию.
Культуру бактерий Е. coli выращивают в жидкой среде LB в течение суток, после чего определяют концентрацию при помощи спектрофотометра NanoDrop 1000 (Thermo). Объем доводят до концентрации бактерий 107 КОЕ/мл, полученный образец последовательно разводят в 10 раз до получения концентрации 102 КОЕ/мл. ДНК из семи образцов МСК выделяют, как описано в разделе «Материалы и методы», однако после переноса 1 мл образца в пробирку объемом 2 мл к нему добавляют 10 мкл бактериальных суспензий, полученных при осуществлении серийных разведений. Таким образом получают образцы объемом 1 мл, содержащие бактериальные клетки в количестве 105, 104, 103, 102, 10 и 1 КОЕ. В один из образцов, являющийся контрольным, бактерии не добавляют.
Проведение ПЦР-амплификации и анализ данных
Образцы ДНК, перечисленные выше, подвергают ПЦР-амплификации, как описано в разделе «Материалы и методы»: удерживание температуры 96°C в течение 5 минут, далее - 50 двухшаговых циклов: первый шаг - плавление при температуре 96°C в течение 10 секунд, второй шаг - отжиг-элонгация при температуре 54°C в течение 45 секунд. Кроме того, для оценки ложноположительных результатов одновременно проводят амплификацию отрицательного контроля - образца, не содержащего ДНК.
Анализ результатов ПЦР осуществляют с помощью электрофореза в 2% агарозном геле с добавлением бромистого этидия в концентрации 0,5 мкг/мл. Полоса 466 п.о. соответствует продукту амплификации гена, кодирующего 16S рРНК; полоса 136 п.о. - продукту амплификации гена бета-актина.
В результате проведенной реакции было выяснено, что чувствительность метода при данной температуре составляет 103 КОЕ/мл (фиг. 1). Полоса, соответствующая внутреннему контролю - продукту амплификации гена бета-актина, обнаруживается во всех исследуемых образцах, содержащих ДНК мезенхимальных стволовых клеток, но отсутствует в отрицательном контроле. При этом нужно заметить, что интенсивность свечения полосы, соответствующей продукту амплификации гена бета-актина, ниже в образцах с более высокими концентрациями бактериальной ДНК, что свидетельствует о взаимной конкуренции двух одновременно протекающих ПЦР-реакций. В образце, не содержащем ДНК, отчетливо наблюдается амплификация бактериальной ДНК, что свидетельствует о контаминации реагентов и возможности появления ложноположительных результатов в отсутствие амплификации гена бета-актина.
Пример 2. Определение чувствительности метода при температуре отжига-элонгации 55°C
ДНК из клеточных препаратов, искусственно обсемененных бактериями, получают так же, как описано в примере 1.
Образцы ДНК, перечисленные в примере 1, подверглись ПЦР-амплификации, как описано в разделе «Материалы и методы»: удерживание температуры 96°C в течение 5 минут, далее - 50 двухшаговых циклов: первый шаг - плавление при температуре 96°C в течение 10 секунд, второй шаг - отжиг и элонгация при температуре 55°C в течение 45 секунд. Для оценки ложноположительных результатов одновременно была проведена амплификация отрицательного контроля - образца, не содержащего ДНК.
Анализ результатов ПЦР был осуществлен с помощью электрофореза в 2% агарозном геле с добавлением бромистого этидия в концентрации 0,5 мкг/мл. Полоса 466 п.о. соответствует продукту амплификации гена, кодирующего 16S рРНК; полоса 136 п.о. - продукту амплификации гена бета-актина.
В результате проведенной реакции было выяснено, что чувствительность метода при данной температуре составляет 1-10 КОЕ/мл (фиг. 2). Аналогично предыдущему случаю полоса, соответствующая внутреннему контролю - продукту амплификации гена бета-актина, обнаруживается во всех исследуемых образцах, содержащих ДНК МСК, но отсутствует в отрицательном контроле. Так же, как и в примере 1, интенсивность свечения полосы, соответствующей продукту амплификации гена бета-актина, ниже в образцах с более высокими концентрациями бактериальной ДНК, что подтверждает наличие конкуренции двух одновременно протекающих ПЦР-реакций.
При проведении ПЦР чувствительность метода и количество побочных продуктов зависят от температуры отжига (гибридизации) праймеров. При сравнении результатов проведенных экспериментов, описанных в примерах 1 и 2, выяснилось, что повышение температуры увеличивает чувствительность метода, которая на два-три порядка выше при протекании гибридизации при температуре 55°C (1-10 КОЕ/мл), чем при 54°C (10-103 КОЕ/мл). Кроме того, повышение температуры снижает количество побочных (неспецифических) продуктов: интенсивность свечения их полос при температуре отжига-элонгации, равной 55°C, ниже, чем при 54°C.
При анализе результатов реакции с помощью гель-элетрофореза в отрицательном контроле обнаруживается полоса, соответствующая продукту амплификации гена, кодирующего 16S рРНК, хотя отсутствуют продукты амплификации внутреннего контроля. Данный результат объясняется контаминацией используемых при ПЦР реактивов, имеющих бактериальное происхождение, в частности рекомбинантной Taq-полимеразы. Одновременное протекание в реакционной смеси двух конкурирующих ПЦР-реакций (амплификация гена, кодирующего 16S рРНК, и амплификация внутреннего контроля - гена человеческого бета-актина) позволяет снизить уровень возможного «шумового» сигнала, связанного с контаминацией используемых при ПЦР реактивов, имеющих бактериальное происхождение, и избежать ложноположительных результатов. Поэтому в образце, в котором присутствует ДНК МСК, но нет бактериальной ДНК, отсутствует полоса, соответствующая продукту амплификации гена 16S рДНК, однако регистрируется сигнал от продуктов амплификации внутреннего контроля. Именно в таком случае результат исследования является отрицательным и можно говорить об отсутствии контаминации клеточной культуры. Положительным результат считается при выявлении сигнала от продуктов обеих ПЦР-реакций.
Интенсивность протекания конкурирующей реакции и, соответственно, чувствительность метода регулируются при помощи изменения температуры отжига-элонгации праймеров. Снижение чувствительности в приведенных примерах не влияет на информативность метода, поскольку по данным литературы чувствительности метода в 102 КОЕ/мл достаточно для детекции бактериальных патогенов в 100% случаев.
Пример 3. Определение возможностей метода при исследовании кондиционированной среды, содержащей продукты секреции клеток человека
Получение ДНК из препаратов кондиционированной среды, искусственно обсемененных бактериями
Для получения кондиционированной среды МСК жировой ткани наращивают до 2-5 пассажа. МСК жировой ткани человека добавляют в количестве 5-15⋅103/см2 в культуральные емкости для выращивания эукариотических клеток, после прикрепления промывают культуральные сосуды с клетками солевым раствором Хэнкса (Панэко, Россия) (в количестве 0,1-0,2 мл/см2 трижды по 10 минут) и заполняют их свежей средой роста для кондиционирования в количестве 0,1-0,2 мл/см2. В качестве последней используют универсальную среду роста для разных типов клеток DMEM with Low Glucose (HyClone, USA) или другую подходящую для кондиционирования среду роста. Затем клетки культивируют в условиях CO2 инкубатора при 37±1°C, 5%-ном содержании CO2 и относительной влажности ≥95% в течение 7 суток. Кондиционированную среду, содержащую все продукты секреции МСК жировой ткани человека, собирают в стерильные емкости для центрифугирования и центрифугируют при 2500 g и температуре (6±2)°C в течение 20 минут. Надосадочную жидкость отбирают, оставляя 1 мл. Осадок ресуспендируют и переносят в пробирку объемом 2 мл, после переноса к нему добавляют 10 мкл бактериальных суспензий, полученных при осуществлении серийных разведений, как описано в примере 1. Таким образом получают образцы объемом 1 мл, содержащие бактериальные клетки в количестве 105, 104, 103, 102, 10 и 1 КОЕ. В один из образцов, являющийся контрольным, бактерии не добавляют. Далее ДНК выделяют, как описано в разделе «Материалы и методы», начиная с этапа центрифугирования образца в течение 10 мин. при ускорении 5000 g.
Проведение ПЦР-амплификации и анализ данных
Образцы ДНК, перечисленные выше, подвергают ПЦР-амплификации, как описано в разделе «Материалы и методы»: удерживание температуры 96°C в течение 5 минут, далее - 50 двухшаговых циклов: первый шаг - плавление при температуре 96°C в течение 10 секунд, второй шаг - отжиг-элонгация при температуре в течение 45 секунд. Кроме того, для оценки ложноположительных результатов одновременно проводят амплификацию отрицательного контроля - образца, не содержащего ДНК. Проводят две серии экспериментов - с температурой отжига-элонгации 54°C и с температурой отжига-элонгации 55°C.
Анализ результатов ПЦР осуществляют с помощью электрофореза в 2% агарозном геле с добавлением бромистого этидия в концентрации 0,5 мкг/мл. Полоса 466 п.о. соответствует продукту амплификации гена, кодирующего 16S рРНК; полоса 136 п.о. - продукту амплификации гена бета-актина.
Данные электрофореза были аналогичны данным, полученным при исследовании клеточных препаратов в примерах 1 и 2, что свидетельствует о возможности использования метода для оценки бактериальной контаминации кондиционированных сред.
Таким образом, ПЦР-амплификация консервативных участков последовательности ДНК гена, кодирующего бактериальную 16S рРНК, является высокочувствительным методом, способным обнаружить бактериальную контаминацию клеточных культур, причем чувствительность метода напрямую зависит от температуры отжига-элонгации праймеров, что позволяет регулировать ее в зависимости от цели исследования. Кроме того, одновременное проведение конкурирующей ПЦР-реакции для обнаружения внутреннего контроля позволяет снизить уровень неспецифического «шумового» сигнала, не уменьшая диагностическую ценность метода.