2-АРИЛ-1,3-ТИАЗОЛИДИН-4-КАРБОНОВЫЕ КИСЛОТЫ, ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ
Вид РИД
Изобретение
Данное изобретение относится к новым 2-арил-1,3-тиазолидин-4-карбоновым кислотам, обладающим противоопухолевой активностью, которые могут быть применены для лечения онкологических заболеваний.
В настоящее время известно огромное множество противораковых соединений, усовершенствованы методы диагностики и лечения данного заболевания, однако рак остается наиболее распространенной причиной смертей во всем мире. Поэтому продолжается поиск высокоэффективных средств от рака, обладающих низкой токсичностью.
К препаратам, обладающим противораковой активностью относятся и производные 1,3-тиазолидин-4-карбоновой кислоты, которые описаны в ряде публикаций как противоопухолевые соединения. Например, описан способ лечения злокачественных опухолей с помощью 1,3-тиазолидин-4-карбоновой кислоты (тиопролина), или ее фармацевтически приемлемых солей (US 4384001, А61К 31/425, 1978). Предполагается, что тиопролин индуцирует обратное преобразование в опухолевых клетках и восстанавливает чувствительность клеток к ингибированию их роста (Brugarolas A, Gosalvez М. Treatment of cancer by an inducer of reverse transformation. Lancet 1980; - P. 68-70). Тиопролин, который легко нитрозируется с образованием нитрозотиопролина, может действовать в качестве акцептора нитрита. Был исследован эффект тиопролина в качестве ингибитора канцерогенеза, индуцированного прекурсорами N-нитрозо-N-бензилметиламина. Показано, что тиопролин подавляет канцерогенез, индуцированный N-бензилметиламином и нитритом, возможно, путем ингибирования нитрозирования in vivo N-бензилметиламина (Tahira Т, Ohgaki Н, Wakabayashi K., et al. The inhibitory effect of thioproline on carcinogenesis induced by N-benzylmethylamine and nitrite. Food Chem Toxicol. 1988. Vol. 26(6). - P. 511-516).
Тиазолидиновый цикл, который можно рассматривать также как аналог пролина - тиопролин, как известно, является частью многих биологически активных соединений с разнообразными свойствами (A. Verma, S.K. Saraf. 4-thiazolidinone - a biologically active scaffold. European Journal of Medicinal Chemistry. - 2008. - Vol. 43. - P. 897-905; A.K. Jain, A. Vaidya, V. Ravichandran. Recent developments and biological activities of thiazolidinone derivatives: A review. Bioorganic & Medicinal Chemistry, 2012, Vol. 20, N. 11, P. 3378-3395; Revelant G et al. Synthesis and biological evaluation of novel 2-heteroarylimino-1,3-thiazolidin-4-ones as potential anti-tumor agents Eur J Med Chem. 2015 Apr 13; 94:102-12; Nagasree K.P. et al. 3D QSAR analysis of 2-(substituted aryl)-thiazolidine-4-carboxamides as potent antitubercular agents. Curr Comput Aided Drug Des. 2014. Vol. 10, N. 3. P. 274-281; Devi P.B. et al. Structure-guided design of thiazolidine derivatives as Mycobacterium tuberculosis pantothenate synthetase inhibitors. ChemMedChem. 2014, 9 (11), P. 2538-47).
К противоопухолевым соединениям относят и комплексы 1,3-тиазолидин-4-карбоновой кислоты с различными переходными металлами, которые показали цитотоксическую и противоопухолевую активность. (D.G. Craciunescu, A. Doadrio et al. Synthesis and Antitumor Properties of Complexes with Heavy Transition Metals and Thioproline. Inorganica Chimica Acta, 67 (1982) L11-L13).
Для лечения и профилактики рака применяются также 2-метил-тиазолидин-2,4-дикарбоновая кислота (2-MTDC) и ее физиологически приемлемые соли (US 2003/0149085, 2003), а также 2-замещенные 5,5-диметил-4-тиазолидин карбоновые кислоты (US 5169858,), проявляющие себя как потенциальные ингибиторы тирозиназы. В качестве эффективных ингибиторов тирозиназы применяются и различные 2-гидроксифенилзамещенные 4-тиазолидинкарбоновые кислоты (Young Mi Haa et al. Design, synthesis and biological evaluation of 2-(substituted phenyl)thiazolidine-4-carboxylic acid derivatives as novel tyrosinase inhibitors. Biochimie. - 2012. Vol. 94. P. 533-540).
Как потенциальные противоопухолевые соединения описаны производные 2-оксоспиро(индолин-3,2'-тиазолидин)-4'-карбоксилатов, которые являются модуляторами белка р53 и ингибируют рост различных линий человеческих раковых клеток в наномолярных концентрациях (Bertamino A, Soprano М, Musella S. Synthesis, in vitro, and in cell studies of a new series of [indoline-3,2'-thiazolidine]-based p53 modulators. J Med Chem. -2013. Vol. 56, N 13. - P. 5407-21).
Как противоопухолевые агенты заявлены и 2-арилзамещенные 4-тиазолидинкарбоновые кислоты, действующие на солидные опухоли и стабильные к окислению воздухом при хранении (JP 56133216, JP 55167220), и 2-замещенные 4-тиазолидинкарбоновые кислоты, обладающие канцеростатической активностью и имеющие во 2-м положении такие заместители как алкил, фенил, замещенный фенил, нафтил, бензил (US 4840936).
В качестве сильнодействующих цитотоксических агентов как для рака простаты, так и для меланомы предлагаются амиды 2-арил-тиазолидин-4-карбоновой кислоты [(US 2006/040998 A1; US 2008/0255213; US 8,592,465), (Li et al., "Synthesis and antiproliferative activity of thiazolidine analogs for melanoma," Bioorg. Med. Chem. Lett. 17:4113-7 (2007); Li et al., "Structure-activity relationship studies of arylthiazolidine amides as selective cytotoxic agents for melanoma," Anticancer Res. 27:883-888 (2007); Gududuru et al., "SAR studies of 2-arylthiazolidine-4-carboxylic acid amides: a novel class of cytotoxic agents for prostate cancer," Bioorg. Med. Chem. Lett. 15:4010-4013 (2005); Gududuru et al., "Discovery of 2-arylthiazolidine-4-carboxylic acid amides as a new class of cytotoxic agents for prostate cancer," J. Med. Chem. 48:2584-2588 (2005)].
Известно, что амиды 2-арил-тиазолидин-4-карбоновой кислоты были разработаны из структуры лизофосфатидиновой кислоты (ЛФК) с липидной цепью. Целью исследований, проводимых с данными соединениями, было ингибирование сигналов GPCR (рецептора, сопряженного с G-белком), которые задействованы в пролиферации и выживании рака простаты [Raj et al., "Guanosine phosphate binding protein coupled receptors in prostate cancer: A review," J. Urol. 167:1458-1463 (2002); Kue et al., "Essential role for g proteins in prostate cancer cell growth and signaling," J. Urol. 164:2162-7 (2000); Guo et al., "Expression and function of lysophosphatidic acid lpa 1 receptor in prostate cancer cells," Endocrinology 147:4883-4892 (2006)]. Выявлено, что наиболее активные из амидов 2-арил-тиазолидин-4-карбоновой кислоты могли ингибировать раковые клетки простаты со средним значением IC50 в диапазоне от 0,7 до 1,0 мкМ, а средние значения IC50 в отношении клеток меланомы составляли 1,8-2,6 мкМ (Li et al., "Synthesis and antiproliferative activity of thiazolidine analogs for melanoma," Bioorg. Med. Chem. Lett. 17:4113-7 (2007)).
Высокую цитотоксичность на линиях клеток лейкемии (Daudi и Jurkat) и на трех линиях клеток солидных опухолей (DU-145, PC-3 и HeLa) показывают N-сульфонилзамещенные тиопролин-(Р2)-пептидил альдегиды (R. Korukonda, N. Guan, J.Т. Dalton et al. Synthesis, Calpain Inhibitory Activity, and Cytotoxicity of Р2-Substituted Proline and Thiaproline Peptidyl Aldehydes and Peptidyl α-Ketoamides. J. Med. Chem. 2006, Vol. 49. - P. 5282-5290).
Для синтеза производных тиазолидиндикарбоновых кислот применяются различные методы, описанные в патенте РФ (RU 2514427, C07D 277/34, 2012). Известно, что при получении тиазолидинкарбоновых кислот в качестве промежуточных соединений получаются тиазольные соединения дегидрогенизацией амидов Вайнреба. Далее промежуточные соединения вводят в реакцию с литиевыми соединениями или реактивами Гриньяра, после чего проводят обработку их раствором хлористого аммония, что приводит к получению тиазолиновых соединений. Так при получении производных тиазолидиндикарбоновых кислот по патенту (RU 2514427) промежуточные амиды обрабатывают реактивами Гриньяра, содержащими соответствующие радикалы для образования тиазольного или имидазольного или оксазольного цикла.
Получение производных тиазолидинкарбоновых кислот, а именно (2R,4R)-2-алкил-3-(2-меркаптобензоил)-1,3тиазолидин-4-карбоновых кислот, описано и в патенте РФ (RU 2526619, C07D 277/06,2014), осуществляемое ацилированием 2-алкил-1,3-тиазолидин-4-карбоновых кислот с помощью дихлорангидрида дитиосалициловой кислоты.
Известно, что 2-Арил-тиазолидин-4-карбоновые кислоты получают взаимодействием соответствующих бензальдегидов с L- или D-цистеином или их гидрохлоридами. При этом используются различные растворители или смеси растворителей и процесс проводится при различной температуре, например, в метаноле при кипении (US 5846988; Yan, Y., Wan-Shun, L., Bao-Qin, H., and Hai-Zhou, S. Nutrition Research, 2006. Vol. 26, P. 369-377 ); в смеси метанол-вода (5:1) при 25°С в течение 1-10 часов (RU 2526619); в смеси этанол-вода (10:1) при 25°С в течение 6-15 часов (RU 2514427), в смеси этанол-вода 1:1 при 25°С в течение 6 часов (D. Sriram, P. Yogeeswari, J.Т. Patrisha et al. Exploring arylthiazolidinecarboxamides as a new class of antimycobacterials. Pharmacology online. 2011. Vol. 1, P. 185-195).
Несомненный интерес для нового изобретения представляет публикация, касающаяся синтеза анисовых альдегидов, замещенных в 3-м положении бензольного кольца, используемых в качестве исходных при синтезе новых 2-арил-1,3-тиазолидин-4-карбоновые кислот (Хачатрян Д.С, Разинов А.Л., Колотаев А.В., С.К. Белусь, К.Р. Матевосян. Алкилирование NH-, ОН- и SH-кислот в присутствии карбоната калия. Известия АН. Серия химическая, 2015, №2. - С. 395-404).
Целью настоящего изобретения является получение новых производных тиазолидин-4-карбоновых кислот являющихся эффективными противораковыми соединениями с низкой токсичностью с расширенным спектром противоопухолевого действия.
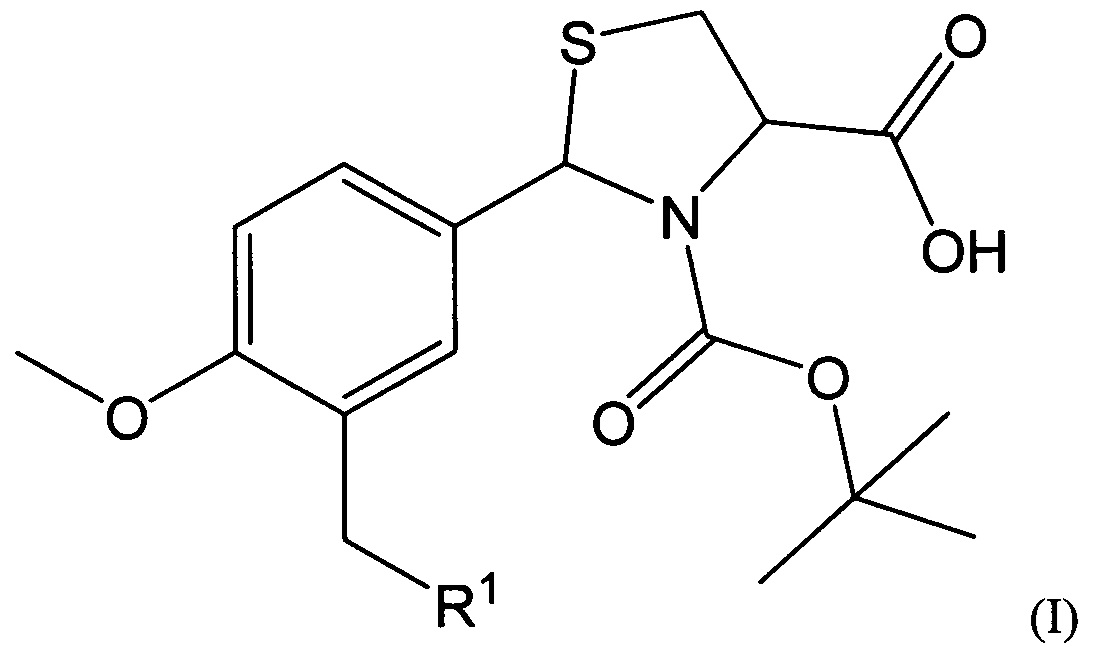
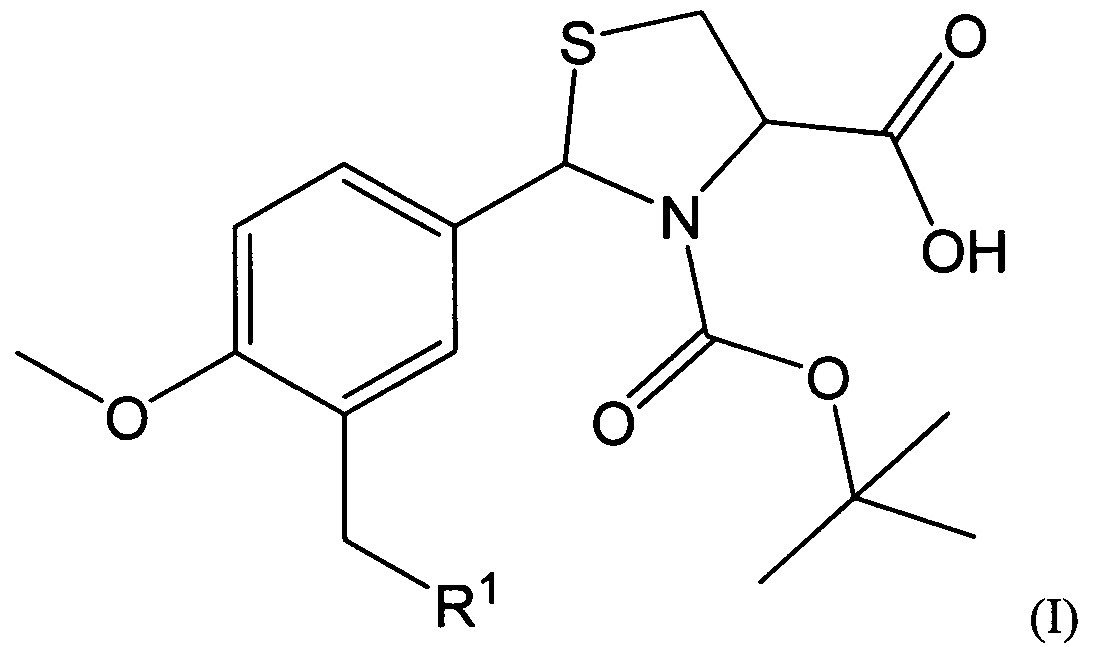
В качестве таких соединений предлагаются 2-Арил-1,3-тиазолидин-4-карбоновые кислоты общей формулы I:
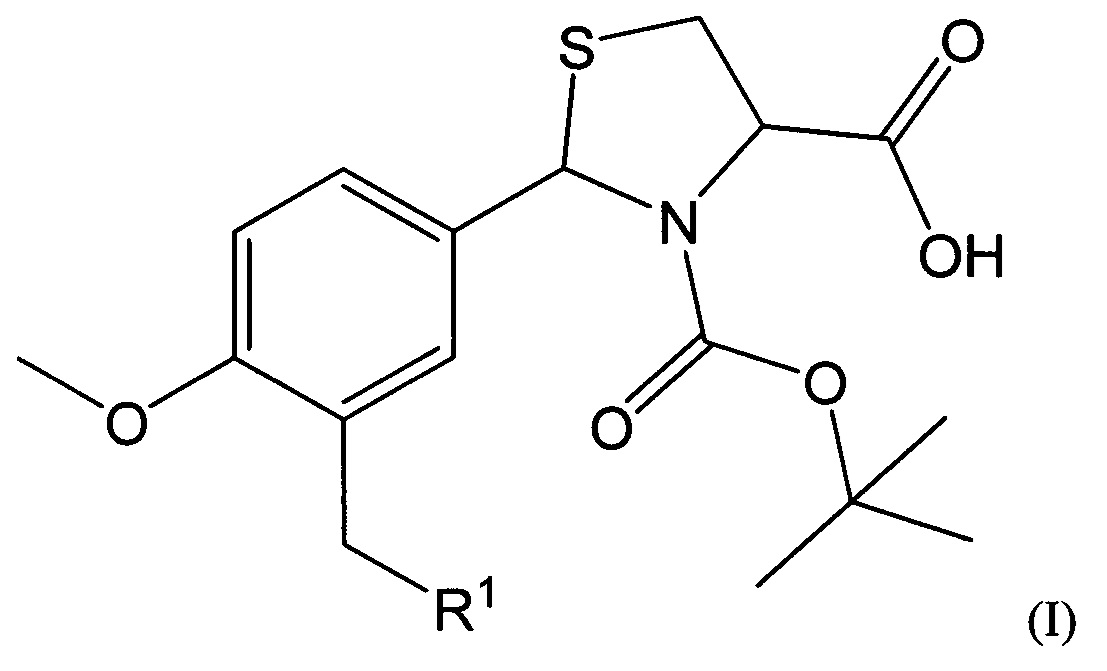
где R1 представляет собой -OR2, -SR3, -NR4R5,
где R2 представляет собой арильный фрагмент, замещенный в различных положениях галогенами, оксиалкильными группами;
R3 представляет собой конденсированные гетероциклические системы, выбранные из группы бензотиазолов;
-NR4R5 представляет собой замещенные или незамещенные гетероциклические системы, в которых атом азота включен в насыщенный гетероцикл, выбранные из группы: 3,4-дигидрохинолинов-2(Н), пиразолов, замещенных метилом и нитрогруппой.
Соединения, имеющие общую формулу I, могут быть представлены в виде их фармацевтически приемлемых солей, гидратов или пролекарств.
Способ получения 2-арил-1,3-тиазолидин-4-карбоновых кислот, имеющих общую формулу I, включает две стадии. Первую стадию осуществляют путем взаимодействия 3-замещенных анисовых альдегидов с цистеином в спиртовой или водно-спиртовой среде, предпочтительно в среде 95%-ного этанола, при рН 7-8 и при температуре кипения реакционной массы с последующим ацилированием полученных 2-арил-1,3-тиазолидин-4-карбоновых кислот трет-бутилпирокарбонатом в среде смеси диоксан-вода или диметилформамид-вода в присутствии основания, последующей экстракцией полученного продукта органическим растворителем, отгонкой растворителя, сушкой и выделением конечного продукта (соединения 2а-з).
Способ получения 2-арил-1,3-тиазолидин-4-карбоновых кислот, имеющих общую формулу I, включает стадию ацилирования, осуществляемую в присутствии основания, преимущественно выбранного из группы: гидроксид натрия, карбонат калия, бикарбонат натрия, и экстракцию полученного продукта органическим растворителем, предпочтительно этилацетатом.
К предлагаемым соединениям общей формулы I, например, относятся:
3-трет-бутилоксикарбонил-2-(3-(1,3-бензотиазол-2-илтиометил)-4-метоксифенил)-1,3-L-тиазолидин-4-карбоновая кислота (соединение 3а)
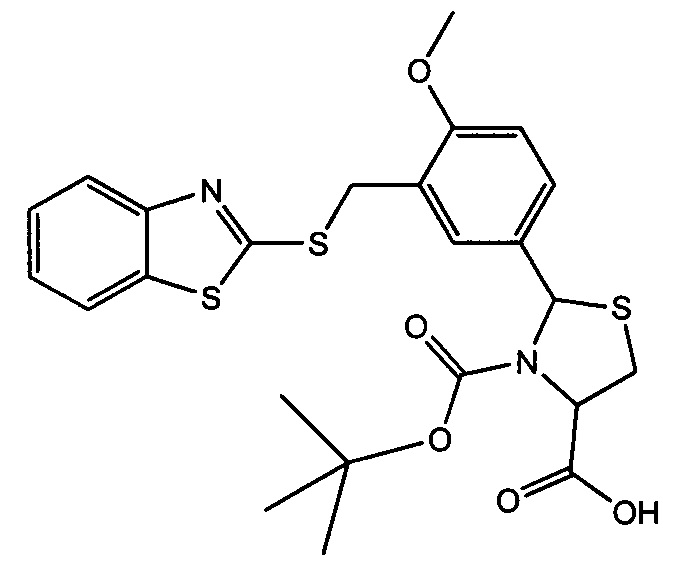
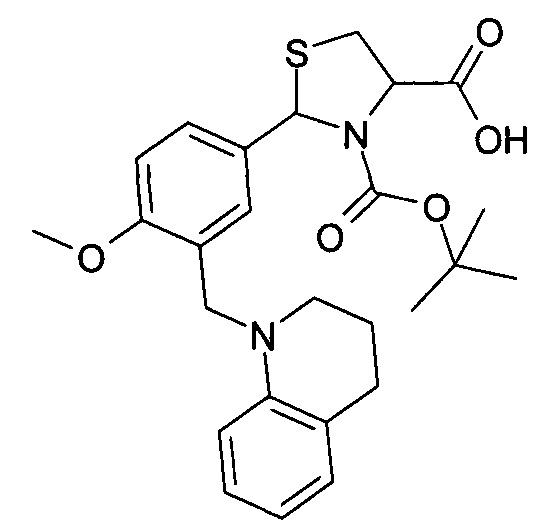
3-трет-бутилоксикарбонил-2-(3-(3,4-дигидрохинолин-1(2Н)-илметил)-4-метоксифенил)-1,3-L-тиазолидин-4-карбоновая кислота (соединение 3б).
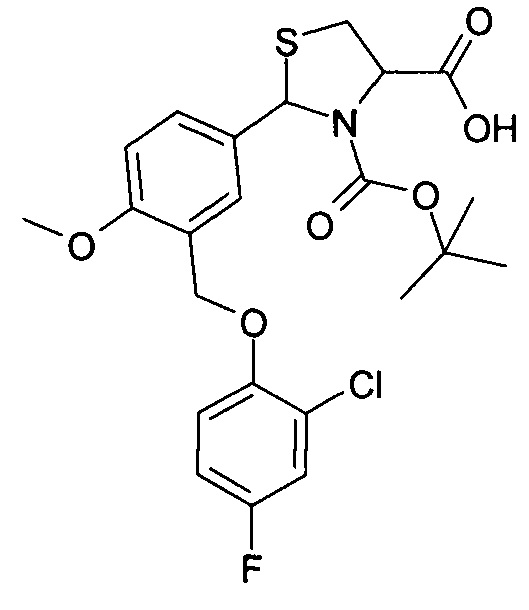
3-трет-бутилоксикарбонил-2-(3-(4-фтор-2-хлорфеноксиметил)-4-метоксифенил)-1,3-L-тиазолидин-4-карбоновая кислота (соединение 3в)
Ниже приводятся способы получения данных соединений (Примеры 1-12).
Предлагаемые 2-Арил-1,3-тиазолидин-4-карбоновые кислоты могут быть представлены в виде их фармацевтически приемлемых солей, гидратов и пролекарств.
Предлагаемые соединения получают в три этапа: сначала осуществляют синтез анисовых альдегидов, замещенных в 3-м положении (Схема 1); затем осуществляют синтез 2-арил-1,3-тиазолидин-4-карбоновых кислот путем взаимодействия соответствующих альдегидов с энантиомерным (L или D) или рацемическим цистеином (Схема 2); и на последней стадии проводят ацилирование 2-арил-1,3-тиазолидин-4-карбоновых кислот по атому азота в 3-м положении тиазолидинового цикла (Схема 1).
Синтез анисовых альдегидов, замещенных в 3-м положении бензольного кольца, описан в статье (Хачатрян Д.С, Разинов А.Л., Колотаев А.В., С.К. Белусь, К.Р. Матевосян. Алкилирование NH-, ОН- и SH-кислот в присутствии карбоната калия. Известия АН. Серия химическая, 2015, №2. - С. 395-404), которая полностью включена в данную заявку путем ссылки. В статье описаны анисовые альдегиды, включающие полностью все фрагменты представленные в преимущественном варианте данного изобретения (Схема 1). Синтез анисовых альдегидов, замещенных в 3-м положении осуществляют по схеме 1 следующим образом:
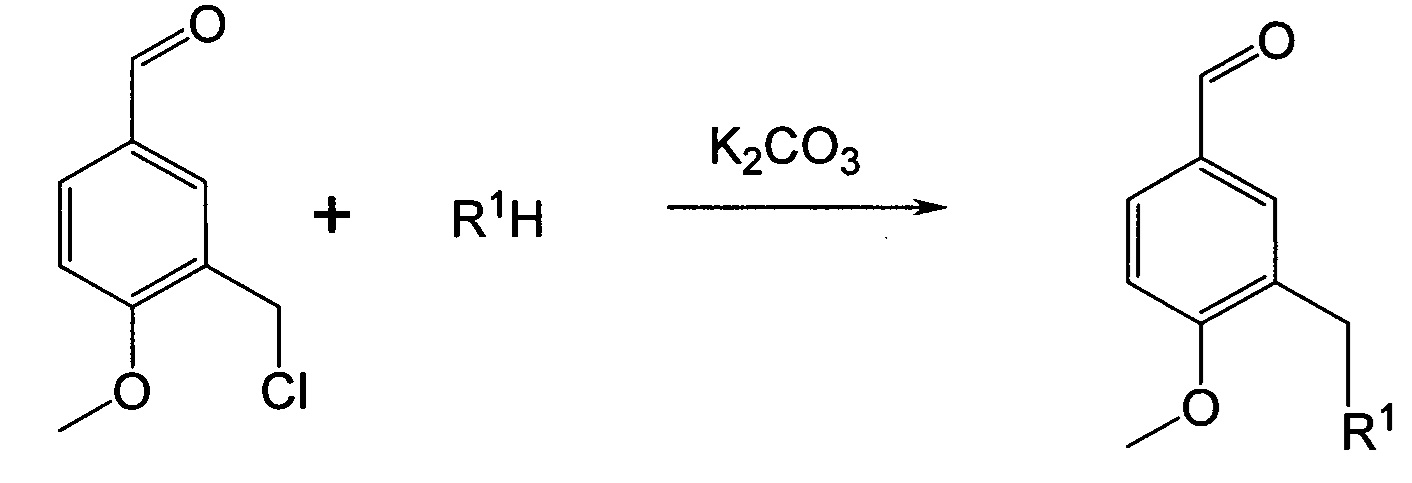
R1 представляет собой -OR2, -SR3, -NR4R5,
Для замещения хлора различными нуклеофилами (фенолы, вторичные амины, тиолы) в качестве основания для генерации соответствующих анионов преимущественно может быть выбран карбонат калия. Применение карбоната калия в качестве основания дает возможность: исключить побочные реакции гидролиза (сольволиза) хлорметильной группы, а также побочные реакции альдегидной функции (например, реакция Канницаро), тем самым повысить селективность и выходы процесса получения анисовых альдегидов замещенных в 3-м положении. В качестве растворителя для реакции могут применяться такие растворители как этанол, бензол, толуол, ацетонитрил, ДМФА или их смеси, в которых исходные нуклеофилы растворяются, а конечные продукты выделяются в твердом виде. Реакция может проводиться при температуре 20-110°С, преимущественной температурой является температура кипения используемого растворителя. Время реакции может быть 3-12 часов (Схема 1).
Синтез 2-арил-1,3-тиазолидин-4-карбоновых кислот осуществляется в результате прямого взаимодействия ароматических альдегидов с цистеином. Характерной особенностью метода получения 2-арил-1,3-тиазолидин-4-карбоновых кислот является то, что в качестве бензальдегидов используются замещенные в 3-м положении анисовые альдегиды. Синтез заключается в реакции взаимодействия замещенных анисовых альдегидов с цистеином в спиртовой или водно-спиртовой среде, причем если применяемый цистеин в солевой форме, то прибавлением in situ соответствующих количеств основания (гидроксиды или ацетаты щелочных металлов) цистеин переводят в основную форму, с дальнейшим контролированием рН реакционной массы (Схема 2). Предпочтительным вариантом является использование 95%-ного этанола в качестве растворителя, ацетата натрия в качестве основания и проведение реакции при температуре кипения реакционной массы. Синтез 2-арил-1,3-тиазолидин-4-карбоновых кислот путем взаимодействия соответствующих альдегидов с энантиомерным (L или D) или рацемическим цистеином по схеме 2 осуществляют следующим образом:
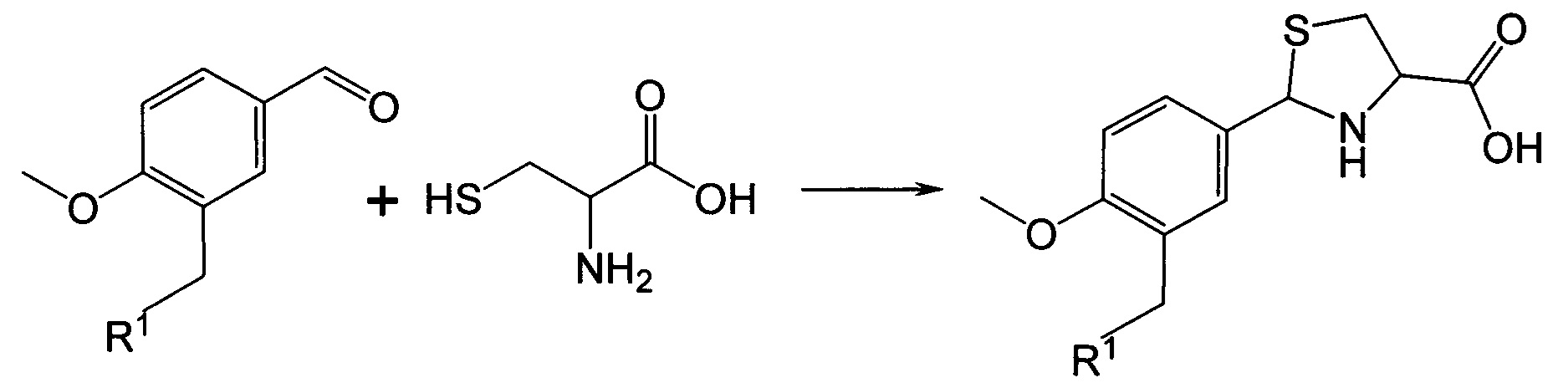
R1 представляет собой -OR2, -SR3, -NR4R5,
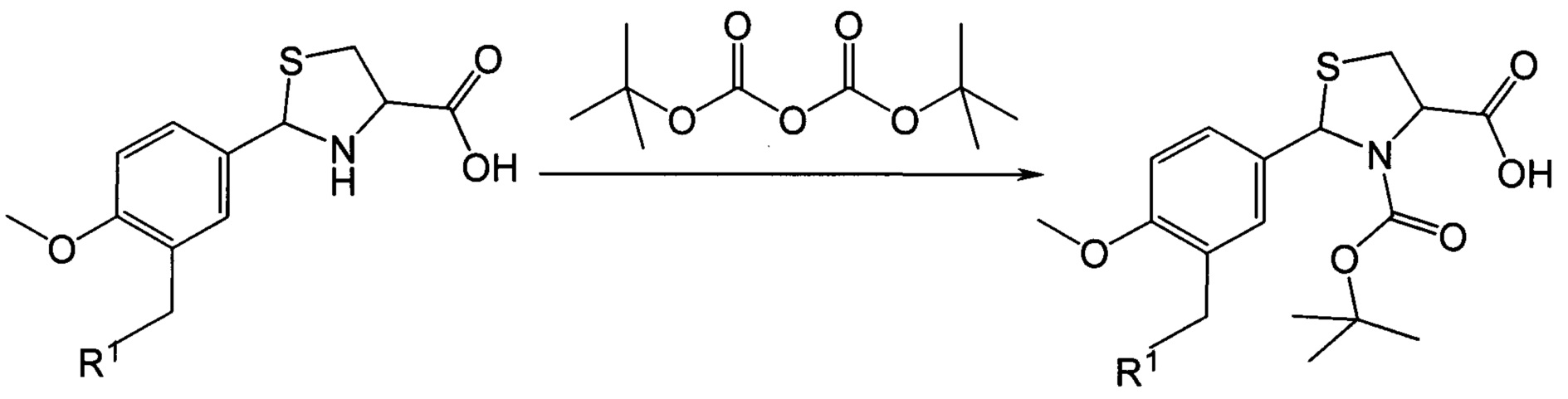
Ацилирование 2-арил-1,3-тиазолидин-4-карбоновых кислот по атому азота в 3-м положении тиазолидинового цикла проводят по схеме 3:.
 .
.
R1 представляет собой -OR2, -SR3, -NR4R5,
Ацилирование 2-арил-1,3-тиазолидин-4-карбоновых кислот трет-бутилпирокарбонатом осуществляется в условиях реакции Шоттен-Баумана. Растворителем может являться смеси диоксан-вода или диметилформамид-вода. В качестве основания в данном способе синтеза могут быть использованы: гидроксид натрия, карбонат калия, бикарбонат натрия и др.
Данный способ получения относится ко всем соединениям общей формулы I.
Ниже изобретение иллюстрируется примерами, которые не ограничивают объем притязаний в рамках заявленной формулы изобретения.
Исходные реагенты и растворители (чистота 99% и 99+%) фирмы Aldrich применяли без дополнительной очистки. Ход реакций контролировали методом ТСХ на пластинах Silufol UV-254, элюент хлороформ-метанол (8:2), проявление - УФ-облучением и парами иода. Спектры ЯМР 1H и 13С зарегистрированы на спектрометре «Bruker AVANCE III NanoBay» (300 МГц) в режиме стабилизации по дейтерию, термостабилизация 25°С, внутренний стандарт - Me4Si. Элементный состав определен на CHNS-анализаторе «Eurovector Euro EA 3000». Температуры плавления определяли на приборе марки "Melting Point М-565" (BUCHI).
Получение 3-замещенных-4-метоксибензальдегидов.
Синтез анисовых альдегидов, замещенных в 3-м положении, и их физико-химические характеристики описаны в статье (Хачатрян Д.С, Разинов А.Л., Колотаев А.В., С.К. Белусь, К.Р. Матевосян. Алкилирование NH-, ОН- и SH-кислот в присутствии карбоната калия. Известия АН. Серия химическая, 2015, №2. - С. 395-404), которая полностью включена в данную заявку путем ссылки.
В качестве примера приводится получение 3-(4-фтор-2-хлорфеноксиметил)-4-метоксибензальдегида, синтез которого в цитируемой статье не приводится.
Пример 1. Получение 3-(4-фтор-2-хлорфеноксиметил)-4-метоксибензальдегида (соединение 1).
В одногорлую колбу объемом 100 мл, снабженную обратным холодильником помещают 1.85 г (0.010 моль) 4-метокси-3-хлорметилбензальдегида, 0.011 моль 4-фтор-2-хлорфенола и 2.00 г (0.015 моль) карбоната калия, растворенных в 20 мл смеси ацетонитрил-ДМФА (от 9:1 до 8:2, по объему). Реакционную смесь перемешивают при кипячении в течение 5-7 ч (контроль по ТСХ до исчезновения исходного соединения, хлороформ/этанол = 8:2). Отгоняют растворитель в вакууме, полученный остаток обрабатывают 30 мл воды, выпавший осадок продукта отфильтровывают, промывают 20 мл 40%-ного этанола и сушат на воздухе. Выход 97%. Т.пл. 114-114.5°С. Спектр ЯМР 1Н, δ, м.д. (J/Гц): 3.94 (с, 3Н, ОСН3); 5.12 (с, 2Н, CH2O); 6.99-7.07(м, 1H, CHAr); 7.25-7.40 (м, 3Н, CHAr); 7.91-7.98 (м, 2Н, CHAr); 9.89 (с, 1Н, СНО). Найдено: С 61.02, Н 3.98; C15H12ClFO3, Вычислено: С 61.13, Н 4.10.
Получение 2-арил-1,3-тиазолидин-4-карбоновых кислот
Пример 2. Получение 2-(3-(1,3-бензотиазол-2-илтиометил)-4-метокси-фенил)-1,3-L-тиазолидин-4-карбоновой кислоты (соединение 2а).
Раствор смеси L-цистеина гидрохлорида 1.8 г (10.45 ммоль), ацетата натрия 0.9 г (11.4 ммоль) и 3-(1,3-бензотиазол-2-илтиометил)-4-метоксибензальдегида 3.0 г (9.5 ммоль) в 80 мл этанола в плоскодонной колбе (объем 250 мл), снабженной обратным холодильником, кипятят при перемешивании на магнитной мешалке в течение 12-24 часов. Окончание реакции определяют тонкослойной хроматографией на силикагеле, по отсутствию исходного альдегида (элюент: хлороформ/метанол = 9:1). Если в процессе реакции рН становится меньше 7, то добавляют поташ в количестве 0.5-1 г до рН=7. Охлаждают реакционную смесь до комнатной температуры, выпавший осадок продукта отфильтровывают, промывают этанолом и сушат на воздухе. Выход 67%. Т.пл. 137.0-137,5°С. Спектр ЯМР 1Н, δ, м.д. (J/Гц): 3.01-3.12 (м, 1H, 5-CHThz); 3.23-3.37 (м, 1Н, 5-CHThz); 3.83 (с, 1.5Н, ОМе) и 3.85 (с, 1.5Н, ОМе); 3.83-3.87 (м, 0.5Н, 4-CHThz); 4.16-4.20 (м, 0.5Н, 4-CHThz); 4.57 (с, 1H, CH2S) и 4.58 (с, 1Н, CH2S); 5.43 (с, 0.5Н, 2-CHThz) и 5.60 (с, 0.5Н, 2-CHThz); 6.99-7.05 (м, 1Н, CHAr); 7.33-7.50 (м, 3Н, CHAr); 7.57 (д, 0.5Н, CHAr, J=2.0), 7.67 (д, 0.5Н, CHAr, J=2.0), 7.90 (д. д, 1Н, CHAr, J=8.0, J=3.1), 8.00 (д, 1H, CHAr, J=8.0). Найдено: С 54.28, Н 4.07, N 6.36, S 22.49; C19H18N2O3S3, Вычислено: С 54.52, Н 4.33, N 6.69, S 22.98.
Пример 3. Получение 2-(3-(3,4-дигидрохинолин-1(2H)-илметил)-4-метоксифенил)-1,3-L-тиазолидин-4-карбоновой кислоты (соединение 2б).
Указанное в названии соединение получается при осуществлении процесса таким же образом, как описано в Примере 2, путем реакции 3-(3,4-дигидрохинолин-1(2Н)-илметил)-4-метоксибензальдегида с L-цистеином гидрохлоридом. Выход 48%. Т.пл. 141.6-142.7°С. Спектр ЯМР 1Н, δ, м.д. (J/Гц): 1.87-1.99 (м, 2Н, Het-СН2); 2.74 (т, 2Н, Het-CH2, J=6.1); 2.87-2.94 (м, 1Н, 5-CHThz); 3.23-3.30 (м, 1H, 5-CHThz); 3.30-3.37 (м, 2Н, Het-CH2); 3.59-3.64 (м, 0.5Н, 4-CHThz); 3.81 (с, 1.5Н, ОМе) и 3.84 (с, 1.5Н, ОМе); 3.94-3.99 (м, 0.5Н, 4-CHThz); 4.35 (с, 1H, CH2N) и 4.37 (с, 1Н, CH2N); 5.32 (с, 0.5Н, 2-CHThz) и 5.60 (с, 0.5Н, 2-CHThz); 6.30 (д.д, 1H, CHAr, J=7.8, J=3.2); 6.44 (т, 1H, CHAr, J=7.2); 6.81-6.90 (м, 2Н, CHAr); 6.95-7.05 (м, 1H, CHAr); 7.08 (д, 0.4Н, CHAr, J=2.1); 7.13 (д, 0.6Н, CHAr, J=2.1); 7.30 (д.д, 0.4Н, CHAr, J=8.5, J=2.1). 7.39 (д.д, 0.6H, CHAr, J=8.5, J=2.1). Найдено: С 65.69, Н 6.22, N 7.37, S 7.96; C21H24N2O3S, Вычислено: С 65.60, Н 6.29, N 7.29, S 8.34.
Пример 4. Получение 2-(3-(4-фтор-2-хлорфеноксиметил)-4-метоксифенил)-1,3-L-тиазолидин-4-карбоновой кислоты (соединение 2в).
Указанное в названии соединение получается при осуществлении процесса таким же образом, как описано в Примере 2, путем реакции 3-(4-фтор-2-хлорфеноксиметил)-4-метоксибензальдегида с L-цистеином гидрохлоридом. Выход 76%. Т.пл. 132.5-133.5°С. Спектр ЯМР 1Н, δ, м.д. (J/Гц): 3.02- 3.14 (м, 1Н, 5-CHThz); 3.26-3.40 (м, 1H, 5-CHThz); 3.81 (с, 1.5Н, ОМе) и 3.83 (с, 1.5Н, ОМе); 3.84-3.89 (м, 0.5Н, 4-CHThz); 4.17-4.20 (м, 0.5Н, 4-CHThz); 5.09 (с, 1Н, CH2O) и 5.11 (с, 1Н, CH2O); 5.47 (с, 0.5Н, 2-CHThz) и 5.65 (с, 0.5Н, 2-CHThz), 7.00-7.07 (м, 1H, CHAr); 7.14-7.29 (м, 2Н, CHAr); 7.40-7.60 (м, 3Н, CHAr). Найдено: С 54.43, Н 4.21, N 3.44, S 7.84; C18H17ClFNO4S, Вычислено: С 54.34, Н 4.31, N 3.52, S 8.06.
Пример 5. Получение 2-(3-(4-фтор-3-хлорфеноксиметил)-4-метоксифенил)-1,3-L-тиазолидин-4-карбоновой кислоты (соединение 2г).
Указанное в названии соединение получается при осуществлении процесса таким же образом, как описано в Примере 2, путем реакции 3-(4-фтор-3-хлорфеноксиметил)-4-метоксибензальдегида с L-цистеином гидрохлоридом. Выход 71%. Т.пл. 141.1-142.5°С. Спектр ЯМР 1Н, δ, м.д. (J/Гц): 3.02-3.17 (м, 1H, 5-HTHZ), 3.26-3.39 (м, 1Н, 5-CHTHZ), 3.81 (с, 1.5Н, ОМе), 3.83 (с, 1.5Н, ОМе), 3.83-3.90 (м, 0.5Н, 4-CHTHZ), 4.19-4.25 (м, 0.5Н, 4-CHTHZ), 5.02 (с, 1Н, CH2O), 5.04 (с, 1H, CH2O), 5.46 (с, 0.5Н, 2-CHTHZ), 5.62 (с, 0.5Н, 2-CHTHZ), 6.98-7.08 (м, 2Н, CHAr), 7.24-7.29 (м, 1H, CHAr), 7.30-7.37 (м, 1Н, CHAr), 7.43 (д.д, 0.5Н, CHAr, J=8.5, J=2.1), 7.49 (д, 0.75Н, CHAr, J=2.1), 7.52 (д, 0.25Н, CHAr, J=2.1), 7.57 (д, 0.5Н, CHAr, J=2.1)
Пример 6. Получение 2-(4-метокси-3-(4-метоксифеноксиметил)фенил)-1,3-L-тиазолидин-4-карбоновой кислоты (соединение 2д).
Указанное в названии соединение получается при осуществлении процесса таким же образом, как описано в Примере 2, путем реакции 3-(4-метоксифеноксиметил)-4-метоксибензальдегида с L-цистеином гидрохлоридом. Выход 47%. Т.пл. 93.4-94.8°С. Спектр ЯМР 1Н, δ, м.д. (J/Гц): 2.90-3.02 (м, 1Н, 5-CHThz), 3.18-3.33 (м, 1Н, 5-CHThz), 3.39-3.48 (м, 0.5Н, 4-CHThz), 3.52-3.61 (м, 0.5Н, 4-CHThz), 3.69 (с, 3Н, -СН2ОС6Н4ОСН3), 3.79 (с, 1.5Н, n-ОМе), 3.82 (с, 1.5Н, n-ОМе), 4.94 (с, 1Н, CH2O), 4.97 (с, 1Н, CH2O), 5.41 (с. 0.5Н, 2-CHTHZ), 5.73 (с. 0.5Н, 2-CHTHZ), 6.85 (уш. д, 2Н, CHAr, J=8.8), 6.94 (уш. д, 2Н, CHAr, J=8.8), 6.97 (д, 0.5Н, 5-CHAr, J=8.5), 7.03 (д, 0.5Н, 5-CHAr, J=8.5), 7.32-7.38 (уш. д, 0.5Н, 6-CHAr), 7.40-7.47 (уш. м, 1H, 5-CHAr+6-CHAr), 7.51 (уш. с, 1H, 6-CHAr).
Пример 7. Получение 2-(4-метокси-3-(4-фторфеноксиметил)фенил)-1,3-L-тиазолидин-4-карбоновой кислоты (соединение 2е).
Указанное в названии соединение получается при осуществлении процесса таким же образом, как описано в Примере 2, путем реакции 3-(4-фторфеноксиметил)-4-метоксибензальдегида с L-цистеином гидрохлоридом. Выход 66%. Т.пл. 130.6-131.8°С. Спектр ЯМР 1Н, δ, м.д. (J/Гц): 3.02-3.15 (м, 1Н, 5-CHThz), 3.24-3.39 (м, 1Н, 5-CHThz), 3.81 (с, 1.5Н, ОМе), 3.83 (с, 1.5Н, ОМе), 3.84-3.89 (м, 0.5Н, 4-CHThz), 4.19-4.24 (м, 0.5Н, 4-CHThz), 4.99 (с, 1Н, CH2O), 5.01 (с, 1Н, CH2O), 5.46 (с. 0.5Н, 2-CHTHZ), 5.62 (с. 0.5Н, 2-CHTHZ), 6.98-7.07 (м, 3Н, CHAr), 7.08-7.15 (м, 2Н, CHAr), 7.39-7.43 (д.д, 0.5Н, CHAr, J=8.5, J=2.1), 7.46-7.51 (м, 1Н, CHAr), 7.56 (д, 0.5Н, CHAr, J=2.1).
Пример 8. Получение 2-(3-((3,5-диметил-4-нитро-1H-пиразол-1-ил)метил-4-метоксифенил)-1,3-L-тиазолидин-4-карбоновой кислоты (соединение 2ж).
Указанное в названии соединение получается при осуществлении процесса таким же образом, как описано в Примере 2, путем реакции 3-(3,5-диметил-4-нитро-1Н-пиразол-1-ил)метил-4-метоксибензальдегида с L-цистеином гидрохлоридом. Выход 50%. Т.пл. 134.5-135.7°С. Спектр ЯМР 1H, δ, м.д. (J/Гц): 2.37 (с, 3Н, 5-MeHet), 2.62 (с, 1.5Н, 3-MeHet), 2.63 (с, 1.5Н, 3-MeHet), 2.99-3.12 (м, 1H, 5-CHThz), 3.22-3.47 (м, 1H, 5-CHThz), 3.79-3.83 (м, 3.5Н, ОМе+4-CHThz), 4.12-4.16 (м, 0.5Н, 4-CHTHZ), 5.21 (с, 1H, CH2N), 5.23 (с, 1H, CH2N), 5.42 (с, 0.5Н, 2-CHTHZ), 5.60 (с, 0.5Н, 2-CHTHZ), 6.99 (д, 0.5Н, 5-CHAr, J=8.7), 7.03 (д, 0.5Н, 5-CHAr, J=8.7), 7.10 (д, 0.5Н, 2-CHAr, J=2.2), 7.16 (д, 0.5Н, 2-CHAr, J=2.2), 7.40 (д.д, 0.5Н, 6-CHAr, J=8.7, J=2.2), 7.50 (д.д, 0.5Н, 6-CHAr, J=8.7, J=2.2).
Пример 9. Получение 2-(4-метокси-3-((4-нитро-1H-пиразол-1-ил)метил)фенил)-1,3-L-тиазолидин-4-карбоновой кислоты (соединение 2з).
Указанное в названии соединение получается при осуществлении процесса таким же образом, как описано в Примере 2, путем реакции 4-метокси-3-((4-нитро-1H-пиразол-1-ил)метил)бензальдегида с L-цистеином гидрохлоридом. Выход 81%. Т.пл. 111.5-112.8°С. Спектр ЯМР 1Н, δ, м.д. (J/Гц): 2.91-3.07 (м, 1H, 5-CHTHZ), 3.19-3.37 (м. 1H, 5-CHTHZ), 3.58-3.67 (м, 0.5Н, 4-CHTHZ), 3.79 (с, 1.5Н, ОМе), 3.82 (с, 1.5Н, ОМе), 3.99-4.06 (с. 0.5Н, 4-CHTHZ), 5.33 (с, 1Н, CH2N), 5.35 (с, 1Н, CH2N), 5.39 (с. 0.5Н, 2-CHTHZ), 5.65 (с. 0.5Н, 2-CHTHZ), 6.99 (д, 0.5Н, 5-CHAr, J=8.6), 7.04 (д, 0.5Н, 5-CHAr, J=8.6), 7.24 (д, 0.5Н, 2-CHAr, J=2.1), 7.31 (д, 0.5Н, 2-CHAr, J=2.1), 7.40 (д.д, 0.5Н, 6-CHAr, J=8.6, J=2.1), 7.48 (д.д, 0.5Н, 6-CHAr, J=8.6, J=2.1), 8.23 (с, 1Н, 5-CHPyr), 8.83 (с, 0.5Н, 3-CHPyr), 8.87 (с, 0.5Н, 3-CHPyr)/
Получение N-трет-бутилоксикарбонил-замещенных 2-арил-1,3-тиазолидин-4-карбоновых кислот.
Пример 10. Получение 3-трет-бутилоксикарбонил-2-(3-(1,3-бензотиазол-2-илтиометил)-4-метоксифенил)-1,3-L-тиазолидин-4-карбоноврй кислоты (соединение 3а).
В плоскодонной колбе объемом 25 мл помещают 2.50 ммоль соединения 2а в 5 мл диоксана, и добавляют 2.50 мл 1N водного раствора гидроксида натрия. Полученный раствор охлаждают до 5°С, и к нему прибавляют 0.58 г (2.76 ммоль) расплавленного трет-бутилпирокарбоната, убирают охлаждение и реакционную смесь перемешивают при комнатной температуре в течение 12 часов, добавляют 10 мл воды и отгоняют диоксан в вакууме. Полученный водный раствор экстрагируют этилацетатом, отделяют органический слой, а водный - подкисляют 10% лимонной кислотой до рН=3 и экстрагируют этилацетатом. Экстракт промывают водой, сушат над безводным сернокислым натрием, и отгоняют растворитель в вакууме, получая кристаллический продукт. Выход 67%. Т.пл. 74-76°С. Спектр ЯМР 1Н, δ, м.д. (J/Гц): 1.03 (уш. с, 4.9Н, Boc); 1.33 (уш. с, 4.1Н, Boc); 2.99-3.18 (уш. с, 1Н, 5-CHThz); 3.38-3.44 (м, 1Н, 5-CHThz); 3.84 (с, 3Н, ОМе); 4.50-4.59 (м, 0.5Н, 4-CHThz); 4.54 (с, 1Н, CH2S); 4.63-4.74 (м, 0.5Н, 4-CHThz); 5.89 (с, 0.5Н, 2-CHThz) и 6.05 (с, 0.5Н, 2-CHThz), 7.00 (д, 1Н, CHAr, J=8.4); 7.36 (д.т, 1Н, CHAr, J=7.6, J=1.1); 7.47 (д. т, 1H, CHAr, J=7.7,J=1.3); 7.62 (д.д, 1Н, CHAr, J=8.5, J=1.6), 7.68 (с, 1Н, CHAr), 7.89 (д, 1Н, CHAr, J=8.0), 7.99 (д, 1Н, CHAr, J=8.0). Найдено: С 55.28, Н 5.29, N 5.20, S 18.21; C24H26N2O5S3, Вычислено: С 55.58, Н 5.05, N 5.40, S 18.55.
Пример 11. Получение 3-трет-бутилоксикарбонил-2-(3-(3,4-дигидрохинолин-1(2Н)-илметил)-4-метоксифенил)-1,3-L-тиазолидин-4-карбоновой кислоты (соединение 3б).
Указанное в названии соединение получается при осуществлении процесса таким же образом, как описано в Примере 10, путем реакции 2-(3-(3,4-дигидрохинолин-1(2H)-илметил)-4-метоксифенил)-1,3-L-тиазолидин-4-карбоновой кислоты с трет-бутилпирокарбонатом. Выход 59%. Т.пл. 96-97.5°С. Спектр ЯМР 1Н, δ, м.д. (J/Гц): 1.06 (уш. с, 5.1Н, Boc); 1.32 (уш. с, 3.9Н, Boc); 1.87-1.97 (м, 2Н, Het-CH2); 2.72 (т, 2Н, Het-CH2, J=6.4); 3.05-3.15 (м, 1H, 5-CHThz); 3.35-3.42 (уш.с, 3Н, 5-CHThz+Het-CH2); 3.83 (с, 3Н, ОМе); 4.34 (с, 2Н, CH2N); 4.49 (уш. с, 0.40Н, 4-CHThz); 4.64 (уш. с, 0.60Н, 4-CHThZ); 5.85 (уш. с, 0.60Н, 2-CHThz) и 6.00 (с, 0.40Н, 2-CHThz); 6.33 (уш. с, 1Н, CHAr); 6.42 (т, 1Н, CHAr, J=7.5); 6.78-6.89 (м, 2Н, CHAr); 6.97 (д, 1Н, CHAr, J=7.5); 7.08 (д, 0.4Н, CHAr, J=2.1); 7.27 (уш. с, 1Н, CHAr); 7.56 (уш. с, 1Н, CHAr); 12.87 (уш. с, 1H, CHAr). Найдено: С 64.60, Н 6.60, N 5.61, S 6.23; C26H32N2O5S, Вычислено: С 64.44, Н 6.66, N 5.78, S 6.62.
Пример 12. Получение 3-трет-бутилоксикарбонил-2-(3-(4-фтор-2-хлорфеноксиметил)-4-метоксифенил)-1,3-L-тиазолидин-4-карбоновой кислоты (соединение 3в).
Указанное в названии соединение получается при осуществлении процесса таким же образом, как описано в Примере 10, путем реакции 2-(3-(4-фтор-2-хлорфеноксиметил)-4-метоксифенил)-1,3-L-тиазолидин-4-карбоновой кислоты с трет-бутилпирокарбонатом. Выход 77%. Т.пл. 66.5-68.0°С. Спектр ЯМР 1Н, δ, м.д. (J/Гц): 1.12 (уш. с, 5.1Н, Boc); 1.35 (уш. с, 3.9Н, Boc); 3.00-3.21 (уш. с, 1Н, 5-CHThz); 3.41-3.48 (м, 1Н, 5-CHThz); 3.81 (с, 3Н, ОМе); 4.56 (уш. с, 0.45Н, 4-CHThz); 4.69 (уш. с, 0.55Н, 4-CHThz); 5.06 (с, 1Н, СН2О); 5.93 (уш. с, 0.55Н, 2-CHThz) и 6.09 (с, 0.45Н, 2-CHThz); 7.03 (д, 1Н, CHAr, J=9.1); 7.15 (т.д, 1H, CHAr, J=8.6, J=3.1); 7.23-7.28 (м, 1H, CHAr), 7.42 (д.д, 1Н, CHAr, J=8.6, J=3.1); 7.61 (д, 1H, CHAr, J=2.2); 7.70 (д.д, 1Н, CHAr, J=8.6, J=2.2); 12.96 (уш. с, 1Н, СООН). Найдено: С 55.35, Н 5.19, N 2.82, S 6.33; C23H25ClFNO6S, Вычислено: С 55.48, Н 5.06, N 2.81, S 6.44.
Биологическая активность предлагаемых соединений продемонстрирована в экспериментах in vitro на клеточных линиях с помощью МТТ-теста.
Пример 13. Исследование цитотоксичности in vitro.
Биологическая активность соединений настоящего изобретения продемонстрирована экспериментах in vitro на клеточных линиях с помощью МТТ-теста.
МТТ-тест основан на восстановлении желтой соли тетразолия (3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия бромид, МТТ) митохондриальными и цитоплазматическими дегидрогеназами живых метаболически активных клеток с образованием голубых кристаллов формазана. Количество полученного в результате этой реакции формазана зависит от числа клеток и их жизнеспособности и определяется фотометрически по уровню оптической плотности раствора.
Исследование in vitro проводили на клеточных линиях: рака молочной железы MCF-7, HL60, карциномы простаты человека LNCap, LNCap-LN3, РС-3, DU-145 и лейкемии Jurcat.
Клеточные линии культивировали в среде RPMI-1640, содержащей 10% телячьей эмбриональной сыворотки, 10 мМ HEPES (Sigma, США), 2 мМ L-глутамина (Sigma, США), 40 нг/мл гентамицина (ICN, США), 0,1% 1000x раствора аминокислот и 0,1% 1000x раствора витаминов (ПанЭко, Россия), при 37°С в атмосфере 5% СО2. Клетки поддерживали в логарифмической фазе роста постоянным пересевом культуры через 3-4 дня.
Для открепления клеток с пластика использовали раствор Версена. Клетки отмывались чистой бессывороточной средой RPMI-1640 и пересаживались в 96-луночные плоскодонные планшеты по 4×104 клеток в 180 мкл полной среды RPMI-1640 на лунку. Через сутки в лунки с клетками добавляли по 20 мкл водного раствора испытуемого соединения в различных концентрациях. Все эксперименты повторяли не менее чем 3 раза для каждой концентрации. Исследуемые вещества предварительно растворяли в ДМСО до получения концентрации 1×10-2 М, для последующего разведения веществ использовалась бессывороточная культуральная среда.
Планшеты с клетками помещали в СО2-инкубатор в атмосфере 5% CO2, 100% влажности и при температуре 37°С. В качестве контроля использовали лунки с клетками, в которые добавляли 20 мкл воды или 2 мкл диметилсульфоксида.
Через 24 или 72 ч в каждую лунку вносили по 20 мкл раствора МТТ [3-(4,5-диметилтиазолин-2)-2,5-дифенилтетразолий бромид] (маточный раствор 5 мг/мл), и инкубировали 4 ч при 37°С в атмосфере 5% СО2, 100% влажности.
После образования формазана планшеты с клетками центрифугировали, надосадочную жидкость аккуратно удаляли. Осадок растворяли, добавляя в лунки по 150 мкл диметилсульфоксида. Планшеты помещали на 5-7 минут в термостат при температуре 37°С. Далее, планшеты встряхивали на шейкере, после чего интенсивность окрашивания среды измеряли на фотометрическом анализаторе иммуноферментных реакций «АИФР-01 Униплан» (ЗАО «Пикон») при λ=530 нм. Величина поглощения прямо пропорциональна числу живых клеток.
В таблице 1 приводятся результаты исследований ингибиторноой активности in vitro синтезированных соединений в отношении пролиферации раковых клеток, подтверждающие противоопухолевую эффективность новых соединений
Результаты исследований in vitro противораковой цитотоксичности показали широкую активность производных тиазолидинкарбоновой кислоты в отношении различных типов раковых клеток в концентрации 100 МкМ. Активность N-трет-бутилоксикарбонил-замещенных 2-арил-1,3-тиазолидин-4-карбоновых кислот была значительно выше соответствующих незамещенных 2-арил-1,3-тиазолидин-4-карбоновых кислот.
К изобретению ««2-Арил-1,3-тиазолидин-4-карбоновые кислоты, обладающие противоопухолевой активностью»
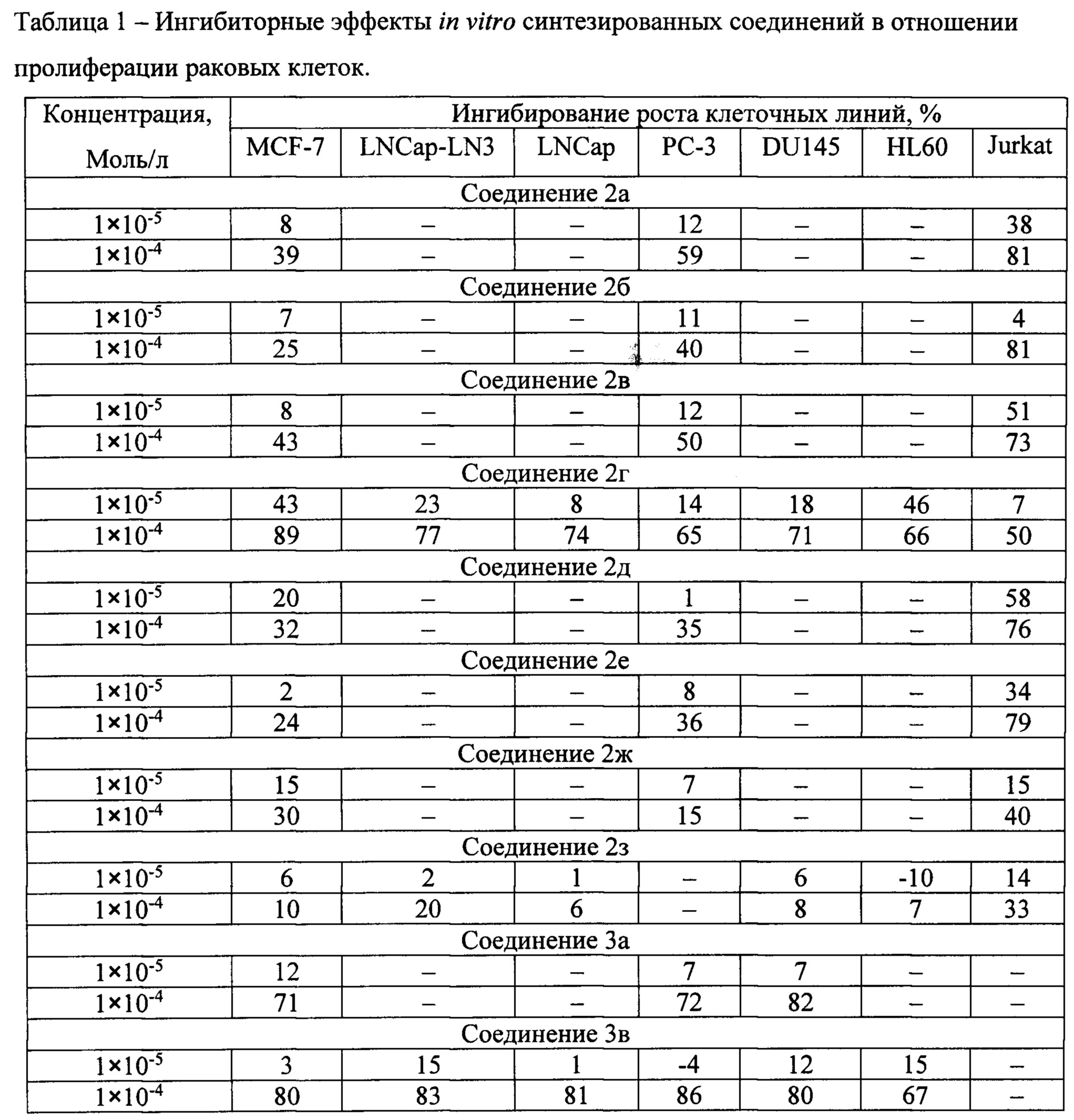

Результаты исследований in vitro противораковой цитотоксичности показали широкую активность производных тиазолидинкарбоновой кислоты в отношении различных типов раковых клеток в концентрации 100 МкМ. Активность N-трет-бутилоксикарбонил-замещенных 2-арил-1,3-тиазолидин-4-карбоновьгх кислот была значительно выше соответствующих незамещенных 2-арил-1,3-тиазолидин-4-карбоновых кислот.