Результат интеллектуальной деятельности: СПОСОБ ВВЕДЕНИЯ ПРОТИВООПУХОЛЕВОГО АГЕНТА
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к усовершенствованным способам введения 4-{[(2R,3S,4R,5S)-4-(4-хлор-2-фторфенил)-3-(3-хлор-2-фторфенил)-4-циано-5-(2,2-диметилпропил)-пирролидин-2-карбонил]-амино}-3-метоксибензойной кислоты (обозначаемой здесь как Соединение A) при лечении рака. В частности, изобретение относится к усовершенствованным способам введения Соединения A, которые обеспечивают желаемый антинеопластический эффект при удовлетворительном уровне токсичности. Способы по изобретению отличаются менее частым введением доз, включающих относительно высокие концентрации Соединения А. Данный режим, как ожидается, более безопасен и по крайней мере так же эффективен (возможно, и более эффективен), как и введение более частых доз в меньших концентрациях или более высоких доз в промежуточные периоды.
Настоящее изобретение также относится к фармацевтическому продукту, включающему в качестве активного ингредиента Соединение A, отличающемуся тем, что указанное Соединение A вводят в соответствии с вышеупомянутым усовершенствованным протоколом.
Предшествующий уровень техники
Соединение A представляет собой перорально вводимый пирролидин, который ингибирует связывание MDM2 с p53 и, таким образом, применим в лечении рака. Он имеет следующую химическую структуру:
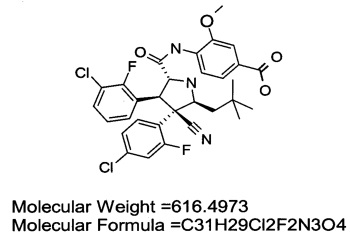
Молекулярная масса = 616,4973
Молекулярная формула (брутто-формула) = C31H29Cl2F2N3O4
Соединение A недавно поступило на I фазу клинических испытаний для лечения солидных опухолей. См. сайт ClinicalTrials.gov, идентификатор NCT01462175. Данное соединение раскрыто в публикации патентной заявки США №2010/0152190 A1. В той мере, в которой это необходимо, данная патентная публикация включена в настоящее описание посредством ссылки. Соединение A, также как и способы его изготовления, также раскрыто в WO 2011/098398.
Заявители обнаружили, что Соединение A в терапии рака особенно эффективно и наилучшим образом переносимо, если его вводят в специальных дозах и в соответствии со специальными протоколами, описанными здесь.
Краткое описание изобретения
Настоящее изобретение относится к способу лечения пациента, страдающего раком, в частности раком толстого кишечника, раком молочной железы, раком предстательной железы, раком легкого или почки, или остеосаркомой, включающему введение пациенту Соединения А в количестве от примерно 800 до примерно 3000 мг/сутки, или от примерно 1000 до примерно 2500 мг/сутки, или от примерно 1250 до примерно 1800 мг/сутки, в течение периода применения до примерно 7 дней, предпочтительно, до примерно 5 дней, в дни 1-7, или, предпочтительно, в дни 1-5 28-дневного цикла лечения, с последующим перерывом от примерно 21 до примерно 23 дней, предпочтительно, до примерно 23 дней.
Настоящее изобретение также относится к фармацевтическому продукту, включающему Соединение A в качестве активного ингредиента, отличающемуся введением указанного Соединения А в вышеуказанных количествах и дозах.
Краткое описание Фигур
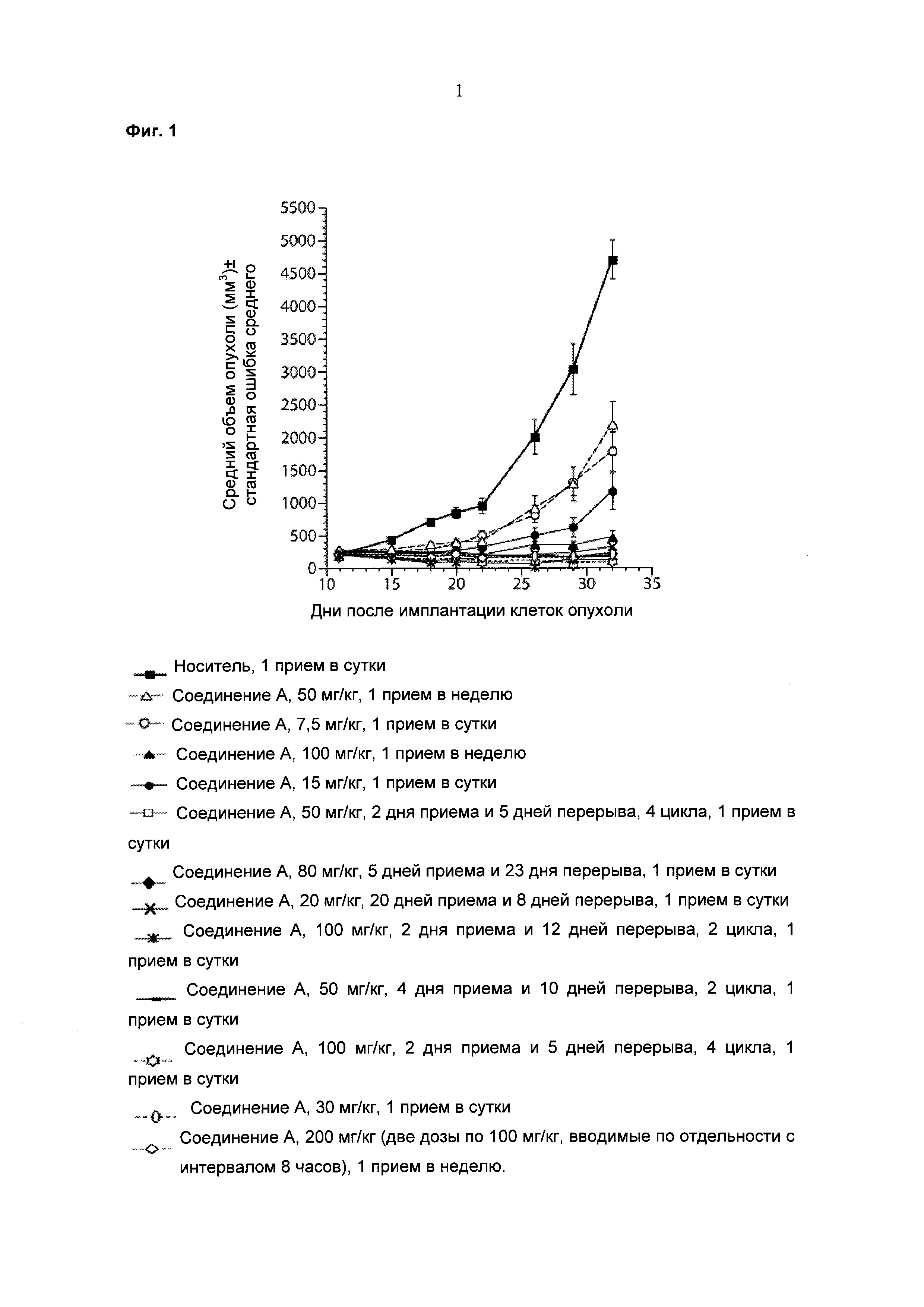
Фигура 1 иллюстрирует противоопухолевую активность, как она отражена через изменение среднего объема опухоли в динамике при монотерапии Соединением А для множества различных режимов дозирования, включая непрерывный 5-дневный режим дозирования.
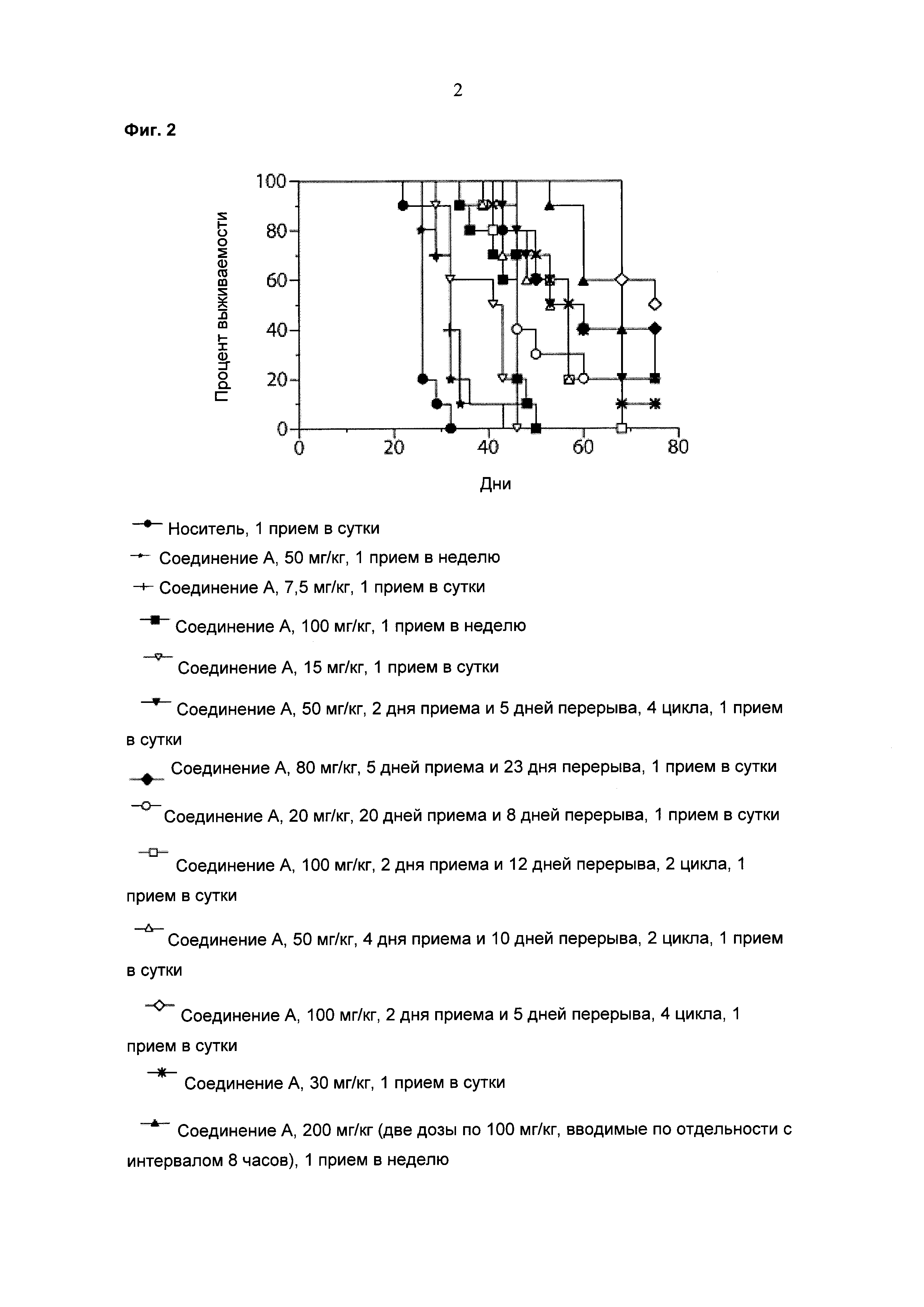
Фигура 2 показывает увеличившуюся продолжительность жизни мышей, получавших лечение Соединением А в различных режимах дозирования, также отраженных на Фигуре 1.
Подробное описание изобретения
"Контроль над опухолью" означает, что перпендикулярные диаметры поражения, поддающегося измерению, не увеличились на 25% или больше по сравнению с последним измерением. См., например, Руководство Всемирной организации здравоохранения (ВОЗ) по сообщению результатов лечения рака (Женева, 1979). Установление контроля над опухолью или ее уменьшения (также обозначаемого как "регресс") выполняется известными способами, например оценкой симптомов пациента, физическими методами исследования (объективное обследование), рентгеновским, магнитно-резонансно томографическим или компьютерно-аксиально томографическим сканированием или другими общепринятыми методами анализа.
В одном варианте осуществления изобретения настоящее изобретение относится к фармацевтическому продукту, включающему, в качестве активного ингредиента, Соединение A в количестве от примерно 800 до примерно 3000 мг/сутки, или от примерно 1000 до примерно 2500 мг/сутки, или от примерно 1250 до примерно 1800 мг/сутки, в течение периода применения до примерно 7 дней, предпочтительно, до примерно 5 дней, в дни 1-7, или, предпочтительно, в дни 1-5 28-дневного цикла лечения, с последующим перерывом от примерно 21 до примерно 23 дней, предпочтительно, до примерно 23 дней. Курс предпочтительного цикла составляет примерно 28 дней, хотя предполагаются циклы любой продолжительности от примерно 14 до примерно 28 дней. Этот цикл лечения повторяется так долго, как опухоль остается под контролем и режим хорошо клинически переносится. Цикл лечения может, например, повторяться до 12 раз.
В другом варианте осуществления изобретения настоящее изобретение относится к способу лечения пациента, страдающего раком, в частности раком толстого кишечника, раком груди, раком предстательной железы или раком почки, также как и остеосаркомой или саркомой тканей, включающему введение пациенту Соединения А в количестве от примерно 800 до примерно 3000 мг/сутки, или от примерно 1000 до примерно 2500 мг/сутки, или от примерно 1250 до примерно 1800 мг/сутки, в течение периода введения до примерно 7 дней, предпочтительно, до примерно 5 дней, в дни 1-7, или, предпочтительно, в дни 1-5 28-дневного цикла лечения, с последующим периодом перерыва от примерно 21 до примерно 23 дней, предпочтительно, до примерно 23 дней. Курс предпочтительного цикла составляет примерно 28 дней, хотя предполагаются циклы любой продолжительности от примерно 14 до примерно 28 дней. Этот цикл лечения повторяется так долго, как опухоль остается под контролем и режим хорошо переносится клинически.
Дозирование Соединения А может быть осуществлено как в виде дозы, адаптированной к площади поверхности тела ("ППТ") (мг/м2/сутки), так и в виде последующей постоянной дозы (мг/сутки). Соединение A может вводиться в виде одной дозы в сутки или может быть разделено на многократные дозы, вводимые в течение суток.
Измерение поверхности тела пациента в квадратных метрах ("м2") в типичном случае варьирует от примерно 1,4 м2 до примерно 2,2 м2. Таким образом, общее количество Соединения A (в мг), которое должно быть доставлено в ходе цикла лечения, с использованием адаптированной дозы, учитывающей ППТ, может быть вычислено следующим образом:
[Интенсивность дозы (мг/м2/неделю)]×[ППТ (м2)]×[количество недель цикла лечения]
В варианте осуществления изобретения настоящий продукт или способ отличается тем, что Соединение A вводят ежедневно в течение примерно 5 дней, в дни 1-5 цикла лечения, с последующим перерывом 23 дня ("5+/23-"). Схема лечения "5+/23-", как ожидается, превосходит промежуточные схемы лечения или более продолжительные схемы лечения, т.к. продолжающиеся в настоящее время исследования Фазы I показывают, что в солидных опухолях максимальный апоптоз происходит только после примерно 48 часов непрерывного воздействия, и воздействие и более длительные режимы, по-видимому, приводят к возникновению отсроченной тромбоцитопении ("ТЦП"). Таким образом, 3-5-дневная схема лечения, как ожидается, обеспечивает наилучшее отношение "риск : польза".
В определенных вариантах осуществления изобретения настоящий продукт или способ отличается тем, что Соединение A вводят ежедневно, либо один, либо два раза в сутки, предпочтительно, один раз в сутки. Соединение вводят пациенту в пероральной разовой дозированной форме, предпочтительно, в форме таблетки.
Предпочтительно, 5-дневная схема лечения повторяется каждые двадцать восемь дней, или как только восстановление после токсического действия делает возможным такое повторение, пока опухоль находится под контролем или регрессирует, а пациент хорошо переносит режим лечения. Предпочтительно, эти циклы лечения повторяются так, что их общее число составляет до 12 циклов.
В варианте осуществления изобретения настоящий продукт или способ отличается тем, что Соединение A вводят ежедневно в количестве от примерно 800 до примерно 3000 мг/сутки в течение периода до примерно 5 дней, в дни 1-5 28-дневного цикла.
В другом варианте осуществления изобретения настоящий продукт или способ отличается тем, что Соединение A вводят ежедневно в количестве от примерно 1000 до примерно 2500 мг/сутки в течение периода до примерно 5 дней, в дни 1-5 28-дневного цикла.
В другом варианте осуществления изобретения настоящий продукт или способ отличается тем, что Соединение A вводят ежедневно в количестве от примерно 1250 до примерно 1800 мг/сутки в течение периода до примерно 5 дней, в дни 1-5 28-дневного цикла.
В еще одном другом варианте осуществления изобретения настоящий продукт или способ отличается тем, что Соединение A вводят в соответствии с дозировками и режимами, раскрытыми в Таблице 1 Примера 1 ниже, каждый режим в которой (например, №№2-13 в Таблице 1/Примере 1) образует отдельное воплощение в соответствии с настоящим изобретением.
В еще одном другом варианте осуществления изобретения предлагается фармацевтический продукт, как он определен выше, для лечения рака, конкретно для лечения солидных опухолей, более конкретно, для лечения рака толстого кишечника, рака груди, рака предстательной железы или рака почки, так же как и для лечения остеосаркомы или саркомы тканей.
Настоящее изобретение может быть подтверждено примерами контролируемых доклинических испытаний на животных, как показано в Примерах ниже, которые иллюстрируют изобретение без ограничений.
Примеры
Более высокая эффективность 5-дневного режима по настоящему изобретению в лечении солидных опухолей демонстрируется следующими экспериментами.
Сокращения, использованные здесь, представляют собой следующее:
|
Токсичность
В нижеприведенных примерах потеря массы тела графически представлена как процент изменения средней величины массы тела в группе, определяемый с использованием формулы: ((W-W0)/W0)×100, где 'W' представляет собой среднюю массу тела в группе, подвергающейся лечению, в конкретный день, а 'W0' представляет собой среднюю массу тела в той же самой группе, подвергающейся лечению, в начале лечения. Максимальная потеря массы тела также была выражена с использованием вышеуказанной формулы и показывала максимальный процент потери массы тела, наблюдавшийся в какое-либо время в ходе всего эксперимента в конкретной группе. Токсичность определялась как процент мышей, равный или превышающий 20%, демонстрировавших потерю массы тела, равную или превышающую 20%, или смерть.
Ингибирование роста опухоли (ИРО) и анализ выживаемости/увеличения продолжительности жизни (УПЖ)
Данные об эффективности были графически представлены как средний объем опухоли ± стандартная ошибка среднего (SEM). В дополнение к этому объемы опухоли в группах, подвергавшихся лечению, были представлены в процентах от объема опухолей в контрольных группах (% Т/С), с использованием формулы: 100×((T-T0)/(C-C0)), где T представляет собой средний объем опухоли в группе, подвергавшейся лечению, в определенный день в ходе эксперимента, T0 представляет собой средний объем опухоли в той же группе, подвергавшейся лечению, в первый день лечения; С представляет собой средний объем опухоли в контрольной группе в определенный день в ходе эксперимента, и C0 представляет собой средний объем опухоли в той же группе, подвергавшейся лечению, в первый день эксперимента.
Объем опухоли (в мм3) вычисляли с использованием формулы эллипсоида: (D×(d2))/2, где "D" представляет собой больший диаметр опухоли, а "d" представляет собой меньший диаметр. В некоторых случаях регресс опухоли и/или процент изменения объема опухоли вычислялись с использованием формулы: ((T-T0)/T0)×100, где 'T' представляет собой средний объем опухоли в группе, подвергающейся лечению, в конкретный день, а 'T0' представляет собой средний объем опухоли в той же группе, подвергающейся лечению, в начале лечения.
Статистический анализ был определен с помощью рангового критерия, однофакторного дисперсионного анализа и апостериорного t-критерия Бонферрони (SigmaStat, версия 2.0, Jandel Scientific, Сан-Франциско, Канзас, США). Различия между группами признавались значимыми, если значение вероятности (p) не превышало 0,05.
Для анализа выживаемости вычисляли процент увеличившейся продолжительности жизни как 100×[(средний день выживания в группе, подвергающейся лечению - средний день выживания в контрольной группе)/средний день выживания в контрольной группе]. Среднюю выживаемость определяли с использованием анализа выживаемости по Каплану-Мейеру. Выживаемость в группах, подвергавшихся лечению, статистически сравнивали с группой, получавшей носитель, а сравнения выживаемости между группами осуществляли с использованием логарифмического рангового критерия (Graph Pad Prism, Ла Йолла, Канзас, США). Различия между группами признавались значимыми, если значение вероятности (p) не превышало 0,05.
Пример 1
Оценивали противоопухолевую активность Соединения А на ксенотрансплантатной модели рака (остеосаркомы человека) SJASA1 у иммунокомпрометированных мышей, используя множество различных схем.
Исследуемое соединение А
Соединение A, изготовленное в виде состава порошка преципитата мелкозернистой аморфной твердой дисперсии, содержащего 30% лекарственного вещества и 70% полимера ГПМЦ-АС, ресуспендировали непосредственно перед введением в виде суспензии в смеси Klucel/Tween, и суспензию, остающуюся после введения дозы, выбрасывали. Все дозы охарактеризованы как действительные дозы Соединения А, а не как лекарственное вещество + полимер.
В: Исследования in vivo.
Животные:
Использовали самок бестимусных мышей Crl:NU-Foxn1nu (по 10 мышей в каждой группе), полученных от лабораторий Charles River Laboratories (Вилмингтон, Германия), в возрасте примерно 10-12 недель, весивших 23-25 г. Здоровье мышей исследовали ежедневно с помощью макроскопического наблюдения и анализа образцов крови, взятых у сигнальных животных, размещенных на общедоступных стеллажах. Всем животным позволяли акклиматизироваться и восстановиться после стресса, связанного с транспортировкой, в течение по меньшей мере 72 часов перед использованием в эксперименте. К автоклавированной воде и облученному корму (мышиный сухой корм 5058-ms Pico Lab, производство Пурина Миллс, Ричмонд, Индианаполис) предоставлялся свободный доступ, и животные содержались в 12-часовом цикле смены освещенности и затемнения. Клетки, подстилки и бутыли с водой автоклавировали перед использованием и еженедельно меняли. Все эксперименты на животных осуществляли в соответствии с Руководством по содержанию и использованию лабораторных животных, локальными правилами и протоколами, одобренными Комитетом компании Roche по содержанию и использованию лабораторных животных, аккредитованным в Международной ассоциации по аттестации и аккредитации содержания лабораторных животных.
Опухоли
Клетки SJSA (ATCC) культивировали в среде RPMI 1640 с добавлением 10 объем. % фетальной бычьей сыворотки, инактивированной нагреванием, и 1 объем. % L-глутамина (200 нмоль/л). Каждая мышь получала 5×106 клеток в смеси 1:1 забуференного фосфатным буфером физиологического раствора и Matrigel, общим объемом 0,2 мл. Клетки имплантировали подкожно в правый бок, используя 1 сс шприц и иглу 26 калибра.
Дизайн исследования:
Выбранные для Соединения А дозы и используемые в настоящем исследовании режимы показаны в Таблице 1 ниже.

Лечение
Соединение A вводили перорально (п/о), используя 1 см3 шприц и зонд для внутрижелудочного питания 18 калибра (0,2 мл/животное). Продолжительность лечения составляла 2-4 недели. Даты имплантации опухолей, начала лечения (дата начала исследования) и окончания лечения (дата окончания исследования) можно найти в Таблице 6 ниже. Исходный объем опухоли в этом исследовании составлял примерно 220 мм3. Объемы опухолей и массу тела животных измеряли три раза в неделю, а наличие клинических признаков у животных наблюдали ежедневно.
Результаты данного эксперимента суммированы в Таблицах 1-3 ниже и на Фигурах 1 и 2. Как можно видеть, 5-дневная схема лечения обеспечила наибольший процент увеличения продолжительности жизни (% УПЖ), а также высокий процент ингибирования опухолевого роста (% ИРО) при умеренной токсичности. Фигура 1 также показывает удовлетворительную ингибиторную активность при использовании схемы лечения, предполагающей прием препарата в течение 5 дней с последующим перерывом в течение 23 дней.
 Т
Т
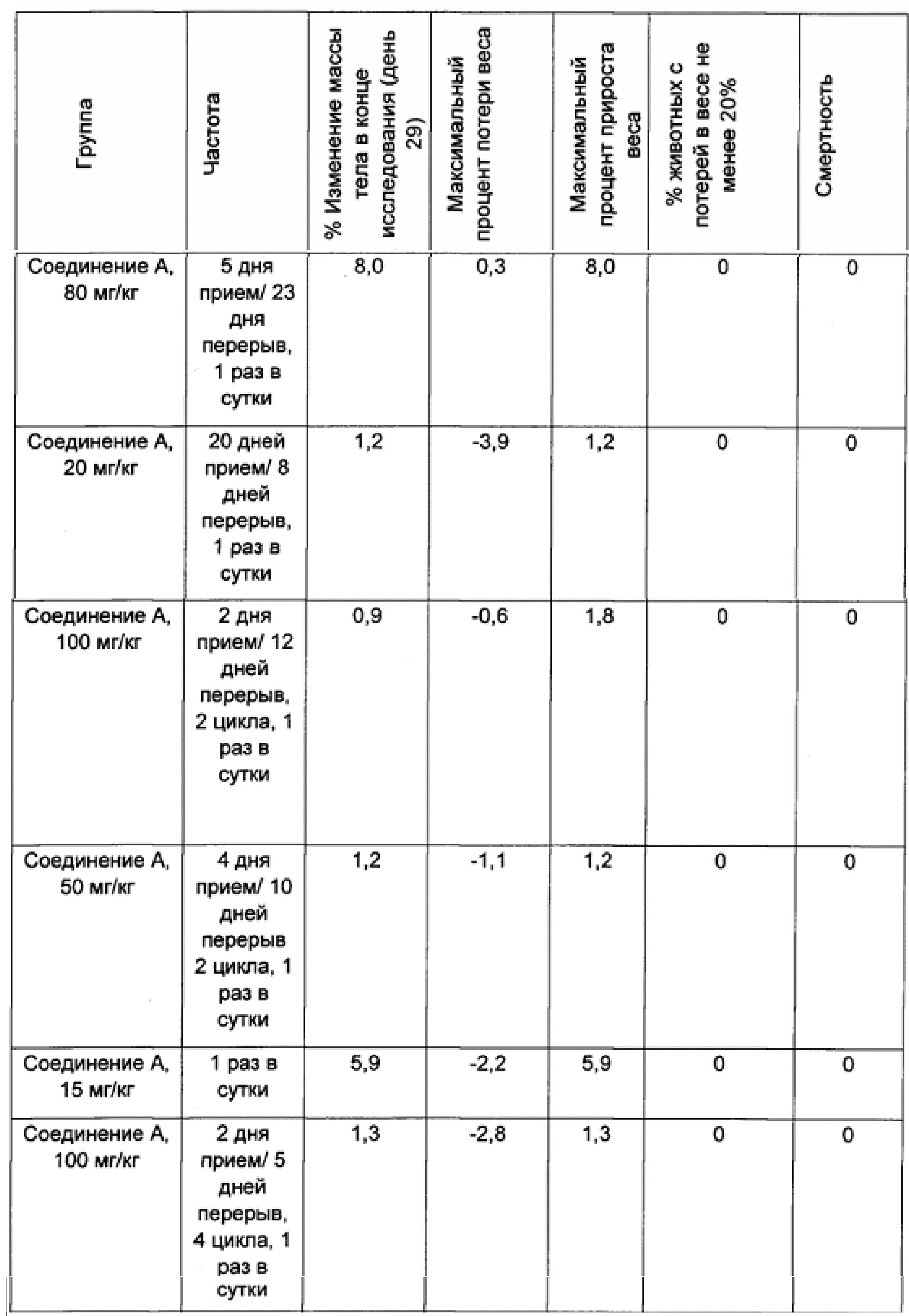
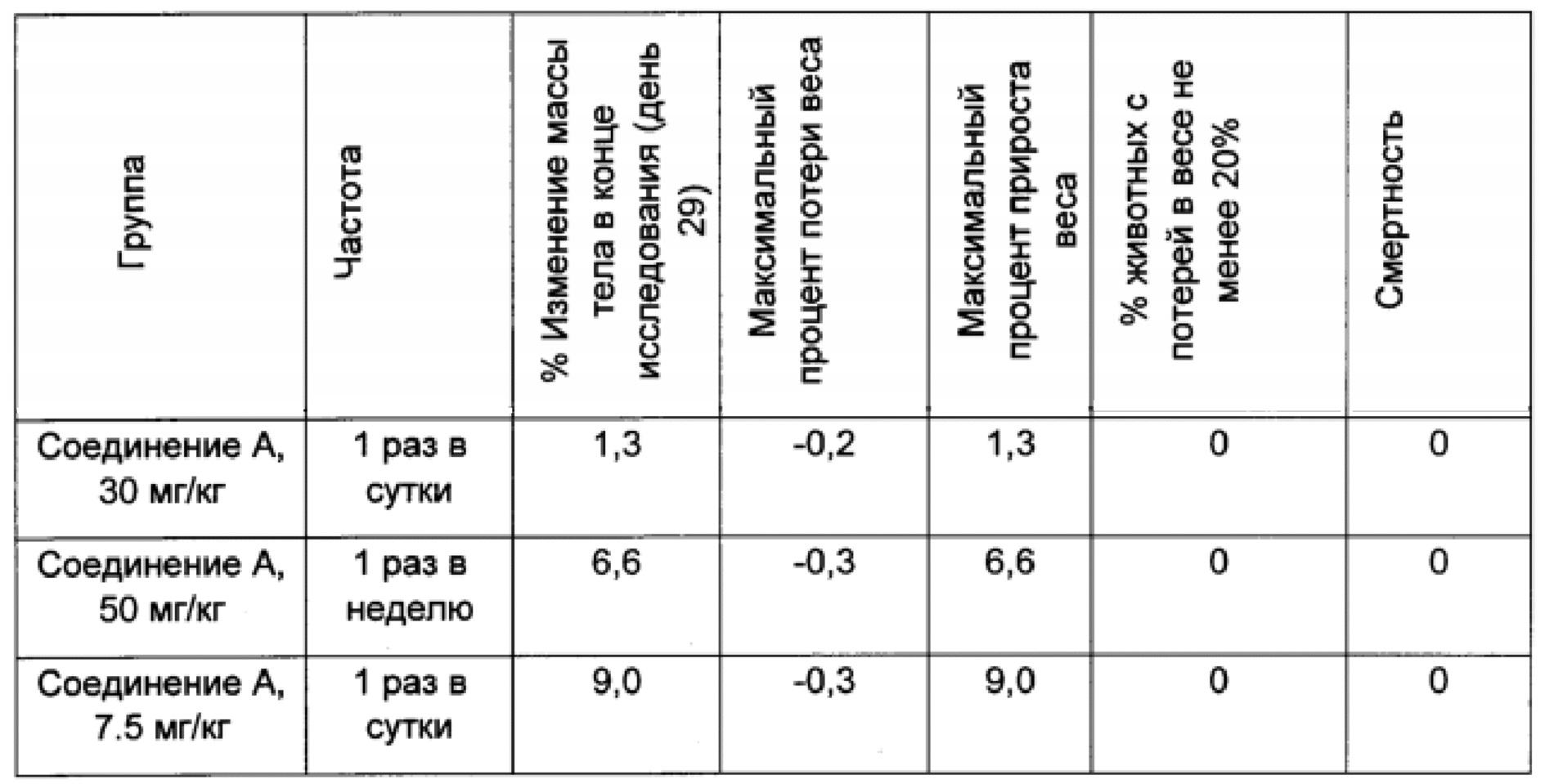

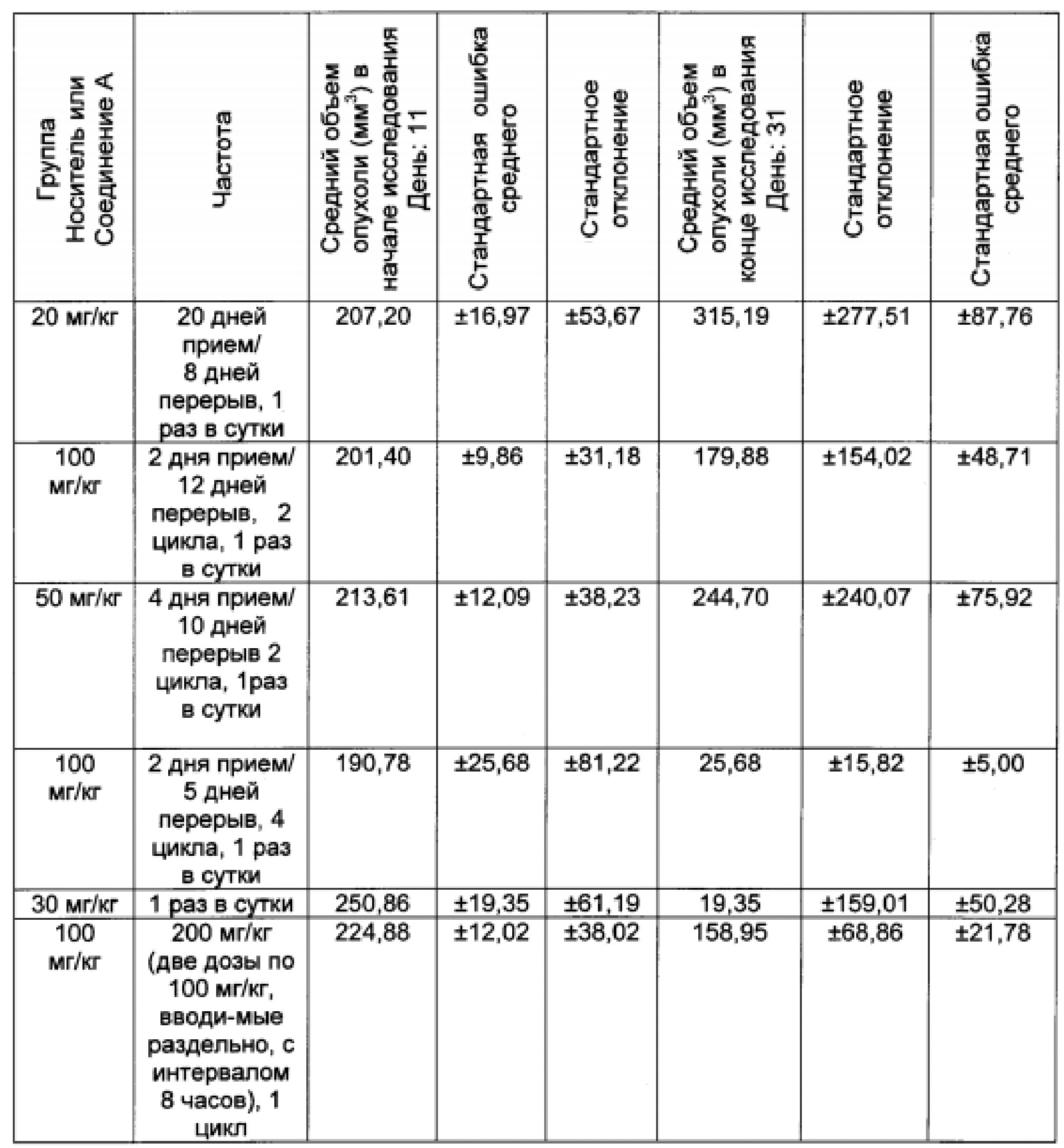
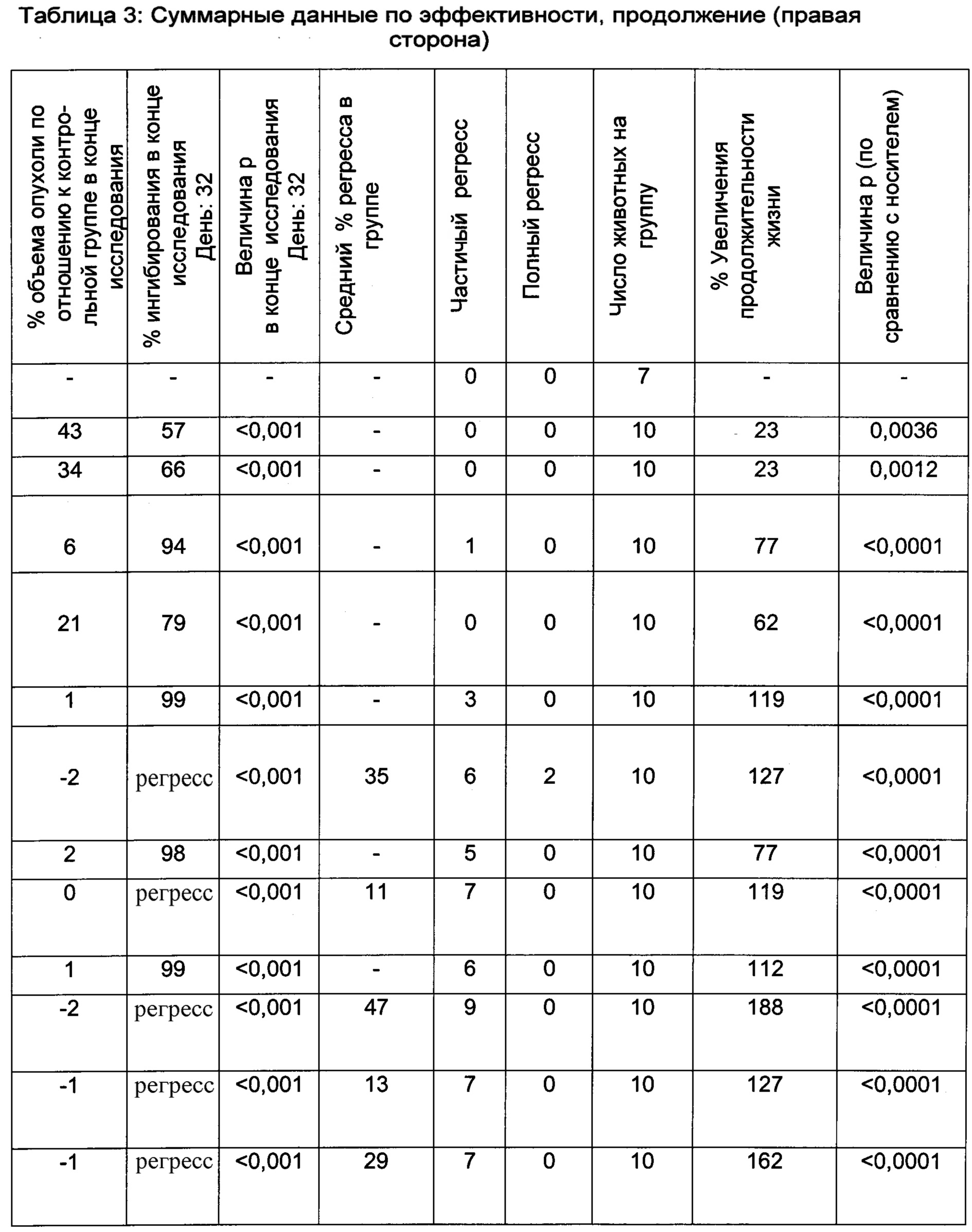
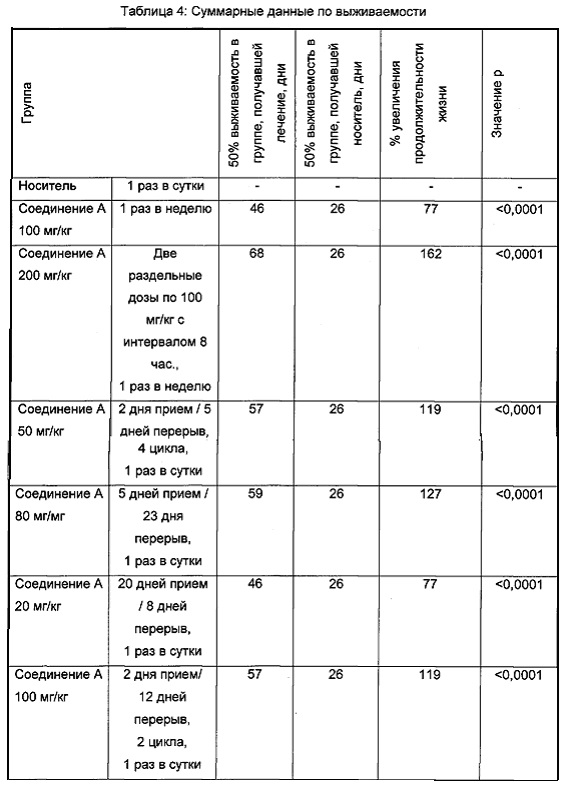
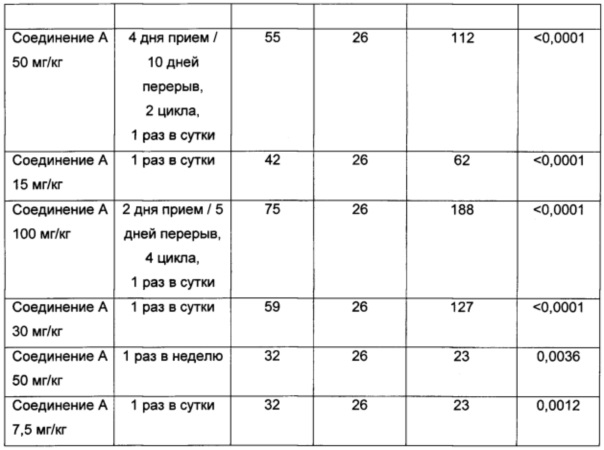
В целом, режим, предусматривающий введение лекарства в течение 5 дней и перерыв в течение 23 дней (5+/23-), как предполагается, уменьшает тромбоцитопению, индуцированную ингибитором MDM2, у людей, переносящих лечение солидных опухолей, при сохранении прежней противоопухолевой эффективности, по сравнению с другими рассматриваемыми режимами.