Результат интеллектуальной деятельности: СИСТЕМА ТРАНСМУКОЗАЛЬНОГО ВВЕДЕНИЯ ФАРМАЦЕВТИЧЕСКОГО ЛЕКАРСТВЕННОГО СРЕДСТВА
Вид РИД
Изобретение
Настоящее изобретение касается системы трансмукозального введения для введения хинонов, бензохинонов и, в особенности, 1,4-бензохинонов через слизистую ротовой полости пациента. Конкретнее, настоящее изобретение касается системы трансмукозального введения 2,3-диметокси-5-метил-6-(10-гидроксидецил)-1,4-бензохинона (идебенона) и его аналогов в виде пленочного препарата (пластинки для перорального введения).
Предшествующий уровень техники
Идебенон представляет собой синтетический аналог коэнзима Q10 (CoQ10), жизненно необходимого антиоксиданта клеточной мембраны и неотъемлемого компонента митохондриальной цепочки переноса электронов (ETC), продуцирующей аденозин-трифосфат (АТФ). Вплоть до сегодняшнего дня идебенон применяется в различных областях медицины. Аналогично коэнзиму Q10, идебенон подвергается циклам восстановления/окисления в живых организмах, и восстановленный идебенон представляет собой антиоксидант и акцептор свободных радикалов (A. Mordente, G.Е. Martorana, G. Minotti, В. Giardina, Chem. Res. Toxicol. 11 (1998), 54-63). Известно, что идебенон защищает клеточные мембраны и митохондрии от окислительного разрушения благодаря своей способности подавлять перекисное окисление липидов (М. Suno, М. Shibota, A. Nagaoka, Arch. Gerontol. Geriatr. 8 (1989), 307-311). Идебенон также взаимодействует с ETC, защищая синтез АТФ в ишемических состояниях. Было показано, что данное соединение стимулирует фактор роста нервов, и это свойство может оказаться важным для лечения болезни Альцгеймера и других нейродегенеративных заболеваний (К. Yamada, A. Nitta, Т. Hasegawa, К. Fuji, М. Hiramatsu, Т. Kameyama, Y. Furukawa, К. Hayashi, Т. Nabeshima, Behav. Brain Res. 83 (1997), 117-122). Данное соединение также предлагалось для лечения наследственной атаксии Фридрейха и других митохондриальных и нервно-мышечных заболеваний (А. О. Hausse, Y. Aggoun, D. Bonnet, D. Sidi, A. Munnich, A. Rotig, P. Rustin, Heart 87 (2002), 346-349; Di Prospero N.A., Baker A., Jeffries N, Fischbeck K.H. Lancet Neurol 6 (2007) 878-886).
Будучи липофильным соединением, идебенон хорошо всасывается в желудочно-кишечном тракте после обычного перорального введения, которое является нормальным путем введения данного соединения. Такие дозированные формы как таблетки или капсулы широко применяются в клинических испытаниях и в имеющихся на рынке продуктах. В ходе исследований фармакологического профиля идебенона, авторы настоящего изобретения обнаружили, что данное соединение после всасывания в кишечнике очень быстро метаболизируется при первом прохождении через печень («эффект первого прохода»). Эксперименты показали, что более 98% идебенона метаболизируется при первом прохождении через печень. Метаболизм идебенона в печени происходит через окисление боковой цепи, восстановление хиноного цикла, конъюгацию с сульфатом и глюкуронидом и последующую экскрецию через почки. Высокая метаболизация в печени сильно снижает потенциальные концентрации фармакологически активного идебенона в крови. Из-за сильного метаболизма при первом прохождении пероральное введение идебенона требует высоких дозировок данного соединения для достижения фармакологически эффективной концентрации в крови в живом организме. Такие высокие дозировки могут привести к нежелательным побочным эффектам, таким как диарея.
Кроме того, требование проглатывания препаратов идебенона для перорального применения создает трудности при практическом введении пациентам, имеющим проблемы с глотанием, например пациенту с серьезным нервно-мышечным заболеванием, таким как миодистрофия Дюшена или наследственная атаксия Фридрейха, престарелым или юным пациентам.
Краткое описание предпочтительных вариантов осуществления настоящего изобретения
В настоящем изобретении представлено решение указанной проблемы, которое основано на данных, полученных для особого типа системы трансмукозального введения, состоящей из особо тонкой полимерной пленки, которая при присоединении к слизистой ротовой полости высвобождает действующее вещество напрямую в слизистую или частично в слюну в ротовой полости, пищевод и желудок. Действующее вещество всасывается через слизистую, главным образом в ротовой полости, пищеводе и желудке, таким образом избегая метаболизма при первом прохождении, наблюдаемого при обычном пероральном введении и всасывании в желудочно-кишечном тракте. Такую дозированную форму называют также пластинкой для перорального введения.
Принцип работы этой системы может использоваться также в отношении аналогов идебенона, таких как другие бензохиноны или хиноны, имеющих обратимо восстанавливающийся хиноновый цикл с липофильной боковой цепью. Термин "аналоги убихинона", при использовании в настоящем тексте, охватывает природные убихиноны (коэнзим Q-n), а также их структурные аналоги, имеющие хиноновый цикл с липофильной боковой цепью, например идебенон или децилубихинон.
Поставленная цель была достигнута посредством использования предпочтительно тонкого пленочного препарата (пластинка для перорального введения), содержащего, в особенности, идебенон. Было неожиданно обнаружено (см. Фиг.), что концентрация идебенона в крови после введения через слизистую оболочку ротовой полости пластинки А (содержащей 30 мг), пластинки В (содержащей 15 мг в виде твердого раствора) значительно выше, по сравнению с пероральным введением (300 мг/кг в виде микроэмульсии) таким же подопытным собакам (гончим) (n=3).
Краткое описание чертежей
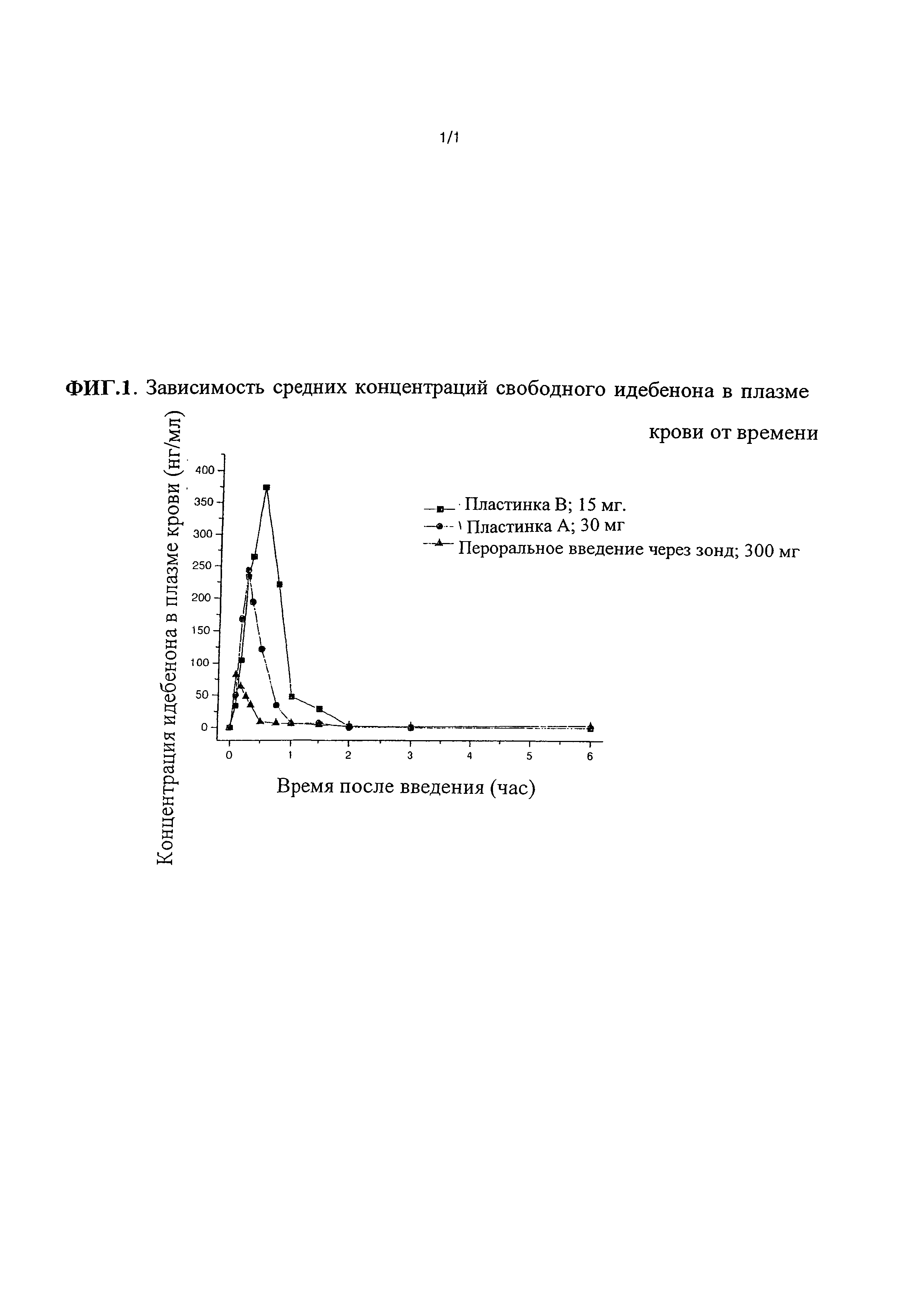
Фиг. 1 представляет собой графическую иллюстрацию средних концентраций свободного идебенона в плазме крови в зависимости от времени после однократного введения различных иллюстративных препаратов (пероральных и тонкопленочных) самкам собак.
Подробное описание предпочтительных вариантов осуществления настоящего изобретения
Настоящее изобретение касается препарата для введения через слизистую ротовой полости, который содержит эффективное количество действующего вещества общей структурной формулы (I), в которой R1 представляет собой низшую алкильную группу; R2 представляет собой атом водорода или алкильную или алкенильную группу, которая может быть замещенной; R3 и R4 каждый независимо представляют собой низшую алкильную или низшую алкоксигруппу, или они вместе представляют собой бутадиениленовую группу.

В представленной выше общей формуле (I), низшая алкильная группа R1 представляет собой низшую алкильную группу, содержащую 1-4 атома углерода, такую как метил, этил, пропил, бутил и т.п. Алкильный фрагмент незамещенной или замещенной алкильной группы R2 включает ациклические углеводородные остатки, содержащие 1-22 атомов углерода, такие как метил, этил, пропил, бутил, пентил, гексил, гептил, октил, нонил, децил, ундецил, додецил, тридецил, пентадецил, гептадецил, эйкозил, докозил и т.п. Предпочтительным среди них является алкил, содержащий 8-13 атомов углерода. Алкенильный фрагмент незамещенной или замещенной алкенильной группы R2 включает ациклические углеводородные остатки, содержащие 2-15 атомов углерода, такие как этенил, 1-пропенил, 3-метил-2-бутенил, 3,7-диметил-2,6-октадиенил и т.д., в которых число двойных связей может обычно составлять от 1 до 3, и данные двойные связи могут быть сопряженными. Примеры заместителей в алкильных и алкенильных группах R2 включают гидрокси, карбокси, алкоксикарбонил (например, С1-4 алкоксикарбонильные группы, такие как метоксикарбонил, этоксикарбонил, пропионилоксикарбонил, бутоксикарбонил и т.д.), арил (например, фенил, 1-нафтил, 2-нафтил, инданил и т.д.), гетероциклические группы (например, 2-пиридил, 3-пиридил, 2-тиенил, 3-тиенил и т.д.) и галоген (например, фтор, хлор, бром и иод). Когда группа-заместитель представляет собой арильную группу или гетероциклическую группу, данная группа может иметь в кольце один или более заместителей в возможных положениях циклической структуры. Указанные выше заместители включают (но не ограничиваются только ими) незамещенные С1-4 алкильные группы (например, метил, этил, пропил, бутил и т.д.), гидрокси, карбокси и С2-5 алкоксикарбонил (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил и т.д.). Положение заместителей в алкильной или алкенильной группе R2 опциональное, но предпочтительно положение 1 или положение омега. Низшая алкильная группа, представленная R3 и R4, может представлять собой С1-6 алкильную группу, такую как метил, этил, пропил, изо-пропил, бутил, изо-бутил, втор-бутил, трет-бутил, амил, гексил и т.д., и предпочтительно С1-3 алкильную группу. Данные низшие алкильные группы могут иметь заместители, такие как гидрокси, галоген (фтор, хлор, бром и иод), нитро, трифторметил, карбокси, С2-5 алкоксикарбонил (например, метоксикарбонил, этоксикарбонил и т.д.), 3-пиридил, 1-имидазолил, 5-тиазолил и т.п. Низшая алкоксигруппа, представленная R3 и R4, может представлять собой С1-3 алкоксигруппу, такую как метокси, этокси, пропокси, изо-пропокси и т.п. Когда R3 и R4 представляют собой бутадиениленовую группу, они составляют бензольное кольцо вместе с атомами углерода, к которым присоединены соответственно R3 и R4, и построенное таким образом бензольное кольцо может иметь 1-3 группы-заместителя в опциональных положениях, и такие группы-заместители включают, среди прочих, низшие (C1-3) алкильные группы (например, метил, этил, пропил и т.д.), низшие (C1-3) алкокси-группы (например, метокси, этокси, пропокси и т.д.), гидрокси, нитро и галоген.
Настоящее изобретение касается также применения хинона или бензохинона, в особенности идебенона (международное непатентованное название (INN): идебенон; химическое название: 2-(10-гидроксидецил)-5,6-диметокси-3-метил-2,5-циклогексадиен-1,4-дион; CAS-номер: 58186-27-9) и его аналогов для приготовления предпочтительно тонкого пленочного препарата, который при присоединении к слизистой оболочке ротовой полости высвобождает действующее вещество напрямую в слизистую или частично в слюну в ротовой полости (называемого также пластинкой для перорального введения) и применяется для трансмукозального введения человеку или животным. Такой тип системы обеспечивает намного более высокие концентрации соединения по сравнению с пероральным введением. Далее описана предпочтительная система трансмукозального введения фармацевтического действующего вещества, представляющая собой препараты в виде тонкой пленки (пластинка для перорального введения), содержащие действующее вещество идебенон вместе с добавками и наполнителями, в связке с соответствующим процессом производства данного типа препаратов.
Идебенон имеет следующую химическую структурную формулу (II):

2,3-диметокси-5-метил-6-(10-гидроксидецил)-1,4-бензохинон, идебенон.
Идебенон, представитель семейства хинонов, коммерчески продвигался как синтетический аналог Коэнзима Q10, и было показано, что он может применяться для лечения ряда заболеваний и/или состояний. Кроме того, предметом различных медицинских исследований было изучение его эффективности в лечении, например, нервно-мышечных заболеваний, таких как наследственная атаксия Фридрейха или неврологических заболеваний, таких как болезнь Альцгеймера. Идебенон использовался также в препаратах для наружного применения для лечения морщин. Таким образом, идебенон можно считать токсикологически безопасным, что означает - он может применяться в качестве фармацевтически активного ингредиента в лекарственных средствах. Токсикологическая безопасность идебенона была подтверждена в ходе клинического исследования на 536 пациентах, которым давали 360 мг идебенона три раза в день. По сравнению с контрольной группой на плацебо, не было обнаружено никаких побочных эффектов от введения, за исключением некоторого желудочно-кишечного раздражения, а также небольшого повышения числа ортопедических жалоб (L.J. Thai, М. Grundman, J. Berg, К. Emstrom, R. Margolin, E. Pfeiffer, M.F. Weiner, E. Zamrini, R.G. Thomas, Neurology 61 (2003), 1498-1502).
Наблюдалось, что после обычного перорального введения и всасывания в кишечнике идебенон быстро метаболизируется во время первого прохождения через печень. Главными метаболитами являются конъюгаты идебенона, такие как глюкуронаты и сульфаты, а также их производные, в которых боковая цепь материнского соединения окислена. Метаболиты идебенона не обладают заметной фармакологической активностью и быстро выводятся из организма. Из-за интенсивного метаболизма во время первого прохождения, пероральное введение идебенона требует высоких дозировок для достижения концентрации в крови, оказывающей фармакологический эффект. Такие высокие дозировки приводят к нежелательным побочным эффектам, таким как диарея и нарушения работы желудочно-кишечного тракта (ЖКТ), часто наблюдаемым при клиническом применении.
При использовании предпочтительного тонкого пленочного препарата (пластинка для перорального введения) было неожиданно обнаружено, что даже при 20-кратно меньшей дозировке, по сравнению с методом перорального введения, можно достичь более чем 5-кратного значения AUC (площадь под кривой), что при дозонормализованном уровне, дает >100-кратное значение AUC (см. Таблицу 4). Кроме того, это открывает возможности достижения концентраций фармакологически активной молекулы в крови, которые намного превышают значения, достигаемые при пероральном пути введения.
Посредством применения такой системы и трансмукозального пути введения, можно эффективно избежать интенсивного метаболизма при первом прохождении, наблюдаемого после обычного перорального введения идебенона.
Обход интенсивного метаболизма идебенона при первом прохождении посредством применения тонкопленочного препарата (пластинки для перорального введения) позволяет:
a) достичь одинаково высоких концентраций данного действующего вещества в плазме крови, при этом значительно снижая вводимую дозу препарата. В целом считается, что меньшее количество действующего вещества дает меньший риск нежелательных побочных эффектов и обуславливает преимущество в медицинском плане, связанное с повышением согласия пациента. В конкретном случае с идебеноном, можно избежать описанных выше побочных эффектов в ЖКТ.
b) достичь значительно более высоких концентраций в плазме крови, по сравнению со значениями, достижимыми при пероральном введении препаратов действующего вещества, всасываемых в желудочно-кишечном тракте. Это может привести к расширению применения идебенона для дополнительных новых показаний в области нервно-мышечных заболеваний, которые требуют высоких концентраций, например, для пересечения гемато-энцефалического барьера.
c) достичь более высокого уровня согласия пациента, поскольку пленочный препарат (пластинка для перорального введения) тонкая, легкая в применении, и одна пластинка способна заменить проглатывание нескольких крупных таблеток.
d) вводить тонкий пленочный препарат (пластинку для перорального введения) пациентам с проблемами при глотании, таким как пациенты, страдающие определенными нервно-мышечными заболеваниями, или дети младше 8 лет, что может улучшить согласие пациентов и удобство применения.
В настоящем изобретении термин "тонкие пленочные препараты" или "пластинка для перорального введения" означает препарат, который предназначен для применения и/или введения через слизистую ротовой полости пациента и в котором действующее вещество всасывается в организм через слизистую оболочку. По настоящему изобретению такой препарат составляет основу введения лекарственного препарата, содержащего идебенон, при таком специфическом способе введения. Слизистая ротовой полости включает слизистую оболочку всей ротовой полости и прилегающих полостях, включая (но не ограничиваясь только ими) слизистую подъязычной полости, буккальную слизистую оболочку, слизистую оболочку десен и языка, а также слизистую оболочку пищевода. Система имеет предпочтительно однослойную или двуслойную конструкцию.
Цель настоящего изобретения достигается с помощью системы трансмукозального введения, которая растворяется во рту пациента и которая содержит 0.01-80 вес.%, предпочтительно 2-70 вес.%, по меньшей мере одного хинона и 20-99.99 вес.%, предпочтительно 30-98 вес.%, носителя. Подходящие материалы носителя представляют собой, в частности, целлюлозу и ее производные, такие как метилцеллюлоза, этилцеллюлоза, гидроксипропил-целлюлоза, гидроксиэтилцеллюлоза, гидроксипропилметил-целлюлоза (НРМС), карбоксиметилцеллюлоза (CMC); полиспирты, такие как поливиниловый спирт (PVA); поли-N-винилпирролидоны; винил-пирролидон-винилацетатные сополимеры; крахмал; производные крахмала; желатин; производные желатина; Soluplus (поливинил капролактам-поливинилацетат-полиэтиленгликоль графт-сополимер); Kollicoat (поливиниловый спирт-полиэтил енгликоль графт-сополимер) и их комбинации. Система введения высвобождает содержащийся в ней хинон с высокими значениями биодоступности. Предпочтительно, система способна обеспечить высокие значения биодоступности без добавления усилителей проникновения.
Система введения, содержащая суспензию действующего вещества, предпочтительно содержит 30-60 вес.%, особенно предпочтительно 40-50 вес.% хинона, особенно 1,4-бензохинона, и 40-70 вес.%, предпочтительно 50-60 вес.% носителя, особенно полиспирта и/или производного целлюлозы, в которой действующее вещество предпочтительно микронизировано. Микронизация включает уменьшение размера частиц до размера предпочтительно менее 100 мкм, особенно предпочтительно менее 10 мкм.
Система введения, содержащая аморфную форму (или аморфную композицию) действующего вещества, предпочтительно содержит 3-20 вес.%, особенно предпочтительно 5-10 вес.% хинона, особенно 1,4-бензохинона, и 80-97 вес.%, предпочтительно 90-95 вес.%, носителя, особенно надлежащим образом замещенного углевода или другого водорастворимого полимера.
Система введения, содержащая эмульсию действующего вещества, предпочтительно содержит 3-50 вес.%, особенно предпочтительно 5-30 вес.% хинона, особенно 1,4-бензохинона, и 50-97 вес.%, предпочтительно 79-95 вес.% носителя, особенно производного целлюлозы.
Одна особенно предпочтительная система введения содержит 50 вес.% 1,4-бензохинона из группы, состоящей из идебенона, аналогов идебенона, убихинона или аналогов убихинона, и 40 вес.% поливинилового спирта (PVA) и 10 вес.% носителя, представляющего собой натрия карбоксиметил-целлюлозу.
Другая особенно предпочтительная система введения содержит 10 вес.% 1,4-бензохинона из группы, состоящей из идебенона, аналогов идебенона, убихинона или аналогов убихинона, и 90 вес.% носителя НРМС.
В настоящем изобретении предпочтительно, чтобы системы введения, которые растворяются во рту, имели форму пленки. Такие системы введения в форме пленки называют также "полосками" или "пластинками". Изобретенные системы введения в форме пленки могут, в частном варианте осуществления, изготавливаться таким образом, что они обладают адгезией к слизистой оболочке. Под этим подразумевается свойство прилипать к слизистой мембране пациента, в частности таким образом, что такую систему введения трудно или невозможно отделить от слизистой мембраны после нанесения.
Для настоящего изобретения предпочтительно, чтобы описанная система введения в форме пленки имела высокое отношение площади поверхности к весу. Также предпочтительно, чтобы описанная система введения обладала гелеобразной консистенцией в ротовой полости после набухания в слюне.
Системы введения в форме пленки по настоящему изобретению имеют площадь между 1 и 10 см2, предпочтительно между 2 и 8 см2, и особенно предпочтительно между 5 и 7 см2. Кроме того, они имеют значения веса на единицу площади между 50 и 250 г/м, предпочтительно между 100 и 150 г/м. Последний параметр примерно коррелирует с толщиной от 40 до 300 мкм, предпочтительно от 50 до 100 мкм.
Система введения растворяется во рту пациента предпочтительно за период времени меньше 30 минут, особенно предпочтительно за период времени меньше 15 минут. Хинон, который поступает в кровь трансмукозально из описанной системы введения, приводит к быстрому повышению концентрации данного хинона в крови. В этом случае максимальная концентрация хинона в крови достигается предпочтительно за период времени меньше 60 минут, особенно предпочтительно за период времени от 5 до 30 минут после введения.
С помощью описанной в настоящем изобретении системы введения возможно достичь относительно высокой биодоступности, замеряемой по значению AUC концентрации действующего вещества в крови, которая по меньшей мере в 5 раз (на 500 %) выше, предпочтительно по меньшей мере в 10 раз (на 1000 %) выше, чем концентрация хинона при применении формы таблеток (или симуляции формы таблеток), с поправкой на вводимую дозу. Особенно предпочтительный рост биодоступности составляет 20-кратный рост (на 2000 %).
Система введения в форме пленки может, помимо носителя и хинона, содержать другие соединения, например ароматизаторы, красители, подсластители, наполнители, пластификаторы, поверхностно-активные вещества, жидкие, предпочтительно липофильные - вспомогательные вещества, которые способны растворять хинон и формировать вторую фазу в предпочтительно гидрофильном носителе, солюбилизаторы, стабилизаторы рН, разрыхлители, усилители растворимости, усилители всасывания и/или усилители проникновения.
Хиноны по настоящему изобретению могут представлять собой 1,4-гидрохиноны и родственные соединения. Предпочтительными 1.4-гидрохинонами являются идебенон, аналоги идебенона и убихинон и родственные ему соединения. Термин "убихинон и родственные ему соединения" при использовании в настоящем тексте охватывает натуральные убихиноны (коэнзим Q-n), а также его структурные аналоги, имеющие обратимо восстанавливаемый хиноновый цикл с липофильной боковой цепью.
Система трансмукозального введения 1,4-гидрохинонов и родственных соединений по настоящему изобретению может применяться в лечении пациентов, страдающих различными заболеваниями и/или состояниями, включая митохондриальные, нейромышечные или неврологические заболевания. Примеры заболеваний, которые можно лечить, включают (но не ограничиваются только ими) наследственную атаксию Фридрейха, миодистрофию Дюшена, мышечную дистрофию Беккера, болезнь Альцгеймера, нейропатию зрительного нерва Лебера, MELAS (митохондриальная миопатия, энцефалопатия, лактацидоз с инсультоподобными эпизодами), болезнь Паркинсона и митохондриальную миопатию. Кроме того, есть предварительные доказательства того, что 1,4-бензохинон, Коэнзим Q10 или CoQ10, могут быть эффективны в лечении ишемической болезни сердца, миоклонической эпилепсии и разорванных красных волокон, синдрома Кирнса-Сейра, прогрессивной внешней офтальмоплегии, сахарного диабета и глухоты, синдрома Лейга, подострой склеродирующей энцефалопатии, NARP (нейропатия, атаксия, пигментная дистрофия сетчатки и птоз) и митохондриальной нейрогастроинтестинальной энцефалопатии, мигрени, рака, гипертензии, возрастной дегенерации желтого пятна, болезни Альцгеймера, индуцированной антрациклиновой химиотерапией кардиотоксичности, астмы и многих других. Другими частным применением является совместное введение пациентам 1,4-бензохинона со статинами и бета-блокаторами.
В предпочтительном варианте осуществления в комбинации с любыми описанными выше или ниже по тексту вариантами осуществления, система введения предназначена для применения в лечении митохондриального заболевания, предпочтительно выбранного из группы, состоящей из атрофии зрительного нерва Лебера (LHON), аутосомной доминантной атрофии зрительного нерва (DOA), дегенерации желтого пятна, глаукомы, ретинопатии, катаракты, друзы диска зрительного нерва (ODD), митохондриальной миопатии, энцефаломиопатии, лактацидоза, синдрома MELAS, миоклонической эпилепсии с разорванными красными волокнами (MERRF), митохондриальной нейрогастроинтестинальной энцефаломиопатии (MNGIE), синдрома Кирнса-Сейра, дефицита CoQ10 и дефицита митохондриального комплекса (1-5, СРЕО); нейродегенеративного заболевания, предпочтительно выбранного из группы, состоящей из наследственной атаксии Фридрейха (FRDA), амиотрофического бокового склероза (ALS), болезни Паркинсона, болезни Альцгеймера, болезни Хантингтона, инсульта/реперфузионного повреждения и деменции; нервно-мышечного заболевания, предпочтительно выбранного из группы, состоящей из миодистрофии Дюшена (DMD), мышечной дистрофии Беккера (BMD), дистрофии Лейдена (LGMD), сцепленной с Х-хромосомой дилатационной кардиомиопатии (XLDCM), пантотенаткиназа-связанной нейродегенерации (PKAN), спинально-мышечной атрофии (SMA), рассеянного склероза, рецидивирующе-ремитирующего рассеянного склероза (RR-MS), первично-прогрессирующего рассеянного склероза (PP-MS), вторично-прогрессирующего рассеянного склероза (SP-MS), болезни Кугельберга-Веландера и болезни Верднига-Гоффмана;
психического расстройства, предпочтительно выбранного из группы, состоящей из шизофрении, большого депрессивного расстройства, биполярного расстройства и эпилепсии;
метаболического нарушения, предпочтительно выбранного из группы, состоящей из старческого упадка сил, ожирения, избыточного веса, диабета II типа и метаболического синдрома;
рака; рассеянного склероза; или
нарушения иммунитета, предпочтительно выбранного из группы, состоящей из артрита, псориаза и ревматоидного артрита.
В предпочтительном варианте осуществления в комбинации с любыми описанными выше или ниже по тексту вариантами осуществления, система введения предназначена для применения в лечении митохондриального заболевания. Предпочтительно, митохондриальное заболевание выбрано из группы, состоящей из атрофии зрительного нерва Лебера (LHON), аутосомной доминантной атрофии зрительного нерва (DOA), дегенерации желтого пятна, глаукомы, ретинопатии, катаракты, друзы диска зрительного нерва (ODD), митохондриальной миопатии, энцефаломиопатии, лактацидоза, синдрома MELAS, миоклонической эпилепсии с разорванными красными волокнами (MERRF), митохондриальной нейрогастроинтестинальной энцефаломиопатии (MNGIE), синдрома Кирнса-Сейра, дефицита CoQ10 и дефицита митохондриального комплекса (1-5, СРЕО).
В предпочтительном варианте осуществления в комбинации с любыми описанными выше или ниже по тексту вариантами осуществления, система введения предназначена для применения в лечении атрофии зрительного нерва Лебера (LHON).
В предпочтительном варианте осуществления в комбинации с любыми описанными выше или ниже по тексту вариантами осуществления, тонкопленочная система введения лекарственного средства предназначена для лечения митохондриальной миопатии, энцефаломиопатии, лактацидоза, синдрома MELAS.
В предпочтительном варианте осуществления в комбинации с любыми описанными выше или ниже по тексту вариантами осуществления, система введения предназначена для применения в лечении нейродегенеративного заболевания. Предпочтительно, нейродегенеративное заболевание выбрано из группы, состоящей из наследственной атаксии Фридрейха (FRDA), амиотрофического бокового склероза (ALS), болезни Паркинсона, болезни Альцгеймера, болезни Хантингтона, инсульта/реперфузионного повреждения и деменции.
В предпочтительном варианте осуществления в комбинации с любыми описанными выше или ниже по тексту вариантами осуществления, система введения предназначена для применения в лечении нервно-мышечного заболевания. Предпочтительно, нервно-мышечное заболевание выбрано из группы, состоящей из миодистрофии Дюшена (DMD), мышечной дистрофии Беккера (BMD), дистрофии Лейдена (LGMD), сцепленной с Х-хромосомой дилатационной кардиомиопатии (XLDCM), пантотенаткиназа-связанной нейродегенерации (PKAN), спинально-мышечной атрофии (SMA), рассеянного склероза и первично-прогрессирующего рассеянного склероза (PP-MS), болезни Кугельберга-Веландера и болезни Верднига-Гоффмана.
В предпочтительном варианте осуществления в комбинации с любыми описанными выше или ниже по тексту вариантами осуществления, система введения предназначена для применения в лечении миодистрофии Дюшена (DMD).
В предпочтительном варианте осуществления в комбинации с любыми описанными выше или ниже по тексту вариантами осуществления, система введения предназначена для применения в лечении первично-прогрессирующего рассеянного склероза (PP-MS).
В предпочтительном варианте осуществления в комбинации с любыми описанными выше или ниже по тексту вариантами осуществления, система введения предназначена для применения в лечении психического расстройства. Предпочтительно, психиатрическое заболевание выбрано из группы, состоящей из шизофрении, большого депрессивного расстройства, биполярного расстройства и эпилепсии.
В предпочтительном варианте осуществления в комбинации с любыми описанными выше или ниже по тексту вариантами осуществления, система введения предназначена для применения в лечении метаболического нарушения. Предпочтительно, метаболическое нарушение выбрано из группы, состоящей из старческого упадка сил, ожирения, избыточного веса, диабета II типа и метаболического синдрома.
В предпочтительном варианте осуществления в комбинации с любыми описанными выше или ниже по тексту вариантами осуществления, система введения предназначена для применения в лечении рака.
В предпочтительном варианте осуществления в комбинации с любыми описанными выше или ниже по тексту вариантами осуществления, система введения предназначена для применения в лечении рассеянного склероза.
В предпочтительном варианте осуществления в комбинации с любыми описанными выше или ниже по тексту вариантами осуществления, система введения предназначена для применения в лечении первично-прогрессирующего рассеянного склероза, рецидивирующе-ремитирующего рассеянного склероза и вторично-прогрессирующего рассеянного склероза, более предпочтительно для применения в лечении первично-прогрессирующего рассеянного склероза.
В предпочтительном варианте осуществления в комбинации с любыми описанными выше или ниже по тексту вариантами осуществления, система введения предназначена для применения в лечении нарушения иммунитета. Предпочтительно, нарушение иммунитета выбрано из группы, состоящей из артрита, псориаза и ревматоидного артрита.
В сравнении с эффективной дозировкой идебенона, вводимой обычным пероральным способом с всасыванием в желудочно-кишечном тракте, ожидается, что эффективная дозировка препарата, описанного в настоящем изобретении, будет значительно ниже. С другой стороны, ожидается, что с описанным препаратом и в зависимости от вводимой дозы у пациентов можно создать значительно более высокую концентрацию действующего вещества в крови и достичь потенциально усиленной клинической эффективности. Кроме того, благодаря повышенной концентрации в крови применение идебенона можно расширить на дополнительные показания в области нервно-мышечных заболеваний, которые требуют высоких концентраций лекарственного соединения, например для пересечения гематоэнцефалического барьера пациента.
Подходящие дозировки действующего вещества, вводимого с помощью тонкого пленочного препарата (пластинки для перорального введения), составляют от 0.01 до 60 мг/кг/день. Предпочтительно, например, идебенон вводят в дозировке от 0.01 до 20 мг/кг/день, более предпочтительно в дозировке от 0.01 до 10 мг/кг/день, и еще более предпочтительно в дозировке от 0.01 до менее 5 мг/кг/день. Наиболее предпочтительно, дозировка действующего вещества идебенона составляет от 0.1 до 4 мг/кг/день. Исследования показали, что, неожиданно, такие низкие дозировки позволяют достичь необходимой концентрации идебенона в крови, если он вводится через слизистую оболочку рта. Необходимые дозировки могут быть легко установлены квалифицированным специалистом в данной области.
В предпочтительном варианте осуществления, идебенон можно вводить в комбинации со вторым терапевтическим агентом, где указанный второй терапевтический агент предпочтительно выбран из глюкокортикостероидов, таких как 6а-метилпреднизолон-21 натрия сукцинат (SOLUMEDROL®) или дефлазакорт (CALCORT®), которые обычно применяются у пациентов с миодистрофией Дюшена (DMD) для лечения воспаления и слабости мышц. Сходным образом, идебенон можно вводить в комбинации с любым лекарственным средством, применяемым для пациентов с DMD для лечения связанной с DMD кардиомиопатией, таким как АСЕ-ингибиторы, бета-блокаторы и диуретики, а также ингибиторы HMG-CoA редуктазы.
В другом предпочтительном варианте осуществления, идебенон можно вводить в комбинации с другими терапевтическими агентами, при этом указанные терапевтические агенты предпочтительно представляют собой эритропоэтин, витамин Е, витамин С или митохинон (Mito Q; К.М. Taylor, R. Smith, WO 05019232 A1).
Идебенон и другие терапевтические агенты можно применять одновременно, по отдельности или последовательно, для лечения или профилактики симптомов заболевания. Терапевтические агенты могут содержаться в одной дозированной форме или в разных препаратах, каждый из которых содержит по меньшей мере одно действующее вещество.
Описанные далее примеры иллюстрируют настоящее изобретение, но не предназначены для ограничения объема изобретения.
Пример 1
112 г PVA добавляли к 720 мл воды и перемешивали до полного растворения. При необходимости растворение проводят при нагревании. После охлаждения гомогенно диспергировали 140 г идебенона. После этого добавляли 28 г CMC, и полученную смесь перемешивали до полного растворения.
Полученную смесь дегазировали, наносили в виде тонкого слоя и сушили. Получали тонкую опалесцирующую пленку толщиной от 50 до 150 мкм. Опалесцирующие пластинки, содержащие 30 мг идебенона, получали, вырезая образцы нужного размера.
Пример 2
28 г идебенона добавляли в 720 мл смеси 75:25 метанол:вода, которую затем перемешивали до полного растворения действующего вещества. Добавляли 250 г НРМС и перемешивали до полного растворения. Затем смесь дегазировали, наносили тонким слоем и сушили. Получали тонкую прозрачную пленку толщиной от 100 до 300 мкм. Прозрачные пластинки, содержащие 15 мг идебенона, получали, вырезая образцы нужного размера.
Можно отметить, что высушенная система из Примера 1 содержит бензохинон в виде частиц в отдельной фазе, суспендированной в носителе, в то время как бензохинон в Примере 2 имеет вид мономолекулярной дисперсии в носителе.
Экспериментальные данные:
Данные фармакокинетики после оромукозального введения идебенона. Концентрацию идебенона в плазме крови изучали после введения двух разных тонких пленочных препаратов (пластинок для перорального введения), которые вводили через слизистую ротовой полости, и сравнивали с профилем, полученным после дозировки идебенона перорально (принудительное введение) в виде микроэмульсии. Исследованные дозировки составляли 30 мг оромукозально (пероральная пластинка А, суспензионный тип), 15 мг оромукозально (пероральная пластинка В, форма твердого раствора) и 300 мг перорально (TPGS/Miglyol микроэмульсия, вводимая принудительно перорально).
Данное исследование представляло собой трехстороннее перекрестное исследование с 1-недельным периодом вымывания между введениями. Препараты вводили самкам собак (гончие) в условиях голодания. Для каждого препарата определяли фармакокинетический профиль свободного (неконъюгированного) идебенона и его метаболитов (общий идебенон, общий QS10, общий QS6 и общий QS4).
Образцы крови отбирали в несколько моментов времени в течение 6 часов после введения. Измеряли концентрации идебенона в плазме крови методом ВЭЖХ-МС/МС и вычисляли фармакокинетические параметры.
Для этого идебенон отделяли и количественно определяли методом ВЭЖХ-МС/МС: для ВЭЖХ использовали колонку SynergiTM 4μ MAX-RP (50×2 мм) (Phenomenex, Schlieren, Швейцария). Температура колонки: 50°C. Подвижная фаза А: вода+30 мМ NH4OAc; подвижная фаза В: МеОН/H2O 100/3 (об/об)+30 мМ NH4OAC, элюирование в градиенте (Таблица 4). Поток: 250 мкл/мин и 400 мкл/мин.
После выделения идебенон количественно определяли методом ESI-MC/MC (API 4000, Perkin-Elmer-Europe BV, Rotkreuz, Швейцария) в режиме детектирования положительно заряженных ионов.

Конъюгаты идебенона, такие как глюкуронаты и сульфаты, количественно определяли после кислотного гидролиза, как описано в работе R. Artuch, С. Colomé, М.A. Vilaseca, A. Aracil. М. Pineda, J. Neurosci. Meth. 115 (2002), 63-66.
Фармакокинетический анализ включал максимальную концентрацию в плазме крови (Cмах), время, в которое наблюдалась максимальная концентрация в плазме крови (Tмакс), и площадь под кривой зависимости концентрации от времени с момента времени 0 час до 360 минут (AUC0-360 мин). Относительную биодоступность идебенона после подъязычного введения, в сравнении с пероральным введением, вычисляли для каждой собаки по нормализованным (1 мг/кг) значениям AUC. Также вычисляли соотношения AUC метаболитов. Кроме того, вычисляли также соотношения Cмах, нормализованные к дозировке 1 мг/кг.
Полученные результаты представлены ниже в Таблице 2.

Как показано в Таблице 2, два препарата идебенона в форме пластинок, введенные через слизистую ротовой полости, полученные согласно примерам 1 и 2, явным образом дают значительно более высокие концентрации идебенона в плазме крови по сравнению с обычным пероральным введением. Оба значения (Cмах и AUC0-360) превышали значения для перорального введения в случае обоих препаратов в форме пластин (пластинка для перорального введения). Наблюдается также отчетливое различие между пластинкой А, которая содержит 30 мг идебенона в виде микронизированного порошка, суспендированного в полимерной матрице, и пластинкой В, которая содержит всего 15 мг, но в твердом растворе, т.е. в молекулярно диспергированном состоянии. Последний препарат из перечисленных явно растворяется намного более эффективно и лучше всасывается.
На Фиг. 1 показаны средние концентрации в плазме крови относительно времени для свободного идебенона после однократного введения в виде разных препаратов (перорально и тонкие пластинки) самкам собак (гончих).
Как показано на Фиг. 1, пластинка В (15 мг, пластинка типа твердого раствора) показала наибольшие значения Cмах и наивысшее значение AUC в сравнении с другими препаратами. Пластинка А (30 мг, пластинка типа суспензии) показала более высокое значение Cмах и более высокое значение AUC в сравнении с пероральным путем введения (300 мг, микросуспензия).


Как показано выше в Таблице 3, рост концентрации, полученный с двумя препаратами идебенона в форме пластинок, вводимых через слизистую ротовой полости (получены согласно примерам 1 и 2), в сравнении с пероральным способом введения, становится еще более явным после нормализации с учетом разницы в дозировках.

Как показано в Таблице 4, сравнение с нормализацией по дозировке демонстрирует, что пластинка А дает 26-кратно более высокое значение AUC (33-кратное Cмах), чем препарат для перорального введения при нормализации по дозировке, а пластинка В дает 121-кратно более высокое значение AUC (144-кратное Cмах) в сравнении с пероральным способом введения. Пластинка В (твердый раствор) обеспечивает >4-кратное повышение воздействия идебенона в сравнении с пластинкой А (суспензионного типа).
В заключение можно сделать следующие выводы:
- Орально-мукозальное введение идебенона посредством тонкого пленочного препарата (пластинка для перорального введения), построенного по технологии твердого раствора, сильно повышает относительную биодоступность идебенона примерно в 100 раз по сравнению с пероральным введением. Главной причиной повышенной биодоступности является изначальный обход кишечно-печеночного кровотока.
- Кроме того, есть свидетельство, что всасывание идебенона из пластинки усиливается по сравнению с пероральным введением идебенона через зонд.
- Пластинка, созданная по технологии микронизированной суспензии, также улучшает относительную биодоступность идебенона, хотя и в меньшей степени.
- Метаболические спектры идебенона после перорального введения через зонд и после орально-мукозального введения являются сравнимыми.
Препарат в форме пластинки дает следующие преимущества в сравнении с препаратами, вводимыми пероральным способом:
- значительное уменьшение дозировки (меньше побочных эффектов),
- более высокие достижимые концентрации в крови,
- повышение согласия пациентов,
- введение пациентам, имеющим проблемы с глотанием.
Изобретенные системы могут дополнительно содержать полимерный матрикс, и фармацевтическое действующее вещество может быть введено в состав полимерного матрикса в виде суспензии, суспензии после микронизации, эмульсии, микро- или нано-эмульсии, или в солюбилизированной, и/или молекулярно диспергированной форме.