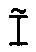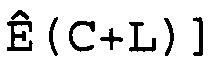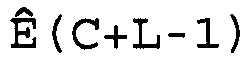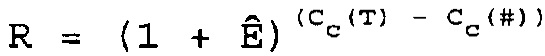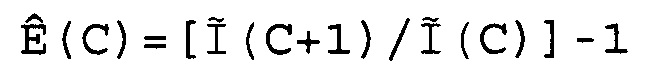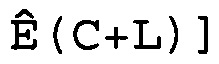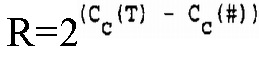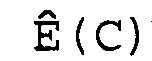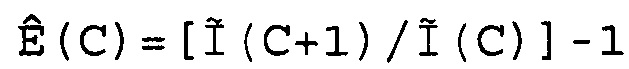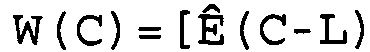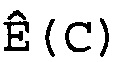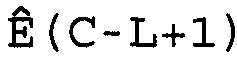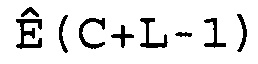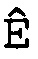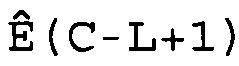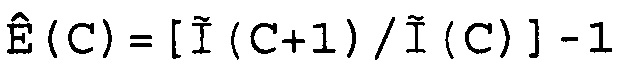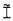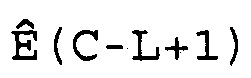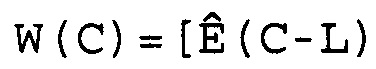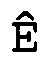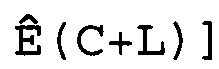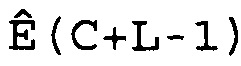Результат интеллектуальной деятельности: СПОСОБЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ НУКЛЕИНОВЫХ КИСЛОТ
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области количественного определения нуклеиновых кислот посредством полимеразной цепной реакции (ПЦР).
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Количественное определение нуклеиновых кислот играет важную роль во множестве областей от молекулярной биологии и генетических исследований до диагностики и определения патогенов. Когда присутствуют достаточные количества нуклеиновых кислот, для количественного определения можно использовать способы блоттинга. Однако ограниченная чувствительность этих способов делает невозможным их использование во многих случаях.
Разработанные в недавнем прошлом количественные способы ПЦР предоставляют инструменты для анализа в тех случаях, когда необходима значительно более высокая чувствительность. Эти способы основаны на том факте, что во время амплификации ПЦР количество продукта растет экспоненциально, и таким образом количество продукта, полученного после сравнительно малого числа циклов, можно определить стандартными средствами (например, определением флуоресценции). Кроме того, в принципе, количество продукта, которое присутствовало исходно, т.е. в начале амплификации, можно определить по количеству продукта, полученному в конце амплификации, если известно число циклов амплификации.
Вкратце, на практике нуклеиновые кислоты-мишени, так же как образцы стандартов и/или образцы для сравнения, подвергают ПЦР при определенных условиях реакции и осуществляют мониторинг образования продукта ПЦР по мере осуществления процесса амплификации. Определение продукта ПЦР осуществляют, например, посредством флуоресцентно меченых зондов для гибридизации, испускающих специфические сигналы после связывания с мишенью или посредством ДНК-интеркалирующих флуоресцентных красителей, которые позволяют определять двухцепочечный продукт. Определяют число циклов амплификации, необходимое для получения конкретного порогового уровня флуоресценции, которое обозначают как величины Ct, величину Ct мишени сравнивают с величинами Ct образцов серией разведений стандарта нуклеиновой кислоты с известной концентрацией (определение абсолютного количества). Для того чтобы определить абсолютное количество мишени, строят калибровочную кривую по величинам Ct образцов стандарта, используют ее для определения исходной концентрации мишени. Альтернативно, величину Ct мишени сравнивают с величиной Ct одной нуклеиновой кислоты для сравнения, представляющей интерес (определение относительного количества). В этом случае определяют отношение величин Ct мишени и образца для сравнения и используют его для оценки отношения исходных количеств мишени и нуклеиновой кислоты для сравнения. К сожалению, практическое применение этих подходов осложнено множеством проблем, некоторые из которых рассмотрены ниже.
Некоторые задачи в области количественной ПЦР относятся к растущей потребности в анализе большого числа образцов за короткие промежутки времени. Поскольку постоянно расширяющийся диапазон применений количественной ПЦР требует высокопроизводительного анализа очень большого числа образцов, например, в клинической практике, необходимо разрабатывать такие количественные способы ПЦР, которые можно полностью автоматизировать и которые требуют незначительного взаимодействия с человеком или не требуют такого взаимодействия вовсе. В некоторых случаях это имеет принципиальную важность, поскольку высокопроизводительные применения (например, в клинической практике) просто невозможно реализовать в рамках требуемых коротких периодов времени, если требуется взаимодействие с человеком.
Дополнительная выгода, которую можно реализовать при использовании таких автоматизированных способов, состоит в усовершенствованной сопоставимости аналитических данных из различных лабораторий, которые в настоящее время используют значительно различающиеся лабораторные протоколы для количественной ПЦР. Это вопрос наивысшей важности, если принимать во внимание растущее число лабораторий, использующих способы количественной ПЦР для фундаментальных исследований. Создание автоматизированного способа в качестве объективного эталона для экспериментов по количественному определению окажет значительную помощь в этих исследовательских попытках.
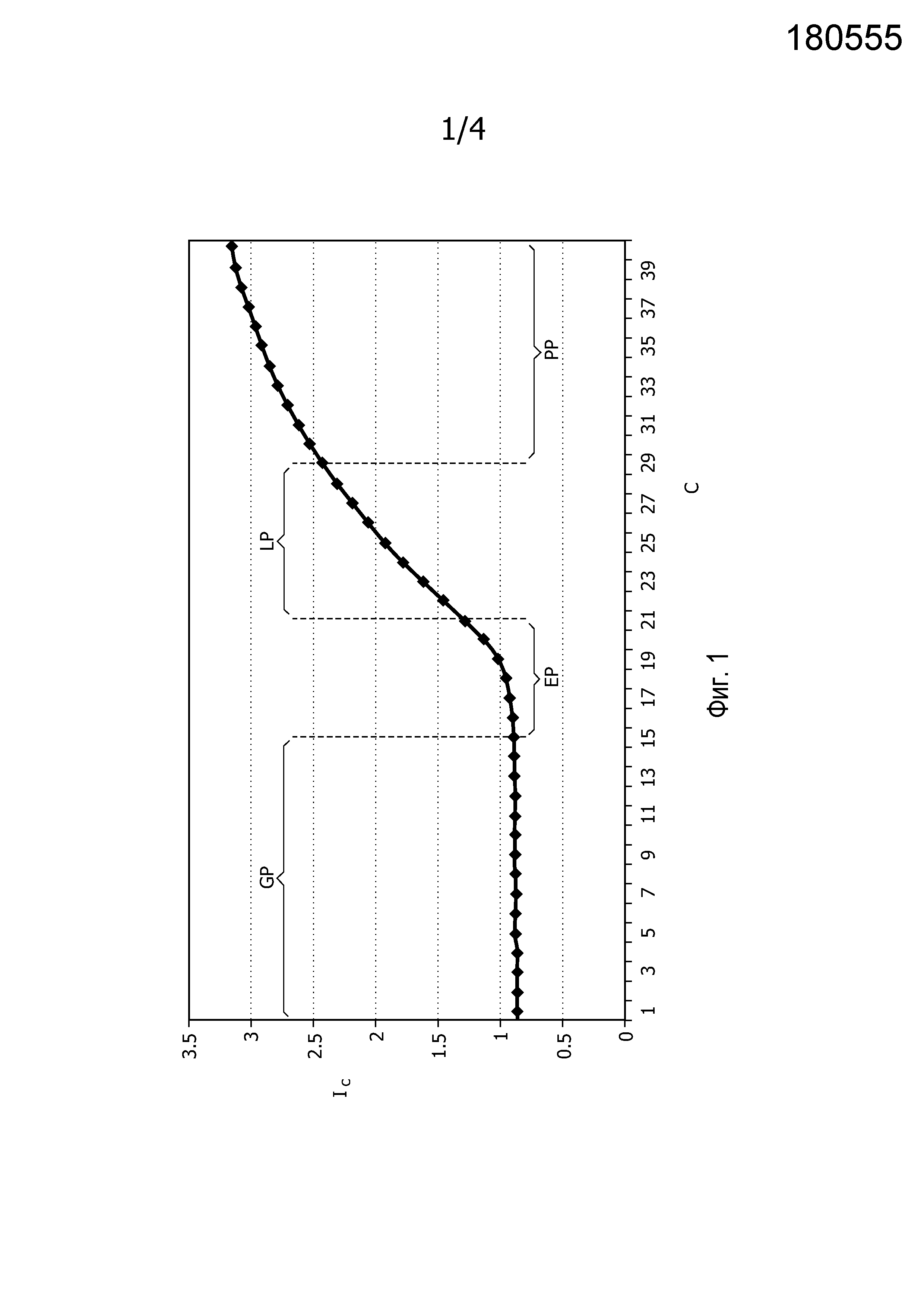
Типичный график образования продукта ПЦР по мере осуществления реакции амплификации выявляет четыре различные фазы процесса амплификации (см. фиг.1): (1) Начальная фаза, где над сигналом флуоресценции преобладает фоновая флуоресценция и шум; (2) экспоненциальная фаза, где сигнал продукта ПЦР становится выше исходного уровня и растет экспоненциально; (3) логарифмически-линейная фаза, где сигнал растет со скоростью ниже экспоненциальной вследствие снижения эффективности амплификации, обусловленного такими факторами, как уменьшение количества реактивов для ПЦР и разрушение зондов для определения; (4) фаза плато с минимальным ростом сигнала вследствие нарастающего замедления и, в конце концов, остановки реакции амплификации.
Несмотря на кажущуюся простоту идеи, выбор подходящего порогового уровня сигнала для того, чтобы определить величины Ct, является не простой задачей. Как можно видеть на графике на фиг.1, выбор высокого порогового уровня может привести к величинам Ct в логарифмически-линейной фазе или фазе плато реакции амплификации. Это нежелательно, поскольку в этой области реакции происходит замедление экспоненциального роста, что скрывает корреляцию между исходными и присутствующими количествами нуклеиновых кислот. С другой стороны, выбор низкого порогового уровня может привести к тому, что величина Ct будет расположена в начальной фазе реакции амплификации, где шум и фоновый сигнал могут усложнять измерения. Таким образом, очевидно, что желательно выбрать такой пороговый уровень, который ведет к величинам Ct, соответствующим циклам с экспоненциальным ростом, т.е. расположенным в экспоненциальной фазе.
Для достижения этой цели разработано множество подходов (см., например, JD Durtschi et al. Analytical biochemistry 2007 (361) 55-64). Основной пороговый подход требует, чтобы экспериментатор посмотрел на кривую амплификации и использовал свою собственную экспертную оценку при выборе подходящего порога сигнала, который пересекает экспоненциальную фазу. Поскольку абсолютный уровень сигнала зависит от множества факторов, включая длину нуклеиновой кислоты и используемых средств определения, пороговый уровень для этого способа следует проверять и, если необходимо, корректировать для каждого применения. Аналогичным образом, в способе аппроксимации точек экспериментатор должен выбрать подходящий пороговый уровень, основываясь на самостоятельной экспертной оценке. Однако вместо того, чтобы присвоить Ct тому числу циклов, при котором зарегистрированный сигнал пересекает порог, линейную аппроксимацию моделируют на графике экспоненциальной части кривой в полулогарифмических координатах, а тот цикл, при котором эта прямая линия пересекает порог, обозначают как Ct. Другую идею называют способом максимума второй производной, где максимум второй производной кривой амплификации определяют численно. Предполагают, что соответствующий цикл представляет конец фазы экспоненциального роста, где реакция начинает замедляться до линейного роста. Это число циклов используют, аналогично Ct, для определения количества мишени. В отличие от основного порогового способа и способа аппроксимации точек, этот способ требует минимального взаимодействия с человеком или не требует такого взаимодействия вовсе, поскольку экспериментатор не должен задавать пороговый уровень. Еще один другой подход называют способом аппроксимации сигмовидной кривой, где сигмовидную функцию моделируют на кривой амплификации. Число циклов, соответствующее точке перегиба кривой, можно получить из модели, и его используют аналогично Ct для определения количества мишени. Этот способ также требует минимального взаимодействия с человеком или не требует такого взаимодействия вовсе. В принципе, способ максимума второй производной и способ аппроксимации сигмовидной кривой кажутся подходящими для выполнения автоматизации. Однако основной пороговый способ и способ аппроксимации точек по своей природе требуют взаимодействия с человеком и таким образом не подходят для автоматизации. Однако обнаружено, что способ максимума второй производной и способ аппроксимации сигмовидной кривой имеют ограниченное использование в применениях, требующих высокой чувствительности (JD Durtschi et al. Analytical biochemistry 2007 (361) 55-64).
Следовательно, цель настоящего изобретения состоит в том, чтобы предоставить способы, подходящие для полностью автоматизированного количественного определения нуклеиновых кислот с высокой чувствительностью.
ЦЕЛИ И КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Эту цель в соответствии с изобретением достигают способом определения относительного количества по меньшей мере одной нуклеиновой кислоты-мишени в образце, который содержит стадии:
(a) амплификация каждой из по меньшей мере одной нуклеиновой кислоты-мишени, которая содержится в образце, и одновременное получение сигналов, коррелирующих с амплификацией каждой из по меньшей мере одной нуклеиновой кислоты-мишени,
(b) амплификация каждого из по меньшей мере одного образца нуклеиновой кислоты для сравнения и одновременное получение сигналов, коррелирующих с амплификацией каждой из по меньшей мере одной нуклеиновой кислоты для сравнения,
(c) введение поправки в полученные сигналы для учета фоновых сигналов,
(d) вычисление эффективности амплификации для смежных циклов Ê(C) для каждого цикла амплификации нуклеиновой кислоты-мишени и нуклеиновой кислоты для сравнения,
(e) вычисление меры беспорядочности M эффективности амплификации для смежных циклов Ê(C) для нуклеиновой кислоты-мишени и нуклеиновой кислоты для сравнения,
(f) идентификация числа циклов CM, где M минимально для нуклеиновой кислоты-мишени и нуклеиновой кислоты для сравнения,
(g) вычисление характеристических чисел циклов CC по величинам CM,
(h) определение относительных количеств каждой из по меньшей мере одной нуклеиновой кислоты-мишени в образце по отношению к нуклеиновым кислотам для сравнения посредством сравнения CC мишени и образцов для сравнения.
Альтернативно, эту цель в соответствии с изобретением достигают способом определения абсолютного количества по меньшей мере одной нуклеиновой кислоты-мишени в образце, который содержит стадии:
(a) амплификация каждой из по меньшей мере одной нуклеиновой кислоты-мишени, которая содержится в образце, и одновременное получение сигналов, коррелирующих с амплификацией каждой из по меньшей мере одной нуклеиновой кислоты-мишени,
(b) амплификация образцов серии разведений стандарта нуклеиновой кислоты с известной концентрацией и одновременное получение сигналов, коррелирующих с амплификацией нуклеиновых кислот в образцах стандарта,
(c) введение поправки в полученные сигналы для учета фоновых сигналов,
(d) вычисление эффективности амплификации для смежных циклов Ê(C) для каждого цикла амплификации мишеней и образцов стандарта,
(e) вычисление меры беспорядочности M эффективности амплификации для смежных циклов Ê(C) для мишеней и образцов стандарта,
(f) идентификация числа циклов CM, где M минимально для мишеней и образцов стандарта,
(g) вычисление характеристических чисел циклов CC по величинам CM,
(h) определение исходных количеств каждой из по меньшей мере одной нуклеиновой кислоты-мишени в образце посредством сравнения CC мишеней и образцов стандарта.
Альтернативно, эту цель в соответствии с изобретением достигают способом определения величины Ct по меньшей мере одной нуклеиновой кислоты-мишени в образце, который содержит стадии:
(a) амплификация каждой из по меньшей мере одной нуклеиновой кислоты-мишени, которая содержится в образце,
(b) одновременное получение сигналов, коррелирующих с амплификацией каждой из по меньшей мере одной нуклеиновой кислоты-мишени,
(c) введение поправки в полученные сигналы для учета фоновых сигналов,
(d) вычисление эффективности амплификации для смежных циклов Ê(C) для каждого цикла амплификации каждой нуклеиновой кислоты-мишени,
(e) вычисление меры беспорядочности M эффективности амплификации для смежных циклов Ê(C) для каждой нуклеиновой кислоты-мишени,
(f) идентификация числа циклов CM, где M минимально для каждой нуклеиновой кислоты-мишени,
(g) вычисление характеристических чисел циклов CC по величинам CM,
(h) вычисление величин Ct по величинам CC.
Полученные величины Ct можно использовать для количественного определения нуклеиновых кислот известными в данной области способами.
Альтернативно, эту цель в соответствии с изобретением достигают способом определения относительного количества по меньшей мере одной нуклеиновой кислоты-мишени в образце, который содержит стадии:
(a) введение поправки в полученные сигналы для кривых амплификации по меньшей мере одной нуклеиновой кислоты-мишени и по меньшей мере одной нуклеиновой кислоты для сравнения для учета фоновых сигналов,
(b) вычисление эффективности амплификации для смежных циклов Ê(C) для каждого цикла амплификации нуклеиновой кислоты-мишени и нуклеиновой кислоты для сравнения,
(c) вычисление меры беспорядочности M эффективности амплификации для смежных циклов Ê(C) для нуклеиновой кислоты-мишени и нуклеиновой кислоты для сравнения,
(d) идентификация числа циклов CM, где M минимально для нуклеиновой кислоты-мишени и нуклеиновой кислоты для сравнения,
(e) вычисление характеристических чисел циклов CC по величинам CM,
(f) определение относительных количеств каждой из по меньшей мере одной нуклеиновой кислоты-мишени в образце по отношению к нуклеиновым кислотам для сравнения посредством сравнения CC мишени и образцов для сравнения.
Альтернативно, эту цель в соответствии с изобретением достигают способом определения абсолютного количества по меньшей мере одной нуклеиновой кислоты-мишени в образце, который содержит стадии:
(a) введение поправки в полученные сигналы для кривых амплификации по меньшей мере одной нуклеиновой кислоты-мишени и образцов серии разведений стандарта нуклеиновой кислоты с известной концентрацией для учета фоновых сигналов,
(b) вычисление эффективности амплификации для смежных циклов Ê(C) для каждого цикла амплификации мишеней и образцов стандарта,
(c) вычисление меры беспорядочности M эффективности амплификации для смежных циклов Ê(C) для мишеней и образцов стандарта,
(d) идентификация числа циклов CM, где M минимально для мишеней и образцов стандарта,
(e) вычисление характеристических чисел циклов CC по величинам CM,
(f) определение исходных количеств каждой из по меньшей мере одной нуклеиновой кислоты-мишени в образце посредством сравнения CC мишеней и образцов стандарта.
Альтернативно, эту цель в соответствии с изобретением достигают способом определения величины Ct по меньшей мере одной нуклеиновой кислоты-мишени в образце, который содержит стадии:
(a) введение поправки в полученные сигналы для кривых амплификации по меньшей мере одной нуклеиновой кислоты-мишени для учета фоновых сигналов,
(b) вычисление эффективности амплификации для смежных циклов Ê(C) для каждого цикла амплификации каждой нуклеиновой кислоты-мишени,
(c) вычисление меры беспорядочности M эффективности амплификации для смежных циклов Ê(C) для каждой нуклеиновой кислоты-мишени,
(d) идентификация числа циклов CM, где M минимально для каждой нуклеиновой кислоты-мишени,
(e) вычисление характеристических чисел циклов CC по величинам CM,
(f) вычисление величин Ct по величинам CC.
Полученные величины Ct можно использовать для количественного определения нуклеиновых кислот известными в данной области способами.
Кроме того, настоящее изобретение относится к способам, как описано выше, которые осуществляют полностью автоматизированным образом, т.е. без взаимодействия с человеком.
Кроме того, настоящее изобретение относится к машиночитаемой среде, в которой хранят инструкции для осуществления стадии с (c) по (h) описанных выше способов.
Кроме того, настоящее изобретение относится к устройству для анализа образцов нуклеиновых кислот, содержащему машиночитаемое запоминающее устройство, содержащее информацию для осуществления описанных выше способов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 представлен типичный график образования продуктов ПЦР по мере осуществления реакции амплификации, который выявляет различные фазы процесса амплификации: GP=начальная фаза, EP = экспоненциальная фаза, LP = логарифмически-линейная фаза, PP = фаза плато. C обозначает число циклов и Ic обозначает зарегистрированную интенсивность сигнала.
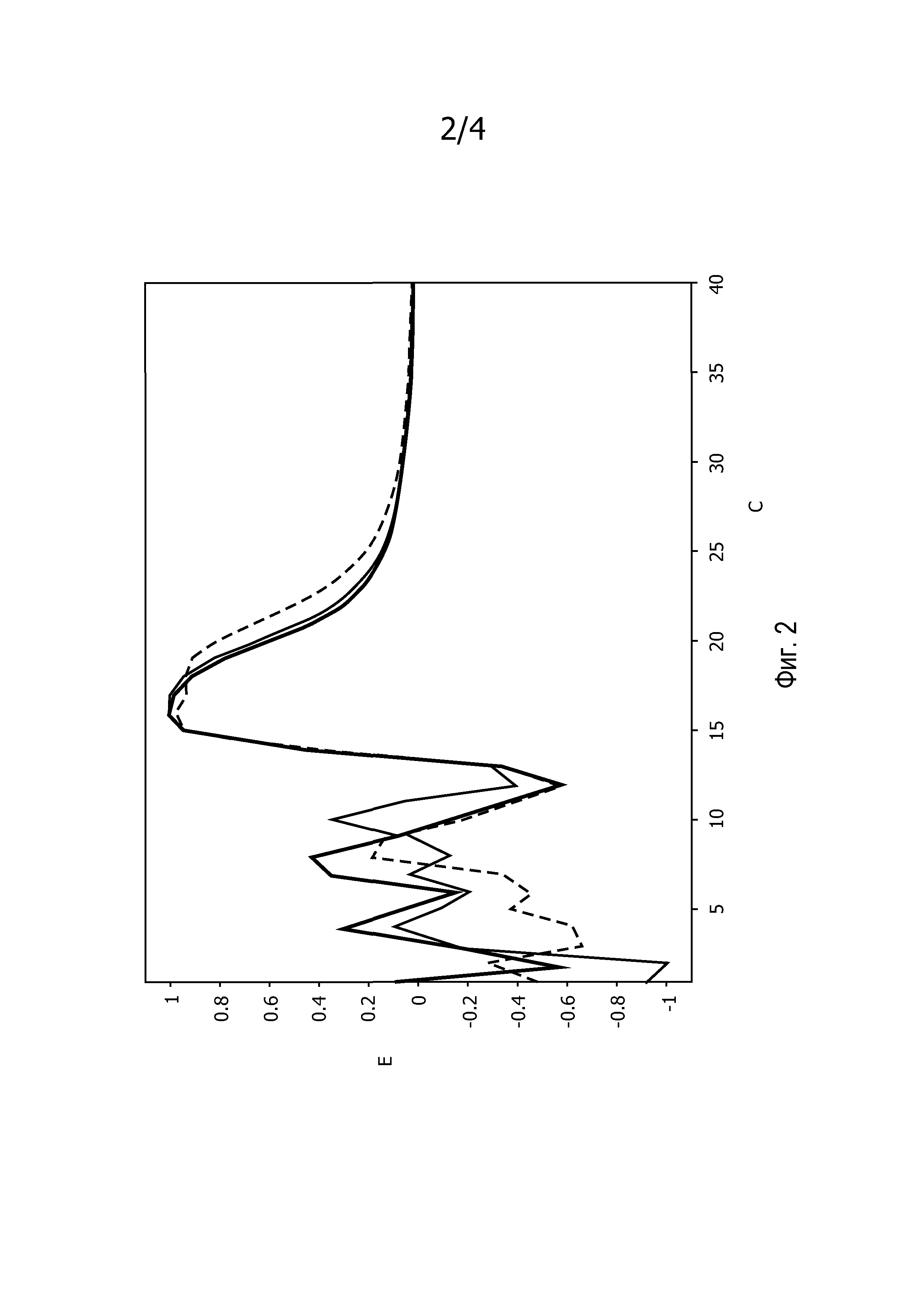
На фиг.2 представлены численно вычисленные кривые Ê(C) для трех амплификаций ПЦР, начиная с исходного количества ДНК, равного 106 копий в объеме 25 мкл.
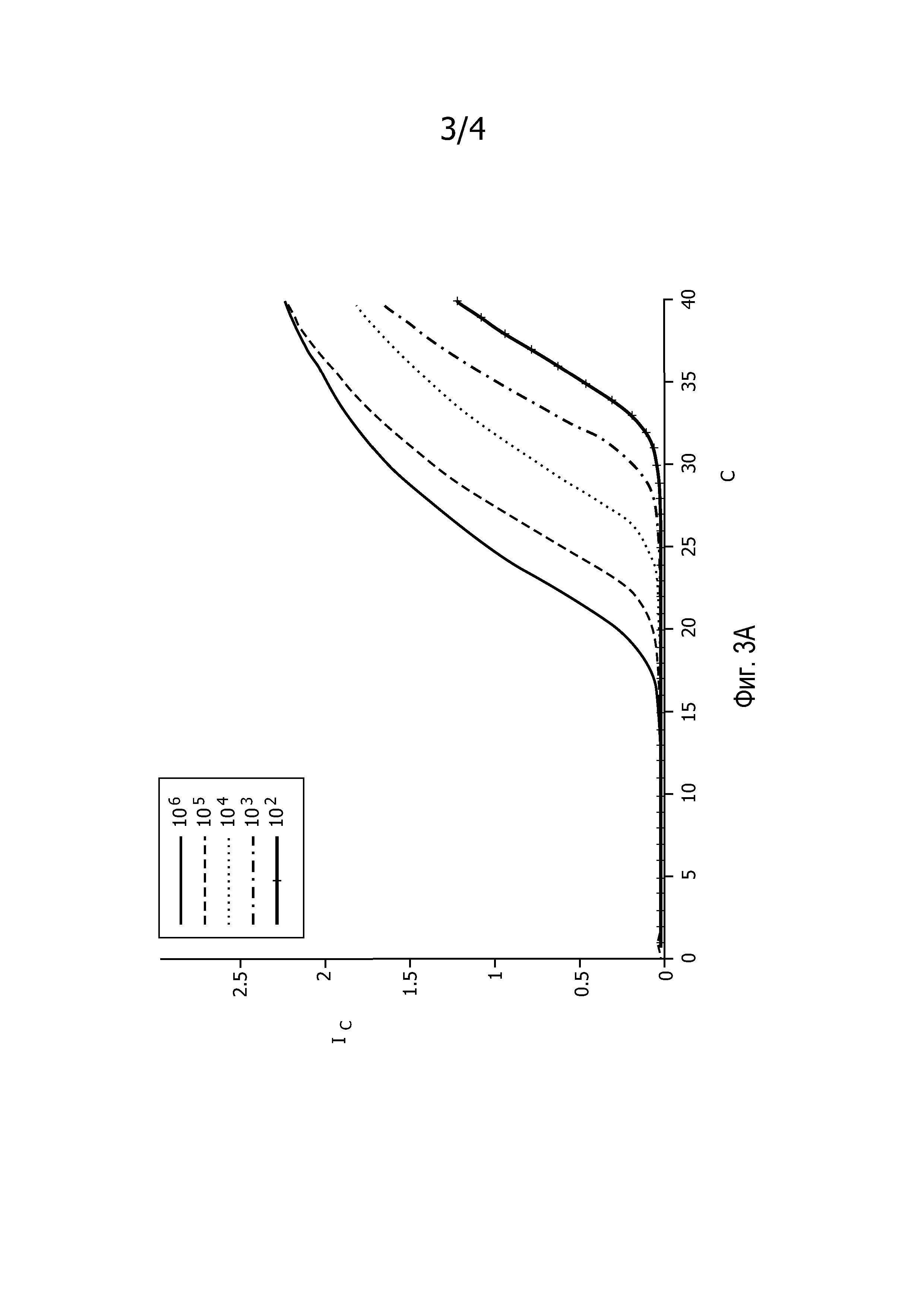
На фиг.3A представлены скорректированные по фону кривые амплификации, полученные в примере 1.
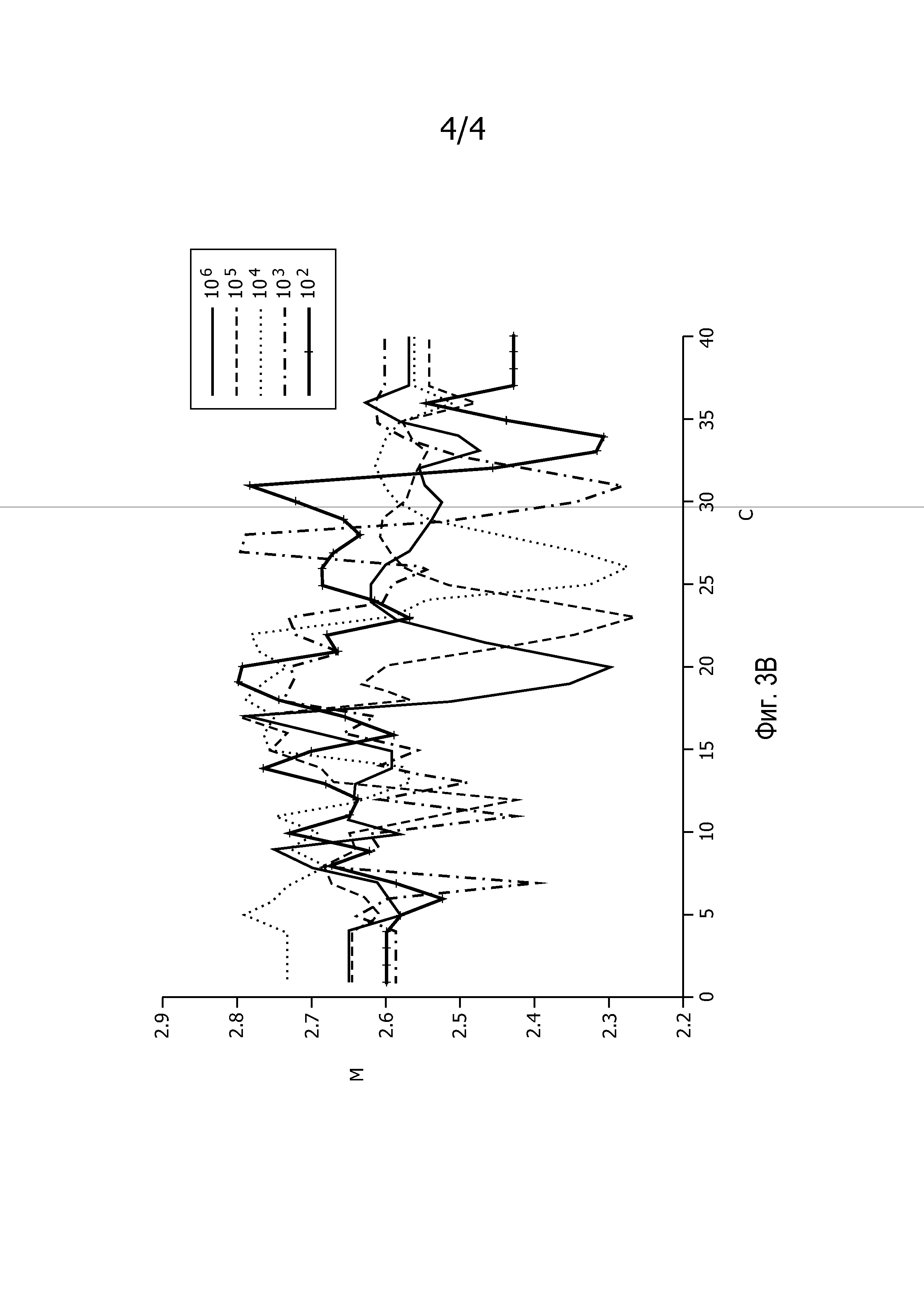
На фиг.3B представлены кривые спектральной энтропии, полученные в примере 1. На фигуре показано, что спектральная энтропия (M) отображает характеристические минимумы на 20, 23, 26, 31 и 34 цикле (C) для образцов с концентрациями 106, 105, 104, 103, 102 копий в 25 мкл соответственно.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Мера беспорядочности эффективности амплификации имеет выраженный минимум, который можно использовать в качестве характеристической точки амплификации.
Присвоение величин Ct кривым амплификации в ходе количественного определения нуклеиновых кислот с использованием основного порогового способа или способа аппроксимации точек требует участия человека. На основе самостоятельно экспертной оценки экспериментатор должен выбрать пороговый уровень сигнала, которого достигают до окончания экспоненциальной фазы, когда происходит значительное замедление амплификации, и которого, кроме того, достигают после того, когда фоновый сигнал и шум доминируют над начальной фазой. Следовательно, по своим свойствам эти способы не подходят для автоматизации.
В отличие от этого, способ максимума второй производной и способ аппроксимации сигмовидной кривой используют определение характеристических точек на кривых без участия человека. Следовательно, в принципе, эти способы не кажутся неподходящими для автоматизации. Однако недавно показано, что способ максимума второй производной и способ аппроксимации сигмовидной кривой являются ненадежными для количественного определения малого количества копий мишени (JD Durtschi et al. Analytical biochemistry 2007 (361) 55-64).
Неожиданно выяснилось, что график меры беспорядочности эффективности амплификации имеет выраженный минимум или выраженный переход к минимуму. Число циклов, соответствующее этому минимуму или переходу к минимуму, можно назначить в качестве характеристической точки для каждой кривой амплификации без участия человека и его можно использовать для надежного количественного определения нуклеиновых кислот, включая количественное определение малого числа копий мишеней.
Преимущество использования минимума или перехода к минимуму меры беспорядочности эффективности амплификации в качестве характеристической точки происходит из того факта, что эта точка обычно расположена в ранней части экспоненциальной фазы. Поскольку на эффективность амплификации влияют различные факторы, такие как длина, содержание GC и возможная вторичная структура продуктов ПЦР, так же как и ингибиторы, которые могут присутствовать в смеси для амплификации, то выгодно использовать характеристическую точку в ранней части экспоненциальной фазы, поскольку различия в эффективности амплификации имеют ограниченное влияние на этой стадии.
Другое преимущество использования минимума или перехода к минимуму меры беспорядочности эффективности амплификации в качестве характеристической точки происходит из того факта, что для многих применений желательно осуществлять амплификацию более чем одного вида нуклеиновой кислоты в одном реакционном объеме. Тем самым можно облегчить мультиплексный тип анализа (более одной мишени в одном объеме) или использование внутренних стандартов. Основные преимущества этих реакций в одном сосуде состоят в том, что нужно осуществлять манипуляции с меньшими реакционными объемами и что каждая нуклеиновая кислота в объеме подвергается одинаковому химическому окружению, которое может содержат ингибиторы реакции ПЦР. Необходимым условием таких анализов в одном сосуде является использование различных меток для каждого вида нуклеиновой кислоты для того, чтобы осуществлять мониторинг амплификации каждого вида отдельно. Доступно множество различных флуоресцентных красителей, которые можно использовать для этой цели в низких концентрациях. Однако при повышении концентрации взаимодействие флуорофоров может привести к искажению сигналов флуоресценции, таким образом, снижая точность анализа. Следовательно, чтобы минимизировать такое взаимодействие флуорофоров, предпочтительно использовать характеристическую точку в ранней части экспоненциальной фазы, когда концентрации меченых продуктов ПЦР являются сравнительно низкими.
Следовательно, другая цель настоящего изобретения состоит в том, чтобы предоставить способы количественного определения нуклеиновых кислот, где сигналы, которые используют для количественного определения, представляют собой сигналы, полученные в ранней части экспоненциальной фазы амплификации. В предпочтительных вариантах осуществления настоящего изобретения считают, что ранняя часть экспоненциальной фазы амплификации представляет собой одно из следующего: первая половина экспоненциальной фазы, первые 10 циклов экспоненциальной фазы, первые пять циклов экспоненциальной фазы, первые три цикла экспоненциальной фазы или первый цикл экспоненциальной фазы.
Определение абсолютного и относительного количества
Настоящее изобретение относится к способам определения относительного количества нуклеиновых кислот, которые содержат стадии:
(a) амплификация каждой из по меньшей мере одной нуклеиновой кислоты-мишени, которая содержится в образце, и одновременное получение сигналов, коррелирующих с амплификацией каждой из по меньшей мере одной нуклеиновой кислоты-мишени,
(b) амплификация каждого из по меньшей мере одного образца нуклеиновой кислоты для сравнения и одновременное получение сигналов, коррелирующих с амплификацией каждой из по меньшей мере одной нуклеиновой кислоты для сравнения,
(c) введение поправки в полученные сигналы для учета фоновых сигналов,
(d) вычисление эффективности амплификации для смежных циклов Ê(C) для каждого цикла амплификации нуклеиновой кислоты-мишени и нуклеиновой кислоты для сравнения,
(e) вычисление меры беспорядочности M эффективности амплификации для смежных циклов Ê(C) для нуклеиновой кислоты-мишени и нуклеиновой кислоты для сравнения,
(f) идентификация числа циклов CM, где M минимально для нуклеиновой кислоты-мишени и нуклеиновой кислоты для сравнения,
(g) вычисление характеристических чисел циклов CC по величинам CM,
(h) определение относительных количеств каждой из по меньшей мере одной нуклеиновой кислоты-мишени в образце по отношению к нуклеиновым кислотам для сравнения посредством сравнения CC мишени и образцов для сравнения.
Настоящее изобретение дополнительно относится к способам определения абсолютного количества по меньшей мере одной нуклеиновой кислоты-мишени в образце, которые содержат стадии:
(a) амплификация каждой из по меньшей мере одной нуклеиновой кислоты-мишени, которая содержится в образце, и одновременное получение сигналов, коррелирующих с амплификацией каждой из по меньшей мере одной нуклеиновой кислоты-мишени,
(b) амплификация образцов серии разведений стандарта нуклеиновой кислоты с известной концентрацией и одновременное получение сигналов, коррелирующих с амплификацией нуклеиновых кислот в образцах стандарта,
(c) введение поправки в полученные сигналы для учета фоновых сигналов,
(d) вычисление эффективности амплификации для смежных циклов Ê(C) для каждого цикла амплификации мишеней и образцов стандарта,
(e) вычисление меры беспорядочности M эффективности амплификации для смежных циклов Ê(C) для мишеней и образцов стандарта,
(f) идентификация числа циклов CM, где M минимально для мишеней и образцов стандарта,
(g) вычисление характеристических чисел циклов CC по величинам CM,
(h) определение исходных количеств каждой из по меньшей мере одной нуклеиновой кислоты-мишени в образце посредством сравнения CC мишеней и образцов стандарта.
Настоящее изобретение дополнительно относится к способам определения величины Ct по меньшей мере одой нуклеиновой кислоты-мишени в образце, которые содержат стадии:
(a) амплификация каждой из по меньшей мере одной нуклеиновой кислоты-мишени, которая содержится в образце,
(b) одновременное получение сигналов, коррелирующих с амплификацией каждой из по меньшей мере одной нуклеиновой кислоты-мишени,
(c) введение поправки в полученные сигналы для учета фоновых сигналов,
(d) вычисление эффективности амплификации для смежных циклов Ê(C) для каждого цикла амплификации каждой нуклеиновой кислоты-мишени,
(e) вычисление меры беспорядочности M эффективности амплификации для смежных циклов Ê(C) для каждой нуклеиновой кислоты-мишени,
(f) идентификация числа циклов CM, где M минимально для каждой нуклеиновой кислоты-мишени,
(g) вычисление характеристических чисел циклов CC по величинам CM,
(h) вычисление величин Ct по величинам CC.
Полученные величины Ct можно использовать для количественного определения нуклеиновых кислот известными в данной области способами.
Настоящее изобретение дополнительно относится к способам определения относительного количества по меньшей мере одной нуклеиновой кислоты-мишени в образце, которые содержат стадии:
(a) введение поправки в полученные сигналы для кривых амплификации по меньшей мере одной нуклеиновой кислоты-мишени и по меньшей мере одной нуклеиновой кислоты для сравнения для учета фоновых сигналов,
(b) вычисление эффективности амплификации для смежных циклов Ê(C) для каждого цикла амплификации нуклеиновой кислоты-мишени и нуклеиновой кислоты для сравнения,
(c) вычисление меры беспорядочности M эффективности амплификации для смежных циклов Ê(C) для нуклеиновой кислоты-мишени и нуклеиновой кислоты для сравнения,
(d) идентификация числа циклов CM, где M минимально для нуклеиновой кислоты-мишени и нуклеиновой кислоты для сравнения,
(e) вычисление характеристических чисел циклов CC по величинам CM,
(f) определение относительных количеств каждой из по меньшей мере одной нуклеиновой кислоты-мишени в образце по отношению к нуклеиновым кислотам для сравнения посредством сравнения CC мишени и образцов для сравнения.
Настоящее изобретение дополнительно относится к способам определения абсолютного количества по меньшей мере одной нуклеиновой кислоты-мишени в образце, которые содержат стадии:
(a) введение поправки в полученные сигналы для кривых амплификации по меньшей мере одной нуклеиновой кислоты-мишени и образцов серии разведений стандарта нуклеиновой кислоты с известной концентрацией для учета фоновых сигналов,
(b) вычисление эффективности амплификации для смежных циклов Ê(C) для каждого цикла амплификации мишеней и образцов стандарта,
(c) вычисление меры беспорядочности M эффективности амплификации для смежных циклов Ê(C) для мишеней и образцов стандарта,
(d) идентификация числа циклов CM, где M минимально для мишеней и образцов стандарта,
(e) вычисление характеристических чисел циклов CC по величинам CM,
(f) определение исходных количеств каждой из по меньшей мере одной нуклеиновой кислоты-мишени в образце посредством сравнения CC мишеней и образцов стандарта.
Настоящее изобретение дополнительно относится к способам определения величины Ct по меньшей мере одной нуклеиновой кислоты-мишени в образце, которые содержат стадии:
(a) введение поправки в полученные сигналы для кривых амплификации по меньшей мере одной нуклеиновой кислоты-мишени для учета фоновых сигналов,
(b) вычисление эффективности амплификации для смежных циклов Ê(C) для каждого цикла амплификации каждой нуклеиновой кислоты-мишени,
(c) вычисление меры беспорядочности M эффективности амплификации для смежных циклов Ê(C) для каждой нуклеиновой кислоты-мишени,
(d) идентификация числа циклов CM, где M минимально для каждой нуклеиновой кислоты-мишени,
(e) вычисление характеристических чисел циклов CC по величинам CM,
(f) вычисление величин Ct по величинам CC.
Полученные величины Ct можно использовать для количественного определения нуклеиновых кислот известными в данной области способами.
Определение относительного количества нуклеиновых кислот в соответствии с настоящим изобретением относится к получению количественной меры отношения количеств соответствующих нуклеиновых кислот в образце перед анализом.
Определение абсолютного количества нуклеиновой кислоты в соответствии с настоящим изобретением относится к получению абсолютной меры количества нуклеиновой кислоты в образце перед анализом, например, числа копий или количества вещества.
Нуклеиновые кислоты, к которым можно применять настоящее изобретение, содержат ДНК, РНК, а также нуклеиновые кислоты с модифицированными остовами и/или структурами оснований. Обычно амплификацию осуществляют посредством полимеразной цепной реакции (ПЦР) посредством способов и с помощью инструментария, доступного профессионалу в данной области. Однако для целей этого изобретения нуклеиновые кислоты, которые нельзя амплифицировать непосредственно с помощью ПЦР, можно транскрибировать в ДНК средствами, известными профессионалу в данной области. Например, РНК можно транскрибировать в ДНК перед амплификацией, используя фермент обратную транскриптазу. Для того чтобы сделать возможным восстановление исходных количеств соответствующих нуклеиновых кислот, такой процесс транскрипции следует осуществлять в условиях, которые позволяют делать сравнительно точные предположения относительно отношения количества нуклеиновой кислоты, которую транскрибировали в ДНК, и ДНК, которую получили в ходе транскрипции. Условия реакции такого типа хорошо известны в данной области.
Каждую нуклеиновую кислоту, которую амплифицировали в ходе практического выполнения настоящего изобретения, обычно амплифицируют избирательным образом. Один способ достижения избирательной амплификации во время ПЦР заключается в использовании специфических праймеров. Создание и использование таких праймеров хорошо известно профессионалам в данной области.
В соответствии с настоящим изобретением сигналы, коррелирующие с амплификацией нуклеиновых кислот, регистрируют по мере осуществления реакции амплификации. Представление сигналов, зарегистрированных по мере осуществления всех циклов реакции амплификации, в целом обозначают кривой амплификации. Обычно такие сигналы представляют собой излучение флуоресценции, однако настоящее изобретение также включает другие сигналы, используемые в данной области. Излучение флуоресценции могут испускать флуоресцентные красители, некоторые из которых известны в данной области. Некоторые флуоресцентные красители имеют спектры поглощения и испускания, которые в достаточной мере разделены для того, чтобы сделать возможным параллельное определение в одном и том же образце.
Для целей настоящего изобретения амплификацию нуклеиновых кислот, т.е. получение нуклеиновых кислот посредством реакции амплификации, определяют посредством регистрации сигналов, которые коррелируют с амплификацией нуклеиновых кислот. Этого можно достичь, например, посредством флуоресцентно меченных зондов для гибридизации, которые испускают специфические сигналы после связывания с мишенью, или посредством ДНК-интеркалирующих флуоресцентных красителей, которые позволяют определять двухцепочечный продукт. Такие флуоресцентно меченные зонды для гибридизации и ДНК-интеркалирующие флуоресцентные красители хорошо известны в данной области. В предпочтительном варианте осуществления настоящего изобретения амплификацию нуклеиновых кислот определяют с помощью по меньшей мере одного из следующего: флуоресцентно меченные зонды для гибридизации, зонды для гибридизации FRET, молекулярные маяки, праймеры-"скорпионы", праймеры Lux, зонды TaqMan, связывающиеся с ДНК красители.
Настоящее изобретение содержит способы и средства для анализа нуклеиновых кислот. Один анализ может относиться к одному виду нуклеиновой кислоты-мишени или более чем к одному виду нуклеиновой кислоты-мишени. В тех случаях, где анализу подвергают более чем одну нуклеиновую кислоту-мишень, сигналы, которые регистрируют для мониторинга амплификации каждой нуклеиновой кислоты-мишени, должны представлять собой различимые сигналы, т.е. сигналы, которые можно регистрировать раздельно в одно и то же время. Способы и средства для получения таких сигналов хорошо известны в данной области. Например, некоторые флуоресцентные красители имеют спектры поглощения и испускания, которые разделены в достаточной мере, чтобы сделать возможным параллельную регистрацию их сигналов флуоресценции в одно и то же время. Таким образом, настоящее изобретение содержит мультиплексные анализы нескольких мишеней в образце в одно и то же время.
В соответствии с настоящим изобретением нуклеиновые кислоты для сравнения можно использовать для определения эталонных величин для определения относительного количества нуклеиновых кислот-мишеней. Одну или несколько таких нуклеиновых кислот для сравнения можно использовать в соответствии с настоящим изобретением. Не нужно знать абсолютное количество нуклеиновой кислоты для сравнения в образце перед анализом. Например, можно использовать мРНК конститутивных генов в клетке в качестве нуклеиновых кислот для сравнения. Для того чтобы посредством ПЦР амплифицировать мРНК, обычно ее предварительно транскрибируют в ДНК.
В соответствии с настоящим изобретением серию разведений стандарта нуклеиновой кислоты с известной концентрацией можно использовать для определения эталонных величин для определения абсолютного количества нуклеиновых кислот-мишеней. Мишени и разведенные образцы стандарта нуклеиновой кислоты одновременно можно анализировать в различных реакционных объемах или в одном реакционном объеме. Если анализ одновременно осуществляют в одном реакционном объеме, различные нуклеиновые кислоты и различные образцы серии разведений следует определять с использованием различимых сигналов, т.е. сигналов, которые можно раздельно регистрировать в одно и то же время.
В ходе практического выполнения настоящего изобретения фоновую составляющую вычитают из зарегистрированных сигналов. Для того чтобы осуществить такое введение фоновой поправки, линейную кривую моделируют в течение нескольких первых циклов кривой амплификации, например, посредством линейной регрессии. Предпочтительно первые 10 циклов кривой амплификации используют для создания этой линейной кривой. Альтернативно, можно использовать способ статистических тестов для определения тех циклов кривой амплификации, которые подходят для создания этой линейной кривой, в частности, когда сигнал содержит шумы. Впоследствии эту линейную кривую вычитают из кривой амплификации.
В соответствии с настоящим изобретением эффективность амплификации для смежных циклов Ê вычисляют, используя формулу:
Ê(C)=[Ĩ(C+1)/Ĩ(C)]-1,
где Ê = эффективность амплификации для смежных циклов,
C = число циклов,
Ĩ = интенсивность сигнала, скорректированная с учетом фонового сигнала.
В некоторых вариантах осуществления настоящего изобретения эффективность амплификации Ê вычисляют с использованием величин Ĩ для более чем двух последовательных циклов, т.е. применяют сглаживание. В предпочтительных вариантах осуществления настоящего изобретения сглаживание применяют с использованием 3, 5 или 7 частных значений.
На фиг.2 представлены численно вычисленные кривые Ê(C) трех ПЦР амплификаций, вначале которых исходное количество ДНК составляло 106 копий в 25 мкл.
В соответствии с настоящим изобретением вычисляют меру беспорядочности M эффективности амплификации для смежных циклов Ê(C). Спектральная энтропия является примером такой меры беспорядочности. Спектральную энтропию можно вычислить по формуле
(1) Сформировать массив Ê(C) как
W(C)=[Ê(C-L), Ê(C-L+1),..., Ê(C),..., Ê(C+L-1), Ê(C+L)],
где 2L+1 представляет собой число Ê в этом массиве, которое расположено в центре цикла C. Предпочтительно L принимает значение 3 или 4, и поэтому W(C) имеет 7 или 9 элементов. Для того чтобы показатель Ê не был ниже единицы или не превышал последнее доступное число циклов Cmax кривой амплификации, C должно находиться в диапазоне
L<C<=(Cmax-L);
(2) Применить дискретное преобразование Фурье (DFT) к W(C), чтобы получить массив S(C), который обычно содержит комплексные значения,
S(C)= DFT{W(C)}=[s(1), s(2),..., s(2N-1), s(2N)],
где 2N представляет собой размер DFT и может составлять, например, 16 или 32;
(3) Взять модуль S(C) и сформировать новый массив с использованием части его элементов
P(C)=[|s(2)|, |s(3)|,..., |s(N-1)|, |s(N)|];
(4) Нормализовать суммирование элементов P(C), чтобы оно приняло значение единицы, чтобы получить
Pn(C)=P(C)/sum{P(C)},
где sum{ } представляет собой оператор массива, который вычисляет сумму элементов массива;
(5) Вычислить спектральную энтропию (M) массива Pn(C) как
M(C)=sum{Pn(C)*log2{Pn(C)}},
где как умножение *, так и операцию логарифмирования осуществляют поэлементно;
(6) Обновить массив W(C) посредством размещения его центра в цикле C+1 и повторения стадий (1)-(5).
Указанным выше способом вычисляют спектральную энтропию (M) для Ê(C) как функцию C. Чем меньше спектральная энтропия, тем ниже степень беспорядочности сигнала.
M характеризуют посредством выраженного минимума, который расположен после начальной фазы и в экспоненциальной фазе кривой амплификации.
Настоящее изобретение содержит варианты осуществления, в которых используют другие меры беспорядочности. Примерами других мер беспорядочности являются: (a) Остаточная ошибка полиномиальной аппроксимации кривой; (b) подсчет пересечений нуля; (c) вычисление энергии (RMS) после высокочастотной фильтрации. Все эти способы выполняют с указанным выше массивом W(C). Предшествующий способ (a) основан на представлении о том, что полиномиальную функцию не более чем с определенной точностью можно аппроксимировать к детерминированной функции, но не к стохастической функции. В последних двух способах ((b) и (c)) используют такое наблюдение, что шум совершает вокруг своего среднего значения большие колебания, чем детерминированный сигнал и, таким образом, происходит больше пересечений нуля, а также образуется больше энергии.
В соответствии с настоящим изобретением определяют число циклов CM, где M имеет минимальную величину. CM можно получить численно в соответствии с основными алгоритмами, хорошо известными в данной области. В некоторых вариантах осуществления настоящего изобретения число циклов CM определяют как цикл, где M достигает своего минимума в первый раз.
В соответствии с настоящим изобретением характеристические числа циклов CC вычисляют по величинам CM. Это вычисление осуществляют для того, чтобы сделать поправку на ширину любых использованных интервалов при вычислении меры беспорядочности. Например, если M вычисляют как спектральную энтропию, как описано выше, CC получают из CM, вычитая L
CC=CM-L,
где L представляет собой половину разложения массива W(C).
В зависимости от способа, используемого для вычисления меры беспорядочности, профессионалу в данной области очевидны другие способы получения CC из CM. Кроме того, настоящее изобретение содержит варианты осуществления, где величину CM используют в качестве величины CC, т.е. где CC=CM.
Величины CC можно использовать для вычисления величин Ct (пороговое число циклов), которое в свою очередь можно использовать для количественного определения нуклеиновых кислот способом, известным профессионалу в данной области (см., например, JD Durtschi et al. Analytical biochemistry 2007 (361) 55-64). В предпочтительном варианте осуществления настоящего изобретения величины Ct вычисляют по величинам CC, принимая величины CC в качестве величин Ct, т.е. Ct=CC.
В соответствии с настоящим изобретением определение относительного количества (R) нуклеиновой кислоты-мишени (T) по отношению к нуклеиновой кислоте для сравнения (#) можно осуществить посредством вычисления
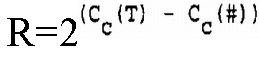
где R = отношение количеств нуклеиновой кислоты-мишени и нуклеиновой кислоты для сравнения,
Cc(T) = величина CC для нуклеиновой кислоты-мишени,
Cc(#)=величина CC для нуклеиновой кислоты для сравнения.
Альтернативно, если доступна информация относительно эффективности амплификации Ê, то отношение R можно вычислить следующим образом:
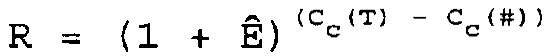
В соответствии с настоящим изобретением определение исходных количеств каждой нуклеиновой кислоты-мишени в образце посредством сравнения CC мишеней и образцов стандарта можно осуществить следующим образом:
Построение калибровочной кривой по образцам стандарта (исходные концентрации образцов стандарта в зависимости от величин CC образцов стандарта) и использование этой калибровочной кривой для получения исходной концентрации мишени по величине CC для мишени. Калибровочная кривая может представлять собой линейную функцию величин CC в зависимости от логарифмов величин концентраций. Однако настоящее изобретение также включает альтернативные способы, известные в данной области.
Настоящее изобретение содержит способы и средства, которые позволяют осуществлять способы по изобретению автоматизированным образом, т.е. при минимальном взаимодействии с человеком или вовсе без такого взаимодействия. В предпочтительном варианте осуществления настоящее изобретение относится к способам и средствам, которые позволяют осуществлять способы по изобретению без взаимодействия с человеком. Настоящее изобретение позволяет профессионалу в данной области использовать инструментарий, доступный в данной области, для осуществления способов по изобретению при минимальном взаимодействии с человеком или вовсе без такого взаимодействия. В предпочтительном варианте осуществления настоящее изобретение позволяет профессионалу в данной области использовать инструментарий, доступный в данной области, для осуществления способов по изобретению без взаимодействия с человеком.
Машиночитаемая среда
Настоящее изобретение относится к машиночитаемой среде, которая содержит инструкции для осуществления стадии с (c) по (h) способов по изобретению.
Устройство для анализа образцов нуклеиновых кислот
Настоящее изобретение относится к устройству для анализа образцов нуклеиновых кислот, содержащему машиночитаемое запоминающее средство, содержащее информацию для осуществления способов по изобретению.
Примеры
Пример 1
Полученные разведением образцы ДНК Staphylococcus aureus (5' часть геномного фрагмента 442 Sau3A1, 256 пар оснований в pCR2.1-TOPO, клонированном из S. aureus ATCC-25923) в объеме 25 мкл и с концентрацией 106, 105, 104, 103, 102 копий в 25 мкл амплифицировали в отдельных сосудах с помощью 40 циклов ПЦР на термоциклере для ПЦР в реальном времени ABI 7099HT версии 2.3. Для реакции ПЦР использовали Taqman Universal PCR mastermix компании ABI и зонды TaqMan FAM-Black Hole Quencher 1. Получали продукт амплификации. В полученные сигналы вводили поправку для учета фоновых сигналов посредством моделирования линейной функции сигнала, полученного в течение первых 10 циклов ПЦР, и вычитания этой линейной кривой из кривых амплификации, полученных для каждого образца. На фиг.3A представлены полученные кривые. Эффективность амплификации для смежных циклов Ê(C) вычисляли для каждой кривой амплификации, используя уравнение
Ê(C)=[Ĩ(C+1)/Ĩ(C)]-1,
где Ê = ффективность амплификации для смежных циклов,
C = число циклов,
Ĩ = интенсивность сигнала, скорректированная с учетом фонового сигнала.
Спектральную энтропию вычисляли в качестве меры беспорядочности M эффективности амплификации для смежных циклов Ê(C) для каждой кривой амплификации. Вычисляли скользящий интервал из 9 точек вдоль кривой Ê(C), отражающий степень беспорядочности частных значений внутри интервала. Результат представлен на фиг.3B: спектральная энтропия M отображает выраженные минимумы для эффективности амплификации для смежных циклов Ê(C) каждой реакции амплификации. Величины, полученные для CM, составляют 20, 23, 26, 31 и 34 для концентраций 106, 105, 104, 103 и 102 копий в 25 мкл соответственно. Величины для CC, вычисленные по формуле CC=CM-4, таким образом составляют 16, 19, 22, 27 и 30 для концентраций 106, 105, 104, 103 и 102 копий в 25 мкл, соответственно. Линейная регрессия величин CC, полученная для зависимости от логарифмов соответствующих чисел копий, давала коэффициент Пирсона R2=0,9908, что указывает на хорошее соответствие результатов линейной зависимости, как и ожидалось.