Результат интеллектуальной деятельности: ВОЛОКОННО-ОПТИЧЕСКИЙ НЕЙРОИНТЕРФЕЙС И СПОСОБ ДЛЯ ДОЛГОВРЕМЕННОЙ ОПТИЧЕСКОЙ РЕГИСТРАЦИИ ПРОЦЕССОВ В МОЗГЕ ЖИВЫХ СВОБОДНО ДВИЖУЩИХСЯ ЖИВОТНЫХ
Вид РИД
Изобретение
Предлагаемое изобретение относится к волоконно-оптическим устройствам и способам, предназначенным для проведения измерений функционально значимых нейрофизиологических процессов, происходящих в мозге живых свободно движущихся лабораторных животных, оптическими методами.
Для того, чтобы понять, какие клеточные и системные процессы лежат в основе специфичного поведения, адаптации и обучения животных, необходимо визуализировать работу мозга и проводить исследования различных динамических свойств нейронов живых активных животных, вовлеченных в разнообразные виды когнитивной деятельности. В настоящее время для визуализации процессов, происходящих в клетке, в условиях сильно рассеивающих биологических сред, для увеличения глубины доставки излучения и сбора оптического отклика под поверхностью биологической ткани используют нелинейно-оптические методики или применяют волоконно-оптические эндоскопы для оптической in vivo визуализации нейронной активности. Работа с живыми объектами в режиме in vivo накладывает особые требования к устройствам визуализации, поэтому возникает существенная необходимость в новых подходах и методах визуализации различных биохимических процессов, протекающих в нервных клетках различных структур мозга живого бодрствующего животного. Возможность визуализации биологических структур внутри живых организмов глубоко внутри тела незаменима, как в исследовательских задачах, так и в задачах диагностики. Основными условиями подобных исследований является необходимость их проведения в режиме реального времени и с высоким пространственным разрешением. Оптические методы являются одними из наиболее перспективных направлений проведения диагностики и измерений в биологии и биомедицинских приложениях и являются практически безальтернативным способом наблюдения за молекулярными процессами в отдельных клетках в контексте функциональной активности всего живого организма.
Применение волоконно-оптических эндоскопов для доставки излучения и сбора оптического отклика позволяет ценой минимального вмешательства в исследуемую систему преодолеть проблемы проникновения возбуждающего излучения и рассеяния. Возможность визуализации биологических структур внутри живых организмов глубоко внутри тела незаменима, как в исследовательских задачах, так и в задачах диагностики.
Волоконно-оптические флуоресцентные эндоскопы хорошо себя зарекомендовали, как инструменты для минимально возмущающей визуализации глубоко лежащих структур биологических тканей, требуемых в задачах in vivo визуализации в живых свободноподвижных животных.
В публикации патентной заявки США US20060276866 описана система, содержащая микроэлектроды, имеющие кремниевую подложку и многочисленные проводящие электроды для глубокого мозгового электрического стимулирования или записи нервных сигналов. Подложка имеет верхний конец с многочисленными проводящими частями для соединения. Многочисленные каналы и места электродов могут точно быть установлены на одном устройстве для местной доставки лекарств или записи или стимулирования нейронов. Устройство содержит массив электрических контактов и встроенный кабель для разъема. Однако проблема с вживляемостью и сроком службы ограничивает их широкое применение, несмотря на использование губчатой платины, проводящих полимеров и высокостойких полимерных покрытий.
В публикации патентной заявки США US 20060293578 описан нейроинтерфейс, который содержит считыватель и массив устройств записи. Считыватель излучает и получает радиочастотные сигналы. Массив записывающих устройств включает беспроводную секцию и сенсорную секцию. Беспроводная секция включает преобразователь, антенну и модулятор. Преобразователь преобразует радиочастотный сигнал. Сенсорная секция принимает стабильные силовые сигналы. Сенсорная секция приспособлена для обнаружения нервной деятельности и выдает выходные сигналы, содержащие информацию, указывающую на такую нервную деятельность модулятору беспроводной секции, посредством чего модулятор передает информацию на выходные сигналы считывателя.
В публикации патентной заявки США US 20090088680 описана система для стимулирования клеток, содержащая удлиненную конструкцию, имеющую два конца и канал, для вставки через череп и в мозг, резервуар для хранения вирусных векторов для экспрессии, по меньшей мере, одного из ChR2 и NpHR в целевых нейронов; устройство для доставки, чтобы переместить вирусные векторы из резервуара через канал в целевые нейроны; оптическое волокно, которое вводят в канал и генератор светового излучения. При этом свет поступает через оптическое волокно и освещает область мозга, в котором расположены целевые нейроны.
В публикации патентной заявки США US 20110172653 описано оптическое устройство для доставки света в живой организм, содержащее: источник света; оптический элемент для его передачи, выполненный из материала, который является прозрачным для света, имеющий продолговатую форму; крепление для фиксации оптического элемента к пациенту; и тепловыделительную часть для отвода тепла из-под источника света.
В публикации патентной заявки США Mauna Kea Technologies US 20050242298 описаны устройство и принципиальные особенности получения изображений органов и тканей с клеточным разрешением с помощью многоканального волоконно-оптического зонда. В состав устройства входит оптическое многоканальное волокно, лазерный источник возбуждения, система заведения излучения в волокно на основе сканирующих гальванических зеркал и оптическая система регистрации. Через каналы оптического многоканального волокна излучение накачки передается к объекту, возбуждает флуоресцентный сигнал, который собирается и передается в систему регистрации тем же самым волокном.
Однако, указанные технические разработки не позволяют проводить исследования процессов формирования памяти и обучения живых свободноподвижных животных. Также недостатком вышеприведенных технических решений является то, что лабораторное животное должно постоянно содержаться в клетке, в непосредственной близости от системы регистрации, а возможность проводить биологические эксперименты на протяжении длительного времени является ключевой для многих исследований.
Таким образом, в настоящее время отсутствуют разработки по созданию оптоволоконных нейроинтерфейсов для комплексного исследования процессов когнитивных функций живых свободноподвижных животных, то есть, такого волоконно-оптического нейроинтерфейса, который бы удовлетворял целому ряду требований: был бы максимально легким и компактным для вживления в мозг, обеспечивал бы животному жизнь в естественных условиях вне времени проведения измерений, обеспечивал бы возможность точной адресации к одой и той же исследуемой области в течение длительного времени, а также обладал бы возможностью для одновременного параллельного оптического зондирования.
Задачей, которую решает заявленное изобретение, является создание волоконно-оптического нейроинтерфейса и способа для долговременной оптической регистрации процессов в мозге живых свободно движущихся животных, позволяющего осуществлять долговременную (в масштабах нескольких дней и недель) стабильную оптическую регистрацию нейронной активности у живых свободноподвижных животных, обеспечить возможность для параллельного оптического зондирования пространственно-разделенных функционально различающихся (не менее, чем двух) областей головного мозга живого бодрствующего животного.
Также задачей является осуществление долговременных параллельных измерений нейронной активности в нескольких пространственно-разнесенных областях мозга живых свободноподвижных животных и одновременная регистрация нейронной активности в нескольких глубоколежащих областях головного мозга живых свободноподвижных животных.
Поставленная задача решается тем, что волоконно-оптический нейроинтерфейс для долговременной оптической регистрации процессов в мозге живых свободно движущихся животных, включает, по крайней мере, по крайней мере, один зонд, соединенный с лазерной системой оптического возбуждения и системой регистрации и измерения отклика исследуемого участка мозга, которая соединена с компьютером, снабженным программным обеспечением для управления процессом измерения, сохранения и отображения результатов измерений. При этом зонд состоит из двух разъемных частей, где первая часть представляет собой керамическую ферулу весом менее 0.3 г, предназначенную для закрепления на черепе животного и выполненную с возможностью размещения в ней внутреннего отрезка оптоволокна, а вторая часть представляет собой ответную ферулу с закрепленным в ней внешним отрезком оптоволокна, размещенным в соединительном керамическом корпусе, выполненным с возможностью плотного соединения с ферулой первой части зонда. При этом внутренний отрезок оптоволокна имеет длину, обеспечивающую его внедрение в мозг животного на необходимую глубину для проведения соответствующих исследований с обеспечением оптической связи с внешним отрезком оптоволокна. Лазерная система оптического возбуждения состоит из, не менее трех, одночастотных лазеров с различными длинами волн излучения для мультиспектрального возбуждения, снабженных внешним амплитудным модулятором лазерного излучения, а соединение зонда с лазерной системой оптического возбуждения и системой регистрации оптического отклика реализовано посредством внешнего длинного отрезка оптоволокна, система регистрации и измерения отклика включает линзу или микроскопный объектив для эффективного вывода излучения из волокна, делительную пластину, настраиваемый полосовой фильтр, спектрометр, фотоэлектронный умножитель или чувствительный фотодиод, фотодиод для регистрации опорного сигнала, синхронный усилитель и аналого-цифровой преобразователь. Оптоволокно использовано стандартных типов со ступенчато изменяющимся показателем преломления, фотонно-кристаллических типов или многосердцевинных типов. Внешний диаметр волокна меняется от 125 до 250 мкм. Внутренний отрезок оптоволокна, выходящий за пределы ферулы и входящий в мозг животного, имеет длину от 0,1 до 10 мм.
Способ долговременной оптической регистрации процессов в мозге живых свободно движущихся животных, включающий установку, по крайней мере, одного зонда устройства в область черепа подопытного животного в проекции выбранного для исследования участка мозга, введение внутреннего отрезка оптоволокна через канал ферулы первой части зонда в указанный участок, затем, после вживления ферулы первой части зонда, к ней с помощью соединительного корпуса на время проведения измерений крепится ферула второй части зонда с внешним отрезком оптоволокна, далее излучением лазерного источника облучают указанный участок мозга, после чего в системе регистрации детектируют оптический отклик и проводят анализ данных с помощью компьютера. Предусмотрена возможность одновременно с первым зондом устанавливать второй зонд для обеспечения одновременной регистрации нейронной активности в нескольких областях головного мозга животного.
Выполнение заявленного волоконно-оптического нейроинтерфейса с зондом из двух разъемных частей позволяет создать для подопытных животных оптимальные условия для жизни, поскольку животные в большей части времени находятся в естественных или искусственно-созданных условиях в свободном состоянии. Выполнение первой части корпуса зонда в виде керамической ферулы миниатюрного размера и веса менее 0.3 грамм позволяет закрепить его на черепе подопытного животного малоинвазивным способом. Для этого с черепа анестезированного подопытного животного убирается шерсть, сверлится отверстие в черепе, и крепится ферула первой части зонда с помощью специального клея или цемента. Отрезок оптоволокна выходит за габариты ферулы на необходимую длину для достижения исследуемой области мозга, и эта длина меняется от 0,1 до 10 мм. Внешний диаметр волокна изменяется от 125 до 250 мкм. Волокно стерилизуется перед операцией по установке зонда. В дальнейшем, в виду своих малых размеров, корпус зонда не мешает подопытному животному в процессе его жизнедеятельности.
Вторая часть зонда содержит внешний отрезок оптоволокна, и его длина может меняться в зависимости от необходимой для проведения эксперимента длины. Закрепление внешнего отрезка оптоволокна в керамической феруле и использование соединительного керамического элемента позволяет создать устойчивое оптическое соединение между отрезком внутреннего оптоволокна волоконно-оптического нейроинтерфейса и внешним длинным отрезком оптоволокна нейроинтерфейса во время проведения исследования. При этом, конец внешнего отрезка оптоволокна нейроинтерфейса соединен с источником излучения для визуализации функциональных флуоресцентных маркеров и системой регистрации и измерения флуоресцентного отклика изучаемого объекта, которая соединена с компьютером с программным обеспечением для управления процессом измерения, отображения и сохранения экспериментальных данных.
В качестве зонда используется керамическая ферула, имеющая по центру отверстие диаметром от 126 до 270 мкм и весом до 0.3 г. Для изготовления первой части нейроинтерфейса, которая вживляется в мозг живого животного, оптическое волокно вклеивается в ферулу таким образом, что его первый конец выходит за пределы ферулы и предназначен для контакта с мозгом животного, а второй конец оптоволокна находится в феруле и предназначен для оптического соединения с первым концом отрезка оптоволокна второй части нейроинтерфейса в зонда. Длина выступающего отрезка оптоволокна первой части зонда регулируется путем скалывания волокна на заданном расстоянии от ферулы с помощью алмазного или рубинового ножа и подбирается в зависимости от целей эксперимента для адресации к различным структурам мозга живого животного. Второй конец оптоволокна полируется таким образом, что торец волокна и торец ферулы образуют одну плоскость. Для обеспечения стабильного соединения обеих частей зонда диаметр внутреннего отверстия ферулы должен практически совпадать с внешним диаметром используемого волокна. Для оптимального соединения внешний диаметр волокна должен быть на 1 мкм меньше, чем диаметр внутреннего отверстия ферулы. Расположение волокон первой и второй частей зонда является соосным, что обеспечивается наличием соединительного керамического корпуса. Процедура изготовления первой части зонда обеспечивает возможности для использования в качестве зондов различных типов оптоволокон: стандартных волноводов со ступенчато изменяющимся показателем преломления, фотонно-кристаллических волноводов, а также многосердцевинных оптоволокон.
Зонд соединяют с источником излучения для визуализации функциональных флуоресцентных маркеров и системой регистрации флуоресцентного отклика изучаемого объекта только во время измерений. Данная схема метода крепления оптоволокна дает возможность проводить долговременный ряд экспериментов на одном и том же животном в любой структуре мозга и при этом сохранять уверенность в получении сигнала от одной и той же группы клеток. При этом весь период времени между измерениями животные могут жить в своих домашних клетках без опасности повредить оптоволокно.
Лазерная система оптического возбуждения состоит из, не менее трех, одночастотных лазеров с различными длинами волн излучения, снабженных внешним амплитудным модулятором лазерного излучения, а система регистрации и измерения флуоресцентного отклика состоит из спектрометра, фотоэлектронного умножителя, оптического полосового фильтра, синхронного усилителя и аналого-цифрового преобразователя, совмещенного с компьютером. Выполнение лазерной системы оптического возбуждения из, не менее трех, одночастотных лазеров, снабженных внешним амплитудным модулятором лазерного
излучения, с различными длинами волн излучения обеспечивает мультиспектральность измерений. Поскольку полосы поглощения наиболее распространенных биомаркеров составляют десятки нанометров, то для большинства задач достаточно использовать три-четыре источника в спектральной области 400-600 нм (для специфических биомаркеров возможно использование дополнительных источников в более длинноволновой области спектра). Важной особенностью заявляемого устройства является использование одночастотных (с одной продольной модой) лазерных источников. В случае проведения флуоресцентных измерений это свойство источников накачки обеспечивает значительное уменьшение высокочастотных шумов и повышение стабильности измерений.
Приемниками излучения регистрируют флуоресцентный сигнал от исследуемых участков мозга используемых объектов.
Оптическое волокно имеет разнообразную структуру - во-первых, обладает одной световодной сердцевиной и оболочкой со ступенчатым профилем показателя преломления, характерным для стандартных телекоммуникационных волокон, при этом в зависимости от диаметра сердцевины режим распространения излучения может быть как многомодовым, так и одномодовым. Во-вторых, используемое волокно может быть фотонно-кристаллическим и иметь сложную микроструктурированную архитектуру, которое обеспечивает уникальные режимы распространения света, в том числе сильную локализацию света на торце волокна, обеспечивающее оптическое возбуждение области сопоставимое с размером клетки в мозге живой мыши. Волокно может быть также многоканальным, т.е. содержать большое число волноводных каналов для получения изображений клеточной структуры вживленной в мозг животных. Размеры световодных каналов многоканального оптоволокна и расстояние между ними составляет единицы микрометров, что позволяет получать изображения биологических тканей в эндоскопическом режиме с клеточным разрешением. Изображение исследуемого объекта формируется в конфокальном режиме из области прилегающего к торцу волокна и передается в обратном направлении в систему регистрации и измерения.
Разработанный нейроинтерфейс основан на использовании преимуществ волоконно-оптических технологий зондирования и позволяет достигнуть следующих преимуществ, необходимых при долговременной (в масштабах нескольких дней) регистрации нейронной активности в живых животных от одной и той же области мозга.
Во-первых, длинное и гибкое оптоволокно позволяет проводить все измерения на свободноподвижных животных, во время их активности и обучения. Во-вторых, т.к. один
из торцов оптоволокна все время проведения исследования жестко закреплен в интересующей нас области - все измерения на протяжении всего времени эксперимента (который может длиться больше месяца) проводятся на одной и той же группе клеток. При этом мы можем проводить неограниченное число измерений, т.к. каждое новое присоединение оптоволокна осуществляется к специальному соединительному элементу, не затрагивая, таким образом, ткани мозга, и, следовательно, не наносит каких-либо дополнительных повреждающих эффектов на мозг. Также с помощью реализованного нейроинтерфейса возможно, с одной стороны, регистрировать медленные процессы, протекающие в мозге на масштабе времени от нескольких часов до нескольких недель, с другой стороны, устройство позволяет регистрировать такие быстрые процессы, как изменение кальциевых токов, с разрешением в миллисекунды.
Компактность и малый вес зонда реализованного нейроинтерфейса обеспечивает возможность проведения долговременных параллельных измерений нейронной активности из нескольких (не менее чем двух) пространственно-разнесенных областей мозга живых свободноподвижных животных. Одновременная регистрация нейронной активности в нескольких глубоколежащих областях головного мозга живых свободноподвижных животных необходима в задачах исследования работы мозга как целой системы.
Кроме того, измерение из разных участков мозга позволяет одновременно осуществлять контрольные измерения, что в целом обеспечивает необходимое количество подопытных животных при сохранении необходимой статистики и в целом повышает достоверность измерений.
Техническим результатом изобретения является разработка устройства и способа для исследования тканей головного мозга свободноподвижных животных с высоким пространственным разрешением в эндоскопическом режиме на основе регистрации оптического сигнала, получаемого за счет различных физических методов возбуждения оптического отклика биологической ткани. Предлагаемое изобретение принципиально рассчитано на длительные, в масштабах нескольких недель, измерения нейронной активности. Созданная конструкция волоконно-оптического нейроинтерфейса позволяет размыкать корпус зонда, т.е. отделять ферулу с внутренним оптоволокном от ферулы с внешним оптоволокном и соединительным элементом, что дает возможность проводить долговременный ряд экспериментов на одном и том же животном в любой структуре мозга и при этом сохранять уверенность в получении сигнала от одной и той же группы клеток. При этом, благодаря максимально легкому (менее 0.3 грамма) и компактному размеру вживляемой системы (корпуса зонда), в период между измерениями животные могут жить в своих домашних клетках без каких-либо неудобств, а также без опасности повредить оптоволокно.
Важным преимуществом предлагаемого изобретения является возможность вживления зонда в несколько пространственно-разнесенных областей мозга для целей проведения параллельных измерений активности в этих областях, что обеспечивает как возможность контроля, так и получение принципиально различной информации о функциональной активности разнесенных в пространстве групп нейронов. Возможность использования различных типов волокон в нейроинтерфейсе обеспечивает, при использовании зонда, возможность пространственного разрешения вплоть до одного нейрона, а также получение изображений полученных результатов с помощью многоканального волокна.
Устройство иллюстрируется рисунком, представленными на Фиг. 1.
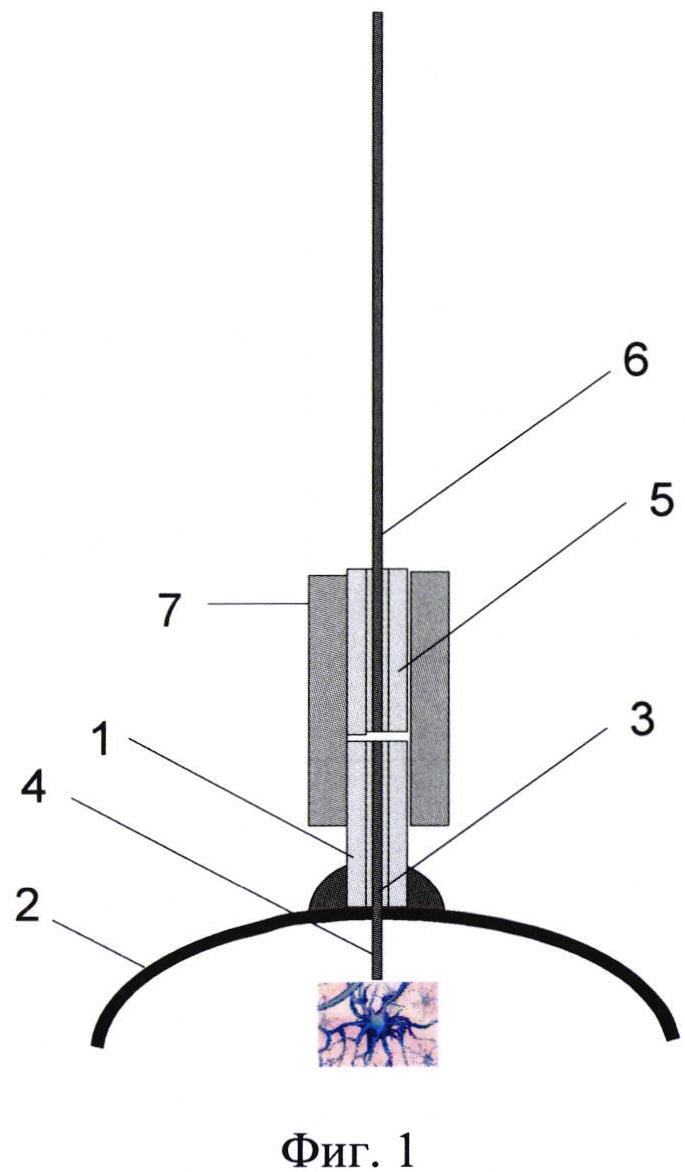
Фиг. 1 представляет собой общий вид зонда с керамической ферулой, вживленной в череп подопытного животного, с подсоединенным к нему внешним отрезком оптоволокна, на которой изображено: корпус первой части зонда в виде керамической ферулы - 1, закрепленной на кости - 2 черепа подопытного животного, внутренний отрезок оптоволокна - 3, при этом его первый конец - 4 выходит за пределы корпуса ферулы - 1 в мозг подопытного животного, а второй конец оптоволокна находится в феруле - 1 и оптически соединяется с внешним дойным отрезком оптоволокна - 6, который установлен в ответной керамической феруле - 5, и с помощью керамического соединительного элемента - 7 плотно крепится на корпус ферулы - 1.
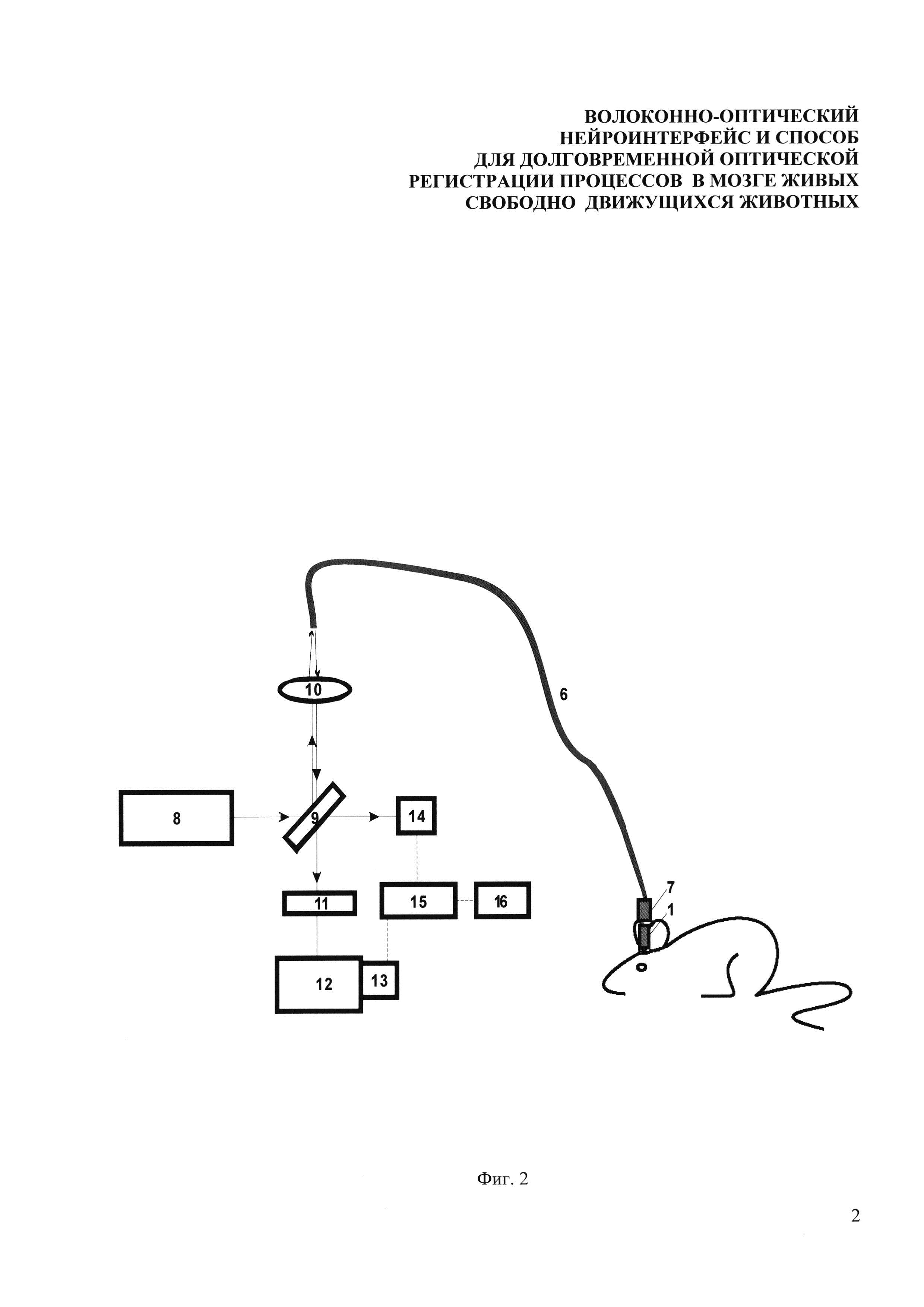
Фиг. 2. Схема проведения эксперимента с использованием размыкаемого зонда, в котором: 8 - лазерная система возбуждения, содержащая не менее трех одночастотных лазерных источника и систему амплитудной модуляции; 9 - делительная пластина (дихроичное зеркало или стеклянная пластина (клин)); 10 - линза или микроскопный объектив для эффективного заведения излучения в волокно; 6 - внешнее оптическое волокно, проходящее через соединительный элемент - 7; 1 - корпус зонда, в виде ферулы вживляемый в мозг подопытного животного; 11 - полосовой оптический фильтр; 12 - спектрометр; 13 - фотоэлектронный умножитель или чувствительный фотодиод; 14 - фотодиод для регистрации опорного сигнала; 15 - синхронный усилитель; 16 - аналого-цифровой преобразователь с компьютером.
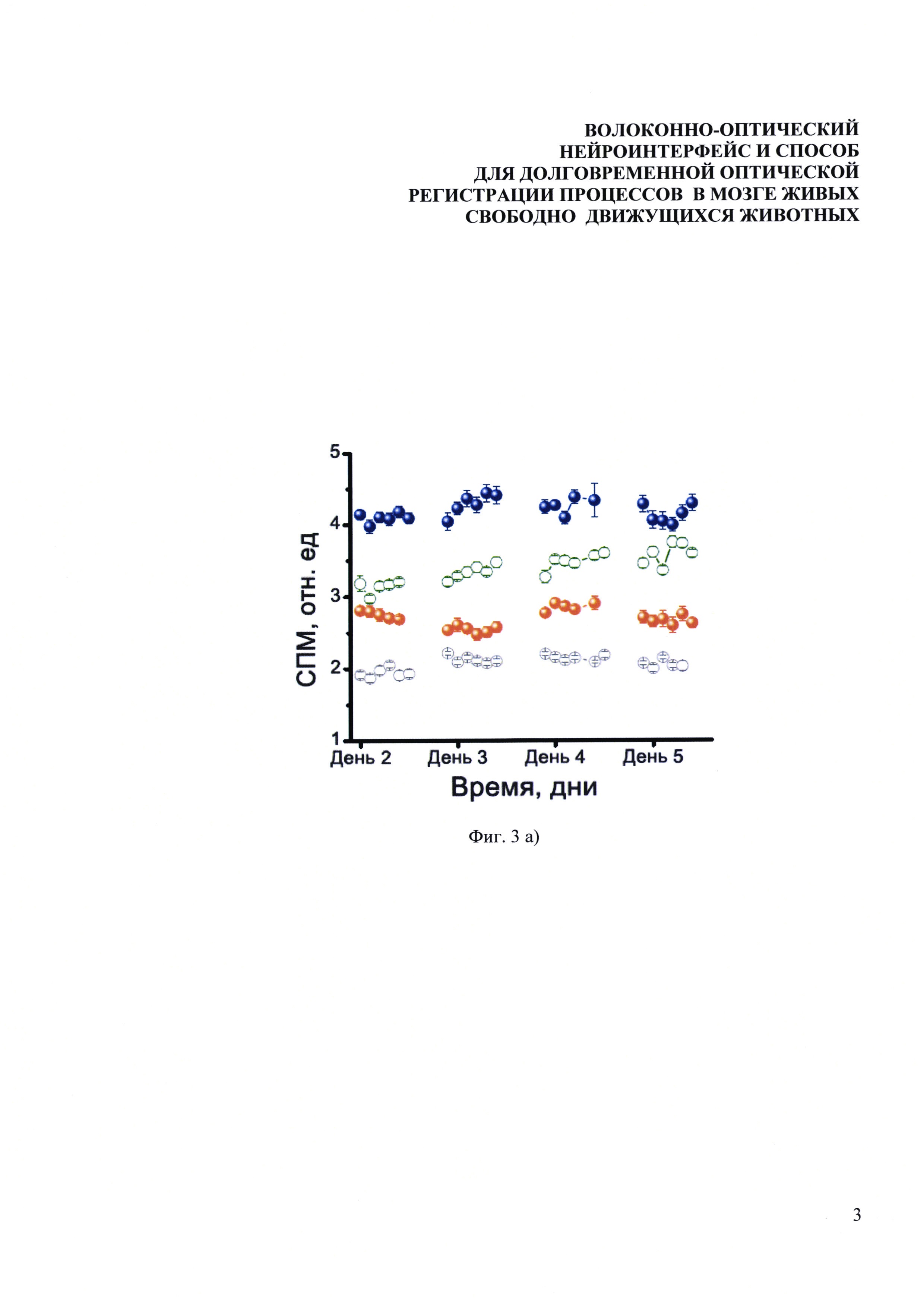
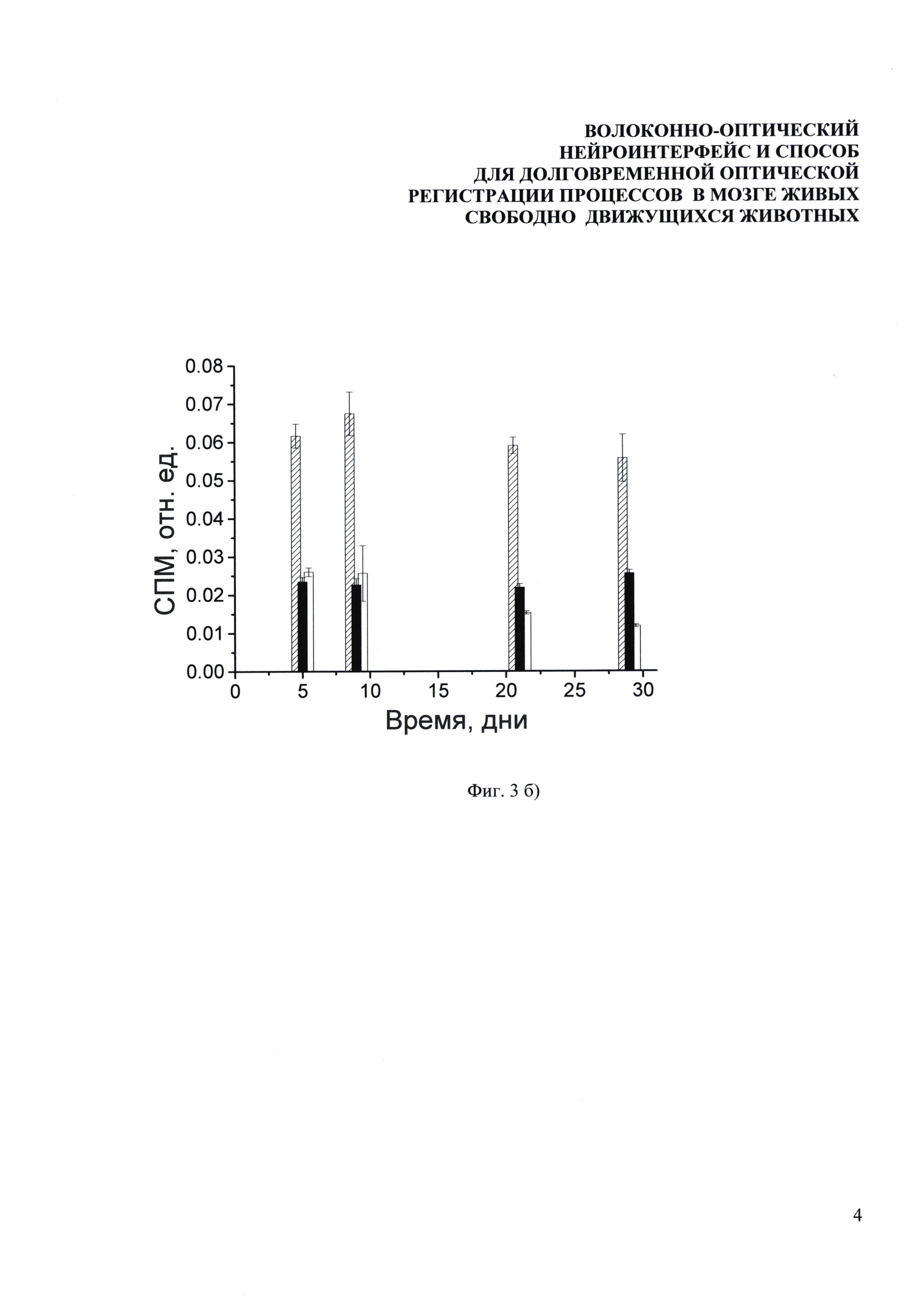
Фиг. 3. Долговременные измерения нейронной активности у мышей, содержащихся в стандартных лабораторных условиях без дополнительных воздействий. Зависимости уровня экспрессии EGFP от времени (а) измеренные для 4-х мышей на протяжении четырех дней после вживления оптоволокна в СА1 область гиппокампа (открытые кружочки) и бочонковые поля соматосенсорной коры (закрашенные кружочки), (б) измеренные для 3-х мышей на протяжении одного месяца. Одна точка соответствует (а) 10-ти минутам измерения (б) одному дню измерения. Отклонение сигнала в течение каждого из экспериментальных дней составляло менее 10%.
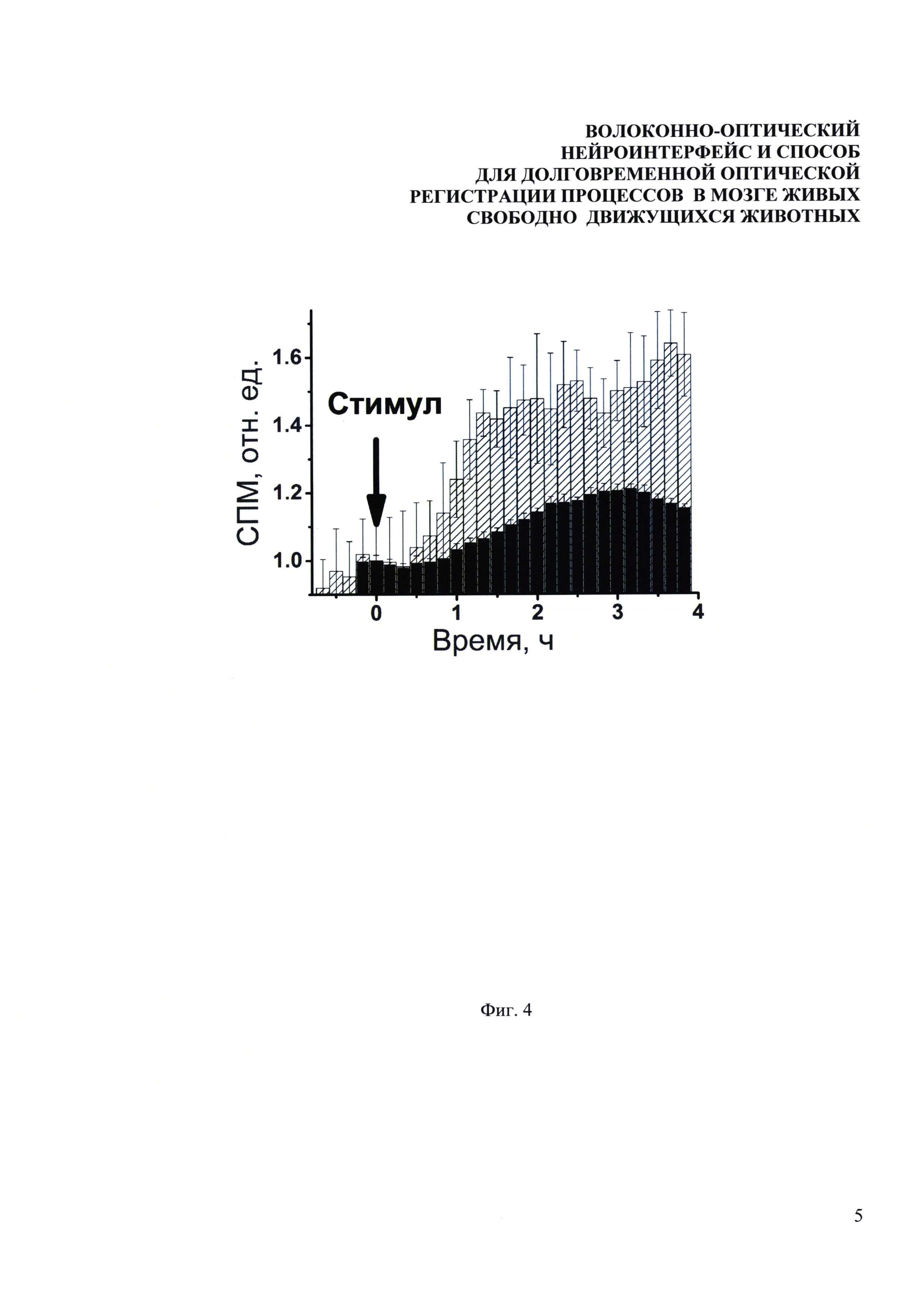
Фиг. 4. Экспериментально измеренные зависимости уровня экспрессии EGFP в СА1 области гиппокампа от времени в течение 4-х часов после электрокожной стимуляции (столбцы с диагональной штриховкой) и после введения судорожного агента пентилентетразола (черные столбцы). Момент стимуляции отмечен стрелкой.
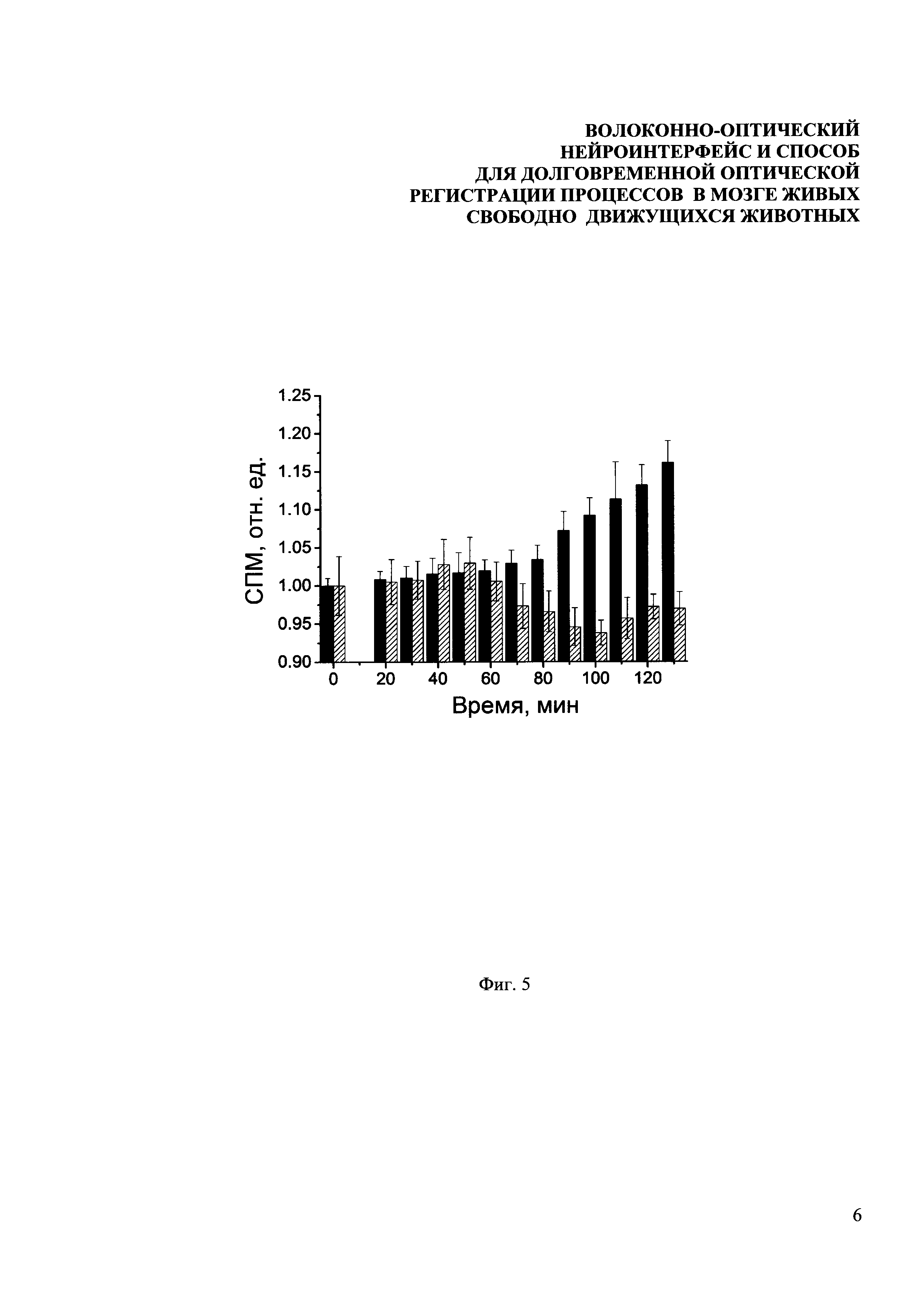
Фиг. 5. Зависимость уровня экспрессии маркерного белка EGFP от времени после унилатеральной стимуляции вибрисс. Черные столбцы соответствует данным для соматосенсорной коры контрлатерального полушария, столбцы с диагональной штриховкой - данным для ипсилатерального полушария.
Фиг. 6. Фотография экспериментального животного со вживленным с двумя зондами, закрепленными в нескольких пространственно-разделенных областях головного мозга.
Заявленное устройство используют следующим образом. На кость - 2 черепа подопытного животного с помощью специального клея или цемента крепят первую часть зонда - 1, выполненную в виде керамической ферулы с отверстием, в которое вклеен внутренний отрезок оптоволокна - 3, при этом его первый конец - 4 выходит на необходимую длину за пределы корпуса ферулы - 1 в мозг подопытного животного, а второй конец оптоволокна находится в корпусе ферулы - 1. Во время проведения исследования, внутренний отрезок оптоволокна 3 оптически соединяется с внешним длинным отрезком оптоволокна - 6, который закреплен в ответной керамической феруле - 5, и с помощью керамического соединительного элемента - 7 плотно крепится на корпусе ферулы - 1.
Рассмотрим примеры применения заявленного волоконно-оптического нейроинтерфейса в способе для долговременной оптической регистрации процессов в мозге живых свободно движущихся животных (работы проводились в МГУ имени М.В. Ломоносова). В представляемых экспериментах мы демонстрируем, что наличие волоконно-оптического нейроинтерфейса является определяющим звеном для регистрации нейронной активности живых животных, и обладает рядом несомненных преимуществ перед простым вживлением оптоволокна в мозг животного.
Отличительными особенностями представляемых экспериментов является использовании преимуществ нашего волоконно-оптического нейроинтерфейса для оптического зондирования в сочетании с генетически встроенными или апплицируемыми метками в биологических тканях, что позволяет проводить измерения уровня флуоресцентных маркеров в живых животных при их свободном поведении во время и после обучения. Специальная размыкаемая конструкция волоконно-оптического нейроинтерфейса дает возможность проводить долговременный ряд экспериментов на одном и том же животном в любой структуре мозга и при этом сохранять уверенность в получении сигнала от одной и той же группы клеток. При этом, благодаря максимально легкому и компактному размеру вживляемой части (корпуса зонда), весь период между измерениями животные могут жить в своих домашних клетках без каких-либо неудобств, а также без опасности повредить оптоволокно.
В экспериментах использовались самцы трансгенных мышей линии Zif-EGFP, у которых ген флуоресцентного белка EGFP встроен под промотор немедленно раннего гена zif/268 (Egr1). Мышей содержали в стандартных лабораторных клетках с постоянным доступом к воде и еде.
Принципиальная схема эксперимента представлена на Фиг. 2. Заявляемый способ состоит в следующем:
Возбуждение флуоресценции маркерного белка EGFP осуществлялось непрерывным излучением второй гармоники Nd: YAG лазера (8) на длине волны 473 нм, которое заводилось с помощью делительной пластины (9) и микрообъектива (10) в отрезок оптического волокна (6) с внешним диаметром оболочки 125 мкм и диаметром сердцевины 50 мкм. В качестве делительной пластины (9) возможно использовать либо дихроичное зеркало, либо стеклянный клин, отражающий от одной из граней около 4% накачки (френелевское отражение). По оптическому волокну (6) излучение проходило через соединительный элемент (7) и корпус (1) зонда, и далее доставлялось до выбранной области внутри мозга свободноподвижной мыши. Мощность излучения накачки, доставляемого по волокну и действующего на ткани мозга, не превышала 2 мкВт, чтобы избежать повреждений живой ткани, а также выгорания светочувствительного белка EGFP. Флуоресцентный отклик собирался тем же самым отрезком волокна, закрепленным в корпусе (1) зонда и передавался обратно по пути излучения накачки, затем отделялся при помощи делительной пластины (9) и оптического фильтра (11) и направлялся в систему регистрации. В системе регистрации имелась возможность контролировать спектральный состав флуоресцентного отклика при помощи спектрометра (12) и измерять его с помощью фотоэлектронного умножителя (13). Электрический сигнал с фотоэлектронного умножителя дополнительно фильтровался с помощью схемы синхронного детектирования, состоящего из фотодиода (14) и синхронного усилителя (15), что обеспечило требуемый низкий уровень шума и высокую долговременную стабильность. Анализ данных собирался и анализировался с помощью аналого-цифрового преобразователя и компьютера (16). С помощью фотодиода (14) также контролировалась долговременная стабильность лазерного источника. Для уменьшения уровня воздействия излучения на биологическую ткань при проведении экспериментов сигнал снимался не непрерывно на протяжении нескольких часов, а в течение одной минуты (полученные данные усреднялись) каждые 10 минут. Итоговая зависимость усреднялась бегущим средним по четырем точкам, чтобы избавится от более высокочастотных шумов и для наглядности оставить только общую динамику изменений.
В описываемых тестовых экспериментах использовались оптоволокна с диаметром сердцевины 50 мкм, которые обеспечивали согласно оценкам объем исследуемой области в 105 мкм3. С другой стороны, разработанная система универсальна и позволяет работать с разными типами оптических волокон, включая фотонно-кристаллические и многосердцевинные (многоканальные) волокна, что дает возможность подобрать необходимое в задаче пространственное разрешение зонда, вплоть до размеров одного нейрона. Также система позволяет использовать несколько лазерных источников с различными длинами волн для возбуждения различных маркеров.
В зависимости от целей эксперимента оптоволокно вживляли либо в область СА1 гиппокампа, либо в поле бочонков соматосенсорной коры. Координаты вживления определяли перед операцией с помощью стереотаксического атласа.
В специальной серии экспериментов были количественно оценены долговременные изменения уровня флуоресцентного отклика в мозге мышей со вживленным волоконным зондом, содержащихся в стандартных условиях без каких-либо дополнительных стимуляций. Для этого после проведения операции ежедневно или раз в несколько дней к корпусу зонда, закрепленному на голове мыши, присоединялся соединительный элемент с длинным оптоволокном, и в течение одного часа проводились измерения уровня экспрессии EGFP. На Фиг. 3 приведены нормированные результаты измерений экспрессии EGFP на протяжении четырех дней для четырех мышей, живущих все это время в своих домашних клетках без каких-либо дополнительных воздействий. У одних мышей оптоволокно было вживлено в СА1 область гиппокампа (открытые кружочки, Фиг. 3(а)), у других в бочонковые поля соматосенсорной коры (закрашенные кружочки, Фиг. 3(а)). Базальный уровень экспрессии zif-268 варьируется для различных мышей и разных структур мозга. Видно, что при отсутствии каких-либо раздражающих факторов сигнал флуоресценции остается стабильным во времени, как в течение одного дня, так и на протяжении четырех дней.
Для демонстрации возможностей долговременных измерений часть мышей жила в стандартных условиях со вживленным оптоволоконным зондом больше одного месяца, при этом регулярно проводились измерения уровня экспрессии маркерного белка EGFP. Результаты данных измерений для трех мышей представлены на Фиг. 3б, одна точка соответствует усредненным данным одного дня измерений. Максимальный разброс сигнала составляет менее 10%. видно, что динамика экспрессии EGFP в течение одного месяца немного отличается для разных животных и таким образом служит индикатором индивидуальных особенностей.
Следующие эксперименты были направлены на регистрацию изменения уровня экспрессии zif/268 в результате различных физиологических и фармакологических воздействий на животных. Зонд вживлялся таким образом, что свободный конец волокна был подведен к СА1 области гиппокампа. В одном случае мышам внутрибрюшинно вводили судорожный агент пентилентетразол, в другом случае мыши получали несколько коротких ударов током в 1 мА. После стимуляции на протяжении четырех часов следили за изменением уровня экспрессии EGFP. Результаты измерений представлены на Фиг. 4. Данные нормированы на значения в первые моменты времени. Моменты стимуляции совмещены по времени и отмечены стрелкой. Видно, что в обоих экспериментальных случаях экспрессия имеет одинаковую динамику роста, и ее максимум достигается в районе двух-трех часов после стимуляции. Более слабый рост сигнала в случае введения пентилентетразола может быть связан как с меньшей активацией клеток мозга в этом случае в сравнении со стимуляцией током, так и с различным базальным уровнем активации zif/268 у разных животных. Таким образом, было экспериментально показано, что разработанный нейроинтерфейс позволяет проводить измерения нейронной активности в глубоких слоях мозга живых свободноподвижных животных в различных временных масштабах: в течение нескольких дней, как в стандартных условиях, так и во время длительных специфичных воздействий, в течение нескольких часов, после разнообразных фармакологических и физиологических стимуляций.
Одновременная регистрация нейронной активности в нескольких глубоколежащих областях головного мозга живых свободноподвижных животных необходима в задачах исследования работы мозга как целой системы. Разработанный волоконно-оптический нейроинтерфейс за счет компактности деталей позволяет вживлять в мозг и регистрировать флуоресцентный отклик одновременно из двух (и более) разных пространственно-разнесенных структур головного мозга живых животных. Были проведены исследования на живой бодрствующей мыши, что позволило демонстрировать оптическую регистрацию маркеров нейронной активности одновременно двух пространственно-разнесенных областей мозга живого свободноподвижного животного. Как и в предыдущих экспериментах проводилась регистрации флуоресцентного отклика белка EGFP в мозге трансгенных животных, у которых ген флуоресцентного белка встроен под промотор немедленно раннего гена zif/268. В качестве физиологического стимула использовалась унилатеральная стимуляция вибрисс, а регистрация геномного отклика осуществлялась в сомантосенсорной коре левого и правого полушарий головного мозга одновременно. Для этого мышам вживлялось два зонда в заранее выбранные координаты. Фотография экспериментального животного со вживленными зондами нейроинтерфейса представлена на Фиг. 6.
Благодаря двухкомпонентной конструкции зонда разработанного волоконно-оптического интерфейса была возможность начать эксперименты по оптическому зондированию несколько дней спустя после операции, уменьшая, таким образом, вклад постоперационного стресса и помогая восстановить естественное поведение животных. Известно, что сенсорная информация от механорецепторов в фолликулах вибрисс, вызываемая их угловым отклонением, передается через клетки троичного ганглия к ипсилатеральной части мозгового ствола (trigeminal nuclei). Затем сигнал от вибрисс передается к контрлатеральной части таламуса и дальше обрабатывается нейронамисоматосенсорной коры. Причем информация от правых вибрисс обрабатывается в левом полушарии, а от левых - в правом. Тактильная стимуляция вибрисс приводит к изменению поведения животного по отношению к стимулу. В день эксперимента всем мышам в качестве седативного средства вводился золетил (20 мг/кг) и измерялся базальный уровень экспрессии EGFP, затем вибриссы с одной стороны головы стимулировались в течение 15 минут. После этого на протяжении двух часов измерялся геномный ответ в одном или сразу в обоих полушариях мозга. На Фиг. 5 представлен флуоресцентный отклик мозга свободноподвижных мышей при контралатеральной и ипсилатеральной стимуляции вибрисс до стимуляции и через 2 часа после стимуляции. Черные столбцы соответствует данным для соматосенсорной коры контрлатерального полушария, столбцы с диагональной штриховкой - данным для ипсилатерального полушария. Видно, что в среднем через 2 часа после стимуляции вибрисс уровень сигнала в соматосенсорной коре контрплатерального полушария повышается на 16%, тогда как в ипсилатеральном полушарии остается постоянным в пределах погрешности измерений. Как и ожидалось, экспрессия немедленно раннего гена zif/268, маркируемого флуоресцентным белком EGFP увеличивается в соматосенсорной коре, лежащей контрлатерально, относительно проведенной стимуляции.
Таким образом, показано, что разработанный волоконно-оптический нейроинтерфейс позволяет следить за долговременной динамикой уровня экспрессии генов живого свободноподвижного животного на протяжении нескольких дней и недель, а также за изменением уровня сигнала после введения медицинских препаратов или после стрессорного воздействия. Разработанный интерфейс также позволяет проводить исследования одновременно в нескольких пространственно-разделенных глубоколежащих структурах мозга живого свободноподвижного животного, что до сих пор было неосуществимо с помощью оптических методов.
Реализуемая методика эндоскопии с помощью разработанного устройства и способа имеет важные преимущества по сравнению со стандартной оптической визуализацией, поскольку при сохранении клеточного разрешения позволяет проникать в исследуемую ткань головного мозга на практически неограниченную глубину. При этом сохраняется возможность движения животного и его активность в заданных условиях. Данный интерфейс обеспечивает доступ к одной и той же группе нейронов, лежащей в глубоких слоях мозга живого животного, и позволяет осуществлять их оптическое зондирование на протяжении многих недель экспериментальной работы, обеспечивая высокоточную долговременную оптическую регистрацию геномной активности в ответ на разнообразные физиологические и фармакологические стимулы. Компактность и малый вес реализованного зонда нейроинтерфейса обеспечивает возможность проведения долговременных параллельных измерений нейронной активности из нескольких (не менее, чем двух) пространственно-разнесенных областей мозга живых свободноподвижных животных. Используемое оптическое волокно может иметь разнообразную структуру: стандартную, фотонно-кристаллическую, многоканальную, что обеспечивает контролируемое пространственное разрешение и принципиальную возможность получения изображений тканей головного мозга исследуемых животных.