Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ, ВКЛЮЧАЮЩЕЙ ВЫСОКОКОНЦЕНТРИРОВАННЫЕ АНТИТЕЛА, ПУТЕМ УЛЬТРАФИЛЬТРАЦИИ
Вид РИД
Изобретение
Представленное изобретение относится к области биологической науки, более конкретно к области получения антитела. В частности, представленное изобретение касается способа получения композиции, содержащей высококонцентрированные антитела, путем ультрафильтрации. Способ, используемый в представленном изобретении, позволяет терапии антителами достичь составов с высокой концентрацией при температуре окружающей среды, такой как выше 100 г/л, предпочтительно выше 200 г/л, особенно предпочтительно выше 250 г/л.
[Уровень техники]
Существует растущий спрос на высококонцентрированные препараты низкого объема для терапии антителами для подкожного введения, особенно в области терапии хронического заболевания, чтобы улучшить удобство и соблюдение режима терапии пациентом, предлагая амбулаторное лечение.
В производстве лекарственной субстанции антитела, ультрафильтрация/диафильтрация (УФ/ДФ), как правило, является последней стадией процесса. Ультрафильтрация представляет собой процесс на основе мембранного разделения, при котором молекулы в растворе разделяются на основе размера. Диафильтрация является специфическим типом ультрафильтрации, в котором водный буфер добавляется к ретентату. На данной стадии очищенную лекарственную субстанцию концентрируют и обменивают на концентрацию белка и композицию наполнителя, необходимую для разработки лекарственного продукта.
Преобладающей технологией, используемой в промышленности для способа ультрафильтрации/диафильтрации (УФ/ДФ), является одна из форм тангенциальной проточной фильтрации (TFF) (в основном смотри, Shiloach J. et al., 1988, Van Reis R. et al., 2001). В данной технологии белковый раствор рециркулируют под давлением, тангенциально к ультрафильтрационной мембране. Данный TFF подход хорошо работает для лекарственной субстанции при низких и умеренных концентрациях и в большинстве случаев способ УФ/ДФ для одного антитела хорошо адаптируется для другого антитела с минимальными изменениями. Однако в ситуациях с высокими концентрациями белка появился ряд технических трудностей с производительностью процесса (в основном смотри Shire SJ. et al., 2004, Luo R. et al., 2006, Shire SJ., 2009).
Достижение составов с высокой концентрацией по TFF технологии может быть затруднено, потому что высококонцентрированные белковые растворы могут привести к ограниченному массопереносу за счет уменьшения потока и в конечном итоге к загрязнению мембраны (смотри, например, Suki A. et al., 1984, 1986, Kim KJ. et al., 1992). Несмотря на то что это может быть преодолено путем увеличения площади поверхности мембраны или замены мембраны, это может привести к снижению выхода. Другим ограничением является высокая вязкость, что может привести к высокому давлению подачи, превышающему верхний предел для целостности мембраны во время процесса (смотри, например, Turker М. et al., 1987, Liu J. et al., 2005). Несмотря на то что осуществление разработки соответствующего состава, такого как с увеличенной ионной силой или с добавлением отдельных соединений, может помочь уменьшить вязкость (смотри, например, Liu J. et al., 2006), уменьшение вязкости может вызывать сложности при исполнении, в то же время обеспечивая композицию стабильного состава. В ситуации, когда необходимым является большое снижение вязкости, то это может решаться путем обработки при повышенных температурах (смотри, например. Winter С., 2009). Тем не менее, в таких случаях, стабильность белков может быть снижена при длительном воздействии повышенных температур. Проблема, которую необходимо решать с помощью представленного изобретения, состоит в том, чтобы обеспечить новый способ обработки для достижения высокой концентрации белка путем манипулирования другими параметрами технологического процесса.
[Список цитирования]
[Патентная литература]
[ПтЛ 1] Liu J, Shire SJ. Reduced-viscosity concentrated protein formulations. US Patent Dec. 15, 2006, US 20070116700 A1.
[ПтЛ 2] Winter C. Process for concentration of antibodies and therapeutic products thereof. US Patent Feb. 19, 2009, US 20090214522 A1.
[Непатентная литература]
[НПЛ 1] Kim KJ, Fane AG, Fell CJD, Joy DC. Fouling mechanisms of membranes during protein ультрафильтрация, J. Membr. Sci. 68 (1992) 79.
[НПЛ 2] Liu J, Nguyen MDH, Andya JD, Shire SJ. Reversible selfassociation increases the viscosity of a concentrated моноклонального антитела in aqueous solution. J Pharm Sci (2005), 94:1928-1940.
[НПЛ 3] Luo R, Waghmare R, Krishnan M, Adams C, Poon E, Kahn D. High concentration UF/DF of а моноклонального антитела. Strategy for optimization and scale-up, BioProcess Int. 4 (2006) 44.
[НПЛ 4] Shiloach J, Martin N, Moes H. Tangential flow filtration. Adv Biotechnol Process (1988),8:97-125.
[НПЛ 5] Shire SJ, Shahrokh Z, Liu J. Challenges in the development of high protein concentration formulations. J Pharm Sci (2004), 93:1390-1402.
[НПЛ 6] Shire SJ. Formulation and manufacturability of biologies. Curr Opin Biotechnol (2009), 20:708-714.
[НПЛ 7] Suki A, Fane AG, Fell CJD. Flux decline in protein ультрафильтрация, J. Membr. Sci. 21 (1984) 269.
[НПЛ 8] Suki A, Fane AG, Fell CJD. Modeling fouling mechanisms in protein ультрафильтрация, J. Membr. Sci. 27 (1986) 181.
[НПЛ 9] Turker M, Hubble J. Membrane fouling in a constant-flux ультрафильтрация cell, J. Membr. Sci. 34 (1987) 267.
[НПЛ 10] Van Reis R, Zydney A. Membrane separations in biotechnology. Curr Opin Biotechnol (2001), 12:208-211.
[Сущность изобретения]
Стандартная промышленная технология для концентрирования белков в промышленном масштабе представляет собой ультрафильтрацию с использованием тангенциального потока. Ключевые проблемы для продуктов с высокими конечными концентрациями представляют собой предотвращение загрязнения мембраны и устранение высокого давления подачи.
В общих чертах, представленное раскрытие описывает конкретные манипулирования параметрами процесса для успешного концентрирования белков, таких как антительный препарат, фармацевтические композиции, содержащие такой препарат, и их использование в терапии человека или лечении животного.
В вариантах осуществления, представленное изобретение предусматривает способ, в котором скорость подачи потока поддерживают высокой скоростью потока до оптимальной концентрации белка, затем снижают до более низкого значения, чтобы продолжить дальнейшее концентрирование. Например, концентрирование выполняют со скоростью подачи потока, равной или большей чем 200 л/м2/час до тех пор, пока раствор ретентата концентрируют до концентрации белка большей чем 200 г/л, где давление подачи накапливается до 85-100% указанного максимального давления подачи ультрафильтрационной мембраны, затем дополнительно концентрирование продолжают при скорости подачи потока, равной или меньше 120 л/м2/час. Достигаемая концентрация белка в рамках эксплуатационных пределов является более высокой, чем в обычном способе, включающем или одну стадию с постоянной скоростью подачи потока или две стадии ступенчатого снижения с контролем подачи потока на раннем переходе.
Представленное изобретение, кроме того, предусматривает, в вариантах осуществления, более предпочтительный способ, в котором скорость подачи потока поддерживают насколько это возможно высоким до конца процесса концентрирования. Например, скорость подачи потока контролируют автоматически таким образом, чтобы поддерживать давление подачи в пределах 85-100% от указанного максимального давления подачи на ультрафильтрационную мембрану, однократно достигается давление подачи 85-100% от указанного максимального давления подачи на ультрафильтрационную мембрану при постоянной скорости подачи потока.
Представленное изобретение, кроме того, предусматривает, в вариантах осуществления, эффективность стадии циркуляции, включенной в середине процесса концентрирования. Например, 20 минут циркуляции при скорости подачи потока 10-80 п/м2/ч однократно вводит давление подачи, которое достигает 85-100% указанного максимального давления подачи на ультрафильтрационную мембрану при постоянной скорости подачи потока. Данная стадия циркуляции может уменьшить повышение давления подачи во время последующего процесса ультрафильтрации.
Таким образом, объектом представленного изобретения является обеспечение следующего от [1] до [33].
[1] Способ получения композиции, содержащей высококонцентрированные антитела путем ультрафильтрации, где способ включает стадии:
1) регулирования скорости подачи потока, что позволяет увеличить значение давления подачи, которое применяют к ультрафильтрационной мембране, до 85-100% от указанного максимального давления подачи на ультрафильтрационную мембрану; и
2) уменьшение скорости подачи потока, чтобы поддерживать или уменьшить значение давления подачи, прикладываемого к ультрафильтрационной мембране после стадии (1).
[2] Способ по пункту [1], в котором препарат антитела производят при температуре окружающей среды.
[3] Способ по пункту [1], в котором препарат антитела производят при температуре от 10 до 30 градусов С.
[4] Способ по пункту [1], в котором препарат антитела производят при температуре от 15 до 30 градусов С.
[5] Способ по пункту [1], в котором высококонцентрированные антитела имеют высокую концентрацию выше 100 г/л или вязкость выше 2 мПа⋅с.
[6] Способ по пункту [1], в котором высококонцентрированные антитела имеют высокую концентрацию выше 200 г/л или вязкость выше 10 мПа⋅с.
[7] Способ по пункту [1], в котором высококонцентрированные антитела имеют высокую концентрацию выше 250 г/л или вязкость выше 40 мПа⋅с.
[8] Способ по пункту [1], в котором скорость подачи потока на стадии (1) поддерживают на 200 ЛМЧ (л/м2/час) или выше.
[9] Способ по пункту [1], в котором скорость подачи потока на стадии (1) поддерживают на 250 ЛМЧ (л/м2/час) или выше.
[10] Способ по пункту [1], [8] и [9], в котором скорость подачи потока на стадии (1) поддерживают с постоянной скоростью.
[11] Способ по пункту [1], в котором максимальное значение давления подачи, прилагаемое к ультрафильтрационной мембране на стадии (1), составляет от 2,0 бар до 4,0 бар.
[12] Способ по пункту [1], в котором максимальное значение давления подачи, прилагаемое к ультрафильтрационной мембране на стадии (1) составляет 3,5 бар.
[13] Способ по пункту [1], в котором максимальное значение давления подачи, прилагаемое к ультрафильтрационной мембране на стадии (1), составляет 85-100% от указанного максимального давления подачи на ультрафильтрационную мембрану.
[14] Способ по пункту [1], в котором стадия (1) переходит в стадию (2), когда раствор ретентата концентрируют до концентрации белка больше, чем 200 г/л.
[15] Способ по пункту [1], в котором стадия (1) переходит в стадию (2), когда раствор ретентата концентрируют до концентрации белка, которая равна или больше, чем 220 г/л.
[16] Способ по пункту [1], в котором стадия (1) переходит в стадию (2), когда раствор ретентата концентрируют до концентрации белка, которая равна 240 г/л.
[17] Способ по пункту [13], в котором скорость подачи потока, после того как значение давления подачи уменьшают на стадии (2), поддерживают на постоянной скорости.
[18] Способ по пункту [13] или [17], в котором скорость подачи потока, после того как значение давления подачи уменьшают на стадии (2), поддерживают на 120 ЛМЧ (л/м2/час) или ниже.
[19] Способ по пункту [13] или [17], в котором скорость подачи потока, после того как значение давления подачи уменьшают на стадии (2), поддерживают на 80 ЛМЧ (л/м2/час) или ниже.
[20] Способ по пункту [1], в котором значение давления подачи, прилагаемого к ультрафильтрационной мембране на стадии (2), поддерживают на постоянном значении.
[21] Способ по пункту [1], в котором значение давления подачи, прилагаемого к ультрафильтрационной мембране на стадии (2), поддерживают в пределах 85-100% от указанного максимального давления подачи на ультрафильтрационную мембрану путем линейного снижения скорости подачи потока.
[22] Способ по пункту [20] или [21], в котором скорость подачи потока регулируют автоматически таким образом, чтобы поддерживать давление подачи в пределах 85-100% от указанного максимального давления подачи на ультрафильтрационную мембрану путем регулирования обратной связи между давлением подачи и скоростью подачи потока.
[23] Способ по пункту [1], который дополнительно включает между стадией (1) и стадией (2) следующую стадию:
3) рециркулирования препарата антитела через мембрану с закрытым клапаном проникновения.
[24] Способ по пункту [23], в котором препарат антитела рециркулирует с полностью открытым клапаном контроля давления ретентата.
[25] Способ по пункту [23], в котором скорость подачи потока на стадии (3) поддерживают на постоянной скорости потока от 5 до 120 ЛМЧ (л/м2/час).
[26] Способ по пункту [23], в котором скорость подачи потока на стадии (3) поддерживают на постоянной скорости потока от 10 до 80 ЛМЧ (л/м2/час).
[27] Способ по пункту [1], в котором буферная композиция препарата антитела содержит от 10 до 30 ммоль/л гистидина.
[28] Способ по пункту [1], в котором буферная композиция препарата антитела содержит 20 ммоль/л гистидина.
[29] Способ по пункту [1], в котором рН препарата антитела составляет от рН 3,0 до рН 10,0.
[30] Способ по пункту [1], в котором рН препарата антитела составляет от рН 5,5 до рН 6,5.
[31] Способ по пункту [1], в котором рН препарат антитела составляет рН 6,0.
[32] Способ по пункту [1], в котором ультрафильтрационная мембрана имеет отсечение по молекулярной массе 50 кДа или меньше.
[33] Способ по пункту [1], в котором ультрафильтрационная мембрана имеет отсечение по молекулярной массе 30 кДа или меньше.
[34] Способ по пункту [1], в котором композиция содержит высококонцентрированные моноклональные антитела против рецепторов интерлейкина-6 человека.
[35] Способ по пункту [34], в котором композиция содержит высококонцентрированный тоцилизумаб.
[36] Жидкая композиция, которая содержит высококонцентрированные антитела, полученные согласно способу по пункту [1].
[37] Фармацевтическая жидкая композиция, которая содержит высококонцентрированные антитела, полученные согласно способу по пункту [1] и фармацевтически приемлемый носитель.
[38] Способ получения композиции, которая содержит высококонцентрированные белки, полученные путем ультрафильтрации, в котором способ включает стадии:
1) регулирования скорости подачи потока, что позволяет значению давления подачи, прилагаемого к ультрафильтрационной мембране, увеличиться до 85-100% от указанного максимального давления подачи на ультрафильтрационную мембрану; и
2) уменьшения скорости подачи потока, чтобы поддерживать или уменьшать значение давления подачи, прилагаемого к ультрафильтрационной мембране после стадии (1).
Кроме того, следует понимать, что как вышеизложенная сущность представленного изобретения, так и последующее подробное описание являются иллюстративными вариантами осуществления, и не ограничивают представленное изобретение или другие альтернативные варианты осуществления представленного изобретения. Другие объекты и признаки изобретения станут более полно наглядными, когда нижеследующее подробное описание понимается в сочетании с прилагаемыми фигурами и примерами. В частности, в то время как изобретение описывается в данном документе со ссылкой на ряд конкретных вариантов осуществления, следует понимать, что описание является иллюстративным для изобретения и не построено, как ограничение изобретения. Различные модификации и приложения могут иметь место для тех, кто является квалифицированным специалистом в данной области, без отхода от сущности и объема изобретения, как описано в прилагаемой формуле изобретения. Аналогичным образом, другие объекты, признаки, полезные свойства и преимущества представленного изобретения будут очевидными из данного краткого изложения и некоторых вариантов осуществления, описанных ниже, и будут, очевидно, выраженными для квалифицированных специалистов в данной области. Такие объекты, признаки, полезные свойства и преимущества будут очевидными из вышеизложенного в сочетании с прилагаемыми примерами, данными, цифрами и всеми приемлемыми заключениями, чтобы сделать из него выводы, самостоятельно или с учетом ссылок, включенных в данных документ.
[Краткое описание чертежей]
Различные аспекты и варианты применения представленного изобретения станут очевидными квалифицированным специалистам в данной области при рассмотрении краткого описания фигур и детального описания представленного изобретения и предпочтительных вариантов его осуществления, которые следуют далее:
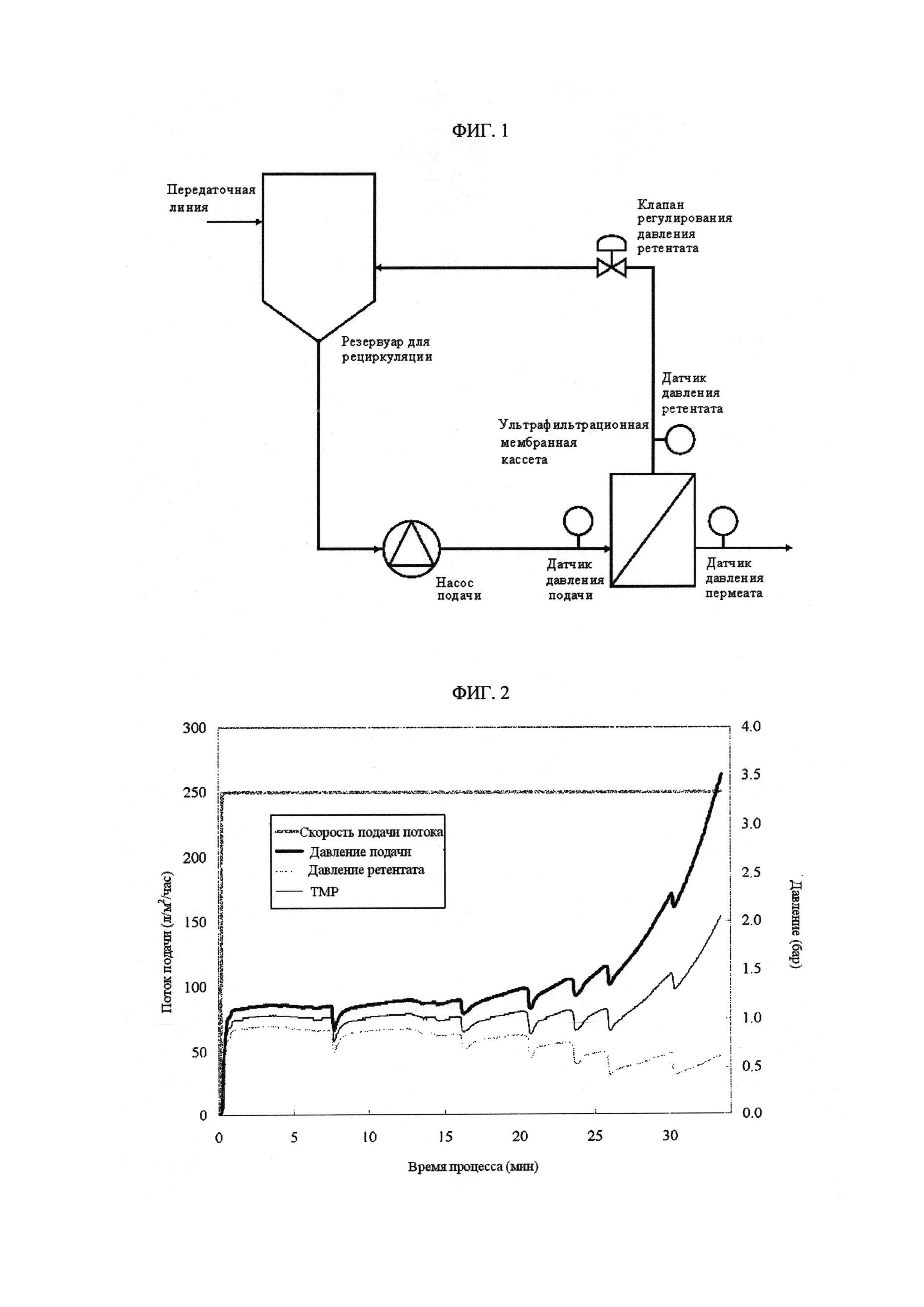
[Фиг. 1]
Фигура 1 демонстрирует установку для процесса УФ/ДФ, в вариантах осуществления представленного изобретения.
[Фиг. 2]
Фигура 2 демонстрирует измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР в лабораторных условиях. Скорость подачи потока была установлена на постоянной скорости 250 ЛМЧ (л/м2/час) во время всего процесса.
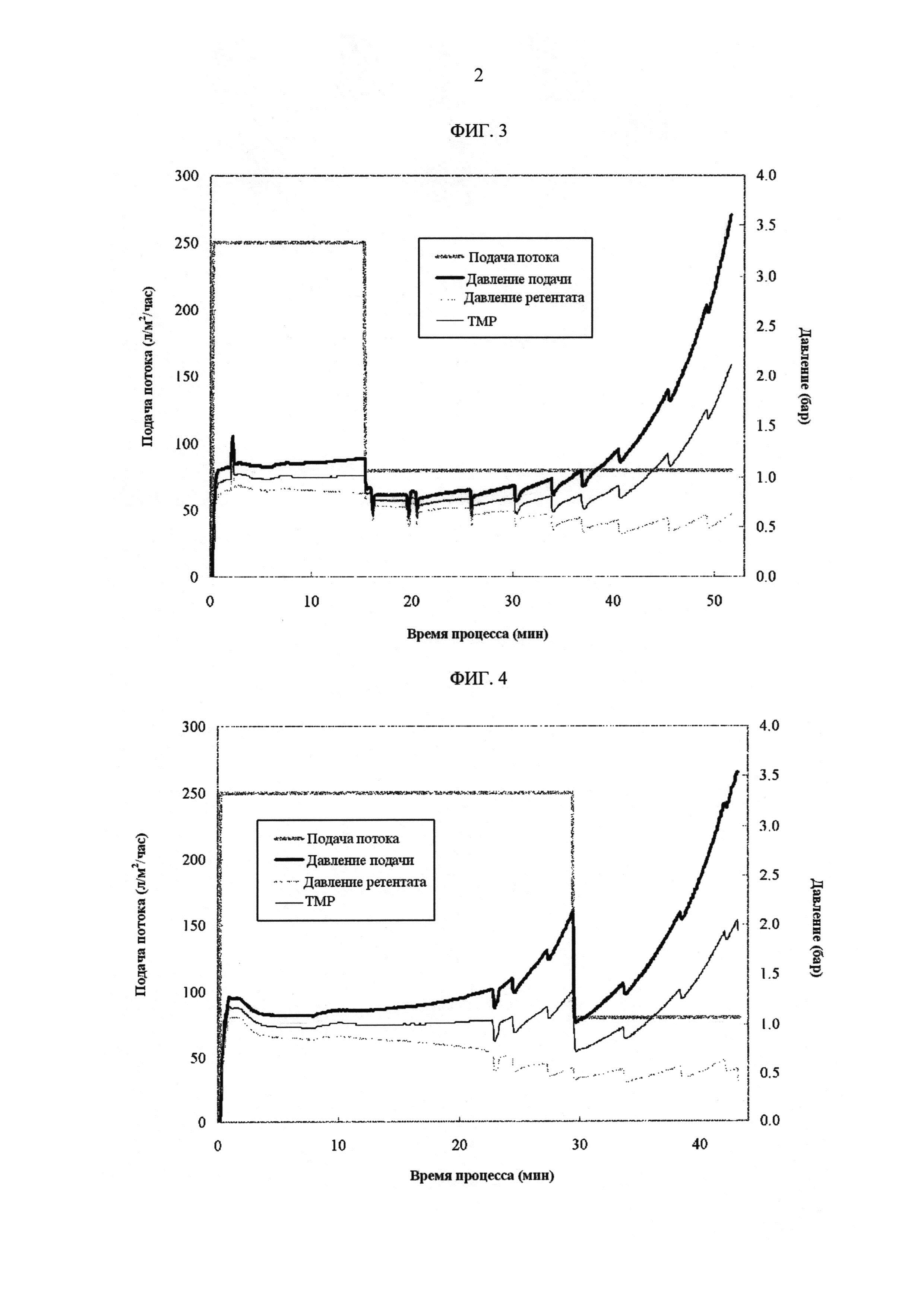
[Фиг. 3]
Фигура 3 демонстрирует измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР в лабораторных условиях. Скорость подачи потока была снижена до 80 л/м2/час, когда объем ретентата достигал значения, которое соответствует концентрации белка 100 г/л.
[Фиг. 4]
Фигура 4 демонстрирует измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР в лабораторных условиях. Скорость подачи потока была снижена до 80 л/м2/час, когда объем ретентата достигал значения, которое соответствует концентрации белка 200 г/л.
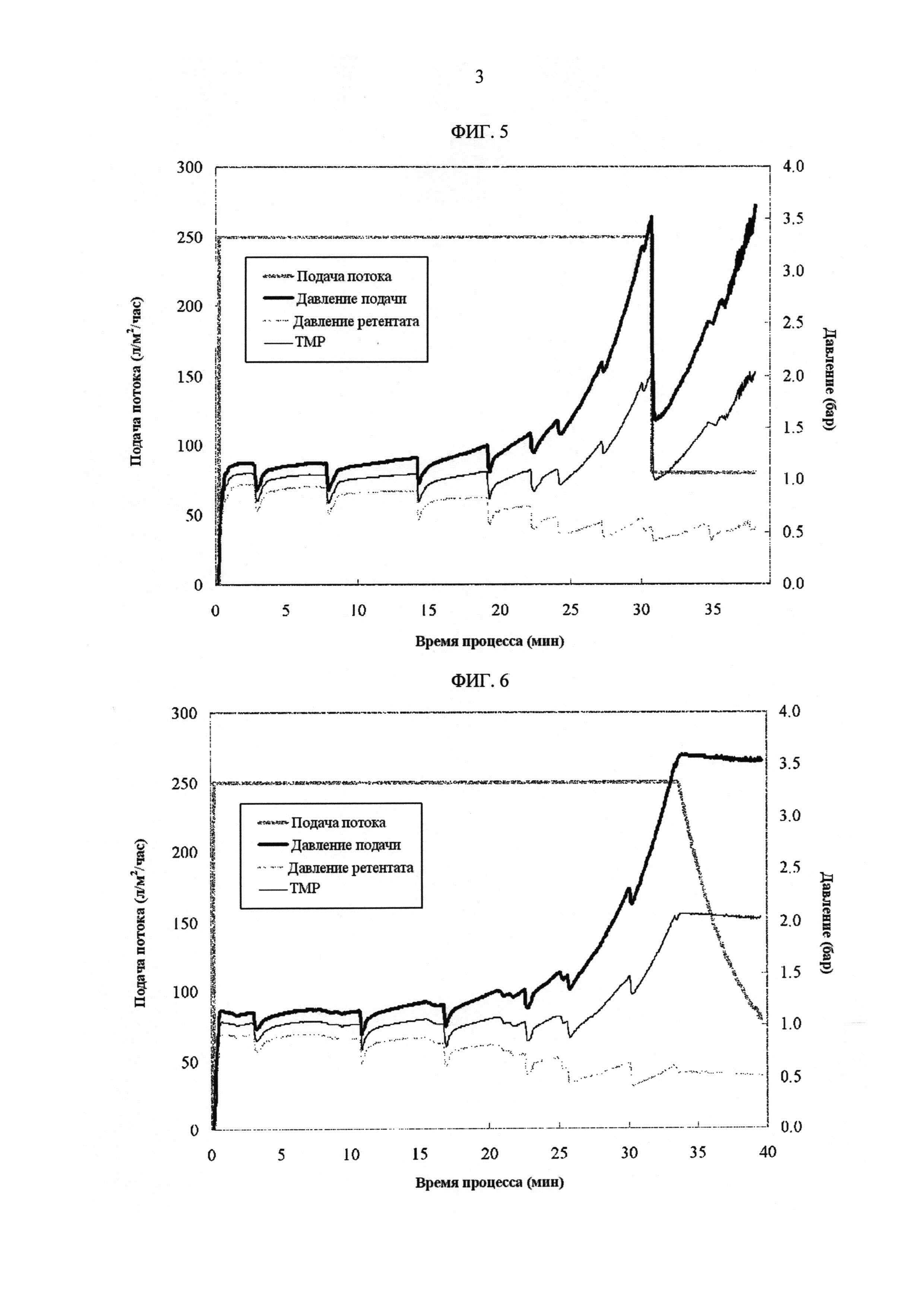
[Фиг. 5]
Фигура 5 демонстрирует измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР в лабораторных условиях. Скорость подачи потока была снижена до 80 л/м2/час, когда давление подачи превышало 3,5 бар, которое соответствует концентрации белка 240 г/л.
[Фиг. 6]
Фигура 6 демонстрирует измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР в лабораторных условиях. Если только давление подачи превышало 3,5 бар при постоянной скорости подачи потока 250 л/м2/час, скорость подачи потока была установлена для автоматического управления технологическим процессом таким образом, чтобы поддерживать давление подачи 3,5 бар. Процесс прекращали, когда скорость подачи потока уменьшалась до 80 л/м2/час.
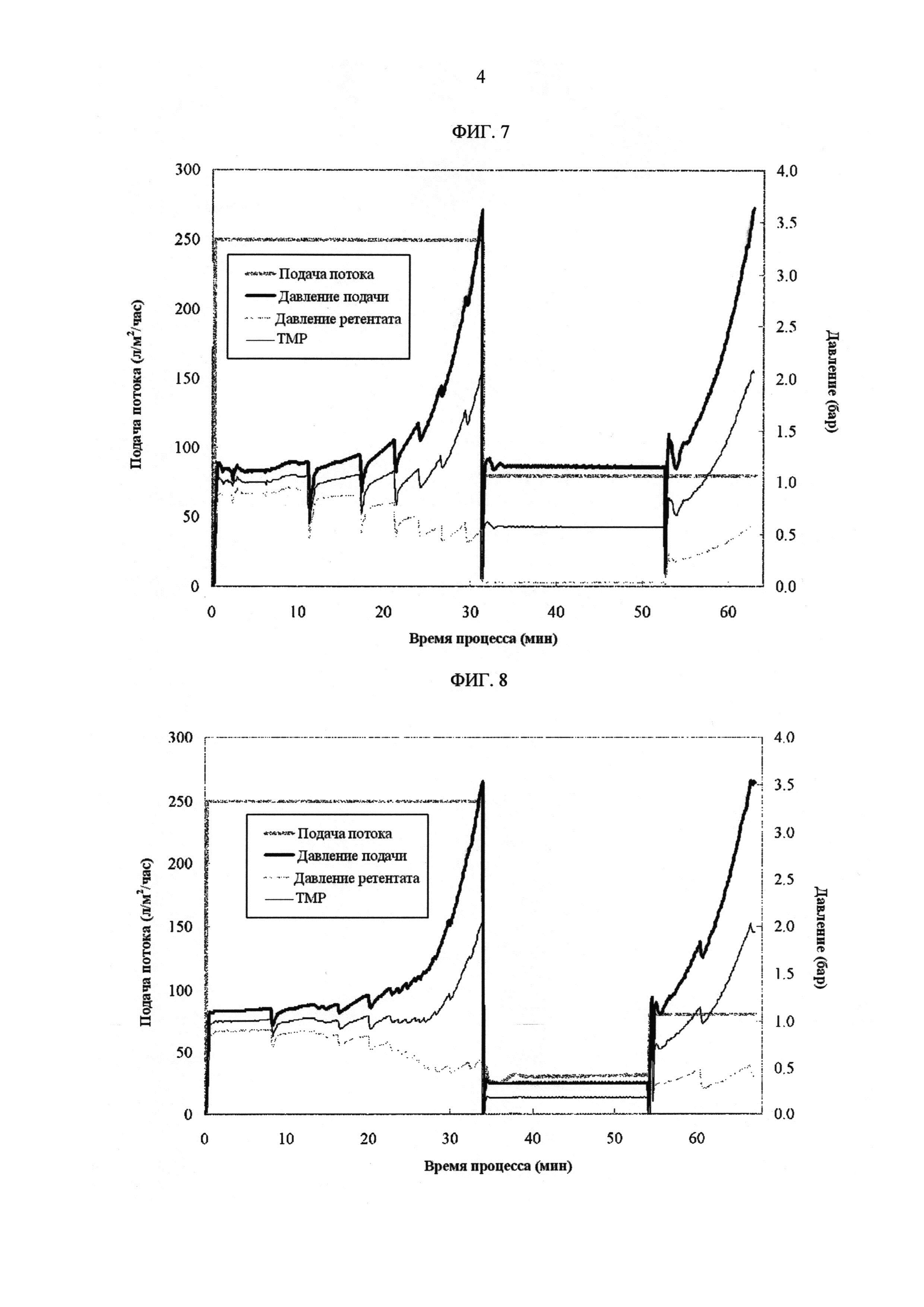
[Фиг. 7]
Фигура 7 демонстрирует измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР в лабораторных условиях. Направление потока переключали в режим циркуляции, как только давление подачи превышало 3,5 бар. После циркуляции в течение 20 минут при постоянной скорости подачи потока 80 л/м2/час ультрафильтрацию возобновляли с той же скоростью подачи потока.
[Фиг. 8]
Фигура 8 демонстрирует измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР в лабораторных условиях. Циркуляцию выполняли с постоянной скоростью подачи потока 10 л/м2/час.
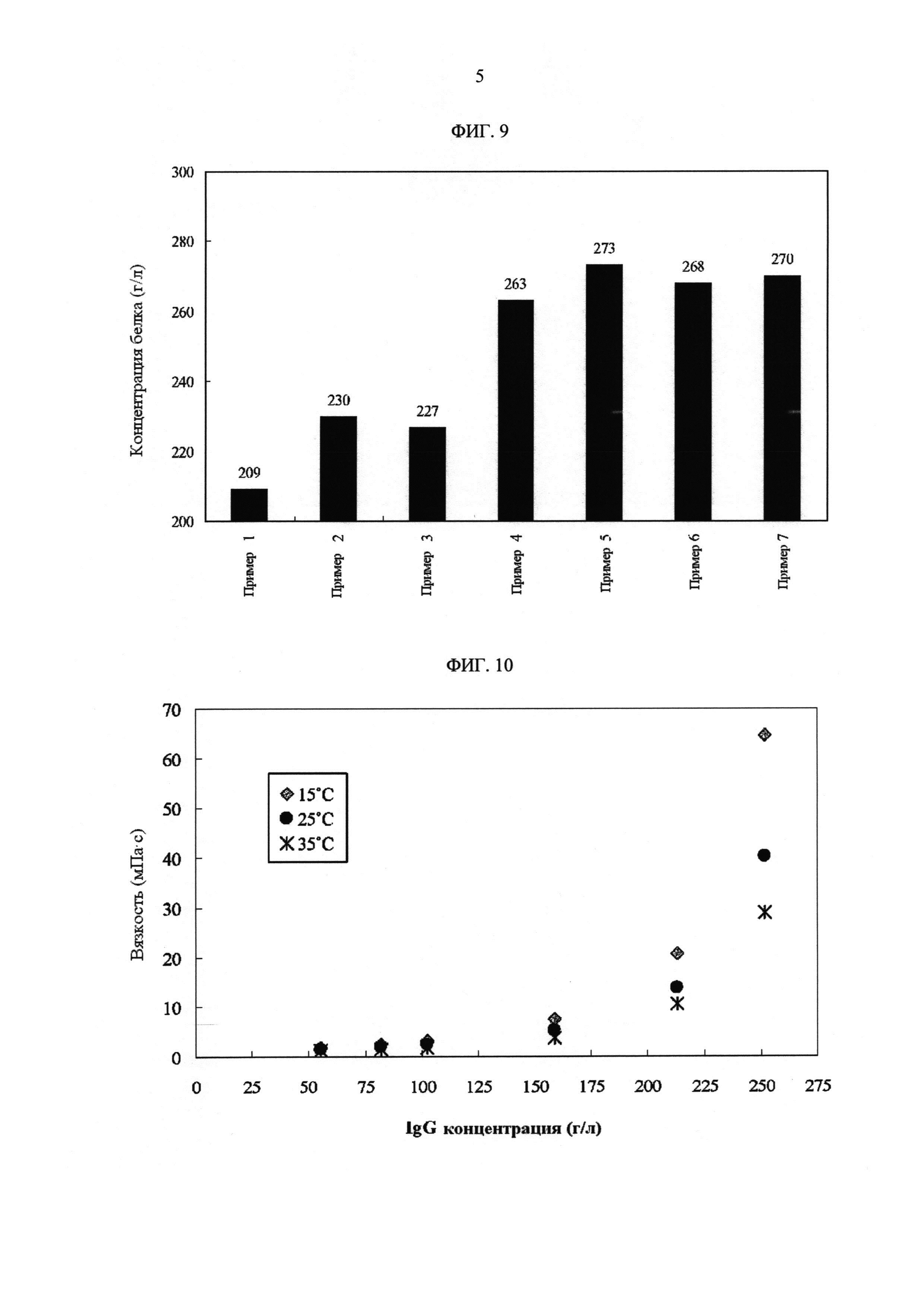
[Фиг. 9]
Фигура 9 суммирует концентрацию белка восстановленного пула в лабораторных условиях, в вариантах осуществления представленного изобретения.
[Фиг. 10]
Фигура 10 демонстрирует профиль вязкости концентрированного гуманизированного IL-6R моноклонального антитела, в вариантах осуществления согласно представленному изобретению.
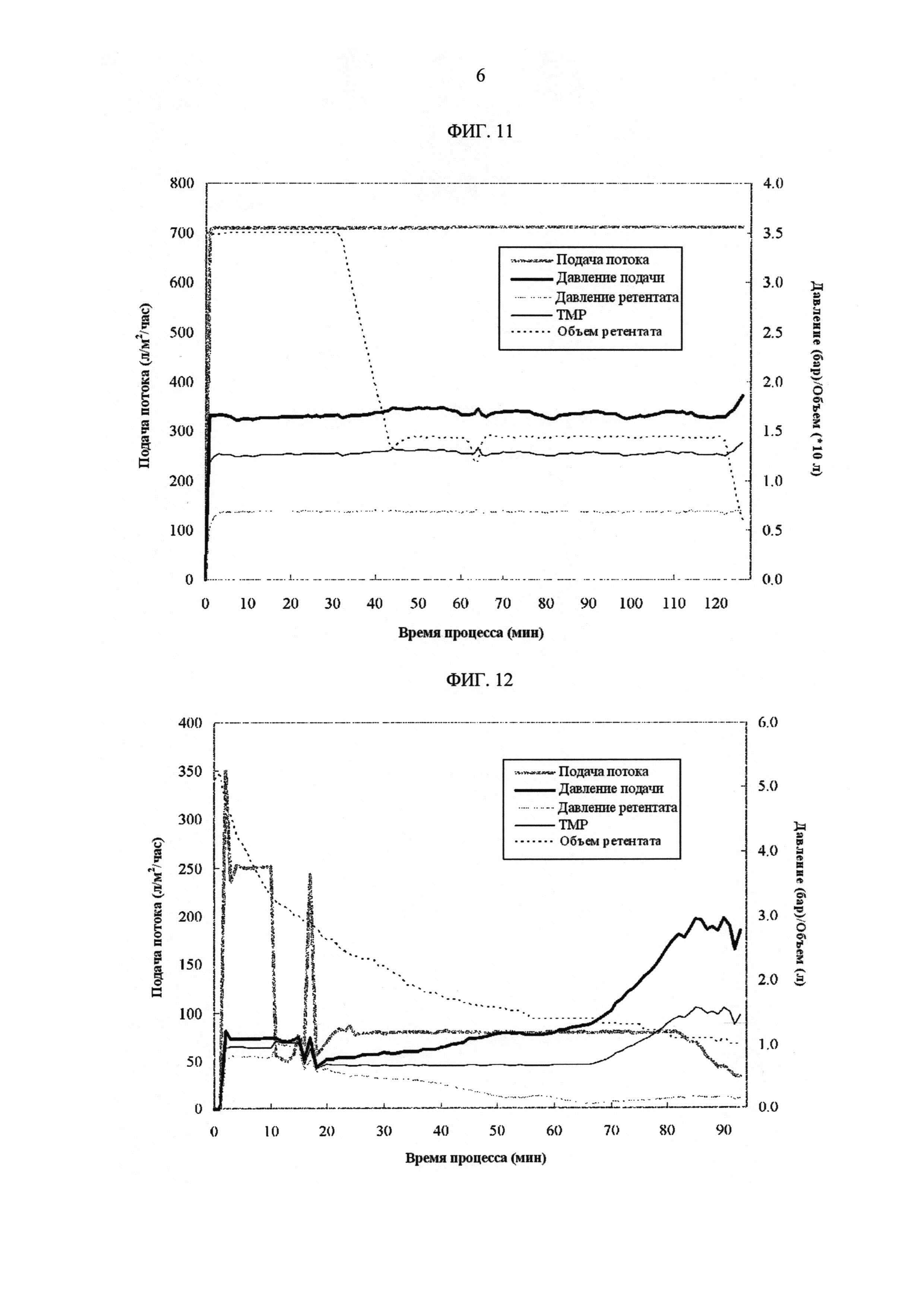
[Фиг. 11]
Фигура 11 демонстрирует измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР и объема ретентата на УФ1/ДФ/УФ2 стадиях в полупромышленном масштабе.
[Фиг. 12]
Фигура 12 демонстрирует измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР и объема ретентата на УФ3/УФ4 стадиях в полупромышленном масштабе.
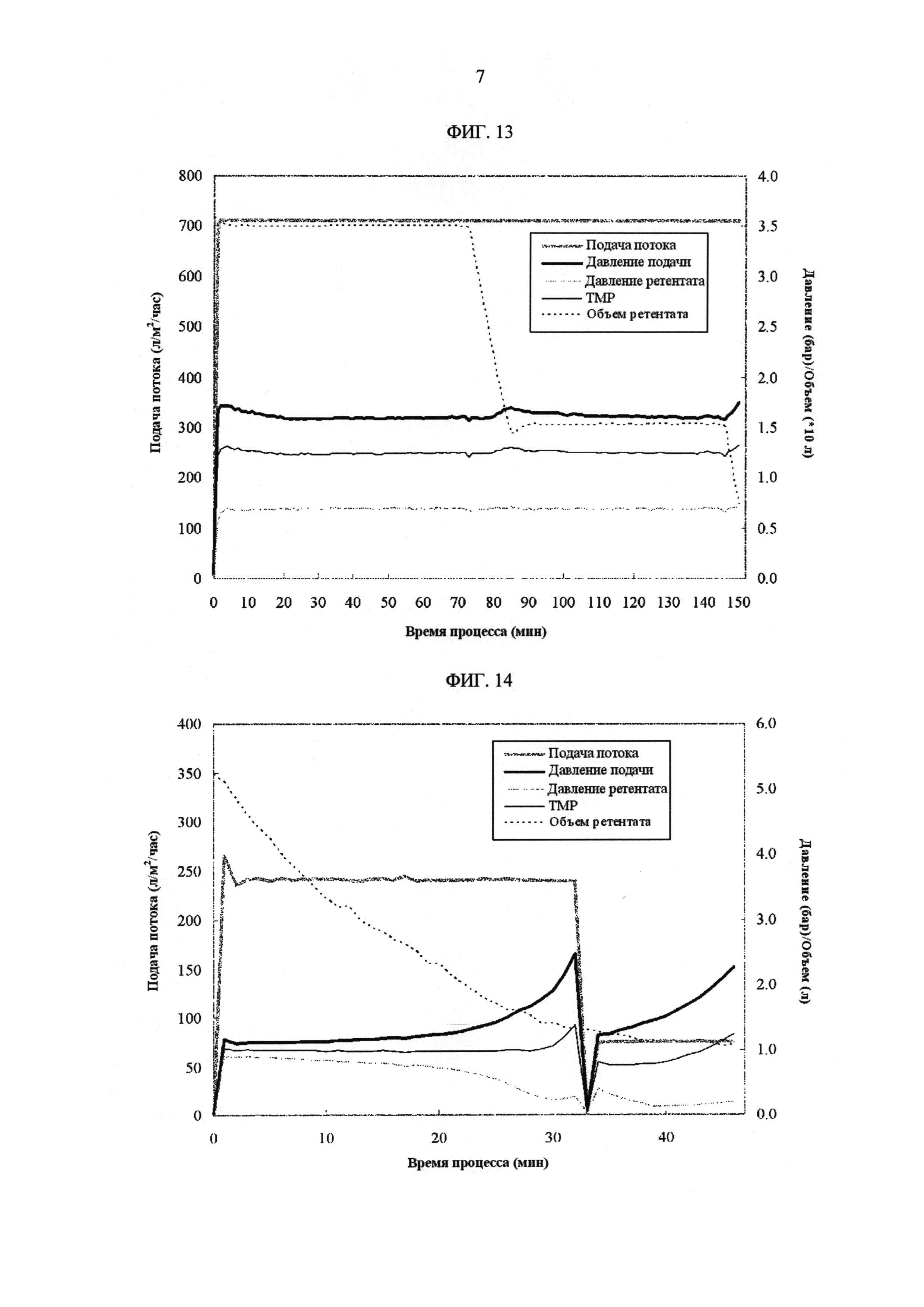
[Фиг. 13]
Фигура 13 демонстрирует измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР и объема ретентата на УФ1/ДФ/УФ2 стадиях в полупромышленном масштабе.
[Фиг. 14]
Фигура 14 демонстрирует измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР и объема ретентата на УФ3/УФ4 стадиях в полупромышленном масштабе.
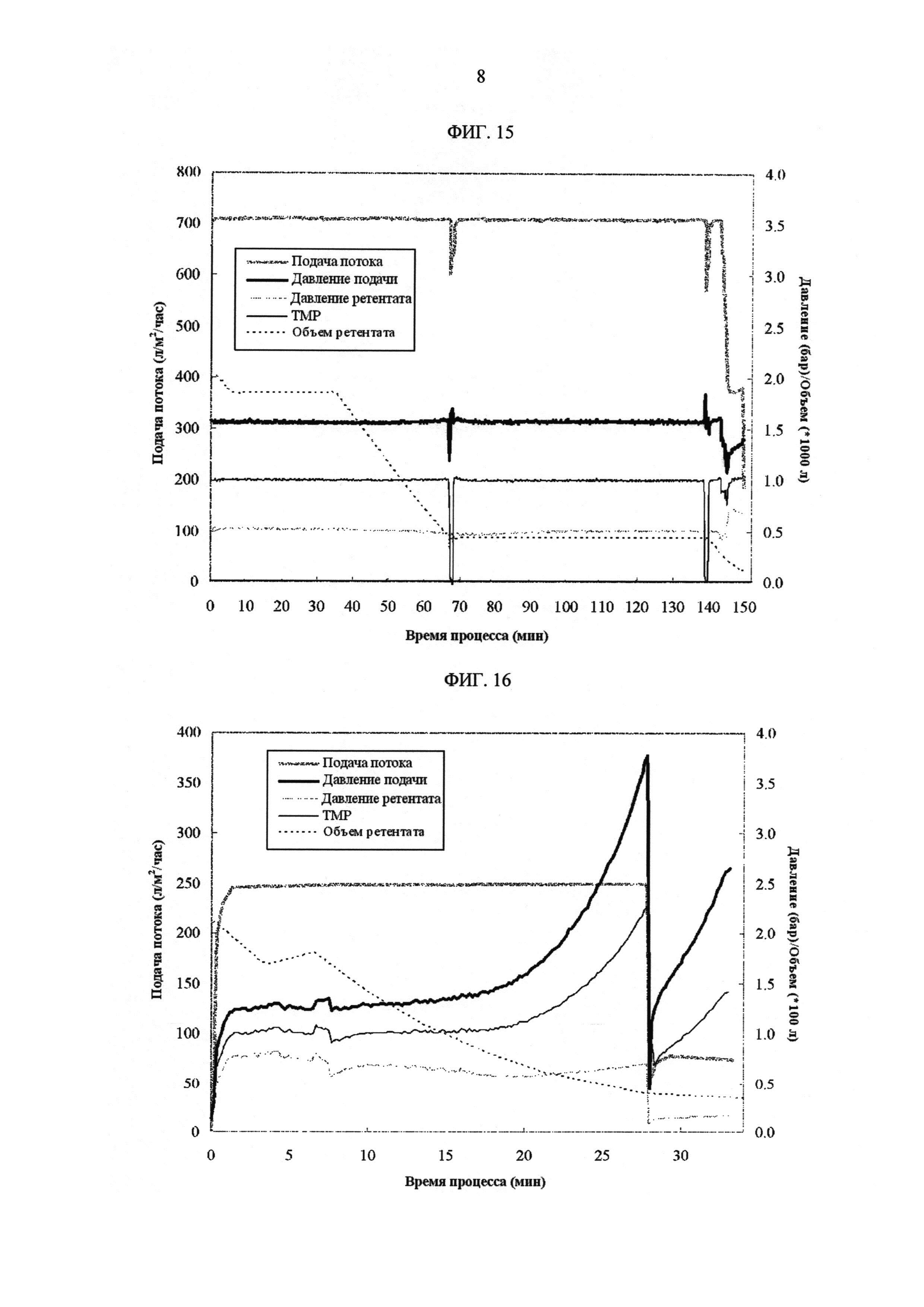
[Фиг. 15]
Фигура 15 демонстрирует измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР и объема ретентата на УФ1/ДФ/УФ2 стадиях в промышленных условиях.
[Фиг. 16]
Фигура 16 демонстрирует измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР и объема ретентата на УФ3/УФ4 стадиях в промышленных условиях.
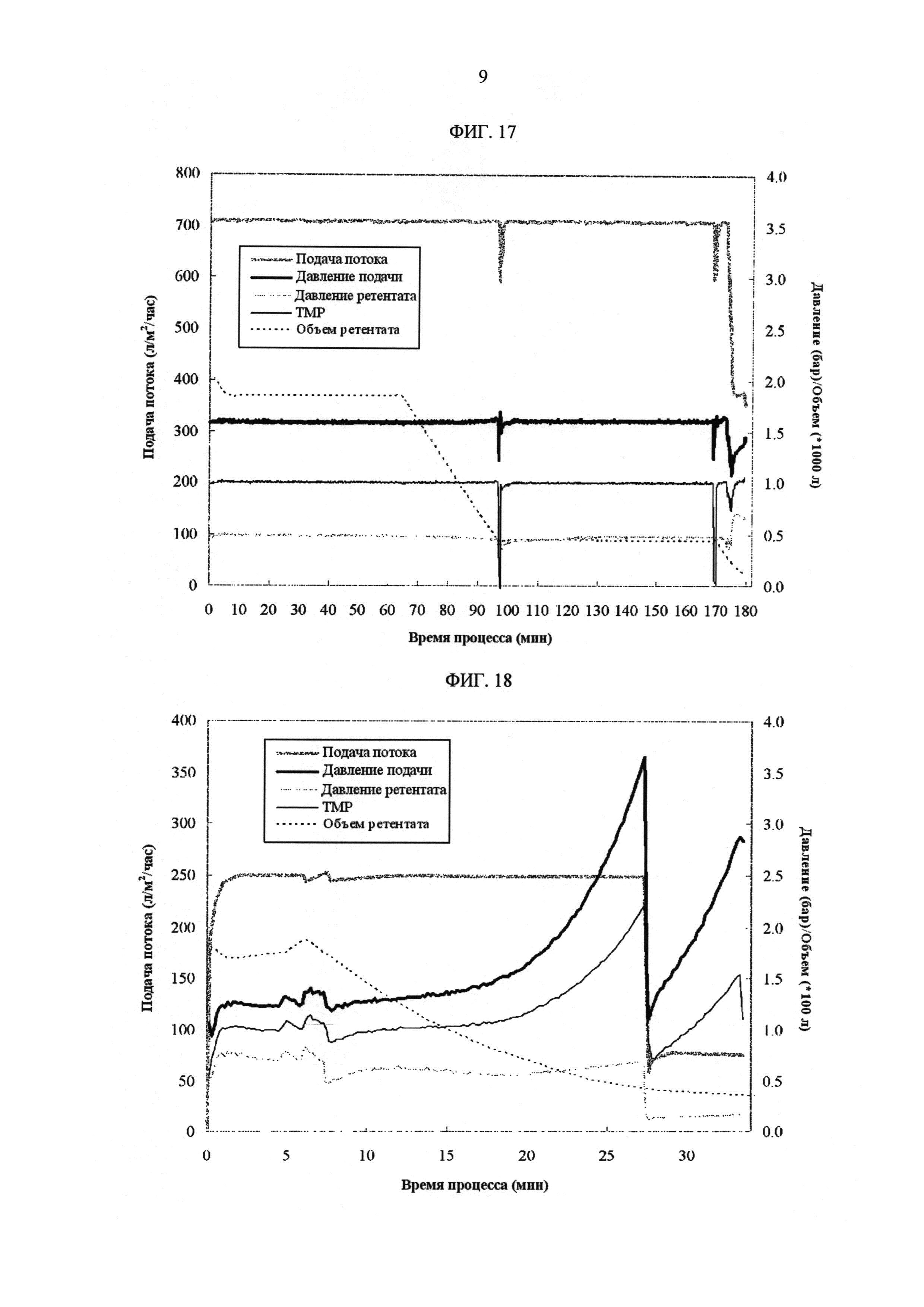
[Фиг. 17]
Фигура 17 демонстрирует измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР и объема ретентата на УФ1/ДФ/УФ2 стадиях в промышленных условиях.
[Фиг. 18]
Фигура 18 демонстрирует измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР и объема ретентата на УФ3/УФ4 стадиях в промышленных условиях.
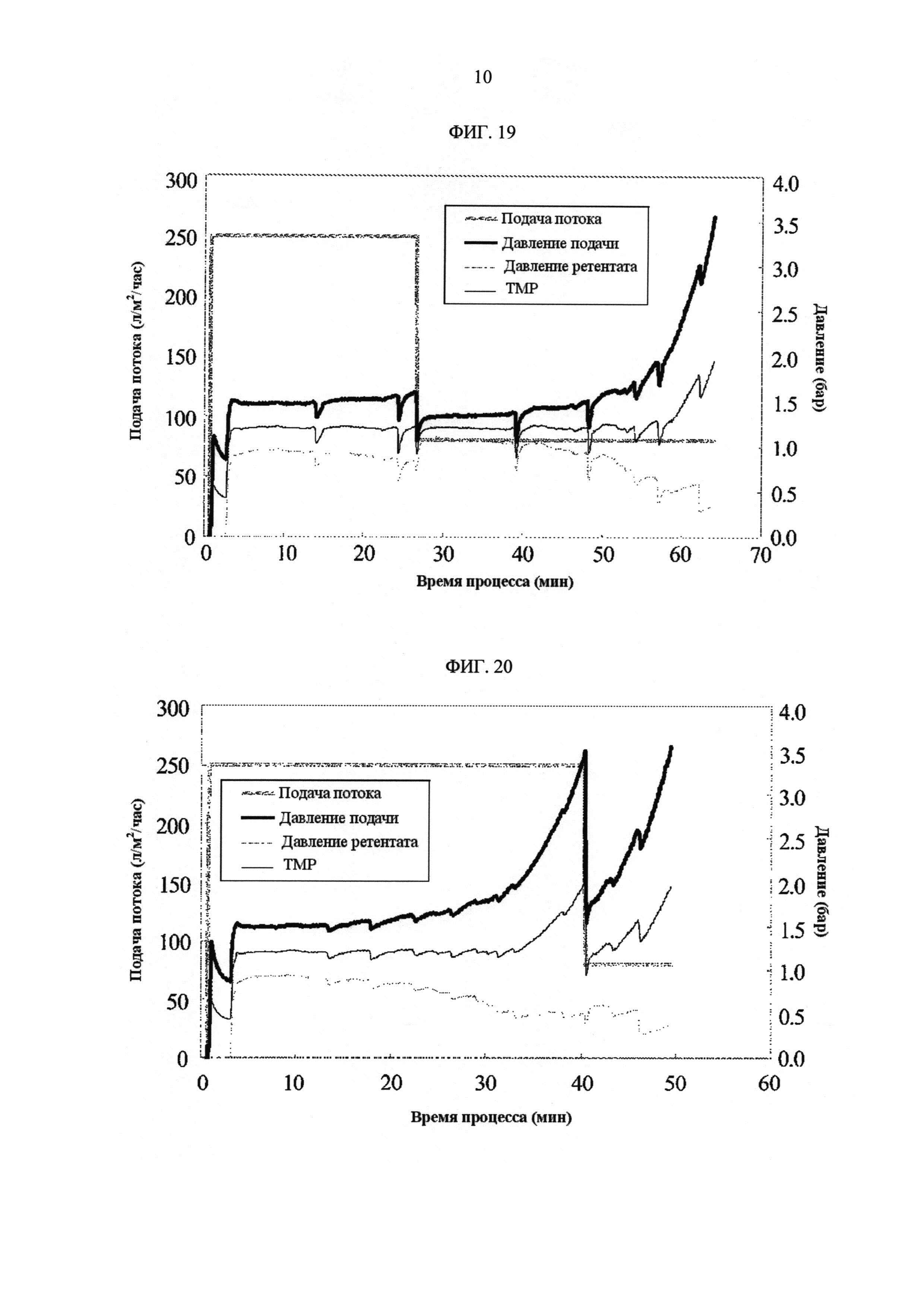
[Фиг. 19]
Фигура 19 демонстрирует измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР. Скорость подачи потока осуществляли при постоянной скорости 250 ЛМЧ (л/м2/час) и потом снижали до 80 л/м2/час, когда объем ретентата достигал значения, которое соответствует концентрации белка 60 г/л.
[Фиг. 20]
Фигура 20 демонстрирует измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР. Скорость подачи потока уменьшали до 80 л/м2/час, когда давление подачи превышало 3,5 бар. Значение объема ретентата в этой точке соответствует концентрации белка 145 г/л.
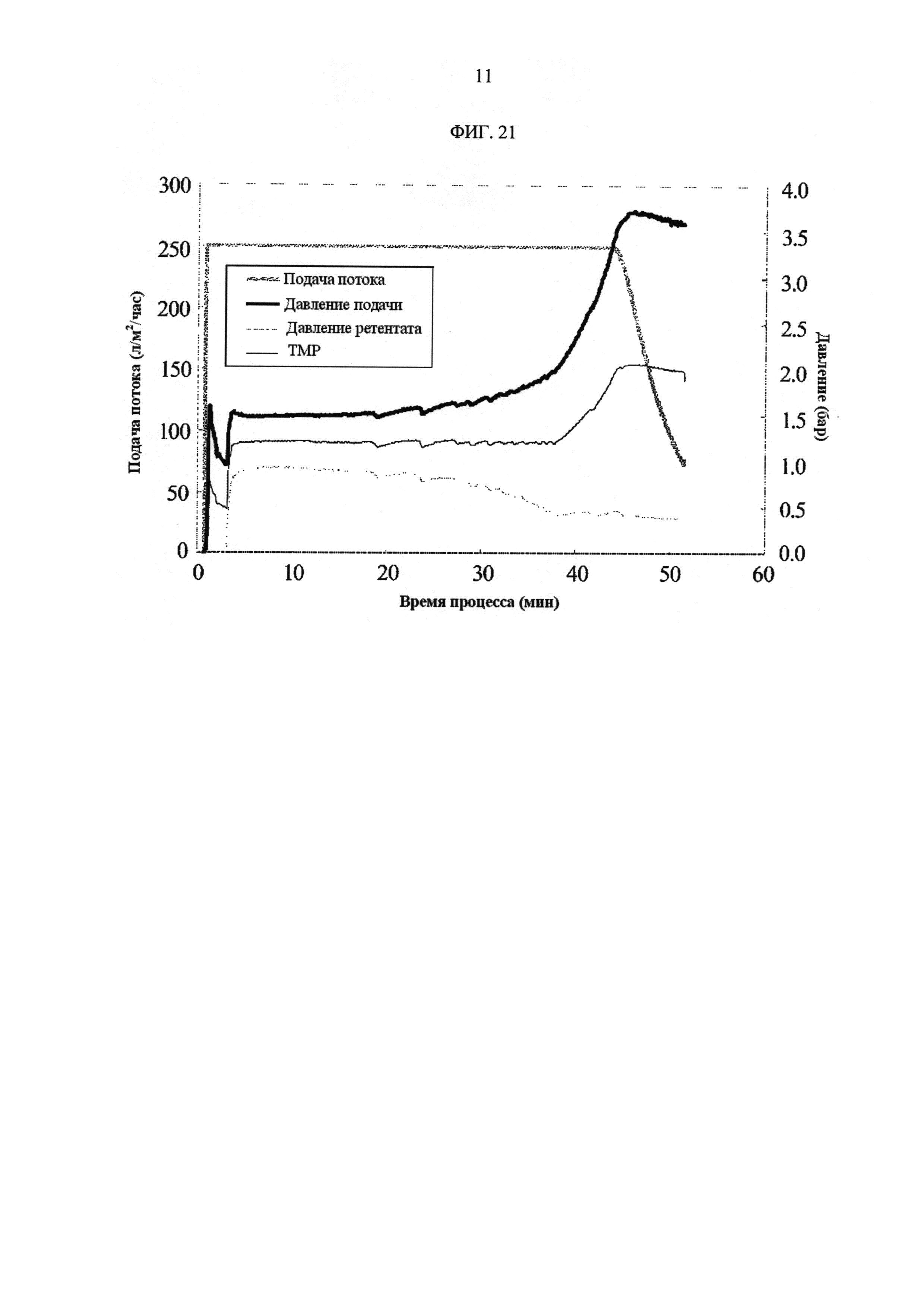
[Фиг. 21]
Фигура 21 демонстрирует измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР. Как только давление подачи превышало 3,5 бар с постоянной скоростью подачи потока 250 л/м2/час, скорость подачи потока устанавливалась автоматическим регулированием потока таким образом, чтобы поддерживать давление подачи 3,5 бар. Производственный процесс останавливали, когда скорость подачи потока снижалась до 80 л/м2/час.
[Описание вариантов осуществления]
Несмотря на то что какие-либо способы и материалы, подобные или эквивалентные тем, которые описаны в данном документе, могут быть использованы в практике или при тестировании вариантов осуществления представленного изобретения, сейчас будут описаны предпочтительные способы. Однако, прежде чем описывать представленные способы, следует понимать, что представленное изобретение не ограничивается конкретными размерами, формами, измерениями, материалами, методиками, протоколами и т.д., описанными в данном документе, так как они могут варьировать в соответствии с обычным экспериментированием и оптимизацией. Кроме того, следует понимать, что терминология, используемая в описании, применяется с целью описания конкретных версий или только вариантов осуществления, и не предназначена для ограничения объема представленного изобретения, которое будет ограничено только прилагаемой формулой изобретения.
Раскрытие каждой публикации, патента или патентной заявки, упомянутое в данном описании, в частности, является включенным в данный документ в качестве ссылки в полном объеме. Однако ничто в данном документе не является таким, что интерпретируется как допущение того, что изобретение не является названным, чтобы датировать задним числом такое раскрытие в силу предшествующего изобретения.
Если не определено иначе, все технические и научные термины, используемые в данном документе, имеют те же значения, которые обычно понимаются квалифицированным специалистом в данной области с уровня техники, к которому принадлежит представленное изобретение. В случае противоречий представленное описание, включая определения, будет контролировать. Кроме того, материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения.
Представленное изобретение касается способа получения композиции, содержащей высококонцентрированные антитела путем ультрафильтрации.
Представленное изобретение включает способ получения композиции, содержащей высококонцентрированные антитела путем ультрафильтрации, в котором скорость подачи потока и давление подачи, прилагаемое к ультрафильтрационной мембране, являются переменными и изменяются во время процесса фильтрации.
Особенно предпочтительные варианты осуществления представленного изобретения изложены ниже.
Способ получения композиции, содержащей высококонцентрированные антитела путем ультрафильтрации, где способ включает стадии:
1) регулирования скорости подачи потока, что позволяет увеличить значение давления подачи, прилагаемое к ультрафильтрационной мембране до 85-100% от указанного максимального давления подачи на ультрафильтрационную мембрану; и
2) уменьшение скорости подачи потока для поддержания или уменьшения значения давления подачи, прилагаемого к ультрафильтрационной мембране после стадии (1).
Термин "ультрафильтрация", который используется в представленном изобретении, обозначает процесс на основе мембранного разделения, при котором разделение молекул в растворе происходит на основе размера. Термин "фильтрации с тангенциальным потоком (TFF)" обозначает конкретный способ фильтрации, в котором жидкость течет по касательной к мембране. Раствор, содержащий белковые молекулы, концентрируют при протекании вдоль, т.е. по касательной к поверхности ультрафильтрационной мембраны под давлением. Ультрафильтрационная мембрана имеет размер пор с определенной пороговой величиной. В одном варианте осуществления пороговое значение находится в диапазоне 50 кДа или меньше, предпочтительно 30 кДа или меньше.
Термин "подача потока" обозначает поток жидкости из подающего насоса к мембране. Термин "скорость потока подачи" обозначает объемную скорость потока раствора к мембране. Скорость подачи потока обычно дается в пересчете на объем за единицу времени, как литр/минуту и нормализуется в пересчете на объем на единицу площади мембраны в единицу времени, как литр/м2/час (ЛМЧ). Термин "поток" означает нормированный поток фильтрата через мембрану в пересчете на объем на единицу площади мембраны в единицу времени, как литр/м2/час (ЛМЧ).
Термин "давление подачи" означает давление, прилагаемое на входе ультрафильтрационной мембраны. Выражение "максимальное давление подачи" обозначает приемлемое максимальное значение давления подачи, которое указывается поставщиком как техническая характеристика продукта ультрафильтрационной мембраны. Термин "давления ретентата" означает давление, прилагаемое на выходе ультрафильтрационной мембраны. Термин "давление проникновения" означает давление, прилагаемое к проницаемой стороне ультрафильтрационной мембраны. Термин "трансмембранное давление (ТМР)" обозначает давление, которое приводит в движение жидкость, чтобы фильтроваться через ультрафильтрационную мембрану. Значение ТМР может быть рассчитано как:
ТМР=(Рподача+Рретентат)/2-Рпроникновение
ТМР представляет собой среднее значение от давления подачи и давления ретентата в случае, когда проницаемая сторона является открытой в TFF оборудовании. Значение давления, как правило, дается в единицах исчисления, "бар", или "МПа", или "фунт на квадратный дюйм".
Термин "антитело" касается белка, специфически распознающего антиген. Антитела могут быть моноклональными или поликлональными. Антитела могут существовать в различных форматах, включая, например, Fv, Fab и F(ab)2, а также одиночные цепи (scFv) или диатела. Кроме того, какой-либо фрагмент или модификация (например, химерное антитело, гуманизированное антитело и т.д.) антитела могут быть использованы для представленного способа. Способы получения этих видов антител хорошо известны в данной области с уровня техники, и какой-либо способ может быть использован в представленном изобретении, для получения таких антител и их фрагментов.
Моноклональные антитела, используемые в представленном изобретении, включают не только те, которые получены от животных, таких как человек, мыши, крысы, хомяки, кролики, овцы, верблюды и обезьяны, но и искусственно модифицированные генные рекомбинантные антитела, такие как химерные антитела, гуманизированные антитела и биспецифические антитела. Антитела согласно представленному изобретению, кроме того, включают генные рекомбинантные антитела, которые получают в результате искусственного модифицирования константных областей антител, чтобы изменить физические свойства молекулы антитела (в частности, изменение изоэлектрической точки (PI), улучшение аффинности к Fc-рецептору, и т.д.) с целью улучшения стойкости крови и фармакокинетики in vivo.
Иммуноглобулиновый класс антител, используемый в представленном изобретении, особенно не ограничен; и класс может быть каким-либо классом, включая IgG, такой как IgG1, IgG2, IgG3 и IgG4, IgA, IgD, IgE и IgM. Однако предпочтительными являются IgG и IgM.
Антитела, используемые в представленном изобретении, включают, но не ограничиваются этим, антитела против тканевого фактора, антитела против рецептора IL-6, анти-1b-6 антитела, моноклональные антитела против антигена НМ1.24, пептидные антитела, связанные с анти-паратиреоидным гормоном (анти-PTHrP антитела), антитела против глипикан-3, антитела против ганглиозида GM3, антитела против агониста рецептора ТРО, антитела как функциональная замена фактора свертывания VIII, антитела против IL31 рецептора, антитела анти-HLA, антитела анти-AXL, антитела анти-СХСК4, антитела анти-NR10 и биспецифические антитела против фактора IX и фактора X.
Предпочтительные гуманизированные антитела, используемые в представленном изобретении, включают антитела против рецепторов гуманизированного интерлейкина 6 (IL-6) (тоцилизумаб, HPN-1 и MRA) (смотри WO 92/19759), гуманизированные моноклональные антитела против антигена НМ1.24 (смотри WO 98/14580), гуманизированные пептидные антитела, связанные с анти-паратироидным гормоном (анти-PTHrP антитела) (смотри WO 98/13388), гуманизированные антитела против тканевого фактора (смотри WO 99/51743), гуманизированные антитела против глипикан 3-IgG1каппа (смотри PCT/JP 05/013103) и гуманизированные антитела против NR10 (смотри WO 2009/072604). Особенно предпочтительными гуманизированными антителами, используемыми в представленном изобретении, являются гуманизированные антитела против рецептора IL-6.
Предпочтительные человеческие антитела IgM включают рекомбинантные человеческие анти-ганглиозидные антитела GM3 IgM (смотри WO 05/05636).
Предпочтительные минитела включают диатела против агонистов ТРО-рецептора (смотри WO 02/33072) и диатела против агонистов CD47 (смотри WO 01/66737).
Кроме того, антитела с улучшенной изоэлектрической точки, включают, например, Mabi, которое является антителом против рецептора IL-6, описанным в WO 2011/090088 (Н цепь/SEQ ID NO: 1 в ней; L цепь/SEQ ID NO: 2 в ней), и полностью гуманизированное антитело NS22, которое является гуманизированным антителом против NR10, полученные способом, описанным в примере 12 WO 2009/072604.
Представленное изобретение, кроме того, касается способа получения композиции, содержащей высококонцентрированные белки за исключением антител путем ультрафильтрации. Представленное изобретение включает способ получения композиции, содержащей высококонцентрированные белки путем ультрафильтрации, где скорость подачи потока и давление подачи, прилагаемое к ультрафильтрационной мембране, являются переменными и изменяются во время процесса фильтрации. Белки, используемые в представленном изобретении, включают, но не ограничиваются этим, ферменты, цитокины и пептидные аптамеры.
Выражение "композиция, содержащая высококонцентрированные антитела", как используется в представленной заявке, означает водный, буферный раствор, содержащий высококонцентрированные антитела. Термин "буфер" как используется в представленной заявке, означает раствор, в котором изменения рН из-за добавления или высвобождения кислотных или основных веществ выравниваются за счет буферного вещества. Какое-либо буферное вещество, приводящее в результате к такому эффекту, может быть использовано. В одном варианте осуществления используют фармацевтически приемлемые буферные вещества, такие как, например, фосфорная кислота или ее соли, уксусная кислота или ее соли, лимонная кислота или ее соли, морфолин или его соли, 2-(N-морфолино)этансульфоновая кислота или ее соли, или три(гидроксиметил)аминометан (TRIS) или его соли. В предпочтительном варианте осуществления буферная композиция препарата антитела содержит от 10 до 30 ммоль/л гистидина. В более предпочтительном варианте осуществления буферная композиция препарата антитела содержит 20 ммоль/л гистидина.
В одном варианте осуществления согласно представленному изобретению, рН препарата антитела составляет от рН 3,0 до рН 10,0, предпочтительно от рН 5,5 до рН 6,5, более предпочтительно рН 6,0.
В одном варианте осуществления согласно представленному изобретению, препарат антитела производят при температуре окружающей среды, предпочтительно при температуре от 10 до 30 градусов С, более предпочтительно при температуре от 15 до 30 градусов С.
В одном варианте осуществления, высококонцентрированные антитела имеют концентрацию белка выше 100 г/л или вязкость выше 2 мПа⋅сек. В предпочтительном варианте осуществления, высококонцентрированные антитела имеют концентрацию белка выше 200 г/л или вязкость выше 10 мПа⋅сек. В более предпочтительном варианте осуществления, высококонцентрированные антитела имеют концентрацию белка выше 250 г/л или вязкость выше 40 мПа сек.
В одном варианте осуществления скорость подачи потока на стадии (1) поддерживают на 200 ЛМЧ (л/м2/час) или выше. В предпочтительном варианте осуществления, скорость подачи потока на стадии (1) поддерживают на 250 ЛМЧ (л/м2/час) или выше. В данных вариантах осуществления скорость подачи потока на стадии (1) предпочтительно поддерживают на постоянной скорости.
В одном варианте осуществления, максимальное значение давления подачи, прилагаемое к ультрафильтрационной мембране на стадии (1), составляет в пределах 85-100% от указанного максимального давления подачи на ультрафильтрационную мембрану. В предпочтительном варианте осуществления, максимальное значение давления подачи составляет от 2,0 бар до 4,0 бар. В более предпочтительном варианте осуществления, максимальное значение давления подачи, прилагаемое к ультрафильтрационной мембране на стадии (1), составляет 3,5 бар.
В одном варианте осуществления, стадия (1) переходит в стадию (2), когда раствор ретентата концентрируют до концентрации белка больше чем 200 г/л. В предпочтительном варианте осуществления, стадия (1) переходит в стадию (2), когда раствор ретентата концентрируют до концентрации белка, которая равна или больше чем 220 г/л. В более предпочтительном варианте осуществления стадия (1) переходит в стадию (2), когда раствор ретентата концентрируют до концентрации белка, которая равна 240 г/л.
В данном варианте осуществления, скорость подачи потока, после того как значение давления подачи уменьшают на стадии (2), поддерживают на постоянной скорости, предпочтительно 120 ЛМЧ (л/м2/час) или ниже, или более предпочтительно 80 ЛМЧ (л/м2/час) или ниже.
В одном варианте осуществления, значение давления подачи, прилагаемое к ультрафильтрационной мембране на стадии (2), поддерживают на постоянной скорости.
В одном варианте осуществления, значение давления подачи, прилагаемое к ультрафильтрационной мембране на стадии (2), поддерживают в пределах 85-100% от указанного максимального давления подачи на ультрафильтрационную мембрану путем линейного снижения скорости подачи потока.
В одном варианте осуществления, скорость подачи потока регулируют автоматически таким образом, чтобы поддерживать давление подачи в пределах 85-100% от указанного максимального давления подачи на ультрафильтрационную мембрану путем контроля с обратной связью между давлением подачи и скоростью подачи потока.
В одном варианте осуществления способа получения в соответствии с представленным изобретением дополнительно включают между стадией (1) и стадией (2), следующую стадию:
3) рециркулирования препарата антитела через мембрану с закрытым клапаном проникновения.
В данном варианте осуществления, препарат антитела рециркулирует с полностью открытым клапаном контроля давления ретентата.
В данном варианте осуществления, скорость подачи потока на стадии (3) предпочтительно поддерживают на постоянной скорости потока от 5 до 120 ЛМЧ (л/м2/час), и более предпочтительно от 10 до 80 ЛМЧ (л/м2/час).
Представленное изобретение, кроме того, касается жидкой композиции, которая содержит высококонцентрированные антитела, полученные по способам согласно представленному изобретению.
Представленное изобретение, кроме того, касается жидких фармацевтических композиций. Фармацевтические жидкие композиции согласно представленному изобретению могут включать фармацевтически приемлемые носители.
В представленном изобретении жидкие фармацевтические композиции обычно относятся к агентам для лечения, предупреждения, тестирования или диагностики заболеваний.
Жидкие фармацевтические композиции согласно представленному изобретению могут быть сформулированы, используя способы, известные квалифицированному специалисту в данной области с уровня техники. Например, их могут использовать парентерально, в форме инъекций стерильных растворов или суспензий, которые включают воду или другую фармацевтически приемлемую жидкость. Например, такие жидкие композиции могут быть сформулированы путем смешивания в виде единичной дозы, которая требуется, в основном, утвержденной медицинской производственной практикой, путем соответствующего комбинирования с фармацевтически приемлемыми носителями или средами, в частности, со стерильной водой, физиологическим раствором, растительным маслом, эмульгатором, суспензией, поверхностно-активного вещества, стабилизатором, вкусовым агентом, наполнителем, носителем, консервантом, связывающим веществом или др. В таких составах, количество активного ингредиента регулируются так, чтобы получить соответствующее количество в заранее определенном диапазоне.
Стерильные композиции для инъекции могут быть сформулированы, используя носители, такие как дистиллированная вода для инъекций, в соответствии со стандартной практикой формулирования.
Водные растворы для инъекции включают, например, физиологический раствор и изотонические растворы, содержащие декстрозу или другие вспомогательные вещества (например, D-сорбит, D-манноза, D-маннит и хлорид натрия). Кроме того, возможным является использование в комбинации соответствующих солюбилизаторов, например, спиртов (этанол и подобные), полиспиртов (пропиленгликоль, полиэтиленгликоль и подобные), неионных поверхностно-активных веществ (полисорбат 80 (ТМ), НСО-50 и подобные).
Масла включают кунжутное и соевое масла. Бензилбензоат и/или бензиловый спирт могут быть использованы в комбинации как солюбилизаторы. Кроме того, возможным является комбинирование буферов (например, фосфатного буфера и натрий ацетатного буфера), успокаивающих средств (например, гидрохлорида прокаина), стабилизаторов (например, бензилового спирта и фенола), и/или антиоксидантов. Соответствующие ампулы заполняют подготовленными инъекционными растворами.
Жидкие фармацевтические композиции согласно представленному изобретению предпочтительно вводят парентерально. Например, жидкие композиции могут находиться в дозированной форме для инъекций, трансназального введения, транспульмонарного введения или трансдермального введения. Например, они могут быть введены системно или местно путем внутривенной инъекции, внутримышечной инъекции, внутрибрюшинной инъекции, подкожной инъекции или подобной.
Способы введения, соответственно, могут быть выбраны, принимая во внимание возраст и симптомы пациента. Доза жидкой фармацевтической композиции, содержащей антигенсвязывающую молекулу, может составлять, например, от 0,0001 до 1000 мг/кг для каждого введения. Кроме того, доза может составлять, например, от 0,001 до 100 000 мг на одного пациента. Однако представленное изобретение не ограничивается числовыми значениями, описанными выше. Дозы и способы введения варьируют в зависимости от веса пациента, возраста, симптомов и подобного. Квалифицированные специалисты в данной области могут установить соответствующие дозы и способы введения, принимая во внимание факторы, описанные выше.
[Примеры]
Следующие примеры служат для более полного описания способа использования описанного выше раскрытия, а также, чтобы представить лучшие режимы, предусмотренные для выполнения различных аспектов изобретения. Следует понимать, что данные примеры никоим образом не служат для ограничения истинного объема данного изобретения, а скорее представлены с целью иллюстрации.
Пример сравнения 1
ФИГ. 1 иллюстрирует основные компоненты устройства, которое используют для выполнения процесса ультрафильтрации. Резервуар для рециркуляции содержит исходное вещество и ретентат. Устройство для смешивания обеспечивает равномерное перемешивание между первоначальным слоем жидкости, добавляемым через трубопровод перекачки и ретентат, который обратно возвращают в резервуар для рециркуляции с ультрафильтрационной мембраны. Насос подачи создает тангенциальный поток через мембрану. Давление подачи измеряют на входе мембраны. Клапан регулирования давления ретентата используют со стороны ретентата, ниже по потоку от мембраны, чтобы регулировать давление ретентата, например, при контролировании трансмембранного давления (ТМР). Между мембраной и клапаном регулирования давления ретентата датчик давления меряет давление ретентата. На проницаемой стороне мембран, давление фильтруемой жидкости через мембрану контролируют с помощью датчика давления пермеата.
Для процесса ультрафильтрации в лабораторных условиях используют автоматизированную TFF систему AKTAcrossflow (GE Healthcare, US). Процесс ультрафильтрации выполняли, используя 0,02 м Sartocon слоистую кассету с Hydrosart мембраной из регенерированной целлюлозы, с порогом номинальной молекулярной массы 30 кДа и характеристикой максимального давления подачи 4,0 бар (Sartorius, Germany).
Перед использованием мембранная кассета была очищена 1 моль/л гидроксидом натрия и промыта очищенной водой. Нормализованный поток определяли, чтобы обеспечить сопоставимые свойства мембраны. Мембранная кассета была уравновешена 30 ммоль/л гистидиновым буфером с рН 5,8 перед процессом. Ультрафильтрацию осуществляли при температуре окружающей среды.
Исходное вещество получали из очищенного пула гуманизированного моноклонального антитела против рецептора интерлейкина-6 (IL-6R) человека (тоцилизумаб (зарегистрированный товарный знак: ACTEMRA, RoACTEMRA), смотри публикацию РСТ № WO 92/19759, патент США №5795965). Очищенный пул концентрировали вплоть до 60 мг/мл и обменный буфер с 30 ммоль/л гистидинового буфера, рН 5,8.
Пул обменного буфера (ДФ пул) загружали в TFF систему с 625 г антитело/м2. Скорость подачи потока была представлена постоянной скоростью 250 ЛМЧ (л/м2/час) в течение всего процесса. ТМР контролировали на 1,0 бар до полного открытия клапана регулирования давления ретентата. Процесс ультрафильтрации осуществляли с остающейся открытой проницаемой стороной. Операцию завершали, когда давление подачи превышало 3,5 бар. После процесса ультрафильтрации, концентрированный раствор циркулировал с проницаемой стороны, закрытой в течение 15 минут при постоянной скорости потока ретентата 10 мл/мин, и затем извлекали в градуированный цилиндр. Извлеченный пул перемешивали до визуально однородного состояния.
Для измерения концентрации белка извлеченный пул разбавляли гравиметрически, используя значение плотности, измеренное с помощью измерителя плотности DMA 4500 (Anton Paar, Austria). УФ-поглощение при 280 нм измеряли с помощью УФ/видимой области спектрофотометра DU800 (Beckman Coulter, US).
ФИГ. 2 показывает измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР. Таблица 1 показывает результат измерения концентрации белка.
|
Пример сравнения 2
Пример сравнения 1 повторяли за исключением следующего. Скорость подачи потока уменьшали до 80 л/м2/час, когда объем ретентата достигал значения, которое соответствует концентрации белка 100 г/л.
ФИГ. 3 показывает измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР. Таблица 2 показывает результат измерения концентрации белка.
|
Пример сравнения 3
Пример сравнения 1 повторяли за исключением следующего. Скорость подачи потока уменьшали до 80 л/м2/час, когда объем ретентата достигал значения, которое соответствует концентрации белка 200 г/л.
ФИГ. 4 показывает измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР. Таблица 3 показывает результат измерения концентрации белка.
|
Пример 4
Пример сравнения 1 повторяли за исключением следующего. Скорость подачи потока уменьшали до 80 л/м2/час, когда давление подачи превышало 3,5 бар. Значение объема ретентата в этой точке соответствует концентрации белка 240 г/л.
ФИГ. 5 показывает измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР. Таблица 4 показывает результат измерения концентрации белка.
|
Пример 5
Пример 4 повторяли за исключением следующего. Если только давление подачи превышало 3,5 бар при постоянной скорости подачи потока 250 л/м2/час, скорость подачи потока устанавливали с автоматическим регулированием потока таким образом, чтобы поддерживать давление подачи 3,5 бар. Операцию прекращали, когда скорость подачи потока уменьшалась до 80 л/м2/час.
ФИГ. 6 показывает измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР. Таблица 5 показывает результат измерения концентрации белка.
|
Пример 6
Пример 4 повторяли за исключением следующего. Направление потока переключали в режим циркуляции, если только давление подачи превышало 3,5 бар. В режиме циркуляции, ретентат циркулировал через мембрану при полностью открытом клапане регулирования давления ретентата и закрытом проникновении. После циркуляции в течение 20 минут с постоянной скоростью подачи потока 80 л/м2/час, ультрафильтрацию возобновляли с той же скоростью подачи потока.
ФИГ. 7 показывает измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР. Таблица 6 показывает результат измерения концентрации белка.
|
Пример 7
Пример 6 повторяли за исключением следующего. Циркуляцию выполняли с постоянной скоростью подачи потока 10 л/м2/час.
ФИГ. 8 показывает измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР. Таблица 7 показывает результат измерения концентрации белка.
|
ФИГ. 9 суммирует концентрацию восстановленного пула в примерах 1-7.
Пример 8
Вязкость концентрированного пула гуманизированного моноклонального антитела IL-6R измеряли, используя AR1000 реометр и конус, и геометрию пластины с диаметром 40 мм, углом 2 градуса и усечением 53 микрометра (ТА Instruments, US).
ФИГ. 10 показывает график вязкости против концентрации при температурах 15 градусов С, 25 градусов С и 35 градусов С.
Пример сравнения 9
Для исследования масштабирования, процесс УФ/ДФ выполняли в полупромышленном масштабе. Процесс осуществляли в две стадии с разными размерами TFF системы. Большую TFF систему, использующую 1,20 м2 Sartocon кассеты, использовали для процесса на УФ1/ДФ/УФ2 стадиях. Меньшую TFF систему, использующую 0,30 м2 Sartocon кассеты, использовали для процесса на УФ3/УФ4 стадиях. Весь процесс осуществляли при температурах окружающей среды с остающейся открытой проницаемой стороной. Используемые Sartocon кассеты имели 30 кДа (порог отсечения) Hydrosart мембраны (Sartorius, Germany).
Перед использованием мембранные кассеты очищали, используя 1 моль/л гидроксид натрия, и промывали очищенной водой. Определяли нормализованный поток, чтобы обеспечить сопоставимые свойства мембраны.
Перед процессом, мембранные кассеты уравновешивали 30 ммоль/л гистидиновым буфером с рН 5,8 в большой системе и 20 ммоль/л гистидиновым буфером с рН 6,1 в малой системе, соответственно. Весь процесс проводили при температуре окружающей среды.
В большой системе, очищенный пул гуманизированного моноклонального антитела против IL-6R человека загружали из расчета 259 г антитела/м2. Скорость подачи потока устанавливали при постоянной скорости 710 л/м2/час. ТМР регулировали на уровне 1,0 бар. Очищенный пул концентрировали до 20 г/л на УФ1 стадии и затем подвергали диафильтрации с 7 объемами 30 ммоль/л гистидинового буфера с рН 5.8. После диафильтрации, пул дополнительно концентрировали до 60 г/л на УФ2 стадии. УФ2 пул циркулировал через мембрану в течение 15 минут при низком дифференциальном давлении 5 фунтов на квадратный дюйм, а затем извлекался в отдельный контейнер.
В малой системе, извлеченный УФ2 пул загружали из расчета 990 г антитела/м2. На УФ3 стадии, скорость подачи потока устанавливали при постоянной скорости 250 л/м2/час. УФ3 стадию завершали, когда объем ретентата достигал значения, которое соответствует концентрации белка 100 г/л. Скорость подачи потока устанавливали при постоянной скорости 80 л/м2/час на УФ4 стадии. ТМР регулировали на уровне 1,0 бар до полного открытия клапана регулирования давления ретентата. Операцию прекращали, когда объем ретентата уменьшался до значения, которое соответствует концентрации белка 240 г/л. Важно отметить, что скорость подачи потока снижали вручную через 80 минут, поскольку давление подачи приближалось к верхней границе до объема ретентата, который достигался как целевой объем.
УФ4 пул циркулировал через мембрану в течение 15 минут при низком дифференциальном давлении 15 фунтов на квадратный дюйм, а затем его извлекали в отдельный контейнер. Извлеченный УФ4 пул хорошо перемешивали путем переворачивания контейнера.
Для измерения концентрации белка, извлеченный УФ4 пул разбавляли гравиметрически, используя значение плотности, измеренное с помощью измерителя плотности Densito 30РХ (Mettler Toledo, Switzerland). УФ-поглощение при 280 нм измеряли с помощью УФ/видимая область спектрофотометра UV-1700 (Shimadzu, Japan).
ФИГ. 11 показывает измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР и объема ретентата на УФ1/ДФ/УФ2 стадиях.
ФИГ. 12 показывает измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР на УФ3/УФ4 стадиях.
Таблица 8 показывает результат измерения концентрации белка.
|
Таблица 9 показывает результат расчета выхода на стадии.
|
Пример 10
Пример сравнения 9 повторяли за исключением следующих. УФ3/4 стадии выполняли, используя 0,40 m2 Sartocon кассеты с Hydrosart мембраной с пороговым отсечением 30 кДа (Sartorius, Germany). В большой системе, очищенный пул загружали из расчета 274 г антитела/м2. В малой системе извлеченный УФ2 пул загружали из расчета 804 г антитела/м2. Процесс перехода от УФ3 стадии до УФ4 стадии, когда объем ретентата достигал значения, которое соответствует концентрации белка 220 г/л.
ФИГ. 13 показывает измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР и объема ретентата на УФ1/ДФ/УФ2 стадиях.
ФИГ. 14 показывает измеренные значения процесса с течением времени для скорости подачи потока, давление подачи, давление ретентата, ТМР и объем ретентата на УФ3/УФ4 стадиях.
Таблица 10 показывает результат измерения концентрации белка.
|
Таблица 11 показывает результат расчета выхода на стадии.
|
Пример 11
Пример 10 повторяли за исключением следующего. Промышленного масштаба TFF системы использовали на GMP производственном предприятии. y01/DF/y02 стадии проводили, используя 35,10 м2 Sartocon кассеты, и УФ3/4 стадии проводили, используя 17,55 м2 Sartocon кассеты с Hydrosart мембраной с пороговым отсечением 30 кДа (Sartorius, Germany). В большой системе, очищенный пул загружали из расчета 243 г антитела/м2. В малой системе извлеченный УФ2 пул загружали из расчета 478 г антитела/м2. ДФ буфер меняли на 39 ммоль/л гистидиновый буфер с рН 5.8. Целевая концентрация белка УФ2 пула возрастала до 75 г/л. В конце УФ2 стадии, скорость подачи потока уменьшали для предотвращения ценообразования в емкости для возвращения в цикл. Для максимального извлечения, УФ2 пул и УФ4 пул восстанавливали, используя буферное замещение 70 л и 1 л, соответственно. Восстановленный УФ4 пул формулировали при 180 г/л в 20 ммоль/л гистидиновом буфере с рН 6,0, 30 ммоль/л метионина, 100 ммоль/л аргинина и 0,2% полисорбата 80 (смотри РСТ публикация №WO 2009/084659). Для измерения концентрации белка, УФ4 пул и восстановленный УФ4 пул разбавляли гравиметрически, используя эталонную плотность. УФ-поглощение при 280 нм измеряли с помощью УФ/видимая область спектрофотометра UV-2450 (Shimadzu, Japan).
ФИГ. 15 показывает измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР и объема ретентата на УФ1/ДФ/УФ2 стадиях.
ФИГ. 16 показывает измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР и объема ретентата на УФ3/УФ4 стадиях.
Таблица 12 показывает результат измерения концентрации белка.
|
Таблица 13 показывает результат расчета выхода на стадии.
|
Концентрацию гистидина измеряли, используя ВЭЖХ систему Alliance 2695 (Waters, US) и YMC-Pack ODSA, 250×4,6 мм колонка (YMC, Japan). Таблица 14 показывает результат количественного анализа на гистидин.
|
Содержание мономера во внутрипроизводственных пулах измеряли, используя ВЭЖХ систему Alliance 2695 (Waters, US) и TSK G3000SWXL колонку (Tosoh, Japan). Таблица 15 показывает результат гель-хроматографического анализа.
|
Пример 12
Пример 11 повторяли за исключением следующего. В большой системе, очищенный пул загружали из расчета 246 г антитела/м2. В малой системе, извлеченный UF2 пул загружали из расчета 482 г антитела/м2.
ФИГ. 17 показывает измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР и объема ретентата на УФ1/ДФ/УФ2 стадиях.
ФИГ. 18 показывает измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР на УФ3/УФ4 стадиях.
Таблица 16 показывает результат измерения концентрации белка.
|
Таблица 17 показывает результат расчета выхода на стадии.
|
Концентрацию гистидина измеряли, используя ВЭЖХ систему Alliance 2695 (Waters, US) и YMC-Pack ODSA, 250×4,6 мм колонку (YMC, Japan). Таблица 18 показывает результат количественного анализа на гистидин.
|
Содержание мономера во внутрипроизводственных пулах измеряли, ВЭЖХ систему Alliance 2695 (Waters, US) и TSK G3000SWXL колонку (Tosoh, Japan). Таблица 19 показывает результат гель-хроматографического анализа.
|
Пример сравнения 13
Автоматизированную TFF систему для лабораторных условий AKTAcrossflow (GE Healthcare, US) использовали для процесса ультрафильтрации. Процесс ультрафильтрации осуществляли, используя две 88 см2 Pellicon 3 кассеты с мембранами Ultracel из регенерированной целлюлозы, номинальный молекулярный вес отсекания 30 кДа (Merck Millipore, Germany).
Перед использованием мембранные кассеты очищали, используя 0,5 моль/л гидроксид натрия, и промывали очищенной водой. Определяли нормализованный поток, чтобы обеспечить сопоставимые свойства мембраны. Перед процессом мембранные кассеты уравновешивали 20 ммоль/л Трис, 150 ммоль/л аргининового буфера с рН 7,0. Ультрафильтрацию осуществляли при температуре окружающей среды.
Исходное вещество получают из очищенного пула гуманизированного моноклонального антитела анти-NR10 (полностью гуманизированного антитела NS22, полученного в соответствии со способом, представленным в примере 12 WO 2009/072604), которое принадлежит к классу антитела IgG2. Оно представляет собой антитело, аминокислотная последовательность которого была модифицирована таким образом, что pI снижается до 5,6. Очищенный пул концентрировали вплоть до 20 мг/мл и буфер заменяли на буфер, содержащий 20 ммоль/л Трис, 150 ммоль/л аргинина с рН 7,0.
Пул с замененным буфером (ДФ пул) загружали из расчета 625 г антитела/м2. Скорость подачи потока осуществляли при постоянной скорости 250 ЛМЧ (л/м2/час) и потом уменьшали до 80 г антитела/м2, когда объем ретентата достигал значения, которое соответствует концентрации белка 60 г/л. ТМР регулировали на уровне 1,0 бар до полного открытия клапана регулирования давления ретентата. Процесс ультрафильтрации осуществляли с остающейся открытой проницаемой стороной. Операцию прекращали, когда давление подачи превышало 3,5 бар. После процесса ультрафильтрации, концентрированный раствор циркулировал с закрытой проницаемой стороной в течение 15 минут с постоянной скоростью подачи потока 10 мл/мин и затем извлекали в градуированный цилиндр. Извлеченный пул перемешивали до визуально однородного состояния.
Для измерения концентрации белка, извлеченный пул разбавляли гравиметрически, используя значение плотности, измеренное с помощью измерителя плотности DMA 4500 (Anton Paar, Austria). УФ-поглощение при 280 нм измеряли с помощью УФ/видимая область спектрофотометра DU800 (Beckman Coulter, US).
ФИГ. 19 показывает измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР. Таблица 20 показывает результат измерения концентрации белка.
|
Пример 14
Пример сравнения 13 повторяли за исключением следующего. Скорость подачи потока уменьшили до 80 л/м2/час, когда давление подачи превысило 3,5 бар. Значение объема ретентата в этой точке соответствует концентрации белка 145 г/л.
ФИГ. 20 показывает измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР. Таблица 21 показывает результат измерения концентрации белка.
|
Пример 15
Пример 14 повторяли за исключением следующего. Если только давление подачи превышало 3,5 бар при постоянной скорости подачи потока 250 л/м2/час, скорость подачи потока устанавливали автоматическим регулированием потока таким образом, чтобы поддерживать давление подачи 3,5 бар. Операцию прекращали, когда скорость подачи потока уменьшалась до 80 л/м2/час.
ФИГ. 21 показывает измеренные значения процесса с течением времени для скорости подачи потока, давления подачи, давления ретентата, ТМР. Таблица 22 показывает результат измерения концентрации белка.
|