Результат интеллектуальной деятельности: Способ оценки влияния нитрозаминов на апоптоз у детей, проживающих в неблагоприятных условиях среды обитания
Вид РИД
Изобретение
Изобретение относится к области медицины и биологии, в частности, к исследованиям таких канцерогенных веществ, как нитрозамины, модифицирующие апоптоз у детей, проживающих в неблагоприятных условиях среды обитания, и может быть использовано для диагностики и прогнозирования токсического действия нитрозаминов на процесс апоптоза, приводящий к нарушению иммунной системы, для тестирования ранних нарушений здоровья пациента, например, для установления индивидуальной предрасположенности к онкозаболеваниям, учитываемой при проведении мероприятий социально-гигиенического мониторинга.
Статистика показывает, что в 85% от общего количества городов России население в той или иной степени постоянно подвергается воздействию различных вредных веществ, отрицательно влияющих на здоровье человека. Особенно это касается детского населения как наиболее уязвимого. Детская популяция представляет собой группу высокого риска, так как дети имеют ряд физиологических особенностей, характеризуются наличием критических периодов развития, большей чувствительностью к влиянию токсичных веществ. От своевременности обнаружения сдвигов в состоянии здоровья детей зависит эффективность корригирующих и профилактических мероприятий, предупреждающих развитие тех заболеваний, которые с большой долей вероятности могут возникнуть под влиянием конкретных токсикантов, например онкозаболеваний под воздействием нитрозаминов.
В частности, нитраты, попадая в человеческий организм с растительной пищей, восстанавливаются до нитритов, которые приводят к образованию метгемоглобина и нарушению транспортной функции крови, а также угнетению нервной системы и процессов тканевого дыхания.
Исследователями США, Германии, Чехословакии, России установлено, что нитросоединения вызывают у человека метгемоглобинемию, рак желудка, отрицательно влияют на нервную и сердечно-сосудистую системы, на развитие эмбрионов.
Актуальным на территориях с высоким содержанием нитратов в объектах окружающей среды является организация биомониторинга содержания токсикантов в биологических средах, а также оценка вызываемых ими эффектов со стороны прежде всего иммунной системы и показателей, характеризующих противоопухолевый потенциал организма.
Апоптоз - генетическая запрограммированная форма клеточной гибели, определяемая на основе характерных морфологических изменений умирающих клеток. Данный процесс является одним из ключевых процессов, определяющих формирование антигенспецифической составляющей иммунной системы и в значительной степени реализацию ее эффекторных функций. Однако известны патологические состояния, при которых механизм запрограммированной клеточной гибели оказывается либо заблокированным, либо активированным, что приводит либо к неконтролируемой клеточной пролиферации, не сдерживаемой конкурирующим процессом апоптоза, либо к ускоренной клеточной гибели и к снижению их иммунокомпетентности. При этом экотоксиканты, в частности нитрозамины, способны нарушать регуляторные функции иммунной системы, что может способствовать снижению адаптационных возможностей организма, возникновению онкологических, аутоиммунных и иммунодефицитных состояний. Этим и обусловлена потребность в получении оценки апоптоза, модифицированного нитрозаминами.
Из уровня техники известен ряд способов, при реализации которых оценивают апоптоз у биологических объектов, а именно:
- «Способ определения тяжести заболевания и эффективности лечения у больных бронхолегочными заболеваниями» (Заявка на изобретение №2009101693). Согласно указанному известному решению производят отбор исследуемого материала, выделение из него клеточной субстанции, подготовку ее к исследованию, определение величины альтерации клеток путем оценки их апоптоза, при этом в качестве исследуемого материала используют индуцированную мокроту больного и здорового человека, в клеточной субстанции дополнительно определяют величину альтерации клеток путем некроза, при этом показатели апоптоза и некроза определяют при двух и более обследованиях с интервалом в 1-3 суток, полученные показатели выражают в виде апоптотического индекса (АИ) и индекса некроза (ИН), рассчитывают индекс альтерации клеток (ИАК) по формуле: ИАК=ИН/АИ, где ИН - индекс некроза; АИ - апоптотический индекс; при этом тяжесть заболевания определяют путем сравнения показателя индекса альтерации клеток больного с показателем индекса альтерации клеток здоровых лиц, и диагностируют легкое течение бронхолегочного заболевания при показателях ИАК более 1,5, среднее до 1,0 и тяжелое менее 1,0, а эффективность лечения определяют путем сравнения начальных показателей индекса альтерации клеток больного с показателем индекса альтерации после лечения, и диагностируют положительную динамику лечения при увеличении ИАК до значений для здоровых лиц 2,0.
Предлагаемый способ отличается от указанного известного тем, что оценивается не степень тяжести патологии, а идентифицируется этиологический фактор (химический - нитрозамины), инициирующий процесс апоптоза, а также степень вызываемых исключительно этим фактором отклонений по данному критерию. Кроме того, в качестве показателя гибели в заявляемом способе используется критерий только апоптоза (некроз, как в известном способе, не учитывается), причем именно ген внутриклеточного транскрипционного фактора, отвечающего за апоптоз, что позволяет прогнозировать и анализировать предлагаемым способом ранние нарушения состояния запрограммированного процесса клеточной гибели.
- «Функциональный иммуноанализ in vitro» (Патент РФ №2416797), согласно которому производят выделение клеток, первичную инкубацию из крови, сыворотки или плазмы пациента клеток с исследуемым веществом, получение супернатанта или смеси из клеток и супернатанта первичной инкубации, вторичную инкубацию клеток-мишеней с супернатантом или смесью из клеток и супернатанта и анализ клеток-мишеней. При этом в случае выделенных клеток речь идет о первичной инкубации эффекторных клеток иммунной системы. В случае клеток-мишеней вторичной инкубации речь идет о клетках человека или клетках высших млекопитающих.
В известном способе вещество используется как лекарственное преиммобилизационное средство, измененные клетки и супернатант после экспозиции которого будут применяться для апоптоза опухолевых клеток. В предлагаемом же способе оценивается угнетение апоптоза самих клеток иммунной системы под воздействием исследуемого вещества - нитрозамина, что не ставится задачей известного способа, но может привести к недостаточной эффективности в дальнейшем апоптоза опухолевых клеток.
Также известен Способ количественной оценки апоптоза, модифицированного органическими низкомолекулярными соединениями (Патент РФ №2471190), согласно которому производят отбор пробы крови у пациента, выделение из пробы мононуклеарных клеток и инкубацию клеток с исследуемым соединением, где выделение из пробы мононуклеарных клеток производят путем введения в пробу этилендиаминтетраацетата, разведения ее водным раствором хлорида натрия, наслоения на 3 мл фиколла-урографина с градиентом плотности 1,077 г/мл, с последующим центрифугированием в течение 30 мин при 1500 об/мин и отбором мононуклеарных клеток, затем производят двукратный отмыв выделенных клеток раствором хлорида натрия и проводят ресуспендирование указанных клеток в рабочем растворе буфера для окрашивания 1X Annexin V Binding Buffer до концентрации 1×106 клеток/мл, при этом рабочий раствор буфера для окрашивания 1X Annexin V Binding Buffer представляет собой смесь концентрированного буфера для окрашивания 10Х Annexin V Binding Buffer с дистиллированной водой в объемном соотношении 1:9 соответственно, затем осуществляют инкубацию полученных клеток с исследуемым органическим низкомолекулярным соединением, получая опытный образец, и осуществляют инкубацию полученных клеток без добавления указанного соединения, получая контрольный образец, при этом инкубацию полученных клеток с исследуемым органическим низкомолекулярным соединением и без него проводят в течение 1 часа при температуре 37°C, после инкубации в опытный и контрольный образцы вводят реагенты аннексии V и йодид пропидия, образцы вновь инкубируют в темноте при комнатной температуре в течение 15 мин, добавляют рабочий раствор буфера для окрашивания 1X Annexin V Binding Buffer и осуществляют цитометрический анализ полученных образцов с определением содержания в них аннексина V, сравнивают численные величины содержания аннексина V в контрольном и опытном образцах и по соотношению большего числа содержания аннексина V к меньшему количественно оценивают апоптоз, модифицированный органическим низкомолекулярным соединением, причем при указанном соотношении, равном 1,5 и более, судят об апоптозе - критическом состоянии запрограммированной клеточной гибели в связи с влиянием указанного органического соединения.
Однако известный способ предназначен для оценки состояния апоптоза клеток под воздействием анализируемого химического вещества как факта свершившегося, то есть идентификация происходит на последней стадии процесса апоптоза, когда мероприятия по нейтрализации нарушений апоптоза будут запоздалыми, в то время как предлагаемый способ предполагает оценку раннего состояния апоптоза, а выявление генотипов Arg72Pro гена ТР53 позволяет получить максимально раннюю информацию об апоптозе на уровне прогноза и использовать ранние превентивные мероприятия.
Из патента РФ №2540500 известен способ прогнозирования ранней стадии апоптоза. При его реализации выделяют клетки, инкубируют их 48 часов при температуре 37°C и 5% содержании CO2 с добавлением индуктора апоптоза дексаметазона в концентрации 10-4 моль/мл. Жизнеспособность лимфоцитов определяют количественно по включению трипанового синего с последующим определением концентрации восстановленного и окисленного глутатионов в лизате лимфоцитов после предварительной инкубации в течение 30 минут с 10 мМ 2-винилпиридина. Раннюю стадию апоптоза лимфоцитов прогнозируют при одновременном комплексном снижении концентрации восстановленного глутатиона на 17% и более и увеличении концентрации окисленного глутатиона на 19% и более по сравнению с контролем.
Из уровня техники также известен способ морфологической оценки гибели клеток при апоптозе (заявка на изобретение №99104906), заключающийся в однократном введении испытуемого вещества, извлечении тимуса, приготовлении цитологического препарата, его высушивании, фиксации, окрашивании и определении содержания апоптозных тел и клеток под микроскопом, при этом испытуемое вещество вводят лабораторному животному, через 6 ч удаляют тимус и из гомогената его фрагмента с аутологической сывороткой готовят мазки.
Недостатком указанного способа является невозможность оценки предрасположенности к нарушению клеточной гибели, так как не анализируются кандидатные гены, а также указанным способом не представляется возможным оценить гибель клеток у населения, подверженного хронической низкоуровневой интоксикации, так как используемый методический подход предполагает оценку острого действия и использование исключительно лабораторных животных в эксперименте.
При этом из уровня техники не были выявлены известные способы оценки влияния нитрозаминов на апоптоз, поэтому сделать выбор ближайшего аналога к заявляемому объекту не представляется возможным.
Технический результат, достигаемый предлагаемым изобретением, заключается в обеспечении точности оценки влияния нитрозаминов на апоптоз, с обеспечением возможности в последующем судить о развитии иммунодефицитных и иммунопролиферативных состояний населения уже на ранних стадиях.
Поставленный технический результат достигается предлагаемым Способом оценки влияния нитрозаминов на апоптоз у детей, проживающих в неблагоприятных условиях среды обитания, заключающимся в том, что производят отбор пробы крови у ребенка, и определяют в пробе наличие нитрозамина - нитрозодиметиламина НДМА, в тех пробах крови пациентов, где установлено наличие НДМА, извлекают мононуклеарные клетки и с использованием метода проточной цитометрии определяют количество внутриклеточного транскрипционного фактора - белка р53, также у указанного ребенка отбирают пробу буккального эпителия, осуществляют выделение из указанной пробы дезоксирибонуклеиновой кислоты ДНК, затем на детектирующем амплификаторе с использованием полимеразной цепной реакции проводят генотипирование полиморфизма, используя в качестве праймера участок ДНК Arg72Pro (rs1042522) гена ТР53, путем исследования его аллельного состояния, устанавливая при этом для гена ТР53 одно из следующих его состояний: гетерозиготное, или нормальное гомозиготное, или патологическое гомозиготное, и при одновременном выполнении следующих условий: наличие патологического гомозиготного или гетерозиготного генотипов Arg72Pro гена ТР53, снижение в крови содержания белка р53 в 1,5 и более раз, по отношению к нижней границе физиологической нормы для детей, и при наличии в крови нитрозодиметиламина оценивают процесс апоптоза у ребенка под влиянием нитрозаминов как замедленный, а при отсутствии хотя бы одного из вышеуказанных условий оценивают процесс апоптоза у ребенка под влиянием нитрозаминов как нормальный.
Указанный технический результат достигается за счет следующего.
По данным Всемирной организации здравоохранения основной путь поступления N-нитрозаминов в организм человека - это метаболизм нитритов и нитратов, содержащихся в продуктах питания, питьевой воде под действием микрофлоры и кислой среды желудка.
Хроническое отравление нитратами опасно тем, что восстанавливающиеся из них нитриты соединяются с аминами и амидами любых доброкачественных белковых продуктов и образуют канцерогенные нитрозамины и нитрозамиды, обладающие мутагенной активностью.
Нитрозамины токсичны и канцерогенны в присутствии дополнительных ферментных систем, которые всегда имеются в организме человека и животных, и поражают кроветворную, лимфоидную, пищеварительную системы, подавляют иммунитет.
Нитрозамины - высокотоксичные соединения 1-го класса опасности, входят в список приоритетных токсикантов, утвержденных Международной организацией по исследованию рака (IARC) и Агентством по охране окружающей среды (США) [IARC Monographs on the Evaluation of Carcinogenic Risks for Humans, Lyon, 1987, Suppl. 7. v. 1-42; «Нитраты, нитриты и N-нитрозосоединения». Женева: Всемирная организация здравоохранения. 1981. 118 с.].
Канцерогенные свойства нитрозаминов впервые были обнаружены в 1956 г. Magee и Barnes. В хронических опытах на крысах они показали, что нитрозамин вызывает у животных опухоли печени. К настоящему времени изучено на канцерогенность более 300 нитрозаминов, 90% из которых индуцировали у животных опухоли [Preussman R.]. Для многих нитрозаминов характерна высокая канцерогенная активность. Некоторые из них, такие как нитрозодиэтиламин (НДЭА) или нитрозодиметиламин (НДМА), вызывали опухоли у 40 различных видов животных от моллюсков до обезьян [Boorman G., Eustis S.]. Канцерогенные нитрозамины вызывают опухоли различной локализации и морфологии. Локализация опухолей может меняться в зависимости от путей введения и дозы (низкие дозы НДМА вызывают опухоли печени, а высокие - почек).
Метаболическая активация непрямого канцерогенного вещества N-нитрозодиметиламина (НДМА) (относится к группе канцерогенных веществ класса 2А), который использовали в предлагаемом способе в качестве представителя нитрозаминов, вызывающего опухоли у многих видов животных, осуществляется с образованием диазогидроксида, который способен алкилировать биополимеры клетки, в т.ч. нуклеофильные центры оснований ДНК. Предполагают, что при этом наиболее важная мишень - гуанин, алкилирование которого по атому кислорода в положении 6 приводит к возникновению мутаций («Канцерогенные вещества»: Шабад Л.М. Эволюция концепций бластомогенеза, М., 1979; Итоги науки и техники. Сер. Онкология, т.15. Химический канцерогенез. М., ВИНИТИ, 1986; IARC monographs on the evaluation of the carcinogenic risk of chemicals to humans. Suppl., v. 4 Chemicals, industrial processes and industries associated with cancer in humans, Lyon, 1982 (IARC Monographs, v. 1 to 29); Valinio H. [a.o.], "Carcmogenesis", 1985, v. 6, №11, p. 1653-65. Г.А. Белицкий).
В настоящее время важнейшими для изучения вклада в подверженность раку и поведения опухоли являются исследования генетических полиморфизмов, описанных для гена ТР53. Одним из наиболее изученных для ТР53 полиморфизмов является Arg72Pro, расположенный в 72 кодоне экзона 4, который приводит к структурной модификации белков. Предполагается, что ТР53 Arg72Pro аллеля эффективней в запуске процесса апоптоза, потому что он имеет большую связывающую активность к мишеням MDM2. Таким образом, он может действовать как фактор выживания больных раком желудка, что корреспондируется с результатами исследования ТР53 Arg72Pro, которые обосновывают данные, указывающие на ТР53 с Arg72Pro, ассоциированного с более поздним началом рака [Neves Filho Е.Н.С. Cordeiro D.E.F. Vieira A.P.F. Rabenhorst S.H.B. TP53 Codon 72 and Intron 3 Polymorphisms and Mutational Status in Gastric Cancer: An Association with Tumor Onset and PrognosisPathobiology. 2012;79:323-328].
В настоящее время важная роль отводится гену ТР53, как индуктору опухолевого роста при раке молочной железы. Это ген супрессор, который локализован на коротком плече 17 хромосомы (17р13.1), кодирует белок р53.
Ген ТР53 - наиболее часто мутирующий ген, связанный с опухолевым ростом у человека. В норме ТР53 участвует в регуляции клеточного цикла, запускает апоптоз; мутация ТР53 регистрируется практически во всех видах опухолей. [Bunz F., Hwang P.M., Torrance С.Et al. Disruption of p53 in human cancer cells alters the responses to therapeutic agents // J. Clin. Invest-1999. - 104. - Р. 263-9].
Из известных в настоящее время полиморфизмов гена ТР53 функционально значимым считается экзонный полиморфизм Arg72Pro (rs 1042522). Данный полиморфизм обусловлен трансверсией гуанина на цитозин в 72-м кодоне 4-го экзона, что ведет к трансляции функционально и биохимически измененного белка р53 [Мухаммадиева Г.Ф.. Бакиров А.Б., Каримова Л.К., Валеева Э.Т. Анализ ассоциаций полиморфных локусов гена-супрессора опухолевого роста ТР53 со злокачественными новообразованиями у работающих в условиях производства стекловолокна / Гигиена и Санитария. №4. 2014. - С. 59-61]. Гуанин, в свою очередь, является основной мишенью нитрозодиметиламина, что лежит в основе мутагенного (канцерогенного) эффекта нитрозамина.
Благодаря использованию в предлагаемом способе в качестве исследуемого материала пробы венозной крови, а также стандартных методик изучения таких параметров, как содержание в пробе крови нитрозаминов (нитрозодиметиламина) и белка р53, обеспечивается простота, надежность и доступность исследований, а также получение результатов нужной информативности.
При реализации предлагаемого способа определяют содержание нитрозодиметиламина (далее НДМА), но при этом теоретически экстраполируются полученные результаты на все нитрозамины, т.к. НДМА относится к самым распространенным представителем этого класса соединений (чаще обнаруживаются два представителя этого класса вредных веществ - нитрозодиметиламин и нитрозодиэтиламин) и отличающийся канцерогенными свойствами (не все представители нитрозаминов являются канцерогенами). Проведенные нами исследования по изучению причинно-следственных связей между содержанием нитрозаминов в крови с возможным ответом в виде экспрессии онкомаркеров показали, что выявлены достоверные сильные зависимости, ассоциированные с концентрацией нитрозодиметиламина в крови - повышение синтеза нейронспецифической энолазы (коэффициент детерминации R2=0,939; критерий Фишера F=1972,6; вероятность р<0,05), а также карцинального антигена СА199 (R2=0,941; F=1686,6; р<0,05). Исследования показали, что использование при реализации предлагаемого способа другого представителя нитрозаминов, например нитрозодиэтиламина, приводит к получению недостоверных результатов при анализе достоверности полученных взаимосвязей с экспрессией онкофетальных белков, при этом достоверность превышает величину 0,05, что является свидетельством более слабой стимуляции данным производным нитрозаминов онкопролиферативного процесса в отличие от нитрозодиметиламина, что позволяет использовать величину содержания в крови нитрозодиметиламина как маркера анализируемых пролиферативных процессов.
Мутации и потери аллелей в гене ТР53 - наиболее распространенные повреждения, идентифицируемые в опухолевых клетках человека. р53 является стресс-зависимым белком; в ответ на повреждение ДНК он тормозит смену фаз клеточного цикла или индуцирует апоптоз. Оказалось, что р53, первоначально описанный как онкоген, способен супрессировать пролиферацию генетически дефектных клеток. В дальнейшем было установлено, что таким образом интактный р53 поддерживает нормальный фенотип клеток организма. р53 супрессирует развитие опухоли, стимулируя апоптоз. Гомологичный внутриклеточный противоапоптотический белок Вс1-2 также регулируется белком р53. Проведенная нами оценка причинно-следственных связей между содержанием белка р53 и концентрацией нитрозаминов в крови выявили достоверные сильные зависимости, ассоциированные с угнетением р53, а значит и связанного с ним апоптоза, при возрастании содержания нитрозодиметиламина (R2=0,575; F=172,9; р<0,05).
Благодаря использованию в качестве исследуемого материала буккального эпителия (пробы биологического материала со слизистой щеки), обеспечивается простота и надежность исследований, а также получение нужной информативности, в плане выделения из указанной пробы дезоксирибонуклеиновой кислоты (ДНК) и посредством полимеразной цепной реакции (ПЦР) проведения генотипирования полиморфизма используется в качестве праймера участок ДНК Arg72Pro (rs 1042522) гена ТР53 путем исследования его аллельного состояния, устанавливая при этом для гена ТР53 одно из следующих его состояний: гетерозиготное, или нормальное гомозиготное, или патологическое гомозиготное.
А выбор в качестве исследуемого гена ТР53 обусловлен тем, что он кодирует р53 и его экспрессию и в случае полиморфизма гена (гетерозиготное или патологическое гомозиготное его состояние) наблюдается снижение (замедление) функции запуска событий апоптоза и «старение» клетки.
Нитрозамины оказывают воздействие на апоптоз, угнетая его. В случае генетической поломки рецептора гена ТР53, действие фактора усиливается.
Таким образом, при оценке на детей влияния нитрозамина на апоптоз в предлагаемом способе рекомендуется использовать три критерия и их количественное соотношение: наличие патологического гомозиготного или гетерозиготного генотипов Arg72Pro гена ТР53, снижение в крови содержания белка р53 в 1,5 и более раз, по отношению к нижней границе физиологической нормы для детей, и при наличии в крови нитрозамина (его представителя - нитрозодиметиламина). А при отсутствии хотя бы одного из вышеуказанных условий оценивают процесс апоптоза у ребенка в присутствии нитрозамина как нормальный, т.е. не приводящий к старению клетки, накоплению нефункционального клеточного материала и развитию иммунопролиферативных, онкологических и других патологических состояний.
Именно благодаря расширению информационных показателей, связанных с апоптозом, и одновременно с количеством химического токсиканта - нитрозамина (нитрозодиметиламина) в крови и будет обеспечена точность оценки влияния нитрозаминов на апоптоз у детей.
Исходя из вышеизложенного, можно сделать вывод, что поставленный технический результат обеспечивается за счет совокупности операций предлагаемого способа, их последовательности и режимов его реализации.
Предлагаемый способ реализуется следующим образом.
1. Производят забор периферической венозной крови утром, натощак, в пробирку, содержащую этилендиаминтетраацетат натрия (ЭДТА).
2. Для исследования кровь с ЭДТА разводят раствором хлорида натрия (9 г/л, рН=7,2) в два раза, наслаивают на 3 мл градиента плотности фиколла-урографина (концентрация фиколла составляла 9%, плотность градиента - 1,077 г/мл) и центрифугируют 30 мин при 1500 об/мин.
3. Образовавшееся в интерфазе «кольцо» мононуклеарных клеток отбирают пипеткой, полученную клеточную взвесь дважды отмывают раствором хлорида натрия (9 г/л, pH 7,2).
4. Полученную взвесь мононуклеаров ресуспендируют в рабочем растворе фосфатно-солевого буфера (PBS) до концентрации 1×106 клеток/мл. В состав фосфатно-солевого буфера PBS входит смесь солей: хлорида натрия, гидроортофосфата натрия, дигидроортофосфата натрия и азида натрия, с pH=7,2.
5. Фенотипирование фракции мононуклеаров (фракция мононуклеаров представляет собой преимущественно лимфоцитарные клетки, и порядка 10 - 15% это циркулирующие моноциты крови) проводится методом проточной цитометрии на цитометре FACSCalibur фирмы «Becton Dickinson» («BD», USA) с использованием программы CellQuest-PrO («BD», USA). Этот известный метод подробно расписан в следующих источниках информации:
- [Kootstra CJ, Van Der Giezen DM, Van Krieken JH, De Heer E, Bruijn JA. Effective treatment of experimental lupus nephritis by combined administration of anti-CD11a and anti-CD54 antibodies. Clin Exp Immunol. 1997; 108(2): 324-332];
- [Driessens MH, van Hulten P, Zuurbier A, La Riviere G, Roos E. Inhibition and stimulation of LFA-1 and Mac-1 functions by antibodies against murine CD18. Evidence that the LFA-1 binding sites for ICAM-1, -2, and -3 are distinct. J Leukoc Biol. 1996; 60(6): 758-765. (Clone-specific: Blocking)];
- [Reed JC, Tsujimoto Y, Alpers JD, Croce CM, Nowell PC. Regulation of bcl-2 proto-oncogene expression during normal human lymphocyte proliferation. Science. 1987; 236 (4806): 1295-1299. (Biology)].
6. Содержание внутриклеточного транскрипционного фактора белка р53 (%) определяли с помощью меченых моноклональных антител (МКАТ), конъюгированных с РЕ (фикоэритрином) (набор 51-14215Х «РЕ Mouse Anti-p53 Set», клон G59-12, «BD Bioscience», США).
7. Содержание нитрозодиметиламина в крови определяли методом хромато-масс-спектрометрии: на газовом хроматографе Agilent 7890А (USA) с масс-селективным детектором (MCD) 5975С и квадрупольным масс-анализатором. Режим ионизации электронным ударом при 70 эВ. Для исследований использовали капиллярную колонку серии HP- FFAP 30 m ⋅ 0,250 mm ⋅0,250 длиной 30 метров, внутренним диаметром 0,25 мм и толщиной пленки неподвижной фазы 0,25 μm.
8. Также у указанного ребенка отбирают пробу буккального эпителия (в виде мазка со слизистой оболочки щеки), причем забор осуществляют сухими стерильными зондами с ватными тампонами вращательными движениями без травматизации после предварительного полоскания полости рта водой. После забора материала тампон (рабочую часть зонда с ватным тампоном) помещают в стерильную пробирку типа «Эппендорф» с 500 мкл транспортной среды (стерильный 0,9%-ный раствор NaCl). Конец зонда отламывают или отрезают, с расчетом, чтобы он позволил плотно закрыть крышку пробирки. Пробирку с раствором и рабочей частью зонда закрывают.
Далее производят выделение ДНК из пробы. Для этого пробы в количестве 100 мкл лизируют 300 мкл лизирующего раствора, представляющего собой 0,5%-ный раствор саркозила и протеиназы K (20 мг/мл) в ацетатном буфере (pH 7,5). Затем добавляют сорбент (каолин) и последовательными процедурами промывки отмывают фосфатно-солевым буфером (pH 7,2) пробы от белков и смесью изопропиловый спирт: ацетон от липидов. Нуклеиновые кислоты остаются при этом на сорбенте. Далее адсорбированные на сорбенте ДНК из пробы экстрагируют ТЕ-буфером, представляющим собой смесь 10 мМ трис-HCl и 1 мМ ЭДТА (pH 8,0). Экстракт подвергают центрифугированию. После центрифугирования пробирки надосадочная жидкость содержит очищенную ДНК.
Полученный материал готов к постановке полимеразной цепной реакции (ПЦР). Полимеразную цепную реакцию проводят на детектирующем амплификаторе с гибридизационно-флуоресцентной детекцией в режиме «реального времени» с использованием готовых наборов праймеров и зондов производства Applied Biosystems, в котором в качестве праймера использовался участок ДНК Arg72Pro гена ТР53.
Проводят реакцию амплификации, это достигается тем, что для исследования аллельного состояния каждого гена у отдельного человека готовят свою реакционную смесь. В пробирку вносят 0,1 мкл готовой смеси праймеров (принятый в генетике термин, обозначающий конечные нуклеотиды с меткой, ограничивающие (отрезающие) амплифицируемую цепочку нуклеотидов гена) и зондов для выбранного гена ТР53 (использован Набор реагентов для определения полиморфизма Arg72Pro гена ТР53 (rs 1042522) производства ЗАО «Синтол», Москва). В эту же пробирку добавляют остальные компоненты необходимые для осуществления ПЦР: нуклеотиды (дезоксинуклеозидтрифосфаты: по 10 мМ дАТФ, дТТФ, дГТФ, дЦГФ), буфера (100 мМ трис-HCl-буфера, 500 мМ KCl, 40 мМ MgCb) и Tag F-полимеразы. Вносят пробу в количестве 10 мкл. Таким образом, общий объем реакционной смеси составляет 25 мкл.
Пробирка плотно закрывается пробкой и устанавливается в амплификатор.
При проведении ПЦР амплификацию и детекцию проводят на детектирующем амплификаторе CFX96 фирмы Bio-Rad.
Используется универсальная программа амплификации, подобранная производителем реактивов. Она включает в себя несколько этапов: 1 этап - активация TaqF-полимеразы (режим «горячего старта») продолжается 15 мин при 95°C; 2 этап - установочные циклы амплификации без измерения флуоресценции (5 циклов); 3 этап - рабочие циклы амплификации с измерением флюоресценции (40 циклов).
Каждый цикл амплификации включает в себя денатурацию ДРЕК (5 с при 95°C), отжиг праймеров (20 с при 60°C) и саму реакцию полимеризации ДНК (15 с при 72°C).
Регистрация сигнала флюоресценции, возникающего при накоплении продуктов амплификации участков ДНК проводится в режиме «реального времени» после стадии отжига праймеров для выбранных генов по каналу VIC - для детекции одного из аллельных вариантов генов, и по каналу FAM - для альтернативного варианта.
Результаты интерпретируются на основании наличия (или отсутствия) пересечения кривой флюоресценции с установленной на заданном уровне пороговой линией, что соответствует наличию (или отсутствию) значения порогового цикла (N) в соответствующей графе в таблице результатов, отображаемой в программном обеспечении для амплификатора CFX96.
По соотношению пороговых циклов, полученных по двум каналам детекции, определяют состояние гена ТР53 в исследуемом участке ДНК Arg72Pro (rs1042522) (метод аллельной дискриминации). Возможных вариантов состояния гена было два: гомозиготное - в случае, когда одно из значений порогового цикла не определяется (ниже пороговой линии) и гетерозиготное - в случае, когда получено два значения пороговых циклов и по этим каналам получены параболические кривые флюоресценции. В зависимости от того, накопление какого продукта амплификации происходит в реакции, устанавливается гетерозиготное, или нормальное гомозиготное, или патологическое гомозиготное состояние гена ТР53.
9. И при одновременном выполнении следующих условий: наличие патологического гомозиготного или гетерозиготного генотипов Arg72Pro гена ТР53, снижение в крови содержания белка р53 в 1,5 и более раз, по отношению к нижней границе физиологической нормы для детей, и при наличии в крови нитрозодиметиламина оценивают процесс апоптоза у ребенка под влиянием нитрозаминов как замедленный, а при отсутствии хотя бы одного из вышеуказанных условий оценивают процесс апоптоза у ребенка под влиянием нитрозаминов как нормальный.
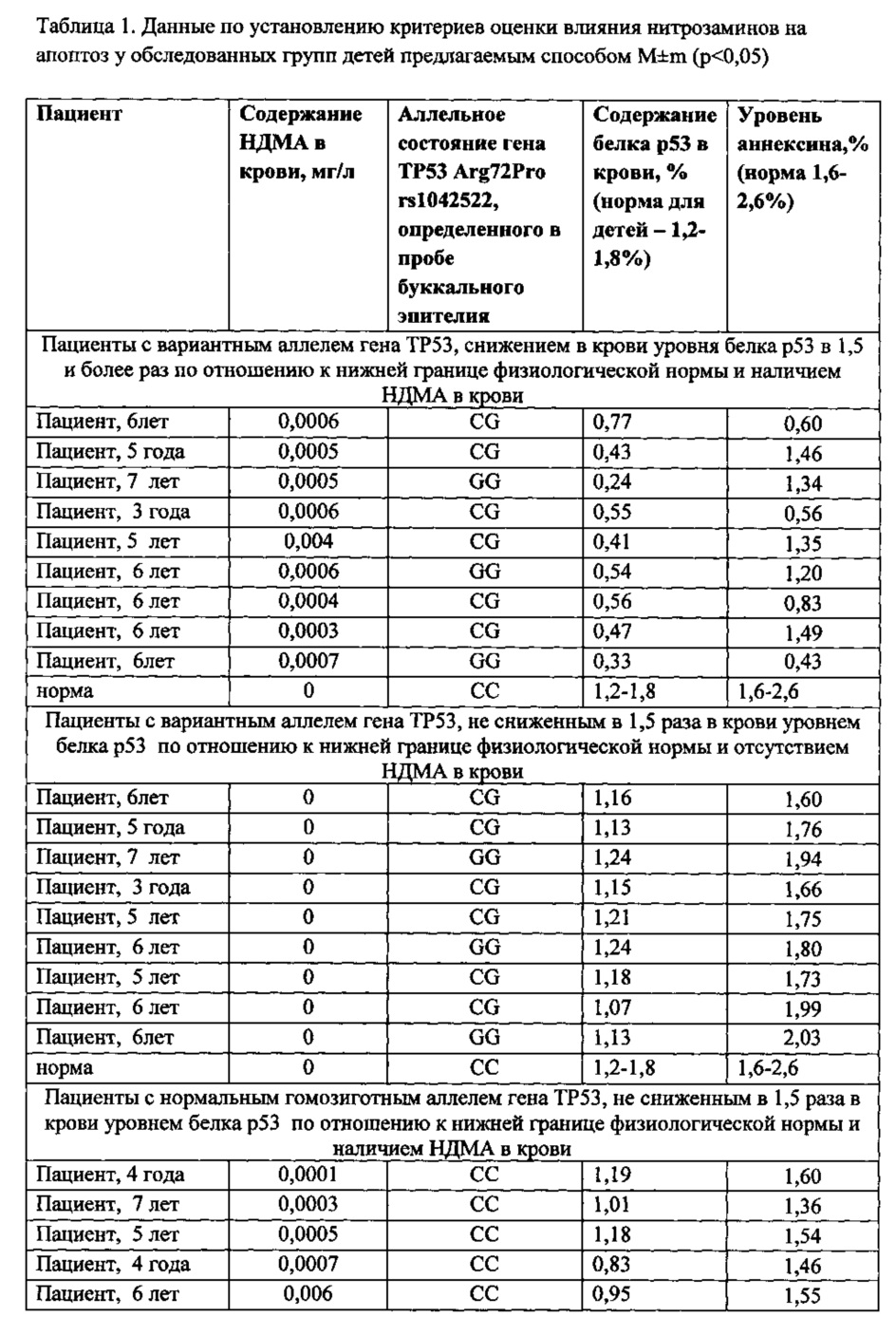
При проведении испытаний по реализации предлагаемого способа выполнено исследование детского населения, проживающего в различных по содержанию нитратов в питьевой воде (7-50 мг/л, при ПДК 45 мг/л) условиях среды обитания. Группу наблюдения составили 62 ребенка (возраст 3-7 лет) из п. Ляды Пермского края. Группа контроля - 44 ребенка из сельской местности. Группа наблюдения и контрольная группа были сопоставимы по полу, возрасту, соматической заболеваемости. При этом в п. Ляды концентрация нитратов в питьевой воде на порядок выше, чем на территории группы контроля: 50 мг/л и 7 мг/л соответственно.
Кроме того, для подтверждения точности и достоверности оценки влияния нитрозаминов на апоптоз предлагаемым способом, схема реализации которого приведена выше, у указанных детей был установлен уровень аннексина - маркера апоптоза. Этот маркер позволяет достоверно установить завершение клеткой процедуры апоптоза, проявляющийся в накоплении в мембране белка фосфатидилсерина, что фиксируется красителем аннексином.
Установление уровня аннексина проводили следующим образом. Мононуклеарные клетки из пробы крови ребенка собирают с интерфазной поверхности и ресуспендируют в рабочем растворе фосфатно-солевого буфера (PBS) до концентрации 1×106 клеток/мл. Содержание лимфоцитов в состоянии апоптоза определяют с помощью окрашивания клеток аннексином V-FITC (Annexin V-FITC) и 7-аминоактиномицином D (7-AAD), согласно протоколу фирмы-производителя (ВС, США). Тестирование осуществляется на проточном цитометре FACSCalibur (BD, США).
Полученные данные приведены в таблице 1.
Данные, приведенные в таблице 1, показывают, что при сочетании вариантного (это гетерозиготный или патологический гомозиготный генотип) аллеля гена ТР53 Arg72Pro (rs1042522) и наличия в крови виновного фактора НДМА, наблюдается снижение концентрации белка р53 в 1,5 и более раз по отношению к значениям, соответствующим нижней границе физиологической нормы у детей. Тогда как при отсутствии НДМА в крови, даже в условиях наследования вариантного генотипа гена ТР53 Arg72Pro, содержание белка р53 снижено менее, чем в 1,5 раза по сравнению с физиологической нормой.
Эти выводы подтверждаются показателем маркера апоптоза - аннексином. При совокупности трех указанных критериев (наличие патологического гомозиготного или гетерозиготного генотипов гена ТР53, снижение в крови уровня белка р53 в 1,5 и более раз по отношению к нижней границе физиологической нормы и при наличии НДМА в крови) уровень аннексина в организме пациента (пациенты 1-5) выходит за пределы нормы, а значит это указывает на снижение (замедление) процесса апоптоза или запрограммированной клеточной гибели и, таким образом подтверждает точность и достоверность предлагаемого способа. При других вариантах уровень аннексина в организме соответствует норме.
Таким образом, для выявления реализации генетической поломки нарушений физиологического процесса клеточной гибели, ассоциированного с экспозицией стронция в крови, рекомендуется использование методического подхода, основанного на определении содержания НДМА в крови, генотипа гена ТР53 Arg72Pro, и содержание внутриклеточного белка р53. И при наличии заявленных в предлагаемом способе критериев фиксируется реализация нирозаминами негативной генетической программы у ребенка.
Для иллюстрации реализации предлагаемого способа приведены два примера по конкретным пациентам одного возраста и этнической принадлежности:
- из группы пациентов с наличием НДМА в крови, наличием вариантного аллеля гена ТР53 Arg72Pro (rs1042522) и со сниженным в крови содержанием белка р53 в 1,56 раз, по отношению к нижней границе физиологической нормы;
- из группы пациентов с отсутствием НДМА в крови, наличием вариантного аллеля гена ТР53 Arg72Pro и с содержанием белка р53 ниже нижней границы физиологической нормы, но в пределах заявляемого коэффициента 1,5.
Пример 1. Пациент 6 лет, русский. Уровень НДМА в крови 0,0006 мг/дм3. Определяется наличие мутантного аллеля гена ТР53 Arg72Pro по гетерозиготному генотипу (CG). Содержание внутриклеточного белка р53: 0,77% - в 1,56 раза ниже нижней границы нормы. Содержание аннексии прокрашенных клеток, т.е. клеток ушедших в апоптоз - 0,60% - ниже диапазона нормы (1,6-2,6%). Таким образом, установлено, что при снижение содержания белка р53 более чем в 1,5 раза по отношению к нижней границе нормы (1,2-1,8%), на фоне наличия НДМА в крови, а также наличия гетерозиготного полиморфизма гена ТР53, происходит снижение числа клеток, ушедших в апоптоз за пределы нижней границы нормы (по аннексину) с коэффициентом более 1,5, таким образом, у данного пациента реализуется негативная генетическая программа угнетения апоптоза и усугубляется действием нитрозаминов.
Пример 2. Пациент 5 лет, русский. Определяется отсутствие НДМА в крови - 0,0 мг/дм3. Определяется наличие мутантного аллеля гена ТР53 Arg72Pro по гетерозиготному генотипу (CG). Значение содержания белка р53: 1,18%, т.е. в 1,01 раза ниже нижней границы нормы. Содержание аннексии прокрашенных клеток, т.е. клеток, ушедших в апоптоз 1,99%, т.е. - в диапазоне нормы (1,6-2,6%). Таким образом, при анализе содержания белка р53 установлено его снижение менее чем в 1,5 раза по отношению к нижней границе нормы (1,2-1,8%), на фоне отсутствия НДМА в крови, а также наличие гетерозиготного полиморфизма гена ТР53 без снижения количества клеток ушедших в апоптоз, что указывает на отсутствие у данного пациента реализации негативной генетической программы до фенотипического угнетения апоптоза, так как нет реализующего это угнетение воздействующего фактора - нитрозамина в крови (НДМА).
Таким образом, приведенные данные показывают, что при реализации предлагаемого способа с использованием предлагаемых критериев обеспечивается его назначение.