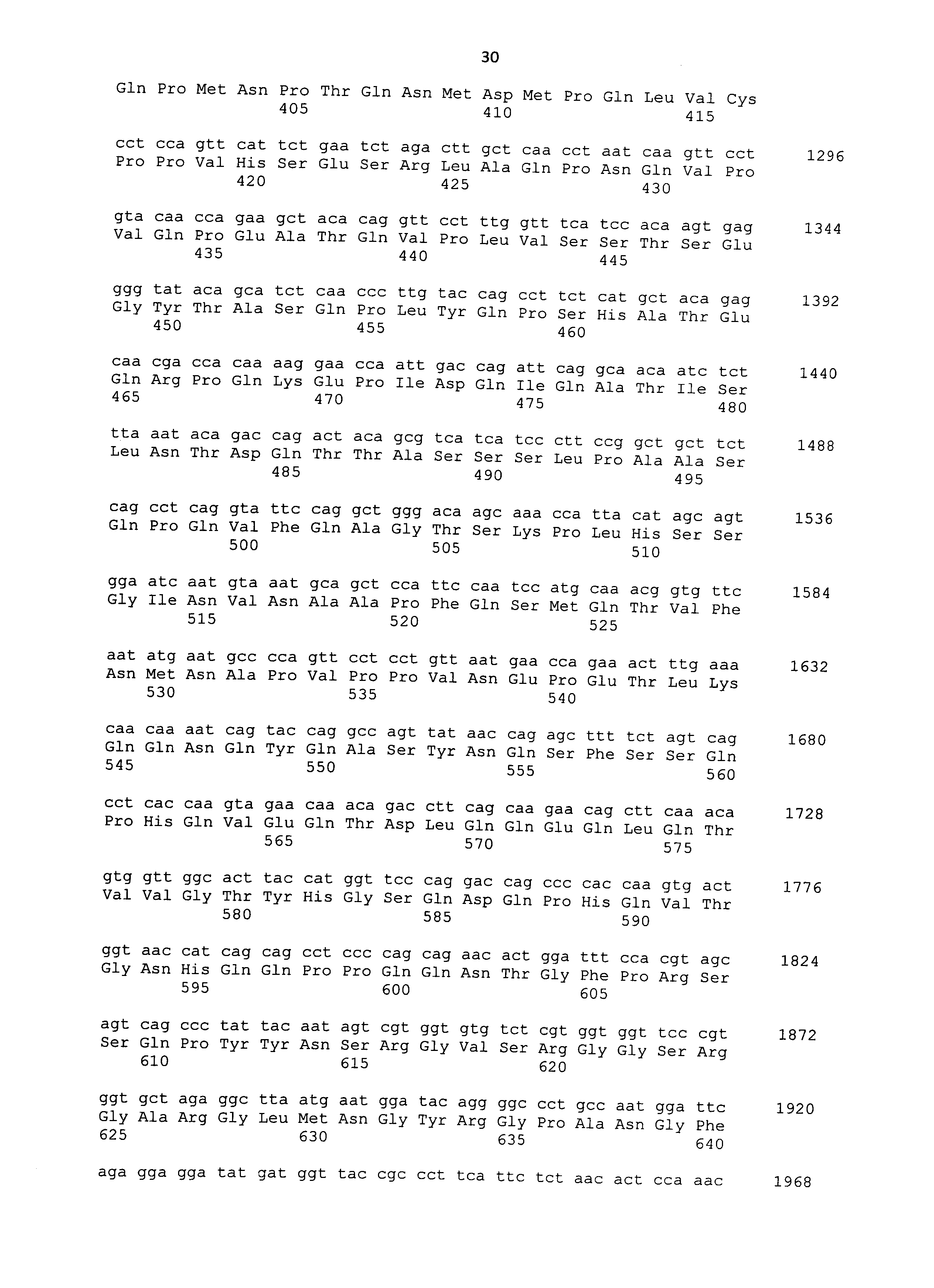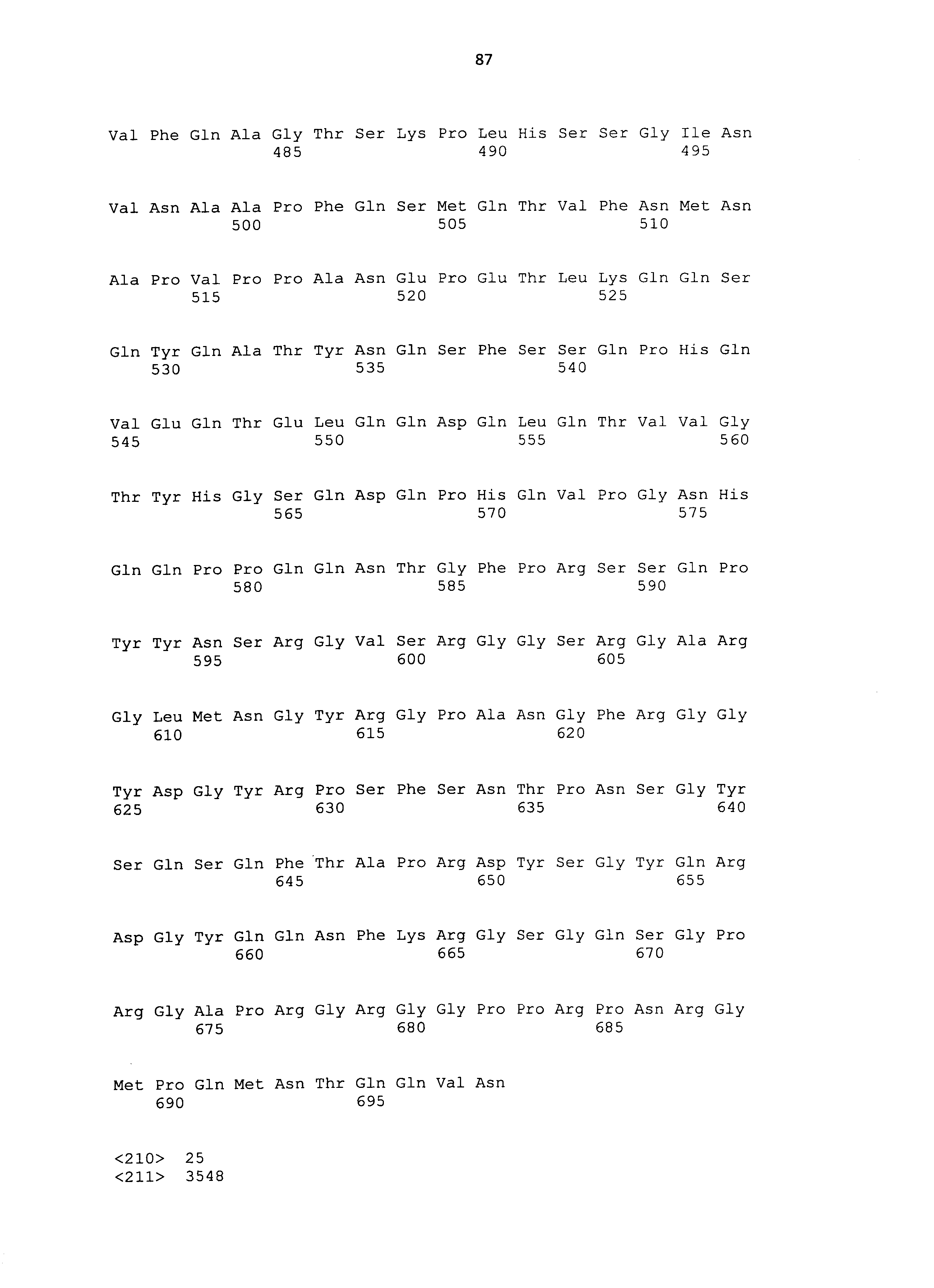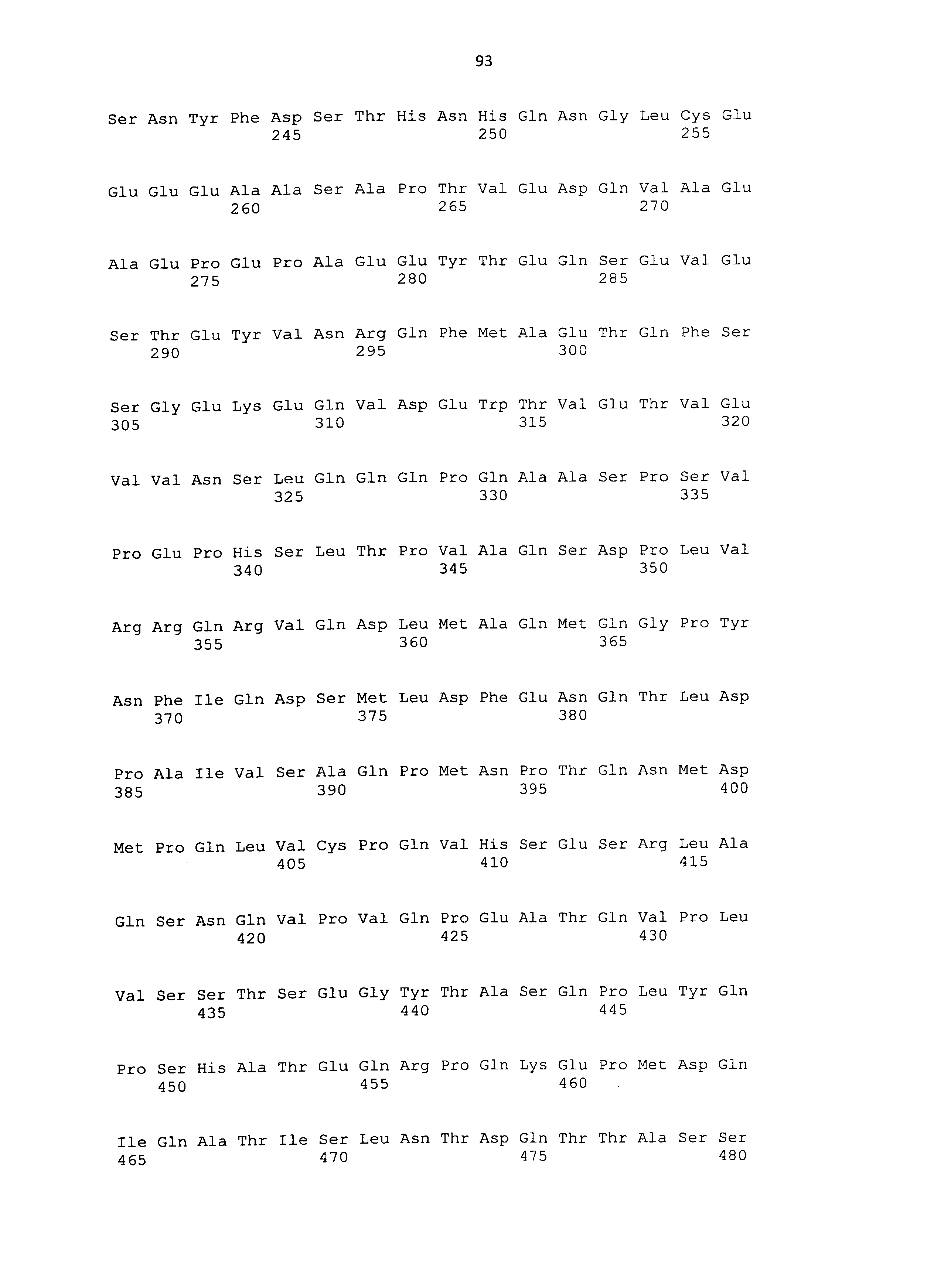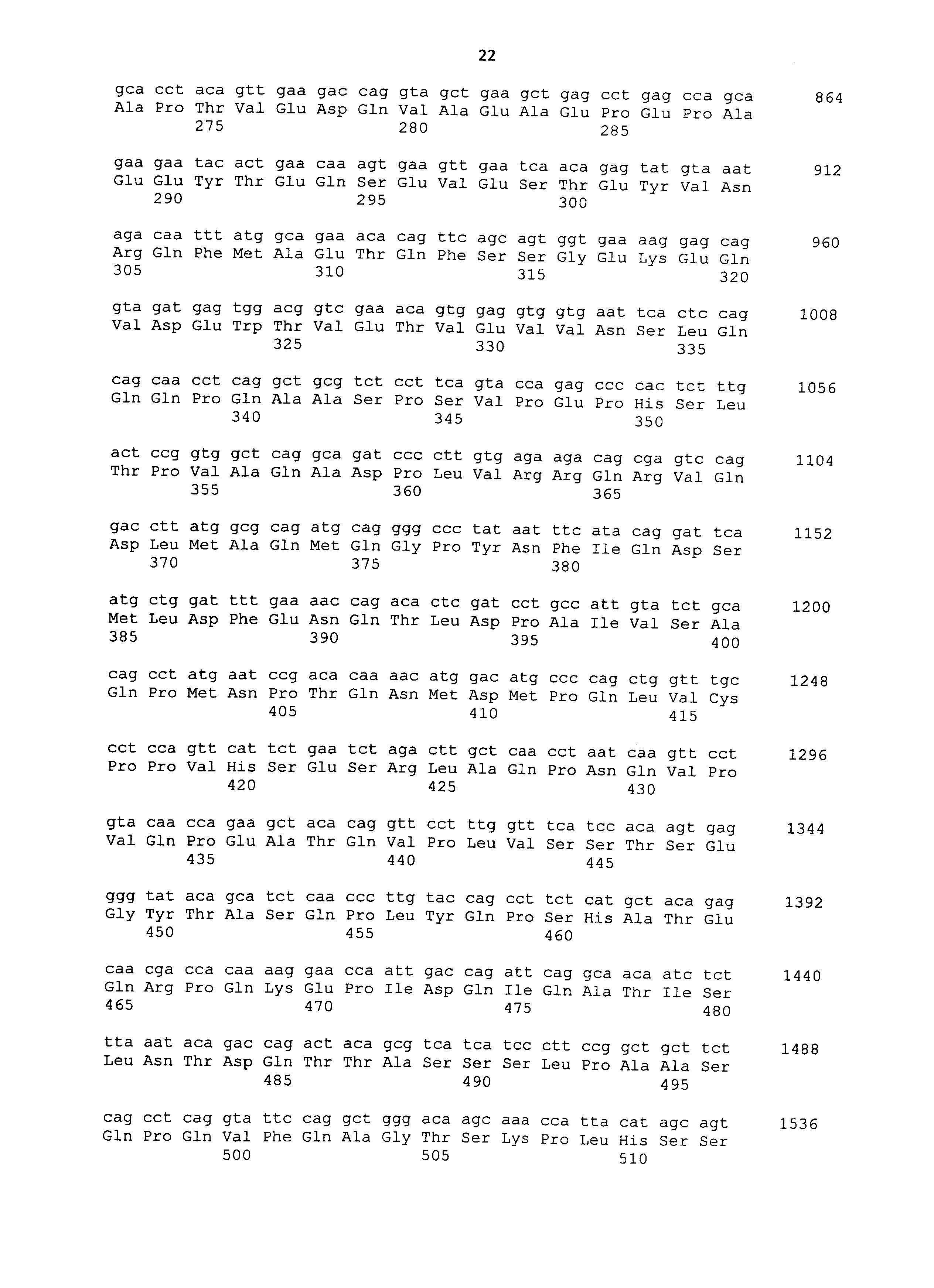Результат интеллектуальной деятельности: СПОСОБ ОБНАРУЖЕНИЯ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способу обнаружения рака поджелудочной железы с использованием CAPRIN-1 в качестве маркера опухоли.
УРОВЕНЬ ТЕХНИКИ
Сообщается, что в Японии более 10000 пациентов имеют рефрактерный рак поджелудочной железы, его встречаемость увеличивается каждый год и предполагается, что количество пациентов будет продолжать увеличиваться. Даже если рак поджелудочной железы хирургически удалить, небольшое количество клеток часто инфильтруют и метастазируют в другие органы. Таким образом, рак поджелудочной железы часто рецидивирует, и выживаемость в течение 5 лет составляет только 9%; то есть, прогноз рака поджелудочной железы является очень плохим. Для цели предупреждения послеоперационного рецидива используют гемцитабин, средство против злокачественной опухоли. Однако основной целью введения гемцитабина является смягчение боли, и уменьшения размера опухоли или пользы для выживания едва ли можно ожидать. В некоторых лечебных учреждениях используют другое средство против злокачественной опухоли, TS-1, которое в настоящее время используют против рака желудка, хотя трудно ожидать каких-либо терапевтических эффектов.
Для улучшения прогноза рака поджелудочной железы является важным раннее обнаружение, как и в случае других злокачественных опухолей; однако раннее обнаружение является трудным, поскольку рак поджелудочной железы по существу не проявляет первоначальных симптомов. На сегодняшний день, активно используют способы обнаружения рака поджелудочной железы с использованием карциноэмбрионального антигена (CEA) и гликопротеинов (CA19-9 и Dupan-2) в биологических образцах в качестве маркеров рака поджелудочной железы. Однако уровни таких маркеров опухоли не повышаются до тех пор, пока рак поджелудочной железы не достигнет развернутой стадии, и такие маркеры иногда демонстрируют нормальные величины на стадии прогрессирования. Таким образом, такие опухолевые маркеры считаются недостаточными для точного обнаружения рака поджелудочной железы. Кроме того, большинство опухолевых маркеров, которые в настоящее время известны, присутствуют в жидкостях организма в очень низких количествах (на уровне пг/мл). Таким образом, для выявления таких малых количеств маркеров необходимы способы обнаружения с высокой чувствительностью или специализированные способы. В этих обстоятельствах можно ожидать, что новый способ обнаружения рака поджелудочной железы простым образом с высокой чувствительностью будет применим для диагностики рака поджелудочной железы. Для выявления рака поджелудочной железы на ранней стадии необходимо проходить периодическое всестороннее обследование. Таким образом, является желательным способ обнаружения злокачественной опухоли, который можно осуществлять простым образом с использованием образцов сыворотки крови или мочи без наложения физической или финансовой нагрузки как на здоровых индивидуумов без рака поджелудочной железы, так и на пациентов со злокачественной опухолью.
Также, рак поджелудочной железы является рефрактерным у собак. Хотя в абдоминальной области собаки, страдающей раком поджелудочной железы, может обнаруживаться образование, основными симптомами является быстрая потеря энергии, неустойчивая походка и нарушения походки вследствие гипогликемии. В большинстве случаев развитие злокачественной опухоли не обнаруживают, пока не появляются симптомы. Кроме того, часто, когда обнаруживают такие симптомы, рак поджелудочной железы, возможно, уже находится на развернутой стадии. Таким образом, в дополнение к хирургическому удалению рака поджелудочной железы, терапевтические способы ограничиваются поддерживающей терапией и введением средств против злокачественной опухоли. Как и в случае пациентов-людей, ранее обнаружение является важным для собак, страдающих раком поджелудочной железы, для эффективного лечения такого рака поджелудочной железы. Как и в случае человека, в прошлом отсутствовали диагностические средства для собак, которые позволяют обнаружение рака поджелудочной железы на ранней стадии простым образом. В области ветеринарной медицины способы обнаружения, такие как радиографические способы с использованием рентгеновского излучения, CT или MRI еще не стали распространенными. В настоящее время обнаружение проводят пальпацией, простым исследованием крови и рентгенофотографией, и диагностика в высокой степени зависит от опыта ветеринаров. Если бы были предоставлены простые средства для обнаружения злокачественной опухоли с высокой чувствительностью, которые можно использовать для диагностики рака поджелудочной железы у собак, то можно было бы проводить адекватное лечение, которое обеспечивает значительные преимущества для владельцев собак и ветеринаров.
Цитоплазматический и ассоциированный с пролиферацией белок 1 (CAPRIN-1) представляет собой внутриклеточный белок, который экспрессируется при активации или клеточном делении нормальных клеток в фазе покоя. Также известно, что CAPRIN-1 вовлечен в контроль транспорта и трансляции мРНК через образование цитоплазматических стрессовых гранул и РНК в клетке. Также показано, что гены, кодирующие белки CAPRIN-1, экспрессируются в семенниках собаки и человека и злокачественных опухолевых клетках, анализ FCM клеток рака молочной железы с использованием антител против CAPRIN-1 демонстрирует экспрессию CAPRIN-1 на поверхности клеток рака молочной железы, и иммуногистохимическое окрашивание с использованием тканей рака молочной железы демонстрирует экспрессию CAPRIN-1 в клетках рака молочной железы на высоком уровне. Кроме того, было описано, что антитела, упомянутые выше, могут повреждать клетки рака молочной железы через функционирование лимфоцитов, и что антитела против CAPRIN-1 проявляют высокие противоопухолевые эффекты в моделях на мышах, имеющих злокачественную опухоль, которым трансплантировали клетки рака молочной железы (патентный документ 1). Также было описано, что злокачественные опухоли, такие как рак молочной железы, можно диагностировать путем измерения либо антител, индуцированных в организме индивидуума против CAPRIN-1, присутствующих в сыворотке крови, либо полипептидов, которые подвержены взаимодействиям антиген-антитело с CAPRIN-1 (патентный документ 2). Однако вплоть до настоящего времени отсутствовали сообщения о том, что рак поджелудочной железы можно диагностировать путем измерения либо антител против CAPRIN-1, индуцированных в сыворотке крови пациента с раком поджелудочной железы, либо полипептидов, которые подвержены взаимодействиям антиген-антитело с CAPRIN-1.
Документы уровня техники
Патентные документы
Патентный документ 1: международная публикация № WO 2010/016526
Патентный документ 2: международная публикация № WO 2010/016527
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ПРОБЛЕМА, РЕШАЕМАЯ ИЗОБРЕТЕНИЕМ
Задачей настоящего изобретения является предоставление средств для обнаружения рака поджелудочной железы, которые пригодны для диагностики рака поджелудочной железы.
СПОСОБЫ РЕШЕНИЯ ПРОБЛЕМЫ
Авторы настоящего изобретения провели тщательные исследования. В результате, авторы настоящего изобретения открыли, что рак поджелудочной железы можно диагностировать, исследовать или обнаруживать на основании экспрессии CAPRIN-1 в раке поджелудочной железы, определения (или анализа) антител против CAPRIN-1, индуцированных в сыворотке крови пациента с раком поджелудочной железы с использованием белка CAPRIN-1, и связывания антител, продуцированных с использованием таких белков, с CAPRIN-1 в ткани рака поджелудочной железы. Это привело к осуществлению настоящего изобретения.
В частности, настоящее изобретение относится к способу обнаружения рака поджелудочной железы, включающему измерение экспрессии CAPRIN-1 в образце, взятом от индивидуума. Термин "обнаружение", как используют в рамках изобретения, может быть использован взаимозаменяемо с терминами "исследование" или "оценка". Также, настоящее изобретение относится к реагенту или набору для обнаружения рака поджелудочной железы, содержащим полипептид, который подвержен взаимодействию антиген-антитело с антителом против CAPRIN-1, индуцированным или стимулированным в организме индивидуума. Кроме того, настоящее изобретение относится к реагенту или набору для обнаружения рака поджелудочной железы, содержащим антитело, которое подвержено взаимодействию антиген-антитело с CAPRIN-1, или антигенсвязывающий фрагмент антитела. Более того, настоящее изобретение относится к реагенту или набору для обнаружения рака поджелудочной железы, содержащим полинуклеотид, специфически гибридизующийся с частичной последовательностью, содержащей по меньшей мере 15-19 нуклеотидов или по меньшей мере 20-30 нуклеотидов нуклеотидной последовательности, соответствующей любой из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, …, 29. Выражение "реагент или набор для обнаружения рака поджелудочной железы", используемое в рамках изобретения, также может быть указано как "реагент или набор, обнаруживающие рак поджелудочной железы".
В частности, настоящее изобретение имеет признаки, описанные ниже.
(1) Способ обнаружения рака поджелудочной железы, включающий измерение наличия или количества полипептида, обладающего реактивностью в форме специфического связывания с антителом против белка CAPRIN-1 через взаимодействие антиген-антитело, или наличия или количества нуклеиновой кислоты, кодирующей этот полипептид, в образце, взятом от индивидуума.
(2) Способ согласно (1), где полипептид, подлежащий измерению, представляет собой белок CAPRIN-1, состоящий из аминокислотной последовательности, соответствующей любой из SEQ ID NO: 2-30 с четным номером, или полипептид, состоящий из аминокислотной последовательности, обладающей 85-90% или более идентичностью последовательности с белком CAPRIN-1.
(3) Способ согласно (1) или (2), где индивидуумом является человек или собака.
(4) Способ согласно (3), где индивидуумом является собака, и полипептид, подлежащий определению, содержит аминокислотную последовательность, соответствующую любой из SEQ ID NO: 2-30 с четным номером.
(5) Способ согласно (4), где индивидуумом является собака, и полипептид, подлежащий определению, содержит аминокислотную последовательность, соответствующую SEQ ID NO: 6, 8, 10, 12 или 14.
(6) Способ согласно (3), где индивидуумом является человек, и полипептид, подлежащий определению, содержит аминокислотную последовательность, соответствующую SEQ ID NO: 2 или 4.
(7) Способ согласно любому из (1)-(6), где наличие или количество полипептида определяют путем иммунологического определения антитела, индуцируемого против полипептида, подлежащего измерению, в организме индивидуума, которое может содержаться в образце.
(8) Способ согласно любому из (1)-(6), где наличие или количество нуклеиновой кислоты, кодирующей полипептид, определяют путем определения нуклеиновой кислоты, кодирующей такой полипептид, содержащейся в образце.
(9) Способ согласно (8), где наличие или количество нуклеиновой кислоты в образце измеряют с использованием полинуклеотида, специфически гибридизующегося с частичной последовательностью, содержащей по меньшей мере 15-19 нуклеотидов, предпочтительно по меньшей мере 20-25 нуклеотидов, и более предпочтительно по меньшей мере 30 нуклеотидов нуклеотидной последовательности в нуклеиновой кислоте или последовательности, комплементарной ей.
(10) Способ согласно (9), где индивидуумом является собака, и полинуклеотид специфически гибридизуется с частичной последовательностью, содержащей по меньшей мере 15-19 нуклеотидов, предпочтительно по меньшей мере 20-25 нуклеотидов, и более предпочтительно по меньшей мере 30 нуклеотидов в нуклеотидной последовательности, соответствующей SEQ ID NO: 5, 7, 9, 11 или 13, или последовательности, комплементарной ей.
(11) Способ согласно (9), где индивидуумом является человек, и полинуклеотид специфически гибридизуется с частичной последовательностью, содержащей по меньшей мере 15-19 нуклеотидов, предпочтительно по меньшей мере 20-25 нуклеотидов, и более предпочтительно по меньшей мере 30 нуклеотидов, в нуклеотидной последовательности, соответствующей SEQ ID NO: 1 или 3, или последовательности, комплементарной ей.
(12) Способ согласно любому из (1)-(6), где наличие или количество полипептида определяют путем определения полипептида, содержащегося в образце.
(13) Способ согласно (12), где анализ представляет собой иммунологический анализ.
(14) Способ согласно любому из (1)-(13), где образец представляет собой кровь, сыворотку, плазму крови, асцитную жидкость, плевральный выпот, ткани или клетки.
(15) Реагент или набор для обнаружения рака поджелудочной железы, содержащие один или несколько полипептидов, обладающих реактивностью в форме связывания через взаимодействие антиген-антитело с антителом, индуцированным против белка CAPRIN-1, в организме индивидуума.
(16) Реагент или набор для обнаружения рака поджелудочной железы, содержащие одно или несколько антител, которые подвержены взаимодействию антиген-антитело с полипептидом, обладающим реактивностью в форме связывания через взаимодействие антиген-антитело с антителом против белка CAPRIN-1 или с антигенсвязывающим фрагментом антитела, и продуцируемым в организме индивидуума.
(17) Реагент или набор согласно (15) или (16), где белок CAPRIN-1 обладает аминокислотной последовательностью, соответствующей любой из SEQ ID NO: 2-30 с четным номером.
(18) Реагент или набор согласно (16) или (17), где антитело или его антигенсвязывающий фрагмент, которые подвержены взаимодействию антиген-антитело с полипептидом, представляют собой антитело или его антигенсвязывающий фрагмент, которые связываются с поверхностью клетки рака поджелудочной железы.
(19) Реагент или набор согласно любому из (16)-(18), где антитело или его антигенсвязывающий фрагмент, которые подвержены взаимодействию антиген-антитело с полипептидом, включают антитело или его фрагмент, обладающие иммунологической реактивностью в отношении полипептида, состоящего из аминокислотной последовательности, содержащей по меньшей мере 7-12 последовательно расположенных аминокислотных остатков в области аминокислотных остатков № 50-98 или аминокислотных остатков № 233-344 аминокислотной последовательности, соответствующей любой из SEQ ID NO: 2-30 с четным номером, за исключением SEQ ID NO: 6 и 18, или в отношении полипептида, включающего этот полипептид в качестве частичной последовательности.
(20) Реагент или набор согласно любому из (16)-(19), где антитело или антигенсвязывающий фрагмент, которые подвержены взаимодействию антиген-антитело с полипептидом, представляют собой одно или несколько антител, выбранных из группы, состоящей из: антитела, связывающегося с полипептидом, содержащим аминокислотную последовательность, соответствующую SEQ ID NO: 43, или его антигенсвязывающего фрагмента; моноклонального антитела, содержащего аминокислотные последовательности, соответствующие SEQ ID NO: 44 и 45, или его антигенсвязывающего фрагмента; моноклонального антитела, содержащего аминокислотные последовательности, соответствующие SEQ ID NO: 44 и 46, или его антигенсвязывающего фрагмента; моноклонального антитела, содержащего аминокислотные последовательности, соответствующие SEQ ID NO: 44 и 47, или его антигенсвязывающего фрагмента; моноклонального антитела, содержащего аминокислотные последовательности, соответствующие SEQ ID NO: 44 и 48, или его антигенсвязывающего фрагмента; моноклонального антитела, содержащего аминокислотные последовательности, соответствующие SEQ ID NO: 49 и 50, или его антигенсвязывающего фрагмента; моноклонального антитела, содержащего аминокислотные последовательности, соответствующие SEQ ID NO: 51 и 52, или его антигенсвязывающего фрагмента; моноклонального антитела, содержащего аминокислотные последовательности, соответствующие SEQ ID NO: 53 и 54, или его антигенсвязывающего фрагмента; моноклонального антитела, содержащего аминокислотные последовательности, соответствующие SEQ ID NO: 55 и 56, или его антигенсвязывающего фрагмента; моноклонального антитела, содержащего аминокислотные последовательности, соответствующие SEQ ID NO: 57 и 58, или его антигенсвязывающего фрагмента; и моноклонального антитела, содержащего аминокислотные последовательности, соответствующие SEQ ID NO: 59 и 60, или его антигенсвязывающего фрагмента.
(21) Реагент или набор для обнаружения рака поджелудочной железы, содержащие один или несколько полинуклеотидов, которые специфически гибридизуются с частичной последовательностью, содержащей по меньшей мере 15-19 нуклеотидов, предпочтительно по меньшей мере 20-25 нуклеотидов, и более предпочтительно по меньшей мере 30 нуклеотидов, в нуклеотидной последовательности, соответствующей любой из SEQ ID NO: 1-29 с нечетным номером и кодирующей белок CAPRIN-1, или в последовательности, комплементарной этой нуклеотидной последовательности.
(22) Способ обнаружения рака поджелудочной железы, включающий определение наличия или количества белка CAPRIN-1, антитела против белка CAPRIN-1 или нуклеиновой кислоты, кодирующей белок CAPRIN-1, в образце от индивидуума с использованием по меньшей мере одного реагента или набора согласно любому из (15)-(21).
(23) Способ обнаружения рака поджелудочной железы согласно любому из (1)-(14), включающий определение наличия или количества белка CAPRIN-1, антитела против белка CAPRIN-1 или нуклеиновой кислоты, кодирующей белок CAPRIN-1, в образце от индивидуума с использованием по меньшей мере одного реагента или набора согласно любому из (15)-(21).
В соответствии с настоящим изобретением, предусмотрен новый способ обнаружения рака поджелудочной железы. Как конкретно описано в примерах ниже, рекомбинантный полипептид, полученный на основе аминокислотной последовательности CAPRIN-1 (или Caprin-1), способен специфически взаимодействовать с антителом, которое существует в сыворотке пациента с раком поджелудочной железы. Соответственно, рак поджелудочной железы, имеющийся у индивидуума, можно обнаруживать путем определения антитела в образце способом по настоящему изобретению. Также рак поджелудочной железы, имеющийся у индивидуума, можно обнаруживать путем определения (или анализа) самого CAPRIN-1. Как описано в примерах ниже, кроме того, высокие уровни экспрессии гена CAPRIN-1 наблюдаются специфически в семенниках и клетках рака поджелудочной железы индивидуумов (далее, такой продукт экспрессии иногда называют "нуклеиновой кислотой, кодирующей (белок) CAPRIN-1"). Таким образом, рак поджелудочной железы также можно обнаруживать путем определения нуклеиновой кислоты. Кроме того, наличие или количество (экспрессии) CAPRIN-1 в ткани рака поджелудочной железы можно измерять с использованием антитела против CAPRIN-1. Такое определение можно проводить у пациентов с раком поджелудочной железы заранее, так чтобы можно было выбирать пациентов, для которых применимо нацеленное на CAPRIN-1 лекарственное средство (например, антительное лекарственное средство).
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В соответствие со способом по настоящему изобретению, наличие или количество (экспрессии) CAPRIN-1 определяют с использованием образца, взятого от индивидуума. Примеры способов определения наличия или количества (экспрессии) CAPRIN-1 включают: способ иммунологического определения антитела против CAPRIN-1, содержащегося в образце (первый способ); способ иммунологического определения самого CAPRIN-1, содержащегося в образце (второй способ); и способ определения содержащейся в образце нуклеиновой кислоты, кодирующей CAPRIN-1, такой как мРНК или кДНК, синтезированная с мРНК (третий способ). В рамках настоящего изобретения наличие или количество (экспрессии) CAPRIN-1 можно определять любым из указанных выше способов. В рамках настоящего изобретения термин "определение" включает любое из следующих значений: обнаружение, качественное определение, количественное определение и полуколичественное определение.
Аминокислотная последовательность, соответствующая SEQ ID NO: 6, 8, 10, 12 или 14, представляет собой аминокислотную последовательность CAPRIN-1 собаки. CAPRIN-1 собаки, имеющий такую аминокислотную последовательность, был идентифицирован как полипептид, связывающийся с антителом, специфически присутствующим в сыворотке, полученной от собаки со злокачественной опухолью (см. пример 1). Антитело против CAPRIN-1, обладающего аминокислотной последовательностью, соответствующей SEQ ID NO: 6, 8, 10, 12 или 14, специфически индуцируется или стимулируется в организме собаки, имеющей злокачественную опухоль. В частности, рак поджелудочной железы собаки можно обнаруживать путем определения указанного выше антитела против CAPRIN-1, имеющего аминокислотную последовательность, соответствующую SEQ ID NO: 6, 8, 10, 12 или 14, первым способом. Также рак поджелудочной железы собаки можно обнаруживать путем определения самого CAPRIN-1 в качестве антигена, имеющего аминокислотную последовательность, соответствующую SEQ ID NO: 6, 8, 10, 12 или 14, вторым способом. Поскольку ген CAPRIN-1 экспрессируется на довольно высоких уровнях в клетках рака рак поджелудочной железы, рак поджелудочной железы собаки можно обнаруживать путем определения нуклеиновой кислоты в соответствии с третьим способом.
Термин "имеющий аминокислотную последовательность", используемый в настоящем описании, относится к аминокислотным остаткам, расположенным в данном порядке. Таким образом, например, выражение "полипептид, имеющий аминокислотную последовательность, соответствующую SEQ ID NO: 2," относится к полипептиду, имеющему 709 аминокислотных остатков, который состоит из аминокислотной последовательности Met Pro Ser Ala … (частично пропущено) … Gln Gln Val Asn, соответствующей SEQ ID NO: 2. Также, выражение "полипептид, имеющий аминокислотную последовательность, соответствующую SEQ ID NO: 2", может сокращенно указываться, например, как "полипептид SEQ ID NO: 2". Вышеуказанное применимо к выражению "имеющий/нуклеотидную последовательность". В этом случае, термин "имеющий" может быть заменен выражением "содержащий" или "состоящий из".
Также, термин "полипептид", используемый в настоящем описании, относится к молекуле, которая образуется из множества аминокислот посредством пептидной связи. Примеры такой молекулы включают не только полипептидные молекулы с большими количествами составляющих аминокислот, но также низкомолекулярные молекулы (олигопептиды) с небольшими количествами аминокислот и полноразмерные белки. Кроме того, настоящее изобретение охватывает полноразмерные белки CAPRIN-1, каждый из которых имеет аминокислотную последовательность, соответствующую любой из SEQ ID NO: 2-30 с четным номером (т.е. SEQ ID NO: 2, 4, 6,⋅⋅⋅26, 28 и 30).
Термин "индивидуум", используемый в настоящем описании, относится к позвоночным, в том числе млекопитающим и птицам, предпочтительно млекопитающим, и более предпочтительно людям, собакам, коровам и лошадям.
Термин "образец", используемый в настоящем описании, относится к биологическому образцу, подвергаемому исследованию, нацеленному на обнаружение рака поджелудочной железы. Примеры образца включают жидкости организма, ткани и клетки, взятые от индивидуума. Примеры жидкостей организма включают, но не ограничиваются ими, кровь, сыворотку, плазму крови, асцитную жидкость и плевральный выпот. В объем термина "образец" входят ткани или клетки поджелудочной железы, предположительно пораженной злокачественной опухолью.
В способе по настоящему изобретению, мишенями, подлежащими измерению, являются не только CAPRIN-1 собаки SEQ ID NO: 6, 8, 10, 12 или 14, но также CAPRIN-1 других млекопитающих (который далее может быть указан как "гомолог" (или "ортолог") для CAPRIN-1 собаки). Когда он просто указан как "CAPRIN-1", также мишенью для определения является CAPRIN-1 другого млекопитающего, в том числе человека, в дополнение к CAPRIN-1 собаки. Как конкретно описано в примерах ниже, уровень экспрессии гена CAPRIN-1 человека является довольно высоким в клетках рака поджелудочной железы человека, в то время как в здоровом организме человека не обнаруживается антитело против гена CAPRIN-1 человека. Соответственно, рак поджелудочной железы млекопитающего, отличного от собаки, можно обнаруживать путем определения экспрессии CAPRIN-1 у млекопитающего. Примером CAPRIN-1 млекопитающего, отличного от собаки, который можно определять способом по настоящему изобретению, является, но не ограничивается этим, CAPRIN-1 человека. Нуклеотидные последовательности, кодирующие CAPRIN-1 человека, и их аминокислотные последовательности соответствуют SEQ ID NO: 1 и 3 и SEQ ID NO: 2 и 4 в списке последовательностей. Идентичность последовательностей между CAPRIN-1 человека и CAPRIN-1 собаки составляет 94% для нуклеотидной последовательности и 98% для аминокислотной последовательности. Идентичность последовательностей между генетически отдаленными млекопитающими, такими как собака и человек, для аминокислотных последовательностей CAPRIN-1 составляет вплоть до 98%. Таким образом, считается, что между собакой и млекопитающим, отличным от человека; т.е. CAPRIN-1 собаки и его гомологом, идентичность последовательности составляет приблизительно 85% или более. CAPRIN-1, экспрессия которого подлежит определению способом по настоящему изобретению, предпочтительно имеет 85% или более, более предпочтительно 90% или более, и еще предпочтительно 95% или более идентичность последовательности с аминокислотной последовательностью CAPRIN-1, соответствующей SEQ ID NO: 6, 8, 10, 12 или 14, хотя идентичность последовательностей не ограничивается этим.
В первом способе антитело, которое может присутствовать в образце, можно без труда определять с помощью иммуноанализа с использованием антигенного вещества, которое подвержено взаимодействию антиген-антитело с антителом. Сам по себе иммуноанализ является хорошо известным общепринятым способом, как конкретно описано ниже. В качестве антигенного вещества для иммуноанализа можно использовать, например, белок CAPRIN-1 собаки SEQ ID NO: 6, 8, 10, 12 или 14, который индуцирует антитело в организме собаки, имеющей злокачественную опухоль, или фрагмент, содержащий эпитоп такого белка. Кроме того, антитело обладает перекрестной реактивностью. Также с антителом, индуцированным против иммуногена, может связываться через взаимодействие антиген-антитело молекула, отличная от антигенного вещества, которое в действительности служит в качестве иммуногена, при условии, что молекула обладает структурой, аналогичной эпитопу иммуногена. В частности, между белком из определенного типа млекопитающего и его гомологом из другого животного идентичность их аминокислотных последовательностей является высокой, и эпитопные структуры часто аналогичны друг другу. Как конкретно описано в примерах ниже, CAPRIN-1 собаки с SEQ ID NO: 6, 8, 10, 12 или 14 подвержен взаимодействию антиген-антитело с антителом, индуцированным против CAPRIN-1 собаки в организме собаки, имеющей злокачественную опухоль. Также CAPRIN-1 человека подвержен взаимодействию антиген-антитело с антителом, индуцированным в организме собаки, имеющей злокачественную опухоль. Таким образом, в соответствии с первым способом по настоящему изобретению CAPRIN-1 из любого млекопитающего можно использовать в качестве антигена для иммуноанализа.
Когда антигенное вещество представляет собой белок и т.п., имеющий сложную структуру и являющийся высокомолекулярным, как правило, на молекуле присутствует множество участков, имеющих различные структуры. Таким образом, в организме индивидуума продуцируется множество типов антител, способных распознавать и связывать различные участки таких антигенных веществ. В частности, антитело, которое продуцируется у индивидуума против антигенного вещества, такого как белок, представляет собой поликлональное антитело, которое представляет собой смесь множества типов антител. Антитело, обнаруженное авторами настоящего изобретения, также представляет собой поликлональное антитело, которое специфически присутствует в сыворотке, полученной от индивидуума, имеющего злокачественную опухоль, и специфически связывается, через взаимодействие антиген-антитело, с рекомбинантным белком CAPRIN-1. Термин "поликлональное антитело", используемый в рамках настоящего изобретения, относится к антителу, которое существует в сыворотке, полученной от индивидуума, содержащей антигенное вещество, и индуцировано против такого антигенного вещества.
В примерах ниже, полипептиды SEQ ID NO: 6 и SEQ ID NO: 8 (оба CAPRIN-1 собаки) и полипептид SEQ ID NO: 2 (CAPRIN-1 человека) были получены в качестве антигенов для иммуноанализа специфических антител у живых животных, имеющих злокачественную опухоль. Затем была подтверждена реактивность между этими полипептидами и антителами в сыворотке, полученными от индивидуума, имеющего злокачественную опухоль. Однако антитела, упомянутые выше, представляют собой поликлональные антитела, и они по своей природе связываются с полипептидами, состоящими из гомологов SEQ ID NO: 6, 8 и 2. Даже в случае фрагмента такого полипептида, он может связываться с антителом, содержащимся в сыворотке, полученной от индивидуума, имеющего злокачественную опухоль, поскольку некоторые поликлональные антитела способны распознавать структуру фрагмента. Иными словами, как полипептид (т.е. полноразмерный белок CAPRIN-1) гомолога SEQ ID NO: 6, 8 или 2, так и его фрагмент можно аналогичным образом использовать для анализа поликлонального антитела, специфически содержащегося в сыворотке индивидуума, имеющего злокачественную опухоль, и они пригодны для обнаружения злокачественной опухоли. Таким образом, полипептид, используемый в качестве антигена для иммуноанализа в первом способе по настоящему изобретению, не ограничивается только полипептидом, состоящим из полноразмерной области белка CAPRIN-1 (например, SEQ ID NO: 6, 8 или 2). Он может представлять собой фрагмент полипептида, состоящий из по меньшей мере 7-12, и предпочтительно по меньшей мере 8, 9 или 10, последовательно расположенных аминокислот аминокислотной последовательности белка CAPRIN-1, который подвержен взаимодействию антиген-антитело с поликлональным антителом против белка CAPRIN-1 (далее он для удобства может быть указан как "специфически реактивный частичный полипептид"). В данной области известно, что полипептид, содержащий приблизительно 7-12 или более аминокислотных остатков, может проявлять антигенность. Однако если количество аминокислотных остатков является слишком низким, такой полипептид с высокой вероятностью будет перекрестно реагировать с антителом против белка, отличного от белка CAPRIN-1, который присутствует в образце. С точки зрения повышения точности иммуноанализа, таким образом, количество аминокислотных остатков в полипептидном фрагменте предпочтительно составляет 20 или более, 30 или более, и 50 или более, более предпочтительно 100 или более или 150 или более, еще более предпочтительно 300 или более, и еще более предпочтительно 600 или более. Количество аминокислотных остатков может составлять 1000 или более, или 1500 или более.
Предпочтительные примеры полипептидов, используемых в качестве антигенов, включают полипептиды SEQ ID NO: 2-30 с четным номером или их фрагменты, содержащие эпитопы (например, полипептидный фрагмент, содержащий приблизительно 7-12 или более аминокислотных остатков).
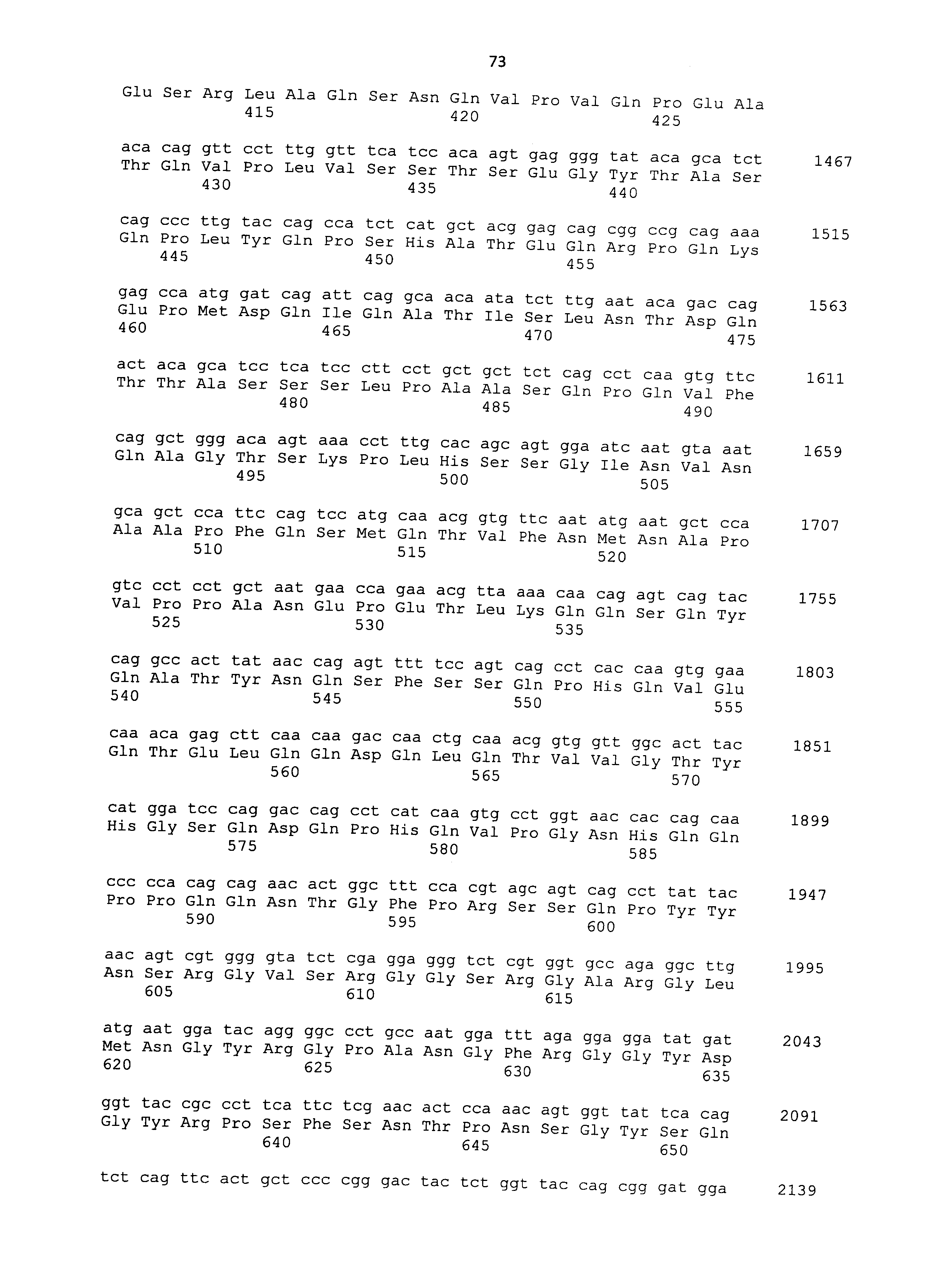
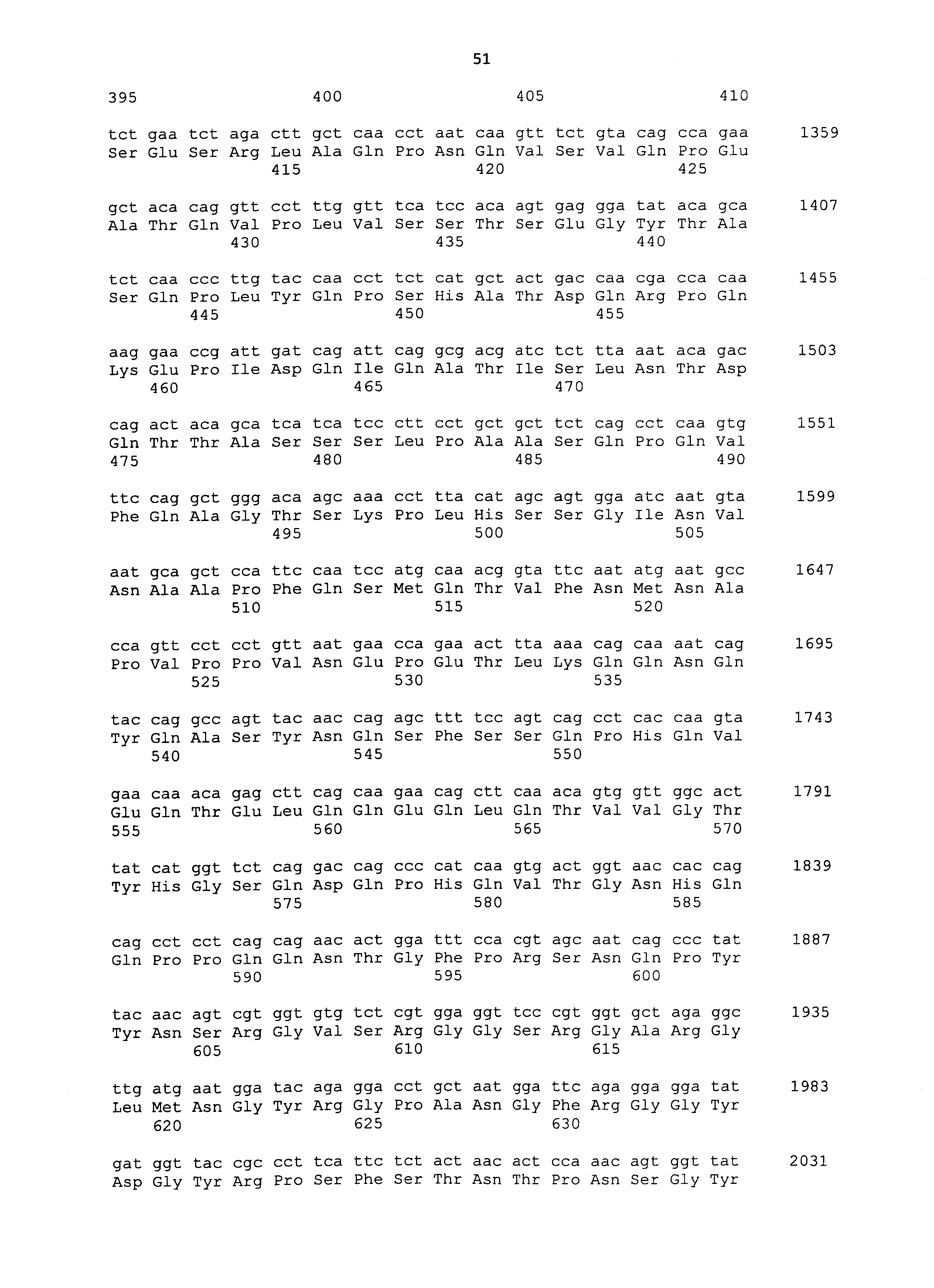
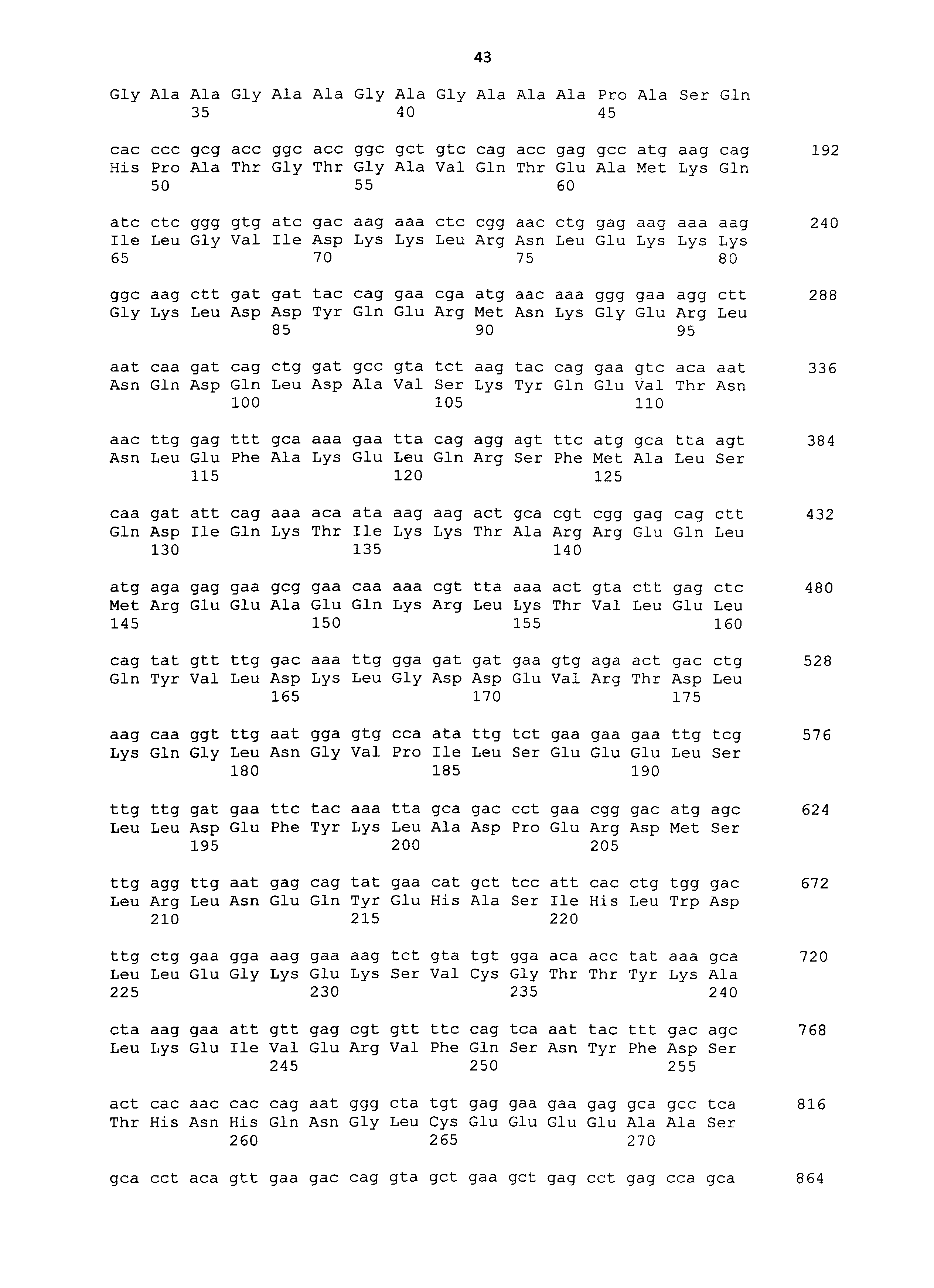
Нуклеотидные последовательности полинуклеотидов, кодирующих белки, состоящие из аминокислотных последовательностей SEQ ID NO: 2-30 с четным номером (т.е. SEQ ID NO: 2, 4, 6... 28 и 30) соответствуют SEQ ID NO: 1-29 с нечетным номером (т.е. SEQ ID NO: 1, 3, 5...27 и 29).
Как правило, в данной области хорошо известно, что белковые антигены сохраняют антигенность, практически эквивалентную антигенности исходного белка, если в аминокислотной последовательности белка небольшое количество аминокислотных остатков заменены, удалены, добавлены и вставлены. Таким образом, для обнаружения злокачественной опухоли можно использовать полипептид, обладающей последовательностью, образованной из аминокислотной последовательности белка CAPRIN-1 путем замены, делеции и/или инсерции небольшого количества (предпочтительно одного или нескольких) аминокислотных остатков, имеющей 80% или более, 85-90% или более, предпочтительно 90% или более, более предпочтительно 95% или более, еще более предпочтительно 98% или более, и еще более предпочтительно 99% или более идентичность последовательности с исходной последовательностью, и, в частности, связывающийся через взаимодействие антиген-антитело с антителом против CAPRIN-1 (далее он для удобства может указываться как "специфически реактивный модифицированный полипептид") аналогично тому, как в случае полипептидов, описанных выше. Предпочтительно, специфически реактивный модифицированный полипептид обладает аминокислотной последовательностью, образованной из аминокислотной последовательности белка CAPRIN-1 путем замены, делеции и/или инсерции одного или нескольких аминокислотных остатков. Термин "несколько", используемый в настоящем описании, относится к целому числу от 2 до 10, предпочтительно к целому числу от 2 до 6, и еще более предпочтительно к целому числу от 2 до 4.
Термин "идентичность последовательности", используемый в настоящем описании применительно к аминокислотным последовательностям, определяется выравниванием двух аминокислотных последовательностей, подвергаемых сравнению, так чтобы совпадало максимально возможное количество аминокислотных остатков, делением количества аминокислотных остатков, которые совпали, на общее количество аминокислотных остатков, а затем выражением результатов в значениях процентов (%). При описанном выше выравнивании при необходимости встраивают пропуски в одну или обе из последовательностей, подвергаемых сравнению. Такое выравнивание последовательностей можно проводить с использованием хорошо известной программы или алгоритма, таких как BLAST, FASTA, или CLUSTAL W (Karlin and Altschul, Proc. Natl. Acad. Sci. U.S.A., 87: 2264-2268, 1993; Altschul et al., Nucleic Acids Res., 25: 3389-3402, 1997).
Двадцать типов аминокислот, составляющих встречающиеся в природе белки, можно подразделить на группы аминокислот, имеющих свойства, аналогичные друг другу: нейтральные аминокислоты, имеющие боковые цепи с низкой полярностью (Gly, Ile, Val, Leu, Ala, Met и Pro); нейтральные аминокислоты, имеющие высокогидрофильные боковые цепи (Asn, Gln, Thr, Ser, Tyr и Cys); кислые аминокислоты (Asp и Glu); основные аминокислоты (Arg, Lys и His); и ароматические аминокислоты (Phe, Tyr, Trp и His). Известно, что замена среди этих аминокислот (т.е. консервативная замена) редко изменяет свойства полученного полипептида. Таким образом, когда осуществляют замену аминокислотных остатков CAPRIN-1, замену проводят среди представителей одной и той же группы, так чтобы вероятность сохранения связывания с соответствующим антителом была более высокой. Однако в рамках настоящего изобретения описанный выше вариант может вовлекать неконсервативную замену при условии, что обеспечивается активность индукции иммунитета, эквивалентная или практически эквивалентная активности индукции иммунитета у немодифицированного полипептида.
Также для обнаружения рака поджелудочной железы можно использовать полипептид (который далее для удобства может указываться как "специфически реактивный полипептид с вставкой"), который содержит, в качестве частичной последовательности, указанный полипептид, используемый в рамках настоящего изобретения (например, полученный присоединением другого (поли)пептида к одному или обоим концам полипептида, используемого в рамках настоящего изобретения) и специфически связывается через взаимодействие антиген-антитело с антителом против CAPRIN-1, аналогично случаям описанных выше полипептидов.
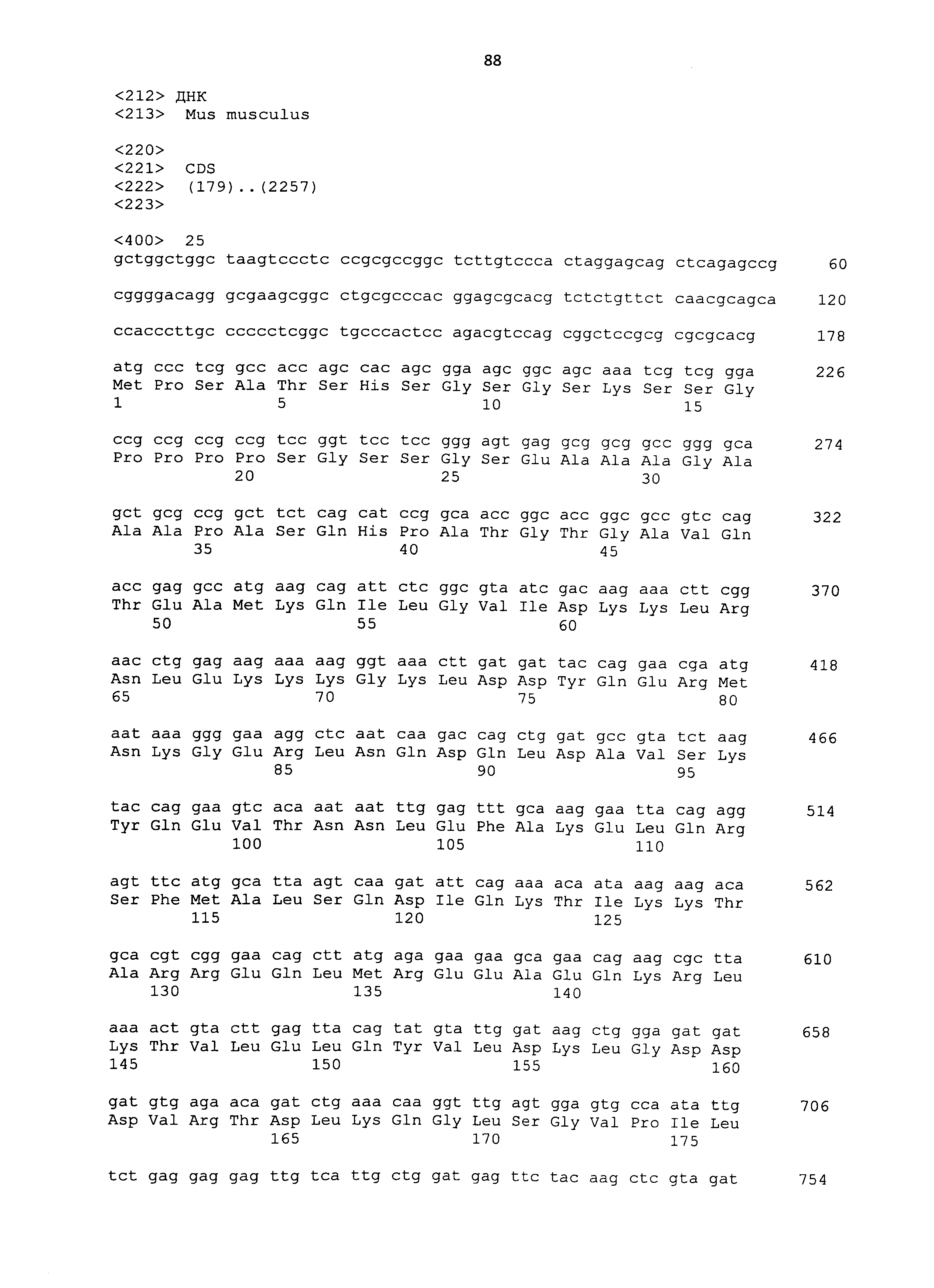
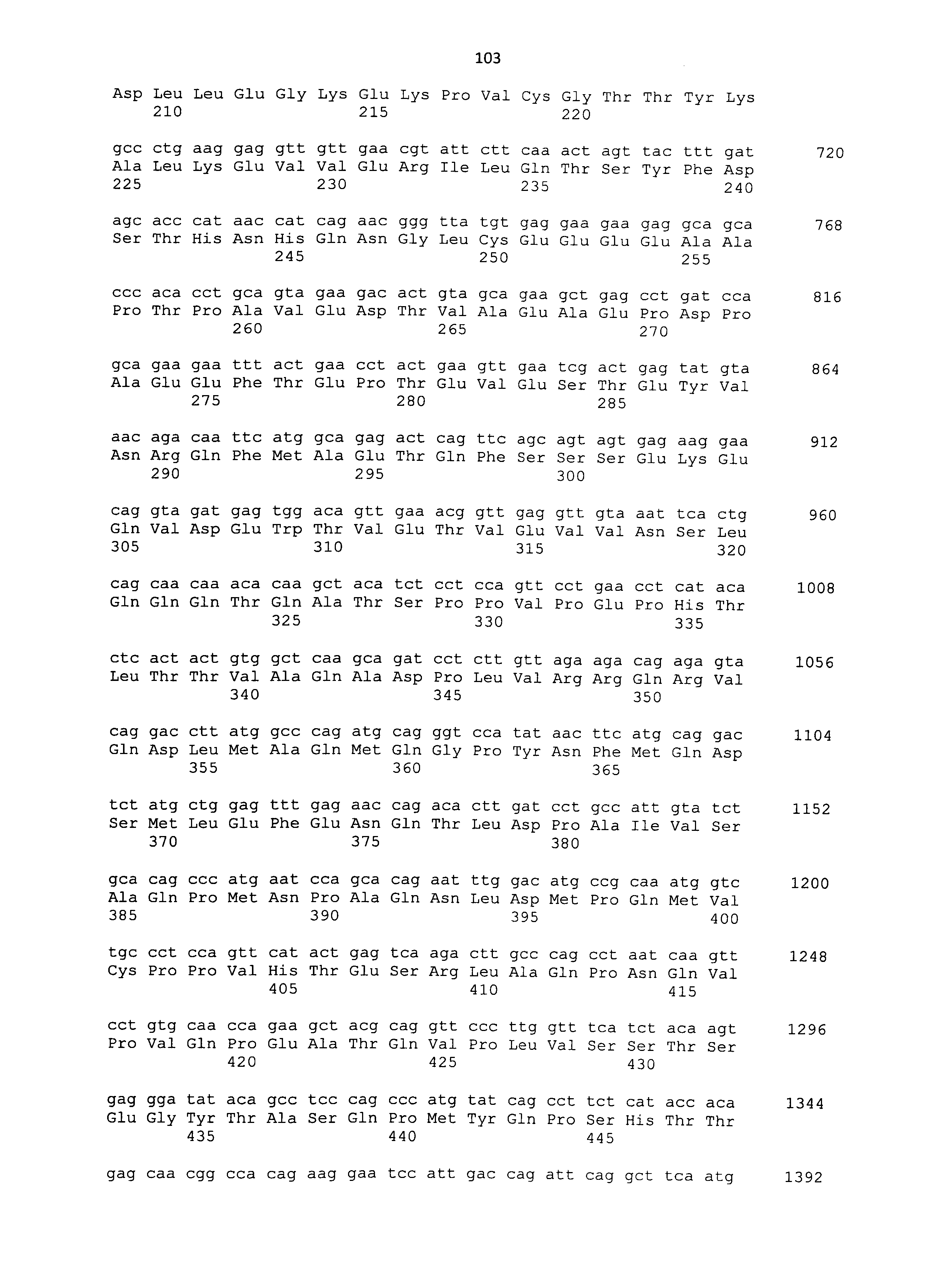
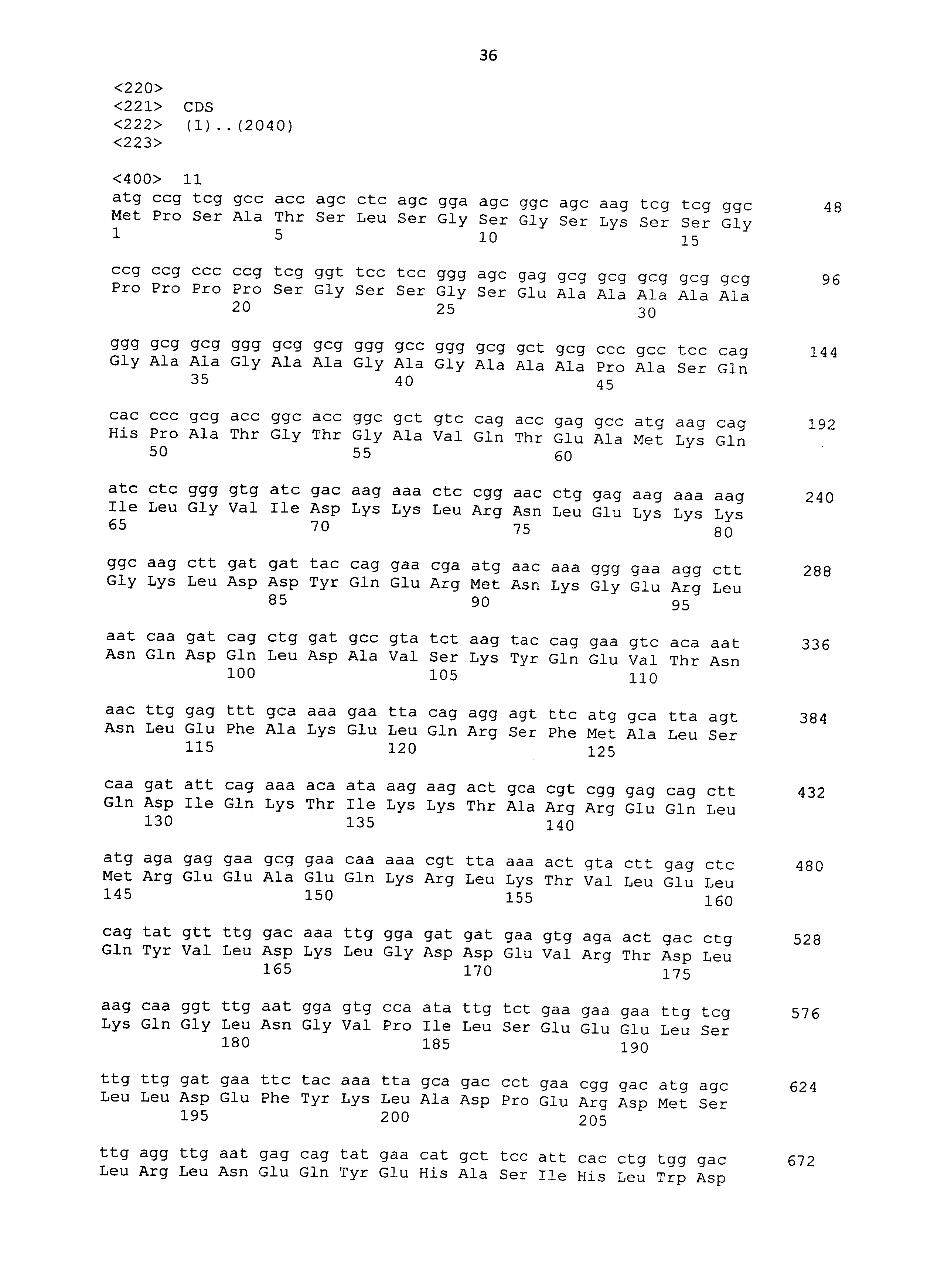
Полипептиды, используемые в рамках настоящего изобретения, можно синтезировать в соответствии со способом химического синтеза, таким как способ Fmoc (способ с флуоренилметилоксикарбонилом) или способ tBoc (способ с трет-бутилоксикарбонилом) (Japanese Biochemical Society (ed.), Seikagaku Jikken Koza (Biochemical Experimental Lecture Series) 1, Tanpakushitsu no Kagaku (Protein Chemistry) IV, Kagaku Shushoku to Peptide Gousei (Chemical Modification and Peptide Synthesis), TOKYO KAGAKU DOZIN CO., LTD, Japan, 1981). Также полипептиды можно синтезировать общепринятым способом с использованием различных коммерчески доступных устройств для синтеза пептидов. Альтернативно полипептиды можно без труда получать известными способами генетической инженерии (например, Sambrook et al., Molecular Cloning, 2nd Edition, Current Protocols in Molecular Biology, 1989, Cold Spring Harbor Laboratory Press; Ausubel et al., Short Protocols in Molecular Biology, 3rd Edition, A Compendium of Methods from Current Protocols in Molecular Biology, 1995, John Wiley & Sons). Из РНК, экстрагированной из ткани, экспрессирующей ген, кодирующий CAPRIN-1 человека SEQ ID NO: 2 или его гомолог, например, получают кДНК гена способом ОТ-ПЦР, полноразмерную последовательность или желаемую частичную последовательность кДНК встраивают в экспрессирующий вектор, а затем вектор вводят в клетку-хозяина. Таким образом, можно получать представляющий интерес полипептид. Нуклеотидные последовательности кДНК, кодирующих CAPRIN-1 собаки SEQ ID NO: 6, 8, 10, 12 и 14, представлены в SEQ ID NO: 5, 7, 9, 11 и 13, соответственно. Нуклеотидные последовательности их гомологов человека; т.е. кДНК, кодирующие CAPRIN-1 человека SEQ ID NO: 2 и 4, представлены в SEQ ID NO: 1 и 3, соответственно. Таким образом, с помощью этих нуклеотидных последовательностей можно без труда конструировать праймеры, используемые для ОТ-ПЦР. Как описано ниже, также с использованием праймеров, сконструированных с помощью нуклеотидных последовательностей SEQ ID NO: 1-29 с нечетным номером, можно амплифицировать ген, кодирующий CAPRIN-1 не являющегося человеком млекопитающего. Таким образом, кДНК, кодирующую, например, CAPRIN-1 кошки, можно без труда получить способами, сходными с описанными выше способами. Экстракцию РНК, ОТ-ПЦР, встраивание кДНК в вектор и введение вектора в клетку-хозяина можно проводить, например, хорошо известными способами, как описано ниже. Также векторы и клетки-хозяева, используемые в рамках настоящего изобретения, хорошо известны, и различные векторы и клетки-хозяева являются коммерчески доступными.
Указанные выше клетки могут представлять собой любые клетки при условии, что они могут экспрессировать описанные выше полипептиды. Примеры прокариотических клеток-хозяев включают Escherichia coli. Примеры эукариотических клеток-хозяев включают культивируемые клетки млекопитающих, такие как клетки почки обезьяны (COS1), клетки яичника китайского хомячка (CHO), клеточная линия эмбриональной почки человека (HEK293) и клеточная линия эмбриональной кожи мыши (NIH3T3), почкующиеся дрожжи, делящиеся дрожжи, клетки тутового шелкопряда и яйцеклетки Xenopus.
Когда в качестве клеток-хозяев используют прокариотические клетки, используют экспрессирующий вектор, имеющий ориджин репликации в прокариотических клетках, промотор, область связывания рибосомы, участок множественного клонирования, терминатор, ген устойчивости к лекарственному средству, ген ауксотрофной комплементарности и т.п. Примеры экспрессирующих векторов для Escherichia coli включают векторы pUC, pBluescriptII, экспрессирующие системы pET и экспрессирующие системы pGEX. ДНК, кодирующую каждый полипептид, встраивают в такой экспрессирующий вектор, прокариотические клетки-хозяева трансформируют вектором, и полученные таким образом трансформанты культивируют. Таким образом, полипептид, кодируемый ДНК, может экспрессироваться в прокариотических клетках-хозяевах. В то же время, полипептид также может экспрессироваться в качестве слитого белка с другим белком. ДНК, кодирующую указанный выше полипептид, можно получать путем получения кДНК, например, способом ОТ-ПЦР, как описано выше. Альтернативно такую ДНК можно синтезировать общепринятым способом с использованием коммерчески доступного устройства для синтеза нуклеиновых кислот, как описано ниже. Нуклеотидные последовательности кДНК генов, кодирующих CAPRIN-1 SEQ ID NO: 2 и 4, представлены в SEQ ID NO: 1 и 3 в списке последовательностей, соответственно.
Когда в качестве клеток-хозяев используют эукариотические клетки, используют экспрессирующий вектор для эукариотических клеток, имеющий промотор, область сплайсинга, участок добавления поли(А) и т.п. Примеры такого экспрессирующего вектора включают pKA1, pCDM8, pSVK3, pMSG, pSVL, pBK-CMV, pBK-RSV, вектор EBV, pRS, pcDNA3 и pYES2. Как описано выше, ДНК, кодирующую полипептид, используемый в рамках настоящего изобретения, встраивают в такой экспрессирующий вектор, эукариотические клетки-хозяева трансформируют вектором, и полученные таким образом трансформанты культивируют. Таким образом, полипептид, кодируемый описанной выше ДНК, может экспрессироваться в эукариотических клетках-хозяевах. Когда в качестве экспрессирующего вектора используют pIND/V5-His, pFLAG-CMV-2, pEGFP-N1, pEGFP-C1 и т.п., описанный выше полипептид может экспрессироваться в качестве слитого белка с различными метками, такими как His-метки (например, (His)6-(His)10), FLAG-метка, myc-метка, HA-метка или GFP.
Экспрессирующий вектор можно вводить в клетку-хозяина в соответствии с хорошо известным способом, таким как электропорация, способ с фосфатом кальция, способ с липосомами, способ с DEAE-декстраном, микроинъекция, вирусная инфекция, липофекция или связывание с проникающим через клеточную мембрану пептидом.
Представляющий интерес полипептид можно выделять и очищать из клеток-хозяев с использованием известных способов выделения в комбинации. Примеры таких способов включают обработку с использованием денатурирующего агента, такого как мочевина или поверхностно-активное вещество, обработку ультразвуковым излучением, ферментативное расщепление, высаливание, фракционирование и преципитацию с помощью растворителей, диализ, центрифугирование, ультрафильтрацию, гель-фильтрацию, SDS-PAGE, изоэлектрическое фокусирование, ионообменную хроматографию, гидрофобную хроматографию, аффинную хроматографию и обращено-фазовую хроматографию.
Полипептиды, полученные описанными выше способами, включают полипептиды в форме белков, слитых с другими белками. Примеры таких слитых белков включают белок, слитый с глутатион-S-трансферазой (GST), и белок, слитый с His-меткой. Полипептиды в форме таких слитых белков также находятся в объеме описанных выше специфически реактивных полипептидов со вставкой, и такие полипептиды можно использовать для первого способа обнаружения по настоящему изобретению. Кроме того, полипептиды, экспрессируемые в трансформированных клетках, иногда можно подвергать различным типам модификации в клетках после трансляции. Такой посттрансляционно модифицированный полипептид можно использовать в первом способе обнаружения по настоящему изобретению при условии, что он способен специфически связываться через взаимодействие антиген-антитело с антителом против белка CAPRIN-1. Примеры такой посттрансляционной модификации включают удаление N-концевого метионина, N-концевое ацетилирование, гликозилирование, ограниченный протеолиз внутриклеточной протеазой, миристоилирование, изопренилирование и фосфорилирование.
Антитело в образце можно без труда определять с помощью иммуноанализа с использованием указанного выше полипептида в качестве антигена. Иммуноанализ сам по себе хорошо известен в данной области. Иммуноанализ подразделяют на сэндвич-способ, конкурентный способ, способ агглютинации, способ вестерн-блоттинга и т.п., основываясь на типах реакций. Также, иммуноанализ подразделяют на основе меток, например, на радиоиммунный анализ, флуоресцентный иммуноанализ, иммуноферментный анализ и иммуноанализ с биотином. Иммуноанализ указанного выше антитела можно проводить с использованием любого из этих способов. В способе по настоящему изобретению в качестве способа иммуноанализа указанного выше антитела предпочтительно используют Сэндвич-ELISA или способ агглютинации, поскольку методики этих способов удобны и не требуют крупного устройства и т.п., хотя способы не ограничиваются ими. Когда в качестве метки для антитела используют фермент, такой фермент конкретно не ограничен при условии, что он удовлетворяет следующим условиям: число оборотов является высоким; он остается стабильным, даже если он связан с антителом; и он специфически вызывает развитие цвета субстрата. Можно использовать ферменты, которые можно использовать для общего иммуноферментного анализа, такие как пероксидаза, β-галактозидаза, щелочная фосфатаза, глюкозооксидаза, ацетилхолинэстераза, дегидрогеназа 6-фосфорилирования глюкозы и дегидрогеназа яблочной кислоты. Кроме того, можно использовать ингибирующие ферменты вещества, коферменты и т.п. Связывание этих ферментов с антителами можно проводить известными способами, вовлекающими использование сшивающего агента, такого как малеинимидное соединение, системы биотин-(стрепт)авидин и т.п. В качестве субстрата можно использовать известное вещество, в зависимости от типа используемого фермента. Когда в качестве фермента используют пероксидазу, можно использовать, например, 3,3',5,5'-тетраметилбензидин. Когда используют щелочную фосфатазу, можно использовать, например, пара-нитрофенол. Можно использовать радиоактивный изотоп, который обычно используют для радиоиммунного анализа, такой как 125I или 3H. Можно использовать флуоресцентный краситель, который используют для общих способов с флуоресцентными антителами, такой как флуоресцентный изотиоцианат (FITC), тетраметилродамин изотиоцианат (TRITC), или цианиновый флуоресцентный краситель (например, Cy3 или Cy5).
В настоящем описании нет необходимости объяснять указанные выше способы иммуноанализа, поскольку эти способы хорошо известны; однако, в кратком изложении, например, сэндвич-способ включает иммобилизацию указанного выше полипептида, используемого в качестве антигена, на твердую фазу, обеспечение взаимодействия полипептида с образцом, таким как сыворотка, промывание, обеспечение взаимодействия соответствующего вторичного антитела с антителом из образца, вновь промывание, а затем определение вторичного антитела, связавшегося с твердой фазой. Путем иммобилизации антигенного полипептида на твердую фазу, можно легко удалять не связавшееся вторичное антитело. Таким образом, это является предпочтительным вариантом осуществления способа обнаружения злокачественной опухоли по настоящему изобретению. В качестве вторичного антитела можно использовать, например, антитело против IgG собаки, если образец взят от собаки. Вторичное антитело заранее метят веществом для мечения, проиллюстрированным выше, так чтобы можно было измерять вторичное антитело, связавшееся с твердой фазой. Количество вторичного антитела, определенного таким образом, соответствует количеству указанного выше антитела в образце сыворотки. Когда фермент используют в качестве вещества для мечения, количество антитела можно определять путем добавления субстрата, который деградирует с развитием цвета под действием фермента, а затем оптического определения количества деградировавшего субстрата. Когда в качестве вещества для мечения используют радиоизотоп, можно измерять количество радиации из радиоактивного изотопа с использованием сцинтилляционного счетчика и т.п.
Во втором способе по настоящему изобретению определяют CAPRIN-1, который может содержаться в образце, полученном от индивидуума. Как описано выше, количество антитела, которое подвергается взаимодействию антиген-антитело с CAPRIN-1 собаки, человека и т.п., является значительно более высоким у индивидуумов с раком поджелудочной железы, по сравнению со здоровыми индивидуумами. Это указывает на то, что количество накапливающегося CAPRIN-1 в качестве антигена является значительно более высоким в клетках рака поджелудочной железы. В случае здоровых индивидуумов, уровень экспрессии CAPRIN-1 является более низким, чем предел обнаружения, или экспрессия CAPRIN-1 в ткани является слабой и может происходить только в клетках. Рак поджелудочной железы также можно обнаруживать путем прямого определения CAPRIN-1, как конкретно описано в примерах ниже. Таким образом, рак поджелудочной железы можно обнаруживать у индивидуума путем определения самого CAPRIN-1, как и в случае первого способа.
Полипептид в образце можно без труда определять хорошо известными способами иммуноанализа. В частности, антитело, которое подвержено взаимодействию антиген-антитело с CAPRIN-1, или его антигенсвязывающий фрагмент получают, и проводят иммуноанализ, используя его. Таким образом, можно определять присутствие CAPRIN-1 в образце. Как описано выше, антитело обладает перекрестной реактивностью. Таким образом, с использованием антитела, которое подвержено взаимодействию антиген-антитело с CAPRIN-1 собаки SEQ ID NO: 6, или его антигенсвязывающего фрагмента, можно определять не только CAPRIN-1 человека SEQ ID NO: 6, но также и его гомологи у других млекопитающих (например, CAPRIN-1 человека SEQ ID NO: 2 или 4). Сам по себе способ иммуноанализа является хорошо известным общепринятым способом, как описано выше.
Это исследование показывает, что CAPRIN-1 представляет собой белок клеточной мембраны, который экспрессируется на поверхности клеток рака поджелудочной железы. У индивидуума со злокачественной опухолью содержится множество протеаз в злокачественных тканях. Таким образом, часть последовательности CAPRIN-1, экспрессируемая наружу злокачественных клеток, отщепляется и отделяется от злокачественных клеток, и количество такой части является более высоким, чем количество части последовательности CAPRIN-1, экспрессируемой в злокачественных клетках. Таким образом, если антитело, способное связываться с поверхностью клеток рака поджелудочной железы, используют в качестве антитела против CAPRIN-1 при определении, или если используют его антигенсвязывающий фрагмент, можно обнаружить большее количество CAPRIN-1 и рак поджелудочной железы можно диагностировать с более высокой чувствительностью.
Таким образом, в рамках настоящего изобретения использование антитела, которое связывается с частью молекулы белка CAPRIN-1, экспрессируемой на поверхности клетки рака поджелудочной железы, является предпочтительным. Примером частичного пептида белка CAPRIN-1, экспрессируемого на поверхности клетки рака поджелудочной железы, является полипептид, состоящий из аминокислотной последовательности 7-12 или более последовательно расположенных аминокислотных остатков в области аминокислотных остатков (а.к.) 50-98 или аминокислотных остатков (а.к.) 233-305 в любой из аминокислотных последовательностей, соответствующих SEQ ID NO: 2-30 с четным номером в списке последовательностей, за исключением SEQ ID NO: 6 и SEQ ID NO: 18. Его конкретный пример представляет собой, но не ограничивается ими, аминокислотную последовательность, соответствующую SEQ ID NO: 43 или SEQ ID NO: 61 (в аминокислотной последовательности, соответствующей SEQ ID NO: 61, предпочтительной является область аминокислотной последовательности, соответствующая SEQ ID NO: 62 или SEQ ID NO: 63) или аминокислотную последовательность, имеющую 80% или более, предпочтительно 85% или более, более предпочтительно 90% или более, и еще более предпочтительно 95% или более идентичность последовательности с соответствующей аминокислотной последовательностью. Кроме того, все антитела, связывающиеся с этими полипептидами, входят в объем антител, используемых в рамках настоящего изобретения. Конкретные примеры включает антитело, связывающееся с полипептидом, содержащим аминокислотную последовательность, соответствующую SEQ ID NO: 43, или его антигенсвязывающий фрагмент, моноклональное антитело, имеющее аминокислотные последовательности, соответствующие SEQ ID NO: 44 и 45, или его антигенсвязывающий фрагмент, моноклональное антитело, имеющее аминокислотные последовательности, соответствующие SEQ ID NO: 44 и 46, или его антигенсвязывающий фрагмент, моноклональное антитело, имеющее аминокислотные последовательности, соответствующие SEQ ID NO: 44 и 47, или его антигенсвязывающий фрагмент, моноклональное антитело, имеющее аминокислотные последовательности, соответствующие SEQ ID NO: 44 и 48, или его антигенсвязывающий фрагмент, моноклональное антитело, имеющее аминокислотные последовательности, соответствующие SEQ ID NO: 49 и 50, или его антигенсвязывающий фрагмент, моноклональное антитело, имеющее аминокислотные последовательности, соответствующие SEQ ID NO: 51 и 52, или его антигенсвязывающий фрагмент, моноклональное антитело, имеющее аминокислотные последовательности, соответствующие SEQ ID NO: 53 и 54, или его антигенсвязывающий фрагмент, моноклональное антитело, имеющее аминокислотные последовательности, соответствующие SEQ ID NO: 55 и 56, или его антигенсвязывающий фрагмент, моноклональное антитело, имеющее аминокислотные последовательности, соответствующие SEQ ID NO: 57 и 58, или его антигенсвязывающий фрагмент, и моноклональное антитело, имеющее аминокислотные последовательности, соответствующие SEQ ID NO: 59 и 60, или его антигенсвязывающий фрагмент.
Термин "антигенсвязывающий фрагмент", используемый в настоящем описании, относится к фрагменту антитела, способному связываться с антигеном, такому как Fab-фрагмент, F(ab')2-фрагмент или Fv-фрагмент, содержащемуся в молекуле антитела. Антитело может представлять собой поликлональное антитело или моноклональное антитело. Для иммуноанализа предпочтительным является моноклональное антитело с высокой воспроизводимостью. Способы получения поликлонального антитела и моноклонального антитела с использованием полипептида в качестве иммуногена хорошо известны и их можно без труда проводить обычным образом. Например, животное иммунизируют CAPRIN-1 или его фрагментом отдельно, или CAPRIN-1 или его фрагментом, связанными с белком-носителем, таким как гемоцианин лимфы улитки (KLH), казеин или сывороточный альбумин, в качестве иммуногена, вместе с адъювантом, а затем можно индуцировать антитело против CAPRIN-1. Антителопродуцирующие клетки, такие как спленоциты или лимфоциты, собранные от иммунизированного животного, подвергают слиянию с клетками миеломы для получения гибридом, и гибридомы, продуцирующие антитело, которое связывается с CAPRIN-1, отбирают, а затем выращивают. Таким образом, моноклональное антитело, соответствующим антигеном которого является CAPRIN-1, можно получать из культурального супернатанта. Способ, описанный выше, представляет собой хорошо известный общепринятый способ.
В третьем способе по настоящему изобретению определяют нуклеиновую кислоту, кодирующую CAPRIN-1 (например, мРНК или кДНК, синтезированная с мРНК), которая может содержаться в образце, полученном из живого организма. Как конкретно описано в примерах ниже, нуклеиновая кислота, кодирующая CAPRIN-1 собаки SEQ ID NO: 6, 8, 10, 12 или 14 или CAPRIN-1 человека SEQ ID NO: 2 или 4, экспрессируется на довольно высоком уровне в клетках рака поджелудочной железы. Таким образом, злокачественную опухоль, присутствующую в живом организме, можно обнаруживать путем определения такой нуклеиновой кислоты в образце.
мРНК в образце можно количественно определять, например, общепринятым способом, таким как ОТ-ПЦР с детекцией в реальном времени, с использованием мРНК в качестве матрицы. Такую мРНК, как правило, можно количественно определять, исходя из интенсивности окрашивания и т.п. в общепринятом способе нозерн-блоттинга. Последовательности кДНК, кодирующие CAPRIN-1 SEQ ID NO: 2-30 с четным номером, соответствуют SEQ ID NO: 1-29 с нечетным номером, соответственно. Таким образом, полинуклеотид, специфически гибридизующийся с частичной областью в нуклеотидной последовательности, соответствующей любой из SEQ ID NO: 1-29 с нечетным номером (далее указывается как "полинуклеотид для обнаружения злокачественной опухоли"), получают на основе этих последовательностей, и такой полинуклеотид используют в качестве зонда или праймера для амплификации нуклеиновой кислоты для определения количества мРНК в образце. Если полинуклеотид способен специфически гибридизоваться с частичной областью в нуклеотидной последовательности, соответствующей любой из SEQ ID NO: 1-29 с нечетным номером, также можно определять мРНК, кодирующую CAPRIN-1 у млекопитающих, отличных чем собаки, как описано далее. В рамках настоящего изобретения полинуклеотид может представлять собой РНК или ДНК.
Термин "специфически гибридизующийся с", используемый в настоящем описании, относится к ситуации, когда указанный полинуклеотид гибридизуется только с заданной частичной областью и по существу не гибридизуется с какими-либо другими областями в жестких условиях гибридизации.
Термин "в жестких условиях гибридизации", используемый в настоящем описании, относится к условиям, используемым для отжига в обычной ПЦР или обнаружения с использованием зонда. В случае ПЦР с использованием Taq-полимеразы, например, реакцию проводят при подходящей температуре отжига в диапазоне приблизительно от 54°C до 60°C с использованием общего буфера, такого как буфер, содержащий 50 мМ KCl, 10 мМ Tris-HCl (pH 8,3-9,0), и 1,5 мМ MgCl2. В случае нозерн-гибридизации, например, реакцию проводят с использованием общего раствора для гибридизации, такого как as 5x SSPE, 50% формамид, 5x раствор Денхардта, и 0,1-0,5% SDS, или 0,1-5x SSC и 0,1-0,5% SDS при соответствующей температуре гибридизации в диапазоне приблизительно 42-65°C. После гибридизации проводят промывание, например, 0,1-0,2x SSC и 0,1% SDS. Соответствующие температуры отжига или температуры гибридизации не ограничиваются описанными выше примерами, и такие температуры определяют на основе величины Tm для полинуклеотида для обнаружения злокачественной опухоли, который используют в качестве праймера или зонда, и эмпирических правил экспериментаторов. Специалист в данной области может без труда определить такой диапазон температур.
Выражение "по существу не гибридизуется", используемое в настоящем описании, относится к ситуации, когда указанный полинуклеотид вообще не гибридизуется с заданной частичной областью или крайне низкое количество полинуклеотида гибридизуется с заданной частичной областью, т.е. относительно ничтожное количество, даже когда он гибридизуется с заданной частичной областью. Примером полинуклеотида, специфически гибридизующегося в таких условиях с полинуклеотидом, имеющим определенный уровень или более высокий уровень идентичности последовательности с нуклеотидной последовательностью заданной частичной области. Например, такой полинуклеотид имеет 70% или более, предпочтительно 80% или более, более предпочтительно 85% или более, еще более предпочтительно 90% или более, еще более предпочтительно 93% или более, еще более предпочтительно 95% или более, и особенно предпочтительно 98% или более идентичность последовательности. Наиболее предпочтительно, полинуклеотид имеет нуклеотидную последовательность, идентичную нуклеотидной последовательности заданной частичной области. Идентичность последовательностей определяют аналогично тому, как и идентичность последовательностей для аминокислотных последовательностей, описанных выше. Даже если конец полинуклеотида для обнаружения злокачественной опухоли содержит область, которая не гибридизуется с ним, в случае зонда, его можно использовать для обнаружения при условии, что гибридизующаяся область занимает приблизительно половину или более всего зонда. В случае праймера, его можно использовать для обнаружения при условии, что гибридизующаяся область занимает приблизительно половину или более всего праймера и расположена на 3'-конце, поскольку это позволяет прохождение нормального отжига и реакции удлинения. Когда конец полинуклеотида для обнаружения злокачественной опухоли содержит не гибридизующуюся область, как описано выше, идентичность последовательности с заданной нуклеотидной последовательностью вычисляют, фокусируясь только на гибридизующейся области, не учитывая не гибридизующуюся область.
В рамках настоящего изобретения, термин "частичная последовательность" (или "частичная область") относится к части нуклеотидной последовательности, соответствующей любой из SEQ ID NO: 1-29 с нечетными номерами. В частности, частичная последовательность содержит по меньшей мере 15-19 последовательно расположенных нуклеотидов, предпочтительно 18 или более последовательно расположенных нуклеотидов, более предпочтительно по меньшей мере 20 или 25 последовательно расположенных нуклеотидов, и еще более предпочтительно по меньшей мере 30, 40 или 50 последовательно расположенных нуклеотидов. Выражение "нуклеотидная последовательность, соответствующая SEQ ID NO: 5", используемое в настоящем описании, относится, в дополнение к нуклеотидной последовательности, фактически представленной в SEQ ID NO: 5, к последовательности, комплементарной ей. Таким образом, выражение "полинуклеотид, имеющий нуклеотидную последовательность, соответствующую SEQ ID NO: 5," относится, например, к одноцепочечному полинуклеотиду, имеющему нуклеотидную последовательность, фактически соответствующую SEQ ID NO: 5, одноцепочечному полинуклеотиду, имеющему нуклеотидную последовательность, комплементарную нуклеотидной последовательности, соответствующей SEQ ID NO: 5, или двухцепочечному полинуклеотиду, состоящему из двух одноцепочечных полинуклеотидов. Когда получают полинуклеотид, используемый в рамках настоящего изобретения, или получают полинуклеотид, кодирующий полипептид, используемый в рамках настоящего изобретения, можно соответствующим образом выбирать любую из нуклеотидных последовательностей, и специалист в данной области может без труда сделать такой выбор.
Количество нуклеотидов в полинуклеотиде для обнаружения злокачественной опухоли предпочтительно составляет 18 или более для обеспечения специфичности. Когда полинуклеотид используют в качестве зонда, он предпочтительно содержит 18 или более нуклеотидов, и еще более предпочтительно он содержит от 20 нуклеотидов до полноразмерной кодирующей области. Когда полинуклеотид используют в качестве праймера, он предпочтительно содержит 18-50 нуклеотидов. Предпочтительным примером полинуклеотида для обнаружения злокачественной опухоли является полинуклеотид, содержащий 18 или более последовательно расположенных нуклеотидов в нуклеотидной последовательности, соответствующей любой из SEQ ID NO: 1-29 с нечетным номером.
Специалисту в области, к которой относится настоящее описание, очевидно, что: полинуклеотид, специфически гибридизующийся с частичной областью в SEQ ID NO: 5, 7, 9, 11 или 13, используют для определения количества нуклеиновой кислоты (например, мРНК или кДНК, синтезированная с мРНК), кодирующей белок CAPRIN-1 собаки SEQ ID NO: 6, 8, 10, 12 или 14, соответственно; и полинуклеотид, специфически гибридизующийся с частичной областью в SEQ ID NO: 1 или 3, используют для определения количества нуклеиновой кислоты (например, мРНК или кДНК, синтезированная с мРНК), кодирующей белок CAPRIN-1 человека SEQ ID NO: 2 или 4, соответственно. Однако белок из данного млекопитающего и его гомологи из другого млекопитающего, как правило, обладают высокой идентичностью последовательностей даже на уровне нуклеотидных последовательностей. Таким образом, идентичность последовательностей среди нуклеотидных последовательностей SEQ ID NO: 1-13 также составляет от 94% до 100%. Таким образом, полинуклеотид, специфически гибридизующийся с частичной областью последовательности SEQ ID NO: 5, также может специфически гибридизоваться с частичной областью, соответствующей частичной области любой из SEQ ID NO: 1-29 с нечетным номером.
В действительности, пара праймеров, имеющих нуклеотидные последовательности, соответствующие SEQ ID NO: 33 и 34, специфически гибридизуется как с частичной областью любой из SEQ ID NO: 1-29 с нечетным номером, так и с частичной областью последовательности SEQ ID NO: 5, как описано в примерах ниже. Таким образом, можно определять как мРНК, кодирующую CAPRIN-1 собаки SEQ ID NO: 6, так и мРНК, кодирующую ее гомолог. Таким образом, с использованием полинуклеотида, специфически гибридизующегося с частичной областью последовательности SEQ ID NO: 5, можно определять не только мРНК, кодирующую CAPRIN-1 собаки SEQ ID NO: 6, но также мРНК, кодирующую CAPRIN-1 человека SEQ ID NO: 2 или 4. Аналогично, можно определять мРНК, кодирующую CAPRIN-1 другого млекопитающего, такого как кошка. Когда конструируют полинуклеотид для обнаружения злокачественной опухоли, является более желательным выбор частичных областей, имеющих особенно высокую идентичность последовательности, из SEQ ID NO: 1-29 с нечетным номером (и предпочтительными являются идентичные нуклеотидные последовательности). Если существует особенно высокая идентичность последовательностей между частичными областями CAPRIN-1 собаки и CAPRIN-1 человека, ожидается, что область, проявляющая очень высокую идентичность последовательности с такой областью, также будет присутствовать в гене гомолога другого вида животного. Путем выбора такой частичной области, можно увеличивать точность определения мРНК, кодирующей CAPRIN-1 вида животного, отличного от собаки или человека.
Способ определения нуклеиновой кислоты в исследуемом объекте с использованием полинуклеотида, специфически гибридизующегося с частичной областью нуклеиновой кислоты, в качестве зонда или праймера(ов) для способа амплификации нуклеиновой кислоты, такого как ПЦР, хорошо известен. Примеры такого способа включают, в дополнение к ОТ-ПЦР, как конкретно описано в примерах ниже, нозерн-блоттинг и гибридизацию in situ. Когда количество мРНК измеряют в рамках настоящего изобретения, можно использовать любой из таких хорошо известных способов определения.
Способ амплификации нуклеиновых кислот, такой как ПЦР, хорошо известен в данной области, и наборы реагентов и устройства, используемые для них, являются коммерчески доступными, так что способ можно без труда выполнять. В частности, каждую из стадий денатурации, отжига и удлинения проводят с использованием нуклеиновой кислоты из исследуемого объекта (например, кДНК гена, кодирующая белок, имеющий аминокислотную последовательность, соответствующую любой из SEQ ID NO: 2-30 с четным номером), в качестве матрицы и пары полинуклеотидов (праймеров) для обнаружения злокачественной опухоли в известном буфере в присутствии термостабильной ДНК-полимеразы, такой как Taq-полимераза или Pfu-полимераза и dNTP (в данном случае, N=A, T, C и G) путем варьирования температуры реакционного раствора на каждой стадии. Как правило, стадию денатурации проводят при 90°C-95°C, стадию отжига проводят при Tm, или около того, матрицы и праймеров (предпочтительно в пределах ±4°C), и стадию удлинения проводят при 72°C, что является оптимальной температурой для термостабильной ДНК-полимеразы, такой как Taq-полимераза или Pfu-полимераза, или при температуре вблизи оптимальной температуры. Длительность каждой стадии надлежащим образом выбирают так, чтобы она составляла приблизительно от 30 секунд до 2 минут. Этот цикл нагрева повторяют приблизительно от 25 до 40 раз, например, так чтобы амплифицировалась область нуклеиновой кислоты-матрицы, расположенная между парой праймеров. Способ амплификации нуклеиновых кислот не ограничивается ПЦР, и можно использовать любые другие способы амплификации нуклеиновых кислот, хорошо известные в данной области. Когда способ амплификации нуклеиновой кислоты осуществляют с использованием пары полинуклеотидов для обнаружения злокачественной опухоли в качестве праймеров и нуклеиновой кислоты в исследуемом объекте в качестве матрицы, как описано выше, нуклеиновая кислота амплифицируется. Однако если образец не содержит исследуемую нуклеиновую кислоту, амплификация не происходит. Таким образом, продукт амплификации можно выявлять так, чтобы определить наличие или отсутствие нуклеиновой кислоты в образце. Продукт амплификации можно выявлять способом, который включает проведение электрофореза реакционного раствора после амплификации, а затем окрашивание полосы бромидом этидия и т.п., или способом, который включает иммобилизацию продукта амплификации после электрофореза на твердую фазу, такую как нейлоновая мембрана, проведение гибридизации с зондом для мечения, который специфически гибридизуется с нуклеиновой кислотой, промывание, а затем выявление метки. Также проводят так называемую ПЦР с детекцией в реальном времени с использованием флуоресцентного красителя-тушителя и репортерного флуоресцентного красителя, и, таким образом, можно определять количество нуклеиновой кислоты в образце. Поскольку наборы для ПЦР с детекцией в реальном времени являются коммерчески доступными, ПЦР с детекцией в реальном времени можно без труда проводить. Кроме того, также можно проводить полуколичественное определение нуклеиновой кислоты в исследуемом объекте, исходя из интенсивности полосы при электрофорезе. Нуклеиновая кислота в исследуемом объекте может представлять собой либо мРНК, либо кДНК, обратно транскрибированную с мРНК. Когда мРНК амплифицируют в качестве нуклеиновой кислоты, также можно использовать способ NASBA (способ 3SR или способ TMA) с использованием описанной выше пары праймеров. Способ NASBA хорошо известен, и наборы для него являются коммерчески доступными, так что способ можно без труда осуществлять с использованием описанной выше пары праймеров.
В качестве зонда можно использовать меченный зонд, который получают путем мечения полинуклеотида для обнаружения злокачественной опухоли флуоресцентной меткой, радиоактивной меткой, биотиновой меткой и т.п. Способы мечения полинуклеотида хорошо известны. Наличие или отсутствие нуклеиновой кислоты в образце можно исследовать путем иммобилизации нуклеиновой кислоты или продукта ее амплификации, проведения гибридизации с меченным зондом, промывания, а затем измерения метки, связавшейся с твердой фазой. Альтернативно иммобилизуют полинуклеотид для обнаружения злокачественной опухоли, нуклеиновую кислоту в исследуемом объекте гибридизуют с ним, а затем исследуемую нуклеиновую кислоту, связавшуюся с твердой фазой, можно выявлять с использованием меченого зонда и т.п. В таком случае полинуклеотид для обнаружения злокачественной опухоли, связанный с твердой фазой, также называют "зондом". Способы определения нуклеиновой кислоты с использованием полинуклеотидного зонда также хорошо известны в данной области. Такой способ можно осуществлять путем осуществления контактирования в буфере полинуклеотидного зонда с нуклеиновой кислотой в исследуемом объекте при Tm или около Tm (предпочтительно, ±4°C) для гибридизации, промывания, а затем определения гибридизованного меченого зонда или нуклеиновой кислоты-матрицы, связавшейся с зондом твердой фазы. Примеры такого способа включают хорошо известные способы, такие как нозерн-блоттинг, гибридизация in situ и саузерн-блоттинг. В рамках настоящего изобретения применим любой хорошо известный способ.
В соответствии со способом обнаружения по настоящему изобретению, оценку того, страдает ли рассматриваемое животное (или индивидуум) раком поджелудочной железы, проводят, исходя из наличия или величины экспрессии CAPRIN-1, определенных, как описано выше. Хотя рак поджелудочной железы можно обнаруживать только путем определения наличия или величины экспрессии CAPRIN-1 у рассматриваемого животного, предпочтительно, чтобы исследовали уровни экспрессии (уровень антитела, уровень полипептида или уровень мРНК) CAPRIN-1 в одном или нескольких образцах здоровых индивидуумов и величину, определенную для рассматриваемого животного, сравнивали со стандартной величиной, полученной для здоровых индивидуумов, для увеличения точности обнаружения. Для дальнейшего повышения точности обнаружения определяют уровни экспрессии CAPRIN-1 для образцов, полученных от множества пациентов, у которых выявлено наличие рака поджелудочной железы, чтобы получить стандартную величину для пациентов с раком поджелудочной железы, а затем величину, определенную для рассматриваемого животного, можно сравнивать как со стандартной величиной для здоровых индивидуумов, так и со стандартной величиной для пациентов с раком поджелудочной железы. Описанные выше стандартные величины можно определять, например, путем количественного определения уровней экспрессии CAPRIN-1 в каждом образце и вычисления их средней величины. Стандартную величину для здоровых индивидуумов и для пациентов с раком поджелудочной железы можно определять заранее путем определения уровней экспрессии CAPRIN-1 у многих здоровых индивидуумов и пациентов с раком поджелудочной железы. Таким образом, когда в способе по настоящему изобретению проводят сравнение со стандартной величиной, можно использовать стандартную величину, определенную заранее.
Способ обнаружения по настоящему изобретению может включать диагностику на основе других антигенов злокачественной опухоли или маркеров злокачественной опухоли в комбинации. Это может далее повысить точность обнаружения рака поджелудочной железы. Когда антитело, специфически присутствующее у пациентов с раком поджелудочной железы, измеряют способом по настоящему изобретению, в качестве антигена можно использовать, например, другой полипептид, который часто экспрессируется в злокачественной опухоли, в комбинации, аналогично тому, как и для полипептидов, описанных выше. Также, способ по настоящему изобретению можно осуществлять в комбинации с диагностикой с использованием ранее известного маркера злокачественной опухоли.
Рак поджелудочной железы, обнаруживаемый способом обнаружения рака поджелудочной железы по настоящему изобретению, представляет собой рак поджелудочной железы, экспрессирующий CAPRIN-1. Примеры такого рака включают, но не ограничиваясь ими, протоковую карциному поджелудочной железы, инвазивную протоковую карциному поджелудочной железы, аденокарциному, карциному ацинарных клеток, железисто-плоскоклеточную карциному, гигантоклеточную опухоль, внутрипротоковое папиллярно-муцинозное новообразование (IPMN), муцинозное кистозное новообразование (MCN), панкреатобластому, серозную цистаденокарциному, солидную псевдопапиллярную опухоль (SPT), гастриномы (синдром Золлингера-Эллисона), глюкагоному, инсулиному, множественное эндокринное новообразование 1 типа (MEN1) (синдром Вермера), опухоль нефункциональных островковых клеток, соматостатиномы и ВИПомы. Индивидуумом в способе по настоящему изобретению является млекопитающее, предпочтительно человек или собака.
Примеры образцов, исследуемых способом по настоящему изобретению, включают жидкости организма, такие как кровь, сыворотка, плазма крови, асцитная жидкость и плевральный выпот, ткани и клетки. В первом способе и втором способе, в частности, предпочтительно можно использовать образцы сыворотки, плазмы крови, асцитной жидкости, плеврального выпота, ткани и клеток. В третьем способе, включающем определение нуклеиновой кислоты, такой как мРНК, предпочтительными являются образцы ткани и клеток.
Один или несколько полипептидов, используемых в качестве антигенов для иммуноанализа в первом способе, описанном выше (т.е. CAPRIN-1 собаки SEQ ID NO: 2 и его гомолог, специфически реактивный частичный полипептид, специфически реактивный модифицированный полипептид, и специфически реактивный полипептид со вставкой) могут быть предоставлены в качестве реагентов или наборов для обнаружения рака поджелудочной железы. Такой реагент может состоять из указанного выше полипептида, или он может содержать различные добавки, пригодные для стабилизации полипептида, буфер, необходимый для анализа, вторичные антитела, субстраты для ферментов и т.п., по отдельности. Альтернативно такой реагент может быть иммобилизован на твердой фазе, такой как планшет или мембрана. Предпочтительные примеры таких полипептидов приведены выше.
Также могут быть предоставлены антитело или его антигенсвязывающий фрагмент, которые подвержены взаимодействию антиген-антитело с CAPRIN-1, используемые для иммуноанализов CAPRIN-1 вторым способом, в форме реагента для обнаружения рака поджелудочной железы. Реагент для рака поджелудочной железы может состоять из описанного выше антитела или его антигенсвязывающего фрагмента. Реагент может содержать различные добавки, пригодные для стабилизации такого антитела или его антигенсвязывающего фрагмента. Альтернативно с антителом или его антигенсвязывающим фрагментом может быть связан металл, такой как марганец или железо. Когда такое связанное с металлом антитело или его антигенсвязывающий фрагмент вводят в живой организм, связанное с металлом антитело или его антигенсвязывающий фрагмент накапливаются на повышенном уровне в области, где антигенный белок присутствует на более высоком уровне. Когда такое связанное с металлом антитело или его антигенсвязывающий фрагмент вводят в живой организм, связанное с металлом антитело или его антигенсвязывающий фрагмент накапливаются на повышенном уровне в области, в которой антигенный белок присутствует на более высоком уровне. Таким образом, металл определяют с помощью MRI и т.п., и, таким образом, обнаруживают наличие злокачественных клеток, продуцирующих антигенный белок.
Более того, также в качестве реагента или набора для обнаружения рака поджелудочной железы могут быть предоставлены один или несколько из описанных выше полинуклеотидов для обнаружения рака поджелудочной железы, используемых для определения нуклеиновой кислоты, такой как мРНК, в третьем способе. В таком случае, реагент для обнаружения рака поджелудочной железы может состоять из полинуклеотида, или он может содержать различные добавки, пригодные для стабилизации полипептида, буфер, необходимый для анализа (например, с флуоресцентной меткой) и т.п., по отдельности. Полинуклеотид для обнаружения рака поджелудочной железы, содержащийся в реагенте, предпочтительно представляет собой праймер(ы) или зонд(ы). Условия и предпочтительные примеры полинуклеотида для обнаружения рака поджелудочной железы являются такими, как описано выше.
Примеры
Настоящее изобретение описано более подробно с помощью следующих примеров, хотя технический объем настоящего изобретения не ограничивается примерами.
Пример 1. Получение антигенного белка рака поджелудочной железы способом SEREX
(1) Конструирование библиотеки кДНК
Тотальную РНК экстрагировали из ткани семенников здоровой собаки способом с использованием кислого гуанидия-фенола-хлороформа, и поли-A РНК очищали с использованием набора для очистки мРНК Oligotex-dT30 (Takara Shuzo Co., Ltd.) в соответствии с протоколом, прилагаемым к набору.
С использованием полученной таким образом мРНК (5 мкг) синтезировали фаговую библиотеку кДНК семенника собаки. Фаговую библиотеку кДНК конструировали с использованием наборов для синтеза кДНК ZAP-cDNA Synthesis Kit и ZAP-cDNA Gigapack III Gold Cloning Kit (Stratagene Corp.) в соответствии с протоколами, прилагаемыми к наборам. Размер сконструированной таким образом фаговой библиотеки кДНК составил 7,73×105 б.о.е./мл.
(2) Скрининг библиотеки кДНК с использованием сыворотки
С использованием фаговой библиотеки кДНК семенника собаки, сконструированной, как описано выше, проводили иммунный скрининг. В частности, хозяев E. coli (XL1-Blue MRF') инфицировали фагами на агарозном планшете NZY (φ90×15 мм) с получением 2210 клонов. Хозяев культивировали при 42°C в течение 3-4 часов, чтобы образовались бляшки. Чашку покрывали нитроцеллюлозной мембраной (Hybond C Extra: GE HealthCare Bio-Sciences Ltd.), пропитанной IPTG (изопропил-β-D-тиогалактозид) при 37°C в течение 4 часов для индукции экспрессии белка для переноса белков на мембрану. Затем мембрану извлекали, погружали в TBS (10 мМ трис-HCl, 150 мМ NaCl, pH 7,5), содержавший 0,5% сухого обезжиренного молока, и встряхивали в течение ночи при 4°C, чтобы подавить неспецифичную реакцию. Этот фильтр подвергали взаимодействию с разбавленной в 500 раз сывороткой больной собаки при комнатной температуре в течение 2-3 часов.
В качестве описанной выше сыворотки больной собаки использовали сыворотку, полученную от собаки, страдающей раком поджелудочной железы. Сыворотку хранили при -80°C и затем подвергали предварительной обработке непосредственно перед использованием. Способ предварительной обработки сыворотки был следующим. В частности, хозяев Escherichia coli (XL1-Blure MRF') инфицировали фагами λ ZAP Express, не имеющими вставки чужеродного гена, и культивирование продолжали в течение ночи на чашке со средой NZY при 37°C. Затем в чашку добавляли буфер (0,2 М NaHCO3 (pH 8,3)), содержавший 0,5 М NaCl, чашку оставляли стоять при 4°C в течение 15 часов, а затем супернатант собирали в виде экстракта Escherichia coli/фага. Затем собранный таким образом экстракт Escherichia coli/фага наносили на NHS-колонку (GE HealthCare Bio-Sciences Ltd.), чтобы иммобилизовать на нее происходящий из Escherichia coli/фага белок. На эту колонку с иммобилизованным белком наносили сыворотку больной собаки для взаимодействия, а затем Escherichia coli и антитело, адсорбированные на фаг, удаляли из сыворотки. Фракцию сыворотки, которая прошла через колонку, разбавляли в 500 раз TBS, содержавшим 0,5% сухое обезжиренное молоко. Разбавленную фракцию сыворотки использовали в качестве материала для иммунологического скрининга.
Мембрану, на которую с помощью блоттинга переносили обработанную таким образом сыворотку и слитый белок, промывали 4 раза TBS-T (0,05% твин 20/TBS). Мембрану подвергали взаимодействию с антителом козы против IgG собаки (конъюгированное с HRP антитело козы против IgG-h+I собаки: BETHYL Laboratories) в качестве второго антитела, разбавленным в 5000 раз в TBS, содержавшем 0,5% сухого обезжиренного молока, при комнатной температуре в течение 1 часа. Регистрацию осуществляли на основе цветной ферментативной реакции, используя раствор для реакции NBT/BCIP (Roche). Колонии, соответствующие участкам положительной цветной реакции, собирали из чашки с агарозой размером φ90×15 мм и затем разбавляли в 500 мкл буфера SM (100 мМ NaCl, 10 мМ MgClSO4, 50 мМ трис-HCl, 0,01% желатин, pH 7,5). Вторичный скрининг и третичный скрининг повторяли способом, подобным указанному выше, вплоть до унификации положительных в цветной реакции колоний, тем самым проведя скрининг 30940 фаговых клонов, взаимодействующих с IgG сыворотки. Таким образом, было выделено 5 положительных клонов.
(3) Поиск гомологии для выделенного гена антигена
Для анализа нуклеотидной последовательности 5 положительных клонов, выделенных указанным выше способом, проводили преобразование фаговых векторов в плазмидные векторы. В частности, получали 200 мкл раствора, содержавшего хозяев Escherichia coli (XL1-Blue MRF') при поглощении (OD 600) 1,0. Раствор смешивали с 250 мкл очищенного раствора с фагом и 1 мкл хелперного фага ExAssist (STRATAGENE), смесь подвергали реакции при 37°C в течение 15 минут, к ней добавляли 3 мл среды LB, а затем проводили культивирование при 37°C в течение 2,5-3 часов. Сразу после этого, температуру раствора поддерживали на водяной бане при 70°C в течение 20 минут, проводили центрифугирование при 4°C и 1000 × g в течение 15 минут, а затем супернатант собирали в качестве раствора с фагмидой. Затем получали 200 мкл раствора, содержавшего хозяина фагмиды Escherichia coli (SOLR) при поглощении OD600 1,0. Полученный раствор смешивали с 10 мкл очищенного раствора с фагом, а затем проводили взаимодействие при 37°C в течение 15 минут. Продукт взаимодействия (50 мл) высевали на среду с LB-агаром, содержавшую ампициллин (конечная концентрация: 50 мкг/мл), и культивирование проводили при 37°C в течение ночи. Единичную колонию трансформированных SOLR собирали, а затем культивировали в среде LB, содержавшей ампициллин (конечная концентрация: 50 мкг/мл) при 37°C. После этого плазмидную ДНК, содержавшую представляющую интерес вставку, очищали с использованием набора QIAGEN Plasmid Miniprep Kit (QIAGEN).
Очищенную плазмиду подвергали анализу полноразмерной последовательности вставки способом опосредуемой праймерами "прогулки" с использованием праймера T3, соответствующего SEQ ID NO: 31, и праймера T7, соответствующего SEQ ID NO: 32. В результате анализа последовательности, были получены последовательности генов, соответствующие SEQ ID NO: 5, 7, 9, 11 и 13. С использованием нуклеотидных последовательностей и аминокислотных последовательностей (SEQ ID NO: 6, 8, 10, 12 и 14) генов выполняли программу поиска гомологии BLAST Search (http://www.ncbi.nlm.nih.gov/BLAST/). В результате этого поиска гомологии с известными генами, было обнаружено, что все из 5 полученных генов кодируют CAPRIN-1. В областях, транслируемых в белки, идентичность последовательностей среди этих 5 генов составляла 100% для нуклеотидной последовательности и 99% для аминокислотной последовательности. Также в областях, транслируемых в белки, идентичность последовательностей между геном собаки (любая из SEQ ID NO: 5, 7, 9, 11 или 13) и геном, кодирующим его гомолог человека, составляла 94% для нуклеотидной последовательности и 98% для аминокислотной последовательности. Нуклеотидные последовательности гомолога человека соответствуют SEQ ID NO: 1 и 3, и его аминокислотные последовательности соответствуют SEQ ID NO: 2 и 4. Также идентичность последовательностей между полученным геном собаки и геном, кодирующим гомолог крупного рогатого скота, составила 94% для нуклеотидной последовательности и 97% для аминокислотной последовательности в областях, транслируемых в белки. Нуклеотидная последовательность гомолога крупного рогатого скота соответствует SEQ ID NO: 15 и его аминокислотная последовательность соответствует SEQ ID NO: 16. Идентичность последовательностей между геном, кодирующим гомолог человека, и геном, кодирующим гомолог крупного рогатого скота, составляла 94% для нуклеотидных последовательностей и находилась в диапазоне 93%-97% для аминокислотной последовательности в областях, транслируемых в белки. Также, идентичность последовательностей между полученным геном собаки и геном, кодирующим гомолог лошади, составила 93% для нуклеотидной последовательности и 97% для аминокислотной последовательности в областях, транслируемых в белки. Нуклеотидная последовательность гомолога лошади соответствует SEQ ID NO: 17 и его аминокислотная последовательность соответствует SEQ ID NO: 18. Идентичность последовательностей между геном, кодирующим гомолог человека, и геном, кодирующим гомолог лошади, составляла 93% для нуклеотидной последовательности и 96% для аминокислотной последовательности в областях, транслируемых в белки. Также идентичность последовательностей между полученным геном собаки и геном, кодирующим гомолог мыши, находилась в диапазоне от 87% до 89% для нуклеотидной последовательности и находилась в диапазоне от 95% до 97% для аминокислотной последовательности в областях, транслируемых в белки. Нуклеотидные последовательности гомолога мыши соответствуют SEQ ID NO: 19, 21, 23, 25 и 27, и его аминокислотные последовательности соответствуют SEQ ID NO: 20, 22, 24, 26 и 28. Идентичность последовательностей между геном, кодирующим гомолог человека, и геном, кодирующим гомолог мыши, находилась в диапазоне от 89% до 91% для нуклеотидной последовательности и находилась в диапазоне от 95% до 96% для аминокислотной последовательности в областях, транслируемых в белки. Также, идентичность последовательностей между полученным геном собаки и геном, кодирующим гомолог курицы, составляла 82% для нуклеотидной последовательности и 87% для аминокислотной последовательности в областях, транслируемых в белки. Нуклеотидная последовательность гомолога курицы соответствует SEQ ID NO: 29 и его аминокислотная последовательность соответствует SEQ ID NO: 30. Идентичность последовательностей между геном, кодирующим гомолог человека, и геном, кодирующим гомолог курицы, находилась в диапазоне от 81% до 82% для нуклеотидной последовательности и составляла 86% для аминокислотной последовательности в областях, транслируемых в белки.
(4) Анализ экспрессии генов в клеточных линиях рака поджелудочной железы
Экспрессию генов, полученных описанным выше способом, в нормальных тканях человека (т.е. молочная железа, головной мозг, костный мозг, легкое, пищевод, поджелудочная железа и яичко) и 4 типах клеточных линий рака поджелудочной железы (т.е. Capan-2, MIAPaCa-2, PANC-1 и BxPC-3) исследовали способом ОТ-ПЦР (ПЦР с обратной транскрипцией). Реакцию обратной транскрипции проводили следующим образом. В частности, тотальную РНК (от 50 мг до 100 мг) экстрагировали из каждой ткани и каждой клеточной линии (5-10×106 клеток) с использованием реагента TRIZOL (Invitrogen) в соответствии с прилагаемыми протоколами. Синтезировали кДНК с использованием тотальной РНК и системы для синтеза первой цепи Superscript для ОТ-ПЦР (Invitrogen) в соответствии с прилагаемыми протоколами. ПЦР проводили следующим образом с использованием праймеров, специфичных к полученным генам (соответствующих SEQ ID NO: 33 и 34). В частности, ПЦР проводили путем приготовления реакционного раствора, доводя его общее количество до 25 мкл путем добавления реагентов и прилагаемого буфера (т.е. 0,25 мкл образца, полученного реакцией обратной транскрипции, указанные выше праймеры (2 мкМ каждого), dNTP (0,2 мМ каждого), 0,65 Е ExTaq-полимеразы (Takara Shuzo, Co., Ltd.)), полученный раствор подвергали циклу из 94°C в течение 30 секунд, 60°C в течение 30 секунд и 72°C в течение 30 секунд с использованием термоциклера (BIO RAD), и этот цикл повторяли 30 раз. Специфичные к гену праймеры, упомянутые выше, использовали для амплификации области между нуклеотидом № 698 и нуклеотидом № 1124 в нуклеотидной последовательности, соответствующей SEQ ID NO: 1 (ген CAPRIN-1 человека). Для сравнения, одновременно использовали специфичные к GAPDH праймеры (соответствующие SEQ ID NO: 35 и 36). В результате исследования экспрессии гена CAPRIN-1 человека, его экспрессия была выявлена только в семенниках в случае здоровых тканей собаки, хотя экспрессию наблюдали и в клетках рака поджелудочной железы. Результаты демонстрируют, что экспрессия CAPRIN-1 не наблюдалась в нормальных тканях, отличных от семенника, между тем как экспрессия CAPRIN-1 наблюдалась в клетках рака поджелудочной железы.
5) Экспрессия CAPRIN-1 в нормальных тканях мыши и собаки
Мышей (Balb/c, самки) и собак (бигль, самки) обескровливали под анестезией простым эфиром и под анестезией смесью кетамин/изофлуран. После лапаратомии каждый из органов (желудок, печень, глазное яблоко, тимус, мышца, костный мозг, матка, тонкий кишечник, пищевод, сердце, почка, слюнная железа, толстый кишечник, молочная железа, головной мозг, легкое, кожа, надпочечник, яичник, поджелудочная железа, селезенка и мочевой пузырь) переносили на 10-см чашку, содержавшую PBS. Каждый орган рассекали в PBS, а затем фиксировали путем перфузии в течение ночи 0,1 M фосфатного буфера (pH 7,4), содержавшего 4% параформальдегид (PFA). Перфузат удаляли, тканевую поверхность каждого органа промывали PBS, а затем раствор PBS, содержавший 10% сахарозу, помещали в 50-мл центрифужную пробирку. Затем в каждую пробирку помещали ткань, а затем проводили встряхивание с использованием ротора при 4°C в течение 2 часов. Каждый раствор заменяли раствором PBS, содержавшим 20% сахарозу, а затем позволяли стоять при 4°C до тех пор, пока ткани не оседали. Каждый раствор заменяли раствором PBS, содержавшим 30% сахарозу, а затем позволяли стоять при 4°C, пока ткани не оседали. Каждую ткань извлекали и необходимую часть вырезали с помощью хирургического скальпеля. Затем наносили соединение OCT (Tissue Tek) и распределяли над поверхностью каждой ткани, а затем ткани помещали на Cryomold. Cryomold помещали на сухой лед для быстрого замораживания. Ткани нарезали на фрагменты длиной 10-20 мкм с использованием криостата (LEICA), затем нарезанные фрагменты ткани сушили воздухом на предметных стеклах в течение 30 минут с использованием фена, и таким образом получали предметные стекла, на которые были нанесены срезы фрагментов тканей. Затем каждое предметное стекло помещали в бутылку для окрашивания, заполненную PBS-T (солевой раствор, содержащий 0,05% Tween 20), каждые 5 минут проводили замену PBS-T на свежий PBS-T, и это действие повторяли 3 раза. Избыток воды вокруг каждого образца удаляли с использованием Kimwipes, а затем каждый срез обводили с использованием DAKOPEN (DAKO). В качестве блокирующих растворов на ткань мыши наносили блокирующий реагент для Ig мыши MOM (VECTASTAIN) и на ткань собаки наносили раствор PBS-T, содержавший 10% эмбриональную телячью сыворотку. Полученным предметным стеклам позволяли стоять во влажной камере при комнатной температуре в течение 1 часа. Затем на каждое предметное стекло наносили раствор, приготовленный из блокирующего раствора с 10 мкг/мл моноклонального антитела против CAPRIN-1 (моноклональное антитело #8), имеющего вариабельную область тяжелой цепи SEQ ID NO: 55 и вариабельную область легкой цепи SEQ ID NO: 56, которое взаимодействует с поверхностью злокачественных клеток, полученных согласно примеру 3, а затем позволяли им стоять во влажной камере при 4°C в течение ночи. После 3 промываний в течение 10 минут PBS-T, на каждое предметное стекло наносили меченное биотином антитело против IgG MOM (VECTASTAIN), разбавленное в 250 раз блокирующим раствором, а затем позволяли им стоять во влажной камере при комнатной температуре в течение 1 часа. После 3 промываний в течение 10 минут PBS-T, наносили реагент авидин-биотин ABC (VECTASTAIN), а затем им позволяли стоять во влажной камере при комнатной температуре в течение 5 минут. После 3 промываний в течение 10 минут PBS-T наносили раствор для окрашивания DAB (10 мг DAB + 10 мкл 30% H2O2, и 50 мл 0,05M Tris-HCl, pH 7,6), а затем предметным стеклам позволяли стоять во влажной камере при комнатной температуре в течение 30 минут. Предметные стекла промывали дистиллированной водой, а затем наносили реагент на основе гематоксилина (DAKO). Предметным стеклам позволяли стоять при комнатной температуре в течение 1 минуты, а затем их промывали дистиллированной водой. Предметные стекла помещали в 70%, 80%, 90%, 95% и 100% растворы этанола в указанном порядке на 1 минуту в каждом случае, а затем позволяли стоять в ксилоле в течение ночи. Предметные стекла удаляли, заливали средой для заливки Glycergel (DAKO), а затем проводили наблюдение. В результате, экспрессию CAPRIN-1 наблюдали в небольшой степени в клетках всех из тканей слюнной железы, почки, толстого кишечника и желудка, однако на поверхностях клеток экспрессии CAPRIN-1 не наблюдали. Также, абсолютно не наблюдали экспрессии CAPRIN-1 в тканях из других органов.
Пример 2. Получение белков CAPRIN-1 собаки и человека
(1) Получение рекомбинантного белка
Рекомбинантный белок получали следующим способом на основе гена SEQ ID NO: 5, полученного согласно примеру 1. ПЦР проводили путем приготовления реакционного раствора, доводя его общее количество до 50 мкл добавлением реагентов и прилагаемого буфера (т.е. 1 мкл вектора, полученного из раствора с фагмидой, полученного согласно примеру 1, а затем подвергнутого анализу последовательности, 2 типа праймеров, содержащих последовательности для расщепления ферментами рестрикции NdeI и KpnI (0,4 мкМ каждого; SEQ ID NO: 37 и 38), 0,2 мМ dNTP, и 1,25 Е полимеразы PrimeSTAR HS (Takara Shuzo, Co., Ltd.)), полученный реакционный раствор подвергали циклу из 98°C в течение 10 секунд и 68°C в течение 1,5 минут с использованием термоциклера (BIO RAD), и этот цикл повторяли 30 раз. Указанные выше 2 типа праймеров использовали для амплификации области, кодирующей полноразмерную аминокислотную последовательность SEQ ID NO: 6 (CAPRIN-1 собаки). После ПЦР амплифицированную ДНК подвергали электрофорезу на 1% агарозном геле, а затем из геля очищали фрагмент ДНК размером приблизительно 1,4 т.п.н. с использованием набора для экстракции из геля QIAquick (QIAGEN).
Очищенный фрагмент ДНК лигировали с клонирующим вектором PCR-Blunt (Invitrogen). Вектор трансформировали в Escherichia coli, плазмиду собирали и секвенированием подтверждали, что амплифицированный фрагмент соответствует последовательности-мишени. Плазмиду, которая соответствовала последовательности-мишени, обрабатывали ферментами рестрикции NdeI и KpnI, полученный материал очищали с использованием набора для экстракции из геля QIAquick, и последовательность гена-мишени встраивали в экспрессирующий вектор pET30b (Novagen) для Escherichia coli, обработанный ферментами рестрикции NdeI и KpnI. С использованием полученного вектора можно получать слитый с His-меткой рекомбинантный белок. Плазмиду трансформировали в Escherichia coli BL21 (DE3) для экспрессии, и белок-мишень индуцировали для экспрессии в Escherichia coli с помощью 1 мМ IPTG.
Отдельно получали рекомбинантный белок гена гомолога собаки на основе гена SEQ ID NO: 7 следующим способом. ПЦР проводили путем приготовления реакционного раствора, доводя его общее количество до 50 мкл добавлением реагентов и прилагаемого буфера (т.е. 1 мкл ДНК, экспрессия которой была подтверждена ОТ-ПЦР, выбранная из различных тканей, и клеточная кДНК, полученная согласно примеру 1, 2 типа праймеров, содержащих последовательности для расщепления ферментами рестрикции NdeI и KpnI (0,4 мкМ каждого; SEQ ID NO: 39 и 40), 0,2 мМ dNTP, и 1,25 Е полимеразы PrimeSTAR HS (Takara Shuzo, Co., Ltd.)), полученный реакционный раствор подвергали циклу из 98°C в течение 10 секунд и 68°C в течение 2,5 минут с использованием термоциклера (BIO RAD), и этот цикл повторяли 30 раз. Указанные выше 2 типа праймеров использовали для амплификации области, кодирующей полноразмерную аминокислотную последовательность SEQ ID NO: 8. После ПЦР амплифицированную ДНК подвергали электрофорезу на 1% агарозном геле, а затем из геля очищали фрагмент ДНК размером приблизительно 2,2 т.п.н. с использованием набора для экстракции из геля QIAquick (QIAGEN).
Очищенный фрагмент ДНК лигировали с клонирующим вектором PCR-Blunt (Invitrogen). Вектор трансформировали в Escherichia coli, плазмиду собирали и секвенированием подтверждали, что амплифицированный фрагмент соответствует последовательности-мишени. Плазмиду, которая соответствовала последовательности-мишени, обрабатывали ферментами рестрикции NdeI и KpnI, полученный материал очищали с использованием набора для экстракции из геля QIAquick, и последовательность гена-мишени встраивали в экспрессирующий вектор pET30b (Novagen) для Escherichia coli, обработанный ферментами рестрикции NdeI и KpnI. С использованием полученного вектора можно получать слитый с His-меткой рекомбинантный белок. Плазмиду трансформировали в Escherichia coli BL21 (DE3) для экспрессии, и белок-мишень индуцировали для экспрессии в Escherichia coli с помощью 1 мМ IPTG.
Отдельно получали рекомбинантный белок гена гомолога человека на основе гена SEQ ID NO: 1 следующим способом. ПЦР проводили путем приготовления реакционного раствора, доводя его общее количество до 50 мкл добавлением реагентов и прилагаемого буфера (т.е. 1 мкл ДНК, экспрессия которой была подтверждена ОТ-ПЦР, выбранная из различных тканей, и клеточная кДНК, полученная согласно примеру 1, 2 типа праймеров, содержащих последовательности для расщепления ферментами рестрикции SacI и XhoI (0,4 мкМ каждого; SEQ ID NO: 41 и 42), 0,2 мМ dNTP, и 1,25 Е полимеразы PrimeSTAR HS (Takara Shuzo, Co., Ltd.)), полученный реакционный раствор подвергали циклу из 98°C в течение 10 секунд и 68°C в течение 2,5 минут с использованием термоциклера (BIO RAD), и этот цикл повторяли 30 раз. Указанные выше 2 типа праймеров использовали для амплификации области, кодирующей полноразмерную аминокислотную последовательность SEQ ID NO: 2. После ПЦР амплифицированную ДНК подвергали электрофорезу на 1% агарозном геле, а затем из геля очищали фрагмент ДНК размером приблизительно 2,1 т.п.н. с использованием набора для экстракции из геля QIAquick (QIAGEN).
Очищенный фрагмент ДНК лигировали с клонирующим вектором PCR-Blunt (Invitrogen). Вектор трансформировали в Escherichia coli, плазмиду собирали и секвенированием подтверждали, что амплифицированный фрагмент соответствует последовательности-мишени. Плазмиду, которая соответствовала последовательности-мишени, обрабатывали ферментами рестрикции SacI и XhoI, полученный материал очищали с использованием набора для экстракции из геля QIAquick, и последовательность гена-мишени встраивали в экспрессирующий вектор pET30a (Novagen) для Escherichia coli, обработанный ферментами рестрикции SacI и XhoI. С использованием полученного вектора можно получать слитый с His-меткой рекомбинантный белок. Плазмиду трансформировали в Escherichia coli BL21 (DE3) для экспрессии, и белок-мишень индуцировали для экспрессии в Escherichia coli с помощью 1 мМ IPTG.
(2) Очистка рекомбинантного белка
Рекомбинантный штамм Escherichia coli, экспрессирующий SEQ ID NO: 1, 5 или 7, полученный, как описано выше, культивировали при 37°C в среде LB, содержавшей 30 мкг/мл канамицина до тех пор, пока поглощение при 600 нм не достигало приблизительно 0,7. После этого добавляли изопропил-β-D-1-тиогалактопиранозид до конечной концентрации 1 мМ, и культивирование проводили при 37°C в течение 4 часов. Затем культуру центрифугировали при 4800 об./мин. в течение 10 минут для сбора клеток. Клеточный осадок суспендировали в фосфатно-солевом буфере, а затем центрифугировали при 4800 об./мин. в течение 10 минут для промывания клеток.
Клетки суспендировали в фосфатно-солевом буфере, а затем подвергали обработке ультразвуковым излучением на льду. Обработанный ультразвуковым излучением раствор с Escherichia coli центрифугировали при 6000 об./мин. в течение 20 минут, полученный супернатант обозначили как растворимая фракция, а полученный осадок обозначили как нерастворимая фракция.
Растворимую фракцию наносили на никель-хелатирующую колонку (носитель: Chelating SepharoseTM Fast Flow (GE Healthcare), емкость колонки: 5 мл, буфер на основе 50 мМ хлористоводородной кислоты (pH 8,0) в качестве уравновешивающего буфера)), приготовленную в соответствии с общепринятым способом. Неадсорбированную фракцию промывали 10 объемами колонки буфера на основе 50 мМ хлористоводородной кислоты (pH 8,0) и 20 мМ фосфатного буфера (pH 8,0), содержавшего 20 мМ имидазола. Сразу после этого элюировали 6 слоев 20 мМ фосфатным буфером (pH 8,0), содержавшим 100 мМ имидазола. После, того, как элюирование представляющего интерес белка было подтверждено окрашиванием Кумасси, элюированную фракцию 20 мМ фосфатного буфера (pH 8,0), содержавшего 100 мМ имидазола, наносили на сильную анионообменную колонку (носитель: Q SepharoseTM Fast Flow (GE Healthcare), объем колонки: 5 мл, и 20 мМ фосфатный буфер (pH 8,0) в качестве уравновешивающего буфера). Неадсорбированную фракцию промывали 10 объемами колонки 20 мМ фосфатного буфера (pH 7,0) и 20 мМ фосфатного буфера (pH 7,0), содержавшего 200 мМ хлорида натрия. Сразу после этого элюировали 5 слоев с использованием 20 мМ фосфатного буфера (pH 7,0), содержавшего 400 мМ хлорида натрия. Таким образом, получали очищенные фракции белков, имеющих аминокислотные последовательности, соответствующие SEQ ID NO: 2, 6 и 8, и эти очищенные фракции использовали впоследствии в качестве материалов для исследования введения.
Каждый из очищенных препаратов, полученных описанным выше способом (200 мкл каждого) распределяли в 1 мл реакционного буфера (20 мМ Tris-HCl, 50 мМ NaCl, 2 мМ CaCl2, pH 7,4), а затем добавляли 2 мкл энтерокиназы (Novagen). Препарату позволяли стоять при комнатной температуре в течение ночи для реакции, отщепляли His-метку, а затем проводили очистку в соответствии с протоколами, прилагаемыми к набору Enterokinase Cleavage Capture Kit (Novagen). Затем 1,2 мл очищенного препарата, полученного описанным выше способом, заменяли на физиологический фосфатный буфер (Nissui Pharmaceutical Co., Ltd.) с использованием ультрафильтрации NANOSEP 10K OMEGA (PALL). Проводили стерилизацию фильтрованием с использованием 0,22-мкм HT Tuffryn Acrodisc (PALL), и полученные материалы использовали в последующих экспериментах.
Пример 3. Получение антитела против CAPRIN-1
(1) Получение поликлонального антитела против пептида, происходящего из CAPRIN-1
Для получения антитела, связывающегося с CAPRIN-1, синтезировали пептид, происходящий из CAPRIN-1 (Arg-Asn-Leu-Glu-Lys-Lys-Lys-Gly-Lys-Leu-Asp-Asp-Tyr-Gln; SEQ ID NO: 43). Пептид в качестве антигена (1 мг) смешивали с эквивалентным объемом раствора неполного адъюванта Фрейнда (IFA), и смесь подкожно вводили кролику 4 раза каждые 2 недели. После этого проводили взятие крови и получали антисыворотку, содержащую поликлональное антитело. Далее антисыворотку очищали с использованием белка G-носителя (GE Healthcare Bio-Sciences), а затем получали поликлональное антитело против пептида, происходящего из CAPRIN-1. Затем исследовали реактивность полученного поликлонального антитела в отношении CAPRIN-1 на поверхности злокачественных клеток с использованием клеток рака молочной железы. В частности, 106 клеток клеточной линии рака молочной железы человека MDA-MB-231 V подвергали центрифугированию в 1,5-мл микроцентрифужной пробирке, добавляли раствор PBS, дополненный 0,1% эмбриональной телячьей сывороткой (FBS), содержащий поликлональное антитело, а затем полученному материалу позволяли стоять на льду в течение 1 часа. После промывания PBS, к раствору добавляли меченное FITC антитело козы против IgG мыши (Invitrogen), разбавленное в 500 раз с помощью PBS, содержавшего 0,1% FBS, а затем раствору позволяли стоять на льду в течение 1 часа. После промывания PBS измеряли интенсивность флуоресценции с использованием FACS Calibur (Becton, Dickinson and Company). Отдельно получали контроль в соответствии с методикой, аналогичной методике, описанной выше, за исключением, того, что вместо поликлонального антитела добавляли PBS, содержавший 0,1% FBS. В результате было выявлено, что интенсивность флуоресценции в клетках, обработанных поликлональным антителом, была более высокой, чем в контрольных клетках, и, таким образом, было выявлено, что полученное поликлональное антитело связывается с поверхностью клеток рака молочной железы.
(2) Получение моноклонального антитела против белка CAPRIN-1
Антигенный белок (CAPRIN-1 человека) (100 мкг) соответствующий SEQ ID NO: 2, полученный согласно примеру 2, смешивали с эквивалентным количеством адъюванта MPL+TDM (Sigma), и эту смесь использовали в качестве антигенного раствора на мышь. Антигенный раствор вводили внутрибрюшинно мыши Balb/c в возрасте 6 недель (Japan SLC Inc.), а затем вводили 3 раза каждую неделю. Через 3 суток после последней иммунизации селезенку извлекали, растирали между стерильными предметными стеклами, промывали PBS (-) (Nissui), а затем центрифугировали при 1500 об./мин. в течение 10 минут для удаления супернатантов. Это действие повторяли 3 раза, получая клетки селезенки. Полученные таким образом клетки селезенки смешивали с клетками миеломы мыши SP2/0 (приобретенные от ATCC) в соотношении 10:1. К клеткам добавляли раствор PEG, полученный смешением 200 мкл среды RPMI1640, содержавшей 10% FBS, нагретой до 37°C, и 800 мкл PEG1500 (Boehringer). Раствору позволяли стоять в течение 5 минут для слияния клеток. Центрифугирование проводили при 1700 об./мин. в течение 5 минут для удаления супернатантов, клетки суспендировали в 150 мл среды RPMI1640 (селективная среда HAT), содержавшей 15% FBS, дополненной 2% эквивалентом раствора HAT (Gibco), а затем суспензию высевали в пятнадцать 96-луночных планшетов (Nunc) в количестве 100 мкл/лунка. Клетки культивировали в течение 7 суток при 37°C в присутствии 5% CO2. Таким образом, получали гибридомы, полученные слиянием клеток селезенки с клетками миеломы.
Гибридомы отбирали с использованием, в качестве показателя, аффинности связывания антитела, продуцируемого полученными гибридомами, в отношении белка CAPRIN-1. Раствор белка CAPRIN-1 (1 мкг/мл), полученный согласно примеру 2, добавляли в 96-луночный планшет в количестве 100 мкл/лунка, и полученному материалу позволяли стоять при 4°C в течение 18 часов. Каждую лунку промывали 3 раза PBS-T, добавляли 0,5% раствор бычьего сывороточного альбумина (BSA) (Sigma) в количестве 400 мкл/лунка, а затем планшету позволяли стоять при комнатной температуре в течение 3 часов. Раствор удаляли и каждую лунку промывали 3 раза 400 мкл PBS-T. Затем добавляли каждый культуральный супернатант гибридом, полученных, как описано выше, в количестве 100 мкл/лунка, а затем полученному материалу позволяли стоять при комнатной температуре в течение 2 часов. Каждую лунку промывали 3 раза PBS-T, добавляли меченное HRP антитело против IgG мыши (H+L) (Invitrogen), разбавленное в 5000 раз PBS в количестве 100 мкл/лунка, и полученному материалу позволяли стоять при комнатной температуре в течение 1 часа. Каждую лунку промывали 3 раза PBS-T, а затем добавляли раствор субстрата TMB (Thermo) в количестве 100 мкл на лунку, и полученному материалу позволяли стоять в течение 15-30 минут, чтобы обеспечить развитие цвета. После этого добавляли 1 Н серную кислоту в количестве 100 мкл/лунка для завершения реакции. Поглощение измеряли при 450 нм и 595 нм с использованием спектрофотометра. В результате было выбрано множество гибридом, продуцирующих антитела, проявляющие высокие величины поглощения.
Выбранные таким образом гибридомы добавляли в 96-луночный планшет в количестве 0,5 гибридом на лунку, а затем культивировали. Через 1 неделю наблюдали гибридомы, образующие единичные колонии. Клетки в этих лунках далее культивировали, и отбирали гибридомы с использованием, в качестве показателя, аффинности связывания антитела, продуцируемого клонированными гибридомами в отношении белка CAPRIN-1. Раствор белка CAPRIN-1 (1 мкг/мл), полученный согласно примеру 2, добавляли в 96-луночный планшет в количестве 100 мкл/лунка, и полученному материалу позволяли стоять при 4°C в течение 18 часов. Каждую лунку промывали 3 раза PBS-T, добавляли 0,5% раствор BSA в количестве 400 мкл/лунка, а затем планшету позволяли стоять при комнатной температуре в течение 3 часов. Раствор удаляли и каждую лунку промывали 3 раза 400 мкл PBS-T. Затем добавляли каждый культуральный супернатант гибридом, полученных, как описано выше, в количестве 100 мкл/лунка, а затем полученному материалу позволяли стоять при комнатной температуре в течение 2 часов. Каждую лунку промывали 3 раза PBS-T, добавляли меченное HRP антитело против IgG мыши (H+L) (Invitrogen), разбавленное в 5000 раз PBS в количестве 100 мкл/лунка, и полученному материалу позволяли стоять при комнатной температуре в течение 1 часа. Каждую лунку промывали 3 раза PBS-T, а затем добавляли раствор субстрата TMB (Thermo) в количестве 100 мкл на лунку, и полученному материалу позволяли стоять в течение 15-30 минут, чтобы обеспечить развитие цвета. После этого добавляли 1 Н серную кислоту в количестве 100 мкл/лунка для завершения реакции, и поглощение измеряли при 450 нм и 595 нм с использованием спектрофотометра. В результате было выбрано множество гибридом, продуцирующих моноклональные антитела, проявляющие реактивность в отношении белка CAPRIN-1, культуральные супернатанты гибридом очищали с использованием белка G-носителя, и получили 150 моноклональных антител, связывающихся с белком CAPRIN-1.
Затем, из этих моноклональных антител отбирали моноклональные антитела, проявляющие реактивность в отношении поверхностей злокачественных клеток, экспрессирующих CAPRIN-1, с использованием клеток рака молочной железы. В частности, 106 клеток клеточной линии рака молочной железы MDA-MB-231 V подвергали центрифугированию в 1,5-мл микроцентрифужной пробирке, добавляли 100 мкл культурального супернатанта, а затем полученному материалу позволяли стоять на льду в течение 1 часа. После промывания PBS, к раствору добавляли меченное FITC антитело козы против IgG мыши (Invitrogen), разбавленное в 500 раз PBS, содержавшим 0,1% FBS, а затем раствору позволяли стоять на льду в течение 1 часа. После промывания PBS измеряли интенсивность флуоресценции с использованием FACS Calibur (Becton, Dickinson and Company). Отдельно получали контроль в соответствии с методикой, сходной с методикой, описанной выше, за исключением того, что вместо антитела добавляли среду. В результате было отобрано 10 моноклональных антител, проявляющих более высокую интенсивность флуоресценции, чем контроль; т.е. 10 моноклональных антител, проявляющих реактивность в отношении поверхности клеток рака молочной железы (#1-#10). Вариабельные области тяжелой цепи и вариабельные области легкой цепи этих моноклональных антител представлены в SEQ ID NO: 44-60. Указанное выше моноклональное антитело #1 содержит вариабельную область тяжелой цепи SEQ ID NO: 44 и вариабельную область легкой цепи SEQ ID NO: 45, моноклональное антитело #2 содержит вариабельную область тяжелой цепи SEQ ID NO: 44 и вариабельную область легкой цепи SEQ ID NO: 46, моноклональное антитело #3 содержит вариабельную область тяжелой цепи SEQ ID NO: 44 и вариабельную область легкой цепи SEQ ID NO: 47, моноклональное антитело #4 содержит вариабельную область тяжелой цепи SEQ ID NO: 44 и вариабельную область легкой цепи SEQ ID NO: 48, моноклональное антитело #5 содержит вариабельную область тяжелой цепи SEQ ID NO: 49 и вариабельную область легкой цепи SEQ ID NO: 50, моноклональное антитело #6 содержит вариабельную область тяжелой цепи SEQ ID NO: 51 и вариабельную область легкой цепи SEQ ID NO: 52, моноклональное антитело #7 содержит вариабельную область тяжелой цепи SEQ ID NO: 53 и вариабельную область легкой цепи SEQ ID NO: 54, моноклональное антитело #8 содержит вариабельную область тяжелой цепи SEQ ID NO: 55 и вариабельную область легкой цепи SEQ ID NO: 56, моноклональное антитело #9 содержит вариабельную область тяжелой цепи SEQ ID NO: 57 и вариабельную область легкой цепи SEQ ID NO: 58, и моноклональное антитело #10 содержит вариабельную область тяжелой цепи SEQ ID NO: 59 и вариабельную область легкой цепи SEQ ID NO: 60.
(3) Идентификация пептидов в белке CAPRIN-1, с которыми связываются антитела против CAPRIN-1, взаимодействующие с поверхностью клеток рака молочной железы
С использованием моноклональных антител #1-#10 против CAPRIN-1, взаимодействующих с поверхностью клеток рака молочной железы, полученных, как описано выше, идентифицировали частичные последовательности в белке CAPRIN-1, распознаваемые этими моноклональными антителами.
К 100 мкл раствора рекомбинантного белка CAPRIN-1, доведенного до концентрации 1 мкг/мкл с помощью PBS, сначала добавляли DTT (Fluka) до конечной концентрации 10 мМ, и реакции позволяли протекать при 95°C в течение 5 минут, чтобы восстановить дисульфидные связи в белке CAPRIN-1. Затем добавляли йодацетамид (конечная концентрация: 20 мМ; Wako Pure Chemical Industries, Ltd.), и тиольные группы подвергали алкилированию при 37°C в течение 30 минут в условиях затемнения. Моноклональные антитела #1-#10 против CAPRIN-1 (50 мкг каждого) добавляли к 40 мкг восстановленного-алкилированного белка CAPRIN-1, объем смеси доводили до 1 мл 20 мМ фосфатным буфером (pH 7,0), и реакции позволяли протекать при 4°C при взбалтывании и перемешивании.
Затем добавляли трипсин (Promega) до конечной концентрации 0,2 мкг. Реакции позволяли протекать при 37°C в течение 1 часа, 2 часов, 4 часов, а затем 12 часов, полученные материалы смешивали со стеклянными гранулами с белком A (GE), которые были предварительно блокированы PBS, содержавшим 1% BSA (Sigma) и промыты PBS, в 1 мМ карбонате кальция и буфере NP-40 (20 мМ фосфатный буфер (pH 7,4), 5 мМ EDTA, 150 мМ NaCl и 1% NP-40), и реакции позволяли далее протекать в течение 30 минут.
Каждый из реакционных растворов промывали 25 мМ аммоний-карбонатным буфером (pH 8,0), затем комплексы антиген-антитело элюировали с использованием 100 мкл 0,1% муравьиной кислоты, и элюиты подвергали анализу LC-MS с использованием Q-TOF Premier (Waters-MicroMass) в соответствии с протоколами, прилагаемыми к устройству.
В результате, полипептид SEQ ID NO: 61 был идентифицирован в качестве частичной последовательности CAPRIN-1, которая распознавалась всеми из моноклональных антител #1-#10 против CAPRIN-1. Далее, пептид SEQ ID NO: 62 был идентифицирован в качестве частичной последовательности в полипептиде SEQ ID NO: 61, указанном выше, которая распознавалась моноклональными антителами #1-#4, #5-#7 и #9. Кроме того, было выявлено, что моноклональные антитела #1-#4 распознают пептид SEQ ID NO: 63, который был его частичной пептидной последовательностью.
Пример 4. Диагностика рака поджелудочной железы с использованием полипептида CAPRIN-1
1) Диагностика рака поджелудочной железы собаки
В результате патологической диагностики с использованием извлеченных образцов опухолевой ткани, были взяты образцы крови от больных собак, для которых было подтверждено, что они имеют злокачественную протоковую карциному поджелудочной железы, и выделяли сыворотку. С использованием белка CAPRIN-1 собаки (SEQ ID NO: 8), полученного согласно примеру 2, и антитела против IgG собаки, определяли титр сывороточных IgG-антител, специфически взаимодействующих с белком CAPRIN-1 собаки, способом ELISA.
Полученный белок CAPRIN-1 собаки иммобилизовывали добавлением раствора рекомбинантного белка, разбавленного до 5 мкг/мл фосфатно-солевым буфером, в 96-луночный планшет Immobilizer Amino Plate (Nunc) в количестве 100 мкл/лунка, а затем позволяя планшету стоять при 4°C в течение ночи. Блокирование проводили путем добавления 50 мМ натрий-бикарбонатного буферного раствора (pH 8,4) (далее называемый "блокирующим раствором"), содержавшего 0,5% BSA (бычий сывороточный альбумин, Sigma Aldrich Japan) в количестве 100 мкл/лунка, а затем проводили встряхивание при комнатной температуре в течение 1 часа. Добавляли сыворотку, разбавленную в 1000 раз блокирующим раствором, в количестве 100 мкл/лунка, а затем смесь подвергали реакции путем встряхивания при комнатной температуре в течение 3 часов. Продукт реакции промывали 3 раза фосфатно-солевым буфером, содержавшим 0,05% Tween 20 (Wako Pure Chemical Industries, Ltd.; этот раствор в настоящем описании обозначается как "PBS-T"), добавляли модифицированное HRP антитело против IgG собаки (антитело козы против IgG-h+I собаки, конъюгированное с HRP: BETHYL Laboratories), разбавленное в 3000 раз блокирующим раствором, в количестве 100 мкл/лунка, и смесь подвергали реакции при встряхивании при комнатной температуре в течение 1 часа. Продукт реакции промывали 3 раза PBS-T, а затем добавляли раствор субстрата HRP TMB (1-Step Turbo TMB (тетраметилбензидин), PIERCE) в количестве 100 мкл/лунка, а затем проводили фермент-субстратную реакцию при комнатной температуре в течение 30 минут. После этого добавляли 0,5 M раствор серной кислоты (Sigma Aldrich Japan) в количестве 100 мкл/лунка для завершения реакции, и определяли поглощение при 450 нм с использованием устройства для считывания микропланшетов. В качестве контролей, образец, на котором не был иммобилизован полученный рекомбинантный белок, и образец, с которым не позволяли реагировать сыворотке собаки, имеющей злокачественную опухоль, подвергали обработке и сравнению аналогично тому, как описано выше.
В результате, было обнаружено, что титр антитела против белка CAPRIN-1 в сыворотке, полученной от собак, имеющих злокачественную опухоль, является более высоким, чем в контролях.
(2) Диагностика рака поджелудочной железы у собак с использованием белка CAPRIN-1 человека
С использованием белка CAPRIN-1 человека (SEQ ID NO: 2), полученного согласно примеру 2, в сыворотке собак измеряли титр IgG-антител, взаимодействующих с белком CAPRIN-1 человека, аналогично тому, как описано выше. Когда образцы сыворотки, полученные от здоровых собак, подвергали тому же измерению, поглощения при 450 нм по существу не наблюдали, как описано выше. Образцы сыворотки, полученные от собак с раком поджелудочной железы согласно (1), проявляли более высокий титр антитела против белка CAPRIN-1 человека, чем у контроля.
(3) Диагностика рака поджелудочной железы человека
С использованием белка CAPRIN-1 человека (SEQ ID NO: 2), полученного согласно примеру 2, и антитела против IgG человека, определяли титр IgG-антител в образцах сыворотки, полученных от здоровых индивидуумов, взаимодействующих с полипептидом. Белок CAPRIN-1 человека иммобилизовывали добавлением раствора рекомбинантного белка, разбавленного до 100 мкг/мл фосфатно-солевым буфером, в 96-луночный планшет Immobilizer Amino Plate (Nunc) в количестве 100 мкл/лунка, а затем позволяя планшету стоять при 4°C в течение ночи. Блокирование проводили следующим образом. Соответственно, 4 г порошка Block Ace (DS PHARMA BIOMEDICAL Co., Ltd.) растворяли в 100 мл очищенной воды, раствор разбавляли в 4 раза очищенной водой (далее, называемый "блокирующим раствором"), блокирующий раствор добавляли в количестве 100 мкл/лунка, и смесь подвергали встряхиванию при комнатной температуре в течение 1 часа. Добавляли сыворотку, разбавленную в 1000 раз блокирующим раствором, в количестве 100 мкл/лунка, а затем подвергали взаимодействию при встряхивании при комнатной температуре в течение 3 часов. Полученный материал промывали 3 раза фосфатно-солевым буфером, содержавшим 0,05% Tween 20 (Wako Pure Chemical Industries, Ltd.; этот раствор в настоящем описании обозначается как "PBS-T"), добавляли модифицированное HRP антитело против IgG человека (HRP-антитело козы против IgG (H+L) человека, конъюгат: Zymed Laboratories), разбавленное в 10000 раз блокирующим раствором, в количестве 100 мкл/лунка, а затем подвергали реакции при встряхивании при комнатной температуре в течение 1 часа. Продукт реакции промывали 3 раза PBS-T, а затем добавляли субстрат HRP TMB (1-Step Turbo TMB (тетраметилбензидин), PIERCE) в количестве 100 мкл/лунка, а затем проводили фермент-субстратную реакцию при комнатной температуре в течение 30 минут. После этого добавляли 0,5 M раствор серной кислоты (Sigma Aldrich Japan) в количестве 100 мкл/лунка для завершения реакции, и определяли поглощение при 450 нм с использованием устройства для считывания микропланшетов. Антиген овальбумина, доведенный до 50 мкг/мл фосфатно-солевым буфером, иммобилизовывали, а затем использовали в качестве положительного контроля. В результате, было выявлено, что поглощение при 450 является высоким в случае антигена овальбумина, хотя не было выявлено поглощения (0) в случае белка CAPRIN-1 человека.
Далее образцы сыворотки, полученные от пациентов с протоковой карциномой поджелудочной железы, подвергали измерению титра сывороточных IgG-антител, специфически взаимодействующих с белком CAPRIN-1 человека (аминокислотная последовательность SEQ ID NO: 2) аналогично тому, как описано выше. В результате, было выявлено, что поглощение при 450 нм является более низким, чем наиболее низкий предел обнаружения в случае здоровых индивидуумов, хотя было выявлено, что он был высоким в случае пациентов с раком поджелудочной железы. С использованием белка CAPRIN-1 собаки (SEQ ID NO: 8), полученного согласно примеру 2, и антитела против IgG человека, определяли титр сывороточных IgG-антител человека, специфически взаимодействующих с белком CAPRIN-1 собаки, аналогично тому, как описано выше. В результате, было выявлено, что пациенты с раком поджелудочной железы обладают более высокими титрами, чем здоровые индивидуумы.
Таким образом, было продемонстрировано, что способом по настоящему изобретению можно обнаруживать рак поджелудочной железы.
Пример 5. Диагностика рака поджелудочной железы с использованием антитела против CAPRIN-1
(1) Диагностика рака поджелудочной железы путем определения белка CAPRIN-1
С использованием поликлонального антитела против пептида, происходящего из CAPRIN-1 (SEQ ID NO: 43), полученного согласно примеру 3 (1), в комбинации с каждым моноклональным антителом против белка CAPRIN-1, полученным согласно примеру 3 (2), проводили сэндвич-ELISA для выявления белка CAPRIN-1 (сыворотка от индивидуума со злокачественной опухолью) с положительной реакцией при диагностике злокачественной опухоли с использованием белка CAPRIN-1 согласно примеру 4 (1)-(3). В качестве первичного антитела использовали поликлональное антитело, и каждое моноклональное антитело использовали в качестве вторичного антитела. Определяли количество белков, специфически реагирующих с каждым из описанных выше антител в сыворотке.
Первичное антитело иммобилизовывали добавлением раствора поликлонального антитела, разбавленного до 5 мкг/мл фосфатно-солевым буфером, в 96-луночный планшет Immobilizer Amino Plate (Nunc) в количестве 100 мкл/лунка, и встряхиванием планшета при комнатной температуре в течение 2 часов. Блокирование проводили путем добавления 50 мМ натрий-бикарбонатного буферного раствора (pH 8,4) (далее называемого "блокирующим раствором"), содержавшего 0,5% BSA (бычий сывороточный альбумин, Sigma Aldrich Japan) в количестве 100 мкл/лунка, с последующим встряхиванием при комнатной температуре в течение 1 часа. После этого, добавляли образцы сыворотки, полученные от индивидуумов со злокачественной опухолью, разбавленные блокирующим раствором в количестве 100 мкл/лунка, а затем подвергали взаимодействию при встряхивании при комнатной температуре в течение 3 часов. Степень разведения в это время изменяли посредством серии 10-кратных разведений (т.е. разведений в 10-1000 раз). Продукт реакции промывали 3 раза фосфатно-солевым буфером, содержавшим 0,05% Tween 20 (Wako Pure Chemical Industries, Ltd.; этот раствор в настоящем описании обозначается как "PBS-T"), добавляли каждое моноклональное антитело в качестве вторичного антитела, разбавленное до концентрации 1 мкг/мл блокирующим раствором, в количестве 100 мкл/лунка, а затем полученный материал подвергали встряхиванию при комнатной температуре в течение 1 часа для взаимодействия. Продукт реакции промывали 3 раза PBS-T, добавляли меченное HRP антитело против IgG мыши (H+L) (Invitrogen) в качестве третичного антитела, разбавленное в 5000 раз блокирующим буфером, в количестве 100 мкл/лунка, а затем полученному материалу позволяли стоять при комнатной температуре в течение 1 часа. Каждую лунку промывали 3 раза PBS-T, а затем добавляли раствор субстрата TMB (Thermo) в количестве 100 мкл на лунку, и полученному материалу позволяли стоять в течение 15-30 минут, позволяя развитие цвета. После этого добавляли 1 Н серную кислоту в количестве 100 мкл/лунка для завершения реакции. Поглощение измеряли при 450 нм с использованием спектрофотометра.
Когда моноклональные антитела #1-#10, реагирующие с поверхностью злокачественных клеток, использовали в качестве вторичных антител, в результате были обнаружены высокие величины поглощения для всех собак с протоковой карциномой поджелудочной железы, хотя поглощение не обнаруживалось в случае здоровых собак. Когда моноклональные антитела, которые взаимодействуют с белком CAPRIN-1, но не взаимодействуют с поверхностью злокачественных клеток, использовали в качестве вторичных антител, некоторые количества полипептида были выявлены во всех образцах. Однако все величины поглощения были ниже предела обнаружения, т.е. были ниже результатов для комбинаций антител, взаимодействующих с поверхностями злокачественных клеток.
Таким образом, злокачественную опухоль также можно диагностировать или исследовать с помощью этого способа, который включает обнаружение белков CAPRIN-1 с использованием антител против CAPRIN-1.
(2) Диагностика или исследование злокачественной опухоли путем определения антигенного полипептида на ткани рака поджелудочной железы с помощью иммуногистохимического окрашивания
Иммуногистохимическое окрашивание проводили с использованием матрицы (BIOMAX), имеющей 101 образец залитой парафином ткани рака поджелудочной железы человека. Матрицу тканей рака поджелудочной железы человека обрабатывали при 60°C в течение 3 часов, полученный материал помещали в бутылку для окрашивания, заполненную ксилолом, ксилол заменяли на свежий ксилол каждые 5 минут, и это действие повторяли 3 раза. Затем сходные действия проводили с использованием этанола и PBS-T вместо ксилола. Матрицу тканей рака поджелудочной железы человека помещали в бутылку для окрашивания, заполненную 10 мМ цитратным буфером (pH 6,0), содержавшим 0,05% Tween 20, обрабатывали при 125°C в течение 5 минут, а затем позволяли стоять при комнатной температуре в течение 40 минут или более. Избыток воды вокруг каждого образца удаляли с использованием Kimwipes, каждый срез обводили с помощью DAKOPEN (DAKO), а затем на матрицу капельно добавляли соответствующее количество Peroxidase Block (DAKO). Матрице позволяли стоять при комнатной температуре в течение 5 минут, матрицу помещали в бутылку для окрашивания, заполненную PBS-T, и PBS-T заменяли свежим PBS-T каждые 5 минут. Это действие повторяли 3 раза. В качестве блокирующего раствора на матрицу наносили раствор PBS-T, содержавший 10% FBS, а затем матрице позволяли стоять во влажной камере при комнатной температуре в течение 1 часа. Затем на матрицу наносили моноклональные антитела #1-#10, полученные согласно примеру 3, в доведенные до концентрации 10 мкг/мл раствором PBS-T, содержавшим 5% FBS, и матрице позволяли стоять во влажной камере при 4°C в течение ночи. Матрицу промывали PBS-T в течение 10 минут 3 раза, на матрицу капельно добавляли соответствующее количество Peroxidase Labeled Polymer Conjugated (DAKO), и матрице позволяли стоять во влажной камере при комнатной температуре в течение 30 минут. Матрицу промывали PBS-T в течение 10 минут 3 раза, а затем на матрицу наносили раствор для развития цвета DAB (DAKO), а затем матрице позволяли стоять при комнатной температуре в течение приблизительно 10 минут. Раствор для развития цвета удаляли, а затем матрицу промывали PBS-T в течение 10 минут 3 раза, ополаскивали дистиллированной водой, последовательно помещали в 70%, 80%, 90%, 95% и 100% растворы этанола на 1 минуту в каждом случае, а затем позволяли стоять в ксилоле в течение ночи. Предметные стекла извлекали, заливали средой для заливки Glycergel (DAKO), а затем проводили наблюдение. В результате, экспрессию CAPRIN-1 наблюдали на мембранах клеток рака поджелудочной железы и в клетках рака поджелудочной железы в образцах тканей рака поджелудочной железы, с использованием любых антител. Когда иммуногистохимическое окрашивание проводили с использованием антитела #8, например, наблюдали высокую экспрессию CAPRIN-1 в 54 образцах среди всех образцов тканей рака поджелудочной железы (101 образец) (т.е. 54%).
Аналогично, иммуногистохимическое окрашивание проводили с использованием матрицы (BIOMAX) залитых парафином нормальных тканей человека, включающих нормальные ткани поджелудочной железы человека. Избыток воды вокруг каждого образца удаляли с использованием Kimwipes, каждый срез обводили с помощью DAKOPEN (DAKO), а затем на матрицу капельно добавляли соответствующее количество Peroxidase Block (DAKO). Матрице позволяли стоять при комнатной температуре в течение 5 минут, матрицу помещали в бутылку для окрашивания, заполненную PBS-T, и PBS-T заменяли свежим PBS-T каждые 5 минут. Это действие повторяли 3 раза. В качестве блокирующего раствора на матрицу наносили раствор PBS-T, содержавший 10% FBS, а затем матрице позволяли стоять во влажной камере при комнатной температуре в течение 1 часа. Затем на матрицу наносили моноклональные антитела #1-#10, полученные согласно примеру 3, в доведенные до концентрации 10 мкг/мл раствором PBS-T, содержавшим 5% FBS, и матрице позволяли стоять во влажной камере при 4°C в течение ночи. Матрицу промывали PBS-T в течение 10 минут 3 раза, на матрицу капельно добавляли соответствующее количество Peroxidase Labeled Polymer Conjugated (DAKO), и матрице позволяли стоять во влажной камере при комнатной температуре в течение 30 минут. Матрицу промывали PBS-T в течение 10 минут 3 раза, а затем на матрицу наносили раствор для развития цвета DAB (DAKO), а затем матрице позволяли стоять при комнатной температуре в течение приблизительно 10 минут. Раствор для развития цвета удаляли, а затем матрицу промывали PBS-T в течение 10 минут 3 раза, ополаскивали дистиллированной водой, последовательно помещали в 70%, 80%, 90%, 95% и 100% растворы этанола на 1 минуту в каждом случае, а затем позволяли стоять в ксилоле в течение ночи. Предметные стекла извлекали, заливали средой для заливки Glycergel (DAKO), а затем проводили наблюдение. В результате, ни одна из происходящих из поджелудочной железы нормальных тканей не окрашивалась, и не наблюдали экспрессии CAPRIN-1, независимо от того, какое использовали антитело.
Промышленная применимость
Настоящее изобретение является промышленно применимым для диагностики или обнаружения рака поджелудочной железы.
Все публикации, патенты и патентные заявки, цитированные в настоящем описании, включены в настоящее описание в качестве ссылок в полном объеме.
Свободный текст списка последовательностей
SEQ ID NO: 31-42: праймеры.
Список последовательностей приведен в графической части (после формулы изобретения).