Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ЛУЛИКОНАЗОЛ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к фармацевтической композиции. В частности, настоящее изобретение относится к фармацевтической композиции, содержащей луликоназол, в которой подавляется образование аналога луликоназола.
УРОВЕНЬ ТЕХНИКИ
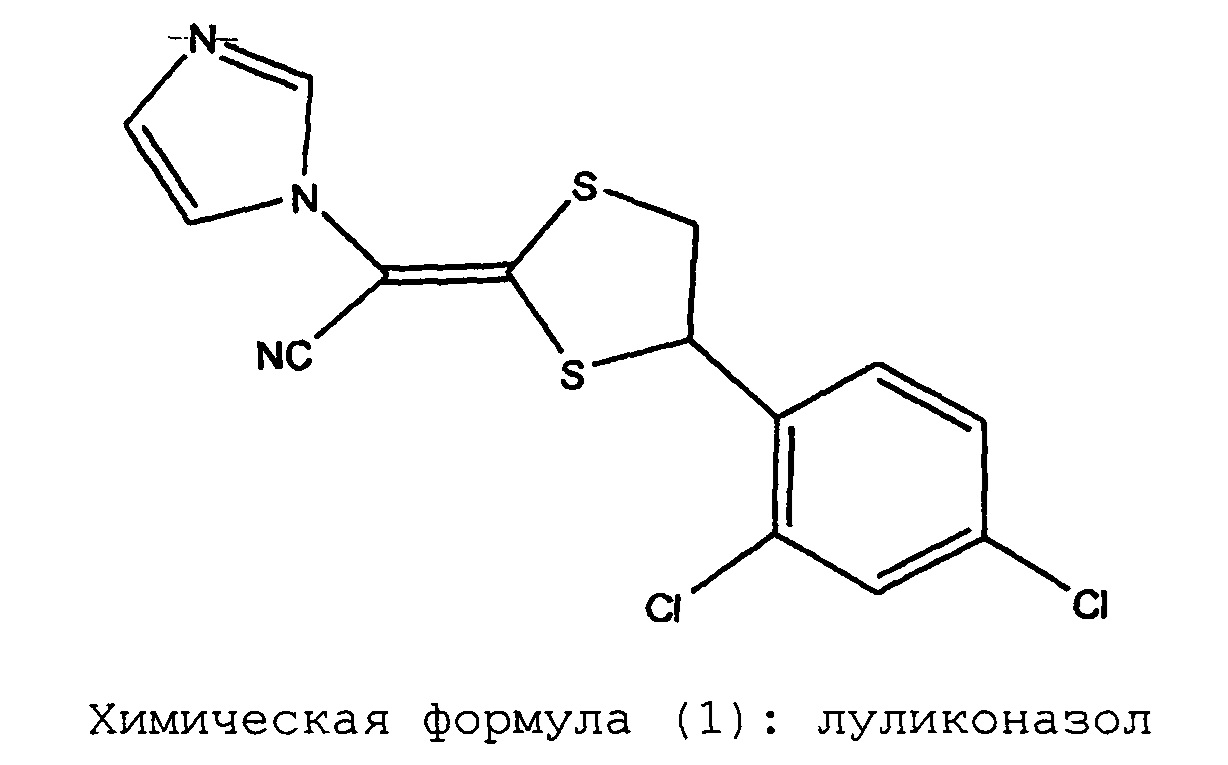
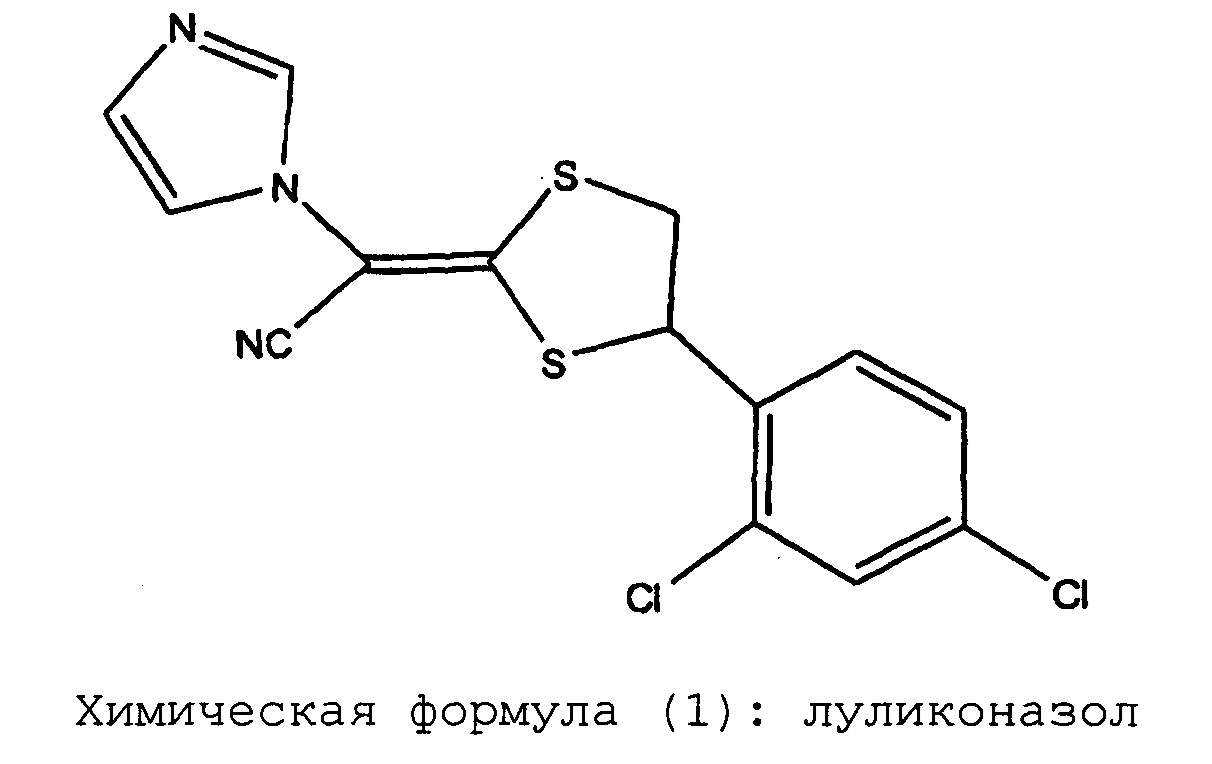
Луликоназол является противогрибковым агентом, обладающим исключительно сильным действием на грибки. В настоящее время, луликоназол широко применяется в качестве фармацевтического или лекарственного средства для лечения дерматофитии стоп и дерматофитии туловища, и кроме того планируется его применение для борьбы с дерматофитией ногтей. Что касается фармацевтических препаратов (лекарственных препаратов) луликоназола, известно, что проблемами, требующими решения, является превращение луликоназола в стереоизомерные формы, например, SE изомер и Z изомер, а также кристаллизация луликоназола, происходящая сразу же после нанесения препарата (смотрите, например, патентные документы 1-6).
ДОКУМЕНТЫ ИЗВЕСТНОГО УРОВНЯ ТЕХНИКИ
Патентные документы 1: WO 2007/102241;
Патентный документ 2: WO 2007/102242;
Патентный документ 3: WO 2007/102243;
Патентный документ 4: WO 2009/031642;
Патентный документ 5: WO 2009/031643;
Патентный документ 6: WO 2009/031644.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Техническая проблема
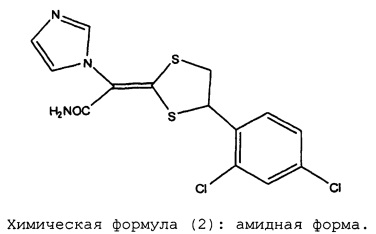
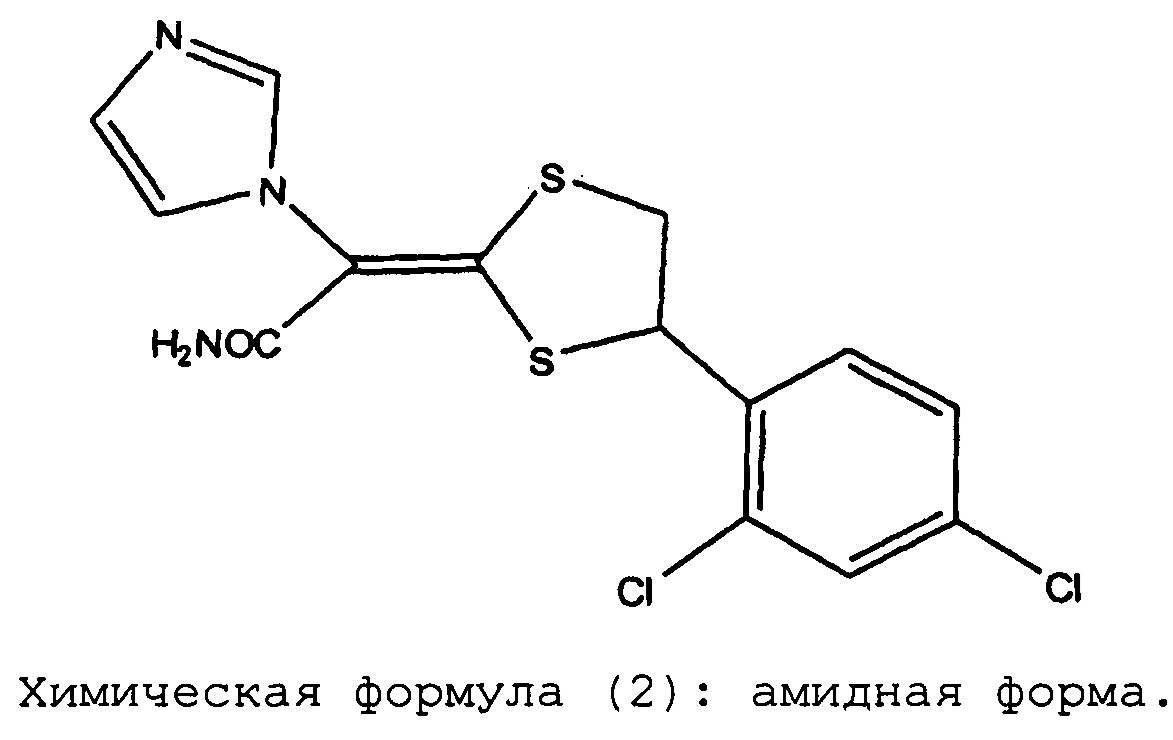
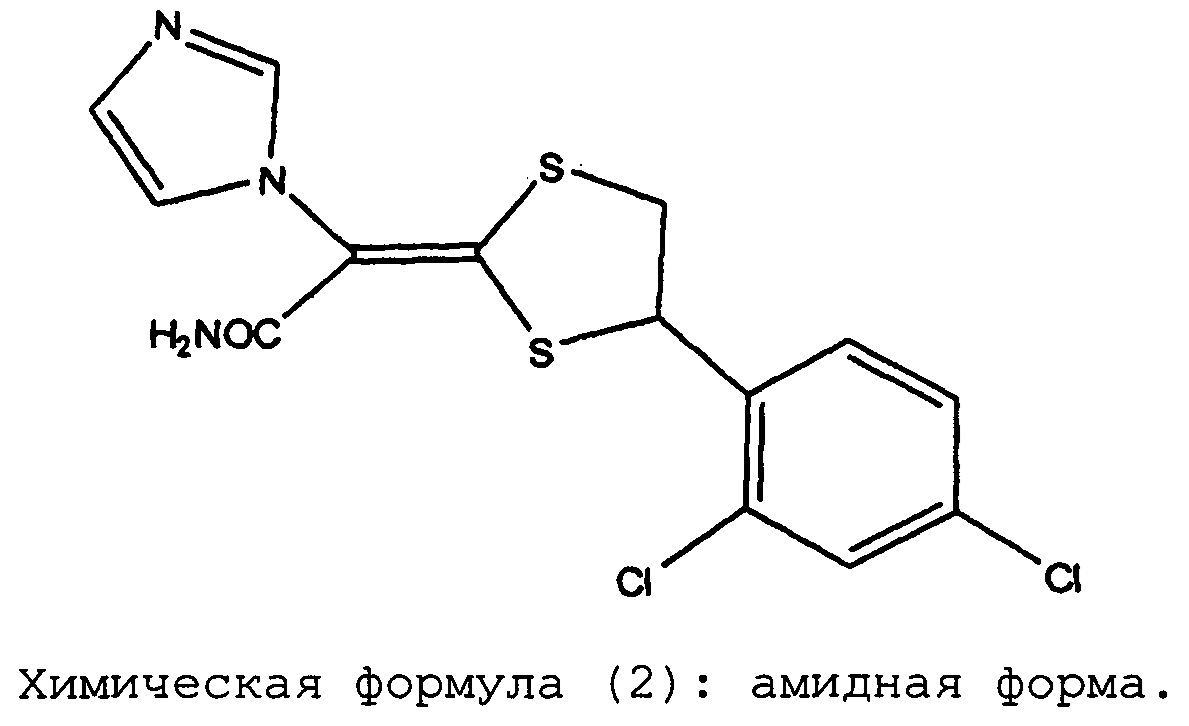
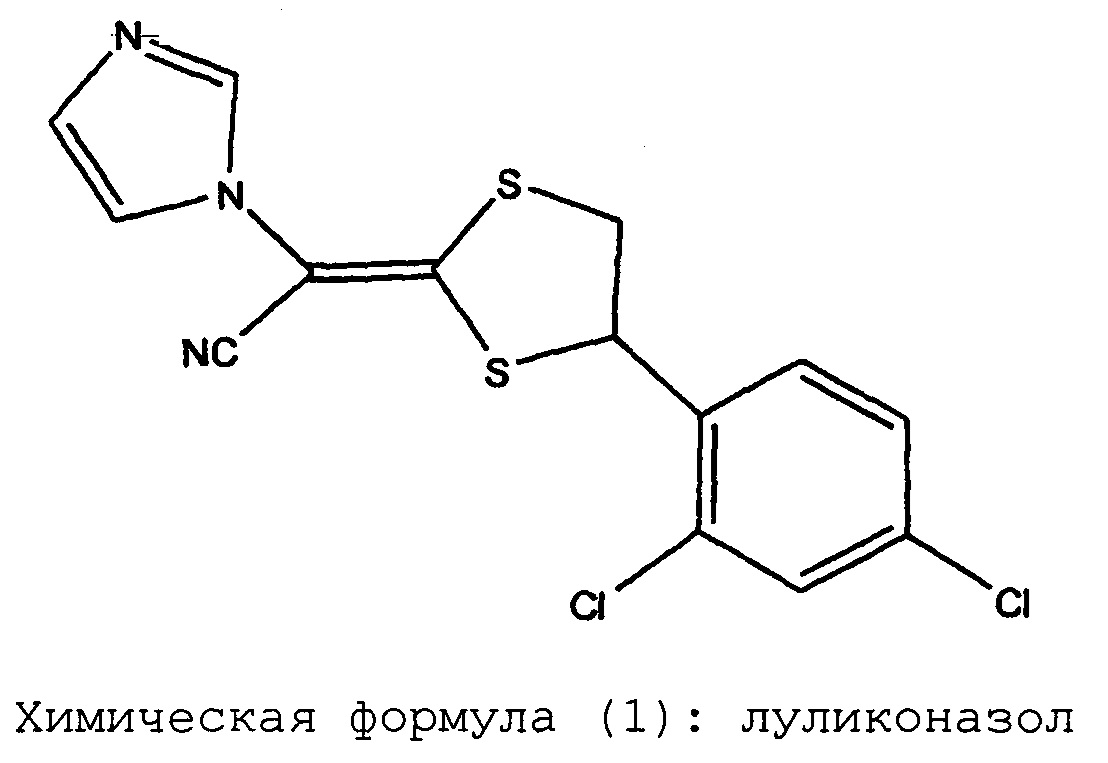
При проведении исследований дозированных форм препаратов луликоназола, было обнаружено, что в этих фармацевтических препаратах иногда появляется аналог действующего вещества, который не был известен во время разработки луликоназола, во время хранения препаратов при проведении теста на хранение в жестких условиях (тест на хранение при 60°C в течение 3 недель) или хранения в условиях ускоренного старения (тест на хранение при 40°C в течение 6 месяцев). К настоящему моменту было установлено, что этот аналог не содержится в действующем ингредиенте с самого начала, и что этот аналог впервые появляется или образуется при изготовлении фармацевтического препарата и во время теста на хранение. Ситуация с появлением или образованием упомянутого аналога различается в зависимости от типа выбранного растворителя. В результате определения структуры этого аналога было установлено, что он представляет собой амидную форму, в которой нитрильная группа луликоназола подверглась гидролизу и превращению в амидную группу. Как было указано выше, амидная форма луликоназола не образуется при получении действующего ингредиента. Таким образом, эта амидная форма луликоназола впервые образуется или появляется при получении фармацевтического препарата, в результате случайного добавления компонента, который облегчает образование амидной формы при проведении ускоренного теста или теста в жестких условиях. Следовательно, можно утверждать, что в мире до сих пор не существует каких-либо фармацевтических препаратов луликоназола, для которых в данных обстоятельствах было продемонстрировано наличие амидной формы луликоназола.
Во время разработки способа получения луликоназола, амидное производное, представленное химической формулой (2), было совершенно неизвестно. Также было неизвестно, что появление или отсутствие этого вещества является важным критерием для выбора растворителя при получении фармацевтического препарата. Кроме того, амидное производное формулы (2) является новым веществом, которое не было описано в существующей химической литературе. Известно, что нитрилы, как правило, вступают в реакцию присоединения с водой, которая вызывается действием кислоты или щелочи, превращаясь при этом в амиды. Таким образом считается, что описанное выше вещество образуется в результате присоединения воды к нитрильной группе луликоназола. Однако в общем случае трудно предположить, что это соединение образуется или появляется при хранении в зависимости от типа использованного растворителя. Также было абсолютно неизвестно и невозможно предсказать, что образования описанной выше амидной формы можно избежать путем смешивания луликоназола с каким-либо компонентом, который не является ни кислотным ни щелочным. Далее, была также неизвестна какая-либо взаимосвязь между нитрильной группой, изопропилмиристатом, триглицеридами жирных кислот со средней длиной цепи, триацетином, триэтилцитратом, ацетоном, метилэтилкетоном, POE эфиром жирной кислоты, POE алкиловым (алкениловым) эфиром, сложным эфиром жирной кислоты и сорбитана, POE сложным эфиром жирной кислоты и сорбитана, POE гидрированным касторовым маслом, эфиром двухосновной кислоты, гидроксиэтилиден дифосфоновой кислотой и салицилатом этиленгликоля. До настоящего времени практически неизвестны такие случаи, когда образование или появление амидной формы облегчается или подавляется в зависимости от типа примененного растворителя.
При получении препарата луликоназола для наружного применения, если общее количество действующего вещества, вводимого за день, не превышает одного грамма, Закон о фармацевтической продукции (Японии) для препарата наружного применения определяет требуется ли последующее наблюдение за пациентом, в зависимости от того, превышает ли образование аналога 0,2% или составляет не более 0,2%. Вследствие этого исключительно важно, чтобы количество аналогов в применяемом препарате можно было понизить путем уменьшения образующегося количества любого конкретного аналогичного вещества до значения не превышающего 0,2%. Не будет преувеличением сказать, что появление таких способов является ожидаемым. Далее, что касается препарата для наружного применения, содержащего луликоназол, утверждается, что фармацевтический препарат, в котором количество амидной формы, образовавшейся в жестких условиях хранения при 60°C в течение 3 недель, не превышает 0,2% по отношению к действующему ингредиенту, не смотря на то, что фармацевтический препарат содержит какой-либо компонент или ингредиент, облегчающий образование амидной формы, является подходящим для применения в качестве фармацевтического препарата луликоназола.

Химическая формула (1): луликоназол

Химическая формула (2): амидная форма
Настоящее изобретение было сделано в описанных выше обстоятельствах и цель изобретения заключалась в разработке средств для регулирования количества амидной формы, образующейся или появляющейся в некоторых случаях в зависимости от комбинации компонентов состава или, другими словами, средств для стабилизации нитрильной группы луликоназола.
Решение проблемы
Принимая во внимание описанные выше обстоятельства, авторы настоящего изобретения провели настойчивые и тщательные исследования с целью поиска средств для регулирования количества амидной формы, которая иногда образуется или появляется в зависимости от комбинации компонентов состава. В результате было обнаружено, что требуемым действием обладают компоненты, выбранные из карбоновых кислот и их производных, кетонов, фосфорной кислоты и ее производных, местных анестетиков, антигистаминных препаратов и неионных ПАВ на основе POE. Это позволило завершить работу над настоящим изобретением. Таким образом, в настоящее изобретение входят следующие аспекты.
1. Фармацевтическая композиция, содержащая 1) луликоназол, представленный формулой (1), и 2) один компонент, или два или несколько компонентов, выбранных из карбоновых кислот и их производных, кетонов, фосфорной кислоты и ее производных, местных анестетиков, антигистаминных препаратов и неионных ПАВ на основе POE, где:
содержание амидной формы, представленной химической формулой (2), не превышает 0,2 масс.% от введенного в композицию количества луликоназола, после хранения при 60°C в течение 3 недель или при 40°C в течение 6 месяцев:

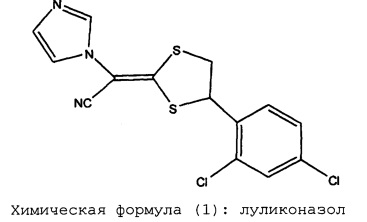
Химическая формула (1): луликоназол

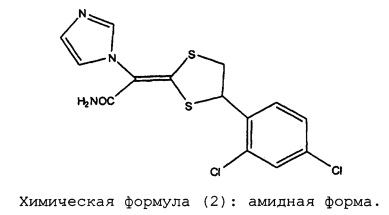
Химическая формула (2): амидная форма
2. Фармацевтическая композиция по п. 1, где компонент, который выбран из карбоновых кислот и их производных, кетонов, фосфорной кислоты и ее производных, местных анестетиков, антигистаминных препаратов и неионных ПАВ на основе POE, выбран из следующей группы (A):
(A)
карбоновые кислоты и их производные выбраны из: изопропил миристата, сложных эфиров жирных кислот и сорбитана, триглицеридов жирных кислот со средней длиной цепи, триацетина, триэтил цитрата, эфиров двухосновных кислот и салицилата этиленгликоля;
кетоны выбраны из: ацетона, метилэтилкетона;
фосфорная кислота и ее производные выбраны из гидроксиэтилиден дифосфоновой кислоты;
местные анестетики выбраны из: лидокаина и его солей;
антигистаминные препараты выбраны из: дифенгидрамина и его солей;
неионные ПАВ на основе POE выбраны из: POE эфиров жирных кислот, POE алкиловых (алкениловых) простых эфиров, POE сложных эфиров жирной кислоты и сорбитана, POE гидрированного касторового масла.
3. Фармацевтическая композиция по п. 1 или 2, дополнительно включающая один компонент, или два или несколько компонентов, выбранных из многоатомных спиртов, одноатомных спиртов со средними цепями, длинными цепями или циклических, а также пирролидона и его производных.
4. Фармацевтическая композиция по п. 3, где многоатомный спирт, одноатомный спирт со средней цепью, длинной цепью или циклический, а также пирролидон и его производное выбраны из следующей группы (B):
(B)
многоатомные спирты выбраны из: 1,3-бутандиола, полиэтиленгликоля, пропиленгликоля, полипропиленгликоля и глицерина;
одноатомные спирты со средней цепью, длинной цепью или циклические выбраны из: бензилового спирта, олеилового спирта и изостеарилового спирта;
пирролидон и его производные выбраны из: пирролидона и его производных.
5. Фармацевтическая композиция, содержащая 1) луликоназол, представленный химической формулой (1), и 2) один компонент, или два или несколько компонентов, выбранных из многоатомных спиртов, одноатомных спиртов со средними цепями, длинными цепями или циклических, а также пирролидона и его производных в количестве менее 1 масс.%, где:
содержание амидной формы, представленной химической формулой (2), не превышает 0,2 масс.% от введенного в композицию количества луликоназола, после хранения при 60°C в течение 3 недель или при 40°C в течение 6 месяцев:

Химическая формула (1): луликоназол

Химическая формула (2): амидная форма
6. Фармацевтическая композиция по п. 5, где один компонент, или два или несколько компонентов, выбранных из многоатомных спиртов, одноатомных спиртов со средними цепями, длинными цепями или циклических, а также пирролидона и его производных, выбран/выбраны из следующей группы (B):
(B)
многоатомные спирты выбраны из: 1,3-бутандиола, полиэтиленгликоля, пропиленгликоля, полипропиленгликоля и глицерина;
одноатомные спирты со средней цепью, длинной цепью или циклические выбраны из: бензилового спирта, олеилового спирта и изостеарилового спирта;
пирролидон и его производные выбраны из: пирролидона и его производных.
7. Фармацевтическая композиция по любому из пп. 1-6, где указанная фармацевтическая композиция представляет собой средство в форме жидкости или крема.
8. Ингибирующий агент для подавления превращения луликоназола, представленного химической формулой (1), в амидную форму, представленную химической формулой (2), при хранении при 60°C в течение 3 недель или при 40°C в течение 6 месяцев, где упомянутый ингибирующий агент состоит из одного компонента, или двух или нескольких компонентов, выбранных из карбоновых кислот и их производных, кетонов, фосфорной кислоты и ее производных, местных анестетиков, антигистаминных препаратов и неионных ПАВ на основе POE:

Химическая формула (1): луликоназол

Химическая формула (2): амидная форма
9. Способ получения фармацевтической композиции, содержащей луликоназол в качестве действующего начала, где указанный способ включает:
стадию получения фармацевтического препарата, на которой 1) луликоназол, представленный химической формулой (1), смешивают с 2) одним компонентом, или двумя или несколькими компонентами, выбранными из карбоновых кислот и их производных, кетонов, фосфорной кислоты и ее производных, местных анестетиков, антигистаминных препаратов и неионных ПАВ на основе POE и 3) одним компонентом, или двумя или несколькими компонентами, выбранными из многоатомных спиртов, одноатомных спиртов со средними цепями, длинными цепями или циклических, а также пирролидона и его производных; и
стадию подтверждения того, что количество амидной формы не превышает 0,2 масс.% от введенного в препарат количества луликоназола, путем выполнения теста на хранение в жестких условиях (60°C в течение 3 недель) или в условиях ускоренного старения (40°C в течение 6 месяцев):

Химическая формула (1): луликоназол

Химическая формула (2): амидная форма
10. Фармацевтическая композиция, включающая луликоназол в качестве действующего начала, полученная способом по п. 9.
Полезные эффекты изобретения
Согласно настоящему изобретению, имеется возможность получить средства для управления количеством амидной формы, иногда образующейся или появляющейся в зависимости от комбинации компонентов состава.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
1. Фармацевтическая композиция по настоящему изобретению
Фармацевтическая композиция по настоящему изобретению представляет собой фармацевтическую композицию, содержащую луликоназол, который находится в составе такого фармацевтического препарата, который позволяет уменьшить количество амидной формы (химической формулы (2)), образующейся или появляющейся из луликоназола во время производства или хранения. Конкретно, фармацевтическая композиция по настоящему изобретению обладает следующим признаком. Количество образующейся амидной формы не превышает 0,2 масс.% от общего количества (количества, введенного в состав препарата) луликоназола после хранения при 60°C в течение 3 недель или хранения при 40°C в течение 6 месяцев. Т.е. количество образующейся амидной формы не превышает 0,002 масс.% от общей массы фармацевтического препарата, для препарата, содержащего луликоназол в количестве 1 масс.%. Более предпочтительно, количество образующейся амидной формы не превышает 0,1 масс.% и это количество составляет не более 0,001 масс.% от массы фармацевтического препарата для состава с содержанием луликоназола 1 масс.%.
Предпочтительное содержание луликоназола в фармацевтической композиции по настоящему изобретению составляет от 0,1 до 20 масс.%. Более предпочтительно, содержание луликоназола составляет от 0,5 до 15 масс.% и, наиболее предпочтительно, от 1 до 10 масс.%.
Предпочтительными примерами фармацевтической композиции по настоящему изобретению являются препараты для наружного применения, которые включают например, средства в форме жидкости, средства в форме крема, геля, пены, спрея и мази. Предпочтительным примером методики получения фармацевтической композиции, имеющей описанные выше свойства, может служить приведенный ниже способ. А именно, компонент, который легко образует амидную форму и компонент, который подавляет образование этой амидной формы, рассматривают отдельно от других компонентов, применяемых для получения фармацевтического препарата, и осуществляют их выбор и разделение на группы. Если хотя бы один компонент, который легко образует амидную форму, применяется в качестве компонента фармацевтического препарата, состав этого препарата подбирают таким образом, чтобы он содержал компонент, который подавляет образование амидной формы.
Предпочтительно, чтобы компонент, который подавляет образование амидной формы, обязательно входил в состав композиции. С этой точки зрения, фармацевтическая композиция по настоящему изобретению в качестве принципиально значимого компонента содержит компонент, который подавляет образование амидной формы и который выбран из карбоновых кислот и их производных, кетонов, фосфорной кислоты и ее производных, местных анестетиков, антигистаминных препаратов и неионных ПАВ на основе POE. В композиции может содержаться один, или два или несколько компонентов из числа перечисленных выше.
Примерами компонентов, которые облегчают образование амидной формы, могут служить многоатомные спирты, одноатомные спирты со средними цепями, длинными цепями или циклические, а также пирролидон и его производные. Если в композиции содержится указанный выше компонент, предпочтительно, чтобы в ней одновременно содержался описанный выше компонент, затрудняющий образование амидной формы. Имеется возможность, чтобы в композиции содержался один из этих компонентов, или два или несколько таких компонентов.
Среди фармацевтических препаратов, например, фармацевтических композиций, полученных смешиванием указанных выше компонентов, в случае, если подтверждено, что количество образовавшейся амидной формы не превышает 2 масс.% от введенного в препарат количества луликоназола после хранения при 40°C в течение 6 месяцев или при хранении при 60°C в течение 3 недель, т.е. содержание луликоназола составляет 1 масс.% и образовавшееся количество не превышает 0,002 масс.% относительно общей массы фармацевтического препарата, то такой фармацевтический препарат является фармацевтической композиций по настоящему изобретению. Как установили авторы настоящего изобретения, условия хранения при 60°C в течение 3 недель и условия хранения при 40°C в течение 6 месяцев хорошо коррелируют друг с другом во многих отношениях и можно использовать одну или обе этих комбинации условий. Т.е. что касается результатов хранения при 60°C в течение 3 недель и хранения при 40°C в течение 6 месяцев, результат, полученные для одной из этих комбинаций условий можно считать результатом, полученным для другой комбинации условий. Однако предпочтительно применять условия 60°C в течение 3 недель, поскольку оценку можно провести за более короткое время.
Фармацевтическую композицию по настоящему изобретению, которая содержит луликоназол в качестве действующего начала, можно получать путем смешивания луликоназола, представленного химической формулой (1), с одним компонентом, или двумя или несколькими компонентами, выбранными из карбоновых кислот и их производных, кетонов, фосфорной кислоты и ее производных, местных анестетиков, антигистаминных препаратов и неионных ПАВ на основе POE, с получением фармацевтического препарата; и проведения теста на хранение в жестких условиях (60°C в течение 3 недель) или условиях ускоренного старения (40°C в течение 6 месяцев) для подтверждения того, что количество амидной формы не превышает 0,2 масс.% от введенного в препарат количества луликоназола. Кроме того, если композиция содержит один компонент, или два или несколько компонентов, выбранных из многоатомных спиртов, одноатомных спиртов со средними цепями, длинными цепями или циклических, а также пирролидона и его производных, фармацевтическую композицию можно также изготовить путем получения фармацевтического препарата описанным выше способом и проведения теста на хранение в жестких условиях (60°C в течение 3 недель) или условиях ускоренного старения (40°C в течение 6 месяцев) для подтверждения того, что количество амидной формы не превышает 0,2 масс.% от введенного в препарат количества луликоназола.
При получении описанной выше амидной формы, ее можно получать обработкой луликоназола водой в присутствии катализатора на основе металла, например, меди, иридия, оксида алюминия, гидроксиапатита и т.п. В качестве альтернативы, амидную форму можно также получить действием кислоты или щелочи на луликоназол в этаноле, содержащем воду. Полученную описанными способами амидную форму можно очистить, например, с помощью хроматографии, например, колоночной хроматографии на силикагеле, колоночной хроматографии на силикагеле, модифицированном октадецилом, и т.п. или перекристаллизации, например, из смеси жидкостей, состоящей из этилацетата-н-гексана, этанола, изопропанола или подобных растворителей. Полученную амидную форму можно применять в качестве стандартного вещества (стандартного эталона), которое может использоваться в качестве метки для аналога луликоназола в способе получения фармацевтической композиции, содержащей луликоназол в качестве действующего начала, по настоящему изобретению. Амидная форма имеет следующие физико-химические характеристики.
1H ЯМР (CDCl3, мд): 3,617 (дд, 1H), 3,639 (дд, 1H), 5,554 (дд, 1H), 6,993 (с, 1H), 7,231-7,311 (м, 2H), 7,447-7,664 (м, 3H);
т.пл.: 238-244°C
Описанную выше амидную форму можно также обнаружить и количественно измерить ее содержание с помощью ВЭЖХ. Если подтверждено наличие аналогов луликоназола, во многих случаях используют колонку с хиральной нормальной фазой, для выявления изомеров, например, SE-изомера или Z-изомера. Однако соединение формулы (1) с трудом определяется в условиях элюирования на колонке с нормальной хиральной фазой. Поэтому предпочтительно проводить хроматографию при применении колонки с обращенной фазой с использованием противоиона, захватывающего катионы, например, алкилсульфоната или подобного. Описанные выше условия анализа могут быть предпочтительно проиллюстрированы следующим примером. В этих условиях наряду с луликоназолом можно также определить его основные аналоги, например, SE изомер, Z изомер и т.п. Приведенные ниже условия являются особенно предпочтительным примером описанных выше условий проведения хроматографического анализа.
Колонка: ODS-2 4,6 x 150 мм, температура колонки: 40°C, подвижная фаза: 0,15% раствор ундекан-1-сульфоната натрия в смеси (вода/ацетонитрил/уксусная кислота (100) (50:49:1, объем/объем/объем)), скорость потока: 1,0 мл/мин, детектирование: 295 нм.
2. Компонент, подавляющий образование амидной формы
Примерами компонента, который подавляет образование амидной формы являются компоненты, выбранные из карбоновых кислот и их производных, кетонов, фосфорной кислоты и ее производных, местных анестетиков, антигистаминных препаратов и неионных ПАВ на основе POE.
Конкретно, в качестве предпочтительных примеров карбоновых кислот можно привести, в т.ч., гидроксикислоты, такие как молочная кислота, лимонная кислота и винная кислота; алифатические карбоновые кислоты, такие как муравьиная кислота, угольная кислота, уксусная кислота и жирные кислоты; а также ароматические карбоновые кислоты, такие как бензойная кислота и салициловая кислота. В качестве предпочтительных примеров производных кислот можно привести соли или эфиры. В качестве предпочтительных примеров солей карбоновых кислот можно привести в т.ч. соли щелочных металлов, такие как гидрокарбонат натрия, дигидроцитрат натрия, тартрат натрия и т.п. В качестве предпочтительных примеров эфиров карбоновых кислот можно привести изопропил миристат, цетил изоцианат, октил додецил олеат, глицерина моностеарат, триэтил цитрат, этиленгликоля салицилат, эфиры сорбитана и жирных кислот (например, сорбитана моностеарат), или эфиры двухосновных кислот, такие как диизопропил адипат, диэтил адипат, диэтил себацинат, этилен карбонат, пропилен карбонат и т.п., или триглицериды, например, триэфиры глицерина и жирных кислот со средней длиной цепи (число атомов углерода: от 8 до 12), оливковое масло, триэфир глицерина и изостеариновой кислоты, триацетин и т.п. Среди перечисленных соединений в качестве предпочтительного примера можно указать на диизопропил адипат.
Что касается кетонов, то в качестве предпочтительных примеров можно привести ацетон и метилэтилкетон.
В качестве предпочтительных примеров неионных ПАВ на основе POE, можно привести POE эфиры жирных кислот, POE алкиловые(алкениловые) простые эфиры, POE эфиры жирных кислот и сорбитана, POE гидрированное касторовое масло.
В качестве предпочтительных примеров POE эфиров жирных кислот можно привести в т.ч. POE эфиры олеиновой кислоты, POE эфиры стеариновой кислоты, POE эфиры изостеариновой кислоты, POE эфиры миристиновой кислоты и POE эфиры лауриновой кислоты. В качестве предпочтительных примеров POE алкиловых(алкениловых) простых эфиров можно привести в т.ч. моноэтиловый эфир диэтиленгликоля, диэтиловый эфир диэтиленгликоля, моноэтиловый эфир триэтиленгликоля, POE лауриловый эфир, POE цетиловый эфир, POE стеариловый эфир, POE изостеариловый эфир, POE олеиловый эфир и POE бегениловый эфир. В качестве предпочтительных примеров POE эфиров жирных кислот и сорбитана можно привести в т.ч. POE эфир олеиновой кислоты и сорбитана, POE эфир стеариновой кислоты и сорбитана, а также POE эфир изостеариновой кислоты и сорбитана.
В случае применения неионного ПАВ на основе POE, количество молей присоединенной полиэтиленоксидной группы предпочтительно составляет от 10 до 40 и более предпочтительно от 15 до 30.
В качестве предпочтительных примеров фосфорной кислоты и ее производных можно привести в т.ч. фосфорную кислоту, фармацевтически приемлемые соли фосфорной кислоты и гидроксиэтилидендифосфоновую кислоту.
В качестве местного анестетика предпочтительно применять любой местный анестетик амидного типа. Предпочтительными примерами таких анестетиков служат лидокаин и его фармацевтически приемлемые соли.
Что касается антигистаминных препаратов, предпочтительно применять антигистаминные средства на основе дифенгидрамина и хлорфенирамина. Предпочтительными примерами таких средств могут служить дифенгидрамин и его фармацевтически приемлемые соли, и хлорфенирамин и его фармацевтически приемлемые соли.
Если компонент, который подавляет образование амидной формы, как описано выше, присутствует в составе в количестве не менее 1 масс.%, то подтверждается его вклад в подавление образования амидной формы. Поэтому в качестве предпочтительного примера можно привести случай, когда компонент, подавляющий образование амидной формы, присутствует в составе в количестве не менее 1 масс.%, и более предпочтительным примером является случай, когда этот компонент содержится в количестве не менее 5 масс.%. С точки зрения ограничений, относящихся к физическим свойствам состава, предпочтительно, чтобы содержание этого компонента не превышало 30 масс.% и особенно предпочтительно, чтобы содержание этого компонента не превышало 15 масс.%.
3. Компонент, облегчающий образование амидной формы
Примерами компонента фармацевтического препарата по настоящему изобретению, который облегчает образование амидной формы, предпочтительно могут являться многоатомные спирты, одноатомные спирты со средней цепью, длинной цепью или циклические, а также пирролидон и его производные.
В качестве примеров многоатомных спиртов можно привести многоатомные спирты, содержащие от 3 до 1000 атомов углерода. Предпочтительными примерами таких соединений являются 1,3-бутандиол, полиэтиленгликоль, пропиленгликоль, полипропиленгликоль и глицерин. В качестве спирта со средней цепью, длинной цепью или циклического, допустимо применять любой алифатический спирт или ароматический спирт. Примерами алифатических спиртов могут служить спирты, включающие от 8 до 30 атомов углерода. Предпочтительными примерами таких спиртов могут служить в том числе цетанол (цетиловый спирт), лауриловый спирт, олеиловый спирт, изостеариловый спирт, цетостеариловый спирт, стеариловый спирт и бегениловый спирт. Что касается ароматических спиртов, предпочтительными примерами могут служить в т.ч. бензиловый спирт и фенетиловый спирт.
Предпочтительными примерами пирролидона и его производных могут служить в том числе пирролидон карбоновая кислота, N-алкил-2-пирролидоны, например, N-метил-2-пирролидон, N-этил-2-пирролидон и N-пропил-2-пирролидон.
Содействие образованию амидной формы подтверждается в том случае, когда описанные выше компоненты присутствуют в составе в количестве не менее 1 масс.%. Поэтому, если указанный компонент, облегчающий образование амидной формы, содержится в составе в количестве не менее 1 масс.%, предпочтительно, чтобы вместе с ним в состав входил компонент, подавляющий образование амидной формы. Если компонент, облегчающий образование амидной формы, содержится в составе в количестве не менее 5 масс.%, еще более предпочтительно, чтобы вместе с ним в состав входил компонент, подавляющий образование амидной формы. Даже в случае необходимости добавления в состав указанного выше компонента, облегчающего образование амидной формы, предпочтительно, чтобы этот компонент содержался в составе в количестве не более 30 масс.% и особенно предпочтительно, чтобы содержание этого компонента в составе не превышало 15 масс.%. Необходимо, чтобы содержание компонента, облегчающего образование амидной формы, было снижено до минимального возможного значения. Однако, во многих случаях указанный выше компонент, облегчающий образование амидной формы, необходим для получения фармацевтического состава, например, для повышения растворимости действующего компонента или ингредиента. В этих случая важно, чтобы описанный выше компонент, подавляющий образование амидной формы, обязательно был включен в состав. В зависимости, например, от типа компонента, предпочтительно, чтобы описанный выше компонент, который подавляет образование амидной формы, содержался в составе, как минимум, примерно в том же массовом количестве, что и компонент, облегчающий образование амидной формы. Из указанных выше компонентов обычно применяется бензиловый спирт, поскольку он обладает отличным солюбилизирующим действием. Однако в случае луликоназола, бензиловый спирт является сильнодействующим фактором, способствующим образованию амидной формы. Поэтому, если этот компонент применяется в качестве солюбилизирующего агента, предпочтительно избегать его одновременного применения с другими компонентами, облегчающими образование амидной формы, такими как цетостеариловый спирт, изостеариловый спирт, пропиленгликоль и т.п. В частности, нежелательно смешивать этот компонент с тремя или более компонентами, выбранными из других соединений, способствующих образованию амидной формы, например, комбинацией изостеарилового спирта, цетостеарилового спирта и пропиленгликоля, поскольку повышается риск образования амидной формы. В этой ситуации предпочтительно ввести в состав любой компонент, который ингибирует образование амидной формы, таким же образом, как описано выше. С другой стороны, такой компонент, как полиэтиленгликоль, который облегчает образование амидной формы, не обладает столь же сильной способностью облегчать образование амидной формы, как бензиловый спирт. Поэтому, при применении этого компонента нет необходимости вводить в состав и применять избыточное количество агента(ов), подавляющего образование амидной формы, как, например, комбинации триглицерида жирной кислоты со средней цепью, фосфорной кислоты и метилэтилкетона, только с целью недопущения образования амидной формы. Такое избыточное применение не является предпочтительным, поскольку понижается степень свободы при выборе компонентов состава. Кроме того, утверждается, что любой фармацевтический препарат, в котором количество образовавшегося амидной формы даже в жестких условиях при 60°C в течение 3 недель или в условиях ускоренного старения при 40°C в течение 6 месяцев, является достаточно незначительным, а именно, образовавшееся количество амидной формы не превышает 0,1 масс.% относительно введенного в препарат количества луликоназола, при том, что в композиции содержится указанный выше компонент, облегчающий образование амидной формы, также хорошо подходит в качестве фармацевтического препарата, даже если механизм подавления образования амидной формы остается невыясненным.
4. Необязательные компоненты
Фармацевтическая композиция по настоящему изобретению может содержать необязательные компоненты, которые обычно входят в состав фармацевтических композиций. Что касается указанных выше необязательных компонентов, их предпочтительными примерами могут являться в том числе углеводороды, например, вазелин, микрокристаллический воск и жидкий парафин; силиконы, в т.ч., например, диметикон и циклометикон; сложные эфиры, в т.ч., например, спермацет и растительный воск; триглицериды, в т.ч., например, оливковое масло, говяжье сало и кокосовое масло; неионные ПАВ, не относящиеся к основным компонентам, в т.ч., например, моноглицерид стеариновой кислоты, моноглицерид олеиновой кислоты и POE моноглицерид стеариновой кислоты; анионные ПАВ, в т.ч., например, лаурилсульфат натрия и POE лаурилсульфат натрия; жирные кислоты, в т.ч., например, стеариновая кислота, олеиновая кислота, лауриновая кислота, пальмитиновая кислота и миристиновая кислота; антиоксиданты, в т.ч., например, BHT, BHA и токоферол; красители; смазывающие вещества; а также средства, корректирующие вкус/запах. Фармацевтическую композицию по настоящему изобретению можно получить путем обработки указанных выше компонентов по стандартной методике и подтверждения того, что подавлено образование амидной формы, с помощью теста на хранение.
Фармацевтическая композиция по настоящему изобретению предпочтительно применяется для подавления или лечения заболеваний, вызванных любыми грибками, или предупреждения ухудшения течения заболевания, причем действие композиции обусловлено характеристиками луликоназола. Примерами заболеваний, вызванных любыми грибками, могут служить дерматофития стоп, например, стопа атлета, дерматофития туловища, например, кандидоз и разноцветный лишай, а также трихофитоз (стригущий лишай) твердых кератиновых участков, например, дерматофития ногтей. Особенно предпочтительно применять фармацевтическую композицию по настоящему изобретению для лечения заболевания твердых кератиновых участков, например, дерматофитии ногтей, поскольку они обладают очень хорошим эффектом. Действие фармацевтической композиции по настоящему изобретению особенно предпочтительно проявляется на ногтях. Однако действие композиций по настоящему изобретению проявляется также и при любом обычном дерматомикозе. Поэтому фармацевтическая композиция, которая направлена на борьбу с дерматомикозом, и которая соответствует принципам настоящего изобретения, также входит в объем настоящего изобретения. Примерами указанного выше дерматомикоза могут служить, в том числе, дерматофития стоп и трихофитоз, распространяющийся через роговые вещества, и возникающий, например, на пятках, который включен в дерматофитию стоп. Что касается описанного выше дерматомикоза, предпочтительно применять составы по настоящему изобретению для борьбы с трихофитозом, распространяющимся через роговое вещество, при котором обычные агенты или лекарственные средства оказываются малоэффективными, поскольку при этом наиболее явно проявляется действие состава по настоящему изобретению.
Схему применения состава можно выбрать надлежащим образом с учетом, например, массы тела, возраста, пола и симптомов или состояния пациента. Тем не менее для взрослых пациентов в случае обычных заболеваний предпочтительно вводить луликоназол в количестве от 0,01 до 1 г в день. Можно сослаться на количества луликоназола, традиционно применяемые для лечения заболеваний, вызванных теми или иными грибками.
Например, в случае любого препарата для наружного применения, в качестве примера его применения, можно привести нанесение в необходимом количестве на больной участок один или несколько раз в день. Предпочтительно, чтобы описанное выше лечение осуществлялось ежедневно. В частности, в случае дерматофитии ногтей, в ноготь можно ввести такое количество луликоназола, в качестве действующего ингредиента, которое нельзя доставить с помощью любого обычного фармацевтического препарата. Соответственно, дерматофитию ногтей можно лечить только наружным нанесением, без необходимости принимать какой-либо противогрибковый агент в течение продолжительного времени. Кроме того, при дерматофитии ногтей серьезной проблемой являются рецидивы и повторные заражения. Однако имеется возможность избежать упомянутых выше рецидивов и повторных заражений, за счет введения фармацевтической композиции по настоящему изобретению в течение 1-2 недель после исчезновения симптомов. При таком режиме применения фармацевтическая композиция по настоящему изобретению обладает профилактическим действием.
ПРИМЕРЫ
Ниже по тексту настоящее изобретение будет более подробно объяснено с помощью приведенных примеров. Однако настоящее изобретение не ограничено приведенными ниже примерами.
Пример 1
Получали фармацевтические препараты луликоназола 1-4, имеющие приведенные ниже составы. При этом компоненты состава растворяли при нагревания и перемешивания, после чего охлаждали при перемешивании и получали фармацевтические препараты 1-4, каждый из которых имел форму лосьона. Полученные препараты хранили при 60°C в течение 3 недель и после хранения измеряли содержание амидной формы с помощью ВЭЖХ. Результаты показаны в таблице 1. Соответственно, из приведенных данных понятно, что количество образовавшейся амидной формы увеличивается в зависимости от типа многоатомного спирта. Кроме того, приведенные данные показывают, что фармацевтический препарат 4, в котором подавление образования амидной формы вызвано действием изопропиладипата, представляет собой фармацевтическую композицию по настоящему изобретению.
Условия проведения ВЭЖХ: колонка: ODS-2 4,6×150 мм, температура колонки: 40°C, подвижная фаза: 0,15% раствор ундекан-1-сульфоната натрия в смеси (вода/ацетонитрил/уксусная кислота (100) (50:49:1, объем/объем/объем)), скорость потока: 1,0 мл/мин, детектирование: 295 нм.
|
Пример 2
Фармацевтические препараты 5-7 и фармацевтический препарат 36 получали по методике, аналогичной методике примера 1. Результаты показаны в таблице 2. Из показанных данных понятно, что образование амидной формы подавляется диизопропил адипатом.
|
|
Пример 3
Фармацевтические препараты 8-11 и 37 получали по методике, аналогичной описанной в примере 1, и определяли количество амидной формы после хранения при 60°C в течение 3 недель. Результаты показаны в таблице 3. Из приведенных результатов главным образом понятно, что многоатомный спирт и бензиловый спирт способствуют образованию амидной формы. Очевидно, что эти препараты не являются фармацевтическими композициями по настоящему изобретению, поскольку компонент, способствующий образованию амидной формы, содержится в значительных количествах и поэтому подавить образование амидной формы невозможно.
|
|
Пример 4
Фармацевтический препарат 12 и сравнительный фармацевтический препарат 1, имеющие показанные ниже составы, получали по методике, аналогичной описанной в примере 1. Содержание амидной формы в фармацевтическом препарате 12 и сравнительном фармацевтическом препарате 1, образовавшейся после хранения при 60°C в течение 3 недель, составляло 0,02 масс.% и 0,08 масс.% соответственно, относительно количества луликоназола. Из полученных результатов понятно, что образование амидной формы, которое облегчается добавлением полиэтиленгликоля 400, подавляется до значения не более 0,1 масс.%, благодаря ингибирующему действию триглицерида жирной кислоты со средней цепью и метилэтилкетона. Соответственно, понятно, что данный фармацевтический препарат является фармацевтической композиций по настоящему изобретению.
|
|
Пример 5
Фармацевтические препараты 13-16 и 38-40, имеющие показанные ниже составы, получали согласно методике, описанной в примере 1. Определяли также количества амидной формы, образовавшейся после хранения при 60°C в течение 3 недель. Результаты показаны в таблице 5. В соответствии с полученными данными считается, что образование амидной формы ингибируется диизопропиладипатом. Далее, из полученных данных также понятно, что пиролидоны обеспечивают тенденцию к существенному облегчению образования амидной формы. Из указанных фармацевтических препаратов, только фармацевтический препарат 13 и фармацевтический препарат 39 следует считать фармацевтическими препаратами по настоящему изобретению.
|
Пример 6
Фармацевтические препараты 17-21 и 41, имеющие показанные ниже составы, получали по методике, аналогичной описанной в примере 1, и определяли содержание образовавшейся амидной формы. Результаты показаны в таблице 6. Соответственно, из приведенных данных понятно, что местные анестетики и антигистаминные препараты обладают способностью подавлять образование амидной формы. Следовательно можно также понять, что образование амидной формы ингибируется также в состав этих компонентов совместно с компонентами, облегчающими образование амидной формы. Кроме того, понятно, что фармацевтические препараты 20, 21 и 41 являются препаратами для наружного применения по настоящему изобретению.
|
Пример 7
Фармацевтические препараты 22-30 и 42-44, имеющие показанный ниже состав, получали по методике, аналогичной описанной в примере 1, и измеряли количество образовавшейся амидной формы. Результаты показаны в таблице 7. Из данных таблицы следует, что образование амидной формы ингибируется во всех фармацевтических препаратах 22-29 по сравнению с фармацевтическим препаратом 30. Т.е. очевидно, что наблюдается эффект подавления образования амидной формы, возникающий благодаря присутствию фосфорной кислоты, молочной кислоты, лимонной кислоты, винной кислоты, триглицерида жирной кислоты с цепью средней длины, триацетина, салицилата этиленгликоля, триэтилцитрата и моноэтилового эфира диэтиленгликоля. Тем не менее, содержание амидной формы после хранения при 60°C в течение 3 недель превышало 0,2 масс.%. Поэтому ни один из фармацевтических препаратов 22-30 и 42 не относится к числу фармацевтических композиций по настоящему изобретению. Другими словами утверждается, что в случае этих фармацевтических препаратов агент, подавляющий образование амидной формы, относится к объему настоящего изобретения, но сами эти препараты не входят в число фармацевтических композиций по настоящему изобретению. Также можно утверждать, что такое положение возникает из-за того, что в препаратах содержится агент, облегчающий образование амидной формы.
Эффект ингибирования образования амидной формы подтверждается для фармацевтических препаратов 43 и 44, и композиции 43 и 44 относятся к фармацевтическим композициям по настоящему изобретению.
|
|
|
|
Пример 8
Фармацевтические препараты 31-38, 46 и 47, имеющие показанный ниже состав, по методике, аналогичной описанной в примере 1, и определяли количество образовавшейся амидной формы. Результаты показаны в таблице 8. Исходя из данных таблицы понятны следующие факты. А именно, все фармацевтические препараты 31-38, 46 и 47 содержат компонент, который облегчает образование амидной формы, и компонент, который ингибирует образование амидной формы, причем количество образовавшейся амидной формы не превышает 0,2 масс.% при хранении при 60°C в течение 3 недель, и данные препараты являются фармацевтическими композициями по настоящему изобретению. Т.е. было подтверждено, что образование амидной формы подавляется при одновременном включении в состав компонента, который ингибирует образование амидной формы, согласно способу по настоящему изобретению, если этот состав включает компонент, который облегчает образование амидной формы.
|
|
|
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Настоящее изобретение применимо в области лекарственных средств.