Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-ФЕНИЛ[1,2,4]ТРИАЗОЛО[1,5-а]ПИРИДИНА
Вид РИД
Изобретение
Настоящее изобретение относится к новому способу получения производных 2-фенил[1,2,4]триазоло[1,5-а]пиридина формулы I или его соли
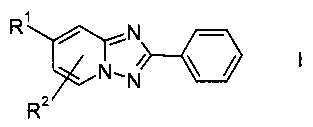
где
R1 обозначает водород, галоген, возможно защищенную гидроксильную группу или возможно защищенную аминогруппу, а
R2 обозначает водород или галоген.
Производные 2-фенил[1,2,4]триазоло[1,5-а]пиридина формулы I с их ядром из 1,2,4-триазола образуют структурный остов огромного количества функционализованных молекул в медицинской химии (J. Am. Chem. Soc. 2009, 131, 15080-15081).
Описан целый ряд попыток синтезировать на практике эти важные молекулы.
Достаточно усовершенствованный подход к данной проблеме, проиллюстрированный на схеме ниже, описан Нагасавой в соавторстве с другими учеными (см. Nagasawa et al. J. Am. Chem. Soc. 2009, 131, 15080-15081).
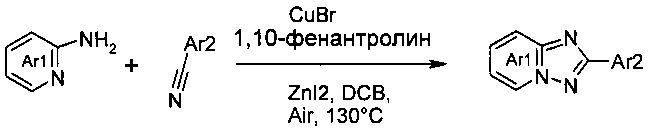
Они обнаружили, что добавление йодида цинка существенно улучшило эффективность реакции, т.е. удвоило выход их целевого продукта. Как сообщалось, наибольшему выходу продукта способствовал растворитель 1,2-дихлорбензол.
Однако было обнаружено, что данная реакция трудно переносима на более крупномасштабные процессы. С одной стороны, применение 1,2-дихлорбензола - ХФУ (хлорфторуглерода) - в промышленных масштабах в качестве растворителя нежелательно из-за его способности разрушать озоновый слой. С другой стороны, было обнаружено, что использование йодида цинка в процессе синтеза 7-бромпроизводных производных 2-фенил-[1,2,4]триазоло[1,5-а]пиридина общей формулы I во многом приводит к образованию побочного продукта - неразделяемого 7-йодпроизводного. Также для отделения чистых продуктов требовались трудоемкие хроматографические чистки сырья.
Таким образом, цель настоящего изобретения заключается в том, чтобы найти способ синтеза, применимый в крупных масштабах и не имеющий недостатков, с которыми столкнулись при известном из существующего уровня техники синтезе.
Данную цель можно достичь раскрываемым в настоящем изобретении способом получения производных 2-фенил[1,2,4]триазоло[1,5-а]пиридина формулы I или их солей
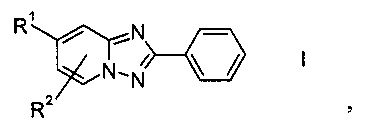
где
R1 обозначает водород, галоген, возможно защищенную гидроксильную группу или возможно защищенную аминогруппу, а
R2 обозначает водород или галоген,
способ включает взаимодействие соединения пиридина формулы II или его соли,
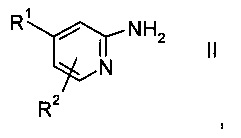
где
R1 и R2 представляют собой такие, как указано выше, с бензонитрилом в присутствии Cu-катализатора, производного 1,10-фенантролина и смеси O2/N2, отличающийся тем, что никакие другие растворители, кроме участвующего в реакции бензонитрила, в способе не применяют.
Ниже с целью иллюстрации приведены определения и области применения различных терминов, используемых в описании настоящего изобретения.
Термин ʺсольʺ обозначает соли соединений формулы I с их неорганическими или органическими кислотами, такими как соляная кислота, бромистоводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, малеиновая кислота, уксусная кислота, фумаровая кислота, янтарная кислота, винная кислота, метансульфокислота, салициловая кислота, p-толуолсульфокислота, трифторуксусная кислота и им подобные. Предпочтительными солями с их кислотами являются формиаты, малеаты, цитраты, гидрохлориды, гидробромиды и соли метансульфокислоты, наиболее предпочтительными являются гидрохлориды и гидробромиды.
Термин ʺзащищенная аминогруппаʺ обозначает аминогруппу, защищенную любыми заместителями, обычно применяемыми для замедления реактивности аминогруппы. Подходящие защищенные аминогруппы приведены в следующем источнике: Green Т., ʺProtective Groups in Organic Synthesisʺ, 4th Ed. by Wiley Interscience, 2007, Chapter 7, 696 ff. Подходящие защищенные аминогруппы можно выбрать из Boc, Fmoc, Cbz, Moz, Troc, Teoc или Voc, в частности применяется Boc.
Термин ʺзащищенная гидроксильная группаʺ обозначает гидроксильную группу, защищенную любыми заместителями, обычно применяемыми для замедления реактивности гидроксильной группы. Подходящие защищенные гидроксильные группы приведены в следующем источнике: Green Т., ʺProtective Groups in Organic Synthesisʺ, 4th Ed. by Wiley Interscience, 2007, Chapter 2, 16 ff. Соответственно, применяются трифторметилсульфонил (Tf), триметилсилил (TMS) или бензил (Bn).
Термин ʺгалогенʺ обозначает хлор, бром или йод.
Соединения пиридина формулы II
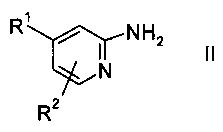
или его соли, где R1 и R2 представляют собой такие, как указано выше, как правило, есть в продаже, в противном случае их можно синтезировать способами, хорошо известными специалистам в данной области.
В конкретном варианте осуществления настоящего изобретения R1 обозначает галоген, a R2 представляет собой водород, в частности, R1 обозначает бром.
Способ согласно настоящему изобретению отличается тем, что участвующий в реакции бензонитрил является единственным растворителем, и никакие дополнительные растворители не применяются.
Далее реакция отличается тем, что значение температуры реакции выбирают из значений между 80°C и 170°C, в более конкретном варианте осуществления настоящего изобретения - между 110°C и 150°C, а в еще более конкретном варианте осуществления настоящего изобретения - около 130°C.
Значение давления реакции можно выбрать из значений между 1 и 100 бар (100 кПа - 10 МПа). В более конкретном варианте осуществления настоящего изобретения значение давления выбирают из значений между 1 и 60 бар (100 кПа - 6 МПа), а в еще более конкретном варианте осуществления настоящего изобретения - между 1 и 20 бар (100 кПа - 2 МПа).
Обнаружили, что увеличение концентрации соединения пиридина формулы II в бензонитриле положительно влияет на выход целевого продукта.
Таким образом, значение концентрации соединения пиридина формулы II в бензонитриле можно выбрать из значений между 2 мас.% и 30 мас.%.
В конкретном варианте осуществления настоящего изобретения концентрация соединения пиридина формулы II в бензонитриле находится между 5 мас.% и 20 мас.%, в частности, между 7 мас.% и 15 мас.%.
Указанный способ получения можно осуществлять с использованием смесей O2/N2, где O2 содержится от 1 об.% до 21 об.%. При этом подразумевается, что вышеуказанные смеси O2/N2 включают в себя воздух.
В более конкретном варианте осуществления настоящего изобретения содержание O2 в смеси O2/N2 находится между 3 об.% и 8 об.%, в частности между 5 об.% и 8 об.%.
Способ согласно настоящему изобретению отличается тем, что присутствует Cu-катализатор.
Как правило, в случае, если R1 в соединении пиридина формулы II для защищенной гидроксильной или защищенной аминогруппы на выбор обозначает бром, выбирают CuBr.
Также CuBr выбирают в случае, если R1 в соединении пиридина формулы II обозначает водород, a R2 обозначает бром или водород.
CuCl выбирают в случае, когда R1 в соединении пиридина формулы II обозначает хлор, a CuI выбирают в случае, когда R1 в соединении пиридина формулы II обозначает йод.
В конкретном варианте осуществления настоящего изобретения, где R1 в соединении пиридина формулы II обозначает, как указывалось выше, бром, Cu-катализатор представляет собой CuBr.
Как правило, Cu-катализатор применяют в количестве от 0,1 мол.% до 20 мол.%, в частности, в количестве от 1 мол.% до 5 мол.% относительно соединения пиридина формулы II.
Далее способ согласно настоящему изобретению отличается тем, что присутствует производное 1,10-фенантролина. Как правило, применяется доступный в свободной продаже моногидрат 1,10-фенантролина.
Как правило, производное 1,10-фенантролина применяется в количестве от 0,1 мол.% до 20 мол.%, в частности, в количестве от 1 мол.% до 5 мол.% относительно соединения пиридина формулы II.
Хотя специалисты в данной области понимают, что время протекания реакции может различаться в зависимости от заданных параметров реакции, как правило, примерно после 20-30 ч реакция завершена.
Отделение требуемого производного 2-фенил-[1,2,4]триазоло[1,5-а]пиридина формулы I от реакционной смеси можно, как правило, проводить фильтрацией. Дальнейшая очистка сырого продукта может проходить в виде угольной очистки раствора продукта, например, в таком подходящем растворителе, как этилацетат, и в виде последующей кристаллизации.
Примеры
Аббревиатуры:
к.т. = комнатная температура, DCM = дихлорметан, THF = тетрагидрофуран, TBME = трет-бутилметиловый эфир, EtOAc = этилацетат, NCMe = ацетонитрил.
Сравнительный пример 1 (с Znl2, но без дополнительного растворителя)
7-Бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин
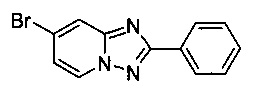
Смесь 2-амино-4-бромопиридина (5,00 г, 28,9 ммоль), бромида меди (I) (207 мг, 1,44 ммоль), моногидрата 1,10-фенантролина (289 мг, 1,44 ммоль), йодида цинка (923 мг, 2,89 ммоль) и бензонитрила (125 мл) нагревали в трехгорлой колбе объемом 250 мл до 130°C. В течение 23 ч через реакционную смесь выходил слабый поток воздуха в виде пузырьков (конверсия 93%, см. метод ВЭЖХ в примере 1.3). Затем темно-коричневую суспензию охлаждали до 0-5°C и фильтровали. Фильтрационный кек промывали ТВМЕ (50 мл) и сушили до выхода твердого сырого 7-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридина (5,36 г, 51%) зеленого цвета с чистотой 76,0% (пик ВЭЖХ, %, см. метод ВЭЖХ в примере 1.3). Основной побочный продукт представлял собой 7-йодо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин (13,0%).
Угольная очистка сырого продукта активированным углем марки Norit SA II (1,1 г) в EtOAc (200 мл) при противотоке и последующей кристаллизации (посредством частичного испарения EtOAc) позволяла получать твердый 7-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин (3,71 г, 40%) белого цвета с чистотой 90,4% (пик ВЭЖХ, %, см. метод ВЭЖХ ниже), содержащий в качестве неразделяемой примеси 8,6% 7-йодо-2-фенил-[1,2,4]триазоло[1,5-а]пиридина (метод ВЭЖХ: фенильная колонка X-Bridge Phenyl column, 50×4,6 мм; подвижная фаза, A: вода/NCMe (95:5), B: NCMe, C: глициновый буфер pH 9; расход: 2,5 мл/мин; градиент от 90/5/5 (A/B/C) до 10/85/5 (A/B/C) в пределах 4 мин, изократические 10/85/5 (A/B/C) в течение 1 мин. Время удерживания: 1,37 мин (2-амино-4-бромопиридин), 2,54 мин (7-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин), 2,67 мин (7-йодо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин)).
Сравнительный пример 2 (согласно JACS. 2009, 131, 15080-15081)
7-Бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин
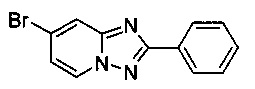
Смесь 2-амино-4-бромопиридина (0,50 г, 2,89 ммоль), бромида меди (I) (20,7 мг, 0,14 ммоль), моногидрата 1,10-фенантролина (28,9 мг, 0,14 ммоль), йодида цинка (92,3 мг, 0,29 ммоль), бензонитрила (298 мг, 0,29 мл, 2,89 ммоль) и 1,2-дихлорбензола (25 мл) нагревали в трехгорлой колбе объемом 100 мл до 130°C. В течение 22 ч через реакционную смесь выходил слабый поток воздуха в виде пузырьков (конверсия 69%, см. метод ВЭЖХ в примере 1.3). Затем темно-коричневую суспензию охлаждали до 0-5°C и фильтровали. Фильтрационный кек промывали EtOAc (30 мл) и смешанные фильтраты концентрировали в вакууме до испарения большей части EtOAc. Получившийся в результате раствор сырого продукта в 1,2-дихлорбензоле затем загружали в колонку с силикагелем с целью получить на выходе после хроматографии (соотношение гексана к EtOAc - от 9:1 до 7:3) твердый 7-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин (345 мг, 41%) желтоватого цвета с чистотой 97,6% (пик ВЭЖХ, %, см. метод ВЭЖХ в сравнительном примере 1), содержащий в качестве неразделяемой примеси 1,4% 7-йодо-2-фенил-[1,2,4]триазоло[1,5-а]пиридина.
Пример 1.1
7-Бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин
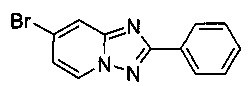
Смесь 2-амино-4-бромопиридина (10,0 г, 56,6 ммоль), бромида меди (I) (400 мг, 2,70 ммоль), моногидрата 1,10-фенантролина (560 мг, 2,80 ммоль) и бензонитрила (130 мл) нагревали в четырехгорлой колбе объемом 350 мл до 130°C. В течение 45 ч через реакционную смесь выходил слабый поток O2/N2 в виде пузырьков (5:95) (конверсия >99%, см. метод ВЭЖХ ниже). Затем темно-коричневую суспензию охлаждали до 0-5°C и фильтровали. Фильтрационный кек промывали ТВМЕ (50 мл) и сушили до получения твердого сырого 7-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридина (11,6 г, 75%) зеленого цвета с чистотой 100% (пик ВЭЖХ, %, см. метод ВЭЖХ ниже).
Угольная очистка сырого продукта активированным углем марки Norit SA II (2,5 г) в EtOAc (400 мл) при противотоке и последующей кристаллизации (посредством частичного испарения EtOAc) позволяла получать твердый 7-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин (9,81 г, 63%) белого цвета с чистотой 100% (пик ВЭЖХ, %, метод ВЭЖХ: монолитная колонка Onyx monolithic С18 column, 100×4,6 мм; подвижная фаза, A: вода/NCMe (95:5), B: NCMe; расход: 2 мл/мин; градиент от 95/5 (A/B) до 15/85 (A/B) в пределах 3 мин, изократические 15/85 (A/B) в течение 2,5 мин, градиент от 15/85 (A/B) до 95/5 (A/B) в пределах 2 мин. Время удерживания: 2,50 мин (2-амино-4-бромопиридин), 3,39 мин (7-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин)).
По методу масс-спектрометрии с электронной ионизацией отношение массы к заряду составляет 273,99 (М+Н)+. (EI-MS: m/z=273,99 (М+Н)+)
Пример 1.2a-d
7-Бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин
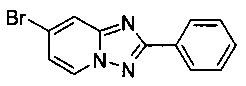
Смесь 2-амино-4-бромопиридина (1,00 г, 5,66 ммоль), бромида меди (I) (41,5 мг, 0,28 ммоль), моногидрата 1,10-фенантролина (56,7 мг, 0,28 ммоль) и бензонитрила (13 мл) нагревали в четырехгорлой колбе объемом 100 мл до 110°C. В течение 23 ч через реакционную смесь выходил слабый поток O2/N2 в виде пузырьков (5:95) (конверсия >99%, см. метод ВЭЖХ в примере 1.1). Затем темно-коричневую суспензию охлаждали до 0-5°C и фильтровали. Фильтрационный кек промывали ТВМЕ (50 мл) и сушили до получения твердого сырого 7-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридина (1,21 г, 79%) зеленого цвета с чистотой 99,0% (пик ВЭЖХ, %, см. метод ВЭЖХ в примере 1.1).
Реакции, примеры которых приведены в Таблице 1, проводили согласно вышеописанной процедуре, но при повышенной температуре:
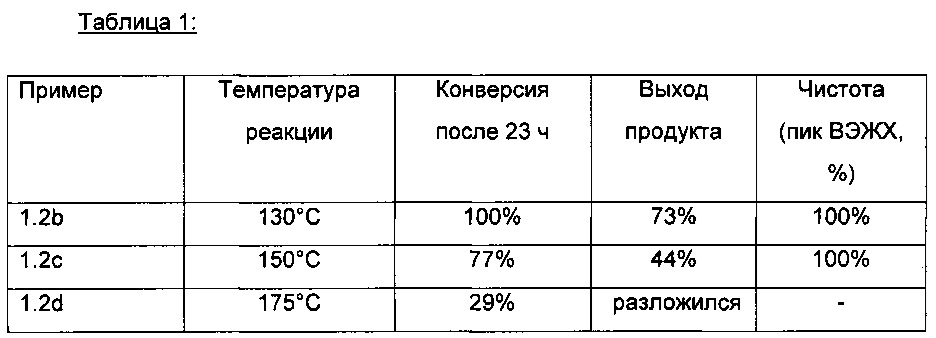
Пример 1.3
7-Бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин
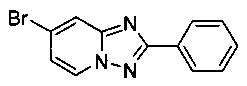
Смесь 2-амино-4-бромопиридина (5,00 г, 28,9 ммоль), бромида меди (I) (207 мг, 1,44 ммоль), моногидрата 1,10-фенантролина (289 мг, 1,44 ммоль) и бензонитрила (125 мл) нагревали в трехгорлой колбе объемом 250 мл до 130°C. В течение 23 ч через реакционную смесь выходил слабый поток воздуха в виде пузырьков (конверсия 80%, см. метод ВЭЖХ ниже). Затем темно-коричневую суспензию охлаждали до 0-5°C и фильтровали. Фильтрационный кек промывали ТВМЕ (50 мл) и сушили до получения твердого сырого 7-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридина (4,87 г, 60%) зеленого цвета с чистотой 97,3% (пик ВЭЖХ, %, см. метод ВЭЖХ ниже).
Угольная очистка сырого продукта активированным углем марки Norit SA II (1,0 г) в EtOAc (200 мл) при противотоке и последующей кристаллизации (посредством частичного испарения EtOAc) позволяла получать твердый 7-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин (3,97 г, 50%) белого цвета с чистотой 98,9% (пик ВЭЖХ, %, метод ВЭЖХ: колонка X-Bridge С18 column, 150×4,6 мм; подвижная фаза, A: вода/NCMe (95:5), B: NCMe, C: буфер NBu4HSO4 с pH 3-4; расход: 1,5 мл/мин; градиент от 90/0/10 (A/B/C) до 5/85/10 (A/B/C) в пределах 6 мин, изократические 5/85/10 (A/B/C) в течение 4 мин. Время удерживания: 2,25 мин (2-амино-4-бромопиридина), 3,00 мин (N-(4-бромо-пиридин-2-ил)-бензамидин), 6,40 мин (7-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин), 6,62 мин (7-йодо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин)).
Пример 1.4
7-Бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин
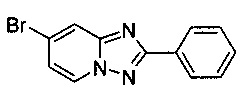
Смесь 2-амино-4-бромопиридина (5,00 г, 28,9 ммоль), бромида меди (I) (207 мг, 1,44 ммоль), моногидрата 1,10-фенантролина (289 мг, 1,44 ммоль) и бензонитрила (65 мл) нагревали в четырехгорлой колбе объемом 100 мл до 130°C. В течение 23 ч через реакционную смесь выходил слабый поток воздуха в виде пузырьков (конверсия >99%, см. метод ВЭЖХ в примере 1.3). Затем темно-коричневую суспензию охлаждали до 0-5°C и фильтровали. Фильтрационный кек промывали ТВМЕ (50 мл) и сушили до получения твердого сырого 7-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридина (6,13 г, 75%) зеленого цвета с чистотой 97,1% (пик ВЭЖХ, %, см. метод ВЭЖХ в примере 1.3).
Угольная очистка сырого продукта активированным углем марки Norit SA II (1,2 г) в EtOAc (220 мл) при противотоке и последующей кристаллизации (посредством частичного испарения EtOAc) позволяла получать твердый 7-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин (5,23 г, 65%) белого цвета с чистотой 98,8% (пик ВЭЖХ, %, см. метод ВЭЖХ в примере 1.3).
Пример 1.5
7-Бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин
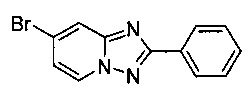
Смесь 2-амино-4-бромопиридина (5,00 г, 28,9 ммоль), бромида меди (I) (207 мг, 1,44 ммоль), моногидрата 1,10-фенантролина (289 мг, 1,44 ммоль) и бензонитрила (40 мл) нагревали в четырехгорлой колбе объемом 100 мл до 130°C. В течение 23 ч через реакционную смесь выходил слабый поток воздуха в виде пузырьков (конверсия 91%, см. метод ВЭЖХ в примере 1.3). Затем темно-коричневую суспензию охлаждали до 0-5°C и фильтровали. Фильтрационный кек промывали ТВМЕ (50 мл) и сушили до получения твердого сырого 7-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридина (6,39 г, 72%) зеленого цвета с чистотой 89,4% (пик ВЭЖХ, %, см. метод ВЭЖХ в примере 1.3).
Пример 1.6
7-Бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин
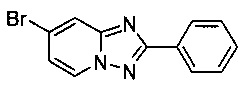
Смесь 2-амино-4-бромопиридина (5,00 г, 28,3 ммоль), бромида меди (I) (207 мг, 1,44 ммоль), моногидрата 1,10-фенантролина (284 мг, 1,44 ммоль) и бензонитрила (60 мл) нагревали в автоклаве объемом 380 мл до 130°C и перемешивали в течение 23 ч при давлении O2/N2 (5:95) в 20 бар. Затем после вентилирования и открытия автоклава (конверсия 100%, см. метод ВЭЖХ в примере 1.3) темно-коричневую реакционную суспензию охлаждали до 0-5°C и фильтровали. Фильтрационный кек промывали ТВМЕ (40 мл) и сушили до получения твердого сырого 7-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридина (5,12 г, 64%) зеленого цвета с чистотой 97,0% (пик ВЭЖХ, %, см. метод ВЭЖХ в примере 1.3).
Угольная очистка сырого продукта активированным углем марки Norit SA II (1,0 г) в EtOAc (200 мл) при противотоке и последующей кристаллизации (посредством частичного испарения EtOAc) позволяла получать твердый 7-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин (4,18 г, 53%) белого цвета с чистотой 99,2% (пик ВЭЖХ, %, см. метод ВЭЖХ в примере 1.3).
Пример 1.7
7-Бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин
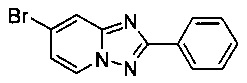
Смесь 2-амино-4-бромопиридина (5,00 г, 28,3 ммоль), бромида меди (I) (207 мг, 1,44 ммоль), моногидрата 1,10-фенантролина (284 мг, 1,44 ммоль) и бензонитрила (125 мл) нагревали в автоклаве объемом 380 мл до 130°C и перемешивали в течение 23 ч при давлении воздуха в 20 бар. Затем после вентилирования и открытия автоклава (конверсия 100%, см. метод ВЭЖХ в примере 1.3) темно-коричневую реакционную суспензию охлаждали до 0-5°C и фильтровали. Фильтрационный кек промывали ТВМЕ (40 мл) и сушили до получения твердого сырого 7-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридина (4,74 г, 60%) зеленого цвета с чистотой 97,7% (пик ВЭЖХ, %, см. метод ВЭЖХ в примере 1.3).
Угольная очистка сырого продукта активированным углем марки Norit SA II (0,9 г) в EtOAc (200 мл) при противотоке и последующей кристаллизации (посредством частичного испарения EtOAc) позволяла получать твердый 7-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин (3,76 г, 48%) белого цвета с чистотой 99,4% (пик ВЭЖХ, %, см. метод ВЭЖХ в примере 1.3).
Пример 1.8
7-Бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин
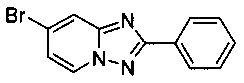
Смесь 2-амино-4-бромопиридина (5,00 г, 28,3 ммоль), бромида меди (I) (207 мг, 1,44 ммоль), моногидрата 1,10-фенантролина (284 мг, 1,44 ммоль) и бензонитрила (60 мл) нагревали в автоклаве объемом 380 мл до 130°C и перемешивали в течение 23 ч при давлении O2/N2 (5:95) в 60 бар. Затем после вентилирования и открытия автоклава (конверсия 100%, см. метод газовой хроматографии (GC) ниже) темно-коричневую реакционную суспензию охлаждали до 0-5°C и фильтровали. Фильтрационный кек промывали ТВМЕ (40 мл) и сушили до получения твердого сырого 7-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридина (5,71 г, 74%) зеленого цвета с чистотой 100% (пик GC, %, метод газовой хроматографии: колонка J&W 113-5432 SE-54 (30 м, внутренний диаметр - 0,32 мм); температура печи сначала 80°C - 140°C (5°C/мин и держится в течение 5 мин), затем повышается до 280°C (10°C/мин и держится в течение 5 мин), температура инжектора - 250°C, температура детектора - 300°C, газ носитель - H2 (66 кПа), коэффициент деления - 1/20. Подготовка пробы: 1-1,5 мг пробы растворяли в 1 мл метанола, вводили 2 мкл пробы. Время удерживания: 10,4 мин (2-амино-4-бромопиридин), 12,1 мин (бензамид), 26,9 (3,5-дифенил-1,2,4-оксадиазол), 29,8 мин (7-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин)).
Пример 1.9
7-Бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин
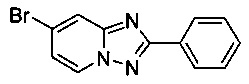
Смесь 2-амино-4-бромопиридина (100,0 г, 0,566 моль), бромида меди (I) (4,15 г, 28,3 ммоль), моногидрата 1,10-фенантролина (5,67 г, 28,3 ммоль) и бензонитрила (600 мл) нагревали в автоклаве объемом 1,5 л до 130°C и перемешивали в течение 23 ч при постоянном расходе газа (O2/N2 8:92) в 200 мл/мин (постоянное давление - 20 бар). Затем после вентилирования и открытия автоклава (конверсия 100%, см. метод газовой хроматографии в примере 1.8) темно-коричневую реакционную суспензию охлаждали до 0-5°C и фильтровали. Фильтрационный кек промывали MeOH (600 мл) и сушили до получения твердого сырого 7-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридина (120,6 г, 78%) зеленого цвета с чистотой 100% (пик ВЭЖХ, %, см. метод газовой хроматографии в примере 1.8).
Пример 2
7-Йодо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин
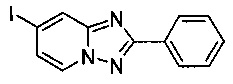
Смесь 2-амино-4-йодопиридина (2,60 г, 11,8 ммоль), йодида меди (I) (115 мг, 0,60 ммоль), моногидрата 1,10-фенантролина (120 мг, 0,60 ммоль) и бензонитрила (33 мл) нагревали в четырехгорлой колбе объемом 100 мл до 130°C. В течение 23 ч через реакционную смесь выходил слабый поток O2/N2 (5:95) в виде пузырьков (конверсия 99%, см. метод ВЭЖХ ниже). Затем темно-коричневую суспензию охлаждали до 0-5°C и фильтровали. Фильтрационный кек промывали ТВМЕ (10 мл) и сушили до получения твердого сырого 7-йодо-2-фенил-[1,2,4]триазоло[1,5-а]пиридина (2,31 г, 61%) зеленого цвета с чистотой 100% (пик ВЭЖХ, %, см. метод ВЭЖХ ниже).
Угольная очистка сырого продукта активированным углем марки Norit SA II (0,6 г) в EtOAc (100 мл) при противотоке и последующей кристаллизации (посредством частичного испарения EtOAc) позволяла получать твердый 7-йодо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин (1,82 г, 48%) белого цвета с чистотой 100% (пик ВЭЖХ, %, метод ВЭЖХ: монолитная колонка Onyx monolithic С18 column, 100×4,6 мм; подвижная фаза, А: вода/NCMe (95:5), В: NCMe; расход: 2 мл/мин; градиент от 95/5 (A/B) до 15/85 (A/B) в пределах 3 мин, изократические 15/85 (A/B) в течение 2,5 мин, градиент от 15/85 (A/B) до 95/5 (A/B) в пределах 2 мин. Время удерживания: 2,77 мин (2-амино-4-йодопиридин), 3,51 мин (7-йодо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин)).
По методу масс-спектрометрии с электронной ионизацией отношение массы к заряду составляет 321,98 (М+Н)+ (EI-MS: m/z=321,98 (М+Н)+).
Пример 3
7-Амино-2-фенил-[1,2,4]триазоло[1,5-а]пиридин
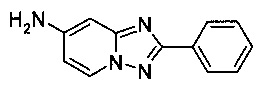
Смесь 2,4-диамино-пиридина (1,26 г, 11,5 ммоль), бромида меди (I) (82,8 мг, 0,57 ммоль), моногидрата 1,10-фенантролина (114,0 мг, 0,57 ммоль) и бензонитрила (13 мл) нагревали в трехгорлой колбе объемом 50 мл до 150°C. В течение 41 ч через реакционную смесь выходил слабый поток O2/N2 (5:95) в виде пузырьков (конверсия 42%, см. метод ВЭЖХ ниже). Затем реакционную смесь фильтровали. Получившийся в результате раствор чисто коричневого цвета выпаривали досуха, а сырой продукт очищали использующимся в хромотографии силикагелем (соотношение гексана к EtOAc - 2:8) с целью получить твердый 7-амино-2-фенил-[1,2,4]триазоло[1,5-а]пиридин (0,72 г, 29%) светло желтого цвета с чистотой 99,0% (пик ВЭЖХ, %, метод ВЭЖХ: колонка X-Bridge С18 column, 150×4,6 мм; подвижная фаза, A: вода/NCMe (95:5), B: NCMe, C: буфер NBu4HSO4 с pH 3-4; расход: 1,5 мл/мин; градиент от 90/0/10 (A/B/C) до 5/85/10 (A/B/C) в пределах 6 мин, изократические 5/85/10 (A/B/C) в пределах 4 мин. Время удерживания: 0,95 мин (2,4-диамино-пиридин), 4,08 мин (7-амино-2-фенил-[1,2,4]триазоло[1,5-а]пиридин)).
По методу масс-спектрометрии с электронной ионизацией отношение массы к заряду составляет 211,09 (М+Н)+ (EI-MS: m/z=211,09 (М+Н)+).
Пример 4
7-Хлоро-2-фенил-[1,2,4]триазоло[1,5-а]пиридин
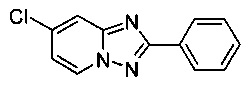
Смесь 2-амино-4-хлорпиридина (5,00 г, 38,9 ммоль), хлорида меди (I) (195 мг, 1,97 ммоль), моногидрата 1,10-фенантролина (390 мг, 1,97 ммоль) и бензонитрила (65 мл) нагревали в четырехгорлой колбе объемом 100 мл до 130°C. В течение 23 ч через реакционную смесь выходил слабый поток O2/N2 (5:95) в виде пузырьков (конверсия >99%, см. метод ВЭЖХ ниже). Затем темно-коричневую суспензию охлаждали до 0-5°C и фильтровали. Фильтрационный кек промывали ТВМЕ (50 мл) и сушили до получения твердого сырого 7-хлоро-2-фенил-[1,2,4]триазоло[1,5-а]пиридина (7,09 г, 79%) зеленого цвета с чистотой 100% (пик ВЭЖХ, %, см. метод ниже).
Угольная очистка сырого продукта активированным углем марки Norit SA II (1,50 г) в EtOAc (240 мл) при противотоке и последующей кристаллизации (посредством частичного испарения EtOAc) позволяла получать твердый 7-хлоро-2-фенил-[1,2,4]триазоло[1,5-а]пиридин (6,25 г, 70%) белого цвета с чистотой 100% (пик ВЭЖХ, %, метод: монолитная колонка Onyx Monolithic С18 column, 100×4,6 мм; подвижная фаза, A: вода с 5% NCME, B: NCMe; расход: 2 мл/мин; градиент от 95/5 (A/B) до 15/85 (A/B) в пределах 3 мин, изократические 15/85 (A/B) в течение 2,5 мин, градиент от 15/85 (A/B) до 95/5 (A/B) в пределах 2 мин. Время удерживания: 2,53 мин (2-амино-4-хлорпиридин), 3,31 мин (7-хлоро-2-фенил-[1,2,4]триазоло[1,5-а]пиридин)).
По методу масс-спектрометрии с электронной ионизацией отношение массы к заряду составляет 230,3 (М+Н)+ (EI-MS: m/z=230,3 (М+Н)+).
Пример 5
8-Бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин
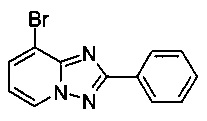
Смесь 2-амино-3-бромопиридина (2,00 г, 11,2 ммоль), бромида меди (I) (240 мг, 1,64 ммоль), моногидрата 1,10-фенантролина (336 мг, 1,68 ммоль) и бензонитрила (25 мл) нагревали в трехгорлой колбе объемом 50 мл до 130°C. В течение 4 дней через реакционную смесь выходил слабый поток O2/N2 (5:95) в виде пузырьков (конверсия >99%, см. метод ВЭЖХ ниже). Затем темно-коричневую суспензию охлаждали до 0-5°C и фильтровали. Фильтрационный кек промывали ТВМЕ (10 мл) и сушили до получения твердого сырого 8-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридина (1,85 г, 60%) светло-коричневого цвета с чистотой 97,5% (пик ВЭЖХ, %, см. метод ВЭЖХ ниже).
Угольная очистка сырого продукта активированным углем марки Norit SA II (0,4 г) в EtOAc (65 мл) при противотоке и последующей кристаллизации (посредством частичного испарения EtOAc) позволяла получать твердый 8-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин (1,07 г, 35%) желтоватого цвета с чистотой >99,9% (пик ВЭЖХ, %, метод ВЭЖХ: монолитная колонка Опух monolithic С18 column, 100×4,6 мм; подвижная фаза, A: вода/NCMe (95:5), B: NCMe; расход: 2,0 мл/мин; градиент от 95/5 (A/B) до 15/85 (A/B) в пределах 3 мин, изократические 15/85 (A/B) в течение 2,5 мин. Время удерживания: 2,34 мин (2-амино-3-бромопиридин), 3,32 мин (8-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин).
По методу масс-спектрометрии с электронной ионизацией отношение массы к заряду составляет 274,00 (М+Н)+ (EI-MS: m/z=274,00 (М+Н)+).
Пример 6
6-Бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин
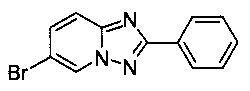
Смесь 2-амино-5-бромопиридина (2,00 г, 11,6 ммоль), бромида меди (I) (160 мг, 1,09 моль), моногидрата 1,10-фенантролина (225 мг, 1,12 ммоль) и бензонитрила (25 мл) нагревали в трехгорлой колбе объемом 50 мл до 130°C. В течение 24 ч через реакционную смесь выходил слабый поток O2/N2 (5:95) в виде пузырьков (конверсия >97%, см. метод ВЭЖХ ниже). Затем темно-коричневую суспензию охлаждали до 0-5°C и фильтровали. Фильтрационный кек промывали ТВМЕ (10 мл) и сушили до получения твердого сырого 6-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридина (1,14 г, 36%) светло-коричневого цвета с чистотой 99,7% (пик ВЭЖХ, %, см. метод ВЭЖХ ниже).
Угольная очистка сырого продукта активированным углем марки Norit SA II (0,25 г) в EtOAc (40 мл) при противотоке и последующей кристаллизации (посредством частичного испарения EtOAc) позволяла получать твердый 6-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин (0,83 г, 26%) белого цвета с чистотой>99,9% (пик ВЭЖХ, %, метод ВЭЖХ: монолитная колонка Опух monolithic С18 column, 100×4,6 мм; подвижная фаза, A: вода/NCMe (95:5), B: NCMe; расход: 2,0 мл/мин; градиент от 95/5 (A/B) до 15/85 (A/B) в пределах 3 мин, изократические 15/85 (A/B) в течение 2,5 мин. Время удерживания: 2,34 мин (2-амино-5-бромопиридин), 3,45 мин (6-бромо-2-фенил-[1,2,4]триазоло[1,5-а]пиридин).
По методу масс-спектрометрии с электронной ионизацией отношение массы к заряду составляет 274,00 (М+Н)+ (EI-MS: m/z=274,00 (М+Н)+).
Пример 7
2-Фенил-[1,2,4]триазоло[1,5-а]пиридин
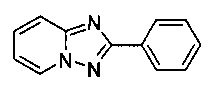
Смесь 2-амино-пиридина (2,00 г, 21,0 ммоль), бромида меди (I) (160 мг, 1,09 ммоль), моногидрата 1,10-фенантролина (225 мг, 1,12 ммоль) и бензонитрила (25 мл) нагревали в трехгорлой колбе объемом 50 мл до 130°C. В течение 27 ч через реакционную смесь выходил слабый поток O2/N2 (5:95) в виде пузырьков (конверсия >99%, см. метод ВЭЖХ ниже). Затем темно-коричневую суспензию охлаждали до 0-5°C и фильтровали. Фильтрат выпаривали при 60°C / 0,1 мбар досуха, а темно-коричневый остаток растворяли в DCM (30 мл). Органический раствор промывали водой (30 мл), высушивали сульфатом натрия, фильтровали и выпаривали до получения 6,07 г сырого 2-фенил-[1,2,4]триазоло[1,5-а]пиридина, содержащего примерно 4 г остаточного бензонитрила.
Угольная очистка сырого продукта активированным углем марки Norit SA II (0,90 г) в EtOAc (140 мл) при противотоке и последующей кристаллизации (посредством частичного испарения EtOAc и добавления гептана) позволяла получать твердый 2-фенил-[1,2,4]триазоло[1,5-а]пиридин (2,00 г, 48%) желтоватого цвета с чистотой >99,9% (пик ВЭЖХ, %, метод ВЭЖХ: монолитная колонка Onyx monolithic С18 column, 100×4,6 мм; подвижная фаза, A: вода/NCMe (95:5), B: NCMe; расход: 2,0 мл/мин; градиент от 95/5 (A/B) до 15/85 (A/B) в пределах 3 мин, изократические 15/85 (A/B) в течение 2,5 мин. Время удерживания: 1,63 мин (2-амино-пиридин), 2,85 мин (2-фенил-[1,2,4]триазоло[1,5-а]пиридин).
По методу масс-спектрометрии с электронной ионизацией отношение массы к заряду составляет 196,09 (М+Н)+ (EI-MS: m/z=196,09 (М+Н)+).
Пример 8
7-Бензилокси-2-фенил-[1,2,4]триазоло[1,5-а]пиридин
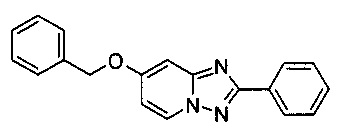
Смесь 2-амино-4-бензилоксипиридина (2,00 г, 9,49 ммоль), бромида меди (I) (70 мг, 0,05 ммоль), моногидрата 1,10-фенантролина (95 мг, 0,05 ммоль) и бензонитрила (25 мл) нагревали в трехгорлой колбе объемом 50 мл до 130°C. В течение 23 ч через реакционную смесь выходил слабый поток O2/N2 (5:95) в виде пузырьков (конверсия >99%, см. метод ВЭЖХ ниже). Затем темно-коричневый раствор выпаривали при 60°C /0,1 мбар досуха, а темно-коричневый остаток растворяли в DCM (30 мл). Органический раствор промывали водой (30 мл), высушивали сульфатом натрия, фильтровали и выпаривали до получения темного масла, содержащего сырой 7-бензилокси-2-фенил-[1,2,4]триазоло[1,5-а]пиридин и остатки бензонитрила.
Угольная очистка сырого продукта активированным углем марки Norit SA II (0,90 г) в EtOAc (120 мл) при противотоке, фильтрации и последующей кристаллизации (посредством частичного испарения EtOAc и добавления гептана) позволяла получать твердый 7-бензилокси-2-фенил-[1,2,4]триазоло[1,5-а]пиридин (1,78 г, 62%) желтоватого цвета с чистотой >99,9% (пик ВЭЖХ, %, метод ВЭЖХ: монолитная колонка Onyx monolithic С18 column, 100×4,6 мм; подвижная фаза, A: вода/NCMe (95:5), B: NCMe; расход: 2,0 мл/мин; градиент от 95/5 (A/B) до 15/85 (A/B) в пределах 3 мин, изократические 15/85 (A/B) в течение 2,5 мин. Время удерживания: 3,40 мин (2-амино-4-бензилоксипиридин), 3,60 мин (7-бензилокси-2-фенил-[1,2,4]триазоло[1,5-а]пиридин).
По методу масс-спектрометрии с электронной ионизацией отношение массы к заряду составляет 302,13 (М+Н)+ (EI-MS: m/z=302,13 (М+Н)+).
![СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-ФЕНИЛ[1,2,4]ТРИАЗОЛО[1,5-а]ПИРИДИНА](https://fips.edrid.ru/images/rid/68/ee/b5/c492506e9b09e01095921e711227b502.jpg)
![СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-ФЕНИЛ[1,2,4]ТРИАЗОЛО[1,5-а]ПИРИДИНА](https://fips.edrid.ru/images/rid/68/ee/b5/3e938bdf70c46b6f488cc15371449b22.jpg)
![СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-ФЕНИЛ[1,2,4]ТРИАЗОЛО[1,5-а]ПИРИДИНА](https://fips.edrid.ru/images/rid/68/ee/b5/eb4651ceb006c76602a22f8567f94211.jpg)
![СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-ФЕНИЛ[1,2,4]ТРИАЗОЛО[1,5-а]ПИРИДИНА](https://fips.edrid.ru/images/rid/68/ee/b5/18fb821e4bf943f777b2f3c4bf5be076.jpg)

