Результат интеллектуальной деятельности: СПОСОБ ОКРАШИВАНИЯ ПРЕПАРАТОВ ЦЕЛЬНЫХ БИОЛОГИЧЕСКИХ ТКАНЕЙ И ОРГАНОВ МЕТОДОМ КЛИК-ГИСТОХИМИИ (ВАРИАНТЫ)
Вид РИД
Изобретение
Предлагаемая группа изобретений относится к области экспериментальной биологии и медицины, где необходимо приготовление препаратов цельных биологических тканей и органов для оптической проекционной, блок-фэйс и серийной двухфотонной томографии, конфокальной, мультифотонной и светоплоскостной микроскопии с целью получения трехмерных карт гистологической локализации популяций клеток, меченных этинильным маркером. Изобретения могут быть использованы для предклинических испытаний фармакологических препаратов и оценки физиологических воздействий на организм, а также для работы с материалом биопсий в диагностических и исследовательских целях.
В последние годы в связи с развитием методов трехмерной микроскопии и оптической томографии возникла потребность в новых методах детекции различных популяций клеток в цельных (несекционированных) биологических образцах. В настоящий момент с этой целью используют иммуногистохимические техники. Несмотря на достоинства иммуногистохимии, ее использование для окрашивания крупных образцов ткани затруднено ограниченной проницаемостью высокомолекулярных соединений, таких как антитела, вглубь биологического образца. Это обуславливает длительность процесса иммуногистохимического окрашивания цельных образцов.
В последние годы в качестве альтернативы иммуногистохимической реакции стали использовать клик-реакции, в частности реакцию [3+2] алкил-азидного циклоприсоединения. Для этого животному вводят в качестве экзогенного маркера алкильную (обычно этинильную) группу, которую детектируют затем при помощи флуоресцентно меченного азида. Несмотря на то, что молекулы азида почти 1/500 раз меньше молекулы антител, благодаря чему они имеют гораздо более высокую скорость диффузии внутрь ткани, данный метод для окрашивания цельных образцов биологической ткани до сих пор практически не использовался.
Известен способ клик-гистохимического окрашивания цельных образцов биологической ткани, в котором использовали нефиксированные образцы тонкого кишечника толщиной 1-2 см, для чего у мышей маркировали пролиферирующие клетки внутрибрюшинным введением 100-200 мкг 5-этинил-2'-дезоксиуридина (EdU), забирали образцы через 24, 48 или 96 ч после инъекции, отмывали их фосфатным буфером, а затем инкубировали в течение 30 мин в свежеприготовленном растворе, содержащем 100 мМ Tris (pH 8.5), 0.5-1 мМ CuSO4, 100 мкМ азида, конъюгированного с TMR, 50-100 мМ аскорбиновой кислоты, после чего образцы отмывали буфером, фиксировали формальдегидом и несколько раз промывали фосфатным буфером с 0.2% Triton Х-100 [Salic A., Mitchison Т.J. A chemical method for fast and sensitive detection of DNA synthesis in vivo // Proc. Natl. Acad. Sci. USA. - 2008. - V. 105. - №7. - Р. 2415-2420].
Однако описанный в данной работе способ применялся к нефиксированным образцам ткани взрослых животных, в то время как фиксированная ткань обладает большей гидрофобностью в сравнение с нефиксированной и, как следствие, худшей проницаемостью для реагентов. Оценка глубины окрашивания не производилась. Реакционная смесь, применяемая в данной работе, не позволяет проводить клик-реакцию в течение длительного времени, необходимого для окрашивания крупных образцов, вследствие быстрого снижения ее реакционной способности.
Известен способ клик-гистохимического окрашивания цельных эмбрионов курицы (до 18 стадии), которых маркировали 500 мкМ - 2 мМ EdU в течение 4 ч, фиксировали в растворе 4% параформальдегида в течение ночи при 4°С, отмывали 3 раза по 3 мин в фосфатном буфере, затем 3 мин в воде, 2 раза по 3 мин в 3% БСА на фосфатном буфере, затем пермеабилизировали в растворе 0.5% Triton Х-100 в течение 20 мин, инкубировали 2 раза по 3 мин 3% БСА на фосфатном буфере при комнтаной температуре, затем проводили клик-реакцию с азидом, конъюгированным с AlexaFluor488 при помощи Click-iT™ Kit (Invitrogen, США) в течение 30 мин в темноте и отмывали в 3% БСА на фосфатном буфере [Warren М., Puskarczyk K., Chapman S.C. Chick embryo proliferation studies using EdU labeling // Dev. Dyn. - 2009. - V. 238. - №4. - P. 944-949].
Однако описанный в данной работе способ применялся к образцам малого размера (толщина до 500 мкм), использовались эмбрионы, а не ткани взрослых животных, в то время как использование гистохимических техник в зрелой ткани, в особенности в нервной системе, в отличие от эмбриональной ткани, сильно затруднено вследствие ее высокой гидрофобности. Образцы эмбрионов старше 72 ч прокрашивались не полностью. Реакционная смесь, применяемая в данной работе, не позволяет проводить клик-реакцию в течение длительного времени, необходимого для окрашивания крупных образцов, вследствие быстрого снижения ее реакционной способности.
Известен способ клик-гистохимического окрашивания цельных хрусталиков взрослых мышей, в котором у мышей маркировали пролиферирующие клетки внутрибрюшинным введением 100-200 мкг EdU за 1 ч до декапитации, изолированные хрусталики фиксировали 10% нейтральным формалином при комнатной температуре в течение 10 мин, после чего отмывали и пермеабилизировали образцы в растворе 0.5% Triton-X100 на фосфатном буфере в течение 1 ч, а затем проводили клик-реакцию с азидом, конъюгированным с AlexaFluor488 при помощи Click-iT™ Kit (Invitrogen, США) в течение 1 ч в темноте, по окончанию окраски хрусталики отмывали фосфатным буфером с 0.03% азидом натрия в течение 1 ч при 4°С [Wiley L.A., Shui Y.B., Beebe D.C. Visualizing lens epithelial cell proliferation in whole lenses // Mol. Vis. - 2010. - V. 16. - Р. 1253-1259].
Описанный в данной работе способ применялся к небольшим образцам ткани взрослых животных размером до 2 мм, при этом пролиферирующие клетки располагались у поверхности образца, вследствие чего невозможно оценить глубину окрашивания образцов. Реакционная смесь, применяемая в данной работе, не позволяет проводить клик-реакцию в течение длительного времени, необходимого для окрашивания крупных образцов, вследствие быстрого снижения ее реакционной способности.
Техническим результатом предлагаемой группы изобретений является окрашивание методом клик-гистохимии препаратов цельных биологических тканей и органов (в частности, мозга) животных разного возраста толщиной не менее 10 мм с сохранением морфологии образцов, возможностью проведения детализированного качественного и количественного трехмерного анализа выявленных меток за счет высокого соотношения фон - сигнал, а также короткой продолжительностью процесса, в сравнении с иммуногистохимическим окрашиванием.
Указанный технический результат достигается тем, что в предлагаемом способе окрашивания препаратов цельных биологических тканей и органов методом клик-гистохимии, включающем фиксацию ткани раствором параформальдегида, постфиксацию, дегидратацию в метаноле, регидратацию в растворах метанола, отмывку фосфатным буфером, инкубацию в растворе для клик-реакции, удаление ионов меди, отмывку, дегидратацию, просветление в смеси бензил бензоата:бензиловый спирт, взятых в соотношении 2:1, постфиксацию сначала проводят 1-4%-ным параформальдегидом в течение 24 ч при 4°С, а затем после трехкратной отмывки фосфатным буфером при комнатной температуре, в растворе 20%-ного диметилсульфоксида в 100%-ном метаноле в течение 1-2 ч при температуре 4-20°С, после этого образец ткани отбеливают в растворе, содержащем 100%-ный метанол:диметилсульфоксид:30%Н2О2 в соотношении 4:1:1, в течение 2-4 ч на ярком свету при комнатной температуре до полного обесцвечивания, затем отмывают 3 раза по 1-2 ч в 100%-ном метаноле при комнатной температуре и замораживают не менее чем на 1 час при -70…-80°С, после чего регидратируют последовательно в 50, 25 и 12.5%-ных растворах метанола в фосфатном буфере по 60-90 мин в каждом при комнатной температуре, затем образцы отмывают от метанола сначала фосфатным буфером в течение 1-2 ч при комнатной температуре, а затем дважды в фосфатном буфере, содержащем 0,01%-ный Triton Х-100 и 5% диметилсульфоксид по 1-2 ч при комнатной температуре, после этого проводят клик-реакцию в реакционном растворе, содержащем 5% диметилсульфоксид, 0.01% Triton Х-100, 0.2% сапонина, 10-20 мМ меченого азида, 6 мМ CuSO4, 120 мМ аскорбата натрия в фосфатном буфере в течение 4-18 ч при комнатной температуре и в темноте, после клик-реакции ионы Cu (II) удаляют, отмывая образцы в фосфатном буфере, содержащем 0,1М ЭДТА (рН 8.0), 0.01%-ный Triton Х-100 и 5% диметилсульфоксид сначала 2 раза в течение 2 ч при комнатной температуре, а затем в течение ночи при комнатной температуре, после чего образцы отмывают в фосфатном буфере, содержащем 0,01%-ный Triton Х-100 и 5% диметилсульфоксид сначала 2 раза по 2 ч при комнатной температуре, а затем в течение ночи при комнатной температуре, итоговую отмывку осуществляют в фосфатном буфере сначала 3 раза по 2 ч при комнатной температуре, а затем в течение ночи при комнатной температуре, способ окрашивания, начиная с операции постфиксации, проводят при постоянном помешивании.
Указанный технический результат достигается также тем, что ткань фиксируют методом транскардиальной перфузии 1-4% раствором параформальдегида, охлажденным до 4-10°С.
Указанный технический результат достигается также тем, что ткань фиксируют методом погружения образца в 1-4% раствор параформальдегида в течение 24-48 ч при 4°С.
Указанный технический результат достигается также тем, что дегидратированные образцы до окрашивания накапливают и хранят в 100% метаноле в условиях глубокой заморозки при -70…-80°С.
Указанный технический результат достигается также тем, что окрашенные образцы дегидратируют последовательно в 50, 75, 96%-ных растворах этанола по 60-90 мин в каждом при комнатной температуре, затем выдерживают сначала в 100%-ном этаноле при комнатной температуре 2-3 раза по 60-90 мин, а затем помещают в 2-бутоксиэтанол для длительного хранения при 4°С.
Указанный технический результат достигается тем, что предлагаемый способ окрашивания препаратов цельных биологических тканей и органов методом клик-гистохимии, включающий фиксацию ткани раствором параформальдегида, постфиксацию, дегидратацию в метаноле, регидратацию в растворах метанола, пермеабилизацию, отмывку фосфатным буфером, инкубацию в растворе для клик-реакции, удаление ионов меди, отмывку, дегидратацию, просветление в смеси бензил бензоата:бензиловый спирт, взятых в соотношении 2:1, отличается тем, что постфиксацию сначала проводят 1-4%-ным параформальдегидом в течение 24 ч при 4°С, а затем после трехкратной отмывки фосфатным буфером при комнатной температуре, в растворе 20%-ного диметилсульфоксида в 100%-ном метаноле в течение 1-2 ч при температуре 4-20°С, после этого образец ткани отбеливают в растворе, содержащем 100%-ный метанол:диметилсульфоксид:30%Н2О2 в соотношении 4:1:1, в течение 2-4 ч на ярком свету при комнатной температуре до полного обесцвечивания, затем отмывают 3 раза по 1-2 ч в 100%-ном метаноле при комнатной температуре и замораживают не менее чем на 1 час при -70…-80°С, после чего регидратируют последовательно в 50, 25 и 12.5%-ных растворах метанола в фосфатном буфере по 60-90 мин в каждом при комнатной температуре, затем образцы трижды отмывают от метанола фосфатным буфером, причем два раза отмывают по 1-2 ч при комнатной температуре, а последнюю отмывку проводят в течение ночи при 4°С, последующую пермеабилизацию образца проводят в фосфатном буфере, содержащем 2%-ный сапонин, 5%-ный диметилсульфоксид, в течение 1 ч при 37°С, затем образец отмывают дважды в фосфатном буфере, содержащем 0.01% %-ный Triton Х-100 и 5% диметилсульфоксид по 1-2 ч при комнатной температуре, после этого проводят клик-реакцию в реакционном растворе, содержащем 5% диметилсульфоксид, 0.01% Triton Х-100, 0,2% сапонина, 10-20 мМ меченого азида, 6 мМ CuSO4, 120 мМ аскорбата натрия в фосфатном буфере в течение 4-18 ч при комнатной температуре и в темноте, после клик-реакции ионы Сu (II) удаляют, отмывая образцы в фосфатном буфере, содержащем 0.1М ЭДТА (рН 8.0), 0.01%-ный Triton Х-100 и 5% диметилсульфоксид сначала 2 раза в течение 2 ч при комнатной температуре, а затем в течение ночи при комнатной температуре, после чего образцы отмывают в фосфатном буфере, содержащем 0.01%-ный Triton Х-100 и 5% диметилсульфоксид сначала 2 раза по 2 ч при комнатной температуре, а затем в течение ночи при комнатной температуре, итоговую отмывку осуществляют в фосфатном буфере сначала 3 раза по 2 ч при комнатной температуре, а затем в течение ночи при комнатной температуре, способ окрашивания, начиная с операции постфиксации, проводят при постоянном помешивании.
Указанный технический результат достигается также тем, что ткань фиксируют методом транскардиальной перфузии 1-4% раствором параформальдегида, охлажденным до 4-10°С.
Указанный технический результат достигается также тем, что ткань фиксируют методом погружения образца в 1-4% раствор параформальдегида в течение 24-48 ч при 4°С.
Указанный технический результат достигается также тем, что дегидратированные образцы до окрашивания накапливают и хранят в 100% метаноле в условиях глубокой заморозки при -70…-80°С.
Указанный технический результат достигается также тем, что окрашенные образцы дегидратируют последовательно в 50, 75, 96%-ных растворах этанола по 60-90 мин в каждом при комнатной температуре, затем выдерживают сначала в 100%-ном этаноле при комнатной температуре 2-3 раза по 60-90 мин, а затем помещают в 2-бутоксиэтанол для длительного хранения при 4°С.
Сущность настоящей группы изобретений поясняется иллюстративным материалом в виде микрофотографий окрашенных по способу образцов биологической ткани на фиг. 1-2, где:
на фиг. 1 - слева представлено изображение среза мозга взрослой мыши (возраст 2 мес) с пролиферирующими клетками, выявленными с помощью заявленного способа окрашивания методом клик-гистохимии цельного мозга, и демонстрирующее полное его прокрашивание; справа представлено трехмерное изображение гиппокампа взрослой мыши в возрасте 2 мес, окрашенного заявленным способом, и увеличенный фрагмент гранулярного слоя зубчатой фасции гиппокампа с флуоресцентно меченными ядрами пролиферирующих клеток, визуализация осуществлена при помощи сканирующей конфокальной микроскопии.
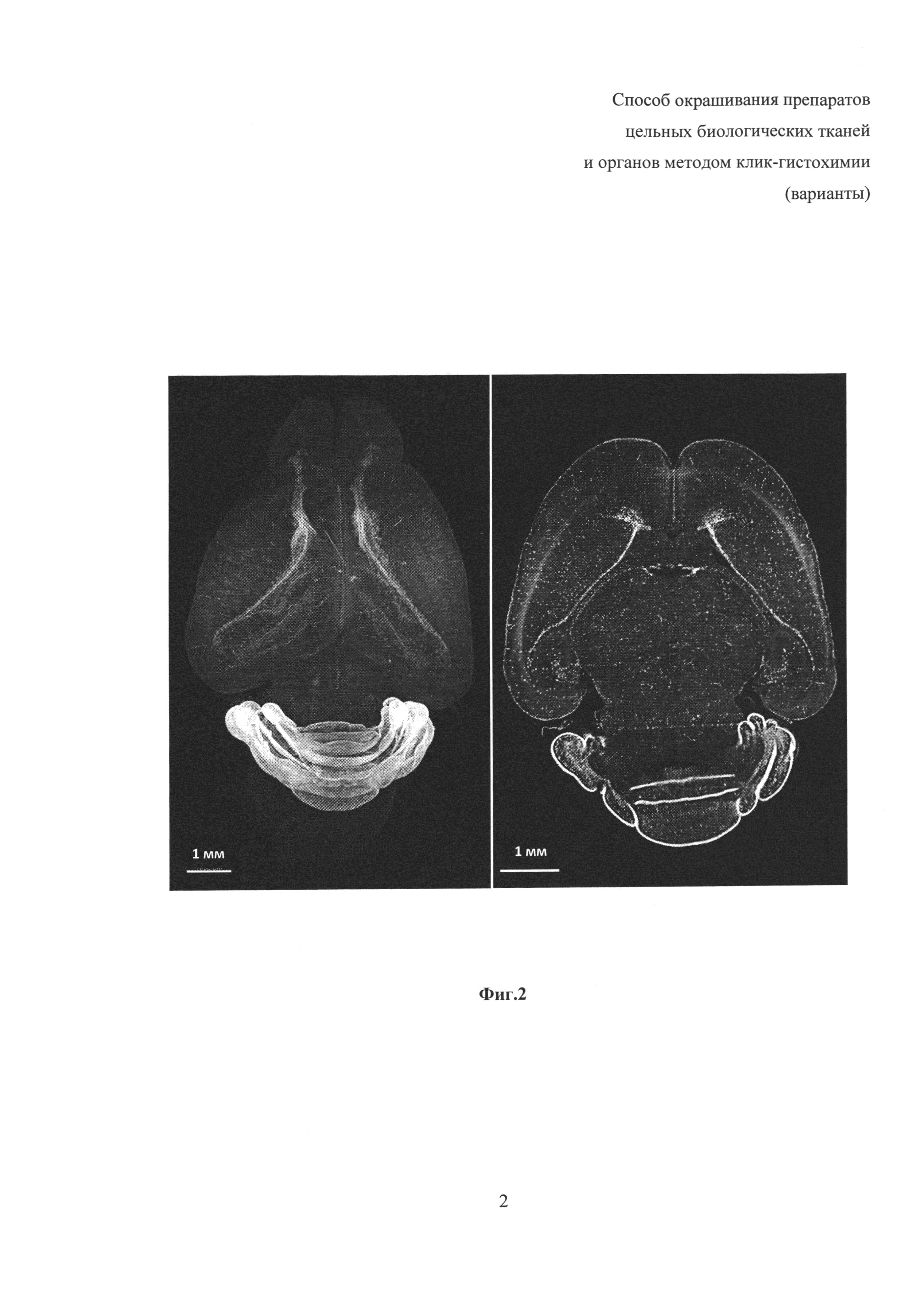
на фиг. 2 - представлено трехмерное изображение цельного мозга новорожденной мыши в возрасте 9 сут, окрашенное заявленным способом, справа представлен оптический срез этого образца, демонстрирующий полное его прокрашивание, визуализация осуществлена при помощи светоплоскостной микроскопии.
Первый вариант заявленного способа иммуногистохимического окрашивания тотальных препаратов образцов биологических тканей осуществляют следующим образом. Образцы биологической ткани (мозг новорожденных и молодых мышей, другие легкоразрушающиеся ткани) фиксируют методом транскардиальной перфузии 1-4%-ным параформальдегидом в фосфатном буфере при рН7.4, охлажденным до 4-10°С. Далее все операции проводят при постоянном помешивании. Образцы постфиксируют сначала 1-4%-ным параформальдегидом в течение 24 ч при 4°С, а затем после трехкратной отмывки фосфатным буфером при комнатной температуре, в растворе 20%-ного диметилсульфоксида (ДМСО) в 100%-ном метаноле в течение 1-2 ч при температуре 4-20°С. Ткань также можно фиксировать методом погружения образца в 1-4% раствор параформальдегида в течение 24-48 ч при 4°С, а затем постфиксировать в растворе 20%-ного ДМСО в 100%-ном метаноле, как описано выше.
Фиксированные образцы ткани отбеливают в растворе, содержащем 100%-ный метанол : ДМСО : 30% Н2О2 в соотношении 4:1:1, в течение 2-4 ч на ярком свету при комнатной температуре до полного обесцвечивания, после чего их отмывают 3 раза по 60 мин в 100%-ном метаноле при комнатной температуре и замораживают не менее чем на 1 час при -70…-80°С. На этом этапе дегидратированные образцы можно накапливать и хранить длительное время в 100% метаноле в условиях глубокой заморозки при -70…-80°С. Далее дегидратированные препараты регидратируют последовательно в 50, 25 и 12,5%-ных растворах метанола в фосфатном буфере по 60-90 мин в каждом при комнатной температуре, а затем образцы отмывают от метанола сначала фосфатным буфером в течение 1-2 ч при комнатной температуре, а затем дважды в фосфатном буфере, содержащем 0,01%-ный Triton Х-100 и 5% диметилсульфоксид по 1-2 ч при комнатной температуре. После этого проводят клик-реакцию в реакционном растворе, содержащем 5% диметилсульфоксид, 0.01% Triton Х-100, 0.2% сапонина, 10-20 мМ меченого азида, 6 мМ CuSO4, 120 мМ аскорбата натрия в фосфатном буфере в течение 4-18 ч при комнатной температуре и в темноте (время инкубации подбирается в зависимости от размера образца, чем крупнее образец - тем дольше инкубация).
После клик-реакции ионы Сu (II) удаляют, отмывая образцы в фосфатном буфере, содержащем 0,1М ЭДТА (рН 8.0), 0.01%-ный Triton Х-100 и 5% диметилсульфоксид сначала 2 раза в течение 2 ч при комнатной температуре, а затем в течение ночи при комнатной температуре. После этого образцы отмывают в фосфатном буфере, содержащем 0,01%-ный Triton Х-100 и 5% диметилсульфоксид сначала 2 раза по 2 ч при комнатной температуре, а затем в течение ночи при комнатной температуре, итоговую отмывку осуществляют в фосфатном буфере сначала 3 раза по 2 ч при комнатной температуре, а затем в течение ночи при комнатной температуре. Окрашенные образцы дегидратируют последовательно в 50, 75, 96%-ных растворах этанола по 60-90 мин в каждом при комнатной температуре, затем выдерживают сначала в 100%-ном этаноле при комнатной температуре 2-3 раза по 60-90 мин, а затем помещают в 2-бутоксиэтанол для длительного хранения при 4°С.
Второй вариант заявленного способа иммуногистохимического окрашивания тотальных препаратов образцов биологических тканей осуществляют следующим образом. Образцы биологической ткани (образцы мозга взрослых животных) фиксируют методом транскардиальной перфузии 1-4%-ным параформальдегидом в фосфатном буфере при рН7.4, охлажденным до 4-10°С. Далее все операции проводят при постоянном помешивании. Образцы постфиксируют сначала 1-4%-ным параформальдегидом в течение 24 ч при 4°С, а затем после трехкратной отмывки фосфатным буфером при комнатной температуре, в растворе 20%-ного диметилсульфоксида (ДМСО) в 100%-ном метаноле в течение 1-2 ч при температуре 4-20°С. Ткань также можно фиксировать методом погружения образца в 1-4% раствор параформальдегида в течение 24-48 ч при 4°С, а затем постфиксировать в растворе 20%-ного ДМСО в 100%-ном метаноле, как описано выше.
Фиксированные образцы ткани отбеливают в растворе, содержащем 100%-ный метанол : ДМСО : 30% Н2О2 в соотношении 4:1:1, в течение 2-4 ч на ярком свету при комнатной температуре до полного обесцвечивания, после чего их отмывают 3 раза по 60 мин в 100%-ном метаноле при комнатной температуре и замораживают не менее чем на 1 час при -70…-80°С. На этом этапе дегидратированные образцы можно накапливать и хранить длительное время в 100% метаноле в условиях глубокой заморозки при -70...-80°С. Далее дегидратированные препараты регидратируют последовательно в 50, 25 и 12,5%-ных растворах метанола в фосфатном буфере по 60-90 мин в каждом при комнатной температуре, а затем образцы отмывают от метанола сначала фосфатным буфером в течение 1-2 ч при комнатной температуре, а затем дважды в фосфатном буфере, содержащем 0,01% %-ный Triton Х-100 и 5% диметилсульфоксид по 1-2 ч при комнатной температуре.
Далее осуществляют пермеабилизацию образца в фосфатном буфере, содержащем 2%-ный сапонин, 5%-ный диметилсульфоксид, в течение 1 ч при 37°С, после чего образец отмывают дважды в фосфатном буфере, содержащем 0.01%-ный Triton Х-100 и 5% диметилсульфоксид по 1-2 ч при комнатной температуре. После этого проводят клик-реакцию в реакционном растворе, содержащем 5% диметилсульфоксид, 0.01% Triton Х-100, 0.2% сапонина, 10-20 мМ меченого азида, 6 мМ CuSO4, 120 мМ аскорбата натрия в фосфатном буфере в течение 4-18 ч при комнатной температуре и в темноте (время инкубации подбирается в зависимости от размера образца, чем крупнее образец - тем дольше инкубация). После клик-реакции ионы Cu (II) удаляют, отмывая образцы в фосфатном буфере, содержащем 0,1М ЭДТА (рН 8.0), 0.01%-ный Triton Х-100 и 5% диметилсульфоксид сначала 2 раза в течение 2 ч при комнатной температуре, а затем в течение ночи при комнатной температуре. После этого образцы отмывают в фосфатном буфере, содержащем 0,01%-ный Triton Х-100 и 5% диметилсульфоксид сначала 2 раза по 2 ч при комнатной температуре, а затем в течение ночи при комнатной температуре, итоговую отмывку осуществляют в фосфатном буфере сначала 3 раза по 2 ч при комнатной температуре, а затем в течение ночи при комнатной температуре. Окрашенные образцы дегидратируют последовательно в 50, 75, 96%-ных растворах этанола по 60-90 мин в каждом при комнатной температуре, затем выдерживают сначала в 100%-ном этаноле при комнатной температуре 2-3 раза по 60-90 мин, а затем помещают в 2-бутоксиэтанол для длительного хранения при 4°С.
Ниже приведены конкретные примеры реализации заявленных способов:
Пример 1.
Окрашивали образцы целого головного мозга новорожденных мышей линии NestinCFPnuc в возрасте 9-и постнатальных суток. Мышатам вводили подкожно 5-этинил-2'-дезоксиуридин (EdU) в дозе 123 мкг на кг веса за 2 ч до декапитации. Мозг извлекали и фиксировали методом погружения образца в 1% раствор параформальдегида в течение 48 ч при 4°С. Далее все операции проводили при помешивании. После трехкратной отмывки фосфатным буфером при комнатной температуре образцы постфиксировали в растворе 20%-ного ДМСО в 100%-ном метаноле в течение 2 ч при температуре 4°С. Фиксированные препараты мозга отбеливали в растворе, содержащем 100%-ный метанол : ДМСО : 30% Н2О2 в соотношении 4:1:1, в течение 2 ч на ярком свету при комнатной температуре до полного обесцвечивания, после чего их отмывали 3 раза по 60 мин в 100%-ном метаноле при комнатной температуре и замораживали не менее чем на 1 час при -80°С.
Далее препараты регидратировали последовательно в 50, 25 и 12,5%-ных растворах метанола в фосфатном буфере по 90 мин в каждом при комнатной температуре, а затем образцы отмывали от метанола сначала фосфатным буфером в течение 2 ч при комнатной температуре, а затем дважды в фосфатном буфере, содержащем 0,01% %-ный Triton Х-100 и 5% диметилсульфоксид по 2 ч при комнатной температуре. Последнюю отмывку делали в течение ночи. Далее осуществляли клик-реакцию в реакционном растворе, содержащем 5% диметилсульфоксид, 0.01% Triton Х-100, 0.2% сапонина, 10 мМ меченого азида, 6 мМ CuSO4, 120 мМ аскорбата натрия в фосфатном буфере при комнатной температуре и в темноте в течение 18 ч. После клик-реакции ионы Сu (II) удаляли, отмывая образцы в фосфатном буфере, содержащем 0,1М ЭДТА (рН 8.0), 0.01%-ный Triton Х-100 и 5% диметилсульфоксид сначала 2 раза в течение 2 ч при комнатной температуре, а затем в течение ночи при комнатной температуре. После этого образцы отмывали в фосфатном буфере, содержащем 0,01%-ный Triton Х-100 и 5% диметилсульфоксид сначала 2 раза по 2 ч при комнатной температуре, а затем в течение ночи при комнатной температуре, итоговую отмывку осуществляли в фосфатном буфере сначала 3 раза по 2 ч при комнатной температуре, а затем в течение ночи при комнатной температуре. Окрашенные препараты дофиксировали 4%-ным параформальдегидом в фосфатном буфере при рН7.4 в течение ночи при 4°С и отмывали в фосфатном буфере сначала 2 раза по 2 ч при комнатной температуре, а затем в течение ночи при комнатной температуре.
Окрашенные образцы мозга дегидратировали последовательно в 50, 96%-ных растворах этанола в фосфатном буфере по 60 мин в каждом при комнатной температуре, затем выдерживали сначала в 100%-ном этаноле при комнатной температуре 2 раза по 60 мин, а затем в 2-бутоксиэтаноле при 4°С в течение 18 ч. На этом этапе окрашенные образцы ткани хранили в 2-бутоксиэтаноле при 4°С. Дегидратированные образцы просветляли при комнатной температуре в течение ночи в смеси бензил бензоата:бензиловый спирт, взятых в соотношении 2:1. Съемку препаратов проводили на светоплоскостном микроскопе, построение трехмерных реконструкций окрашенных образцов осуществляли в Imaris 6.0 (Bitplane AG, Швейцария).
В препаратах, окрашенных по заявленному способу, отчетливо видны ядра пролиферирующих клеток, включивших во время S-фазы клеточного цикла синтетический аналог тимидина - 5-этинил-2'-дезоксиуридин (EdU), в структурах с активным нейрогенезом - в обонятельной луковице, субвентрикулярной зоне, ростральном миграционном пути и в субгранулярной зоне зубчатой фасции гиппокампа, мозжечке, а также в ряде других структур (Фиг. 1). Препараты целого новорожденного мозга прокрашены целиком, без затухающего градиента (Фиг. 1, справа). После просветления в растворе Мюррея не наблюдаются потери флуоресцентного сигнала, ядерное разрешение наблюдается по всей глубине образца (Фиг. 1, справа). В окрашенных образцах достигается высокое соотношение сигнал : фон, что делает принципиально возможным осуществление автоматизированного количественного и качественного анализа.
Пример 2.
Окрашивали образцы целого полушария головного мозга и изолированного гиппокампа взрослых мышей линии NestinCFPnuc в возрасте около 60-х постнатальных суток. Мышам вводили внутрибрюшинно 5-этинил-2'-дезоксиуридин (EdU) в дозе 123 мкг на кг веса за 2 ч до декапитации. Проводили транскардиальную перфузию сначала 0.1М фосфатным буфером при рН 7.4 в объеме 30 мл, а затем охлажденным до 10°С 1%-ным параформальдегидом в фосфатном буфере при рН 7.4, также в объеме 30 мл. После этого извлекали головной мозг и постфиксировали его 1%-ным параформальдегидом в фосфатном буфере при 4°С в течение 48 ч. После этого мозг либо разрезался пополам, либо из него извлекали гиппокамп. Далее все операции проводили при помешивании. После трехкратной отмывки фосфатным буфером при комнатной температуре образцы постфиксировали в растворе 20%-ного ДМСО в 100%-ном метаноле в течение 2 ч при температуре 4°С. Фиксированные препараты отбеливали в растворе, содержащем 100%-ный метанол:ДМСО: 30% Н2О2 в соотношении 4:1:1, в течение 2 ч на ярком свету при комнатной температуре до полного обесцвечивания, после чего их отмывали 3 раза по 60 мин в 100%-ном метаноле при комнатной температуре и замораживали не менее чем на 1 час при -80°С.
Далее дегидратированные полушария и гиппокампы регидратировали последовательно в 50, 25 и 12,5%-ных растворах метанола в фосфатном буфере по 90 мин в каждом при комнатной температуре, а затем образцы отмывали от метанола сначала фосфатным буфером в течение 2 ч при комнатной температуре, а затем дважды в фосфатном буфере, содержащем 0,01% %-ный Triton Х-100 и 5% диметилсульфоксид по 2 ч при комнатной температуре. Последнюю отмывку делали в течение ночи. Далее осуществляли пермеабилизацию образца в фосфатном буфере, содержащем 2%-ный сапонин, 5%-ный диметилсульфоксид, в течение 1 ч при 37°С, после чего образцы отмывали дважды в фосфатном буфере, содержащем 0.01%-ный Triton Х-100 и 5% диметилсульфоксид по 2 ч при комнатной температуре. После этого проводили клик-реакцию в реакционном растворе, содержащем 5% диметилсульфоксид, 0.01% Triton X-100, 0.2% сапонина, 10-20 мМ меченого азида, 6 мМ CuSO4, 120 мМ аскорбата натрия в фосфатном буфере при комнатной температуре и в темноте в течение 4 ч (изолированные гиппокампы) или 18 ч (целые полушария).
После клик-реакции ионы Сu (II) удаляли, отмывая образцы в фосфатном буфере, содержащем 0,1М ЭДТА (рН 8.0), 0.01%-ный Triton Х-100 и 5% диметилсульфоксид сначала 2 раза в течение 2 ч при комнатной температуре, а затем в течение ночи при комнатной температуре. После этого образцы отмывали в фосфатном буфере, содержащем 0,01%-ный Triton Х-100 и 5% диметилсульфоксид сначала 2 раза по 2 ч при комнатной температуре, а затем в течение ночи при комнатной температуре, итоговую отмывку осуществляли в фосфатном буфере сначала 3 раза по 2 ч при комнатной температуре, а затем в течение ночи при комнатной температуре. Окрашенные препараты дофиксировали 4%-ным параформальдегидом в фосфатном буфере при рН 7.4 в течение ночи при 4°С и отмывали в фосфатном буфере сначала 2 раза по 2 ч при комнатной температуре, а затем в течение ночи при комнатной температуре.
Из окрашенных целиком полушарий мозга при помощи вибратома изготавливали срезы толщиной 50 мкм, помещали их на предметные стекла и покрывали средой Fluoromount (Sigma, США). Окрашенные препараты изолированных гиппокампов дегидратировали последовательно в 50, 96%-ных растворах этанола в фосфатном буфере по 60 мин в каждом при комнатной температуре, затем выдерживали сначала в 100%-ном этаноле при комнатной температуре 2 раза по 60 мин, а затем в 2-бутоксиэтаноле при 4°С в течение 18 ч. На этом этапе окрашенные образцы ткани хранили в 2-бутоксиэтаноле при 4°С. Дегидратированные образцы просветляли при комнатной температуре в течение 4 ч в смеси бензил бензоата:бензиловый спирт, взятых в соотношении 2:1. Анализ и съемку образцов осуществляли с помощью конфокального лазерного сканирующего микроскопа (Olympus FluoView 1000, Япония). Послойное панорамное сшивание и построение трехмерных реконструкций окрашенных гиппокампов осуществляли в Imaris 6.0 (Bitplane AG, Швейцария).
В препаратах, окрашенных по заявленному способу, отчетливо видны ядра пролиферирующих клеток, включивших во время S-фазы клеточного цикла синтетический аналог тимидина - 5-этинил-2'-дезоксиуридин (EdU), в нейрогенных структурах зрелого мозга - в обонятельной луковице, субвентрикулярной зоне, ростральном миграционном пути и в субгранулярной зоне зубчатой фасции гиппокампа (Фиг. 2). Препараты целого мозга прокрашены целиком, без затухающего градиента (Фиг. 2, слева). После просветления в растворе Мюррея не наблюдаются потери флуоресцентного сигнала, ядерное разрешение наблюдается по всей глубине образца (Фиг. 2, справа). В окрашенных образцах достигается высокое соотношение сигнал:фон, что делает принципиально возможным осуществление количественного анализа как на отдельных гиппокампах, так и в целиком окрашенных полушариях.
Предлагаемые варианты способа окрашивания препаратов цельных биологических тканей и органов методом клик-гистохимии позволяют окрашивать препараты образцов биологических тканей молодых и взрослых животных целиком, без предварительного секционирования. Использование предлагаемых способов окрашивания позволяет сохранять морфологию образцов и высокоспецифично выявлять этинильную группу даже в толще крупных препаратов (не менее 5 мм) биологической ткани. Продолжительность окрашивания с помощью предлагаемого способа составляет от 4 до 6 суток, однако значительно облегчает и ускоряет процесс визуализации и анализа препаратов за счет использования методов трехмерной микроскопии и томографии.
Препараты образцов, окрашенные предлагаемыми способами, обладают высоким соотношением сигнал : фон и специфичностью окраски, что позволяет использовать их для проведения автоматизированного количественного и качественного анализа выявленных меток.