ЗАМЕЩЕННЫЕ ПИРАЗОЛО[1,5-а]ПИРИДО[3,4-е]ПИРИМИДИНЫ И ИХ ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗ
Вид РИД
Изобретение
Изобретение относится к области органической химии и химии биологически активных веществ, к некоторым производным пиразоло[1,5-а]пиридо[3,4-е]пиримидинов, которые проявляют ингибирующее действие в отношении ряда протеинкиназ и могут найти применение в качестве лекарственных средств для лечения онкологических заболеваний.
Геном человека содержит более 500 комплементов протеинкиназ, которые переносят γ-фосфатные остатки АТФ на гидроксильные группы субстратных фрагментов аминокислот серина, треонина или тирозина. Протеинкиназы регулируют клеточный цикл, рост и дифференцировку клеток, апоптоз. Нарушения нормального протекания процессов фосфорилирования обуславливают многие патологии, например онкологические, воспалительные, кардиоваскулярные заболевания, различные формы диабета и др. К настоящему времени клинически разрешенным является весьма незначительное количество лекарственных препаратов, ингибирующих процессы фосфорилирования с участием протеинкиназ и применяемых для лечения онкологических заболеваний различной этиологии (хроническая миелогенная лейкемия, рак языка, желудка, поджелудочной железы и др.).
В основе новых направлений идентификации лекарственных мишеней являются знания о передаче сигнала ключевых компонентов и их связи с болезнями. Так как нарушения в сигналах являются главной причиной патологий и поскольку большинство недавно проведенных исследований препаратов имеют отношение к молекулам-мишеням, являясь передатчиками сигнала, связанными с макромолекулами (прежде всего киназами), терапия передачи сигнала становится одной из важнейших областей исследования лекарств [G. Keri et. al., 2006, Curr. Signal Transduction Ther. 1: 67-95; Levitzki A., 1996, Curr. Opin. Cell Biol. 8: 239-244; Y. Hu, J. Bajorath, 2015, J. Med. Chem., 58 (1): 315-332; Ch. Merrit et. al., 2014, Chem. Rev. 114: 11280-11304; Ya. Tong et. al., 2015, Med. Chem. Let. 6: 58-62].
Большинство игибиторов протеинкиназ относится к азагетероциклическим соединениям. Они могут обладать различными типами ингибирующего действия в отношении протеинкиназ, проявляя противораковую, противовоспалительную и другие виды активности.
Известны производные пиразоло[1,5-а]пиримидина, ингибирующие тирозиновые киназы (MerTK, ВТК), которые могут быть использованы в качестве противораковых, противовоспалительных, иммуностимулирующих и иммуномодулирующих средств [WO 2015157125, 2015 г., МХ 2015002955, 2015 г.]. Ингибирующим действием в отношении киназы JNK обладают пиразоло[1,5-а]пиримидины, представленные в работах [NZ 20100622283, 2010 г., US 2015152117, 2015 г., US 2014107099, 2014 г.]. Эти производные могут применяться для лечения рака, тромбоцитоза, миелофиброза, ревматоидного артрита, псориаза и контактного дерматита. Замещенные пиразоло[1,5-а]пиримидины ингибируют циклинзависимые (CDK2), митоген-активированные (MARK/ERK) киназы. Помимо противоракового действия такие соединения обладают противовирусной активностью, а также могут использоваться при лечении нейродегенеративных заболеваний, например болезни Альцгеймера [RU 2380369, 2003 г., RU 2441005, 2006 г.].
С другой стороны, известны ингибиторы тирозиновых киназ, содержащие в своей структуре пиридопиримидиновый фрагмент. Так, в работах [US 2015158874, 2015 г., CN 104302647, 2015 г.] отмечено ингибирующее действие пиридопиримидинов в отношении киназ семейства PI3K, обуславливающее возможность их применения для лечения воспалительных, сердечно-сосудистых, аутоиммунных заболеваний, астмы и аллергии.
Наиболее близким к предлагаемому изобретению является заявка [US 20100190811, 2010], в которой описаны производные пиримидина, обладающие ингибирующим действием в отношении киназ c-KIT, PDGFR-α, PDGFR-β.
Отличительными особенностями предлагаемого изобретения являются:
- использование соединений, содержащих гетероциклическую систему пиразоло[1,5-а]пиридо[3,4-е]пиримидина в качестве ингибиторов протеинкиназ;
- проявление некоторыми замещенными пиразоло[1,5-а]пиридо[3,4-е]пиримидинами ингибирующего действия в концентрациях менее 1 мкМ.
Задачей настоящего изобретения является создание новых ингибиторов протеинкиназ формулы
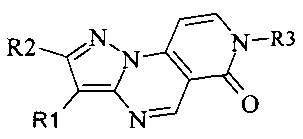
где R1 - водород или ароматический заместитель;
R2 - водород или алифатический заместитель;
R3 - алифатический заместитель, в том числе содержащий дополнительные функциональные группы, гетероциклические заместители, или замещенная аминогруппа,
обладающих противораковой активностью.
Технический результат заключается в получении новых ингибиторов протеинкиназ в ряду пиразоло[1,5-а]пиридо[3,4-е]пиримидинов, проявляющих ингибирующее действие при низких концентрациях.
Технический результат достигается:
- использованием в качестве ингибиторов протеинкиназ одного из соединений ряда пиразоло[1,5-а]пиридо[3,4-е]пиримидинов;
- получением пиразоло[1,5-а]пиридо[3,4-е]пиримидинов последовательным взаимодействием 6-карбэтокси-7-метилпиразоло[1,5-а]пиримидинов с N,N-диметилацеталем диметилформамида и реагентом, содержащим незамещенную аминогруппу.
Технический результат подтверждают проведенные исследования с выявлением высокой ингибирующей способности замещенных пиразоло[1,5-а]пиридо[3,4-е]пиримидинов в отношении протеинкиназ c-KIT, PDGFR-α, VEGFR-2.
В качестве объекта исследований выбраны серин-треониновые киназы Aurora A, CDC7, CHK1, Haspin, JNK3, IRAK, р38-α, тирозиновые киназы: AXL, BTK, c-KIT, EGFR, ЕРНА2, FLT3, LCK, LYN, PDGFR-α, PDGFR-β, TRKA, VEGFR-2.
Первичный скрининг ингибирующего действия замещенных пиразоло[1,5-а]пиридо[3,4-е]пиримидинов в отношении протеинкиназ проводился с целью определения относительной ингибирующей активности методом иммуноферментного анализа ELISA.
Для испытания ингибирующего влияния на протеинкиназы были синтезированы пиразоло[1,5-а]пиридо[3,4-е]пиримидины [F. Bruni et. al., 1995, J. Heterocyclic. Cem. 32: 291-298; F. Bruni et. al., 1997, Farmaco. 52(10): 639-643]. Для 6-карбэтокси-7-метилпиразоло[1,5-а]пиримидинов была проведена реакция диметиламинометиленирования. Ввиду высокой СН-кислотности метальной группы исходных пиразолопиримидинов, а также низкой растворимости продуктов реакции, выход енаминов составляет 95 и выше процентов. Взаимодействие 6-карбэтокси-7-[2-диметиламино-1-винил]пиразоло[1,5-а]пиримидинов с алифатическими, гетероциклическими аминами и гидразидами карбоновых кислот приводит к 7-R-пиразоло[1,5-а]пиридо[3,4-е]пиримидин-6(7)Н-онам.
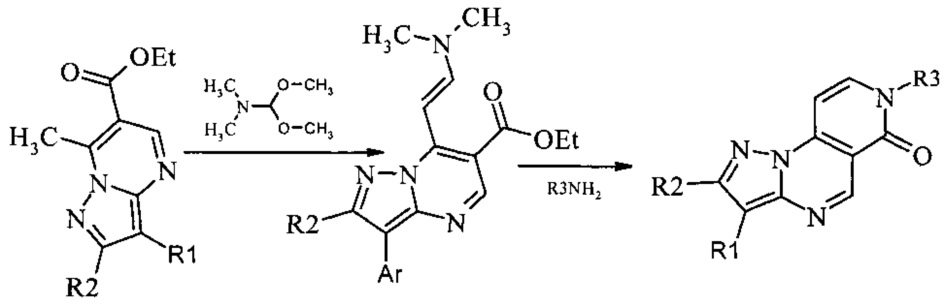
ПРИМЕР 1
Синтез 7-этилпиразоло[1,5-а]пиридо[3,4-е]пиримидин-6(7Н)-она 1 протекает по следующей схеме:
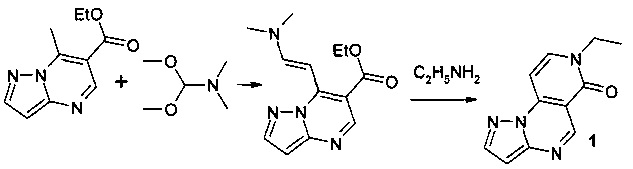
Смесь 1.025 г (5 ммоль) 6-карбэтокси-7-метилпиразоло[1,5-а]пиримидина и 0.595 г (5 ммоль) диметилацеталя диметилформамида нагревали в 5 мл диметилформамида (ДМФА) в течение 1 часа, выпавший осадок 6-карбэтокси-7-[2-диметиламино-1-винил]-[1,2,4]пиразоло[1,5-а]пиримидина отфильтровывали, промывали изопропанолом и высушивали. Смесь 1.04 г (4 ммоль) 6-карбэтокси-7-[2-диметиламино-1-винил]-[1,2,4]пиразоло[1,5-а]пиримидина, 0.321 г (4 ммоль) 70% водного раствора этиламина и 5 мл уксусной кислоты кипятили с обратным холодильником в течение 30 мин. Выпавший при охлаждении осадок отфильтровывали, промывали водой, перекристаллизовывали из ДМФА. Тпл.>300°С. Выход 52%. Спектр ЯМР 1Н (ДМСО-d6, м.д., δ): 1.66-2.05 (м, 5Н, Налиф); 7.03-7.95 (м, 5Н, Наром). Найдено (%): С, 61.67; Н, 4.71; N, 26.15. Вычислено (%): С, 61.70; Н, 4.69; N, 26.33.
ПРИМЕР 2
Синтез 7-[(3-диметиламино)пропил]пиразоло[1,5-а]пиридо[3,4-е]пиримидин-6(7Н)-она 2 проводят согласно способу, описанному в примере 1, взаимодействием с N,N-диметиламинопропиламином. Тпл.>300°С. Выход 59%. Спектр ЯМР 1Н (ДМСО-d6, м.д., δ): 1.03-2.49 (м, 12Н, Налиф); 7.03-7.91 (м, 5Н, Наром). ИК (ν, см-1) 1685 (N-CO). Найдено (%): С, 61.98; Н, 6.32; N, 25.81. Вычислено (%): С, 62.00; Н, 6.35; N, 25.80.
ПРИМЕР 3
Синтез 7-(4-хлорбензил)-пиразоло[1,5-а]пиридо[3,4-е]пиримидин-6(7Н)-она 3 проводят согласно способу, описанному в примере 1, взаимодействием с 4-хлорфенилметиламином. Тпл. 230-232°С. Выход 51%. Спектр ЯМР 1Н (ДМСО-d6, м.д., δ): 2.35 (с, 2Н, СН2); 7.03-7.85 (м, 9Н, Наром). ИК (ν, см-1) 1697 (N-CO). Найдено (%): С, 61.84; Н, 3.57; N, 18.03. Вычислено (%): С, 61.70; Н, 3.69; N, 18.00.
ПРИМЕР 4
Синтез 4-(6-оксопиразоло[1,5-а]пиридо[3,4-е]пиримидин-7(6Н)-ил]бутановой кислоты 4 проводят согласно способу, описанному в примере 1, взаимодействием с 4-аминобутановой кислотой. Тпл.>300°С. Выход 58%. Спектр ЯМР 1H (ДМСО-d6, м.д., δ): 1.66-2.05 (м, 6Н, Hалиф); 7.03-7.95 (м, 5Н, Наром); 12.05 (с, 1H, ОН). ИК (ν, см-1) 1688 (N-CO), 3625 (ОН). Найдено (%): С, 57,35; Н, 4,44; N, 20,58. Вычислено (%): С, 57,40; Н, 4,49; N, 20,43.
ПРИМЕР 5
Синтез 7-(пиридин-3-илметил)пиразоло[1,5-а]пиридо[3,4-е]пиримидин-6(7Н)-она 5 проводят согласно способу, описанному в примере 1, взаимодействием с пиридин-3-илметиламином. Тпл.>300°С. Выход 53%. Спектр ЯМР 1Н (ДМСО-d6, м.д., δ): 2.35 (с, 2Н, СН2); 7.03-8.11 (м, 9Н, Наром). ИК (ν, см-1) 1682 (N-CO). Найдено (%): С, 64.97; Н, 4.00; N, 25.26. Вычислено (%): С, 64.97; Н,4.00; N,25.26.
ПРИМЕР 6
Синтез 4-метокси-N-(6-оксопиразоло[1,5-а]пиридо[3,4-е]пиримидин-7(6Н)-ил]бензамида 6 протекает по следующей схеме:
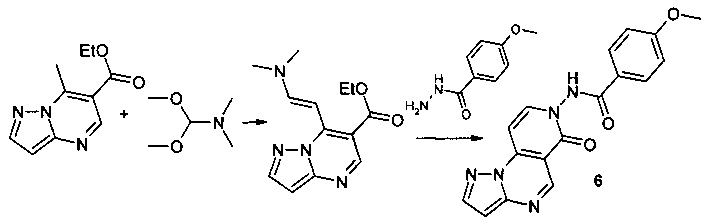
Смесь 1.025 г (5 ммоль) 6-карбэтокси-7-метилпиразоло[1,5-а] пиримидина и 0.595 г (5 ммоль) диметилацеталя диметилформамида нагревали в 5 мл ДМФА в течение 1 часа, выпавший осадок 6-карбэтокси-7-[2-диметиламино-1-винил]-[1,2,4]пиразоло[1,5-а]пиримидина отфильтровывали, промывали изопропанолом и высушивали. Смесь 1.04 г (4 ммоль) 6-карбэтокси-7-[2-диметиламино-1-винил]-[1,2,4]пиразоло[1,5-а]пиримидина, 0.664 г (4 ммоль) гидразида 4-метоксибензойной кислоты и 5 мл уксусной кислоты кипятили с обратным холодильником в течение 30 мин. Выпавший при охлаждении осадок отфильтровывали, промывали водой, перекристаллизовывали из ДМФА. Тпл. 284-286°С. Выход 66%. Спектр ЯМР 1Н (ДМСО-d6, м.д., δ): 3.57 (с, 3Н, ОСН); 7.00-7.87 (м, 9Н, Наром); 11.03 (с, 1Н, NH). ИК (ν, см-1) 1689 (N-CO). Найдено (%): С, 60.89; Н, 3.91; N, 20.89. Вычислено (%): С, 60.70; Н, 3.99; N, 21.00.
ПРИМЕР 7
Синтез 2-метокси-N-(6-оксопиразоло[1,5-а]пиридо[3,4-е]пиримидин-7(6Н)-ил]ацетамида 7 проводят согласно способу, описанному в примере 6, взаимодействием с гидразидом метоксиуксусной кислоты. Тпл.>300°С. Выход 61%. Спектр ЯМР 1Н (ДМСО-d6, м.д., δ): 6.71 (с, 2Н, NH2); 7.00-7.87 (м, 9Н, Наром); 11.03 (с, 1Н, NH). ИК (ν, см-1) 1639 (N-CO). Найдено (%): С, 49.18; Н, 3.30; N, 34.41. Вычислено (%): С, 49.25; Н, 3.29; N, 34.33.
ПРИМЕР 8
Синтез N-(6-оксопиразоло[1,5-а]пиридо[3,4-е]пиримидин-7(6Н)-ил]мочевины 8 протекает по следующей схеме:
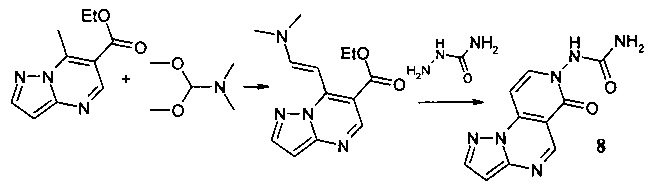
Смесь 1.025 г (5 ммоль) 6-карбэтокси-7-метилпиразоло[1,5-а]пиримидина и 0.595 г (5 ммоль) диметилацеталя диметилформамида нагревали в 5 мл ДМФА в течение 1 часа, выпавший осадок 6-карбэтокси-7-[2-диметиламино-1-винил]-[1,2,4]пиразоло[1,5-а]пиримидина отфильтровывали, промывали изопропанолом и высушивали. Смесь 1.04 г (4 ммоль) 6-карбэтокси-7-[2-диметиламино-1-винил]-[1,2,4]пиразоло[1,5-а]пиримидина, 0.3 г (4 ммоль) семикарбазида и 5 мл уксусной кислоты кипятили с обратным холодильником в течение 30 мин. Выпавший при охлаждении осадок отфильтровывали, промывали водой, перекристаллизовывали из ДМФА. Тпл.>300°С. Выход 61%. Спектр ЯМР 1Н (ДМСО-d6, м.д., δ): 6.71 (с, 2Н, NH2); 7.00-7.87 (м, 9Н, Наром); 11.03 (с, 1H, NH). ИК (ν, см-1) 1639 (N-CO). Найдено (%): С, 49.18; Н, 3.30; N, 34.41. Вычислено (%): С, 49.25; Н, 3.29; N, 34.33.
ПРИМЕР 9
Синтез 7-(2-гидроксиэтил)-3-фенилпиразоло[1,5-а]пиридо[3,4-е]пиримидин-6(7Н)-она 9 протекает по следующей схеме:
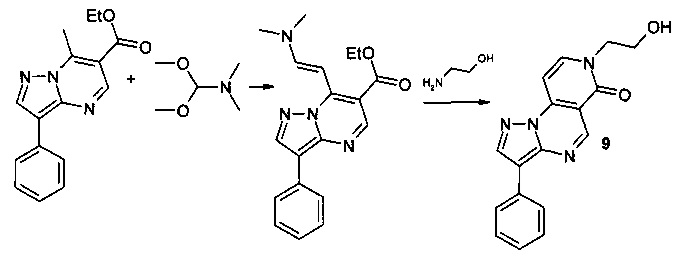
Смесь 1.405 г (5 ммоль) 6-карбэтокси-7-метил-3-фенилпиразоло[1,5-а]пиримидина и 0.595 г (5 ммоль) диметилацеталя диметилформамида нагревали в 5 мл ДМФА в течение 1 часа, выпавший осадок 6-карбэтокси-7-[2-диметиламино-1-винил]-3-фенил[1,2,4]пиразоло[1,5-а]пиримидина отфильтровывали, промывали изопропанолом и высушивали. Смесь 1.334 г (4 ммоль) 6-карбэтокси-7-[2-диметиламино-1-винил]-3-фенил[1,2,4]пиразоло[1,5-а]пиримидина, 0.244 г (4 ммоль) 2-гидроксиэтиламина и 5 мл уксусной кислоты кипятили с обратным холодильником в течение 30 мин. Выпавший при охлаждении осадок отфильтровывали, промывали водой, перекристаллизовывали из ДМФА. Тпл. 245-247°С. Выход 54%. Спектр ЯМР 1Н (ДМСО-d6, м.д., δ): 1.66-2.05 (м, 4Н, Налиф); 7.03-7.89 (м, 9Н, Наром); 12.05 (с, 1Н, ОН). ИК (ν, см-1) 1679 (N-CO), 3612 (ОН). Найдено (%): С, 66.66; Н, 4.61; N, 18.29. Вычислено (%): С, 66.70; Н, 4.69; N, 18.33.
ПРИМЕР 10
Синтез 7-(2-морфолин-4-илэтил)-3-фенилпиразоло[1,5-а]пиридо[3,4-е]пиримидин-6(7Н)-она 10 проводят согласно способу, описанному в примере 9, взаимодействием с морфолин-4-илэтиламином. Тпл. 195-197°С. Выход 53%. Спектр ЯМР 1Н (ДМСО-d6, м.д., δ): 1.45-3.15 (м, 12Н, Налиф); 7.00-7.91 (м, 9Н, Наром). ИК (ν, см-1) 1687 (N-CO). Найдено (%): С, 67.18; Н, 5.64; N, 18.65. Вычислено (%): С, 67.23; Н, 5.68; N, 18.33.
ПРИМЕР 11
Синтез 7-(4Н-1,2,4-триазол-4-ил)-пиразоло[1,5-а]пиридо[3,4-е]пиримидин-6(7Н)-она 11 протекает по следующей схеме:
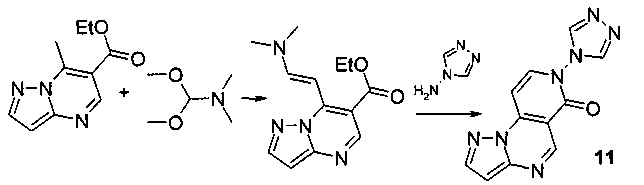
Смесь 1.025 г (5 ммоль) 6-карбэтокси-7-метилпиразоло[1,5-а] пиримидина и 0.595 г (5 ммоль) диметилацеталя диметилформамида нагревали в 5 мл диметилформамида (ДМФА) в течение 1 часа, выпавший осадок 6-карбэтокси-7-[2-диметиламино-1-винил]-[1,2,4]пиразоло[1,5-а]пиримидина отфильтровывали, промывали изопропанолом и высушивали. Смесь 1.04 г (4 ммоль) 6-карбэтокси-7-[2-диметиламино-1-винил]-[1,2,4]пиразоло[1,5-а]пиримидина, 0.336 г (4 ммоль) 4-амино-1,2,4-триазола и 5 мл уксусной кислоты кипятили с обратным холодильником в течение 30 мин. Выпавший при охлаждении осадок отфильтровывали, промывали водой, перекристаллизовывали из ДМФА. Тпл.>300°С. Выход 53%. Спектр ЯМР 1Н (ДМСО-d6, м.д., δ): 7.29-7.99 (м, 7Н, Наром). ИК (ν, см-1) 1673 (N-CO). Найдено (%): С, 52.18; Н, 2.71; N, 38.72. Вычислено (%): С, 52.20; Н, 2.69; N, 38.65.
ПРИМЕР 12
Исследование ингибирующего действия замещенных пиразоло[1,5-а]пиридо[3,4-е]пиримидин-6(7)Н-онов на протеинкиназы
Анализ соединений проводился в три этапа: первичный скрининг, перепроверка результатов первичного скрининга, определение IC50. Первичный скрининг проводился для всех соединений в одном повторе. Конечная концентрация соединений в реакции - 10 мкМ, концентрация DMSO - 5%. В качестве позитивного контроля (максимальная активность фермента) использовалась полная реакционная смесь с добавлением DMSO до 5%. В качестве негативного контроля (бланк) использовалась реакционная смесь без АТР. При анализе данных значение бланка приравнивалось к 100% ингибированию фермента.
Вещества, показавшие активность более 50%, отбирались на перепроверку. Перепроверка соединений проводилась в двух повторах. Для соединений с подтвержденной активностью определялось значение IC50 (в мкМ). Величина IC50 определялась по восьми концентрационным точкам (в трехкратном разведении) в двух повторах. Данные анализировались с использованием программного обеспечения GraphPad Prism (v.3.1).
Скрининг функционально замещенных пиразоло[1,5-а]пиридо[3,4-е]пиримидин-6(7)Н-онов на ингибирование протеинкиназ проводился с целью определения относительной ингибирующей активности (в %%) методом иммуноферментного анализа (ELISA).
Реакцию по определению киназной активности проводили в полипропиленовых планшетах (Costar, 3363) в реакционном буфере (20 мМ HEPES, pH 7.5, 15 мМ MgCl2, 2 мМ DTT, 0.2 мМ Na3VO4, 0.005% Triton Х-100) в течение 60 минут при 30°С и интенсивном перемешивании. Конечная концентрация компонентов реакции: 0.05 мкг/мл соответствующей киназы, 5 нМ биотинилированный субстрат Histon Н3 (1-21) (Anaspec, 61702), 150 мкМ ATP (Sigma, А6419), 10 мкМ анализируемое соединение, 5% ДМСО.
Ферментативную реакцию останавливали буфером, содержащим 20 мМ HEPES (Sigma, Н4034), pH 7.5 и 150 мМ EDTA (Sigma, Е5513).
Далее для детекции фосфорилированного субстрата реакционную смесь переносили в заранее подготовленные планшеты (Nunc, 468667), покрытые нейтравидином (1 нг/лунку; Pierce, 31000) и обработанные бычьим сывороточным альбумином (BSA) для блокирования мест неспецифического связывания. Инкубацию проводили в течение часа при комнатной температуре. После трехкратной отмывки планшетов фосфатно-солевым буфером (PBS) с Tween-20 последовательно проводили инкубацию с anti-phospho-Histon Н3 антителами (0.3 нг/мкл; Millipore, 04-746) и со специфическими антителами, конъюгированными ферментом-меткой (пероксидаза) Anti-rabbit IgG, HRP-linked Antibody (титр 1/5000; Cell Signaling, 7074). После завершения каждой стадии инкубации (60 минут при комнатной температуре и постоянном перемешивании) платы трижды отмывали от несвязавшихся молекул антител раствором PBS с Tween-20 и добавляли по 100 мкл субстрата ТМБ (Sigma, Т8768), приготовленного по инструкции производителя.
Перед измерением оптической плотности проводили остановку реакции с помощью 0.5 М H2SO4. Оптическую плотность раствора определяли при λ=450 нм с использованием планшетного спектрофотометра (TECAN Safire). Полученные данные обрабатывали и импортировали в программу HTSCalc.
На втором этапе ингибирующее действие синтезированных соединений также определяли методом гомогенного флуоресцентного анализа (HTRF).
Реакцию по определению ферментативной активности белка проводили в 96-луночных планшетах (Costar, 3694) в реакционном буфере (20 мМ HEPES, pH 7.4, 15 мМ MgCl2, 2 мМ DTT, 0.2 мМ Na3VO4, 0.005% Triton Х-100) в течение 60 минут при 30°С и интенсивном перемешивании. Конечная концентрация компонентов реакции: 0.06 мкг/мл Aurora А, 80 нМ биотинилированный субстрат S2-STK (CisBio, 62ST2PEC), 5 мкМ ATP (Sigma, А6419), 10 мкМ анализируемое соединение, 5% ДМСО.
Для детектирования фосфорилированного субстрата к реакционной смеси добавляли детектирующий буфер (CisBio, 62SDBRDF), содержащий антитела, меченные европием (CisBio, 62ST2PEC), и хромофор Sa-XL665, меченный стрептавидином (CisBio, 610SAXLG). Конечная концентрация компонентов реакции: 0.5Х детектирующего буфера, 0.05Х антитела, 10 нМ Sa-XL665. Инкубацию с антителами проводили в течение 1.5 часов при комнатной температуре и интенсивном перемешивании. Флуоресценцию определяли при λех=340 нм и λem=615 и 665 нм с использованием планшетного спектрофотометра (Perkin Elmer, Victor 3).
В таблице 1 на фиг. 1 представлены результаты исследования ингибирующего действия замещенных пиразоло[1,5-а]пиридо[3,4-е]пиримидин-6(7)Н-онов на протеинкиназы PDGFR-α, c-KIT, VEGEFR-2. Для киназ Aurora A, CDC7, CHK1, Haspin, JNK3, IRAK, р38-α, AXL, BTK, EGFR, ЕРНА2, FLT3, LCK, LYN, PDGFR-β, TRKA ингибирующее действие не выявлено или значения IC50 выше 100 мкМ.
Таким образом, впервые обнаружено ингибирующее действие соединений ряда пиразоло[1,5-а]пиридо[3,4-е]пиримидина в отношении различных протеинкиназ.
ПРИМЕР 13
Сравнительное тестирование пиразоло[1,5-а]пиридо[3,4-е]пиримидин-6(7)Н-онов с препаратами медицинского назначения
В качестве референсных соединений были использованы:
- для серин-треониновых киназ Aurora А - препарат Nerviano (Phase II) IC50 22-76 nM, метод [HTRF]; CDC7 - препарат Staurosporin IC50 105-260 nM, метод [HTRF]; CHK1 - препарат Staurosporine IC50 15 nM, метод [HTRF]; Haspin - препарат Staurosporine IC50 31 nM, метод [ELISA]; IRAK4 - препарат Staurosporine IC50 2-6 nM, метод [HTRF]; JNK3 - препарат JNK inhibitor II IC50 - 200 nM, метод [ELISA]; р38-α - препарат Р38 alfa inhibitor IC50 67-98 nM, метод [ELISA]; PIM1 - препарат Staurosporine IC50 - 10 nM, метод [HTRF];
- для тирозоновых киназ AXL - препарат Sunitinib IC50 181 nM, метод [ELISA]; BTK - препарат Dasatinib IC50 0.4 nM, метод [ELISA]; c-KIT - препарат Sturosporine IC50 4 nM, метод [HTRF]; EGFR - препарат Erlotinib/Tarceva IC50 3-8 nM, метод [ELISA]; ЕРНА2 - препарат Staurosporine IC50 550 nM, метод [ELISA]; FLT3 - препарат Sunitinib IC50 5 nM, метод [ELISA]; LCK - препарат Dasatinib IC50 0.2 nM, метод [ELISA]; LYN - препарат Dasatinib IC50 0.3 nM, метод [ELISA]; PDGFR-α - препарат Dasatinib IC50 1.4 nM, метод [ELISA]; PDGFR-β - препарат Dasatinib IC50 2.6-11 nM, метод [ELISA]; TRKA - препарат Staurosporine IC50 5 nM, метод [ELISA]; VEGFR2 - препарат Sunitinib IC50 9 nM, метод [ELISA].
В таблице 2 на фиг. 2 представлены соединения ряда пиразоло[1,5-а]пиридо[3,4-е]пиримидин-6(7)Н-онов, имеющие наиболее близкие к референсным веществам значения IC50 и которые могут рассматриваться как перспективные соединения-лидеры для дальнейшей оптимизации их структуры с целью повышения эффективности ингибирования.
![ЗАМЕЩЕННЫЕ ПИРАЗОЛО[1,5-а]ПИРИДО[3,4-е]ПИРИМИДИНЫ И ИХ ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗ](https://fips.edrid.ru/images/rid/af/ca/4c/4ad549ab1ae8877aeff08e8db641bded.jpg)
![ЗАМЕЩЕННЫЕ ПИРАЗОЛО[1,5-а]ПИРИДО[3,4-е]ПИРИМИДИНЫ И ИХ ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗ](https://fips.edrid.ru/images/rid/af/ca/4c/3b4793f58bd96dc69585ae1c6c175f0c.png)
![ЗАМЕЩЕННЫЕ ПИРАЗОЛО[1,5-а]ПИРИДО[3,4-е]ПИРИМИДИНЫ И ИХ ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗ](https://fips.edrid.ru/images/rid/af/ca/4c/4fea7ddc4226e4d896e89bc20e084fe6.png)
![ЗАМЕЩЕННЫЕ ПИРАЗОЛО[1,5-а]ПИРИДО[3,4-е]ПИРИМИДИНЫ И ИХ ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗ](https://fips.edrid.ru/images/rid/af/ca/4c/029c66d9d39601b0fe496c75b2ae0d0d.jpg)

