Результат интеллектуальной деятельности: Способ получения ω-(бис(пиридин-2-илметил)амино)алифатических кислот - прекурсоров с хелатными центрами для связывания металлов
Вид РИД
Изобретение
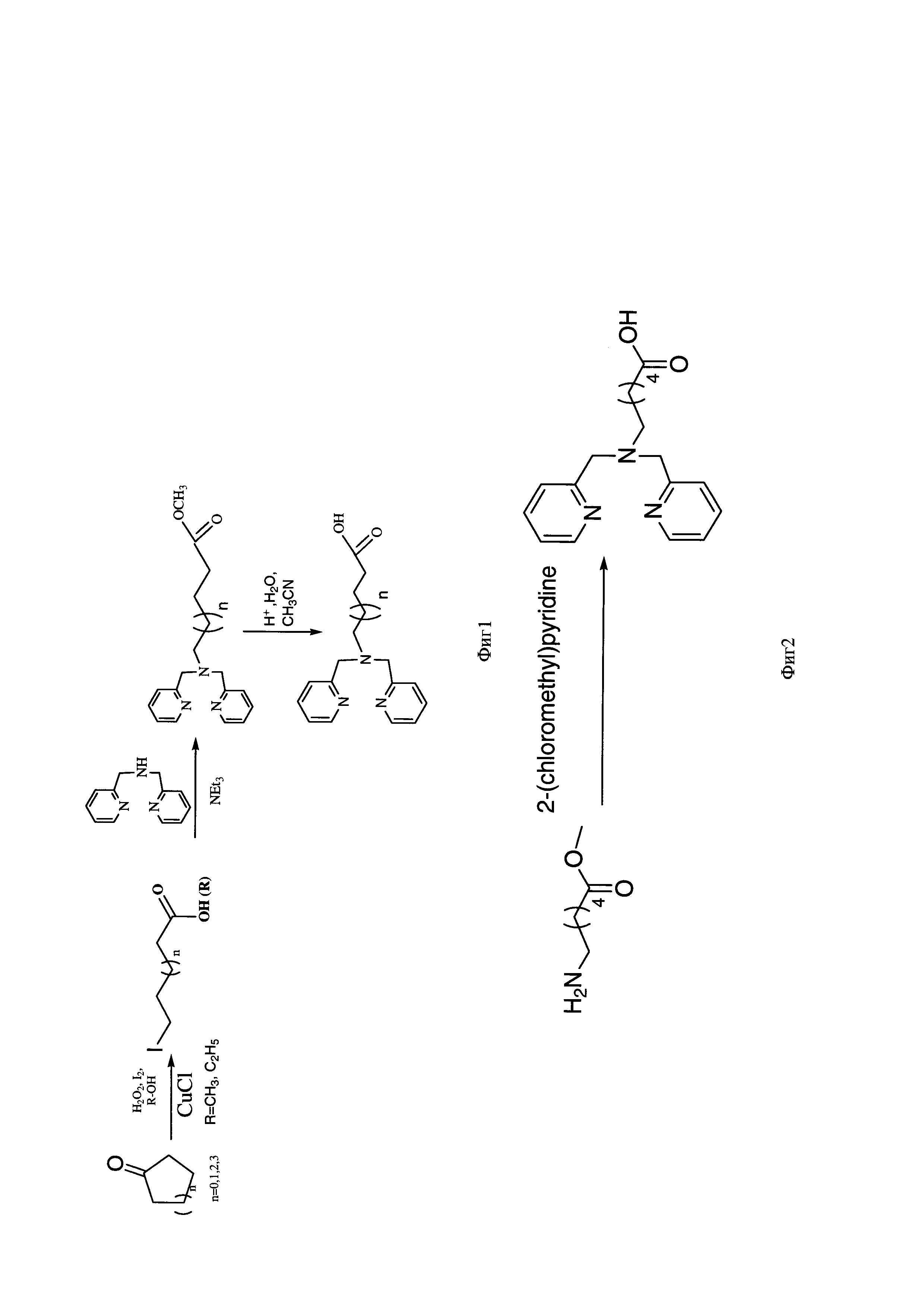
Изобретение относится к области органической химии, в частности к способам получения ω-бис(пиридин-2-илметил)амино)алифатических кислот - прекурсоров с хелатными центрами для связывания металлов на основе реакции расщепления циклических кетонов, соответствующих принципам «зеленой» химии (Green Chemistry), которые могут применяться в различных областях техники, в том числе в органической и фармацевтической химии, биохимии и в медицине, в частности, в качестве радиофармпрепаратов (фиг 1).
Значительное место в диагностике и терапии занимают радиофармацевтические препараты на основе изотопов технеция-99 и рения-188 соответственно. Главным в разработке синтеза таких радиофармпрепаратов является введение в их структуры прекурсоров - лиганд с высокой хелатирующей способностью для прочного связывания технеция-99 или рения-188, в качестве которых успешно применяются ω-бис(пиридин-2-илметил)амино)алифатические кислоты. Таким образом, разработка на основе реакции расщепления алифатических циклических кетонов нового способа получения ω-бис(пиридин-2-илметил)амино)алифатических кислот в качестве прекурсоров для связывания металлов является актуальной.
Известен способ получения производных ω-бис(пиридин-2-илметил)амино)алифатических кислот, основанный на синтезе из омега-аминопропановой и омега-аминогексановой кислот и 2-пиколил хлорид гидрохлоридом (фиг. 2). Исходные кислоты и 2-пиколил хлорид гидрохлорид растворяют в воде и перемешивают в течение 5 дней при комнатной температуре. Далее реакционную смесь подвергают обработке последовательно кислотой и щелочью и экстрагируют хлороформом. Грубый продукт очищают перекристаллизацией, и выход продукта составляет не более 41%. Главным недостатком этого метода является длительность процесса получения и низкие выходы конечных продуктов [2].
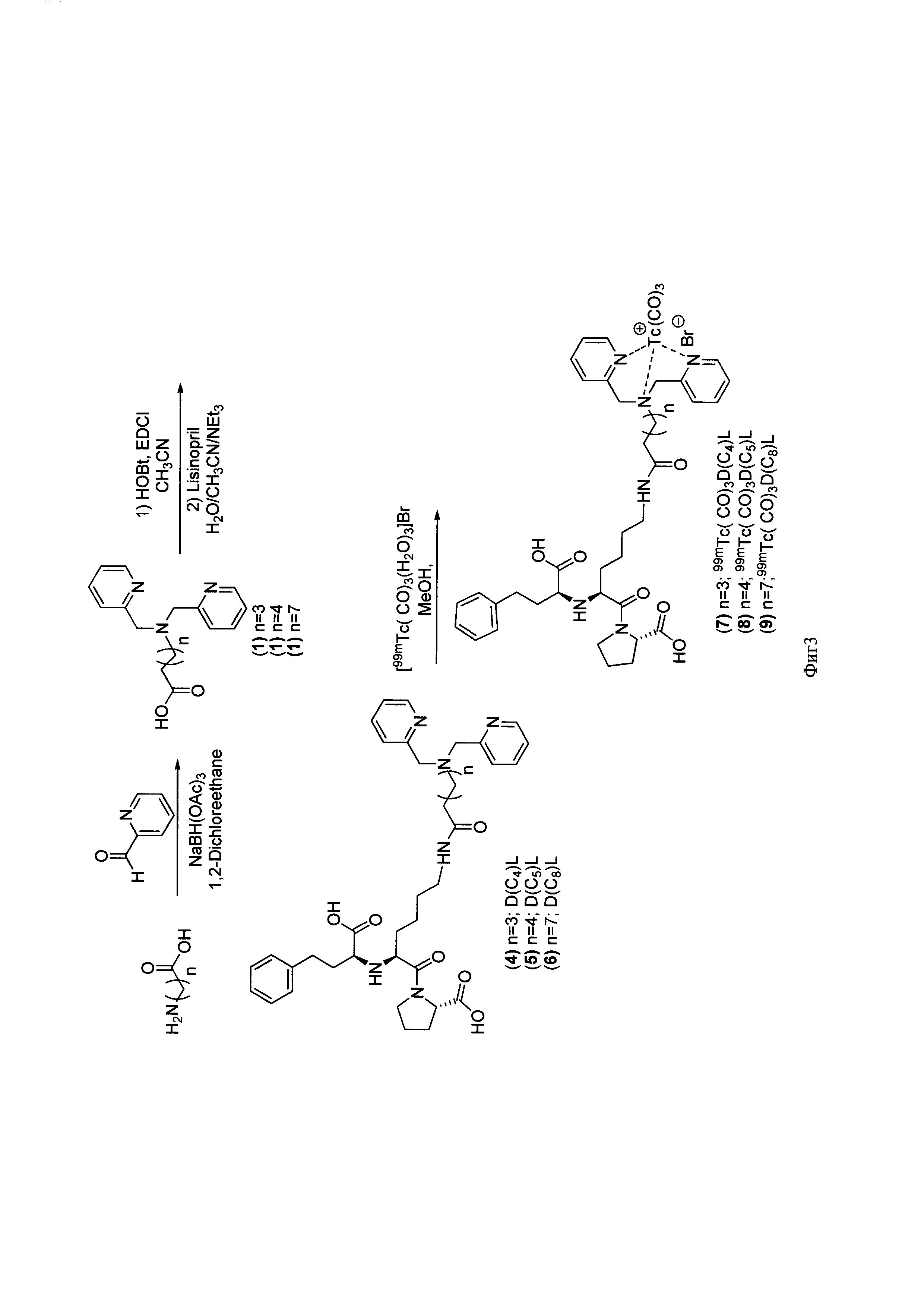
Известен способ получения ω-бис(пиридин-2-илметил)амино)алифатических кислот, основанный на синтезе из омега-аминоалифатических кислот и пиридин-2-карбальдегида в присутствии натрия триацетоксиборгидрида и дихлорэтана. Синтез ведут при перемешивании в течение 8 часов при комнатной температуре с последующим выделением продуктов экстракцией хлороформом и очисткой флэш-хроматографией (фиг. 3) [3]. Выходы продуктов невысокие (40-80%), реагенты малодоступные.
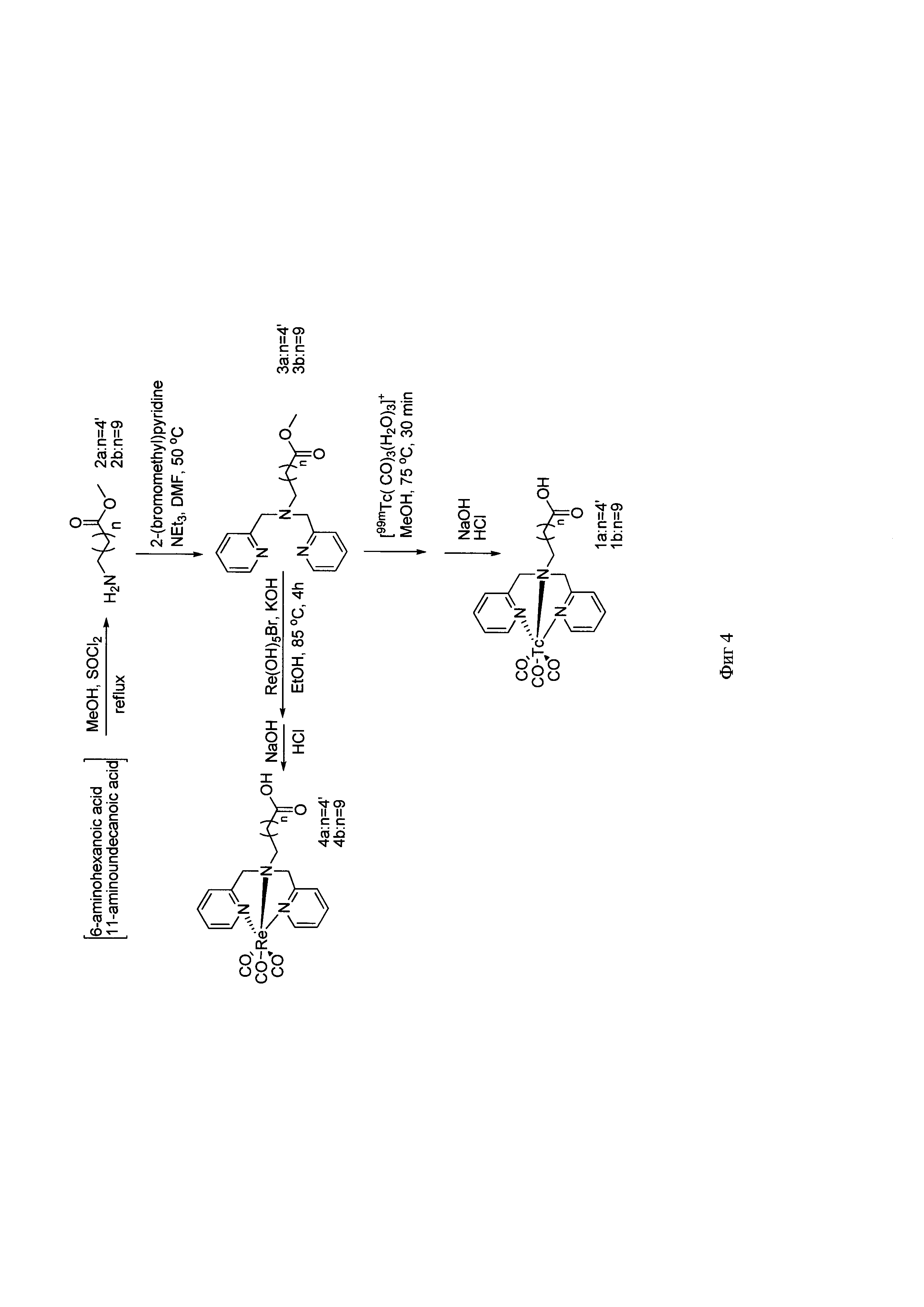
Наиболее близким к предлагаемому можно считать способ получения 6-(бис(пиридин-2-илметил)амино)гексановой и 11-(бис(пиридин-2-илметил)амино)ундекановой кислот, который включает реакцию нуклеофильного замещения атомов водорода в амино-группах 6-аминокапроновой кислоты или 11-аминоундекановой кислоты на 2-пиколин бромид (фиг. 4) [4]. В данном способе на первой стадии исходные субстраты 6-аминогексановую кислоту или 11-(бис(пиридин-2-илметил)амино)ундекановую кислоту этерифицируют метиловым спиртом с использованием токсичного тионилхлорида. Выходы продуктов составили не более 45%. На второй стадии метилированные продукты реагируют с двухкратным избытком 2-пиколин бромида в течение 5 дней при перемешивании при температуре 50°C. Выходы целевых продуктов 34-41%. Недостатками способа являются необходимость проводить предварительно трудоемкую реакцию этерификацию исходных субстратов с использованием токсичного тионилхлорида, низкие выходы продуктов реакции, большой расход реагента 2-пиколин бромида и длительность синтеза.
Новая техническая задача - упрощение способа, повышение селективности способа, повышение выходов продуктов, универсальность метода.
Для решения поставленной задачи в способе получения ω-бис(пиридин-2-илметил)амино)алифатических кислот, включающем получение эфиров ω-производных алифатических кислот с последующим взаимодействием с реагентом, содержащим пиколил-заместитель, на первом этапе получают промежуточные продукты синтеза - эфиры ω-иодалифатических карбоновых кислот путем окислительного расщепления алифатических циклических кетонов под действием пероксида водорода в присутствии катализатора ионов меди и соединений иода, при комнатной температуре, при этом, подвергают расщеплению такие циклические кетоны, как циклопентанон, циклогексанон, или циклогептанон, или 4-метилциклогексанон, или любой другой циклический кетон, также, в качестве катализатора используют меди (I) хлорид; получение проводят при следующем соотношении компонентов: циклические кетоны - пероксид водорода - меди (I) хлорид - 1:5:0,1, при перемешивании, в течение 10-20 часов, в присутствии метанольных или этанольных растворов иода, также, количество иода берут в следующем соотношении: циклические кетоны - иод - 1:0,5. Для выделения и разделения промежуточных продуктов в реакционную массу добавляют насыщенный раствор натрия гидрокарбоната, при этом, ω-иодалифатические карбоновые кислоты переводят в водный слой в виде натриевых солей, а их эфиры отделяют путем экстракции водного слоя этилацетатом, после этого, этилацетатное извлечение осушают с помощью натрия сульфата безводного, этилацетат отгоняют и получают эфиры ω-иодалифатических карбоновых кислот. На второй стадии способа в эфирах ω-иодалифатических карбоновых кислот атом иода замещают на бис(пиридин-2-илметил)амино)-группу, для этого используют ди-2-пиколиламин. Вторую стадию проводят при следующем соотношении компонентов: эфиры ω-иодалифатических карбоновых кислот - ди-2-пиколиламин - триэтиламин - 1:1,16:1, при перемешивании при 50°C в течение 24 часов. Для выделения эфиров ω-бис(пиридин-2-илметил)амино)алифатических кислот в реакционную массу добавляют насыщенный раствор натрия гидрокарбоната и экстрагируют этилацетатом, этилацетатное извлечение осушают с помощью натрия сульфата безводного, этилацетат отгоняют. Остаток подвергают очистки методом колоночной хроматографии на силикагеле с использованием в качестве элюента смесь гексан - этилацетат (1:1) постепенно повышая градиент последнего и выделяют эфир ω-бис(пиридин-2-илметил)амино)алифатической кислоты. Полученный эфир подвергают гидролизу в ацетонитриле под действием концентрированной хлороводородной кислотой в течение 2 часов при температуре 50°C. Растворитель отгоняют под вакуумом и получают ω-бис(пиридин-2-илметил)амино)алифатические кислоты, не требующие дополнительной очистки.
Отличительные признаки проявили в заявляемой совокупности предлагаемого способа новые свойства, явным образом не вытекающие из уровня техники в данной области и не очевидные для специалиста.
Предлагаемая совокупность признаков не описана в патентной и научно-технической литературе.
Примеры конкретных способов получения ω-бис(пиридин-2-илметил)амино)алифатических кислот
Пример 1. Получение метилового эфира ω-иодгексановой кислоты
К раствору циклогексанона в 10 мл метанола (6 ммоль, 0,588 г, ρ=0,946 г/см3) добавляют иод (3 ммоль, 0,762 г), катализатор меди (I) хлорида (0,6 ммоль, 0,06 г). Затем при перемешивании при комнатной температуре по каплям вносят раствор пероксида водорода в метаноле (12 ммоль, 1,275 г пергидроля (32%-ного H2O2, ρ=1,125 г/см3) в 5 мл метанола) в течение 4 часов. Далее добавляют 12 ммоль (1,275 г) пергидроля и меди (I) хлорида (0,3 ммоль, 0,03 г), перемешивают при комнатной температуре 10 часов и после этого добавляют еще 6 ммоль (0,638 г) пергидроля при перемешивании еще 6 часов в тех же условиях.
К реакционной смеси добавляют насыщенный раствор натрия гидрокарбоната до прекращения выделения углекислого газа и натрия сульфит для окисления остатка иода. Далее реакционную смесь фильтруют, отбрасывая осадок, содержащий соли меди (I) хлориды и иодиды. Полученный фильтрат экстрагируют этилацетатом (2×10 мл). Этилацетатное извлечение осушают путем пропускания через натрий сульфат безводный и растворитель отгоняют. Полученную светло-желтую маслообразную массу сушат под вакуумом. Выход 1,248 г (81%). Спектр ЯМР 1Н (500 MHz, CDCl3, δ, м.д.): 3,67 (с, 3H), 3,18 (т, 2Н), 2,32 (т, 2Н), 1,84 (кв, 2Н), 1,62 (кв, 2Н), 1,43(кв, 2Н) (фиг. 5).
Пример 2. Получение метилового эфира 6-(бис(пиридин-2-илметил)амино)гексановой кислоты при 30°C
К метиловому эфиру ω-иодгексановой кислоты (2,37 ммоль, 0,6068 г), полученному по примеру 1, добавляют 500 мкл (2,76 ммоль) 2-(дипикалил)амина, 2 мл изопропанола и 330 мкл (2,37 ммоль) триэтиламина. Реакционную массу перемешивают при 30°C в течение 24 часов. Конец реакции определяют методом тонкослойной хроматографии (элюент : этилацетат-этанол =10:3).
После к реакционной массе добавляют 5 мл 10% раствора соды и экстрагируют этилацетатом (2×5 мл). Этилацетатное извлечение промывают рассолом, сушат с безводным натрия сульфатом и растворитель отгоняют. Полученный продукт подвергают очистки методом колоночной хроматографии на силикагели с использованием в качестве элюента смесь гексан - этилацетат (1:1) постепенно повышая градиент последнего. Выход продукта составил 32%.
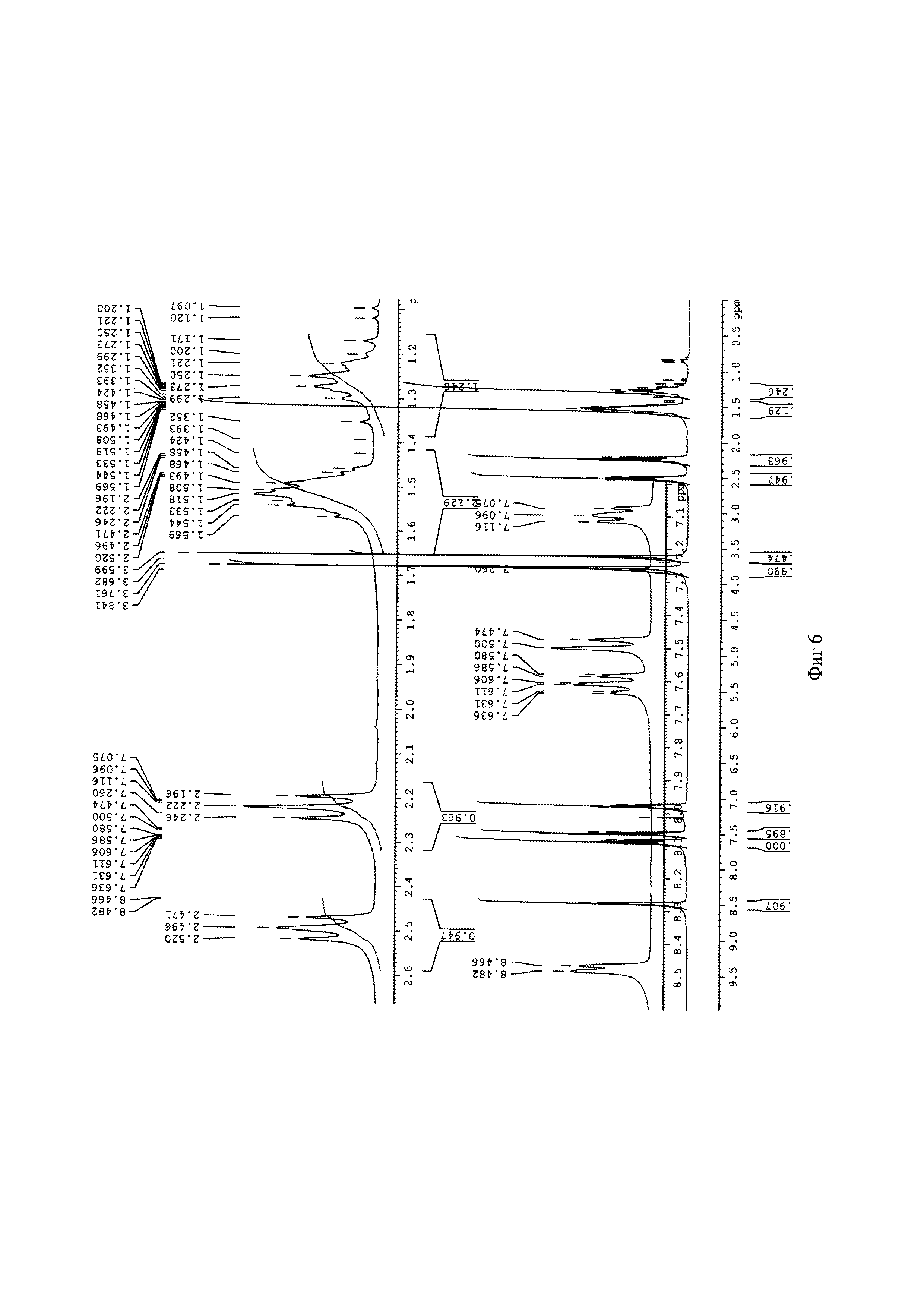
Для идентификации синтезированного метил 6-(бис(пиридин-2-илметил)амино)гексаноата был получен 1H-ЯМР-спектр, вид которого соответствует структуре синтезированного эфира (300 МГц, CDCl3, δ, м.д., J, Гц): 8,48 (д, 2Наром, J=4,8 Гц), 7,61 (т, 2Наром), 7,48 (д, 2Наром, J=7,8 Гц), 7,11 (т, 2Наром), 3,8 (с, СН2), 3,67 (с, СН3), 2,52 (т, СН2), 2,24 (т, СН2), 1,52 (м, СН2), 1,25 (м, СН2) (фиг. 6). MS (ESI)-m/z: (М+Н)+ - найдено: 328,2032, (М+Н)+ - вычислено: 328,2020 (фиг. 7).
Пример 3. Получение метилового эфира 6-(бис(пиридин-2-илметил)амино)гексановой кислоты при 40°C
К метиловому эфиру ω-иодгексановой кислоты (2,37 ммоль, 0,6068 г), полученному по примеру 1, добавляют 500 мкл (2,76 ммоль) 2-(дипикалил)амина, 2 мл изопропанола и 330 мкл (2,37 ммоль) триэтиламина. Реакционную массу перемешивают при 40°C в течение 24 часов. Конец реакции определяют методом тонкослойной хроматографии (элюент : этилацетат-этанол =10:3).
После к реакционной массе добавляют 5 мл 10% раствора соды и экстрагируют этилацетатом (2×5 мл). Этилацетатное извлечение промывают рассолом, сушат с безводным натрия сульфатом и растворитель отгоняют. Полученный продукт подвергают очистки методом колоночной хроматографии на силикагели с использованием в качестве элюента смесь гексан - этилацетат (1:1) постепенно повышая градиент последнего. Выход продукта составил 61%.
Для идентификации синтезированного метил 6-(бис(пиридин-2-илметил)амино)гексаноата был получен 1H-ЯМР-спектр, вид которого соответствует структуре синтезированного эфира (300 МГц, CDCl3, δ, м.д., J, Гц): 8,48 (д, 2Наром, J=4,8 Гц), 7,61 (т, 2Наром), 7,48 (д, 2Наром, J=7,8 Гц), 7,11(т, 2Наром), 3,8 (с, СН2), 3,67 (с, СН3), 2,52 (т, СН2), 2,24 (т, СН2), 1,52 (м, СН2), 1,25 (м, СН2) (фиг. 6). MS (ESI)-m/z: (М+Н)+ - найдено: 328,2032, (М+Н)+ - вычислено: 328,2020 (фиг. 7).
Пример 4. Получение метилового эфира 6-(бис(пиридин-2-илметил)амино)гексановой кислоты при 45°C
К метиловому эфиру ω-иодгексановой кислоты (2,37 ммоль, 0,6068 г), полученному по примеру 1, добавляют 500 мкл (2,76 ммоль) 2-(дипикалил)амина, 2 мл изопропанола и 330 мкл (2,37 ммоль) триэтиламина. Реакционную массу перемешивают при 45°C в течение 24 часов. Конец реакции определяют методом тонкослойной хроматографии (элюент : этилацетат-этанол =10:3).
После к реакционной массе добавляют 5 мл 10% раствора соды и экстрагируют этилацетатом (2×5 мл). Этилацетатное извлечение промывают рассолом, сушат с безводным натрия сульфатом и растворитель отгоняют. Полученный продукт подвергают очистки методом колоночной хроматографии на силикагели с использованием в качестве элюента смесь гексан - этилацетат (1:1) постепенно повышая градиент последнего. Выход продукта составил 83%.
Для идентификации синтезированного метил 6-(бис(пиридин-2-илметил)амино)гексаноата был получен 1H-ЯМР-спектр, вид которого соответствует структуре синтезированного эфира (300 МГц, CDCl3, δ, м.д., J, Гц): 8,48 (д, 2Наром, J=4,8 Гц), 7,61 (т, 2Наром), 7,48 (д, 2Наром, J=7,8 Гц), 7,11 (т, 2Наром), 3,8 (с, СН2), 3,67 (с, СН3), 2,52 (т, СН2), 2,24 (т, СН2), 1,52 (м, СН2), 1,25 (м, СН2) (фиг. 5). MS (ESI)-m/z: (М+Н)+ - найдено: 328,2032, (М+Н)+ - вычислено: 328,2020 (фиг. 6).
Пример 5. Получение метилового эфира 6-(бис(пиридин-2-илметил)амино)гексановой кислоты при 50°C
К метиловому эфиру ω-иодгексановой кислоты (2,37 ммоль, 0,6068 г), полученному по примеру 1, добавляют 500 мкл (2,76 ммоль) 2-(дипикалил)амина, 2 мл изопропанола и 330 мкл (2,37 ммоль) триэтиламина. Реакционную массу перемешивают при 50°C в течение 24 часов. Конец реакции определяют методом тонкослойной хроматографии (элюент : этилацетат-этанол =10:3).
После к реакционной массе добавляют 5 мл 10% раствора соды и экстрагируют этилацетатом (2×5 мл). Этилацетатное извлечение промывают рассолом, сушат с безводным натрия сульфатом и растворитель отгоняют. Полученный продукт подвергают очистки методом колоночной хроматографии на силикагели с использованием в качестве элюента смесь гексан - этилацетат (1:1) постепенно повышая градиент последнего. Выход продукта составил 90%.
Для идентификации синтезированного метил 6-(бис(пиридин-2-илметил)амино)гексаноата был получен 1H-ЯМР-спектр, вид которого соответствует структуре синтезированного эфира (300 МГц, CDCl3, δ, м.д., J, Гц): 8,48 (д, 2Наром, J=4,8 Гц), 7,61 (т, 2Наром), 7,48 (д, 2Наром, J=7,8 Гц), 7,11 (т, 2Наром), 3,8 (с, СН2), 3,67 (с, СН3), 2,52 (т, СН2), 2,24 (т, СН2), 1,52 (м, СН2), 1,25 (м, СН2) (фиг. 6). MS (ESI)-m/z: (М+Н)+ - найдено: 328,2032, (М+Н)+ - вычислено: 328,2020 (фиг. 7).
Пример 6. Получение метилового эфира 6-(бис(пиридин-2-илметил)амино)гексановой кислоты при 55°C
К метиловому эфиру ω-иодгексановой кислоты (2,37 ммоль, 0,6068 г), полученному по примеру 1, добавляют 500 мкл (2,76 ммоль) 2-(дипикалил)амина, 2 мл изопропанола и 330 мкл (2,37 ммоль) триэтиламина. Реакционную массу перемешивают при 55°C в течение 24 часов. Конец реакции определяют методом тонкослойной хроматографии (элюент : этилацетат-этанол =10:3).
После к реакционной массе добавляют 5 мл 10%) раствора соды и экстрагируют этилацетатом (2×5 мл). Этилацетатное извлечение промывают рассолом, сушат с безводным натрия сульфатом и растворитель отгоняют. Полученный продукт подвергают очистки методом колоночной хроматографии на силикагели с использованием в качестве элюента смесь гексан - этилацетат (1:1) постепенно повышая градиент последнего. Выход продукта составил 86%.
Для идентификации синтезированного метил 6-(бис(пиридин-2-илметил)амино)гексаноата был получен 1Н-ЯМР-спектр, вид которого соответствует структуре синтезированного эфира (300 МГц, CDCl3, δ, м.д., J, Гц): 8,48 (д, 2Наром, J=4,8 Гц), 7,61 (т, 2Наром), 7,48 (д, 2Наром, J=7,8 Гц), 7,11 (т, 2Наром), 3,8 (с, СН2), 3,67 (с, СН3), 2,52 (т, СН2), 2,24 (т, СН2), 1,52 (м, СН2), 1,25 (м, СН2) (фиг. 6). MS (ESI)-m/z: (М+Н)+ - найдено: 328,2032, (М+Н)+ - вычислено: 328,2020 (фиг. 7).
Пример 7. Получение метилового эфира 6-(бис(пиридин-2-илметил)амино)гексановой кислоты при 60°C
К метиловому эфиру ω-иодгексановой кислоты (2,37 ммоль, 0,6068 г), полученному по примеру 1, добавляют 500 мкл (2,76 ммоль) 2-(дипикалил)амина, 2 мл изопропанола и 330 мкл (2,37 ммоль) триэтиламина. Реакционную массу перемешивают при 60°C в течение 24 часов. Конец реакции определяют методом тонкослойной хроматографии (элюент : этилацетат-этанол =10:3).
После к реакционной массе добавляют 5 мл 10% раствора соды и экстрагируют этилацетатом (2×5 мл). Этилацетатное извлечение промывают рассолом, сушат с безводным натрия сульфатом и растворитель отгоняют. Полученный продукт подвергают очистки методом колоночной хроматографии на силикагели с использованием в качестве элюента смесь гексан - этилацетат (1:1) постепенно повышая градиент последнего. Выход продукта составил 64%.
Для идентификации синтезированного метил 6-(бис(пиридин-2-илметил)амино)гексаноата был получен 1H-ЯМР-спектр, вид которого соответствует структуре синтезированного эфира (300 МГц, CDCl3, δ, м.д., J, Гц): 8,48 (д, 2Наром, J=4,8 Гц), 7,61 (т, 2Наром), 7,48 (д, 2Наром, J=7,8 Гц), 7,11 (т, 2Наром), 3,8 (с, СН2), 3,67 (с, СН3), 2,52 (т, СН2), 2,24 (т, СН2), 1,52 (м, СН2), 1,25 (м, СН2) (фиг. 6). MS (ESI)-m/z: (М+Н)+ - найдено: 328,2032, (М+Н)+ - вычислено: 328,2020 (фиг. 7).
Пример 8. Получение метилового эфира 6-(бис(пиридин-2-илметил)амино)гексановой кислоты при 70°C
К метиловому эфиру ω-иодгексановой кислоты (2,37 ммоль, 0,6068 г), полученному по примеру 1, добавляют 500 мкл (2,76 ммоль) 2-(дипикалил)амина, 2 мл изопропанола и 330 мкл (2,37 ммоль) триэтиламина. Реакционную массу перемешивают при 70°C в течение 24 часов. Конец реакции определяют методом тонкослойной хроматографии (элюент : этилацетат-этанол =10:3).
После к реакционной массе добавляют 5 мл 10% раствора соды и экстрагируют этилацетатом (2×5 мл). Этилацетатное извлечение промывают рассолом, сушат с безводным натрия сульфатом и растворитель отгоняют. Полученный продукт подвергают очистки методом колоночной хроматографии на силикагели с использованием в качестве элюента смесь гексан - этилацетат (1:1) постепенно повышая градиент последнего. Выход продукта составил 42%.
Для идентификации синтезированного метил 6-(бис(пиридин-2-илметил)амино)гексаноата был получен 1H-ЯМР-спектр, вид которого соответствует структуре синтезированного эфира (300 МГц, CDCl3, δ, м.д., J, Гц): 8,48 (д, 2Наром, J=4,8 Гц), 7,61 (т, 2Наром), 7,48 (д, 2Наром, J=7,8 Гц), 7,11 (т, 2Наром), 3,8 (с, СН2), 3,67 (с, СН3), 2,52 (т, СН2), 2,24 (т, СН2), 1,52 (м, СН2), 1,25 (м, СН2) (фиг. 6). MS (ESI)-m/z: (М+Н)+ - найдено: 328,2032, (М+Н)+ - вычислено: 328,2020 (фиг. 7).
Пример 9. Получение метилового эфира 6-(бис(пиридин-2-илметил)амино)гексановой кислоты
К метиловому эфиру ω-иодгексановой кислоты (2,37 ммоль, 0,6068 г), полученному по примеру 1, добавляют 500 мкл (2,76 ммоль) 2-(дипикалил)амина, 2 мл изопропанола и 165 мкл (1,86 ммоль) триэтиламина. Реакционную массу перемешивают при 50°C в течение 24 часов. Конец реакции определяют методом тонкослойной хроматографии (элюент : этилацетат-этанол =10:3).
После к реакционной массе добавляют 5 мл 10% раствора соды и экстрагируют этилацетатом (2×5 мл). Этилацетатное извлечение промывают рассолом, сушат с безводным натрия сульфатом и растворитель отгоняют. Полученный продукт подвергают очистки методом колоночной хроматографии на силикагели с использованием в качестве элюента смесь гексан - этилацетат (1:1) постепенно повышая градиент последнего. Выход продукта составил 32%.
Для идентификации синтезированного метил 6-(бис(пиридин-2-илметил)амино)гексаноата был получен 1H-ЯМР-спектр, вид которого соответствует структуре синтезированного эфира (300 МГц, CDCl3, δ, м.д., J, Гц): 8,48 (д, 2Наром, J=4,8 Гц), 7,61 (т, 2Наром), 7,48 (д, 2Наром, J=7,8 Гц), 7,11 (т, 2Наром), 3,8 (с, СН2), 3,67 (с, СН3), 2,52 (т, СН2), 2,24 (т, СН2), 1,52 (м, СН2), 1,25 (м, СН2) (фиг. 6). MS (ESI)-m/z: (М+Н)+ - найдено: 328,2032, (М+Н)+ - вычислено: 328,2020 (фиг. 7).
Пример 10. Получение метилового эфира 6-(бис(пиридин-2-илметил)амино)гексановой кислоты
К метиловому эфиру ω-иодгексановой кислоты (2,37 ммоль, 0,6068 г), полученному по примеру 1, добавляют 430 мкл (2,37 ммоль) 2-(дипикалил)амина, 2 мл изопропанола и 330 мкл (2,37 ммоль) триэтиламина. Реакционную массу перемешивают при 50°C в течение 24 часов. Конец реакции определяют методом тонкослойной хроматографии (элюент : этилацетат-этанол =10:3).
После к реакционной массе добавляют 5 мл 10% раствора соды и экстрагируют этилацетатом (2×5 мл). Этилацетатное извлечение промывают рассолом, сушат с безводным натрия сульфатом и растворитель отгоняют. Полученный продукт подвергают очистки методом колоночной хроматографии на силикагели с использованием в качестве элюента смесь гексан - этилацетат (1:1) постепенно повышая градиент последнего. Выход продукта составил 32%.
Для идентификации синтезированного метил 6-(бис(пиридин-2-илметил)амино)гексаноата был получен 1H-ЯМР-спектр, вид которого соответствует структуре синтезированного эфира (300 МГц, CDCl3, δ, м.д., J, Гц): 8,48 (д, 2Наром, J=4,8 Гц), 7,61 (т, 2Наром), 7,48 (д, 2Наром, J=7,8 Гц), 7,11 (т, 2Наром), 3,8 (с, СН2), 3,67 (с, СН3), 2,52 (т, СН2), 2,24 (т, СН2), 1,52 (м, СН2), 1,25 (м, СН2) (фиг. 6). MS (ESI)-m/z: (М+Н)+ - найдено: 328,2032, (М+Н)+ - вычислено: 328,2020 (фиг. 7).
Пример 11. Методика синтеза 6-(бис(пиридин-2-илметил)амино)гексановой кислоты при 50°C
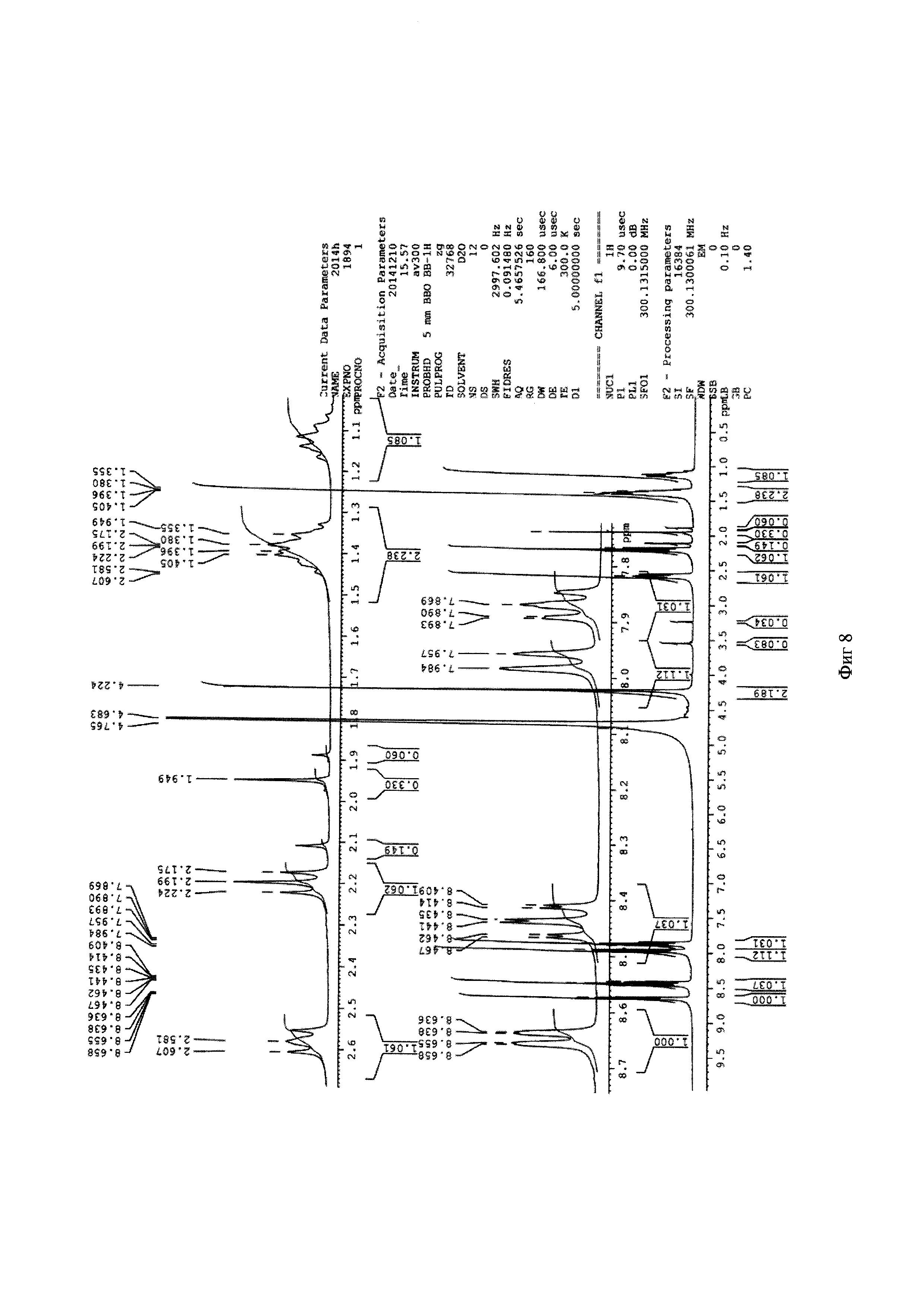
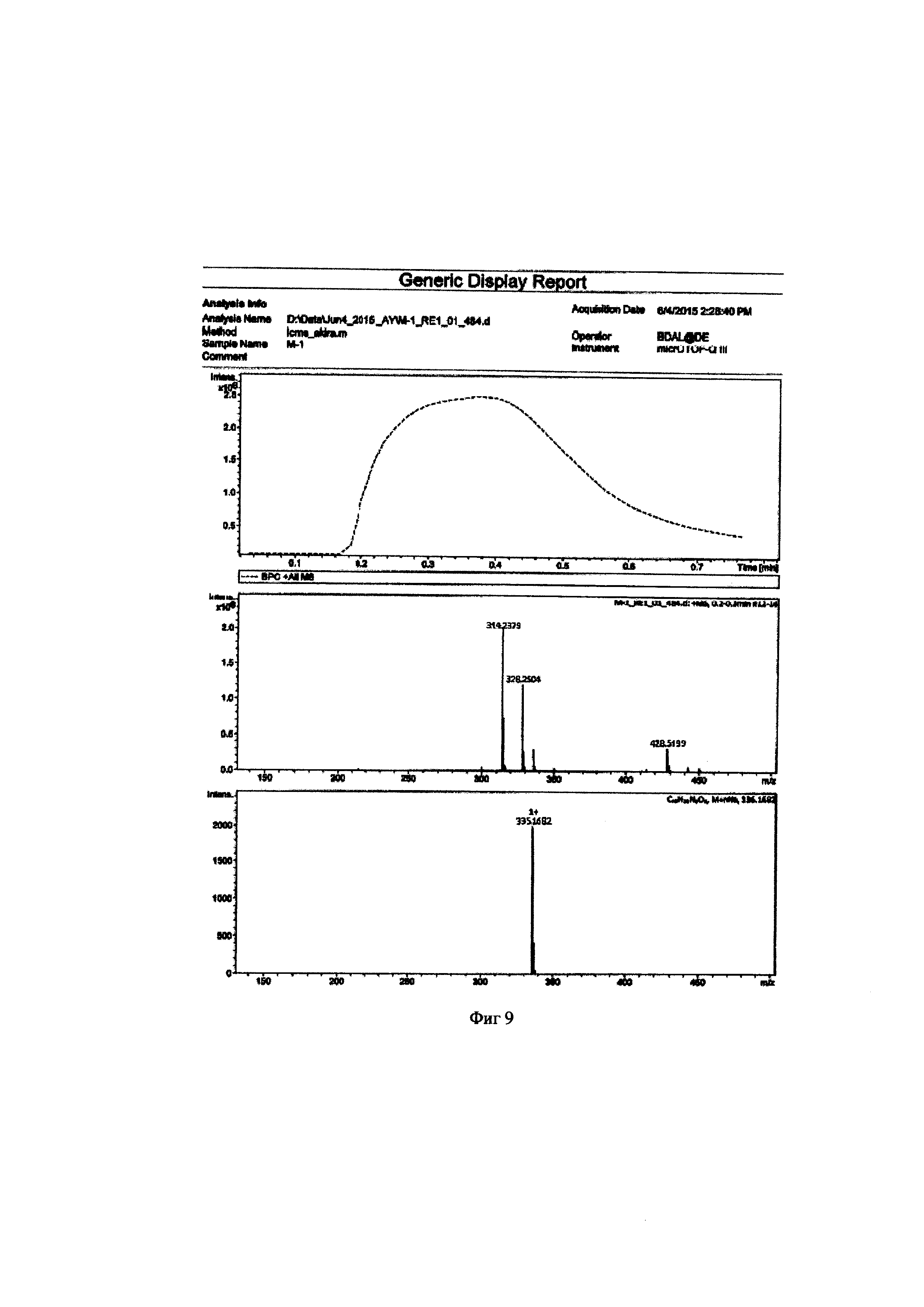
Метил 6-(бис(пиридин-2-илметил)амино)гексаноат 0,053 г (0,16 ммоль) растворяют в 2 мл ацетонитрила и добавляют 50 мкл HCl (36%). Реакционную массу перемешивают в течение 2 часов при температуре 50°C. Конец реакции определяют методом тонкослойной хроматографии (элюент : этилацетат - этанол =10:3). После окончания гидролиза растворители отгоняют при пониженном давлении. Выход продукта составил 96%. Для идентификации синтезированной 6-(бис(пиридин-2-илметил)амино)гексановой кислоты был получен 1Н-ЯМР-спектр, вид которого соответствует структуре синтезированной кислоте (300 МГц, H2O, δ, м.д., J, Гц): 8,65 (д, 2Наром, J=5,7 Гц), 8,4 (т, 2Наром), 7,97 (д, 2Наром, J=9,1 Гц), 7,89 (т, 2Наром), 4,24 (с, СН2), 2,20 (т, СН2), 1,40 (м, СН2), 1,10 (м, СН2). (фиг. 8). MS (ESI)-m/z для C18H24N3O2: (М+Н)+ - найдено: 314,1879; (М+Н)+ - вычислено: 314,1869 (фиг. 9)
Пример 12. Методика синтеза 6-(бис(пиридин-2-илметил)амино)гексановой кислоты при 40°C
Метил 6-(бис(пиридин-2-илметил)амино)гексаноат 0,053 г (0,16 ммоль) растворяют в 2 мл ацетонитрила и добавляют 50 мкл HCl (36%). Реакционную массу перемешивают в течение 2 часов при температуре 40°C. Конец реакции определяют методом тонкослойной хроматографии (элюент : этилацетат - этанол =10:3). После окончания гидролиза растворители отгоняют при пониженном давлении. Выход продукта составил 76%. Для идентификации синтезированной 6-(бис(пиридин-2-илметил)амино)гексановой кислоты был получен 1H-ЯМР-спектр, вид которого соответствует структуре синтезированной кислоте (300 МГц, H2O, δ, м.д., J, Гц): 8,65 (д, 2Наром, J=5,7 Гц), 8,4 (т, 2Наром), 7,97 (д, 2Наром, J=9,1 Гц), 7,89 (т, 2Наром), 4,24 (с, СН2), 2,20 (т, СН2), 1,40 (м, СН2), 1,10 (м, СН2). (фиг. 8). MS (ESI)-m/z для C18H24N3O2: (М+Н)+ - найдено: 314,1879; (М+Н)+ - вычислено: 314,1869 (фиг. 9).
Пример 13. Методика синтеза 6-(бис(пиридин-2-илметил)амино)гексановой кислоты при 45°C
Метил 6-(бис(пиридин-2-илметил)амино)гексаноат 0,053 г (0,16 ммоль) растворяют в 2 мл ацетонитрила и добавляют 50 мкл HCl (36%). Реакционную массу перемешивают в течение 2 часов при температуре 45°C. Конец реакции определяют методом тонкослойной хроматографии (элюент : этилацетат - этанол =10:3). После окончания гидролиза растворители отгоняют при пониженном давлении. Выход продукта составил 95%. Для идентификации синтезированной 6-(бис(пиридин-2-илметил)амино)гексановой кислоты был получен 1Н-ЯМР-спектр, вид которого соответствует структуре синтезированной кислоте (300 МГц, H2O, δ, м.д., J, Гц): 8,65 (д, 2Наром, J=5,7 Гц), 8,4 (т, 2Наром), 7,97 (д, 2Наром, J=9,1 Гц), 7,89 (т, 2Наром), 4,24 (с, СН2), 2,20 (т, СН2), 1,40 (м, СН2), 1,10 (м, СН2). (фиг. 8). MS (ESI)-m/z для C18H24N3O2: (М+Н)+ - найдено: 314,1879; (М+Н)+ - вычислено: 314,1869 (фиг. 9).
Пример 14. Методика синтеза 6-(бис(пиридин-2-илметил)амино)гексановой кислоты при 55°C
Метил 6-(бис(пиридин-2-илметил)амино)гексаноат 0,053 г (0,16 ммоль) растворяют в 2 мл ацетонитрила и добавляют 50 мкл HCl (36%). Реакционную массу перемешивают в течение 2 часов при температуре 55°C. Конец реакции определяют методом тонкослойной хроматографии (элюент : этилацетат - этанол =10:3). После окончания гидролиза растворители отгоняют при пониженном давлении. Выход продукта составил 96%. Для идентификации синтезированной 6-(бис(пиридин-2-илметил)амино)гексановой кислоты был получен 1H-ЯМР-спектр, вид которого соответствует структуре синтезированной кислоте (300 МГц, H2O, δ, м.д., J, Гц): 8,65 (д, 2Наром, J=5,7 Гц), 8,4 (т, 2Наром), 7,97 (д, 2Наром, J=9,l Гц), 7,89 (т, 2Наром), 4,24 (с, СН2), 2,20 (т, СН2), 1,40 (м, СН2), 1,10 (м, СН2). (фиг. 8). MS (ESI)-m/z для C18H24N3O2: (М+Н)+ - найдено: 314,1879; (М+Н)+ - вычислено: 314,1869 (фиг. 9).
Пример 15. Методика синтеза 6-(бис(пиридин-2-илметил)амино)гексановой кислоты при 60°C
Метил 6-(бис(пиридин-2-илметил)амино)гексаноат 0,053 г (0,16 ммоль) растворяют в 2 мл ацетонитрила и добавляют 50 мкл HCl (36%). Реакционную массу перемешивают в течение 2 часов при температуре 50°C. Конец реакции определяют методом тонкослойной хроматографии (элюент : этилацетат - этанол =10:3). После окончания гидролиза растворители отгоняют при пониженном давлении. Выход продукта составил 90%. Для идентификации синтезированной 6-(бис(пиридин-2-илметил)амино)гексановой кислоты был получен 1H-ЯМР-спектр, вид которого соответствует структуре синтезированной кислоте (300 МГц, Н2О, δ, м.д., 7 Гц): 8,65 (д, 2Наром, J=5,7 Гц), 8,4 (т, 2Наром), 7,97 (д, 2Наром, J=9,1 Гц), 7,89 (т, 2Наром), 4,24 (с, СН2), 2,20 (т, СН2), 1,40 (м, СН2), 1,10 (м, СН2). (фиг. 8). MS (ESI)-m/z для C18H24N3O2: (М+Н)+ - найдено: 314,1879; (М+Н)+ - вычислено: 314,1869 (фиг. 9)
Пример 16. Методика синтеза 6-(бис(пиридин-2-илметил)амино)гексановой кислоты
Метил 6-(бис(пиридин-2-илметил)амино)гексаноат 0,053 г (0,16 ммоль) растворяют в 2 мл ацетонитрила и добавляют 50 мкл HCl (36%). Реакционную массу перемешивают в течение 1,5 часов при температуре 50°C. Конец реакции определяют методом тонкослойной хроматографии (элюент : этилацетат - этанол =10:3). После окончания гидролиза растворители отгоняют при пониженном давлении. Выход продукта составил 86%. Для идентификации синтезированной 6-(бис(пиридин-2-илметил)амино)гексановой кислоты был получен 1Н-ЯМР-спектр, вид которого соответствует структуре синтезированной кислоте (300 МГц, H2O, δ, м.д., 7 Гц): 8,65 (д, 2Наром, J=5,7 Гц), 8,4 (т, 2Наром), 7,97 (д, 2Наром, J=9,1 Гц), 7,89 (т, 2Наром), 4,24 (с, СН2), 2,20 (т, СН2), 1,40 (м, СН2), 1,10 (м, СН2). (фиг. 8). MS (ESI)-m/z для C18H24N3O2: (М+Н)+ - найдено: 314,1879; (М+Н)+ - вычислено: 314,1869 (фиг. 9)
Обоснование режима
Экспериментальным путем подобран оптимальный температурный режим получения ω-бис(пиридин-2-илметил)амино)алифатических кислот (примеры 2-8). Установлено, что реакцию получения эфиров ω-бис(пиридин-2-илметил)амино)алифатических кислот необходимо проводить при температуре 45-55°C, при этом выход продуктов составляет 80-90%, а увеличение температуры до 60-70°C приводит к снижению выхода на 20-40%.
Оптимальным является соотношение компонентов в реакционной смеси эфиры ω-иодалифатических карбоновых кислот - ди-2-пиколиламин - триэтиламин - 1:1,16:1. Такое соотношение позволяет практически полностью заместить атомы иода на остаток ди-2-пиколиламин, что необходимо для достижения высоких выходов целевых продуктов (примеры 5, 9-10).
Для стадии гидролиза принципиальными оказались температурный режим и время проведения гидролиза. Оптимальным является проведение гидролиза при температуре 45-55°C, при этом выход ω-бис(пиридин-2-илметил)амино)алифатических кислот свыше 98%. Так, при более высокой температуре (более 60°C) выходы существенно снижались (на 10-15%), так как помимо гидролиза происходило образованию побочных продуктов (примеры 11-15).
Выход ω-бис(пиридин-2-илметил)амино)алифатических кислот достигается наибольшим при проведении гидролиза в течение 2-3 часов (примеры 11, 16). Уменьшение времени реакции (менее 2 ч) приводит к неполному гидролизу эфиров и, следовательно, к снижению выхода целевых кислот.
Таким образом, предлагаемый способ имеет принципиальные преимущества перед известными способами получения ω-бис(пиридин-2-илметил)амино)алифатических кислот. Во-первых, это доступность субстратов - эфиров ω-иодалифатических карбоновых кислот, которые предлагается получать из дешевых, коммерчески доступных, не обладающих токсичностью циклических кетонов. Используемые остальные компоненты синтеза также отвечают принципам «зеленой» химии. Во-вторых, подобранные условия, а именно соотношения реагентов, время реакции и температура реакции, позволяют получить продукты с выходами 80-95%). Также, по результатам экспериментов было установлено, что выход меченного комплекса 99mTc с ω-бис(пиридин-2-илметил)амино)алифатическими кислотами составил 83,6% при радиохимической чистоте 90,3%, что позволяет успешно предлагать ω-бис(пиридин-2-илметил)амино)алифатические кислоты, полученные по разработанному способу, для связывания технеция-99 м.
Источники информации
1. Патент №2494087 от 27.09.2013. Способ получения ω-иодалифатических карбоновых кислот и их эфиров / Юсубов М.С., Жданкин В.В., Ларькина М.С., Дрыгунова Л.А.
2. Amino Acid and Peptide Bioconjugates of Copper(II) and Zinc(II) Complexes with a Modified N,N-Bis(2-picolyl)amine Ligand / Srecko I. Kirin, Pierre Dubon, Thomas Weyhermuller, Eckhard Bill, and Nils Metzler-Nolte // Inorganic Chemistry, Vol. 44, No. 15, 2005. P. 5405-5415.
3. Synthesis and Evaluation of a Series of 99mTc(CO)31 Lisinopril Complexes for In Vivo Imaging of Angiotensin-Converting Enzyme Expression / Frank J. Femia, Kevin P. Maresca, Shawn M. Hillier, Craig N. Zimmerman, John L. Joyal, John A. Barrett, Omer Aras, Vasken Dilsizian, William C. Eckelman, and John W. Babich // The journal of nuclear medicine. Vol. 49. No. 6. June 2008. P. 970-977.
4. Huahui, Z. Synthesis, characterization and biodistribution of new fatty acids conjugates bearing N,N,N-donorsincorporated [99mTc/Re(CO)3]+ / Dalton Transaction. - 2012. - Vol. 42. - P. 2894.
Фигура 1 - Схема получения ω-бис(пиридин-2-илметил)амино)алифатических кислот - прекурсоров с хелатными центрами для связывания металлов
Фигура 2 - Схема получения 6-(бис(пиридин-2-илметил)амино)гексановой кислоты
Фигура 3 - Схема получения производных ω-бис(пиридин-2-илметил)амино)алифатических кислот
Фигура 4 - Схема получения производных ω-бис(пиридин-2-илметил)амино)алифатических кислот
Фигура 5 - 1H-ЯМР-спектр метил 6-иодгексаноата (300 МГц, CDCl3, δ, м.д., J, Гц)
Фигура 6 - 1H-ЯМР-спектр метил 6-(бис(пиридин-2-илметил)амино)гексаноата (300 МГц, CDCl3, δ, м.д., J, Гц)
Фигура 7 - Элементный анализ метил 6-(бис(пиридин-2-илметил)амино)гексаноата
Фигура 8 - 1Н-ЯМР-спектр 6-(бис(пиридин-2-илметил)амино)гексановой кислоты (в виде гидрохлорида) (300 МГц, H2O, δ, м.д., J, Гц)
Фигура 9 - Элементный анализ 6-(бис(пиридин-2-илметил)амино)гексановой кислоты
Способ получения ω-(бис(пиридин-2-илметил)амино)алифатических кислот, включающий получение эфиров ω-производных алифатических кислот с последующим взаимодействием с реагентом, содержащим пиколил-заместитель, отличающейся тем, что на первом этапе получают промежуточные продукты синтеза - эфиры ω-иодалифатических карбоновых кислот - путем окислительного расщепления алифатических циклических кетонов под действием пероксида водорода в присутствии катализатора ионов меди и соединений иода при комнатной температуре, далее подвергают расщеплению циклические кетоны, в качестве катализатора используют меди(I) хлорид; получение проводят при следующем соотношении компонентов: циклические кетоны:пероксид водорода:меди(I) хлорид=1:5:0,1, при перемешивании в течение 10-20 ч в присутствии метанольных или этанольных растворов иода, также количество иода берут в следующем соотношении: циклические кетоны:иод=1:0,5, далее в реакционную массу добавляют насыщенный раствор натрия гидрокарбоната, переводя ω-иодалифатические карбоновые кислоты в водный слой в виде натриевых солей, а их эфиры отделяют путем экстракции водного слоя этилацетатом, затем этилацетатное извлечение осушают с помощью натрия сульфата безводного, этилацетат отгоняют и получают эфиры ω-иодалифатических карбоновых кислот; на второй стадии в эфирах ω-иодалифатических карбоновых кислот атом иода замещают на бис(пиридин-2-илметил)аминогруппу, для этого используют ди-2-пиколиламин, также вторую стадию проводят при следующем соотношении компонентов: эфиры ω-иодалифатических карбоновых кислот:ди-2-пиколиламин:триэтиламин=1:1,16:1, соответственно, при перемешивании при 50°C в течение 24 ч, после этого выделяют эфиры ω-(бис(пиридин-2-илметил)амино)алифатических кислот, для чего в реакционную массу добавляют насыщенный раствор натрия гидрокарбоната и экстрагируют этилацетатом, этилацетатное извлечение осушают с помощью натрия сульфата безводного, этилацетат отгоняют, остаток подвергают очистке методом колоночной хроматографии на силикагеле с использованием в качестве элюента смеси гексан-этилацетат (1:1), постепенно повышая градиент последнего, и выделяют эфир ω-(бис(пиридин-2-илметил)амино)алифатической кислоты, полученный эфир подвергают гидролизу в ацетонитриле под действием концентрированной хлороводородной кислоты в течение 2 ч при температуре 50°C, растворитель отгоняют под вакуумом и получают ω-(бис(пиридин-2-илметил)амино)алифатические кислоты, не требующие дополнительной очистки.