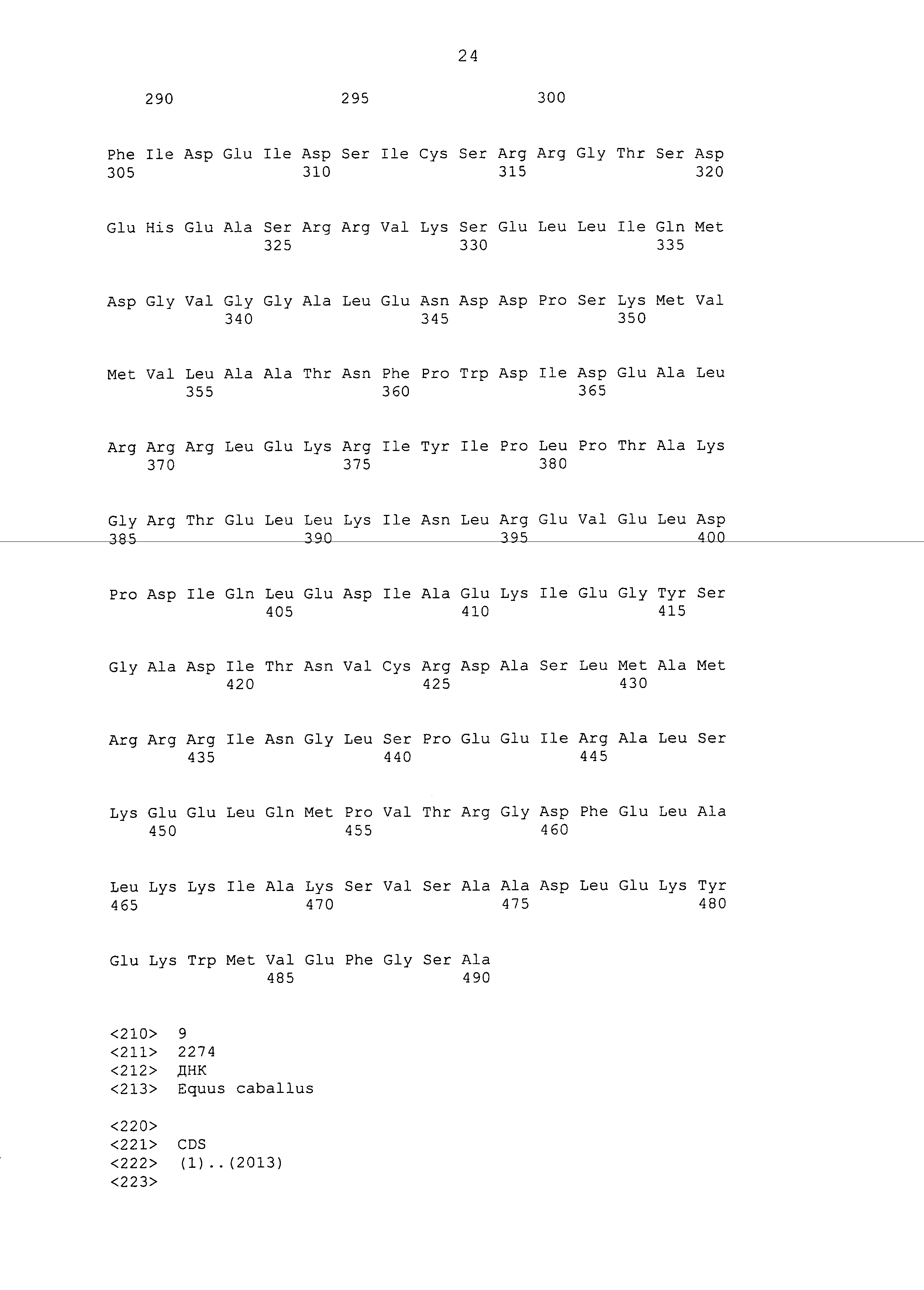Результат интеллектуальной деятельности: СРЕДСТВО, ИНДУЦИРУЮЩЕЕ ИММУНИТЕТ
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к средству, индуцирующему иммунитет, эффективному в качестве терапевтического и/или профилактического средства против злокачественного новообразования.
Уровень техники
Злокачественное новообразование является наиболее частой причиной смерти среди всех причин смерти, и современным методом его лечения, в основном, является хирургическое лечение, которое можно проводить в сочетании с лучевой терапией и/или химиотерапией. Несмотря на разработку в последнее время новых хирургических методов и открытие новых противораковых средств, до настоящего времени в лечении злокачественного новообразования, за исключением некоторых его форм, не было достигнуто больших успехов. В последние годы, благодаря достижениям в области молекулярной биологии и иммунологии злокачественных новообразований, были определены антигены злокачественных новообразований, распознаваемые цитотоксическими T-клетками, активными в отношении злокачественных клеток, а также гены, кодирующие антигены злокачественных новообразований, благодаря чему возросла надежда на антиген-специфическую иммунотерапию.
В иммунотерапии для уменьшения побочных эффектов пептид или белок, распознаваемый в качестве антигена, должен практически полностью отсутствовать в нормальных клетках и присутствовать только в злокачественных клетках. В 1991 г. Boon et al. Ludwig Institute in Belgium выделили антиген MAGE 1 меланомы человека, распознаваемый CD8-положительными T-клетками, методом экспрессионного клонирования кДНК с использованием аутологичной линии раковых клеток и активных в отношении злокачественного новообразования T-клеток (непатентный документ 1). Вслед за этим появилось сообщение о способе SEREX (серологической идентификации антигенов путем рекомбинантного экспрессионного клонирования), при котором опухолевые антигены, распознаваемые антителами, продуцируемыми в организме больного со злокачественным новообразованием в ответ на собственные злокачественные клетки пациента, идентифицируют с использованием способа экспрессионного клонирования генов (патентный документ 1, непатентный документ 2), и несколько антигенов злокачественных новообразований были выделены с помощью этого способа. Были начаты клинические испытания иммунотерапии злокачественного новообразования с использованием части антигенов злокачественных новообразований в качестве мишеней.
С другой стороны, как у человека, так у собак и у кошек также известен ряд опухолей, таких как опухоль молочной железы и плоскоклеточная карцинома, и статистика заболеваемости собак и кошек указывает на то, что они являются ведущей причиной смертности. Однако в настоящее время не существует какого-либо терапевтического, профилактического или диагностического средства, эффективного против злокачественных новообразований у собак и кошек. Поскольку большинство опухолей у собак и кошек обнаруживаются хозяевами только после того, как опухоли увеличиваются в размерах при прогрессировании заболевания, бывает слишком поздно обращаться за лечением, и даже в случае проведения хирургического удаления опухоли или введения предназначенного для лечения человека лекарственного средства (противоракового лекарственного средства или тому подобного), животные часто умирают вскоре после лечения. При таких обстоятельствах, если терапевтические и профилактические средства против злокачественных новообразований, эффективные для собак и кошек, будут доступны, ожидается, что будут разработаны способы их применения в случае злокачественного новообразования у собак.
Белок 1, подобный субъединице A катанина p60 (KATNAL1), был идентифицирован как белок, имеющий домен связывания микротрубочек (патентный документ 2, непатентный документ 3). Однако нет информации о том, что белок KATNAL1 обладает активностью индукции иммунитета против злокачественных клеток и, следовательно, что белок эффективен для лечения или профилактики злокачественных новообразований.
Документы предшествующего уровня техники
Патентные документы
[Патентный документ 1] US 5698396 B
[Патентный документ 2] JP 2004-8216 A
Непатентные документы
[Непатентный документ 1] Bruggen P. et al., Science, 254: 1643-1647 (1991).
[Непатентный документ 2] Proc. Natl. Acad. Sci. USA, 92: 11810-11813 (1995).
[Непатентный документ 3] Rigden D.J. et al., FEBS Lett., Mar 4; 583(5): 872-8 (2009).
Сущность изобретения
Проблемы, решаемые с помощью изобретения
Настоящее изобретение относится к обнаружению нового полипептида, эффективного для создания терапевтического и/или профилактического средства против злокачественного новообразования, и к получению полипептида для применения в средстве, индуцирующем иммунитет.
Способы решения проблем
Используя способ SEREX с использованием библиотеки кДНК, полученной из семенников собаки, и сыворотки, полученной у собаки с опухолью, авторы настоящего изобретения провели интенсивные исследования для получения кДНК, кодирующей белок, который связывается с антителами, присутствующими в сыворотке, полученной из организма с опухолью, и на основании кДНК получили полипептид белка 1, подобного субъединице A катанина p60 собаки (далее в настоящем документе называемого KATNAL1), имеющий аминокислотную последовательность SEQ ID NO:2. Кроме того, на основании генов человека и мыши, гомологичных полученному гену, были получены белки KATNAL1 человека и мыши, имеющие аминокислотные последовательности SEQ ID NO:4 и 6. Далее, авторы настоящего изобретения обнаружили, что эти полипептиды KATNAL1 специфически экспрессируются в тканях или клетках рака молочной железы, опухоли головного мозга, перианальной аденокарциномы, нейробластомы, мастоцитомы, рака печени, рака предстательной железы, рака легкого, рака щитовидной железы и лейкоза. Кроме того, авторы настоящего изобретения обнаружили, что введение KATNAL1 в организм способствует индукции иммуноцитов против KATNAL1 в организме и регрессии в организме опухоли, экспрессирующей KATNAL1. Далее, авторы настоящего изобретения обнаружили, что рекомбинантный вектор, способный экспрессировать полинуклеотид, кодирующий полипептид KATNAL1 или его фрагмент, вызывает противоопухолевый эффект в отношении клеток злокачественных новообразований, экспрессирующих KATNAL1, в организме.
Кроме того, авторы настоящего изобретения обнаружили, что полипептид KATNAL1 обладает способностью быть презентированным антиген-презентирующими клетками, вызывая активацию и рост цитотоксических T-клеток, специфичных для пептида (активность индукции иммунитета), и, следовательно, что полипептид является эффективным для лечения и/или профилактики злокачественных новообразований. Далее, авторы настоящего изобретения обнаружили, что антиген-презентирующие клетки, которые приводят в контакт с полипептидом, и T-клетки, которые приводят в контакт с антиген-презентирующими клетками, являются эффективными для лечения и/или профилактики злокачественных новообразований и, таким образом, осуществили настоящее изобретение.
Таким образом, настоящее изобретение имеет следующие отличительные признаки.
(1) Средство, индуцирующее иммунитет, содержащее в качестве активного(ых) ингредиента(ов) по меньшей мере один полипептид, обладающий активностью индукции иммунитета, выбранный из полипептидов (a)-(c) ниже, и/или рекомбинантный(е) вектор(ы), содержащий(е) полинуклеотид(ы), кодирующий(е) по меньшей мере один полипептид, где рекомбинантный(е) вектор(ы) способен(ны) экспрессировать полипептид(ы) in vivo:
(a) полипептида, состоящего не менее чем из 7 последовательных аминокислот в любой из аминокислотных последовательностей SEQ ID NO:4, 2, 8, 10 и 12 из списка последовательностей;
(b) полипептида, последовательность которого не менее чем на 85% идентична полипептиду, указанному в (a), и состоящего не менее чем из 7 аминокислот; и
(c) полипептида, содержащего полипептид (a) или (b) в качестве части своей последовательности.
(2) Средство, индуцирующее иммунитет, по п. (1), отличающееся тем, что полипептид, обладающий активностью индукции иммунитета, представляет собой полипептид, имеющий аминокислотную последовательность SEQ ID NO:4, 2, 8, 10 или 12 из списка последовательностей.
(3) Средство, индуцирующее иммунитет, по п. (1) или (2), представляющее собой средство для обработки антиген-презентирующих клеток.
(4) Средство, индуцирующее иммунитет, по п. (1) или (2), представляющее собой терапевтическое и/или профилактическое средство против злокачественного(ых) новообразования(ий).
(5) Средство, индуцирующее иммунитет, по п. (4), отличающееся тем, что злокачественное(ые) новообразование(ия) является(ются) злокачественным(ими) новообразованием(ями), экспрессирующим(и) KATNAL1.
(6) Средство, индуцирующее иммунитет, по п. (4) или (5), отличающееся тем, что злокачественное(ые) новообразование(ия) представляет(ют) собой рак молочной железы, опухоль головного мозга, перианальную аденокарциному, нейробластому, мастоцитому, рак печени, рак предстательной железы, рак легкого, рак щитовидной железы и/или лейкоз.
(7) Средство, индуцирующее иммунитет, по любому из пунктов (1)-(6), дополнительно содержащее иммуностимулятор.
(8) Средство, индуцирующее иммунитет, по п. (7), отличающееся тем, что иммуностимулятор представляет собой по меньшей мере один из иммуностимуляторов, выбранных из группы, состоящей из неполного адъюванта Фрейнда; монтанида; поли-I:C, а также их производных; олигонуклеотидов CpG; интерлейкина-12; интерлейкина-18; интерферона-α; интерферона-β; интерферона-ω; интерферона-γ; а также лиганда Flt3.
Эффект изобретения
Настоящее изобретение относится к новому средству, индуцирующему иммунитет, эффективному для лечения, профилактики, и/или тому подобному, злокачественного новообразования. Как конкретно описано в нижеприведенных примерах, введение полипептида по настоящему изобретению в организм способствует индукции иммуноцитов в организме, и уже имеющаяся в организме злокачественная опухоль может уменьшиться в размерах или регрессировать. Таким образом, полипептид является эффективным для лечения и/или профилактики злокачественного новообразования.
Краткое описание чертежей
На фигуре 1 представлен профиль экспрессии идентифицированного гена KATNAL1 в нормальных тканях, опухолевых тканях и линиях раковых клеток собаки. Номером 1 обозначен профиль экспрессии гена KATNAL1 собаки в различных тканях и клеточных линиях собаки; номером 2 обозначен профиль экспрессии гена GAPDH собаки в различных тканях и клеточных линиях собаки.
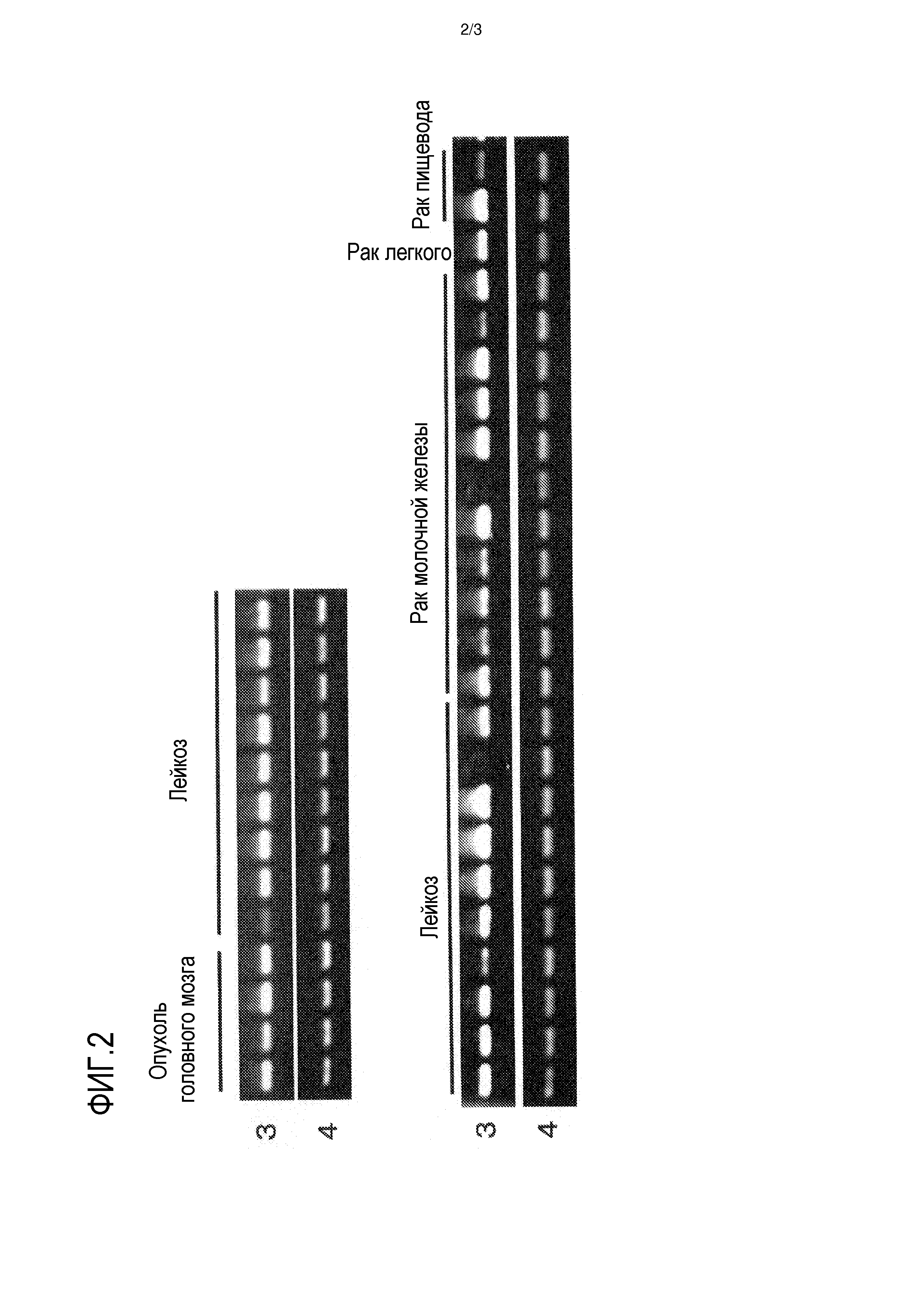
На фигуре 2 представлен профиль экспрессии идентифицированного гена KATNAL1 в нормальных тканях, опухолевых тканях и линиях раковых клеток человека. Номером 3 обозначен профиль экспрессии гена KATNAL1 человека в различных тканях и клеточных линиях человека; номером 4 обозначен профиль экспрессии гена GAPDH человека в различных тканях и клеточных линиях человека.
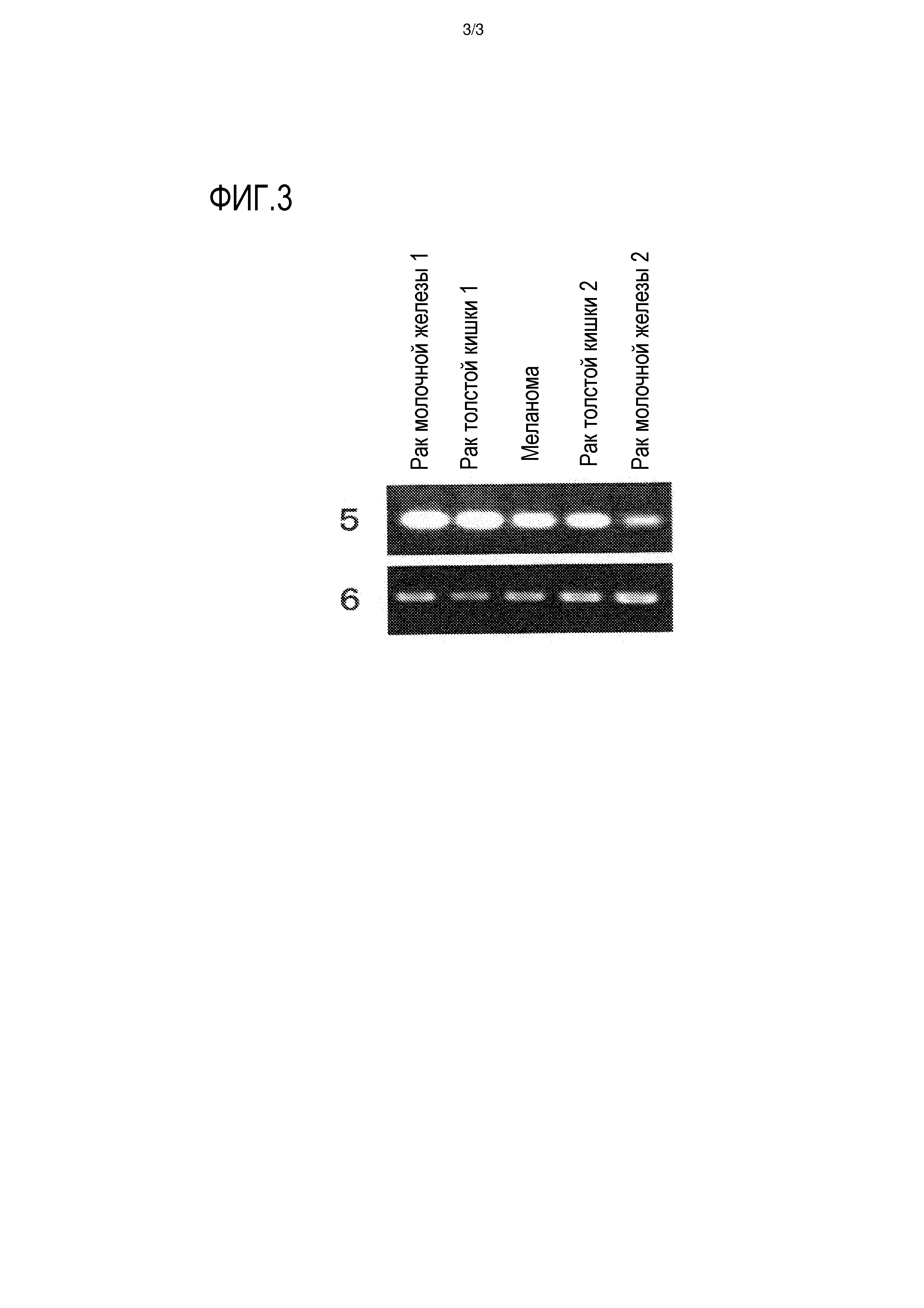
На фигуре 3 представлен профиль экспрессии идентифицированного гена KATNAL1 в нормальных тканях, опухолевых тканях и линиях раковых клеток мыши. Номером 5 обозначен профиль экспрессии гена KATNAL1 мыши в различных тканях и клеточных линиях мыши; номером 6 обозначен профиль экспрессии гена GAPDH мыши в различных тканях и клеточных линиях мыши.
Лучший вариант осуществления изобретения
Примеры полипептида, содержащегося в средстве, индуцирующем иммунитет, по настоящему изобретению в качестве активного ингредиента, включают следующие. В настоящем изобретении термин «полипептид» означает молекулу, образованную множеством аминокислот, соединенных пептидными связями, и включает не только полипептидные молекулы с большим количеством составляющих их аминокислот, но и низкомолекулярные молекулы с небольшим числом аминокислот (олигопептиды), а также полноразмерные белки. Настоящее изобретение также охватывает полноразмерные белки KATNAL1, имеющие аминокислотную последовательность SEQ ID NO: 2, 4, 8, 10 или 12.
(a) Полипептид, состоящий не менее чем из 7 последовательных аминокислот в полипептиде с аминокислотной последовательностью SEQ ID NO: 4, 2, 8, 10 или 12 из списка последовательностей и обладающий активностью индукции иммунитета.
(b) Полипептид, состоящий не менее чем из 7 аминокислот, последовательность которого не менее чем на 85% идентична полипептиду (a), и обладающий активностью индукции иммунитета.
(c) Полипептид, содержащий полипептид (a) или (b) в качестве части своей последовательности и обладающий активностью индукции иммунитета.
В настоящем изобретении термин «имеющий аминокислотную последовательность» означает, что аминокислотные остатки расположены в указанном порядке. Таким образом, например, «полипептид, имеющий аминокислотную последовательность SEQ ID NO:2» означает полипептид, имеющий аминокислотную последовательность Met Asn Leu Ala … (разрыв) … Glu Phe Gly Ser Ala, приведенную в SEQ ID NO: 2, при этом полипептид имеет длину 490 аминокислотных остатков. Кроме того, например, «полипептид, имеющий аминокислотную последовательность SEQ ID NO:2» можно для краткости называть «полипептид SEQ ID NO:2». Это также относится к термину «имеющий последовательность оснований». В этом случае термин «имеющий» можно заменить выражением «состоящий из».
Используемый в настоящем документе термин «активность индукции иммунитета» означает способность к индукции иммуноцитов, которые секретируют цитокины, такие как интерферон, в организме.
Обладает ли полипептид активностью индукции иммунитета, можно определять, например, с помощью известного анализа ELISPOT. Более конкретно, например, как описано ниже в примерах, клетки, такие как мононуклеарные клетки периферической крови, получают из организма после введения в него полипептида, активность индукции иммунитета которого нужно оценить, и полученные клетки затем культивируют совместно с полипептидом, после чего измеряют количество(а) цитокина(ов), продуцируемого(мых) клетками, используя специфическое антитело/антитела, что позволяет измерять число иммуноцитов среди клеток. С помощью этого можно оценивать активность индукции иммунитета.
Альтернативно, как описано в нижеприведенных примерах, введение рекомбинантного полипептида по любому из пунктов (a)-(c), описанного выше, животному с опухолью приводит к регрессии опухоли вследствие его активности индукции иммунитета. Таким образом, вышеуказанную активность индукции иммунитета (далее в настоящем документе называемую «противоопухолевой активностью») можно также оценивать как способность подавлять рост клеток злокачественного новообразования или вызывать уменьшение в размерах или исчезновение раковой ткани (опухоли). Противоопухолевую активность полипептида можно подтверждать, например, как более конкретно описано в приведенных ниже примерах, наблюдением за тем, уменьшается ли в размерах опухоль, когда полипептид вводят в организм с имеющейся опухолью.
Альтернативно, противоопухолевую активность полипептида можно также оценивать по тому, демонстрируют ли T-клетки, стимулированные полипептидом (то есть, T-клетки, приведенные в контакт с антиген-презентирующими клетками, представляющими полипептид), цитотоксическую активность в отношении опухолевых клеток in vitro. Контакт между T-клетками и антиген-презентирующими клетками можно создавать путем их совместного культивирования в жидкой среде, как указано ниже. Измерение цитотоксической активности можно проводить, например, известным способом, называемым анализом с высвобождением 51Cr, который описан в журнале Int. J. Cancer, 58: стр. 317, 1994. В случаях, когда полипептид будут использовать для лечения и/или профилактики злокачественного новообразования, оценку активности индукции иммунитета, предпочтительно, проводят, используя в качестве показателя противоопухолевую активность, хотя показатели этим не ограничиваются.
Каждая из аминокислотных последовательностей SEQ ID NO:2, 4, 8, 10 и 12 из списка последовательностей, раскрытых в настоящем изобретении, представляет собой аминокислотную последовательность белка KATNAL1, который был выделен способом SEREX с использованием библиотеки кДНК, полученной из семенников собаки, и сыворотки, полученной у собаки с опухолью, как полипептид, который специфически связывается с антителом, присутствующим в сыворотке собаки с опухолью, или гомолог полипептида у человека, коровы, лошади или курицы (см. пример 1). KATNAL1 человека, который является человеческим гомологом KATNAL1 собаки, который идентичен последовательности на 95% с точки зрения последовательности оснований и на 98% с точки зрения аминокислотной последовательности; KATNAL1 быка, который является гомологом быка, который идентичен последовательности на 91% с точки зрения последовательности оснований и на 97% с точки зрения аминокислотной последовательности; KATNAL1 лошади, который является гомологом лошади, который идентичен последовательности на 87% с точки зрения последовательности оснований и на 88% с точки зрения аминокислотной последовательности; и KATNAL1 курицы, который является гомологом курицы, имеет идентичность последовательности 81% с точки зрения последовательности оснований и 90% с точки зрения аминокислотной последовательности.
Полипептид (a) представляет собой полипептид, состоящий не менее чем из 7 последовательных, предпочтительно, 8, 9 или не менее чем 10 последовательных аминокислот в полипептиде, имеющем аминокислотную последовательность SEQ ID NO: 2, 4, 8, 10 или 12, и обладающий активностью индукции иммунитета. Более предпочтительно, полипептид представляет собой полипептид, состоящий из аминокислотной последовательности, которая идентична последовательности не менее чем на 85% аминокислотной последовательности SEQ ID NO:4, и особенно предпочтительно, полипептид имеет аминокислотную последовательность SEQ ID NO:2, 4, 8, 10 или 12. Как известно в данной области, полипептид, содержащий не менее чем 7 аминокислотных остатков, может проявлять свою антигенность и иммуногенность. Таким образом, полипептид, имеющий не менее чем 7 последовательных аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 2 или 4, может обладать активностью индукции иммунитета и, следовательно, полипептид можно использовать для получения средства, индуцирующего иммунитет, по настоящему изобретению.
В принципе, известно, что, когда вызывают иммунитет путем введения полипептидного антигена злокачественного новообразования, обычно происходит следующий процесс: полипептид попадает в антиген-презентирующую клетку, а затем под действием пептидаз в клетке распадается на более мелкие фрагменты, после чего презентируется на поверхности клетки. Затем фрагменты распознаются цитотоксической T-клеткой или тому подобными, которые избирательно убивают клетки, презентирующие антиген. Размер полипептида, презентированного на поверхности антиген-презентирующей клетки, относительно невелик и составляет примерно 7-30 аминокислот. Вследствие этого, с точки зрения презентации полипептида на поверхности антиген-презентирующей клетки, одним из предпочтительных вариантов вышеописанного полипептида (a) является полипептид, состоящий из примерно 7-30 последовательных аминокислот в аминокислотной последовательности SEQ ID NO:2, 4, 8, 10 или 12, и более предпочтительно, полипептид, состоящий примерно из 8-30 или примерно из 9-30 является достаточным в качестве полипептида (a). В некоторых случаях эти относительно небольшие полипептиды представлены непосредственно на поверхности антиген-презентирующих клеток, не будучи включенными в антиген-презентирующие клетки.
Кроме того, полипептид, включенный в антиген-презентирующую клетку, расщепляется в случайных сайтах клеточными пептидазами с образованием различных полипептидных фрагментов, которые затем презентируются на поверхности антиген-презентирующей клетки. Вследствие этого, введение большого полипептида, такого как полноразмерная область SEQ ID NO:2, 4, 8, 10 или 12, неизбежно вызывает образование полипептидных фрагментов в результате деградации в антиген-презентирующей клетке, и эти фрагменты являются эффективными для вызывания иммунитета при помощи антиген-презентирующей клетки. Вследствие этого, также для вызывания иммунитета при помощи антиген-презентирующих клеток можно, предпочтительно, использовать большой полипептид, и полипептид может состоять не менее чем из 30, предпочтительно, не менее чем из 100, более предпочтительно, не менее чем из 200, еще более предпочтительно, не менее чем из 250 аминокислот. Еще более предпочтительно, полипептид может состоять из полноразмерной области SEQ ID NO:2, 4, 8, 10 или 12.
Полипептид (b) представляет собой тот же полипептид, что и полипептид (a), за исключением того, что небольшое число (предпочтительно, один или несколько) аминокислотных остатков заменены, делетированы и/или вставлены, который идентичен последовательности не менее чем на 90%, предпочтительно, не менее чем на 95%, более предпочтительно, не менее чем на 98%, еще более предпочтительно, не менее чем на 99% или не менее чем на 99,5% исходной последовательности и обладает активностью индукции иммунитета. В данной области хорошо известно, что часто бывают случаи, когда белковый антиген сохраняет почти такую же антигенность, что и исходный белок, даже если аминокислотная последовательность белка модифицирована таким образом, что небольшое число аминокислотных остатков заменены, делетированы и/или вставлены. Вследствие этого, поскольку полипептид (b) может также проявлять активность индукции иммунитета, его можно использовать для получения средства, индуцирующего иммунитет, по настоящему изобретению. Кроме того, полипептид (b) также, предпочтительно, представляет собой полипептид, имеющий такую же аминокислотную последовательность, что и аминокислотная последовательность SEQ ID NO:2, 4, 8, 10 или 12, за исключением того, что один или несколько аминокислотных остатков заменены, делетированы и/или вставлены. Используемый в настоящем документе термин «несколько» означает целое число от 2 до 10, предпочтительно, целое число от 2 до 6, более предпочтительно, целое число от 2 до 4.
Используемый в настоящем документе термин «идентичность последовательности» аминокислотных последовательностей или последовательностей оснований означает величину, рассчитанную путем сравнения двух аминокислотных последовательностей (или последовательностей оснований), которые предстоит сравнивать, таким образом, чтобы число совпадающих аминокислотных остатков (или оснований) было максимальным между аминокислотными последовательностями (или последовательностями оснований), и деления числа совпадающих аминокислотных остатков (или числа совпадающих оснований) на общее число аминокислотных остатков (или общее число оснований), данную величину представляют в процентном выражении. При сравнении один или более разрывов вносят в одну или обе последовательности, которые сравнивают, если это необходимо. Такое сравнение последовательностей можно проводить с использованием хорошо известной программы, такой как BLAST, FASTA или CLUSTAL W. Если вносят один или более разрывов, вышеописанное общее число аминокислотных остатков представляет собой число остатков, рассчитанное, если принимать один разрыв за один аминокислотный остаток. Если рассчитанное таким образом общее число аминокислотных остатков различается между двумя сравниваемыми последовательностями, идентичность последовательностей (%) рассчитывают путем деления числа совпадающих аминокислотных остатков на общее число аминокислотных остатков в более длинной последовательности.
Двадцать видов аминокислот, составляющих природные белки, можно разделить на группы, каждая из которых образована по принципу общности свойств, например, нейтральные аминокислоты с боковыми цепями, имеющими низкую полярность (Gly, Ile, Val, Leu, Ala, Met, Pro), нейтральные аминокислоты с гидрофобными боковыми цепями (Asn, Gln, Thr, Ser, Tyr, Cys), кислые аминокислоты (Asp, Glu), основные аминокислоты (Arg, Lys, His) и ароматические аминокислоты (Phe, Tyr, Trp). Известно, что во многих случаях замена аминокислоты на другую аминокислоту из той же группы не меняет свойства полипептида. Вследствие этого, в случаях, когда аминокислотный остаток в полипептиде (а) по настоящему изобретению заменен, вероятность того, что активность индукции иммунитета будет сохранена, можно увеличить, если проводить замену внутри одной группы, что является предпочтительным.
Полипептид (с) представляет собой полипептид, который содержит полипептид (a) или (b) в качестве части своей последовательности и обладает активностью индукции иммунитета. То есть, полипептид (c) представляет собой полипептид, в котором одна или более аминокислот и/или один или более полипептидов добавлены на одном или обоих концах полипептида (a) или (b), и который обладает активностью индукции иммунитета. Такой полипептид также можно использовать для получения средства, индуцирующего иммунитет, по настоящему изобретению.
Вышеописанные полипептиды можно синтезировать, например, способом химического синтеза, таким как Fmoc-способ (способ с использованием флуоренилметилоксикарбонила) или tBoc-способ (способ с использованием трет-бутилоксикарбонила). Кроме того, их можно синтезировать общепринятыми способами, используя коммерчески доступные пептидные синтезаторы различных типов. Кроме того, интересующий полипептид можно получать с использованием известных способов генной инженерии, получая полинуклеотид, кодирующий полипептид, и встраивая этот полинуклеотид в вектор экспрессии, с последующим введением полученного вектора в клетку-хозяина и созданием условий для продукции клеткой-хозяином этого полипептида.
Полинуклеотид, кодирующий вышеуказанный полипептид, может быть легко получен известными способами генной инженерии или общепринятым способом с использованием коммерчески доступного синтезатора нуклеиновых кислот. Например, ДНК, имеющую последовательность оснований SEQ ID NO:1, можно получать способом ПЦР с использованием хромосомной ДНК или библиотеки кДНК собаки в качестве матрицы, и пары праймеров, сконструированных таким образом, что с их помощью можно амплифицировать последовательность оснований SEQ ID NO:1. ДНК, имеющую последовательность оснований SEQ ID NO:3, можно аналогичным образом получать с использованием хромосомной ДНК или библиотеки кДНК человека в качестве матрицы. Можно соответствующим образом устанавливать условия для ПЦР, и примеры условий реакции включают, но ими не ограничиваются, повторение процесса реакции при 94°C в течение 30 секунд (денатурация), при 55°C в течение периода времени от 30 секунд до 1 минуты (отжиг) и при 72°C в течение 2 минут (удлинение) на протяжении, например, 30 циклов, с последующей реакцией при 72°C в течение 7 минут. Кроме того, нужную ДНК можно выделять, создавая соответствующий зонд или праймер на основе информации о последовательности оснований или аминокислотной последовательности SEQ ID NO:1 или 3 из списка последовательностей в настоящем описании, и проводя скрининг библиотеки кДНК собаки, человека, и тому подобных, с использованием зонда или праймера. Библиотеку кДНК, предпочтительно, получают из клеток, органов или тканей, экспрессирующих белок SEQ ID NO:2 или 4. Вышеописанные операции, такие как создание зонда или праймера, конструирование библиотеки кДНК, скрининг библиотеки кДНК и клонирование интересующего гена, известны специалистам в данной области, и могут быть выполнены способами, описанными в Molecular Cloning, второе издание; Current Protocols in Molecular Biology, и/или тому подобных. Из полученной таким образом ДНК можно получать ДНК, кодирующую полипептид (a). Кроме того, поскольку кодоны, кодирующие каждую аминокислоту, известны, последовательность оснований полинуклеотида, кодирующего конкретную аминокислотную последовательность, можно легко определять. Вследствие этого, поскольку последовательность оснований полинуклеотида, кодирующего полипептид (b) или полипептид (c), также можно легко определять, такой полинуклеотид также можно легко синтезировать общепринятым способом с использованием коммерчески доступного синтезатора нуклеиновых кислот.
Клетки-хозяева не имеют ограничений при условии, что клетки способны экспрессировать описанный выше полипептид, и примеры клеток включают, но ими не ограничиваются, прокариотические клетки, такие как E. coli, и эукариотические клетки, такие как культивируемые клетки млекопитающих, включая клетки почки обезьяны COS1 и клетки яичника китайского хомячка CHO; почкующиеся дрожжи; делящиеся дрожжи; клетки шелкопряда и яйцеклетки Xenopus laevis.
В случаях, когда прокариотические клетки используют в качестве клеток-хозяев, используют вектор экспрессии, содержащий точку начала репликации, делающую возможной репликацию вектора в прокариотической клетке, промотор, сайт связывания рибосомы, сайт клонирования ДНК, терминатор и/или тому подобное. Примеры вектора экспрессии для E. coli включают систему pUC, pBluescriptII, экспрессионную систему pET и экспрессионную систему pGEX. Путем встраивания ДНК, кодирующей вышеуказанный полипептид, в такой вектор экспрессии и трансформирования прокариотических клеток-хозяев таким вектором, с последующим культивированием полученных трансформантов, можно добиться экспрессии полипептида, кодируемого ДНК, в прокариотических клетках-хозяевах. В таком случае полипептид также может быть экспрессирован в виде слитого белка с другим белком.
В случаях, когда эукариотические клетки используют в качестве клеток-хозяев, в качестве вектора экспрессии используют вектор экспрессии для эукариотических клеток, содержащий промотор, сайт сплайсинга, сайт добавления поли(A) и/или тому подобное. Примеры такого вектора экспрессии включают pKA1, pCDM8, pSVK3, pMSG, pSVL, pBK-CMV, pBK-RSV, EBV вектор, pRS, pcDNA3, pMSG и pYES2. Как и в предыдущем случае, путем встраивания ДНК, кодирующей вышеуказанный полипептид, в такой вектор экспрессии и трансформирования эукариотических клеток-хозяев таким вектором с последующим культивированием полученных трансформантов можно добиться экспрессии полипептида, кодируемого ДНК, в эукариотических клетках-хозяевах. В случаях, когда pIND/V5-His, pFLAG-CMV-2, pEGFP-N1, pEGFP-C1 или тому подобные используют в качестве вектора экспрессии, вышеуказанный полипептид может быть экспрессирован в виде слитого белка, содержащего маркер, такой как His-таг, FLAG маркер, myc маркер, HA маркер или GFP.
Для введения вектора экспрессии в клетки-хозяева можно использовать хорошо известные способы, такие как электропорация, кальций-фосфатный способ, липосомный способ или способ с ДЭАЭ-декстраном.
Выделение и очистку интересующего полипептида из клеток-хозяев можно проводить при помощи сочетания известных способов разделения. Примеры известных способов разделения включают, но ими не ограничиваются, обработку денатурирующим средством, таким как мочевина, или сурфактантом; обработку ультразвуком; расщепление ферментами; высаливание или дробное осаждение растворителем; диализ; центрифугирование; ультрафильтрацию; гель-фильтрацию; SDS-ПААГ; изоэлектрическое фокусирование; ионообменную хроматографию; гидрофобную хроматографию; аффинную хроматографию и обращенно-фазовую хроматографию.
Полипептиды, полученные вышеуказанными способами, также включают, как упоминалось выше, полипептиды в форме слитого белка с другим произвольным белком. Примеры таких полипептидов включают слитые белки с глутатион-S-трансферазой (GST) и слитые белки с His-тагом. Такой полипептид в виде слитого белка также включен в объем настоящего изобретения, как описанный выше полипептид (c). Кроме того, в некоторых случаях, полипептид, экспрессируемый в трансформированной клетке, модифицируется различными способами в клетке после трансляции. Такой посттрансляционно модифицированный полипептид также включен в объем настоящего изобретения при условии, что он обладает активностью индукции иммунитета. Примеры такой посттрансляционной модификации включают: удаление N-концевого остатка метионина; N-концевое ацетилирование; гликозилирование; ограниченное расщепление внутриклеточными протеазами; миристоилирование; изопренилирование и фосфорилирование.
Как описано более конкретно в нижеприведенных примерах, введение полипептида, обладающего активностью индукции иммунитета, в организм с опухолью делает возможной регрессию уже существующей опухоли. Вследствие этого, средство, индуцирующее иммунитет, по настоящему изобретению может быть использовано в качестве терапевтического и/или профилактического средства против злокачественного новообразования. Кроме того, полипептид, обладающий активностью индукции иммунитета, можно использовать в способе лечения и/или профилактики злокачественных новообразований путем индукции иммунитета.
Используемые в настоящем документе термины «опухоль» и «злокачественное новообразование» означают злокачественное новообразование и используются как взаимозаменяемые.
В данном случае формы злокачественного новообразования, которое предстоит лечить, не имеют ограничений, при условии, что ген, кодирующий полипептид SEQ ID NO:KATNAL1, экспрессируется при данной форме злокачественного новообразования, и злокачественное новообразование, предпочтительно, представляет собой рак молочной железы, опухоль головного мозга, перианальную аденокарциному, нейробластому, мастоцитому, рак печени, рак предстательной железы, рак легкого, рак щитовидной железы или лейкоз.
Животным, предпочтительно, является млекопитающее, более предпочтительно, такое млекопитающее, как примат, домашнее животное, сельскохозяйственное животное или спортивное животное, особенно предпочтительными, являются человек, собака или кошка.
Способ введения средства, индуцирующего иммунитет, по настоящему изобретению в организм может представлять собой либо пероральное введение, либо парентеральное введение, и, предпочтительно, представляет собой парентеральное введение, такое как внутримышечное введение, подкожное введение, внутривенное введение или внутриартериальное введение. В случаях, когда средство, индуцирующее иммунитет, используют для лечения злокачественных новообразований, его можно вводить в региональный лимфатический узел в непосредственной близости от опухоли, которую предстоит лечить, как описано в приведенных ниже примерах, в целях повышения его противораковой активности. Доза может быть любой дозой при условии, что эта доза эффективна для индукции иммунитета, и, например, в случаях, когда средство используют для лечения и/или профилактики злокачественных новообразований, доза может быть дозой, эффективной для лечения и/или профилактики злокачественного новообразования. Дозу, эффективную для лечения и/или профилактики злокачественного новообразования, соответствующим образом выбирают в зависимости от размера, симптомов, и тому подобного, опухоли, и эффективная доза, как правило, составляет от 0,0001 мкг до 1000 мкг, предпочтительно, от 0,001 мкг до 1000 мкг на животное в сутки. Средство можно вводить один раз или несколько раз по частям. Средство, предпочтительно, вводят несколько раз по частям, раз в несколько дней или несколько месяцев. Как конкретно показано в приведенных ниже примерах, средство, индуцирующее иммунитет, по настоящему изобретению способно вызывать регрессию уже существующей опухоли. Вследствие этого, поскольку средство может проявлять свою противораковую активность также против небольшого количества клеток злокачественных новообразований на ранней стадии, развитие или рецидив злокачественного новообразования можно предотвращать, применяя средство до развития злокачественного новообразования или после лечения злокачественного новообразования. То есть, средство, индуцирующее иммунитет, по настоящему изобретению эффективно как для лечения, так и для профилактики злокачественных новообразований.
Средство, индуцирующее иммунитет, по настоящему изобретению может содержать только полипептид или может быть получено путем смешивания, по мере необходимости, с добавкой, такой как фармацевтически приемлемый носитель, разбавитель или наполнитель, для каждого способа введения. Способы получения и добавки, которые можно использовать, хорошо известны в области разработки лекарственных препаратов, и можно использовать любые из способов и добавок. Конкретные примеры добавок включают, но ими не ограничиваются, такие разбавители, как физиологические буферные растворы; такие наполнители, как сахар, лактоза, кукурузный крахмал, фосфат кальция, сорбит и глицин; такие связующие вещества, как сироп, желатин, гуммиарабик, сорбит, поливинилхлорид и трагакант; и такие смазывающие вещества, как стеарат магния, полиэтиленгликоль, тальк и диоксид кремния. Примеры препаратов включают пероральные препараты, такие как таблетки, капсулы, гранулы, порошки и сиропы; и парентеральные препараты, такие как вдыхаемые препараты, инъекционные растворы, суппозитории и растворы. Эти препараты можно получать общеизвестными способами получения.
Средство, индуцирующее иммунитет, по настоящему изобретению можно использовать в сочетании с иммуностимулятором, способным усиливать иммунный ответ в организме. Иммуностимулятор может содержаться в средстве, индуцирующем иммунитет, по настоящему изобретению или вводиться пациенту как отдельная композиция в сочетании со средством, индуцирующем иммунитет, по настоящему изобретению.
Примеры иммуностимулятора включают адъюванты. Адъюванты могут усиливать иммунный ответ, создавая депо антигена (внеклеточное или внутри макрофагов), активируя макрофаги и стимулируя определенные группы лимфоцитов, тем самым усиливая иммунный ответ и, следовательно, противораковое действие. Вследствие этого, особенно в случаях, когда средство, индуцирующее иммунитет, по настоящему изобретению используют для лечения и/или профилактики злокачественных новообразований, средство, индуцирующее иммунитет, предпочтительно, содержит адъювант, в дополнение к описанному выше полипептиду в качестве активного ингредиента. В данной области хорошо известны многие типы адъювантов, и любой из этих адъювантов можно использовать. Конкретные примеры адъювантов включают MPL (SmithKline Beecham), гомологи липополисахарида из Salmonella minnesota Re 595, полученные после очистки и кислотного гидролиза липополисахарида; QS21 (SmithKline Beecham), чистый сапонин QA-21, очищенный из экстракта Quillja saponaria; DQS21, описанный в PCT заявке WO 96/33739 (SmithKline Beecham); QS-7, QS-17, QS-18 и QS-L1 (So и 10 соавторов, «Molecules and cells», 1997, Vol. 7, p. 178-186); неполный адъювант Фрейнда; полный адъювант Фрейнда; витамин Е; монтанид; квасцы; олигонуклеотиды CpG (см., например, Kreig и 7 соавторов, Nature, Vol. 374, p. 546-549); поли-I:C и их производные (например, поли ICLC); а также различные эмульсии типа «вода-в-масле», полученные из биоразлагаемых масел, таких как сквален и/или токоферол. Среди них предпочтительными являются неполный адъювант Фрейнда; монтанид; поли-I:C и их производные; а также олигонуклеотиды CpG. Соотношение в смеси между вышеописанным адъювантом и полипептидом, как правило, составляет примерно от 1:10 до 10:1, предпочтительно, примерно от 1:5 до 5:1, более предпочтительно, примерно 1:1. Однако адъювант не ограничивается описанными выше примерами, и при введении средства, индуцирующего иммунитет, по настоящему изобретению можно также использовать известные в данной области адъюванты, помимо тех, которые описаны выше, (см., например, Goding, «Monoclonal Antibodies: Principles and Practice, 2е издание», 1986). Способы получения смесей или эмульсий полипептида и адъюванта хорошо известны специалистам в области вакцинации.
Кроме того, в дополнение к вышеописанным адъювантам, в качестве описанных выше иммуностимуляторов можно использовать факторы, стимулирующие иммунный ответ индивида. Например, различные цитокины, имеющие свойство стимулировать лимфоциты и/или антиген-презентирующие клетки, можно использовать в качестве иммуностимуляторов в сочетании со средством, индуцирующим иммунитет, по настоящему изобретению. Многие такие цитокины, способные усиливать иммунный ответ, известны специалистам в данной области, и примеры цитокинов включают, но ими не ограничиваются, интерлейкин-12 (IL-12), GM-CSF, IL-18, интерферон-α, интерферон-β, интерферон-ω, интерферон-γ, а также лиганд Flt3, которые, как показано, усиливают профилактическое действие вакцин. Такие факторы также могут быть использованы в качестве вышеописанного иммуностимулятора, и могут содержаться в средстве, индуцирующим иммунитет, по настоящему изобретению, либо могут быть изготовлены в виде отдельной композиции для введения пациенту в сочетании со средством, индуцирующим иммунитет, по настоящему изобретению.
Путем создания контакта между вышеуказанным полипептидом и антиген-презентирующими клетками in vitro можно добиться того, что антиген-презентирующие клетки будут представлять полипептид. То есть, полипептиды (a)-(c), описанные выше, можно использовать в качестве средств для обработки антиген-презентирующих клеток. Примеры антиген-презентирующих клеток, которые, предпочтительно, можно использовать, включают дендритные клетки и В-клетки, имеющие молекулы MHC класса I. Различные молекулы MHC класса I идентифицированы и хорошо известны. Молекулы MHC у человека называются HLA. Примеры молекул HLA класса I включают HLA-A, HLA-B и HLA-C, более конкретно, HLA-A1, HLA-A0201, HLA-A0204, HLA-A0205, HLA-A0206, HLA-A0207, HLA-A11, HLA-A24, HLA-A31, HLA-A6801, HLA-B7, HLA-B8, HLA-B2705, HLA-B37, HLA-Cw0401 и HLA-Cw0602.
Дендритные клетки или В-клетки, имеющие молекулы МНС класса I, можно получать из периферической крови хорошо известным способом. Например, специфичные для опухоли дендритные клетки можно индуцировать путем индукции дендритных клеток из костного мозга, пуповинной крови или периферической крови пациента при помощи гранулоцитарно-макрофагального колоние-стимулирующего фактора (GM-CSF) и IL-3 (или IL-4), с последующим добавлением относящегося к опухоли пептида в систему культивирования.
Путем введения эффективного количества таких дендритных клеток можно вызывать ответ, желательный для лечения злокачественного новообразования. В качестве клеток можно использовать костный мозг или пуповинную кровь, добровольно предоставленные здоровым индивидуумом, или костный мозг, периферическую кровь и тому подобное от пациента. При использовании аутологичных клеток пациента можно добиться высокой безопасности и, предположительно, избежать серьезных побочных эффектов. Периферическая кровь или костный мозг может представлять собой любое из свежего образца, охлажденного образца и криоконсервированного образца. Что касается периферической крови, можно культивировать цельную кровь или отдельно лейкоцитарные компоненты можно выделять и культивировать, при этом последний вариант является более эффективным и, следовательно, предпочтительным. Кроме того, в числе лейкоцитарных компонентов можно выделять мононуклеарные клетки. В случаях, когда клетки происходят из костного мозга или пуповинной крови, можно культивировать все клетки, составляющие костный мозг, или из него можно выделять мононуклеарные клетки и культивировать. Периферическая кровь, ее лейкоцитарные компоненты и клетки костного мозга содержат мононуклеарные клетки, гемопоэтические стволовые клетки и незрелые дендритные клетки, из которых происходят дендритные клетки, и, кроме того, CD4-положительные клетки и тому подобное. Способ получения цитокинов не имеет ограничений, и можно использовать природные или рекомбинантные цитокины, или тому подобное, при условии, что была подтверждена их безопасность и физиологическая активность. Предпочтительно, используют препараты с гарантированным качеством для медицинского применения в минимально необходимом количестве. Концентрация цитокина(ов) для добавления не имеет ограничений при условии, что при данной концентрации индуцируются дендритные клетки, и, как правило, общая концентрация цитокина(ов), предпочтительно, составляет от 10 до 1000 нг/мл, более предпочтительно, примерно от 20 до 500 нг/мл. Культивирование можно проводить с использованием хорошо известной среды, обычно используемой для культивирования лейкоцитов. Температура культивирования не имеет ограничений при условии, что при данной температуре возможна пролиферация лейкоцитов, и наиболее предпочтительной является температура примерно 37°C, которая соответствует температуре тела человека. Атмосферная среда в процессе культивирования не имеет ограничений при условии, что в данной атмосфере возможна пролиферация лейкоцитов, и, предпочтительно, культивирование проводят в потоке 5% CO2. Период культивирования не имеет ограничений при условии, что индуцируется необходимое число клеток, и, как правило, он составляет от 3 дней до 2 недель. Что касается устройств, используемых для разделения и культивирования клеток, подходящими устройствами, предпочтительно, являются такие, безопасность которых для применения в медицинских целях была подтверждена, и которые работают стабильно и просты в управлении. В частности, примеры устройств для культивирования клеток включают не только обычные емкости, такие как чашки Петри, колбы и бутыли, но также и многослойные емкости, многокамерные емкости, роллерные флаконы, вращающиеся бутыли, культуральные мешки и половолоконные колонки.
Способ, как таковой, который используют для создания контакта между вышеописанным полипептидом и антиген-презентирующими клетками in vitro, может быть способом, хорошо известным в данной области. Например, антиген-презентирующие клетки можно культивировать в питательной среде, содержащей вышеописанный полипептид. Концентрация пептида в среде не имеет ограничений, и она, как правило, составляет примерно 1-100 мкг/мл, предпочтительно, примерно 5-20 мкг/мл. Плотность клеток в процессе культивирования не имеет ограничений и, как правило, она составляет примерно 103-107 клеток/мл, предпочтительно, примерно от 5×104 до 5×106 клеток/мл. Культивирование, предпочтительно, проводят общепринятым способом при 37°C в атмосфере 5% CO2. Максимальная длина пептида, который может быть представлен на поверхности антиген-презентирующих клеток, как правило, составляет примерно 30 аминокислотных остатков. Вследствие этого, в случаях создания контакта между антиген-презентирующими клетками и полипептидом in vitro полипептид можно получать таким образом, чтобы его длина не превышала примерно 30 аминокислотных остатков, хотя длина не ограничена.
В результате культивирования антиген-презентирующих клеток совместно с описанным выше полипептидом полипептид включается в молекулы MHC антиген-презентирующих клеток и презентируются на поверхности антиген-презентирующих клеток. Таким образом, используя вышеописанный полипептид, можно получать выделенные антиген-презентирующие клетки, содержащие комплекс между полипептидом и молекулой MHC. Такие антиген-презентирующие клетки могут представлять полипептид T-клеткам in vivo или in vitro для индукции и возможной пролиферации цитотоксических T-клеток, специфичных для полипептида.
При создании контакта между полученными таким образом антиген-презентирующими клетками, содержащими комплекс вышеописанного полипептида с молекулой MHC, и T-клетками in vitro, цитотоксические T-клетки, специфичные для полипептида, можно индуцировать и получать возможность для пролиферации. Это можно осуществлять путем совместного культивирования вышеописанных антиген-презентирующих клеток и T-клеток в жидкой среде. Например, антиген-презентирующие клетки можно суспендировать в жидкой среде и помещать в емкость, такую как лунка планшета для микротитрования, с последующим добавлением в лунку T-клеток, а затем проводить культивирование. Соотношение в смеси антиген-презентирующих клеток и T-клеток при совместном культивировании не имеет ограничений и, как правило, составляет примерно от 1:1 до 1:100, предпочтительно, примерно от 1:5 до 1:20 по количеству клеток. Плотность антиген-презентирующих клеток, суспендированных в жидкой среде, не имеет ограничений и составляет, как правило, примерно от 100 до 10000000 клеток/мл, предпочтительно, примерно от 10000 до 1000000 клеток/мл. Совместное культивирование, предпочтительно, проводят общепринятым способом при температуре 37°C в атмосфере 5% CO2. Период культивирования не имеет ограничений и составляет, как правило, от 2 дней до 3 недель, предпочтительно, примерно от 4 дней до 2 недель. Совместное культивирование, предпочтительно, проводят в присутствии одного или более интерлейкинов, таких как IL-2, IL-6, IL-7 и/или IL-12. В таких случаях концентрация IL-2 или IL-7, как правило, составляет примерно от 5 до 20 Ед/мл, концентрация IL-6, как правило, составляет примерно от 500 до 2000 Ед/мл, а концентрация IL-12, как правило, составляет примерно от 5 до 20 нг/мл, однако концентрации интерлейкинов этим не ограничены. Вышеуказанное совместное культивирование можно повторять от одного до нескольких раз с добавлением свежих антиген-презентирующих клеток. Например, процедуру отбрасывания культурального супернатанта после совместного культивирования и добавления свежей суспензии антиген-презентирующих клеток для дальнейшего проведения совместного культивирования можно повторять от одного до нескольких раз. Условия для каждого совместного культивирования могут быть такими же, как описано выше.
В результате вышеуказанного совместного культивирования цитотоксические Т-клетки, специфичные для полипептида, индуцируются и получают возможность пролиферировать. Таким образом, используя описанный выше полипептид, можно получать выделенные T-клетки, которые избирательно связываются с комплексом между полипептидом и молекулой МНС.
Как описано в приведенных ниже примерах, ген KATNAL1 специфически экспрессируется в клетках рака молочной железы, тканях рака молочной железы, клетках опухоли головного мозга, тканях опухоли головного мозга, тканях перианальной аденокарциномы, клетках перианальной аденокарциномы, тканях мастоцитомы, клетках мастоцитомы, клетках нейробластомы, клетках рака печени, тканях рака печени, клетках рака предстательной железы, тканях рака предстательной железы, клетках рака легкого, тканях рака легкого, клетках рака щитовидной железы, тканях рака щитовидной железы и клетках лейкоза. Таким образом, считается, что в этих формах злокачественного новообразования присутствует значительно большее количество KATNAL1, чем в нормальных клетках. Вследствие этого, когда часть полипептида KATNAL1, присутствующего в злокачественных клетках, презентируется молекулами MHC на поверхности злокачественных клеток, и подготовленные указанным образом цитотоксические T-клетки вводят в организм, цитотоксические Т-клетки могут повреждать злокачественные клетки, используя представленный полипептид в качестве маркера. Поскольку антиген-презентирующие клетки, представляющие вышеописанный полипептид, могут вызывать и способствовать пролиферации цитотоксических T-клеток, специфичных для полипептида, также in vivo, злокачественные клетки могут также повреждаться в результате введения в организм антиген-презентирующих клеток. То есть, цитотоксические Т-клетки и антиген-презентирующие клетки, полученные с использованием полипептида, также эффективны в качестве терапевтических и/или профилактических средств против злокачественных новообразований, аналогично средству, индуцирующему иммунитет, по настоящему изобретению.
В случаях, когда вышеописанные выделенные антиген-презентирующие клетки или выделенные Т-клетки вводят в организм, их предпочтительно, получают, обрабатывая антиген-презентирующие клетки или Т-клетки, полученные от пациента, которого предстоит лечить, с помощью полипептидов (a), (b) или (c), как описано выше, чтобы избежать иммунного ответа в организме, при котором такие клетки атакуются как инородные тела.
Терапевтическое и/или профилактическое средство против злокачественных новообразований, содержащее в качестве активного ингредиента антиген-презентирующие клетки или Т-клетки, предпочтительно, вводят парентеральным способом, например, внутривенным или внутриартериальным введением. Дозу соответствующим образом выбирают в зависимости от симптомов, цели введения и тому подобного, и она, как правило, составляет от 1 клетки до 10000000000000 клеток, предпочтительно, от 1000000 клеток до 1000000000 клеток, при этом дозу, предпочтительно, вводят с периодичностью от одного раза в несколько дней до одного раза в несколько месяцев. Препарат может представлять собой, например, клетки, суспендированные в физиологическом солевом буферном растворе, и препарат можно использовать в сочетании с другим/другими противораковым препаратом(ами) и/или цитокином(ами). Кроме того, можно добавлять одну или более добавок, хорошо известных в области создания фармацевтических препаратов.
Кроме того, в результате экспрессии полинуклеотида, кодирующего любой из полипептидов (a)-(c), в организме субъекта-животного образование антител и цитотоксических T-клеток может индуцироваться в организме, и может быть достигнут эффект, сравнимый с тем, который получают в случае введения полипептида. То есть, средство, индуцирующее иммунитет, по настоящему изобретению может быть средством, содержащим в качестве активного ингредиента рекомбинантный вектор, содержащий полинуклеотид, кодирующий любой из полипептидов (a)-(c), при этом рекомбинантный вектор способен экспрессировать полипептид в организме. Такой рекомбинантный вектор, способный экспрессировать антигенный полипептид, как показано в нижеприведенных примерах, также называют генной вакциной.
Вектор, используемый для получения генной вакцины, не имеет ограничений при условии, что он представляет собой вектор, способный экспрессировать полипептид в клетке животного (предпочтительно, в клетке млекопитающего), и может представлять собой либо плазмидный вектор, либо вирусный вектор, и можно использовать любой известный вектор в области генных вакцин. Полинуклеотид, такой как ДНК или РНК, кодирующий описанный выше полипептид, можно легко получать общепринятым способом, как указано выше. Включение полинуклеотида в вектор можно осуществлять способом, хорошо известным специалистам в данной области.
Способ введения генной вакцины, предпочтительно, представляет собой парентеральный способ, такой как внутримышечное, подкожное, внутривенное или внутриартериальное введение. Дозу можно соответствующим образом выбирать в зависимости от типа антигена и тому подобного, и она, как правило, составляет примерно от 0,1 мкг до 100 мг, предпочтительно, примерно от 1 мкг до 10 мг массы генной вакцины в расчете на кг массы тела.
Примеры способа с использованием вирусного вектора включают те, в которых полинуклеотид, кодирующий описанный выше полипептид, вводят в РНК-вирус или ДНК-вирус, такой как ретровирус, аденовирус, аденоассоциированный вирус, вирус герпеса, вирус коровьей оспы, вирус оспы, вируса полиомиелита или вируса Синдбис, а затем субъекта-животное инфицируют полученным вирусом. Среди этих способов особенно предпочтительным является способ с использованием ретровируса, аденовируса, аденосвязанного вируса, вируса коровьей оспы или тому подобного.
Примеры других способов включают способ, в котором экспрессионную плазмиду непосредственно вводят внутримышечно (способ ДНК-вакцины), а также способ с использованием липосом, способ с использованием липофектина, способ микроинъекции, кальций-фосфатный способ и способ электропорации. Особенно предпочтительными являются способы ДНК-вакцины и липосомный способ.
Способы получения гена, кодирующего вышеописанный полипептид, используемый по настоящему изобретению, фактически действующий как фармацевтический препарат, включают in vivo способы, в которых ген непосредственно вводят в организм, и ex vivo способы, в которых определенный вид клеток собирают от субъекта-животного, а затем ген вводят в клетки ex vivo, после чего клетки возвращают в организм (Nikkei Science, 1994, April, p. 20-45; The Pharmaceutical Monthly, 1994, Vol. 36, No. 1, p. 23-48; Experimental Medicine, Extra Edition, 1994, Vol.12, No. 15; а также ссылки, цитированные в этих литературных источниках, и тому подобное). Более предпочтительными являются in vivo способы.
В случаях, когда ген вводят in vivo способом, ген можно вводить соответствующим способом введения, в зависимости от заболевания, которое предстоит лечить, симптомов и тому подобного. Ген можно вводить, например, внутривенным, внутриартериальным, подкожным или внутримышечным введением. В случаях, когда ген вводят in vivo способом, ген можно включать в состав препарата, такой как раствор, и, как правило, его включают в инъекционный раствор или тому подобное, содержащий ДНК, кодирующую описанный выше пептид по настоящему изобретению, в качестве эффективного ингредиента. При необходимости, туда также можно добавлять обычно используемый носитель. В случаях липосом или сливающихся с мембраной клетки липосом (вирус Сендай (HVJ)-липосома или тому подобное), содержащих ДНК, липосомы можно формулировать в липосомный препарат, такой как суспензия, замороженный препарат или сконцентрированный центрифугированием замороженный препарат.
В настоящем изобретении «последовательность оснований SEQ ID NO:1» включает не только фактическую последовательность оснований SEQ ID NO:1, но также и комплементарную ей последовательность. Таким образом, «полинуклеотид, имеющий последовательность оснований SEQ ID NO:1» включает одноцепочечной полинуклеотид, имеющий фактическую последовательность оснований SEQ ID NO:1, одноцепочечной полинуклеотид, имеющий комплементарную ей последовательность оснований, а также двухцепочечный полинуклеотид, состоящий из этих одноцепочечных полинуклеотидов. Когда получают полинуклеотид, кодирующий полипептид, используемый по настоящему изобретению, соответствующим образом выбирают любую из этих последовательностей оснований, и специалисты в данной области могут легко делать такой выбор.
Примеры
Далее настоящее изобретение будет описано более конкретно с помощью примеров.
Пример 1: Получение нового белкового антигена злокачественного новообразования способом SEREX
(1) Получение библиотеки кДНК
Общую РНК экстрагировали из семенников собаки способом кислой гуанидин тиоцианат-фенол-хлороформной экстракции, и поли(A) РНК очищали с помощью набора для очистки мРНК Oligotex-dT30 (производства Takara Shuzo Co., Ltd.) в соответствии с протоколом, прилагаемым к набору.
Используя полученную мРНК (5 мкг), синтезировали фаговую библиотеку кДНК. Для получения фаговой библиотеки кДНК использовали набор для синтеза кДНК, набор Zap-cDNA Synthesis Kit и набор ZAP-cDNA Gigapack III Gold Cloning Kit (производства STRATAGENE) в соответствии с протоколами, прилагаемыми к наборам. Размер полученной фаговой библиотеки кДНК составлял 1×106 БОЕ/мл.
(2) Скрининг библиотеки кДНК при помощи сыворотки
Используя полученную указанным образом фаговую библиотеку кДНК, проводили иммуноскрининг. Более конкретно, хозяина E. coli (XL1-Blue MRF’) инфицировали библиотекой так, что 2340 клонов появилось на чашке с агарозой NZY размером 90 мм диаметр × 15 мм, и проводили культивирование при 42°C в течение 3-4 часов для того, чтобы фаги образовали бляшки. Чашку накрывали нитроцеллюлозной мембраной (Hybond C Extra: производства GE Healthcare Bio-Science), пропитанной ИПТГ (изопропил-β-D-тиогалактозид), при 37°C в течение 4 часов для индукции и экспрессии белков, и белки были перенесены на мембрану. После этого мембрану извлекали и замачивали в TBS (10 мМ трис-HCl, 150 мМ NaCl; pH 7,5) с добавлением 0,5% обезжиренного сухого молока. Затем мембрану встряхивали при 4°С в течение ночи для подавления неспецифических реакций. После этого этот фильтр подвергали реакции с разведенной в 500 раз сывороткой больной собаки при комнатной температуре в течение 2-3 часов.
В качестве вышеописанной сыворотки больной собаки использовали сыворотку, полученную от больной собаки с перианальной опухолью. Сыворотку хранили при -80°C и предварительно обрабатывали непосредственно перед применением. Способ предварительной обработки сыворотки был следующим. Вкратце, хозяина E. coli (XL1-Blue MRF’) инфицировали фагом λ ZAP Express, не имеющим вставки чужеродного гена, а затем культивировали на чашке со средой NZY при 37°C в течение ночи. Затем в чашку добавляли 0,2 M NaHCO3 буфер (pH 8,3) с 0,5 M NaCl, и чашку выдерживали при 4°C в течение 15 часов, после чего собирали супернатант как E. coli/фаговый экстракт. Затем собранный E. coli/фаговый экстракт пропускали через NHS-колонку (производства GE Healthcare Bio-Science) для иммобилизации на ней белков, полученных из E. coli/фага. Сыворотку от больной собаки пропускали через колонку, на которой она реагировала с иммобилизованными на колонке белками, для удаления антител, которые адсорбировались на E. coli и/или фаге. Фракцию сыворотки, пропущенную через колонку, разводили в 500 раз TBS с добавлением 0,5% обезжиренного сухого молока, и полученный разведенный раствор использовали в качестве материала для иммуноскрининга.
Мембрану с перенесенным на нее вышеописанным слитым белком, проинкубированную с обработанной подобным образом сывороткой, промывали 4 раза TBS-T (0,05% Tween 20/TBS) и подвергали реакции с антителами козы против IgG собаки (конъюгированные с HRP антитела козы против тяжелой и легкой цепей IgG собаки: производства BETHYL Laboratories), разведенными в 5000 раз TBS с добавлением 0,5% обезжиренного сухого молока, в качестве вторичных антител при комнатной температуре в течение 1 часа, с последующим обнаружением при помощи реакции ферментативного окрашивания с использованием реакционного раствора NBT/BCIP (производства Roche). Колонии в местах, соответствующих окрашенным в результате колориметрической реакции местам, извлекали из чашки с агарозой NZY, имеющей размеры 90 мм диаметр × 15 мм, и растворяли в 500 мкл буфера SM (100 мМ NaCl, 10 мМ MgClSO4, 50 мМ трис-HCl, 0,01% желатина; pH 7,5). Скрининг повторяли как второй и третий скрининг таким же образом, как описано выше, до получения одной окрашенной в результате колориметрической реакции колонии. Одна положительная по окраске колония была выделена после скрининга 9110 фаговых клонов, реагирующих с IgG в сыворотке.
(3) Поиск гомологии последовательности выделенного гена антигена
Чтобы провести анализ последовательности оснований единственного положительного клона, выделенного описанным выше способом, фаговый вектор превращали в плазмидный вектор. Более конкретно, 200 мкл раствора, полученного таким образом, что хозяин E. coli (XL1-Blue MRF’) содержался в концентрации, соответствующей оптической плотности OD600 = 1,0, смешивали с 100 мкл очищенного раствора фага и, кроме того, с 1 мкл фага-помощника ExAssist (производства STRATAGENE) и оставляли для протекания реакции при 37°C в течение 15 минут. После этого к реакционной смеси добавляли 3 мл среды LB и проводили культивирование полученной смеси при 37°C в течение 2,5-3 часов. Полученную культуру немедленно переносили для инкубации в водяную баню с температурой 70°C на 20 минут. Затем культуру центрифугировали при 4°C и 1000×g в течение 15 минут и отбирали супернатант в качестве раствора фагмида. Вслед за этим, 200 мкл раствора, полученного таким образом, что фагмидный хозяин E. coli (SOLR) содержался в концентрации, соответствующей оптической плотности OD600 = 1,0, смешивали с 10 мкл очищенного раствора фага и оставляли для протекания реакции при 37°C в течение 15 минут. После этого 50 мкл реакционной смеси высевали на среду LB-агар с добавлением ампициллина (конечная концентрация: 50 мкг/мл), и проводили культивирование при 37°С в течение ночи. Одиночную колонию трансформированной SOLR извлекали и культивировали в среде LB с добавлением ампициллина (конечная концентрация: 50 мкг/мл) при 37°С, с последующей очисткой плазмидной ДНК, имеющей интересующую вставку, при помощи набора QIAGEN plasmid Miniprep Kit (производства Qiagen).
Для очищенной плазмиды проводили анализ полноразмерной последовательности вставки способом «блуждающей затравки», используя праймер T3 с SEQ ID NO:13 и праймер T7 с SEQ ID NO:14. С помощью такого анализа последовательности получали последовательность гена SEQ ID NO:1. Используя последовательность оснований и аминокислотную последовательность данного гена, проводили поиск гомологии среди известных генов при помощи программы поиска гомологии последовательностей BLAST (http://www.ncbi.nlm.nih.gov/BLAST/). В результате было обнаружено, что полученный ген представляет собой ген KATNAL1. KATNAL1 человека, который является человеческим гомологом KATNAL1 собаки, имеет идентичность последовательности 95% с точки зрения последовательности оснований и 98% с точки зрения аминокислотной последовательности; KATNAL1 мыши, который является гомологом мыши, который идентичен последовательности 85% с точки зрения последовательности оснований и 94% с точки зрения аминокислотной последовательности; KATNAL1 быка, который является гомологом быка, имеет идентичность последовательности 91% с точки зрения последовательности оснований и 97% с точки зрения аминокислотной последовательности; KATNAL1 лошади, который является гомологом, имеет идентичность последовательности 87% с точки зрения последовательности оснований и 88% с точки зрения аминокислотной последовательности; и KATNAL1 курицы, который является гомологом курицы, имеет идентичность последовательности 81% с точки зрения последовательности оснований и 90% с точки зрения аминокислотной последовательности. Последовательность оснований и аминокислотная последовательность KATNAL1 человека приведены в SEQ ID NO:3 и SEQ ID NO:4, соответственно; последовательность оснований и аминокислотная последовательность KATNAL1 мыши приведены в SEQ ID NO:5 и SEQ ID NO:6, соответственно; последовательность оснований и аминокислотная последовательность KATNAL1 быка приведены в SEQ ID NO:7 и SEQ ID NO:8, соответственно; последовательность оснований и аминокислотная последовательность KATNAL1 лошади приведены в SEQ ID NO:9 и SEQ ID NO:10, соответственно; и последовательность оснований и аминокислотная последовательность KATNAL1 курицы приведены в SEQ ID NO:11 и SEQ ID NO:12, соответственно.
(4) Анализ экспрессии в различных тканях
Экспрессию генов, полученных описанным выше способом, в нормальных тканях собаки, человека и мыши, а также различных клеточных линиях исследовали при помощи способа ОТ-ПЦР (ПЦР с обратной транскрипцией). Реакцию обратной транскрипции проводили следующим образом. Вкратце, из 50-100 мг каждой ткани или 5×106-10×106 клеток каждой клеточной линии, экстрагировали общую РНК при помощи реагента тризола (производства Invitrogen) в соответствии с протоколом, описанным в прилагаемой инструкции. Используя общую РНК, синтезировали кДНК при помощи системы Superscript для синтеза первой цепи для ОТ-ПЦР (производства Invitrogen) в соответствии с протоколом, описанным в прилагаемой инструкции. В качестве кДНК нормальных тканей человека (мозга, гиппокампа, семенников, толстой кишки и плаценты) использовали библиотеку Gene Pool cDNA (производства Invitrogen), QUICK-Clone cDNA (производства CLONETECH) и Large-Insert cDNA (производства CLONETECH). Реакцию ПЦР проводили с использованием праймеров, специфичных для полученного гена (праймеры для гена собаки приведены в SEQ ID NO:15 и 16, праймеры для гена человека приведены в SEQ ID NO:17 и 18, и праймеры для гена мыши приведены в SEQ ID NO:19 и 20), как описано ниже. Вкратце, реагенты и прилагаемый буфер смешивали таким образом, что 0,25 мкл образца, полученного реакцией обратной транскрипции, 2 мкМ каждого из вышеуказанных праймеров, 0,2 мМ каждого из дНТФ и 0,65 Ед полимеразы ExTaq (производства Takara Shuzo Co., Ltd.) содержались в полученной смеси в конечном объеме 25 мкл, и реакцию проводили на протяжении 30 циклов при 94°С в течение 30 секунд, при 55°C в течение 30 секунд и при 72°C в течение 1 минуты, используя термоциклер (производства BIO-RAD). В качестве контроля для сравнения одновременно использовали праймеры, специфичные для GAPDH (праймеры для GAPDH собаки и человека приведены в SEQ ID NO:21 и 22; и праймеры для GAPDH мыши приведены в SEQ ID NO:23 и 24). В результате, как показано на фигуре 1, ген KATNAL1 собаки не был экспрессирован в большинстве здоровых тканей собаки, при том, что этот ген был сильно экспрессирован в опухолевых тканях собаки. Что касается генов KATNAL1 человека и мыши, экспрессию не наблюдали в большинстве нормальных тканей человека и мыши, при этом экспрессию наблюдали в большинстве линий клеток злокачественного новообразования (фиг. 2 и 3), как и в случае с геном KATNAL1 собаки.
(5) Количественный анализ экспрессии в различных тканях
Для гена, полученного вышеуказанным способом, изучали экспрессию в нормальных тканях человека способом количественной ОТ-ПЦР (ПЦР с обратной транскрипцией). В качестве кДНК для нормальных тканей и раковых тканей человека использовали панель I Tissue scan™ для скрининга в реальном времени на наличие злокачественного новообразования (Tissue scan Real Time cancer survey Panel I) (производства ORIGENE). Количественную ОТ-ПЦР проводили с использованием системы в реальном времени CFX96-C1000 термоциклера, производства Bio-Rad Laboratories, Inc. Реакцию ПЦР проводили следующим образом с использованием праймеров, специфичных для полученного гена (приведены в SEQ ID NO:17 и 18). Вкратце, 5 мкл образца кДНК, 2 мкМ каждого из праймеров, а также реагенты и буфер, содержащиеся в смеси 2 × SYBR Premix Ex TaqII polymerase (производства Takara Shuzo Co., Ltd.), смешивали для получения смеси в конечном объеме 20 мкл, и реакцию проводили на протяжении 30 циклов при 94°С в течение 30 секунд, при 55°C в течение 30 секунд и при 72°C в течение 1 минуты. В результате, уровень экспрессии гена KATNAL1 в каждом случае из рака молочной железы, рака толстой кишки, рака щитовидной железы, рака печени, рака предстательной железы и рака легкого был не менее чем в 5 раз выше, чем уровень экспрессии в соответствующих нормальных тканях. На основании данных результатов можно предвидеть, что не стоит беспокоиться о возможности побочных эффектов в результате применения противоопухолевых средств, направленных на KATNAL1 человека, в нормальных тканях, и что польза от фармакологического эффекта средств в значительной степени превышает риск их побочных эффектов.
Пример 2: Анализ антигенности KATNAL1 в случае злокачественного новообразования in vivo
(1) Получение рекомбинантного вектора, экспрессирующего KATNAL1 in vivo
Взяв за основу последовательность оснований SEQ ID NO:5, получали рекомбинантный вектор, экспрессирующий KATNAL1 in vivo. ПЦР проводили с использованием клеточной линии рака мышей N2a (приобретено у ATCC), которая продемонстрировала экспрессию в примере 1. Реагенты и прилагаемый буфер смешивали таким образом, что 1 мкл кДНК, 0,4 мкМ каждого из двух видов праймеров, имеющих сайты рестрикции для HindIII и XbaI (приведены в SEQ ID NO:25 и 26), 0,2 мМ дНТФ и 1,25 Ед полимеразы PrimeSTAR HS (производства Takara Shuzo Co., Ltd.) содержались в полученной смеси в конечном объеме 50 мкл, и ПЦР проводили на протяжении 30 циклов при 98°C в течение 10 секунд, при 55°C в течение 15 секунд и при 72°C в течение 4 минут, используя термоциклер (производства BIO RAD). Вышеописанные два вида праймеров были праймерами для амплификации области, кодирующей полноразмерную аминокислотную последовательность SEQ ID NO:5. После ПЦР амплифицированную ДНК подвергали электрофорезу в 1% агарозном геле, и фрагмент ДНК размером примерно 1500 п.н. очищали при помощи набора QIAquick для экстракции из геля (производства QIAGEN).
Очищенный фрагмент ДНК лигировали в клонирующий вектор pCR-Blunt (производства Invitrogen). E. coli трансформировали полученным продуктом лигирования, а затем плазмиду извлекали. С помощью секвенирования подтверждали, что последовательность амплифицированного генного фрагмента является той же самой, что и интересующая последовательность. Плазмиду, содержащую интересующую последовательность, обрабатывали ферментами рестрикции HindIII и XbaI и очищали при помощи набора QIAquick для экстракции из геля с последующей вставкой интересующей генной последовательности в вектор экспрессии млекопитающих pcDNA3.1 (производства Invitrogen), который был обработан ферментами рестрикции HindIII и XbaI. Использование этого вектора делает возможной продукцию белка KATNAL1 в клетках млекопитающих.
К 100 мкг полученной таким образом плазмидной ДНК добавляли 50 мкг частиц золота (производства Bio Rad), 100 мкл спермидина (производства SIGMA) и 100 мкл 1 М CaCl2 (производства SIGMA), и полученную в результате смесь перемешивали на вортексе, после чего выдерживали смесь в течение 10 минут при комнатной температуре (полученные частицы далее в настоящем документе называют частицами золото-ДНК). Затем смесь центрифугировали при 3000 об/мин в течение 1 минуты и супернатант отбрасывали, после чего осадок промывали 3 раза 100% этанолом (производства WAKO). К частицам золото-ДНК добавляли 6 мл 100% этанола и полученную смесь достаточно перемешивали на вортексе, после чего заливали частицы золото-ДНК в тефзеловую трубку (производства Bio Rad), давая возможность частицам оседать на поверхности стенок. Этанол удаляли из тефзеловой трубки с прикрепленными частицами золото-ДНК высушиванием на воздухе, и трубку затем нарезали на куски, имеющие длину, которая подходит для генной пушки.
(2) Противоопухолевый эффект KATNAL1 при использовании способа ДНК-вакцинации
Полученную вышеуказанным способом трубку помещали в генную пушку и трансдермально вводили ДНК-вакцину под давлением 400 фунтов на квадратный дюйм, используя чистый газообразный гелий, в общей сложности 3 раза с интервалом 7 дней в брюшную полость каждой из 10 особей мышей A/J (возраст 7 недель, самцы, приобретены у Japan SLC) и мышей Balb/c (возраст 7 недель, самцы, приобретены у Japan SLC) после сбривания шерсти (что соответствует инокуляции 2 мкг/особь плазмидной ДНК). После этого, линию клеток N2a нейробластомы мыши или линию клеток CT26 рака толстой кишки трансплантировали каждой мыши в количестве 1×106 клеток для оценки противоопухолевого эффекта (профилактическая модель). Для каждой модели, плазмидную ДНК, не содержащую встроенный ген KATNAL1, вводили 10 особям мышей, чтобы обеспечить контроль.
Противоопухолевый эффект оценивали на основании размера опухоли (большая ось × малая ось2/2) и доли оставшихся в живых мышей из общего количества. Результаты этого исследования свидетельствовали о том, что в профилактической модели с использованием линии клеток нейробластомы размеры опухолей соответствовали 2886 мм3 и 659 мм3 в день 43 в контрольной группе и в группе с введением плазмиды KATNAL1, соответственно. Таким образом, заметную регрессию опухоли наблюдали в группе с введением плазмиды KATNAL1. Кроме того, результаты наблюдения за выживаемостью в профилактической модели с использованием линии клеток нейробластомы указывали на то, что во всех случаях смерть наступала ко дню 76 после введения в контрольной группе, тогда как 60% мышей выжили в группе с введением плазмиды KATNAL1. Данные результаты свидетельствуют о значительном противоопухолевом эффекте в группе с введением плазмиды KATNAL1 по сравнению с контрольной группой. Аналогично, в профилактической модели с использованием линии клеток рака толстой кишки размеры опухоли составляли 2598 мм3 и 763 мм3 в день 35 в контрольной группе и в группе с введением плазмиды KATNAL1, соответственно. Таким образом, заметную регрессию опухоли наблюдали в группе с введением плазмиды KATNAL1. Кроме того, результаты наблюдения за выживаемостью свидетельствовали о том, что во всех случаях смерть наступала ко дню 50 после введения в контрольной группе, тогда как 50% мышей выжили в группе с введением плазмиды KATNAL1. Эти результаты свидетельствуют о значительном противоопухолевом эффекте в группе с введением плазмиды KATNAL1 по сравнению с контрольной группой.
Пример 3: Получение рекомбинантного белка KATNAL1 человека и оценка его способности индукции иммунитета
(1) Получение рекомбинантного белка KATNAL1 человека
Исходя из последовательности оснований SEQ ID NO:3, получали рекомбинантный белок KATNAL1 человека. Реагенты и прилагаемый буфер смешивали таким образом, что 1 мкл кДНК, полученной в примере 1, экспрессия которой может быть подтверждена для кДНК из различных тканей и клеток с помощью способа ОТ-ПЦР, 0,4 мкМ каждого из двух видов праймеров, имеющих сайты рестрикции для EcoRI и XhoI (приведены в SEQ ID NO:27 и 28), 0,2 мМ дНТФ и 1,25 Ед полимеразы PrimeSTAR HS (производства Takara Shuzo Co., Ltd.), содержались в полученной смеси в конечном объеме 50 мкл, и ПЦР проводили на протяжении 30 циклов при 98°C в течение 10 секунд, при 55°C в течение 15 секунд и при 72°C в течение 4 минут, используя термоциклер (производства BIO RAD). Вышеописанные два вида праймеров были праймерами для амплификации области, кодирующей полноразмерную аминокислотную последовательность SEQ ID NO:4. После ПЦР амплифицированную ДНК подвергали электрофорезу в 1% агарозном геле, и фрагмент ДНК размером примерно 1500 п.н. очищали при помощи набора QIAquick для экстракции из геля (производства QIAGEN).
Очищенный фрагмент ДНК лигировали в клонирующий вектор pCR-Blunt (производства Invitrogen). E. coli трансформировали полученным продуктом лигирования, а затем плазмиду извлекали. С помощью секвенирования подтверждали, что последовательность амплифицированного генного фрагмента является той же самой, что и интересующая последовательность. Плазмиду, содержащую интересующую последовательность, обрабатывали ферментами рестрикции EcoRI и XhoI и очищали при помощи набора QIAquick для экстракции из геля с последующей вставкой интересующей генной последовательности в вектор экспрессии для E. coli, pET30a (производства Novagen), который был обработан ферментами рестрикции EcoRI и XhoI. Использование данного вектора делает возможной продукцию рекомбинантного белка, слитого с His-тагом. E. coli для экспрессии, BL21 (DE3), трансформировали данной плазмидой, и экспрессию индуцировали 1 мМ ИПТГ, что позволяло экспрессировать интересующий белок в E. coli.
(2) Очистка рекомбинантного белка KATNAL1
Полученную таким образом рекомбинантную E. coli, экспрессирующую SEQ ID NO: 4, культивировали в среде LB с добавлением 100 мкг/мл ампициллина при 37°С до тех пор, пока оптическая плотность при 600 нм не достигала величины примерно 0,7, и затем к культуре добавляли изопропил-β-D-1-тиогалактопиранозид в конечной концентрации 1 мМ, с последующим дополнительным культивированием рекомбинантной E. coli при 37°C в течение 4 часов. Затем бактериальные клетки собирали центрифугированием при 4800 об/мин в течение 10 минут. Осадок бактериальных клеток суспендировали в фосфатно-солевом буферном растворе и вновь центрифугировали при 4800 об/мин в течение 10 минут для промывания бактериальных клеток.
Бактериальные клетки суспендировали в 50 мМ трис-HCl буфере (рН 8,0) и обрабатывали ультразвуком на льду. Жидкость, полученную при обработке ультразвуком E. coli, центрифугировали при 6000 об/мин в течение 20 минут для получения супернатанта в качестве растворимой фракции и осадка в качестве нерастворимой фракции.
Нерастворимую фракцию суспендировали в 50 мМ трис-HCl буфере (рН 8,0) и затем центрифугировали при 6000 об/мин в течение 15 минут. Эту операцию повторяли дважды для удаления протеаз.
Остаток суспендировали в 50 мМ трис-HCl буфере (рН 8,0) с добавлением 6 М гуанидина гидрохлорида и 0,15 М хлорида натрия, и выдерживали при 4°С в течение 20 часов для денатурации белка. После этого суспензию центрифугировали при 6000 об/мин в течение 30 минут, и полученную растворимую фракцию помещали на колонку с хелатированным никелем, подготовленную общепринятым способом (носитель: хелатирующая сефароза (торговая марка) Fast Flow (GE Health Care); объем колонки: 5 мл; уравновешивающий буфер: 50 мМ трис-HCl буфер (pH 8,0) с добавлением 6М гуанидин гидрохлорида и 0,15 М хлорида натрия), после чего колонку выдерживали при 4°C в течение ночи для адсорбции на носителе с хелатированным никелем. Носитель колонки центрифугировали при 1500 об/мин в течение 5 минут, и полученный супернатант отбирали. Затем носитель колонки суспендировали в фосфатно-солевом буферном растворе и вновь заполняли колонку.
Фракцию, не адсорбированную на колонке, смывали 10 объемами колонки 0,1 М ацетатного буфера (рН 4,0) с добавлением 0,5 М хлорида натрия, и сразу же после этого проводили элюирование 0,1 М ацетатным буфером (рН 3,0) с добавлением 0,5 М хлорида натрия для получения очищенной фракции, которую использовали позже в качестве материала для испытания при введении. Присутствие интересующего белка в каждой элюированной фракции подтверждали окрашиванием Кумасси, которое проводили общепринятым способом.
Буфер очищенного препарата, полученного указанным выше способом, заменяли реакционным буфером (50 мМ трис-HCl, 100 мМ NaCl, 5 мМ CaCl2 (pH 8,0)), и в полученном образце проводили отщепление His-тага протеазой фактором Xa, а также очистку интересующего белка с использованием набора Factor Xa Cleavage Capture Kit (производства Novagen) в соответствии с протоколом, прилагаемым к набору. Затем 12 мл буфера очищенного препарата, полученного вышеуказанным способом, заменяли физиологическим фосфатным буфером (производства Nissui Pharmaceutical), используя устройство для ультрафильтрации NANOSEP 10K OMEGA (производства PALL), полученный образец подвергали асептической фильтрации через 0,22-мкм мембрану HT Tuffryn Acrodisc (производства PALL) и использовали в эксперименте.
(3) Индукция CD8-положительных цитотоксических Т-клеток, реагирующих с рекомбинантным белком KATNAL1 человека
Получали периферическую кровь от здорового индивидуума, и периферическую кровь наслаивали на среду для разделения лимфоцитов (OrganonpTeknika, Durham, NC), а затем центрифугировали при 1500 об/мин при комнатной температуре в течение 20 минут. Фракцию, содержащую мононуклеарные клетки периферической крови (МКПК) (PBMCs), отбирали и промывали 3 (или более) раза в холодном фосфатном буфере для получения МКПК. Полученные МКПК суспендировали в 20 мл среды AIM-V (Life Technololgies, Inc., Grand Island, NY, USA), и клетки оставляли для прикрепления к культуральному флакону (Falcon) при 37°С в атмосфере 5% CO2 в течение 2 часов. Неадгезивные клетки использовали для получения T-клеток, а адгезивные клетки использовали для получения дендритных клеток.
С другой стороны, адгезивные клетки культивировали в среде AIM-V в присутствии IL-4 (1000 Ед/мл) и GM-CSF (1000 Ед/мл). Неадгезивные клетки, полученные через 6 дней, собирали и к клеткам добавляли рекомбинантный белок KATNAL1 человека в концентрации 10 мкг/мл, с последующим культивированием клеток при 37°С в атмосфере 5% СО2 в течение 4 часов. После этого среду заменяли средой AIM-V с добавлением IL-4 (1000 Ед/мл), GM-CSF (1000 Ед/мл), IL-6 (1000 Ед/мл, Genzyme, Cambridge, MA), IL-1β (10 нг/мл, Genzyme, Cambridge, MA) и TNF-α (10 нг/мл, Genzyme, Cambridge, MA), и культивирование продолжали еще в течение 2 дней для получения популяции неадгезивных клеток с целью их использования в качестве дендритных клеток.
Полученные дендритные клетки суспендировали в среде AIM-V при плотности клеток 1×106 клеток/мл, и к суспензии вновь добавляли рекомбинантный белок KATNAL1 человека в концентрации 10 мкг/мл. Используя 96-луночный планшет, клетки культивировали при 37°С в атмосфере 5% СО2 в течение 4 часов. После культивирования проводили рентгеновское облучение (3000 рад), и клетки промывали средой AIM-V с последующим суспендированием в среде AIM-V с добавлением 10% AB сыворотки человека (Nabi, Miami, FL), IL-6 (1000 Ед/мл) и IL-12 (10 нг/мл, Genzyme, Cambridge, MA). Затем клетки помещали в 24-луночный планшет в количестве 1×105 клеток/лунку. После этого добавляли полученную популяцию T-клеток в каждую лунку в количестве 1×106 клеток и культивировали при 37°С в атмосфере 5% CO2. Каждый культуральный супернатант отбрасывали через 7 дней, и дендритные клетки, полученные таким же образом, как описано выше, путем обработки белком человека с последующим рентгеновским облучением, суспендировали в среде AIM-V с добавлением 10% AB сыворотки человека (Nabi, Miami, FL), IL-7 (10 Ед/мл, Genzyme, Cambridge, MA) и IL-2 (10 Ед/мл, Genzyme, Cambridge, MA) (плотность клеток 1×105 клеток/мл). Полученную суспензию добавляли в 24-луночный планшет в количестве 1×105 клеток/лунку, и клетки дополнительно культивировали. После повторения той же операции от 4 до 6 раз с интервалами в 7 дней, стимулированные T-клетки извлекали, и индукцию CD8-положительных T-клеток подтверждали способом проточной цитометрии.
В качестве отрицательного контроля использовали белок с последовательностью, не входящей в объем настоящего изобретения (SEQ ID NO: 29).
Затем изучали, способны ли CD8-положительные T-клетки, стимулированные полипептидом по настоящему изобретению, повреждать экспрессирующие опухолевые клетки.
В 50-мл центрифужную пробирку собирали 105 клеток клеточной линии T98G злокачественной опухоли мозга (Stein GH et al., J. Cell Physiol., 99: 43-54 (1979); приобретено у ATCC), в которых экспрессия была подтверждена, и к клеткам добавляли 100 мкКи хрома 51, с последующей инкубацией полученной смеси при 37°С в течение 2 часов. После этого клетки промывали 3 раза средой AIM-V с добавлением 10% AB сыворотки человека и помещали в 96-луночный V-донный планшет в количестве 103 клеток на лунку. Затем в каждую лунку добавляли 105, 5×104, 2,5×104 или 1,25×104 CD8-положительных T-клеток, которые были стимулированы рекомбинантным белком человека и суспендированы в среде AIM-V с добавлением 10% AB сыворотки человека, и культивирование проводили при 37°С в атмосфере 5% СО2 в течение 4 часов. После этого количество хрома 51, высвободившегося из поврежденных опухолевых клеток в культуральный супернатант, измеряли с использованием гамма-счетчика, чтобы рассчитать цитотоксическую активность CD8-положительных Т-клеток, стимулированных рекомбинантным белком человека.
В результате было обнаружено, что CD8-положительные T-клетки, стимулированные рекомбинантным белком человека, обладали цитотоксической активностью против T98G. С другой стороны, CD8-положительные T-клетки, индуцированные с использованием белка отрицательного контроля (SEQ ID NO:29), не проявляли цитотоксической активности. Таким образом, было обнаружено, что рекомбинантный белок человека, используемый в настоящем изобретении, обладает способностью индуцировать CD8-положительные цитотоксические Т-клетки, которые могут повреждать опухолевые клетки.
Цитотоксическая активность означает цитотоксическую активность CD8-положительных Т-клеток против T98G, определенную путем: смешивания 105 CD8-положительных Т-клеток, стимулированных и индуцированных, как описано выше, с 103 клеток клеточной линии T98G злокачественной опухоли мозга, в которые был включен хром 51; культивирования полученной смеси в течение 4 часов; измерения количества хрома 51, высвободившегося в среду, после культивирования; и проведения вычисления по формуле 1.
Формула 1: Цитотоксическая активность (%) = количество хрома 51, высвободившегося из T98G после добавления CD8-положительных Т-клеток (имп/мин)/количество хрома 51, высвободившегося из целевых клеток после добавления 1 н соляной кислоты (имп/мин) × 100.
Промышленная применимость
Настоящее изобретение является эффективным для лечения и/или профилактики злокачественных новообразований, поскольку по настоящему изобретению предложено средство, индуцирующее иммунитет, содержащее полипептид, проявляющий противоопухолевую активность в отношении различных форм злокачественных новообразований.