Результат интеллектуальной деятельности: Фармацевтическая композиция на основе соединения палладия
Вид РИД
Изобретение
Область техники
Изобретение относится к медицине и фармацевтике, конкретно к новой фармацевтической композиции на основе соединения палладия, проявляющей противоопухолевую активность, а также обладающей антиметастатическим действием, которая может быть использована при лечении широкого спектра злокачественных опухолей.
Предшествующий уровень техники
В настоящее время препараты на основе металлов платиновой группы занимают одно из ведущих мест в лечении онкологических заболеваний.
Появление платиносодержащих препаратов изменило представления онкологов о возможности химиотерапии опухолей и гемобластозов. Комбинации с включением противоопухолевых препаратов на основе платины позволили повысить эффективность лечение заболеваний, увеличив число ремиссий и продолжительность жизни больных.
Противоопухолевые препараты на основе платины относятся к соединениям алкилирующего типа. Биологическое действие таких препаратов определяется их способностью замещать атом водорода в ДНК. В результате нарушения репликации ДНК, возникают мутации и гибель клетки.
В клинической практике широко и успешно применяются такие известные препараты на основе платины, как цисплатин, карбоплатин и оксалиплатин (Государственный реестр лекарственных средств, http://grls.rosminzdrav.ru).
Однако, несмотря на значительную терапевтическую активность, высокая токсичность препаратов на основе платины, наличие побочных реакций, осложнений и резистентность опухолей к ним, делает актуальным поиск новых противоопухолевых препаратов среди соединений других платиновых металлов.
В этой связи, наиболее перспективными являются соединения палладия, поскольку они значительно менее токсичны по сравнению с соединениями платины.
Биологическая активность соединений палладия известна из научных и патентных источников информации.
Различные соединения палладия и их свойства проанализированы в обзоре «КАТИОННО-АНИОННЫЕ КОМПЛЕКСЫ ПАЛЛАДИЯ: ВЛИЯНИЕ ХАРАКТЕРА ВОДОРОДНЫХ СВЯЗЕЙ НА ИХ СТАБИЛЬНОСТЬ И БИОЛОГИЧЕСКУЮ АКТИВНОСТЬ» (И.А. Ефименко, О.Н. Шишилов, Институт общей и неорганической химии им. Н.С. Курнакова РАН, г. Москва, 2012 год).
В патентах: CN 102408452, CN 103450282, CN 101863927, CN 101863926, CN 101857610, CN 103394086, CN 101797392, PCT: CN 02/00412, CN 103214526 описаны соединения палладия, обладающие противоопухолевой активностью, а также способы их получения. Как следует из реферативной информации, все указанные соединения могут быть использованы для изготовления противоопухолевых лекарственных средств.
Кроме того, в международной заявке WO 2004019924 (публ. 2011-03-08, заявитель FUNDACAODEAMPAROAPESQUISA [BR]), описана группа соединений палладия, их биологическая активность, в частности, их применение для лечения злокачественных опухолей.
Ряд патентов описывает использование в качестве противоопухолевых агентов наночастиц палладия (CN 103394086), радиоактивного Палладия-103 (CN 101797392), палладийорганический комплекс (US 2010076076), координационный комплекс диаминоциклогексана платины(II) с сополимером (RU 2335512), производными бензоизоселеназолонила с палладием (RU 2324688). Кроме того, выявлена повышенная активность палладиевого комплекса по патенту KR 20140041711 и комплексов палладия и фтора (US 2014018538), а также комплексов палладия с липоевой кислотой и длинноцепочечными жирными кислотами (WO 2011130271).
Известны соединения палладия с ароматическими аминами, обладающие иммуномодулирующими свойствами, и, в частности, специфической активностью - защитным действием при облучении (EA 010431).
В качестве наиболее близкого аналога заявляемого изобретения по химической структуре биологически активного компонента может быть выбрано изобретение «КОМПЛЕКСЫ ПАЛЛАДИЯ С ГЕТЕРОЦИКЛИЧЕСКИМИ ЛИГАНДАМИ» по патенту RU 2291872, согласно которому получены новые комплексы палладия катион-анионного типа, содержащие в своем составе анион [PdCl4]2 и обладающие противоопухолевой активностью.
Однако в данном изобретении не предложены фармацевтические композиции и эффективные дозы, которые могут быть использованы для лечения злокачественных опухолей.
Краткое описание изобретения
Задачей настоящего изобретения является расширение арсенала лекарственных средств, предназначенных для лечения злокачественных опухолей, путем создания новой фармацевтической композиции на основе соединения палладия, обладающей противоопухолевым действием при низкой токсичности.
Поставленная задача решается созданием фармацевтической композиции на основе соединения палладия, которая, согласно изобретению, содержит ацидокомплекс палладия формулы: (C5H12NO)2[PdCl4] в качестве активного компонента, и фармацевтически приемлемый растворитель, в частности, 0,9% водный раствор хлорида натрия, в эффективных количествах.
Кроме того, поставленная задача решается тем, что вышеописанная фармацевтическая композиция, согласно изобретению, проявляет противоопухолевое действие при однократном и при курсовом парентеральном введении терапевтически эффективных доз.
Кроме того, поставленная задача решается тем, что вышеописанная фармацевтическая композиция, согласно изобретению, проявляет антиметастатическое действие при курсовом парентеральном введении терапевтически эффективных доз.
Также поставленная задача решается тем, что вышеописанная фармацевтическая композиция, согласно изобретению, усиливает действие цитостатиков различных классов.
Кроме того, поставленная задача решается тем, что вышеописанная фармацевтическая композиция, согласно изобретению, усиливает специфический противоопухолевый иммунитет.
Заявленная фармацевтическая композиция в качестве активного компонента содержит ацидокомплекс палладия из группы соединений палладия, описанных в изобретении по патенту RU 2291872. Изучение свойств соединений палладия, полученных согласно указанному изобретению, позволило выявить наиболее перспективное из них для создания новой композиции противоопухолевого действия. Так, проведенные исследования показали, что соединение формулы: (C5H12NO)2[PdCl4] (1) проявляет высокую противоопухолевую активность и обладает низкой токсичностью.
В качестве фармацевтически приемлемого растворителя заявленная фармацевтическая композиция содержит 0,9% водный раствор хлорида натрия (NaCl), что определяется стабильностью свойств соединения (1) в водном растворе NaCl при комнатной температуре на свету в течение 12 месяцев.
Проведенные токсикологические и патоморфологические исследования свидетельствуют об отсутствии у заявляемой композиции многих побочных эффектов, свойственных препаратам на основе платины, а ее токсичность в 5 раз ниже, чем, например, у препарата Цисплатин.
При этом заявляемая композиция не обладает аллергизирующим и анафилактоидным действием, эмбриотоксическими свойствами, мутагенным эффектом, что делает возможным лечение и молодых женщин и даже беременных, не опасаясь за здоровье будущего поколения.
Авторами заявляемой фармацевтической композиции экспериментально показано, что она обладает широким спектром противоопухолевого действия (7 штаммов опухолей) и значительно превосходит платиносодержащие препараты по показателю выживаемости - основному показателю эффективности лечения раковых заболеваний в соответствии с рекомендациями ВОЗ.
Экспериментальные данные свидетельствуют о выраженном противоопухолевом действии заявляемой композиции, как при однократном, так и при курсовом введении. Причем терапевтически эффективные дозы при однократном парентеральном введении составляют 20 мг/кг и 50 мг/кг, а при курсовом введении: 10-20 мг/кг.
Вместе с тем, проведенные опыты показали, что заявляемая композиция в эффективных дозах не только замедляет или прекращает рост первичной опухоли и сформировавшихся метастазов, но и предотвращает образование метастазов; она усиливает действие цитостатиков различных классов, а также способна усиливать специфический противоопухолевый иммунитет, а именно - формировать противоопухолевую резистентность и корректировать иммунодепрессивное влияние цитостатиков на организм.
Подробное описание изобретения
Количественный состав заявляемой композиции был подобран эмпирическим путем в ходе изучения ее стабильности при различном содержании соединения (1) в 10 мл 0,9% водного раствора хлорида натрия. Стабильность растворов соединения (1) в 0,9% водном растворе хлорида натрия определяли исследованием их электронных спектров (ЭСП).
Данные по стабильности фармацевтической композиции с различным содержанием соединения (1) приведены в следующей таблице:

Из приведенных данных следует, что раствор с содержанием соединения (1) 0,2% остается стабильным до 12 месяцев, с уменьшением содержания соединения (1) от 0,04 до 0,02% наблюдается тенденция к понижению положения пика полосы поглощения [PdCl4]2- -иона, что свидетельствует о процессах гидролиза [PdCl4]2- - иона с образованием аква- или гидроксосоединений [PdCl4⋅n] n=1,2 типа [PdCl2H2O] или [PdCl2OH]2-.
Разбавление раствора с содержанием соединения (1) 0,2% более, чем в два раза приводит к нарушению структуры и потере его свойств.
Таким образом, предпочтительные эффективные количества компонентов в композиции составляют:
|
Заявляемая композиция, содержащая раствор ацидокомплекса палладия формулы: (C5H12NO)2[PdCl4] в 0,9% водном растворе хлорида натрия в эффективных количествах, может быть реализована путем приготовлении раствора для парентерального введения.
Для приготовления заявленной фармацевтической композиции на первом этапе получают соединение (C5H12NO)2[PdCl4] (1) посредством выделения из синтеза твердого комплекса, затем проводят его сушку и анализ (согласно описанию к патенту RU 2291872). Полученное соединение (1) в виде порошка квалификации «чистый» должно соответствовать следующим техническим показателям:
|
На втором этапе 20 мг соединения (1) растворяют в 10 мл 0,9% водном растворе хлорида натрия при постоянном перемешивании, затем фильтруют через стеклянный фильтр, дозируемыми количествами разливают в ампулы 5 мл или 10 мл и запаивают.
Полученная таким образом фармацевтическая композиция, представляет собой раствор с массовой долей соединения (1) 0,2% и имеет pH 5,4-5,7.
Изучение безопасности и фармакологической активности фармацевтической композиции, полученной в примере приготовления, проведено в серии экспериментальных исследований на животных (опыты 1-6).
Определение спектра противоопухолевой активности и терапевтически эффективных доз заявленной фармацевтической композиции проведено в ходе экспериментов, в которых использованы различные перевиваемые опухоли мышей: гемобластозы, асцитные и солидные опухоли. Лечение начинали через 48-72 часа после перевивки опухолевого материала. Заявленную композицию вводили внутрибрюшинно или внутривенно однократно или многократно в оптимальных дозах с различными интервалами между введениями.
Терапевтический эффект оценивали по следующим показателям:
- торможению роста опухоли (ТРО %),
- соотношению торможения роста опухоли к ее стимуляции (Т/С %),
- по средней продолжительности жизни в сутках,
- увеличению продолжительности жизни по сравнению с нелеченым контролем (УПЖ %),
- по количеству особей с полной ремиссией.
Опыт 1. Изучение острой токсичности заявляемой композиции при внутривенном и внутрибрюшинном введении
Острую токсичность композиции изучали на мышах самцах гибридах Fi (CBA х C57BI) массой 20-22 г. и крысах самцах линии Wistar массой 120-150 г. Композицию вводили в хвостовую вену животных в рабочих концентрациях 0,35% для мышей и 0,5% для крыс. В случаях введения композиции в высоких дозах, концентрацию раствора увеличивали до 0,5% для мышей и 1,0% для крыс с целью соблюдения рекомендаций по предельным объемам вводимых растворов.
Мышам вводили композицию внутривенно в диапазоне доз (1): 40; 60; 80; 100; 120 и 160 мг/кг, внутрибрюшинно - в дозах: 40; 80; 100; 140; 180 и 200 мг/кг. Крысам композицию внутривенно вводили в дозах (1): 5; 10; 20; 40; 60; 80; и 100 мг/кг и внутрибрюшинно в дозах (1) 20; 40; 60; 80; 100; 125; 150 и 180 мг/кг.
За состоянием и поведением животных наблюдали ежедневно в течение месяца, еженедельно определяли массу тела. Дозы, характеризующие токсичность композиции рассчитывали по методу Литчфилда и Уилкоксона.
При внутривенном пути введении мышам самцам гибридной линии Fi (CBA х C57BI) массой тела 20-22 г доза ЛД50 составила 97 (82,9-113,5) мг/кг, МПД - 56 (47,8-65,5) мг/кг. Максимальный пик гибели от высоких доз композиции наблюдался в первые 30 минут после ее введения, последующая массовая гибель животных наблюдалась на протяжении 3-х первых суток опыта. Отдаленной гибели животных не наблюдалось. При внутрибрюшинном пути введении мышам самцам гибридной линии Fi (CBA х C57BI) массой тела 20-22 г доза ЛД50 составила 110 (91,6-134,2) мг/кг; МПД - 64 (52,4-78,1) мг/кг. Композиции в дозе 200 мг/кг вызывал гибель всех животных в течение 2-3-х часов. В остальных группах гибель животных продолжалась с 1-х по 4-е сутки эксперимента. Более поздней гибели не наблюдалось. При обоих путях введения выжившие животные в первые 3-5 суток эксперимента теряли в весе до 15% от исходного и к 14-м суткам наблюдения набирали в весе до контрольного уровня.
При внутривенном введении композиции крысам самцам линии Wistar массой 120-150 г доза ЛД50 составила 64 (42,6-96,0) мг/кг, МПД - 15 (10-22,5) мг/кг. Все крысы, получавшие композицию в дозе 100 мг/кг погибли «на игле». В остальных группах, в зависимости от величины примененной дозы, гибель наблюдалась только в течение первых суток эксперимента. Выжившие животные в течение первых 3-5 суток теряли до 24% массы тела, но к 14 суткам наблюдения набирали массу тела до контрольного уровня.
При внутрибрюшинном введении композиции крысам самцам линии Wistar массой 120-150 г доза ЛД50 составила 95 (81,2-111,2) мг/кг; МПД - 58 (49,5-67,9) мг/кг. Крысы, получавшие композицию в дозе 180 мг/кг, пали в течение первых 2-х часов. В других группах гибель животных наблюдалась с 1-х по 4-е сутки эксперимента и находилась в прямой зависимость от примененной дозы.
Таким образом, гибель подопытных животных при применении высоких доз композиции (100-200 мг/кг) наступает очень быстро, иногда практически мгновенно. При применении более низких доз препарата животные приходили в возбуждение, у них наблюдалась взъерошенность шерсти, усиливалась двигательная активность. Наиболее ярко эти симптомы прослеживались у животных, получавших композицию внутривенно
В процессе эксперимента при внутривенном введении композиции была выявлена зависимость токсичности раствора от концентрации и скорости введения: так при введении композиции в концентрациях выше 0,5% и со скоростью более 1 мл в минуту животные погибали независимо от дозы.
Таким образом, терапевтически эффективная доза заявляемой композиции не должна превышать 50 мг/кг (0,5% раствор), при этом вводить композицию предпочтительно внутривенно медленно.
Опыт 2. Изучение влияния заявляемой композиции на рост солидных опухолей
2.1. Противоопухолевое действие композиции изучали на модели Аденокарциномы молочной железы (АК 755) при курсовом внутривенном введении мышам самкам линии C57BL/6j массой тела 20-22 г. Каждая опытная группа насчитывала по 10 особей, контрольная - 20 особей. Опухолевый материал вводили подкожно в количестве 1 млн. клеток на мышь. Лечение начинали через 48 часов после перевивки опухоли. Композицию вводили в виде 0,1% раствора в изотоническом растворе хлорида натрия в дозах (1) 1 мг/кг, 10 мг/кг и 20 мг/кг внутривенно ежедневно в течение 5 дней. Животные контрольной группы получали внутривенно 0,9% раствор хлорида натрия в объеме, эквивалентном объему композиции в большой дозе.
Степень торможения роста опухоли определяли по показателям ТРО и Т/С, на 14 и 21 день после первого введения препарата, а также по показателю полной ремиссии. С полной ремиссией считали животных без признаков опухоли в течение 30 суток от момента перевивки. Полученные результаты представлены в таблице 1.
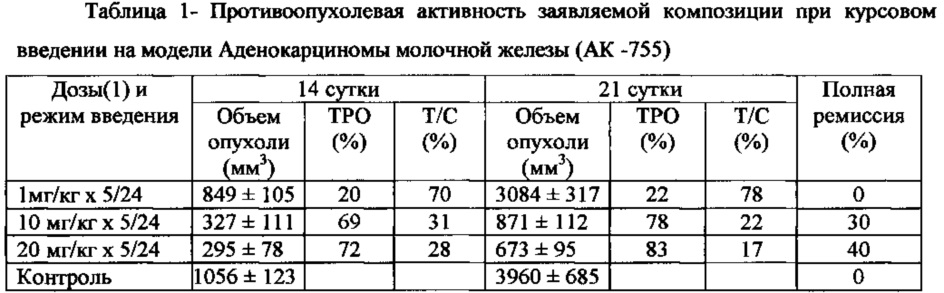
Вывод: при курсовом 5-дневном введении композиции в дозах (1) 10 мг/кг и 20 мг/кг на модели опухоли АК - 755 наиболее выраженный эффект был обнаружен на 21 сутки при введении дозы 20 мг/кг и составил ТРО - 83%, а Т/С - 17%. Полная ремиссия отмечалась при курсовом введении композиции в той же дозе (1) 20 мг/кг и составила 40%.
2.2. Противоопухолевое действие заявляемой композиции изучали на модели Меланомы В-16 при однократном и курсовом 5-дневном внутривенном введении мышам самцам. Опухолевый материал вводили подкожно в количестве 1 млн. клеток на мышь. Лечение начинали через 48 часов после перевивки опухоли. Каждая опытная группа и контроль формировались из 10 особей.
Эффективность при однократном введении изучалась на линейных мышах самцах C57B1 массой тела 20-24 г. Композицию вводили в виде 0,1% раствора в изотоническом растворе хлорида натрия в дозах 20 мг/кг или 50 мг/кг. Эффективность при курсовом введении (внутривенно ежедневно в течение 5 дней) изучали на мышах самцах гибридной линии F1 (CBA х С57В1) массой 20-22 г. Композицию вводили в виде 0,1-0,2% раствора в 10 мл изотонического раствора хлорида натрия, содержащего 10 мг/кг и 20 мг/кг (1). Животные контрольной группы получали внутривенно 0,9% раствор хлорида натрия в объеме, эквивалентному объему композиции в большей дозе.
Степень торможения роста опухоли определяли по показателям ТРО и Т/С на 14 и 21 день после первого введения препарата, а также по показателю полной ремиссии. С полной ремиссией считали животных без признаков опухоли в течение 30 суток от момента перевивки. Полученные результаты представлены в таблицах 2 и 3.


Вывод: при изучении противоопухолевого действия композиции в серии экспериментов на модели Меланомы В-16 при однократном внутривенном введении в дозах (1) 20 мг/кг и 50 мг/кг наиболее выраженный эффект наблюдался на 14 сутки при введении 20 мг/кг и составил ТРО - 43%, а Т/С - 57%. При курсовом введении композиции в дозах (1) 10 мг/кг и 20 мг/кг наиболее выраженный эффект наблюдался на 21 сутки при внутривенном введении 10 мг/кг и составил ТРО - 99%, а Т/С - 1%. Полная ремиссия отмечалась при курсовом введении композиции в дозе 20 мг/кг и составила 60%.
2.3 Изучение противоопухолевого действия при курсовом 5-дневном введении заявляемой композиции на модели Саркомы S-180 проводили на нелинейных мышах самках линии SHK массой тела 18-20 г. Число животных в опытной и контрольной группе составляло 10 особей. Опухолевый материал вводили подкожно в количестве 1 млн. клеток на мышь. Лечение начинали через 48 часов после перевивки опухоли. Композицию 0,2% раствора (1) в изотоническом растворе NaCl (т.е. доза 20 мг/кг в 10 мл 0,9% водного раствора NaCl) вводили внутривенно ежедневно в течение 5 дней. Животные контрольной группы получали внутривенно 0,9% раствор хлорида натрия в объеме, эквивалентном объему вводимой композиции.
Степень торможения роста опухоли определяли по показателям ТРО и Т/С на 14 и 21 день после первого введения препарата, а также по показателю полной ремиссии. С полной ремиссией считали животных без признаков опухоли в течение 30 суток от момента перевивки. Полученные результаты представлены в таблице 4.

Вывод: при курсовом 5-дневном внутривенном введении композиции в дозе (1) 20 мг/кг на модели Саркомы S-180 на 14 сутки показатель торможения роста опухоли (ТРО) составил 83%, а на 21 сутки - 76%. При этом полная ремиссия отмечалась у 20% особей, входящих в опытную группу.
Опыт 3. Изучение влияния заявляемой композиции на асцитные опухоли
3.1. Изучение противоопухолевой активности композиции на модели Лейкемия L-1210 при курсовом 5-дневном введении проводился на мышах самцах линии DBA2 массой тела 20-24 г. В опытной и контрольной группах было по 6 особей. Опухолевый материал вводили внутрибрюшинно в количестве 105 клеток на мышь. Лечение начинали через 48 часов после перевивки опухоли. Композицию вводили в виде 0,2% раствора (1) в дозе 20 мг/кг в 10 мл изотонического раствора хлорида натрия внутривенно ежедневно в течение 5 дней. Животные контрольной группы получали внутривенно 0,9% раствор хлорида натрия в объеме, эквивалентном вводимому объему композиции.
Эффективность композиции оценивали по средней продолжительности жизни в сутках и приросту продолжительности жизни (в процентах) по сравнению с контролем, где
УПЖ (%)=(СПЖ опыт-СПЖ без лечения)/СПЖ без лечения×100.
Полученные результаты представлены в таблице 5.

Вывод: при курсовом введении композиции в дозе 20 мг/кг СПЖ на модели опухоли с лейкемией L-1210 увеличилась на 16 суток, а прирост УПЖ составил 131%.
2.2. Изучение противоопухолевой активности композиции на модели Лимфоидной лейкемии P388 при курсовом 5-дневном введении мышам самцам гибридной линии TC57BL/6jx DBA массой тела 20-24 г. В опытной и контрольной группах было по 10 особей. Опухолевый материал вводили внутрибрюшинно в количестве 0,25 мл на мышь в разведении 1:40. Лечение начинали через 48 часов после перевивки опухоли. Композицию вводили в виде 0,2% раствора (1) в дозе (1) 20 мг/кг в 10 мл изотоническом растворе хлорида натрия внутривенно ежедневно в течение 5 дней. Животные контрольной группы получали внутривенно 0,9% раствор хлорида натрия в объеме, адекватном объему композиции.
Эффективность композиции оценивали по средней продолжительности жизни в сутках и проценту прироста продолжительности жизни по сравнению с контролем, где
УПЖ (%)=(СПЖ опыт-СПЖ без лечения)/СПЖ без лечения×100.
Полученные результаты представлены в таблице 6.

Вывод: при курсовом 5-дневном введении композиции в дозе (1) 20 мг/кг на модели Лейкемии Р-388 средняя продолжительность жизни мышей увеличилась на 10 суток по сравнению с контролем, прирост увеличения продолжительности жизни по сравнению с контролем составил 170%, количество излеченных животных - 84%.
Результаты изучения противоопухолевой активности композиции на различных моделях солидных (аденокарцинома молочной железы (АК 755), меланома В-16, саркома S-180) и асцитных (лейкемия L-1210, лимфоидная лейкемии Р-388) опухолей при курсовом 5-дневном внутривенном введении свидетельствуют о наличии у заявленной композиции выраженного противоопухолевого действия.
Опыт 4. Изучение антиметастатической активности заявляемой композиции
Исследование антиметастатической активности композиции проводилось при позднем начале терапии (введение препарата в уже развившийся опухолевый процесс) - схема, максимально приближенная к реальным клиническим условиям. В качестве экспериментальной модели была использована опухоль меланомы В16, которую перевивали мышам гибридам BDF1, весом 22-24 гр, инокулумом, содержащим 5⋅106 опухолевых клеток. Препарат вводили внутривенно в дозе 20 мг/кг и двух режимах - в течение недели ежедневно или через день. Оценку антиметастатической активности проводили на 28 день эксперимента. Критерием антиметастатической активности служил индекс ингибирования метастазов (ИИМ) который считали по формуле:
ИИМ, %=((Ак*Вк)-(А*В))/Ак*Вк*100, где
Ак - частота метастазирования в контрольной группе,
А - частота метастазирования в опытной группе,
Вк - среднее число метастазов в контрольной группе,
В - средне число метастазов в опытной группе.
Результаты изучения антиметастатической активности композиции на экспериментальной модели метастазирующей опухоли меланомы В16 приведены в таблице 7.

Вывод: в результате исследования антиметастатической активности композиции при позднем (после 7-х суток) начале лечения меланомы В16 установлено, что заявляемая композиция в дозе (1) 20 мг/кг не только предупреждает формирование метастазов, о чем свидетельствует высокий показатель индекса ингибирования метастазов 97-98% в трех сериях опыта при разных режимах внутривенного введения (в течение недели ежедневно и через день), но и замедляет или даже прекращает рост первичной опухоли.
Также не менее важен полученный результат по усилению процессов метастазирования и торможения роста опухоли меланомы В-16 в ранние сроки введения композиции. Так, внутривенное введение композиции в дозе 20 мг/кг ежедневно, начиная со 2-х суток после перевивки опухоли в течение 5 дней, сопровождается предотвращением развития метастазов (ИИМ - 99%) и торможением роста опухоли (ТРО - 90%).
Опыт 5. Изучение противоопухолевой и антиметастатической активности заявляемой композиции в комбинированной противоопухолевой терапии с цитостатиками различных классов
Исследование влияния композиции на эффективность противоопухолевой и антиметастатической терапии при комбинированном применении с известными противоопухолевыми препаратами различных групп было проведено на моделях следующих экспериментальных опухолей:
- Лейкемия Р388, инукулум 1×106 опухолевых клеток, путь введения - внутрибрюшинный,
- Меланома В16, инукулум 5×106 клеток, прививка подкожно,
- Карцинома легких Льюиса (LL), инукулум 106 опухолевых клеток, перевивка внутримышечно.
В комбинированной терапии вместе с заявляемой композицией использовались противоопухолевые препараты Циклофосфан в дозе 30 мг/кг, Адриамицин в дозе 0,5%, Цисплатин в дозе 1,2 мг/кг, Гемцитабин в дозе 100 мг/кг. Препараты вводились в субтерапевтических дозах внутривенно. Режимы введения и полученные результаты представлены в таблице 8, 9 и 10.


Вывод: результаты эксперимента, представленные в таблице 8, свидетельствуют о том, что применение композиции в дозах 10 мг/кг и 20 мг/кг в комбинированной терапии Меланомы В16 с применением препаратов Циклофосфан в дозе 30 мг/кг и Цисплатин в дозе 1,2 мг/кг повышает антиметастатический эффект терапии, о чем свидетельствует достоверное повышение индекса ингибирования метастазов до 71% и 62% соответственно.

Выводы:
- при включении композиции в дозе 10 мг/кг в схему терапии Лейкемии Р388 с применением цитостатика Циклофосфан в дозе 60 мг/кг повышает эффективность противоопухолевой терапии, о чем свидетельствует увеличение количества излеченных животных с 18% до 95% и их продолжительности жизни с 126% до 184%;
- при включении композиции в дозе 20 мг/кг в схему терапии Лейкемии Р388 с применением цитостатика Цисплатин в дозе 1,2 мг/кг повышает эффективность противоопухолевой терапии, о чем свидетельствует увеличение количества излеченных животных с 5% до 24% и их продолжительности жизни с 136% до 174%;
- при включении композиции в дозе 20 мг/кг в схему терапии Лейкемии Р388 с применением цитостатика Адриамицин в дозе 0,5 мг/кг повышает эффективность противоопухолевой терапии, о чем свидетельствует увеличение количества излеченных животных с 2% до 10% и их продолжительности жизни с 143% до 173%.

Вывод: результаты эксперимента, представленные в таблице 10, свидетельствуют о том, что при добавлении композиции в дозе 20 мг/кг в схему противоопухолевой терапии Карциномы LL с применением цитостатика Гемцитабин (100 мг/кг) в целом повышает антиметастатическую эффективность терапии. При этом индекс ингибирования метастазов достоверно повышается до 94% по сравнению с показателями ИИМ 64% и ИИМ 38% при монотерапии препаратом Гемцитабин и заявляемой композиции соответственно.
Опыт 6. Изучение иммуномодулирующего действия заявленной композиции на фоне вторичного иммунодефицита, вызванного введением препарата Циклофосфан, на модели перевиваемой солидной опухоли меланомы В-16
В опыте использована модель перевиваемой солидной меланомы В-16, растущей в сингенных условиях под кожей мышей линии C57B1/6J (В6). С целью моделирования солидной меланомой В-16 3-месячных самцов мышей линии В-16 прививали подкожно 0,2 мл 10% (вес/объем) взвеси клеток меланомы В-16 в день 0. Группы формировались по 10 особей в каждой.
На 6 сутки после прививки опухоли вводили препарат Циклофосфан (ЦФ) однократно внутрибрюшинно в дозе 200 мг/кг, композицию - однократно внутрибрюшинно в дозе 50 мг/кг. Композицию вводили из расчета 0,2 мл 0,5% раствора на 20 г массы животного - в этом объеме препарат не приводит к нагрузке на почки. Внутрибрюшинный путь введения для введения композиции с высоким содержанием (1) - 50 мг/кг использован в связи с тем, что внутривенное введение испытуемого раствора в концентрации 0,5% (0,2 мл на мышь 20 г) сразу после введения вызывает судороги и гибель животных.
На 9 день после введения испытуемых препаратов животных умерщвляли, извлекали опухоли и селезенку. Клетки селезенки использованы в тесте локального адоптивного переноса для определения общей (тотальной) клеточности селезенки (таблица 11).

Как видно из представленных результатов в использованных условиях, лечение на 6 сутки после прививки опухолевых клеток - однократное внутрибрюшинное введение заявляемой композиции в дозе 50 мг/кг привело к резкому торможению роста опухоли. Следует отметить низкую вариабельность и при достаточном уровне достоверности показателя общей клеточности селезенки в опытной группе животных, получавших комбинацию препаратов по сравнению с аналогичным показателем при введении одного препарата Циклофосфан в дозе 200 мг/кг, где данный показатель имел значительный разброс.
Опыт 7. Исследование влияния заявляемой композиции на противоопухолевый иммунитет (на специфический клеточный иммунный ответ на опухоль) - тест локального адоптивного переноса
В работе использовали композицию и препарат Циклофосфан (ЦФ). Образцы хранили при температуре +5°C в защищенном от света месте. Непосредственно пред введением готовили растворы необходимой концентрации. Препараты вводили мышам внутрибрюшинно. Использовали молодых 2-3-месячных половозрелых мышей линии C57B1/6J. Использовали штаммы перевиваемых опухолей: меланома В16. Штаммы хранились в жидком азоте при температуре -196°C. После разморозки штаммы поддерживали пассажами in vivo в сингенных условиях на мышах линии C57B1/6J: меланому В-16 серийными перевивками под кожу.
Для изучения специфического клеточного иммунного ответа на опухоль мышей-доноров прививали в день 0 под кожу 0,2 мл 10% (вес/объем) взвеси опухоли В-16 [Софьина З.П., Сыркин А.Б., Голдин А., Кляйн А., 1980] и, затем, мышей рандомизировали. На 4 день мышам соответствующих групп вводили Циклофосфан в дозе 200 мг/кг. На 8 день мышам соответствующих групп вводили композицию с содержанием (1) 50 мг/кг. Доноры были забиты на 11 день, из них извлекли селезенки для постановки теста локального переноса (местный нейтрализационный тест по Winn'y). Как селезенки, так и опухолевый материал подвергали гомогенизации в среде 199 при помощи стеклянного стерильного гомогенизатора для тканей, фильтровали при помощи стерильного пластикового фильтра от системы переливания крови, держали на холоду, производили подсчет клеток в камере Горяева. Клетки селезенки и опухоли (меланома В-16) смешивали непосредственно перед введением мышам в соотношении 50:1, инокулят вводили реципиентам под кожу в объеме 0,2-0,5 мл. Доза опухолевых клеток составляла 1 млн на мышь. В эксперименте 8 групп по 10 животных.
Группа 1 - контроль роста меланомы В-16
Группа 2 - клетки селезенки интактных мышей + клетки меланомы В-16
Группа 3 - клетки селезенки мышей с В-16 + клетки меланомы В-16
Группа 4 - клетки селезенки мышей с В-16, получавших ЦФ + клетки меланомы В-16
Группа 5 - клетки селезенки мышей с В-16, получавших ЦФ и композицию + клетки меланомы В-16
Группа 6 - клетки селезенки мышей с В-16, получавших композицию + клетки меланомы В-16
О влиянии донорских селезеночных клеток на темп роста опухоли у реципиентов судили по массе опухоли. Для этого, спустя 10 дней после введения инокулята, мышей забивали, извлекли опухоли и определили их вес. Полученные результаты обрабатывали статистически. Достоверность различия средних определяли по критерию t Стьюдента. Достоверность различия в выживаемости определяли по непараметрическому U-критерию Вилкоксона. За достоверное принимали различия при p≤0,05.
Данные теста локального адоптивного переноса представлены в таблице 12. Так, средняя масса опухоли у мышей-реципиентов, которым к опухолевым клеткам добавляли клетки селезенки нелеченых мышей с меланомой В-16 (группа 3) значительно выше, чем у животных, которым к опухолевым клеткам добавляли клетки селезенки интактных (не прививали опухоль и не вводили препараты (группа 2), что указывает на способность клеток селезенки нелеченых мышей стимулировать рост меланомных клеток. Циклофосфан (группа 4) еще более усилил эту отрицательную способность селезеночных клеток. Композиция (группа 5) наоборот, уменьшила отрицательное действие Циклофосфана. Наибольший интерес вызвали результаты действия одной композиции (группа 6), когда клетки селезенки мышей-доноров, леченных композицией, существенно затормозили рост опухоли у мышей-реципиентов.

Полученные данные указывают на способность заявленной композиции усиливать специфический противоопухолевый иммунитет за счет формирования противоопухолевой резистентности в организме мышей с опухолью, а также корректировать иммунодепрессивное влияние цитостатиков.
Таким образом, заявляемая фармацевтическая композиция проявляет выраженное противоопухолевое и антиметастатическое действие при курсовом парентеральном введении терапевтически эффективных доз и может быть использована при лечении широкого спектра злокачественных опухолей.

