Результат интеллектуальной деятельности: АНТИТЕЛО ПРОТИВ ГЛИПИКАНА 3
Вид РИД
Изобретение
Предпосылки создания изобретения
Область изобретения
Настоящее изобретение относится к антителу против глипикана 3, к ингибитору клеточного роста и к противораковому средству, которые содержат антитело в качестве активного ингредиента.
Описание родственной области
Глипикан 3 (GPC3) является членом глипиканового семейства гепарансульфатпротеогликанов, которые присутствуют на клеточной поверхности. Это позволяет предположить, что GPC3 участвует в клеточном делении при развитии или росте раковых клеток, однако его функция еще не вполне ясна.
Было обнаружено, что определенный тип антител, связывающихся с GPC3, ингибирует клеточный рост посредством антителозависимой клеточноопосредованной цитотоксичности (ADCC) и комплементзависимой цитотоксичности (CDC) (международная патентная заявка WO 2003/000883). Кроме того, полагают, что GPC3 расщепляется in vivo и поступает в кровь в виде секретируемой формы GPC3, следовательно, рак можно диагностировать с помощью антител, способных связываться с секретируемой формой GPC3 (международные патентные заявки WO 2004/022739, WO 03/100429 и WO 2004/018667).
Для разработки противоракового средства на основе цитотоксичной активности антитела предпочтительно, чтобы используемое антитело обладало высокой ADCC-активностью или CDC-активностью. Соответственно, требуется антитело против GPC3, обладающее высокой цитотоксичностью, как антитело, распознающее GPC3.
Целью настоящего изобретения является предоставление антитела против GPC3, которое обладает более высокой ADCC-активностью и CDC-активностью, чем традиционное антитело.
Краткое описание изобретения
Авторам настоящего изобретения удалось получить антитело с более высокой цитотоксичностью, чем у традиционного антитела против глипикана 3. Кроме того, авторы анализировали эпитопы такого антитела, и им удалось определить участки GPC3, распознаваемые антителом с высокой цитотоксической активностью.
В одном аспекте настоящее изобретение предлагает антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий участки CDR 1, 2 и 3 по любому из пунктов (1)-(12):
(1) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 123, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 124, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 125;
(2) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 109, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 110, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 111;
(3) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 106, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 107, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 108;
(4) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 132, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 133, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 134;
(5) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 106, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 135, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 136;
(6) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 126, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 127, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 128;
(7) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 129, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 130, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 131;
(8) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 103, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 104, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 105;
(9) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 118, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 121, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 122;
(10) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 115, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 116, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 117;
(11) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 112, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 113, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 114; или
(12) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 118, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 119, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 120.
В другом аспекте данное изобретение предлагает антитело, включающее в себя вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3 по любому из пунктов (1)-(13):
(1) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 143, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 144, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 158;
(2) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 143, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 144, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 145;
(3) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 140, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 141, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 142;
(4) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 167, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 168, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 169;
(5) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 170, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 144, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 171;
(6) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 159, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 160, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 161;
(7) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 162, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 147, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 163;
(8) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 164, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 165, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 166;
(9) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 137, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 138, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 139;
(10) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 155, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 156, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 157;
(11) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 149, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 150, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 151;
(12) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 146, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 147, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 148; или
(13) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 152, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 153, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 154.
Предпочтительно, антитело данного изобретения выбрано из группы, состоящей из антител по любому из пунктов (1)-(13):
(1) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 143, 144 и 158, соответственно;
(2) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 109, 110 и 111, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 143, 144 и 145, соответственно;
(3) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 106, 107 и 108, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 140, 141 и 142, соответственно;
(4) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 132, 133 и 134, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 167, 168 и 169, соответственно;
(5) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 106, 135 и 136, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 170, 144 и 171, соответственно;
(6) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 126, 127 и 128, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 159, 160 и 161, соответственно;
(7) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 129, 130 и 131, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 162, 147 и 163, соответственно;
(8) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 129, 130 и 131, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 164, 165 и 166, соответственно;
(9) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 103, 104 и 105, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 137, 138 и 139, соответственно;
(10) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 118, 121 и 122, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 155, 156 и 157, соответственно;
(11) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 115, 116 и 117, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 149, 150 и 151, соответственно;
(12) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 112, 113 и 114, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 146, 147 и 148, соответственно; и
(13) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 118, 119 и 120, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 152, 153 и 154, соответственно.
В другом аспекте данное изобретение предлагает антитело, содержащее вариабельный участок тяжелой цепи по любому из пунктов (1)-(7):
(1) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 84;
(2) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 85;
(3) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 86;
(4) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 87;
(5) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 88;
(6) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 89; или
(7) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 90.
В другом аспекте данное изобретение предлагает антитело, содержащее вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 92.
Предпочтительно, антитело данного изобретения выбрано из группы, состоящей из антител по любому из пунктов (1)-(7):
(1) антитело, включающее в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 84, и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 92;
(2) антитело, включающее в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 85, и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 92;
(3) антитело, включающее в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 86, и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 92;
(4) антитело, включающее в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 87, и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 92;
(5) антитело, включающее в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 88, и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 92;
(6) антитело, включающее в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 89, и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 92; и
(7) антитело, включающее в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 90, и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 92.
В другом аспекте данное изобретение предлагает антитело, включающее в себя вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3 по любому из пунктов (1)-(15):
(1) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 174, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 144, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 158;
(2) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 175, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 144, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 158;
(3) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 176, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 144, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 158;
(4) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 177, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 144, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 158;
(5) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 178, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 144, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 158;
(6) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 179, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 144, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 158;
(7) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 180, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 144, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 158;
(8) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 181, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 144, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 158;
(9) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 182, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 144, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 158;
(10) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 183, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 144, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 158;
(11) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 184, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 144, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 158;
(12) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 185, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 144, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 158;
(13) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 186, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 144, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 158;
(14) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 187, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 144, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 158; или
(15) CDR1, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 188, CDR2, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 144, и CDR3, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 158.
В другом аспекте данное изобретение предлагает антитело, выбранное из группы, состоящей из антител пунктов (1)-(15):
(1) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 174, 144 и 158, соответственно;
(2) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 175, 144 и 158, соответственно;
(3) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 176, 144 и 158, соответственно;
(4) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 177, 144 и 158, соответственно;
(5) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 178, 144 и 158, соответственно;
(6) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 179, 144 и 158, соответственно;
(7) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 180, 144 и 158, соответственно;
(8) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 181, 144 и 158, соответственно;
(9) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 182, 144 и 158, соответственно;
(10) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 183, 144 и 158, соответственно;
(11) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 184, 144 и 158, соответственно;
(12) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 185, 144 и 158, соответственно;
(13) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 186, 144 и 158, соответственно;
(14) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 187, 144 и 158, соответственно; и
(15) антитело, включающее в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 188, 144 и 158, соответственно.
В следующем аспекте данное изобретение предлагает антитело, содержащее вариабельный участок легкой цепи, выбранный из вариабельных участков (1)-(15):
(1) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 191;
(2) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 192;
(3) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 193;
(4) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 194;
(5) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 195;
(6) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 196;
(7) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 197;
(8) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 198;
(9) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 199;
(10) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 200;
(11) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 201;
(12) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 202;
(13) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 203;
(14) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 204; и
(15) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 205.
В другом аспекте данное изобретение предлагает антитело, содержащее вариабельный участок легкой цепи, выбранный из группы, состоящей из вариабельных участков (1)-(15):
(1) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 191;
(2) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 192;
(3) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 193;
(4) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 194;
(5) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 195;
(6) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 196;
(7) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 197;
(8) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 198;
(9) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 199;
(10) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 200;
(11) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 201;
(12) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 202;
(13) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 203;
(14) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 204; и
(15) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 205;
и вариабельный участок тяжелой цепи, выбранный из группы, состоящей из вариабельных участков (1)-(7):
(1) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 84;
(2) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 85;
(3) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 86;
(4) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 87;
(5) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 88;
(6) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 89; и
(7) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 90.
Вариабельный участок тяжелой цепи (H), вариабельный участок легкой цепи (L) и аминокислотная последовательность CDR 1, 2 и 3, а также номера SEQ ID NO приведены в таблице ниже.
|
|
|
Кроме того, в данном изобретении описывается антитело, обладающее активностью, эквивалентной активности описанного выше антитела, и имеющее описанную выше аминокислотную последовательность, в которой один или несколько аминокислотных остатков замещены, удалены или добавлены и/или вставлены.
Предпочтительно, антитело данного изобретения представляет собой гуманизированное антитело.
Так, в другом аспекте данное изобретение предлагает гуманизированное антитело, способное связываться с глипиканом 3.
В следующем аспекте данное изобретение предлагает антитело, способное связываться с пептидом, состоящим из последовательности аминокислотных остатков 524-563 глипикана 3.
Предпочтительно, антитело данного изобретения способно связываться с пептидом, состоящим из последовательности аминокислотных остатков 537-563 глипикана 3. Более предпочтительно, антитело данного изобретения не связывается с пептидом, состоящим из последовательности аминокислотных остатков 550-563 глипикана 3.
Предпочтительно, антитело способно связываться с пептидом, состоящим из последовательности аминокислотных остатков 544-553 глипикана 3, или с пептидом, состоящим из последовательности аминокислотных остатков 546-551 глипикана 3.
В следующем аспекте данное изобретение предлагает антитело, способное связываться с эпитопом, с которым может связываться вторичное антитело, где упомянутое вторичное антитело включает в себя вариабельный участок тяжелой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, соответственно, и вариабельный участок легкой цепи, содержащий CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 143, 144 и 158, соответственно. А именно, антитело данного изобретения может конкурировать с вторичным антителом за связывание с GPC3.
В предпочтительном воплощении антитело данного изобретения может связываться с глипиканом 3 и обладает высокой CDC-активностью по отношению к клеткам, экспрессирующим глипикан 3, и/или высокой ADCC-активностью по отношению к клеткам, экспрессирующим глипикан 3.
В другом аспекте данное изобретение предлагает полинуклеотид, кодирующий вариабельный участок тяжелой цепи или вариабельный участок легкой цепи антитела данного изобретения.
Предпочтительно, полинуклеотид данного изобретения имеет последовательность, описанную в SEQ ID NO: 11-21, 33-43, 55-59, 65-70 и 77-83.
В следующем аспекте данное изобретение предлагает ингибитор клеточного роста и противораковое средство, содержащие в качестве активного ингредиента антитело данного изобретения. Предпочтительно, противораковое средство данного изобретения используют для лечения гепатомы.
В следующем аспекте данное изобретение предлагает пептид, содержащий последовательность аминокислотных остатков 524-563 глипикана 3, последовательность аминокислотных остатков 537-563 глипикана 3, последовательность аминокислотных остатков 544-553 глипикана 3 или последовательность аминокислотных остатков 546-551 глипикана 3.
Краткое описание рисунков
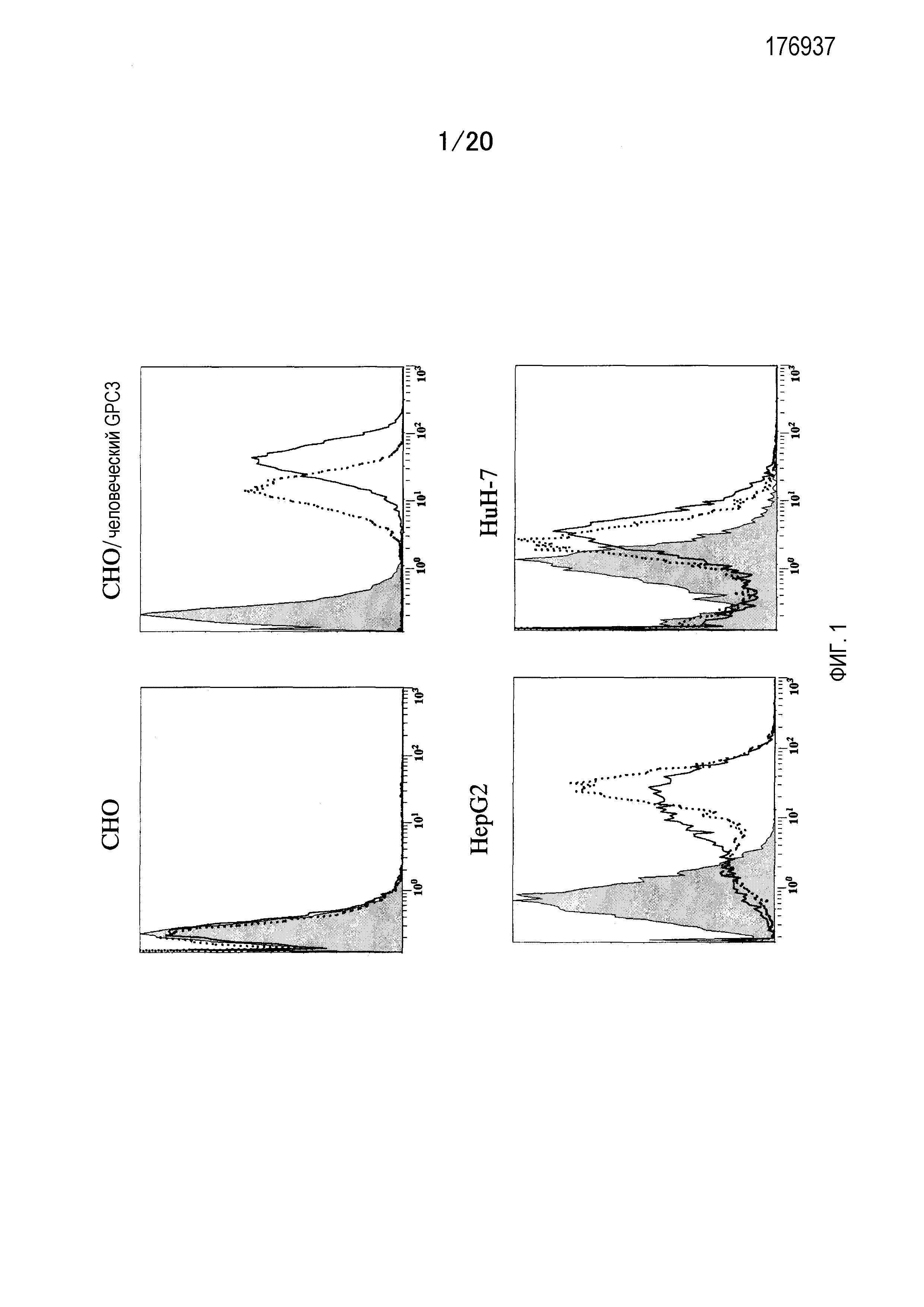
На фиг.1 показана связывающая активность антитела против GPC3 в клетке CHO, клетке CHO, экспрессирующей полноразмерные GPC3, HepG2 и HuH-7, измеренная с помощью проточной цитометрии. M1E7 (сплошная линия) и M11F1 (пунктирная линия) используют в концентрации 5 мкг/мл, соответственно.
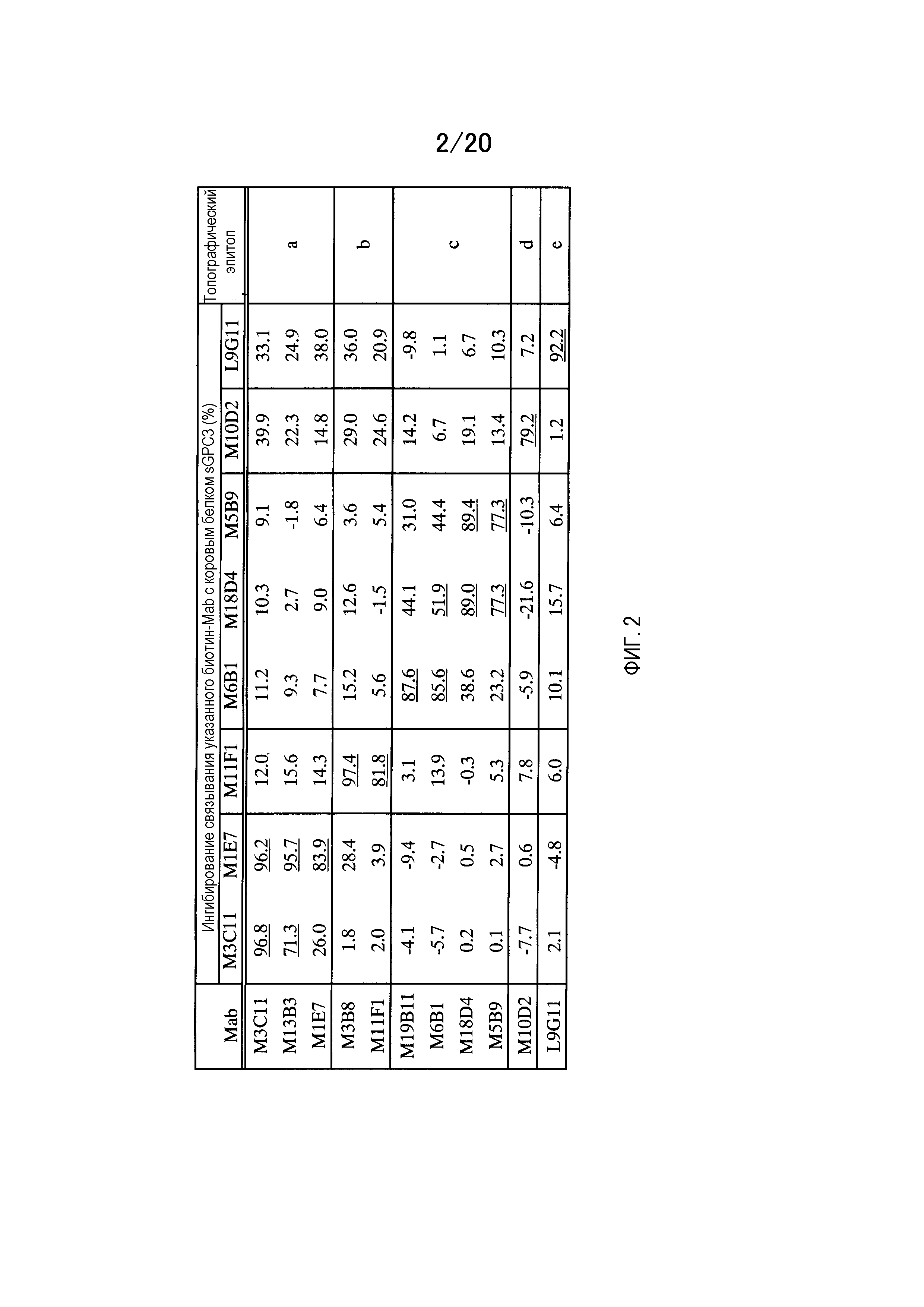
На фиг.2 приведена таблица, демонстрирующая результаты классификации по эпитопам, полученные с помощью конкурентного анализа ELISA. Степень конкурентного ингибирования связывания биотинилированного антитела против GPC3 приведена в процентах. Эпитопы подразделяют на 5 групп, от a до e, в соответствии с характером конкурентного ингибирования.
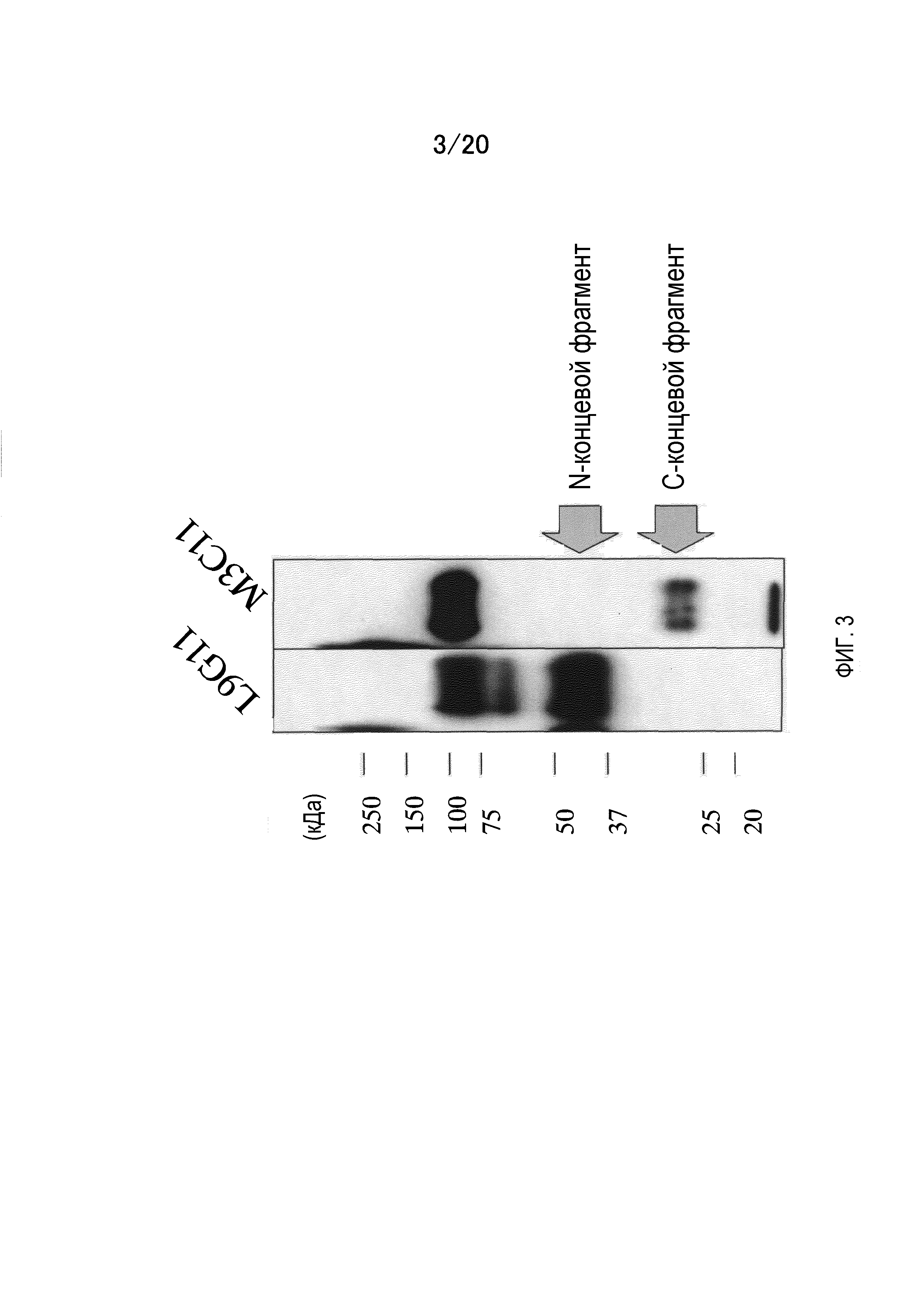
На фиг.3 приведены результаты вестерн-блоттинга, которые показывают, с каким фрагментом растворимой формы корового белка GPC3 связывается антитело против GPC3: с N-концевым фрагментом размером 40 кДа или с C-концевым фрагментом размером 30 кДа. Было обнаружено, что L9G11 связывается с N-концевым фрагментом, а M3C11 связывается с С-концевым фрагментом.
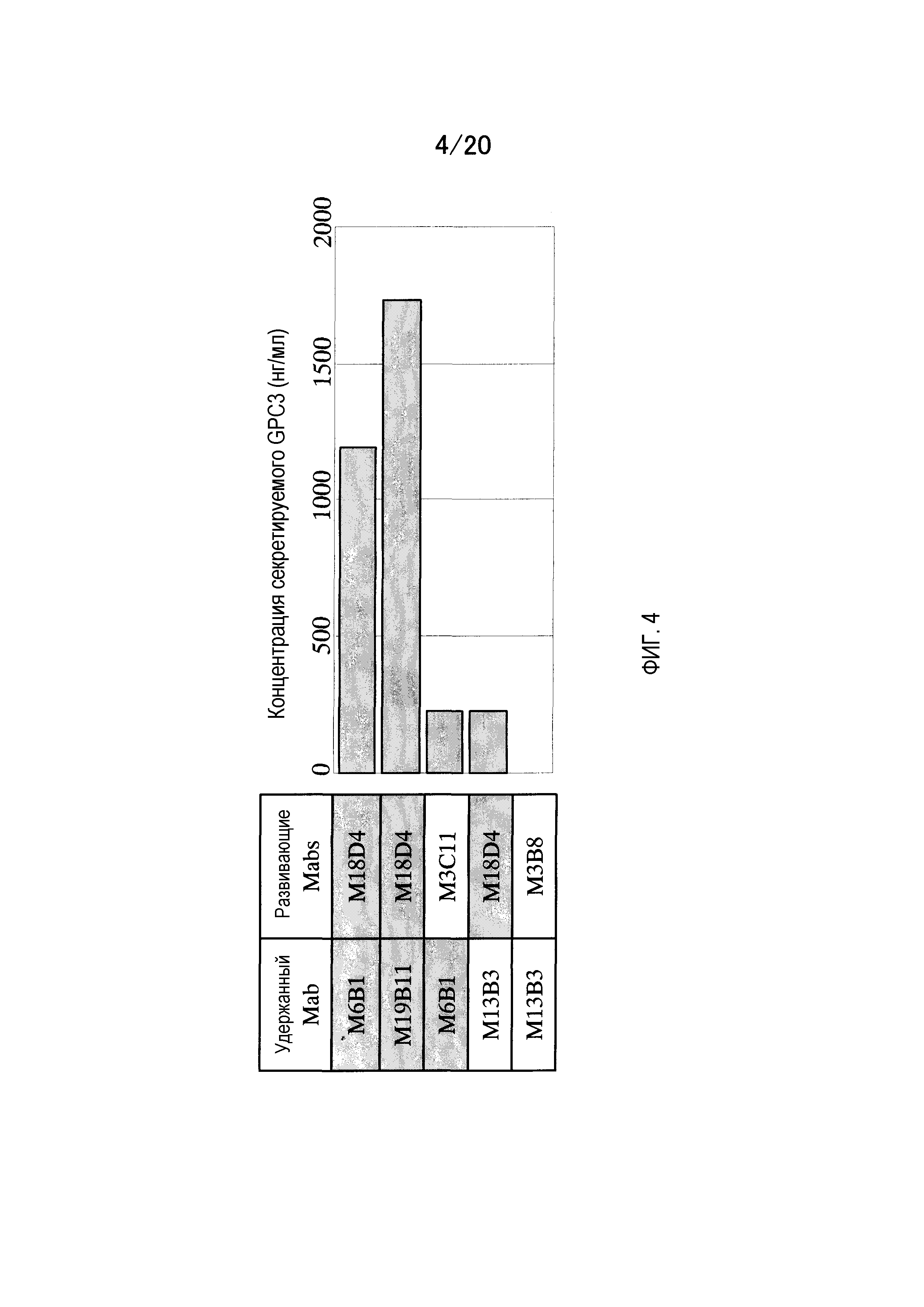
На фиг.4 показаны результаты детекции секретируемой формы GPC3 в культуральном супернатанте HepG2 с помощью сэндвич-метода ELISA. Секретируемая форма хорошо детектируется при использовании сочетания антител, которые связываются с N-концевым фрагментом, таким как M6B1, M18D4 или M19B11, и плохо детектируется при использовании сочетания антител, которые связываются с С-концевым фрагментом, таким как M3C11, M13B3 или M3B8.
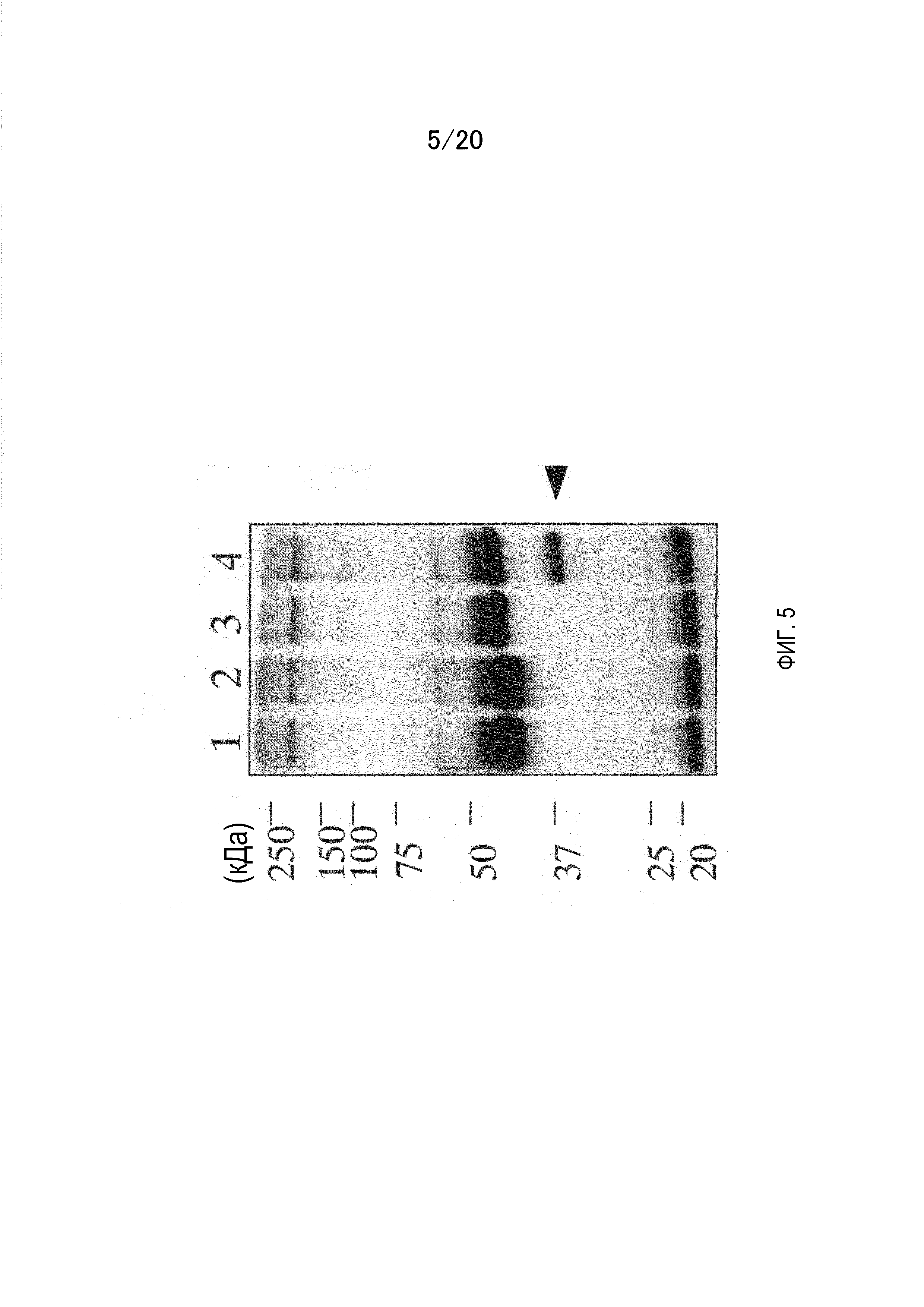
На фиг.5 показаны результаты иммунопреципитации культурального супернатанта HepG2 с использованием антитела против GPC3 и детекции секретируемой формы GPC3. Среду в качестве контроля (линии 1 и 3) и культуральный супернатант HepG2 (линии 2 и 4) подвергают иммунопреципитации с использованием M1E7 (линии 1 и 2) и M10D2 (линии 3 и 4). Секреторный GPC3 детектируют с помощью M10D2, который связывается с N-концевым фрагментом.
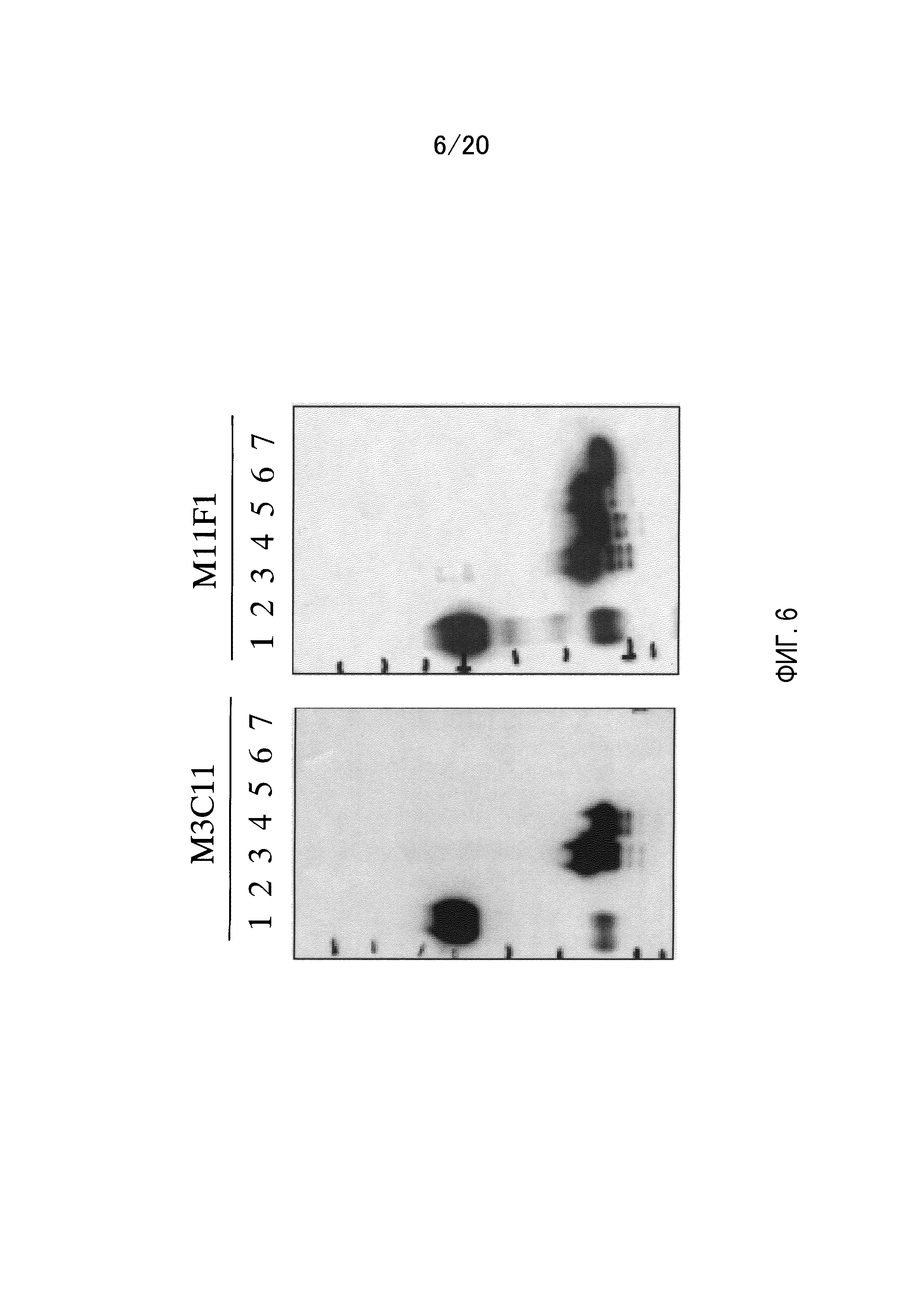
На фиг.6 показаны результаты анализа эпитопа антител, который связывается с C-концевым фрагментом GPC3, методом вестерн-блоттинга с использованием гибридного белка C-концевого пептида GPC3 и GST. Коровый белок растворимой формы GPC3 (линия 1), GST (линия 2), GC-1 (линия 3), GC-2 (линия 4), GC-3 (линия 5), GC-4 (линия 6) и GC-5 (линия 7) подвергают SDS-электрофорезу в восстанавливающих условиях и детекции методом вестерн-блоттинга с использованием M3C11 и M11F1.
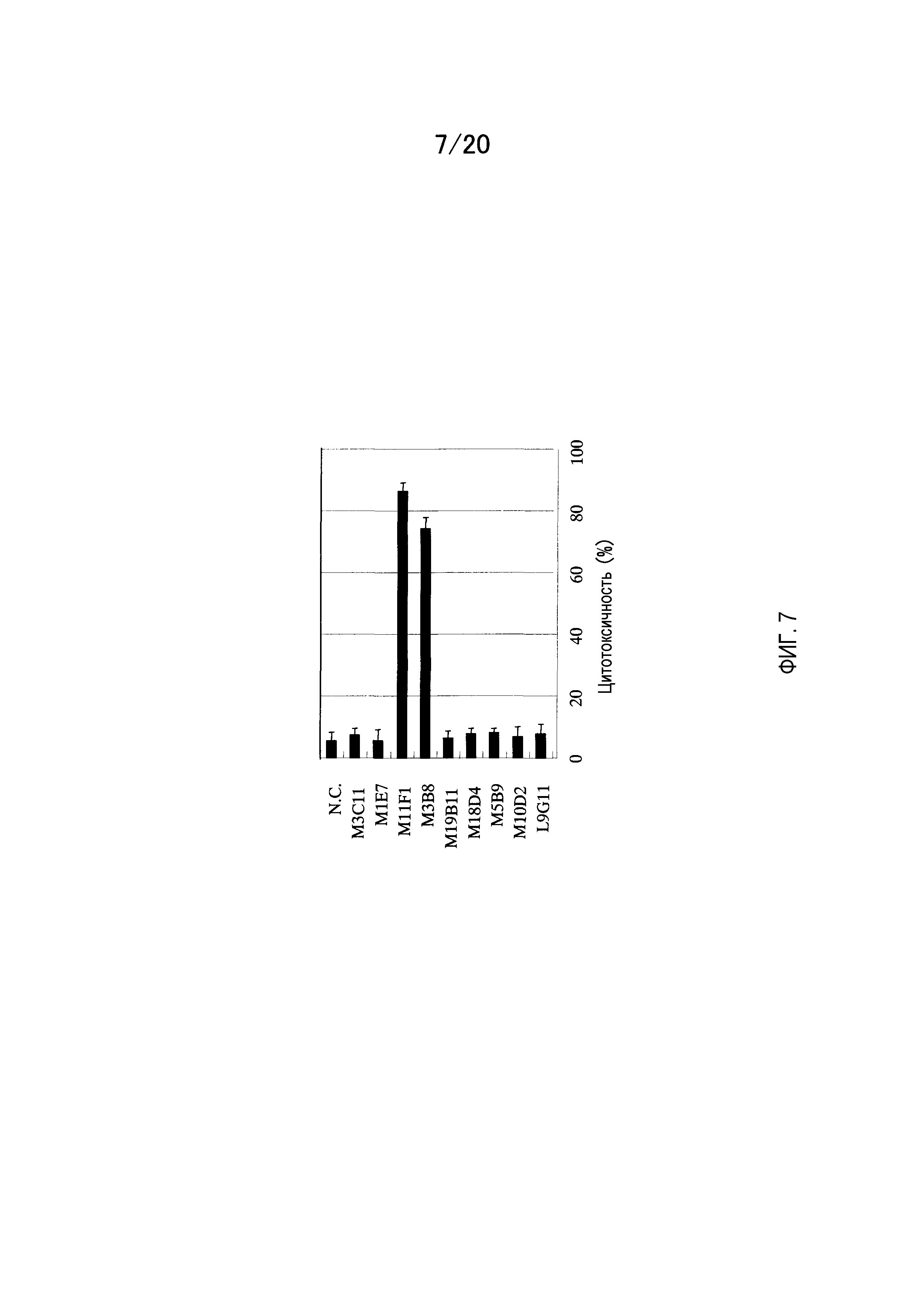
На фиг.7 показаны результаты измерения активности CDC мышино-человеческого химерного антитела против GPC3 на клетках CHO, которые экспрессируют GPC3.
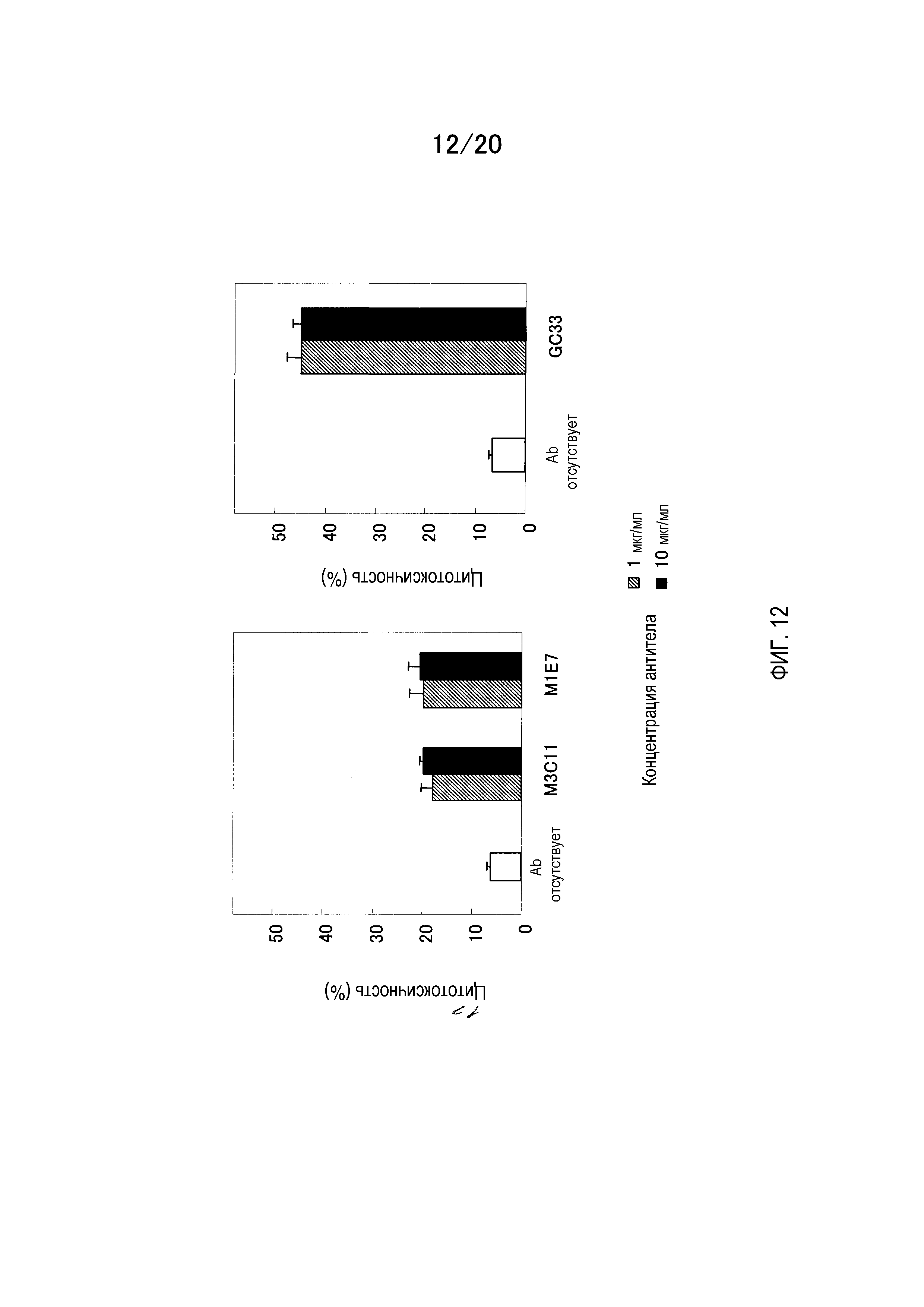
На фиг.8 показаны результаты измерения активности ADCC мышино-человеческого химерного антитела против GPC3 на клетках CHO, которые экспрессируют GPC3 и HepG2.
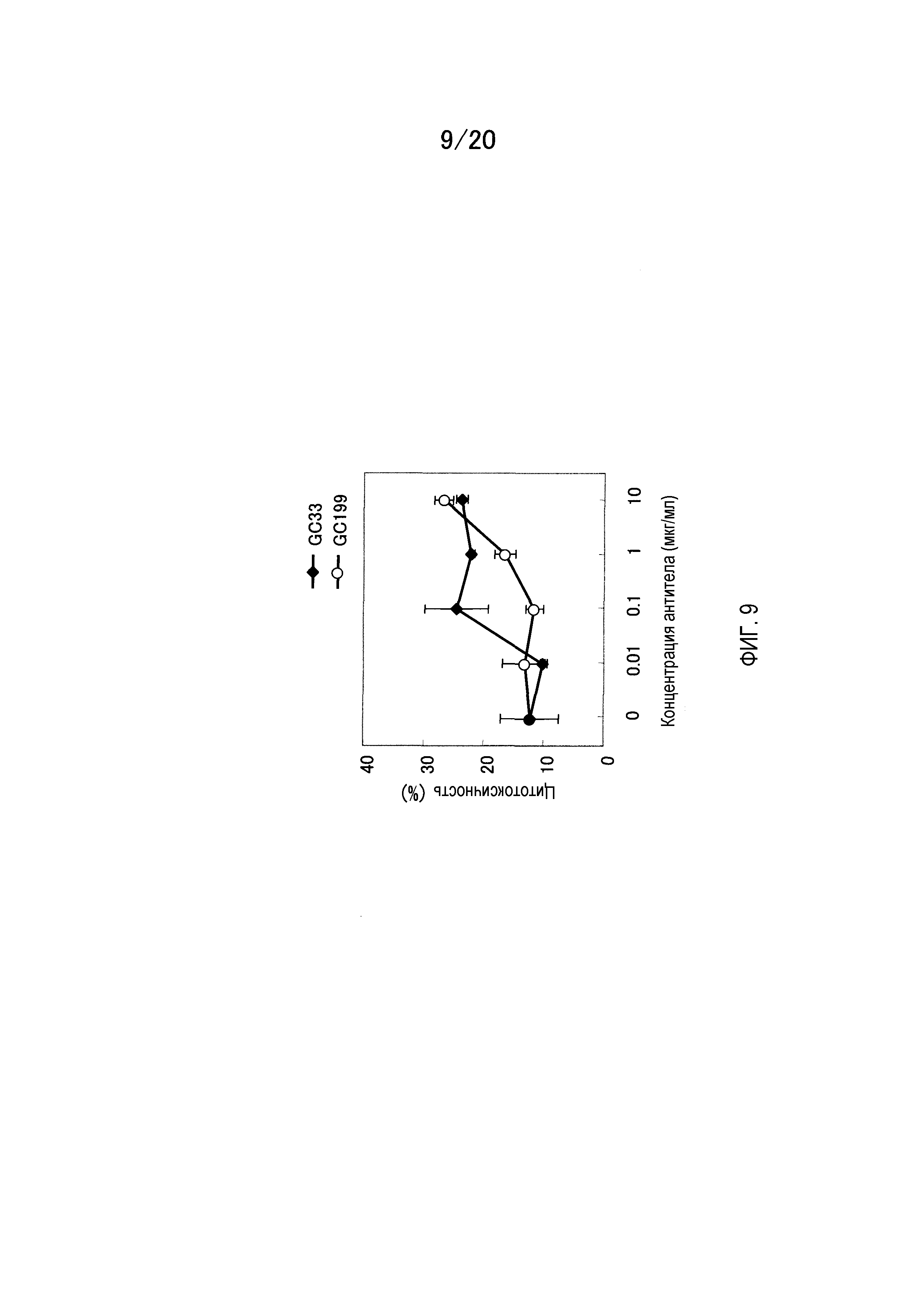
На фиг.9 показаны результаты измерения активности ADCC GC33 на клеточной линии человеческой гепатомы, HuH-7, с использованием эффекторных клеток мышиного костного мозга.
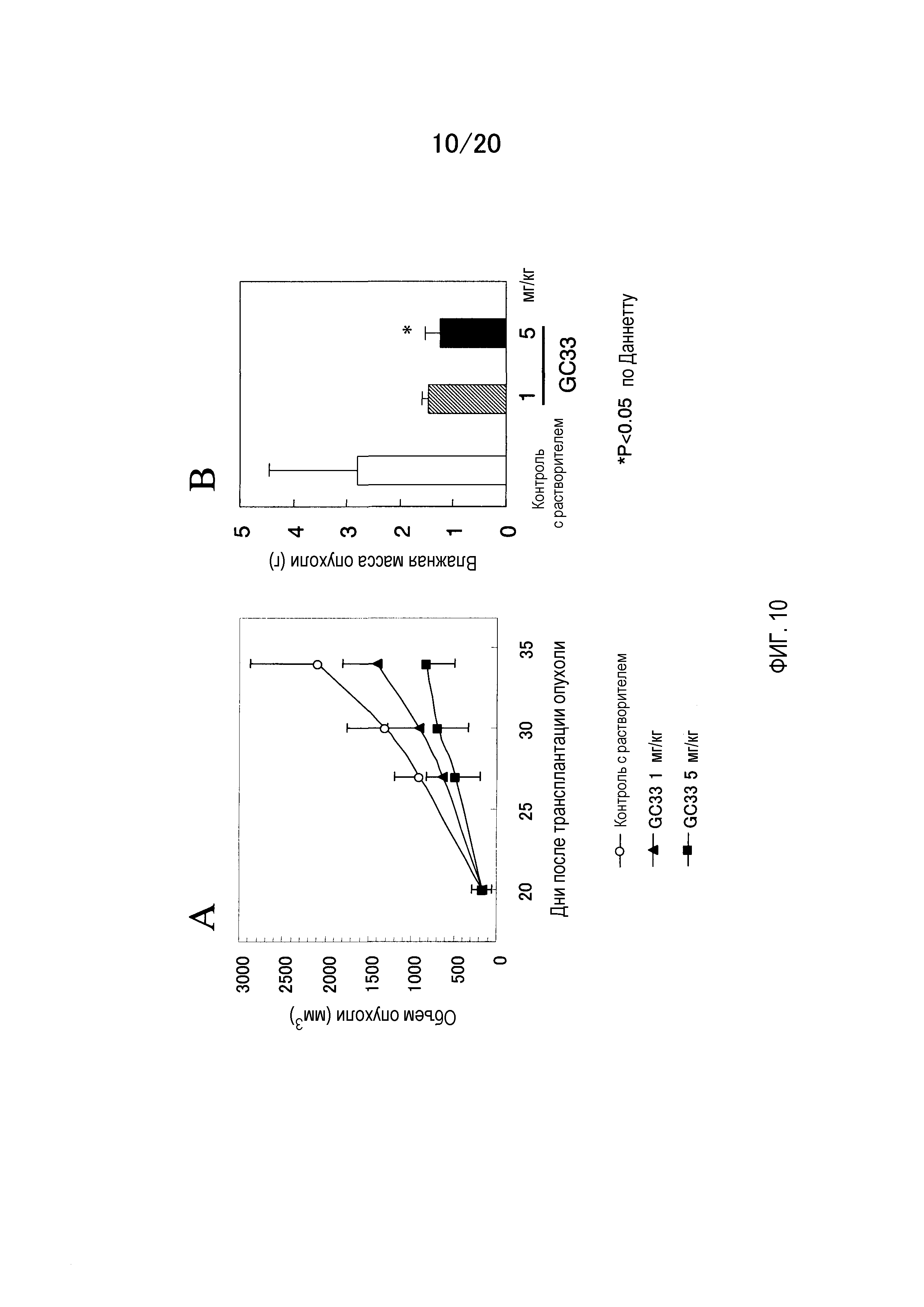
На фиг.10 показаны результаты измерения противоопухолевой активности антитела GC33 на мышиной модели с трансплантированной гепатомой человека.
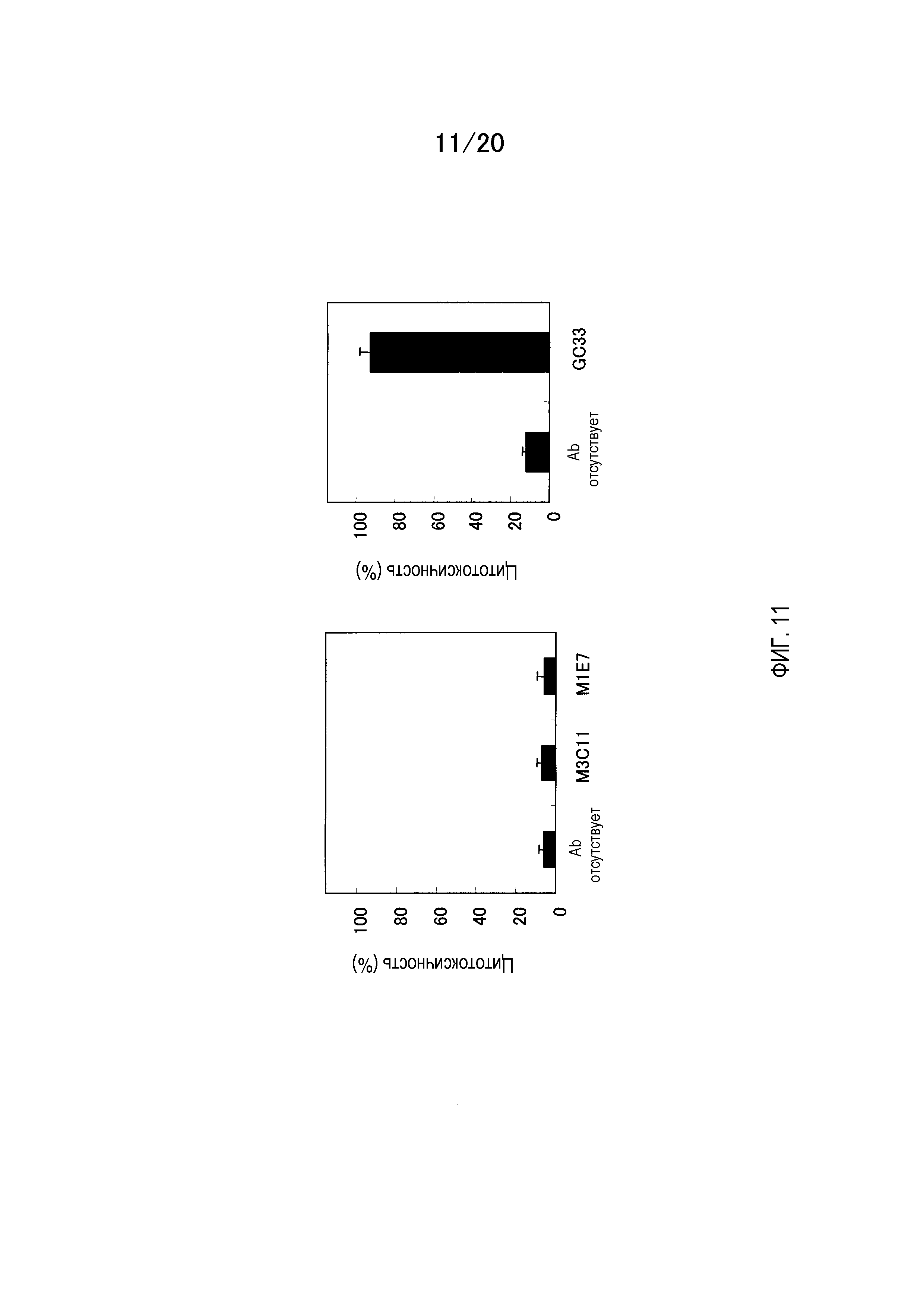
На фиг.11 показаны результаты измерения активности CDC мышино-человеческого химерного антитела GC33 на клетках CHO, которые экспрессируют GPC3.
На фиг.12 показаны результаты измерения активности ADCC мышино-человеческого химерного антитела GC33 на HepG2.
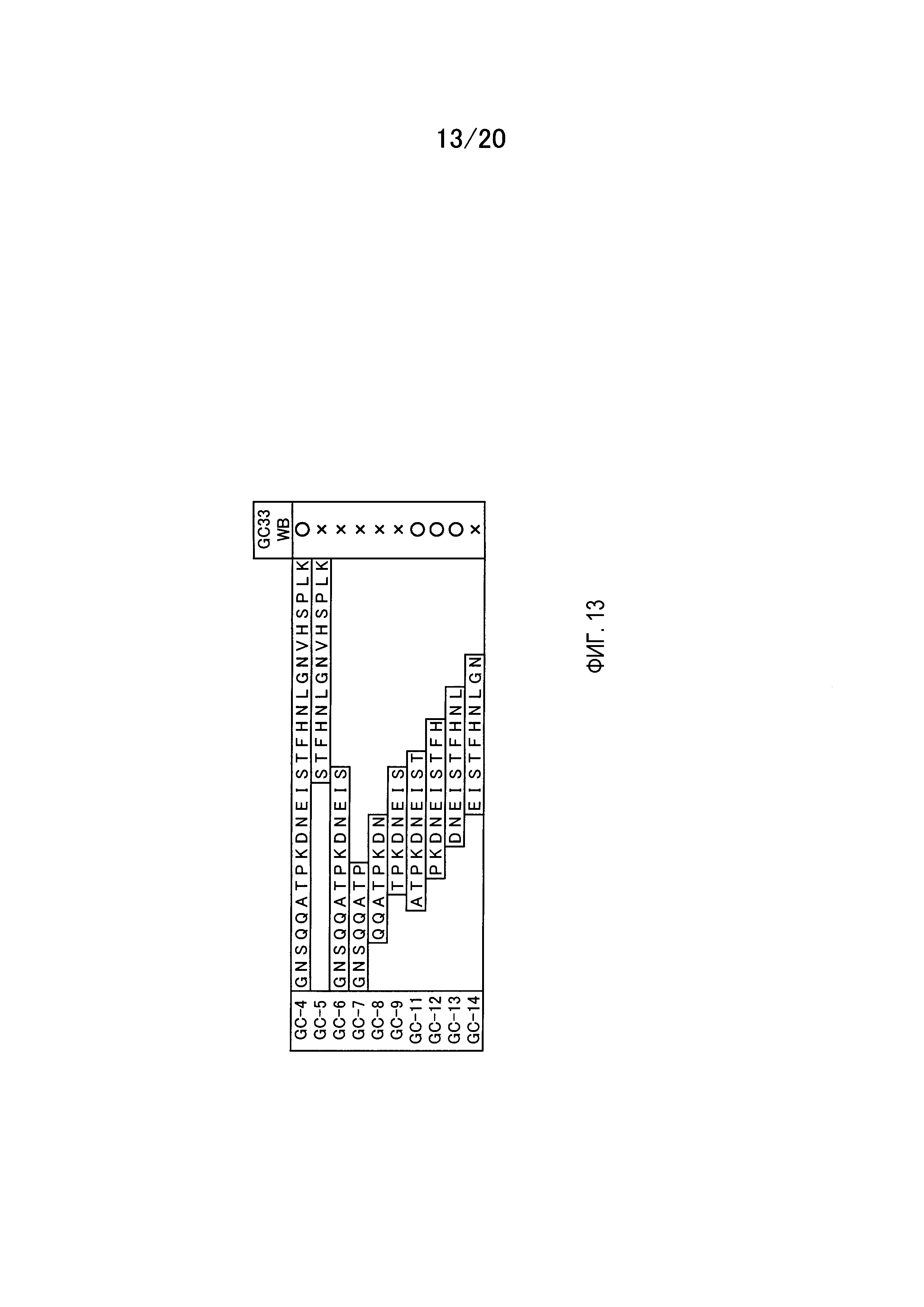
На фиг.13 показаны последовательности GPC3, содержащиеся в белках, гибридизованных с GST (GC-4, 5, 6, 7, 8, 9, 11, 12, 13 и 14), полученные для анализа эпитопа GC33.
На фиг.14 показаны результаты вестерн-блоттинга с использованием GC33 после разделения GST, GC-7, 8, 9, 11, 12, 13 и 14 методом SDS-PAGE в восстанавливающих условиях.
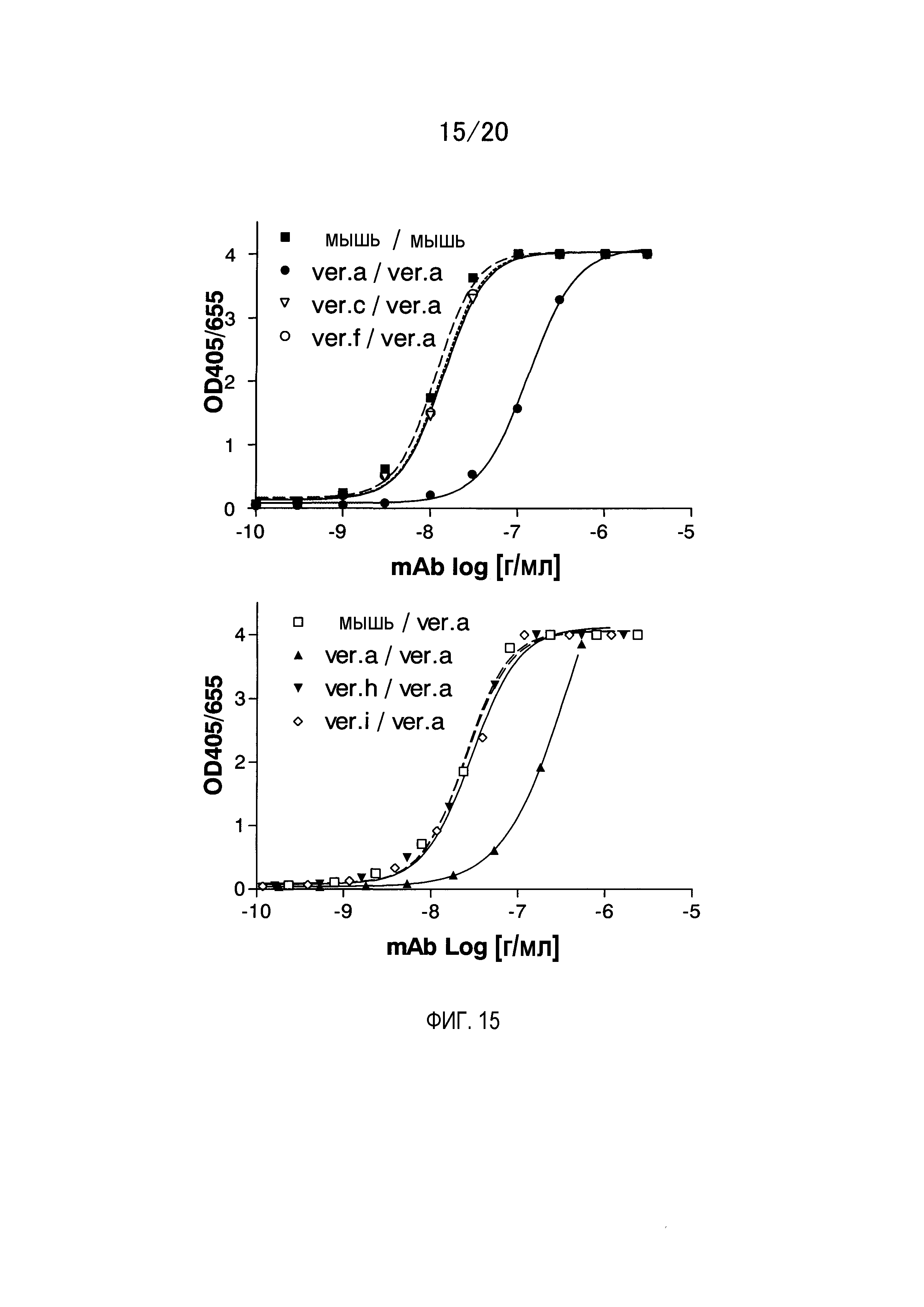
На фиг.15 показаны результаты измерения связывающей активности гуманизированного GC33 по отношению к GPC3 методом ELISA.
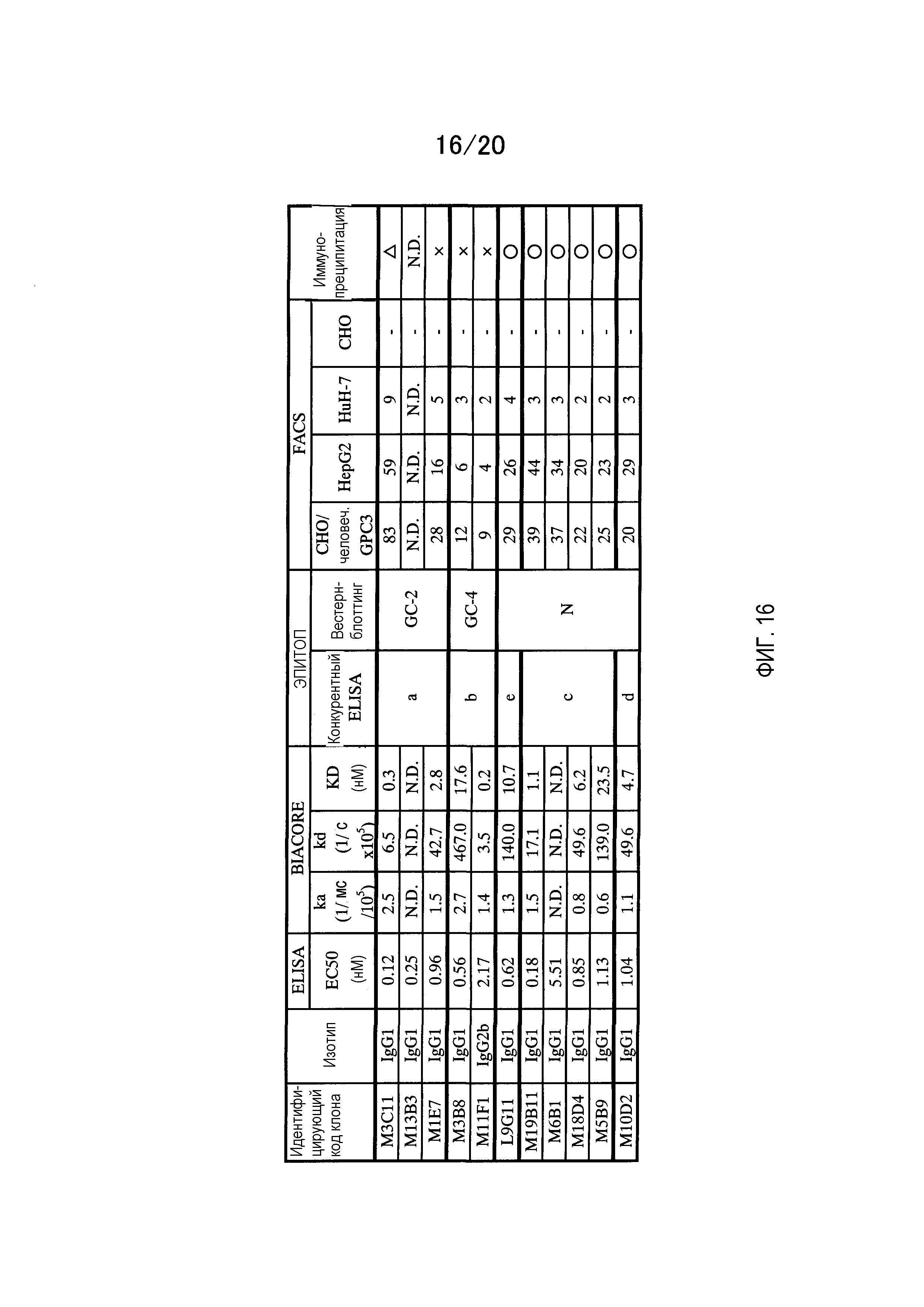
На фиг.16 приведена таблица антител, в которую включены изотипы и результаты ELISA, BIAcore, FACS, эпитопного анализа и иммунопреципитации для клонов, полученных из мышей, иммунизированных растворимой формой GPC3.
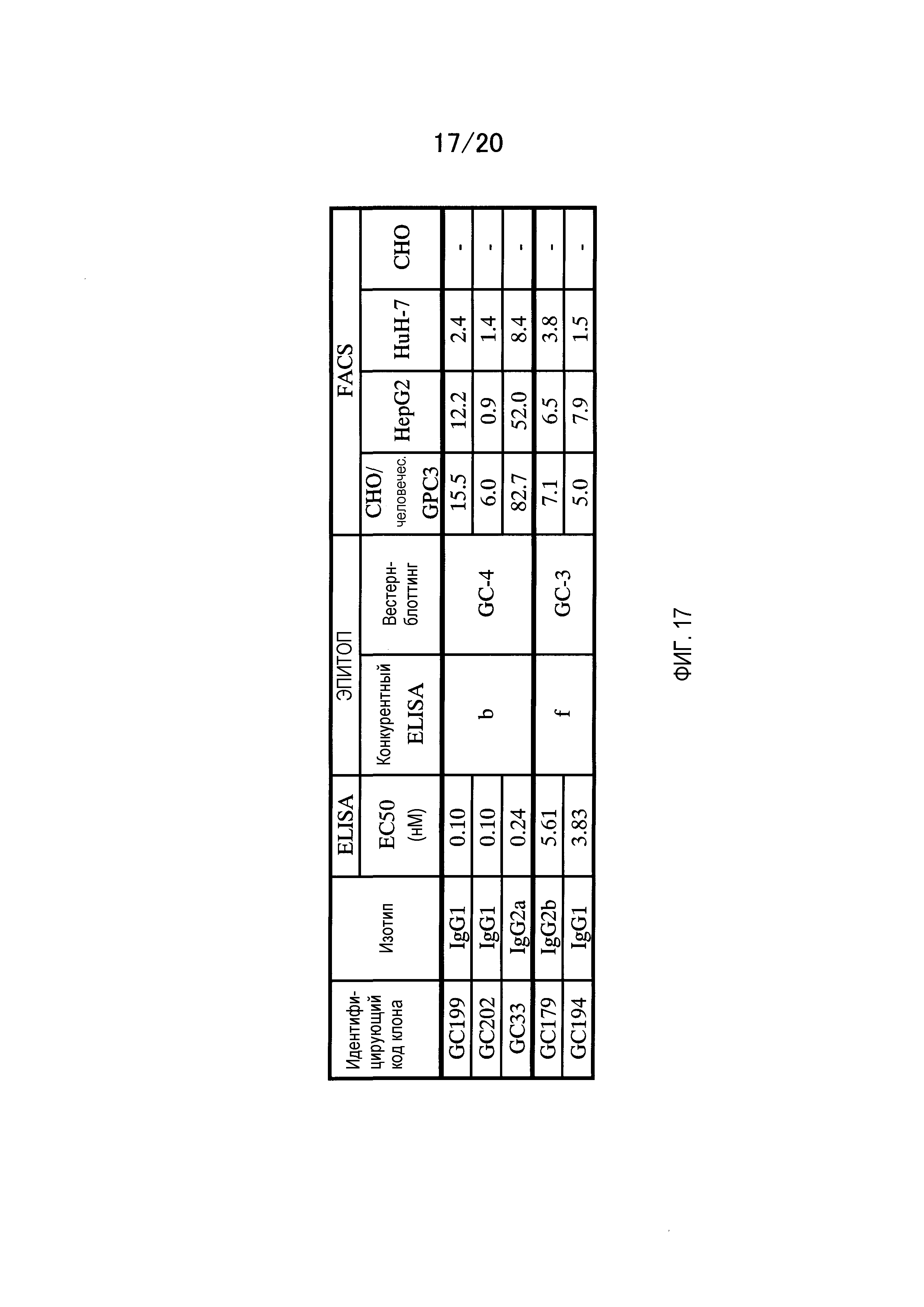
На фиг.17 приведена таблица антител, в которую включены изотипы и результаты ELISA, FACS и эпитопного анализа для клонов, полученных из мышей, иммунизированных GC-3.
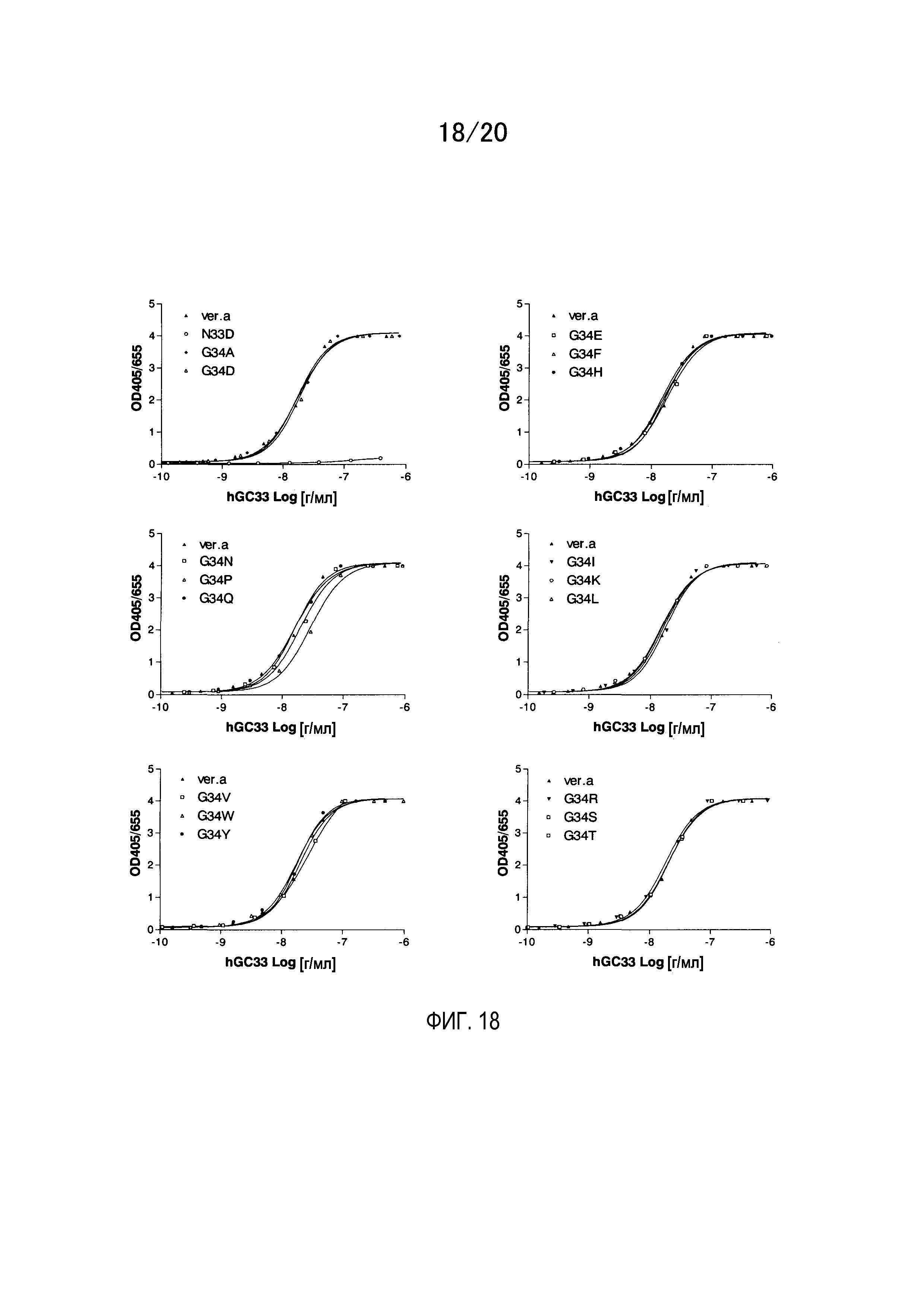
На фиг.18 показаны результаты измерения связывающей активности модифицированных антител по отношению к коровому белку растворимой формы GPC3 методом ELISA. Gly34, который находится в CDR1 вариабельного участка L-цепи гуманизированного GC33, заменяют любой из 17 аминокислот, отличных от Cys и Met.
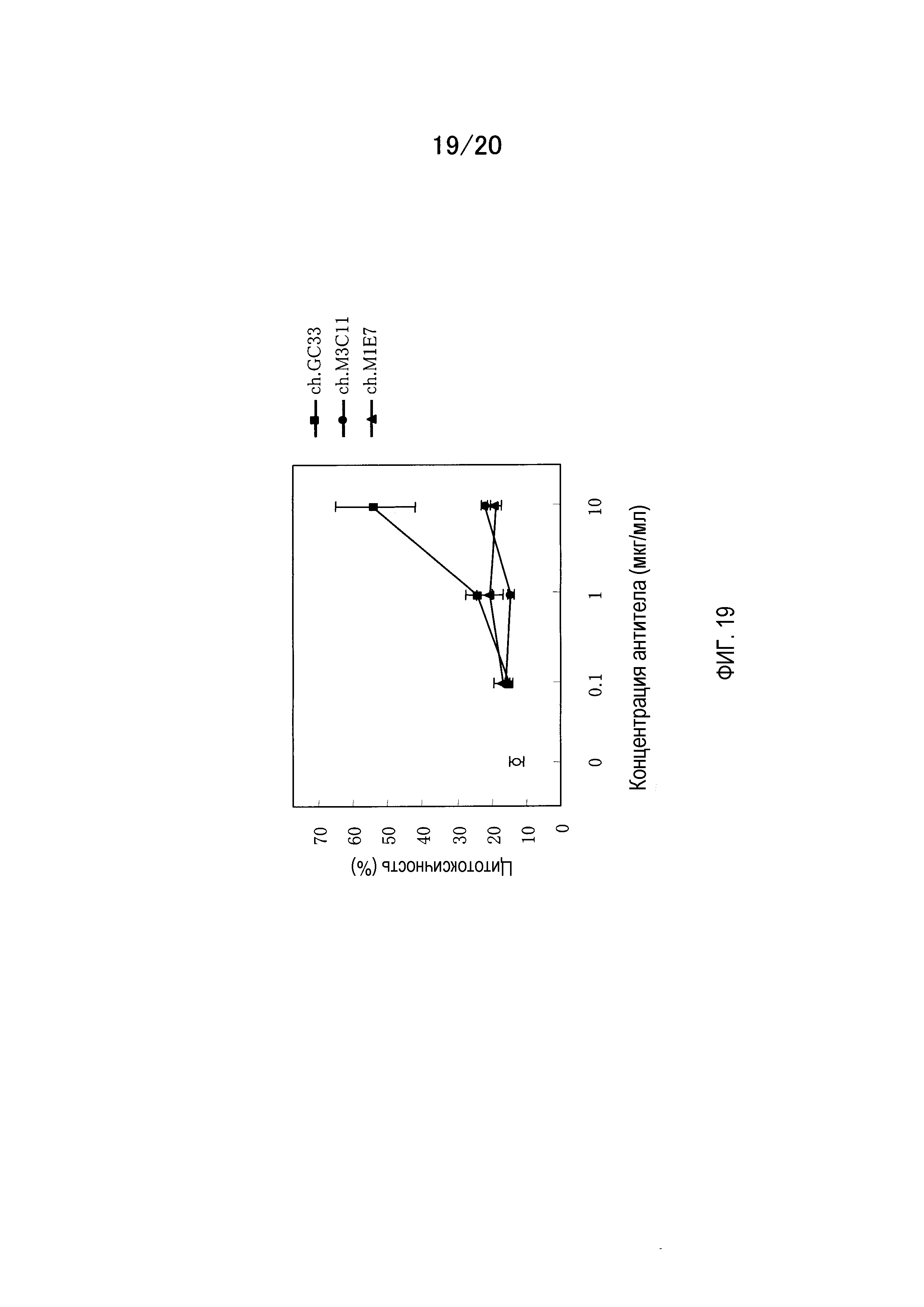
На фиг.19 показаны результаты измерения активности CDC мышино-человеческих химерных антител GC33, M3C11 и M1E7 на клетках CHO, экспрессирующих полноразмерный GPC3.
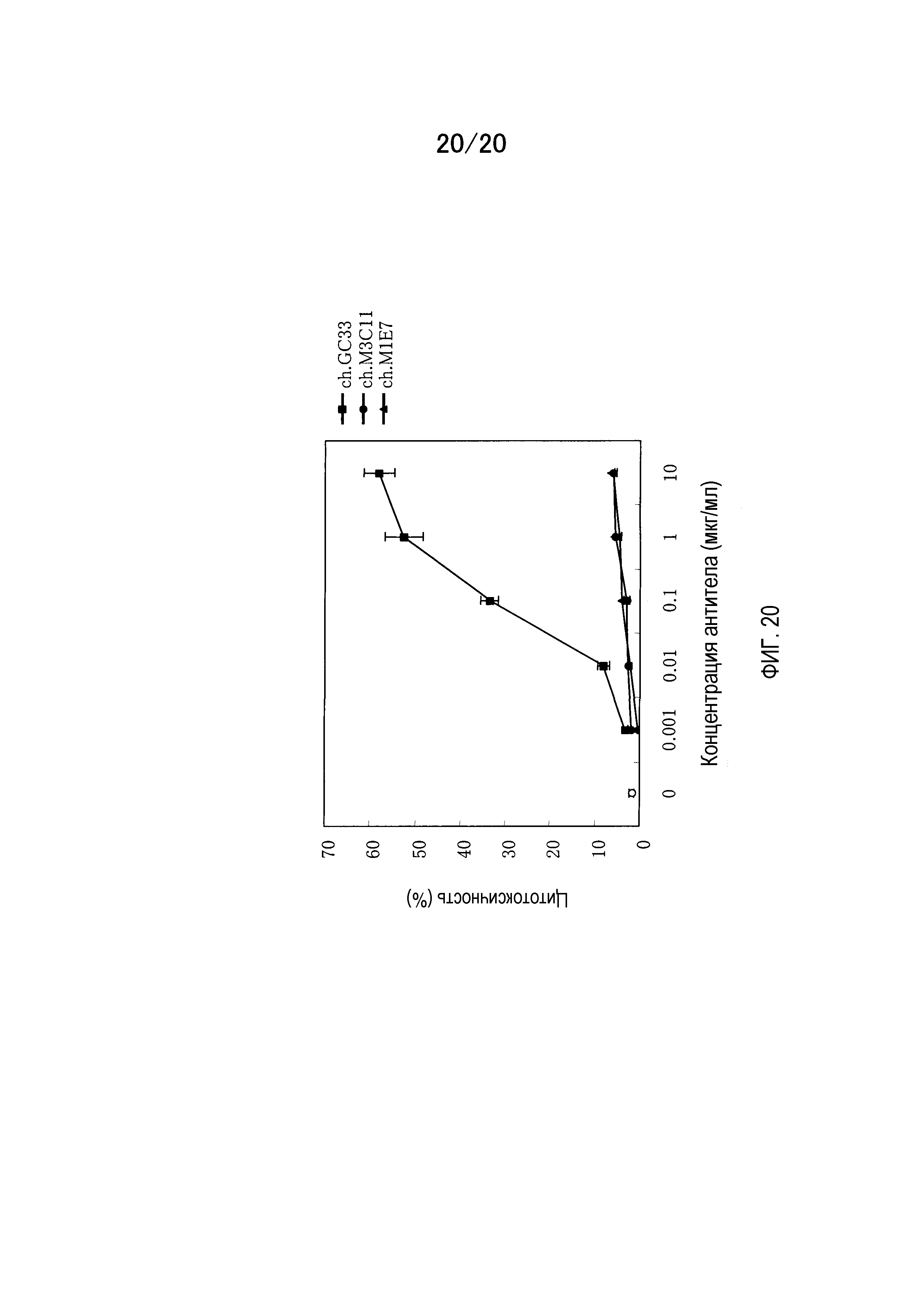
На фиг.20 показаны результаты измерения активности ADCC мышино-человеческих химерных антител GC33, M3C11 и M1E7 на клеточной линии гепатомы человека SK-03, экспрессирующей полноразмерный GPC3.
Подробное описание изобретения
Антитело
Настоящее изобретение предлагает антитела, описанные в нижеследующих пунктах (I)-(XI).
(I) Антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO, приведенных в любом из нижеследующих пунктов (1)-(12):
(1) SEQ ID NO: 123, 124 и 125 (GC33),
(2) SEQ ID NO: 109, 110 и 111 (M11F1),
(3) SEQ ID NO: 106, 107 и 108 (M3B8),
(4) SEQ ID NO: 132, 133 и 134 (GC199),
(5) SEQ ID NO: 106, 135 и 136 (GC202),
(6) SEQ ID NO: 126, 127 и 128 (GC179),
(7) SEQ ID NO: 129, 130 и 131 (GC194),
(8) SEQ ID NO: 103, 104 и 105 (M13B3),
(9) SEQ ID NO: 118, 121 и 122 (L9G11),
(10) SEQ ID NO: 115, 116 и 117 (M6B1),
(11) SEQ ID NO: 112, 113 и 114 (M5B9) и
(12) SEQ ID NO: 118, 119 и 120 (M10D2).
Среди антител, описанных в пунктах (1)-(12), предпочтительны антитела, описанные в пунктах (1)-(8), более предпочтительны антитела, описанные в пунктах (1)-(5), и особенно предпочтительно антитело, описанное в пункте (1). Антитела, описанные в пунктах (1)-(8), распознают C-концевой пептид глипикана 3 (пептид, содержащий 374-580 аминокислоты глипикана 3); и используются как терапевтические антитела. Кроме того, антитела, описанные в пунктах (9)-(12), распознают N-концевой пептид глипикана 3 (пептид, содержащий 1-373 аминокислоты глипикана 3); и используются как диагностические антитела.
(II) Антитело, включающее в себя вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO, приведенных в любом из нижеследующих пунктов (1)-(13):
(1) SEQ ID NO: 143, 144 и 158 (GC33),
(2) SEQ ID NO: 143, 144 и 145 (M11F1),
(3) SEQ ID NO: 140, 141 и 142 (M3B8),
(4) SEQ ID NO: 167, 168 и 169 (GC199),
(5) SEQ ID NO: 170, 144 и 171 (GC202),
(6) SEQ ID NO: 159, 160 и 161 (GC179),
(7) SEQ ID NO: 162, 147 и 163 (GC194 (1)),
(8) SEQ ID NO: 164, 165 и 166 (GC194 (2)),
(9) SEQ ID NO: 137, 138 и 139 (M13B3),
(10) SEQ ID NO: 155, 156 и 157 (L9G11),
(11) SEQ ID NO: 149, 150 и 151 (M6B1),
(12) SEQ ID NO: 146, 147 и 148 (M5B9) и
(13) SEQ ID NO: 152, 153 и 154 (M10D2).
Среди антител, описанных в пунктах (1)-(13), предпочтительны антитела, описанные в пунктах (1)-(8), более предпочтительны антитела, описанные в пунктах (1)-(5), и особенно предпочтительно антитело, описанное в пункте (1). Антитела, описанные в пунктах (1)-(8), распознают C-концевой пептид глипикана 3 (пептид, содержащий 374-580 аминокислоты глипикана 3); и используются как терапевтические антитела. Кроме того, антитела, описанные в пунктах (9)-(13), распознают N-концевой пептид глипикана 3 (пептид, содержащий 1-373 аминокислоты глипикана 3); и используются как диагностические антитела.
(III) Антитело, выбранное из группы, состоящей из антител, описанных в нижеследующих пунктах (1)-(13):
(1) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 143, 144 и 158 (GC33),
(2) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 109, 110 и 111, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 143, 144 и 145 (M11F1),
(3) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 106, 107 и 108, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 140, 141 и 142 (M3B8),
(4) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 132, 133 и 134, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 167, 168 и 169 (GC199),
(5) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 106, 135 и 136, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 170, 144 и 171 (GC202),
(6) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 126, 127 и 128, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 159, 160 и 161 (GC179),
(7) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 129, 130 и 131, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 162, 147 и 163 (GC194 (1)),
(8) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 129, 130 и 131, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 164, 165 и 166 (GC194 (2)),
(9) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 103, 104 и 105, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 137, 138 и 139 (M13B3),
(10) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 118, 121 и 122, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 155, 156 и 157 (L9G11),
(11) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 115, 116 и 117, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 149, 150 и 151 (M6B1),
(12) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 112, 113 и 114, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 146, 147 и 148 (M5B9),
(13) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 118, 119 и 120, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 152, 153 и 154 (M10D2).
Среди антител, описанных в пунктах (1)-(13), предпочтительны антитела, описанные в пунктах (1)-(8), более предпочтительны антитела, описанные в пунктах (1)-(5), и особенно предпочтительно антитело, описанное в пункте (1). Антитела, описанные в пунктах (1)-(8), распознают C-концевой пептид глипикана 3 (пептид, содержащий 374-580 аминокислоты глипикана 3); и используются как терапевтические антитела. Кроме того, антитела, описанные в пунктах (9)-(13), распознают N-концевой пептид глипикана 3 (пептид, содержащий 1-373 аминокислоты глипикана 3); и используются как диагностические антитела.
(IV) Антитело, содержащее вариабельный участок тяжелой цепи, описанный в любом из нижеследующих пунктов (1)-(7):
(1) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 84 (GC33 VH ver.a),
(2) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 85 (GC33 VH ver.c),
(3) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 86 (GC33 VH ver.f),
(4) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 87 (GC33 VH ver.h),
(5) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 88 (GC33 VH ver.i),
(6) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 89 (GC33 VH ver.j), и
(7) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 90 (GC33 VH ver.k).
Среди антител, описанных в пунктах (1)-(7), особенно предпочтительны антитела, описанные в пунктах (2)-(7).
(V) Антитело, включающее в себя вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 92 (GC33 VL ver.a).
(VI) Антитело, выбранное из группы, состоящей из антител, описанных в нижеследующих пунктах (1)-(7):
(1) антитело, включающее в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 84 (GC33 VH ver.a), и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 92 (GC33 VL ver.a),
(2) антитело, включающее в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 85 (GC33 VH ver.c), и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 92 (GC33 VL ver.a),
(3) антитело, включающее в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 86 (GC33 VH ver.f), и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 92 (GC33 VL ver.a),
(4) антитело, включающее в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 87 (GC33 VH ver.h), и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 92 (GC33 VL ver.a),
(5) антитело, включающее в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 88 (GC33 VH ver.i), и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 92 (GC33 VL ver.a),
(6) антитело, включающее в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 89 (GC33 VH ver.j), и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 92 (GC33 VL ver.a), и
(7) антитело, включающее в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 90 (GC33 VH ver.k), и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 92 (GC33 VL ver.a).
Среди антител, описанных в пунктах (1)-(7), особенно предпочтительны антитела, описанные в пунктах (2)-(7).
(VII) Антитело, описанное в любом из нижеследующих пунктов (1)-(15):
(1) антитело, включающее в себя вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 174, 144 и 158,
(2) антитело, включающее в себя вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 175, 144 и 158,
(3) антитело, включающее в себя вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 176, 144 и 158,
(4) антитело, включающее в себя вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 177, 144 и 158,
(5) антитело, включающее в себя вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 178, 144 и 158,
(6) антитело, включающее в себя вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 179, 144 и 158,
(7) антитело, включающее в себя вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 180, 144 и 158,
(8) антитело, включающее в себя вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 181, 144 и 158,
(9) антитело, включающее в себя вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 182, 144 и 158,
(10) антитело, включающее в себя вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 183, 144 и 158,
(11) антитело, включающее в себя вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 184, 144 и 158,
(12) антитело, включающее в себя вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 185, 144 и 158,
(13) антитело, включающее в себя вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 186, 144 и 158,
(14) антитело, включающее в себя вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 187, 144 и 158, и
(15) антитело, включающее в себя вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 188, 144 и 158.
Среди антител, описанных в пунктах (1)-(15), предпочтительно антитело, описанное в пункте (15).
(VIII) Антитело, описанное в любом из нижеследующих пунктов (1)-(15):
(1) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 174, 144 и 158,
(2) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 175, 144 и 158,
(3) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 176, 144 и 158,
(4) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 177, 144 и 158,
(5) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 178, 144 и 158,
(6) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 179, 144 и 158,
(7) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 180, 144 и 158,
(8) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 181, 144 и 158,
(9) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 182, 144 и 158,
(10) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 183, 144 и 158,
(11) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 184, 144 и 158,
(12) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 185, 144 и 158,
(13) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 186, 144 и 158,
(14) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 187, 144 и 158 и
(15) антитело, включающее в себя вариабельные участки тяжелой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 123, 124 и 125, и вариабельные участки легкой цепи, содержащие CDR 1, 2 и 3, имеющие аминокислотные последовательности, описанные в SEQ ID NO: 188, 144 и 158.
Среди антител, описанных в пунктах (1)-(15), предпочтительно антитело, описанное в пункте (15).
(IX) Антитело, описанное в любом из нижеследующих пунктов (1)-(15):
(1) антитело, содержащее вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 191,
(2) антитело, содержащее вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 192,
(3) антитело, содержащее вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 193,
(4) антитело, содержащее вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 194,
(5) антитело, содержащее вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 195,
(6) антитело, содержащее вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 196,
(7) антитело, содержащее вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 197,
(8) антитело, содержащее вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 198,
(9) антитело, содержащее вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 199,
(10) антитело, содержащее вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 200,
(11) антитело, содержащее вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 201,
(12) антитело, содержащее вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 202,
(13) антитело, содержащее вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 203,
(14) антитело, содержащее вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 204, и
(15) антитело, содержащее вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 205.
Среди антител, описанных в пунктах (1)-(15), предпочтительно антитело, описанное в пункте (15).
(X) Антитело, содержащее вариабельный участок легкой цепи, выбранный из группы, состоящей из вариабельных участков легкой цепи, описанных в нижеследующих пунктах (1)-(15):
(1) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 191,
(2) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 192,
(3) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 193,
(4) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 194,
(5) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 195,
(6) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 196,
(7) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 197,
(8) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 198,
(9) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 199,
(10) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 200,
(11) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 201,
(12) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 202,
(13) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 203,
(14) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 204, и
(15) вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 205, и вариабельный участок тяжелой цепи, выбранный из группы, состоящей из вариабельных участков тяжелой цепи, описанных в нижеследующих пунктах (1)-(7):
(1) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 84,
(2) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 85,
(3) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 86,
(4) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 87,
(5) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 88,
(6) вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 89, и
Среди описанных выше антител предпочтительно антитело, содержащее вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 205, и вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 90.
(XI) Антитело, имеющее описанную в любом из приведенных выше пунктов (I)-(X) аминокислотную последовательность, в которой одна или несколько аминокислот замещены, удалены, добавлены и/или вставлены, и которое обладает активностью, эквивалентной активности антитела, описанного в любом из пунктов (I)-(X).
В настоящем изобретении фраза "активность, эквивалентная активности антитела, описанного в любом из пунктов (I)-(X)" означает эквивалентность связывающей активности антитела по отношению к человеческому глипикану 3, или цитотоксическую активность по отношению к клетке, экспрессирующей человеческий глипикан 3 (например, HepG2 или рекомбинантные клетки CHO, экспрессирующие человеческий глипикан 3, и др.).
Гуманизированное антитело
Одним предпочтительным воплощением антитела в соответствии с настоящим изобретением является гуманизированное антитело, которое связывается с глипиканом 3. Гуманизированное антитело можно получить известным способом.
Гуманизированное антитело также упоминается как видоизмененное человеческое антитело, которое получают путем пересаживания участка, определяющего комплементарность (CDR) антитела млекопитающего, отличного от человека, например, мышиного антитела, в CDR человеческого антитела. Для получения таких антител также используются общие методы рекомбинантных ДНК (см. Европейскую патентную заявку EP 125023 и международную патентную заявку WO 96/02576).
Например, если CDR получают из мышиного антитела, последовательность ДНК, которую конструируют для соединения CDR мышиного антитела с каркасным участком (FR) человеческого антитела, синтезируют методом ПЦР с использованием нескольких олигонуклеотидов в качестве праймеров, которые получают так, чтобы фрагменты перекрывались друг с другом по обоим концам CDR и FR (см. способ, описанный в международной патентной заявке WO 98/13388).
Выбирают каркасный участок человеческого антитела, который при соединении с CDR позволяет получить гипервариабельный участок с желательным антигенсвязывающим центром. При необходимости аминокислоту в каркасном участке вариабельного участка антитела можно заменить так, чтобы гипервариабельный участок видоизмененного человеческого антитела мог образовать подходящий антигенсвязывающий центр (Sato, K. et al., Cancer Res. (1993) 53, 851-856).
C-участок человеческого антитела можно использовать в качестве С-участка химерного антитела или гуманизированного антитела, например, Cγ1, Cγ2, Cγ3, и Cγ4 можно использовать в качестве составных частей H-цепи, а Cκ и Cλ можно использовать в качестве составных частей L-цепи. C-участок человеческого антитела также можно модифицировать, чтобы улучшить стабильность антитела или облегчить его получение. Для гуманизации можно использовать любой изотип человеческого антитела, например, IgG, IgM, IgA, IgE и IgD, предпочтительно IgG, более предпочтительно IgG1 или IgG3 и особенно предпочтительно IgG1. В настоящем изобретении IgG1 эффективно, если антитело используется в качестве противоракового средства, то есть обладает высокой цитотоксичной активностью (Chemical immunology, 65: 88 (1997)).
Кроме того, после получения гуманизированного антитела аминокислоту в вариабельном (например, в FR) или константном участке можно заменить другой аминокислотой.
Происхождение CDR в гуманизированном антителе особо не ограничивается, и CDR может быть получен от любого животного. Например, можно использовать последовательность, полученную из мышиного антитела, крысиного антитела, кроличьего антитела, верблюжьего антитела или т.п. Предпочтительно использовать последовательность CDR мышиного антитела.
Как правило, при гуманизации антитела трудно сохранить агонистическую активность первоначального антитела. Однако в настоящем изобретении успешно получают гуманизированное антитело, обладающее агонистической активностью, эквивалентной активности исходного мышиного антитела. Поскольку антигенность гуманизированного антитела в организме человека уменьшается, его можно использовать для введения человеку в терапевтических целях.
Предпочтительные примеры гуманизированного антитела против глипикана 3 настоящего изобретения включают в себя, например, антитело, содержащее вариабельный участок тяжелой цепи, описанный в SEQ ID NO: 84 (GC33 VH ver.a), SEQ ID NO: 85 (GC33 VH ver.c), SEQ ID NO: 86 (GC33 VH ver.f), SEQ ID NO: 87 (GC33 VH ver.h), SEQ ID NO: 88 (GC33 VH ver.i), SEQ ID NO: 89 (GC33 VH ver.j) или SEQ ID NO: 90 (GC33 VH ver.k), или антитело, содержащее вариабельный участок легкой цепи, описанный в SEQ ID NO: 92 (GC33 VL ver.a). Особенно предпочтительные примеры антител включают в себя антитело, содержащее вариабельный участок тяжелой цепи, описанный в SEQ ID NO: 84 (GC33 VH ver.a), SEQ ID NO: 85 (GC33 VH ver.c), SEQ ID NO: 86 (GC33 VH ver.f), SEQ ID NO: 87 (GC33 VH ver.h), SEQ ID NO: 88 (GC33 VH ver.i), SEQ ID NO: 89 (GC33 VH ver.j) или SEQ ID NO: 90 (GC33 VH ver.k), и вариабельный участок легкой цепи, описанный в SEQ ID NO: 92 (GC33 VL ver.a).
Кроме того, предпочтительный пример гуманизированного антитела против глипикана 3 включает в себя антитело, содержащее вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 90, и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 205.
Предпочтительное воплощение антитела по настоящему изобретению представляет собой антитело, которое связывается с эпитопом, с которым связывается антитело, описанное в любом из нижеследующих пунктов (1)-(8):
(1) антитело, включающее в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 62, и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 73 (GC33),
(2) антитело, включающее в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 26, и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 48 (M11F1),
(3) антитело, включающее в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 25, и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 47 (M3B8),
(4) антитело, включающее в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 60, и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 71 (GC199),
(5) антитело, включающее в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 61, и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 72 (GC202),
(6) антитело, включающее в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 63, и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 74 (GC179),
(7) антитело, включающее в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 64, и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 75 (GC194 (1)), и
(8) антитело, включающее в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 64, и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 76 (GC194 (2)). Более предпочтительно антитело, связывающееся с эпитопом, с которым связывается антитело, описанное в любом из пунктов (1)-(5), и особенно предпочтительно антитело, связывающееся с эпитопом, с которым связывается антитело, описанное в пункте (1).
Используют антитело, которое связывается с эпитопом, с которым связывается любое из вышеуказанных антител, так как оно обладает особенно высокой цитотоксичностью.
Антитело, описанное в любом из пунктов (1)-(7), связывается с участком от 524-ой аминокислоты до 580-ой аминокислоты человеческого глипикана 3. В особенности, оно связывается с участком от 524-ой аминокислоты до 563-ей аминокислоты. Антитело, описанное в любом из пунктов (1)-(5), связывается с участком от 537-ой аминокислоты до 563-ей аминокислоты человеческого глипикана 3. Антитело, описанное в пункте (1), связывается с участком от 544-ой аминокислоты до 553-ей аминокислоты человеческого глипикана 3. В особенности, оно связывается с участком от 546-ой аминокислоты до 551-ой аминокислоты.
Антитела, распознающие вышеуказанные эпитопы, обладают высокой цитотоксичностью, следовательно, их можно использовать для лечения таких заболеваний, как рак. В особенности, можно использовать антитело, которое связывается с участком от 546-ой аминокислоты до 551-ой аминокислоты, так как оно обладает высокой цитотоксичностью.
Соответственно, настоящее изобретение включает в себя антитела, которые связываются с эпитопом на участке от 524-ой аминокислоты до 580-ой аминокислоты человеческого глипикана 3, предпочтительно на участке от 524-ой аминокислоты до 563-ей аминокислоты, более предпочтительно на участке от 537-ой аминокислоты до 563-ей аминокислоты, еще более предпочтительно на участке от 544-ой аминокислоты до 553-ей аминокислоты, особенно предпочтительно на участке от 546-ой аминокислоты до 551-ой аминокислоты.
Другое предпочтительное воплощение настоящего изобретения представляет собой антитело, которое распознает участок от 524-ой аминокислоты до 563-ей аминокислоты человеческого глипикана 3 и не распознает участок от 537-ой аминокислоты до 563-ей аминокислоты.
Другое предпочтительное воплощение настоящего изобретения представляет собой антитело, которое распознает участок от 537-ой аминокислоты до 563-ей аминокислоты человеческого глипикана 3 и не распознает участок от 550-ой аминокислоты до 563-ей аминокислоты.
Анализ эпитопа, распознаваемого антителом, можно проводить известным в данной области способом, например, методом вестерн-блоттинга, который описывается ниже в примерах.
Антитело, которое распознает вышеуказанные участки как эпитопы, можно получить известным в данной области способом. Например, оно может быть получено путем получения пептида, имеющего аминокислотную последовательность целевого участка на основе аминокислотной последовательности человеческого глипикана 3, с последующим получением антитела с использованием данного пептида в качестве иммуногена, или путем получения антитела обычным способом и определения эпитопа, который распознает полученное антитело, с последующим выбором антитела, которое распознает целевой эпитоп.
Предпочтительным примером антитела против глипикана 3 является антитело, обладающее высокой ADCC-активностью, или антитело, обладающее высокой CDC-активностью по отношению к клетке, экспрессирующей глипикан 3.
Фраза "высокая ADCC-активность" или "высокая CDC-активность" в данном описании означает, что антитело данного изобретения имеет более высокую ADCC-активность или более высокую CDC-активность, чем известное антитело против глипикана 3. Известные антитела против глипикана 3 включают в себя, например, M3C11 и M1E07, описанные в международной патентной заявке WO 2004/22739.
ADCC-активность или CDC-активность можно измерить с помощью известного в данной области метода. Например, ее можно измерить по высвобождению хрома. Конкретные условия анализа высвобождения хрома для измерения ADCC-активности особо не ограничиваются, однако, например, ее можно измерять, используя условия, описанные ниже в примерах.
Примеры клеток, экспрессирующих глипикан 3, включают в себя, например, клеточную линию гепатомы, такую как HepG2, клеточную линию CHO, содержащую ген, кодирующий глипикан 3, и т.п. Для измерения ADCC-активности предпочтительно использовать клеточную линию HepG2, а для измерения CDC-активности предпочтительно использовать рекомбинантную клеточную линию CHO, экспрессирующую GPC3. Рекомбинантную клеточную линию CHO, экспрессирующую GPC3, можно получить любым способом, в том числе, ее можно получить, например, по способу, описанному ниже в примерах.
Если антитело против глипикана 3 используют в качестве противоракового средства, предпочтительно, чтобы оно обладало таким же уровнем ADCC-активности, что и антитело, включающее в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 62, и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 73 (GC33). Если антитело против глипикана 3 используют в качестве противоракового средства, предпочтительно, чтобы оно обладало таким же уровнем CDC-активности, что и антитело, включающее в себя вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 62, и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, описанную в SEQ ID NO: 73 (GC33).
Кроме того, настоящее изобретение включает в себя антитело, обладающее высокой связывающей активностью по отношению к глипикану 3.
В настоящем изобретении связывающую активность антитела по отношению к глипикану 3 можно измерить известным в данной области способом. Например, ее можно измерить методом поверхностного плазмонного резонанса с использованием BIAcore. А именно, белок глипикан 3 иммобилизуют на сенсорном чипе для взаимодействия с антителом, и взаимодействие антитела и глипикана 3 рассчитывают как константу скорости реакции исходя из результатов измерения. Кроме того, для измерения связывающей активности можно использовать твердофазный иммуноферментный анализ (ELISA), иммуноферментный анализ (EIA), радиоиммунологический анализ (RIA) или иммунофлуоресцентный анализ. Например, в случае иммуноферментного анализа образец, содержащий анализируемое антитело, например, культуральный супернатант клетки, продуцирующей анализируемое антитело, или очищенное антитело, добавляют в планшет, заранее покрытый антигеном, с которым связывается анализируемое антитело. Затем добавляют вторичное антитело, меченное ферментом, таким как щелочная фосфатаза, после чего планшеты инкубируют и промывают. Затем добавляют субстрат фермента, такой как п-нитрофенилфосфат, и измеряют поглощение, по которому рассчитывают антигенсвязывающую активность. Верхняя граница связывающей активности особо не ограничивается. Однако, например, верхняя граница может находиться в интервале, который определяется техническими возможностями с точки зрения специалиста в данной области. Следует понимать, что по мере совершенствования технологии технически возможный интервал будет расширяться.
Далее, в настоящем изобретении аминокислота, подлежащая дезамидированию, или соседняя аминокислота, может быть заменена на другую аминокислоту, например, для подавления дезамидирования с целью увеличения стабильности антитела. Подлежащая дезамидированию аминокислота включает в себя аспарагин и глутамин, предпочтительно аспарагин. Аминокислота, находящаяся по соседству с аспарагином, особо не ограничивается и может быть любой аминокислотой. Известно, что последовательность аспарагин-глицин является особенно чувствительной к дезамидированию, следовательно, предпочтительно, чтобы по соседству с аспарагином находился глицин. Аминокислота, используемая для замены, особо не ограничивается и может представлять собой любую аминокислоту, отличную от аспарагина и глутамина. Предпочтительно, данная аминокислота отличается от валина и пролина. Следовательно, в настоящем изобретении, если происходит дезамидирование антитела, предпочтительно заменить аминокислоту на аминокислоту, отличную от аспарагина, глутамина, валина и пролина. Подавление дезамидирования путем замены аминокислоты можно проводить, например, по способу, описанному в международной патентной заявке WO 03/057881. Предпочтительно, чтобы после замены аминокислоты с целью подавления дезамидирования сохранялась антигенсвязывающая активность, которая присутствовала до замены.
Другое воплощение стабилизации антитела включает в себя замену глутаминовой кислоты на другую аминокислоту. В настоящем изобретении также было обнаружено, что, если 6-ая аминокислота тяжелой цепи антитела представляет собой глутаминовую кислоту, антитело можно в значительной степени стабилизировать путем замены глутаминовой кислоты на глутамин. Соответственно, настоящее изобретение также относится к способу стабилизации антитела путем замены глутаминовой кислоты в 6-ом положении тяжелой цепи антитела на глутамин. Нумерация аминокислот в антителе известна специалистам в данной области (например, Kabat, E. A. et al., "Sequences of Proteins of Immunological Interest", US Dept. Health and Human Services 1983).
Антитело данного изобретения может представлять собой конъюгированное антитело, то есть антитело может быть соединено с разными молекулами, такими как молекулы полиэтиленгликоля (PEG), радиоактивных веществ и токсинов. Такое конъюгированное антитело можно получить путем химической модификации полученного ранее антитела. Способы модификации антител известны в данной области. Антитело данного изобретения включает в себя такое конъюгированное антитело.
Антитело данного изобретения также может представлять собой биспецифическое антитело (см., например, Journal of Immunology, 1994, 152, 5368-5374). Биспецифическое антитело может распознавать глипикан 3 и другой антиген, или оно может распознавать разные эпитопы на молекуле GPC3.
Кроме того, антитело данного изобретения может нести определенный белок, гибридизованный с N- или C-концом антитела (Clinical Cancer Research, 2004, 10, 1274-1281). Белок для гибридизации с антителом может быть соответственно выбран специалистом в данной области.
Антитело данного изобретения также включает в себя антитело с повышенной цитотоксичностью. Примеры антител с повышенной цитотоксичностью включают в себя антитело, утратившее фукозу, антитело, содержащее разделяющий N-ацетилглюкозамин (GlcNAc), присоединенный к его углеводной цепи, и антитело, обладающее измененной связывающей активностью по отношению к рецептору Fcγ, полученное путем замещения одной или нескольких аминокислот в участке Fc. Такие антитела с повышенной цитотоксичностью можно получить известным в данной области способом.
Способ получения антитела
Антитело, которое связывается с глипиканом 3, можно получить известным в данной области способом. Например, гибридому, продуцирующую моноклональное антитело, можно получить, как указано ниже, используя в основном известный метод. То есть гибридому можно получить путем иммунизации млекопитающего традиционным способом, с использованием в качестве сенсибилизирующего антигена белка глипикана 3 или клетки, экспрессирующей глипикан 3. Полученный таким образом иммуноцит гибридизуют с известной родительской клеткой, используя обычный метод гибридизации клеток, и затем с помощью традиционного метода скрининга отбирают клетки, продуцирующие моноклональные антитела.
Конкретно, моноклональное антитело можно получить следующим образом. Вначале получают белок глипикан 3 на основе генной/аминокислотной последовательностей глипикана 3, описанных в SEQ ID NO: 3 и 4, который используют в качестве сенсибилизирующего антигена для получения антитела. Более конкретно, генную последовательность, кодирующую глипикан 3, вставляют в известную векторную систему экспрессии, полученным вектором трансформируют подходящую клетку-хозяина и затем целевой человеческий белок глипикан 3 выделяют из клетки-хозяина или из культурального супернатанта известным способом.
Затем данный очищенный белок глипикан 3 используют в качестве сенсибилизирующего антигена. Альтернативно, в качестве сенсибилизирующего антигена можно использовать пептидный фрагмент глипикана 3. В данном случае пептидный фрагмент можно получить также путем химического синтеза в соответствии с аминокислотной последовательностью человеческого глипикана 3.
Эпитоп молекулы глипикана 3, который распознается антителом против глипикана 3 настоящего изобретения, не ограничивается конкретным эпитопом. Антитело против глипикана 3 может распознавать любой эпитоп, если эпитоп присутствует на молекуле глипикана 3. Соответственно, для получения антитела против глипикана 3 настоящего изобретения в качестве антигена можно использовать любой фрагмент, который содержит эпитоп, присутствующий на молекуле глипикана 3.
Млекопитающее, которое иммунизируют сенсибилизирующим антигеном, особо не ограничивается, однако его предпочтительно выбирают с точки зрения совместимости с родительской клеткой, используемой для гибридизации клеток. Например, обычно используют грызунов, таких как мыши, крысы и хомяки, кроликов или обезьян.
Иммунизацию животных сенсибилизирующим антигеном проводят известным способом. Например, иммунизацию проводят по общему способу, в котором сенсибилизирующий антиген вводят млекопитающему внутрибрюшинно или подкожно. А именно, сенсибилизирующий антиген разбавляют подходящим количеством, или суспендируют в подходящем количестве PBS (забуференного фосфатом физиологического раствора), физиологического раствора и т.п., при необходимости продукт смешивают с соответствующим количеством стандартного адъюванта, такого как полный адъювант Фрейнда, и затем раствор эмульгируют и вводят млекопитающему несколько раз через каждые 4-21 дней. Для иммунизации сенсибилизирующим антигеном также можно использовать подходящий носитель.
Млекопитающее иммунизируют по описанному выше способу и затем подтверждают, что в сыворотке присутствует повышенный уровень целевого антитела. Затем у млекопитающего берут иммуноциты и подвергают их клеточной гибридизации. Особенно предпочтительным иммуноцитом является спленоцит.
В качестве родительской клетки-партнера для гибридизации с вышеуказанным иммуноцитом используют клетку миеломы млекопитающего. Примеры клеточной линии миеломы, предпочтительно используемые в настоящем изобретении, включают в себя различные известные клеточные линии, такие как P3 (P3x63 Ag8.653) (J. Immunol. (1979) 123, 1548-1550), P3x63 Ag8U.1 (Current Topics in Microbiology and Immunology (1978) 81, 1-7), NS-1 (Kohler. G. and Milstein, C. Eur. J. Immunol. (1976) 6, 511-519), MPC-11 (Margulies. D. H. et al., Cell (1976) 8, 405-415), SP2/0 (Shulman, M. et al., Nature (1978) 276, 269-270), FO (de St. Groth, S. F. et al., J. Immunol. Methods (1980) 35, 1-21), S194 (Trowbridge, I. S. J. Exp. Med. (1978) 148, 313-323) и R210 (Galfre, G. et al., Nature (1979) 277, 131-133).
Гибридизацию вышеупомянутых иммуноцитов с клетками миеломы в основном можно проводить с помощью известного способа, например, способа Kohler and Milstein et al. (Kohler. G. and Milstein, C., Methods Enzymol. (1981) 73, 3-46).
Более конкретно, вышеупомянутую клеточную гибридизацию проводят в обычном питательном растворе для культивирования в присутствии, например, вещества, ускоряющего гибридизацию клеток. В качестве вещества, ускоряющего гибридизацию клеток, используют, например, полиэтиленгликоль (PEG), гемагглютинирующий японский вирус (HVJ). При желании, для дополнительного увеличения эффективности гибридизации можно добавить вспомогательное средство, такое как диметилсульфоксид.
Можно выбрать подходящее соотношение иммуноцитов и миеломных клеток. Например, предпочтительно, чтобы число иммуноцитов было в 1-10 раз выше, чем число миеломных клеток. Культуральный раствор, используемый для вышеупомянутой гибридизации клеток, включает в себя, например, культуральный раствор RPMI1640 или культуральный раствор MEM, подходящий для выращивания вышеупомянутой миеломной клеточной линии, или другой обычный культуральный раствор, используемый для данного типа клеточной культуры. Кроме того, в сочетании с данным раствором можно использовать сывороточную добавку, такую как фетальная телячья сыворотка (FCS).
Гибридизацию клеток проводят следующим образом. Заранее определенное количество вышеупомянутых иммуноцитов и миеломных клеток тщательно перемешивают в вышеупомянутом культуральном растворе, добавляют нагретый приблизительно до 37°C раствор PEG (например, со средней молекулярной массой приблизительно от 1000 до 6000) (общая концентрация от 30 до 60% (масс./об.)), затем раствор перемешивают и получают целевую гибридную клетку (гибридому). После этого добавляют подходящий культуральный раствор и несколько раз проводят стадию удаления супернатанта путем центрифугирования, чтобы удалить реагент для гибридизации клеток или другой реагент, неблагоприятно влияющий на рост гибридомы.
Полученную таким образом гибридому отбирают путем культивирования гибридомы в стандартном селекционном культуральном растворе, таком как культуральный раствор HAT (культуральный раствор, содержащий гипоксантин, аминоптерин и тимидин). Культивацию в вышеупомянутом культуральном растворе HAT продолжают в течение периода времени, достаточного для того, чтобы клетки, отличные от клеток целевой гибридомы (негибридизованные клетки), погибли (обычно от нескольких дней до нескольких недель). Затем с помощью стандартного метода лимитирующих разведений отбирают моноклон гибридомы, который продуцирует целевое антитело.
В добавление к способу иммунизации отличного от человека животного антигеном с целью получения гибридомы, целевое человеческое антитело, обладающее связывающей активностью по отношению к глипикану 3, также можно получить путем сенсибилизации человеческого лимфоцита глипиканом 3 in vitro и гибридизации сенсибилизированного лимфоцита с клеткой миеломы человека, способной к постоянному делению (см. JP-B-1-59878). В другом способе, чтобы получить клетки, продуцирующие антитело против глипикана 3, антиген глипикан 3 вводят трансгенному животному, содержащему весь набор генов человеческих антител, затем полученные клетки иммортализуют, и человеческое антитело против глипикана 3 получают из иммортализованных клеток, продуцирующих антитело против глипикана 3 (см. международные патентные заявки WO 94/25585, WO 93/12227, WO 92/03918 и WO 94/02602).
Полученную таким образом гибридому, которая продуцирует моноклональное антитело, можно культивировать пассажами в стандартном культуральном растворе, или ее можно хранить в течение длительного времени в жидком азоте.
Одним из примеров способа, используемого для получения моноклонального антитела из гибридомы, является культивирование гибридомы и получение моноклонального антитела из культурального супернатанта с помощью стандартного метода. Другой способ включает в себя введение гибридомы млекопитающему, совместимому с гибридомой, чтобы обеспечить ее пролиферацию, и получение моноклонального антитела из асцита. Первый способ подходит для получения антитела высокой чистоты, тогда как последний способ подходит для получения больших количеств антител.
Можно также получить рекомбинантное антитело с использованием метода генной инженерии, путем клонирования гена антитела из гибридомы, внедрения гена в подходящий вектор, введения вектора в хозяина с последующим продуцированием хозяином рекомбинантного антитела (например, см. Vandamme, A. M. et al., Eur. J. Biochem. (1990) 192, 767-775, 1990).
Конкретно, мРНК, кодирующую вариабельный (V) участок антитела против глипикана 3, выделяют из гибридомы, продуцирующей антитело против глипикана 3. мРНК выделяют известным способом, таким как метод ультрацентрифугирования с гуанидином (Chirgwin, J. M. et al., Biochemistry (1979) 18, 5294-5299), или метод AGPC (Chomczynski, P. et al., Anal. Biochem. (1987) 162, 156-159), и получают общую РНК, а затем целевую мРНК получают с помощью набора для выделения мРНК (Pharmacia) или т.п. Кроме того, мРНК можно непосредственно получить с помощью набора для выделения мРНК QuickPrep (Pharmacia).
кДНК V-участка антитела синтезируют, используя обратную транскриптазу и полученную описанным выше способом мРНК. кДНК можно синтезировать, используя набор для синтеза одноцепочечной кДНК с обратной транскриптазой AMV (SEIKAGAKU CORPORATION) или т.п. Для синтеза и амплификации кДНК можно также использовать, например, набор 5’-Ampli FINDER RACE (Clontech), метод 5’-RACE с использованием ПЦР (Frohman, M. A. et al., Proc. Natl. Acad. Sci. USA (1988) 85, 8998-9002, Belyavsky, A. et al., Nucleic Acids Res. (1989) 17, 2919-2932).
Целевой фрагмент ДНК выделяют из полученного продукта ПЦР и затем лигируют с ДНК-вектором. Рекомбинантный вектор получают из продукта, затем вектор вводят в E. coli или т.п. и проводят отбор колоний, получая в результате целевой рекомбинантный вектор. Затем определяют нуклеотидную последовательность целевой ДНК с помощью известного метода, такого как дидезоксинуклеотидный метод обрыва цепи.
После получения ДНК, кодирующей V-участок целевого антитела против глипикана 3, ее вставляют в вектор экспрессии, содержащий ДНК, кодирующую константный участок (C-участок) целевого антитела.
Чтобы получить антитело против глипикана 3, используемое в настоящем изобретении, ген антитела вставляют в вектор экспрессии так, чтобы ген экспрессировался под управлением участка, регулирующего экспрессию гена, включающего в себя, например, энхансер и промотор. Затем клетку-хозяин трансформируют вектором экспрессии, чтобы обеспечить экспрессию антитела хозяином.
Ген антитела можно экспрессировать путем раздельного введения в вектор экспрессии полинуклеотида, кодирующего H-цепь, или полинуклеотида, кодирующего L-цепь, с последующей одновременной трансформацией клетки-хозяина векторами, или путем введения в один вектор экспрессии полинуклеотидов, кодирующих H-цепь и L-цепь, с последующей трансформацией клетки-хозяина вектором (см. международную патентную заявку WO 94/11523).
Полинуклеотид
В другом аспекте настоящее изобретение предлагает полинуклеотид, кодирующий вариабельный участок тяжелой цепи или вариабельный участок легкой цепи антитела настоящего изобретения. Предпочтительно, полинуклеотид настоящего изобретения имеет нуклеотидную последовательность, описанную в любом из SEQ ID NO: 11-21, 33-43, 55-59, 65-70 и 77-83. Настоящее изобретение также охватывает полинуклеотид, который гибридизуется с вышеупомянутым полинуклеотидом в жестких условиях и кодирует антитело, обладающее активностью, эквивалентной активности антитела настоящего изобретения.
Полинуклеотид настоящего изобретения особо не ограничивается, при условии, что он кодирует антитело настоящего изобретения. Он представляет собой полимер, состоящий из совокупности нуклеотидов, таких как дезоксирибонуклеиновые кислоты (ДНК) или рибонуклеиновые кислоты (РНК). Он может содержать основание, отличное от встречающегося в природе. Полинуклеотид настоящего изобретения можно использовать для получения антитела с помощью метода генной инженерии. Кроме того, полинуклеотид настоящего изобретения можно использовать в качестве зонда для отбора антитела, функционально эквивалентного антителу настоящего изобретения. То есть полинуклеотид, кодирующий антитело настоящего изобретения, или его фрагмент, можно использовать в качестве зонда для получения ДНК, которая гибридизуется с данным полинуклеотидом в жестких условиях и кодирует антитело, обладающее активностью, эквивалентной активности антитела настоящего изобретения, с помощью таких методов, как метод гибридизации, метод амплификации генов (например, ПЦР). Такая ДНК также включена в полинуклеотид настоящего изобретения.
Методы гибридизации (Sambrook, J. et al., Molecular Cloning 2nd ed., 9.47-9.58, Cold Spring Harbor Lab. Press, 1989) хорошо известны специалистам в данной области. Примеры условий гибридизации включают в себя, например, условия низкой жесткости. К условиям низкой жесткости относятся, например, следующие условия: 42°C, 0,1×SSC и 0,1% SDS, предпочтительно, 50°C, 0,1×SSC и 0,1% SDS, если промывание проводят после гибридизации. Более предпочтительные примеры условий гибридизации включают в себя, например, условия высокой жесткости. К условиям высокой жесткости относятся, например, следующие условия: 65°C, 5×SSC и 0,1% SDS. В указанных условиях можно ожидать, что при более высокой температуре будет происходить эффективное образование полинуклеотида, обладающего более высокой степенью гомологии. К тому же, существует несколько факторов, которые влияют на точность гибридизации, например, температура и концентрация соли, и путем соответствующего подбора данных факторов специалисты в данной области могут достичь сходной точности.
Антитело, функционально эквивалентное антителу настоящего изобретения, кодируемое полинуклеотидом, полученным таким методом гибридизации и методом амплификации генов, обладает высокой степенью гомологии с антителом с точки зрения аминокислотной последовательности. Антитело настоящего изобретения также включает в себя антитело, функционально эквивалентное антителу настоящего изобретения, и обладает высокой степенью гомологии в отношении аминокислотной последовательности антитела. Высокая степень гомологии означает, как правило, по меньшей мере, 50% или более высокую идентичность, предпочтительно, 75% или более высокую идентичность, более предпочтительно, 85% или более высокую идентичность, и еще более предпочтительно, 95% или более высокую идентичность, на аминокислотном уровне. Чтобы определить гомологию полипептидов, можно использовать алгоритм, описанный в литературе (Wilbur, W. J. and Lipman, D. J., Proc. Natl. Acad. Sci. USA (1983) 80, 726-730).
Настоящее изобретение также предлагает вектор, содержащий полинуклеотид настоящего изобретения. Такой вектор можно использовать для получения антитела настоящего изобретения. Если в качестве хозяина используется E. coli, вектор настоящего изобретения, например, особо не ограничивается, пока он имеет "ori" для амплификации в E. coli с целью получения и амплификации вектора в большом количестве в E. coli (например, JM109, DH5α, HB101 или XLlBlue), и содержит маркерный ген для селекции трансформированных E. coli (например, ген устойчивости к лекарственному средству, который можно идентифицировать с помощью лекарственного средства, такого как ампициллин, тетрациклин, канамицин или хлорамфеникол). Примеры вектора включают в себя векторы серии M13, векторы серии pUC, pBR322, pBluescript, pCR-Script и т.п. Кроме того, для субклонирования и извлечения кДНК наряду с описанными выше векторами можно использовать pGEM-T, pDIRECT и pT7.
В качестве вектора настоящего изобретения предпочтительно использовать вектор экспрессии. Например, вектор экспрессии, предназначенный для использования в E. coli, должен иметь характеристики, указанные для амплификации в E. coli. Кроме того, если в качестве клетки-хозяина используют E. coli, например, JM109, DH5α, HB101 или XL1-Blue, вектор обязательно должен содержать промотор, например, промотор lacZ (Ward et al., Nature (1989) 341, 544-546; FASEB J. (1992) 6, 2422-2427), промотор araB (Better et al., Science (1988) 240, 1041-1043), промотор T7 или т.п., который обеспечивает эффективную экспрессию целевого продукта в E. coli. Примеры такого вектора включают в себя pGEX-5X-1 (Pharmacia), "QIAexpress system" (Qiagen), pEGFP, pET (в данном случае хозяином предпочтительно является BL21, который экспрессирует РНК-полимеразу T7) и т.п., а также векторы, описанные выше.
Вектор также может содержать сигнальную последовательность для секреции полипептида. Если полипептид продуцируется в периплазме E. coli, в качестве сигнальной последовательности для секреции полипептида можно использовать сигнальную последовательность pelB (Lei S. P. et al., J. Bacteriol (1987) 169, 4379). Введение вектора в клетку-хозяина можно осуществлять, например, с использованием хлорида кальция и методом электропорации.
В качестве вектора настоящего изобретения, в добавление к E. coli, можно использовать, например, векторы экспрессии, полученные из млекопитающих (например, pcDNA3 (Invitrogen) и pEGF-BOS (Nucleic Acids Res. (1990) 18(17), p5322), pEF и pCDM8), векторы экспрессии, полученные из клеток насекомых (например, "бакуловирусная система экспрессии Bac-to-BAC" (GIBCO BRL) и pBacPAK8), векторы экспрессии, полученные из растений (например, pMH1 и pMH2), векторы экспрессии, полученные из вирусов животных (например, pHSV, pMV и pAdexLcw), векторы экспрессии, полученные из ретровирусов (например, pZIPneo), векторы экспрессии, полученные из дрожжей (например, "Pichia Expression Kit" (Invitrogen), pNV11 и SP-Q01), и векторы экспрессии, полученные из Bacillus subtilis (например, pPL608 и pKTH50).
Для экспрессии в животной клетке, такой как клетка CHO, клетка COS, клетка NIH3T3 и т.п., вектор обязательно должен содержать промотор, необходимый для экспрессии в клетке, например, промотор SV40 (Mulligan et al., Nature (1979) 277, 108), промотор MMTV-LTR, промотор EFlα (Mizushima et al., Nucleic Acids Res. (1990) 18, 5322), промотор CMV или т.п., и, более предпочтительно, он должен содержать маркерный ген (такой как ген устойчивости к лекарственному средству, который можно идентифицировать с помощью лекарственного средства, такого как неомицин или G418), помогающий отбирать трансформированные клетки. Примеры вектора, имеющего такие характеристики, включают в себя, например, pMAM, pDR2, pBK-RSV, pBK-CMV, pOPRSV и pOP13.
Далее, чтобы обеспечить стабильную экспрессию гена и одновременно увеличение числа копий гена в клетке, в клетку CHO с дефицитом в пути синтеза нуклеиновых кислот вводят вектор (например, pCHOI и др.), содержащий ген DHFR, чтобы заполнить дефицит, и амплифицируют его с метотрексатом (MTX). Чтобы обеспечить временную экспрессию гена, трансформацию проводят с использованием вектора (такого как pcD), содержащего участок инициации репликации SV40, и с использованием клетки COS, содержащей на хромосоме ген, обеспечивающий экспрессию антигена SV40 T. В качестве участка инициации репликации можно использовать участок инициации из вируса полиомы, аденовируса, вируса бычьей папилломы (BPV) и т.п. Чтобы обеспечить увеличение числа копий гена в системе клетки-хозяина, вектор экспрессии может включать в себя, в качестве маркера селекции, ген аминогликозидтрансферазы (APH), ген тимидинкиназы (TK), ген ксантингуанинфосфорибозилтрансферазы E. coli (Ecogpt), ген дигидрофолатредуктазы (dhfr) и т.п.
Чтобы получить антитело настоящего изобретения, вектор вводят в клетку-хозяина. Клетка-хозяин, в которую вводят вектор, особо не ограничивается, однако она включает в себя, например, E. coli или любую животную клетку. Например, клетку-хозяина можно использовать как систему продуцирования для продуцирования или экспрессии антитела настоящего изобретения. Что касается системы продуцирования, используемой для получения полипептида, существует система продуцирования in vitro и система продуцирования in vivo. В системе продуцирования in vitro используются эукариотические и прокариотические клетки.
В качестве эукариотических клеток можно использовать, например, животные клетки, растительные клетки или грибковые клетки. Известные животные клетки включают в себя клетки млекопитающих, такие как клетки CHO (J. Exp. Med. (1995) 108, 945), клетки COS, клетки 3T3, клетки миеломы, клетки почек детенышей хомяков (BHK), клетки HeLa и клетки Vero, клетки амфибий, такие как яйцеклетки Xenopus (Valle, et al., Nature (1981) 291, 358-340), или клетки насекомых, такие как Sf9, Sf21 и Tn5. В настоящем изобретении предпочтительно используют клетки CHO-DG44, CHO-DXB11, COS7, BHK. Для обеспечения широкомасштабной экспрессии из животных клеток предпочтительно использовать клетки CHO. Введение вектора в клетку-хозяина можно осуществить, например, с использованием фосфата кальция, DEAE-декстрана, катионного рибозомного DOTAP (Boehringer Mannheim), метода электропорации, метода липофекции или т.п.
Из растительных клеток в качестве системы продуцирования белков используют, например, клетки Nicotiana tabacum, которые могут быть подвергнуты каллюсному культивированию. Примеры грибковых клеток включают в себя клетки дрожжей, например, относящихся к роду Saccharomyces, более конкретно, Saccharomyces cerevistae и Saccharomyces pombe, и гифомицетов, например, относящихся к роду Aspergillus, более конкретно, Aspergillus niger.
В случае прокариотических клеток можно использовать систему продуцирования с применением бактериальной клетки. Примеры бактериальных клеток включают в себя Escherichia coli (E. coli), такие как JM109, DH5α и HB101, и Bacillus subtilis.
Получение рекомбинантного антитела
Антитело настоящего изобретения можно получить путем культивирования вышеуказанных клеток-хозяев. Антитело можно получить путем культивирования in vitro клетки, трансформированной целевым полинуклеотидом. Культивирование можно проводить с помощью известного метода. Культуральная среда для животных клеток включает в себя, например, DMEM, MEM, RPMI 1640 и IMDM. Среда может быть дополнена сывороткой, такой как FBS или фетальная телячья сыворотка (FCS), или можно использовать среду, не содержащую сыворотки. pH в процессе культивирования предпочтительно находится в интервале от 6 до 8. Культивирование обычно проводят приблизительно при 30-40°C в течение приблизительно 15-200 часов, при необходимости, со сменой среды, при аэрации и встряхивании.
С другой стороны, системы для получения полипептида in vivo включают в себя, например, систему продуцирования, в которой используется животное, и систему продуцирования, в которой используется растение. Целевой полинуклеотид вводят в такое животное или растение, и в организме животного или растения продуцируется полипептид, который затем извлекают. Термин "клетка-хозяин" в данном описании охватывает такое животное и растение.
В случае использования животного доступны системы продуцирования с применением млекопитающего или насекомого. В качестве млекопитающих можно использовать коз, свиней, овец, мышей и крупный рогатый скот (Vicki Glaser, SPECTRUM Biotechnology Applications, 1993). Также можно использовать трансгенное млекопитающее.
Например, целевой полинуклеотид получают в виде гибридного гена с геном, кодирующим полипептид, который в природе продуцируется в молоке, например, козий казеин β. Затем фрагмент ДНК, содержащий данный гибридный ген, вводят в эмбрион козы и эмбрион трансплантируют козе. Целевое антитело можно получить из молока трансгенной козы, рожденной козой, получившей эмбрион, или ее потомка. Для увеличения количества продуцируемого молока, содержащего антитело, трансгенной козе при необходимости можно дать гормон. (Ebert, K. M. et al., Bio/Technology (1994) 12, 699-702).
В качестве насекомого, например, можно использовать тутового шелкопряда. В случае использования тутового шелкопряда, его инфицируют бакуловирусом, в который встроен полинуклеотид, кодирующий целевое антитело. Целевое антитело можно получить из жидкости организма тутового шелкопряда (Susumu, M. et al., Nature (1985) 315, 592-594).
В качестве растения можно использовать, например, табак. При использовании табака полинуклеотид, кодирующий целевое антитело, вставляют в вектор экспрессии для растения, например, pMON 530, а затем вектор вводят в бактерию, такую как Agrobacterium tumefaciens. Затем табак, такой как Nicotiana tabacum, инфицируют бактерией и в результате из листьев табака получают целевое антитело (Julian, K. -C. Ma et al., Eur. J. Immunol. (1994) 24, 131-138).
Полученное таким образом антитело можно выделить из внутренней или наружной (культуральная среда и т.п.) среды клетки-хозяина и затем его можно очистить практически до чистого состояния и однородного антитела. Выделение и очистку антитела можно проводить с помощью метода выделения и очистки, который обычно используется для очистки полипептидов. Например, полипептиды можно выделять и очищать любыми методами, включая колоночную хроматографию, фильтрацию, ультрафильтрацию, высаливание, осаждение растворителем, экстракцию растворителем, перегонку, иммунопреципитацию, электрофорез на SDS-полиакриламдном геле, гель-электрофорез, изоэлектрическое фокусирование, диализ, перекристаллизацию, а также их сочетание.
Примеры хроматографических методов включают в себя, например, аффинную хроматографию, ионообменную хроматографию, гидрофобную хроматографию, гель-фильтрацию, хроматографию на обращенной фазе, адсорбционную хроматографию (Strategies for Protein Purification and Characterization: A Laboratory Course Manual. Ed Daniel R. Marshak et al., Cold Spring Harbor Laboratory Press, 1996). Указанные хроматографические методы можно проводить с использованием жидкостной хроматографии, такой как ВЭЖХ и FPLC (fast-protein liquid chromatography - жидкостная экспресс-хроматография белков). Примеры колонок, используемых для аффинной хроматографии, включают в себя колонку с белком A или колонку с белком G. Примером колонки с белком A является Hyper D, POROS, Sepharose F. F. (Pharmacia).
Кроме того, до или после очистки, по мере необходимости, антитело можно модифицировать, или можно частично удалить пептиды, путем использования подходящего фермента, модифицирующего белки. Используемый для данной цели фермент, модифицирующий белки, включает в себя, например, трипсин, химотрипсин, лизилэндопептидазу, протеинкиназу, глюкозидазу.
Диагностический метод
В другом аспекте настоящее изобретение предлагает метод диагностики заболевания, такого как рак, путем детекции белка GPC3 в анализируемом образце с помощью антитела настоящего изобретения.
Используемая в данном описании детекция включает в себя количественную детекцию и неколичественную детекцию. Неколичественная детекция включает в себя, например, просто определение присутствия белка GPC3, определение присутствия конкретного количества или более белка GPC3, сравнение количества белка GPC3 с его количеством в другом образце (например, в контрольном образце). Количественная детекция включает в себя определение концентрации белка GPC3, определение количества белка GPC3.
Анализируемый образец особо не ограничивается, пока он представляет собой образец, который может содержать белок GPC3, однако предпочтительно он представляет собой образец, взятый у живого организма, такого как млекопитающее, и более предпочтительно он представляет собой образец, взятый у человека. Конкретные примеры анализируемого образца могут включать в себя, например, кровь, интерстициальную жидкость, плазму, внесосудистую жидкость, мозговую жидкость, синовиальную жидкость, плевральную жидкость, сыворотку, лимфатическую жидкость, слюну, предпочтительно кровь, сыворотку и плазму. Кроме того, термин "анализируемый образец настоящего изобретения" также включает в себя образец, полученный из анализируемого образца, такой как культуральный раствор клеток, собранных от живого организма.
Вид диагностируемого рака особо не ограничивается, и конкретные примеры могут включать в себя рак печени, рак поджелудочной железы, рак легкого, рак толстой кишки, рак молочной железы, рак простаты, лейкоз и лимфому, предпочтительно рак печени. Детектируемый GPC3 особо не ограничивается и может представлять собой либо полноразмерный GPC3, либо его фрагмент. Если детектируют фрагмент GPC3, он может представлять собой либо N-концевой фрагмент, либо C-концевой фрагмент, однако N-концевой фрагмент является предпочтительным. Кроме того, белок GPC3 может представлять собой GPC3 с добавленным гепарансульфатом или коровый белок GPC3.
Метод детекции белка GPC3, содержащегося в анализируемом образце, особо не ограничивается, однако детекцию предпочтительно проводят иммунологическим методом с использованием антитела против GPC3. Примеры иммунологических методов включают в себя, например, радиоиммунологический анализ, иммуноферментный анализ, иммунофлуоресцентный анализ, иммунолюминесцентный анализ, иммунопреципитацию, турбидиметрический иммунологический анализ. Предпочтительно использовать иммуноферментный анализ, особенно предпочтительно, твердофазный иммуноферментный анализ (ELISA) (например, сэндвич-метод ELISA). Вышеуказанный иммунологический анализ, такой как ELISA, можно проводить известным в данной области методом.
Общий метод детекции с использованием антитела против GPC3 включает в себя иммобилизацию антитела против GPC3 на подложке, добавление анализируемого образца, инкубацию подложки, чтобы обеспечить связывание антитела против GPC3 с белком GPC3, промывание подложки и детекцию связывания белка GPC3 с подложкой посредством антитела против GPC3 в анализируемом образце.
Связывание антитела против GPC3 с белком GPC3 обычно протекает в буфере. Буферы, используемые в данном изобретении, включают в себя, например, фосфатный буфер, Tris-буфер. Инкубацию проводят в обычных условиях, например, при температуре от 4°C до комнатной, в течение 1-24 часов. Промывание после инкубации можно проводить любым методом, который не сопровождается ингибированием связывания белка GPC3 с антителом против GPC3, с использованием, например, буфера, содержащего поверхностно-активное вещество, такое как Tween 20.
В способе детекции белка GPC3 настоящего изобретения кроме образца, анализируемого на белок GPC3, может присутствовать контрольный образец. Контрольные образцы включают в себя образцы отрицательного контроля, которые не содержат белка GPC3, и образцы положительного контроля, которые содержат белок GPC3. В данном случае белок GPC3 в анализируемом образце можно детектировать путем сравнения результатов, полученных с использованием образца отрицательного контроля, который не содержит белок GPC3, с результатами, полученными с использованием образца положительного контроля, который содержит белок GPC3. Белок GPC3, содержащийся в анализируемом образце, также можно количественно определить путем получения результатов детекции контрольных образцов и анализируемого образца в виде числовых значений и сравнения полученных числовых значений.
Предпочтительным воплощением детекции связывания белка GPC3 с подложкой посредством антитела против GPC3 является метод, в котором используется антитело против GPC3, меченное детектируемой меткой. Например, белок GPC3 можно детектировать путем приведения в контакт анализируемого образца с антителом против GPC3, иммобилизованным на подложке, промывания подложки и затем детекции GPC3 с помощью меченого антитела, которое специфически связывается с белком GPC3.
Антитело против GPC3 можно метить с помощью общеизвестного метода. Примеры известных в данной области детектируемых меток включают в себя флуоресцентный краситель, фермент, кофермент, хемилюминесцентное вещество или радиоактивное вещество. Конкретные примеры могут включать в себя радиоактивные изотопы (32P, 14C, 125I, 3H, 131I и т.п.), флуоресцеин, родамин, дансилхлорид, умбеллиферон, люциферазу, пероксидазу, щелочную фосфатазу, β-галактозидазу, β-глюкозидазу, пероксидазу хрена, глюкоамилазу, лизозим, сахаридоксидазу, микропероксидазу, биотин и т.п. В случае использования биотина в качестве детектируемой метки предпочтительно добавлять меченное биотином антитело и затем авидин, конъюгированный с ферментом, таким как щелочная фосфатаза.
Конкретно, раствор, содержащий антитело против GPC3, добавляют к подложке, такой как планшет, чтобы иммобилизовать на ней антитело против GPC3. После промывания планшет блокируют, например, с помощью БСА, чтобы предотвратить неспецифическое связывание белка. Планшет снова промывают и затем анализируемый образец добавляют к планшету. После инкубации планшет промывают и затем добавляют меченое антитело против GPC3. После инкубации в соответствующих условиях планшет промывают и затем детектируют меченое антитело против GPC3, оставшееся на планшете. Белок можно детектировать известным в данной области методом. Например, если антитело метят радиоактивным веществом, белок можно детектировать с помощью жидкостного сцинтилляционного анализа или методом РИА. Если антитело метят ферментом, белок можно детектировать путем добавления субстрата и детекции ферментативного изменения субстрата, такого как развитие окраски, с помощью устройства считывания абсорбции. Если антитело метят флуоресцентным веществом, белок можно детектировать с помощью флуориметра.
Особенно предпочтительным воплощением метода детекции белка GPC3 настоящего изобретения является метод, в котором используется антитело против GPC3, меченное биотином и авидином. Конкретно, раствор, содержащий антитело против GPC3, добавляют к подложке, такой как планшет, чтобы иммобилизовать на ней антитело против GPC3. После промывания планшет блокируют, например, с помощью БСА, чтобы предотвратить неспецифическое связывание белка. Планшет снова промывают и затем анализируемый образец добавляют к планшету. После инкубации планшет промывают и затем добавляют антитело против GPC3, меченное биотином. После инкубации в соответствующих условиях планшет промывают и затем добавляют авидин, конъюгированный с ферментом, таким как щелочная фосфатаза или пероксидаза. После инкубации планшет промывают и затем добавляют субстрат фермента, конъюгированного с авидином. Затем белок GPC3 детектируют по ферментативному изменению субстрата как индикатора.
Другим воплощением метода детекции белка GPC3 настоящего изобретения является метод, в котором используется первичное антитело, которое специфически связывается с белком GPC3, и вторичное антитело, которое специфически связывается с первичным антителом. Например, анализируемый образец приводят в контакт с антителом против GPC3, иммобилизованным на подложке, подложку инкубируют, промывают и связанный белок GPC3 после промывания детектируют с помощью первичного антитела против GPC3 и вторичного антитела, которое специфически связывается с первичным антителом. В данном случае вторичное антитело предпочтительно метят детектируемой меткой.
Конкретно, раствор, содержащий антитело против GPC3, добавляют к подложке, такой как планшет, чтобы иммобилизовать на ней антитело против GPC3. После промывания планшет блокируют, например, с помощью БСА, чтобы предотвратить неспецифическое связывание белка. Планшет снова промывают и затем анализируемый образец добавляют к планшету. После инкубации планшет промывают и затем добавляют первичное антитело против GPC3. После инкубации в соответствующих условиях планшет промывают и затем добавляют вторичное антитело, которое специфически связывается с первичным антителом. После инкубации в соответствующих условиях планшет промывают и затем детектируют вторичное антитело, оставшееся на планшете. Вторичное антитело можно детектировать вышеупомянутым методом.
Фармацевтическая композиция
В другом аспекте настоящее изобретение предлагает фармацевтическую композицию, содержащую антитело настоящего изобретения. Фармацевтическую композицию, содержащую антитело настоящего изобретения, используют для лечения и/или профилактики заболевания, связанного с пролиферацией клеток, такого как рак, и особенно ее используют для лечения и/или профилактики рака печени. Если антитело настоящего изобретения используют в виде фармацевтической композиции, антитело может быть введено в состав лекарственной формы известным в данной области способом. Например, фармацевтическую композицию можно вводить парентерально путем инъекции стерильного раствора или суспензии в воде, или другого фармацевтически приемлемого раствора. Например, антитело можно ввести в состав лекарственной формы путем смешивания его подходящим образом с фармацевтически приемлемым носителем или растворителем, таким как стерильные вода, физиологический раствор, растительное масло, эмульгатор, суспензия, поверхностно-активное вещество, стабилизатор, флаворант, эксципиент, носитель, консервант, связующее средство, с получением стандартной лекарственной формы, соответствующей общепринятым требованиям применения лекарственных средств (Drug Implementation). Количество активных ингредиентов в данных препаратах выбирают так, чтобы обеспечить введение подходящей дозы в указанном интервале.
Стерильную композицию для инъекций можно получить с использованием такого носителя, как дистиллированная вода для инъекций, в соответствии с общими положениями по применению лекарственных средств.
Примеры водного раствора для инъекций включают в себя, например, физиологический раствор, раствор глюкозы и другие изотонические жидкости, включающие в себя добавки, такие как D-сорбит, D-манноза, D-маннит и хлорид натрия. Их можно использовать в сочетании с подходящим солюбилизатором, таким как спирт, особенно этанол, многоатомный спирт, такой как пропиленгликоль и полиэтиленгликоль, и неионное поверхностно-активное вещество, такое как полисорбат 80 (TM) и HCO-50.
Кунжутное масло или соевое масло можно использовать в качестве маслянистой жидкости в сочетании с бензилбензоатом или бензиловым спиртом в качестве солюбилизатора. Оно может входить в состав композиции вместе с буфером, таким как фосфатный буфер или натрий-ацетатный буфер, обезболивающим средством, таким как прокаина гидрохлорид, стабилизатором, таким как бензиловый спирт или фенол, или антиоксидантом. Полученным раствором для инъекции обычно заполняют подходящую ампулу.
Предпочтительно используют парентеральное введение, конкретные примеры которого включают в себя инъекцию, трансназальное введение, транспульмональное введение, чрескожное введение и т.п. Композицию для инъекции можно вводить системно или местно путем внутривенной инъекции, внутримышечной инъекции, внутрибрюшинной инъекции, подкожной инъекции или т.п.
В зависимости от возраста пациента и симптомов заболевания выбирают подходящий способ введения. Например, одна доза фармацевтической композиции, содержащей антитело или полинуклеотид, кодирующий антитело, может быть выбрана из интервала от 0,0001 мг до 1000 мг на кг массы тела. Альтернативно, например, доза может быть выбрана из интервала от 0,001 мг до 100000 мг/организм пациента, хотя она не всегда ограничивается указанными числовыми значениями. Дозу и способ введения выбирает специалист в данной области в зависимости от массы тела и возраста пациента и симптомов заболевания.
Все патенты и ссылки, цитируемые в данном описании, включены в него в качестве ссылки. Все содержание, раскрытое в описании и рисунках патентной заявки Японии № 2004-203637, по отношению к которой данная заявка заявляет приоритет, включено в данное описание в качестве ссылки.
ПРИМЕРЫ
Настоящее изобретение будет описано более подробно со ссылкой на приведенные ниже примеры. Однако настоящее изобретение не ограничивается данными примерами.
Пример 1
кДНК-клонирование человеческого глипикана 3 (GPC3)
Полноразмерную кДНК, кодирующую человеческий GPC3, амплифицируют методом ПЦР, используя набор Advantage 2 (CLONTECH) и одноцепочечную кДНК, полученную обычным методом из клеточной линии рака толстой кишки, Caco2, в качестве матрицы. Более конкретно, 50 мкл реакционной смеси, содержащей 2 мкл кДНК, полученной из Caco2, 1 мкл смыслового праймера (GATATC-ATGGCCGGGACCGTGCGCACCGCGT: SEQ ID NO: 1), 1 мкл антисмыслового праймера (GCTAGC-TCAGTGCACCAGGAAGAAGAAGCAC: SEQ ID NO: 2), 5 мкл 10× буфера для ПЦР Advantage 2, 8 мкл смеси dNTP (1,25 мМ) и 1,0 мкл полимеразной смеси Advantage подвергают 35 циклам, включающим в себя 94°C в течение 1 минуты, 63°C в течение 30 секунд и 68°C в течение 3 минут. Амплифицированный продукт реакции ПЦР вставляют в вектор TA, pGEM-T Easy, используя pGEM-T Easy Vector System I (Promega). Последовательность подтверждают с помощью ДНК-секвенатора ABI 3100. Таким образом, выделяют кДНК, кодирующую полноразмерный человеческий GPC3. Последовательность, описанная в SEQ ID NO: 3, соответствует нуклеотидной последовательности гена человеческого GPC3, а последовательность, описанная в SEQ ID NO: 4, соответствует аминокислотной последовательности человеческого белка GPC3.
Пример 2
Получение растворимой формы GPC3
Получают иммунный белок для образования антитела против GPC3, растворимую форму белка GPC, в которой удален гидрофобный участок на С-концевой стороне (аминокислоты 564-580).
Используя в качестве матрицы кДНК полноразмерного человеческого GPC3, проводят реакцию ПЦР с использованием антисмыслового праймера (ATA GAA TTC CAC CAT GGC CGG GAC CGT GCG C: SEQ ID NO: 5) и смыслового праймера, к которому добавляют последовательность распознавания EcoRI и последовательность Козака (ATA GGA TCC CTT CAG CGG GGA ATG AAC GTT C: SEQ ID NO: 6). Фрагмент, полученный в результате реакции ПЦР (1711 п.о.), клонируют в pCXND2-Flag. Конструируют pCXND2-Flag для экспрессии Flag-меченного белка путем вставки участка, обеспечивающего экспрессию гена DHFR pCHOI (Hirata et al., FEBS letter 1994; 356; 244-248), в сайт HindIII pCXN2 (Niwa et al., Gene 1991; 108; 193-199) и добавления маркерной последовательности ниже участка мультиклонирования. Сконструированную экспрессионную плазмиду ДНК вводят в клеточную линию CHO, DXB11, и клеточную линию CHO, эффективно экспрессирующую растворимую форму GPC3, получают в результате селекции с использованием 500 мкг/мл генетицина. Проводят широкомасштабное культивирование клеточной линии CHO, эффективно экспрессирующей растворимую форму GPC3, используя 1700-см2 роллерный флакон, и извлекают культуральный супернатант для выделения антитела. Культуральный супернатант наносят на колонку Fast Flow с DEAE-сефарозой (Amersham), после промывания антитело элюируют буфером, содержащим 500 мМ NaCl, и подвергают его аффинной очистке, используя агарозный аффинный гель Anti-Flag M2 (SIGMA). Элюирование проводят с использованием 200 мкг/мл пептида FLAG. После концентрирования элюата с помощью Centriprep-10 (Millipore), пептид FLAG удаляют гель-фильтрацией с использованием Superdex 200 HR 10/30 (Amersham). И наконец, фильтрат концентрируют, используя колонку Fast Flow с DEAE-сефарозой, и элюируют PBS (содержащим 500 мМ NaCl), не содержащим Tween 20, чтобы обеспечить замену буфера.
Пример 3
Получение растворимой формы корового белка GPC3
GPC3 модифицируют гепарансульфатом с получением макромолекулы. Чтобы в скрининге на антитело против GPC3 устранить антитело против гепарансульфата, получают растворимую форму корового белка GPC3, который имеет мутацию в участке связывания гепарансульфата, и используют его в скрининге.
Используя вышеупомянутую растворимую форму GPC3 (1-563) в качестве матрицы, кДНК, в которой остатки Ser в положениях 495 и 509 заменены на Ala, получают путем сборки методом ПЦР, в котором используются праймеры, сконструированные так, чтобы обеспечить добавление His-маркера к C-концу. Полученную кДНК клонируют в векторе pCXND3. pCXND3 конструируют путем вставки участка pCHOI, обеспечивающего экспрессию гена DHFR, в участок HindIII pCXN2. Сконструированную экспрессионную плазмиду ДНК вводят в клеточную линию DXB11, и клеточную линию CHO, эффективно экспрессирующую растворимую форму корового белка GPC3, получают в результате селекции с использованием 500 мкг/мл генетицина.
Проводят широкомасштабное культивирование, используя 1700-см2 роллерный флакон, и извлекают культуральный супернатант для выделения антитела. Культуральный супернатант наносят на колонку Fast Flow с Q-сефарозой (Amersham). После промывания антитело элюируют фосфатным буфером, содержащим 500 мМ NaCl, и подвергают его аффинной очистке, используя колонку Fast Flow с хелатирующей сефарозой (Amersham). Антитело элюируют градиентом 10-150 мМ имидазола. И наконец, элюат концентрируют, используя колонку Fast Flow с Q-сефарозой, и элюируют фосфатным буфером, содержащим 500 мМ NaCl.
Электрофорез на SDS-полиакриламидном геле в восстанавливающих условиях показывает три полосы, соответствующих 70 кДа, 40 кДа и 30 кДа. Результат аминокислотного секвенирования с помощью белкового секвенатора ABI492 (Applied Biosystems) показывает, что полоса 30 кДа соответствует аминокислотной последовательности GPC3, начиная с 359-ой аминокислоты и ниже, или с 375-ой аминокислоты и ниже, позволяя предположить, что GPC3 расщепляется между Arg358 и Ser359 или между Lys374 и Val375, следовательно, он разделяется на N-концевой фрагмент размером 40 кДа и C-концевой фрагмент размером 30 кДа.
Пример 4
Получение клеточной линии CHO, экспрессирующей полноразмерный человеческий GPC3
Для оценки связывающей активности с помощью проточной цитометрии получают клеточную линию CHO, экспрессирующую полноразмерный GPC3.
Смешивают десять микрограмм вектора экспрессии, содержащего ген полноразмерного человеческого GPC3, и 60 мкл SuperFect (QIAGEN). После образования комплекса осуществляют введение гена путем добавления его к клеточной линии CHO, DXB11. После культивирования в течение 24 часов в CO2-инкубаторе начинают селекцию, используя среду αMEM (GIBCO BRL), содержащую генетицин с конечной концентрацией 0,5 мг/мл и 10% FBS. Собирают полученные устойчивые к генетицину колонии и проводят клонирование клеток, используя метод лимитирующих разведений. Каждый клеточный клон солюбилизируют и подтверждают экспрессию полноразмерного человеческого GPC3 методом вестерн-блоттинга с использованием антитела против GPC3. Таким образом, получают клеточную линию со стабильной экспрессией.
Пример 5
Определение связывающей активности методом ELISA
Растворимую форму корового белка GPC3 разбавляют до концентрации 1 мкг/мл буфером для покрытия (0,1 моль/л NaHCO3 (pH 9,6), 0,02% (масс./об.) NaN3), вносят в иммунопланшет и оставляют при 4°C в течение ночи, чтобы завершилось покрытие планшета. После блокирования планшета буфером для разбавления (50 ммоль/л Tris-HCl (pH 8,1), 1 ммоль/л MgCl2, 150 ммоль/л NaCl, 0,05% (об./об.) Tween 20, 0,02% (масс./об.) NaN3, 1% (масс./об.) BSA) добавляют антитело против GPC3 и оставляют стоять при комнатной температуре в течение 1 часа. Промывают буфером для промывания (0,05% (об./об.) Tween 20, PBS), затем добавляют антитело против мышиных IgG (ZYMED), меченное щелочной фосфатазой, и оставляют стоять при комнатной температуре в течение 1 часа. Промывают буфером для промывания, затем добавляют SIGMA 104 (SIGMA), разбавленный до концентрации 1 мг/мл субстратным буфером (50 ммоль/л NaHCO3 (pH 9,8), 10 ммоль/л MgCl2), и оставляют стоять при комнатной температуре в течение 1 часа для развития окраски. Затем измеряют поглощение (при 405 нм, длина волны сравнения 655 нм) с помощью Benchmark Plus (BIO-RAD).
Пример 6
Иммунизация растворимой формой GPC3 и селекция гибридомы
Поскольку человеческий GPC3 и мышиный GPC3 обладают высокой гомологией, 94%, на аминокислотном уровне, считается, что трудно получить антитело против GPC3, если иммунизируют нормальную мышь. Поэтому в качестве иммунизируемого животного используют мышь с аутоиммунным заболеванием, мышь MRL/MpJUmmCrj-lpr/lpr, (далее упоминается как мышь MRL/lpr, поставляемая Charles River Japan, Inc.). Мышей начинают иммунизировать в возрасте 7 или 8 недель. Первую иммунизацию проводят следующим образом: получают растворимую форму GPC3 в количестве 100 мкг/особь, эмульгируют, используя полный адъювант Фрейнда (FCA, Becton Dickinson), и вводят подкожно. Через две недели получают растворимую форму GPC3 в количестве 50 мкг/особь, эмульгируют, используя неполный адъювант Фрейнда (FIA, Becton Dickinson), и вводят подкожно. Затем каждую неделю проводят дополнительную иммунизацию, всего 5 раз. Во время последней иммунизации двум иммунизированным мышам вводят в хвостовую вену растворимую форму GPC3, разбавленную PBS до 50 мкг/особь. На четвертый день после последней иммунизации селезенку удаляют и получают клетки селезенки, которые смешивают с клетками мышиной миеломы, P3-X63Ag8U1 (P3U1, полученными от ATCC), в соотношении 2:1. Гибридизацию клеток проводят путем постепенного добавления PEG 1500 (Roche Diagnostic). Осторожно добавляют среду RPMI 1640 (GIBCO BRL), чтобы разбавить PEG 1500, затем PEG 1500 удаляют центрифугированием, клетки суспендируют в среде RPMI 1640, содержащей 10% FBS, и вносят в 96-луночный культуральный планшет в количестве 100 мкл/лунку. На следующий день добавляют среду RPMI 1640, содержащую 10% FBS, добавку к среде 1× HAT (SIGMA) и добавку для клонирования гибридомы 0,5× BM-Condimed H1 Hybridoma (Roche Diagnostic) (далее упоминается как среда HAT), в количестве 100 мкл/лунку. Через 2, 3 и 5 дней половину культурального раствора заменяют на среду HAT. Через 7 дней проводят скрининг с использованием культурального супернатанта. Скрининг проводят методом ELISA, используя иммунопланшет, покрытый растворимой формой корового белка GPC3. Позитивный клон подвергают моноклонированию методом лимитирующих разведений. В результате получают 11 клонов антител (M3C11, M13B3, M1E7, M3B8, M11F1, L9G11, M19B11, M6B1, M18D4, M5B9 и M10D2), которые обладают сильной связывающей активностью по отношению к GPC3.
Пример 7
Определение изотипа и очистка антитела против GPC3
Изотип определяют методом антиген-зависимого ELISA c использованием набора I для определения изотипов иммуночистых моноклональных антител (PIERCE). Очистку антител проводят следующим образом. Культуральный супернатант гибридомы, культивированной со средой HAT, дополненной FBS (Ultra low IgG) (GIBCO BRL), адсорбируют на Hi Trap ProteinG HP (Amersham) и промывают буфером для связывания (20мМ фосфат натрия (pH 7,0)). Антитело элюируют буфером для элюирования (0,1M глицин-HCl (pH 2,7)). Элюат сразу нейтрализуют буфером для нейтрализации (1M Tris-HCl (pH 9,0)) и диализуют против PBS в течение дня и ночи, чтобы заменить буфер.
Пример 8
Определение связывающей активности методом ELISA
Чтобы оценить связывающую активность полученного ранее антитела против GPC3, определяют зависимое от концентрации связывание антитела с иммунопланшетом, содержащим иммобилизованную растворимую форму корового белка GPC3. Добавляют серии 3-кратных разбавлений (всего 12 разбавлений) очищенного антитела с концентрацией 10 мкг/мл и в качестве вторичного антитела добавляют антитело против мышиных IgG. Развитие окраски осуществляют с использованием SIGMA 104. Поскольку степень развития окраски зависит от времени развития окраски, анализируют данные, полученные точно через 1 час. Каждое антитело дает зависимое от концентрации развитие окраски. Строят график зависимости развития окраски от концентрации антитела и с помощью анализирующего программного обеспечения, GraphPad Prism, получают аппроксимированную кривую. Определяют значение EC50 для антитела и используют его как показатель связывающей активности. Значения EC50 для всех клонов приведены на фиг.16.
Пример 9
Определение связывающей активности с помощью проточной цитометрии
Клетки разъединяют с помощью 1мМ EDTA pH 8,0 (GIBCO)/PBS и суспендируют в буфере FACS (1% FBS/PBS) в концентрации 1×106 клеток/мл. Суспензию вносят в фильтровальный планшет Multiscreen–HV (Millopre) в количестве 100 мкл/лунку и супернатант удаляют центрифугированием. Добавляют антитело против GPC3, разбавленное до подходящей концентрации, и оставляют взаимодействовать на льду в течение 30 минут. Клетки промывают один раз буфером FACS, добавляют FITC-меченое антитело против мышиных IgG и оставляют взаимодействовать на льду в течение 30 минут. После завершения реакции клетки центрифугируют при 500 об/мин в течение 1 минуты и супернатант удаляют. Клетки суспендируют в 400 мкл буфера FACS и анализируют методом проточной цитометрии. В качестве проточного цитометра используют EPICS ELITE ESP (Beckman Coulter). Область живых клеток выбирают по гистограмме с прямым и боковым рассеянием. Как показано на фиг.1, антитело против GPC3 (M3C11, M11F1) хорошо связывается с клеткой CHO, экспрессирующей GPC3, и не связывается с родительской клеткой CHO, указывая на то, что антитело специфически связывается с GPC3, презентированным на клеточной мембране. Кроме того, антитело обладает связывающей активностью по отношению к клеточной линии гепатомы, HepG2 (полученной от ATCC) и HuH-7 (полученной от Health Science Research Resources Bank), позволяя предположить, что антитело может специфически распознавать гепатому. Определенная методом проточной цитометрии связывающая активность клонов, полученных от мышей, иммунизированных растворимой формой GPC3, приведена на фиг.16, где указаны Х-значения гистограммы для концентрации антитела 5 мкг/мл.
Пример 10
Классификация по эпитопам с помощью конкурентного анализа ELISA
Полученные антитела классифицируют по эпитопам с помощью конкурентного анализа ELISA. Антитела биотинилируют, используя набор для мечения биотином (Roche). Растворимую форму корового белка GPC3 разбавляют буфером для покрытия до концентрации 1 мкг/мл, вносят в планшет в количестве 100 мкл/лунку и выдерживают при 4°C в течение ночи, чтобы на планшете образовалось покрытие. На следующий день проводят блокирование путем добавления 200 мкл субстратного буфера. Планшет оставляют при 4°C в течение ночи или дольше, добавляют антитело против GPC3 в количестве 100 мкл/лунку и оставляют взаимодействовать при комнатной температуре в течение 1 часа. После этого, не промывая планшет, добавляют 10 мкл меченного биотином антитела против GPC3 в концентрации 10 мкг/мл и оставляют взаимодействовать еще на 1 час. Планшет промывают 3 раза буфером для промывания по 300 мкл/лунку. Конъюгат AP-стрептавидин (ZYMED) разбавляют в 1000 раз буфером для разбавления, добавляют в количестве 100 мкл/лунку и оставляют взаимодействовать при комнатной температуре в течение 1 часа. Планшет промывают 5 раз буфером для промывания по 300 мкл/лунку. SIGMA 104 разбавляют до концентрации 1 мг/мл субстратным буфером и добавляют в количестве 100 мкл/лунку. После инкубации при комнатной температуре в течение 1 часа измеряют поглощение (при 405 нм, длина волны сравнения 655 нм).
Результаты конкурентного анализа ELISA приведены на фиг.2. Считается, что эпитопы антитела, которое конкурентно ингибирует связывание биотинилированного антитела на 50% или более, в трехмерной конформации расположены близко друг к другу. В результате классификации в соответствии с характером развития окраски при конкурентном ингибировании связывания 8 типов биотинилированных антител, 11 клонов, полученных от мышей, иммунизированных растворимой формой GPC3, подразделяют на 5 групп (a, b, c, d и e) (фиг.16).
Пример 11
Классификация по эпитопам методом Вестерн-блоттинга
Растворимую форму корового белка GPC3 наносят на мини-пластину 10% SDS-PAGE (TEFCO) и подвергают электрофорезу в восстанавливающих условиях. Затем переносят на Immobilon-P (Millipore), используя ячейку для электрофоретического полусухого переноса Trans-Blot SD (BIO-RAD). После краткого промывания мембраны TBS-T (0,05% Tween 20, TBS), ее встряхивают в TBS-T, содержащем 5% обезжиренного молока, в течение 1 часа. Мембрану встряхивают в TBS-T в течение приблизительно 10 минут, затем добавляют каждое антитело против GPC3, разбавленное TBS-T, содержащим 1% обезжиренного молока, и мембрану встряхивают в течение 1 часа. Мембрану промывают TBS-T, встряхивают в растворе HRP-антитела против мышиных IgG (Amersham), разбавленного TBS-T, содержащим 1% обезжиренного молока, в течение 1 часа, и затем промывают TBS-T. Для развития окраски, которую детектируют с помощью Hyperfilm ECL (Amersham), добавляют ECL-Plus (Amersham).
Как показано на фиг.3, L9G11 определяют как антитело, связывающееся с N-концом, так как оно связывается с полосой, соответствующей приблизительно 40 кДа. M3C11 определяют, как антитело, связывающееся с С-концом, так как оно связывается с полосой, соответствующей приблизительно 30 кДа. Все антитела, которые относят к группе c, d или e по результатам конкурентного анализа ELISA, связываются с N-концом, а все антитела, относящиеся к группе a или b, связываются с C-концом (фиг.16). По данным вестерн-блоттинга L9G11 имеет более высокую чувствительность обнаружения, чем другие антитела, которые связываются с N-концом, позволяя предположить, что данное антитело можно использовать для детекции N-концевого фрагмента методом вестерн-блоттинга.
Пример 12
Детекция секретируемой формы GPC3
После того как было обнаружено, что GPC3 расщепляется по 358-ому или по 374-ому аминокислотному остатку, авторы данного изобретения выдвинули гипотезу, что секретируемая форма GPC3 поступает в кровь пациента с раком печени. В связи с этим, чтобы детектировать секретируемую форму GPC3, была разработана сэндвич-система ELISA для детекции GPC3.
Иммунопланшет покрывают антителом против GPC3 в концентрации 10 мкг/мл и блокируют субстратным буфером. Иммунопланшет держат несколько часов при комнатной температуре или в течение ночи при 4°C, затем добавляют культуральный супернатант HepG2 и инкубируют 1 час при комнатной температуре. Иммунопланшет промывают 3 раза буфером для промывания по 300 мкл/лунку, добавляют меченное биотином антитело против GPC3, разбавленное до 10 мкг/мл, и инкубируют 1 час при комнатной температуре. Иммунопланшет промывают 3 раза буфером для промывания по 300 мкл/лунку, добавляют AP-стрептавидин и инкубируют 1 час при комнатной температуре. Иммунопланшет промывают 5 раз буфером для промывания по 300 мкл/лунку. Обеспечивают развитие окраски с помощью AMPAK (DAKO) в соответствии с прилагаемой инструкцией и измеряют поглощение с помощью спектрофотометра для чтения микропланшетов. Антитела, связывающиеся с N-концом (M6B1, M19B11 и M18D4), и антитела, связывающиеся с С-концом (M3C11, M13B3 и M3B8), объединяют для создания пяти сэндвич-систем ELISA. Все указанные сочетания обладают одинаковой чувствительностью по стандартной кривой, полученной с использованием секретируемой формы GPC3. Данные системы оценивают с использованием культурального супернатанта HepG2. При использовании сочетания антител, связывающихся с N-концом, детектируют высокую концентрацию секретируемой формы GPC3, приблизительно 1 мкг/мл (фиг.4). При использовании сочетания антител, связывающихся с С-концом, детектируют низкую концентрацию, это позволяет предположить, что в секретируемой форме GPC3 присутствует преимущественно N-концевой фрагмент.
Затем культуральный супернатант HepG2 подвергают иммунопреципитации, используя антитело против GPC3 для детекции секретируемой формы GPC3. При использовании M10D2, который связывается с N-концевым фрагментом, детектируют секретируемую форму GPC3 размером 40 кДа (фиг.5). С другой стороны, при использовании M1E7, который связывается с С-концевым фрагментом, секретируемую форму GPC3 не обнаруживают. Иммунопреципитацию проводят для всех полученных антител против GPC3. Секретируемая форма GPC3 хорошо обнаруживается с помощью всех антител, связывающихся с N-концевым фрагментом, тогда как при применении антител, связывающихся с С-концевым фрагментом, секретируемая форма GPC3 не обнаруживается или обнаруживается плохо (фиг.16). Предположительно, антитело, которое позволяет детектировать секретируемую форму GPC3 методом иммунопреципитации, можно использовать для диагностики гепатомы. Кроме того, предполагают, что антитело, с помощью которого секретируемая форма GPC3 детектируется плохо, можно использовать для разработки терапевтического антитела, обладающего ADCC-активностью и CDC-активностью, поскольку такое антитело может мигрировать к участку, пораженному гепатомой, не улавливаясь секретируемой формой GPC3, присутствующей в крови.
Пример 13
Клонирование вариабельного участка антитела против GPC3
Вариабельный участок антитела против GPC3 амплифицируют методом ПЦР с обратной транскриптазой с использованием общей РНК, экстрагированной из гибридомы, продуцирующей антитело против GPC3. Общую РНК экстрагируют из 1×107 клеток гибридомы с использованием наборов RNeasy Plant Mini (QIAGEN). 5’-Концевой фрагмент гена амплифицируют, используя 1 мкг общей РНК, набор для амплификации кДНК SMART RACE (CLONTECH) и любой из нижеследующих синтетических олигонуклеотидов:
синтетический олигонуклеотид MHC-IgG1, комплементарный последовательности константного участка мышиного IgG1:
GGG CCA GTG GAT AGACAG ATG (SEQ ID NO: 7);
синтетический олигонуклеотид MHC-IgG2a, комплементарный последовательности константного участка мышиного IgG2a:
CAG GGG CCA GTG GAT AGA CCG ATG (SEQ ID NO: 8);
синтетический олигонуклеотид MHC-IgG2b, комплементарный последовательности константного участка мышиного IgG2b:
CAG GGG CCA GTG GAT AGA CTG ATG (SEQ ID NO: 9); и
синтетический олигонуклеотид каппа, комплементарный последовательности константного участка мышиной каппа-цепи:
GCT CAC TGG ATG GTG GGA AGA TG (SEQ ID NO: 10).
Реакцию обратной транскрипции проводят при 42°C в течение 1 часа и 30 минут. Смесь для ПЦР (50 мкл) содержит 5 мкл буфера для ПЦР 10× Advantage 2, 5 мкл смеси универсальных праймеров А 10×, 0,2мМ dNTPs (dATP, dGTP, dCTP и dTTP), 1 мкл полимеразной смеси Advantage 2 (все реагенты от CLONTECH), 2,5 мкл продукта реакции обратной транскрипции и 10 пмоль синтетического олигонуклеотида MHC-IgG1, MHC-IgG2a, MHC-IgG2b или каппа. ПЦР проводят, используя 5 циклов, включающих в себя 94°C в течение 30 секунд, 94°C в течение 5 секунд и 72°C в течение 3 минут, 5 циклов, включающих в себя 94°C в течение 5 секунд, 70°C в течение 10 секунд и 72°C в течение 3 минут, и 25 циклов, включающих в себя 94°C в течение 5 секунд, 68°C в течение 10 секунд и 72°C в течение 3 минут. И наконец, продукт реакции нагревают при 72°C в течение 7 минут. Каждый продукт ПЦР выделяют из агарозного геля, используя набор для гель-экстракции QIAquick (QIAGEN), клонируют в векторе pGEM-T Easy (Promega) и определяют нуклеотидную последовательность.
Нуклеотидные последовательности вариабельных участков Н-цепи M3C11, M13B3, M1E7, M3B8, M11F1, M19B11, M6B1, M18D4, M5B9, M10D2 и L9G11 описаны в SEQ ID NO: 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 и 21, соответственно, а их аминокислотные последовательности описаны в SEQ ID NO: 22, 23, 24, 25, 26, 27, 28, 29, 30, 31 и 32, соответственно. Нуклеотидные последовательности вариабельных участков L-цепи данных антител описаны в SEQ ID NO: 33, 34, 35, 36, 37, 38, 39, 40, 41, 42 и 43, соответственно, а их аминокислотные последовательности описаны в SEQ ID NO: 44, 45, 46, 47, 48, 49, 50, 51, 52, 53 и 54, соответственно.
Пример 14
Классификация по эпитопам с использованием GST-гибридного белка
Чтобы провести подробный анализ эпитопов антител, связывающихся с C-концевым фрагментом, получают гибридные белки последовательно укороченных С-концевых пептидов GPC3 с GST, а именно GC-1 (от Ser495 до Lys563), GC-2 (от Gly510 до Lys563), GC-3 (от Ala524 до Lys563), GC-4 (от Gly537 до Lys563) и GC-5 (от Ser550 до Lys563). C-концевой участок GPC3 клонируют в pGEX-4T-3 (Amersham), чтобы сконструировать плазмиду ДНК, в которой C-концевой участок GPC3 лигирован с C-концом GST. Плазмиду ДНК вводят в DH5α и в результате получают трансформант. Затем к культуре трансформанта в фазе логарифмического роста добавляют IPTG, чтобы индуцировать экспрессию GST-гибридного белка. Бактериальные клетки собирают после двух часов культивирования. Клетки гомогенизируют путем обработки ультразвуком и центрифугируют при 35000 об/мин в течение 30 минут на ультрацентрифуге XL-80 (Beckman, ротор 70,1 Ti). Затем извлекают культуральный супернатант и очищают с помощью модулей очистки GST (Amersham). Очищенные таким образом GST-гибридные белки разделяют методом SDS-PAGE в восстанавливающих условиях и проводят вестерн-блоттинг с использованием антител против GPC3 (фиг.6). M3C11 и M1E7 позволяют детектировать GC-1 и GC-2, но не GC-3, GC-4 и GC-5, указывая на то, что эпитопы, распознаваемые данными антителами, находятся на участке GC-2, и что участок GC-3 не является достаточным. M3B8 и M11F1 позволяют детектировать GC-1, GC-2, GC-3 и GC-4, но не GC-5, указывая на то, что эпитопы, распознаваемые данными антителами, находятся на участке GC-4, и что участок GC-5 не является достаточным. Минимальные участки GST-гибридного белка, с которыми могут связываться все антитела, перечислены в колонке под заголовком "вестерн-блоттинг" на фиг.16.
Пример 15
Получение мышино-человеческого химерного антитела против GPC3
Последовательности вариабельных участков H-цепи и L-цепи антител против GPC3 лигируют с последовательностями константных участков человеческого IgG1 и каппа-цепи. ПЦР проводят с использованием синтетического олигонуклеотида, комплементарного 5’-концевой нуклеотидной последовательности вариабельного участка Н-цепи каждого антитела, который содержит последовательность Козака, и синтетического олигонуклеотида, комплементарного 3’-концевой нуклеотидной последовательности, который содержит участок NheI. Полученный продукт ПЦР клонируют в векторе pB-CH, в котором константный участок человеческого IgG1 встроен в вектор pBluescript KS(+) (Toyobo). Вариабельный участок мышиной H-цепи и константный участок человеческой H-цепи (цепь γ1) лигируют через участок NheI. Полученный фрагмент гена H-цепи клонируют в векторе экспрессии, pCXND3. В то же время проводят ПЦР с использованием синтетического олигонуклеотида, комплементарного 5’-концевой нуклеотидной последовательности вариабельного участка L-цепи каждого антитела, который содержит последовательность Козака, и синтетического олигонуклеотида, комплементарного 3’-концевой нуклеотидной последовательности, который содержит участок BsiWI. Полученный продукт ПЦР клонируют в векторе pB-CL, в котором константный участок человеческой каппа-цепи встроен в вектор pBluescript KS(+) (Toyobo). Вариабельный и константный участки человеческой L-цепи лигируют через участок BsiWI. Полученный фрагмент гена L-цепи клонируют в векторе экспрессии, pUCAG. Вектор pUCAG получают путем клонирования фрагмента размером 2,6 тыс. п.о., полученного в результате расщепления pCXN (Niwa et al., Gene 1991; 108: 193-200) рестриктазой BamHI по участку BamHI вектора pUC19 (Toyobo).
Чтобы получить вектор экспрессии мышино-человеческого химерного антитела против GPC3, фрагмент гена получают путем расщепления вектора pUCAG, содержащего фрагмент гена L-цепи, рестриктазой HindIII (Takara Shuzo), и клонируют в участке HindIII вектора pCXND3, содержащего ген H-цепи. Данная плазмида будет экспрессировать ген устойчивости к неомицину, ген DHFR и ген мышино-человеческого химерного антитела против GPC3 в клетке животного.
Клеточную линию CHO (клеточная линия DG44), стабильно экспрессирующую антитело, получают следующим образом. Ген вводят в клетки методом электропорации, используя Gene Pulser II (Bio-Rad). Смесь, полученную путем смешивания 25 мкг вектора экспрессии каждого мышино-человеческого химерного антитела против GPC3 и 0,75 мл суспензии клеток CHO в PBS (1×107 клеток/мл), охлаждают на льду в течение 10 минут и переносят в кювету. Затем используют импульсы при напряжении 1,5 кВ и емкости 25 мкФ. После 10-минутного периода восстановления при комнатной температуре клетки, подвергшиеся электропорации, суспендируют в 40 мл среды CHO-S-SFM II (Invitrogen), содержащей добавку 1× HT (Invitrogen). Суспензию разбавляют в 50 раз такой же средой и вносят в 96-луночный культуральный планшет в количестве 100 мкл/лунку. Культивируют в CO2-инкубаторе (5% CO2) в течение 24 часов, затем добавляют генетицин (Invitrogen) в концентрации 0,5 мг/мл и клетки культивируют в течение 2 недель. Культуральный супернатант берут из лунки, содержащей колонию устойчивых к генетицину трансформированных клеток, и количество IgG измеряют с помощью описанного ниже метода определения концентрации. Клеточную линию с высоким уровнем продукции последовательно выращивают, чтобы получить клеточную линию, стабильно экспрессирующую мышино-человеческое химерное антитело против GPC3. Клеточную линию культивируют в широком масштабе и собирают культуральный супернатант. Очистку каждого мышино-человеческого химерного антитела против GPC3 проводят с помощью Hi Trap ProteinG HP (Amersham).
Пример 16
Измерение активности, связанной с комплемент-зависимой цитотоксичностью (CDC-активность)
16.1 Получение человеческий альбумин-веронального буфера (HAVB)
В воде, очищенной на установке milli-Q, растворяют 12,75 г NaCl (высшей категории, Wako Pure Chemicals), 0,5625 г Na-барбитала (высшей категории, Wako Pure Chemicals) и 0,8625 г барбитала (высшей категории, Wako Pure Chemicals) до конечного объема 200 мл и автоклавируют при 121°C в течение 20 минут. Затем добавляют 100 мл обработанной в автоклаве горячей воды milli-Q. pH составляет 7,43 (рекомендованное значение pH: 7,5). Раствор используют в виде 5× веронального буфера. В 50 мл воды, очищенной на установке milli-Q, растворяют 0,2205 г CaCl2⋅2H2O (высшей категории, Junsei Chemical) до конечной концентрации 0,03 моль/л и полученный раствор используют как раствор CaCl2. В 50 мл воды, очищенной на установке milli-Q, растворяют 1,0165 г MgCl2⋅6H2O (высшей категории, Junsei Chemical) до конечной концентрации 0,1 моль/л и полученный раствор используют как раствор MgCl2. В воде, очищенной на установке milli-Q, растворяют 100 мл 5× веронального буфера, 4 мл человеческого сывороточного альбумина (25% Buminate (зарегистрированная торговая марка), концентрация человеческого сывороточного альбумина: 250 мг/мл, Baxter Healthcare), 2,5 мл раствора CaCl2, 2,5 мл раствора MgCl2, 0,1 г KCl (высшей категории, Junsei Chemical), 0,5 г глюкозы (D(+)-глюкоза, безводная, высшей категории, Wako Pure Chemicals) с получением конечного объема 500 мл, и полученный раствор используют как HAVB. После стерилизации фильтрованием HAVB хранят при заранее установленной температуре 5°C.
16.2 Получение клеток-мишеней
Клетки CHO, экспрессирующие полноразмерный человеческий GPC3, полученные в примере 4, культивируют в среде α-MEM, содержащей нуклеиновые кислоты (+) (GIBCO) и дополненной 10% FBS и 0,5 мг/мл генетицина (GIBCO). Клетки отсоединяют от чашки, используя буфер для разъединения клеток (Invitrogen Corp), вносят в каждую лунку 96-луночного плоскодонного планшета (Falcon) в количестве 1×104 клеток/лунку и культивируют 3 дня. После культивирования добавляют 5,55 мБк хрома-51 и клетки культивируют в инкубаторе в атмосфере, содержащей 5% диоксида углерода, при 37°C в течение 1 часа. Полученные клетки дважды промывают HAVB, добавляют 50 мкл HAVB и используют как клетки-мишени.
16.3 Анализ высвобождения хрома (CDC-активность)
Каждое химерное антитело разбавляют HAVB, получая раствор с концентрацией 40 мкг/мл. К клеткам-мишеням добавляют 50 мкл раствора каждого антитела и оставляют на льду в течение 15 минут. Затем в каждую лунку добавляют 100 мкл человеческой сыворотки из периферической крови здорового добровольца, разбавленной HAVB, с получением конечной концентрации 25% (конечная концентрация антитела: 10 мкг/мл) и оставляют в инкубаторе в атмосфере 5% диоксида углерода при 37°C в течение 90 минут. Планшет центрифугируют, после чего из каждой лунки отбирают 100 мкл супернатанта и измеряют радиоактивность с помощью гамма-счетчика. Удельную скорость высвобождения хрома рассчитывают по нижеследующей формуле.
Удельная скорость высвобождения хрома (%) = (A-C)×100/(B-C)
"A" обозначает количество радиоактивности (имп/мин) в каждой лунке, "B" обозначает среднее количество радиоактивности (имп/мин) в лунках, в которых к клеткам-мишеням добавлено 100 мкл 2% водного раствора NP-40 (Nonidet P-40, Code No. 252-23, Nacalai Tesque) и 50 мкл HAVB, и "C" обозначает среднее количество радиоактивности (имп/мин) в лунках, в которых к клеткам-мишеням добавлено 150 мкл HAVB. Анализ проводят с тройными повторами и для CDC-активности рассчитывают среднее значение и стандартное отклонение (%).
Результаты приведены на фиг.7. Среди 9 типов химерных антител против GPC3, M3B8 и M11F1, которые представляют собой антитела, распознающие C-конец, обладают высокой CDC-активностью по отношению к клеткам CHO, экспрессирующим GPC3, однако у других антител CDC-активность не наблюдается. M3B8 и M11F1 относят к группе "b" по результатам конкурентного метода ELISA, и можно обнаружить эпитоп, играющий важную роль в проявлении высокой CDC-активности.
Пример 17
Измерение ADCC-активности с использованием PBMC, полученных из периферической крови человека
17.1 Получение раствора, содержащего человеческие PBMC
Гепаринизированную периферическую кровь, полученную от здоровых добровольцев, разбавляют в 2 раза PBS(-) и наслаивают на Ficoll-Paque TM PLUS (Amersham). После центрифугирования при 500×g в течение 30 минут при 20°C, собирают средний слой, который представляет собой фракцию мононуклеарных лейкоцитов. Клетки промывают 3 раза, суспендируют в 10% FBS/RPMI и используют как раствор, содержащий человеческие PBMC.
17.2 Получение клеток-мишеней
Клетки HepG2, культивированные в среде 10% FBS/RPMI 1640, отсоединяют от чашки с помощью Trypsin-EDTA (Invitrogen), вносят в каждую лунку 96-луночного планшета с U-образным дном (Falcon) в количестве 1×104 клеток/лунку и культивируют в течение 2 дней. Полученные в примере 4 клетки CHO, экспрессирующие полноразмерный человеческий GPC3, культивируют в среде α-MEM, содержащей нуклеиновые кислоты (+) (GIBCO) и дополненной 10% FBS и 0,5 мг/мл генетицина (GIBCO). Клетки отсоединяют от чашки, используя буфер для разъединения клеток (Invitrogen Corp), вносят в каждую лунку 96-луночного плоскодонного планшета (Falcon) в количестве 1×104 клеток/лунку и культивируют 3 дня. В каждую лунку добавляют хром-51 (5,55 мБк) и клетки культивируют в инкубаторе в атмосфере, содержащей 5% диоксида углерода, при 37°C в течение 1 часа. Полученные клетки промывают один раз средой, добавляют 50 мкл среды 10% FBS/RPMI 1640 и используют как клетки-мишени.
17.3 Анализ высвобождения хрома (ADCC-активность)
К клеткам-мишеням добавляют 50 мкл раствора, содержащего разные концентрации антитела, и оставляют взаимодействовать на льду в течение 15 минут. Затем добавляют 100 мкл раствора человеческих PBMC в количестве 5×105 клеток/лунку и клетки культивируют в инкубаторе в атмосфере 5% диоксида углерода при 37°C в течение 4 часов. После культивирования планшет центрифугируют и с помощью гамма-счетчика измеряют радиоактивность в 100 мкл культурального супернатанта. Удельную скорость высвобождения хрома рассчитывают по нижеследующей формуле.
Удельная скорость высвобождения хрома (%) = (A-C)×100/(B-C)
"A" обозначает среднее количество радиоактивности (имп/мин) в каждой лунке, "B" обозначает среднее количество радиоактивности (имп/мин) в лунках, в которых к клеткам-мишеням добавлено 100 мкл 2% водного раствора NP-40 (Nonidet P-40, Code No. 252-23, Nacalai Tesque) и 50 мкл среды 10% FBS/RPMI, и "C" обозначает среднее количество радиоактивности (имп/мин) в лунках, в которых к клеткам-мишеням добавлено 150 мкл среды 10% FBS/RPMI. Анализ проводят с тройными повторами и для ADCC-активности рассчитывают среднее значение и стандартное отклонение (%). Результаты приведены на фиг.8. Среди 9 типов химерных антител против GPC3, антитела, распознающие C-конец, обладают тенденцией проявлять высокую ADCC-активность.
Пример 18
Иммунизация с использованием GC-3 и селекция гибридомы
Среди полученных антител против GPC3 только M11F1 и M3B8 обладают высокой CDC-активностью, указывая на то, что CDC-активность является эпитоп-зависимой. Чтобы получить антитело, обладающее как ADCC-активностью, так и CDC-активностью, для иммунизации используют GST-гибридный белок, содержащий эпитоп, распознаваемый M11F1 и M3B8, который обозначают GC-3. С помощью вышеуказанного метода очищают большое количество GC-3. Буфер меняют на PBS с помощью гель-фильтрации на Superdex 75 (Amersham). Полученный продукт используют в качестве иммунного белка. Трех мышей Balb/c (полученных от Charles River Japan, Inc.) и трех мышей MRL/lpr иммунизируют GC-3 в соответствии с вышеуказанным методом. Для первой иммунизации GC-3 получают в количестве 100 мкг/особь, эмульгируют с использованием FCA и вводят подкожно. Через две недели GC-3 получают в количестве 50 мкг/особь, эмульгируют с использованием FIA и вводят подкожно. После пятой иммунизации проводят последнюю иммунизацию (50 мкг/особь) всех мышей путем введения иммунного белка в хвостовую вену. После гибридизации клеток проводят скрининг гибридом методом ELISA с использованием иммунопланшета, покрытого растворимой формой корового белка GPC3. Позитивный клон подвергают моноклонированию методом лимитирующих разведений. В результате получают 5 клонов антител (GC199, GC202, GC33, GC179 и GC194), обладающих высокой связывающей активностью по отношению к GPC3.
Антитело выделяют из культурального супернатанта гибридомы с использованием Hi Trap proteinG HP и анализируют вышеуказанным методом. Значение EC50 определяют методом ELISA с использованием иммунопланшета, покрытого растворимой формой корового белка GPC3, и с помощью проточной цитометрии получают X-значение гистограммы при концентрации 5 мкг/мл (фиг.17). В соответствии с классификацией по эпитопам конкурентным методом ELISA, антитела разделяют на группу b (GC199, GC202 и GC33) и новую эпитопную группу f (GC179 и GC194). Классификация по эпитопам с использованием GST-гибридных белков показывает, что с помощью GC199, GC202 и GC33 можно детектировать GC-1, GC-2, GC-3 и GC-4, но не GC-5, позволяя предположить, что эпитопы, распознаваемые данными антителами, находятся на участке GC-4, так же, как и эпитопы, распознаваемые M11F1 и M3B8, а участок GC-5 не является достаточным. С другой стороны, с помощью GC179 и GC194 можно детектировать GC-1, GC-2 и GC-3, но не GC-4 и GC-5, позволяя предположить, что эпитопы, распознаваемые данными антителами, находятся на участке GC-3, а участок GC-4 не является достаточным. Минимальные участки GST-гибридных белков, с которыми могут связываться все антитела, перечислены в колонке под заголовком "вестерн-блоттинг" на фиг.17.
Вариабельные участки H-цепи и L-цепи GC199, GC202, GC33, GC179 и GC194 клонируют в соответствии с вышеописанным методом и определяют их последовательности. В случае L-цепи GC194, клонируют 2 типа последовательностей. Нуклеотидные последовательности вариабельных участков H-цепи GC199, GC202, GC33, GC179 и GC194 описаны в SEQ ID NO: 55, 56, 57, 58 и 59, соответственно, а их аминокислотные последовательности описаны в SEQ ID NO: 60, 61, 62, 63 и 64, соответственно. Нуклеотидные последовательности вариабельных участков L-цепи GC199, GC202, GC33, GC179, GC194(1) и GC194(2) описаны в SEQ ID NO: 65, 66, 67, 68, 69 и 70, соответственно, а их аминокислотные последовательности описаны в SEQ ID NO: 71, 72, 73, 74, 75 и 76, соответственно.
Кроме того, определяют степень гомологии данных аминокислотных последовательностей путем сравнения с базой данных аминокислотных последовательностей известных антител, таким образом определяя их гипервариабельные участки, которые приведены ниже.
|
|
|
Пример 19
Определение ADCC-активности с использованием эффекторных клеток костного мозга мыши
19.1 Получение раствора, содержащего эффекторные клетки костного мозга мыши
Клетки костного мозга собирают из бедренной кости мышей SCID (CLEA Japan, Inc., самцы, возраст 10 недель) и суспендируют в среде 10% FBS/RPMI 1640 в концентрации 5×105 клеток/мл. Мышиный GM-CSF (PeproTech) и человеческий IL-2 (PeproTech) добавляют в концентрации 10 нг/мл и 50 нг/мл, соответственно, и клетки культивируют в инкубаторе в атмосфере, содержащей 5% диоксида углерода, при 37°C в течение 5 дней. После культивирования клетки соскабливают скребком и один раз промывают средой. Затем клетки суспендируют в среде 10% FBS/RPMI 1640 в концентрации 5×106 клеток/мл и используют в качестве раствора, содержащего эффекторные клетки мышиного костного мозга.
19.2 Получение клеток-мишеней
Клеточную линию гепатомы человека, HuH-7, поддерживают и субкультивируют с использованием среды DMEM (SIGMA), содержащей 10% FBS (ThermoTrace). Клетки отсоединяют от чашки с помощью буфера для разъединения клеток (Invitrogen), вносят в каждую лунку 96-луночного планшета с U-образным дном (Falcon) в количестве 1×104 клеток/лунку и культивируют 1 день. После культивирования добавляют 5,55 мБк хрома-51 и клетки культивируют в инкубаторе в атмосфере, содержащей 5% диоксида углерода, при 37°C в течение 1 часа. Полученные клетки промывают один раз средой, добавляют 50 мкл среды 10% FBS/RPMI 1640 и используют как клетки-мишени.
19.3 Анализ высвобождения хрома (ADCC-активность)
К клеткам-мишеням добавляют 50 мкл раствора, содержащего разные концентрации антитела, и оставляют взаимодействовать на льду в течение 15 минут. Затем добавляют 100 мкл раствора, содержащего эффекторные клетки мышиного костного мозга, (5×105 клеток/лунку) и клетки культивируют в инкубаторе в атмосфере 5% диоксида углерода при 37°C в течение 4 часов. После культивирования планшет центрифугируют и с помощью гамма-счетчика измеряют радиоактивность в 100 мкл культурального супернатанта. Удельную скорость высвобождения хрома рассчитывают по нижеследующей формуле.
Удельная скорость высвобождения хрома (%) = (A-C)×100/(B-C)
"A" обозначает среднее количество радиоактивности (имп/мин) в каждой лунке, "B" обозначает среднее количество радиоактивности (имп/мин) в лунках, в которых к клеткам-мишеням добавлено 100 мкл 2% водного раствора NP-40 (Nonidet P-40, Code No. 252-23, Nacalai Tesque) и 50 мкл среды 10% FBS/RPMI, и "C" обозначает среднее количество радиоактивности (имп/мин) в лунках, в которых к клеткам-мишеням добавлено 150 мкл среды 10% FBS/RPMI. Анализ проводят с тройными повторами и для ADCC-активности рассчитывают среднее значение и стандартное отклонение (%).
Результаты приведены на фиг.9. Обнаружено, что антитело GC33 проявляет ADCC-активность, если концентрация антитела составляет 0,1 мкг/мл или выше, и что оно обладает более высокой активностью, чем антитело GC199.
Пример 20
Противоопухолевая активность антитела GC33 на мышиной модели с трансплантированной гепатомой человека
20.1 Получение мышиной модели с трансплантированной гепатомой человека
Получают суспензию клеточной линии гепатомы человека HuH-7, 5×107 клеток/мл, в растворе, содержащем среду DMEM и MATRIGEL (BD Bioscience) в соотношении 1:1. За день до этого 100 мкл раствора антитела против асиало-GM1 (Wako Pure Chemicals, содержимое одного флакона растворяют в 1 мл дистиллированной воды для инъекции, затем добавляют 4 мл физиологического раствора) вводят внутрибрюшинно мышам SCID (самцы, возраст 5 недель, CLEA Japan, Inc.). Мышам подкожно трансплантируют в абдоминальную область 100 мкл вышеупомянутой клеточной суспензии (5×106 клеток/мышь).
20.2 Получение и введение антитела
Начиная с 20 дня после трансплантации клеток, раствор антитела, полученный в день введения, с концентрацией 0,5 мг/мл (группа, которой вводят 5 мг/кг) и 0,1 мг/мл (группа, которой вводят 1 мг/кг), PBS(-), вводят мышиной модели с трансплантированными клетками гепатомы человека в количестве 10 мл/кг через хвостовую вену один раз в неделю в течение 3 недель. В качестве отрицательного контроля аналогичным образом вводят среду, PBS(-), в количестве 10 мл/кг через хвостовую вену один раз в неделю в течение 3 недель. Обе группы состоят из 6 мышей каждая.
20.3 Оценка противоопухолевого эффекта
Противоопухолевое действие антитела GC33 на мышиную модель с трансплантированными клетками гепатомы человека оценивают по изменению объема опухоли с течением времени и по массе опухоли через 1 неделю после последнего введения. Объем опухоли рассчитывают по приведенной ниже формуле.
Объем опухоли = (основная ось)×(минорная ось)×(минорная ось)/2
Как показано на фиг.10, в группе, получающей антитело GC33, наблюдается значительное подавление роста опухоли по сравнению с группой, получающей среду.
Таким образом, показано, что GC33 оказывает противоопухолевое действие на мышиную модель с трансплантированными клетками гепатомы человека.
Пример 21
Получение мышино-человеческого химерного антитела GC33
H-цепь и L-цепь GC33 амплифицируют методом ПЦР с использованием синтетического олигонуклеотида, комплементарного 5’-концевым нуклеотидным последовательностям, который содержит последовательность Козака и участок HindIII, и синтетического олигонуклеотида, комплементарного 3’-концевым нуклеотидным последовательностям, который содержит участок BamHI. После расщепления с помощью HindIII и BamHI, полученный продукт ПЦР клонируют в векторе экспрессии, HEFgγ1, в который встроен константный участок человеческого IgG1, и в векторе экспрессии, HEFgκ, в который встроен константный участок человеческой каппа-цепи (Sato et al., Mol Immunol. 1994; 371-381). Векторы вводят в клетки CHO (клеточная линия DG44) в соответствии с вышеописанным методом и получают клеточную линию со стабильной экспрессией. Антитело выделяют из культурального супернатанта с использованием Hi Trap ProteinG HP (Amersham). Концентрацию IgG в культуральном супернатанте измеряют сэндвич-методом ELISA для человеческих IgG, используя козьи антитела против человеческих IgG (BIOSOURCE) и конъюгат козьих антител против человеческих IgG со щелочной фосфатазой (BIOSOURCE), и определяют концентрацию путем сравнения с коммерчески доступным человеческим IgG (Cappel).
Пример 22
Определение CDC-активности и ADCC-активности с использованием мышино-человеческого химерного антитела GC33
CDC-активность и ADCC-активность мышино-человеческих химерных антител GC33, M3C11 и M1E7 измеряют с помощью способов, описанных в примерах 16 и 17. В качестве клеток-мишеней для измерения CDC-активности используют клетки CHO, экспрессирующие полноразмерный GPC3, а для измерения ADCC-активности используют клетки HepG2. Результаты приведены на фиг.11 и фиг.12, соответственно. Обнаружено, что во всех аналитических системах GC33, по сравнению с двумя другими антителами, проявляет высокую CDC-активность и ADCC-активность.
Пример 23
Анализ эпитопов GC33
Чтобы детально определить эпитоп, распознаваемый GC33, получают гибридные белки, состоящие из дополнительно укороченного С-концевого пептида GPC3 и GST, и анализируют их методом вестерн-блоттинга. Полученные пептидные последовательности GPC3, содержащиеся в GST-гибридном белке, приведены на фиг.13. Поскольку GC33 может связываться с GC-4 (аминокислоты 537-563), но не может связываться с GC-5 (аминокислоты 550-563), считается, что эпитоп находится в участке, включающем в себя, по меньшей мере, часть фрагмента от 537 до 550 аминокислоты. Вначале получают пептиды GC-6 (G N S Q Q A T P K D N E I S (SEQ ID NO: 93)), GC-7 (G N S Q Q A T P (SEQ ID NO: 94)), GC-8 (Q Q A T P K D N (SEQ ID NO: 95)) и GC-9 (T P K D N E I S (SEQ ID NO: 96)). Получают прямую олиго-ДНК и обратную олиго-ДНК, которые конструируют так, чтобы сайт расщепления последовательности распознавания EcoRI был присоединен к 5’-концу, а сайт расщепления последовательности распознавания SalI был присоединен к 3’-концу, соответственно. Олиго-ДНК синтезируют с помощью Espec Oligo Service. ДНК выделяют с использованием картриджа C-18, фосфорилируют по 5’-концу и анализируют. Смешивают двадцать пять микролитров прямой олиго-ДНК (10 мкМ) и 25 мкл обратной олиго-ДНК (10 мкМ) и подвергают взаимодействию при 94°C в течение 5 минут, при 37°C в течение 10 минут, и при комнатной температуре в течение 15 минут, затем оставляют при 4°C на 10 минут для отжига прямой олиго-ДНК и обратной олиго-ДНК. Концентрацию олигонуклеотидов определяют путем измерения поглощения при молярном соотношении вставки к вектору 3:1. Олигонуклеотиды клонируют в EcoRI- и SalI-расщепленном векторе pGEX4T-3 и подтверждают нуклеотидные последовательности. GST-гибридный белок получают вышеуказанным способом и очищают с помощью глутатион-сефарозы 4B. Очищенные белки разделяют методом SDS-PAGE в восстанавливающих условиях и анализируют методом вестерн-блоттинга с использованием GC33. Результаты показывают, что антитело GC33 не позволяет достоверно детектировать никакие GST-гибридные белки, следовательно, можно предположить, что для связывания GC33 требуется более длинная последовательность на С-конце (фиг.14). Основываясь на вышеуказанном предположении, получают GC-11 (A T P K D N E I S T (SEQ ID NO: 97)), GC-12 (P K D N E I S T F H (SEQ ID NO: 98)), GC-13 (D N E I S T F H N L (SEQ ID NO: 99)) и GC-14 (E I S T F H N L G N (SEQ ID NO: 100)) и оценивают их таким же способом. Полученные результаты показывают, что GC-11, GC-12 и GC-13 лучше связываются с GC33, следовательно, можно предположить, что эпитоп, распознаваемый GC33, расположен в последовательности от 544-ой до 553-ей аминокислоты (P K D N E I S T F H) на С-конце GPC3.
Пример 24
Гуманизация GC33
Данные по последовательностям антител получают из открытой для широкого доступа базы данных Kabat (ftp://ftp.ebi.ac.uk/pub/databases/kabat/) и из базы данных ImMunoGeneTics (IMGT). Вариабельный участок H-цепи и вариабельный участок L-цепи отдельно анализируют на гомологию. Полученные результаты показывают, что вариабельный участок H-цепи обладает высокой степенью гомологии с DN13 (Smithson et al., Mol Immunol. 1999; 36: 113-124), а вариабельный участок L-цепи обладает высокой степенью гомологии с мРНК IGK homo sapiens участка VLJ легкой цепи каппа иммуноглобулина, неполный cds, клон: K64, номер по каталогу AB064105. Сигнальную последовательность с номером по каталогу S40357, которая обладает высокой степенью гомологии с AB064105, используют в качестве сигнальной последовательности L-цепи. Чтобы получить гуманизированное антитело, гипервариабельный участок (далее упоминается как CDR) GC33 трансплантируют в каркасные участки (далее упоминаются как FR) указанных человеческих антител.
Конкретно, синтетические олиго-ДНК размером приблизительно 50 оснований конструируют так, чтобы приблизительно 20 оснований из них гибридизовались, и затем указанные синтетические олиго-ДНК собирают вместе методом ПЦР, чтобы получить гены, кодирующие все вариабельные участки. Их расщепляют по участку HindIII, встроенному в конец 5’-конца синтетической олиго-ДНК, и по участку BamHI, встроенному в конец 3’-конца синтетической олиго-ДНК. Фрагменты клонируют в векторе экспрессии, HEFgγ1, в котором клонируют константный участок человеческого IgG, или в векторе экспрессии, HEFgκ1, в котором клонируют константный участок человеческой каппа-цепи (Sato et. al., Mol Immunol. 1994; 371-381). H-цепь и L-цепь гуманизированного GC33, сконструированные, как описано выше, называют ver.a, соответственно. Гуманизированное GC33, у которого и H-цепь, и L-цепь, являются ver.a (ver.a/ver.a), обладает более низкой связывающей активностью, чем антитело с вариабельными участками мышиного GC33 (мышь/мышь). Конструируют антитела, в которых химерно объединены последовательность мышиного GC33 и последовательность ver.a (мышь/ver.a, ver.a/мышь), относительно H-цепи и L-цепи, и определяют их связывающую активность. Результаты показывают, что уменьшение связывания наблюдается в случае ver.a/мышь, следовательно, уменьшение связывающей активности вследствие замены аминокислот относится к H-цепи (фиг.15). Затем получают модифицированные H-цепи, ver.c, ver.f, ver.h, ver.i, ver.j, ver.k. Все указанные гуманизированные GC33 обладают такой же связывающей активностью, как и химерное антитело, содержащее вариабельный участок мышиного GC33 (фиг.15). Нуклеотидные последовательности вариабельных участков Н-цепи гуманизированного GC33, ver.a, ver.c, ver.f, ver.h, ver.i, ver.j, ver.k, описаны в SEQ ID NO: 77, 78, 79, 80, 81, 82 и 83, соответственно, а их аминокислотные последовательности описаны в SEQ ID NO: 84, 85, 86, 87, 88, 89 и 90, соответственно. Нуклеотидная последовательность и аминокислотная последовательность вариабельного участка L-цепи гуманизированного GC33, ver.a, описаны в SEQ ID NO: 91 и 92, соответственно. В вариабельных участках Н-цепи гуманизированного GC33 ver.i, ver.j и ver.k 6-ой остаток глутаминовой кислоты заменяют на остаток глутамина. Термостабильность данных антител значительно повышена.
Пример 25
Модификация L-цепи гуманизированного GC33
Известно, что константа скорости реакции дезамидирования белков зависит от первичной последовательности. Также известно, что сочетание Asn-Gly особенно чувствительно к дезамидированию (Rocinson et. al., Proc. Natl. Acad. Sci. USA 2001; 98; 944-949). Что касается Asn33 в CDR1 ver.a L-цепи гуманизированного GC33, описанном в SEQ ID NO: 91, первичной последовательностью является сочетание Asn-Gly, которое, как предсказано, является чувствительным к дезамидированию.
Чтобы оценить влияние дезамидирования Asn33 на связывающую активность, получают модифицированное антитело, в котором Asn33 заменен на Asp. Точечную мутацию вводят с помощью набора для направленного мутагенеза Quick Change (Stratagene). Более конкретно, 50 мкл реакционной смеси, содержащей 125 нг смыслового праймера (CTT GTA CAC AGT GAC GGA AAC ACC TAT: SEQ ID NO: 172), 125 нг антисмыслового праймера (ATA GGT GTT TCC GTC ACT GTG TAC AAG: SEQ ID NO: 173), 5 мкл 10× реакционного буфера, 1 мкл смеси dNTP, 10 нг HEFgκ, в котором клонируют ver.a L-цепи гуманизированного GC33, и 1 мкл ДНК-полимеразы Pfu Turbo подвергают реакции ПЦР, включающей в себя 12 циклов, состоящих из 95°C в течение 30 секунд, 55°C в течение 1 минуты и 68°C в течение 9 минут. Затем добавляют рестриктазу, DpnI, расщепление проводят при 37°C в течение 2 часов и продукт расщепления вводят в компетентную клетку XL1-Blue, присутствующую в наборе, и в результате получают трансформант. Вариабельный участок вырезают из клона, в который соответствующим образом введена каждая мутация, и снова клонируют в HEFgκ. Его вводят в клетку COS7 с использованием Fugene 6 (Roche) вместе с HEFgγ1, в котором клонируют ver.k H-цепи гуманизированного GC33. Из культурального супернатанта выделяют антитело, временно экспрессирующееся в клетке. Концентрацию антитела определяют сэндвич-методом ELISA, используя антитело против человеческого IgG. Связывающую активность модифицированного антитела определяют методом ELISA с использованием иммунопланшета, покрытого растворимой формой корового белка GPC3. Как показано на фиг.18, модифицированное антитело (N33D), в котором Asn33 заменен на Asp, утрачивает связывающую активность, следовательно, можно предположить, что дезамидирование Asn33 оказывает значительное влияние на связывающую активность.
В качестве способа подавления дезамидирования Asn33 была описана замена Gly34 на другую аминокислоту (международная патентная заявка WO 03057881A1). В соответствии с вышеупомянутым методом G34 заменяют на любую из 17 аминокислот, отличных от Cys и Met, с использованием набора для направленного мутагенеза Quick Change и получают ряд модифицированных антител, а именно, G34A, G34D, G34E, G34F, G34H, G34N, G34P, G34Q, G34I, G34K, G34L, G34V, G34W, G34Y, G34R, G34S и G34T. Осуществляют временную экспрессию данных антител в клетках COS7 и в клеточном супернатанте определяют связывающую активность. Было обнаружено, что связывающая активность сохраняется, даже если G34 заменяют на другую аминокислоту, за исключением Pro (G34P) и Val (G34V).
Аминокислотные последовательности CDR1 легкой цепи вышеупомянутых антител описаны в SEQ ID NO: 174 (G34A), SEQ ID NO: 175 (G34D), SEQ ID NO: 176 (G34E), SEQ ID NO: 177 (G34F), SEQ ID NO: 178 (G34H), SEQ ID NO: 179 (G34N), SEQ ID NO: 180 (G34T), SEQ ID NO: 181 (G34Q), SEQ ID NO: 182 (G34I), SEQ ID NO: 183 (G34K), SEQ ID NO: 184 (G34L), SEQ ID NO: 185 (G34S), SEQ ID NO: 186 (G34W), SEQ ID NO: 187 (G34Y), SEQ ID NO: 188 (G34R), SEQ ID NO: 189 (G34V) и SEQ ID NO: 190 (G34P), соответственно. Аминокислотные последовательности вариабельных участков легкой цепи вышеупомянутых антител описаны в SEQ ID NO: 191 (G34A), SEQ ID NO: 192 (G34D), SEQ ID NO: 193 (G34E), SEQ ID NO: 194 (G34F), SEQ ID NO: 195 (G34H), SEQ ID NO: 196 (G34N), SEQ ID NO: 197 (G34T), SEQ ID NO: 198 (G34Q), SEQ ID NO: 199 (G34I), SEQ ID NO: 200 (G34K), SEQ ID NO: 201 (G34L), SEQ ID NO: 202 (G34S), SEQ ID NO: 203 (G34W), SEQ ID NO: 204 (G34Y), SEQ ID NO: 205 (G34R), SEQ ID NO: 206 (G34V) и SEQ ID NO: 207 (G34P), соответственно.
Антитело настоящего изобретения можно использовать в качестве ингибитора клеточного роста, противоракового средства или средства для диагностики рака.
Пример 26
Получение клеточной линии гепатомы человека (SK-03), экспрессирующей полноразмерный человеческий GPC3
Для оценки биологической активности антител против GPC3 получают клеточную линию гепатомы человека, экспрессирующую полноразмерный GPC3.
Один микрограмм вектора экспрессии, содержащего ген полноразмерного человеческого GPC3, обработанного Pvu I, смешивают с 2 мкл FuGENE (Roche), чтобы получить комплекс. Затем вводят ген путем добавления полученного комплекса к клеткам SK-HEP-1 (полученным от ATCC). После инкубации в CO2-инкубаторе в течение 24 часов проводят селекцию клеток, экспрессирующих GPC3, с использованием среды MEM по Дульбекко (D-MEM, SIGMA), содержащей генетицин в конечной концентрации 1 мг/мл и 10% FBS. Собирают устойчивые к генетицину колонии и клетки клонируют, используя метод лимитирующих разведений. Экспрессию человеческого GPC3 в каждом клеточном клоне анализируют методом проточной цитометрии с использованием химерного антитела GC33 и FITC-меченного козьего антитела против человеческих IgG (ICN). Таким образом получают клеточную линию SK-03 со стабильной экспрессией.
Пример 27
Сравнение CDC-активности и ADCC-активности мышино-человеческих химерных антител
Чтобы непосредственно сравнить CDC-активность и ADCC-активность мышино-человеческих химерных антител GC33, M3C11 и M1E7, описанных в примере 22, CDC-активность и ADCC-активность трех антител измеряют в одной аналитической системе по способу, описанному в примерах 16 и 17. В качестве клеток-мишеней для измерения CDC-активности используют клетки CHO, экспрессирующие полноразмерный GPC3, а для измерения ADCC-активности используют клетки SK-03. Результаты приведены на фиг.19 и фиг.20, соответственно. Обнаружено, что в любой аналитической системе GC33 обладает более высокой CDC-активностью и ADCC-активностью, чем два другие антитела.
Применение в промышленности
Антитело настоящего изобретения можно использовать в качестве ингибитора клеточного роста, противоракового средства и средства для диагностики рака.