Результат интеллектуальной деятельности: КОМПОЗИЦИЯ ПОКРЫТИЯ, ПОДХОДЯЩАЯ ДЛЯ ФАРМАЦЕВТИЧЕСКИХ ИЛИ НУТРИЦЕВТИЧЕСКИХ ДОЗИРОВАННЫХ ФОРМ
Вид РИД
Изобретение
Область техники
Данное изобретение относится к композиции покрытия, подходящей для покрытия фармацевтической или нутрицевтической дозированной формы, где композиция покрытия содержит, по меньшей мере, 20% мас. полимерной композиции типа кишечнорастворимая ядро/оболочка, полученной в результате процесса полимеризации в эмульсии, где ядро формируется нерастворимым в воде несшитым полимером или сополимером, и оболочка формируется анионным полимером или сополимером или наоборот.
Уровень техники
(Мет)акрилатные сополимеры, содержащие анионные группы, например, описаны в ЕР 0704208 В1, ЕР 0704207А2, WO 03/072087A1, WO 2004/096185A1.
Фармацевтические композиции с контролируемым высвобождением, обладающие устойчивостью к действию этанола, имеющие покрытие, содержащее нейтральные виниловые полимеры и эксципиенты, известны из международной патентной заявки WO 2010/105672 А1.
Фармацевтические композиции с контролируемым высвобождением, обладающие устойчивостью к действию этанола, имеющие покрытие, содержащее полимерную смесь и эксципиенты известны из международной патентной заявки WO 2010/105673 А1.
PH-зависимые фармацевтические композиции для наркотических средств (опиоидов) с пониженной склонностью к воздействию этанола на высвобождение активного соединения, известны из международных патентных заявок WO 2009/036812 A1 и WO 2010034342 A1.
PH-зависимые фармацевтические композиции для лекарственных средств, которые не являются опиоидами, с пониженной склонностью к воздействию этанола на высвобождение активного соединения, известны из международных патентных заявок WO 2009/036811 А1 и WO 2010034344 А1.
В WO 2008/049657 описано применение желудочно-резистентных (мет)акрилатных сополимеров в пероральных дозированных формах с замедленным высвобождением в качестве матричных форм для активного ингредиента, включенных для минимизации эффекта усиления или ослабления активного ингредиента, выделяемого под воздействием этанола в условиях in-vitro.
Общие определения
Единственное число, применяемое в описании или формуле изобретения, следует понимать как включающее также множественные формы определяемых объектов в пределах данного определения или интервалов, если конкретно не указано иначе.
Например, термин "полимерная композиция типа кишечнорастворимая ядро/оболочка" включает одну или более таких композиций или сополимеров, например их смесей.
Например, термин в единственном числе "(мет)акрилатный сополимер" или "(мет)акрилатный сополимер" включает один или более (мет)акрилатных сополимеров в пределах данного определения или интервалов мономерной композиции. Таким образом, смеси различных (мет)акрилатных сополимеров в пределах данного определения или интервалов мономерной композиции включены в смысл данного изобретения. Термины в единственном числе, такие как "C4-C18-алкильный эфир акриловой или метакриловой кислоты" или "другой виниловый мономер" должны пониматься как включающие один или более таких мономеров.
Предпочтительно, мономерные отношения для сополимеров, описанных здесь, составляют вплоть до 100% мас.
Задача и решение
Фармацевтические или нутрицевтические композиции предназначены для высвобождения активного ингредиента по принципу воспроизводимых кривых высвобождения. Это дает желаемые и устойчивые профили уровня в крови, которые обеспечивают оптимальное терапевтическое действие. Если концентрации в крови слишком малы, активный ингредиент не будет оказывать достаточное терапевтическое действие. Если концентрации в крови слишком велики, это может вызвать токсические эффекты. В обоих случаях не оптимальные концентрации в крови активного ингредиента могут быть опасны для пациента и поэтому их необходимо избегать. Проблема заключается в том, что идеальные отношения, принятые для высвобождения активного ингредиента во время создания фармацевтической или нутрицевтической композиции, могут быть изменены с учетом образа жизни, легкомыслия или зависимости пациентов в отношении потребления этанола или этанолсодержащих напитков. В этих случаях фармацевтические или нутрицевтические формы, которые на самом деле разработаны для исключительно водной среды, дополнительно подвергаются воздействию этанолсодержащей среды в большей или меньшей степени. Так как органы здравоохранения, например Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), все больше фокусируются на проблеме потребления этанола, устойчивость к этанолу может быть важным требованием при регистрации в ближайшем будущем.
Поскольку не все пациенты осведомлены о риске одновременного потребления фармацевтических или нутрицевтических форм и этанолсодержащих напитков, или они не следуют или не способны следовать соответствующим предупреждениям, советам или рекомендациям, существует необходимость в фармацевтических или нутрицевтических композициях с контролируемым высвобождением, особенно в желудочно-резистентных фармацевтических или нутрицевтических композициях, таких, что присутствие этанола оказывало бы минимальное воздействие на способ их действия.
Обычные желудочно-резистентные фармацевтические или нутрицевтические композиции, с покрытием или без, обычно не устойчивы к алкоголю вообще. Поэтому одной из проблем, решаемых в данном изобретении, является получение желудочно-резистентных фармацевтических или нутрицевтических композиций, которые устойчивы к действию этанола.
Особенно эта проблема актуальна для желудочно-резистентных или кишечнорастворимых композиций. Эти типы составов обычно покрыты желудочно-резистентным покрытием (кишечнорастворимое покрытие), нанесенным на ядро, которое имеет такую особенность, что высвобождение фармацевтического или нутрицевтического активного ингредиента в желудке, соответственно, при pH 1,2 в течение 2 часов, согласно USP (Фармакопея США), не должно превышать 10,8 или может быть 5%. Эта особенность обеспечивает защиту чувствительных к кислоте фармацевтических или нутрицевтических активных ингредиентов от инактивации, и то, что фармацевтические или нутрицевтические активные ингредиенты, которые могут раздражать слизистую желудка, не высвобождаются в значительных количествах. С другой стороны, во многих случаях высвобождение фармацевтического или нутрицевтического активного ингредиента в кишечнике, соответственно согласно USP при pH 6,8 в течение одного часа или менее, не превышает, по меньшей мере, 50, 60, 80% или более. Присутствие этанола в концентрациях 20, 30 или 40% (объем/объем) в желудочном соке обычно повышает скорости высвобождения в желудке. Из-за эффекта распределения, воздействие переваренного этанола в кишечнике не настолько важное, как в желудке. Таким образом, эффективная защита от воздействия этанола должна предотвращать нежелательное повышение количества фармацевтического или нутрицевтического активного ингредиента в желудке, в первую очередь. Более того, было бы желательно, чтобы защита от воздействия этанола, по меньшей мере, не оказывала воздействие на сравнительно высокие скорости высвобождения при рН 6,8 в среде без этанола.
Несколько проблем, таких как те, что описаны выше, решаются композицией покрытия, подходящей для покрытия фармацевтических или нутрицевтических дозированных форм, которые содержат ядро, содержащую один или более фармацевтических или нутрицевтических активных ингредиентов, где композиция покрытия содержит, по меньшей мере, 20% мас. полимерной композиции типа кишечнорастворимая ядро/оболочка, полученной в результате процесса полимеризации в эмульсии, где либо ядро полимерной композиции типа ядро/оболочка образовано из нерастворимого в воде несшитого полимера или сополимера и оболочка полимерной композиции типа ядро/оболочка образована из анионного полимера или сополимера, либо наоборот: то есть ядро полимерной композиции типа ядро/оболочка образована из анионного полимера или сополимера и оболочка полимерной композиции типа ядро/оболочка образована из нерастворимого в воде несшитого полимера или сополимера.
Подробное описание изобретения
Изобретение относится к композиции покрытия, подходящей для покрытия фармацевтических или нутрицевтических дозированных форм, которые содержат ядро, содержащую один или более фармацевтических или нутрицевтических активных ингредиентов, где композиция покрытия содержит, по меньшей мере, 20, по меньшей мере, 30, по меньшей мере, 40, по меньшей мере, 50, по меньшей мере, 60, по меньшей мере, 70, по меньшей мере, 80, по меньшей мере, 90 или 100% мас. полимерной композиции типа кишечнорастворимая ядро/оболочка, полученной в результате процесса полимеризации в эмульсии, где либо ядро полимерной композиции типа ядро/оболочка образована из нерастворимого в воде несшитого полимера или сополимера и оболочка полимерной композиции типа ядро/оболочка образована из анионного полимера или сополимера, либо наоборот.
Пищевые или фармацевтические требования
Подходящие для покрытия фармацевтических или нутрицевтических дозированных форм означают, что композиции покрытия или связующие композиции должны полностью соответствовать всем общим и конкретным пищевым или фармацевтическим требованиям, включая нормативные и законодательные требования для фармацевтических или нутрицевтических дозированных форм. Конечно, все другие эксципиенты, применяемые в фармацевтических или нутрицевтических дозированных формах, описанные здесь, также должны полностью соответствовать всем общим и конкретным пищевым или фармацевтическим требованиям, включая нормативные и законодательные требования для фармацевтических или нутрицевтических дозированных форм.
Композиции покрытия
Изобретение относится к композиции покрытия, подходящей для покрытия фармацевтических или нутрицевтических дозированных форм, где композиция покрытия или связующая композиция содержит, по меньшей мере, 20, по меньшей мере, 30, по меньшей мере, 40, по меньшей мере, 50, по меньшей мере, 60, по меньшей мере, 70, по меньшей мере, 80, по меньшей мере, 90 или 100% мас. полимерной композиции типа кишечнорастворимая ядро/оболочка, полученной в результате процесса полимеризации в эмульсии, где либо ядро полимерной композиции типа ядро/оболочка образована из нерастворимого в воде несшитого полимера или сополимера и оболочка полимерной композиции типа ядро/оболочка образована из анионного полимера или сополимера, либо наоборот.
Водная дисперсия
Полимерная композиция типа кишечнорастворимая ядро/оболочка может присутствовать в композиции покрытия в виде твердой фазы или водной дисперсии с содержанием твердых веществ от 1 до 60% мас. Это означает, что водная дисперсия полимера, которую применяют для получения композиции покрытия, может содержать от 1 до 70% мас. композиции покрытия в виде твердой фазы, и от 30 до 99% мас. в виде водной фазы.
Порошок или гранулят
Полимерная композиция типа кишечнорастворимая ядро/оболочка может присутствовать в композиции покрытия в форме сухого порошка или гранулята. По сравнению с дисперсией, порошки или грануляты имеют преимущество незначительной массы и меньшего объема, и они могут храниться в сухом состоянии в течение длительного периода времени без риска коагулирования или микробного заражения.
Твердое вещество из водной дисперсии может быть высвобождено сушкой распылением, сушкой вымораживанием или коагуляцией с получением сухого порошка или гранулятов. Порошки или грануляты могут быть превращены в водную дисперсию повторным диспергированием в воде.
Процесс полимеризации в эмульсии
В типовом процессе полимеризации в эмульсии сначала ядро в форме частиц ядра получают полимеризацией мономеров с получением полимера или сополимера ядра. Далее мономеры для полимера или сополимера оболочки полимеризуют в той же реакционной смеси с получением оболочки по всей поверхности частиц ядра.
Также возможно начинать полимеризацию в эмульсии сначала добавлением легко полимеризуемых частиц полимера, таких как частицы целлюлозы или частицы крахмала, в полимеризационную смесь. Затем мономеры для полимера или сополимера оболочки полимеризуют в этой реакционной смеси с получением оболочки на поверхности легко полимеризуемых частиц полимерного ядра.
В процессе полимеризации в эмульсии операция может предпочтительно проводиться в процессе подачи эмульсии мономера или процессе подачи мономера, соответственно. Для этого воду нагревают до температуры реакции в реакторе полимеризации. Поверхностно-активные вещества и/или инициаторы могут быть добавлены на этой стадии. Затем, в зависимости от режима операции, мономер, смесь мономеров или эмульсию любого из них загружают в реактор. Такая дозированная жидкость может содержать инициаторы и/или поверхностно-активные вещества, или инициатор и/или поверхностно-активное вещество может добавляться параллельно.
В качестве альтернативы, все мономеры ядра могут быть загружены в реактор до добавления инициатора. Этот способ часто называют периодическим режимом.
Регулятор степени полимеризации может быть добавлен для улучшения стабильности процесса и воспроизводимости молекулярной массы (Mw). Обычное количество регулятора степени полимеризации может составлять от 0,05 до 1% мас. Типовым регулятором полимеризации цепи может быть, например, 2-этилгексиловый эфир тиогликолевой кислоты (ТГЭГ) или н-додецилмеркаптан (нДДМ). Однако во многих случаях можно опустить регулятор степени полимеризации, что не влияет на свойства в соответствии с данным изобретением.
Также возможно объединять оба процесса, полимеризуя часть мономеров в периодическом режиме, с последующей загрузкой другой части. Как известно специалисту в данной области техники, тип процесса и режим операции может быть выбран так, чтобы получить желаемый размер частиц, достаточную стабильность дисперсии, стабильный процесс производства и так далее.
Средний размер частиц полимера, полученный в процессе полимеризации в эмульсии, может варьироваться от 10 до 1000, от 20 до 500 или от 50 до 250 нм. Средний размер частиц полимера может быть определен методами, хорошо известными специалисту в данной области техники, например, методом лазерной дифракции. Размер частиц может быть определен лазерной дифракцией с применением Mastersizer® 2000 (Malvern). Значения могут быть обозначены как радиус частиц rMS [нм], который составляет половину медианы распределения размера частиц на основе объема d(v,50).
Эмульгаторы, которые могут применяться, предпочтительно включают анионные и неионогенные поверхностно-активные вещества. Количество эмульгатора обычно составляет не более 5% мас. в пересчете на массу полимера. Типовые поверхностно-активные вещества включают, например, алкилсульфаты (например, додецилсульфат натрия), сульфаты алкильного эфира, сульфосукцинат диоктилнатрия, полисорбаты (например, полиоксиэтилен (20) сорбитан моноолеат), этоксилаты нонилфенола (ноноксинол-9) и другие.
Кроме этих инициаторов, обычно применяемых при полимеризации в эмульсии (например, надсоединений, таких как пероксодисульфат аммония (ПСА)), могут применяться окислительно-восстановительные системы, такие как дисульфит натрия-ПСА-железо. Также могут применяться растворимые азо-инициаторы и/или могут применяться смеси инициаторов. Количество инициатора обычно составляет от 0,005 до 0,5% мас. в пересчете на массу мономеров.
Температура полимеризации зависит от инициаторов в определенных пределах. Например, если применяют ПСА, предпочтительно работать в интервале от 60 до 90°C; если применяют окислительно-восстановительную систему, возможно проводить полимеризацию при более низких температурах, например при 30°C.
Полимерная композиция типа кишечнорастворимая ядро/оболочка
Полимерная композиция типа ядро/оболочка в соответствии с данным изобретением обладает кишечнорастворимыми свойствами. Это означает, что полимерная композиция типа ядро/оболочка является желудочно-резистентной без растворения, но разбухает при кислых значениях pH, например, при pH от 1 до 4, но растворяется более-менее быстро при более высоких значениях pH, например, от pH 5,0 или выше. Будучи кишечнорастворимой, полимерная композиция типа ядро/оболочка обеспечивает желудочную резистентность и быстрое высвобождение активного ингредиента в кишечнике фармацевтической или нутрицевтической дозированной форме, на которую ее наносят в качестве покрытия или в которую ее добавляют в качестве связующего агента. В качестве еще одного преимущества, полимерная композиция типа ядро/оболочка также обеспечивает желудочную резистентность в присутствии этанола в желудке.
Полимерную композицию типа ядро/оболочка получают в результате процесса полимеризации в эмульсии, по меньшей мере, за две стадии. На первой стадии процесса частицы полимера ядра получают полимеризацией мономера в эмульсии. На второй стадии оболочку полимеризуют на полученные частицы ядра последующей полимеризацией мономера в той же эмульсии.
В редких случаях, как известно специалисту в данной области техники, второй полимер не наносят на поверхность изначально образованных частиц, но вместо этого вводится в центр частиц. В результате, полученный первым полимер оттесняют к краю частицы для образования оболочки. Таким образом получают обратную структуру с полученным первым полимером в качестве полимерной оболочки и полученным далее полимером в качестве полимера ядра. Это происходит только в определенных случаях; обычно потому, что полученный вторым полимер является намного более гидрофобным, чем полученный первым полимер.
Между двумя крайними вариантами обычной и обратной структур типа ядро/оболочка возможно множество других структур, которые были описаны; в литературе одну из них, например называют частично поглощенной.
Хотя такие структурные вариации могут оказать влияние на свойства полимерной композиции, не всегда возможно точно определить, какая структура образована. Поэтому в данном изобретении полученный первым полимер называют полимером ядра, даже если это не описывает корректно полученную структуру во всех случаях.
В большинстве случаев вне всяких сомнений образуется обычная структура типа ядро/оболочка.
Изобретение относится к полимерной композиции типа ядро/оболочка, подходящей в качестве покрытия или связующего агента для фармацевтических или нутрицевтических дозированных форм, где полимерную композицию типа ядро/оболочка получают в процессе полимеризации в эмульсии, где ядро полимерной композиции типа ядро/оболочка получают из нерастворимого в воде несшитого полимера или сополимера, и оболочку полимерной композиции типа ядро/оболочка получают из анионного полимера или сополимера, или наоборот.
В изобретении явным образом описана каждая возможная комбинация любого нерастворимого в воде полимера или сополимера, описанного здесь в качестве ядра с любым анионным полимером или сополимером, описанным здесь в качестве оболочки, а также каждая возможная комбинация любого анионного полимера или сополимера, описанного здесь в качестве ядра с любым нерастворимым в воде полимером или сополимером, описанным здесь в качестве оболочки.
Ядро может быть образовано из нерастворимого в воде полимера или сополимера и оболочка может быть образована из анионного полимера или сополимера, или наоборот.
Наиболее предпочтительную ядро образовано из нерастворимого в воде полимера или сополимера и оболочка образована из анионного полимера или сополимера.
В некоторых случаях оболочка может быть образована из нерастворимого в воде полимера или сополимера и ядро может быть образовано из анионного полимера или сополимера. В некоторых случаях это может быть результатом инверсии фаз во время процесса полимеризации в эмульсии.
Полимер или сополимер ядра предпочтительно является нерастворимым в воде полимером и несшитым полимером. Несшитый (несшитый поперечно) означает, что нерастворимый в воде полимер или сополимер не полимеризован из мономеров, содержащих реакционно-способные боковые группы, которые способны поперечно сшивать линейные полимерные цепи. Такие реакционно-способные боковые группы, которые способны поперечно сшивать линейные полимерные цепи, могут быть винильными боковыми группами или аллильными боковыми группами. Например, необходимо избегать применения мономеров с более одной винильной группой или с одной винильной группой и одной или более аллильными группами. Например, мономеры, такие как этиленгликоль-ди-метакрилат (EGDMA), не включены.
Во многих случаях для полимеров, которые не являются сшитыми, может быть найден растворитель, в котором может быть растворен полимер.
Соотношения ядро/оболочка
Масса ядра может составлять от 10 до 95% от массы общей полимерной композиции типа ядро/оболочка.
Полимерная композиция типа ядро/оболочка может содержать, в основном содержит или состоит из от 10 до 95, или от 20 до 90, предпочтительно от 30 до 80% мас. полимеров или сополимеров ядра. Полимерная композиция типа ядро/оболочка может содержать, в основном содержит или состоит из от 5 до 90, или от 10 до 80, предпочтительно от 20 до 70% мас. полимеров или сополимеров оболочки. Ядро и оболочка могут быть добавлены до 100%. Обычно имеется одно ядро и одна оболочка в полимерной композиции типа ядро/оболочка. Однако также возможно наличие более одной оболочки, т.е. два или более различных полимеров или сополимеров оболочки могут быть добавлены к одному полимеру или сополимеру ядра.
Было неожиданно обнаружено, что стандартные покрытия, которые не являются кишечнорастворимыми полимерными покрытиями типа ядро/оболочки, могут быть заменены покрытиями той же толщины на основе полимерных композиций типа ядро/оболочка, описанных здесь, без ухудшения кишечнорастворимых свойств. Более того, устойчивость к этанолу улучшается. В то же время общее количество анионных групп в покрытии снижается. Это является дополнительным преимуществом, так как может быть увеличена максимальная суточная доза, которая обычно ограничена количеством анионных групп.
Различное микроструктурное и физическое поведение
Из-за способа их получения полимерные композиции типа ядро/оболочка в соответствии с данным изобретением демонстрируют различные микроструктурные и различные физические свойства по сравнению с простыми смесями тех же двух полимеров в тех же массовых отношениях. Поскольку каждая полимерная частица дисперсии типа ядро/оболочка содержит полимер как и ядра, так и оболочки, два полимера равномерно распределены. Наоборот, для физической смеси двух полимерных дисперсий, частицы одного и другого полимера распределены хаотично; соседние частицы одного и того же полимера образуют большие домены.
Различие в микроструктуре в определенных случаях может быть визуализировано под оптическим микроскопом, где полимерные композиции типа ядро/оболочка могут показывать более гомогенную структуру без видимого разделения фаз. Различие в физическом поведении может быть показано на примере более или менее специфической промежуточной температуры стеклования по сравнению с двумя пиками температур стеклования в простых смесях. Таким образом, полимерные композиции типа ядро/оболочка в соответствии с данным изобретением дают более гомогенные смеси двух полимеров, чем чистые физические смеси или простые смеси. Это, несомненно, дает более гомогенные покрытия с предполагаемой более мелкой микроструктурой. Между двумя полимерами возникает меньшая несовместимость. Фармацевтическое или нутрицевтическое дозированное средство в оболочке становится более надежным в отношении поведения активного ингредиента и более стабильным в условиях хранения. Также может наблюдаться положительное действие на предел прочности при растяжении и различия в температурах пленкообразования.
В некоторых случаях характеристики высвобождения композиций покрытия, в которых применяются полимерные композиции типа ядро/оболочка в соответствии с данным изобретением, отличаются от таковых соответствующих кишечнорастворимых покрытий, не относящихся к изобретению. Например, в некоторых случаях наблюдается, что при применении полимера типа EUDRAGIT® FS в определенных полимерных композициях типа ядро/оболочка высвобождение активного ингредиента начинается уже при pH 6,8 и происходит более быстро, в то время как высвобождение для соответствующей полимерной смеси происходит при около pH 7,0 и происходит медленнее. Таким образом, композиции покрытий в соответствии с данным изобретением, в которых применяются полимерные композиции типа ядро/оболочка, также могут применяться для модификации характеристик высвобождения определенных полимерных сочетаний. Это является дополнительным преимуществом, так как расширяет свободу специалиста в данной области техники в создании фармацевтических или нутрицевтических дозированных форм.
Предпочтительные полимер или сополимер ядра
Нерастворимые в воде и несшитые полимеры или сополимеры
Нерастворимые в воде и несшитые полимеры или сополимеры, которые, предпочтительно, применяют в качестве ядра композиции типа ядро/оболочка, могут быть выбраны из группы (мет)акрилатных полимеров или сополимеров, либо из группы поливиниловых полимеров или сополимеров, либо из группы целлюлоз.
Нерастворимые в воде и несшитые полимеры или сополимеры в смысле данного изобретения включают полимеры, которые не растворяются в воде или только набухают в воде при полном интервале pH 1-14. Нерастворимые в воде полимеры могут быть в то же время полимерами, содержащими не более 12% мономерных остатков с ионными боковыми группами, такими как, например, EUDRAGIT® NE/NM или EUDRAGIT® RL/RS полимеры.
Нерастворимые в воде полимеры могут содержать менее 10, менее 5, менее 2, менее 1% мас. любых мономерных остатков с ионными боковыми группами, предпочтительно, не более 12, не более 6% мас. любых мономерных остатков с катионными боковыми группами.
Один или более нерастворимых в воде полимеров или один или более целлюлозных полимеров, предпочтительно, может содержать менее 5% мас., предпочтительно не более 2% мас., более предпочтительно не более 1 или 0,05 до 1% мас., мономерных остатков с анионными боковыми группами.
Другие типы нерастворимых в воде и несшитых полимеров в смысле данного изобретения могут представлять собой виниловые сополимеры, такие как поливинилацетат, включая производные поливинилацетата. Поливинилацетат может присутствовать в форме дисперсии. Одним из примеров является тип Kollicoat® SR 30D (BASF), дисперсия поливинилацетата, стабилизированная повидоном и Na-лаурилсульфатом.
Подходящей нерастворимой в воде, несшитой целлюлозой может быть, например, метилцеллюлоза или этилцеллюлоза.
Нерастворимые в воде, несшитые полимеры могут, предпочтительно, принадлежать к группе (мет)акрилатных сополимеров.
Полимеры типа EUDRAGIT® NE 30D/EUDRAGIT® NM 30D
Нерастворимым в воде сополимером, который, предпочтительно, применяют в качестве ядра композиции типа ядро/оболочка, может быть сополимер, имеющий в составе свободнорадикально полимеризованные единицы на более 95% мас., в частности, по меньшей мере, на 98% мас., предпочтительно, по меньшей мере, на 99% мас., в частности, по меньшей мере, на 99% мас., более предпочтительно на 100% мас. (мет)акрилатных мономеров с нейтральными группами, особенно C1-C4-алкильными группами. Эти типы полимеров не растворяются в воде или только набухают в воде во всем интервале pH 1-14.
Подходящими (мет)акрилатными мономерами с нейтральными группами являются, например, метилметакрилат, этилметакрилат, бутилметакрилат, метилакрилат, этилакрилат, бутилакрилат. Предпочтение отдается метилметакрилату, этилакрилату и метилакрилату.
Метакрилатные мономеры с анионными функциональными группами, например акриловая кислота и/или метакриловая кислота, могут присутствовать в незначительных количествах менее 5% мас., предпочтительно не более 2% мас., более предпочтительно не более 1 или от 0,05 до 1% мас.
Подходящие примеры включают нейтральные или виртуально нейтральные (мет)акрилатные сополимеры, имеющие в составе от 20 до 40% мас. этилакрилата, от 60 до 80% мас. метилметакрилата и от 0 до менее 5% мас., предпочтительно от 0 до 2 или от 0,05 до 1% мас. метакриловой кислоты или любой метакриловой кислоты (тип EUDRAGIT® NE 30D или EUDRAGIT® NM 30D).
EUDRAGIT® NE 30D и Eudragit® NM 30D являются дисперсиями, содержащими 30% мас. сополимеров, имеющих в составе свободнорадикально полимеризованные единицы 30% мас. этилакрилата и 70% мас. метилметакрилата.
Предпочтение отдается нейтральным или практически нейтральным метилакрилатным сополимерам, которые, согласно WO 01/68767, получены в виде дисперсий с применением 1-10% мас. неионогенного эмульгатора, имеющего значение ГЛБ от 15,2 до 17,3. Преимущество последнего заключается в том, что не происходит разделение фаз с образованием кристаллических структур эмульгатором (тип Eudragit® NM 30D).
Согласно ЕР 1571164 А2, соответственно, виртуально нейтральные (мет)акрилатные сополимеры с незначительными долями от 0,05 до 1% мас. моноолефинно-ненасыщенных C3-C8-карбоновых кислот могут, однако, применяться при полимеризации в эмульсии в присутствии относительно небольших количеств анионных эмульгаторов, например от 0,001 до 1% мас.
Полимеры типа EUDRAGIT® RL/RS
Другим нерастворимым в воде сополимером, который может предпочтительно применяться в качестве ядра композиции типа ядро/оболочка, может быть сополимер, состоящий из свободнорадикально полимеризованных единиц от 85 до 98% мас. свободнорадикально полимеризованных C1-C4 алкильных эфиров акриловой или метакриловой кислоты, и от 15 до 2% мас. (мет)акрилатных мономеров с четверичными аминогруппами в алкильной группе. Эти типы полимеров не растворяются в воде или только набухают в воде во всем интервале pH 1-14.
Алкил(мет)акрилатные сополимеры
Нерастворимыми в воде сополимерами, которые могут применяться в качестве ядра композиции типа ядро/оболочка, могут быть алкил(мет)акрилатные сополимеры без функциональных групп в спиртовой части мономеров сложного эфира. Полимер, например, может быть полимеризован из 100% мас. н-бутилметакрилата (н-БМА).
Предпочтительный полимер или сополимер оболочки
Анионные полимеры или сополимеры
Анионный полимер или сополимер, который, предпочтительно, может применяться в качестве оболочки композиции типа ядро/оболочка, может быть выбран из группы (мет)акрилатных полимеров или сополимеров или поливиниловых полимеров или сополимеров или целлюлоз. Анионные полимеры или сополимеры предпочтительно являются несшитыми.
Анионные целлюлозы
Подходящими анионными полимерами или сополимерами могут быть карбоксиметилцеллюлоза и ее соли (КМЦ, Na-КМЦ, Blanose®, Tylopur®), карбоксиметилэтилцеллюлоза и ее соли, ацетат фталат целлюлозы (АФЦ), ацетат сукцинат целлюлозы (АСЦ), ацетат тримеллиат целлюлозы (АТЦ), фталат гидроксипропилметилцеллюлозы (ФГПМЦ, НР50, НР55) или ацетат сукцинат гидроксипропилметилцеллюлозы (САГПМЦ-LF, -MF, -HF).
Анионные поливиниловые полимеры
Подходящие поливиниловые полимеры или сополимеры могут содержать структурные единицы, которые получены из ненасыщенных карбоновых кислот, отличных от акриловой кислоты или метакриловой кислоты, и в качестве примера можно привести поливинилацетатфталат или сополимер винилацетата и кротоновой кислоты 9:1.
Анионные (мет)акрилатные сополимеры
Анионные (мет)акрилатные сополимеры могут содержать от 25 до 95, предпочтительно от 40 до 95, в частности от 60 до 40% мас. свободнорадикально полимеризованных C1-C18-алкильных эфиров, предпочтительно C1-C8- или C1-C4-алкильных эфиров акриловой или метакриловой кислоты и от 75 до 5, предпочтительно от 60 до 5, в частности от 40 до 60% мас. (мет)акрилатных мономеров, имеющих анионную группу.
Указанные доли обычно добавляют до 100% мас. Однако также возможно, не приводя к ухудшению или изменению существенных свойств, добавлять незначительные количества от 0 до 10, например от 1 до 5% мас., других мономеров, способных к виниловой сополимеризации, таких как, например, гидроксиэтилметакрилат или гидроксиэтилакрилат. Предпочтительно, другие мономеры, способные к виниловой сополимеризации, не присутствуют.
C1-C4-алкильные эфиры акриловой или метакриловой кислоты представляют собой, в частности, метилметакрилат, этилметакрилат, бутилметакрилат, метилакрилат, этилакрилат и бутилакрилат. (Мет)акрилатным мономером, имеющим анионную группу, является, например, акриловая кислота, предпочтительно метакриловая кислота.
Примеры подходящих анионных (мет)акрилатных сополимеров
Подходящий анионный (мет)акрилатный сополимер может быть содержащим, по существу содержащим, включающим или состоящим из полимеризованных единиц
от 10 до 40% мас. акриловой или метакриловой кислоты,
от 10 до 80% мас. C4-C18-алкильного эфира акриловой или метакриловой кислоты и необязательно
от 0 до 60% мас. других виниловых мономеров без поперечно-сшивающих боковых цепей.
C4-C18-алкильный эфир акриловой или метакриловой кислоты, предпочтительно, выбирают из н-бутилметакрилата, 2-этилгексилакрилата, 2-этилгексилметакрилата, изодецилметакрилата и лаурилметакрилата.
Другим виниловым мономером является виниловый мономер, который не является акриловой или метакриловой кислотой или C4-C18-алкильным эфиром акриловой или метакриловой кислоты. Другим виниловым мономером может быть, предпочтительно, C1-C3-алкильный эфир акриловой или метакриловой кислоты, которым является метилакрилат, этилакрилат, пропилакрилат, метилметакрилат, этилметакрилат или пропилметакрилат. Другим виниловым мономером может быть гидроксиэтилметакрилат, гидроксипропилметакрилат, акрилат поли(этиленгликоль)метилового эфира, метакрилат поли(этиленгликоль)метилового эфира, акрилат поли(пропиленгликоль)метилового эфира, метакрилат поли(пропиленгликоль)метилового эфира или стирол.
Предпочтительно, анионный (мет)акрилатный сополимер является содержащим, по существу содержащим или включающим полимеризованные единицы
от 10 до 40% мас. акриловой или метакриловой кислоты,
от 10 до 50% мас. этилакрилата,
от 10 до 80% мас. C4-C18-алкильного эфира акриловой или метакриловой кислоты и необязательно
от 0 до 20% мас. метилметакрилата.
Предпочтительно, анионный (мет)акрилатный сополимер является содержащим, по существу содержащим или включающим полимеризованные единицы
от 20 до 40% мас. метакриловой кислоты,
от 20 до 40% мас. н-бутилметакрилата и
от 30 до 50% мас. этилакрилата
Предпочтительно, анионный (мет)акрилатный сополимер является содержащим, по существу содержащим или включающим полимеризованные единицы
от 20 до 40% мас. метакриловой кислоты,
от 30 до 50% мас. 2-этилгексилакрилата,
от 15 до 40% мас. этилакрилата и необязательно
от 0 до 20% мас. метилметакрилата.
Предпочтительно, анионный (мет)акрилатный сополимер является содержащим, по существу содержащим или включающим полимеризованные единицы
от 10 до 40% мас. метакриловой кислоты,
от 20 до 70% мас. 2-этилгексилметакрилата и
от 10 до 50% мас. этилакрилата.
Предпочтительно, анионный (мет)акрилатный сополимер является содержащим, по существу содержащим или включающим полимеризованные единицы
от 20 до 40% мас. метакриловой кислоты,
от 20 до 50% мас. 2-этилгексилметакрилата и
от 20 до 50% мас. этилакрилата.
Предпочтительно, анионный (мет)акрилатный сополимер является содержащим, по существу содержащим или включающим полимеризованные единицы
от 10 до 35% мас. метакриловой кислоты,
от 40 до 70% мас. 2-этилгексилметакрилата и
от 10 до 30% мас. этилакрилата.
Предпочтительно, анионный (мет)акрилатный сополимер является содержащим, по существу содержащим или включающим полимеризованные единицы
от 20 до 40% мас. метакриловой кислоты,
от 20 до 40% мас. изодецилметакрилата и
от 40 до 50% мас. этилакрилата.
Предпочтительно, анионный (мет)акрилатный сополимер является содержащим, по существу содержащим или включающим полимеризованные единицы
от 20 до 40% мас. метакриловой кислоты,
от 20 до 40% мас. лаурилметакрилата и
от 30 до 50% мас. этилакрилата.
Другие характеристики анионных (мет)акрилатных сополимеров
Другие характеристики анионного (мет)акрилатного сополимера, особенно анионных (мет)акрилатных сополимеров, описанных выше, могут быть суммированы следующим образом.
Предпочтительно, (мет)акрилатный сополимер может быть охарактеризован средней температурой стеклования от 25 до 120 или от 40 до 80°C (определена путем ДСК согласно DIN EN ISO 11357).
Предпочтительно, (мет)акрилатный сополимер может быть охарактеризован минимальной температурой пленкообразования 50°C или менее (определена согласно DIN ISO 2115).
Предпочтительно, (мет)акрилатный сополимер может быть охарактеризован средней молекулярной массой Mw 80000 или более (определена гельпроникающей хроматографией ГПХ).
Другой подходящий анионный (мет)акрилатный сополимер
Подходящими анионными (мет)акрилатными сополимерами являются те, что имеют в составе от 40 до 60% мас. метакриловой кислоты и от 60 до 40% мас. метилметакрилата или от 60 до 40% мас. этилакрилата (типы EUDRAGIT® L или EUDRAGIT® L100-55).
EUDRAGIT® L является сополимером 50% мас. метилметакрилата и 50% мас. метакриловой кислоты. pH начала высвобождения конкретного активного ингредиента в кишечном соке или искусственном кишечном соке установлена как pH 6,0.
EUDRAGIT® L 100-55 является сополимером 50% мас. этилакрилата и 50% мас. метакриловой кислоты. EUDRAGIT® L30 D-55 является дисперсией, содержащей 30% мас. EUDRAGIT® L 100-55. pH начала высвобождения конкретного активного ингредиента в кишечном соке или искусственном кишечном соке установлена как pH 5,5.
Также подходят анионные (мет)акрилатные сополимеры, имеющие в составе от 20 до 40% мас. метакриловой кислоты и от 80 до 60% мас. метилметакрилата (тип EUDRAGIT® S). pH начала высвобождения конкретного активного ингредиента в кишечном соке или искусственном кишечном соке установлена как pH 7,0.
Подходящими (мет)акрилатными сополимерами являются те, которые состоят из от 10 до 30% мас. метилметакрилата, от 50 до 70% мас. метилакрилата и от 5 до 15% мас. метакриловой кислоты (тип EUDRAGIT FS). pH начала высвобождения конкретного активного ингредиента в кишечном соке или искусственном кишечном соке установлена как pH 7,0.
EUDRAGIT® FS является сополимером 25% мас. метилметакрилата, 65% мас. метилакрилата и 10% мас. метакриловой кислоты. EUDRAGIT® FS 30 D является дисперсией, содержащей 30% мас. EUDRAGIT® FS.
Кроме того, подходящим является сополимер, имеющий в составе
от 20 до 34% мас. метакриловой кислоты и/или акриловой кислоты,
от 20 до 69% мас. метилакрилата и
от 0 до 40% мас. этилакрилата и/или, если приемлемо,
от 0 до 10% мас. других мономеров без поперечно-сшивающих боковых цепей, способных к виниловой сополимеризации,
при условии, что температура стеклования сополимера по ISO 11357-2, подраздел 3.3.3, составляет не более 60°C. Этот (мет)акрилатный сополимер особенно подходит из-за его хороших свойств удлинения при разрушении, для прессования гранул в таблетки.
Кроме того, подходящим является сополимер, имеющий в составе
от 20 до 33% мас. метакриловой кислоты и/или акриловой кислоты,
от 5 до 30% мас. метилакрилата и от 20 до 40% мас.этилакрилата и
более чем от 10 до 30% мас. бутилметакрилата и, если приемлемо,
от 0 до 10% мас. других мономеров без поперечно-сшивающих боковых цепей, способных к виниловой сополимеризации,
где доли мономеров добавляют до 100% мас.,
при условии, что температура стеклования сополимера по ISO 11357-2, подраздел 3.3.3 (средняя температура Tmg), составляет от 55 до 70°C. Сополимеры этого типа особенно подходят благодаря их хорошим механическим свойствам, для прессования гранул в таблетки.
Указанный выше сополимер имеет в составе, в частности, свободнорадикально полимеризованные единицы от 20 до 33, предпочтительно от 25 до 32, особенно предпочтительно от 28 до 31% мас. метакриловой кислоты или акриловой кислоты, предпочтительно метакриловой кислоты,
от 5 до 30, предпочтительно от 10 до 28, особенно предпочтительно от 15 до 25% мас., метилакрилата, от 20 до 40, предпочтительно от 25 до 35, особенно предпочтительно от 18 до 22% мас., этилакрилата, и более чем 10-30, предпочтительно от 15 до 25, особенно предпочтительно от 18 до 22% мас., бутилметакрилата,
где мономерную композицию выбирают так, что температура стеклования сополимера составляет от 55 до 70°C, предпочтительно от 59 до 66, особенно предпочтительно от 60 до 65°C.
Температура стеклования означает в данном описании, в частности, среднюю температуру Tmg согласно ISO 11357-2, подраздел 3.3.3. Измерения проводят без добавления пластификатора, со средним содержанием остаточных мономеров (REMO) менее 100 ч./млн., при нагревании 10°C/мин в атмосфере азота.
Сополимер, предпочтительно, состоит по существу исключительно из 90, 95 или 99-100% мас. мономеров метакриловой кислоты, метилакрилата, этилакрилата и бутилметакрилата в интервалах количеств, указанных выше.
Однако возможно, не ухудшая существенных свойств, добавлять незначительные количества порядка от 0 до 10, например от 1 до 5% мас., других мономеров, способных к виниловой сополимеризации, таких как, например, метилметакрилат, бутилакрилат, гидроксиэтилметакрилат, винилпирролидон, винилмалоновая кислота, стирол, виниловый спирт, винилацетат и/или их производные.
Получение анионных (мет)акрилатных сополимеров
Анионные (мет)акрилатные сополимеры могут быть получены известным методом свободнорадикальной полимеризации мономеров (см., например, ЕР 0704207 А2 и ЕР 0704208 А2) радикальной полимеризацией мономеров в присутствии инициаторов полимеризации и, необязательно, регуляторов молекулярной массы. Сополимеры в соответствии с данным изобретением получают свободнорадикальной полимеризацией в эмульсии в водной фазе в присутствии, предпочтительно, анионных эмульгаторов. Способ полимеризации в эмульсии хорошо известен в данной области техники и описан, например, в DE-C 2135073.
Средняя молекулярная масса Mw (средневесовая, определенная, например, измерением вязкости раствора) анионных (мет)акрилатных сополимеров может находиться, например, в диапазоне от 80000 до 1000000 (г/моль).
Способ получения анионного (мет)акрилатного сополимера
Анионный (мет)акрилатный сополимер может быть получен радикальной полимеризацией мономеров в присутствии инициаторов полимеризации. Регуляторы молекулярной массы могут быть добавлены. Предпочтительным методом полимеризации является полимеризация в эмульсии.
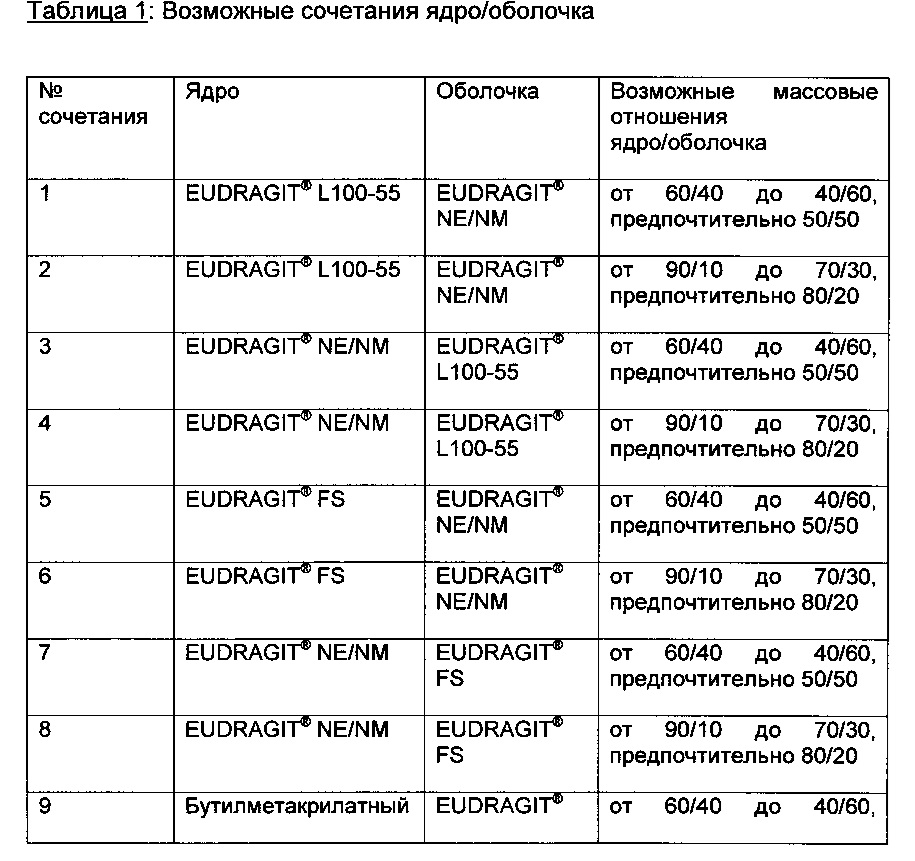
Подходящие сочетания ядро/оболочка
Любые возможные сочетания любого типа полимера или сополимера, описанного здесь как возможный полимер ядра, с любым типом полимера или сополимера, описанным здесь как возможный полимер оболочки, однозначно описаны здесь. Однако некоторые сочетания предпочтительны.
EUDRAGIT® LI 00-55 сополимер качестве полимера ядра или оболочки
EUDRAGIT® L100-55 сополимер представляет собой сополимер, полимеризованный из 40-60, предпочтительно 45-55, особенно предпочтительно 50% мас., этилакрилата (ЭА) и 40-60, предпочтительно 45-55, особенно предпочтительно 50% мас., метакриловой кислоты (МАК). Предпочтительным является EUDRAGIT® L 100-55, который является сополимером 50% мас. этилакрилата и 50% мас. метакриловой кислоты (EUDRAGIT® L30 D-55 является дисперсией, содержащей 30% мас. EUDRAGIT® L 100-55).
EUDRAGIT® L сополимер в качестве полимера ядра или оболочки
EUDRAGIT® L сополимер является сополимером, полимеризованным из 40-60, предпочтительно 45-55, особенно предпочтительно 50% мас., метилметакрилата (ММА) и 40-60, предпочтительно 45-55, особенно предпочтительно 50% мас., метакриловой кислоты (МАК). Предпочтительным является EUDRAGIT® L, который является сополимером 50% мас. метилметакрилата (ММА) и 50% мас. метакриловой кислоты (EUDRAGIT® L30D является дисперсией, содержащей 30% мас. EUDRAGIT® L).
EUDRAGIT S сополимер в качестве полимера ядра или оболочки
EUDRAGIT® S сополимер является сополимером, полимеризованным из 60-80, предпочтительно, 65-75, особенно предпочтительно 70% мас., метилметакрилата (ММА) и 20-40, предпочтительно 25-35, особенно предпочтительно 30% мас., метакриловой кислоты (МАК). Предпочтительным является EUDRAGIT® S100, который является сополимером 70% мас. метилметакрилата (ММА) и 30% мас. метакриловой кислоты.
EUDRAGIT® NE/NM сополимер в качестве полимера ядра или оболочки
EUDRAGIT® NE/NM сополимер является сополимером, полимеризованным из 20-40% мас. этилакрилата, 60-80% мас. метилметакрилата и от 0 до менее 5% мас., предпочтительно от 0 до 2 или от 0,05 до 1% мас., метакриловой кислоты или любой метакриловой кислоты (EUDRAGIT® NE 30D или EUDRAGIT® NM 30D). Предпочтительны сополимеры, имеющие в составе свободнорадикально полимеризованные единицы 30% мас. этилакрилата и 70% мас. метилметакрилата (EUDRAGIT® NE 30D и EUDRAGIT® NM 30D являются дисперсиями, содержащими 30% мас. сополимеров, имеющие в составе свободнорадикально полимеризованные единицы 30% мас. этилакрилата и 70% мас. метилметакрилата.)
EUDRAGIT® FS сополимер в качестве полимера ядра или оболочки
EUDRAGIT® FS сополимер является сополимером, полимеризованным из 10-30% мас. метилметакрилата, 50-70% мас. метилакрилата и 5-15% мас. метакриловой кислоты (EUDRAGIT® FS). Предпочтительным является EUDRAGIT® FS, который является сополимером 25% мас. метилметакрилата, 65% мас. метилакрилата и 10% мас. метакриловой кислоты (EUDRAGIT® FS 30D является дисперсией, содержащей 30% мас. EUDRAGIT® FS.).
Бутилметакрилатный гомополимер в качестве полимера ядра
н-Бутилметакрилатный гомополимер является полимером, полимеризованным из 100% мас. н-бутилакрилата (н-БМА).

Высвобождение фармацевтического или нутрицевтического активного ингредиента в зависимости от композиции покрытия
Высвобождение, согласно USP, фармацевтического или нутрицевтического активного ингредиента составляет не более 10, не более 8 или не более 5% в условиях in vitro при pH 1,2 через 2 часа в 0,1 М HCl с или без добавления 20, 30 или 40% (об./об.) этанола.
Высвобождение, согласно USP, фармацевтического или нутрицевтического активного ингредиента составляет, по меньшей мере, 50, по меньшей мере, 60, по меньшей мере, 80% в условиях in vitro при pH 6,8 через 45 или через 60 минут в буферной среде (фосфатно-солевой буферный раствор, pH 6,8, European Pharmacopoeia 4003200).
В качестве альтернативы, высвобождение фармацевтического или нутрицевтического активного ингредиента может составлять, по меньшей мере, 50, по меньшей мере, 60, по меньшей мере, 80% в условиях in vitro при pH 7,2 через 45 или через 60 минут в буферной среде согласно USP, например, если применяют полимер типа EUDRAGIT® FS в качестве полимера ядра или оболочки. Сополимеры типа EUDRAGIT® FS показывают начало высвобождения определенного активного ингредиента в кишечном соке или искусственном кишечном соке при около pH 7,0.
Таким образом, высвобождение фармацевтического или нутрицевтического активного ингредиента может составлять, по меньшей мере, 50, по меньшей мере, 60, по меньшей мере, 80% в условиях in vitro при pH 6,8 или при pH 7,2 через 45 или через 60 минут в буферной среде согласно USP.
USP (USP = Фармакопея Соединенных Штатов Америки), которая предпочтительно применяется, является USP32/NF27 (NF = Национальный формуляр), аппарат II, способ с использованием лопастной мешалки, 50 об/мин для таблеток, или способ с использованием лопастной мешалки или способ с использованием корзинки от 50 до 100 об/мин, в зависимости от монографии, для гранул.
Ядро, содержащее фармацевтический или нутрицевтический активный ингредиент
Ядро содержит один или более фармацевтических или нутрицевтических активных ингредиентов в качестве ядра или в качестве части ядра. Один или более фармацевтических или нутрицевтических активных ингредиентов могут быть более или менее гомогенно распределены в матричной структуре в структуре ядра, или могут образовывать ядро в виде кристаллической структуры. Один или более фармацевтических или нутрицевтических активных ингредиентов альтернативно может присутствовать в качестве части ядра в форме слоя на грануле носителя. Таким образом, ядро является необработанной, покрытой или непокрытой, но предназначенной для покрытия, фармацевтической или нутрицевтической дозированной формой.
Ядро, соответственно, фармацевтическая или нутрицевтическая дозированная форма, предназначенная для нанесения покрытия из композиции покрытия, может содержать или может состоять из гранул нейтрального носителя, например, сахарных сфер или нонпарелей, на поверхность которых активный ингредиент прикреплен связующим агентом, таким как лактоза или поливинилпирролидон.
Ядро альтернативно может содержать гранулу в форме полимерной матрицы, с которой связан активный ингредиент. Ядро может содержать непокрытые гранулы, состоящие из кристаллизованного активного ингредиента. Ядро также может иметь собственное покрытие, например покрытие для замедленного высвобождения. Такое, уже имеющее покрытие ядро затем может быть покрыто описанной здесь композицией покрытия.
Ядро может не иметь покрытия или может иметь покрытие, которое отличается от покрытия, полученного из описанной здесь композиции покрытия. Ядром может быть гранула с покрытием, например с покрытием для замедленного высвобождения, таблетка без оболочки или в оболочке, минитаблетка в оболочке или без оболочки капсула в оболочке или без оболочки. Ядро также может содержать так называемое "субпокрытие" в качестве внешнего слоя.
Ядро содержит, по меньшей мере, более 80, более 90, более 95, более 98, предпочтительно, 100% от общего количества одного или более фармацевтических или нутрицевтических активных ингредиентов, присутствующих в желудочно-резистентных фармацевтических или нутрицевтических дозированных форм.
В некоторых случаях может быть полезно, чтобы композиция покрытия составляла, дополнительно к активному ингредиенту, присутствующему в ядре, частичное количество, предпочтительно, менее 20, менее 10, менее 5 менее 2% мас. от общего количества одного или более фармацевтических или нутрицевтических активных ингредиентов, например, для обеспечивания исходной дозы активного ингредиента. В этом случае композиция покрытия действует в качестве связующего агента или связующего вещества для дополнительного активного ингредиента. Предпочтительно, композиция покрытия содержит любой активный ингредиент.
Покрытие
Суспензии покрытия могут быть нанесены распылением или покрытием порошком с применением известных методов. Как правило, композиции с покрытием могут быть отверждены при повышенных температурах, например, в течение 24 часов при 40°C или 60°C после распыления для получения воспроизводимой и стабильной функциональности.
Прирост сухой массы полимера слоя покрытия может составлять, по меньшей мере, 2,5, по меньшей мере, 3,5, по меньшей мере, 4, предпочтительно, от 4 до 30, предпочтительно, от 4 до 20, более предпочтительно, от 5 до 18, или наиболее предпочтительно, от 10 до 18 мг/см2 площади поверхности. Это может коррелировать с 2-60% увеличением сухой массы полимера по отношению к массе ядра. Для таблеток в оболочке увеличение сухой массы полимера к массе ядра (ядра таблетки: около 1-25 или 1-10 мм диаметром или длиной) может быть 2-30%. Для гранул в оболочке увеличение сухой массы полимера к массе ядра (ядра гранулы: от 0,1 до 1,5 мм диаметром) может быть 10-60%.
Гранулы обычно покрывают, по меньшей мере, 4% массовыми полимера, по отношению к массе гранул без оболочки (т.е. 4% увеличение массы полимера). Лучшая защита активного ингредиента достигается более толстым покрытием с 6%, 8% или 10% приростом массы полимера.
Обычно не более 40% увеличение массы полимера покрытия применяется для гранул, иначе время, необходимое для растворения слоя покрытия становится более длительным. Во многих случаях достаточно менее 30%, менее 25% или менее 20% прироста массы полимера.
На таблетки и капсулы наносят покрытие в количестве, обычно, по меньшей мере, 2 мг полимера на см2 поверхности. В большинстве случаев наносят, по меньшей мере, 3 мг, 4 мг или 6 мг полимера на см2 поверхности. Количество покрытия более 40 мг полимера на см2 поверхности применяют очень редко; обычно наносят менее 30 мг, менее 25 мг или менее 20 мг полимера на см2 поверхности. В общем, большая толщина покрытия требуется для капсул и таблеток в форме овала, в то время как более сферические дозированные формы требуют меньшего покрытия.
Верхние покрытия и субпокрытия
Желудочно-резистентные фармацевтические или нутрицевтические дозированные формы в соответствии с данным изобретением могут также иметь так называемое "субпокрытие" или так называемое "верхнее покрытие" или оба. Выражения субпокрытие и верхнее покрытие хорошо известны специалисту в данной области техники.
Субпокрытие может быть расположено между ядром и желудочно-резистентным (кишечнорастворимым) покрытием. Функцией субпокрытия является разделение веществ ядра от веществ контролирующего слоя, которые могут быть несовместимыми друг с другом. Субпокрытие, по существу, не оказывает влияние на характеристики высвобождения активного ингредиента. Субпокрытие, предпочтительно, по существу растворимо в воде, например, оно может состоять из веществ, таких как гидроксипропилметилцеллюлоза (ГПМЦ) в качестве пленкообразователя. Средняя толщина слоя субпокрытия очень незначительна, например не более 15 мкм, предпочтительно не более 10 мкм.
Верхнее покрытие также, предпочтительно, по существу растворимо в воде. Функцией верхнего покрытия является окрашивание фармацевтической или нутрицевтической формы или защита от воздействия окружающей среды, например от влаги, во время хранения. Верхнее покрытие может состоять из связующего агента, например водорастворимого полимера, такого как полисахарид или ГПМЦ, или сахарного соединения, такого как сахароза. Верхнее покрытие может также содержать фармацевтические или нутрицевтические эксципиенты, такие как пигменты и скользящие вещества в больших количествах. Верхнее покрытие практически не оказывает влияние на характеристики высвобождения.
Выражения субпокрытие и верхнее покрытие хорошо известны специалисту в данной области техники.
Фармацевтические или нутрицевтические активные ингредиенты
Композиции покрытия могут содержать один или более любых фармацевтических и/или нутрицевтических активных ингредиентов.
Нутрицевтические активные ингредиенты
Настоящее изобретение, предпочтительно, применяется для нутрицевтических дозированных форм.
Нутрицевтики могут быть определены как пищевые экстракты, заявленные как обладающие медицинским действием на здоровье человека. Нутрицевтики обычно содержатся в медицинских формах, таких как капсула, таблетка или порошок, в предписанной дозе. Примеры нутрицевтических активных ингредиентов включают резвератрол из продуктов винограда в качестве антиоксиданта, продукты растворимых пищевых волокон, таких как шелуха семян подорожника, для снижения гиперхолестеринемии, брокколи (сульфан) в качестве профилактики от рака, и соя или клевер (изофлавоноиды) для улучшения здоровья артерий. Другие примеры нутрицевтиков включают флавоноиды, антиоксиданты, альфа-линолевую кислоту из семян льна, бета-каротин из лепестков календулы или антоцианины из ягод. Иногда выражение нейтрицевтик применяют как синоним нутрицевтика.
Желудочно-резистентные фармацевтические или нутрицевтические композиции содержат ядро, содержащее фармацевтический или нутрицевтический активный ингредиент. Фармацевтический или нутрицевтический активный ингредиент может быть фармацевтическим или нутрицевтическим активным ингредиентом, который может быть инактивирован под воздействием желудочного сока при pH 1,2, или фармацевтическим или нутрицевтическим активным ингредиентом, который может раздражать слизистую желудка при его попадании в свободной форме в желудок.
Фармацевтические активные ингредиенты
Изобретение также предпочтительно применяют для кишечнорастворимых фармацевтических дозированных форм.
Предпочтительно классы дозированных средств включают такие (включая, но не ограничиваясь ими), которые используют по соображениями перехода от парентеральных к пероральным формам и/или лекарственным средствам высокой мощности (например, цитостатики, гормоны, агонисты рецепторов гормонов, антагонисты рецепторов гормонов) и/или лекарственным средствам с сильными побочными эффектами и высокой токсичностью (включая метаболизм пролекарств; например, пептиды, пептидомиметики, нуклеотиды, нуклеозиды, аналоги нуклеозидов, таксоиды)
Особенно предпочтительными являются следующие лекарственные средства
Remicade® (Infliximab, Johnson & Johnson, Schering-Plough, Mitsubishi Tanabe Pharma - болезнь Крона, ревматоидный артрит),
Enbrel® (Etanercept, Wyeth - ревматоидный артрит),
Zyprexa® (Olanzapine, Eli Lilly and Company - психоз),
Seroquel® (Quetiapine, AstraZeneca - шизофрения),
Herceptin® (Trastuzumab, Roche, Genentech, Chugai Pharmaceutical - рак молочной железы),
Lexapro®, Cipralex® (Escitalopram, Forest Laboratories, H. Lundbeck - расстройства депрессии, тревоги),
Gleevec®, Glivec (Imatinib, Novartis - лейкемия),
Avastin® (Bevacizumab, Roche, Genentech - рак толстой и ободочной кишки), Taxotere® (Docetaxel, Sanofi-Aventis - рак),
Eloxatin®, Eloxatine® (Oxaliplatin, Sanofi-Aventis - рак толстой и ободочной кишки),
Wellbutrin® (Bupropion, Glaxo SmithKline, Biovail - депрессия, сезонные аффективные расстройства (CAP)),
Ability® (Aripiprazole, Otsuka Pharmaceutical, Bristol-Myers Squibb - психоз, депрессия),
Avonex® (Interferonbeta-Ia, Biogen Idee - рассеянный склероз), Viagra® (Sildenafil, Pfizer - эректильная дисфункция),
Lupron®, Leuplin (Leuprolide, Takeda Pharmaceutical, TAP Pharmaceutical - рак простаты),
Zofran® (Ondansetron, GlaxoSmithKline - тошнота и рвота),
Arimidex® (Anastrozole, AstraZeneca - рак молочной железы),
Prograf® (Tacrolimus, Astellas Pharma - отторжение трансплантата),
CellCept® (Mycophenolatemofetil, Roche, Chugai Pharmaceutical - отторжение трансплантата),
Gemzar® (Gemcitabine, Eli Lilly and Company - рак),
Cymbalta® (Duloxetine, Eli Lilly and Company - депрессия, тревожные расстройства),
Duragesic® (Fentanyl, Johnson & Johnson - боль), Casodex® (Bicalutamide, AstraZeneca - рак простаты),
Truvada® (Tenofovir+Emtricitabine, Gilead Sciences - инфекция ВИЧ),
Flomax® (Tamsulosin, Boehringer Ingelheim - злокачественная гипертрофия простаты),
Lyrica® (Pregabalin, Pfizer - невропатическая боль),
Paxil®, Seroxat® (Paroxetine, Glaxo SmithKline - депрессия, тревожные расстройства),
Kaletra® (Lopinavir, Abbott Laboratories - инфекция ВИЧ),
Erbitux® (Cetuximab, Bristol-Myers Squibb, Merck KGaA - рак толстой и ободочной кишки),
Zoladex® (Goserelin, AstraZeneca - рак простаты),
Combivir® (Lamivudine+Zidovudine, Glaxo SmithKline - инфекция ВИЧ),
Cialis® (Tadalafil, Eli Lilly and Company, Lilly Icos - эректильная дисфункция),
Reyataz® (Atazanavir, Bristol-Myers Squibb - инфекция ВИЧ),
Concerta® (Methylphenidate, Johnson & Johnson - расстройство гиперактивности при дефиците внимания),
Camptosar® (Irinotecan, Pfizer - рак толстой и ободочной кишки),
Adderall® (Amphetamine, Shire Pharmaceuticals - расстройство гиперактивности при дефиците внимания),
Ultane®, Sevorane® (Sevoflurane, Abbott Laboratories - анестезия),
Xeloda® (Capecitabine, Roche, Chugai Pharmaceutical - рак),
Femara® (Letrozole, Novartis, Chugai Pharmaceutical - рак молочной железы),
Viread® (Tenofovir, Gilead Sciences - инфекция ВИЧ),
Tarceva® (Erlotinib, Roche, Genentech - не мелкоклеточный рак легких),
Alimta® (Pemetrexed, Eli Lilly and Company - не мелкоклеточный рак легких),
Actiq® (Fentanyl, Cephalon - боль при раке),
Lidoderm® (Lidocaine, Endo Pharmaceuticals - боль),
Taxol® (Paclitaxel, Bristol-Myers Squibb - рак),
Trizivir® (Abacavir+Lamivudine+Zidovudine, Glaxo SmithKline - инфекция ВИЧ),
Epzicom®, Kixeva® (Abacavir + Lamivudine, GlaxoSmithKline - инфекция ВИЧ),
Venlafaxine® (Effexor, Wyeth - антидепрессант)
… а также лекарственные средства соответствующих классов соединений и/или соответствующим способом действия, подразумеваются в указанных примерах (последнее является описанием не только физико-химии активного фармацевтического ингредиента (АФИ), но также его физиологического поведения и фармацевтического характера).
Терапевтические и химические классы лекарственных средств, применяемых в кишечнорастворимых фармацевтических дозированных форм с покрытием включают, например, обезболивающие агенты, антибиотики или противоинфекционные агенты, антитела, противосудорожные агенты, антигены из растений, противоревматические агенты, бета-блокаторы, производные бензимидазола, бета-блокатор, сердечно-сосудистые лекарственные средства, химиотерапевтические агенты, препараты для ЦНС, гликозиды дигиталиса, желудочно-кишечные лекарственные средства, например, ингибиторы протонного насоса, ферменты, гормоны, жидкие или твердые природные экстракты, олигонуклеотиды, пептидогормональные белки, терапевтические бактерии, пептиды, белки, ингибиторы протонного насоса, соли металлов, например аспартаты, хлориды, ортаты, урологические лекарственные средства, вакцины.
Примеры лекарственных средств, которые являются неустойчивыми к кислоте, раздражающими или требуют контролируемого высвобождения, включают:
Акампростат, аэсцин, амилазу, ацетилсалициловую кислоту, адреналин, 5-аминосалициловую кислоту, ауреомицин, бацитрацин, балсалазин, бета-каротин, бикалутамид бисакодил, бромелаин, будесонид, кальцитоцин, карбамаципин, карбоплатин, цефалоспорины, цетрореликс, кларитромицин, хлоромицетин, циметидин, цизаприд, кладрибин, клоразепат, кромалин, 1-деаминоцистеин-8-D-аргинин-вазопрессин, дерамциклан, детиреликс, дексланзопразол, диклофенак, диданозин, дигитоксин, и другие гликозиды дигиталиса, дигидрострептомицин, диметикон, дивалпроекс, дроспиренон, дулоксетин, ферменты, эритромицин, эзомепразол, эстрогены, этопозид, фамотидин, фториды, чесночное масло, глюкагон, гранулоцитарный колониестимулирующий фактор (Г-КФС), гепарин, гидрокортизон, человеческий гормон роста (чГР), ибупрофен, илапразол, инсулин, интерферон, интерлейкин, Интрон А, кетопрофен, лансопразол, лейпролидацетат липазы, липоевая кислота, литий, кинин, мемантин, месалазин, метенамин, миламелин, минералы, минопразол, напроксен, натамицин, нитрофурантион, новобиоцин, олсалазин, омепразол, оротаты, панкреатин, пантопразол, паратироидный гормон, пароксетин, пенициллин, перпразол, пиндолол, полимиксин, калий, правастатин, преднизон, преглуметацина прогабид, просоматостатин, протеаза, хинаприл, рабепразол, ранитидин, ранолазин, ребоксетин, рутозид, соматостатин стрептомицин, субтилин, сульфасалазин, сульфаниламид, тамсулозин, тенатопразол, трипсин, вальпроевая кислота, вазопрессин, витамины, цинк, включая их соли, производные, полиморфы, изоморфы или любые виды смесей или их сочетания.
Фармацевтические или нутрицевтические эксципиенты (композиция покрытия)
Композиция покрытия может содержать, по существу содержит или включает вплоть до 80, вплоть до 70, вплоть до 60, вплоть до 50, вплоть до 40, вплоть до 30, вплоть до 20% мас. любых фармацевтических или нутрицевтических эксципиентов. Таким образом, количество кишечнорастворимого полимерного ядра/оболочки и фармацевтических или нутрицевтических эксципиентов может составлять вплоть до 100% в композиции покрытия.
В некоторых случаях может быть полезно, чтобы композиция покрытия также содержала, дополнительно к активному ингредиенту в ядре, частичное количество, предпочтительно, менее 10% менее 5% менее 2% мас. от общей массы одного или более фармацевтических или нутрицевтических активных ингредиентов, например, для получения быстро выделяемой первоначальной дозы. В этом случае композиция покрытия действует как связующий агент или связующее вещество для дополнительной части активного ингредиента. Таким образом, в этом случае, количества полимера кишечнорастворимой ядра/оболочки, фармацевтических или нутрицевтических эксципиентов и одного или более фармацевтических или нутрицевтических активных ингредиентов может составлять вплоть до 100% в композиции покрытия.
Композиции покрытия могут содержать вплоть до 80, вплоть до 70, вплоть до 60, вплоть до 50, вплоть до 40, вплоть до 30, вплоть до 20% мас. любых фармацевтических или нутрицевтических эксципиентов, выбранных из группы, включающей антиоксиданты, осветлители, связующие агенты, вкусовые добавки, агенты для повышения текучести, отдушки, скользящие вещества, промоторы проникания, пигменты, пластификаторы, полимеры, которые отличаются от полимеров ядра/оболочки, описанных здесь, порообразующие агенты или стабилизаторы.
Желудочно-резистентные фармацевтические или нутрицевтические дозированные формы
Изобретение относится к желудочно-резистентным фармацевтическим или нутрицевтическим дозированным формам, содержащим ядро, содержащее фармацевтический или нутрицевтический активный ингредиент, и желудочно-резистентное покрытие на ядре, где желудочно-резистентное покрытие получают из композиции покрытия, описанной здесь.
Желудочно-резистентные фармацевтические или нутрицевтические дозированные формы в соответствии с данным изобретением характеризуются высвобождением фармацевтического или нутрицевтического активного ингредиента согласно USP, которое составляет не более 10, не более 8 или не более 5% в условиях in-vitro при pH 1,2 через 2 часа в 1 М HCl с или без добавления 20% (об./об.) этанола.
Желудочно-резистентные фармацевтические или нутрицевтические композиции в соответствии с данным изобретением могут быть также охарактеризованы высвобождением фармацевтического или нутрицевтического активного ингредиента согласно USP, которое составляет, по меньшей мере, 50, по меньшей мере, 60, по меньшей мере, 80% в условиях in- vitro при pH 6,8 через 45 минут в буферной среде (фосфатно-солевой буферный раствор, pH 6,8, European Pharmacopoeia 4003200).
Ссылка на USP32/NF27 (NF = Национальный формуляр), аппарат II, способ с использованием лопастной мешалки, 50 об/мин для таблеток, или способ с использованием лопастной мешалки или способ с использованием корзинки от 50 до 100 об/мин, в зависимости от монографии, для гранул.
Применение в качестве композиции покрытия
Данное изобретение относится к применению композиции покрытия, описанной выше, для покрытия ядра, содержащей фармацевтический или нутрицевтический активный ингредиент, где полученная покрытая фармацевтическая или нутрицевтическая дозированная форма демонстрирует высвобождение фармацевтического или нутрицевтического активного ингредиента не более 10% в условиях in vitro при pH 1,2 через 2 ч в среде согласно USP с и без добавления 20% (об./об.) этанола.
Применение в качестве связующей композиции
Описанная здесь композиция покрытия также может применяться в качестве связующего агента для связывания фармацевтического или нутрицевтического активного ингредиента в покрытии или в ядре фармацевтической или нутрицевтической дозированной формы. Если композиция покрытия не используется в покрытии, но используется в качестве связующего агента в ядре фармацевтической или нутрицевтической дозированной формы, в качестве связующего агента или матрицеобразователя, она может быть названа связующей композицией.
Высвобождение фармацевтического или нутрицевтического активного ингредиента для связующей композиции
Высвобождение фармацевтического или нутрицевтического активного ингредиента составляет не более 10, не более 8 или не более 5% в условиях in vitro при pH 1,2 через 2 часа в среде согласно USP с и без добавления 20, 30 или 40% (об./об.) этанола.
Высвобождение фармацевтического или нутрицевтического активного ингредиента составляет, по меньшей мере, 50, по меньшей мере, 60, по меньшей мере, 80% в условиях in vitro при pH 6,8 через 45 или через 60 минут в буферной среде согласно USP.
USP (USP = Фармакопея Соединенных Штатов Америки), которая предпочтительно применяется, является USP32/NF27 (NF = Национальный формуляр), аппарат II, способ с использованием лопастной мешалки, 50 об./мин. для таблеток, или способ с использованием лопастной мешалки или способ с использованием корзинки от 50 до 100 об/мин, в зависимости от монографии, для гранул.
Полимерная композиция типа ядро/оболочка
Данное изобретение также относится к полимерной композиции типа ядро/оболочка, описанной здесь, для применения в качестве покрытия или связующего агента в фармацевтических или нутрицевтических дозированных формах.
Полимерную композицию типа ядро/оболочка получают способом полимеризации в эмульсии, где либо ядро образовано из нерастворимого в воде полимера или сополимера и оболочка образована из анионного полимера или сополимера, либо наоборот.
Полимерная композиция типа ядро/оболочка, в которой ядро образовано из нерастворимого в воде полимера или сополимера и оболочка образована из анионного полимера или сополимера, является предпочтительной.
Поэтому настоящее изобретение относится к полимерной композиции типа ядро/оболочка, подходящей в качестве покрытия или связующего агента для фармацевтических или нутрицевтических дозированных форм, содержащей ядро и внешнее покрытие, где ядро содержит один или более фармацевтических или нутрицевтических активных ингредиентов, и где покрытие содержит полимерную композицию типа ядро/оболочка, которая образуется в результате процесса полимеризации в эмульсии, где либо ядро полимерной композиции типа ядро/оболочка образована из нерастворимого в воде, несшитого полимера или сополимера и оболочка образована из анионного полимера или сополимера, либо наоборот. Таким образом, полимерная композиция типа ядро/оболочка является частью фармацевтической или нутрицевтической дозированной формы.
Хотя мономеры нерастворимого в воде несшитого полимера или сополимера предпочтительно загружают первыми на стадии полимеризации в эмульсии для образования ядра композиции типа ядро/оболочка, и мономеры анионного полимера или сополимера загружают потом для получения оболочки, может иметь место инверсия, когда ядро и оболочка меняются положением во время процесса.
Как описано в WO 2008/049657, полимерные композиции типа ядро/оболочка в соответствии с данным изобретением могут быть полезны в качестве связующих агентов или матрицеобразователей для активных ингредиентов, включенных в пероральные лекарственные формы и отложенным или замедленным высвобождением для минимизации эффекта усиления или ослабления высвобождения активного ингредиента под влиянием этанола в условиях in vitro.
Примеры
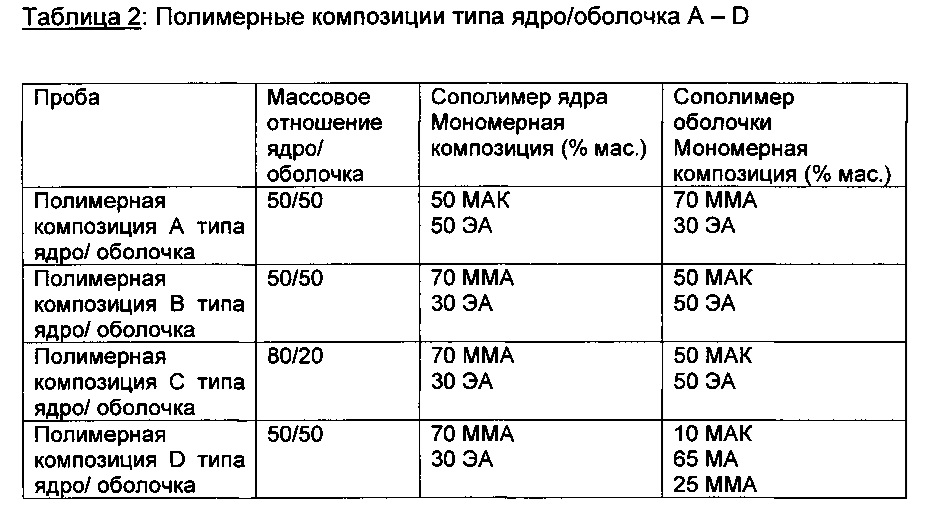
Получение полимерной дисперсии в соответствии с данным изобретением.
Полимер получают в 1-литровой круглодонной колбе, оборудованной крышкой, якорной мешалкой, перегородкой, конденсатором с обратным холодильником, подающей трубкой для азота и температурным датчиком для отслеживания температуры в реакторе. Водяную баню с термостатом применяют для контроля температуры реакции.
653 г деионизированной воды, 13,2 г раствора додецилсульфата натрия (15% в воде; Disponil SDS 15) и 6,5 г полисорбата 80 (TEGO SMO 80V) загружают в колбу. Реактор промывают азотом, и смесь перемешивают мешалкой и нагревают до начальной температуры 82°C.
Две стабильных эмульсии мономеров готовят для полимера ядра и полимера оболочки, соответственно. Суммарно применяют 280,0 г мономеров, разделенные на две колбы согласно желаемому соотношению полимера ядра к полимеру оболочки. Мономерная композиция каждой из двух эмульсий выбирают согласно таблице примеров (см. ниже). Для каждой эмульсии применяют 3% мас. деионизированной воды по отношению к массе мономеров.
В качестве примера "полимерной композиции типа ядро/оболочка А" - как в таблице примеров - мономерную эмульсию ядра получают с 70,0 г метакриловой кислоты, 70,0 г этилакрилата и 4,2 г деионизированной воды. Мономерную эмульсию оболочки получают из 98,0 г метилметакрилата, 42,0 г этилакрилата и 4,2 г деионизированной воды.
Два раствора инициатора (для получения полимера ядра и полимера оболочки, соответственно) готовят растворением 0,12% моль персульфата аммония (по отношению к сумме применяемых мономеров эмульсии мономера ядра и эмульсии мономера оболочки, соответственно) в 5,0 г деионизированной воды.
Когда температура внутри реактора достигает 82°C, раствор инициатора полимера ядра добавляют в реактор. Через две минуты начинают подачу мономерной эмульсии ядра со скоростью подачи 2 г/мин. Корректируя температуру водяной бани, температуру внутри реактора сохраняют на уровне 82°C.После добавлений всей мономерной эмульсии ядра температуру поддерживают в течение 10 минут при 82°C, затем в реактор добавляют раствор инициатора для оболочки. Через 2 минуты начинают подачу мономерной эмульсии оболочки со скоростью подачи 2 г/мин.
После добавления всей мономерной эмульсии оболочки температуру поддерживают на уровне 82°C в течение еще 30 минут, затем содержимое реактора охлаждают до 20°C и фильтруют через 250 мкм сетку.
Получение распыляемой суспензии
8,8 г триэтилцитрата, 210,0 г микронизированного талька и 1057 г деионизированной воды загружают в сосуд и гомогенизируют в течение 15 минут с применением высокоэффективного диспергирующего инструмента ULTRA TURRAX.
350,0 г дисперсии полимера (30% содержание твердых веществ) перемешивают магнитной мешалкой. Затем дисперсию талька медленно выливают в полимерную дисперсию, перемешивание продолжают в течение 60 минут, затем смесь фильтруют через 240 мкм сетку.
Процесс нанесения покрытия
Машину для нанесения покрытия MicroLab (Oystar Huttlin) применяют для получения покрытий.
350 г гранул сукцината метопролола (диаметр 0,7-1,0 мм, 20% содержание активного ингредиента) загружают в инструмент Micro Lab и перемешивают при незначительном воздушном подпоре. В одном примере вместо этого применяют 350 г гранул дипрофиллина (диаметр 0,8-1,0 мм, 50% содержание активного ингредиента).
Температуру кипящего слоя повышают до 23-26°C, и на гранулы наносят покрытие в течение от 1,5 до 2,5 часов вплоть до увеличения массы полимера 10,5 или 17,5% (дополнительная масса из-за полимера в покрытии по отношению к исходной массе гранулы). Скорость распыления медленно повышают до максимума 2 г/мин.
После процесса нанесения покрытия гранулы перемешивают в инструменте в течение еще 5 минут для дополнительной сушки и отверждения. Затем гранулы с покрытием охлаждают в инструменте при незначительной подаче воздуха.
МАК = метакриловая кислота ЭА = этилакрилат ММА = метилметакрилат МА = метилакрилат
Аналитические методы Размер частиц rMS [нм]
Размер частиц определяют лазерной дифракцией с применением Mastersizer 2000 (Malvern). Значения показывают как радиус частиц rMS [нм], который составляет половину медианы распределения размера частиц на основе объема d(v,50).
Число вязкости Vz [мл/г]
Число вязкости Vz часто применяют как меру для молекулярной массы. Ее определяют в соответствии с DIN EN ISO 1628-1.
Применяют контролируемую процессом систему измерения вязкости (PVS, Lauda GmbH & Co. KG) с капилляром Ubbelohde (тип Ос).
Полимер растворяют в ТГФ в концентрации 0,5 г на 100 мл растворителя. Температура измерения составляет 25°C.
Молекулярная масса Mw [г/моль]
Молекулярную массу определяют гельпроникающей хроматографией (ГПХ). Проверку молярной массы проводят на основе поли(метилметакрилата).
Условия измерения выбирают согласно публикации Martina Adler et al. (e-Polymers 2004, 055).
N,N-Диметилацетамид с 6 г/л уксусной кислоты, 3 г/л LiBr и 10 г/л H2O применяют в качестве подвижной фазы со скоростью потока 1,0 мл/мин. Ряд из 4 колонок GRAM 10 мкм (предколонка, 2×10000 А и 30 А колонка - Polymer Standards Service, Mainz, Germany) применяют в качестве неподвижной фазы.
Температура стеклования Tg [°C]
Температуру стеклования Tg определяют путем ДСК согласно DIN EN ISO 11357. Обычно применяют образец 10-12 мг со скоростью нагревания 20 K/мин; интервал температуры составляет от -40°C до 140°C. Измерение проводят в атмосфере азота. Оценка основана на втором цикле нагревания, и указанное значение является средним значением в интервале стеклования.
Минимальная температура пленкообразования МТП [°C]
Самая низкая температура, при которой полимерная дисперсия образует полимерную пленку при выпаривании воды, является минимальной температурой пленкообразования (МТП). МТП является характеристикой дисперсии и, кроме прочего, на нее влияет температура стеклования и размер частиц диспергированных частиц.
Минимальную температуру пленкообразования определяют согласно DIN ISO 2115 с применением дисперсии с помощью снимающего ножа на ленточном нагревателе при определенном градиенте температуры. МТП соответствует самой низкой температуре, при которой образуется пленка без трещин и которая незначительно выше температуры выравнивания спектра (которая является температурой, при которой полимер все еще выглядит беловатым из-за того, что пленка еще не полностью сформирована).
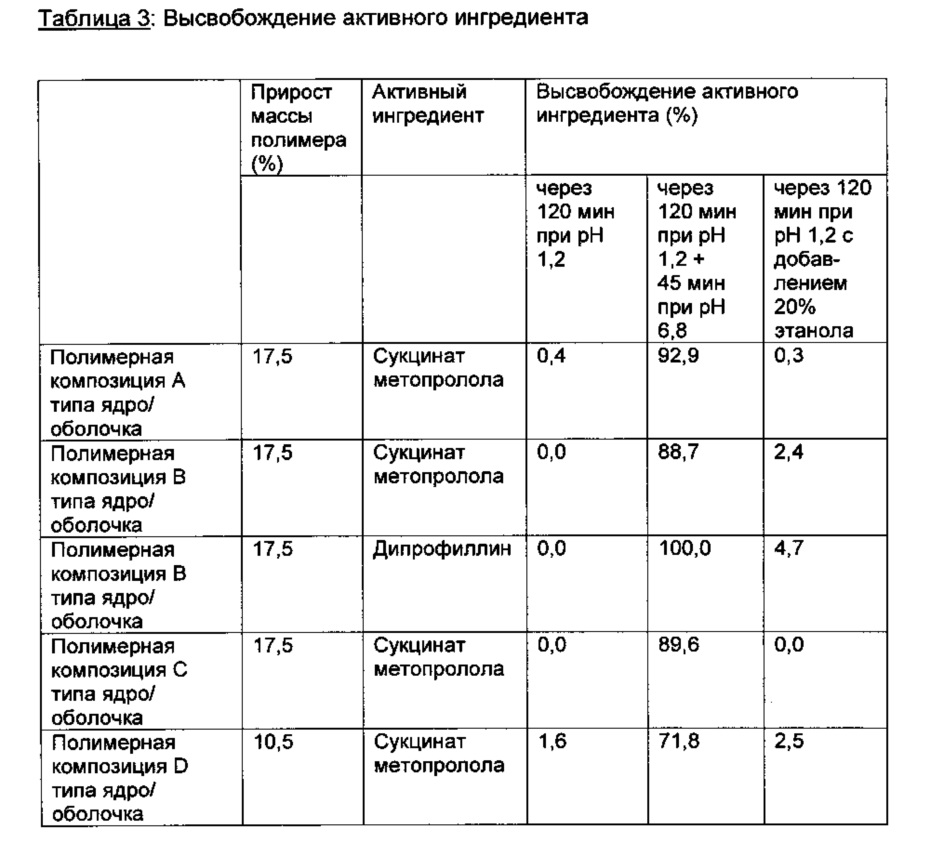
Высвобождение активного ингредиента
Свойства высвобождения определяют на аппарате растворения (USP 32 <711> растворение; тип 1: корзина), со скоростью вращения 100 об./мин, с 900 мл среды для растворения. Температура составляет 37°C±0,5°C.
Средой для растворения является 0,1 N хлористоводородной кислоты (0,1 N HCl) в течение 2 часов; затем проводят полную смену среды для растворения до pH 6,8 EP-буфер 4003200 (= фосфатно-солевой буферный раствор: 8,5 г NaCl, 1 г KH2PO4, 2K2HPO4 в 1 л H2O). Количество высвобожденного API (дипрофиллин или сукцината метопролола) определяют УФ измерениями.
Действие этанола изучают заменой части хлористоводородной кислоты этанолом. Измерения проводят с 20% этанолом (по объему).
Среда для растворения после полной замены до pH 6,8 не содержит этанол (во всех случаях).

