Результат интеллектуальной деятельности: ГРИБНОЕ ПИВО И СПОСОБ ЕГО ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Изобретение относится к технической области биотехнологии и пищевой промышленности, касается производства физиологически функциональных пищевых продуктов, в частности получения пива, обогащенного биологически активными соединениями лекарственных и лекарственно-съедобных высших грибов.
Пиво - широко распространенный и популярный напиток, обладающий привлекательным вкусом, специфическим ароматом и высокой питательностью. Традиционное пиво содержит только четыре основных компонента: вода, солод, хмель и дрожжи. С целью придания ему новых органолептических характеристик в состав пива вводят дополнительные компоненты, как правило, растительного происхождения.
В частности, известно пиво и способ его приготовления путем введения вкусовых добавок в виде экстрактов лекарственных трав: девясила, донника лекарственного и зверобоя продырявленного, а в качестве тонизирующей добавки - пантогематогена [патент РФ №2129593, опубл. 17.04.1999].
Известный способ только косвенно снижает токсические проявления пива в организме потребителя, направлен на коррекцию вкуса и повышение тонизирующего действия напитка. Применение витаминов и добавок, предлагаемых в известном способе, направленно воздействует на защиту отдельных групп клеток организма, однако при злоупотреблении алкоголем поражаются защитные системы и органы в целом и, в первую очередь - печень.
Известно пиво с гепатопротекторными свойствами и способ его производства путем введения в молодое пиво на стадии дображивания и в готовое пиво водно-спиртового раствора экстракта растения солянки хмелевой (фитопрепарат «Лохеин» в интервале концентраций от 14 до 25 мл/л) [патент РФ №2162883 С2, опубл. 10.02.2001].
Известный способ в основном направлен на снижение токсического воздействия на печень организма и способствует снятию определенных симптомов токсических проявлений при злоупотреблении алкоголем. Между тем при длительном употреблении пива по мере накопления в организме метаболитов метанола (формальдегида и муравьиной кислоты), содержание которого в пиве на порядок превосходит крепкие алкогольные напитки, ухудшаются обменные процессы в мозговой ткани, что приводит к мозговым нарушениям и, как следствие - к выраженному слабоумию и снижению личностной оценки.
Из патента RU 2383587, 10.03.2010 известно нетоксичное пиво, обладающее лечебно-профилактическими свойствами при сохранении его органолептических характеристик. Способ получения вышеуказанного пива включает очистку солода и ячменя, дробление солода и ячменя, приготовление затора, фильтрование затора, кипячение сусла с хмелем, отделение сусла от хмелевой дробины, осветление и охлаждение сусла, внесение биомассы дрожжей с добавлением селенита натрия на этапе основного брожения, дображивание и созревание, осветление пива, розлив пива в бутылки и бочки. Согласно изобретению ячмень перед дроблением подвергают микронизации, а брожение проводят до критического содержания сахаров и концентрации ацетоина. Перед розливом в готовое пиво добавляют нетоксичное соединение селена с антиоксидантными свойствами, вводят в качестве гепатопротектора раствор стандартного экстракта расторопши, а в качестве адаптогенов - экстракт элеутерококка в количествах, не изменяющих органолептические характеристики напитка.
В известном техническом решении, в отличие от применяемых многовалентных соединений селена (селенит натрия, селенат натрия и т.п.), применен двухвалентный селен, который обладает высокой всасываемостью (усваивается 85-95% дозы) и не образует в организме токсичный селенистый водород [Van der Torre Н., 1991].
Таким образом, в пивоваренной промышленности широко используются способы получения (производства) пива с повышенной биологической ценностью, то есть, со свойствами физиологически функциональных пищевых продуктов. В частности, добавление в пиво экстракта хмеля, содержащего ксантогумол, придает напитку антиоксидантные и противоопухолевые свойства [Stevens J.F., 2004]. Введение в состав пива экстракта плодов расторопши обеспечивает гепатопротекторные свойства, как было показано выше (патент RU 2383587).
Одним из перспективных источников биологически активных соединений для производства пива являются лекарственные и лекарственно-съедобные высшие грибы. Метаболиты этих грибов обладают антиоксидантной, бактерицидной, противовоспалительной, радиопротекторной, противовирусной, противоопухолевой, иммуностимулирующей, гепатопротекторной, гипогликемической, противоаллергической активностью. Они могут служить адаптогенами для нормализации функционирования организма при повышенных физических, интеллектуальных и эмоциональных нагрузках и для профилактики нейродегенеративных изменений (болезней Альцгеймера, Паркинсона, рассеянного склероза) [Lindequist U., 2005].
О лечебных свойствах лекарственных и лекарственно-съедобных высших грибов известно давно, традиция их применения для лечения и профилактики различных болезней сформировалась еще в древнейшие времена.
Физиологически активные соединения грибов привлекали и привлекают внимание специалистов всего мира. Многие из них стали основой широкого спектра антибиотиков, другие - препаратов онкостатического, иммуномодулирующего действия. К концу XX - началу XXI веков были накоплены данные, показывающие, что грибы, благодаря большой гетерогенности физиолого-биохимических свойств, могут стать новыми перспективными продуцентами в биотехнологии. Повышенному интересу к грибам способствовали многочисленные исследования, показавшие, что эти организмы могут стать незаменимыми источниками для получения лекарственных препаратов, имеющих ранозаживляющую, противовирусную, иммуномодулирующую и, особенно, противоопухолевую активности. Именно на основании этих достижений к 90-м годам прошлого столетия была создана новая область медицины - фармацевтическая микология.
Созданные на основе лекарственных грибов препараты выполняют не только функции нутрицевтиков, но и парафармацевтиков, применяемых для профилактики, вспомогательной терапии и поддержки функциональной активности органов и систем в физиологических границах. Отсутствие в рационе питания физиологически функциональных, незаменимых для человека соединений приводит к нарушениям обмена веществ и, как следствие, к тем или иным заболеваниям.
За последние 20 лет многие болезни возникают у людей все более молодого возраста: «помолодели» атеросклероз, сахарный диабет, злокачественные новообразования. Нарушения иммунитета регистрируются в 50-80% случаев. Одновременно с этими тревожными тенденциями врачи отмечают падение эффективности традиционных методов лечения.
Все исследователи сходятся во мнении, что причиной подобных явлений в решающей степени является неблагоприятное воздействие экологической обстановки.
Природные биополимеры высших грибов и, в частности, β-D-глюканы стали объектом исследований во всем мире благодаря своим противоопухолевым, иммуномодулирующим, противовирусным, противоаллергическим, сахароснижающим и другим ценным лечебным эффектам. Приоритет в этом направлении принадлежит восточной медицине (вьетнамской, китайской, японской), применяющей высшие базидиомицеты на протяжении многих веков.
Сегодня уже доказано, что многие лекарственные и лекарственно-съедобные высшие грибы имеют противоопухолевые свойства. В частности, в Японии 30% всех лекарственных препаратов для лечения онкологических заболеваний - это препараты на основе целебных грибов. Лекарственные грибы включены Правительством Японии в программу «Здоровье нации», как способствующие укреплению здоровья и увеличению продолжительности жизни людей.
Исследования в области фармацевтической микологии привели к открытиям, которые дали надежду онкологическим больным и врачам, работающим в этой области. Исторические данные о лечении опухолей грибами и практика китайской народной медицины стали отправной точкой для применения грибных экстрактов в официальной онкологии.
Доля лекарственных препаратов на основе грибов на мировом фармацевтическом рынке с каждым годом растет. Препараты (в основном, биологически-активные добавки) на основе грибов назначают с общеукрепляющей, антитоксической целью и как симптоматическую терапию с целью влияния на метаболические процессы.
Фитопрепараты и препараты на основе грибов сейчас представляют собой рынок в 60 миллиардов долларов США и составляют 20% ассортимента аптек.
Значительная часть мирового производства грибов приходится на Японию и США, в отличие от американского и европейского рынков, японский ориентирован на лечебно-профилактические продукты.
Лекарственные и лекарственно-съедобные высшие грибы имеют выраженную фармакологическую активность, в первую очередь, противоопухолевые и иммуностимулирующие свойства.
В последнее время именно их культивированию и уделяется наибольшее внимание. Это такие виды, как шиитаке - Lentinus edodes, грифола курчавая - Griffola frondosa, рейши - Ganoderma lucidum, вешенка легочная - Pleurotus pulmonarius, фламмулина бархатистоножковая - Flammulina velutipes и др. [фунго.рф].
Известен способ получения пива с биологически активными компонентами грибов - патент CN 103305359 А, 18.09.2013. В соответствии со способом плодовые тела базидиомицета шиитаке (shiitake) - Lentinus edodes - общей массой, составляющей 2,0%-2,8% от массы пива, промывают, высушивают и измельчают на ножевой мельнице. Порошок гриба вносят в сусло на стадии осахаривания вместе с коммерческими препаратами целлюлазы и протеазы. Такой технологический прием позволяет повысить содержание в пиве несоложенного сырья, в частности, риса.
К недостаткам описанной технологии относятся: использование в качестве источника биологически активных веществ плодовых тел грибов и внесение грибного порошка до стадии кипячения сусла. Использование плодовых тел не позволяет стандартизировать исходное сырье, поскольку показатели качества могут варьировать в широких пределах в зависимости от сезона и региона сбора, технологии выращивания, культуры производства и многих других факторов. Кроме того, в плодовых телах высших грибов могут накапливаться радионуклиды и тяжелые металлы; они могут быть контаминированы личинками насекомых, яйцами гельминтов и патогенными микроорганизмами. Высушивание плодовых тел, рекомендуемое разработчиками, неизбежно приводит к снижению содержания антиоксидантов в мицелии. Кипячение сусла с грибным порошком, с одной стороны, приводит к инактивированию термолабильных биологически активных компонентов мицелия, с другой стороны, способствует экстракции полисахаридов, присутствие которых может снизить эффективность формирования осадка на стадии охлаждения и осветления пивного сусла.
Известен способ получения пива с биологически активными компонентами грибов Ganoderma lucidum - патент CN 1084382 С, 08.05.2002. В соответствии со способом плодовые тела базидиомицета в массовом соотношении с солодом 1:50 - 1:70 измельчают, замачивают в горячей воде температурой не менее 60°С, а затем кипятят. Отвар грибов вносят в сусло до охмеления. Вариантом приведенного способа является патент CN 1263147 А, 16.08.2000, предусматривающий внесение в сусло нефильтрованного отвара вместе с остатками плодовых тел.
К недостаткам описанной технологии относятся: использование в качестве источника биологически активных веществ плодовых тел грибов и внесение грибного отвара до стадии кипячения сусла. Кроме того, отвар грибов может отрицательно повлиять на вкусовые качества готового напитка. В плодовых телах Ganoderma lucidum содержатся вещества с ярко выраженным горько-вяжущим вкусом, в частности, тритерпены, которые в сочетании с альфа-кислотами хмеля могут придать пиву излишнюю горечь.
Известно пиво и способ получения пива с биологически активными полисахаридами базидиомицета трутовика лакированного - патент CN 1115612 А, 31.01.1996. В соответствии со способом из плодовых тел Ganoderma lucidum получают водный экстракт, содержащий полисахариды. Для этого плодовые тела промывают, измельчают, добавляют 8-12 объемов воды, нагревают до 88-92°С и варят в течение 3,5-4,5 часов. После отделения осадка супернатант упаривают при 88-92°С до относительной плотности 1.1 и концентрации полисахаридов 2-3%. Вариантом технологии является повторная экстракция осадка. Экстракт вносят в пиво непосредственно перед розливом в бутылки.
К недостаткам описанной технологии относятся: использование в качестве источника биологически активных веществ плодовых тел грибов, потеря термолабильных биологически активных компонентов мицелия в процессе термической обработки и негативное влияние тритерпенов на вкус пива. Кроме того, внесение экстракта после стадии сбраживания приводит к помутнению готового напитка. Этот недостаток преодолевается, согласно патенту, путем преципитации соединений, легко выпадающих в осадок, этиловым спиртом. Экстракт смешивают с этанолом в соотношении 1:1 и через 7-9 часов отделяют преципитат фильтрованием. Затем экстракт упаривают при 91°С до значения относительной плотности 1,04 и концентрации полисахаридов 2,6%. Полученный продукт не вызывает помутнение пива, однако его получение добавляет к технологическому процессу дополнительную энергозатратную стадию.
Известен способ получения пива с биологически активными компонентами грибов Ganoderma lucidum - патент CN 100422303 С, 01.10.2008. Способ предусматривает более щадящий, по сравнению с приведенными выше, режим выделения биологически активных компонентов мицелия. Плодовые тела заливают 5-15 объемами воды с температурой 50-80°С и настаивают 1-3 часа. Затем экстракт отделяют на проточной центрифуге при скорости вращения ротора 3000 об/мин, фильтруют и концентрируют до остаточной влажности ≤10%. В пиво вносят 0,1-5% концентрированного экстракта. После этого пиво фильтруют.
Недостатком способа является его ориентированность на использование единственного вида лекарственных базидиальных грибов. Кроме того, авторы патента отмечают, что экстракт придает пиву вкус и запах, характерный для средств традиционной китайской медицины, что увеличивает, по их мнению, его привлекательность для китайских потребителей. С точки зрения потребителей, ориентированных на немецкие и чешские традиции пивоварения, такие кардинальные изменения вкуса и запаха могут быть неприемлемы.
Известен способ снижения горечи пива с биологически активными компонентами грибов G. lucidum - патент ЕР 1067178 А1, 10.01.2001, предполагающий три основных технологических этапа: предварительное брожение, получение сухого экстракта, объединение продуктов, полученных на двух первых этапах.
На первом этапе измельченные плодовые тела вносятся в сусло, приготовленное из солода и воды. В более раннем варианте способа - патенте CN 1222569 А, 14.07.1999 - с использованием мальтозного сиропа вместо солода. Затем сусло охмеляют и стерилизуют при 100°С, затем охлаждают до 8-12°С. Сусло аэрируют, вносят в него пивные дрожжи и сбраживают в анаэробных условиях до достижения концентрации этанола 2,5%. Далее процесс ферментации проходит в герметичной емкости при температуре 2°С и давлении 2 кг/см2 в течение 2 месяцев.
На втором этапе преферментированное сусло замораживают и обезвоживают методом сублимации. В результате элементы жидкой фазы превращаются в мелкокристаллическую сухую массу, которая хранится при 0-4°С.
На третьем, заключительном этапе смешивают сухой порошок, полученный на второй стадии, и сброженное сусло, полученное на первой стадии. Дрожжи удаляют фильтрацией, пиво карбонизируют пищевой углекислотой, разливают в бутылки и пастеризуют при 65°С.
Недостатком способа является сложность, энергоемкость и длительность технологического процесса. Продолжительность полного технологического цикла превышает 10 недель.
Известен способ получения пива, содержащего биологически активные метаболиты базидиомицета Flammulina velutipes - патент CN 104073385 А, 01.10.2014. Согласно способу готовят затор из пшеницы и ячменного солода в пропорции 2:1 и варят пивное сусло с добавлением 0,1% хмеля. Начальная экстрактивная плотность охлажденного сусла составляет 10-12°Р. Свежие плодовые тела чистят, моют и кипятят 5 минут в воде, содержащей 0,1% лимонной кислоты, для сохранения цвета экстракта. В настой вносят 0,3%-1,0% пектиназы - папаина - и осуществляют гидролиз затора при 50°С в течение 3 часов. Жидкую фазу отделяют центрифугированием при 4500 об/мин в течение 20 минут. В сусло добавляют экстракт грибов в соотношении 1:20. Далее в сусло вносят дрожжи, осуществляют ферментацию и дозревание пива.
К недостаткам способа относятся отсутствие сведений о соотношении массы плодовых тел и объема воды для получения экстракта, что не позволяет оценить расход биомассы F. velutipes на единицу объема готовой продукции. Кроме того, обработка биомассы папаином - протеолитическим растительным ферментом, катализирующим гидролиз белков, пептидов, амидов и сложных эфиров основных аминокислот, может привести к снижению биологической активности экстракта.
Общим недостатком всех приведенных способов является ориентированность на использование только одного вида лекарственных или лекарственно-съедобных высших грибов. При этом весь перечень используемых грибов сводится к трем видам: L. edodes, G. lucidum и F. velutipes.
Технической задачей заявленного изобретения (заявленной группы изобретений) является создание ассортимента сортов пива с определенной направленностью биологической активности в зависимости от используемого при его приготовлении грибного экстракта из лекарственных и лекарственно-съедобных высших грибов, а также обеспечение возможности управлять органолептическими показателями готового продукта, сохраняя их характерными для традиционного европейского пивоварения или придавая напитку новый оригинальный вкус и аромат грибного экстракта; увеличение сроков хранения готового продукта за счет грибных антиоксидантов и сохранение биологической активности грибных метаболитов в процессе приготовления экстрактов мицелия и в процессе производства пива, обладающего свойствами физиологически функционального пищевого продукта.
Поставленная техническая задача и технический результат достигаются заявленной группой изобретений, в которую входят способ получения грибного пива, содержащего экстракты лекарственных и лекарственно-съедобных высших грибов, а также само грибное пиво, полученное способом, являющимся одним из объектов заявленного изобретения.
Одним из изобретений заявленной группы является способ получения грибного пива, содержащего грибной экстракт из лекарственных и лекарственно-съедобных высших грибов, включающий приготовление затора, его осахаривание, фильтрование, кипячение сусла с хмелем, осветление, охлаждение, брожение и дозревание пива, при этом на стадии брожения в состав сусла вводят грибной экстракт из постферментационной жидкости, полученной методом погруженного культивирования чистых культур лекарственных и лекарственно-съедобных высших грибов в жидких питательных средах, содержащих источники углерода и азота, в асептических аэробных условиях, причем вводимый грибной экстракт получают из постферментационной жидкости с разделением или без разделения ее на жидкую фазу - культуральную жидкость и твердую фазу - биомассу мицелия. Поскольку в технологии пивоварения процесс брожения принято разделять на главное (основное) брожение и дображивание, введение грибных экстрактов возможно как на первой, так и на второй стадии брожения. Таким образом термин «брожение» объединяете в себе оба процесса: сбраживание (главное брожение) и дображивание.
В качестве питательной среды в способе используется, в частности, ячменный солод, неохмеленное пивное сусло, полисахариды, глюкозо-пептонный агар, несоложенное сырье, пшеничный солод, рис (сечка), кукуруза (сечка), а также смесь их, как например конкретная смесь 10 г/л неохмеленного пивного сусла и 5-15 г/л молотого ячменного солода, и другие.
Ниже представлено описание частных случаев, характеризующих грибные экстракты в зависимости от способа переработки постферментационной жидкости с разделением или без разделения ее на культуральную жидкость (жидкую фазу) и биомассу мицелия (твердую фазу).
Таким образом, способ предусматривает следующие варианты постферментационной обработки (переработки) и получения биологически активных экстрактов.
1. Постферментационную жидкость разделяют на жидкую фазу - культуральную жидкость и твердую фазу - биомассу мицелия методом седиментации или фильтрации. В качестве грибного экстракта на стадии брожения используют непосредственно культуральную жидкость, обогащенную за время ферментации биологически активными соединениями, в частности, экзополисахаридами грибов.
2. Биомассу мицелия отделяют методом седиментации или фильтрации. Мицелий вносят в пиво на стадии дображживания. Экстракцию мицелия осуществляют водой или этиловым спиртом, содержащимися в перебродившем сусле. Через 4-15 суток биомассу мицелия отделяют методом фильтрации, флотации или седиментации.
3. Биомассу мицелия отделяют методом седиментации или фильтрации. Экстракцию мицелия осуществляют 5-20 объемами дистиллированной воды или культуральной жидкости при температуре 90°С в течение 120 минут или при 120°С в течение 30 минут. Жмых биомассы мицелия отделяют от экстракта методом сепарирования или центрифугирования. Экстракт вводят в состав пива на стадии брожения.
4. Биомассу мицелия отделяют методом седиментации или фильтрации. Гомогенизируют мицелий в 5-20 объемах дистиллированной воды или культуральной жидкости, экстрагируют при 20-40°С в течение 0,5-4 часов. Жмых биомассы мицелия отделяют от экстракта методом сепарирования или центрифугирования. Экстракт вводят в состав пива на стадии брожения.
5. Биомассу мицелия отделяют методом седиментации или фильтрации. Гомогенизируют мицелий в 5-20 объемах дистиллированной воды или культуральной жидкости, экстрагируют при 20-40°С в течение 0,5-4 часов. Жмых биомассы мицелия отделяют от экстракта методом сепарирования или центрифугирования. Жмых мицелия ресуспендируют в 5-10 объемах дистиллированной воды или культуральной жидкости, повторно экстрагируют при температуре 90°С в течение 120 минут или при 120°С в течение 30 минут. Жмых биомассы мицелия отделяют от экстракта методом сепарирования или центрифугирования. Экстракты первой и второй генерации используют на стадии брожения раздельно или объединяют их.
6. Постферментационную жидкость не разделяют на фазы. Мицелий экстрагируют культуральной жидкостью при температуре 90°С в течение 120 минут или при 120°С в течение 30 минут. Биомассу мицелия отделяют от экстракта методом фильтрации, сепарирования или центрифугирования. Экстракт вводят в состав пива на стадии брожения.
7. Постферментационную жидкость не разделяют на фазы. Мицелий гомогенизируют непосредственно в культуральной жидкости. Мицелий экстрагируют культуральной жидкостью при температуре 90°С в течение 120 минут или при 120°С в течение 30 минут. Биомассу мицелия отделяют от экстракта методом сепарирования или центрифугирования. Экстракт вводят в состав пива на стадии брожения.
8. Постферментационную жидкость не разделяют на фазы. Цельную постферментационную жидкость вносят в пиво на стадии дображивания. Дополнительную экстракцию мицелия осуществляют водой или этиловым спиртом, содержащимися в перебродившем сусле. Через 4-15 суток биомассу мицелия отделяют методом фильтрации, флотации или седиментации.
9. Постферментационную жидкость не разделяют на фазы. Мицелий гомогенизируют непосредственно в культуральной жидкости. Гомогенизат вносят в пиво на стадии дображивания. Дополнительную экстракцию мицелия осуществляют водой или этиловым спиртом, содержащимися в перебродившем сусле. Через 4-15 суток биомассу мицелия отделяют методом фильтрации, флотации или седиментации.
10. Биомассу мицелия отделяют методом седиментации или фильтрации. Мицелий вносят в пиво на стадии дображивания. Дополнительную экстракцию мицелия осуществляют водой или этиловым спиртом, содержащимися в перебродившем сусле. Через 4-15 суток биомассу мицелия отделяют методом фильтрации, флотации или седиментации.
Таким образом, биомассу вегетативного мицелия получают методом погруженного культивирования чистых культур лекарственных и лекарственно-съедобных высших грибов в жидких питательных средах, содержащих источники углерода и азота. Культивирование осуществляют в асептических аэробных условиях. В процессе ферментации контролируют основные технологические параметры: температура, рН среды, скорость перемешивания, расход воздуха. Критериями оценки эффективности ферментации служат показатели чистоты культуры, потребления питательного субстрата (питательной среды), продолжительности культивирования и выхода биомассы (воздушно-высушенного мицелия) с единицы объема питательной среды. Постферментационная обработка направлена на получение экстрактов мицелия, содержащих биологически активные компоненты грибов. Критериями оценки биологической активности субстратов в производственных условиях служат показатели концентрации полисахаридов, определяемой методом спиртового осаждения из водного раствора, и антиоксидантной активности, определяемой кулонометрическим методом с помощью электрогенерированного брома.
Другим изобретением заявленной группы является само грибное пиво, полученное вышеописанным способом, содержащее грибной экстракт из лекарственных и лекарственно-съедобных высших грибов, обладающее свойствами физиологически функционального продукта и повышенным сроком хранения. Грибные экстракты вводят в состав пива в количествах, эквивалентных 0,5-5,0 г/л воздушно-сухого мицелия, а культуральную жидкость - 5-20% от объема готового пива.
Повышенный срок хранения (нефильтрованного и непастеризованного пива - до 6 месяцев) и физиологически функциональные свойства получаемого грибного пива достигаются способом его получения в совокупности со свойствами используемых лекарственных и лекарственно-съедобных высших грибов.
Результаты органолептического исследования опытных партий нефильтрованного и непастеризованного пива, выпущенных ООО «Можайская пивоваренная компания» в пластиковых 30-литровых кегах, подтверждают влияние грибных экстрактов на улучшение потребительских свойств продукта. Светлое пиво «Эноки-Такэ», содержащее 5% экстракта лекарственного гриба Flammulina velutipes, сохраняло присущий ему комплекс органолептических показателей в течение 8 месяцев (срок наблюдения) при температуре хранения 6°С. Контрольная партия пива, выпущенная без грибного экстракта, прокисла через 3 месяца хранения при той же температуре. Темное пиво «Микола зимний», содержащее 5% экстракта лекарственного гриба Ganoderma lucidum, сохраняло присущий ему комплекс органолептических показателей в течение 6 месяцев (срок наблюдения) при температуре хранения 6°С. Контрольная партия пива, выпущенная без грибного экстракта, прокисла через 4 месяца хранения при той же температуре.
В зависимости от способа получения пиво сохраняет характерные органолептические показатели или приобретает новый вкус и аромат грибного экстракта. Полученное по предлагаемому способу грибное пиво вне зависимости от его органолептических характеристик содержит компоненты грибов, обладающие антиоксидантной, иммуностимулирующей, гепатопротекторной, противовирусной, противоопухолевой и иными видами полезной биологической активности.
Для получения заявляемого в качестве изобретения пива используются лекарственные и лекарственно-съедобные высшие грибы, обладающие доказанной биологической активностью, позволяющей использовать их в качестве сырья для фармацевтической промышленности. В соответствии со способом для получения грибного пива могут использоваться виды лекарственных и лекарственно-съедобных высших грибов, обладающие одним или несколькими типами биологической активности, принадлежащие к следующей группе, но не ограниченные ей:
Agaricus brasiliensis Wasser et al., (Agaricus blazei Murrill): противоопухолевая [Mizuno T1., 2002], антимутагенная [Menoli R.C., 2001] и антиоксидантная активность [Soares A.A., 2009].
Agaricus bisporus (J.E. Lange) Imbach: противоопухолевая активность [Yu L.G., 1993].
Cordyceps militaris (L.: Fr.) Link.: антиоксидантная активность [Yu R. 2009].
Flammulina velutipes (Curtis: Fr.) P. Karst.: цитостатическая активность [Wang H.X., 2001], противоаллергическое действие [Sano M., 2002].
Fomitopsis officinalis (Vill.: Fr.) Bondartsev: гипогликемический эффект [Sato M., 2002].
Fomitopsis pinicola (Sowerby: Fr.) P. Karst.: седативное действие на центральную нервную систему [Melzig M.F., 1996].
Ganoderma annulare (Fr.) Gilbn.: антимикробная активность [Smania E.F., 2003].
Ganoderma applanatum (Pers.) Pat.: антимикробная активность [Smania Jr., 1999].
Ganoderma lucidum (Curtis: Fr.) P. Karst.: цитотоксическое действие [Toth J.O1., 1983; Toth J.O2., 1983; Gao J.J., 2002], цитостатическое действие [Lee S., 1998], повышение противоопухолевого иммунитета (в дополнение к противоопухолевой терапии) [Gao Y1., 2002; Gao Y., 2003], противоаллергическое действие [Kohda Н., 1985; Tasaka K., 1988], антиоксидантное действие [Komoda Y., 1989; Lin Z.B. 2004], гипогликемический эффект [Hikino Н., 1985] и лечение диабета [Gao Y., 2004], антиатеросклеротический эффект [Morigiwa А., 1986; Su C.Y., 1999], антигепатотоксический эффект [Hirotani М., 1986; Chen R.Y., 1993; Wang M.Y., 2002; Gao Y2., 2002].
Ganoderma pfeifferi Bres.: антибактериальная активность (против полирезистентных бактерий) [Mothana R.A., 2000], противовирусная активность [Mothana R.A., 2003].
Ganoderma resinaceum Boud.: антиоксидантная, иммунорегуляционная, гепатопротекторная активности [Penga X.-R., 2013].
Grifola frondosa (Dicks: F) S.F. Gray: иммунотерапия (в дополнение к противоопухолевой терапии) [Kodama N., 2002], гипогликемический эффект [Konno S., 2002], противовоспалительный эффект [Zhang Y., 2002].
Hericium coralloides (Scop.: Fr.) Gray: антиноцицептивный (обезболивающий) эффект [Saito Т., 1998].
Hericium erinaceus (Bull.: Fr.) Pers.: терапия хронических заболеваний желудочно-кишечного тракта [Mizuno Т2. 1999], гиполипидемическая [Yang В.-K., 2003], нейротрофическая [Mori K., 2008], антимикробная и антиоксидантная активность [Wong, K.Н., 2009].
Hypsizygus marmoreus (Peck) H.E. Bigelow: цитостатическая активность [Lam S.K., 2001], противоаллергическое действие [Sano М., 2002].
Inonotus hispidus (Bull.: Fr.) P. Karst.: противовирусная активность [Awadh A.N., 2003], противоаллергическая активность [Ali N.A., 1996].
Inonotus obliquus (Pers.: Fr.) Pilat: противоопухолевая активность [Kahlos K,. 1987].
Lentinus edodes (Berk.) Sing.: антимикробная активность [Bender S., 2003; Badalyan S.M., 2004], повышение противоопухолевого иммунитета (в дополнение к противоопухолевой терапии) [Hazama S., 1995; Ochiai Т., 1992; Taguchi Т., 1982; Gordon М., 1995; Yap А.Т., 2003; Bodinet С., 2004], антилипидемический эффект [Tokuda S., 1974].
Phallus impudicus L. противоопухолевая активность [Wasser S.P., 1999; Kuznecovs S., 2000; Kuznecovs S., 2004].
Pleurotus ostreatus (Jacq.: Fr.) P. Kumm.: противоопухолевая активность [Wang H.X., 2000; Zusman I., 1997; Gerasimenya V.P., 2002], антимутагенное действие [Lakshmi В., 2004], антиоксидантная активность [Bobek P., 1998], уменьшение размера атеросклеротических бляшек (антиатерогенный эффект) [Bobek Р., 1999].
Pleurotus eryngii (DC.) Quel.: противоаллергическое действие [Sano М., 2002].
Sparassis crispa (Wulfen): Fr.: иммуномодулирующее действие [Ohno N., 2002; Ohno N., 2003].
Trametes versicolor (L.: Fr.) Pilat.: противовирусная активность [Colins R.A., 1997].
Tremella mesenterica Retz.: гипогликемический, иммуномодулирующий и интерфероногенный эффекты [Wasser S.P., 2002].
Tricholoma populinum J.E. Lange.: противоаллергический эффект [Lindequist U., 1989; Kreisel H., 1990].
Ниже приведены примеры, иллюстрирующие, но не ограничивающие применение способа получения грибного пива, обладающего свойствами физиологически функционального пищевого продукта и увеличенным сроком хранения, а также сохраняющего характерные органолептические показатели или приобретающего новый вкус и аромат грибного экстракта в зависимости от конкретного вида высших грибов и конкретной технологии получения.
Пример 1. Получение пива, содержащего экстракт базидиомицета A. brasiliensis.
Пиво получают способом, включающим приготовление затора, его осахаривание и фильтрование, кипячение сусла с хмелем, осветление, охлаждение, брожение и дозревание пива, отличающимся тем, что на стадии брожения в сусло добавляют экстракт погруженного вегетативного мицелия A. brasiliensis.
Биомассу вегетативного мицелия получают методом погруженного культивирования в асептических аэробных условиях по технологической схеме, включающей следующие основные операции: получение чистых культур, получение посевного материала, проведение погруженного культивирования. Вспомогательные технологические операции включают приготовление питательных сред, контроль технологических параметров и качества продукции.
Для получения чистых культур высших грибов используют изоляты из плодовых тел, собранных в естественных условиях или приобретенных в качестве коммерческого продукта. Предварительно видовую принадлежность высших грибов определяют по совокупности макро- и микроморфологических признаков. Операцию проводят в ламинарном боксе, соблюдая правила асептики. Стерильным скальпелем делают надрез вдоль плодового тела не более чем на 1/3 его толщины. Аккуратно разламывают плодовое тело по линии надреза. Из середины разлома, используя стерильные пинцет и скальпель, выделяют фрагмент мицелия диаметром 3-5 мм и переносят в чашку Петри, содержащую глюкозо-картофельный агар (ГКА). Для приготовления ГКА в 1 л охлажденного и профильтрованного отвара из 200 г очищенной измельченной картошки добавляют 10 г глюкозы и 25 г агара. Среду стерилизуют при 120°С в течение 30 минут. Инокулированные чашки помещают в термостат на 8 суток при температуре 25°С. Производят контроль чистоты культуры путем визуального изучения выросших на поверхности агара колоний и микроскопии препаратов из зоны роста колоний. При отсутствии признаков роста посторонних микроорганизмов образцы полученных штаммов передают в официальную коллекцию промышленных микроорганизмов для депонирования и подтверждения видовой принадлежности методом анализа 16S рРНК.
В качестве посевного материала первой генерации используют фрагменты вегетативного мицелия размером 5×5 мм, срезанные с поверхности рабочих культур отобранных штаммов. Вторую генерацию посевного материала получают в жидкой питательной среде следующего состава, г/л: глюкоза - 20, соевая мука - 10, MgSO4 - 0,25, KH2PO4 - 2,5. Среду стерилизуют при 120°С в течение 30 минут. Начальный рН среды 5,5-6,0. В колбу со средой вносят по 18-20 фрагментов мицелия. Жидкий посевной материал культивируют на ротационной качалке при скорости вращения 200 об/мин в темноте при 28°С в течение 5 суток. Готовую жидкую посевную культуру можно хранить в течение 3 суток при температуре 4°С. Контроль чистоты культуры на стадии получения жидкого посевного материала проводят с помощью световой микроскопии по стандартной методике.
Погруженное культивирование осуществляют в качалочных колбах или в управляемом биореакторе. Для погруженного культивирования используют, например, жидкую питательную среду, содержащую 10 г/л неохмеленного пивного сусла плотностью 12° по шкале Баллинга, 8 г/л сахарозы, 10 г/л молотого ячменного солода. Начальный рН среды 5,0-5,5 устанавливают ведением 5%-ного раствора молочной кислоты или за счет использования кислого (протеолитического) солода при варке сусла. Среду стерилизуют при 120°С в течение 30 минут.
Посевной материал вносят из расчета 10% от объема питательной среды. Культуры грибов выращивают при скорости вращения качалки (мешалки) 220 об/мин в темноте в течение 5 суток. При культивировании в биореакторе расход воздуха устанавливают в пределах 0,5-1,0 объемов на объем среды. Контроль чистоты культуры на стадии погруженного культивирования осуществляют с помощью световой микроскопии по стандартной методике.
Определение выхода биомассы мицелия осуществляют в пробе постферментационной жидкости объемом не менее 100 мл. Биомассу отделяют фильтрацией через лавсановую ткань. Биомассу сушат при 60°С в течение 3-6 часов в сухожаровом шкафу с принудительной циркуляцией воздуха. Воздушно-сухой мицелий (остаточная влажность 3-5%) взвешивают с точностью до 0,01 г. Вычисляют массу мицелия, содержащуюся в 1 л постферментационной жидкости. Выход воздушно-сухой биомассы должен составлять не менее 15 г/л.
Для определения антиоксидантной активности биомассы навеску воздушно-сухого мицелия массой 1 г гомогенизируют в 100 мл дистиллированной воды, а центрифугируют при RCF в 6000 g в течение 20 минут. В надосадочной жидкости определяют суммарное содержание антиоксидантов кулонометрическим методом с помощью электрогенерированного брома на анализаторе «Эксперт 006» (НПК ООО «Эконикс-Эксперт, Россия). Результат измерения выражают в мг аскорбиновой кислоты на 1 г мицелия. Суммарное содержание антиоксидантов в 1 г мицелия должно быть эквивалентно не менее чем 100 мг аскорбиновой кислоты. Антиоксидантную активность водных экстрактов определяют тем же методом. Суммарное содержание антиоксидантов в 100 мл водного экстракта должно быть эквивалентно не менее чем 150 мг аскорбиновой кислоты.
Для определения концентрации полисахаридов отбирают не менее 100 мл культуральной жидкости, отделенной от биомассы, и смешивают с этиловым спиртом в соотношении 1:1,5 или с изопропиловым спиртом в соотношении 1:1. Смесь выдерживают в течение двух часов при температуре 4°С и центрифугируют при RCF в 6000 g в течение 20 минут. Надосадочную жидкость сливают, осадок высушивают при температуре 60°С до остаточной влажности 6-8%. Массу полисахарида определяют взвешиванием с точностью до 0,01 г.
Для получения грибного экстракта возможно разделение постферментационной жидкости на жидкую фазу - культуральную жидкость и твердую фазу - биомассу мицелия методом седиментации. В качестве грибного экстракта используют непосредственно культуральную жидкость, обогащенную за время ферментации биологически активными соединениями, в частности, экзополисахаридами грибов. Культуральную жидкость вносят в объеме 5% от объема сусла.
Пример 2. Получение пива, содержащего экстракт базидиомицета A. bisporus.
Осуществляют процесс, как в Примере 1. Для погруженного культивирования используют жидкую питательную среду, содержащую неохмеленное пивное сусло, сахарозу, молотый ячменный солод и 1 г/л дрожжевого экстракта. В сусло добавляют экстракт погруженного вегетативного мицелия A. bisporus. Биомассу мицелия отделяют методом фильтрации. Культуральную жидкость вносят в объеме 10% от объема сусла.
Пример 3. Получение пива, содержащего экстракт аскомицета С. militaris.
Осуществляют процесс, как в Примере 1. Для погруженного культивирования используют жидкую питательную среду, содержащую неохмеленное пивное сусло, сахарозу, молотый ячменный солод и 1,5 г/л кукурузного экстракта. В сусло добавляют экстракт погруженного вегетативного мицелия С. militaris. Отделяют биомассу мицелия методом фильтрации. Экстракцию мицелия осуществляют 5 объемами дистиллированной воды при температуре 90°С в течение 120 минут. Отделяют жмых биомассы мицелия от экстракта методом сепарирования. На 1 л сусла вносят экстракт биомассы в количестве, эквивалентном 0,5 г воздушно-сухого мицелия.
Пример 4. Получение пива, содержащего экстракт базидиомицета F. velutipes.
Осуществляют процесс, как в Примере 1. В сусло добавляют экстракт погруженного вегетативного мицелия F. velutipes. Отделяют биомассу мицелия методом фильтрации. Экстракцию мицелия осуществляют 10 объемами дистиллированной воды при температуре 120°С в течение 30 минут. Отделяют жмых биомассы мицелия от экстракта методом центрифугирования. На 1 л сусла вносят экстракт биомассы в количестве, эквивалентном 2,0 г воздушно-сухого мицелия.
Пример 5. Получение пива, содержащего экстракт базидиомицета F. officinalis.
Осуществляют процесс, как в Примере 1. В сусло добавляют экстракт погруженного вегетативного мицелия F. officinalis. Отделяют биомассу мицелия методом фильтрации. Экстракцию мицелия осуществляют 15 объемами культуральной жидкости при температуре 90°С в течение 120 минут. Отделяют жмых биомассы мицелия от экстракта методом сепарирования. На 1 л сусла вносят экстракт биомассы в количестве, эквивалентном 2,5 г воздушно-сухого мицелия.
Пример 6. Получение пива, содержащего экстракт базидиомицета F. pinicola.
Осуществляют процесс, как в Примере 1. В сусло добавляют экстракт погруженного вегетативного мицелия F. pinicola. Отделяют биомассу мицелия методом фильтрации. Экстракцию мицелия осуществляют 20 объемами культуральной жидкости при температуре 120°С в течение 30 минут. Отделяют жмых биомассы мицелия от экстракта методом центрифугирования. На 1 л сусла вносят экстракт биомассы в количестве, эквивалентном 3,0 г воздушно-сухого мицелия.
Пример 7. Получение пива, содержащего экстракт базидиомицета G. annulare.
Осуществляют процесс, как в Примере 1. В сусло добавляют экстракт погруженного вегетативного мицелия G. annulare. Отделяют биомассу мицелия методом седиментации. Гомогенизируют мицелий в 5 объемах дистиллированной воды, экстрагируют при 20°С в течение 0,5 часов. Отделяют жмых биомассы мицелия от экстракта методом сепарирования. На 1 л сусла вносят экстракт биомассы в количестве, эквивалентном 5,0 г воздушно-сухого мицелия.
Пример 8. Получение пива, содержащего экстракт базидиомицета G. applanatum.
Осуществляют процесс, как в Примере 1. В сусло добавляют экстракт погруженного вегетативного мицелия G. applanatum. Отделяют биомассу мицелия методом фильтрации. Гомогенизируют мицелий в 10 объемах культуральной жидкости, экстрагируют при 30°С в течение 2 часов. Отделяют жмых биомассы мицелия от экстракта методом центрифугирования. На 1 л сусла вносят экстракт биомассы в количестве, эквивалентном 0,5 г воздушно-сухого мицелия.
Пример 9. Получение пива, содержащего экстракты базидиомицета G. lucidum.
Осуществляют процесс, как в Примере 1. В сусло добавляют экстракт погруженного вегетативного мицелия G. lucidum. Отделяют биомассу мицелия методом фильтрации. Гомогенизируют мицелий в 20 объемах культуральной жидкости, экстрагируют при 40°С в течение 4 часов. Отделяют жмых биомассы мицелия от экстракта методом центрифугирования. В сусло вносят 20% культуральной жидкости и экстракт биомассы в количестве, эквивалентном 1,5 г воздушно-сухого мицелия на 1 л сусла.
Пример 10. Получение пива, содержащего экстракт базидиомицета G. resinaceum.
Осуществляют процесс, как в Примере 1. В сусло добавляют экстракт погруженного вегетативного мицелия G. resinaceum. Отделяют биомассу мицелия методом седиментации. Гомогенизируют мицелий в 5 объемах дистиллированной воды, экстрагируют при 20°С в течение 0,5 часов. Отделяют жмых биомассы мицелия от экстракта методом сепарирования. Ресуспендируют жмых мицелия в 5 объемах дистиллированной воды, повторно экстрагируют при температуре 90°С в течение 120 минут. Отделяют жмых биомассы мицелия от экстракта методом сепарирования. В сусло вносят экстракт биомассы первой экстракции в количестве, эквивалентном 3,0 г воздушно-сухого мицелия на 1 л сусла.
Пример 11. Получение пива, содержащего экстракт базидиомицета G. frondosa.
Осуществляют процесс, как в Примере 1. В сусло добавляют экстракт погруженного вегетативного мицелия G. frondosa. Отделяют биомассу мицелия методом фильтрации. Гомогенизируют мицелий в 10 объемах дистиллированной воды, экстрагируют при 40°С в течение 1 часа. Отделяют жмых биомассы мицелия от экстракта методом центрифугирования. Ресуспендируют жмых мицелия в 5 объемах культуральной жидкости, повторно экстрагируют при температуре 120°С в течение 30 минут. Отделяют жмых биомассы мицелия от экстракта методом центрифугирования. В сусло вносят экстракт биомассы второй экстракции в количестве, эквивалентном 3,0 г воздушно-сухого мицелия на 1 л сусла.
Пример 12. Получение пива, содержащего экстракты базидиомицета H. coralloides.
Осуществляют процесс, как в Примере 1. В сусло добавляют экстракт погруженного вегетативного мицелия Н. coralloides. Отделяют биомассу мицелия методом седиментации. Гомогенизируют мицелий в 20 объемах дистиллированной воды, экстрагируют при 20°С в течение 1,5 часов. Отделяют жмых биомассы мицелия от экстракта методом сепарирования. Ресуспендируют жмых мицелия в 7 объемах дистиллированной воды, повторно экстрагируют при температуре 120°С в течение 30 минут. Отделяют жмых биомассы мицелия от экстракта методом центрифугирования. В сусло вносят экстракт биомассы первой экстракции в количестве, эквивалентном 2,5 г воздушно-сухого мицелия на 1 л сусла и экстракт биомассы второй экстракции в количестве, эквивалентном 2,0 г воздушно-сухого мицелия на 1 л сусла.
Пример 13. Получение пива, содержащего экстракты базидиомицета H. erinaceus.
Осуществляют процесс, как в Примере 1. В сусло добавляют экстракт погруженного вегетативного мицелия H. erinaceus. Отделяют биомассу мицелия методом фильтрации. Гомогенизируют мицелий в 20 объемах культуральной жидкости, экстрагируют при 40°С в течение 2 часов. Отделяют жмых биомассы мицелия от экстракта методом центрифугирования. Ресуспендируют жмых мицелия в 7 объемах культуральной жидкости, повторно экстрагируют при температуре 90°С в течение 120 минут. Отделяют жмых биомассы мицелия от экстракта методом сепарирования. В сусло вносят экстракт биомассы первой экстракции в количестве, эквивалентном 2,0 г воздушно-сухого мицелия на 1 л сусла, и 20% культуральной жидкости.
Пример 14. Получение пива, содержащего экстракты базидиомицета I. hispidus.
Осуществляют процесс, как в Примере 1. В сусло добавляют экстракт погруженного вегетативного мицелия I. hispidus. Отделяют биомассу мицелия методом фильтрации. Гомогенизируют мицелий в 10 объемах культуральной жидкости, экстрагируют при 20°С в течение 3 часов. Отделяют жмых биомассы мицелия от экстракта методом сепарирования. Ресуспендируют жмых мицелия в 10 объемах дистиллированной воды, повторно экстрагируют при температуре 120°С в течение 30 минут. Отделяют жмых биомассы мицелия от экстракта методом сепарирования. В сусло вносят экстракт биомассы второй экстракции в количестве, эквивалентном 2,5 г воздушно-сухого мицелия на 1 л сусла, и 10% культуральной жидкости.
Пример 15. Получение пива, содержащего экстракты базидиомицета I. obliquus.
Осуществляют процесс, как в Примере 1. В сусло добавляют экстракт погруженного вегетативного мицелия I. obliquus. Отделяют биомассу мицелия методом седиментации. Гомогенизируют мицелий в 5 объемах культуральной жидкости, экстрагируют при 40°С в течение 4 часов. Отделяют жмых биомассы мицелия от экстракта методом центрифугирования. Ресуспендируют жмых мицелия в 10 объемах культуральной жидкости, повторно экстрагируют при температуре 90°С в течение 120 минут. Отделяют жмых биомассы мицелия от экстракта методом центрифугирования. В сусло вносят экстракт биомассы первой экстракции в количестве, эквивалентном 1,5 г воздушно-сухого мицелия на 1 л сусла, экстракт биомассы второй экстракции в количестве, эквивалентном 3,0 г воздушно-сухого мицелия на 1 л сусла, и 5% культуральной жидкости.
Пример 16. Получение пива, содержащего экстракт базидиомицета L. edodes.
Осуществляют процесс, как в Примере 1. В сусло добавляют экстракт погруженного вегетативного мицелия L. edodes. Постферментационную жидкость не разделяют на фазы. Экстрагируют мицелий культуральной жидкостью при температуре 90°С в течение 120 минут. Биомассу мицелия отделяют от экстракта методом фильтрации. В сусло вносят 5% экстракта.
Пример 17. Получение пива, содержащего экстракт базидиомицета P. impudicus.
Осуществляют процесс, как в Примере 1. В сусло добавляют экстракт погруженного вегетативного мицелия P. impudicus. Постферментационную жидкость не разделяют на фазы. Экстрагируют мицелий культуральной жидкостью при температуре 120°С в течение 30 минут. Биомассу мицелия отделяют от экстракта методом сепарирования. В сусло вносят 15% экстракта.
Пример 18. Получение пива, содержащего экстракт базидиомицета P. ostreatus.
Осуществляют процесс, как в Примере 1. В сусло добавляют экстракт погруженного вегетативного мицелия P. ostreatus. Постферментационную жидкость не разделяют на фазы. Экстрагируют мицелий культуральной жидкостью при температуре 90°С в течение 120 минут. Биомассу мицелия отделяют от экстракта методом центрифугирования. В сусло вносят 20% экстракта.
Пример 19. Получение пива, содержащего экстракт базидиомицета P. eryngii.
Осуществляют процесс, как в Примере 1. В сусло добавляют экстракт погруженного вегетативного мицелия P. eryngii. Постферментационную жидкость не разделяют на фазы. Гомогенизируют мицелий непосредственно в культуральной жидкости. Экстрагируют мицелий культуральной жидкостью при температуре 90°С в течение 120 минут. Биомассу мицелия отделяют от экстракта методом сепарирования. В сусло вносят экстракт биомассы в количестве, эквивалентном 3,0 г воздушно-сухого мицелия на 1 л сусла.
Пример 20. Получение пива, содержащего экстракт базидиомицета Т. versicolor.
Осуществляют процесс, как в Примере 1. В сусло добавляют экстракт погруженного вегетативного мицелия Т. versicolor. Постферментационную жидкость не разделяют на фазы. Гомогенизируют мицелий непосредственно в культуральной жидкости. Экстрагируют мицелий культуральной жидкостью при температуре 120°С в течение 30 минут. Биомассу мицелия отделяют от экстракта методом сепарирования. В сусло вносят экстракт биомассы в количестве, эквивалентном 2,0 г воздушно-сухого мицелия на 1 л сусла.
Пример 21. Получение пива, содержащего экстракт базидиомицетов Т. mesenterica.
Осуществляют процесс, как в Примере 1. В сусло добавляют экстракт погруженного вегетативного мицелия Т. mesenterica. Постферментационную жидкость не разделяют на фазы. Гомогенизируют мицелий непосредственно в культуральной жидкости. Экстрагируют мицелий культуральной жидкостью при температуре 90°С в течение 120 минут. Биомассу мицелия отделяют от экстракта методом центрифугирования. В сусло вносят экстракт биомассы в количестве, эквивалентном 1,5 г воздушно-сухого мицелия на 1 л сусла.
Пример 22. Получение пива, содержащего экстракты базидиомицетов Т. populinum и G. lucidum.
Осуществляют процесс, как в Примере 1. В сусло добавляют экстракты погруженного вегетативного мицелия Т. populinum и G. lucidum. Отделяют биомассу мицелия Т. populinum методом фильтрации. Гомогенизируют мицелий в 20 объемах дистиллированной воды, экстрагируют при 40°С в течение 2 часов. Отделяют жмых биомассы мицелия от экстракта методом центрифугирования.
Отделяют биомассу мицелия G. lucidum методом фильтрации. Гомогенизируют мицелий в 10 объемах дистиллированной воды, экстрагируют при 40°С в течение 1 часа. Отделяют жмых биомассы мицелия от экстракта методом центрифугирования. Ресуспендируют жмых мицелия в 5 объемах культуральной жидкости, повторно экстрагируют при температуре 120°С в течение 30 минут. Отделяют жмых биомассы мицелия от экстракта методом центрифугирования.
В сусло вносят экстракт биомассы Т. populinum, соответствующей 1,5 г воздушно-сухого мицелия на 1 л сусла, экстракт биомассы G. lucidum второй экстракции в количестве, эквивалентном 3,0 г воздушно-сухого мицелия на 1 л сусла, и 10% культуральной жидкости G. lucidum.
Пример 23. Получение пива, содержащего экстракт базидиомицета Н. marmoreus.
Осуществляют процесс, как в Примере 1. В состав сусла вводят экстракт погруженного вегетативного мицелия Н. marmoreus. Постферментационную жидкость не разделяют на фазы. Цельную постферментационную жидкость вносят в пиво стадии дображивания. Экстракцию мицелия осуществляют за счет этилового спирта или воды, содержащихся в перебродившем сусле. Через 4 суток биомассу мицелия отделяют методом седиментации.
Пример 24. Получение пива, содержащего экстракт базидиомицета G. pfeifferi.
Осуществляют процесс, как в Примере 1. В состав сусла вводят экстракт погруженного вегетативного мицелия G. pfeifferi. Постферментационную жидкость не разделяют на фазы. Гомогенизируют мицелий непосредственно в культуральной жидкости. Гомогенизат вносят в пиво на стадии дображивания. Экстракция мицелия осуществляется за счет этилового спирта, содержащегося в перебродившем сусле. Через 8 суток биомассу мицелия отделяют методом фильтрации.
Пример 25. Получение пива, содержащего экстракт базидиомицета S. crispa.
Осуществляют процесс, как в Примере 1. В состав сусла вводят экстракт погруженного вегетативного мицелия S. crispa. Отделяют биомассу мицелия методом фильтрации. Мицелий вносят в пиво на стадии дображивания. Экстракция мицелия осуществляется за счет этилового спирта и воды, содержащихся в перебродившем сусле. Через 15 суток биомассу мицелия отделяют методом флотации.
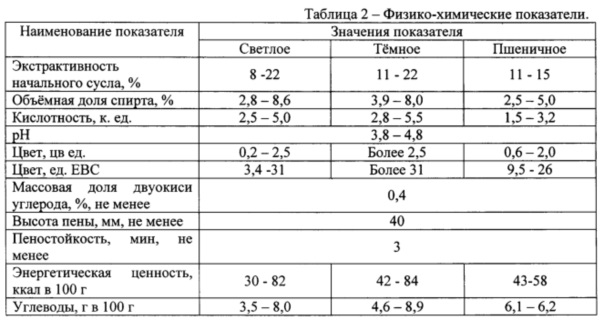
Основные свойства получаемого грибного пива приведены в Таблицах 1 и 2.

Таким образом, как следует из описания, в частности, из примеров, получают грибное пиво, содержащее грибной экстракт из лекарственных и лекарственно-съедобных высших грибов, обладающее увеличенным сроком хранения, характерными органолептическими показателями и повышенной биологической активностью.
Полученное пиво обладает свойствами физиологически функционального пищевого продукта, увеличенным сроком хранения, увеличенным сроком хранения и при этом, в зависимости от способа получения и использования грибных экстрактов, может обладать органолептическими показателями, характерными для традиционных сортов пива, либо приобретать оригинальный аромат и привкус, свойственные экстракту конкретного вида лекарственных и лекарственно-съедобных высших грибов.
ЛИТЕРАТУРА
Ali N.A., Pilgrim Н., Ludke J., Lindequist U. Inhibition of chemiluminescence response of human mononuclear cells and suppression of mitogeninduce proliferation of spleen lymphocytes of mice by hispolon and hispidin. // Pharmazie 1996; 51:667-70.
Awadh A.N., Mothana R.A., Lesnau A., Pilgrim H., Lindequist U. Antiviral activity of extracts and compounds from Inonotus hispidus. // Fitotherapia 2003; 74:483-5.
Badalyan S.M. Antiprotozoal activity and mitogenic effect of mycelium of culinary-medicinal shiitake mushroom Lentinus edodes (Berk.) Singer (Agaricomycetidae). // Int J Med Mushrooms 2004; 6:131-8.
Bender S., Dumitrache C.N., Backhaus J., Christie G., Cross R.F., Lonergan G.T., et al. A case for caution in assessing the antibiotic activity of extracts of culinary-medicinal Shiitake mushroom [Lentinus edodes (Berk.) Singer] (Agaricomycetidae). // Int J Med Mushrooms 2003; 5:31-5.
Bobek P., Galbavy S., Ozdin L. Effect of oyster mushroom (Pleurotus_ostreatus) on pathological changes in dimethylhydrazine-induced rat colon cancer. // Oncol Rep 1998; 5:727-30.
Bodinet C., Lindequist U., Teuscher E., Freudenstein J. Influence of peroral application of a herbal immunomodulator on the antibody production of Peyer's Patches-cells. // Arzneim Forsch 2004; 54:114-8.
Chen R.Y., Yu D.Q. Studies on the triterpenoid constituents of the spores from Ganoderma lucidum Karst. // J Chin Pharm Sci 1993; 2:91-6.
Colins R.A., Ng T.B. Polysaccharopeptide from Coriolus versicolor has potential for use against human immunodeficiency virus type 1 infection // Life Science Journal. 1997. 60:PL383. p. 7.
Gao J.J., Min B.S., Ann E.M., Nakamura N., Lee H.K., Hattori M. New triterpene aldehydes, lucialdehydes A-C, from Ganoderma lucidum and their cytotoxicity against murine and human tumor cells. // Chem Pharm Bull 2002; 50:837-40.
Gao Y., Dai X., Chen G., Ye J., Zhou S. A randomized, placebo-controlled, multicenter study of Ganoderma lucidum (W.Curt.:Fr.) Lloyd (Aphylloromycetidae) polysaccharides (Ganopoly R) in patients with advanced lung cancer. // Int J Med Mushrooms 2003; 5:369-81.
Gao Y., Lan J., Dai X., Ye J., Zhou S. A phase I/II study of ling zhi mushroom Ganoderma lucidum (W.Curt.:Fr.) Lloyd (Aphyllophoromycetidae) extract in patients with type II diabetes mellitus. // Int J Med Mushrooms 2004; 6:33-9.
Gao Y., Zhou S., Chen G., Dai X., Ye J., Gao H.. A phase I/II study of a Ganoderma lucidum (Curt.:Fr.) P. Karst. (Ling Zhi, Reishi mushroom) extract in patients with chronic hepatitis B. Int J Med Mushrooms 2002; 4: 2321-7.
Gao Y1., Zhou S., Chen G., Dai X., Ye J. A phase I/II study of a Ganoderma lucidum (Curt.:Fr.) P. Karst. extract (Ganopoly) in patients with advanced cancer. // Int J Med Mushrooms 2002; 4:207-14.
Gao Y2., Zhou S., Chen G., Dai X., Ye J., Gao H.. A phase I/II study of a Ganoderma lucidum (Curt.:Fr.) P. Karst. (Ling Zhi, Reishi mushroom) extract in patients with chronic hepatitis B. Int J Med Mushrooms 2002; 4:2321-7.
Gerasimenya V.P., Efremenkova O.V., Kamzolina O.V., Bogush T.A., Tolstych I.V., Zennkova V.A. Antimicrobial and antitoxical action of edible and medicinal mushroom Pleurotus ostreatus (Jacq,:Fr.) Kumm. Extracts. // Int J Med Mushrooms 2002; 4:127-32.
Gordon M., Guralnik M., Kaneko Y., Mimura Т., Goodgame J., DeMarzo C., et al. A phase II controlled study of a combination of the immune modulator, lentinan, with didanosine (DDI) in HIV patients with CD4 cells of 200-500/MM(3). // J Med 1995; 26:193-207.
Hazama S., Oka M., Yoshino S., Iizuka N., Wadamori K. Yamamoto, et al. Clinical effects and immunological analysis of intraabdominal and intrapleural injection of lentinan for malignant ascites and pleural effusion of gastric carcinoma. // Cancer Chemother 1995; 22:1595-1597.
Hikino H., Konno C., Mirin Y., Hayashi T. Isolation and hypoglycaemic activities of ganoderans A and B, glucans of Ganoderma lucidum fruit bodies. Planta Med 1985; 51:339-40.
Hirotani M., Ino C., Furuya Т., Shiro M. Ganoderic acids T, S and R, new triterpenoids from the cultured mycelia of Ganoderma lucidum. // Chem Pharm Bull 1986; 34:2282-5.
Kahlos K, Kangas L, Hiltunen R. Antitumor activity of some compounds and fractions from an n-hexane extract of Inonotus obliquus in vitro. // Acta Pharm Fennica. 1987. 96:33. p. 40.
Kodama N., Komuta K., Nanba H. Can maitake MD-fraction aid cancer patients? // Altern Med Rev 2002; 7:236-9.
Kohda H., Tokumoto W., Sakamoto K., Fujii M., Hirai Y., Yamasaki K., et al. The biologically-active constituents of Ganoderma lucidum (Fr) Karst-histamine release-inhibitory triterpenes. // Chem Pharm Bull 1985; 33:1367-73.
Komoda Y., Shimizu M., Sonoda Y., Sato Y. Ganoderic acid and its derivatives as cholesterol synthesis inhibitors. // Chem Pharm Bull 1989; 37:531-3.
Konno S., Aynehchi S., Dolin D.J., Schwartz A.M., Choudhury M.S., Tazakin HN. Anticancer and hypoglycemic effects of polysaccharides in edible and medicinal Maitake mushroom (Grifola frondosa (Dicks.:Fr.) S.F. Gray). // Int J Med Mushrooms 2002; 4:185-95.
Kreisel H., Lindequist U., Horak M. Distribution, ecology and immunosuppressive properties of Tricholoma populinum (Basidiomycetes) // Zentralbl Mikrobiol 1990. 145:393. p. 6.
Kuznecovs S., Kuznecova G. Phallus impudicus in treatment of Lewis lung carcinoma. // XVII International Congress of Allergology and Clinical Immunology - ICACI XVII. 2000. Sydney, p.421.
Kuznecovs S., Jegina K., Kuznecovs I., Kuznecova G. Phallus impudicus in thromboembolic disease prevention in cancer // Abstracts of the 16th MASCC International Symposium Miami Beach. 2004. FL. p. 379.
Lakshmi В., Jose N., Ajith T.A., Jananrdhanan K.K. Antimutagenic activity of methanolic extract of culinary-medicinal oyster mushroom, Pleurotus ostreatus (Jacq.:Fr.) Kumm. (strain floric Eger nom. Nud.) and its protective effect against benzo[a]pyrene-induced hepatic damages. // Int J Med Mushrooms 2004; 6:139-49.
Lam S.K., Ng T.B. Hypsin, a novel thermostable ribosome inactivating protein with antifungal and antiproliferative activities from fruiting bodies of the edible mushroom Hypsizigus marmoreus. // Biochem Biophys Res Commun 2001; 285:1071-5.
Lee S., Park S., Oh J.W., Yang C. Natural inhibitors for protein prenyltransferase. // Planta Med 1998; 64:303-8.
Lindequist U., Teuscher E., Wolf В., Volsgen A., Hoffmann S., Kutschabsky L., et al. Isolierung, Charakterisierung und Strukturaufklarung eines immunsuppressiv wirksamen Inhaltsstoffes aus Tricholoma populinum Lange // Pharmazie 1989. 44:165.
Lindequist U., Niedermeyer T.H.J., Julich W.D. The Pharmacological Potential of Mushrooms // Evidence-Based Complementary and Alternative Medicine. Vol. 2 (2005), Iss. 3, P. 285-299.
Lin Z.B. Focus on anti-oxidative and free radical scavening activity of Ganoderma lucidum. // J Appl Pharmacol 2004; 12:133-7.
Melzig M.F., Pieper S., Siems W.E., Heder G., Bottger A., Liberra K., et al. Screening of selected basidiomycetes for inhibitory activity on neutral endopeptidase (NEP) and angiotensin-converting enzyme (ACE) // Pharmazie. 1996. 51:501. p. 3.
Menoli R.C., Mantovani M.S., Ribeiro L.R., Speit G., Jordalo B.Q. Antimutagenic effects of the mushroom Agaricus blazei Murrill extracts on v79 cells. // Mutation Research. 2001. 12:5. p. 13.
Mizuno Т. Medicinal properties and clinical effects of culinarymedicinal mushroom Agaricus blazei Murrill (Agaricomycetidae) (Review). // International Journal of Legal Medicine Mushrooms. 2002. 4. pp. 299-312.
Mizuno T2. Bioactive substances in Hericium erinaceus (Bull.:Fr.) Pers. (Yamabushitake), and its medicinal utilization. // Int J Med Mushrooms 1999; 1:105-19.
Mori K., Obara Y., Hirota M., Azumi Y., Kinugasa S., Inatomi S., Nakahata N. Nerve growth factor-inducing activity of Hericium erinaceus in 1321N1 human astrocytoma cells. // Biological & Pharmaceutical Bulletin. 2008. 31(9) pp. 1727-1732.
Morigiwa A., Kitabatake K., Fujimoto Y., Ihekawa N. Angiotensin converting enzyme inhibitory triterpenes from Ganoderma lucidum. // Chem Pharm Bull 1986; 34:3025-8.
Mothana R.A., Jansen R., Julich W-D., Lindequist U. Ganomycin A and B, new antimicrobial farnesyl hydroquinones from the basidiomycete Ganoderma pfeifferi. // J Nat Prod 2000; 63:416-8.
Mothana R.A., Awadh N.A., Jansen R., Wegner U., Mentel R., Lindequist U. Antiviral lanostanoid triterpenes from the fungus Ganoderma pfeifferi BRES. // Fitoterapia 2003; 74:177-80.
Ohno N., Harada Т., Masuzawa S., Miura N.N., Adachi Y., Nakajima M., et al. Antitumor activity and hematopoietic response of a b-glucan extracted from an edible and medicinal mushroom Sparassis crispa Wulf.:Fr. (Aphylloromycetidae). // Int J Med Mushrooms 2002; 4: 13-26.
Ohno N., Nameda S., Harada Т., Miura N.N., Adachi Y., Nakajima M., et al. Immunomodulating activity of a b-glucan preparation, SCG, extracted from a culinary-medicinal mushroom, Sparassis crispa Wulf.:Fr. (Aphyllophoromycetidae), and application to cancer patients. // Int J Med Mushrooms 2003; 5:359-68.
Ochiai Т., Isono K., Suzuki Т., Koide Y., Gunji Y., Nagata M., et al. Effect of immunotherapy with lentinan on patients' survival and immunological parameters in patients with advanced gastric cancer: results of a multi-centre randomized controlled study // Int J Immunother 1992; 8:161-9.
Penga X.-R., Liua J.-Q., Hana Z.-H. et al. Protective effects of triterpenoids from Ganoderma resinaceum on H2O2-induced toxicity in HepG2 cells. // Food Chemistry. 2013. Volume 141. Issue 2. pp. 920-926.
Saito Т., Aoki F., Hirai H., Inagaki Т., Matsunaga Y., Sakakibara Т., et al. Erinacine E as a kappa opioid receptor agonist and its new analogs from a basidiomycete, Hericium ramosum // Journal Of Antibiotics. 1998. 51:983. p. 90.
Sano M., Yoshino K., Matsuzawa Т., Ikekawa Т. Inhibitory effects of edible higher basidiomycetes mushroom extracts on mouse type IV allergy. // Int J Med Mushrooms 2002; 4:37-41.
Sato M., Tai Т., Nunoura Y., Yajima Y., Kawashima S., Tanaka K. Dehydrotrametenolic acid induces preadipocyte differentiation and sensitizes animal models of noninsulin-dependent diabetes mellitus to insulin // Biological & Pharmaceutical Bulletin. 2002. 25:81. p. 6.
Smania E.F., Delle Monache F., Smania Jr. A., Yunes R.A. Cuneo. Antifungal activity of sterols and triterpenes isolated from Ganoderma annulare // Fitoterapia. 2003. 74:375. p. 7.
Smania Jr., Delle Monache F., Smania .EF., Cuneo R.S. Antibacterial activity of steroidal compounds isolated from Ganoderma applanatum (Pers.) Pat. (Aphyllophoromycetideae) fruit body. // Int J Med Mushrooms) 1999; 1:325-30.
Soares A.A., Marques de Souza C.G., Daniel F.M. et al. Antioxidant activity and total phenolic content of Agaricus brasiliensis (Agaricus blazei Murril) in two stages of maturity. // Food Chemistry. 2009. - V. 112, I. 4. pp. 775-781.
Stevens J.F., Page J.E. Xanthohumol and related prenylflavonoids from hops and beer: to your good health! // Phytochemistry. - 2004. - V. 65. P. 1317 1330.
Su C.Y., Shiao M.S., Wang C.T. Predominant inhibition of ganodermic acid S on the thromboxane A2-dependent pathway in human platelets response to collagen. // Biochim Biophys Acta 1999; 1437:223-34.
Taguchi Т., Furue H., Kimura Т., Kondoh Т., Hattori Т., Itoh I., et al. Life-span prolongation effect of lentinan on patients with advanced or recurrent colorectal cancer. // Int J Immunopharmacol 1982; 4:271.
Tasaka K., Mio M., Izushi K., Akagi M., Makino Т.. Anti-allergic constituents in the culture medium of Ganoderma lucidum. (II). The inhibitory effect of cyclooctasulfur on histamine release. // Agents Actions 1988; 23:157-60.
Tokuda S., Tapiri А., Kano E., Sugwara Y., Suzuki S., Sato H., et al. Reducing mechanism of plasma cholesterol by Shii-ta-ke. // Mushroom Sci 1974; 9:445-61.
Toth J.O1., Luu В., Ourisson G. Ganoderic acid T and Z: cytotoxic triterpenes from Ganoderma lucidum (Polyporaceae). // Tetrahedron Lett 1983; 24:1081-4.
Toth J.O2., Luu В., Beck J..P, Ourisson G. Chemistry and biochemistry of Oriental drugs. Part IX. Cytotoxic triterpenes from Ganoderma lucidum (Polyporaceae): structures of ganoderic acids U-Z. // J Chem Res Synop 1983; 12:299.
Van der Torre H.W., Van Dokkum W., Schaafsma G., Wedel M., Ockhuizen T. Effect of various levels of selenium in wheat and meat on blood Se status indices and on Se balance in Dutch men/ // Brit. J. Nutr. - 1991 - V. 65. - p 69-80.
Wang H.X., Gao J., Ng T.B. A new lectin with highly potent antihepatoma and antisarcoma activities from the oyster mushroom Pleurotus ostreatus. // Biochem Biophys Res Commun 2000; 275:810-6.
Wang H.X., Ng T.B. Isolation and characterization of velutin, a novel low-molecular-weight ribosome-inactivating protein from winter mushroom (Flammulina velutipes) fruiting bodies. // Life Sci 2001; 68: 2151-8.
Wang M.Y., Liu Q., Che Q.M., Lin Z.B. Effects of total triterpenoids extract from Ganoderma lucidum (Curt.:Fr.) P. Karst. (Reishi Mushroom) on experimental liver injury models induced by carbon tetrachloride or d-galactosamine in mice. // Int J Med Mushrooms 2002; 4: 337-42.
Wasser S.P., Tan K.K., Elisashvili V.I. Hypoglycemic, interferonogenous, and immunomodulatory activity of Tremellastin from the submerged culture of Tremella mesenterica Retz.:Fr. (Heterobasidiomycetes) // International Journal of Medicinal Mushrooms. 2002. 4:215. p. 27.
Wasser S.P., Weis A.L.: Medicinal properties of substances occurring in higher Basidiomycetes // International Journal of Medicinal Mushrooms. 1999. 1: 31. p. 62.
Wong K.H., Sabaratnam V., Abdullah N., Kuppusamy U.R., Naidu M. Effects of cultivation techniques and processing on antimicrobial and antioxidant activities of Hericium erinaceus (Bull.:Fr.) pers. Extracts. // Food Technology and Biotechnology. 2009. 47 (1). pp. 47-55.
Yang B.-K., Park J.-B., Song C.-H. Hypolipidemic Effect of an Exo-biopolymer Produced from a Submerged Mycelial Culture of Hericium erinaceus. // Bioscience, Biotechnology, and Biochemistry. 2003. 67 (6), pp. 1292-1298.
Yap A.T., Ng M.L. Immunopotentiating properties of lentinan (1-3)- b-Dglucan extracted from culinary-medicinal Shiitake mushroom Lentinus edodes (Berk.) Singer (Agaricomycetidae). // Int J Med Mushrooms 2003; 5:339-58.
Yu L.G., Fernig D.J., Smith J.A., Milton J.D., Rhodes J.M. Reversible inhibition of proliferation of epithelial cell lines by Agaricus bisporus (edible mushroom) lectin. // Cancer Res 1993; 53:4627-32.
Yu R., Yin Y., Yang W., Ma W., Yang L., Chen X., Zhang Z., Ye Bin, Song L. Structural elucidation and biological activity of a novel polysaccharide by alkaline extraction from cultured Cordyceps militaris // Carbohydrate Polymers. 2009. 75. pp. 166-171.
Zhang Y., Mills G., Nair M.G. Cyclooxygenase inhibitory and antioxidant compounds from the mycelia of the edible mushroom Grifola frondosa. // J Agric Food Chem 2002; 50:7581-5.
Zusman I., Reifen R., Livni O., Smirnoff P., Gurevich P., Sandler В., et al. Role of apoptosis, proliferating cell nuclear antigen and p53 protein in chemically induced colon cancer in rats fed corncob fiber treated with the fungus Pleurotus ostreatus. // Anticancer Res 1997; 17:2105-13.
Интернет-ресурс http://xn-clatere.xn-plai/o-kompanii/preparaty-iz-vysshikh-gribov-na-mirovom-farmatsevticheskom-rynke/ по состоянию на 31.07.2015.

