Результат интеллектуальной деятельности: РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ Pichia pastoris - ПРОДУЦЕНТ СЕКРЕТИРУЕМОЙ ТЕРМОСТАБИЛЬНОЙ КСИЛОГЛЮКАНАЗЫ, КОДИРУЕМОЙ СИНТЕТИЧЕСКИМ ГЕНОМ, И СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА СЕКРЕТИРУЕМОЙ ТЕРМОСТАБИЛЬНОЙ КСИЛОГЛЮКАНАЗЫ НА ОСНОВЕ ЭТОГО ШТАММА
Вид РИД
Изобретение
Группа изобретений относится к биотехнологии, в частности к биосинтезу ксилоглюканазы, и представляет собой рекомбинантный штамм дрожжей Pichia pastoris, содержащий в геноме синтетический ген ксилоглюканазы и способный синтезировать секретируемую термостабильную ксилоглюканазу, а также способ микробиологического синтеза термостабильной ксилоглюканазы на основе заявленного штамма.
Растительная биомасса - дешевый возобновляемый источник сахаров для нужд биотехнологии. Ферментативный гидролиз - эффективный и экологически безопасный способ конверсии растительной биомассы в сахара. Разнообразие растительного сырья обуславливает необходимость использования широкого спектра ферментов для гидролиза.
Ксилоглюкан (КГ) - один из основных полисахаридов первичной клеточной стенки двудольных и многих однодольных растений. Молекула КГ состоит из мономеров 1,4-β-D-глюкотетрозы, в которой три из четырех глюкозных остатка связаны α-1,6 связями с остатками D-ксилозы. Некоторые из остатков глюкозы, в свою очередь, могут быть связаны β-1,2 связями с остатками D-галактозы или L-арабинозы. Остатки D-галактозы могут быть связаны α-1,2 связями с остатками L-фукозы. Модификация остатков ксилозы видоспецифична, что определяет множество типов КГ в растениях. В клеточной стенке КГ выполняет структурную функцию, формируя матрикс, в который погружены микрофибриллы целлюлозы, поэтому полный гидролиз целлюлозы невозможен без предварительного гидролиза КГ.
Ферменты, специфически расщепляющие β-1,4 связи молекулы КГ, называются ксилоглюканазами. Эндо-ксилоглюканазы (ксилоглюкан-специфические эндо-β-1,4-глюканазы, ЕС 3.2.1.151) случайным образом расщепляют КГ, в результате чего образуются олигоксилоглюканы различной длины. Экзо-ксилоглюканазы (ЕС 3.2.1.155 и ЕС 3.2.1.150) процессивно гидролизуют молекулу КГ с концов цепи. Полный гидролиз КГ осуществляется в результате совокупного действия обоих типов ферментов. По классификации базы CAZy ферменты, гидролизующие КГ, относятся к семействам гликозил-гидролаз GH74, GH5, GH9, GH12, GH16, GH26, GH44. Ферменты, гидролизующие КГ, могут также гидролизовать и целлюлозу.
Олигосахариды, полученные из КГ, могут найти применение в пищевой и кормовой отраслях, а также могут быть использованы в медицине, фармацевтике. Известно, что некоторые растительные олигосахариды обладают иммуномодулирующими/ стимулирующими, пребиотическими, антибиотическими, противовирусными, противоопухолевыми, антипаразитическими, антикоагуляционными, антинейродегернеративными свойствами, а также могут снижать уровень липидов и холестерина. Возможность получения олигосахаридов с такими свойствами делает КГ интересными объектами для изучения и последующего использования.
В источниках информации имеются сведения о микроорганизмах - природных продуцентах ксилоглюканаз: Geotrichum sp. (Yaoi and Mitsuishi, 2004), Aspergillus japonicus, Chrysosporium lucknowense, Trichoderma reesei (Grishutin et al., 2004; Markov et al., 2005; Qi et al., 2013), Phanerochaete chrysosporium (Ishida et al., 2007). Методами селекции и радиационного мутагенеза получены штаммы, синтезирующие повышенные количества ксилоглюканаз: Penicillium verruculosum (RU 2361918), Penicillium funiculosum (RU 2323254), Aspergillus aculeatus (RU 2303057).
Описаны также полученные методами генной инженерии штаммы Escherichia coli - продуценты рекомбинантных ксилоглюканаз из Geotrichum sp. М128 (US 2004038367; Yaoi and Mitsuishi, 2002), Fusarium graminearum (Habrylo et al., 2012), Rhizomucor miehei (Song et al., 2013). В качестве реципиентов для гетерологичной экспрессии грибных ксилоглюканаз используют различные штаммы грибов: в Aspergillus oryzae экспрессированы ксилоглюканазы из Malbranchea cinnamomea (US 6500658), в Fusarium venenatum - ксилоглюканаза из Trichoderma reesei (US 2004067569 A1), в Penicillium canescens - ксилоглюканаза из Penicillium canescens (RU 2358756), в Aspergillus niger - ксилоглюканаза из Thielavia australiensis и собственная ксилоглюканаза (WO 2014138983; Hasper et al., 2002).
Иногда для гетерологичной экспрессии грибных ксилоглюканаз применяют отличные от E.coli бактериальные реципиенты, например Acidothermus cellulolyticus использован для гетерологичной экспрессии ксилоглюканаз из Acremonium sp., Cladorrhinum foecundissimum, Humicola insolens, Thielavia terrestris, Trichoderma reesei, Aspergillus aculeatus, Aspergillus aculeatus, Aspergillus fumigatus, Myceliophthora thermophila (Vlasenko et al., 2010).
Описаны также полученные методами генной инженерии штаммы дрожжей Pichia pastoris - продуценты рекомбинантных ксилоглюканаз из Phanerochaete chrysosporium (Ishida et al., 2007).
Используемые для получения рекомбинантного фермента системы гетерологичной экспрессии в бактериях и микроскопических грибах имеют свои технологические и экономические достоинства и недостатки. Способы с применением бактериальных систем экспрессии, например E.coli, имеют такие ограничения, как невозможность воспроизвести все посттрансляционные модификации, характерные для эукариот (гликозилирование, фосфорилирование, образование дисульфидных связей между цистеиновыми остатками) и формирование нерастворимых телец включения. К недостаткам штаммов-продуцентов на основе микроскопических грибов родов Aspergillus и Penicillium относят невысокий уровень синтеза рекомбинантных ферментов по сравнению с E.coli и сложности с проведением генетических манипуляций на штаммах вследствие нестандартизированного и недостаточно разработанного генетического инструментария (Demain and Vaishnav, 2009).
Интерес к продукции рекомбинантных белков с использованием метилотрофных дрожжей, в частности рода Pichia, Komagataella или Hansenula, основан на ряде преимуществ этих микррорганизмов как с научной, так и с технологический точки зрения. В отличие от Е. coli метилотрофные дрожжи обладают способностью ко всем посттрансляционным модификациям, характерным для эукариотических клеток, включая секрецию белков в культуральную среду. Невысокое количество эндогенных секретируемых белков дрожжей существенно облегчает выделение и очистку целевого рекомбинантного продукта (Macauley-Patrick and Fazenda, 2005). Культуру метилотрофных дрожжей можно выращивать в ферментерах до более высоких плотностей, по сравнению с традиционно используемыми дрожжами Saccharomyces cerevisiae, что позволяет получить более высокий уровень продукции целевого белка (Gellissen, 2000). Метилотрофные дрожжи обладают одними из самых мощных в природе промоторов. Их отличает также альтернативный механизм гликозилирования белков, позволяющий синтезировать низкоиммуногенный целевой белок.
В качестве ближайшего аналога заявляемого штамма рассмотрим штамм дрожжей Pichia pastoris, содержащий на плазмиде pPICZα-A ген XGH74B из Phanerochaete chrysosporium под контролем промотора АОХ1 и экспрессирующий гликозил-гидролазу класса GH74, специфически гидролизующую ксилоглюкан (Ishida et al., 2007). Этот штамм создан с целью получения рекомбинантного фермента и изучения его структуры и свойств и по уровню синтеза XGH74B не охарактеризован. По результатам сравнительного анализа (http://blast.ncbi.nlm.nih.gov) уровень гомологии заявляемого в настоящем изобретении синтетического гена mt74sin, кодирующего ксилоглюканазу, и гена XGH74B из Phanerochaete chrysosporium составляет 55%.
Ближайшим аналогом заявляемого способа микробиологического синтеза ксилоглюканазы является способ получения ферментного препарата с ксилоглюканазной активностью при ферментации штаммов Penicillium canescens, мультикопийных по гомологичному гену xegA (RU 2358756). Активность ксилоглюканазы в конце ферментации в культуральной жидкости штаммов P. canescens XG9 (ВКМ № F-3939D) составляла не менее 60 ед./мл.
Задача заявляемой группы изобретений состоит в разработке способа микробиологического синтеза ксилоглюканазы на основе рекомбинантного штамма Pichia pastoris, сочетающего высокий уровень продукции гетерологичного фермента с его термостабильностью.
Задачу решают путем:
- конструирования рекомбинантного штамма дрожжей Pichia pastoris ВКПМ Y-4269 - продуцента секретируемой термостабильной ксилоглюканазы GH74, кодируемой синтетическим геном, соответствующим SEQ ID NO 1,
- разработки способа микробиологического синтеза ксилоглюканазы на основе рекомбинантного штамма дрожжей Pichia pastoris ВКПМ Y-4269
Процесс конструирования заявляемого штамма состоит из следующих этапов:
- конструирования синтетитического гена mt74sin (SEQ ID NO 1) на основе нуклеотидной последовательности гена mt74, кодирующего ксилоглюканазу семейства GH74 из Myceliophthora thermophila ВКПМ F-244.
- конструирования интегративной плазмидной ДНК (плазмиды) pPIC-mt74sin, содержащей синтетический ген ксилоглюканазы mt74sin.
- конструирования рекомбинантного штамма дрожжей Pichia pastoris/mt74sin, способного синтезировать термостабильную ксилоглюканазу семейства GH74.
- разработки способа микробиологического синтеза ксилоглюканазы на основе рекомбинантного штамма дрожжей Pichia pastoris/mt74sin, сочетающего высокий уровень синтеза гетерологичной ксилоглюканазы семейства GH74 с ее термостабильностью.
Этап 1. Конструирование синтетического гена mt74sin на основе нуклеотидной последовательности гена mt74, кодирующего ксилоглюканазу семейства GH74 из штамма Myceliophthora thermophila ВКПМ F-244
Дизайн нуклеотидной последовательности mt74sin разрабатывают на основании кодирующей области гена mt74 из Myceliophthora thermophila ВКПМ F-244, идентичной кодирующей области гена гликозил-гидролазы семейства GH74 MYCTH_116384 (GenBank: AEO58927.1) из Myceliophthora thermophila АТСС 42464/BCRC 31852/DSM 1799 (Sporotrichum thermophile). Ген mt74 из Myceliophthora thermophila ВКПМ F-244 кодирует ксилоглюканазу, что подтверждают путем анализа белков, секретируемых штаммом ВКПМ F-244, с помощью совокупности методов зимограммы и MALDI-TOF.
Последовательность гена mt74 анализируют, удаляют интроны и, руководствуясь информацией о составе кодонов активно экспрессирующихся генов Pichia pastoris, заменяют нуклеотидные триплеты таким образом, чтобы содержание G+C соответствовало природным генам. Структуру получающейся мРНК анализируют и при необходимости вносят замены с целью удаления обширных вторичных структур и рестрикционных сайтов XhoI и BglII, которыми затем фланкируют последовательность для последующего встраивания в плазмидную конструкцию. Полученную последовательность используют для синтеза ДНК mt74sin. Гомология гена mt74sin и кодирующей области гена MYCTH_116384 из Myceliophthora thermophila АТСС 42464 составляет 73,5%.
Этап 2. Конструирование интегративной плазмидной конструкции pPIC-mt74sin
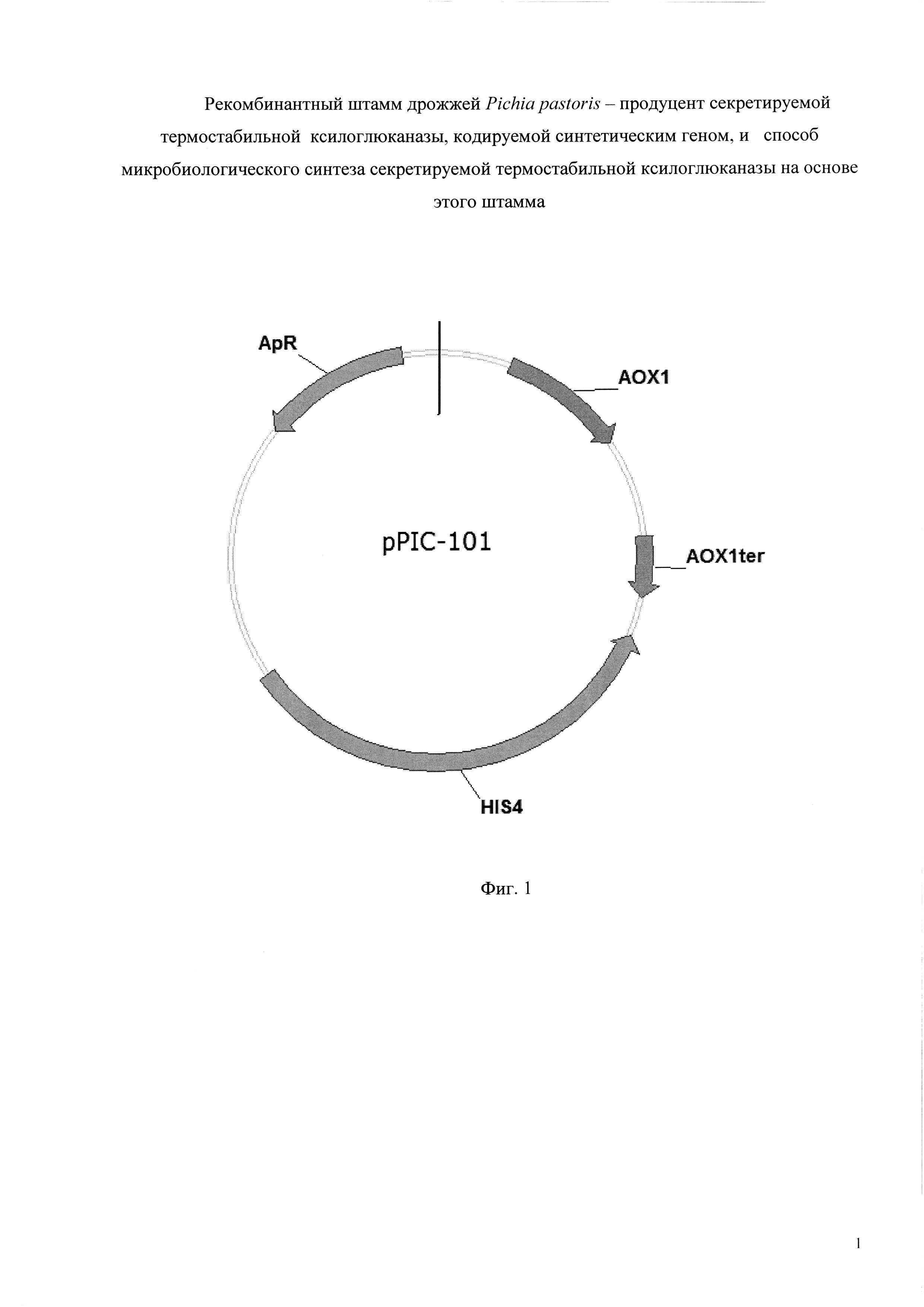
Плазмиду pPIC-mt74sin конструируют путем клонирования полученного на этапе 1 фрагмента ДНК, содержащего синтетический ген mt74sin, в вектор pPIC-101 разработанный для интеграции в штаммы Pichia pastoris (his 4, mut+). Вектор pPIC-101 размером 7404 пары оснований содержит промотор АОХ1; терминатор АОХ1; кодирующую область гена HIS4; кодирующую область гена bla, обеспечивающего устойчивость штаммов Е. coli к ампициллину; репликон pBR-322; последовательность, кодирующую сигнальный пептид α-фактор дрожжей.
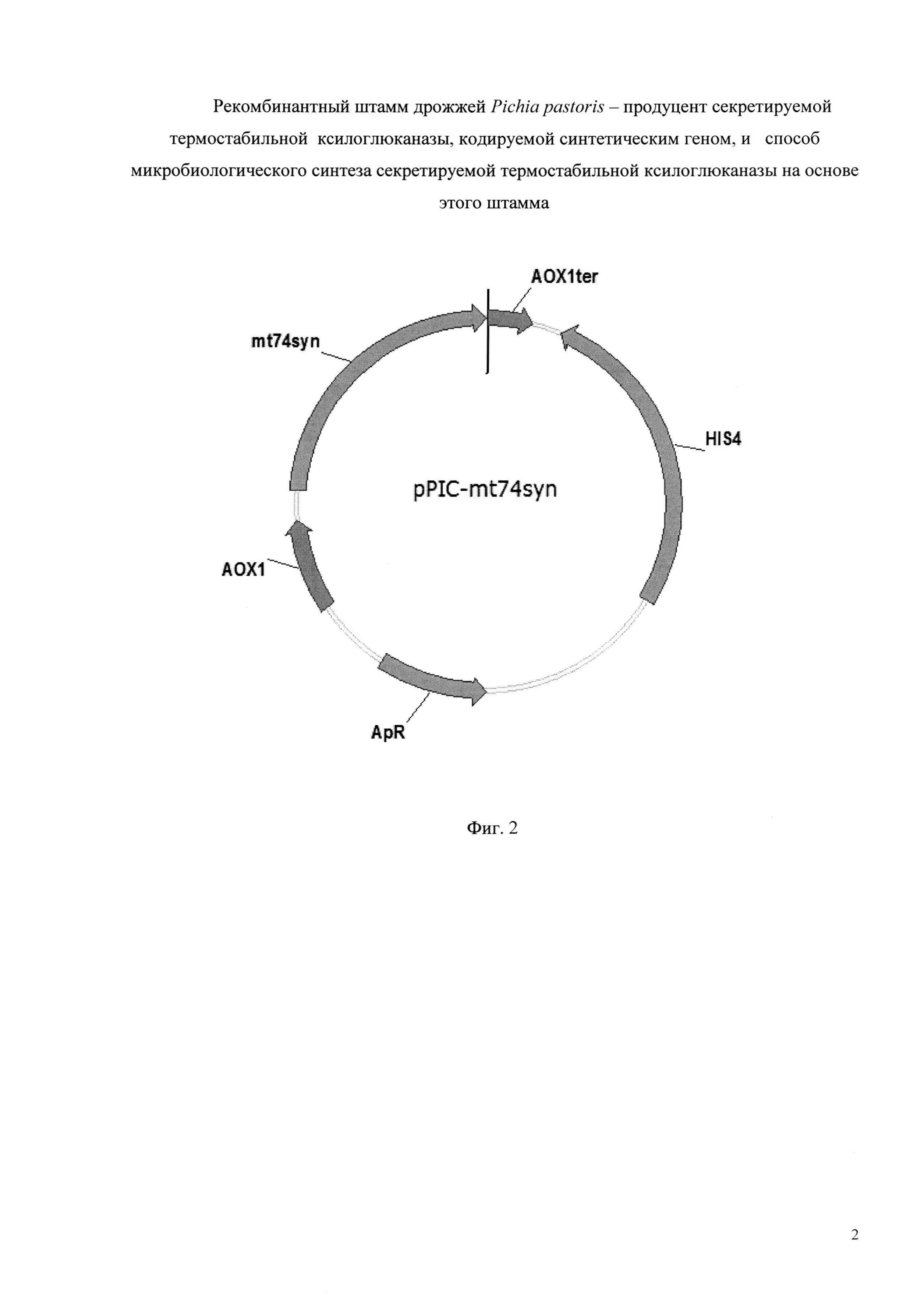
Плазмида pPIC-mt74sin размером 9285 пар оснований, наряду с генами вектора pPIC-101, содержит кодирующую область синтетического гена mt74sin ксилоглюканазы под контролем промотора АОХ1. (Фиг. 2).
Этап 3. Получение рекомбинантного штамма Pichia pastoris/mt74sin
В качестве штамма-реципиента используют штамм Pichia pastoris (his 4, mut+), не синтезирующий ксилоглюканазу. Компетентные клетки данного штамма трансформируют плазмидой pPIC-mt74sin. В результате получают рекомбинантный штамм Pichia pastoris/mt74sin, способный синтезировать термостабильную ксилоглюканазу семейства GH74.
Pichia pastoris/mt74sin депонирован во Всероссийской коллекции промышленных микроорганизмов как Pichia pastoris ВКПМ Y-4269;
Заявляемый штамм Pichia pastoris ВКПМ Y-4269 имеет следующие морфологические и физиолого-биохимические характеристики:
Морфологические признаки
При культивировании при температуре 28°С в течение 48 часов на агаризованной среде YPD следующего состава, мас. %:
пептон - 2,
дрожжевой экстракт - 1,
глюкоза - 2,
агар - 2,
вода - остальное.
Клетки имеют овальную форму, 3-4 мкм в диаметре; почкуются; почкование истинное, многостороннее; истинного мицелия не образуют. На агаризованной среде YPD формируются колонии светло-бежевого цвета с ровным краем, матовой поверхностью, линзовидным профилем и пастообразной консистенцией. При росте в жидкой среде YPD при 28°С в течение 24 ч культивирования - жидкость мутная, осадок белый, коагуляции не наблюдается, пристеночных пленок культура не образует.
Физиолого-биохимические признаки
Штамм является факультативным анаэробом. Температура роста - 20-33°С (оптимум - 28°С); pH среды культивирования - 4,8-7,4 (оптимум - 6,0). В качестве источников углерода штамм может использовать глюкозу, глицерин, метанол, олеат, сорбитол, рамнозу. Не утилизирует галактозу, ксилозу, арабинозу. В качестве источников азота штамм может использовать аминокислоты, сернокислый аммоний, азотнокислый аммоний. Существенными признаками штамма является отсутствие потребности в гистидине. Штамм Pichia pastoris ВКПМ Y-4269 синтезирует рекомбинантную секретируемую термостабильную ксилоглюканазу.
Способ микробиологического синтеза ксилоглюканазы в общем виде
Посевной материал, представляющий собой клетки рекомбинантного штамма-продуцента, подготавливают путем инкубации в течение 15-24 часов при температуре 29°С на среде YPD при постоянной аэрации на термостатируемой качалке (250 об/мин). Затем выросшую культуру переносят в соотношении 1:200 (по объему) в среду YPgM следующего состава, мас. %:
пептон - 2,
дрожжевой экстракт - 1,
глицерин 0,5,
метанол - 0,5,
вода - остальное.
Процесс биосинтеза ведут к колбах Эрленмейера, содержащих 100 мл среды YPgM, в течение 62 часов в ротационном шейкере-термостате (250 об/мин), при температуре 28°С. Каждые 24 часа проводят индукцию метанолом путем асептического добавления 50% раствора метанола в пробирки до конечной концентрации 0,5%. По истечении 62 часов биомассу отделяют центрифугированием. Наличие рекомбинантной ксилоглюканазы в культуральной среде определяют при помощи электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия с последующей зимограммой (Маниатис и др., 1984). Количественную оценку уровня активности рекомбинантной ксилоглюканазы осуществляют при помощи ДНС-метода (Miller, 1959).
Уровень синтеза ксилоглюканазы заявляемым способом составляет не менее 60 ед/мл культуральной жидкости, что не уступает ближайшему аналогу. Оптимум активности рекомбинантной ксилоглюканазы, продуцируемой штаммом Pichia pastoris ВКПМ Y-4269, - 60°С, pH 5.0. Рекомбинантная ксилоглюканаза, продуцируемая штаммом Pichia pastoris ВКПМ Y-4269 является термостабильной: при инкубации препарата фермента в течении часа при 50°С, pH 5.0 сохраняется 100% ферментативной активности, а в результате инкубации в течении часа при 60°С, pH 5.0 сохраняется 80% ферментативной активности.
Изобретение проиллюстрировано следующими фигурами графических изображений
Фиг. 1 - Схема плазмидной ДНК pPIC-101. Плазмидный вектор pPIC-101: промотор АОХ1; терминатор АОХ1; ген HIS4; ген bla, обеспечивающий устойчивость к ампициллину (ApR).
Фиг. 2 - Схема рекомбинантной плазмидной ДНК pPIC-mt74sin. Плазмидный вектор pPIC-mt74sin: промотор АОХ1; терминатор АОХ1; ген HIS4; ген bla, обеспечивающий устойчивость к ампициллину (ApR); mt74syn.
Пример 1. Конструирование рекомбинантной плазмидной ДНК pPIC-mt74sin, содержащей синтетический ген mt74sin, кодирующий ксилоглюканазу семейства GH74
Все стандартные генно-инженерные и микробиологические манипуляции проводят по известным методикам (Маниатис с соавт., 1984).
Синтетический ген mt74sin получают путем оптимизации нуклеотидной последовательности гена mt74 для синтеза в Pichia pastoris. С помощью программы mfold Web Server (http://unafold.rna.albany.edu/doc/old-mfold-manual/) проверяют структуру получающейся мРНК на наличие обширных вторичных структур, а с помощью программы Vector NTI версии 9 (Invitrogen) проверяют на наличие рестрикционных сайтов XhoI и BglII. В последовательность гена вносят замены для удаления нежелательных сайтов рестрикции и вторичных структур. Концы нуклеотидной последовательности модифицируют сайтами рестрикции XhoI и BglII для последующего встраивания фрагментов в плазмидную конструкцию. Полученную последовательность используют для синтеза ДНК mt74sin (SEQ ID NO 1).
Плазмиду p-mt74sin конструируют путем клонирования фрагмента, содержащего ген mt74sin в интегративный вектор pPIC-101 (Фиг. 1).
Гидролиз плазмиды pPIC-101 и фрагмента ДНК, содержащего ген mt74sin, проводят рестриктазами BglII и XhoI (Fermentas, Латвия). Реакционную смесь очищают набором для выделения ДНК из реакционных смесей (Биосилика, Россия) согласно инструкции производителя. Лигирование проводят в реакционной смеси объемом 20 мкл, содержащей 20 нг ДНК вектора, 1,5 нг ДНК фрагмента и 5 ед. Т4 ДНК лигазы (Fermentas, Латвия), согласно методике производителя. Полученной лигазной смесью в количестве 5 мкл трансформируют компетентные клетки штамма Е. coli XL1 blue MRF′ (Stratagene, США) (генотип - Δ(mcrA)183 Δ(mcrCB-hsdSMR-mrr)173 endA1 supE44 thi-1 recA1 gyrA96 relA1 lac [F′ proAB lacIqZΔM15 Tn10 (Tetr)]). Плазмидную ДНК полученных трансформантов анализируют путем гидролиза рестриктазами BglII и XhoI. В результате отбирают клоны, содержащие BglII/XhoI фрагменты размером, равным исходному фрагменту вставки. Правильность клонирования подтверждают секвенированием каждой из рекомбинантных вставок методом Сэнгера на генетическом анализаторе ABI 3500 (Life technology, США). В результате получают рекомбинантную плазмиду pPIC-mt74sin размером 9285 пар оснований, содержащую наряду с генами вектора pPIC-101, также синтетический ген mt74sin, кодирующий секретируемую термостабильную ксилоглюканазу семейства GH74 (SEQ ID NO 2) (Фиг. 2).
Пример 2. Получение заявляемого штамма Pichia pastoris ВКПМ Y-4269 - продуцента ксилоглюканазы семейства GH74
С целью получения рекомбинантного штамма Pichia pastoris ВКПМ Y-4269 - продуцента ксилоглюканазы, клетки штамма Pichia pastoris GS115 (his 4, mut+) (Invitrogen) трансформируют плазмидой pPIC-mt74sin. Трансформацию проводят 5 мг линеаризованной плазмидной ДНК, для получения которой исходную плазмиду обрабатывают эндонуклеазой рестрикции MluI.
Культуру дрожжей штамма Pichia pastoris GS115 (his 4, mut+) выращивают на среде YPD, в аэробных условиях (250 об/мин) до оптической плотности 1-2 единицы. Клетки биомассы, отделенные центрифугированием при 3000 g в течение 5 минут, ресуспендируют в буфере, содержащем 1 мМ дитиотрейтол и 100 мМ HEPES, затем инкубируют на шейкере в течение 30 минут и после двукратного промывания холодной деионизированной водой ресуспендируют в 1 мл 1 М сорбитола. Суспензию разделяют на аликвоты по 40 мкл. Электропорацию проводят на приборе GenePulser Xcell (Biorad) в кюветах с зазором 2 мм при 1500 В, 25 мкФ, 600 Ом. После электропорации быстро добавляют 1 мл холодного раствора 1 М сорбитола, инкубируют 1 час при температуре 30°С и высевают на селективную среду для отбора трансформантов. Отбор трансформантов проводят на минимальной среде М9, содержащей, мас. %:
KH2PO4 - 0,1;
MgSO4 - 0,05;
NaCl - 0,01;
CaCl2 - 0,01;
(NH4)2SO4 - 0,35;
глюкоза - 2;
тиамин - 0,02;
рибофлавин - 0,02;
никотиновая кислота - 0,02;
п-аминобензойная кислота - 0,02;
пантотенат кальция - 0,02;
биотин - 0,0002;
пиридоксин - 0,02;
инозит - 1;
фолиевая кислота - 0,02;
вода - остальное.
Клетки инкубируют при 29°С в течение 3 суток. Трансформанты выявляют методом ПЦР-скрининга. В результате получают заявляемый штамм Pichia pastoris ВКПМ Y-4269, продуцирующий секретируюмую термостабильную ксилоглюканазу.
Пример 3. Микробиологический синтез термостабильной секретируемой ксилоглюканазы заявляемым штаммом Pichia pastoris ВКПМ Y-4269
Посевной матерал выращивают путем инкубации клеток штамма Pichia pastoris ВКПМ Y-4269 в течение 15-24 часов при температуре 29°С на среде YPD при постоянной аэрации (250 об/мин). Среду YPgM засевают подготовленным посевным материалом и ведут процесс биосинтеза в аэробных условиях при температуре 28°С, проводя индукцию метанолом.
Уровень синтеза ксилоглюканазы заявляемым способом составляет не менее 60 Ед/мл, что в 51 раз превышает уровень синтеза ксилоглюканаз природным продуцентом Myceliophthora thermophila ВКПМ F-244 (1,17 ед/мл культуральной жидкости). Оптимум активности рекомбинантной ксилоглюканазы, продуцируемой штаммом Pichia pastoris ВКПМ Y-4269 - 60°С, pH 5.0. При инкубации в течение часа при 50°С, pH 5.0 сохраняется 100% ферментативной активности, а при инкубации в течение часа при 60°С, pH 5.0 сохраняется 80% ферментативной активности.
Таким образом, получен рекомбинантный штамм дрожжей Pichia pastoris ВКПМ Y-4269, способный к биосинтезу секретируемой термостабильной ксилоглюканазы семейства GH74, кодируемой синтетическим геном. При культивировании заявляемым способом уровень синтеза целевого продукта у заявляемого штамма сопоставим с таковым у ближайшего аналога, но в отличие от ближайшего аналога, продуцируемая ксилоглюканаза является термостабильной.
Источники информации
1. Маниатис Т., Фрич Э., Сэмбрук Дж., Молекулярное клонирование, М.: Мир, 1984; Клонирование ДНК. Методы. Под ред. Д. Гловера, Пер. с англ., Москва, Мир, 1988.
2. Demain AL, Vaishnav P. // Production of recombinant proteins by microbes and higher organisms // Biotechnol Adv., 2009.
3. Grishutin S.G., Gusakov A.V., Markov A.V., Ustinov B.B., Semenova M.V., Sinitsyn A.P. // Specific xyloglucanases as a new class of polysaccharide-degrading enzymes. // Biochim Biophys Acta, 2004.
4. Habrylo O., Song X., Forster A., Jeltsch J.M., Phalip V. // Characterization of the four GH12 Endoxylanases from the plant pathogen Fusarium graminearum. // J. Microbiol Biotechnol., 2012.
5. Hasper A.A., Dekkers E., van Mil M., van de Vondervoort P.J., de Graaff L.H. // EglC, a new endoglucanase from Aspergillus niger with major activity towards xyloglucan. // Appl Environ Microbiol., 2002.
6. Ishida Т., Yaoi K., Hiyoshi A., Igarashi K., Samejima M. // Substrate recognition by glycoside hydrolase family 74 xyloglucanase from the basidiomycete Phanerochaete chrysosporium. // FEBS J., 2007.
7. Markov A.V., Gusakov A.V., Kondratyeva E.G., Okunev O.N., Bekkarevich A.O., Sinitsyn A.P. // New effective method for analysis of the component composition of enzyme complexes from Trichoderma reesei. // Biochemistry (Mosc), 2005.
8. Miller G.L. // Use of dinitrosalicylic acid reagent for determination of reducing sugar // Analytical Chemistry. 1959.
9. Qi H., Bai F., Liu A. // Purification and characteristics of xyloglucanase and five other cellulolytic enzymes from Trichoderma reesei QM9414. // Biochemistry (Mosc), 2013.
10. Yaoi K., Mitsuishi Y. // Purification, characterization, cloning, and expression of a novel xyloglucan-specific glycosidase, oligoxyloglucan reducing end-specific cellobiohydrolase. // J Biol Chem., 2002.
11. Yaoi K., Mitsuishi Y. // Purification, characterization, cDNA cloning, and expression of a xyloglucan endoglucanase from Geotrichum sp. M128 // FEBS Lett., 2004.
12. Song S., Tang Y., Yang S., Yan Q., Zhou P., Jiang Z. // Characterization of two novel family 12 xyloglucanases from the thermophilic Rhizomucor miehei. // Appl Microbiol Biotechnol., 2013.
13. Vlasenko E.,  M., Cherry J., Xu F. // Substrate specificity of family 5, 6, 7, 9, 12, and 45 endoglucanases // Bioresour Technol., 2010.
M., Cherry J., Xu F. // Substrate specificity of family 5, 6, 7, 9, 12, and 45 endoglucanases // Bioresour Technol., 2010.
14. Macauley-Patrick S, Fazenda ML (2005) Heterologous protein production using the Pichia pastoris expression system. Yeast 22: 249-270.
15. Gellissen G (2000) Heterologous protein production in methylotrophic yeasts. Appl. Microbiol. Biotechnol. 54(6): 741-750.
16. RU 2358756 // Способ получения ферментного препарата для расщепления гемицеллюлозных гетерополисахаридов клеточной стенки растений и ферментный препарат (варианты) // Дата приоритета: 26.11.2007.
17. RU 2303057 // Штамм мицелиального гриба Aspergillus aculeatus - продуцент комплекса карбогидраз, содержащего ксиланазы, бета-глюканазы, пектиназы и ксилоглюканазы // Дата приоритета: 14.11.2005
18. RU 2323254 // Штамм мицелиального гриба Penicillium funiculosum - продуцент комплекса карбогидраз, содержащего целлюлазы, глюканазы, глюкозидазы, ксиланазы и ксилоглюканазы, и способ получения ферментного препарата комплекса карбогидраз для осахаривания лигноцеллюлозных материалов // Дата приоритета: 04.04.2006.
19. RU 2361918 // Штамм мицелиального гриба Penicillium verruculosum - продуцент комплекса целлюлаз, ксиланазы и ксилоглюканазы и способ получения ферментного препарата комплекса целлюлаз, ксиланазы и ксилоглюканазы для гидролиза целлюлозы и гемицеллюлозы // Дата приоритета: 26.02.2008.
20. US 6500658 // Xyloglucanase from Malbranchea // Priority date: US20000653778 20000901; WO2000DK00450 20000811; US19990149397P 19990817
21. US 2004038367 // Novel xyloglucan oligosaccharide-degrading enzyme, polynucleotide encoding the enzyme, and method of preparing the enzyme // Priority date: JP20020083433 20020325
22. US 2004067569 A1 // Polypeptides having xyloglucanase activity and nucleic acids encoding same // Priority date: US20030420191 20030418; US20020373987P 20020419.
23. WO 2014138983 A1 // Novel cell wall deconstraction enzymes of Malbranchea cinnamomea, Thielavia australiensis, and Paecilomyces byssochlamydoides, and uses thereof // Priority date: US201361783222P 20130314; US201361783313P 20130314; US201361783485P 20130314.