Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ МОНОКОНЪЮГАТА ПОЛИСИАЛОВОЙ КИСЛОТЫ С ТИМОЗИНОМ БЕТА 4 И КОВАЛЕНТНЫЙ МОНОКОНЪЮГАТ ПОЛИСИАЛОВОЙ КИСЛОТЫ С ТИМОЗИНОМ БЕТА 4, УСТОЙЧИВЫЙ К ДЕГРАДАЦИИ В ТОКЕ КРОВИ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к области модификации белков, в частности касается аналогов тимозина бета 4 с пролонгированным временем циркуляции в крови. Оно может быть использовано для получения аналогов человеческого тимозина бета 4.
Уровень техники
Тимозин бета 4 - это пептид, вырабатываемый клетками тимусовой железы, который участвует в регуляции полимеризации актина, а также участвует в пролиферации, миграции и дифференциации клеток. Эти свойства тимозина бета 4 определяют его ценность в качестве медицинского препарата, особенно при лечении ишемической болезни сердца.
Тимозин бета 4 человека представляет собой 43-членный пептид ацетилированный по N-концевой α-аминогруппе.
Немодифицированный тимозин бета 4 получают биотехнологическим методом с помощью технологии рекомбинантной ДНК и далее модифицируют путем избирательного химического ацетилирования N-концевой альфа-аминогруппы. Такой способ описан в работах (К.А. Бейрахова, В.Н. Степаненко, А.И. Мирошников, Р.С. Есипов / Биотехнологический способ получения ацетилированного тимозина бета 4 // Биоорганическая химия, 2011, том 37, №2, с. 1-10), (Д.А. Макаров, Т.И. Муравьева, В.Н. Степаненко, В.И. Швец, Р.С. Есипов, 2014. Оптимизация и масштабирование лабораторного метода получения рекомбинантного тимозина-бета 4 человека до пилотного производства. Биотехнология 4, 35-44)
Природный тимозин бета 4 - коротко живущий пептид, и период его полувыведения из крови напрямую зависит от вводимой дозы в организм [Mora С.А., Baumann С.А., Paino J.E., Goldstein A.L., Badamchian M. / Biodistribution of synthetic thymosin beta4 in the serum, urine, and major organs of mice // Int. J. Immunopharmacol.1997 Jan; 19(1):1-8], что создает трудности при его администрировании. Стандартный подход, применяемый для повышения стабильности терапевтического белка, заключается в присоединении к нему химическими или энзиматическими методами различных защитных групп, обеспечивающих защиту от протеалитических ферментов [Jevsevar S., Kunstelj М., Porekar V.G. PEGylation of the therapeutic proteins. Biotechnol J. 2010 Jan; 5(l):l 13-28; Schlapschy M., Binder U., 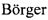 C., Theobald I., Wachinger K., Kisling S., Haller D., Skerra A. PASylation: a biological alternative to PEGylation for extending the plasma half-life of pharmaceutically active proteins. ProteinEngDesSel. 2013 Aug; 26(8):489-501; Susanne M Mumby. Reversible palmitoylation of signaling proteins/ Current Opinionin Cell Biology Volume 9, Issue 2, April 1997, Pages 148-154]. Но принципиальная сложность такого подхода по отношению к тимозину бета 4 заключается в том, что химическая модификация тимозина бета 4 предпочтительна только по N-концевой альфа-аминогруппе. Присоединение функциональной группы к любому другому аминокислотному остатку внутри пептида изменит его нативную структуру, что, в свою очередь, приведет к потере его биологической активности. Известно, что биологическая активность тимозина бета 4 определяется активными сайтами в коротких пептидных последовательностях, так, например, его основной актинсвязывающий сайт расположен в аминокислотных остатках 17-22, основной сайт, проявляющий антиапоптозную активность и осуществляющий защиту от токсичности, располагается в аминокислотных остатках 1-15, а сайт, представляющий собой первые четыре аминокислотных остатка Ac-SPDK, первый из которых ацетилирован по N-концевой альфа-аминогруппе, обладает широким спектром биологической активности. Связано это с тем, что природная посттрансляционная модификация пептида - присоединение ацетильной группы происходит именно по N-концевой альфа-аминогруппе тимозина бета 4. Поскольку концентрация тимозина бета 4 в крови уже через 2 часа падает до базального уровня после его администрирования [Mora С.А., Baumann С.А., Paino J.E., Goldstein A.L., Badamchian M. Biodistribution of synthetic thymosin beta 4 in the serum, urine, and major organs of mice. Int JImmunopharmacol. 1997 Jan; 19(1):1-8], существует потребность в аналогах тимозина бета 4 с пролонгированным временем циркуляции в крови.
C., Theobald I., Wachinger K., Kisling S., Haller D., Skerra A. PASylation: a biological alternative to PEGylation for extending the plasma half-life of pharmaceutically active proteins. ProteinEngDesSel. 2013 Aug; 26(8):489-501; Susanne M Mumby. Reversible palmitoylation of signaling proteins/ Current Opinionin Cell Biology Volume 9, Issue 2, April 1997, Pages 148-154]. Но принципиальная сложность такого подхода по отношению к тимозину бета 4 заключается в том, что химическая модификация тимозина бета 4 предпочтительна только по N-концевой альфа-аминогруппе. Присоединение функциональной группы к любому другому аминокислотному остатку внутри пептида изменит его нативную структуру, что, в свою очередь, приведет к потере его биологической активности. Известно, что биологическая активность тимозина бета 4 определяется активными сайтами в коротких пептидных последовательностях, так, например, его основной актинсвязывающий сайт расположен в аминокислотных остатках 17-22, основной сайт, проявляющий антиапоптозную активность и осуществляющий защиту от токсичности, располагается в аминокислотных остатках 1-15, а сайт, представляющий собой первые четыре аминокислотных остатка Ac-SPDK, первый из которых ацетилирован по N-концевой альфа-аминогруппе, обладает широким спектром биологической активности. Связано это с тем, что природная посттрансляционная модификация пептида - присоединение ацетильной группы происходит именно по N-концевой альфа-аминогруппе тимозина бета 4. Поскольку концентрация тимозина бета 4 в крови уже через 2 часа падает до базального уровня после его администрирования [Mora С.А., Baumann С.А., Paino J.E., Goldstein A.L., Badamchian M. Biodistribution of synthetic thymosin beta 4 in the serum, urine, and major organs of mice. Int JImmunopharmacol. 1997 Jan; 19(1):1-8], существует потребность в аналогах тимозина бета 4 с пролонгированным временем циркуляции в крови.
Раскрытие изобретения
Настоящее изобретение относится к созданию стабильного в токе крови аналога тимозина бета 4 посредством региоселективного химического сиалирования тимозина бета 4. Конкретнее, настоящее изобретение раскрывает способ получения модифицированного тимозина бета 4 с пролонгированной стабильностью в токе крови с высоким выходом, за счет региоспецифической моноконъюгации тимозина бета 4 с бутиральдегидным производным полисиаловой кислоты по свободной N-концевой альфа-аминогруппе тимозина бета 4.
Изобретение иллюстрируется следующими рисунками.
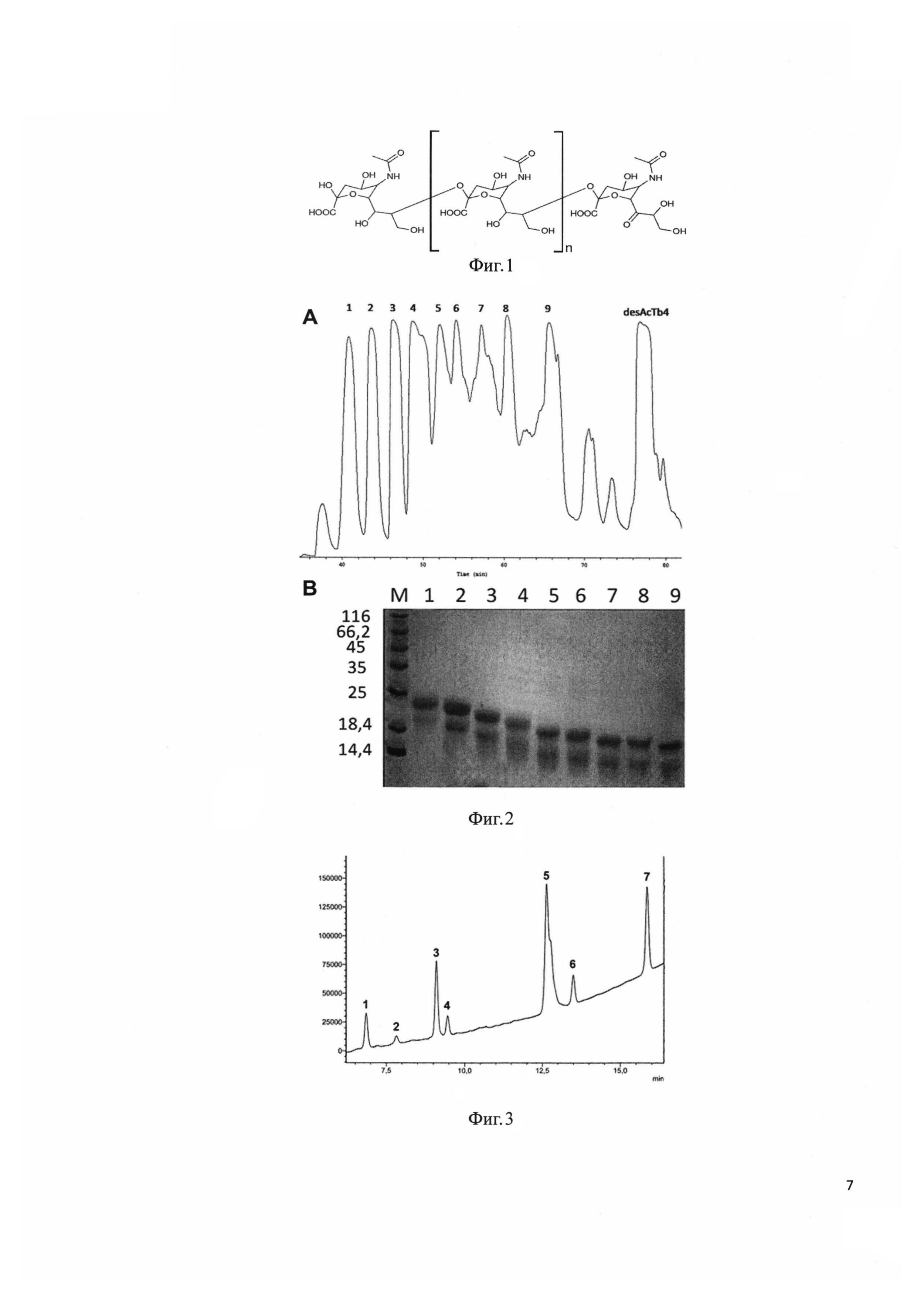
Фиг 1. Формула бутиральдегидного производного полисиаловой кислоты.
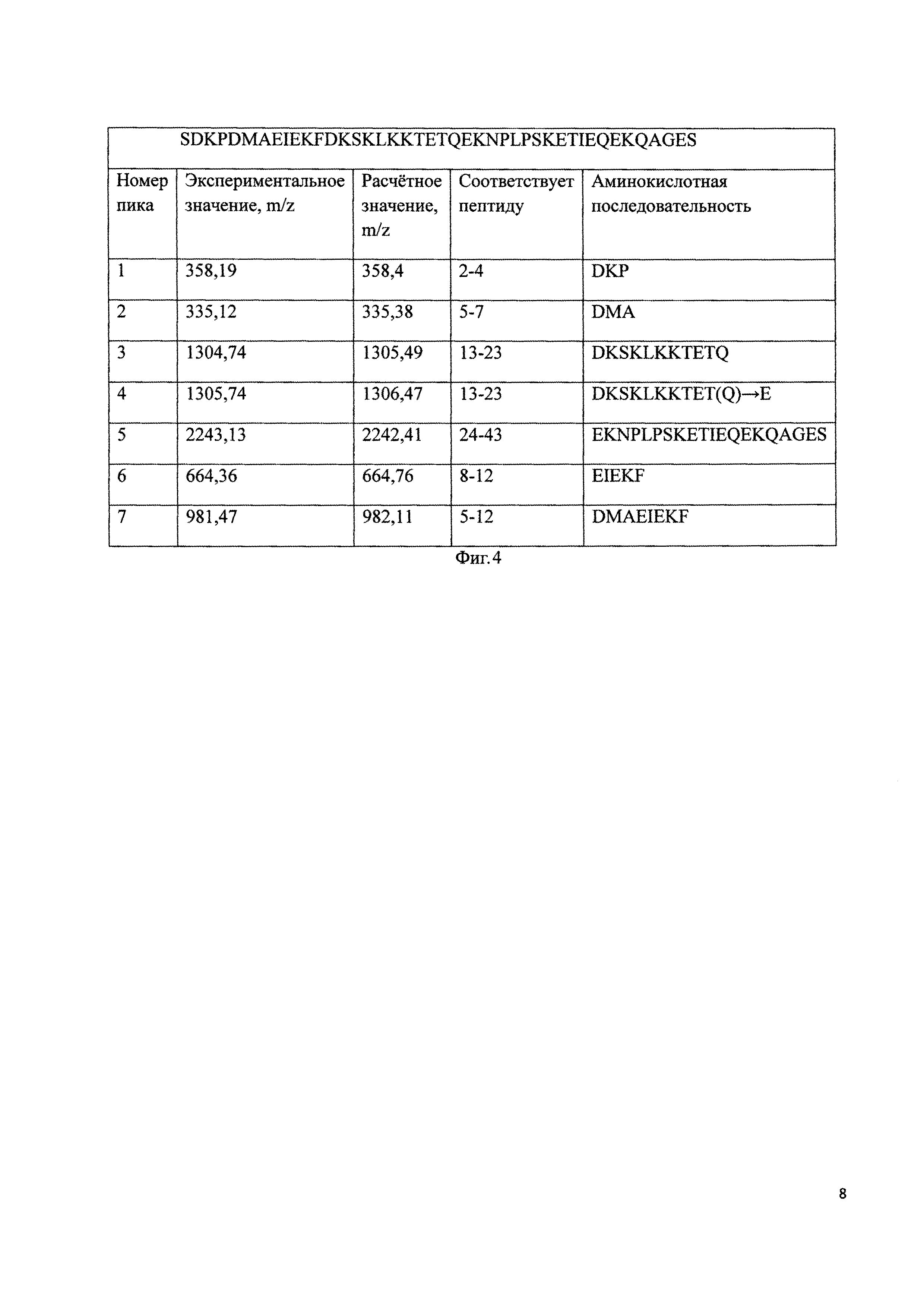
Фиг 2. А - Профиль полупрепаративной хроматографической очистки продуктов реакции сиалирования дезацетилтимозина бета 4. Колонка Диасорб 130 С16Т, 8 мкм, 15Х250 мм. Разделение проводили в градиенте 80% ацетонитрила с 5% NH4OAc 8-23%. В - Электрофоретический анализ фракций полупрепаративной ОФ ВЭЖХ:М - стандарт универсальных масс, 1-23 кДа, 2-22 кДа, 3-21 кДа, 4-20 кДа, 5-18 кДа, 6-17 кДа, 7-16 кДа, 8-15,5 кДа, 9-15 кДа продукты реакции сиалирования дезацетилтимозина бета 4.
Фиг 3. Хроматографический профиль продуктов протеолитического расщепления конъюгата полисиаловой кислоты с тимозином бета 4.
Фиг 4. Однобуквенная последовательность дезацетилтимозина бета 4. Результаты протеолитического расщепления моносиалированного тимозина бета 4.
Подробное описание изобретения
Химическая модификация молекулы белка полисиаловой кислотой направлена на улучшение переносимости препарата, снижение иммуногенности и повышение периода его полужизни. Полисиаловая кислота неиммунногенна и биодеградируема, кроме того уменьшает иммуногенность самого модифицируемого белка. Свойства, демонстрируемые ПСК, позволяют молекулам белка избежать фагоцитоза и увеличить свое время циркуляции в крови. Реакцию сайтспецифического сиалирования тимозина бета 4 проводили только при рН не ниже 4,5 поскольку при более низких значениях рН происходит деградация полисиаловой кислоты. Характерным аспектом изобретения является региоспецифический способ сиалирования, включающий моноселективную конъюгацию альдегида полисиаловой кислоты с тимозином бета 4 по свободной N-концевой альфа-аминогруппе пептида в буферном растворе для сиалирования при мольном соотношении белок/ПСК 1:5. Техническим результатом региоселективной химической модификации является образование моносиалированного тимозина бета 4, выход которого составляет не ниже 60%.
Под буферным раствором для сиалирования подразумевается многокомпонентный водно-органический буферный раствор, содержащий 30% ацетонитрила, который обеспечивает постоянное значение рН 4,5. Такой буфер с концентрацией от 5 мМ до 100 мМ может содержать соли уксусной, лимонной, глутаминовой, фосфорной, сорбиновой, янтарной кислот или 2-(N-морфолино)этансульфоновую кислоту (MES), список не ограничивается перечисленным.
Техническим результатом изобретения является получение моносиалированного тимозина бета 4, обладающего в 3 раз большим временем полувыведения из плазмы крови по сравнению с тимозином бета 4.
Осуществление изобретения
Пример 1
Получение моносиалированного тимозина бета 4.
К растворенному в буфере (50 мМ ацетат натрия, 30% ацетонитрила, рН 4.5) дезацетилтимозину бета 4 добавляют 80 мг цианборгидрида натрия и 140 мг бутиральдегидного производного полисиаловой кислоты, тщательно перемешивают и инкубируют в течение 3 ч при 25°C. Идентификацию образующегося моносиалированного тимозина бета 4 проводят методом электрофореза в денатурирующих условиях. Реакционную смесь разбавляют в 10 раз дистиллированной водой и наносят на колонну Диасорб 130 С16Т, 8 мкм, 15Х250 мм. Разделение проводят в градиенте 80% ацетонитрила с 1% NH4OAc (8-23% за 60 мин). Фракции, содержащие моносиалированный тимозин бета 4 более 98%, объединяют и лиофилизуют. На фигуре 2 под буквой А изображен профиль полупрепаративной хроматографической очистки сиалированного тимозина бета 4, фракции 1-9 соответствуют моносиалированному тимозину бета 4 с разной молекулярной массой. Под буквой В изображен электрофоретический анализ фракций с 1 по 9.
Пример 2
Подтверждение структуры моносиалированного тимозина бета 4.
Лиофилизованный аналог тимозина бета 4 и химически синтезированный тимозин бета 4 в количестве 200 мкг (считают по пептиду) растворяют в 50 мкл буфера (50 мМ Трис/HCl, рН 8,0), затем добавляют 5 мкл 0,067 мг/мл раствора Asp-N протеиназы (0,335 мкг) и инкубируют в течение 3 ч при 37°C. Протеолитическую смесь анализируют методом хромато-масс-спектрометрии. Хроматографические профили продуктов протеолитического расщепления соответствуют профилям на фиг 3. Молекулярные массы фрагментов пептидов соответствуют значениям на фиг 4.
Пример 3
Тестирование стабильности аналога тимозина бета 4 и химически синтезированного тимозина бета 4 на сыворотке крови.
Стабильность определяют как время, за которое в сыворотке крови остается 50% пептида от исходного количества (Т1/2). Сыворотку крови выделяют из крови кролика по стандартным протоколам. Расфасовывают по 50 мкл и замораживают на -70°C. Расфасованную сыворотку крови используют однократно. Тестируемые образцы растворяют в стерильном физиологическом растворе и вводят в концентрации 10 мг/мл в 50 мкл сыворотки крови и инкубируют в течение 1-24 ч при 37°C. Смесь анализируют методом хромато-масс-спектрометрии. Стабильность измеряют по изменению площади поглощения исследуемого образца со временем. Результаты обрабатывают статистически, достоверность отличий результатов определяют параметрическим методом. Для тимозина бета 4 Т1/2 соответствует 2 ч, для сиалированного тимозина бета 4 Т1/2 соответствует 6 ч.