Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКИЙ ИЛИ НУТРИЦЕВТИЧЕСКИЙ СОСТАВ
Вид РИД
Изобретение
Область изобретения
Изобретение относится к фармацевтическому или нутрицевтическому составу, который содержит ядро, содержащее активный фармацевтический или нутрицевтический ингредиент, промотор проникновения, агент, промотирующий биодоступность, который увеличивает биодоступность активного ингредиента, и полимерное покрытие для нацеленного высвобождения активного ингредиента в желудочно-кишечном тракте.
Уровень техники
В заявке DE 19724458 А1 описывается применение протеолитических ферментов для улучшения абсорбции фармацевтически активных ингредиентов.
Заявка ЕР 1302201 А1 описывает фармацевтические композиции, усовершенствованные для пероральной всасываемости. Композиция содержит лекарственное средство, аминоалкил метакриловый сополимер Е и кислое вещество.
Заявка ЕР 1466626 А1 описывает лекарственные композиции для улучшения всасывания при пероральном введении. Аминоалкил метакрилатный сополимер Е описывается здесь как агент для ингибирования разложения биологически активного пептида.
Международная заявка WO 2005007139 А2 описывает пероральную фармацевтическую форму из множества частиц, содержащую гранулы, имеющие размер в диапазоне от 50 до 2500 мкм, которые по существу состоят из
a) внутреннего матричного слоя, содержащего активное вещество, которое является пептидом или белком, включая их производные или конъюгаты, и которое включено в матрицу полимера, имеющего мукоадгезивные свойства, где матрица необязательно может содержать дополнительные фармацевтически приемлемые наполнители,
b) внешнее пленочное покрытие, состоящее по существу из анионного полимера или сополимера, который необязательно может быть составлен с фармацевтически приемлемыми носителями, особенно пластификаторами, характеризующаяся тем, что фармацевтическая форма из множества частиц составлена таким образом, что содержащиеся в ней гранулы высвобождаются в диапазоне pH желудка, внешнее покрытие регулируется, осуществляя выбор анионного полимера или сополимера или их составом с носителями и толщины его слоя таким образом, чтобы покрытие растворялось в диапазонах pH от 4,0 до 8,0 в кишечнике в течение 15-60 мин, так что мукоадгезивный матричный слой, содержащий активное вещество, обнажается и может связаться со слизистой оболочкой кишечника и высвободить здесь активное вещество, где полимер, обладающий мукоадгезивными свойствами, выбирается так, что он проявляет мукоадгезивные свойства ηb=150-1000 мПа·с и коэффициент поглощения воды 10-750% через 15 мин в диапазоне +/-0.5 единиц pH по отношению к значению pH, при котором внешнее покрытие начинает растворяться, и содержание активного вещества в матричном слое максимум составляет 40 мас.% от массы полимера, обладающего мукоадгезивными свойствами.
Указывается, что мукоадгезивный матричный слой может содержать дополнительные наполнители, такие как ингибиторы протеаз, например соевый ингибитор трипсина, или промоторы проникновения.
Тем не менее предполагается применение промоторов проникновения только в сочетании с высокомолекулярными (Mw) активными ингредиентами, такими как белки с молекулярной массой (Mw) равной 10000 или более. Ингибиторы протеаз могут использоваться в сочетании с белками или пептидами с Mw равной 3000-10000 и стабилизаторами, такими как жирные кислоты или жирные спирты, которые образуют липофильную матрицу. Конкретные примеры, в которых комбинируются ингибиторы протеаз и промоторы проникновения, не приводятся.
Патент ЕР 1771157 В1 описывает фармацевтическую лекарственную форму из множества частиц для слаборастворимых активных веществ и способ получения указанной фармацевтической лекарственной формы.
В международной заявке WO 2006/061069 А1 описывается форма для введения, состоящая из множества частиц, которая содержит мукоадгезивные активные ингредиенты, содержащие нуклеиновую кислоту, и способы получения указанных форм введения.
Ингибитор Баумана-Бирка (BBI) является хорошо известным наименованием семейства стабильных низкомолекулярных ингибиторов трипсина и химотрипсина, обнаруженных в соевых бобах и других различных семенах, главным образом в семенах бобовых культур и веществах растительного происхождения. См., например, в патенте US 5,962,414 или US 6,767,564.
Патент US 6,767,564 B2 описывает применение ингибитора Баумана-Бирка (BBI) для лечения множественного склероза и других аутоиммунных заболеваний, таких как Синдром Гийена-Барре и ревматоидный артрит. Указывается, что перорально вводимый ингибитор Баумана-Бирка всасывается и имеет системное действие. Приблизительно 50% принимаемого ингибитора Баумана-Бирка всасывается кровотоком. Далее указывается, что концентрат ингибитора Баумана-Бирка (BBIC), экстракт из соевых бобов, обогащенный ингибитором протеаз, по имеющимся сведениям является более хорошим ингибитором человеческих химаз, чем любой другой ингибитор физиологических протеаз, описанный до настоящего времени.
Проблема и решение
В ходе исследований авторы данного изобретения обнаружили, что фармацевтические или нутрицевтические составы, которые содержат ядро, содержащее активный фармацевтический или нутрицевтический ингредиент, промотор проникновения и полимерное покрытие для нацеленного высвобождения активного ингредиента в желудочно-кишечном тракте, дают хорошие показатели по проникновению в клетку в анализах in-vitro.
Тем не менее обнадеживающие результаты, полученные с активным ингредиентом десмопрессин in vitro, привели к полному разочарованию in vivo. Когда аналогичные составы тестировались in-vivo на минипигах, детектировалась только низкая биодоступность, измеренная in-vivo как концентрация в плазме крови.
Поскольку десмопрессин является пептидом, добавление ингибитора протеолитического фермента, который может предотвратить разложение пептида панкреатическими ферментами in-vivo, тестировалось сначала in-vitro, а затем in-vivo. В исследовании in-vitro в присутствии коктейля панкреатических ферментов, содержащего различные пептидазы и протеиназы, наблюдался определенный защитный эффект добавления ингибитора Баумана-Бирка (BBI) в качестве ингибитора протеолитических ферментов. Ожидалось, что этот эффект обнаружится на том же уровне или несколько более низком в системе in-vivo.
Однако, к огромному удивлению авторов изобретения, in-vivo эффект добавления ингибитора Баумана-Бирка был более чем в пять раз, соответственно почти в десять раз выше, чем ожидалось. Благодаря тому, что in-vivo эффект был настолько выше по сравнению с показателями in-vitro, авторы изобретения считают, что это эффект не может быть объяснен просто защитным эффектом ингибитора протеолитических ферментов по отношению к панкреатическим ферментам. Более того, по-видимому здесь присутствует новый неизвестный эффект, который увеличивает биодоступность активных ингредиентов, вызванный добавлением ингибитора протеолитических ферментов в целом или по меньшей мере такого ингибитора растительного происхождения или по меньшей мере ингибитора Баумана-Бирка в сочетании с другими элементами системы, как заявлено. Таким образом, авторы изобретения полагают, что фармацевтический или нутрицевтический состав, как заявлено, будут применимы к другим активным ингредиентам, которые не являются пептидами или белками.
Одной задачей настоящего изобретения было обеспечить фармацевтический или нутрицевтический состав, содержащий активный фармацевтический или нутрицевтический состав для перорального применения с повышенной биодоступностью.
Задача была решена фармацевтическим или нутрицевтическим составом, который содержит ядро, содержащее активный фармацевтический или нутрицевтический ингредиент, промотор проникновения и агент, промотирующий биодоступность, а также полимерное покрытие для нацеленного высвобождения активного ингредиента в желудочно-кишечном тракте, характеризующаяся тем, что агент, промотирующий биодоступность, является фармацевтически приемлемым ингибитором протеолитических ферментов, который повышает пероральную биодоступность активного ингредиента по меньшей мере в 5 раз, по сравнению с аналогичным составом без агента, промотирующего биодоступность.
Подробное описание
Фармацевтический или нутрицевтический состав
Изобретение относится к фармацевтическому или нутрицевтическому составу, который содержит ядро, содержащее активный фармацевтический или нутрицевтический ингредиент, промотор проникновения и агент, промотирующий биодоступность, а также полимерное покрытие для нацеленного высвобождения активного ингредиента в желудочно-кишечном тракте.
В простом варианте выполнения изобретения фармацевтический или нутрицевтический состав представляет собой покрытую матричную таблетку. Однако предпочтительно, что фармацевтический или нутрицевтический состав является составом, состоящим из множества частиц.
Фармацевтический или нутрицевтический состав, состоящий из множества частиц
Изобретение относится, предпочтительно, к фармацевтическому или нутрицевтическому составу, состоящему из множества частиц, который содержит множество частиц в одной дозированной единице. Частицы, предпочтительно, являются покрытыми или непокрытыми гранулами.
Предпочтительными размерами частиц могут быть 0,2-2, предпочтительно 0,3-1 мм. Сравнительно маленький размер частиц имеет преимущество в том, что по меньшей мере в случае покрытых гранул происходит быстрый и надежный перенос из желудка в двенадцатиперстную кишку. Во всех случаях есть преимущество, заключающееся в высоком уровне стандартизации дозировки активного ингредиента и в хорошем распределении в кишечнике.
Фармацевтический или нутрицевтический состав может содержать 10-1000, предпочтительно 50-500 частиц, которые предпочтительно являются покрытыми или непокрытыми гранулами.
Лекарственное средство в многослойной форме согласно настоящему изобретению в первую очередь является целесообразным в виде фармацевтической или нутрицевтической формы, состоящей из множества частиц.
Форма, состоящая из множества частиц, например, может быть таблеткой, содержащей гранулы, или прессованной таблеткой, минитаблеткой, саше или капсулой, наполненной множеством частиц или гранул, содержащих активный ингредиент.
Все эти термины хорошо известны специалисту в области фармации и галеновых препаратов.
Термин «таблетка, содержащая гранулы» или «прессованная таблетка» хорошо известен специалисту в данной области техники. Такая таблетка может иметь размер около 5-25 мм, например. Обычно, определенные множества маленьких гранул, содержащих активный ингредиент, прессуются в нее вместе со связующими носителями, давая хорошо известную форму таблетки. После перорального приема и контакта с жидкостью тела форма таблетки разрушается и гранулы высвобождаются. Прессованная таблетка объединяет преимущество однодозовой формы с преимуществами многодозовых форм, например точность дозировки.
Термин «минитаблетка» хорошо известен специалисту в данной области техники. Минитаблетка меньше чем традиционная таблетка и может иметь размер около 1-4 или меньше чем 5 мм. Минитаблетка, также как и гранула, является однодозовой формой, предназначенной для многократного приема. По сравнению с гранулами, которые могут такого же размера, минитаблетки обычно имеют преимущество, заключающееся в более правильной поверхности, которая может быть более покрыта более тщательно и более однородно. Минитаблетки могут быть предоставлены заключенными в капсулы, такие как желатиновые капсулы. Такие капсулы разрушаются после перорального приема и контакта с жидкостями желудка или кишечника и тогда минитаблетки высвобождаются. Другое применение минитаблеток заключается в индивидуальном точном подборе дозировки активного ингредиента. В этом случае пациент может принимать определенное количество минитаблеток, которое непосредственно соответствует тяжести болезни, подвергающейся лечению, а также его индивидуальному весу тела. Минитаблетка отличается от прессованной таблетки, содержащей гранулы, как обсуждается выше.
Термин «саше» хорошо известен специалисту в данной области техники. Он относится к маленькой герметичной упаковке, которая содержит активный ингредиент, часто в жидкой содержащей гранулы форме или также в форме сухих гранул или в форме порошка. Само по себе «саше» является формой упаковки, не предназначенной для приема. Содержимое саше может быть растворено в воде либо, как преимущество, его можно увлажнить или принимать его непосредственной без дополнительной жидкости. Последний способ является предпочтительным для пациента, когда лекарственная форма должна приниматься в отсутствие доступной воды. Саше является альтернативной лекарственной формой таблеткам, минитаблеткам или капсулам.
Термин «капсула» хорошо известен специалистам в данной области техники. Капсула, как и саше, является контейнером для жидкостей, содержащих гранулы, а также сухих гранул или порошков. Однако, в противоположность саше капсула состоит из фармацевтически приемлемых наполнителей, таких как желатин или гидроксипропилметилцеллюлоза, и предназначена для проглатывания как таблетка. Капсулы разрушаются после перорального приема и контактируют с жидкостями желудка или кишечника, в результате чего содержащиеся в них многочисленные частицы высвобождаются. Капсулы для фармацевтических целей являются коммерчески доступными в разных стандартизированных размерах.
Гранулы
Гранулы содержат ядро, содержащее активный фармацевтический или нутрицевтический ингредиент, промотор проникновения и агент, промотирующий биодоступность, который повышает биодоступность активного ингредиента. Ядро предпочтительно может содержать покрытие для нацеленного высвобождения активного ингредиента в желудочно-кишечном тракте (кишечнорастворимое покрытие). Например капсула из гидроксипропилметилцеллюлозы (ГПМЦ) или желатина может быть заполнена множество гранул, покрытых кишечнорастворимым покрытием.
Если гранулы не имеют покрытия для нацеленного высвобождения активного ингредиента в желудочно-кишечном тракте, тогда дозированная единица должна содержать такое полимерное покрытие. Например, капсула из ГПМЦ или желатина может содержать гранулы без кишечнорастворимого покрытия, но сама капсула затем покрывается кишечнорастворимым полимером. Кишечнорастворимое покрытие капсул, особенно капсул из ГПМЦ, известна, например, из заявки ЕР 1117386 А1.
Средний диаметр частиц покрытых или непокрытых гранул может варьировать от 100 до 1500 мкм, предпочтительно от 200 до 800 мкм.
Предпочтительно, гранулы состоят из ядра, содержащего активный фармацевтический или нутрицевтический ингредиент, промотор проникновения, агент, промотирующий биодоступность, который повышает биодоступность активного ингредиента, и, необязательно, кишечнорастворимое покрытие.
Наиболее предпочтительно, гранулы состоят из ядер, по существу состоящего из активного фармацевтического или нутрицевтического ингредиента, промотора проникновения, агента, промотирующего биодоступность, который повышает биодоступность активного ингредиента, разделяющий или синхронизирующий слой и кишечнорастворимое покрытие. Состав этой предпочтительной формы снижается до необходимых компонентов, создавая преимущество за счет снижения количества наполнителей, что всегда является преимуществом, поскольку снижаются риски взаимодействий с активным ингредиентом или возможная непереносимость пациента.
Предпочтительно, гранулы, частицы или ядра не содержат никакого или никакого существенного количества полимеров, проявляющих мукоадгезивные свойства. Существенным количеством полимера, проявляющего мукоадгезивные свойства, является приблизительно более чем 10 мас.% в готовом составе. Предпочтительно частицы не содержат никакого или никакого существенного количества мукоадгезивных полимеров, которые проявляют мукоадгезивные свойства ηb=150-1000, предпочтительно 150-600 мПа·с, и коэффициент поглощения воды от 10 до 750, предпочтительно 10-250, особенно предпочтительно 10-160% после 15 мин в диапазоне +/-0,5, предпочтительно +/-0,3 единиц pH по отношению к значению pH, при котором внешнее покрытие начинает растворяться. Предпочтительно частицы не содержат никакого или никакого существенного количества хитозана или (мет)акрилового сополимера, состоящего из 20-40 мас.% метилметакрилата и 60-80 мас.% метакриловой кислоты или карбоксиметилцеллюлозы натрия или сшитой и/или несшитой полиакриловой кислоты или лектина или альгината натрия или пектина.
Измерение мукоадгезивных свойств
Подходящий способ измерения для характеристики мукоадгезивных свойств описывается в статье Hassan and Gallo (1990) (см. Hassan E.E. and Gallo J.M. "A Simple Rheo logical Method for the in Vitro Assessment of Mucin-Polymer Bioadhesive Bond Strength" Pharma Res. 7(5), 491 (1990)). Способ основан на допущении, что вязкость (η, динамическая вязкость или коэффициент вязкости) смеси полимеров с муцином отличается от суммы вязкостей индивидуальных компонентов. Применяемая взаимосвязь выглядит как ηсмеси полимера с муцином=ηмуцина+ηполимера+ηb, где ηb означает различие. Чем выше г|ь, тем сильнее мукоадгезивные свойства. Вязкость индивидуальных компонентов вначале измеряется с помощью ротационного вискозиметра. Используются водный раствор с концентрацией 0.5%> (об./об.) мукоадгезивного полимера и раствор с концентрацией 15% желудочной слизи (муцина) свиньи. Чтобы определить мукоадгезивные свойства ηb, муцин и полимер измеряются отдельно и смешиваются в установленных концентрациях.
Гидратация и поглощение воды
Гидратация полимеров основывается на склонности полимера поглощать воду. Полимеры набухают благодаря этой способности поглощать воду. Это связано с отсутствием равновесия между химическим потенциалом воды в полимере и воды в окружающей среде. Вода поглощается благодаря осмотическому давлению полимера, пока не установится равновесие между внутренней и внешней фазой. Затем полимер становится гидратированным на 100%. Полимеры, имеющие низкий средний молекулярный вес, затем находятся в форме раствора. Гель получается с полимерами, имеющими высокий молекулярный вес, или со сшитыми полимерами. Поглощение воды, пока не установится равновесие, может быть, например, 10-кратным по сравнению с исходным весом, что будет соответствовать 1000% веса полимера.
Измерение коэффициента поглощения воды
Измерение коэффициента поглощения воды является известной методикой для специалиста в данной области техники. Подходящий способ описан, например, в издании Lehrbuch der pharmazeutischen Technologie/Rudolf Voigt, Basel: Verlag Chemie, 5th completely revised edition, 1984, page 151, 7.7.6 under "Aufsaugvermogen". Способ вынуждает использовать так называемый прибор Энслина, в котором стеклянный вакуумный фильтр-воронка связан через трубку с градуированной пипеткой. Пипетка находится точно горизонтально и таким образом, чтобы быть на том же уровне, что и стеклянная фритта. Коэффициент поглощения воды равный 100% определяется в данном случае как поглощение 1 мл воды на 1 г полимера, проявляющего мукоадгезивные свойства через 15 мин.
Ядро
Ядро содержит активный фармацевтический или нутрицевтический ингредиент, промотор проникновения и агент, промотирующий биодоступность, который повышает биодоступность активного ингредиента. Ядро может содержать дополнительные фармацевтически или нутрицевтически приемлемые наполнители, которые отличаются от активного фармацевтического или нутрицевтического ингредиента, промотора проникновения и агента, промотирующего биодоступность. Кроме того, ядро может необязательно содержать синхронизирующий слой.
Ядро может содержать нейтральную частицу ядра (нонпарель), на которую наносится активный фармацевтический или нутрицевтический ингредиент, промотор проникновения и агент, промотирующий биодоступность, например с помощью методик распыления, предпочтительно связанные связующим веществом, таким как, например, лактоза или поливинилпирролидон. Тем не менее предпочтительно ядро не содержит нейтральную частицу ядра (нонпарель).
Предпочтительно ядро содержит, по существу содержит или включает активный фармацевтический или нутрицевтический ингредиент, промотор проникновения и агент, промотирующий биодоступность. Предпочтительно ядро находится в форме сферической частицы, которая может быть получена известными способами, такими как экструзия из раствора, экструзия из расплава, вращательная агломерация или сферонизация. Ядро может содержать активный фармацевтический или нутрицевтический ингредиент, промотор проникновения и агент, промотирующий биодоступность, в форме матричной структуры или в форме слоистой структуры. Слоистая структура может генерироваться или наноситься с помощью известных методик нанесения покрытия распылением.
Активный фармацевтический или нутрицевтический ингредиент, промотор проникновения и агент, промотирующий биодоступность, могут быть смешаны вместе, образуя уникальную матричную структуру.
Ядро в сумме может содержать вплоть до 90, до 50, до 30, до 20, до 10 мас.% дополнительных наполнителей. Предпочтительно ядро не содержит значительного количества каких-либо других наполнителей.
Дополнительно ядро может содержать синхронизирующий слой.
Дополнительно ядро может быть покрыто полимерным кишечнорастворимым покрытием (оболочкой) для нацеленного высвобождения активного ингредиента в желудочно-кишечном тракте.
Дополнительно ядро может быть покрыто синхронизирующим слоем и полимерным покрытием для нацеленного высвобождения активного ингредиента в желудочно-кишечном тракте.
Ядро, покрытое или нет, дополнительно может быть покрыто быстрорастворимым внешний покрытием, содержащим связующее вещество, такое как сахар, и пигмент, например.
Особый подход Галена для анионных активных ингредиентов
В случае, когда активный фармацевтический или нутрицевтический ингредиент является анионным, а промотор проникновения является катионным, нежелательные взаимодействия, такие как осаждение или инактивация свойств промотора проникновения, могут произойти, когда вещества смешиваются вместе в количествах, которые приблизительно являются эквимолярными по отношению к их зарядам, или когда активный ингредиент находится в избытке относительно промотора проникновения.
Чтобы избежать таких нежелательных взаимодействий, активный фармацевтический или нутрицевтический ингредиент и промотор проникновения могут быть разделены в разные слои (слоистая структура ядра). Индивидуальные слои могут содержать дополнительные наполнители, которые отличаются от активного фармацевтического или нутрицевтического ингредиента, промотора проникновения и агента, промотирующего биодоступность, такие как связующие вещества, например поливинилпирролидон или лактоза, или полимеры, такие как целлюлозы или (мет)акриловые сополимеры.
Другим подходом избежать осаждения или инактивации свойств промотора проникновения может быть применение матричной структуры, но с добавлением наполнителей, которые ослабляют нежелательные ионные взаимодействия, такие как соли, как, например, хлорид натрия, хлорид калия, стеарат магния и т.п., амфифильные полимеры или связывающие водород неионные полимеры.
Таким образом, состав согласно изобретению может дополнительно характеризоваться тем, что активный ингредиент является анионным, а промотор проникновения является катионным, но ионных взаимодействий удается избежать за счет
- либо избыточного количества промотора проникновения в смеси обоих компонентов в одном и том же отделе состава;
- либо местного разделения обоих компонентов по разным отделам состава;
- либо добавления солей, амфифильных полимеров или связывающих водород неионных полимеров к смеси обоих компонентов в одном и том же отделе состава.
Термин «отделы состава» подразумевает ядро с гомогенной матричной структурой, содержащее активный ингредиент и промотор проникновения (смесь обоих компонентов в одном и том же отсеке) или ядро с активным ингредиентом и разделительным слоем, которое может содержать промотор проникновения или наоборот (локальное разделение в разных отделах).
Количества основных компонентов в готовом составе
Количество промотора проникновения в готовом составе, под которым подразумевается однодозовая лекарственная форма, готовая для приема, может варьировать от 1 до 60 мас.%, предпочтительно 10-40 мас.%.
Если промотор проникновения также является полимеров с мукоадгезивными свойствами, подобно хитозану, количество в готовом составе не должно превышать 10 мас.%, чтобы состав не стал мукоадгезивным. Таким образом, полимеры с мукоадгезивными свойствами, подобно хитозану, предпочтительно должны быть скомбинированы с промоторами проникновения без таких мукоадгезивных свойств, как, например, EUDRAGIT® Е, если количества более чем 10 мас.% промоторов проникновения необходимы, чтобы обеспечить достаточный эффект промоторов проникновения.
Следует подобрать определенное количество, чтобы получить предпочтительную конечную концентрацию в соответствующих физиологических жидкостях, например в 100 мл кишечного сока, между 0,1-2,5 мг/мл, предпочтительно 0,5-1 мг/мл. Это должно соответствовать трансэпителиальному электрическому сопротивлению (значение TEER) клеток Caco-2 в тест-системе in-vitro 50% или меньше, предпочтительно 40% или меньше, предпочтительно 30% или меньше, предпочтительно 20% или меньше, в присутствии промотора проникновения в концентрации 1 мг/мл после 30 мин, измеренному в эксперименте по изучению переноса, используя десмопрессин в качестве активного агента и монослойную культуру клеток Caco-2 в качестве барьера для переноса.
Количество агента, промотирующего биодоступность, в готовом составе, под которым подразумевается однодозовая лекарственная форма, готовая для приема, может быть в диапазоне от 0,1 до 10 мас.%, предпочтительно 0,5-5 мас.%, наиболее предпочтительно 1-2.5 мас.%. Следует подобрать определенное количество, чтобы получить предпочтительную конечную концентрацию в соответствующих физиологических жидкостях, например в 100 мл кишечного сока, между 0.004-0.1 мг/мл, предпочтительно 0,02-0,04 мг/мл. Это должно соответствовать росту пероральной биодоступности активного ингредиента по меньшей мере в 5 раз по сравнению с аналогичным составом без агента, промотирующего биодоступность.
Количество активного фармацевтического или нутрицевтического ингредиента в составе сильно варьируется в зависимости от терапевтически необходимого количества. В качестве примера, полное терапевтическое необходимое количество десмопрессина составляет около 200 мкг на дозированную форму, в то время как полное терапевтически необходимое количество гепарин может быть около 200 мг на лекарственную форму.
Активный фармацевтический или нутрицевтический ингредиент
Активный ингредиент может быть любым активным фармацевтическим или нутрицевтическим ингредиентом, которому необходима пероральная доставка. Предпочтительно, активный ингредиент принадлежит к классам III и IV БКС (Биофармацевтическая система классификации). Предпочтительно, активный ингредиент является молекулой биологического происхождения, например белком или пептидом, нуклеиновой кислотой, липидом или углеводом или природным или синтетическим производным этих веществ.
Активный ингредиент может быть белком или пептидом, имеющим средний молекулярный вес Mw меньше 3000 Да. Примеры таких пептидов включают в частности абареликс, ангиотензин II, анидулафунгин, антид, аргипрессин, азалин и азалин В, антагонист бомбезина, брадикинин, бусерелин, цетрореликс, циклоспорин А, десмопрессин, детиреликс, энцефалины (Leu-, Met-), ганиреликс, гонадорелин, гозерелин, гормон роста секретагог, микафунгин, нафарелин, лейпролид, лейпрорелин, октреотид, орнтид, окситоцин, рамореликс, секретин, соматотропин, терлипрессин, тетракозактид, тевереликс, трипторелин, тиролиберин, тиротропин, вазопрессин.
Активный ингредиент может быть белком или пептидом, имеющим средний молекулярный вес Mw от 3000 до 10000 Да. Примеры таких белков или пептидов в частности включают кальцитонин, кортикотропин, эндорфины, эпителиальный фактор роста, глюкагон, инсулин, новолин, паратиреоидный гормон, релаксин, про-соматостатин, секретин лосося.
Активный ингредиент может быть белком или пептидов, имеющим средний молекулярный вес Mw более 10000. Примеры таких белков или пептидов в частности включают интерфероны (альфа, бета, гамма), интерлейкины (IL1, IL2), соматотропин, эритропоэтин, фактор некроза опухоли (TNF альфа, бета), релаксин, эндорфин, дорназа альфа, фолликулостимулирующий гормон (FSH), хорионический гонадотропин человека (HCG), фактор высвобождения гормона роста человека (hGRF), лютенеизирующий гормон (LH) или эпидермальный фактор роста.
Активный ингредиент может быть десмопрессином или его производным, как, например, различные соли или ацетат десмопрессина или лактат десмопрессина.
Активный ингредиент может быть полисахаридом. Активный ингредиент может быть гепарином или его производным, как, например, нефракционированные гепарины или среднемолекулярные гепарины и низкомолекулярные гепарины или гепарины с очень низким молекулярным весом.
Активный ингредиент может быть нуклеиновой кислотой или ее производным, как, например, 5-фтор-урацил.
Примеры нутрицевтических активных ингредиентов включают витамины, необходимые жирные кислоты, ресвератрол из виноградных продуктов в качестве антиоксиданта, растворимые диетические продукты из волокон, такие как шелуха семян подорожника для снижения гиперхолистеринемии, брокколи (сульфан) в качестве консерванта развития рака, и соя или клевер (изофлавоноиды) для улучшения здоровья сосудов. Другими примерами активных нутрицевтических ингредиентов являются флавоноиды, антиоксиданты, альфа-линолевая кислота из льняного семени, бета-каротин из лепестков календулы или антоцианины из ягод.
Другими примерами активных нутрицевтических ингредиентов являются витамин и минералы, таурин, Омега-3, катехины зеленого чая, ко-энзим Q10, Алоэ вера, глюкозамин, хондроитин, белок молочной сыворотки, гуарана, гингко, гамма-аминомасляная кислота. Другие активные нутрицевтические ингредиенты могут быть выбраны из классов растительных, пробиотиков, пребиотиков, растительных стеролов и ферментов.
Классы III и IV БКС
Активный(-е) ингредиент(-ы) может (могут), например, принадлежать к классам III и IV БКС (Биофармацевтическая классификационная система согласно проф. Амидону; Amidon et al., Pharm. Res. 12, 413 - 420 (1995)) и/или из группы антиандрогенных, антидепрессивных, антидиабетических, антиревматических, глюкокортикоидов, цитостатических веществ, препаратов от мигрени, нейролептических веществ, антибиотиков, эстрогенов, витаминов, психотропных препаратов, ингибиторов АПФ, β-блокаторов, блокаторов кальциевых каналов, диуретиков, сердечных гликозидов, противосудорожных препаратов, диуретиков/противоглаукомных препаратов, урикостатиков, блокаторов H2-рецептора и виростатиков.
Фармацевтический или нутрицевтический состав содержит по меньшей мере один, обычно только один, активный ингредиент, но при необходимости также комбинации двух или более активных ингредиентов. Следовательно, присутствующий активный ингредиент может состоять из единственного активного ингредиента или при необходимости также из множества индивидуальных активных ингредиентов.
Класс III БКС - Низкая проницаемость, Высокая растворимость
Всасываемость ограничивается скоростью проникновения, но лекарственное средство сольватируется очень быстро.
Класс IV БКС - Низкая проницаемость, Низкая растворимость
Эти соединения характеризуются низкой биодоступностью. Обычно они всасываются через слизистую кишечника и от них ожидают высокого непостоянства.
Активный(-е) ингредиент(-ы) классов III и IV БКС предпочтительно имеет(-ют) проницаемость, которая меньше 90% от введенной дозы на основании расчета материального баланса или по сравнению с дозой, вводимой внутривенно. Проницаемость косвенно основана на степени всасывания лекарственного вещества в человеке и напрямую основана на измерении скоростей массопередачи через мембрану кишечника человека. В качестве альтернативного варианта, могут использоваться нечеловеческие системы, способные предугадывать степень всасывания лекарственного средства в человеке (такие как способы культивирования in-vitro). Лекарственное вещество считается обладающим высокой проницаемостью, когда степень всасывания в человеке определяется равной 90% или более от введенной дозы на основе расчета материального баланса или по сравнению с дозой, вводимой внутривенно.
Активные ингредиенты класса IV БКС могут иметь растворимость в деминерализованной воде равную 3.3 г/л или меньше. Активные ингредиенты класса III БКС имеют хорошую растворимость в воде. Активные ингредиенты класса IV БКС характеризуются низкой проницаемостью. Преимущества изобретения, таким образом, особенно проявляются в случае активных ингредиентов класса III БКС, поскольку проницаемость активного ингредиента здесь является единственным ограничением биодоступности. Тем не менее, повышенная проницаемость активного ингредиента также может быть полезной в случае активных ингредиентов класса IV БКС, для того чтобы достичь определенного улучшения биодоступности, по меньшей мере постепенно, несмотря на ограничение, заключающееся в слабой растворимости в воде этих активных ингредиентов.
Активным(и) ингредиентом(-ами) может(-гут) быть бикалутамид, анастрозол, албендазол, амитриптилин, артеметр, хлорпромазин, ципрофлоксацин, клофазимин, дапсон, дилоксанид, эфавиренз, фолиевая кислота, фуросемид, глибенкламид, гризеофульвин, галоперидол, ивермектин, ибупрофен, индинавир, лопинавир, люмефантрин, мебендазол, мефлохин, никлозамид, нелфинавир, нифедипин, нитрофурантоин, фенитоин, пирантел, пириметамин, ретинол, ритонавир, спиронолактон, сульфадиазин, сульфасалазин, сульфаметоксазол, триклабендазол, триметоприм, вальпроевая кислота, верапамил, варфарин, налидиксовая кислота, невирапин, празиквантел, рифампицин, глимипирид, нилутамид, бромокриптин, кетотифен, летрозол, наратриптан, ганцикловир, орлистат, мизопростол, гранисетрон, пиоглитазон, ламивудин, розиглитазон, зидовудин, эналаприл, атенолол, надолол, фелодипин, бепридил, дигоксин, дигитоксин, карбамазепин, ацетазоламид, аллопуринол, циметидин, ранитидин или окскарбазепин.
Растворимость в воде
Активные ингредиенты могут иметь растворимость в деминерализованной воде равную 3.3 г/л или меньше, предпочтительно 3.3 г/л или меньше, в частности 1,1 г/л или меньше.
Растворимость в воде для активного ингредиента можно определить согласно Немецкой фармакопее DAB 10 (Deutsches Arzneibuch [German Pharmacopoeia], 10th edition with 3rd revision 1994, Deutscher Apothekerverlag, Stuttgart and Govi Verlag, Frankfurt am Main, 2nd revision (1993), IV Allgemeine Vorschriften [IV General methods], p.5-6, "Loslichkeit und Losungsmittel" ["Solubility and solvents"]; см. также Ph. Eur. 4.07, 2004).
Ингибитор ферментативного разложения активного ингредиента
Когда активный ингредиент является молекулой биологического происхождения, например белком или пептидом, нуклеиновой кислотой, липидом или углеводом или природным или синтетическим производным этих веществ, может быть добавлен ингибитор, который предотвращает или снижает ферментативное разложение активного ингредиента, которое может происходить в условиях среды желудочно-кишечного тракта. Ингибитор отличается от агента, промотирующего биодоступность, и, следовательно, может быть добавлен дополнительно. Предпочтительно, такой ингибитор, который предотвращает или снижает ферментативное разложение активного ингредиента, должен быть более или менее специфический по отношению к активному ингредиенту биологического происхождения. Предпочтительно, ингибитор, который предотвращает или снижает ферментативное разложение активного ингредиента, должен быть фармацевтически приемлемым по отношению к конкретному применению на животных или людях. Термин «фармацевтически приемлемый» можно определить как получивший статус «общепризнан безопасным» (generally recognized as safe status, GRAS) или что-то, сопоставимое со статусом GRAS.
В случае, когда активный ингредиент является белком или пептидом, который, главным образом, является субстратом трипсина или химотрипсина, обычно нет нужды добавлять ингибитор протеолитических ферментов, поскольку промотор биодоступности уже является таким ингибитором. Однако не исключено, что другой протеолитический фермент может быть добавлен в случае, когда другие протеолитические ферменты являются ответственными за разложение, хотя предпочтительно, чтобы помимо промотора биодоступности не существовало никакого дополнительного ингибитора протеолитических ферментов, присутствующего в составе.
В случае, когда активным ингредиентом является нуклеиновая кислота, предпочтительно ДНК или РНК, ингибитором ферментативного разложения является ингибитор ДНК-азы или РНК-азы, предпочтительно ингибиторы ДНК-азы или РНК-азы из млекопитающих животных или человека.
В случае, когда активным ингредиентом является гликозидное вещество, предпочтительно сульфонированный или несульфонированный глюкозаминогликан, как, например, протеогликан, гепарин или гепарансульфат, ингибитором ферментативного разложения может быть ингибитор гепараназы (ЕС. 3.2.1.В2) или гепаринлиазы (ЕС. 4.2.2.7) или гепаринсульфатлиазы (ЕС. 4.2.2.8). Дополнительными ингибиторами могут быть ингибитор L-Идуронидазы (ЕС 3.2.1.76), N-сульфоглюкозамин-3-сульфатазы (ЕС 3.1.6.15), идуронат-2-сульфатазы (ЕС 3.1.6.13), гепаран-альфа-глюкозаминид N-ацетилтрансферазы (ЕС 2.3.1.78), альфа- и бета-амилазы (ЕС 3.2.1.1, ЕС 3.2.1.2), глюкан 1,4-альфа-глюкозидазы (ЕС 3.2.1.3), альфа,альфа-трехалазы (ЕС 3.2.1.28) или сахарозы альфа-глюкозидазы (ЕС 3.2.1.48).
Гепараназы (ЕС.3.2.1.В2) являются эндогенными ферментами, которые могут специфически отрезать гепарансульфатные цепочки с поверхности клетки и гепарансульфат-протеогликан базальной мембраны.
Примерами ингибитора ферментативного разложения гепараназы являются полифенолы, предпочтительно из групп стильбенов, флавоноидов, или антоцианов. Предпочтительным является ресвератрол (транс-3,4,5-тригидроксистильбен), который может быть выделенным, например, из Polygonum cuspidatum или из виноградного вина. Ингибирующий эффект ресвератрола по отношению к гепараназе был показан, например, в статье Ann et.al. (2006) Life Sciences 79, 1661-1665.
Промотор проникновения
Промотор проникновения в соответствии с настоящим изобретением понижает трансэпителиальное электрическое сопротивление (значений TEER) клеток Caco-2 в тест-системе in-vitro.
Предпочтительно Промотор проникновения в соответствии с настоящим изобретением может быть охарактеризован как тот, который снижает исходное значение TEER буферного раствора без промотора проникновения (100%) до 50% или меньше, предпочтительно 40% или меньше, предпочтительно 30% или меньше, предпочтительно 20% или меньше, в присутствии промотора проникновения в концентрации 1 мг/мл через 60 мин, измеренное в монослойной культуре клеток Caco-2 в качестве барьера для переноса. Способ исследования значений TEER в эксперименте по изучению переноса, использующий монослойную культуру клеток Caco-2, соответственно через барьер монослойной культуры клеток Caco-2 хорошо изучен и известен специалисту в данной области техники.
Во избежание сомнений внешние условия, применяемые в примере 12, могут быть изложены здесь: количество пассажей с клетками Caco-2 меньше чем 50; Возраст культуры 14-30 дней на фильтрах Transwell™; Значения TEER до и после переноса выше 200 Ω·cm2 (характеризует целостность и плотность монослоя клеток); коэффициент эффективной проницаемости (апикальный/базолатеральный и базолатеральный/апикальный (ab и ba)) слабопроницаемого маркера (Флуоресцеин) меньше чем 1·10-6 см·с-1 (характеризует пригодность модели для идентификации низкопроницаемого переноса, обеспечивает плотность монослоя клеток); Коэффициент эффективной проницаемости (ba) Родамина 123 выше чем 4·10-6 см·с-1 (характеризует заметную экспрессию P-гликопротеин); Коэффициент эффективной проницаемости (ab) пропранолола выше чем 5·10-6 см·с-1 (характеризует пригодность модели для идентификации высокопроницаемого переноса); буферы, которые могут быть использованы в экспериментах по изучению переноса для апикальной или базолатеральной стороны, представляют собой буфер HBSS (раствор Хэнкса) pH 6,5-7,4 для апикальной стороны и буфер HBSS pH 7,4 для базолатеральной стороны (pH регулируется индивидуально); Среда для культуры клеток: Dulbecco's Modified Eagle Medium (DMEM), предпочтительно с добавками неосновных аминокислот и сульфата гентамицина, известная из уровня техники.
Предпочтительно, промотором проникновения является полимерное вещество, или более предпочтительно, катионное полимерное вещество.
Предпочтительно, промотор проникновения может быть катионным (мет)акриловым сополимером, содержащим четвертичные аминогруппы.
Наиболее предпочтительно, промотор проникновения может быть сополимером, состоящим на 30-80 мас.% из C1-C4-алкильных сложных эфиров акриловой или метакриловой кислот, а на 70-20 мас.% из алкил(мет)акриловых мономеров, имеющих четвертичную аминогруппу в алкильном радикале.
Промоторами проникновения, которые могут быть исключены, в особенности, являются пластификаторы, такие как, например, триэтил цитрат, ацетил триэтил цитрат, диэтил себацинат, дибутил себацинат, полимеры, такие как карбомер, натрия карбоксиметилцеллюлоза, поликарбофил-цистеины, длинноцепочечные жирные кислоты, их сложные эфиры (например моно- и диглицериды) и их соли, такие как лауриновая кислота, лауринсульфоновая кислота, пальмитиновая кислота, каприловая кислота, каприновая кислота, олеиновая кислота, ацилкарнитины, хелатирующие агенты, такие как ЭДТУ, салицилаты, циклодекстрины, полиакриловые кислоты, желчные кислоты, такие как холевая кислота, холилтаурин, холилсаркозин, хенодезоксихолевая кислота и их соли, такие как холат натрия, гликохолат натрия, таурохолат натрия, тауродигидрофузидат антрия, гликодигидрофузидат натрия, поверхностно-активные вещества и эмульсификаторы, такие как, в особенности, додецилсульфат натрия (SDS), полисорбат 80 (Tween 80), полиэтоксилированного касторовое масло (Cremophor EL), токсин Zonula occludens toxin (ZOT), и витамин, такие как витамин E (токоферол) или витамин В12.
EUDRAGIT® Е
Катионный (мет)акриловый сополимер, содержащий четвертичные аминогруппы, может состоять полностью или частично из алкилакрилатов и/или алкилметакрилатов, имеющих четвертичную аминогруппу в алкильном радикале. Подходящие (мет)акриловые сополимеры известны, например, из патента ЕР 0058765 В1.
Катионный (мет)акриловый сополимер, содержащий четвертичные аминогрупп, может состоять, например, на 30-80 мас.% из свободнорадикально полимеризованных сложных C1-C4-алкильных эфиров акриловой кислоты или метакриловой кислоты, и на 70-20 мас.% из (мет)акриловых мономеров, имеющих четвертичную аминогруппу в алкильном радикале.
Подходящие мономеры с функциональными четвертичными аминогруппами подробно описаны в патенте US 4705695, колонка 3, строка 64 - колонка 4, строка 13. Следует особенно отметить диметиламиноэтил акрилат, 2-диметиламинопропил акрилат, диметиламинопропил метакрилат, диметиламинобензил акрилат, диметиламинобензил метакрилат, (3-метиламино-2,2-диметил)пропил акрилат, диметиламино-2,2-диметил)пропил метакрилат, (3-диэтиламино-2,2-диметил)пропил акрилат и диэтиламино-2,2-диметил)пропил метакрилат. Особое предпочтение отдается диметиламиноэтил метакрилату.
Содержание мономеров с четвертичными аминогруппами в сополимере преимущественно может быть между 20 и 70 мас.%, предпочтительно между 40 и 60 мас.%. Доля сложных C1-C4-алкильных эфиров акриловой кислоты или метакриловой кислоты составляет 70-30 мас.%. Следует особо отметить метил метакрилат, этил метакрилат, бутил метакрилат, метил акрилат, этил акрилат и бутил акрилат.
Подходящий (мет)акриловый сополимер с четвертичными аминогруппами может быть образован, например, на 20-30 мас.% из метил метакрилата, на 20-30 мас.% из бутил метакрилата и на 60-40 мас.% из диметиламиноэтил метакрилата.
Особенно подходящим коммерческим (мет)акриловым сополимером с четвертичными аминогруппами образован, например, на 25 мас.% из метил метакрилата, на 25 мас.% из бутил метакрилата и на 50 мас.% из диметиламиноэтил метакрилата (EUDRAGIT® Е100 или EUDRAGIT® Е РО (в форме порошка)). EUDRAGIT® Е100 и EUDRAGIT® Е РО являются водорастворимыми ниже приблизительно pH 5,0 и, таким образом, являются также растворимыми в желудочном соке.
Промотором проникновения может быть так называемый "амино метакриловый сополимер (USP/NF)", "основный бутилированный метакриловый сополимер (Ph. Eur)" или "аминоалкиловый метакриловый сополимер Е (JPE)", которые являются типа EUDRAGIT® Е.
Применение насыщенного углекислотой амино(мет)акрилового сополимера
Промотор проникновения, который является амино(мет)акриловым сополимером, катионным (мет)акриловым сополимеров, содержащим четвертичные аминогруппы, преимущественно может быть нанесен на ядро в форме водной среды, насыщенной углекислотой, например путем нанесения покрытия распылением. Таким образом, становится возможным добавлять промотор проникновения к состав ядер, которые могут иметь матричную структуру или слоистую структуру, благодаря чему промотор проникновения в матрице или в слое вокруг ядра не содержит никаких следов кислот.
Было обнаружено, что водная среда, насыщенная углекислотой, может использоваться для воплощения раствора или дисперсии амино(мет)акрилового сополимера. Было показано, что аминогруппы являются по меньшей мере частично нейтрализованной углекислотой/гидрокарбонатом, растворенным в водной фазе и, таким образом, амино(мет)акриловый сополимер становится по меньшей мере диспергированным, частично растворенным или даже полностью растворенным или находится в состоянии между указанных.
С насыщенной углекислотой водной средой, содержащей амино(мет)акриловый сополимер легко обращаться таким же образом, что и с растворами органических растворителей. Однако в этом случае удаляется не органический растворитель, а насыщенная углекислотой вода. Это означает, что высушенное покрытие, изготовленное из дисперсии или раствора, соответствующих настоящему изобретению, будет состоять более или менее из чистого амино(мет)акрилового полимера или сополимера, поскольку диоксид углерода удаляется с паром. Это поразительное преимущество перед водными дисперсиями, которые являются частично нейтрализованными твердыми или жидкими кислотами, где кислоты или другие наполнители всегда остаются в высушенном составе амино(мет)акрилового сополимера.
Таким образом, выгодно применять водную среду, содержащую амино(мет)акриловый сополимер, который является нерастворимым в деминерализованной воде, где содержание жидкой фазы в среде может составлять по меньшей мере 60 мас.%, а содержание твердых веществ - вплоть до 40 мас.%, содержащие амино(мет)акриловый сополимер, благодаря чему жидка фаза обогащается достаточным количеством диоксида углерода, что вынуждает амино(мет)акриловый сополимер присутствовать в растворенной форме в среде.
Агент, промотирующий биодоступность
Агент, промотирующий биодоступность, является фармацевтически приемлемым ингибитором протеолитических ферментов, который повышает пероральную биодоступность активного ингредиента по меньшей мере в пять раз по сравнению с аналогичным составом без агента, промотирующего биодоступность.
Агент, промотирующий биодоступность, является фармацевтически приемлемым ингибитором протеолитических ферментов, предпочтительно ингибитором трипсина и химотрипсина.
Агент, промотирующий биодоступность, может быть определен в пределах экспериментов по изучению ингибирования ферментов, описанных в примере 14. Таким образом, ингибитор протеолитических ферментов в соответствии с настоящим изобретением моет быть определен как такой ингибитор, который в концентрации, не превышающей 1 мг/мл, предотвращает исходное количество 20 мкг десмопрессина ацетата/мл раствора в буфере HBSS pH 6,5 при 37°С и времени инкубации 180 минут от снижения до менее чем 80% в присутствии раствора панкреатина с концентрацией 10 мг/мл.
Агент, промотирующий биодоступность, является фармацевтически приемлемым ингибитором протеолитических ферментов, предпочтительно ингибитором протеолитических ферментов млекопитающих, предпочтительно ингибитором протеолитических ферментов желудочно-кишечного тракта млекопитающих, который повышает биодоступность активного ингредиента в 5 раз, предпочтительно по меньшей мере в 6 раз, предпочтительно по меньшей мере в 7 раз, предпочтительно по меньшей мере в 8 раз, предпочтительно по меньшей мере в 9 раз, предпочтительно по меньшей мере в 10 раз, при этом рост биодоступности активного ингредиента измерялся in-vivo в виде относительной биодоступности по отношению к соответствующему или аналогичному составу, но без ингибитора протеолитических ферментов. Ингибиторы протеолитических ферментов включают ингибиторы пептидаз или протеиназ.
Агент, промотирующий биодоступность, отличает от промотора проникновения. Агент, промотирующий биодоступность, отличается от катионного (мет)акрилового сополимера, содержащего четвертичные аминогруппы.
Примеры ингибиторов фармацевтически приемлемых ингибиторов протеиназ включают антипаин, апротинин, бацитрацин, бензамидин, бестатин, химостатин, овоингибитор куриного яйца, хитозан-ЭДТУ конъюгаты, леупептин, пепстатин, соевый ингибитор трипсина, тиорфан, тозил-лизин хлорметилкетон, картофельный ингибитор карбоксипептидазы.
Предпочтительно ингибитор протеолитических ферментов является пептидом или белком. Предпочтительно ингибитор пептидазы или протеиназы является пептидом или белком с молекулярной массой (средняя молекулярная масса Mw) 3000-100000, предпочтительно 3000-10000 (г/моль).
Ингибитор протеолитических ферментов в соответствии с настоящим изобретением ингибирует протеолитическую активность пептидаз или протеиназ млекопитающих, таких как трипсин или химотрипсин человека. Ингибитор протеолитических ферментов может быть природным ферментом или его производным. Термин «производное природного фермента» означает его фрагменты или варианты. Фрагменты или варианты природного фермента доступны путем синтетической обработки или модификации генно-инженерными методами.
Предпочтительно ингибитор протеолитических ферментов происходит из растительного источника, такого как, например, соевые бобы, нут или бобы лимской фасоли. Типичными сырьем или источником, из которого может быть выделен ингибитор протеолитических ферментов, может быть соевая мука или соевые хлопья, нутовая мука, мука лимской фасоли или соевая сыворотка, изготовленная из промышленного соевого белкового концентрата или путем традиционных процессов обработки соевого белка.
Ингибитор Баумана-Бирка (BBI) является хорошо известным обозначением ингибитора протеолитических ферментов семейства стабильных низкомолекулярных ингибиторов трипсина и химотрипсина, обнаруженных в соевых бобах и других различных семенах, главным образом в семенах бобовых культур и источниках растительного происхождения. Ингибитор Баумана-Бирка (BBI) в соответствии с настоящим изобретением должен обозначать по меньшей мере один или более представителей семейства ингибиторов ферментов Баумана-Бирка.
Ингибитор протеолитических ферментов может быть ингибитором Баумана-Бирка или его производным. Ингибитор Баумана-Бирка предпочтительно может быть выделенным из соевых бобов полипептидом из 71 аминокислоты с разными ингибирующими сторонами для трипсина и химотрипсина. Ингибитор Баумана-Бирка может быть выделен известным способом из указанных выше растительных источников путем водной экстракции, аффинной хроматографии и последующей элюции. В качестве альтернативного варианта, ингибитор Баумана-Бирка является коммерчески доступным и поставляется разными компаниями.
Производное ингибитора Баумана-Бирка может быть его фрагментом или вариантом. Фрагменты или варианты доступны путем синтетической обработки или модификации методами генной инженерии. Термин «производное» в этом смысле является хорошо известным специалисту в данной области техники.
Массовая концентрация ингибитора протеолитических ферментов, предпочтительно, может быть 0,1-100 кратной, предпочтительно 0,5-50 кратной, предпочтительно 5-25 кратной по сравнению с массой активного ингредиента.
Таким образом, изобретение относится к применению агента, промотирующего биодоступность, который является фармацевтически приемлемым ингибитором протеолитических ферментов, в качестве наполнителя, который повышает пероральную биодоступность активного ингредиента состава, соответствующего настоящему изобретению.
Повышенная пероральная биодоступность
Агент, промотирующий биодоступность, является фармацевтически приемлемым ингибитором протеолитических ферментов, который повышает пероральную биодоступность активного ингредиента по меньшей мере в 5 раз, предпочтительно по меньшей мере в 6 раз, предпочтительно по меньшей мере в 7 раз, предпочтительно по меньшей мере в 8 раз, предпочтительно по меньшей мере в 9 раз, предпочтительно по меньшей мере в 10 раз.
Вычисление повышенной пероральной биодоступности
Термины «пероральная биодоступность» и «вычисление относительной пероральной биодоступности» хорошо известны специалисту в данной области техники.
Степень роста пероральной биодоступности активного ингредиента может быть вычислена путем деления уровня концентрации в крови испытуемой группы животных, выраженной как площадь под кривой концентрация-время (AUC0-∞ [пг/мл*мин]) после пероральной доставки состава, на соответствующий уровень концентрации в крови аналогичной испытуемой группы животных после пероральной доставки аналогичного состава без ингибитора протеолитических ферментов.
Испытуемая группа животных, конечно, должна быть представительной или, соответственно, статистически релевантной группой. Специалист в данной области техники знаком со статистикой. Таким образом, представительное или статистически релевантное количество испытуемых животных специалист в данной области техники может легко определить. Предпочтительным животным для экспериментов является минипиг (Gottingen). Представительная или статистически релевантная группа испытуемых минипигов может состоять, например, 8 животных (n=8).
Площадь под кривой концентрация-время (AUC0-∞ [пг/мл*мин]) из крови минипигов после пероральной доставки десмопрессина с составом согласно примеру 11 с ингибитором протеолитических ферментов составляет в примере 16 настоящего изобретения 53823 пг/мл*мин. Это сравнивается с AUC0-∞ аналогичного состава без ингибитора протеолитических ферментов (пример 10), где AUC0-∞ составляет 5155 пг/мл*мин. Таким образом, степень роста пероральной биодоступности составляет 53823/5155=10,44.
Кишечнорастворимое покрытие для нацеленного высвобождения активного ингредиента в желудочно-кишечном тракте
По меньшей мере ядра частиц или дозированная единица содержит полимерное покрытие для нацеленного высвобождения активного ингредиента в желудочно-кишечном тракте. Полимерное покрытие для нацеленного высвобождения активного ингредиента в желудочно-кишечном тракте является кишечнорастворимым покрытием, соответственно слоем кишечнорастворимого покрытия.
Слой кишечнорастворимого покрытия может содержать вплоть до 50, до 40, до 30, до 20, до 10 мас.% других наполнителей, таких как пластификаторы или скользящие вещества. Предпочтительно слой кишечнорастворимого покрытия не содержит значительных количеств любых других наполнителей.
Кишечнорастворимые покрытия хорошо известны специалисту в данной области техники. Кишечнорастворимые покрытия не растворимы в желудочном соке, но растворимы в кишечном соке. Устойчивость в желудке означает, что не более чем 10% активного ингредиента высвобождается в буфере с pH 1,2 в течение 120 мин. Растворимость в кишечном соке означает, что они растворяются при определенных значениях pH между 5.0 и 7,5 в зависимости от их химической природы в двенадцатиперстной кишке, тонкой кишке, подвздошной кишке или толстой кишке.
Полимерное покрытие для нацеленного высвобождения активного ингредиента в желудочно-кишечном тракте может содержать карбоксильные функциональные сополимеры, анионные полисахариды, целлюлозные полимеры, или анионные (мет)акриловые сополимеры. Подходящие карбоксильные функциональные полисахариды или целлюлозные полимеры могут быть выбраны из альгината натрия, карбоксиметилцеллюлозы и их солей (CMC, Na-CMC, Blanose, Tyiopur), карбоксиметилэтилцеллюлозы и их солей, ацетат фталат целлюлозы (CAP), ацетат сукцинат целлюлозы (CAS), ацетат тримеллитат целлюлозы (CAT), фталат гидроксипропилметилцеллюлозы (НРМСР, НР50, НР55), ацетат сукцинат гидроксипропилметилцеллюлозы (HPMCAS-LF, -MF, -HF).
Подходящими карбоксильными функциональными сополимерами являются виниловые сополимеры, содержащие структурные звенья, которые происходят от ненасыщенных карбоновых кислоты, отличных от акриловой кислоты и метакриловой кислоты, в качестве примера можно привести поливинилацетатфталат или сополимер винилацетата и кротоновой кислоты 9:1.
Анионный (мет)акриловый сополимер
Полимерным покрытием для нацеленного высвобождения активного ингредиента в желудочно-кишечном тракте предпочтительно является анионный (мет)акриловый сополимер. Анионные (мет)акриловые сополимеры также могут называться кишечнорастворимыми полимерами.
Анионный (мет)акриловый сополимер содержит 25-95, предпочтительно 40-95, в частности 60-40 мас.% свободнорадикально полимеризованных сложных C1-C4-алкильных эфиров акриловой или метакриловой кислоты и 75-5, предпочтительно 60-5, в частности 40-60 мас.% (мет)акриловых мономеров, имеющих анионную группу.
Указанные пропорции в сумме могут доходить до 100 мас.%. Тем не менее, также дополнительно возможно без приведения к ухудшению или изменению существенных свойств, что могут присутствовать небольшие количества в области 0-10, например 1-5 мас.% других мономомеров, способных к виниловой сополимеризации, такие как, например, гидроксиэтил метакрилат или гидроксиэтил акрилат. Однако, предпочтительно, что никаких таких дополнительных мономеров, способных к виниловой сополимеризации, не присутствует.
Сложные C1-C4-алкильные эфиры акриловой или метакриловой кислоты, в частности, представляют собой метил метакрилат, этил метакрилат, бутил метакрилат, метил акрилат, этил акрилат и бутил акрилат.
(Мет)акриловый мономер, имеющий анионную группу, в частности, представляет собой акриловую кислоту, предпочтительно метакриловую кислоту. Подходящими анионными (мет)акриловыми сополимерами являются те, которые состоят на 40-60 мас.% из метакриловой кислоты и на 60-40 мас.% из метил метакрилата или на 60-40 мас.% из этилакрилата (EUDRAGIT® L или EUDRAGIT® L 100-55).
EUDRAGIT® L является сополимером, состоящим на 50 мас.% из метил метакрилата и на 50 мас.% из метакриловой кислоты. Значение pH начала высвобождения конкретного активного ингредиента в кишечном соке или симулированной кишечной жидкости может быть установлено равным pH 6,0.
EUDRAGIT® L 100-55 является сополимером, состоящим на 50 мас.% из этил акрилата и на 50 мас.% из метакриловой кислоты. EUDRAGIT® L 30 D-55 является дисперсией, содержащей 30 мас.% EUDRAGIT® L 100-55. Значение pH начала высвобождения конкретного активного ингредиента в кишечном соке или симулированной кишечной жидкости может быть установлено равным pH 5,5.
Аналогичным образом, подходящими являются анионные (мет)акриловые сополимеры, состоящие на 20-40 мас.% из метакриловой кислоты и на 80-60 мас.% из метил метакрилата (EUDRAGIT® S). Значение pH начала высвобождения конкретного активного ингредиента в кишечном соке или симулированной кишечной жидкости может быть установлено равным pH 7,0.
Подходящими (мет)акриловыми сополимерами являются те, которые состоят на 10-30 мас.% из метил метакрилата, на 50-70 мас.% из метил акрилата и на 5-15 мас.% из метакриловой кислоты (EUDRAGIT® FS type). Значение pH начала высвобождения конкретного активного ингредиента в кишечном соке или симулированной кишечной жидкости может быть установлено равным pH 7,0.
EUDRAGIT® FS является сополимером, состоящим на 25 мас.% из метил метакрилата, на 65 мас.% из метил акрилата и на 10 мас.% из метакриловой кислоты. EUDRAGIT® FS 30 D является дисперсией, содержащей 30 мас.% EUDRAGIT® FS.
Дополнительно, подходящим является сополимер, состоящий
на 20-34 мас.% из метакриловой кислоты и/или акриловой кислоты,
на 20-69 мас.% из метил акрилата и
на 0-40 мас.% из этил акрилата и/или при необходимости
на 0-10 мас.% дополнительных мономеров, способных к виниловой сополимеризации,
при условии, что температура стеклования сополимера согласно ISO 11357-2, подраздел 3.3.3, не более чем 60°С. Этот (мет)акриловый сополимер является особенно подходящим для прессования гранул в таблетки из-за его хороших свойств удлинения к моменту разрыва.
Дополнительно, подходящим является сополимер, состоящий
на 20-33 мас.% из метакриловой кислоты и/или акриловой кислоты,
на 5-30 мас.% из метил акрилата и
на 20-40 мас.% из этил акрилата и
на более чем 10-30 мас.% из бутил метакрилата и при необходимости
на 0-10 мас.% из дополнительных мономеров, способных к виниловой сополимеризации,
где содержание мономеров в сумме достигает 100 мас.%,
при условии, что температура стеклования сополимера согласно ISO 11357-2, подраздел 3.3.3 (температуры в средней точке Tmg), составляет 55-70°С. Сополимеры этого типа являются особенно подходящими для прессования гранул в таблетки из-за его хороших свойств удлинения к моменту разрыва.
Указанный выше сополимер, в частности, состоит из свободнорадикально полимеризованных звеньев
на 20-33, предпочтительно на 25-32, особенно предпочтительно на 28-31 мас.% из метакриловой кислоты или акриловой кислоты, предпочтительно метакриловой кислоты,
на 5-30, предпочтительно на 10-28, особенно предпочтительно на 15-25 мас.% метил акрилата,
на 20-40, предпочтительно на 25-35, особенно предпочтительно на 18-22 мас.% из этилакрилата, и
на более чем 10-30, предпочтительно на 15-25, особенно предпочтительно на 18-22 мас.% из бутил метакрилата, где состав мономеров подбирается таким образом, чтобы температура стеклования сополимера была от 55 до 70°С, предпочтительно 59-66, особенно предпочтительно 60-65°С.
Термин «температура стеклования» в этом контексте означает, в частности, температуру в средней точке Tmg согласно ISO 1 1357-2, подраздел 3.3.3. Измерение происходит без добавления пластификатора, с содержанием остаточных мономеров (REMO) равным менее чем 100 част./млн, со скоростью нагревания 10°С/мин и в атмосфере азота.
Сополимер предпочтительно состоит по существу или исключительно из 90, 95 или 99-100 мас.% мономеров метакриловой кислоты, метил акрилата, этил акрилата и бутил метакрилата в интервалах содержаний, указанных выше.
Однако, возможно, без того чтобы обязательно привести к ухудшению важных свойств, что дополнительно присутствуют небольшие количества в диапазоне от 0 до 10, например 1-5 мас.% дополнительных мономеров, способных к виниловой сополимеризации, такие как, например, метил метакрилат, бутил акрилат, гидроксиэтил метакрилат, винилпирролидон, винилмалоновая кислота, стирол, виниловый спирт, винил ацетат и/или их производные.
Получение анионных (мет)акриловых сополимеров
Анионные (мет)акриловые сополимеры могут быть получены способом, известным по существу, - свободнорадикальной полимеризацией мономеров (см., например, заявки ЕР 0704207 А2 и ЕР 0704208 А2). Сополимер согласно настоящему изобретению может быть получен способом, известным по существу, - свободнорадикальной эмульсионной полимеризацией в водной фазе в присутствии, предпочтительно, анионных эмульсификаторов, например способом, описанным в патенте DE-C2135073.
Сополимер может быть получен традиционными процессами свободнорадикальной полимеризации, непрерывно или с перерывами (партиями) в присутствии инициаторов, формирующих свободные радикалы, и, при необходимости, регуляторов молекулярной массы неразбавленной, в растворе, путем гранульной полимеризации или в растворе. Средняя молекулярная масса Mw (средняя масса, вычисленная, например, путем измерения вязкости раствора), например, может быть в диапазоне от 80000 до 1000000 (г/моль). Предпочтительной является эмульсионная полимеризация в водной фазе в присутствии водорастворимых инициаторов и (предпочтительно анионных) эмульсификаторов.
В случае полимеризации в массе сополимер может быть получен в твердой форме путем измельчения, экструзии, грануляции или нарезания при нагревании.
(Мет)акриловые сополимеры получают способом, известным по существу, - свободнорадикальной полимеризацией в массе, в растворе, гранульной или эмульсионной полимеризацией. Им необходимо придать до обработки размер частиц в диапазоне согласно изобретения с помощью подходящего способа - измельчения, сушка или распыление. Это можно осуществить путем простого дробления экструдированных и охлажденных гранул или нарезания при нагревании.
Применение порошков может быть выгодным, особенно в смеси с другими порошками или жидкостями. Подходящие аппараты для получения порошков известны специалисту в данной области техники, например воздухоструйные мельницы, штифтовые дисковые мельницы, многокамерные мельницы. При необходимости возможно включать приемлемые стадии просеивания. Подходящей мельницей для обработки больших промышленных объемов является, например, струйная противоточная мельница (Multi No. 4200), работающая под давлением около 6 бар.
Частичная нейтрализация
Основания, подходящие для целей настоящего изобретения, описываются в заявке ЕР 0088951 А2 или международной заявке WO 2004/096185 или их производные. Другими подходящими основаниями для нейтрализации являются раствор гидроксида натрия, раствора гидроксида калия (КОН), гидроксид аммония или органические основания, такие как, например, триэтаноламин, карбонат натрия, карбонат калия, бикарбонат натрия, фосфат тринатрия, цитрат тринатрия или аммония или физиологически допустимые амины, такие как триэтаноламин или трис(гидроксиметил)аминометан.
Другие подходящими катионными, органическими основаниями являются основные аминокислоты гистидин, аргинин и/или лизин.
Регулирование степени частичной нейтрализации смесями
Смеси также могут привести к техническим преимуществам при регулировании степени частичной нейтрализации. В предпочтительном варианте осуществления изобретения для внутреннего покрытия применяются смеси анионных (мет)акриловых сополимеров, различающихся по степени частичной нейтрализации, состоящие из свободнорадикально полимеризованных звеньев: 25-95 мас.% сложных C1-C4-алкильных эфиров акриловой или метакриловой кислоты и 5-75 мас.% (мет)акриловых мономеров, имеющих анионную группу, где 1-80% содержащихся анионных групп, что вычисляется как среднее по смеси, нейтрализованы основанием. Возможно, например, смешать анионный (мет)акриловый сополимер, который не является частично нейтрализованным и состоит из свободнорадикально полимеризованных звеньев: 25-95 мас.% сложных C1-C4-алкильных эфиров акриловой или метакриловой кислоты и 5-75 мас.% (мет)акриловых мономеров, имеющих анионную группу, с частично нейтрализованным (мет)акриловым сополимером с таким же составом мономеров внутри установленных интервалов количеств, так что 1-80% содержащихся анионных групп, что вычисляется как среднее по смеси, являются нейтрализованными. Смесь может быть получена, например, путем примешивания порошка, который был получен из дисперсии частично нейтрализованного анионного (мет)акрилового сополимера, например путем распылительной сушки или сублимационной сушки, в дисперсию анионного (мет)акрилового сополимера, который не был частично нейтрализован.
Синхронизирующий слой как часть ядра
Необязательный синхронизирующий слой (слой под покрытием) может быть добавлен к ядру. Слой имеет функцию синхронизации растворения активного ингредиента и агента, промотирующего биодоступность. Синхронизирующий слой можно назвать также слоем под покрытием или разделительным слоем.
Слой под покрытием может иметь функцию разделять вещества ядра от веществ кишечнорастворимого покрытия, которые могут быть несовместимыми друг с другом. Особенно, когда промотор проникновения в ядре является катионным (мет)акриловым сополимером, содержащим четвертичные аминогруппы, а внешнее кишечнорастворимое покрытие является анионным целлюлозным полимером или анионным (мет)акриловым сополимером, могут происходить нежелательные взаимодействия, которых можно избежать добавлением слоя под покрытием. Слой под покрытием не имеет по существу влияния на характеристики высвобождения. Слой под покрытием, предпочтительно, является по существу водорастворимым, например он может состоять из веществ, подобных гидроксипропилметилцеллюлозе (НРМС) в качестве пленкообразователя. Средняя толщина слоя под покрытием является очень тонкой, например не более 50 мкм, предпочтительно не более 30 мкм.
Слой под покрытием может содержать по меньшей мере 50 мас.% гидроксипропилметилцеллюлозы.
Слой под покрытием может содержать до 90 мас.%, предпочтительно до 50 мас.%, от полного количества агента, промотирующего биодоступность, в составе. Если молекулярная масса активного ингредиента ниже или намного ниже, чем молекулярная масса агента, промотирующего биодоступность, активный ингредиент может диффундировать быстрее из вещества ядра, чем агент, промотирующий биодоступность. В этом случае активный ингредиент может достигать целевых клеток не будучи сопровождаемым агентом, промотирующим биодоступность. Таким образом, желательный эффект может не достигаться, что случилось бы, если бы оба вещества достигли клеток вместе. Следовательно, слой под покрытием, предпочтительно, может содержать до 90 мас.%, предпочтительно до 50 мас.%, агента, промотирующего биодоступность, соответственно ингибитора протеолитических ферментов. Это обеспечивает преимущество, заключающееся в том, что до высвобождения активного ингредиента из ядра по меньшей мере небольшое количество агента, промотирующего биодоступность, из быстро растворимого слоя под покрытием может быть уже на пути к целевым клеткам. Это помогает синхронизировать высвобождение активного ингредиента и агента, промотирующего биодоступность (синхронизирующий слой).
В другом случае слой под покрытием может содержать до 20% активного ингредиента. Если молекулярная масса активного ингредиента выше или намного выше чем молекулярная масса ингибитора пептидазы или протеиназы, активный ингредиент может диффундировать медленнее из вещества ядра, чем ингибитор пептидазы или протеиназы. В этом случае ингибитор пептидазы или протеиназы может достигать целевых клеток не будучи сопровождаемым активным ингредиентом. Таким образом, желательный эффект может не достигаться, что случилось бы, если бы оба вещества достигли клеток вместе. Следовательно, слой под покрытием, предпочтительно, может содержать до 20% активного ингредиента. Это обеспечивает преимущество, заключающееся в том, что до высвобождения ингибитора пептидазы или протеиназы из ядра по меньшей мере определенное количество активного ингредиента из быстро растворимого слоя под покрытием может быть уже на пути к целевым клеткам. Это помогает синхронизировать активный ингредиент и ингибитор пептидазы или протеиназы (синхронизирующий слой).
Синхронизирующий слой, если он присутствует, может содержать вплоть до 50, до 40, до 30, до 20, до 10 мас.% других наполнителей. Предпочтительно синхронизирующий слой не содержит значительных количеств любых других наполнителей.
Получение фармацевтических форм, состоящих из множества частиц
Ядра гранул, содержащие активное вещество, могут обрабатываться с помощью фармацевтически приемлемых наполнителей и способом, известным по существу для фармацевтических форм, состоящих из множества частиц, в частности для содержащих гранулы таблеток, минитаблеток, капсул, суше или порошков для преобразования, которые составлены таким образом, что содержащиеся гранулы высвобождаются в интервале pH желудка. Препарат как фармацевтическая форма, состоящая из множества частиц, показывает высокую надежность дозировки и предлагает преимущество однородного распределения гранул в полости кишечника. Фармацевтическая форма, состоящая из множества частиц, соответствующая настоящему изобретению, может дополнительно содержать различные типы гранулы с различными активными веществами и/или различной структурой гранул.
Прессованные таблетки
Получение фармацевтических форм, состоящих из множества частиц, путем прессования фармацевтически приемлемого связующего вещества с частицами, содержащими активный ингредиент, описывается, например, в статье Beckert et al. (1996), "Compression of enteric-coated pellets to disintegrating tablets", International Journal of Pharmaceutics 143, pp.13-23, и в международной заявке WO 96/01624.
Пленочные покрытия на гранулах, содержащих активное вещество, обычно наносятся в аппаратах с псевдоожиженным слоем. Примеры состава описываются в данном описании. Пленкообразователи обычно смешиваются с пластификаторами и разделительными веществами с помощью подходящего способа. Возможно, в этом случае Пленкообразователи будут находиться в форме раствора или суспензии. Наполнители для образования пленки аналогичным образом могут быть растворенными или суспендированными. Могут использоваться органические или водные растворители или диспергирующие агенты. Дополнительно могут использоваться стабилизаторы для стабилизации дисперсии (например: Tween 80 или другие подходящие эмульсификаторы или стабилизаторы).
Примеры разделительных веществ включают моностеарат глицерина или другие подходящие производные жирных кислот, производные диоксида кремния или тальк. Примеры пластификаторов включают пропиленгликоль, фталаты, полиэтиленгликоли, себацинаты или цитраты, и другие вещества, описываемые в литературе.
Смеси для получения таблеток, состоящих из покрытых частиц, готовятся смешиванием гранул с подходящими связующими агентами для таблетирования, при необходимости с добавлением веществ, промотирующих распад таблетки, и при необходимости с добавлением смазывающих веществ. Смешивание может происходить в подходящих машинах. Неподходящими смесителями являются те, которые приводят к повреждению покрытых частиц, например плужные смесители. Чтобы достигнуть подходящего короткого времени распада, может быть необходимо добавить в покрытые частицы наполнители в определенной последовательности. Это возможно сделать путем предварительного перемешивания с покрытыми частицами смазывающего вещества или разделительного агента стеарата магния для высвобождения из формы, чтобы их поверхность стала гидрофобной и, таким образом, можно было бы избежать адгезии.
Смеси, подходящие для таблетирования, обычно содержат 3-15 мас.% вещества, улучшающего распадаемость, например Kollidon CL, и, например, 0,1-1 мас.% смазывающего и раздельного вещества, такого как магния стеарат. Доля связующего вещества определяется на основании требуемого содержании покрытых частиц.
Примеры типичных связующих веществ включают Cellactose®, микрокристаллическую целлюлозу, фосфаты кальция, Ludipress®, лактозу или другие подходящие сахара, сульфаты кальция или производные крахмала. Предпочтительными являются вещества низкой объемной плотности.
Типичными веществами, улучшающими распадаемость (дезинтеграторами), являются сшитые производные крахмала или производные целлюлозы, и сшитый поливинилпирролидон. Аналогично, подходящими являются производные целлюлозы. Можно обойтись без применения веществ, улучшающих распадаемость, за счет выбора подходящего связующего вещества.
Типичными смазывающими веществами и разделительными веществами, способствующими высвобождению из форму, являются магния стеараты или другие подходящие соли жирных кислот или вещества, подробно описанные в литературе как подходящие для этих целей (например лауриновая кислота, кальция стеарат, тальк и т.д.). Можно обойтись без применения в смеси смазывающего вещества и разделительного вещества, способствующего высвобождению из формы, при применения подходящих машин (например таблеточного пресса с внешней смазкой) или подходящих составов.
Можно, где это уместно, добавлять к смеси вещество для улучшения текучести (например коллоидные производные диоксида кремния, тальк, и т.д.).
Таблетирование может происходить в обычных таблеточных прессах, эксцентриковых или ротационных таблеточных прессах, с сжимающей силой в диапазоне от 5 до 40 кН, предпочтительно 10-20 кН. Таблеточные прессы могут быть снабжены системами внешнего смазывания. При необходимости используются специальные системы для заполнения пресс-формы, которые позволяют избежать заполнения пресс-формы с помощью лопастных гребков.
Другие фармацевтически формы, состоящие из множества частиц
В качестве альтернативы для прессованных таблеток или минитаблеток, также возможно покрытые гранулы, содержащие активное вещество, облекать в форму любой другой перорально вводимой формы, состоящей из множества частиц. Покрытые гранулы, например, могут быть упакованы в капсулы, например желатиновые капсулы, или составлены в подходящую рецептуру для саше или преобразуемых порошков.
Применение
Кроме того, изобретение относится к применению агента, промотирующего биодоступность, который является фармацевтически приемлемым ингибитором протеолитических ферментов, в качестве наполнителя, который повышает пероральную биодоступность активного ингредиента в составе, соответствующем настоящему изобретению. Фармацевтический или нутрицевтический состав, соответствующий настоящему изобретению, может быть применен для человека или животного.
Нутрицевтические активные ингредиенты
Нутрицевтические активные ингредиенты могут быть охарактеризованы как экстракты из пищи, заявленные как имеющие медицинские эффекты для здоровья человека. Нутрицевтический активный ингредиент обычно содержится в лекарственной форме, такой как капсула, таблетка или порошок в заявленной дозировке. Примеры нутрицевтических активных ингредиентов включают ресвератрол из виноградных продуктов в качестве антиоксиданта, растворимые диетические продукты из волокон, такие как шелуха семян подорожника для снижения гиперхолестеринемии, брокколи (сульфан) в качестве консерватора развития рака, и соя или клевер (изофлавоноиды) для улучшения здоровья сосудов. Другие примеры нутрицевтических активных ингредиентов включают флавоноиды, антиоксиданты, альфа-линолевая кислота из льняного семени, бета-каротин из лепестков календулы или антоцианины из ягод. Иногда выражение «нутрицевтики» ("neutraceuticals") используется как синоним «нутрицевтических ингредиентов» ("nutraceuticals").
Наполнители
Ядро, необязательно синхронизирующий слой и кишечнорастворимое покрытие могут помимо их основных компонентов включать другие наполнители, которые отличаются от основных компонентов. Основные компоненты представляют собой активный фармацевтический или нутрицевтический ингредиент, промотор проникновения, агент, промотирующий биодоступность, и полимерное покрытие для нацеленного высвобождения активного ингредиента в желудочно-кишечном тракте. В случае синхронизирующего слоя это, конечно, важно, чтобы слой формировался, предпочтительно, водорастворимым пленкообразующим полимеров с содержанием либо активного фармацевтического, либо нутрицевтического ингредиента, либо агента, промотирующего биодоступность.
Ядро без необязательного синхронизирующего слоя может содержать вплоть до 50, до 40, до 30, до 20, до 10 мас.% других наполнителей. Предпочтительно, ядро не содержит значительных количеств любых других наполнителей.
Синхронизирующий слой, если он имеется, может содержать вплоть до 50, до 40, до 30, до 20, до 10 мас.% других наполнителей. Предпочтительно, синхронизирующий слой не содержит значительных количеств любых других наполнителей.
Слой кишечнорастворимого покрытия может содержать вплоть до 50, до 40, до 30, до 20, до 10 мас.% других наполнителей. Предпочтительно, слой кишечнорастворимого покрытия не содержит значительных количеств любых других наполнителей.
Фармацевтические или нутрицевтические наполнители хорошо известны специалисту в данной области техники.
Фармацевтические или нутрицевтические наполнители могут содержаться для практических целей, например, чтобы избежать слипания или добавить цвета. Тем не менее, эти наполнители обычно не привносят или не дают никакого или почти никакого эффекта на само изобретение, заявленное здесь. Они могут применяться в качестве адъювантов обработки и предназначены для обеспечения надежного и воспроизводимого процесса получения, также как и хорошей стабильности при длительном хранении, или благодаря им фармацевтическая форма получает дополнительные выгодные свойства.
Подходящими наполнителями могут быть антиоксиданты, полировочные вещества, связывающие вещества, вкусовые вещества, вещества, повышающие текучесть, ароматизаторы, скользящие вещества, агенты, промотирующие проникновение, пигменты, пластификаторы, полимеры, вещества, формирующие поры, или стабилизаторы. Все используемые вещества, конечно, должны быть токсикологически безопасными и применяемыми в фармацевтических или нутрицевтических препаратах без риска для пациентов.
Пластификаторы
Пластификаторы за счет физического взаимодействия с полимером обеспечивают снижение температуры стеклования и промотируют образование пленки в зависимости от добавленного количества. Подходящие вещества обычно имеют молекулярную массу между 100 и 20000 и одну или более гидрофильных групп в молекуле, например гидроксильные, сложноэфирные или аминогруппы.
Примеры подходящих пластификаторов включают алкил цитраты, сложные эфиры глицерина, алкил фталаты, алкил себацинаты, сложные эфиры сахаров, сложные эфиры сорбита, диэтил себацинат, дибутил себацинат, пропиленгликоль и полиэтиленгликоли 200-12000. Предпочтительными пластификаторами являются триэтил цитрат (ТЕС), ацетил триэтил цитрат (АТЕС), диэтил себацинат и дибутил себацинат (DBS). Дополнительно следует отметить сложные эфиры, которые при комнатной температуре являются жидкостями, такие как цитраты, фталаты, себацинаты или касторовое масло. Сложные эфиры лимонной кислоты и себациновой кислоты являются предпочтительными.
Добавление пластификаторов к составу можно осуществить известным способом, напрямую, в водном растворе или после предварительной термической обработки смеси. Также можно использовать смеси пластификаторов.
Скользящие вещества / Разделительные вещества / Вещества для уменьшения липкости:
Скользящие вещества, разделительные вещества или вещества для уменьшения липкости обычно обладают липофильными свойствами и обычно добавляются в распыляемые суспензии. Они могут быть добавлены в состав ядра или в кишечнорастворимое покрытие. Они предотвращают агломерацию ядре в ходе образования пленки или агломерацию покрытых гранул. Примеры включают тальк, Mg- или Ca-стеарат, измельченный диоксид кремния, каолин или неионные эмульсификаторы со значением ГЛБ между 2 и 8. Стандартные пропорции для применения скользящих веществ в покрытии, соответствующем настоящему изобретению, и связывающих веществ варьируются между 0,5 и 70 мас.% по отношению к весу ядер или по отношению к весу кишечнорастворимого покрытия.
Расчет данных
Подсчеты проводились, используя электронных таблиц MS Excel.
Коэффициент эффективной проницаемости (Papp)
Papp рассчитывали согласно ур.1.
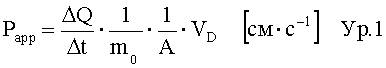
∆Q/∆t скорость проницаемости (скорость переноса в спокойном состоянии), полученная из профиля перенесенного количества субстрата во времени [мкг или dpm в секунду]. Вычисляется с помощью линейной регрессии времени и концентрации
A площадь экспонированного монослоя клеток [см2]
m0 исходная масса тестируемого соединения в донорной зоне [мкг или dpm]
VD объем буфера донорной зоны [см3]
Трансэпителиальное электрическое сопротивление (TEER)
Значение TEER подсчитывали согласно Ур.2.
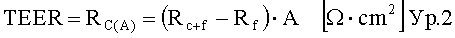
Rc(A) электрическое сопротивление монослоя площадью A [Ω·cm2]
Rc+f электрическое сопротивление монослоя, включая вкладыш [Ω]
Rf электрическое сопротивление вкладыша без клеток [Ω]
A площадь монослоя [см2]
Электрическое сопротивление вкладыша без клеток площадью 1,13 см2 составляет 100 Ω.
Приток
Приток вычисляли согласно Ур.3.
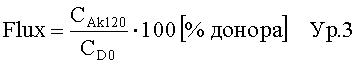
CAk120 Концентрация API [мкг·мл-1] в акцепторе через 120 мин
CD0 Концентрация API [мкг·мл-1] в доноре в момент начала эксперимента (0 мин)
Примеры
Материалы
EUDRAGIT® Е является сополимером, состоящим на 25 мас.% из метил метакрилата, на 25 мас.% из бутил метакрилата и на 50 мас.% из диметиламиноэтил метакрилата.
EUDRAGIT® Е РО является порошковой формой EUDRAGIT® E со средним размером частиц около 15 мкм.
EUDRAGIT® L 30 D-55 является дисперсией, содержащей 30 мас.% EUDRAGIT®L 100-55.
EUDRAGIT® 100-55 является сополимером, состоящим на 50 мас.% из этилакрилата и на 50 мас.% из метакриловой кислоты.
Minirin® является коммерчески доступным лекарственным препаратом в форме таблеток, содержащим ацетат десмопрессина. Одна таблетка Minirin® весит 200 мг и номинально содержит 200 мкг десмопрессина.
Использовался ингибитор Баумана-Бирка (BBI) из соевых бобов (Sigma Aldrich, Germany)
Гепарин: Низкомолекулярный гепарин (LMW-Heparine); Fraxiparin(TM) (Надропарин кальция); Glaxo Smith Kline
Получение. Примеры 1-11
Пример 1
Для примера 1 в качестве препарата десмопрессина использовались коммерчески доступные таблетки, содержащие десмопрессин (Minirin®).
Испытуемый состав Minirin был получен путем смешивания одной таблетки Minirin® с Cellets (гранулы микрокристаллической целлюлозы), чтобы получить вес, равный другим составам десмопрессина.
Одна таблетка Minirin® (200 мг, содержащая номинальное количество 200 мкг десмопрессина) была разрезана пополам. Эти два куска перемешивались с Cellets® 500 (гранулы микрокристаллической целлюлозы), достигая суммарного веса 350 мг.
Пример 2
Получение гранул десмопрессина и EUDRAGIT® Е РО в качестве промотора проникновения
Состав примера 2 был получен в две стадии. Первая стадия представляет собой получение раствора для распыления покрытия. Вторая стадия представляет собой нанесение раствора для распыления покрытия путем распыления покрытия. В этом случае были получены гранулы EUDRAGIT® Е / десмопрессин с размером частиц 400-710 мкм.
Получение раствора для распыления
83 г EUDRAGIT® Е РО добавили в 1000 мл-вый стеклянный стакан. В ходе механического перемешивания при 700 об/мин полное количество 1N HCl и 90% полного количества воды добавили в полимерную суспензию. После постоянного перемешивания в течение 10 мин, в дисперсию добавили 8,3 г Tween® 80. Прозрачный раствор средней вязкости и легким ценообразованием получили после дополнительного перемешивания в течение 1 ч при 850 об/мин. После фильтрации HCl-нейтрализованного EUDRAGIT® Е РО раствора через 0,315 мм-вую проволочную сетку был добавлен раствор десмопрессина. Суммарный раствор перемешивался дополнительные 10 мин для получения однородной смеси.
Получение гранул десмопрессин/EUDRAGIT® Е РО путем распыления покрытия
Исходным материалом для получения ядер десмопрессин/EUDRAGIT® Е РО были 50 г фракции нонпарель гранул сахара размером 250-355 мкм. На них 591,3 мл HCl-нейтрализованного раствора EUDRAGIT® EPO, содержащего десмопрессин, был нанесен путем распыления покрытия.
Вкратце, способ осуществляли следующим образом:
Воздух подавался при 35-51°С и температура продукта поддерживалась на значении 29-35°С. Распыление начиналось со скорости 0,3-2,5 г раствора/мин и поток воздуха поддерживался на значении от 16 до 20 м3/ч. Процесс распыления останавливался через 327 мин. В конце гранулы сушились в машине в течение 10 мин и просеивались через 710 мкм-вое сито. Финальный выход составил 139,77 г, что соответствует 95% от теоретического веса.
Пример 3
Получение гранул десмопрессина. EUDRAGIT® Е РО в качестве промотора проникновения и ингибитора Баумана-Бирка (BBI)
Состав примера 3 был получен в две стадии. Первая стадия представляет собой получение раствора для распыления покрытия. Вторая стадия представляет собой нанесение раствора для нанесения покрытия путем нанесения покрытия. В этом случае были получены гранулы EUDRAGIT® Е / десмопрессин / BBI с размером частиц 400-710 мкм.
Получение раствора для распыления
189.9 г EUDRAGIT® Е РО добавили в 1000 мл-вый стеклянный стакан. При механическом перемешивании при 600 об/мин, к полимеру добавили 16,31 г додецилсульфата натрия, растворенного в 60% полного количества воды. После постоянного перемешивания в течение 10 мин, в стакан медленно добавили 182,7 г раствора уксусной кислоты 10%, чтобы избежать коагуляции полимера. 30 мин спустя в смесь добавили полное количество расплавленной каприновой кислоты. Прозрачный раствор средней вязкости и легким пенообразованием получили после дополнительного перемешивания в течение 2 ч при 850 об/мин. 25.31 г ингибитора Баумана-Бирка (BBI) и оставшееся количество додецилсульфата натрия растворили в 190,4 г воды, используя 250 мл-вый стеклянный сосуд, и добавили в раствора полимера при перемешивании. Десмопрессин растворили в 10% оставшейся воды, используя 50 мл-вый стеклянный стакан. После фильтрации нейтрализованного EUDRAGIT® Е РО раствора через 0,315 мм-вую проволочную сетку добавили десмопрессин. Суммарный раствор перемешивали дополнительные 10 мин, чтобы достичь гомогенности смеси.
Получение гранул десмопрессин/EUDRAGIT® Е PO/BBI путем нанесения покрытия распылением
Исходным материалом для получения ядер десмопрессин/EUDRAGIT® Е PO/BBI были 50 г нон-парель гранул сахара размером 250-355 мкм.
Способ осуществляли следующим образом:
Воздух подавался при 40-48°С и температура продукта поддерживалась на значении 29-33°С. Распыление начиналось со скорости 0,8-4,0 г раствора/мин и поток воздуха поддерживался на значении от 16 до 27 м3/ч. Процесс распыления останавливался через 314 мин. В конце гранулы сушились в машине в течение 10 мин и просеивались через 710 мкм-вое сито. Финальный выход составил 146,15 г, что соответствует 77% гранул десмопрессин/EUDRAGIT® Е PO/BBI 400-710 мкм от полного веса гранул десмопрессин/EUDRAGIT® Е PO/BBI.
Пример 4
Получение гранул из примера 2 с дополнительным слоем покрытия НРМС
Были взяты гранулы из примера 2 и покрыты НРМС. На первой стадии готовился раствор НРМС для распыления покрытия. На второй стадии раствора НРМС для распыления покрытия наносился на гранулы путем распыления покрытия. В этом случае были получены гранулы EUDRAGIT® Е / десмопрессин с покрытием НРМС и размером частиц 400-710 мкм
Получение раствора НРМС для распыления
252.8 г воды добавили в 250 мл-вый стеклянный стакан и нагревали до около 70°С при перемешивании с помощью магнитной мешалки. Полное количество 25 г гидроксипропилметилцеллюлозы добавили постепенно в горячую воду. После постоянного перемешивания в течение 15 мин, раствор убирали с нагревательного прибора и охлаждали до комнатной температуры. Доливали количество потерянной при испарении воды. Раствор НРМС фильтровали через 0,315 мм-вое проволочное сито.
Получение гранул десмопрессин/EUDRAGIT® Е РО с покрытием НРМС
Исходным материалом для получения покрытых гранул были 100 г просеянных гранул из примера 2, фракция <600 мкм. На них наносили путем распыления покрытия 277,8 г раствора НРМС для распыления покрытия.
Способ осуществляли следующим образом:
Температура продукта поддерживалась на значении 29-35°С путем подачи воздуха с температурой 30°С в начале, повышая до 55°С в конце способа, в зависимости от влажности воздуха способа. Распыление начиналось со скорости 0,7-1,4 г раствора/мин и поток воздуха поддерживался на значении от 12 до 16 м3/ч. Процесс распыления останавливался через 215 мин. Гранулы сушили при 10 м3/ч и температуре продукта 34-35°С, используя машину для нанесения покрытия распылением, и затем просеивали через 600 мкм-вое сито. Финальный выход составил 122,99 г, что соответствует 98% покрытых гранул <600 мкм от полного ожидаемого теоретического веса.
Пример 5
Получение гранул из примера 3 с дополнительным синхронизирующим слоем НРМС, содержащим BBI
Были взяты гранулы из примера 3 и дополнительно покрывались НРМС, содержащей BBI. На первой стадии готовился раствор HPMC/BBI для распыления покрытия. На второй стадии раствор HPMC/BBI для распыления покрытия наносили на гранулы путем распыления покрытия. В этом случае гранулы были получены гранулы EUDRAGIT® Е/десмопрессин/BBI с покрытием HPMC/BBI и размером частиц 400-710 мкм.
Получение раствора НРМС для распыления, содержащего BBI
178 г воды добавили в 250 мл-вый стеклянный стакан и нагревали до около 70°С при перемешивании с помощью магнитной мешалки. Полное количество 19,5 г гидроксипропилметилцеллюлозы добавили постепенно в горячую воду. После постоянного перемешивания в течение 15 мин, раствор удаляли с нагревательного прибора и охлаждали до комнатной температуры. Доливали количество потерянной при испарении воды. 2.6 г ингибитора Баумана-Бирка (BBI) растворили в 45,5 г воды, используя 50 мл-вый стеклянный стакан. После фильтрации прозрачного раствора НРМС через 0,315 мм-вую проволочную сетку добавили раствор BBI. Суммарный раствор перемешивали дополнительные 15 мин, чтобы достичь гомогенности смеси.
Получение гранул десмопрессин/EUDRAGIT® Е PO/BBI с покрытием HPMC/BBI
130 г просеянных гранул из примера 3, фракция 500-710 мкм использовали с качестве исходного материала. На них наносили путем распыления покрытия 245,6 мл раствора HPMC/BBI для покрытия.
Способ осуществляли следующим образом:
Воздух подавался при 30-45°С и температура продукта поддерживалась на значении 29-33°С. Распыление начиналось со скорости 0,6, повышая до 2,2 г раствора/мин, и поток воздуха поддерживался на значении от 18 до 24 м3/ч. Процесс распыления останавливался через 134 мин. В конце гранулы сушились в машине в течение 10 мин и просеивались через 710 мкм-вое сито и выход оценивался взвешиванием. Финальный выход составил 149,23 г, что соответствует 98% покрытых гранул <710 мкм от теоретического ожидаемого веса.
Пример 6
Получении гранул из пример 4 с дополнительным слоем кишечнорастворимого покрытия EUDRAGIT® L 30 D-55
Были взяты гранулы из примера 4 и дополнительно покрывались EUDRAGIT® L30D-55. На первой стадии готовили раствор EUDRAGIT® L30D-55 для распыления покрытия. На второй стадии раствор EUDRAGIT® L30D-55 для распыления покрытия наносили на гранулы путем распыления покрытия. В этом случае получили гранулы EUDRAGIT® Е/десмопрессин с покрытием НРМС и кишечнорастворимым покрытием EUDRAGIT@L30D-55 и размером частиц 400-710 мкм.
Получение дисперсии EUDRAGIT® L30D-55 для распыления
В 100 мл-вый стеклянный сосуд добавили 105 г воды и нагревали до около 80°С при перемешивании с помощью магнитной мешалки. После увеличения скорости магнитной мешалки к горячей воде добавили 3,6 г раствора Tween 80 (33,33%) до добавления 3,0 г глицерин моностеарата. После энергичного перемешивания в течение 15 мин, дисперсию убирали с нагревательного прибора и охлаждали при энергичном перемешивании до комнатной температуры. Доливали количество потерянной при испарении воды.
133,3 г дисперсии просеянного EUDRAGIT® L 30 D-55 и 72,4 г воды смешивали в 250 мл-вом стеклянном сосуде. При перемешивании добавили в дисперсию 4 г триэтил цитрата. После дополнительного перемешивания в течение 10 мин, добавляли подготовленную дисперсию глицерин моностеарата, упомянутую выше. Суммарную дисперсию перемешивали в течение дополнительных 40 мин, чтобы достичь гомогенности раствора для распыления.
Получение гранул из примера 4 с кишечнорастворимым покрытием
Исходным материалом для получения покрытых гранул были 100 г просеянных гранул из примера 4, фракция <600 мкм. На них наносили путем распыления покрытия 321,3 г дисперсии EUDRAGIT® L30D-55 для распыления.
Способ осуществляли следующим образом:
Температура продукта поддерживалась на значении 30-36°С путем подачи воздуха с температурой 37°С в начале, повышая до 52°С в конце способа, в зависимости от влажности воздуха способа. Распыление начиналось со скорости 0,6, повышая до 2,6 г раствора/мин, и поток воздуха поддерживался на значении от 16 м3/ч в начале до 18 м3/ч в конце. Процесс распыления останавливался через 213 мин. Гранулы сушились в машине в течение 10 мин при температуре продукта 35-36°С, используя машины для нанесения покрытия распылением, и затем просеивались через 710 мкм-вое сито. Гранулы дополнительно сушили в течение 2 часов при 40°С в сушильном шкафу. Финальный выход составил 145,03 г, что соответствует 98% покрытых гранул <710 мкм от теоретического ожидаемого веса.
Пример 7
Получение гранул из примера 5 с дополнительным слоем кишечнорастворимого покрытия EUDRAGIT® L 30 D-55
Были взяты гранулы из примера 5 и дополнительно покрывались EUDRAGIT® L30D-55. На первой стадии готовили раствор EUDRAGIT® L30D-55 для распыления покрытия. На второй стадии на гранулы наносили путем распыления покрытия раствор EUDRAGIT® L30D-55 для распыления покрытия. В этом случае гранулы EUDRAGIT® Е/десмопрессин/BBI с покрытием HPMC/BBI и кишечнорастворимым покрытием EUDRAGIT® L30D-55 и размером частиц 400-710 мкм.
Получение дисперсии EUDRAGIT® L30D-55 для распыления
52,5 г воды добавили в 100 мл-вый стеклянный сосуд и нагревали до около 80°С при перемешивании на магнитной мешалке. 1.8 г раствора Tween 80 (33,33%) добавили к горячей воде, энергично перемешивая дисперсию, до добавления 1,5 г глицерин моностеарата. После 15 мин энергичного перемешивания дисперсию убирали с нагревательного прибора и охлаждали при энергичном перемешивания до комнатной температуры. Доливали количество потерянной при испарении воды.
66,7 г дисперсии просеянного EUDRAGIT® L 30 D-55 и 36,2 г воды смешивали в 250 мл-вом стеклянном сосуде. При перемешивании в дисперсию добавили 2 г триэтил цитрата. После дополнительно перемешивания в течение 10 мин добавили подготовленную дисперсию глицерин моностеарата, упомянутую выше. Суммарная дисперсия перемешивалась дополнительные 40 мин, чтобы достичь гомогенности раствора для распыления.
Получение гранул из примера 5 с кишечнорастворимым покрытием
Исходным материалом для получения покрытых гранул были 100 г просеянных гранул из примера 4, фракция <710 мкм. На них наносили путем распыления покрытия 160,7 мл описанной выше дисперсии EUDRAGIT® L30D-55 для распыления.
Воздух подавался при 35-46°С и температура продукта поддерживалась на значении 30-33°С. Распыление начиналось со скорости 0,3, повышая до 1,6 г раствора/мин, и поток воздуха поддерживался на значении от 16 до 18 м3/ч. Процесс распыления останавливался через 146 мин. Затем гранулы сушились в машине в течение 10 мин и просеивались через 710 мкм-вое сито и выход оценивался взвешиванием. Финальный выход составил 123,98 г, что соответствует 100% покрытых гранул размером <710 мкм от теоретического ожидаемого веса.
Пример 8 (контрольное лекарственное средство (капсула))
Гранулами примера 1 заполняли капсулы из НРМС размера 1.
Смесями примера 1 заполняли капсулу их НРМС размера 1, используя загрузочную воронку, чтобы получить суммарный вес 350 мг. Однородность веса капсул составила 350,2 мг +/-0,9 (стандартное отклонение, n=10). Однородность содержания десмопрессина в капсулах составила 215,62 +/-5,55 мкг (стандартное отклонение, n=10).
Пример 9 (состав, не соответствующий настоящему изобретению (капсула))
Гранулами из примера 2 заполняли капсулу из НРМС размера 1.
Для одной капсулы 107 мг гранул из примера 2 с содержанием около 205 мкг десмопрессина смешивали с Cellets® 500 в качестве наполнителя, чтобы заполнить капсулы из НРМС размера 1 с суммарным весом 350 мг. Однородность веса капсул составила 350,5 мг +/-0,3 (стандартное отклонение, n=10). Однородность содержания десмопрессина в капсулах составила 204,57 +/-2,42 мкг (стандартное отклонение, n=10).
Пример 10 (состав, не соответствующий настоящему изобретению (капсула))
Гранулами из примера 6 заполняли капсулу из НРМС размера 1.
Для одной капсулы 195.6 мг гранул из примера 6 с содержанием около 225 мкг десмопрессина смешивали с Cellets® 500 в качестве наполнителя, чтобы заполнить капсулы из НРМС размера 1 с суммарным весом 350 мг. Однородность веса капсул составила 350,1 мг +/-0,2 (стандартное отклонение, n=10). Однородность содержания десмопрессина в капсулах составила 225,4 +/-0,51 мкг (стандартное отклонение, n=10).
Пример 11 (состав, соответствующий настоящему изобретению (капсула))
Гранулами из примера 7 заполняли капсулу из НРМС размера 1.
Для одной капсулы 145.5 мг гранул из примера 7 с содержанием около 211 мкг десмопрессина смешивали с Cellets® 500 в качестве наполнителя, чтобы заполнить капсулы из НРМС размера 1 с суммарным весом 350 мг. Однородность веса капсул составила 350,0 мг +/-0.2 (стандартное отклонение, n=10). Однородность содержания десмопрессина в капсулах составила 211,31 +/-1,19 мкг (стандартное отклонение, n=10).
Тестовые примеры 12-16 Пример 12 (TEER)
In-vitro тест препаратов из примеров 1. 4 и 5 на клетках Caco-2 (значения TEER)
Получение монослоев клеток Сасо-2 для измерений трансэпителиального электрического сопротивления
Для экспериментов по изучения переноса клетки Caco-2 были высажены с плотностью 60000 клеток на квадратный сантиметр на планшетные вкладыши Transwell™, которые были расположены в 12-ти луночных планшетах с плоским дном. На вкладыши (апикальная область) подавали 0,5 мл, а на внешние лунки (базовая область) - 1,5 мл культуральной среды DMEM. Клетки культивировали при 37°С, 10% CO2 и 90% относительной влажности в культуральной среде DMEM в течение 14-30 дней до тех пор, пока не образуются сливающиеся монослои. Культуральная среда заменялась каждые 2-3 дня.
Заселенность и плотность монослоя клеток проверяли по стандартной методике, измеряя трансэпителиальное электрическое сопротивление, используя вольтомметр EVOM™.
Партия монослоя клеток Caco-2 характеризуется как клетки Caco-2, высаженные и культивированные одновременно при одних и тех же условиях на вкладышах Transwell™. Определение качества партий монослоев клеток Caco-2 с помощью выбранных маркеров переноса проводится трехкратно для каждого условия переноса. Следующие критерии качества должны выполняться, до того как партия монослоя клеток подается на стадию изучения проницаемости:
- количество пассажей Caco-2 менее чем 50;
- возраст культуры 14-30 дней на вкладышах Transwell™;
- TEER-значения до и после переноса выше 200 Ω·cm2 (характеризует целостность и плотность монослоя клеток);
- коэффициент эффективной проницаемости (апикальный/базолатеральный и базолатеральный/апикальный (ab и ba)) слабопроницаемого маркера (Флуоресцеин) меньше чем 1·10-6 см·с-1 (характеризует пригодность модели для идентификации низкопроницаемого переноса, обеспечивает плотность монослоя клеток);
- коэффициент эффективной проницаемости (ba) Родамина 123 выше чем 4·10-6 см·с-1 (характеризует заметную экспрессию P-гликопротеин); коэффициент эффективной проницаемости (ab) пропранолола выше чем 5·10-6 см·с-1 (характеризует пригодность модели для идентификации высокопроницаемого переноса).
Следующие критерии качества должны выполняться для каждого индивидуального монослоя, используемого для изучения проницаемости исследуемых соединений:
- Монослои являются частью отвечающей критериям партии.
- TEER должно быть выше чем 200 Ω·cm2 после предварительно инкубации (30-45 мин), в противном случае монослой отбраковывается.
- TEER должно быть выше чем 200 Ω·cm2 после изучения переноса, более низкие значения TEER указывают на недостаток целостности монослоя в ходе исследования.
Используемые в экспериментах буферы для апикальной или базолатеральной стороны
|
Значение pH регулировалось при помощи NaOH/HCl
Получение и измерение образцов
Для экспериментов 1 мг порошка таблеток Minirin® из примера 1 или интактных гранул из примеров 4 и 5 наносили в донорную зону. В качестве дополнительного контроля была нанесена смесь десмопрессина ацетата и Cellets® 700.
Влияние состава гранул на TEER оценивали при помощи мониторинга TEER в ходе эксперимента по изучения переноса. TEER измеряли в моменты времени 0, 15, 30, 60, 120 и 240 мин. После последнего измерения TEER, содержимое апикальной и базолатеральной зоны удаляли и клетки промывали и рекультивировали в культуральной среде клеток в течение дополнительных 20 ч. TEER измеряли снова для оценки обратимости улучшения проникновения.
Результаты
|
|
Значения TEER гранул из примеров 4 и 5 снижались до менее чем 15% по сравнению с буферным контролем. В противоположность этому, состав из примера 1 показал снижение только до 70%.
Пример 13 (Приток)
In-vitro анализ препаратов примеров 1. 4 и 5 в клетках Сасо-2 (измерения притока)
Препарат монослоев клеток Caco-2 для измерений притока
Монослои клеток Caco-2 были получены тем же способом, что и в примере 12.
Получение и измерение образцов
Раствор десмопрессина ацетата, содержащий 1000 мкг·мл-1, получили в буфере HBSS pH 6,5 путем растворения 10 мг вещества в 10 мл буфера.
Раствор был нанесен в дозорной зоне вместе с 1 мг гранулярного состава или порошка таблеток Minirin®.
Для экспериментов 1 мг порошка таблеток Minirin® из примера 1 или интактных гранул из примеров 4 и 5 наносили в донорную зону. В качестве дополнительного контроля наносили смесь десмопрессина ацетата и Cellets® 700.
Поскольку предварительной инкубации не проводили, концентрация тестируемого соединения, обнаруженная в растворе переноса, была принята за исходную концентрацию донора (CDO). Через 120 минут образцы объемом 100 мкл были отобраны из акцепторных зон. Между точками измерения монослои инкубировались при 37°С в С02-инкубаторе. Все эксперименты проводились трижды.
В качестве контроля использовались инертные гранулы (Cellets).
Раствор анализировали с помощью ВЭЖХ, используя колонку RP-18 в качестве неподвижной фазы и смесь вода/ацетонитрил (80:20) в качестве подвижной фазы, при длине волны 220 нм. Приток вычисляли как доля в процентах от 1000 мкг·мл-1 десмопрессина, что является 100% количеством, нанесенным в донорную зону. Содержанием десмопрессина в примененных гранулах (около 2 мкг) пренебрегали при вычислениях.
Результаты
Результаты экспериментов по изучения притока суммированы в таблице 3.
|
В результате становится очевидным, что составы из примеров 4 и 5 увеличивают приток десмопрессина в клетках Сасо-2 до величины более чем 20%.
Пример 14 (Ингибирование протеолитических ферментов)
In- vitro анализ по изучению ингибирования панкреатических ферментов на препаратах примеров 1, 4 и 5
План эксперимента
Эксперименты по изучению ингибирования проводились с использованием нового плана исследования, принимая во внимание растворение гранул.
80 мг каждого состава вмешивали в 10 лм буфера HBSS pH 5,8 при самой низкой из возможных скорости перемешивания. Перемешивание прекращали через 30 мин и давали суспензиям осесть, до того как отбирали аликвоту (2 мл) и смешивали ее с 2 мл раствора, содержащего 80 мкг·мл-1 десмопрессина ацетата в буфере HBSS pH 6,5. Значение pH растворов измеряли, но не регулировали.
В качестве отрицательного контроля 2 мл буфера HBSS смешивали с 2 мл раствора, содержащего 80 мкг·мл-1 десмопрессина ацетата в буфере HBSS pH 6,5. Значение pH растворов измеряли, но не регулировали.
В качестве положительного контроля использовали раствор, содержащий 4 мг BBI на мл в буфере HBSS. 2 мл раствора смешивали с 2 мл раствора, содержащего 80 мкг·мл-1 десмопрессина ацетата в буфере HBSS pH 6,5. Значение pH растворов измеряли, но не регулировали.
200 мкл подготовленных растворов смешивали с 200 мкл раствора панкреатина (20 мг·мл-1) и инкубировали в течение 1, 2 и 3 ч при 37°С. Каждый эксперимент проводили трижды (три индивидуально подготовленных раствора).
(Конечные концентрации в положительном контроле: 1 мг/мл BBI, 20 мкг/мл десмопрессина ацетата и 10 мг/мл панкреатина)
Для значения 100%, 80 мг гранулы вмешивали в 10 мл раствора HBSS pH 5,8 в течения и гомогенизировали в течение 30 мин, используя диспергатор Ultra-turrax. Суспензию перемешивали в течение дополнительных 15 минут и давали осесть.
Супернатант отбирали и дополнительно разбавляли десмопрессина ацетатом в буфере HBSS pH 6,5, который описан выше. Значение pH растворов измеряли, но не регулировали.
Для измерений в начальный момент времени (t0) смесь напрямую добавляли в 400 мкл ацетонитрила и разбавляли 1200 мкл буфера HBSS pH 6,5. Раствор анализировали с помощью ВЭЖХ, используя колонку RP-18 в качестве неподвижной фазы и смесь вода/ацетонитрил (80:20) в качестве подвижной фазы, при длине волны 220 нм.
Результаты
Результаты экспериментов по изучению ингибирования ферментов суммированы в таблице 4.
|
|
Получали результаты для составов и контролей (n=3). Таблетка (Minirin®) и гранула из 4 практически не проявили ингибирующих свойств, кинетика разложения схожа с отрицательным контролем (буфер). Практически никакого разницы не наблюдалось между растворенными (30 минут)и гомогенизированными образцами. Только положительный контроль и гранулы из примера 5 смогли значительно снизить разложение десмопрессина ацетата панкреатином. Однако, даже в отсутствие BBI наблюдалась сохранность более чем 60% десмопрессина. Это указывает на то, что эффект BBI обнаруживается, но является минимальным.
Пример 15 (Синхронизация)
In-vitro анализ препаратов примеров 5. 7 и 11 по изучению синхронизации десмопрессина и ингибитора Баумана-Бирка
Тесты на растворимость гранул проводились согласно фармакопее USP метод 2 при 37°С, скорость лопастей 100 об/мин, фосфатный буфер pH 6.0, n=6, 1 г на сосуд в соответствии с около 1400-2100 мкг десмопрессина ацетата. Дополнительно гранулы с кишечнорастворимым покрытием обрабатывались в течение 2 ч в соляной кислоте, 0,1 М, до смены на pH 6,0.
Тесты на растворимость капсул проводили таким же образом, n=6, 5 капсул на сосуд в соответствии с суммарным содержанием 1080 мкг десмопрессина ацетата.
Отобранные образцы анализировали с помощью ВЭЖХ, десмопрессин и BBI измеряли отдельно с УФ-детекцией при 210 нм.
Результаты
Эффект синхронизации показан в таблицах 5, 6 и7 в процентах от полного количества каждого вещества.
Профиль растворимости гранул из примера 5 в фосфатном буфере pH 6.0 показан индивидуально для десмопрессина и BBI
|
Профиль растворимости гранул из примера 7 через 2 ч HCl 0,1N и с переходом на pH 6.0 показан индивидуально для десмопрессина и BBI
|
|
Профиль растворимости капсул из примера 11 через 2 ч HCl 0,1 N и с переходом на pH 6.0 показан индивидуально для десмопрессина и BBI
|
Профиль растворимости гранул из примеров 5 и 7 и капсул из примера 11 показывает быстрое (>90% через 20 мин) и полное (почти 100% через 30 мин) высвобождение при pH 6,0 десмопрессина и BBI синхронно. Расхождение в этих моментах времени (20/30 мин в примере 5 или 140/150 мин в примерах 7 и 11) составляет менее чем 5%.
Пример 16 (исследование in-vivo)
In vivo анализ препаратов примеров 8, 9, 10 и 11 на минипигах (относительная биодоступность)
Описание метода
Минипиги были выбраны ввиду того, что они являются хорошей моделью для изучения пероральной биодоступности у человека. Минипиги меньше одомашненные свиньи и более легки в обращении.
Вид: Минипиг (Gottingen) Источник: Ellegaard Gottingen Minipigs A/S (Dalmose, DK)
Количество, Пол: 8 особей мужского пола; никаких других животных не было включено. Никаких непредвиденных осложнений с животными не возникло.
Возраст, вес тела: На момент введения доз животные были в возрасте 7-8 месяцев со средним весом тела 12 кг. По прибытии в институт TNO (Нидерландская организация для прикладных научных исследования) животные были взвешены и разделены на две группы. За день до каждой сессии введения доз веса животных вновь записывались.
Акклиматизация: Животные акклиматизировались к лабораторным условиям, биотехническому персоналу и процедурам введения доз и забора проб и образцов благодаря ежедневной тренировке по рабочим дням в течение 3 недель до начало исследований.
Состояние здоровья: По прибытии животных забрали в специальное помещение на карантин и запирались для наблюдения на предмет явных признаков нездоровья и аномалий. Помещение для карантина затем почистили для применения в качестве помещения для экспериментов.
Среда содержания: Животные содержались в обычных условиях в одном помещении. Никакой другой тест-системы не содержалось в той же комнате во время исследования. Помещение вентилировалось с кратностью воздухообмена 10 раз в час и поддерживалось при температуре 22°С+/-2°С и относительной влажности по меньшей мере 40%, не превышая 70%, за исключением состояния в ходе уборки помещения. Освещение было искусственным с последовательностью 12 часов - светло и 12 часов - темно.
Уход: В ходе акклиматизации и исследования животных содержались с загонах с соломой в качестве подстилки и развлечения, 4 минипига на загон. В дни забора крови животных содержали индивидуально. Во время второй недели введения доз животные начали драться друг с другом и поэтому стали содержаться индивидуально, чтоб избежать ран от побоев.
Идентификация: Каждое животное было промаркировано на ушах поставщиком.
Они сохраняли эту метку на протяжении всего исследования. Животных также нумеровали от 1 до 8 путем написания номера на лбу.
Диета: Минипигах кормили дважды в день приблизительно 350 г коммерчески доступным кормом для минипигов (Mpig-H). Каждая партия этого корма анализировалась поставщиком (Ssniff Spezialdiaten GmbH, Soest, Germany) на предмет питательных элементов и примесей. Сертификаты анализа, соответствующие партиям, применяемым в исследовании, подшиты в документы исследования.
Питьевая вода: Питьевая вода подавалась без ограничений. Питьевая вода была пригодной для потребления людьми.
Тестируемые составы
Для исследований использовались капсулы из примеров 8, 9, 10 и 11
Содержимое: около 215 мкг десмопрессина на капсулу
Условия хранения: +2 до +8°С
Стабильность: стабильные при условиях хранения
Методика проведения опыта
Животные получали одно дозу каждого состава (1 капсула) и после каждого введения отбирали образцы крови.
Животные 1-4 получали четыре состава в следующем порядке: Капсулы из примеров 9, 10, 11 и 8.
Животные 5-8 получали те же составы в обратном порядке.
Эта методика (перекрестное исследование) позволяет учесть возможные нежелательные эффекты от повторного введения десмопрессина (например продуцирование антител) на параметры, определяющие собственную фармакокинетику, или возможные неучтенные эффекты составов (например эффект на функционирование кишечника).
Уровень дозы, введение, размер группы и обнаружение
Уровень дозы был выбран равным около 215 мкг десмопрессина ацетата абсолютного из расчета на вес человеческого тела 70 кг. Каждая группа содержала 4 мужских особи минипигов. Количества животных, находившихся в экспериментальных группах записывались в ходе исследования, позволяя легко идентифицироваться группы.
Тестируемый препарат вводили перорально каждому животному из расчета 1 капсулы, содержащей соответствующее количество тестируемого вещества. Пероральное введение осуществляли, располагая между зубами животного палочку для захвата зубами (перфорированную в центре). Пистолет для введения таблеток, снабженный трубкой (приблизительно 0,5 см в диаметре) вставлялся через отверстие в рот минипига и капсула выстреливалась напрямую в горло. Палочка для захватывания зубами удалялась, после того как животное проглатывало. Животным пускали к свеженалитой питьевой воде сразу после введения доз.
Каждый состав давался только раз и за каждым введением дозы следовала «отмывочная» фаза.
Отбор крови
Образцы крови приблизительно 0,5 мл каждый отбирались из яремной вены каждого животного в моменты времени 15, 30, 45, 60, 90, 120, 180, 240, 360, 480 минут после каждого введения дозы, меняя место каждую процедуру, чтобы дать месту забора крови восстановиться между двумя процедурами.
Образцы отбирали в вакуумные пробирки Vaccutainers, содержащие K2EDTA. Пробирки центрифугировали при +4°С (3000 об/мин в течение 10 минут) не позже чем через 30 минут после забора крови и плазму отбирали в две аликвоты (A и B) в полиэтиленовые пробирки. Образцы плазмы хранили замороженными при < -70°С до момента, когда их положат на сухой лед в месте проведения анализа.
Каждый образец определяли по номеру опыта, коду животного, типу образца, дате забора крови и времени забора.
Биоанализ: В образцах плазмы определяли концентрацию десмопрессина методом радиоиммунного анализа.
Фармакокинетическое исследование и статистика
Результаты биоанализа были проанализированы, используя программу KineticaR v4.2.. Кривые концентрация в плазме от времени строились по определенным результатам и анализировались путем анализа без использования камерной модели.
Следующие фармакокинетические параметры вычисляли, когда это позволяли данные:
Cmax, Tmax, конечный период полувыведения (Т1/2,), объем распределения (Vz), общий клиренс (CIT), площадь под кривой концентрация-время (AUC0-∞).
Относительная биодоступность вычислялась как отношение AUC0-∞ капсул из примера 8 (Minirin®) и AUC0-∞ составов примеров 9, 10 и 11, соответственно.
Результаты, выраженные как полная площадь под кривой и проценты, сведены в таблицу 8.
|
Примеры 9 и 10 не были лучше чем контрольный пример 8 (Minirin®, контрольное лекарственное средство), демонстрируя относительную биодоступность около 59 и 68% по сравнению с контрольным лекарственным средством. Тем не менее примеры 9 и 10 могут рассматриваться в сопоставимом диапазоне, что и контрольное лекарственное средство примера 8, которое основано на коммерчески доступном продукте.
В противоположность этому, состав примера 11 показал в 7 раз большую относительную биодоступность AUC0-∞ (711%) по сравнению с контрольным лекарственным средством примера 8 (100%).
Рост пероральной биодоступности, как заявлено, вычисляется путем сравнения примера 11 с примером 10. Площадь под кривой концентрация-время (AUC0-∞ [пг/мл*мин]) для крови минипигов после пероральной доставки десмопрессина с составом согласно примеру 11, имеющим ингибитор протеолитических ферментов, составила 53823 пг/мл*мин. Это сравнивается с AUC0-∞ аналогичного состава без ингибитора протеолитических ферментов (пример 10), чей AUC0-∞ составил 5155 пг/мл*мин (=100%). Таким образом, степень роста биодоступности составила 53823/5155=10,44 (=1044%).
Гранулы содержались в капсулах из примеров 8, 9, 10 и 11, которые соответствуют гранулам примеров 1, 4, 6 и 7, соответственно. Составы 6 и 7 представляют собой покрытые кишечнорастворимым покрытием гранулы примеров 4 и 5, соответственно.
Гранулы примеров 4 и 5 показали хорошие характеристики проникновения в клетку в клеточных анализах in-vitro и они описаны в примерах 12 и 13 (значения TEER и притока). Составы из примеров 4 и 5 увеличили приток десмопрессина в клетках Caco-2 до величины, равной более чем 20%. Значения TEER гранул из примеров 4 и 5 снижены до менее чем 15% по сравнению с буферным раствором. В противоположность этому, состав из примера 1 (Minirin®) показал снижение только до 70%.
Тем не менее, полученные in-vitro обнадеживающие результаты гранул примера 4, расположенных в капсулах примеров 9 и 10, соответственно без или с кишечнорастворимым покрытием, привели к огорчающим результатам в исследованиях in-vivo. Когда аналогичные составы тестировались in-vivo на минипигах, детектировали только низкую биодоступность. Значение было меньше чем полученное для капсулы примера 8, которая содержит контрольный препарат примера 1 (контрольное лекарственное средство).
Только капсула из примера 11 (содержащая гранулы из примера 7, которая является версией гранулы примера 5, покрытой кишечнорастворимым покрытием), которая единственная содержала агент, промотирующий биодоступность, BBI, показала явный рост биодоступности в 10,44 раза по сравнению с контрольным составом примера 10, который является составом, соответствующим составу согласно изобретению примера 11.
Этот сильный рост относительной биодоступности нельзя объяснить только слабым эффектом BBI по ингибированию ферментов, показанным в примере 14.
Благодаря тому факту, что эффект in-vivo был настолько выше по сравнению с результатами in-vitro, авторы изобретения полагают, что этот эффект нельзя объяснить просто защитным эффектом ингибитора протеолитических ферментов по отношению к панкреатическим ферментам. Более того, тут, по-видимому, присутствует новый неожиданный эффект, который повышает биодоступность активных ингредиентов благодаря добавлению ингибитора протеолитических ферментов вообще, или, по меньшей мере, такого ингибитора растительного происхождения, или, по меньшей мере, ингибитора Баумана-Бирка (BBI), в сочетании с другими элементами системы, как заявлено в формуле изобретения.
Пример 17 (TEER, чистый промотор проникновения)
Промотор проникновения, соответствующий настоящему изобретению, может быть охарактеризован как тот, который снижает исходное значение TEER буферного раствора без промотора проникновения (100%) до 50% или менее, предпочтительно 40% или менее, предпочтительно 30% или менее, предпочтительно 20% или менее, в присутствии промотора проникновения в концентрации 1 мг/мл через 60 мин, что измеряется на монослойной культуре клеток Caco-2 в качестве барьера для переноса.
Исследование TEER проводили аналогично примеру 12. EUDRAGIT® Е ацетат = EUDRAGIT® Е, растворимый в воде за счет добавления уксусной кислоты до получения прозрачного раствора; EUDRAGIT® Е РО основный = дисперсия EUDRAGIT® Е РО (порошковая форма EUDRAGIT® Е) в воде (нерастворенный); хитозана ацетат = хитозан, растворимый в воде за счет добавления уксусной кислоты до получения прозрачного раствора.
|
EUDRAGIT® Е ацетат, EUDRAGIT® Е основный и хитозана ацетат отвечают требованию TEER для промотора проникновения, поскольку они снижают TEER до менее чем 50% через 60 минут даже при концентрации 0,005%=0,05 мг/мл (ниже 1 мг/мл).
Пример 18 (TEER, катионный промотор проникновения/анионный активный ингредиент)
Исследование TEER проводили аналогично примеру 12.
|
Описание составов: Тестировались следующие смеси в буферах HBSS Сокращения:
Десмопрессина ацетат = Desmo,
EUDRAGIT® Е Карбонат = Е (описание: карбонатный амино(мет)акриловый сополимер)
Ингибитор Баумана-Бирка = BBI
Гепарин: Низкомолекулярный гепарин (LMW-Heparine); Fraxiparin(TM) (Надропарин кальция); 0,6 мл-вый готовый для использования шприц для подкожных инъекций (5700 IU anti-Xa/mg); Ch.В.: 3394-1; Glaxo Smith Kline
Пример 18а: Desmo 0,01%/Е 0,1%/BBI 0.01%
Пример 18b: Desmo 0,01%/BBI 0,01%
Пример 18с: Desmo 0,01% (контроль активного ингредиента)
Пример 18d: Гепарин 0,1% (контроль активного ингредиента)
Пример 18е: Гепарин 0,1%/Е 0,4%/BBI 0,01%
Пример 18f: Гепарин 0,1%/Е 0,1%/BBI 0,01%
Пример 18е: Гепарин 0,1%/Е 0,25%/BBI 0,01%
Пример 18h: Додецилсульфат натрия (SDS) 0,1% (положительный контроль)
Пример 18i: буфер HBSS (отрицательный контроль)
Обсуждение результатов
Примеры 18а, 18е, 18f и 18g показывают качественный состав ядра составов, соответствующих настоящему изобретению (без покрытия для желудочно-кишечного тракта). Примеры 18а и 18е являются эффективными для понижения значений TEER, в то время как примеры 18f и 18g таковыми не являются.
Пример 18а показывает сильное снижение значения TEER, что обусловлено присутствием EUDRAGIT® Е, что явствует из сравнительных примеров 18b и 18c без EUDRAGIT® Е или без EUDRAGIT® Е и BBI, соответственно.
В примерах 18е, 18f и 18g гепарин используется в качестве примера сильно анионного активного ингредиента. В этих примерах гепарин смешивается с катионным EUDRAGIT® в качестве промотора проникновения и BBI. В примерах 18f и 18g не наблюдается снижения TEER. Полагают, что это обусловлено избытком анионного гепарина, который мешает проявлению активности катионного промотора проникновения и подавляет его функционирование. В примере 18е наблюдается отсроченное снижение значения TEER. Полагают, что это обусловлено избыточной активностью катионного промотора проникновения над анионным гепарином, так что активность катионного промотора проникновения не полностью ингибирована как в примере 18f и 18g. Примеры 18е, 18f и 18g показывают, что потеря активности промотора проникновения может произойти, когда анионные и катионные вещества смешиваются вместе в количествах практически эквимолярных по отношению к их зарядам, или когда активный ингредиент присутствует в избытке по отношению к промотору проникновения. Это можно преодолеть, например, путем увеличения полного количества промотора проникновения над активным ингредиентом, как показано в примере 18e.

