Результат интеллектуальной деятельности: РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PNDCTR1, КОДИРУЮЩАЯ ГИБРИДНЫЙ ПОЛИПЕПТИД GST-NDCTR1, ШТАММ БАКТЕРИЙ ESCHERICHIA COLI BL21(DE3)/PNDCTR1 - ПРОДУЦЕНТ ГИБРИДНОГО ПОЛИПЕПТИДА GST-NDCTR1 И ГИБРИДНЫЙ ПОЛИПЕПТИД GST-NDCTR1, ОБЛАДАЮЩИЙ СПОСОБНОСТЬЮ ХЕЛАТИРОВАТЬ ИОНЫ МЕДИ, СЕРЕБРА И ПЛАТИНЫ
Вид РИД
Изобретение
Рекомбинантная плазмидная ДНК pNdCTR1, кодирующая гибридный полипептид GST-NdCTR1, штамм бактерий Escherichia coli BL21(DE3)/pNdCTR1 - продуцент гибридного полипептида GST-NdCTR1 и гибридный полипептид GST-NdCTR1, обладающий способностью хелатировать ионы меди, серебра и платины.
Изобретение относится к генной и белковой инженерии, биотехнологии, молекулярной фармакологии и направлено на получение нового гибридного белка, содержащего фрагмент высокоаффинного импортера меди человека CTR1. Изобретение может быть использовано в медицине и в медицинской промышленности для создания новых лекарственных средств с хелатирующим эффектом.
Даже небольшие нарушения в транспортной системе меди вследствие генетических мутаций, старения или влияния окружающей среды ведут к освобождению меди из координационных сфер белков-переносчиков и нефизиологическому локальному повышению концентрации меди в клетке. Это способствует развитию раковых и нейродегенеративных заболеваний [Gaggelli et al., 2006; Montes et al., 2014], так как окислительный стресс вызывает воспаление (важный фактор малигнизации [Brown et al., 2006]) и провоцирует фибриллогенез, ведущий к гибели нейронов (общий признак нейродегенеративных заболеваний [Gaggelli et al., 2006]).
Для ограничения биодоступной меди в качестве хелаторов меди в клинике применяют d-пенициламин, триентин и тетратиомолибдат. Они применяются для замедления роста опухолей и для лечения нейродегенеративных болезней [Goodman et al., 2004; Babich et al., 2013; Crowe et al., 2013; Brewer, 2014], хронической легочной артериальной гипертензии, развивающейся на фоне прогрессивного роста сосудов [Bogaard et al. 2011], и диабетической кардиоваскулярной миопатии [Zhang S. et al., 2014]. Перечисленные препараты относятся к абиогенным низкомолекулярным органическим веществам, специфически связывающим ионы меди Cu(II). Они токсичны, так как извлекают медь из активных центров ферментов, образуют нерастворимые комплексы с белками, транспортирующими медь, переводят медь в нерастворимые комплексы, накапливающиеся в организме. Развивающийся при приеме этих хелаторов дефицит меди влечет за собой не только снижение активности жизненно важных купроэнзимов, но и обострение инфекционных заболеваний вследствие снижения иммунитета [Mills et al., 1981; Mason, 1986; Suttle, 2012].
Штаммы кишечной палочки широко используют как организмы-продуценты полезных в медицине и народном хозяйстве полноразмерных белков и полипептидных фрагментов. Рекомбинантные плазмиды, несущие нуклеотидные последовательности-интереса, конструируют на общих базовых принципах, вводя ДНК-последовательности, кодирующие конкретный целевой полипептид. Современные экспрессионные векторы, как правило, направлены на получение целевого белка в составе гибридного полипептида. К настоящему времени известны рекомбинантные плазмидные ДНК, обеспечивающие экспрессию различных рекомбинантных полипептидов, соответствующих природным белкам.
Известен генно-инженерный способ получения рекомбинантного полипептида со свойствами эпидермального фактора роста человека (чЭФР) в клетках бактерий в виде гибридного белка с глутатион-S-трансферазой (GST-hEGF). Сконструирована рекомбинантная плазмида pAS007 для экспрессии гибридного белка GST-hEGF в клетках Escherichia coli. [RU патент №2521515].
Известен штамм бактерий Escherichia coli - продуцент биологически активного флагеллина. Охарактеризованный штамм получен трансформацией культуры клеток Е. coli BL21 [DE3] рекомбинантной плазмидной ДНК pET151FliC, полученной на основе вектора pET151FliC, в который был встроен ген fliC, кодирующий биологически активный флагеллин, являющийся эффективным стимулятором иммунной системы [RU патент №2524133].
Известны рекомбинантная плазмидная ДНК рТВ323, кодирующая гибридный полипептид GST-ДЕЛЬТАМРТ64 со свойствами видоспецифичного микобактериального антигена МРТ64 (МРВ64), рекомбинантный штамм бактерий Escherichia coli - продуцент гибридного полипептида GST-ДЕЛЬТАМРТ64 и рекомбинантный полипептид GST-ДЕЛЬТАМРТ64 [RU патент №2458130].
Известно рекомбинантное получение импортера меди человека hCTR1 путем экспрессии вектора на основе pQE30, содержащего кодирующую hCTR1-N/6His ДНК, в клетках Е. coli штамма M15 (pREP4) [KLOMP А.Е.М. et al., Biochemical characterization and subcellular localization of human copper transporter 1 (hCTR1), Biochem. J. (2002) 364, 497-505], выбранный за прототип.
Исследование посвящено характеристике биосинтеза, посттрансляционному процессингу и внутриклеточной локализации белка CTR1 человека в семи различных клеточных линиях. С помощью иммунофлуоресцентного исследования с использованием антисыворотки кролика против рекомбинантного пептида hCTR1 рассмотрены биохимические характеристики и субклеточная экспрессия hCTR1. Рекомбинантный hCTR1 получен путем экспрессии прокариотического вектора pQE30, содержащего фрагмент ДНК, кодирующий N-концевой домен белка CTR1 человека, слитый с шестью остатками гистидина (hCTR1-N/6His), в клетках Е. coli M15(pREP4). Нуклеотидный состав праймеров, примененных для клонирования, позволяет сделать вывод о том, что рекомбинантный пептид hCTR1-N/6His содержит неполный N-концевой фрагмент CTR1 (нет трех первых и двух последних аминокислотных остатков). Очищенный на иммобилизованном металл-аффинном сорбенте hCTR1-N/6His использован авторами только для иммунизации кролика и тестирования антисыворотки.
Недостатки: полученный рекомбинантный полипептид hCTR1-N/6His не может быть использован для тестирования хелатирующих свойств N-концевого домена белка CTR1 человека, т.к. клонирован неполный N-концевой домен, а гистидиновая метка способна связываться с хелатным ионом переходного металла.
Белки, меченные глутатион S-трансферазой (GST), могут быть очищены аффинной хроматографией с использованием иммобилизованного глутатиона. Генно-инженерные способы получения рекомбинантного полипептида со свойствами хелатора ионов тяжелых металлов с использованием векторной плазмиды для экспрессии слитых с GST белков не известны.
Задачей является разработка системы для экспрессии в клетках Е. coli гибридного полипептида GST-NdCTR1, характеризующегося SEQ ID NO: 2, представляющего собой N-концевой полипептидный фрагмент глутатион-S-трансферазы (GST), соединенный через сайт гидролиза тромбином с полипептидным фрагментом N-концевого фрагмента высокоаффинного импортера меди человека CTR1 и осуществление его способности хелатировать ионы меди, серебра и платины.
Для решения задачи предложены:
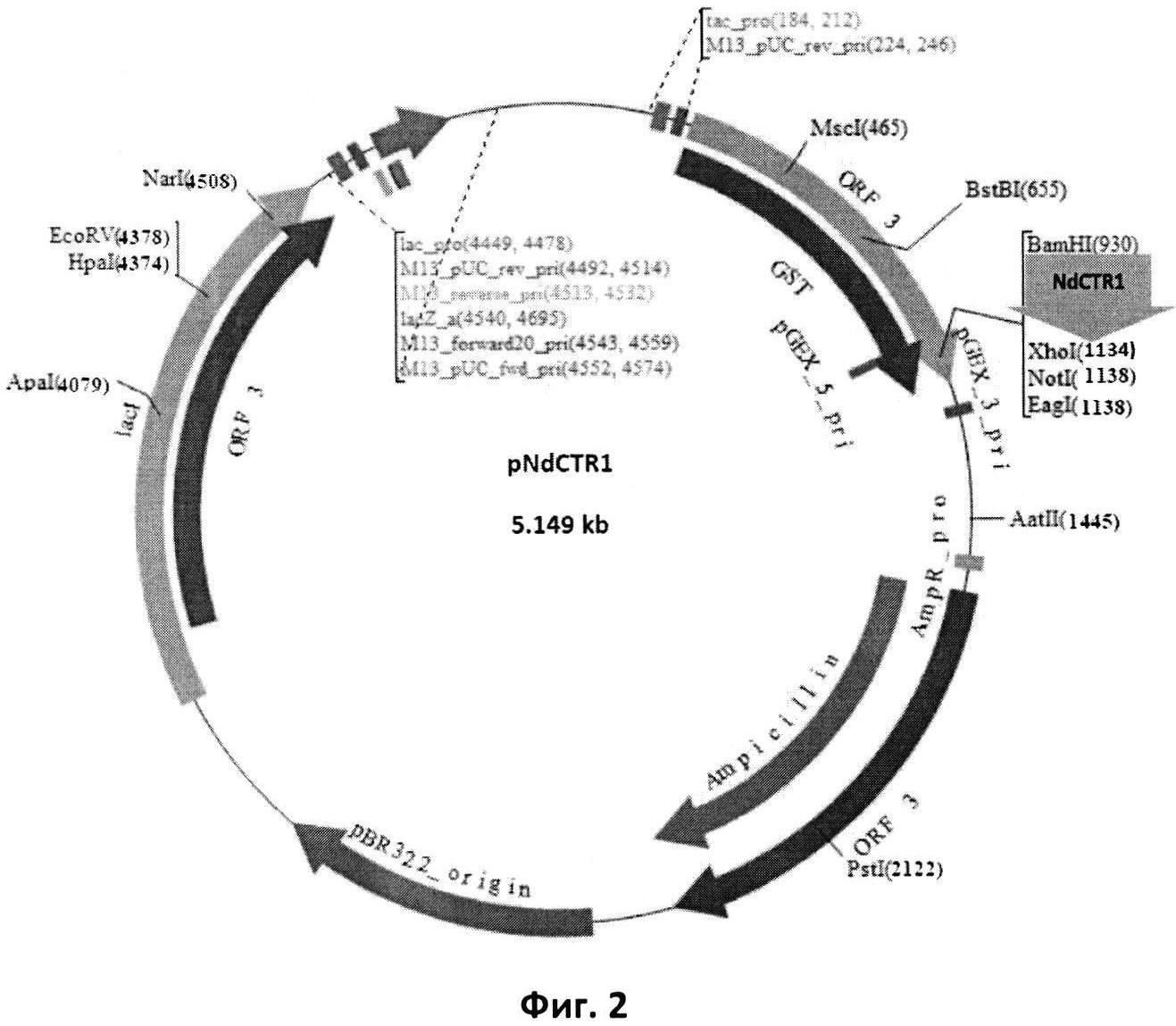
- рекомбинантная плазмидная ДНК pNdCTR1 (Фиг. 2, Seq ID No 1), имеющая размер 5149 п. н., состоящая из BamHI-XhoI - фрагмента векторной плазмиды pGEX-4T-1 (Amersham, ENA Sequence: U13853) размером 4951 п. н. и фрагмента гена SLC31A1 размером 198 п.н., кодирующего N-концевой домен белка CTR1 человека (NdCTR1);
- штамм бактерий Е. coli BL21(DE3)/pNdCTR1, стабильно продуцирующий гибридный полипептид GST-NdCTR1. Способность бактерий Е. coli BL21(DE3)/pNdCTR1 экспрессировать гибридный полипептид GST-NdCTR1 достигается при помощи трансформации клеток Е. coli BL21(DE3) плазмидой pNdCTR1;
- гибридный полипептид GST-NdCTR1 (Seq ID No 2), полученный продуцируемым штаммом бактерий Е. coli BL21(DE3)/pNdCTR1 с молекулярной массой 34,43 кДа, состоящий из 299 а.о. (в том числе 226 а.о. N-концевой последовательности глутатион-S-трансферазы и 66 а.о. NdCTR1), обладающий способностью хелатировать ионы меди, серебра и платины.
Гибридный полипептид GST-NdCTR1 может применяться во многих биологических и медицинских исследованиях, в частности при создании и изучении лекарственных средств и других соединений, являющихся хелаторами тяжелых металлов.
Медь является обязательным компонентом всех организмов [Maison, 1979; Prohaska, 2014]. Свойства меди стабильно существовать в двух состояниях окисления Cu(I)↔Cu(II) и быть комплексообразователем по отношению к аминокислотам, содержащим в боковой цепи -NH2, -СООН, -SH, -S-CH3 и имидазольную группы, делают ее подходящей для использования в качестве каталитического ко-фактора ферментов, осуществляющих окислительно-восстановительные реакции [Karlin, 1993]. Медь включена в активные центры ферментов (купроэнзимов), контролирующих жизненно важные процессы: защиту от оксидативного стресса (Cu/Zn-супероксиддисмутаза), клеточное дыхание (цитохром-с-оксидаза), образование нейропептидов (пептидилглицин α-гидроксилирующая монооксигеназа), синтез катехоламинов (допамин-β-гидроксилаза), формирование соединительной ткани (лизилоксидаза), двунаправленный транспорт железа (семейство голубых церулоплазмин-подобных (ферр)оксидаз) [Karlin, 1993; Vashchenko&MacGillivray, 2013]. Дефицит любого из перечисленных купроэнзимов ведет к развитию тяжелых заболеваний. Биологическая незаменимость меди сочетается с ее высокой токсичностью. Свободные ионы меди способны катализировать реакции типа Фентона, в результате которых образуются активные метаболиты кислорода, провоцирующие оксидативный стресс [Kozlowski et al., 2014]. В координационных сферах активных центров ферментов медь прочно связана в обоих состояниях окисления [Rubino&Franz, 2012]. К местам формирования купроэнзимов (цитозоль, митохондрии, комплекс Гольджи) медь переносится с помощью высоко консервативной системы белков-переносчиков (транспортная система меди). Общим свойством этих белков является наличие мотива, который связывает один ион меди в состоянии окисления Cu(I). Белки-транспортеры, или Cu(I)-шапероны, образуют цепочки, по которым они передают Cu(I) друг другу в направлении повышения аффинности их медь-связывающих мотивов при прямом взаимодействии [Nevitt et al., 2012].
Роль свободной меди в развитии нейродегенерации подтверждается успешным использованием специфических хелаторов меди при лечении болезней Паркинсона, Альцгеймера, Вильсона, а также прионовой болезни [Sigurdsson et al., 2003; Ward et al., 2012; Squitti et al., 2014]. В возникновении и росте опухолей медь играет неоднозначную роль. С одной стороны, она может быть провокатором малигнизации, с другой стороны, рост опухолей зависит от наличия биодоступной меди [Ishida et al., 2013]. Процесс неоваскуляризации зависит от меди, которая секретируется клетками и в примембранном пространстве модулирует связывание эндотелиального фактора роста с его рецептором [Prudovsky, 2013]. Новые, быстро образующиеся поколения клеток нуждаются в меди как в ко-факторе купроэнзимов. Показано, что уже на ранних этапах развития клетки опухоли вырабатывают фактор, стимулирующий метаболизм меди в печени, что приводит к повышению в крови уровня церулоплазмина [Babich et al., 2013], основного транспортера меди к непеченочным клеткам [Vashchenko&MacGillivray, 2013]. На культивируемых клетках и экспериментальных животных, выращивающих аутентичные и гетерологичные опухоли, показано, что ограничение биодоступной меди замедляет рост опухолей, при этом для снижения уровня меди используют те же хелаторы, что и для лечения нейродегенеративных болезней [Goodman et al., 2004; Babich et al., 2013; Crowe et al., 2013; Brewer, 2014]. Их также используют для лечения хронической легочной артериальной гипертензии, развивающейся на фоне прогрессивного роста сосудов [Bogaard et al. 2011], и диабетической кардиоваскулярной миопатии [Zhang S. et al., 2014].
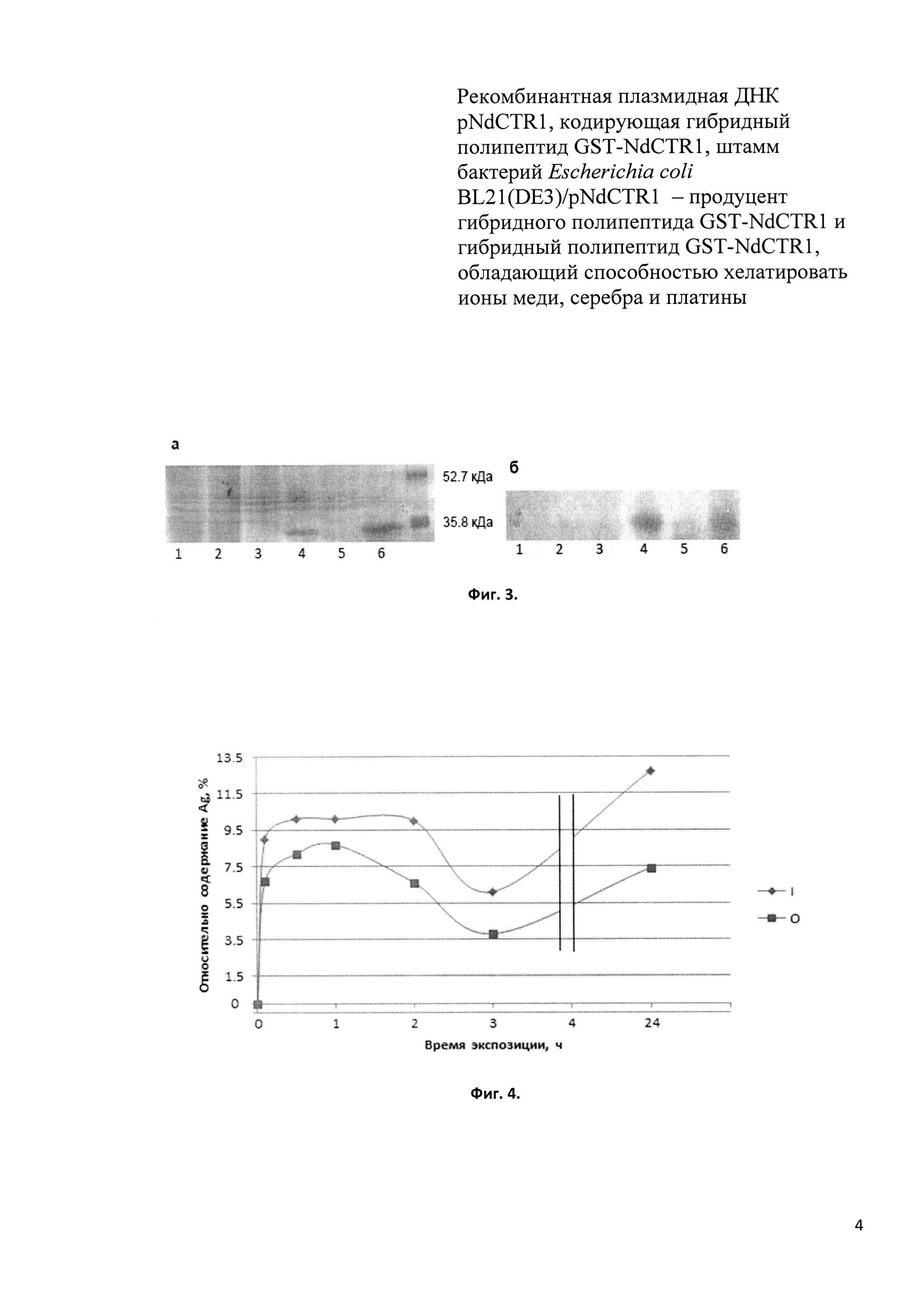
Белок CTR1 человека (кодируется геном SLC31A1) принадлежит семейству высокоаффинных импортеров меди [Sharp, 2003] и является центральным участником ТСМ. Он осуществляет перенос меди из внеклеточной среды во всех типах клеток без затраты энергии как ионный обменник [Handy et al., 2002]. Функциональная форма CTR1 собирается на плазматической мембране из трех идентичных субъединиц [Kim et al., 2008]. Субъединица состоит из 190 аминокислотных остатков, образующих три структурно-функциональных домена: внеклеточный N-концевой домен (NdCTR1), кластер из трех трансмембранных доменов, формирующих купрофильную пору, и цитозольный С-концевой домен (Фиг. 1). Короткий цитозольный домен (13 а.о.) на конце содержит мотив His-Cys-His, координирующий атом меди, который поступает через купрофильный канал. Цитозольные Cu(I)-шапероны принимают этот атом меди при прямом белок-белковом взаимодействии с С-концевым доменом CTR1.
Внеклеточный домен CTR1 (NdCTR1) содержит 66 а.о., обогащенных остатками гистидина и метионина, которые образуют три медь-связывающих мотива, отличающихся друг от друга способностью предпочтительно координировать или Cu(I), или Cu(II) (Фиг. 1). Мотивы 1 и 3 связывают Cu(I), мотив 2 - Cu(II) [Скворцов и др., 2012]. Остатки метионина в устье купрофильной поры образуют тиоэфирную «нанокаплю», удерживающую медь. Благодаря уникальному сочетанию медьсвязывающих мотивов, NdCTR1 может принимать медь, находящуюся в составе циркулирующих в кровотоке доноров, в обоих состояниях окисления (в составе церулоплазмина, альбумина, альфа2-макроглобулина, металлотионеина, или в комплексе с гистидином). Это же является причиной того, что NdCTR1, помимо атомов меди, эффективно связывает два абиогенных металла: серебро и платину. Электронная оболочка Ag(I) изоэлектронна Cu(I), a Pt(II) высокоаффинно связывается метионинами в устье мембранного канала [Zatulovsky et al., 2012; Скворцов и др. 2012; Galliani et al., 2014]. Поэтому CTR1 является основными воротами транспорта в клетки цисплатина, эффективного противоопухолевого препарата [Gupta&Lutsenko, 2009; Abada&Howell, 2010]. Таким образом, NdCTR1 обладает природным свойством хелатировать медь, серебро и платину.
Полипептид NdCTR1 выгодно отличается от используемых в клинике хелаторов следующими свойствами:
1) NdCTR1 - маленький растворимый белок (7,8 кДа) не содержит сигналов транспорта в клетку.
2) Он является внеклеточным участком белка человека, высоко консервативен как у млекопитающих, так и внутри вида, следовательно, не обладает антигенной активностью.
3) NdCTR1 связывает медь в обоих состояниях окисления [Cu(I) и Cu(II)] и, возможно, способен к ее внутримолекулярному восстановлению/окислению.
4) Обладает хелатирующими свойствами вне клетки, так как не содержит остатков цистеина, которые в присутствии электрофильных агентов и отсутствии глутатион-восстанавливающей системы, окисляются с образованием S-S-связей. Поэтому апо-форма NdCTR1 может связывать медь в кровотоке, где и необходимо пресекать транспорт меди к опухолевым клеткам.
5) NdCTR1 может связывать только лабильные атомы меди церулоплазмина, не влияя на его ферроксидазную активность [Zatulovskiy et al., 2007].
Результаты получения биогенного хелатора ионов меди, серебра и платины, соответствующего природному N-концевому полипептидному фрагменту высокоаффинного импортера меди человека CTR1, иллюстрируются следующими графическими материалами.
Seq ID No 1. Полная нуклеотидная последовательность рекомбинантной плазмиды pNdCTR1 (выделена последовательность, соответствующая NdCTR1).
Seq ID No 2. Нуклеотидная и аминокислотная последовательности, соответствующие гибридному полипептиду GST-NdCTR1 (выделен сайт протеолиза).
Фиг. 1. Топологическая структура субъединицы CTR1 человека [Du X. et al. 2012]. Субъединица состоит из внеклеточного домена с тремя медь-связывающими мотивами: мотив 1 (обогащен Н и М): 1MDHSHHMGMSYMD13, мотив 2 (гистидиновый): 19QPSHHHPT26 и мотив 3 (метиониновый): 39SMMMMPMT46; трех трансмембранных доменов, а также цитозольного домена, содержащего мотив НСН.
Фиг. 2. Схема рекомбинантной плазмиды pNdCTR1.
GST-ген глутатион-S-трансферазы; NdCTR1 - клонированный по уникальным сайтам рестрикции BamHI и XhoI фрагмент размером 198 н.п., полученный амплификацией фрагмента гена SLC31A1; ptac - синтетический промотор, присутствующий в векторной (pGEX-4T-1) и рекомбинантной плазмиде; Ampicillin - ген β-лактамазы (bla-ген), обеспечивающий трансформированным бактериальным клеткам устойчивость к ампициллину.
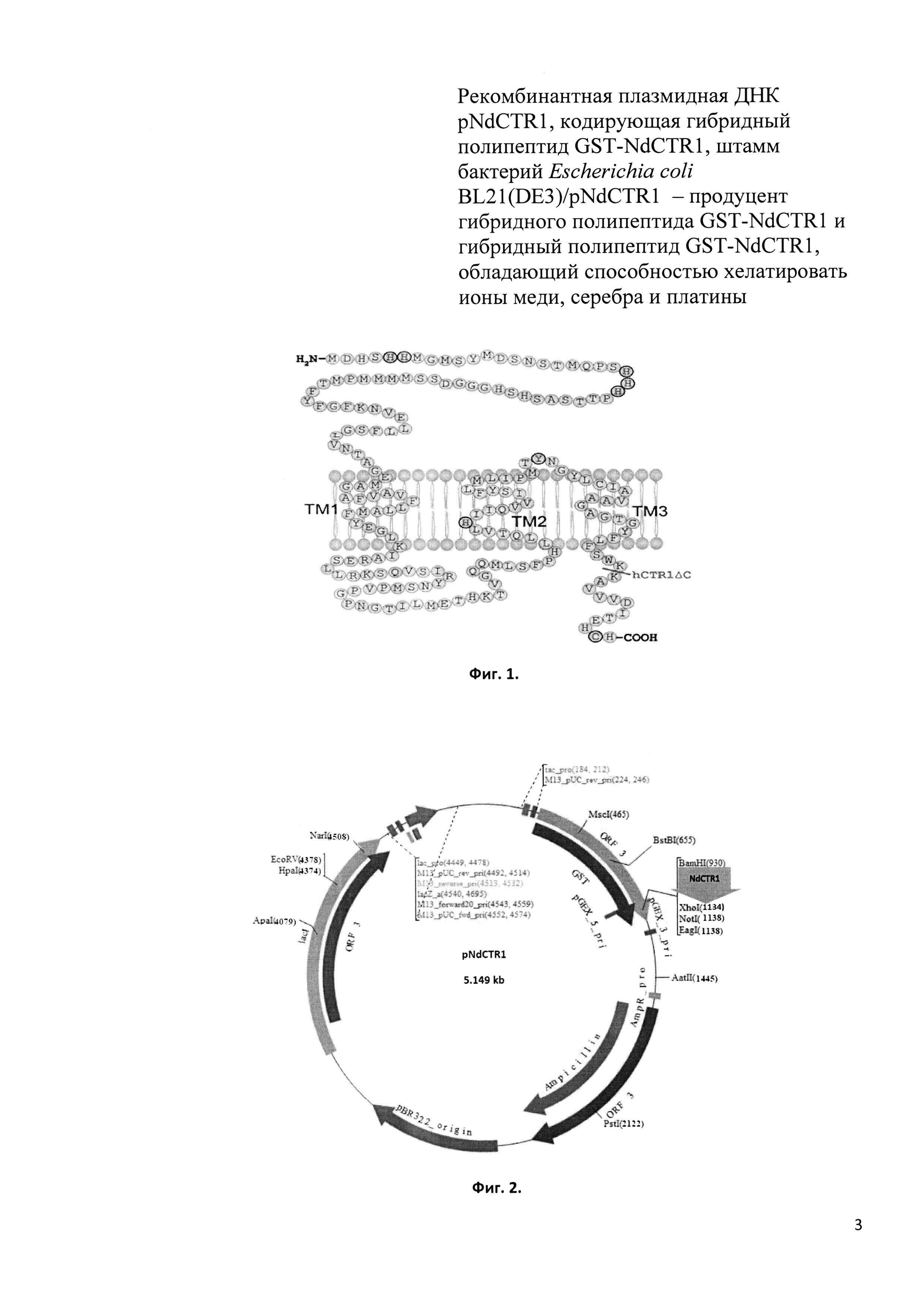
Фиг. 3. SDS-ПААГ (а) и иммуноблотинг с антителами к CTR1 (б) грубых клеточных экстрактов бактерий Е. coli BL21(DE3)/pNdCTR1, неиндуцированных (нечетные дорожки) и индуцированных IPTG (Isopropyl β-D-1-thiogalactopyranoside) в течение 0 мин (2), 90 мин (4) и 210 мин (6).
Фиг. 4. Относительное содержание серебра в образцах IPTG-индуцированных бактерий (I) Е. coli BL21(DE3)/pNdCTR1 (содержащих GST-NdCTR1) и неиндуцированных (О) в зависимости от времени обработки AgNO3.
Примеры осуществления настоящего изобретения
Пример 1. Процедура получения рекомбинантной плазмидной ДНК pNdCTR1, кодирующей гибридный полипептид GST-NdCTR1.
Из культивируемых клеток человека линии HepG2, характеризующихся высоким уровнем экспрессии гена SLC31A1, экстрагируют тотальную клеточную РНК. С помощью обратной транскрипции получают кДНК, которая используется в качестве матрицы для амплификации NdCTR1 - фрагмента гена SLC31A1. Используют уникальные праймеры: 5′cag gga tcc gat cat tcc cac cat atg ggg atg3′ и 5′cag ctc gag tcc agc tgt att gat cac ca3′, содержащие BamHI и XhoI сайты рестрикции, соответственно. Полученный фрагмент гена SLC31A1 (соответствующий NdCTR1), фланкированный BamHI и XhoI, клонируют по этим сайтам рестрикции в плазмидный вектор pGEX-4T-1 (Amersham) таким образом, чтобы нуклеотидная последовательность, соответствующая NdCTR1, находилась в одной рамке считывания с последовательностью, соответствующую GST. Идентичность клонированного фрагмента представленной в базе данных нуклеотидной последовательности (http://www.ncbi.nlm.nih.gov/nuccore/U83460), кодирующей NdCTR1, подтверждают прямым секвенированием. Полученная рекомбинантная плазмидная ДНК, названная pNdCTR1, имеет размер 5149 п.н. (Фиг. 2). Рекомбинантный белок GST-NdCTR1, кодируемый рекомбинантной плазмидой pNdCTR1, имеет размер 299 аминокислотных остатков и расчетную молекулярную массу 34,43 кДа.
Пример 2. Процедура получения штамма бактерий Е. coli BL21(DE3)/pNdCTR1, продуцирующих рекомбинантный белок GST-NdCTR1.
Бактерии Е. coli выращивают в жидкой или на агаризованной питательной среде на основе аминопептида (Самсон-Мед, СПб). Для получения бактериального штамма-продуцента гибридного белка GST-NdCTR1 компетентные клетки Е. coli BL21(DE3) трансформируют сконструированной целевой рекомбинантной плазмидной ДНК pNdCTR1 с помощью стандартной методики трансформации бактерий с использованием хлористого кальция [Маниатис и др. 1984]. Трансформанты отбирают на селективной питательной среде, содержащей 100 мг/л ампициллина. Полученный штамм бактерий Е. coli BL21(DE3)/pNdCTR1 по морфологическим и культуральным признакам не отличается от исходного штамма Е. coli BL21(DE3), не содержащего целевую плазмиду.
Пример 3. Процедура получения рекомбинантного полипептида GST-NdCTR1 в бактериальной системе экспрессии.
Бактерии штамма Е. coli BL21 (DE3)/pNdCTR1 культивируют в жидкой питательной среде с ампициллином (100 мг/л) для получения ночных культур. На следующий день засевают ночной культурой в отношении 1:100 свежую среду с ампициллином и инкубируют при 37°C до плотности OD600=0,6-0,8. Транскрипцию и трансляцию гибридного полипептида GST-NdCTR1 индуцируют 1 мМ IPTG в течение 3,5 часов при 30°C. Параллельно клетки Е. coli BL21(DE3)/pNdCTR1 инкубируют в тех же условиях, но без добавления IPTG. Их используют в качестве контроля. Бактерии собирают центрифугированием и используют в последующих экспериментах.
Денатурирующий электрофорез в ПААГ грубых клеточных экстрактов показал, что индуцированные бактерии, в отличие от неиндуцированных, синтезируют белок, по молекулярной массе соответствующий ожидаемому размеру (34.43 кДа) гибридного полипептида GST-NdCTR1 (Фиг. 3а). В культивируемой среде присутствие рекомбинантного белка обнаружено не было. Данные иммуноблотинга с коммерческими антителами к GST и антителами к конъюгату гемоцианина с химически синтезированным 15-членным пептидом, соответствующим второму медь-связывающему мотиву NdCTR1, подтвердили, что мажорная зона содержит гибридный полипептид GST-NdCTR1 (Фиг. 3б).
Хелатирующие свойства гибридного полипептида GST-NdCTR1 иллюстрируются следующими примерами.
Пример 4. Определение влияния эндогенного гибридного полипептида GST-NdCTR1 на чувствительность бактерий E. coli BL21(DE3)/pNdCTR1 к ионам серебра, меди и платины.
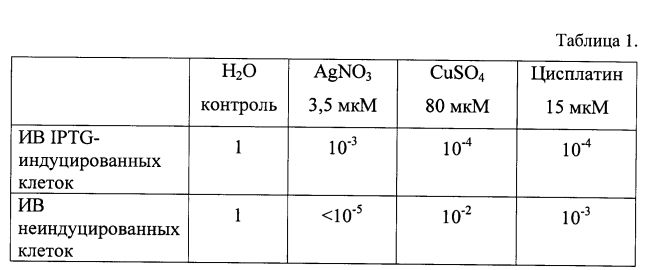
Все тесты на выживаемость бактерий проводят титрованием IPTG-индуцированных и контрольных клеток E. coli BL21(DE3)/pNdCTR1 после их 24-часовой обработки 3,5 мкМ AgNO3, 80 мкМ CuSO4 или 15 мкМ цисплатина при 37°C. Индекс выживаемости (ИВ) определяют как отношение количества бактерий, сохранивших колониеобразующую способность, к исходному количеству жизнеспособных клеток. Результаты показывают, что чувствительность IPTG-индуцированных клеток E. coli BL21(DE3)/pNdCTR1 (содержащих рекомбинантный белок GST-NdCTR1) к ионам серебра заметно снижена и, в то же время, значимо повышена как к ионам двухвалентной меди, так и к цисплатину (Табл. 1). Данные однозначно демонстрируют, что гибридный полипептид GST-NdCTR1 обладает способностью связывать все три металла.
Влияние эндогенного полипептида GST-NdCTR1 на чувствительность бактерий E. coli BL21(DE3)/pNdCTR1 к ионам серебра меди и платины.
Наблюдаемый эффект для цисплатина согласуется с данными, показывающими, что в отсутствии CTR1 раковые клетки демонстрируют устойчивость к цисплатину, снижающую терапевтический эффект этого противоопухолевого препарата [Kuo et al., 2007]. Молекулярные механизмы транспорта цисплатина в клетку не изучены.
Пример 5. Динамика GST-NdCTR1-зависимого накопления серебра в бактериях E. coli BL21(DE3)/pNdCTR1.
Измерения концентрации серебра в IPTG-индуцированных (содержащих рекомбинантный белок GST-NdCTR1) и неиндуцированных бактериях E. coli BL21(DE3)/pNdCTR1 проводят после их 24-часовой обработки 3,5 мкМ AgNO3 при 37°C. После инкубации клетки осаждают центрифугированием при 12000×g, в течение 4 минут. Супернатант отбрасывают, клетки ресуспендируют в воде и после промывки осаждают центрифугированием. Перед проведением измерений концентрации серебра клетки растворяют в высокочистой концентрированной HNO3. Концентрацию металла измеряют на атомно-абсорбционном спектрометре с дейтериевой и Зеемановской коррекцией фона ZEEnit 650Р (Германия). Содержание аккумулированного серебра выражают в процентах количества серебра, обнаруживаемого в бактериях Е. coli BL21(DE3)/pNdCTR1, к количеству серебра, присутствовавшему в среде инкубации в нулевое время (Фиг. 4). Показана достоверно повышенная способность бактерий Е. coli BL21(DE3)/pNdCTR1, содержащих (вследствие IPTG-индукции) рекомбинантный белок GST-NdCTR1, аккумулировать серебро.
Сопоставление индекса выживаемости бактерий E. coli BL21(DE3)/pNdCTR1, обработанных ионами серебра, и динамики накопления металла показывает, что клетки, экспрессирующие GST-NdCTR1, одновременно с повышенной способностью аккумулировать серебро демонстрируют устойчивость к его длительному воздействию. В совокупности данные показывают, что гибридный полипептид GST-NdCTR1 обладает хелатирующей способностью.
Так как гибридный полипептид GST-NdCTR1 содержит глутатион-S-трансферазу, при необходимости он легко может быть очищен в соответствии со стандартной процедурой на колонке с Сефарозой, конъюгированной с глутатионом. Благодаря тому, что в гибридном белке присутствует сайт для специфической протеиназы (тромбина), расположенный между полипептидными фрагментами GST и NdCTR1 (Seq ID No 2), можно получить высокоочищенный препарат NdCTR1.
Таким образом, гибридный полипептид GST-NdCTR1, содержащий N-концевой полипептидный фрагмент глутатион-S-трансферазы, соединенный через сайт гидролиза тромбином с полипептидным фрагментом N-концевого домена высокоаффинного импортера меди человека CTR1, продуцируемый штаммом бактерий Е. coli BL21(DE3)/pNdCTR1, полученным трансформацией клеток Е. coli BL21(DE3) рекомбинантной плазмидной ДНК pNdCTR1, кодирующей гибридный полипептид GST-NdCTR1, обладает хелатирующими свойствами. Это позволяет считать задачу получения биогенного хелатора ионов меди, серебра и платины выполненной.
Список цитированной литературы
1. Скворцов А.Н. и др. 2012. Структурно-функциональная организация CTR1, высокоаффинного импортера меди эукариотов, определяет его способность транспортировать медь, серебро и цисплатин // Мол. Биол. 46: 335-347.
2. Маниатис Т., Фрич Э., Сэмбрук Д.Ж. Методы генетической инженерии. Молекулярное клонирование. М.: Мир. 1984.
3. Abada P., Howell S.B. 2010. Regulation of cisplatin cytotoxicity by Cu influx transporters. Metal. Based. Drugs. 2010:317581.
4. Babich P.S. et al. 2013. Non-hepatic tumors change the activity of genes encoding copper trafficking proteins in the liver // Cancer Biol Ther. 14: 614-624.
5. Bogaard H.J. et al. 2011. Copper dependence of angioproliferation in pulmonary arterial hypertension in rats and humans // Am. J. Respir. Cell. Mol. Biol. 46: 582-591.
6. Brewer GJ. 2014. The promise of copper lowering therapy with tetrathiomolybdate in the cure of cancer and in the treatment of inflammatory disease // J. Trace Elem. Med. Biol. 28: 372-378.
7. Brown D.J.F. et al. 2006. The relationship between an inflammation based prognostic score (GPS) and changes in serum biochemical variables in patients with advanced lung and gastrointestinal cancer // J. Clin. Pathol. doi:10.1136/jcp.2005.033217.
8. Crowe A. 2013. Rapid copper acquisition by developing murine mesothelioma: decreasing bioavailable copper slows tumor growth, normalizes vessels and promotes T cell infiltration // PLoS ONE, 8(8): e73684. doi:10.1371/journal.pone. 0073684.
9. Du X. et al. 2012. Comparison between copper and cisplatin transport mediated by human copper transporter 1 (hCTR1) // Metallomics. 4: 679-685.
10. Gaggelli E. et al. 2006. Copper homeostasis and neurodegenerative disorders (Alzheimer′s, prion, and Parkinson′s diseases and amyotrophic lateral sclerosis) // Chem. Rev. 106: 1995-2044.
11. Galliani A. et al. 2014. Cisplatin handover between copper transporters: the effect of reducing agents // J. Biol. Inorg. Chem. 19(4-5): 705-714.
12. Goodman V.L. et al. 2004. Copper deficiency as an anti-cancer strategy // Endocr Relat Cancer. 11: 255-263.
13. Gupta A., Lutsenko S. 2009. Human copper transporters: mechanism, role in human diseases and therapeutic potential // Future Med Chem. 1: 1125-1142.
14. Handy R.D. et al. 2002. Sodium-dependent copper uptake across epithelia: a review of rationale with experimental evidence from gill and intestine // Biochim. Biophys. Acta. 1566: 104-115.
15. Karlin K.D. 1993. Metalloenzymes, structural motif, and inorganic models // Science. 261: 701-707.
16. Kim B.E. et al. 2008. Mechanisms for copper acquisition, distribution and regulation // Nat Chem Biol. 4: 176-185.
17. Kozlowski H. et al. 2014. General aspects of metal toxicity // Curr. Med. Chem. 21:3721-3740.
18. Kuo M.T. et al. 2007. The roles of copper transporters in cisplatin resistance // Cancer Metastasis Rev. 26(1): 71-83.
19. Mason K.E. 1979. A conspectus of research on copper metabolism and requirements of man // J. Nutr. 109: 1979-2066.
20. Mason J. 1986. Thiomolybdates: mediators of molybdenum toxicity and enzyme inhibitors // Toxicology. 42: 99-109.
21. Mills C.F. et al. 1981. Effects of molybdate, sulfide, and tetrathiomolybdate on copper metabolism in rats // J. Inorg. Biochem. 14: 189-207.
22. Montes S. et al. 2014. Copper and copper proteins in Parkinson′s disease // Hindawi Publishing Corporation Oxidative Medicine and Cellular Longevity. Volume 2014, Article ID 147251, 15 pages http://dx.doi.org/10.1155/2014/147251.
23. Nevitt T. et al. 2012. Charting the travels of copper in eukaryotes from yeast to mammals // Biochim. Biophys. Acta. 1823: 1580-1593.
24. Prohaska J.R. 2014. Impact of copper deficiency in humans // Ann. N.Y. Acad. Sci. 1314:1-5.
25. Prudovsky I. 2013. Nonclassically secreted regulators of angiogenesis // Angiol. Open Access. 1: 1000101.
26. Rubino J.Т., Franz K.J. 2012. Coordination chemistry of copper proteins: how nature handles a toxic cargo for essential function // J. Inorg. Biochem. 107: 129-143.
27. Sharp P.A. 2003. CTR1 and its role in body copper homeostasis // Int. J. Biochem. Cell. Biol. 35: 288-291.
28. Sigurdsson E.M. et al. 2003. Copper chelation delays the onset of prion disease // J. Biol. Chem. 278: 46199-46202.
29. Squitti R. et al. 2014. Low-copper diet as a preventive strategy for Alzheimer′s disease // Neurobiology of Aging. 35: S40eS50.
30. Suttle N.F. 2012. Copper Imbalances in Ruminants and Humans: Unexpected Common Ground // Adv. Nutr. 3: 666-674.
31. Vashchenko G. MacGillivray R.T. 2013. Multi-copper oxidases and human iron metabolism, Nutrients. 5: 2289-2313.
32. Ward R.J. et al. 2012. Chelating agents for neurodegenerative diseases // Curr Med Chem. 19: 2760-2772.
33. Zatulovsky E.A. et al. 2012. Depletion of holo-Cp leads to retardation of cisplatin uptake // J. Inorg. Biochem. 116: 88-96.
34. Zatulovskiy E. et al. 2007. Docking study on mammalian CTR1 copper importer motifs // BMC Systems Biology, 1 (Suppl 1): 51-54.
35. Zhang S. et al. Diabetic cardiomyopathy is associated with defective myocellular copper regulation and both defects are rectified by divalent copper chelation // Cardiovascular Diabetology. 2014. 13: 100-118.