Результат интеллектуальной деятельности: СПОСОБ МОДЕЛИРОВАНИЯ АБСЦЕССА МЯГКИХ ТКАНЕЙ
Вид РИД
Изобретение
Изобретение относится к медицине, экспериментальной и гнойной хирургии и может быть использовано для поиска новых способов лечения абсцессов мягких тканей.
В литературе известны способы моделирования абсцессов мягких тканей:
1) После обработки кожи животного в подкожную клетчатку вводили 1-1,5 мл скипидара, формирование абсцесса происходит через несколько часов, затем в полученную полость вводили 2-4×105 КОЕ St.aureus (Шалимов С.А., Радзинский А.П., Кейсевич А.В. Руководство по экспериментальной хирургии. - М.: Медицина, 1989. - 272 с.). Недостатком этого способа является то, что введенный в подкожную клетчатку скипидар не создает ограниченную полость, а распространяется по подкожному пространству, и введение возбудителя моделирует гнойную распространенную рану, а не абсцесс.
2) После обработки кожи под местной анестезией раствором новокаина 0,5% 10-мл иглой наносили повреждения мягких тканей (область длинных мышц спины) на глубине 3 см шириной 2 см в предполагаемой зоне формирования абсцесса. В день начала эксперимента под наркозом производился разрез скомпрометированной накануне области длинной 3 см и в мягкие ткани вводился стерильный марлевый шарик диаметром 10 мм, пропитанный 1 мл жидкости с патогенным штаммом St.aureus. На рану накладывались первичные швы (Джимак С.С., Барышев М.Г., Басов А.А. Влияние сверхнизких концентраций дейтерия на процессы свободнорадикального окисления у лабораторных животных. - www.biophys.ru/archive/congress2012/proc-p73.pdf). Недостатком этого метода является высокая травматичность, сложность выполнения способа. Также моделированный абсцесс не отвечал всем требованиям отграниченного гнойного воспаления, так как производился обширный дефект одной из стенок, а это уже является гнойной раной, а не абсцессом.
Наиболее близким способом формирования абсцесса мягких тканей является способ, заключающийся в том, что в подкожную клетчатку вначале вводился воздух и в сформировавшийся воздушный пузырь медленно вводился инфекционный агент, через 7 суток формировался подкожный абсцесс (Моделирование экстрасфинктерного свища прямой кишки в эксперименте. / С.В. Шахрай // Медицинский журнал. - 2012. - №3. - С. 131-135). Недостатком этого способа является то, что воздушный пузырь и введенный инфекционный агент не создает стенку предполагаемого абсцесса, которая должна отграничивать гнойное содержимое от его распространения по подкожному пространству. Следовательно, автор моделировал гнойную распространенную рану, а не абсцесс подкожного пространства, как было заявлено.
Нами впервые предложен способ формирования абсцесса мягких тканей в эксперименте, который отвечает всем требованиям отграниченного гнойного воспаления мягких тканей.
Способ осуществляется следующим образом.
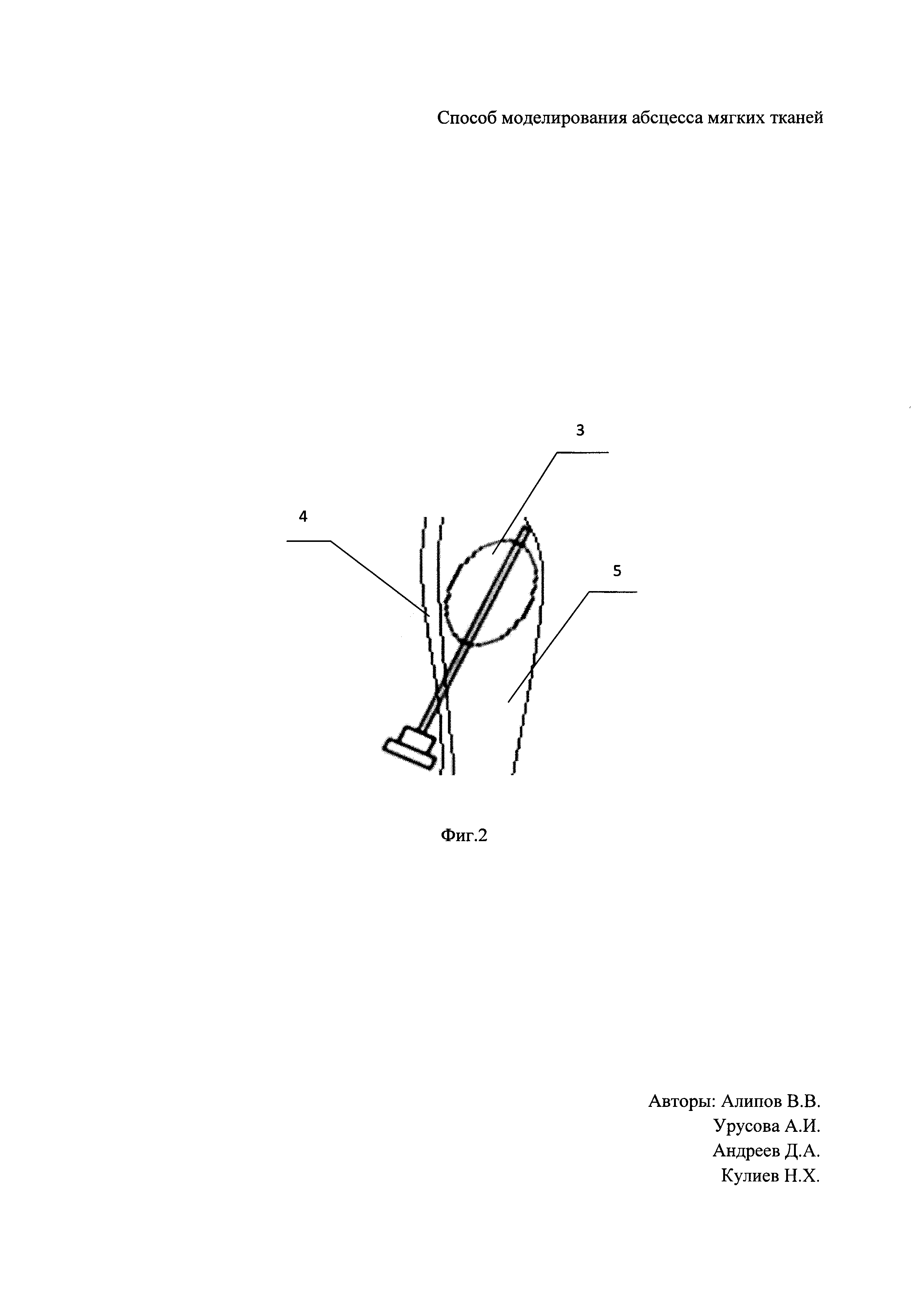
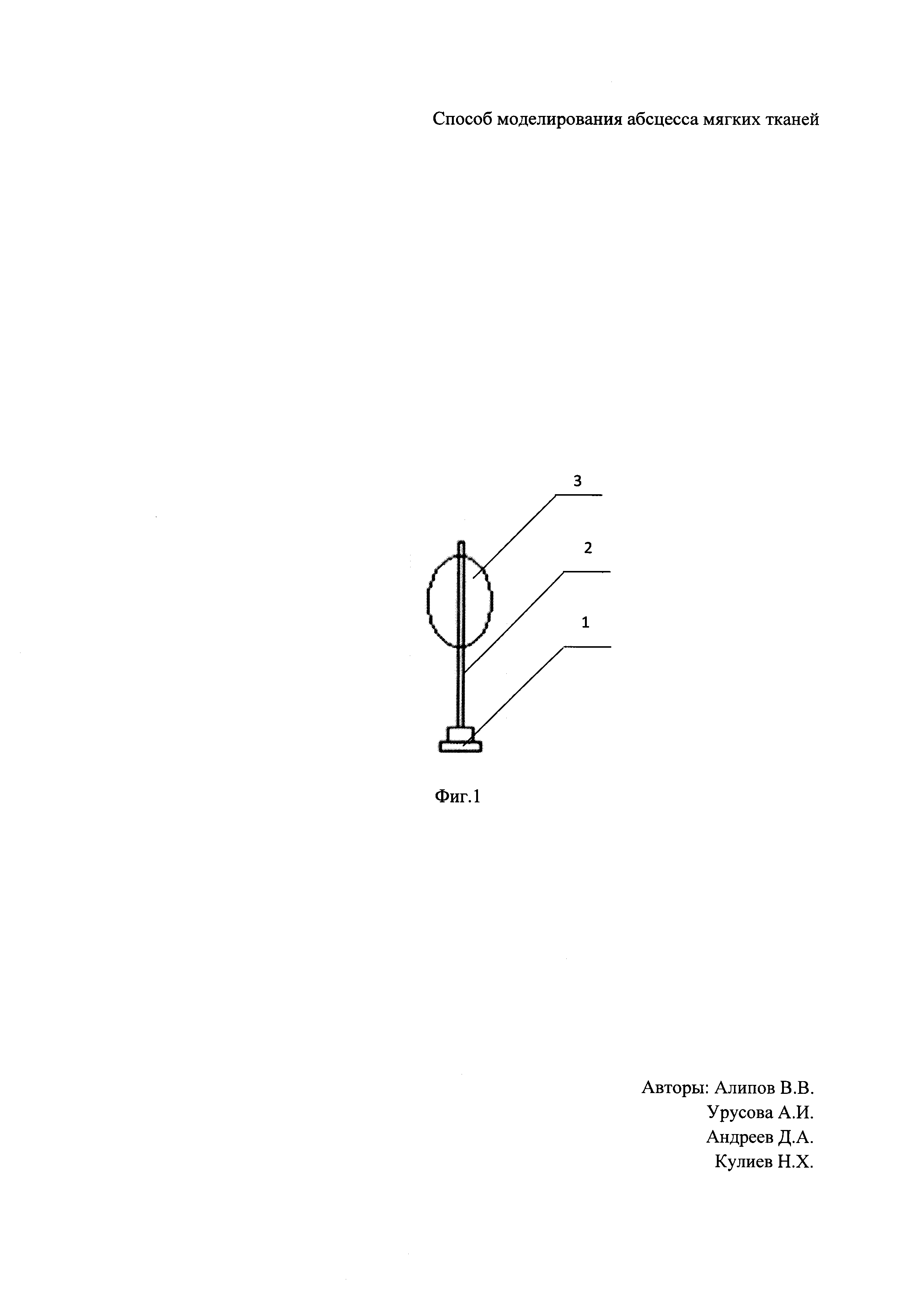
Для формирования абсцесса мягких тканей крысы определен участок кожи в межлопаточной области размером 5×3 см. Область была выбрана не случайно, а как недоступная зона для животного. После чего произведена депиляция и обработка антисептиком (70% этиловый спирт) участка кожи. Далее выполнен наркоз с помощью комбинированного специализированного препарата «Zoletil 100» в дозе 50 мг/кг (Ю.В. Фокин, Д.С. Сахаров. Сравнительная характеристика и возможность использования наркотизирующих препаратов Золетил 100 и диэтиловый эфир при проведении операций по вживлению ЭЭГ-электродов на крысах // Биомедицина, №1, 2011, с. 84-89). Произведена пункция подкожного пространства иглой Дюфо, после в проделанное иглой отверстие в коже диаметром 2 мм введен модифицированный катетер Фогарти, суть модификации в том, что мы изменили длину катетера путем его укорочения до 4 см, смотри Фиг. 1, где 1 - клапан, 2 - проводник, 3 - раздуваемый баллон, и раздут баллон в объеме 2 мл раствором 0,9% NaCl, конец катетера укрыт с помощью кожной дупликатуры, смотри Фиг. 2, на которой схематическое расположение катетера, где 3 - раздуваемый баллон, 4 - кожа, 5 - подкожное пространство.
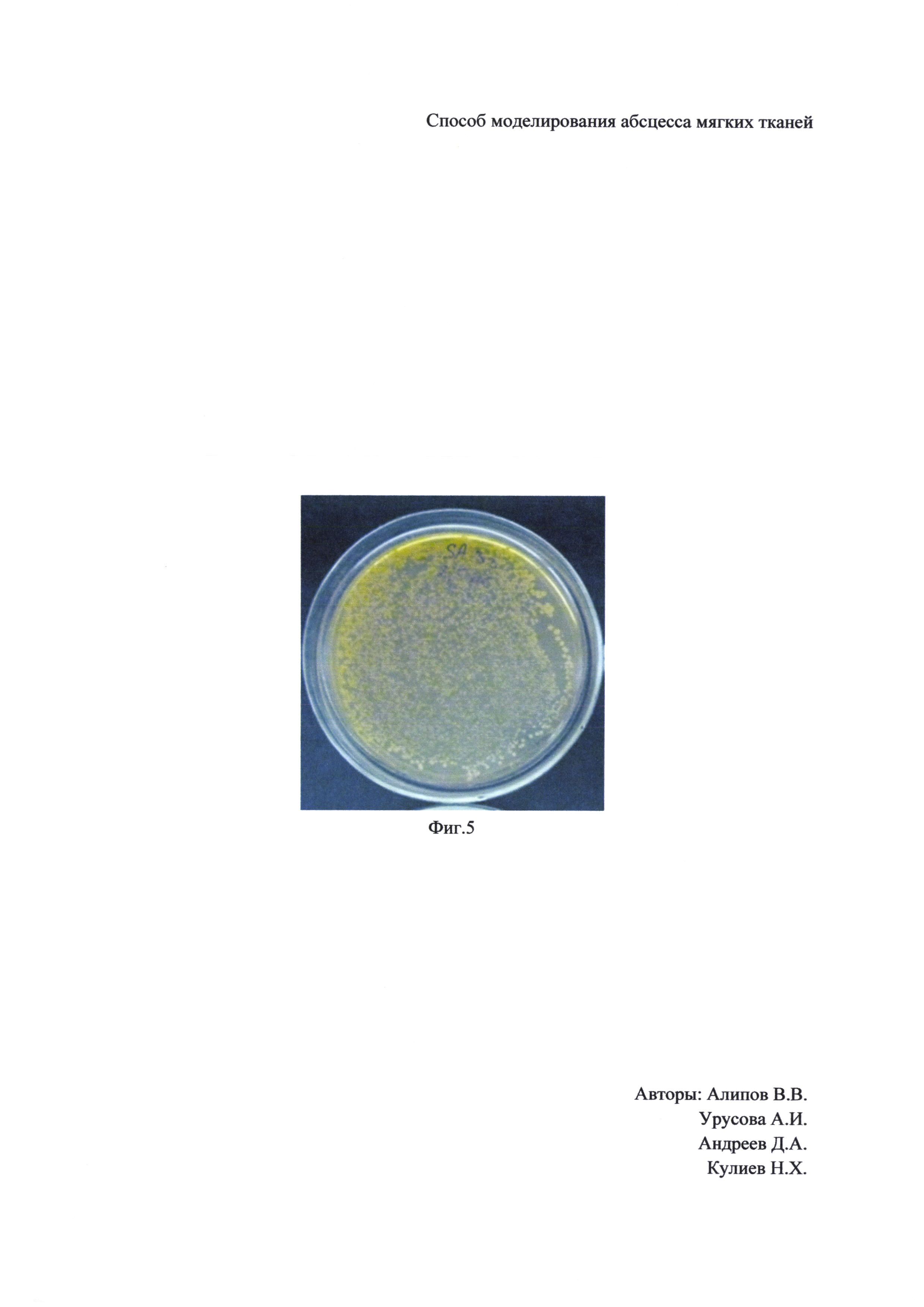
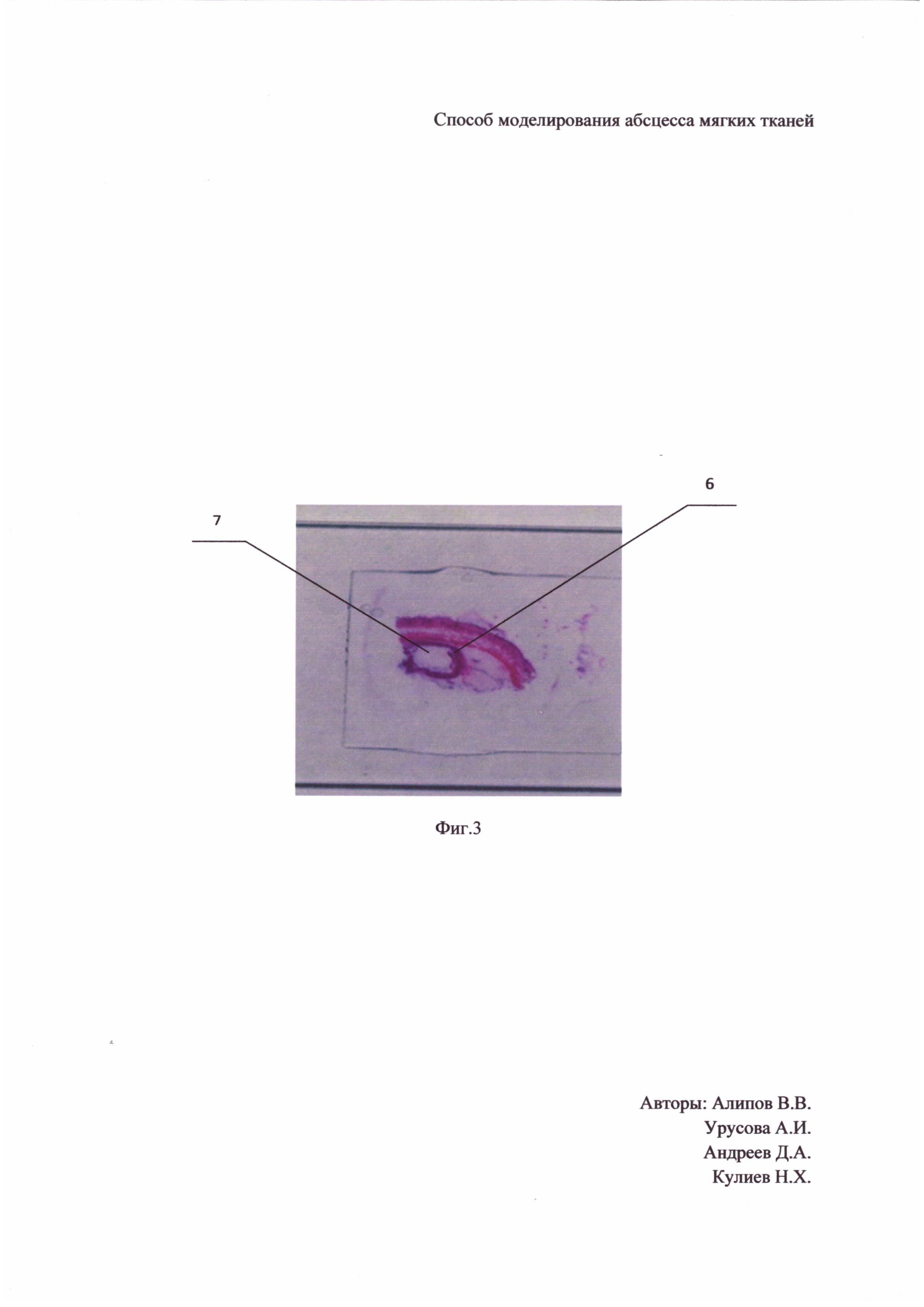
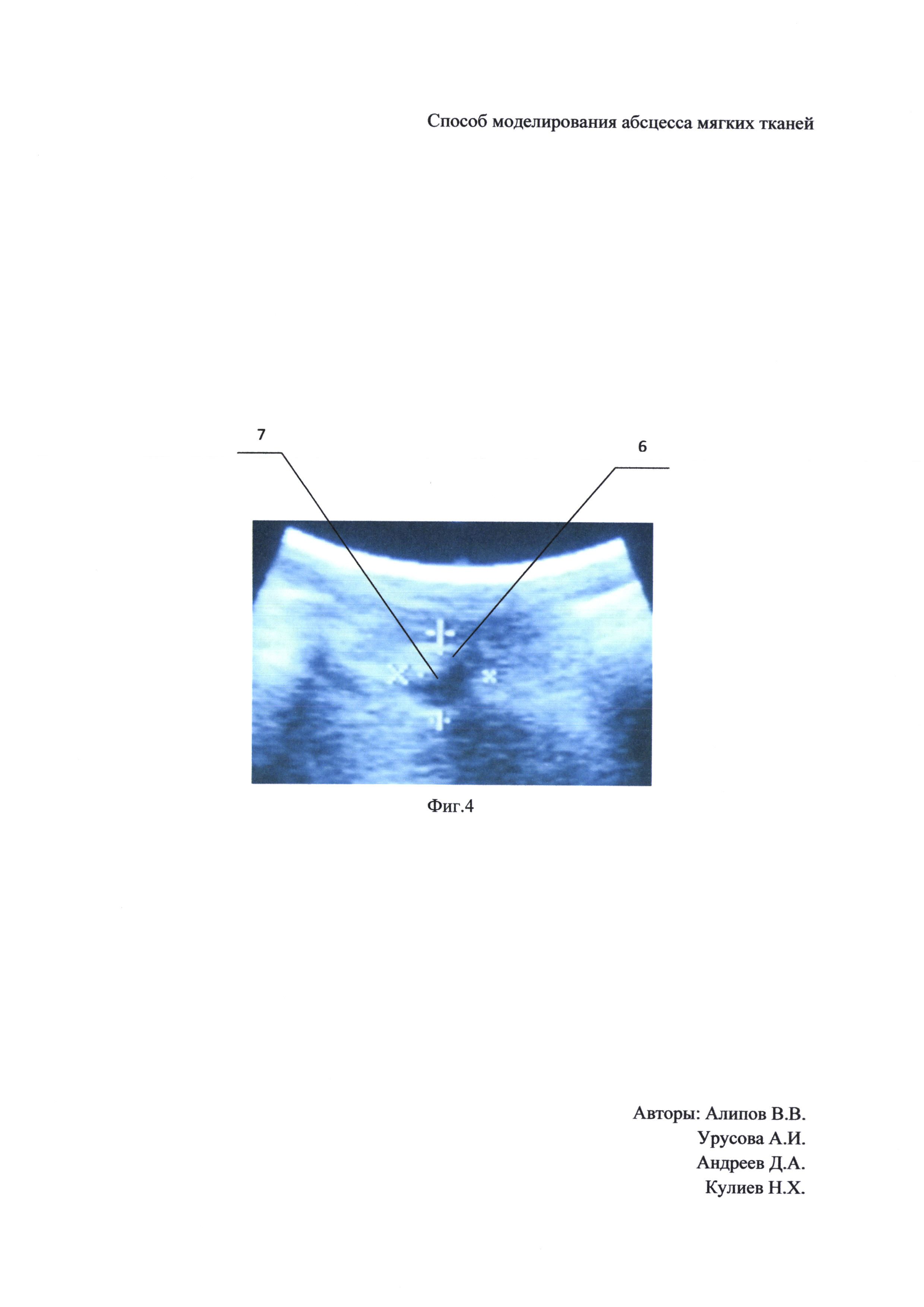
Наши исследования показали, что через 2-е суток после введения катетера стенки полости недостаточно образованы. Так как на 3-е сутки стенки сформированы, то более длительно держать катетер нецелесообразно, на Фиг. 3 показано гистологическое исследование полости, где 6 - стенка абсцесса, 7 - полость абсцесса. Через 3-е суток после установления катетера было произведено опорожнение баллона и удаление катетера, и уже в полученную полость вводили стандартизированную по оптическому стандарту мутности МакФарланда суспензию Staphylococcus aureus с микробной нагрузкой 2 мл × 106 КОЕ. На 5-е сутки был сформирован абсцесс мягких тканей, который отвечал всем требованиям отграниченного абсцесса, как видно на Фиг. 4 при ультразвуковом исследовании, где 6 - стенка абсцесса. 7 - полость абсцесса, и при посеве гнойного отделяемого на питательную среду отмечается рост микроорганизмов сплошным газоном, смотри Фиг. 5. Таким образом, все методы диагностики подтверждают наличие моделированного абсцесса с хорошо сформированными стенками у всех 10 лабораторных животных (крысы-самцы массой 200±10 г).
Пример
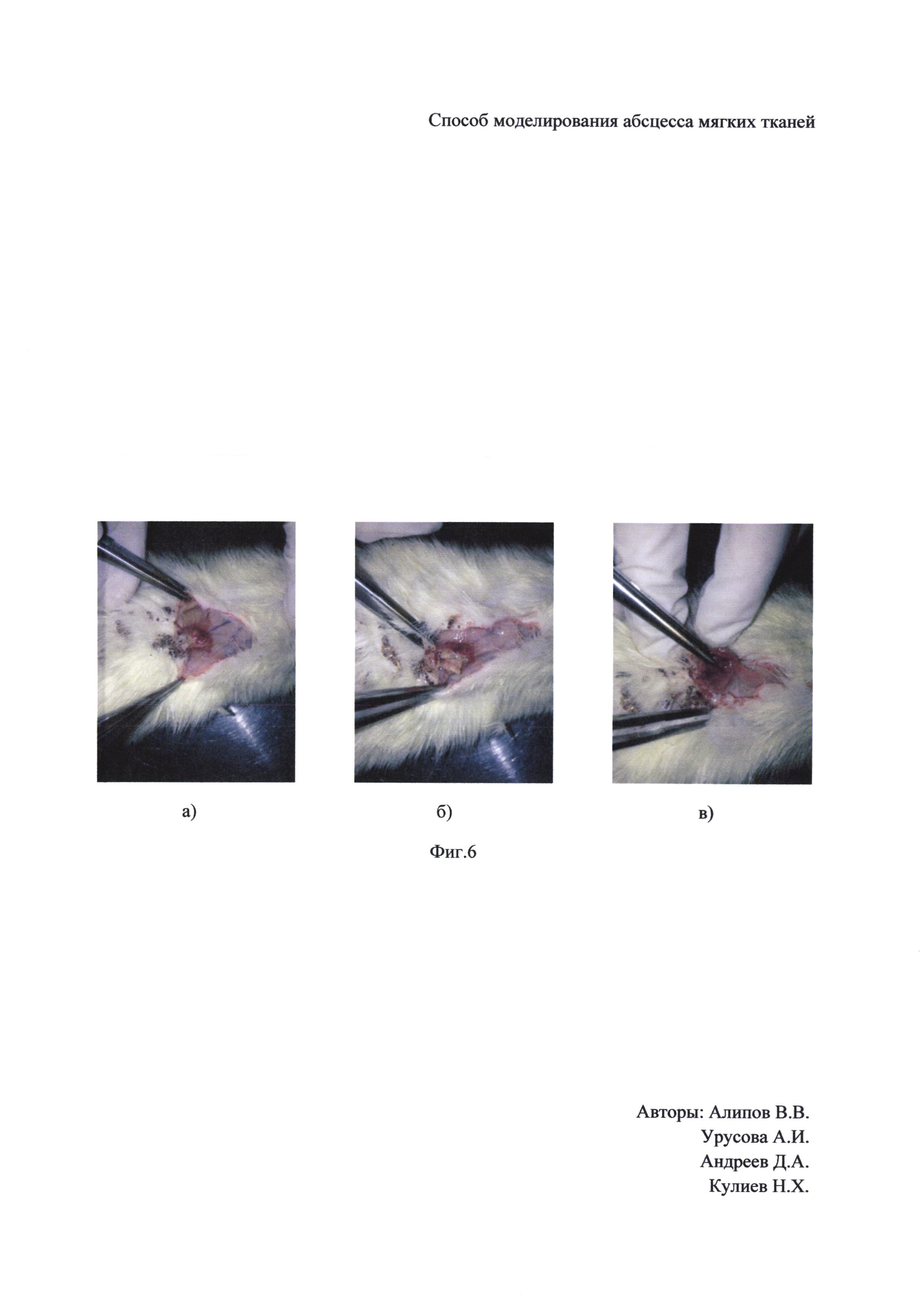
Кролику-самцу породы шиншилла в возрасте 1 год и массой 3±0,5 кг после депиляции и обработки антисептиком кожи произведена пункция подкожного пространства и был установлен катетер и раздут баллон в объеме 2 мл раствором 0,9% NaCl. На 3-е сутки баллон был опорожнен и в образованную полость введена суспензия Staphylococcus aureus с микробной нагрузкой 2 мл × 106 КОЕ. На 5 сутки у кролика был сформирован абсцесс мягких тканей.
На Фиг. 6 изображено макроскопическое исследование, подтверждающие все признаки абсцесса, где а) до вскрытия абсцесса, б) после вскрытия с отделяемым гноем, в) после санирования абсцесса.
Заключение.
Таким образом, предлагаемый нами способ является малотравматичным, обеспечивает гарантированное формирование абсцесса, не требует каких-либо сложных манипуляций и высокого технического оснащения, обеспечивает срок формирования абсцесса до 5 дней.
Способ моделирования абсцесса мягких тканей, включающий введение животному возбудителя патологического процесса в подкожное пространство, отличающийся тем, что предварительно в это пространство вводят катетер с раздуваемым баллоном, при этом баллон раздувают в объеме 2 мл раствором 0,9% NaCl, конец катетера укрывают с помощью кожной дупликатуры, через трое суток опорожняют баллон и удаляют катетер, затем в образовавшуюся полость в качестве возбудителя патологического процесса вводят суспензию Staphylococcus aureus с микробной нагрузкой 2 мл × 10 КОЕ.