Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ ХИНОЛИН-2-АМИНА, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ СПИДа
Вид РИД
Изобретение
Изобретение относится к новым соединениям для получения композиций, полезных для лечения заболеваний, возникающих в результате изменений в процессах сплайсинга.
Некоторые соединения - производные индола, такие как производные эллиптицина и производные азаэллиптицина, уже известны в качестве интеркалирующих молекул для корректировки функциональных нарушений вэкспрессии генов, в частности в репликации ДНК. Они конкретнее описаны для лечения заболеваний, таких как рак, лейкемия или СПИД (см., в частности, патенты FR 2627493, FR 2645861, FR 2436786).
В отношении существующих в настоящее время способов лечения СПИДа, в различных подходах, направленных на уменьшение вирусной нагрузки у пациентов, инфицированных ВИЧ (вирус иммунодефицита человека), используют молекулы, предназначенные для ингибирования ферментативной активности вирусной обратной транскриптазы или протеазы, вовлеченной в созревание вирусного белка. В отношении ингибиторов обратной транскриптазы, данные ингибиторы могут быть по природе нуклеозидными (NRTI), ненуклеозидными (NNRTI) или нуклеотидными. Задача применения этих соединений заключается в том, чтобы предотвратить продукцию кДНК ретровирусного генома и, следовательно, встраивание в геном клетки хозяина. Ингибиторы протеазы (PI) мешают правильному созреванию вирусных белков и приводят к продукции неполных частиц с измененными инфицирующими способностями. Существует другой тип противоретровирусного соединения, используемого ввиду его способности предотвращать проникновение вирусов в клетку. Эти ингибиторы проникновения могут представлять собой или пептиды, которые мешают слиянию вирусных гликопротеинов gp41 или gp120 с мембраной клеток CD4, или молекулы, которые нацелены на ВИЧ клеточные корецепторы CCR5 и CXCR4. Отсутствие клеточных белков, напоминающих интегразу ВИЧ, также использовали для разработки новых молекул против ВИЧ, которые ингибируют данную ферментативную активность. Хотя множество ингибиторов интегразы находятся на стадии клинических испытаний, ни одна молекула еще не доступна в продаже.
Процесс внутриклеточного сплайсинга состоит из удаления интронов в пре-мРНК с получением зрелых матричных РНК, которые могут быть использованы в механизме трансляции в клетке (SHARP, Cell, vol.77, p.805-815, 1994). В случае альтернативного сплайсинга тот же самый предшественник может представлять собой источник матричных РНК, кодирующих белки с отличающимися функциями (BLACK, Annu. Rev. Biochem. vol.72, p.291-336, 2003). Таким образом, точный выбор сайтов 5' и 3' сплайсинга представляет собой механизм, который создает разнообразие и который может приводить к регуляции экспрессии генов в соответствии с типом ткани или в течение развития организма. Факторы, вовлеченные в этот выбор, включают семейство белков, названных SR, характеризующихся наличием одного или двух мотивов распознавания РНК (RRM) и домена, богатого аргининовыми и сериновыми остатками, названного доменом RS (MANLEY & ТАСКЕ, Genes Dev., vol.10, p.1569-1579, 1996). Путем связывания с короткими последовательностями экзонов или интронов пре-мРНК, названными ESE (экзонный энхансер сплайсинга) или ISE (интронный энхансер сплайсинга), белки SR способны активировать, в зависимости от дозы, субоптимальные сайты сплайсинга и делать возможным включение экзонов (GRAVELEY, RNA, vol.6, p.1197-1211, 2000). Активность белка SR в альтернативном сплайсинге является специфической в такой степени, что инактивация соответствующего гена оказывается смертельной (WANG et al., Mol. Cell, vol.7, p.331-342, 2001).
Секвенирование человеческого генома и анализ банков EST (маркер экспрессируемой последовательности) выявили, что 90-94% генов экспрессируются в форме альтернативно сплайсированных вариантов (Wang et al., Nature vol.456, p.470-474, 2008; Pan et al., Nat. Genet, vol.40, p.1413-1425, 2008). Таким образом, этот механизм представляет собой благоприятную мишень для модификаций, которые могут воздействовать на факторы, вовлеченные в регуляцию сплайсинга, и для мутаций, которые воздействуют на последовательности, необходимые для данной регуляции. В настоящее время, по имеющимся оценкам, приблизительно 50% точечных мутаций, ответственных за генетические заболевания, вызывают ошибочный сплайсинг. Эти мутации могут затрагивать сплайсинг путем инактивации или создания сайтов сплайсинга, а также путем модификации или образования регуляторных элементов, таких как энхансеры сплайсинга или сайленсеры сплайсинга в конкретном гене (CARTEGNI et al., Nat. Rev. Genet., vol.3, p.285-298, 2002; TAZI et al., TIBS, vol.40, p.469-478, 2005).
Стратегии, разрабатываемые в настоящее время для коррекции этих дефектов сплайсинга, основываются на применении различных типов молекул (TAZI et al., вышеприведенная, 2005).
Одна стратегия, направленная на разработку новых молекул для коррекции или устранения аномального сплайсинга, например, основывается на сверхэкспрессии белков, которые затрагивают этот тип сплайсинга (NISSIM-RAFINIA et al., Hum. Mol. Genet., vol.9, p.1771-1778, 2000; HOFINANN et al., Proc. Natl. Acad. Sci. U.S.A., vol.97, p.9618-9623, 2000).
Другие стратегии основываются на применении антисмысловых олигонуклеотидов (SAZANI et al., Nat. Biotechnol., vol.20, p.1228-1233, 2002; SAZANI & KOLE, Prog. Mol. Subcell. Biol., vol.31, p.217-239, 2003) или PNA (пептидо-нуклеиновая кислота) (CARTEGNI et al., Nat. Struct. Biol., vol.10, p.120-125, 2003), позволяющих, соответственно, ингибировать или активировать событие сплайсинга.
Еще одна стратегия основывается на идентификации соединений, которые влияют на эффективность сплайсинга соответствующей пре-мРНК (ANDREASSI et al., Hum. Mol. Genet., vol.10, p.2841-2849, 2001).
Наконец, была описана стратегия, основанная на применении транс-сплайсинга для замены мутантных экзонов (LIU et al., Nat. Biotechnol., vol.20, р.47-52, 2002).
Одним из недостатков разработанных вышеприведенных стратегий для корректировки или устранения аномального сплайсинга является их технологическая себестоимость. Действительно, стоимость продукции антисмысловых олигонуклеотидов, которые должны быть модифицированы для улучшения их стабильности, и стоимость молекул PNA является высокой.
Другой недостаток разработанных стратегий, приведенных выше, заключается в том, что для них требуется применение экспрессирующих векторов, таких как, например, для стратегии, основанной на применении транс-сплайсинга.
В Международной заявке WO 05023255, с приоритетом заявок Франции FR 0310460 и FR 0400973, поданной заявителем, было раскрыто применение производных индола для лечения заболеваний, связанных с процессом сплайсинга пре-мРНК в клетке.
Таким образом, было недавно показано, что определенные производные индола оказываются особенно эффективными в лечении метастатического рака и в лечении СПИДа (BAKKOUR et al., PLoS Pathogens, vol.3, p.1530-1539, 2007).
Тем не менее, описанные соединения обладают плоской структурой с четырьмя кольцами, которые обладают недостатком интеркаляции между основаниями ДНК и, таким образом, могут приводить к клеточной токсичности.
Для сведения к минимуму риска того, что эти производные индола интеркалируют между основаниями ДНК, авторы изобретения разработали новые соединения, которые являются особенно эффективными при лечении заболеваний, связанных с процессом сплайсинга, но которые неожиданным образом обладают клеточной токсичностью, которая явно меньше, чем у производных индола предшествующего уровня техники. Кроме того, эти соединения способны избирательно ингибировать определенные события сплайсинга.
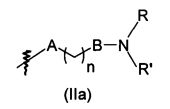
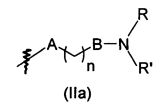
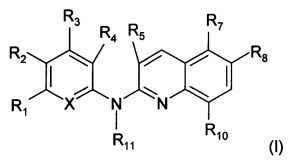
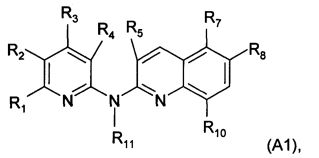
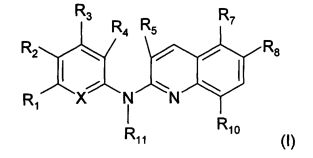
Согласно первому аспекту объект настоящего изобретения относится к соединению формулы (I) для применения в качестве агента для предупреждения, ингибирования или лечения СПИДа
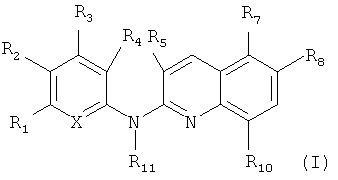
где:
X представляет собой CR0 или N, т.е. образует вместе с кольцом, к которому он относится, соответственно бензольную или пиридиновую группу,
R0, R1, R2, R3, R4, R7 и R8 независимо представляют собой атом водорода, атом галогена или группу, выбранную из (С1-C5)алкильной группы, (C3-С6)циклоалкильной группы, (С1-C5)фторалкильной группы, (C1-С5)алкоксигруппы, (С1-C5)фторалкоксигруппы, группы -CN, группы -COORa, группы -NO2, группы -NRaRb, группы -NRa-SO2-NRaRb, группы -NRa-SO2-Ra, группы -NRa-C(=O)-Ra, группы -NRa-C(=O)-NRaRb, группы -SO2-NRaRb, группы -SO3H, группы -OH, группы -O-SO2-ORc, группы -O-P(=O)-(ORc)(ORd), группы -O-CH2-COORc, и может дополнительно представлять собой группу, выбранную из:
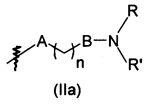
A представляет собой ковалентную связь, атом кислорода или NH,
В представляет собой ковалентную связь или NH,
n равен 1, 2, 3, 4 или 5,
m равен 1, 2 или 3,
R, R', Ra и Rb независимо представляют собой атом водорода, (C1-С5)алкильную группу или (С3-C6)циклоалкильную группу,
R и R' могут дополнительно образовывать вместе с атомом азота, к которому они присоединены, насыщенный 5- или 6-членный гетероцикл, возможно содержащий дополнительный гетероатом, выбранный из N, О и S, причем указанный гетероцикл возможно замещен одним или более чем одним R,
Rc и Rd независимо представляют собой атом водорода, Li+, Na+, K+, N+(Ra)4 или бензильную группу,
R5 представляет собой атом водорода, (C1-С5)алкильную группу или (С3-C6)циклоалкильную группу,
R10 представляет собой атом водорода или атом хлора, и
R11 представляет собой атом водорода или (C1-С4)алкильную группу,
или любой из его фармацевтически приемлемых солей,
при условии, что по меньшей мере три из R5, R7, R8 и R10 отличаются от атома водорода, или в качестве альтернативы
при условии, что один из R7 и R8 представляет собой группу, выбранную из

 , группу -NRa-SO2-NRaRb, группу -NRa-SO2-Ra, группу -NRa-C(=O)-Ra и группу -NRa-C(=O)-NRaRb, где R, R', A, B, Ra, Rb, n и m являются такими, как определено выше, а другой из R7 и R8 представляет собой атом водорода, или в качестве альтернативы
, группу -NRa-SO2-NRaRb, группу -NRa-SO2-Ra, группу -NRa-C(=O)-Ra и группу -NRa-C(=O)-NRaRb, где R, R', A, B, Ra, Rb, n и m являются такими, как определено выше, а другой из R7 и R8 представляет собой атом водорода, или в качестве альтернативы
при условии, что один из R0, R1, R2, R3 и R4 представляет собой группу, выбранную из

 , группу -NRa-SO2-NRaRb, группу -NRa-SO2-Ra, группу -NRa-C(=O)-Ra и группу -NRa-C(=O)-NRaRb, где R, R', А, В, Ra, Rb, n и m являются такими, как определено выше.
, группу -NRa-SO2-NRaRb, группу -NRa-SO2-Ra, группу -NRa-C(=O)-Ra и группу -NRa-C(=O)-NRaRb, где R, R', А, В, Ra, Rb, n и m являются такими, как определено выше.
Согласно другому аспекту объект настоящего изобретения относится к самому соединению формулы (I), определенному выше, или любой из его фармацевтически приемлемых солей,
и при условии, что исключены следующие соединения:
- соединение формулы (I), где, если R2 представляет собой -OH, то ни R1, ни R3 не представляет собой радикал 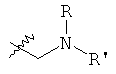 , где R и R' являются такими, как определено выше,
, где R и R' являются такими, как определено выше,
- соединение формулы (I), где, если R8 представляет собой метоксигруппу, то ни R1, ни R3 не представляет собой радикал  , где R и R' являются такими, как определено выше,
, где R и R' являются такими, как определено выше,
- соединение формулы (I) где, если R8 представляет собой группу -NH-С(=O)-CH3, то R2 не представляет собой группу -N(CH3)2,
- и за исключением следующих соединений
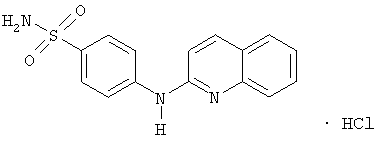 и
и 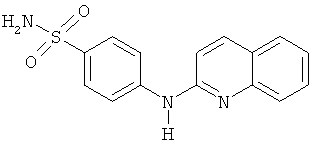
Согласно более конкретному воплощению настоящее изобретение в частности фокусируется на самом соединении формулы (I), где:
X представляет собой CR0 или N, т.е. образует вместе с кольцом, к которому он относится, соответственно бензольную или пиридиновую группу,
R0 и R4 независимо представляют собой атом водорода, атом фтора, группу NO2, группу NH2, метильную группу, метоксигруппу, трифторметоксигруппу, группу -N-SO2-N(CH3)2, группу -N-SO2-CH3, группу -N-С(=O)-CH3 или группу -N-C(=O)-NRaRb,
R1 и R3 независимо представляют собой атом водорода, метильную группу или трифторметильную группу, атом хлора, метоксигруппу, трифторметоксигруппу или группу, выбранную из:
 и
и  ,
,
X1 представляет собой O, N(CH3) или CH2,
m равен 1 или 2,
R2 представляет собой атом водорода, атом фтора, метильную группу, трифторметильную группу, группу NH2, метоксигруппу, трифторметоксигруппу, группу -O-CH2-CH2-ОН, группу -N-SO2-N(CH3)2, группу -N-SO2-CH3, группу -N-С(=O)-CH3 или группу -N-C(=O)-NRaRb,
R5 представляет собой атом водорода или метильную группу,
R7 представляет собой атом водорода, группу NH2, или, когда R8 представляет собой атом водорода, R7 может дополнительно представлять собой группу, выбранную из:

 , группу -N-SO2-N(CH3)2, группу -N-SO2-СН3, группу -N-С(=O)-CH3 и группу -N-C(=O)-N(Ra)(Rb),
, группу -N-SO2-N(CH3)2, группу -N-SO2-СН3, группу -N-С(=O)-CH3 и группу -N-C(=O)-N(Ra)(Rb),
n равен 1, 2 или 3,
А, В, R, R', Ra и Rb являются такими, как определено выше в формуле (I),
R8 представляет собой атом водорода, группу NH2 или когда R7 представляет собой атом водорода, R8 может дополнительно представлять собой группу, выбранную из:

 ,
,
R10 представляет собой атом водорода или атом хлора, и
R11 представляет собой атом водорода или (C1-С4)алкильную группу,
или любой из его фармацевтически приемлемых солей,
при условии, что по меньшей мере три из R5, R7, R8 и R10 отличаются от атома водорода, или в качестве альтернативы
при условии, что один из R7 и R8 представляет собой группу, выбранную из:


а другой из R7 и R8 представляет собой атом водорода, причем R7 дополнительно способен представлять собой группу -N-SO2-N(СН3)2, группу -N-SO2-СН3, группу -N-С(=O)-CH3 или группу -N-C(=O)-NRaRb, когда R8 представляет собой атом водорода, где R, R', А, В, Ra, Rb, n и m являются такими, как определено выше, или в качестве альтернативы
при условии, что R1 или R3 представляет собой группу, выбранную из:
 и
и  где X1 и m являются такими, как определено выше, или в качестве альтернативы
где X1 и m являются такими, как определено выше, или в качестве альтернативы
при условии, что R0, R2 или R4 представляет собой группу, выбранную из группы -N-SO2-N(СН3)2, группы -N-SO2-CH3, группы -N-С(=O)-CH3 и группы -N-C(=O)-NRaRb, где Ra и Rb являются такими, как определено выше,
и при условии, что исключено следующее соединение:

Согласно конкретному воплощению дополнительный объект настоящего изобретения представляет собой само соединение формулы (А1)
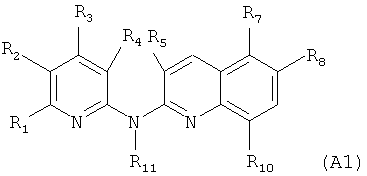
где:
R1 и R3 независимо представляют собой атом водорода, метильную группу или трифторметильную группу,
R2 представляет собой атом водорода, атом фтора, метильную группу, трифторметильную группу, группу NH2, группу N-SO2-N(СН3)2, группу -N-SO2-CH3, группу -N-С(=O)-СН3 или группу -N-C(=O)-NRaRb,
R4 представляет собой атом водорода, группу NO2, группу NH2, атом фтора, метильную группу, группу -N-SO2-N(CH3)2, группу -N-SO2-CH3, группу -N-С(=O)-CH3 или группу -N-C(=O)-NRaRb,
R5 представляет собой атом водорода или метильную группу,
R7 представляет собой атом водорода, группу NH2, или, когда R8 представляет собой атом водорода, R7 представляет собой группу, выбранную из:

 , группу -N-SO2-N(CH3)2, группу -N-SO2-CH3, группу -N-С(=O)-CH3 и группу -N-C(=O)-NRaRb,
, группу -N-SO2-N(CH3)2, группу -N-SO2-CH3, группу -N-С(=O)-CH3 и группу -N-C(=O)-NRaRb,
n равен 1, 2 или 3,
m равен 1 или 2,
А, В, R, R', Ra и Rb являются такими, как определено выше в формуле (I),
R8 представляет собой атом водорода, группу NH2, или, когда R7 представляет собой атом водорода, R8 может дополнительно представлять собой группу, выбранную из:


R10 представляет собой атом водорода или атом хлора, и
R11 является таким, как определено выше в формуле (I), и предпочтительно представляет собой атом водорода,
или любую из его фармацевтически приемлемых солей,
при условии, что по меньшей мере три из R5, R7, R8 и R10 отличаются от атома водорода, или в качестве альтернативы
при условии, что один из R7 и R8 представляет собой группу, выбранную из:

 , а другой из R7 и R8 представляет собой атом водорода, причем R7 дополнительно способен представлять собой группу -N-SO2-N(CH3)2, группу -N-SO2-CH3, группу -N-С(=O)-СН3 или группу -N-C(=O)-NRaRb, когда R8 представляет собой атом водорода, где R, R', А, В, Ra, Rb, n и m являются такими, как определено выше, или в качестве альтернативы
, а другой из R7 и R8 представляет собой атом водорода, причем R7 дополнительно способен представлять собой группу -N-SO2-N(CH3)2, группу -N-SO2-CH3, группу -N-С(=O)-СН3 или группу -N-C(=O)-NRaRb, когда R8 представляет собой атом водорода, где R, R', А, В, Ra, Rb, n и m являются такими, как определено выше, или в качестве альтернативы
при условии, что R2 или R4 представляет собой группу, выбранную из группы -N-SO2-N(CH3)2, группы -N-SO2-CH3, группы -N-С(=O)-CH3 и группы -N-C(=O)-NRaRb, где Ra и Rb являются такими, как определено выше,
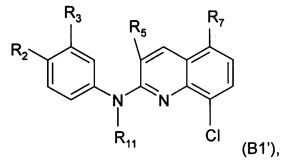
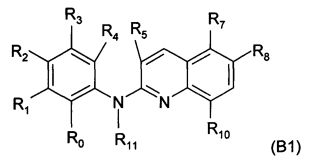
Согласно другому конкретному воплощению дополнительный объект настоящего изобретения представляет собой само соединение формулы (В1)
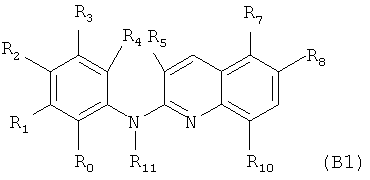
где:
R0 и R4 независимо представляют собой атом водорода, группу NO2, группу NH2, метильную группу, метоксигруппу, трифторметоксигруппу, группу -N-SO2-N(CH3)2, группу -N-SO2-CH3, группу -N-С(=O)-СН3 или группу -N-С(=O)-NRaRb,
R1 и R3 независимо представляют собой атом водорода, атом хлора, метоксигруппу, трифторметоксигруппу или группу, выбранную из:

 ,
,
X1 представляет собой О, N(СН3) или СН2,
m равен 1 или 2,
R2 представляет собой атом водорода, метоксигруппу, трифторметоксигруппу или группу -O-CH2-CH2-OH,
R5 представляет собой атом водорода или метильную группу,
R7 представляет собой атом водорода, группу NH2, или, когда R8 представляет собой атом водорода, R7 представляет собой группу, выбранную из:

 , группу -N-SO2-N(CH3)2, группу -N-SO2-CH3, группу -N-С(=O)-CH3 и группу -N-C(=O)-NRaRb,
, группу -N-SO2-N(CH3)2, группу -N-SO2-CH3, группу -N-С(=O)-CH3 и группу -N-C(=O)-NRaRb,
n равен 1, 2 или 3,
А, В, R, R', Ra и Rb являются такими, как определено выше в формуле (I),
R8 представляет собой атом водорода, группу NH2 или, когда R7 представляет собой атом водорода, R8 может дополнительно представлять собой группу, выбранную из:


R10 представляет собой атом водорода или атом хлора, и
R11 является таким, как определено выше в формуле (I), и предпочтительно представляет собой атом водорода,
или любую из его фармацевтически приемлемых солей,
при условии, что по меньшей мере три из R5, R7, R8 и R10 отличаются от атома водорода, или в качестве альтернативы
при условии, что один из R7 и R8 представляет собой группу, выбранную из:

 , а другой или R7 и R8 представляет собой атом водорода, причем R7 дополнительно способен представлять собой группу -N-SO2-N(CH3)2, группу -N-SO2-CH3, группу -N-С(=O)-СН3 или группу -N-C(=O)-NRaRb, когда R8 представляет собой атом водорода, где R, R', А, В, Ra, Rb, n и m являются такими, как определено выше, или в качестве альтернативы
, а другой или R7 и R8 представляет собой атом водорода, причем R7 дополнительно способен представлять собой группу -N-SO2-N(CH3)2, группу -N-SO2-CH3, группу -N-С(=O)-СН3 или группу -N-C(=O)-NRaRb, когда R8 представляет собой атом водорода, где R, R', А, В, Ra, Rb, n и m являются такими, как определено выше, или в качестве альтернативы
при условии, что R1 или R3 представляет собой группу, выбранную из:
 и
и 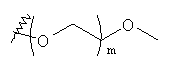 где X1 и m являются такими, как определено выше, или в качестве альтернативы
где X1 и m являются такими, как определено выше, или в качестве альтернативы
при условии, что R0, R2 или R4 представляет собой группу, выбранную из группы -N-SO2-N(СН3)2, группы -N-SO2-СН3, группы -N-С(=O)-СН3 и группы -N-C(=O)-NRaRb, где Ra и Rb являются такими, как определено выше,
и при условии, что исключено следующее соединение:

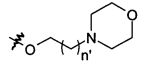
Согласно более конкретному воплощению настоящее изобретение в частности фокусируется на самом соединении формулы (А1), где:
R1, R2, R8 и R11 представляют собой атом водорода,
R3 представляет собой метильную группу или трифторметильную группу,
R4 представляет собой атом водорода или группу NH2,
R5 представляет собой атом водорода или метильную группу,
R7 представляет собой атом водорода, группу NH2, или, когда R8 представляет собой атом водорода, R7 может дополнительно представлять собой группу, выбранную из:
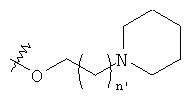
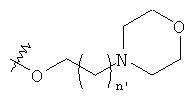 , и группу -N-SO2-N(СН3)2,
, и группу -N-SO2-N(СН3)2,
n' равен 0, 1 или 2 и более предпочтительно 1, и
R10 представляет собой атом водорода или атом хлора,
или любой из его фармацевтически приемлемых солей,
при условии, что по меньшей мере три из R5, R7, R8 и R10 отличаются от атома водорода, или в качестве альтернативы
при условии, что R7 представляет собой группу, выбранную из:

 , и группу -N-SO2-N(СН3)2, где n' является таким, как определено выше.
, и группу -N-SO2-N(СН3)2, где n' является таким, как определено выше.
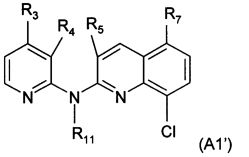
Еще согласно этому более конкретному воплощению настоящее изобретение в частности фокусируется на самих соединениях формулы (А1')
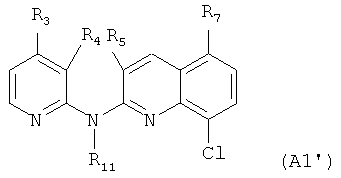
где:
R3 представляет собой атом водорода, метильную группу или трифторметильную группу, и предпочтительно представляет собой метильную группу или трифторметильную группу,
R4 представляет собой атом водорода, группу NO2, группу NH2, атом фтора, метильную группу, группу -N-SO2-N(СН3)2, группу -N-SO2-СН3, группу -N-С(=O)-СН3 или группу -N-C(=O)-NRaRb, и предпочтительно представляет собой атом водорода или группу NH2,
R5 представляет собой атом водорода или метильную группу,
R7 представляет собой атом водорода, группу NH2 или группу, выбранную из:

 , группу -N-SO2-N(СН3)2, группу -N-SO2-CH3, группу -N-C(=O)-CH3 и группу -N-C(=O)-NRaRb, и предпочтительно группу -N-SO2-N(СН3)2, группу NH2 или группу, выбранную из:
, группу -N-SO2-N(СН3)2, группу -N-SO2-CH3, группу -N-C(=O)-CH3 и группу -N-C(=O)-NRaRb, и предпочтительно группу -N-SO2-N(СН3)2, группу NH2 или группу, выбранную из:


n равен 1, 2 или 3, и предпочтительно равен 2,
n' равен 0, 1 или 2, и предпочтительно равен 1,
m равен 1 или 2,
А, В, R, R', Ra и Rb являются такими, как определено выше в формуле (I), и
R11 является таким, как определено выше в формуле (I), и предпочтительно представляет собой атом водорода,
или любой из их фармацевтически приемлемых солей,
при условии, что R5 и R7 не представляют собой атом водорода, или в качестве альтернативы
при условии, что R5 представляет собой атом водорода и R7 выбран из

 , группы -N-SO2-N(СН3)2, группы -N-SO2-СН3, группы -N-С(=O)-СН3 и группы -N-C(=O)-NRaRb, где R, R', А, В, Ra, Rb, n и m являются такими, как определено выше, или в качестве альтернативы
, группы -N-SO2-N(СН3)2, группы -N-SO2-СН3, группы -N-С(=O)-СН3 и группы -N-C(=O)-NRaRb, где R, R', А, В, Ra, Rb, n и m являются такими, как определено выше, или в качестве альтернативы
при условии, что R7 представляет собой атом водорода и R4 выбран из группы -N-SO2-N(СН3)2, группы -N-SO2-СН3, группы -N-С(=O)-СН3 и группы -N-C(=O)-NRaRb, где Ra и Rb являются такими, как определено выше.
Согласно другому более конкретному воплощению настоящее изобретение в частности фокусируется на самом соединении формулы (В1), где:
R0, R1, R4, R8 и R11 независимо представляют собой атом водорода,
R2 представляет собой метоксигруппу, трифторметоксигруппу или группу -O-СН2-СН2-ОН,
R3 представляет собой атом водорода, атом хлора или группу, выбранную из:
 ,
,  и
и  ,
,
m равен 1 или 2 и более предпочтительно 2,
R5 представляет собой атом водорода или метильную группу,
R7 представляет собой атом водорода, группу NH2, или, когда R8 представляет собой атом водорода, R7 может дополнительно представлять собой группу, выбранную из:

 , и группу -NH-SO2-N(СН3)2,
, и группу -NH-SO2-N(СН3)2,
n' равен 0, 1 или 2, и более предпочтительно 1, и
R10 представляет собой атом водорода или атом хлора,
или любой из его фармацевтически приемлемых солей,
при условии, что по меньшей мере три из R5, R7, R8 и R10 отличаются от атома водорода, или в качестве альтернативы
при условии, что R7 представляет собой группу, выбранную из:

 , и группу -N-SO2-N(СН3)2, где n' является таким, как определено выше, или в качестве альтернативы
, и группу -N-SO2-N(СН3)2, где n' является таким, как определено выше, или в качестве альтернативы
при условии, что R3 представляет собой группу, выбранную из:
 ,
,  и
и  , где m является таким, как определено выше.
, где m является таким, как определено выше.
Еще согласно этому более конкретному воплощению настоящее изобретение в частности фокусируется на самих соединениях формулы (В1')
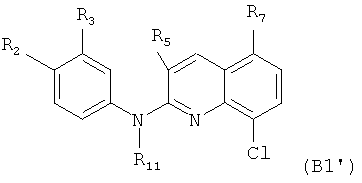
где:
R2 представляет собой атом водорода, метоксигруппу, трифторметоксигруппу или группу -O-СН2-СН2-ОН, и предпочтительно представляет собой метоксигруппу, трифторметоксигруппу или группу -O-СН2-СН2-ОН,
R3 представляет собой атом водорода, атом хлора, метоксигруппу, трифторметоксигруппу или группу, выбранную из:
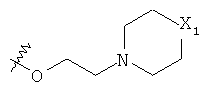 и
и  , и предпочтительно представляет собой атом хлора, атом водорода, группу -O-СН2-СН2-O-СН2-СН2-O-СН3,
, и предпочтительно представляет собой атом хлора, атом водорода, группу -O-СН2-СН2-O-СН2-СН2-O-СН3,  или
или  ,
,
или X1 представляет собой O, N(СН3) или СН2, и предпочтительно представляет собой O или СН2,
m равен 1 или 2, и предпочтительно представляет собой 2,
R5 представляет собой атом водорода или метильную группу,
R7 представляет собой атом водорода, группу NH2, или, когда R8 представляет собой атом водорода, R7 представляет собой группу, выбранную из:

 , группу -N-SO2-N(CH3)2, группу -N-SO2-СН3, группу -N-С(=O)-СН3 и группу -N-C(=O)-NRaRb, и предпочтительно атом водорода, группу NH2, группу -NH-SO2-N(СН3)2 или группу, выбранную из
, группу -N-SO2-N(CH3)2, группу -N-SO2-СН3, группу -N-С(=O)-СН3 и группу -N-C(=O)-NRaRb, и предпочтительно атом водорода, группу NH2, группу -NH-SO2-N(СН3)2 или группу, выбранную из  and
and  , и
, и
n' равен 0, 1 или 2, и более предпочтительно 1,
n равен 1, 2 или 3, и предпочтительно равен 2,
R, R', А, В, Ra и Rb являются такими, как определено выше в формуле (I), и
R11 является таким, как определено выше в формуле (I), и предпочтительно представляет собой атом водорода,
или любой из их фармацевтически приемлемых солей,
при условии, что R5 и R7 не представляют собой атом водорода, или в качестве альтернативы
при условии, что R5 представляет собой атом водорода, и R7 представляет собой группу, выбранную из:

 , группу -N-SO2-N(СН3)2, группу -N-SO2-СН3, группу -N-С(=O)-СН3 и группу -N-C(=O)-NRaRb, где R, R', А, В, Ra, Rb, n и m являются такими, как определено выше, или в качестве альтернативы
, группу -N-SO2-N(СН3)2, группу -N-SO2-СН3, группу -N-С(=O)-СН3 и группу -N-C(=O)-NRaRb, где R, R', А, В, Ra, Rb, n и m являются такими, как определено выше, или в качестве альтернативы
при условии, что R7 представляет собой атом водорода, и R3 представляет собой группу, выбранную из:
 и
и  , где X1 и m являются такими, как определено выше.
, где X1 и m являются такими, как определено выше.
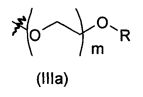
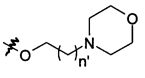
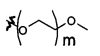
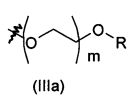
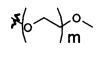
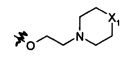
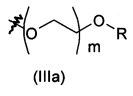
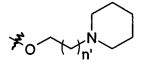
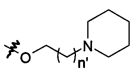
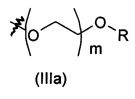
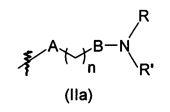
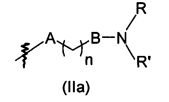
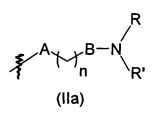
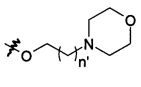
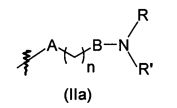
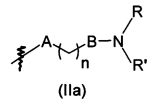
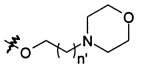
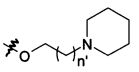
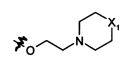
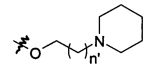
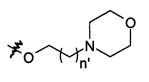
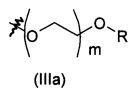
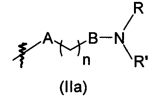
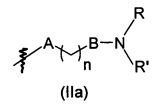
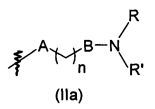
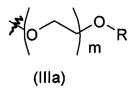
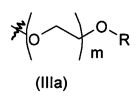
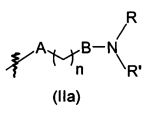
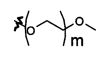
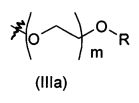
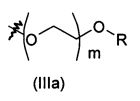
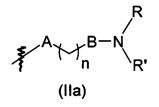
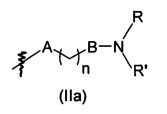
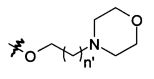
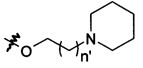
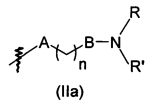
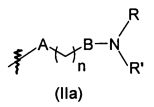
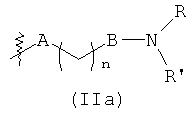
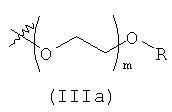
В предпочтительном воплощении в определенных выше соединениях формул (I), (А1), (В1), (А1') и (В1'), группа формулы (IIа) представляет собой группу, выбранную из:
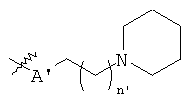
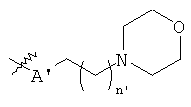
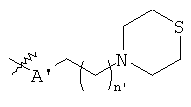
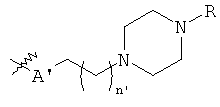
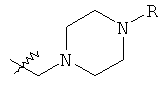
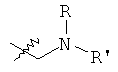
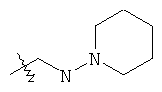
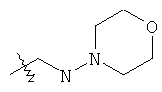
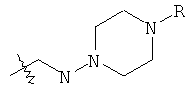
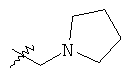 и
и 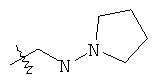
где А' представляет собой O или NH, n' равен 0, 1, 2, 3, или 4, и R и R' являются такими, как определено выше в формулах (I), (А1), (В1), (А1') и (В1'). Предпочтительно, в позиции R8 радикал А' представляет собой O.
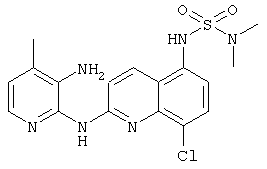
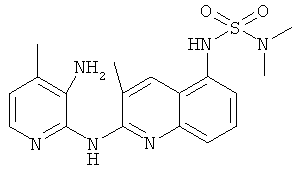
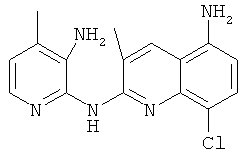
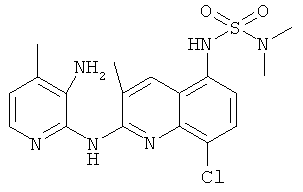
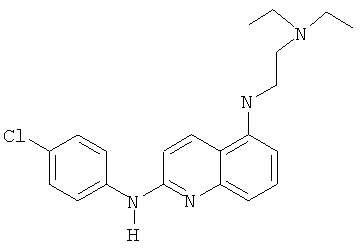
Согласно предпочтительному воплощению настоящего изобретения новое соединение формулы (I) выбрано из:
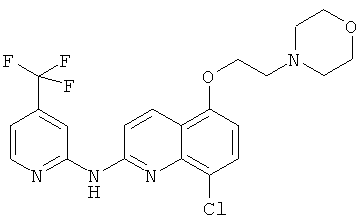
- (1) 8-хлор-5-(2-морфолиноэтокси)-N-(4-(трифторметил)пиридин-2-ил)хинолин-2-амина
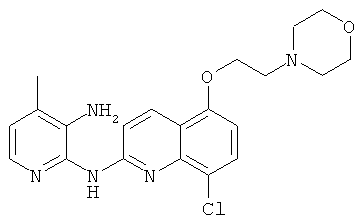
- (2) N2-(8-хлор-5-(2-морфолиноэтокси)хинолин-2-ил)-4-метилпиридин-2,3-диамина
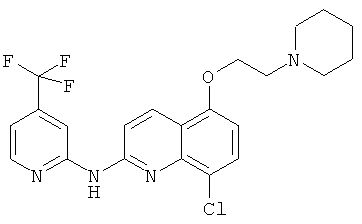
- (3) 8-хлор-5-(2-(пиперидин-1-ил)этокси)-N-(4-(трифторметил)пиридин-2-ил)хинолин-2-амина
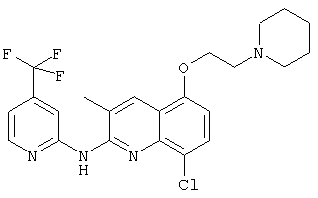
- (4) 8-хлор-3-метил-5-(2-(пиперидин-1-ил)этокси)-N-(4-(трифторметил)пиридин-2-ил)хинолин-2-амина
- (5) N2-(8-хлор-3-метил-5-(2-(пиперидин-1-ил)этокси)хинолин-2-ил)-4-метилпиридин-2,3-диамина
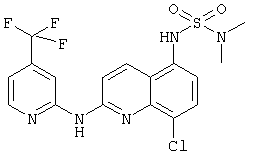
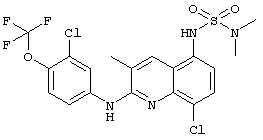
- (6) N,N-диметил-N'-[2-[(4-трифторметилпиридин-2-ил)амино]-8-хлор-5-хинолинил]сульфамида
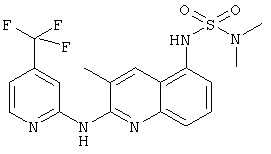
- (7) N,N-диметил-N'-[2-[(4-трифторметилпиридин-2-ил)амино]-3-метил-5-хинолинил]сульфамида
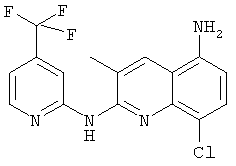
- (8) 8-хлор-3-метил-N2-(4-(трифторметил)пиридин-2-ил)хинолин-2,5-диамина
- (9) N,N-диметил-N'-[2-[(4-трифторметил-пиридин-2-ил)амино]-8-хлор-3-метил-5-хинолинил]сульфамида
- (10) N'-[2-[(3-амино-4-метилпиридин-2-ил)амино]-8-хлор-5-хинолинил]N,N-диметилсульфамида
- (11) N'-[2-[(3-амино-4-метилпиридин-2-ил)амино]-8-хлор-3-метил-5-хинолинил]-N,N-диметилсульфамида
- (12) N2-(3-амино-4-метилпиридин-2-ил)-8-хлор-3-метилхинолин-2,5-диамина
- (13) N'-[2-[(-3-амино-4-метилпиридин-2-ил)амино]-3-метил-5-хинолинил]-N,N-диметилсульфамида
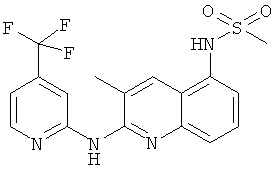
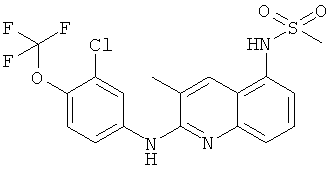
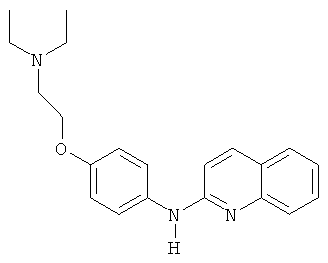
- (26) N-[3-метил-2-[(4-трифторметилпиридин-2-ил)амино]-5-хинолинил]-метансульфонамида
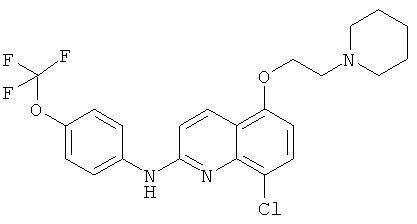
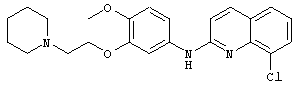
- (14) 8-хлор-5-(2-(пиперидин-1-ил)этокси)-N-(4-(трифторметокси)фенил)хинолин-2-амина
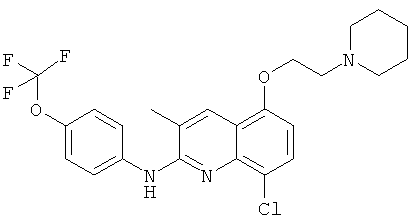
- (15) 8-хлор-3-метил-5-(2-(пиперидин-1-ил)этокси)-N-(4-(трифторметокси)фенил)хинолин-2-амина
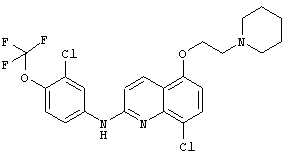
- (16) 8-хлор-N-(3-хлор-4-(трифторметокси)фенил)-5-(2-(пиперидин-1-ил)этокси)хинолин-2-амина
- (17) 8-хлор-N-(3-хлор-4-метоксифенил)-5-(2-морфолиноэтокси)хинолин-2-амина
- (18) 8-хлор-N2-(3-хлор-4-(трифторметокси)фенил)-3-метилхинолин-2,5-диамина
- (19) N'-[2-[(3-хлор-4-(трифторметокси)фенил)амино]-3-метил-5-хинолинил]-N,N-диметилсульфамида
- (20) N'-[2-[(3-хлор-4-(трифторметокси)фенил)амино]-8-хлор-5-хинолинил]-N,N-диметилсульфамида
- (21) N'-[2-[(3-хлор-4-(трифторметокси)фенил)амино]-8-хлор-3-метил-5-хинолинил]-N,N-диметилсульфамида
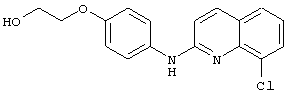
- (22) 2-(4-((8-хлорхинолин-2-ил)амино)фенокси)этанола
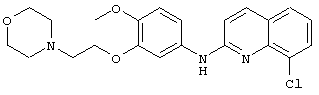
- (23) 8-хлор-N-(4-метокси-3-(2-морфолиноэтокси)фенил)хинолин-2-амина
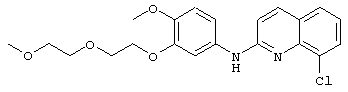
- (24) 8-хлор-N-(4-метокси-3-(2-(2-метоксиэтокси)этокси)фенил)хинолин-2-амина
- (25) 8-хлор-N-(4-метокси-3-(2-(пиперидин-1-ил)этокси)фенил)хинолин-2-амина
- (27) N-[2-[(3-хлор-4-(трифторметокси)фенил)амино]-3-метил-5-хинолинил]-метансульфонамида
- и их фармацевтически приемлемых солей.
Таким образом, настоящее изобретение распространяется на соединения (1)-(27) и их фармацевтически приемлемые соли, такие как бромгидрат, тартрат, цитрат, трифторацетат, аскорбат, хлоргидрат, тартрат, трифлат, малеат, мезилат, формиат, ацетат и фумарат.
Согласно другому аспекту объект настоящего изобретения относится к соединению формулы (I), (А1), (А1'), (В1) и (В1'), где X, R1, R2, R3, R4, R5, R7, R8 и R10 являются такими, как определено выше в соединениях формулы (I), (A1), (А1'), (В1) и (В1'), или любой из его фармацевтически приемлемых солей, и любому из соединений (1)-(27) или любой из их фармацевтически приемлемых солей для применения в качестве лекарственного средства.
Согласно другому аспекту объект настоящего изобретения относится к соединению формулы (I), (A1), (А1'), (В1) и (В1'), определенному выше, или любой из его фармацевтически приемлемых солей, и любому из соединений (1)-(27) или любой из их фармацевтически приемлемых солей для применения в качестве агента для предупреждения, ингибирования или лечения СПИДа.
Используемый в данном документе термин "предупреждение" обозначает уменьшение риска возникновения или замедление проявления данного явления, а именно в настоящем изобретении заболевания, возникающего в результате по меньшей мере одной аномалии сплайсинга, такого как СПИД.
Соединения по изобретению могут существовать в форме свободных оснований или солей присоединения фармацевтически приемлемых кислот.
Подходящие физиологически приемлемые соли присоединения кислот соединений формулы (I) включают бромгидрат, тартрат, цитрат, трифторацетат, аскорбат, хлоргидрат, тартрат, трифлат, малеат, мезилат, формиат, ацетат и фумарат.
Соединения формулы (I), (A1), (А1'), (В1) и (В1') и или их соли могут образовывать сольваты или гидраты, и изобретение включает все такие сольваты и гидраты.
Термины "гидраты" и "сольваты" просто означают, что соединения (I) по изобретению могут находиться в форме гидрата или сольвата, т.е. комбинированными или связанными с одной или более чем одной молекулой воды или растворителя. Представляет собой единственную химическую характеристику таких соединений, которая может быть применена в отношении всех органических соединений этого типа.
В контексте настоящего изобретения термин:
- под термином "галоген" понимается хлор, фтор, бром или йод, и, в частности, хлор, фтор или бром,
- "(C1-С5)алкил", используемый в данном документе, соответственно относится к C1-C5 нормальному, вторичному или третичному насыщенному углеводороду. Примеры представляют собой, но не ограничиваются метилом, этилом, 1-пропилом, 2-пропилом, бутилом, пентилом,
- "(C3-С6)циклоалкил", используемый в данном документе, соответственно относится к циклическому насыщенному углеводороду. Примеры представляют собой, но не ограничиваются циклопропилом, циклобутилом, циклопентилом, циклогексилом,
- "(C1-С5)алкокси", используемый в данном документе, соответственно относится к O-(С1-С5)алкильной группировке, где алкил представляет собой такой, как определено выше. Примеры представляют собой, но не ограничиваются метокси, этокси, 1-пропокси, 2-пропокси, бутокси, пентокси,
- "фторалкильная группа" и "фторалкоксигруппа" относится соответственно к алкильной группе и алкоксигруппе, определенной выше, причем указанные группы замещены по меньшей мере одним атомом фтора. Примеры представляют собой перфторалкильные группы, такие как трифторметил или перфторпропил,
- "насыщенный 5- или 6-членный гетероцикл", используемый в данном документе, соответственно относится к насыщенному циклу, содержащему по меньшей мере один гетероатом. Примеры представляют собой, но не ограничиваются морфолином, пиперазином, тиоморфолином, пиперидином, пирролидином,
- "пациент" может распространяться на людей или млекопитающих, таких как кошки или собаки.
Соединения формул (I), (А1), (А1'), (В1) и (В1') могут содержать один или более чем один асимметричный атом углерода. Таким образом, они могут существовать в форме энантиомеров или диастереоизомеров. Эти энантиомеры, диастереоизомеры и их смеси, включающие рацемические смеси, охвачены в объеме настоящего изобретения.
Согласно другому аспекту объект настоящего изобретения относится к самому соединению, выбранному из:
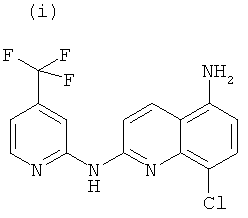
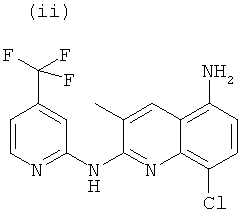
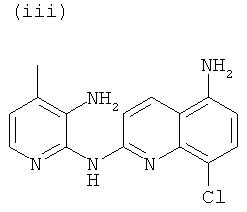
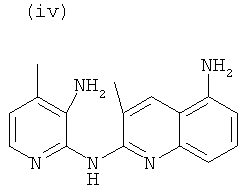
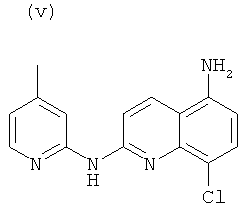
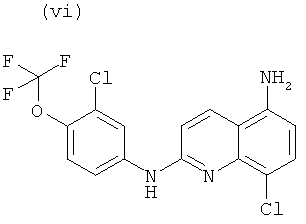
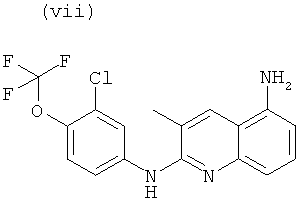
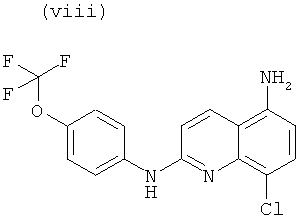 , или любой из его фармацевтически приемлемых солей, таких как бромгидрат, тартрат, цитрат, трифторацетат, аскорбат, хлоргидрат, тартрат, трифлат, малеат, мезилат, формиат, ацетат и фумарат.
, или любой из его фармацевтически приемлемых солей, таких как бромгидрат, тартрат, цитрат, трифторацетат, аскорбат, хлоргидрат, тартрат, трифлат, малеат, мезилат, формиат, ацетат и фумарат.
Согласно другому аспекту объект настоящего изобретения относится к соединению (i), (ii), (iii), (iv), (v), (vi), (vii) или (viii), или любой из его фармацевтически приемлемых солей для применения в качестве лекарственного средства.
Согласно другому аспекту объект настоящего изобретения относится к соединению (i), (ii), (iii), (iv), (v), (vi), (vii) или (viii), или любой из его фармацевтически приемлемых солей для применения в качестве агента для ингибирования, предупреждения или лечения СПИДа.
Новые соединения по настоящему изобретению, т.е. соединения формул (I), (А1), (В1), (А1') и (В1'), любое из соединений (1)-(27) или любая из его фармацевтически приемлемых солей, и специфические соединения формул (i), (ii), (iii), (iv), (v), (vi), (vii) или (viii) не только полезны в качестве агента для ингибирования, предупреждения или лечения СПИДа, но могут также быть полезны для ингибирования, предупреждения или лечения преждевременного старения и для ингибирования, предупреждения или лечения рака, и, в частности, рака ободочной и прямой кишки, рака поджелудочной железы, рака легкого, включая немелкоклеточный рак легкого, рака молочной железы, рака мочевого пузыря, рака желчного пузыря, рака печени, рака щитовидной железы, меланомы, рака матки/шейки матки, рака пищевода, рака почек, рака яичников, рака предстательной железы, рака головы и шеи и рака желудка, и т.д.
Согласно аспекту изобретения указанные соединения могут быть полезны для ингибирования, предупреждения и/или лечения заболеваний, связанных с преждевременным старением, и заболеваний, которые вероятно связаны с ошибочным сплайсингом гена ядерного ламина А. Среди них указанное заболевание может включать синдром преждевременного старения Хатчинсона-Гилфорда (HGPS), прогерию, преждевременное старение, связанное с инфекцией ВИЧ, мышечную дистрофию, амиотрофию Шарко-Мари-Тута, синдром Вернера, а также атеросклероз, инсулинорезистентный сахарный диабет II типа, катаракты, остеопороз и старение кожи, такое как ограничивающая дермопатия.
Соединения по настоящему изобретению могут быть получены при помощи обычных способов органического синтеза, практически используемых специалистами в данной области техники. Общие последовательности реакций, изложенные ниже, представляют собой общий способ, полезный для получения соединений по настоящему изобретению, и подразумевается, что они не являются ограничивающими объем или полезность изобретения.
Соединения общей формулы (I) могут быть получены согласно нижеприведенной схеме 1.
Как следует из указанной схемы существуют два пути для выделения соединения формулы (I) по настоящему изобретению.
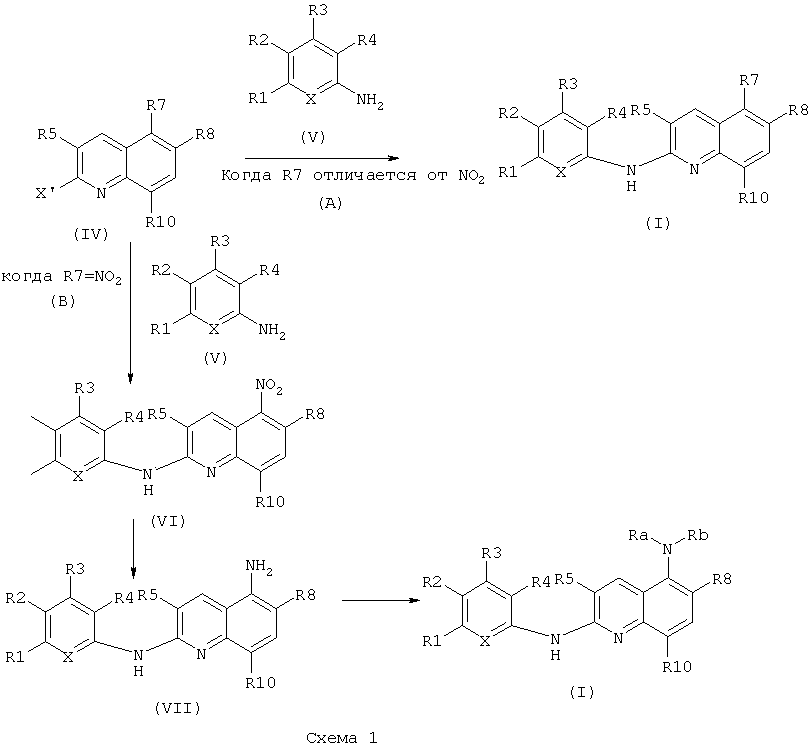
Путь (А) осуществляют из соединения формулы (IV), где R5, R7, R8 и R10 являются такими, как определено выше, X' представляет собой атом хлора или атом брома, и R7 отличается от -NO2, для получения соединения формулы (I), где R1, R2, R3, R4, R5, X, R7, R8 и R10 являются такими, как определено выше, и R7 отличается от -NO2 или -NRaRb, где Ra и Rb являются такими, как определено выше.
Путь (В) осуществляют из соединения формулы (IV), где R5, R8 и R10 являются такими, как определено выше, X' представляет собой атом хлора или атом брома, и R7 представляет собой -NO2, для получения соединения формулы (I), где R1, R2, R3, R4, R5, X, R8 и R10 являются такими, как определено выше, и R7 представляет собой -NO2 или -NRaRb, где Ra и Rb являются такими, как определено выше.
Согласно пути (А) соединение формулы (IV) помещают в протонный растворитель, такой как трет-бутанол. Соединение формулы (V), где R1, R2, R3, R4, и X являются такими, как определено выше, затем добавляют в мольном соотношении, находящемся в диапазоне от 1 до 1,5 относительно соединения формулы (IV), в присутствии неорганического основания, такого как Cs2CO3 или K2CO3, в мольном соотношении, находящемся в диапазоне от 1 и 2, в присутствии дифосфина, такого как Xantphos (4,5-бис(дифенилфосфино)-9,9-диметилксантен) или X-Phos (2-дициклогексилфосфино-2',4',6'-триизопропилбифенил), в количестве, находящемся в диапазоне от 2 мол.% до 10 мол.%, относительно общего количества соединения формулы (IV), и в присутствии катализатора, такого как Pd(OAc)2 или Pa2dba3, в количестве, находящемся в диапазоне от 2 мол.% до 10 мол.% относительно общего количества соединения формулы (IV). Реакционная смесь затем может быть нагрета при температуре, находящейся в диапазоне от 80 до 120°C, например, при 90°C, и перемешиваться в течение периода времени, находящегося в диапазоне от 15 до 25 часов, например, в течение 20 часов, в атмосфере инертного газа и, например, аргона. Реакционная смесь может быть концентрирована при пониженном давлении, и остаток может быть разведен органическим растворителем, таким как этилацетат. Органическая фаза может быть промыта водой, декантирована и высушена над сульфатом магния. Наконец, твердое вещество может быть высушено в вакууме в течение ночи с получением соединения формулы (I) или соединения формулы (VI), где R1, R2, R3, R4, R5, X, R8 и R10 являются такими, как определено выше. Когда R0 или R1, или R2, или R3, или R4 представляет собой -NO2, затем стадия восстановления может быть проведена, как описано в пути (В) ниже.
Исходные соединения формулы (IV) и (V) имеются в наличии или могут быть получены согласно способам, известным специалисту в данной области техники.
огласно пути (В), соединение формулы (VI) и дигидрат хлорида олова (II) в соотношении, находящемся в диапазоне от 3 до 8 эквивалентов, помещают в протонный растворитель, такой как этанол. Реакционная смесь затем может быть нагрета при температуре, находящейся в диапазоне от 40 до 80°C, например, при 60°C, и перемешиваться в течение периода времени, находящегося в диапазоне от 15 до 25 часов, например, в течение 20 часов. Реакционная смесь затем может быть концентрирована при пониженном давлении, и получающийся в результате остаток может быть разведен органическим растворителем, таким как этилацетат. Органическая фаза может быть промыта 1 н. водным раствором NaOH, высушена над сульфатом магния, профильтрована и концентрирована при пониженном давлении с получением соединения формулы (VII), где R1, R2, R3, R4, R5, X, R8 и R10 являются такими, как определено выше.
Для получения соединения формулы (IV), где R7 представляет собой нитрогруппу, т.е. соединения формулы (IVb), где R5, R8 и R10 являются такими, как определено выше, могут быть проведены реакции, описанные на схеме 2.
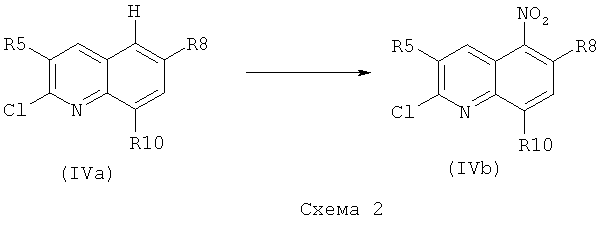
Согласно схеме 2 соединение формулы (IVa), где R5, R8 и R10 являются такими, как определено выше, может быть помещено в серную кислоту. Смесь азотной кислоты в соотношении, находящемся в диапазоне от 3 до 8 эквивалентов, например, 6, и серной кислоты в отношении, находящемся в диапазоне от 1 до 4 эквивалентов, например, 2, может быть добавлена при 0°C. Реакционная смесь затем может быть нагрета при температуре, находящейся в диапазоне от 30 до 80°C, например, при 40°C, и перемешиваться в течение периода времени, находящегося в диапазоне от 15 до 60 минут, например, в течение 30 минут. Затем может быть добавлена вода, и твердое вещество может быть собрано путем фильтрования и высушено с получением соединения формулы (IVb).
Для получения соединений формулы (IV) следующая последовательность реакций может быть проведена, как изображено на схеме 3 ниже.
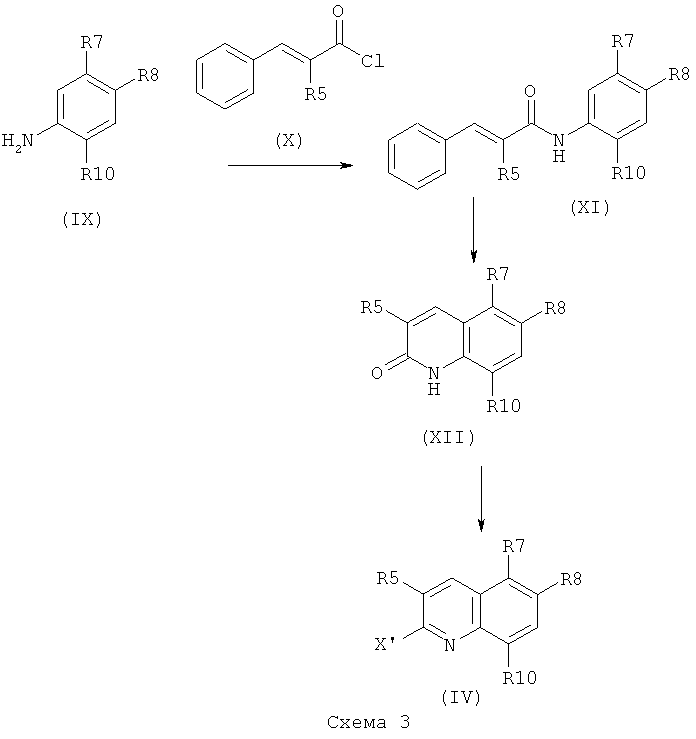
Соединение формулы (IX), где R7, R8 и R10 являются такими, как определено выше, может быть помещено в смесь ацетона и воды в присутствии неорганического основания, такого как Cs2CO3 или K2CO3, в мольном соотношении, находящемся в диапазоне от 1 до 2. При 0°C соединение формулы (X), где R5 представляет собой такой, как определено выше, затем может быть добавлено в мольном соотношении, находящемся в диапазоне от 1 до 1,5 относительно соединения формулы (IX). Реакционной смеси могут давать нагреться до комнатной температуры, и она может перемешиваться в течение периода времени, находящегося в диапазоне от 2 часов до 18 часов, например, в течение 18 часов. Реакционная смесь может быть экстрагирована органическим растворителем, таким как этилацетат. Органическая фаза может быть декантирована, высушена над сульфатом магния, профильтрована и концентрирована при пониженном давлении с получением соединения формулы (XI), где R5, R7, R8 и R10 являются такими, как определено выше.
Соединение формулы (XI) может быть помещено в апротонный растворитель, такой как хлорбензол, в присутствии трихлорида алюминия в мольном соотношении, находящемся в диапазоне от 5 и 10, например, 6. Реакционная смесь затем может быть нагрета при температуре, находящейся в диапазоне от 100 до 150°C, например, при 125°C, и перемешиваться в течение периода времени, находящегося в диапазоне от 1 до 4 часов, например, в течение 2 часов. Реакционная смесь может быть разведена смесью воды и льда, и экстрагирована органическим растворителем, таким как этилацетат. Органическая фаза может быть декантирована, высушена над сульфатом магния, профильтрована и концентрирована при пониженном давлении до соединения формулы (XII), где R5, R7, R8 и R10 являются такими, как определено выше.
Соединение формулы (XII) может быть помещено в апротонный растворитель, такой как ацетонитрил, в присутствии POCl3 в мольном соотношении, находящемся в диапазоне от 2 до 10, например, 5, и в присутствии триэтилбензиламмоний хлорида в мольном соотношении, находящемся в диапазоне от 2 до 10, например, 5. Реакционная смесь затем может быть нагрета при температуре, находящейся в диапазоне от 100 до 120°C, например, при 120°C, и перемешиваться в течение периода времени, находящегося в диапазоне от 1 до 4 часов, например, в течение 3 часов. Смесь затем может быть концентрирована при пониженном давлении, и, после добавления воды к остатку, может перемешиваться при комнатной температуре в течение периода времени, находящегося в диапазоне от 15 до 60 минут, например, в течение 30 минут. Получающийся в результате осадок затем может быть промыт водой и профильтрован с получением соединения формулы (IV).
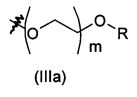
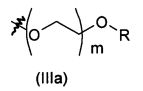
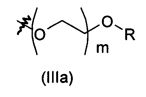
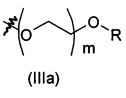
Соединение формулы (V) (Схема 1) или соединение формулы (IX) (Схема 3) с цепью, присоединенной по атому кислорода к ароматическому кольцу, может быть получено согласно схеме 4, как изображено ниже.
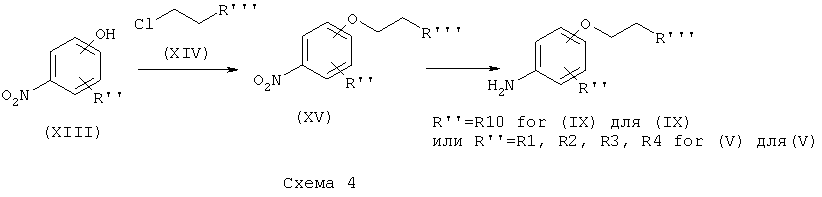
Соединение формулы (XIII), где R'' представляет собой такой, как определено выше на схеме 4, может быть помещено в полярный растворитель, такой как N,N-диметилформамид. Соединение формулы (XIV), где R''' представляет собой -(O-CH2-CH2)f-O-R или -B-NRR', f равен 0, 1 или 2, и В, R и R' являются такими, как определено выше, затем может быть добавлено в мольном соотношении, находящемся в диапазоне от 1 до 1,5 относительно соединения формулы (XIII), в присутствии неорганического основания, такого как Cs2CO3 или K2CO3, в мольном соотношении, находящемся в диапазоне от 1 до 2, и в присутствии йодида калия в соотношении, находящемся в диапазоне от 1,5 до 3, например, 2,2 эквивалента. Реакционная смесь затем может быть нагрета при температуре, находящейся в диапазоне от 60 до 100°C, например, при 80°C, и перемешиваться в течение периода времени, находящегося в диапазоне от 15 до 25 часов, например, в течение 20 часов. Реакционная смесь затем может быть концентрирована при пониженном давлении, и получающийся в результате остаток может быть разведен органическим растворителем, таким как этилацетат. Органическая фаза может быть промыта 1% водным раствором NaOH, высушена над сульфатом магния, профильтрована и концентрирована при пониженном давлении с получением соединения формулы (XV), где R'' и R''' являются такими, как определено выше.
Соединение формулы (XV) и дигидрат хлорида олова (II) в соотношении, находящемся в диапазоне от 3 до 8 эквивалентов, может быть помещено в протонный растворитель, такой как этанол. Реакционная смесь затем может быть нагрета при температуре, находящейся в диапазоне от 40 до 80°C, например, при 60°C, и перемешиваться в течение периода времени, находящегося в диапазоне от 15 до 25 часов, например, в течение 20 часов. Реакционная смесь затем может быть концентрирована при пониженном давлении, и получающийся в результате остаток может быть разведен органическим растворителем, таким как этилацетат. Органическая фаза может быть промыта 1 н. водным раствором NaOH, высушена над сульфатом магния, профильтрована и концентрирована при пониженном давлении с получением соединения формулы (V) или (IX).
Химические структуры и спектроскопические данные некоторых соединений формулы (I) по изобретению проиллюстрированы соответственно в следующей Таблице I и Таблице II.
|
|
|
|
|
|
|
|
|
Следующие примеры приведены в качестве иллюстраций и никоим образом не ограничивают объем данного изобретения.
Следующие примеры подробно иллюстрируют получение некоторых соединений по изобретению. Структуры полученных продуктов были подтверждены при помощи спектров ЯМР (ядерный магнитный резонанс).
Примеры
Пример 1: соединение (2) в таблице I
4-Хлор-3-нитрофенол (5 г, 28,8 ммоль, 1 экв.) помещали в диметилформамид (96 мл) с 4-(2-хлор-этил)морфолином (16 г, 86,4 ммоль, 3 экв.), Cs2CO3 (65 г, 0,20 ммоль, 7 экв.), KI (10,5 г, 63,4 ммоль, 2,2 экв.). Реакционную смесь нагревали при 80°C и перемешивали в течение 20 часов. Реакционную смесь затем концентрировали при пониженном давлении, и получающийся в результате остаток разводили этилацетатом. Органическую фазу промывали 1% водным раствором NaOH, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Получающийся в результате остаток очищали путем колоночной хроматографии на силикагеле с получением 4-(2-(4-хлор-3-нитрофенокси)этил)морфолина. (7,5 г, 96%).
1H ЯМР (300 МГц, CDCl3) δ 7.43 (d, J=4,5, 1H), 7.41 (d, J=1,3, 1H), 7.08 (dd, J=2,9, 9,0, 1H), 4.14 (t, J=5,6, 2H), 3.78-3.68 (m, 4H), 2.82 (t, J=5,6, 2H), 2.62-2.51 (m, 4H).
4-(2-(4-хлор-3-нитрофенокси)этил)морфолин (7,5 г, 28,0 ммоль, 1 экв.) и дигидрат хлорида олова (II) (33 г, 146,9 ммоль, 5 экв.) помещали в EtOH (280 мл), нагревали при 60°C и перемешивали в течение 19 часов. Реакционную смесь затем концентрировали при пониженном давлении, и получающийся в результате остаток разводили этилацетатом. Органическую фазу промывали 1 н. водным раствором NaOH, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении с получением 2-хлор-5-(2-морфолиноэтокси)анилина (5,8 г, 80%).
1H ЯМР (300 МГц, CDCl3) δ 7.10 (d, J=8,7, 1H), 6.31 (d, J=2,8, 1H), 6.25 (dd, J=2,8, 8,7, 1H), 4.02 (d, J=5,7, 2H), 3.76-3.68 (m, 4H), 2.76 (t, J=5,7, 2H), 2.59-2.50 (m, 4H).
2-Хлор-5-(2-морфолиноэтокси)анилин (1,9 г, 7,4 ммоль, 1 экв.) помещали в смесь ацетона (2,5 мл) и воды (3,2 мл) в присутствии K2CO3 (2,1 г, 14,4 ммоль, 2 экв.). Затем при 0°C добавляли хлорангидрид коричной кислоты (1,2 г, 7,4 ммоль, 1 экв.). Реакционную смесь оставляли нагреваться до комнатной температуры, перемешивали в течение 2 часов и экстрагировали этилацетатом. Органическую фазу сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Получающийся в результате остаток очищали путем колоночной хроматографии на силикагеле с получением N-(2-хлор-5-(2-морфолиноэтокси)фенил)циннамамида (1,7 г, 60%).
1H ЯМР (300 МГц, CDCl3) δ 8.24 (d, J=2,7, 1H), 7.85 (s, 1H), 7.74 (d, J=15,5, 1H), 7.58-7.49 (m, 2H), 7.41-7.33 (m, 3H), 7.23 (d, J=8,9, 1H), 6.65-6.55 (m, 2H), 4.11 (t, J=5,5, 2H), 3.75-3.67 (m, 4H), 2.78 (t, J=5,6, 2H), 2.60-2.49 (m, 4H).
МС (масс-спектрометрия) (ESI (ионизация электрораспылением)) [М+H]+=387,3
N-(2-хлор-5-(2-морфолиноэтокси)фенил)циннамамид (800 мг, 2,1 ммоль, 1 экв.) помещали в хлорбензол (1,9 мл) в присутствии трихлорида алюминия (1,6 г, 12,4 ммоль, 6 экв.). Реакционную смесь нагревали при 125°C и перемешивали в течение 2 часов. После охлаждения до комнатной температуры, ее разводили смесью воды и льда и экстрагировали этилацетатом. Органическую фазу сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Получающийся в результате остаток очищали путем колоночной хроматографии на силикагеле с получением 8-хлор-5-(2-морфолиноэтокси)хинолин-2(1Н)-она (220 мг, 34%).
1H ЯМР (300 МГц, CDCl3) δ 8.98 (s, 1H), 8.12 (d, J=9,8, 1H), 7.44 (d, J=8,8, 1H), 6.61 (t, J=10,0, 2H), 4.22 (t, J=5,6, 2H), 3.77-3.66 (m, 4H), 2.89 (t, J=5,7, 2H), 2.66-2.52 (m, 4H).
8-Хлор-5-(2-морфолиноэтокси)хинолин-2(1Н)-он (200 мг, 0,6 ммоль, 1 экв.) помещали в ацетонитрил (1,7 мл) в присутствии POCl3 (301 мкл, 3,2 ммоль, 5 экв.) и триэтиламмоний хлорида (738 мг, 3,2 ммоль, 5 экв.). Реакционную смесь перемешивали при 120°C в течение 3 часов. Смесь затем концентрировали при пониженном давлении и после добавления воды к остатку (5 мл) перемешивали при комнатной температуре в течение 30 минут. Затем получающийся в результате осадок промывали водой и фильтровали с получением 4-(2-((2,8-дихлорхинолин-5-ил)окси)этил)морфолина (234 мг, 100%).
1H ЯМР (300 МГц, d6-ДМСО (диметилсульфоксид)) δ 8.69 (d, J=8,8, 1H), 7.84 (d, J=7,4, 1H), 7.65 (d, J=8,8, 1H), 7.16 (s, 1H), 4.58 (s, 3Н), 3.85 (s, 4H), 3.65 (s, 2H), 3.33 (s, 4H).
MC(ESI)[М+Н]+=327,1
Реакционную смесь 4-(2-((2,8-дихлорхинолин-5-ил)окси)этил)морфолина (81,5 мг, 0,25 ммоль, 1 экв.), 2-амино-3-нитропиридина (41,3 мг, 0,27 ммоль, 1,1 экв.), Pd(OAc)2 (1,1 мг, 2 мол.%), XantPhos (2,9 мг, 2 мол.%) и Cs2CO3 (228 мг, 2,8 экв.)) в t-BuOH (1 мл) нагревали при 90°C и перемешивали в течение 20 часов. Реакционную смесь затем концентрировали при пониженном давлении, и получающийся в результате остаток разводили этилацетатом. Органическую фазу промывали водой, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Получающийся в результате остаток очищали путем колоночной хроматографии на силикагеле с получением 8-хлор-N-(4-метил-3-нитропиридин-2-ил)-5-(2-морфолиноэтокси)хинолин-2-амина (41 мг, 37%).
1H ЯМР (300 МГц, CDCl3) δ 8.42 (dd, J=9,1, 42,5, 1H), 8.27 (d, J=5,1, 1H), 7.97 (d, J=9,6, 0Н), 7.50 (dd, J=8,5, 60,4, 1H), 6.81 (dd, J=7,7, 14,6, 1H), 6.60 (dd, J=8,4, 22,9, 1H), 4.31-4.14 (m, 2H), 3.80-3.67 (m, 4H), 2.96-2.83 (m, 2H), 2.62 (s, 4H), 2.42 (d, J=62,1, 3Н).
MC(ESI)[M+H]+=444,2
8-Хлор-N-(4-метил-3-нитропиридин-2-ил)-5-(2-морфолиноэтокси)хинолин-2-амин (35 мг, 79 мкмоль, 1 экв.) и дигидрат хлорида олова (II) (89 мг, 394 мкмоль, 5 экв.) помещали в этанол (79 мкл), нагревали при 60°C и перемешивали в течение 19 часов. Реакционную смесь затем концентрировали при пониженном давлении, и получающийся в результате остаток разводили этилацетатом. Органическую фазу промывали 1 н. водным раствором NaOH, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Получающийся в результате остаток очищали путем колоночной хроматографии на силикагеле с получением соединения (2) (33 мг, 100%).
1H ЯМР (300 МГц, MeOD) δ 8.29 (d, J=8,0, 1H), 7.58 (d, J=5,4, 1H), 7.53 (d, J=8,6, 1H), 7.27 (d, J=9,7, 1H), 6.86 (d, J=3,6, 1H), 6.69 (d, J=9,0, 1H), 4.24 (s, 2H), 3.71 (s, 4H), 2.89 (s, 2H), 2.63 (s, 4H), 2.25 (s, 3Н)
MC(ESI)[М+Н]+=414,2
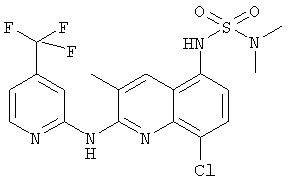
Пример 2: соединение (4) в таблице I
4-Хлор-3-нитрофенол (2,5 г, 14,4 ммоль, 1 экв.) помещали в диметилформамид (48 мл) с 4-(2-хлор-этил)пиперидином (8 г, 43,2 ммоль, 3 экв.), Cs2CO3 (33 г, 100,8 ммоль, 7 экв.), KI (5,3 г, 31,7 ммоль, 2,2 экв.). Реакционную смесь нагревали при 80°C и перемешивали в течение 20 часов. Реакционную смесь затем концентрировали при пониженном давлении, и получающийся в результате остаток разводили этилацетатом. Органическую фазу промывали 1% водным раствором NaOH, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Получающийся в результате остаток очищали путем колоночной хроматографии на силикагеле с получением 4-(2-(4-хлор-3-нитрофенокси)этил)пиперидина (2,3 г, 56%).
1H ЯМР (300 МГц, CDCl3) δ 7.38 (s, 1H), 7.36 (d, J=6,5, 1H), 7.04 (dd, J=3,0, 8,9, 1H), 4.08 (t, J=5,9, 2H), 2.73 (t, J=5,9, 2H), 2.50-2.39 (m, 4H), 1.62-1.50 (m, 4H), 1.41 (dd, J=5,8, 11,0, 2H).
4-(2-(4-Хлор-3-нитрофенокси)этил)пиперидин (2,3 г, 8,1 ммоль, 1 экв.) и дигидрат хлорида олова (II) (9,1 г, 40,4 ммоль, 5 экв.) помещали в EtOH (81 мл). Реакционную смесь нагревали при 60°C и перемешивали в течение 19 часов. Реакционную смесь затем концентрировали при пониженном давлении, и получающийся в результате остаток разводили этилацетатом. Органическую фазу промывали 1 н. водным раствором NaOH, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении с получением 2-хлор-5-(2-пиперидиноэтокси)анилина (1,9 г, 92%).
1H ЯМР (300 МГц, CDCl3) δ 7.09 (d, J=8,7, 1H), 6.32 (d, J=2,7, 1H), 6.26 (dd, J=2,8, 8,7, 1H), 4.00 (s, 2H), 2.73 (t, J=6,1, 2H), 2.47 (d, J=4,9, 4H), 1.60 (dd, J=5,6, 11,1, 4H), 1.44 (d, J=5,1, 2H).
2-Хлор-5-(2-пиперидиноэтокси)анилин (705 мг, 3,9 ммоль, 1 экв.) помещали в смесь ацетона (653 мкл) и воды (852 мкл) в присутствии K2CO3 (1,1 г, 7,8 ммоль, 2 экв.). Затем при 0°C добавляли (Е)-2-метил-3-фенилакрилоил хлорид (705 мг, 3,9 ммоль, 1 экв.). Реакционную смесь оставляли нагреваться до комнатной температуры, перемешивали в течение 2 часов и экстрагировали этилацетатом. Органическую фазу сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Получающийся в результате остаток очищали путем колоночной хроматографии на силикагеле с получением (Е)-N-(2-хлор-5-(2-(пиперидин-1-ил)этокси)фенил)-2-метил-3-фенилакриламида (500 мг, 66%).
1H ЯМР (300 МГц, CDCl3) δ 8.22 (d, J=2,6, 1H), 8.18 (s, 1H), 7.51 (s, 1H), 7.36 (s,4H), 7.33-7.26 (m, 1H), 7.21 (d, J=8,8, 1H), 6.61 (d, J=8,8, 1H), 4.09 (t, J=5,9, 2H), 2.74 (t, J=5,9, 2H), 2.47 (s, 4H), 2.21 (s, 3H), 1.57 (d, J=5,1, 4H), 1.41 (s, 2H).
MC(ESI)[M+H]+=399,2
(Е)-N-(2-Хлор-5-(2-(пиперидин-1-ил)этокси)фенил)-2-метил-3-фенилакриламид (100 мг, 0,2 ммоль, 1 экв.) помещали в хлорбензол (500 мкл), в присутствии трихлорида алюминия (201 мг, 1,5 ммоль, 6 экв.). Реакционную смесь нагревали при 125°C и перемешивали в течение 2 часов. После охлаждения до комнатной температуры ее разводили смесью воды и льда и экстрагировали этилацетатом. Органическую фазу сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Получающийся в результате остаток очищали путем колоночной хроматографии на силикагеле с получением 8-хлор-3-метил-5-(2-(пиперидин-1-ил)этокси)хинолин-2(1Н)-она (25 мг, 31%).
1H ЯМР (300 МГц, CDCl3) δ 7.96 (s, 1H), 7.36 (d, J=8,6, 1H), 6.58 (d, J=8,8, 1H), 4.24 (s, 2H), 2.94 (s, 2H), 2.63 (s, 4H), 2.15 (s, 3H), 1.66 (s, 4H), 1.52-1.44 (m, 2H).
8-Хлор-3-метил-5-(2-(пиперидин-1-ил)этокси)хинолин-2(1Н)-он (160 мг, 0,5 ммоль, 1 экв.) помещали в ацетонитрил (1,2 мл) в присутствии POCl3 (233 мкл, 2,5 ммоль, 5 экв.) и триэтиламмоний хлорида (570 мг, 2,5 ммоль, 5 экв.). Реакционную смесь перемешивали при 120°C в течение 3 часов. Смесь затем концентрировали при пониженном давлении и после добавления воды к остатку (5 мл) перемешивали при комнатной температуре в течение 30 минут. Затем получающийся в результате осадок промывали водой и фильтровали с получением 2,8-дихлор-3-метил-5-(2-(пиперидин-1-ил)этокси)хинолина (170 мг, 100%).
1H ЯМР (300 МГц, d6-ДМСО) δ 10.60-10.31 (m, 1H), 8.81 (s, 1H), 7.86 (d, J=8,5, 1H), 7.14 (s, 1H), 4.56 (s, 2H), 3.59 (s, 4H), 3.04 (s, 2H), 2.54 (s, 3H), 1.81 (s, 5H).
Реакционную смесь 2,8-дихлор-5-(2-(пиперидин-1-ил)этокси)хинолина (55 мг, 162 мкмоль, 1 экв.), 2-амино-4-трифторметилпиридина (29 мг, 178 мкмоль, 1,1 экв.), Pd(OAc)2 (1 мг, 2 мол.%), XantPhos (2 мг, 2 мол.%) и Cs2CO3 (148 мг, 2,8 экв.) в t-BuOH (650 мкл) нагревали при 90°C и перемешивали в течение 20 часов. Реакционную смесь затем концентрировали при пониженном давлении, и получающийся в результате остаток разводили этилацетатом. Органическую фазу промывали водой, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Получающийся в результате остаток очищали путем колоночной хроматографии на силикагеле с получением соединения (4) (50 мг, 66%).
1H ЯМР (300 МГц, CDCl3) δ 9.78 (s, 1H), 8.41 (d, J=5,1, 1H), 8.23 (s, 1H), 7.84 (s, 1H), 7.59 (d, J=8,4, 1H), 7.18 (d, J=5,0, 1H), 6.65 (d, J=8,4, 1H), 4.27 (t, J=5,9, 2H), 2.94 (t, J=5,8, 2H), 2.62 (s, 4H), 2.51 (s, 3H), 1.66 (s, 5H), 1.48 (s, 2H)
13C ЯМР (75 МГц, CDCl3) δ 148.4, 132.2, 128.5, 113.3, 109.9, 103.7, 66.6, 57.6, 54.9, 25.7, 23.6, 17.3
MC(ESI)[М+Н]+=465,2
Пример 3: соединение (14) в таблице I
4-Хлор-3-нитрофенол (2,5 г, 14,4 ммоль, 1 экв.) помещали в диметилформамид (48 мл) с 4-(2-хлор-этил)пиперидином (8 г, 43,2 ммоль, 3 экв.), Cs2CO3 (33 г, 100,8 ммоль, 7 экв.), KI (5,3 г, 31,7 ммоль, 2,2 экв.). Реакционную смесь нагревали при 80°C и перемешивали в течение 20 часов. Реакционную смесь затем концентрировали при пониженном давлении, и получающийся в результате остаток разводили этилацетатом. Органическую фазу промывали 1% водным раствором NaOH, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Получающийся в результате остаток очищали путем колоночной хроматографии на силикагеле с получением 4-(2-(4-хлор-3-нитрофенокси)этил)пиперидина (2,3 г, 56%).
1H ЯМР (300 МГц, CDCl3) δ 7.38 (s, 1H), 7.36 (d, J=6,5, 1H), 7.04 (dd, J=3,0, 8,9, 1H), 4.08 (t, J=5,9, 2H), 2.73 (t, J=5,9, 2H), 2.50-2.39 (m, 4H), 1.62-1.50 (m,4H), 1.41 (dd, J=5,8, 11,0, 2H).
4-(2-(4-Хлор-3-нитрофенокси)этил)пиперидин (2,3 г, 8,1 ммоль, 1 экв.) и дигидрат хлорида олова (II) (9,1 г, 40,4 ммоль, 5 экв.) помещали в EtOH (81 мл). Реакционную смесь нагревали при 60°C и перемешивали в течение 19 часов. Реакционную смесь затем концентрировали при пониженном давлении, и получающийся в результате остаток разводили этилацетатом. Органическую фазу промывали 1 н. водным раствором NaOH, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Получающийся в результате остаток очищали путем колоночной хроматографии на силикагеле с получением 2-хлор-5-(2-пиперидиноэтокси)анилина (1,9 г, 92%).
1H ЯМР (300 МГц, CDCl3) δ 7.09 (d, J=8,7, 1H), 6.32 (d, J=2,7, 1H), 6.26 (dd, J=2,8, 8,7, 1H), 4.00 (s, 2H), 2.73 (t, J=6,1, 2H), 2.47 (d, J=4,9, 4H), 1.60 (dd, J=5,6, 11,1, 4H), 1.44 (d, J=5,1, 2H)
2-Хлор-5-(2-пиперидиноэтокси)анилин (500 мг, 1,9 ммоль, 1 экв.) помещали в смесь ацетона (653 мкл) и воды (852 мкл) в присутствии K2CO3 (541 мг, 3,9 ммоль, 2 экв.). Затем при 0°C добавляли хлорангидрид коричной кислоты (326 мг, 1,9 ммоль, 1 экв.). Реакционную смесь оставляли нагреваться до комнатной температуры, перемешивали в течение 2 часов и экстрагировали этилацетатом. Органическую фазу сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Получающийся в результате остаток очищали путем колоночной хроматографии на силикагеле с получением N-(2-хлор-5-(2-(пиперидин-1-ил)этокси)фенил)циннамамида (521 мг, 69%).
1H ЯМР (300 МГц, CDCl3) δ 8.23 (s, 1H), 7.83 (s, 1H), 7.75 (d, J=15,5, 1H), 7.53 (d, J=3,8, 2H), 7.40-7.32 (m, 3H), 7.22 (d, J=8,9, 1H), 6.65-6.53 (m, 2H), 4.10 (t, J=5,9, 2H), 2.75 (t, J=5,9, 2H), 2.48 (s, 4H), 1.65-1.52 (m, 4H), 1.43 (d, J=5,2, 2H)
N-(2-Хлор-5-(2-(пиперидин-1-ил)этокси)фенил)циннамамид (436 мг, 1,1 ммоль, 1 экв.) помещали в хлорбензол (2,1 мл) в присутствии трихлорида алюминия (906 мг, 1,5 ммоль, 6 экв.). Реакционную смесь нагревали при 125°C и перемешивали в течение 2 часов. После охлаждения до комнатной температуры ее разводили смесью воды и льда и экстрагировали этилацетатом. Органическую фазу сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Получающийся в результате остаток очищали путем колоночной хроматографии на силикагеле с получением 8-хлор-5-(2-(пиперидин-1-ил)этокси)хинолин-2(1Н)-она (225 мг, 67%).
1H ЯМР (300 МГц, CDCl3) δ 9.20 (s, 1Н), 8.04 (d, J=9,6, 1H), 7.33 (d, J=8,3, 1H), 6.51 (t, J=8,4, 2H), 4.12 (s, 2H), 2.78 (s, 2H), 2.46 (s, 4H), 1.54 (s, 4H), 1.39 (s, 2H)
8-Хлор-5-(2-(пиперидин-1-ил)этокси)хинолин-2(1Н)-он (275 мг, 0,9 ммоль, 1 экв.) помещали в ацетонитрил (2,3 мл) в присутствии POCl3 (418 мкл, 4,5 ммоль, 5 экв.) и триэтиламмоний хлорида (1 г, 4,5 ммоль, 5 экв.). Реакционную смесь перемешивали при 120°C в течение 3 часов. Смесь затем концентрировали при пониженном давлении и после добавления воды к остатку (5 мл) перемешивали при комнатной температуре в течение 30 минут. Затем получающийся в результате осадок промывали водой и фильтровали с получением 2,8-дихлор-5-(2-(пиперидин-1-ил)этокси)хинолина (228 мг, 100%).
1H ЯМР (300 МГц, d6-ДМСО) δ 8.86 (d, J=8,7, 1H), 7.93 (s, 1H), 7.70 (d, J=8,6, 1H), 7.16 (s, 1H), 4.61 (s, 2H), 3.60 (s, 4H), 3.04 (s, 2H), 1.80 (s, 4H), 1.74-1.58 (m, 2H)
Реакционную смесь 2,8-дихлор-5-(2-(пиперидин-1-ил)этокси)хинолина (75 мг, 231 мкмоль, 1 экв.), 4-(трифторметокси)анилина (34 мкл, 178 мкмоль, 1,1 экв.), Pd(OAc)2 (1 мг, 2 мол.%), XantPhos (3 мг, 2 мол.%) и Cs2CO3 (210 мг, 2,8 экв.) в t-BuOH (924 мкл) нагревали при 90°C и перемешивали в течение 20 часов. Реакционную смесь затем концентрировали при пониженном давлении, и получающийся в результате остаток разводили этилацетатом. Органическую фазу промывали водой, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Получающийся в результате остаток очищали путем колоночной хроматографии на силикагеле с получением 8-хлор-5-(2-(пиперидин-1-ил)этокси)-N-(4-(трифторметил)пиридин-2-ил)хинолин-2-амина (14) (63 мг, 59%).
1H ЯМР (300 МГц, CDCl3) δ 8.32 (d, J=9,0, 1H), 7.90 (d, J=8,9, 2H), 7.58 (d, J=8,4, 1H), 7.23 (d, J=8,5, 2H), 7.01 (s, 1H), 6.86 (d, J=9,0, 1H), 6.59 (d, J=8,5, 1H), 4.24 (t, J=5,8, 2H), 2.90 (t, J=5,8, 2H), 2.58 (s, 4H), 1.63 (s, 4H), 1.46 (s, 2H)
13C ЯМР (75 МГц, CDCl3) δ 153.4, 144.0, 138.6, 133.0, 129.5, 121.9, 120.3, 116.8, 111.4, 103.1, 66.6, 57.6, 54.9, 25.8, 23.6
MC(ESI)[М+Н]+=466,1
Пример 4: соединение (23) в таблице I
2-Метокси-6-нитрофенол (254 мг, 1,5 ммоль, 1 экв.) помещали в диметилформамид (3 мл) с 4-(2-хлор-этил)морфолин гидрохлоридом (837 мг, 4,5 ммоль, 3 экв.), Cs2CO3 (3,4 г, 10,7 ммоль, 7 экв.), KI (547 мг, 3,3 ммоль, 2,2 экв.). Реакционную смесь нагревали при 80°C и перемешивали в течение 20 часов. Реакционную смесь затем концентрировали при пониженном давлении, и получающийся в результате остаток разводили этилацетатом. Органическую фазу промывали 1% водным раствором NaOH, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Получающийся в результате остаток очищали путем колоночной хроматографии на силикагеле с получением 4-(2-(2-метокси-5-нитрофенокси)этил)морфолина (386 мг, 91%).
1H ЯМР (300 МГц, MeOD) δ 7.92 (dd, J=2,6, 9,0, 1H), 7.82 (d, J=2,6, 1H), 7.10 (d, J=9,0, 1H), 4.23 (t, J=5,4, 2H), 3.94 (s, 3Н), 3.76-3.67 (m, 4H), 2.85 (t, J=5,4, 2H), 2.67-2.59 (m, 4H)
4-(2-(2-Метокси-5-нитрофенокси)этил)морфолин (350 мг, 1,2 ммоль, 1 экв.) и дигидрат хлорида олова (II) (1,4 г, 6,20 ммоль, 5 экв.) помещали в EtOH (12,3 мл). Реакционную смесь нагревали при 60°C и перемешивали в течение 19 часов. Реакционную смесь затем концентрировали при пониженном давлении, и получающийся в результате остаток разводили этилацетатом. Органическую фазу промывали 1 н. водным раствором NaOH, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Получающийся в результате остаток очищали путем колоночной хроматографии на силикагеле с получением 4-метокси-3-(2-морфолиноэтокси)анилина (143 мг, 46%).
1H ЯМР (300 МГц, MeOD) δ 6.73 (d, J=8,5, 1H), 6.43 (d, J=2,5, 1H), 6.29 (dd, J=2,5, 8,4, 1H), 4.06 (t, J=5,6, 2H), 3.71 (s, 3Н), 3.70-3.67 (m, 4H), 2.75 (t, J=5,6, 2H), 2.59-2.55 (m, 4H)
Реакционную смесь 2,8-дихлорхинолина (101 мг, 0,5 ммоль, 1 экв.) и 4-метокси-3-(2-морфолиноэтокси)анилина (143 мг, 0,55 ммоль, 1,1 экв.), Pd(OAc)2 (2,3 мг, 2 мол.%), XantPhos (6 мг, 2 мол.%) и Cs2CO3 (465 мг, 2,8 экв.)) в t-BuOH (2 мл) нагревали при 90°C и перемешивали в течение 20 часов. Реакционную смесь затем концентрировали при пониженном давлении, и получающийся в результате остаток разводили этилацетатом. Органическую фазу промывали водой, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Получающийся в результате остаток очищали путем колоночной хроматографии на силикагеле с получением соединения (23) (44 мг, 21%).
1Н ЯМР (300 МГц, CDCl3) δ 8.06 (d, J=1,9, 1H), 7.85 (d, J=8,9, 1H), 7.70 (dd, J=1,2, 7,6, 1H), 7.53 (dd, J=1,0, 7,9, 1H), 7.18 (t, J=7,8, 1H), 6.99 (s, 1H), 6.93 (dd, J=2,4, 8,6, 1H), 6.85 (dd, J=2,9, 8,8, 2H), 4.29 (t, J=6,1, 2H), 3.85 (s, 3H), 3.78-3.68 (m, 4H), 2.88 (t, J=6,1, 2H), 2.66-2.52 (m, 4H)
MC(ESI)[M+H]+=414,1
Фармакологические данные
Соединения по изобретению подвергали фармакологическим испытаниям, которые продемонстрировали их пригодность в качестве активных веществ в терапии и, в частности, для предупреждения, ингибирования или лечения СПИДа.
Пример 5: Разработка производных соединений IDC16
Авторы изобретения показали, что соединение IDC16 (BAKKOUR et al., приведенная выше, 2007) взаимодействует функционально с комплексом SF2/ASF и, таким образом, вносит вклад в блокирование альтернативного сплайсинга в течение репликации ВИЧ, приводя к прекращению продукции белка Tat.
Соответственно, известно, что семейство полициклических индолов, к которым относится соединение IDC16, демонстрирует свойства интеркалирующих ДНК агентов. Таким образом, такие соединения представляют риск с точки зрения нежелательных побочных действий.
Таким образом, авторы изобретения стремились разработать новые молекулы, демонстрирующие активность, сравнимую с IDC16 с точки зрения активности, ингибирующей сплайсинг ВИЧ, но в то же время, не проявляя характеристик интеркалирующих ДНК агентов.
В исходной гипотезе авторы изобретения предположили, что два полярных гетероцикла с двух концов соединения IDC16 связаны с его активностью, и что два кольца, находящихся посередине, менее важны.
На основе этой гипотезы авторы изобретения предположили, что:
- азот индолина и кольца D IDC16 могли бы действовать в качестве акцепторов водородных связей;
- N-метилированный 4-пиридиноновый мотив мог бы сохраняться в аналогах;
- плоская тетрациклическая геометрия не была оптимальна, и может быть целесообразно заменить кольца В и С на другие мотивы для ограничения ДНК интеркалирующих свойств.
Пример 6: Ингибирование продукции ВИЧ-1 в инфицированных мононуклеарных клетках периферической крови (РВМС)
Материалы и методы
Первое определение заключается в определении концентрации соединения, которая демонстрирует наименьшее количество побочных действий с точки зрения жизнеспособности клеток и последовательности клеточного цикла.
В рамках этой концепции мононуклеарные клеткки периферической крови (РВМС) здоровых доноров выделяют путем центрифугирования в градиенте FICOLL. Клетки затем активируют в течение двух суток до плотности 1,5×106 клеток/мл в среде RPMI plutamax, дополненной 10% фетальной телячьей сывороткой (FCS), 40 ед/мл IL2 и 5 мкг/мл РНА (фитогемагглютинин) в инкубаторе при 37°С, 5% CO2.
Стандартный эксперимент с использованием 96-луночных планшетов для тестирования 30 молекул в трех параллелях, включая положительные и отрицательные контроли, проводят следующим образом:
PHA/IL2 активированные РВМС промывают RPMI 10% FCS и ресуспендируют в 1,5×106 клеток/мл в RPMI glutamax 10% FCS, 40 ед/мл II2. Клетки высевают в 96-луночные планшеты (1,5 105 клеток/лунку/100 мкл). Инфицирование вирусами осуществляют с использованием 1 нг AdaM/лунку. 100 мкл тестируемых молекул в концентрации 20 мкМ добавляют в каждую лунку (конечная концентрация 10 мкМ). Продукцию вируса определяют при помощи иммуносорбентных анализов на р24 антиген после 3 и 6 суток инфицирования (Kit Innogenetics). Как правило, РВМС получают из нескольких здоровых доноров (приблизительно 11 различных доноров). Затем строили кривые зависимости «доза-эффект» для выбранных соединений для определения IC50.
Протокол для оценки цитотоксичности:
Для оценки цитотоксичности различных соединений использовали тот же самый протокол, как указано выше, для засеивания клеток HOS-CD4+-CCR5+ или РВМС в конечном объеме 50 мкл без добавления вируса, и 50 мкл тестируемых молекул. После инкубации в течение 6 суток при 37°C добавляют 20 мкл раствора CellTiter96 AqueousOne для определения количества жизнеспособных клеток в анализах пролиферации и цитотоксичности (Promega). CellTiter96 AqueousOne представляет собой раствор для колориметрического анализа, который обладает множеством преимуществ по сравнению с анализами МТТ и дает удовлетворительные результаты.
Также оценили действие выбранных молекул на пролиферацию CD4 и CD8 с использованием красителя карбоксифлуоресцеина диацетата сукцинимидильный эфир (CFSE) (Invitrogen) для отслеживания деления.
Результаты:
Эффективность соединений по настоящему изобретению измеряют при помощи ВИЧ-специфичного твердофазного иммуноферментного анализа, р24 ELISA. Эффективность лекарственного средства выражают в виде относительного ингибирования антигена ВИЧ р24 в этом быстром и чувствительном анализе. Ожидается, что соединения по настоящему изобретению демонстрируют IC50 (концентрация полумаксимального ингибирования) меньше 100 мкМ in vitro, когда РВМС из различных доноров сенсибилизировали штаммом adaM ВИЧ-1. Согласно конкретным воплощениям ожидают, что IC50 in vitro составляет меньше 10 мкМ, или даже меньше, чем от 1 наномолярной до пикомолярной.
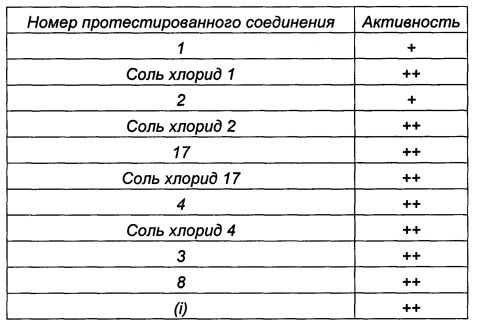
Для протестированных соединений могут быть приведены следующие результаты:
В качестве примеров фармацевтически приемлемых носителей композиция может включать эмульсии, микроэмульсии, эмульсии типа масло в воде, безводные липиды и эмульсии типа вода в масле или другие типы эмульсии.
Композиция по изобретению может дополнительно включать одну или более чем одну добавку, такую как разбавители, эксципиенты, стабилизаторы и консерванты. Такие добавки хорошо известны специалистам в данной области техники и, в частности, описаны в "Ullmann′s Encyclopedia of Industrial Chemistry,
6th Ed." (разные издатели, 1989-1998, Marcel Dekker) и в "Pharmaceutical Dosage Forms and Drug Delivery Systems" (ANSEL et al., 1994, WILLIAMS & WILKINS).
Вышеупомянутые эксципиенты выбраны согласно лекарственной форме и желательному способу введения.
В этом контексте они могут быть представлены в любой фармацевтической форме, подходящей для энтерального или парентерального введения, в сочетании с подходящими эксципиентами, например, в форме плоских или покрытых оболочкой таблеток, твердых желатиновых, мягких капсул и других капсул, суппозиториев или напитка, такого как суспензии, сиропы, или инъекционных растворов или суспензий, в дозах, которые позволяют суточно вводить от 0,1 до 1000 мг активного вещества.
Еще одна задача заключается в применении по меньшей мере одного соединения формул (I), (А1), (А1'), (В1) и (В1'), определенных выше, и соединений (1)-(27) и (i), (ii), (iii), (iv), (v), (vi), (vii) или (viii), определенных выше, или одной из их фармацевтически приемлемых солей по настоящему изобретению для получения лекарственного средства для лечения у субъекта заболевания, возникающего в результате по меньшей мере одной аномалии сплайсинга.
Используемый в настоящей заявке термин "субъект" относится к млекопитающему, такому как грызун, кошка, собака, примат или человек, предпочтительно указанный субъект представляет собой человека.
Предпочтительно, соединения по изобретению обладают способностью ингибировать процессы сплайсинга пре-мРНК, которые являются конститутивными или, конкретнее, зависят от регуляторных последовательностей, известных как ESE (экзонный энхансер сплайсинга), ISE (интронный энхансер сплайсинга), ESS (экзонный сайленсер сплайсинга) и ISS (интронный сайленсер сплайсинга).
В особенно предпочтительном пути процессы сплайсинга являются или конститутивными и/или зависят от регуляторных последовательностей ESE.
Предпочтительно, настоящее изобретение относится к применению по меньшей мере одного соединения формул (I), (А1), (А1'), (В1) и (В1'), определенных выше, и соединений (1)-(27) и (i), (ii), (iii), (iv), (v), (vi), (vii) или (viii), определенных выше, или одной из их фармацевтически приемлемых солей по настоящему изобретению для получения лекарственного средства для лечения у субъекта СПИДа.
Таким образом, настоящее изобретение относится к одному соединению формул (I), (А1), (А1'), (В1) и (В1'), определенных выше, и соединению (1)-(27) и (i), (ii), (iii), (iv), (v), (vi), (vii) или (viii) или одной из их приемлемых солей в качестве агента для ингибирования, предупреждения или лечения СПИДа.
Другая задача изобретения относится к терапевтическому способу для лечения субъекта от генетического заболевания, возникающего в результате аномалий сплайсинга, при котором вводят терапевтически эффективное количество соединения формул (I), (А1), (А1'), (В1) и (В1'), соединений (1)-(27) и (i), (ii), (iii), (iv), (v), (vi), (vii) или (viii), определенных выше, или одной из их приемлемых солей.
Предпочтительно, указанное генетическое заболевание, возникающее в результате аномалий сплайсинга, представляет собой СПИД.
"Терапевтически эффективное количество" обозначает количество, которое вызывает ингибирование сплайсинга соответствующей пре-мРНК. Специалисты в данной области техники будут способны определить указанное терапевтически эффективное количество на основе общего уровня знаний и способов, описанных в примерах.
Соединения могут быть введены любым способом введения, таким как, например, внутримышечный, внутривенный или пероральный путь, и т.д.
Соединения по настоящему изобретению могут в подходящих случаях быть введены в виде пролекарств, таких как сложные эфиры соединений, к которым относится изобретение. "Пролекарство" обозначает соединение, которое превращается in vivo посредством метаболизма (например, путем гидролиза, восстановления или оксиления) до соединения по настоящему изобретению. Например, сложноэфирное Пролекарство соединения по настоящему изобретению может быть превращено путем гидролиза in vivo до исходной молекулы. Подходящие сложные эфиры соединений по настоящему изобретению представляют собой, например, ацетаты, цитраты, лактаты, тартраты, малонаты, оксалаты, салицилаты, пропионаты, сукцинаты, фумараты, малеаты, метилен-бис-β-гидроксинафтоаты, гентизаты, изетионаты, ди-пара-толуоилтартраты, метансульфонаты, этансульфонаты, бензолсульфонаты, пара-толуолсульфонаты, циклогексилсульфаматы и хинаты. Примеры сложноэфирных пролекарств представляют собой пролекарства, описанные F.J. Leinweber, Drug Metab. Res., 1987, 18, 379. Подразумевается, что в данном контексте ссылки на соединения по настоящему изобретению также включают формы пролекарства.
В одном воплощении по изобретению указанная композиция дополнительно включает эксципиент, позволяющий приготовить в виде препарата соединения по изобретинию таким образом, что указанная композиция представлена в твердой или жидкой форме, которую получают и вводят внутривенным путем.
Соединения по изобретению предпочтительно будут вводить внутривенным путем в концентрации 80-100 мг/м2. Концентрация будет выбрана специалистами в данной области техники в зависимости от органа или ткани, которые будут лечить, состояния развития заболевания и используемого режима регулирования.