Результат интеллектуальной деятельности: АВТОМАТИЗИРОВАННАЯ ИДЕНТИФИКАЦИЯ ПОЛОЖЕНИЯ РЕГУРГИТАЦИОННОГО ОТВЕРСТИЯ МИТРАЛЬНОГО КЛАПАНА НА УЛЬТРАЗВУКОВОМ ИЗОБРАЖЕНИИ
Вид РИД
Изобретение
По настоящей заявке испрашивается приоритет по предварительной заявке на патент США № 61/426,669, зарегистрированной 23 декабря 2010 г.
Данное изобретение относится к медицинским диагностическим ультразвуковым системам и, в частности, к использованию диагностических систем ультразвуковой визуализации для анализа потока митральной регургитации.
Поток регургитации является серьезным медицинским состоянием, которое требует анализа и адекватного лечения. Непосредственно перед сокращением левого желудочка для нагнетания крови в тело митральный клапан должен полностью закрыться таким образом, чтобы сокращение выбрасывало весь поток крови в аорту. Если клапан не закроется полностью, некоторая часть крови в левом желудочке будет выброшена назад в левое предсердие через отверстие в неполностью закрытом клапане. Этот ретроградный кровоток - как правило, небольшая кратковременная струя кровотока, бьющая назад через неполностью закрытые створки клапана - снижает отток крови от сердца и, следовательно, эффективность каждого сокращения сердца. При этом сердце должно осуществлять нагнетание быстрее, чтобы обеспечивать в теле необходимое снабжение питательным кровотоком. Сердце перегружается из-за его неэффективности, что приводит к сердечной недостаточности.
Клинические врачи в течение многих лет использовали ультразвуковую визуализацию, пытаясь обнаружить регургитационный кровоток. Ультразвуковое обнаружение клапанной регургитации поначалу осуществлялось путем поиска вышеупомянутой струи крови на ультразвуковом изображении левой стороны сердца. За последние двадцать лет наблюдение струи упростилось благодаря двумерной (2D) цветовой доплеровской визуализации кровотока, при которой высокая скорость и турбулентность небольшой струи крови обнаруживаются путем тщательного поиска этих аномальных скоростей локального потока вблизи протекающего сердечного клапана. Но обнаружение плоскости изображений, в которой струя является наиболее распространенной, в сочетании с движением сердца и клапана и турбулентностью кровотока в окрестности митрального клапана, а также кратковременное появление струи создают трудности для такого субъективного подхода. В последние годы в тех случаях, когда положение струи могло наблюдаться с помощью ультразвука, клинические врачи использовали метод, называемый PISA, что означает площадь формирующейся струи митральной регургитации, чтобы попытаться численно определить регургитационный кровоток. В данном способе подозреваемый клапан и область внутри полости левого желудочка сердца и вблизи клапана отображаются с помощью цветового доплеровского картирования. Во время возникновения струи при мгновенном возрастании скоростей кровотока в проксимальной области по направлению к регургитационному отверстию в этой области формируется область схождения потока (FCR). Такая структура потока приводит к наложению цветовой карты при кратковременном превышении скоростями потока диапазона скоростей, используемого для цветовой карты. Цветовая карта в этот момент фиксируется и застывает на экране дисплея. Затем выполняется измерение скорости v на первой линии наложения FCR, при этом измерение выполняется на расстоянии r от линии наложения до предполагаемого центра отверстия клапана. Эти два результата измерения используются затем для вычисления скорости потока через отверстие с помощью выражения Qt=2πr2v.
При проведении этой процедуры возникают некоторые трудности. Одна из них состоит в том, что наивысшая точность обеспечивается при фиксации струи на цветовой карте в самом ее максимуме. Продолжительность струи за время сердечного цикла может составлять всего лишь 300-450 миллисекунд, однако, при этом частота кадров цветовой карты может находиться в диапазоне 10-20 кадров в секунду. Таким образом, возможно, что время получения одного из кадров цветовой карты не будет в точности совпадать с моментом, когда струя находится в своем максимуме. Клинический врач может повторять последовательность получения цветовой карты для дополнительных сердечных циклов или может довольствоваться неточностью, вызванной проведением измерений не совсем в максимуме струи.
Другая проблема состоит в том, что на цветовой карте нелегко определить центр отверстия клапана. Ткань клапана создает большие отражения ультразвука, быстро перемещается при осуществлении сканирования и может выглядеть на изображении как объемная, расплывчатая или нечеткая масса. Таким образом, возможно, что точность измерения r пострадает из-за невозможности оценить точное положение отверстия.
Третья проблема состоит в том, что базовый метод PISA представляет собой всего лишь единичное, одномерное измерение. Выполняется лишь одно измерение скорости, и в вычислениях используется лишь один радиус r отверстия. Данный способ предполагает, что остальной кровоток в FCR ведет себя так же, как и при единичном измерении. Очевидно, что любая неточность в проведении единичного измерения даст неточный результат.
Расширением базового метода PISA, в котором делается попытка устранить эти неточности, является проведение многократных измерений скорости вокруг дуги, очерчивающей внешнюю границу FCR на двумерном изображении. Измеряется расстояние r от каждой точки измерения скорости до отверстия, и полученное множество результатов измерений используется для вычисления скорости потока Qt. Несмотря на то, что множество результатов измерений может предотвратить зависимость от единичного неточного измерения, возникает еще одна проблема. Метод единичных измерений, как правило, осуществляется путем нацеливания центрального луча ультразвукового зонда через верхушку сердца и непосредственно сквозь предполагаемое регургитационное отверстие и проведения измерений скорости v и расстояния r вдоль линии этого луча. При установленной таким образом линии луча при использовании этого вектора регургитационного потока измеренная скорость будет точной, и на нее не будет оказывать влияние допплеровский угол. Как известно, на ультразвуковые измерения доплеровской скорости влияет угол между направлением потока и направление ультразвукового луча. Поток, который расположен непосредственно на одной линии с направлением луча, будет измерен точно, а поток, который расположен под ненулевым углом относительно направления луча, уменьшится на косинус этого угла. Поток, перпендикулярный (90°) направлению луча, не даст допплеровского отклика. Следовательно, доплеровская скорость, измеренная с помощью ультразвука, должна корректироваться в зависимости от угла между вектором потока и направлением луча, чтобы обеспечить более точное измерение скорости. В случае 2D метода PISA дополнительные измерения скорости вдоль дуги FCR будут неточными из-за изменения углов между их векторами потока и направлением луча в каждой точке, в которой осуществляется измерение скорости. Таким образом, несмотря на то, что многократные измерения могут компенсировать ошибку, создаваемую при единичном измерении скорости, совокупные измерения занизят скорость потока из-за изменения допплеровских углов в каждой точке измерения.
Еще одной проблемой, присущей методу PISA, является неточность знания точного положения регургитационного отверстия клапана. Как упоминалось выше, наложение цветового изображения преобладает вблизи утечки клапана ввиду внезапного ускорения кровотока по направлению к отверстию и сквозь него. Цветовое изображение при этом зашумляется засветками наложенных цветов в допплеровском изображении вблизи отверстия. Кроме того, плоскость митрального клапана во время сокращения сердца находится в движении. Поскольку точность метода PISA зависит от знания положения отверстия для измерения расстояния r, эти препятствия для точного знания положения отверстия могут привести к неточному измерению r и, следовательно, к неточному вычислению скорости потока. Эксперименты продемонстрировали, что уже ошибка в один миллиметр в положении отверстия может привести к значительной ошибке в вычислении скорости потока через место утечки. Кроме того, известно, что многие регургитирующие клапаны имеют не одиночную точечную утечку, а утечку через щель от неточного закрытия клапана. Поэтому предположение об утечке, вызываемой одиночным отверстием в клапане, может оказаться необоснованным.
В связи с этим, желательно создать способ и устройство для количественного определения скорости потока и объемного расхода регургитации митрального клапана, которые устраняют вышеуказанные ограничения метода PISA. Целью настоящего изобретения является точная оценка точного положения регургитационного отверстия клапана. Еще одной целью настоящего изобретения является проведение ряда измерений, не подверженных влиянию допплеровского угла в каждом положении измерения. Еще одной целью настоящего изобретения является возможность выявления и количественного определения регургитации митрального клапана не только из-за одиночной точечной утечки, но и из-за щели по линии закрытия клапана.
В соответствии с принципами настоящего изобретения, описываются ультразвуковая диагностическая система и способ визуализации для количественного определения регургитационного кровотока. На ультразвуковом изображении регургитирующего клапана очерчивается дугообразная (двумерная) или полусферическая (трехмерная) область кровотока вблизи предполагаемого положения утечки митрального клапана. Внутренняя граница этой области находится на области наложения, смежной с отверстием утечки, или непосредственно за ней, а наружная граница области находится вне внутренней границы и концентрична ей. Делаются исходные допущения относительно потока регургитации, включая положение регургитационного отверстия. Эти допущения используются для расчета модели поля скоростей потока регургитации. Параметры модели регулируются в соответствии с физикой ультразвука и/или настройками ультразвуковой системы для определения ожидаемых наблюдаемых ультразвуковой системой векторов скорости VOBS в очерченной области. Измерения скорости выполняются ультразвуковой системой в очерченной области, при этом измеренные скорости сравниваются с ожидаемыми скоростями. Вычисляются различия между измеренными и ожидаемыми скоростями, и с помощью нелинейной аппроксимации кривой выполняются регулировки в соответствии с одним или более значением модели. Данный процесс итерационно повторяется до тех пор, пока ожидаемые и измеренные значения не сойдутся в приемлемой степени. Итерационно регулируемые параметры модели используются для проведения количественного измерения скорости потока или положения протекающего отверстия в клапане.
В соответствии с еще одним аспектом настоящего изобретения, изначально предполагаемое положение регургитационного отверстия на ультразвуковом изображении автоматически обновляется предшествующим процессом для индикации фактического положения отверстия на изображении. При этом клиническому врачу показывается точное положение регургитационного отверстия, несмотря на наличие помех на изображении вблизи митрального клапана.
В соответствии с еще одним аспектом настоящего изобретения, вышеизложенный метод повторяется во множестве пространственных положений вдоль митрального клапана. Совокупный поток регургитации, измеренный в этих пространственных положениях, дает показатель потока регургитации из-за регургитирующей утечки, происходящей скорее в щели по линии закрытия клапана, чем в одиночном протекающем точечном отверстии.
В соответствии с еще одним аспектом настоящего изобретения, описывается несколько характеристик фильтров стенок сосудов, которые являются предпочтительными для реализации измерения потока регургитации в соответствии с настоящим изобретением, в том числе, фильтр стенок сосудов с характеристикой, достигающей максимума при промежуточных скоростях потока, которые часто встречаются в области потока вблизи регургитационного отверстия.
НА ЧЕРТЕЖАХ:
Фиг. 1 в виде блок-схемы иллюстрирует ультразвуковую систему диагностической визуализации, выполненную в соответствии с принципами настоящего изобретения.
Фиг. 2 представляет собой блок-схему, иллюстрирующую функционирование процессора количественной оценки потока, изображенного на фиг. 1.
Фиг. 3 иллюстрирует ультразвуковое допплеровское изображение струи регургитации.
Фиг. 4 иллюстрирует ультразвуковое изображение с изначально предполагаемым положением отверстия и автоматически индицируемым положением отверстия в соответствии с настоящим изобретением.
Фиг. 5 иллюстрирует метод количественного определения потока регургитации щели вдоль клапана в соответствии с настоящим изобретением.
Фиг. 6 иллюстрирует характеристику чувствительности фильтра стенок сосудов, подходящего для использования в ультразвуковой системе настоящего изобретения.
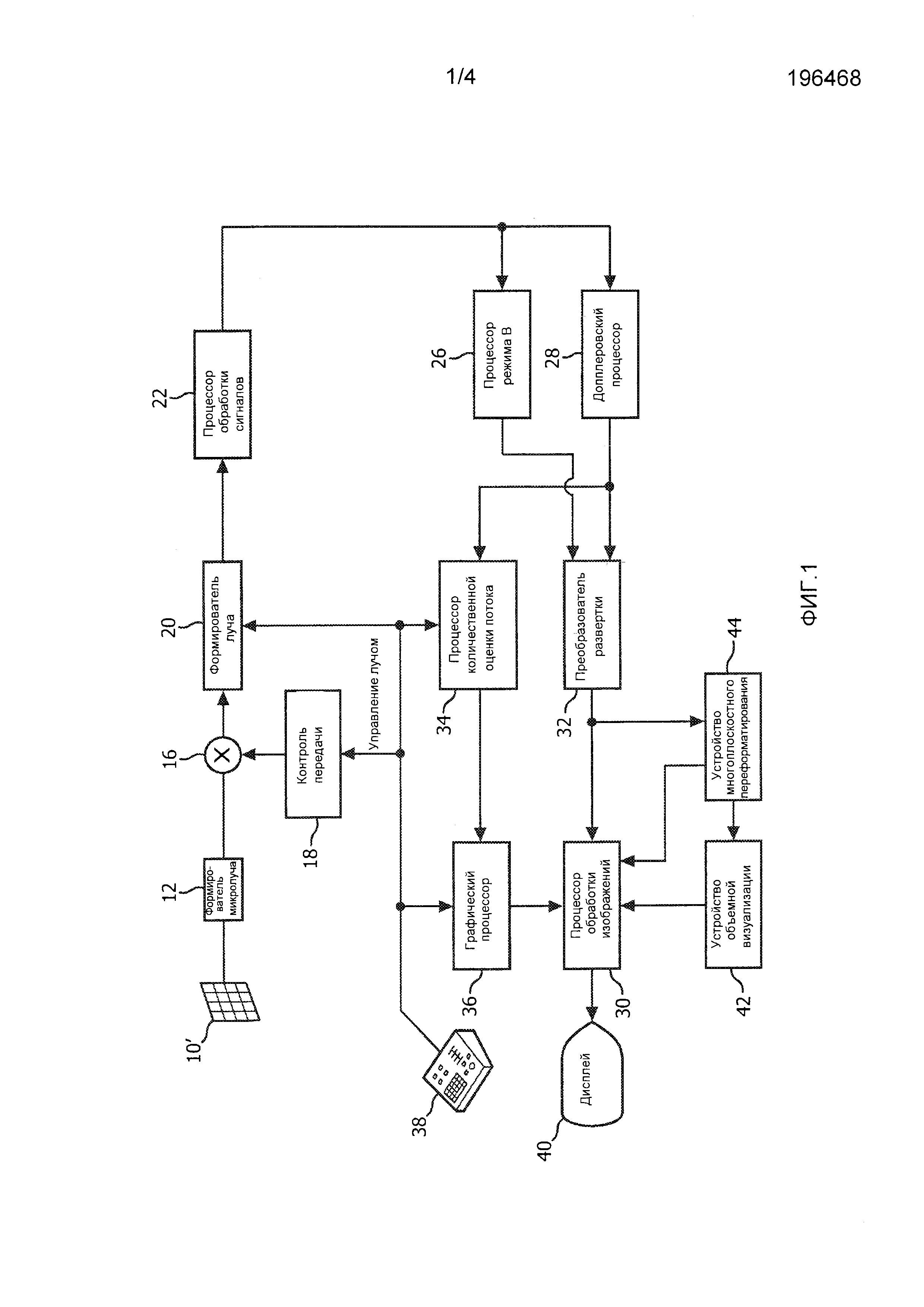
На фиг. 1 в виде блок-схемы показана ультразвуковая система диагностической визуализации, выполненная в соответствии с принципами настоящего изобретения. На фиг. 1 в ультразвуковом зонде 10 предусмотрена матрица 10' преобразователей для передачи ультразвуковых волн и приема отраженной информации. Матрица 10' преобразователей предпочтительно является двумерной матрицей преобразовательных элементов, выполненной с возможностью сканирования в трех измерениях, например, как по возвышению, так и по азимуту относительно положения митрального клапана для трехмерной (3D) визуализации. Матрица преобразователей связана с формирователем 12 микролуча в зонде, который контролирует передачу и прием сигналов элементами матрицы. Формирователи микролуча выполнены с возможностью, по меньшей мере, частичного формирования луча по сигналам, принимаемым группами или «участками» преобразовательных элементов, как описано в патентах США 5,997,479 (Саворд с соавт.), 6,013,032 (Саворд с соавт.) и 6,623,432 (Пауэрс с соавт.). Формирователь микролуча связан кабелем зонда с переключателем 16 передачи/приема (T/R), который переключается между передачей и приемом и защищает формирователь 20 главного луча от мощных передаваемых сигналов. Управление передачей ультразвуковых лучей от матрицы 10 преобразователей под контролем формирователя 12 микролуча осуществляется контроллером 18 передачи, связанным с переключателем T/R и формирователем 20 главного луча, который принимает вводимую пользователем информацию от пользовательского интерфейса или панели 38 управления. Одной из функций, управление которой осуществляется с помощью контроллера передачи, является направление, в котором осуществляется управление лучами. Управление лучами может осуществляться прямо вперед от матрицы преобразователей (перпендикулярно ей) или под различными углами для обеспечения более широкого поля обзора.
Сигналы, для которых частично сформированы лучи, создаваемые формирователем 12 микролуча, подаются на формирователь 20 главного луча, в котором сигналы, для которых частично сформированы лучи, от отдельных участков элементов объединяются в сигнал, для которого лучи сформированы полностью. Например, формирователь 20 главного луча может иметь 128 каналов, каждый из которых принимает сигнал, для которого лучи сформированы частично, от участка из 12 преобразовательных элементов. Таким образом, сигналы, принимаемые более чем 1500 преобразовательными элементами двумерной матрицы, могут эффективно способствовать формированию пучков для отдельного сигнала, для которого сформированы лучи.
Сигналы, для которых сформированы лучи, подаются на процессор 22 обработки сигналов. Процессор 22 обработки сигналов может обрабатывать принимаемые эхо-сигналы различными способами, такими как полосовая фильтрация, прореживание, разделение компонентов I и Q и разделение гармонических сигналов, которое реализует разделение линейных и нелинейных сигналов с тем, чтобы обеспечить идентификацию нелинейных эхо-сигналов, отраженных от ткани и микропузырьков. Процессор обработки сигналов может также выполнять дополнительное выделение сигнала, такое как понижение уровня спеклов, смешивание сигналов и подавление шумов.
Обработанные сигналы подаются на процессор 26 режима В и допплеровский процессор 28. Процессор 26 режима В использует амплитудное детектирование для визуализации таких структур в теле, как ткань стенок сердца, митральный клапан и клетки крови. В режиме В изображения структуры тела могут быть сформированы либо в режиме работы на гармониках, либо в основном режиме, либо в совокупности этих режимов, как описывается в патенте США 6,283,919 (Раундхилл с соавт.) и патенте США 6,458,083 (Джаго с соавт.). Допплеровский процессор 28 обрабатывает разделенные по времени сигналы от ткани и кровотока для обнаружения движения веществ, такого как поток клеток крови в поле изображения. Допплеровский процессор, как правило, включает в себя фильтр стенок сосудов с параметрами, которые могут устанавливаться на пропускание и/или блокирование эхо-сигналов, отраженных от отдельных типов материалов тела. Например, в фильтре стенок сосудов может быть установлена характеристика полосы пропускания, благодаря которой пропускается сигнал относительно низкой амплитуды от материалов с более высокой скоростью и одновременно блокируются относительно сильные сигналы от материала с более низкой или нулевой скоростью. Благодаря такой характеристике полосы пропускания будут пропускать сигналы от текущей крови и одновременно будут блокироваться сигналы от расположенных поблизости неподвижных или медленно движущихся объектов, таких как стенка сердца. Благодаря обратной характеристике будут пропускаться сигналы от движущейся ткани сердца и одновременно будут блокироваться сигналы от кровотока для так называемой тканевой допплеровской визуализации - обнаружения и отображения движения ткани. Допплеровский процессор принимает и обрабатывает последовательность разделенных по времени эхо-сигналов от различных точек в поле изображения, при этом последовательность эхо-сигналов от отдельной точки называется ансамблем. Ансамбль эхо-сигналов, принимаемых в быстрой последовательности в течение относительно короткого интервала времени, может использоваться для оценки частоты допплеровского сдвига текущей крови с установлением соответствия допплеровской частоты скорости, указывающей на скорость кровотока. Ансамбль эхо-сигналов, принимаемых в течение более длительного интервала времени, используется для оценки скорости более медленно протекающей крови или медленно движущейся ткани. Для оценки митральной регургитации быстро возникающей струи обычно используются небольшие длительности ансамбля (меньшее число выборок), поэтому может быть реализована высокая частота кадров сбора данных. Допплеровский сдвиг Δf может быть оценен с помощью уравнения в виде  , где f0 - частота передачи, с - скорость распространения ультразвука, v - скорость, а θ - угол между направлением луча и направлением кровотока.
, где f0 - частота передачи, с - скорость распространения ультразвука, v - скорость, а θ - угол между направлением луча и направлением кровотока.
Сигналы от структур и сигналы движения, формируемые процессором режима В и допплеровским процессором, подаются на преобразователь 32 развертки и устройство 44 многоплоскостного переформатирования. Преобразователь развертки выстраивает эхо-сигналы в пространственные положения, из которых они принимались, в требуемом формате изображений. Например, преобразователь развертки может выстраивать эхо-сигнал в двумерный (2D) секторообразный формат или в пирамидальное трехмерное (3D) изображение. Преобразователь развертки может накладывать на изображение структуры в режиме В цвета, которые соответствуют движению в точках в поле изображения, соответствующих расчетным допплеровским скоростям, для формирования цветного допплеровского изображения, на котором отображается движение ткани и кровотока в поле изображения. Устройство многоплоскостного переформатирования будет преобразовывать эхо-сигналы, принимаемые из точек в общей плоскости в объемной области тела, в ультразвуковое изображение этой плоскости, как описывается в патенте США 6,443,896 (Детмер). Устройство 42 объемной визуализации преобразует эхо-сигналы набора 3D данных в проецируемое 3D изображение, если смотреть из заданной опорной точки, как описывается в патенте США 6,530,885 (Энтеркин с соавт.). 2D или 3D изображения подаются с преобразователя 32 развертки, устройства 44 многоплоскостного переформатирования и устройства 42 объемной визуализации на процессор 30 обработки изображений для последующего улучшения качества, буферизации и временного хранения для отображения на графическом дисплее 40.
В соответствии с принципами настоящего изобретения, значения скорости кровотока, формируемые допплеровским процессором 28, подаются на процессор 34 количественной оценки потока. Процессор количественной оценки потока функционирует в соответствии с приведенным ниже описанием для формирования показателя скорости потока через регургитационное отверстие, объемного расхода через отверстие и пространственного положения отверстия. Процессор количественной оценки потока может принимать вводимую информацию от пользовательской панели 38 управления, например, начальную оценку положения отверстия, как описано ниже. Выходные данные с процессора количественной оценки потока подаются на графический процессор 36 для воспроизведения выходных данных с процессора с помощью изображения на дисплее 40. Графический процессор 36 может также формировать накладные графические элементы для отображения с использованием ультразвуковых изображений. Эти накладные графические элементы могут содержать стандартную идентифицирующую информацию, такую как имя пациента, дата и время изображения, параметры визуализации и т.п. В этих целях графический процессор принимает вводимую информацию от пользовательского интерфейса 38, такую как набранное на клавиатуре имя пациента. Пользовательский интерфейс также связан с контроллером 18 передачи для управления формированием ультразвуковых сигналов с матрицы 10' преобразователей и, следовательно, изображений, формируемых матрицей преобразователей и ультразвуковой системой. Пользовательский интерфейс также связан с устройством 44 многоплоскостного переформатирования для выбора и управления отображением множества многоплоскостных переформатированных (MPR) изображений, которые могут использоваться для количественного определения потока регургитации в MPR-изображениях в соответствии с настоящим изобретением, как описано ниже.
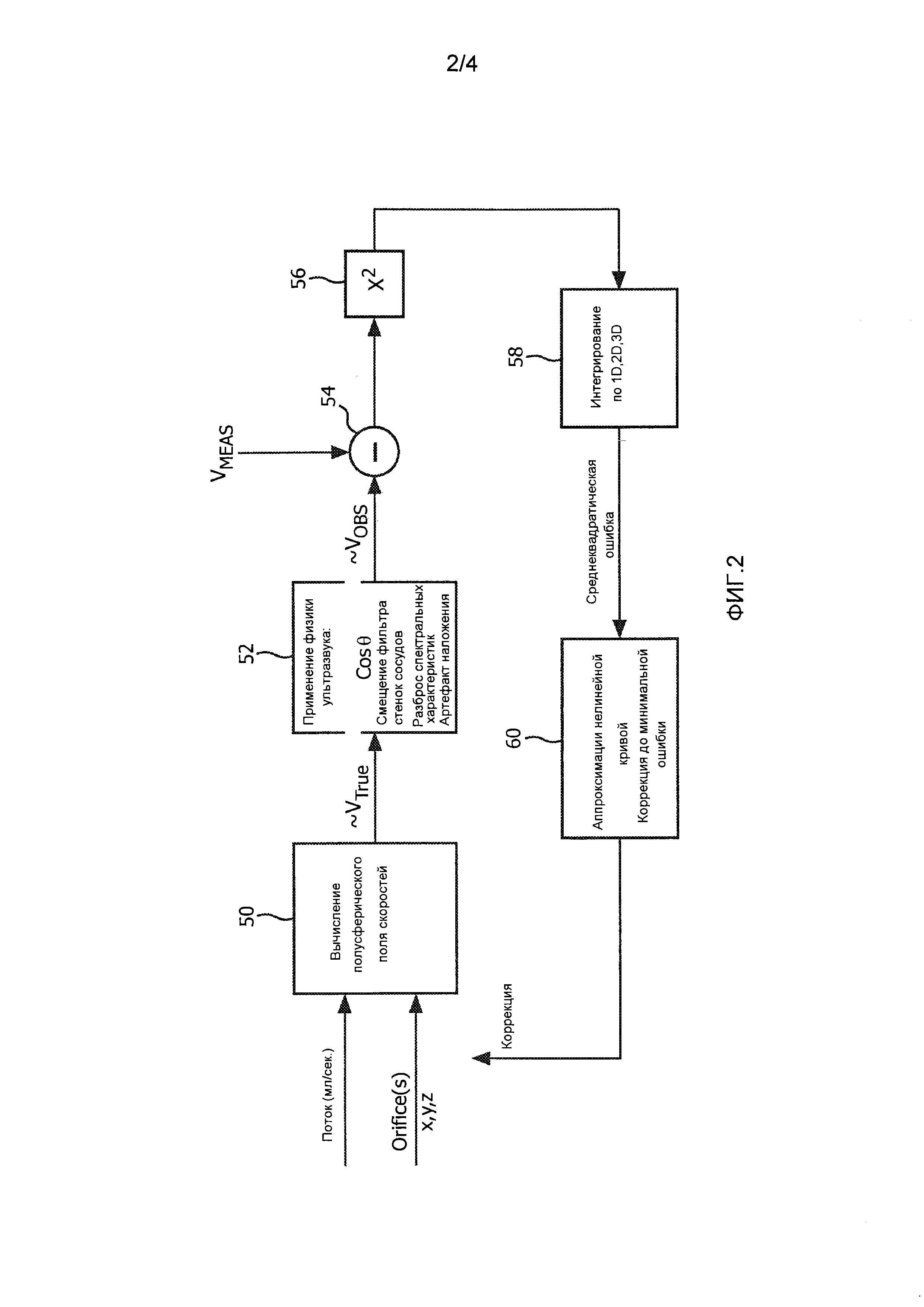
Фиг. 2 описывает функционирование процессора количественной оценки потока, изображенного на фиг. 1. Процессор основан на математической модели поля скоростей потока в потоках измерения в пределах зоны включений, как описано ниже. В варианте осуществления с 2D изображением зона включений предпочтительно представляет собой изогнутую полосу, очерчиваемую двумя дугами с центром в месте расположения регургитационного отверстия {x0, y0, z0}. В варианте осуществления с 3D изображением изогнутая полоса выполнена в виде полусферической оболочки, как описывается ниже в соответствии с фиг. 3. В предпочтительном варианте осуществления данная модель является моделью скорости вектора поля скоростей потока в виде

или

где  для вектора
для вектора  потока, а r - расстояние от точки в (x, y, z) в трехмерных координатах в зоне включений до регургитационного отверстия, при этом отверстие располагается в координатах {x0, y0, z0} в трехмерном пространстве. Это означает, что расстояние r, выражаемое векторно для указания направления отверстия, имеет вид
потока, а r - расстояние от точки в (x, y, z) в трехмерных координатах в зоне включений до регургитационного отверстия, при этом отверстие располагается в координатах {x0, y0, z0} в трехмерном пространстве. Это означает, что расстояние r, выражаемое векторно для указания направления отверстия, имеет вид

В прямоугольнике 50 на фиг. 2 скорость потока каждой точки в зоне включения моделируется таким образом. Вначале модель может начинаться с принятых или расчетных величин для неизвестных параметров, включая поток  и положение {x0, y0, z0} регургитационного отверстия. Например, модель может начинаться с параметров, которые номинально характерны для потока регургитации. Пользователь может вводить параметры, например, указывая предполагаемое положение регургитационного отверстия на ультразвуковом изображении. Либо для вычисления значений, используемых в качестве начальных параметров для поля скоростей потока, может использоваться известный метод, такой как PISA.
и положение {x0, y0, z0} регургитационного отверстия. Например, модель может начинаться с параметров, которые номинально характерны для потока регургитации. Пользователь может вводить параметры, например, указывая предполагаемое положение регургитационного отверстия на ультразвуковом изображении. Либо для вычисления значений, используемых в качестве начальных параметров для поля скоростей потока, может использоваться известный метод, такой как PISA.
Модель поля скоростей потока аппроксимирует векторы скорости, которые были бы точными, если бы были известны истинные физиологические векторы скорости. Векторы скорости, аппроксимированные моделью, показаны на выходе прямоугольника 50 как ~VTRUE. При этом прямоугольник 52 вводит некоторые ограничения и корректировки в ~VTRUE из-за практических факторов, таких как физика ультразвука и рабочие параметры используемой ультразвуковой системы. Затем модель поля скоростей потока корректируется или масштабируется, чтобы принять во внимание эти практические факторы с учетом реальных значений скорости, которые наблюдались бы ультразвуковой системой. Одним из практических факторов, для которого могут выполняться корректировки, является допплеровский угол. Как упоминалось выше, допплеровские измерения, выполняемые ультразвуковой системой, весьма точны только в тех случаях, когда направление потока соответствует направлению ультразвукового луча - при нулевом допплеровском угле. Для всех остальных углов между направлением луча и направлением потока скорость занижается. В уравнении допплеровского сдвига, приведенном выше, допплеровский угол взвешивается в результате членом cosθ, где θ - допплеровский угол. Еще одним практическим фактором ультразвуковой системы является смещение фильтра стенок сосудов. Доплеровский фильтр стенок сосудов, как правило, имеет нелинейную характеристику, которая для обнаружения кровотока имеет нулевой отклик при постоянном токе (DC) (отсутствии движения) и возрастает до максимального отклика на отдельной высокой частоте ±f. В соответствии с другим вариантом, фильтр стенок сосудов может иметь максимальный отклик на частоте ниже частоты, обусловленной пределом Найквиста частоты дискретизации ансамбля, как описывается ниже. Контрольный объем в теле, в котором измеряется допплеровский сдвиг, не является в теле одной точкой, а имеет конечный размер, в результате чего отражение допплеровских сигналов свидетельствует о диапазоне скоростей. Неравномерный отклик фильтра стенок сосудов может привести к тому, что большой разброс скоростей может иметь большее увеличение в различных местах амплитудно-частотной характеристики, например, более высокие скорости подняты больше, чем более низкие скорости. Такой неравномерный отклик может создать сдвиг воспринимаемого центра разброса скоростей, называемого смещением фильтра стенок сосудов. Эффект смещения фильтра стенок сосудов может также учитываться путем корректировки модели. Еще одним связанным с этим фактором, который может приниматься во внимание, является разброс спектральных характеристик - эффект допплеровского уширения спектра, возникающий в результате различных путей и углов от контрольного объема до каждого приемного элемента активной апертуры матричного преобразователя. См. патент США 5,606,972 (Раус). Еще одним фактором, который может приниматься во внимание, является эффект артефактов наложений - выдача неверной информации о допплеровских частотах и скоростях в тех случаях, когда движение кровотока происходит на скорости, превышающей скорость, которая может быть однозначно обнаружена пределом Найквиста частоты дискретизации ансамбля эхо-сигналов. В прямоугольнике 52 подобные факторы учитываются с помощью корректировки скалярного произведения модели поля скоростей потока, которая для описанных выше моделей может быть выполнена в виде

где  - векторное представление факторов физической и ультразвуковой системы, для которых выполняется корректировка. Результат показан на фиг. 2 в виде VOBS, при этом модель корректируется с помощью ожидаемых эффектов и того, что ожидается в сигналах, измеряемых ультразвуковой системой.
- векторное представление факторов физической и ультразвуковой системы, для которых выполняется корректировка. Результат показан на фиг. 2 в виде VOBS, при этом модель корректируется с помощью ожидаемых эффектов и того, что ожидается в сигналах, измеряемых ультразвуковой системой.
Компаратор 54 сравнивает ожидаемые значения скорости VOBS из модели поля скоростей потока с фактическими результатами измерений скорости по точкам (контрольным объемам) в поле VMEAS, формируемыми допплеровским процессором 28. В прямоугольнике 56 различия между ожидаемыми и полученными значениями возводятся в квадрат для получения параметра ошибки для каждой точки. Параметры ошибки интегрируются по всей зоне включений, которая может представлять собой одномерную (например, 1D линию), двумерную (например, 2D линейный дугообразный участок) или трехмерную (например, 3D полусферическую оболочку) зону включений для получения среднеквадратического параметра ошибки для всей зоны. Затем параметр ошибки используется для корректировки параметров модели поля, таких как r и скорость потока, для обеспечения снижения измеряемого впоследствии параметра ошибки. Предпочтительный метод корректировки состоит в использовании аппроксимации нелинейной кривой для модификации модели с целью снижения ошибки. Одним таким методом аппроксимации нелинейной кривой, который может использоваться, является алгоритм Левенберга-Маркара, который уточняет координаты положения регургитационного отверстия и потока  или скорость потока (Qt) поля по направлению к отверстию или через него.
или скорость потока (Qt) поля по направлению к отверстию или через него.
Цикл на фиг. 2 итерационно повторяется для снижения параметра ошибки. С каждым проходом по циклу более точно модифицированная модель поля корректируется и сравнивается с результатами измерений скорости ультразвука из области принятия, при этом параметр ошибки итерационно уменьшается. При уменьшении параметра ошибки до приемлемо низкого уровня модель демонстрирует требуемые фактические измерения положения отверстия и кровотока через отверстие. Эти параметры, а при необходимости и другие, формируются в виде выходных данных процессором 34 количественной оценки потока и выводятся на дисплей для пользователя.
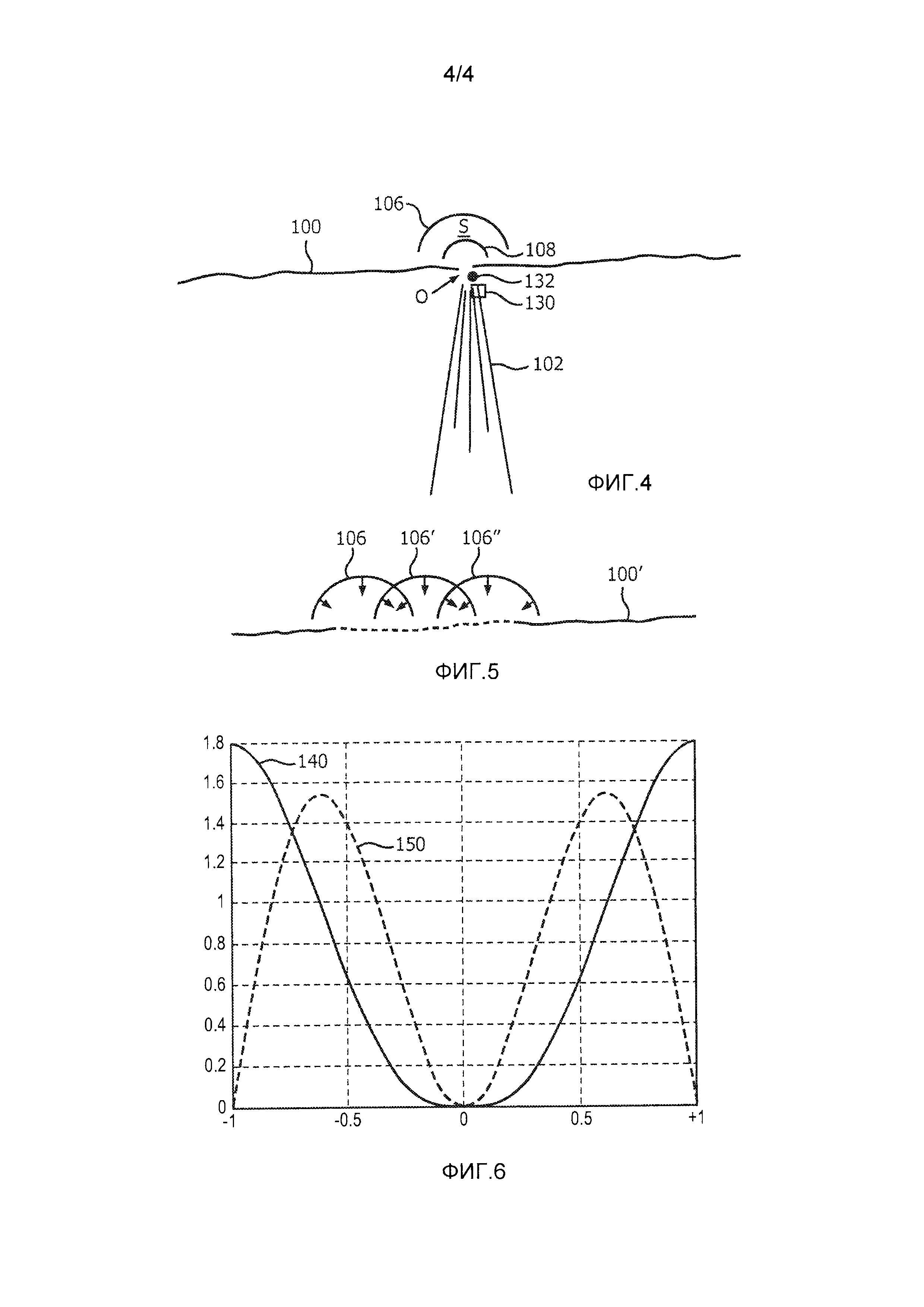
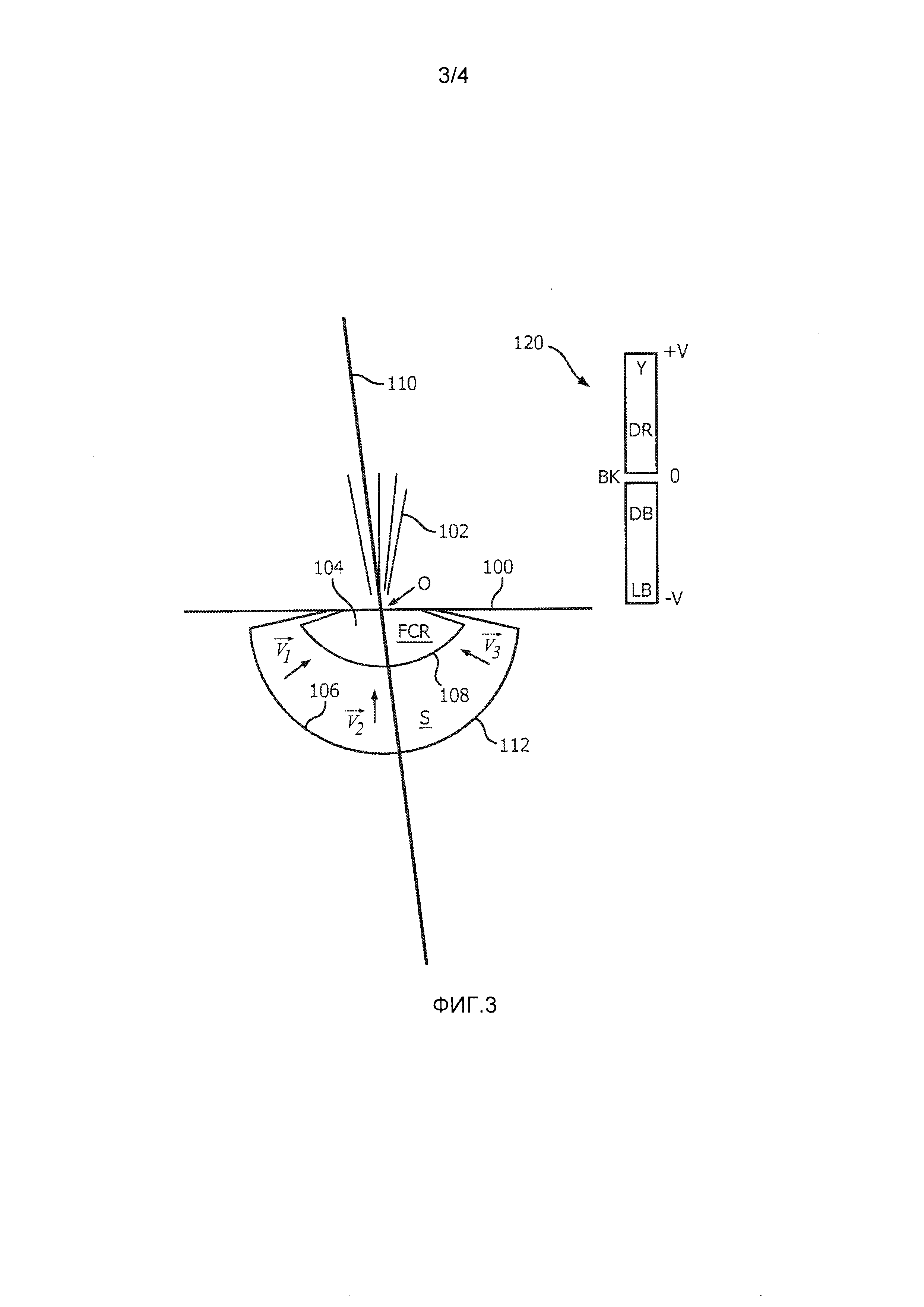
Фиг. 3 представляет собой схематичное 2D ультразвуковое изображение, иллюстрирующее практическое использование настоящего изобретения для измерения регургитации митрального клапана. Линия 100 отображает плоскость митрального клапана, в которой происходит регургитационная утечка через отверстие О. При сокращении левого желудочка струя 102 крови просачивается назад в правое предсердие. В способе PISA эта струя считывается допплеровским лучом 110, проходящим через отверстие О. В патенте США 6,719,697 (Ли) представлено усовершенствование метода PISA, в котором осуществляется отображение цветового M-режима в течение цикла сердечной деятельности из положения допплеровского луча 110. Процессор для обработки цветовых доплеровских изображений настраивается на пределы отображения, показанные контрольной цветной полосой 120 на правой стороне изображения, простирающейся от центра отсчета с нулевой скоростью (ВК=черный) до максимальных скоростей +V и -V в противоположных направлениях. Цветовая гамма (Y=желтый; DR=темно-красный и т.д.) отображена в соответствии с этим диапазоном скоростей. К отверстию непосредственно примыкает область 104 схождения потока (FCR). Вне области схождения потока находится область 112 (S) принятия, используемая в реализации настоящего изобретения.
Как метод PISA, так и настоящее изобретение основаны на предположении о том, что поток регургитации в левом желудочке вблизи отверстия сходится и протекает по направлению к месту О отверстия. Это показано векторами  ,
,  и
и  потока в области S принятия. Но как показывает направление допплеровского луча 110, практически все векторы потока не будут лежать на одной прямой с направлением луча даже в том случае, когда используются изменяющиеся углы луча фазированного секторного датчика. Следовательно, для различных векторов потока будут существовать допплеровские лучи различной величины, что учитывается путем корректировок допплеровского угла в соответствии с моделью поля скоростей потока в прямоугольнике 52 на фиг. 2, как описано выше.
потока в области S принятия. Но как показывает направление допплеровского луча 110, практически все векторы потока не будут лежать на одной прямой с направлением луча даже в том случае, когда используются изменяющиеся углы луча фазированного секторного датчика. Следовательно, для различных векторов потока будут существовать допплеровские лучи различной величины, что учитывается путем корректировок допплеровского угла в соответствии с моделью поля скоростей потока в прямоугольнике 52 на фиг. 2, как описано выше.
Цветовое допплеровское изображение FCR 104 является хаотическим и изменчивым. Причина состоит в том, что пространственная ориентация клеток крови и скорости кровотока в этой области изменяются очень быстро при изменении направления кровотока и кратковременного ускорения его в направлении отверстия О во время систолического сокращения. Выборки ансамбля, полученные в течение этого интервала времени, часто некоррелированы друг с другом, что нарушает корреляцию внутри ансамбля, от которой зависят традиционные допплеровские процессоры оценивания. Вследствие этого, несмотря на то, что поток в пределах 104 может быть в целом ламинарным, цветовая визуализация кровотока может оказаться визуализацией сильно турбулентного потока и артефакта наложения. Внутренняя граница 108 области S принятия предпочтительно устанавливается вне области 104 схождения потока, чтобы избежать изменчивых оценок скорости от FCR. Один из подходов к установлению границы 108 состоит в установлении ее на границе разрыва скорости или вне ее. Это может осуществляться визуально на основе цветовой визуализации кровотока или автоматически на основе порога разрыва скорости.
Внешняя граница 106 области принятия может устанавливаться в отношении измеримых скоростей. Несмотря на то, что скорости потока регургитации относительно высоки вблизи отверстия, они становятся все ниже с увеличением расстояний от отверстия. Внешняя граница 106 может устанавливаться на расстоянии от отверстия О, на котором низкие допплеровские скорости все еще могут измеряться достоверно. Это может быть определено по отношению к доле предела Найквиста или по отношению к низкой скорости потока, такой как 5 мм/сек. Внешняя граница 106 может при этом устанавливаться на расстоянии, на котором допплеровским процессором все еще может быть реализована приемлемая чувствительность к небольшим потокам.
Область 112 принятия в примере на фиг. 3 наблюдается как двумерная дугообразная зона S, имеющая центр вращения на отверстии О. Настоящее изобретение может использоваться в одном, двух или трех измерениях. В одномерной реализации и модели может, например, рассматриваться лишь сегмент линии 110 луча, которая находится, например, между дугами 108 и 106. Двумерной реализацией является реализация, в которой осуществляется выборка области принятия, являющейся плоской, такой как область 112 принятия на фиг. 3. В трехмерной реализации рассматривается дугообразная область принятия, такая как 112, но в полной полусфере с центром в отверстии. Более высокая точность ожидается при использовании двумерной и трехмерной реализаций. В предпочтительной реализации используется зонд 3D визуализации с двумерным матричным преобразователем, как показано на фиг. 1, при этом обнаружение и моделирование осуществляются в полусферической или четвертьсферической объемной оболочке вокруг отверстия. Более высокие значения частоты кадров могут быть реализованы при использовании двумерной визуализации, при этом MPR-кадр через отверстие и струю может выбираться из объема, сканируемого 3D зондом с помощью устройства 44 многоплоскостного переформатирования. Требуемая плоскость может многократно сканироваться с высокой частотой кадров сбора данных, при этом измерения скорости и вычисления потока осуществляются с использованием двумерной области принятия, показанной в 2D MPR-изображении.
Несмотря на то, что могут существовать области принятия, из которых поток по круговой схеме сходится в направлении отверстия, как показано на фиг. 3, оказалось, что в некоторых случаях имеются иные некруговые схемы. Другими словами, вектора потока, направленные в сторону отверстия, могут располагаться по схеме, отличной от дуги чистого круга. Вместо изображенной на фиг. 3 круглой формы область принятия может иметь форму параболы или сплющенного круга. В трехмерных реализациях область принятия может представлять собой оболочку в форме параболоида или сплюснутого сфероида. Форма области принятия, то есть, площадь или объем, в котором скорости измеряются по сравнению с моделью, может динамически изменяться во время итерационных проходов по циклу обработки, изображенному на фиг. 2, таким образом, что процесс будет изменяться и стремиться к измененной форме относительно формы, используемой в исходной модели.
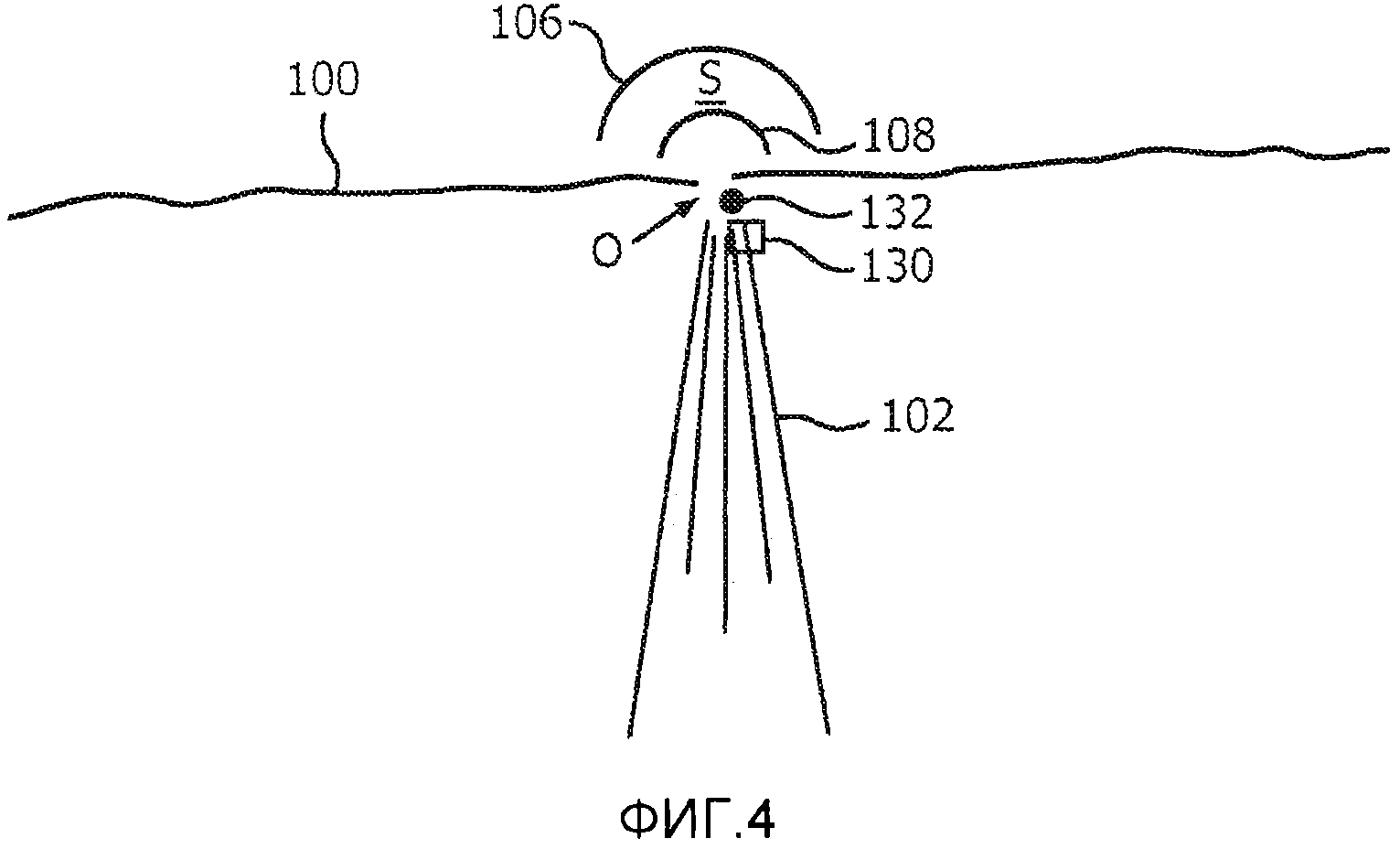
Как упоминалось выше, клиническому врачу часто бывает трудно точно установить на ультразвуковом изображении положение узкого регургитационного отверстия. В тех случаях, когда сердце не сокращается, отверстие отсутствует, а в тех случаях, когда оно присутствует, его положение искажается артефактами результирующей турбулентности, например, вблизи области схождения потока. В соответствии с еще одним аспектом настоящего изобретения, в одной реализации настоящего изобретения может автоматически указываться положение протекающего отверстия на ультразвуковом изображении. Фиг. 4 иллюстрирует ультразвуковое изображение, в котором описанные выше элементы в соответствии с фиг. 3 имеют те же ссылочные позиции. Данное изображение также включает в себя небольшую коробку 130, которая помещается клиническим врачом над изображением в начале диагностирования для указания предполагаемого положения регургитационного отверстия. Управление панелью 38 управления, такой как шаровой манипулятор, осуществляется клиническим врачом для помещения пиктограммы 130 в том месте на изображении, где, по мнению клинического врача, расположено отверстие. Координаты указанной пиктограммы отверстия используются для начала обработки процессором количественной оценки потока, изображенным на фиг. 2, при этом данные координаты используются в качестве начальных координат отверстия в математической модели прямоугольника 50. Процессор 34 итерационно уточняет моделируемые значения векторов скорости потока по направлению к месту положения отверстия в ответ на получение измеренных значений скорости VMEAS. Было обнаружено, что вертикальное размещение положения отверстия оказывает наибольшее влияние на сходимость моделируемых векторов скорости с измеренными значениями скорости. Несмотря на то, что во время систолы сердце сокращается, движение при сокращении заставляет митральный клапан перемещаться на изображении вертикально по направлению к центру левого желудочка. Таким образом, естественное движение при сокращении сердца может служить источником наибольшей ошибки при оценке потока регургитации. Процессор 34 итерационно уточняет положение отверстия для сокращения ошибочного расхождения между измеренным и расчетным значениями скорости в поле скоростей потока (область S принятия) между границами 106 и 108. По мере того, как процессор количественной оценки потока выполняет итерации для схождения на истинных координатах отверстия, окончательно определенные координаты используются процессором 34 количественной оценки потока и графическим процессором 36 для автоматического перемещения пиктограммы 130 отверстия на вычисленные координаты на изображении. В соответствии с другим вариантом, графический процессор помещает другую (вычисленную) пиктограмму 132 отверстия на дисплей в положение истинных координат, определенное с помощью итеративной корректировки модели. Как упоминалось выше, уже смещение отверстия на 1 мм может оказать значительное влияние на вычисления скорости потока в отверстии и объемного расхода, причем объемный расход является интегралом скорости потока по времени, в течение которого сердце сокращается (около 1/3 цикла сердечной деятельности). Объемный расход достигает максимума приблизительно в середине систолического интервала. На фиг. 4 видно, что система поместила вычисленную пиктограмму 132 отверстия в своем истинном положении в поле изображения, которое отличается от начальной оценки положения отверстия клиническим врачом. При выполнении ультразвуковых исследований с 2D визуализацией координаты отверстия, как правило, являются декартовыми координатами (x, y, z). При использовании 3D визуализации, как правило, используется сферическая система координат (r, θ, ϕ). Кроме того, как иллюстрирует ультразвуковое изображение на фиг. 4, область S принятия графически выделена на отображаемом ультразвуковом изображении, и любое изменение формы области принятия, как описано выше, вносится в отображаемую форму и графическое выделение области принятия на дисплее.
Как упоминалось выше, регургитационные отверстия не всегда существуют в виде одиночной точечной утечки в закрытом клапане. Утечки могут создаваться щелевыми отверстиями или множеством небольших утечек. Фиг. 5 является иллюстрацией использования одной реализации настоящего изобретения для оценки скорости потока и объемного расхода щелей и множества утечек при закрытии клапана. Как показано на фиг. 5, процесс настоящего изобретения осуществляется для ряда положений отверстия, расположенных вдоль протекающего митрального клапана 100'. Эти отдельные положения точечного отверстия могут использоваться для моделирования сложных щелеобразных отверстий или множества отверстий в закрытом клапане. На фиг. 5 показан пример трех таких определений, при этом каждое имеет свою собственную область принятия, показанную внешними границами 106, 106' 106” зоны, и векторы потока (показанные небольшими стрелками), направленные на схождение в другом месте отверстия вдоль клапана 100'. Поле скоростей векторов, связанное с каждым точечным отверстием, складывается векторно с другими отверстиями таким образом, что определяется единая совокупная область принятия с единым совокупным полем скоростей векторов. Для множества отверстий совокупное поле скоростей векторов далее приближается к истинным физиологическим векторам скорости (~Vtrue - выход прямоугольника 50 на фиг. 2). Обработка совокупного поля скоростей векторов определяет скорость потока или объемный расход всех точечных отверстий, соответствующих полной щели вдоль закрытия митрального клапана. Несмотря на то, что на фиг. 5 приведен пример поля скоростей векторов, сформированного по трем точечным отверстиям, для адекватного моделирования щели может использоваться любое число отверстий. Области принятия, используемые для каждого измерения, могут объединяться, как показано на фиг. 5, поскольку поток, который определяется для совокупных отверстий, является векторным потоком, направленным к единственному отверстию или положению вдоль щели. При трехмерной реализации линия измерений не ограничивается прямой линией в плоскости, а может повторять нелинейный путь закрытия створок митрального клапана.
Фиг. 6 иллюстрирует характеристику чувствительности двух допплеровских фильтров стенок сосудов, которые могут использоваться при реализации настоящего изобретения. Координаты по оси абсцисс графика на фиг. 6 отложены в единицах пределов Найквиста дискретных данных фильтров стенок сосудов, где пределы +1 и -1 являются нормализованными пределами Найквиста фильтра, соответствующего скоростям кровотока. Нулевое состояние (DC или отсутствие потока) находится в центре. Координаты по оси ординат показывают относительную амплитудно-частотную характеристику характеристики фильтра. Кривая 140 характеристики является типичной кривой характеристики фильтра стенок сосудов для измерения кровотока и может использоваться при реализации настоящего изобретения. Эта характеристика имеет нулевой отклик в центре, что приводит к отсутствию отклика на неподвижные объекты, такие как неподвижные стенки сосудов. Заметно, что характеристика непрерывно растет по мере удаления кривой от нуля, при этом максимальный отклик на пределах Найквиста для наибольших скоростей потоков может обнаруживаться без наложения в выбранном интервале дискретизации. В результате, такая амплитудно-частотная характеристика наиболее чувствительна к потоку при наибольших скоростях потоков.
Кривая 150 отклика представляет собой кривую, которая часто предпочтительна для фильтра стенок сосудов в одной реализации настоящего изобретения. Заметно, что ход этой кривой 150 имеет максимум на относительно высокой, но промежуточной частоте дискретизации немного выше ±0,5 Найквиста, предпочтительно - в диапазоне от 1/2 до 2/3 Найквиста, и спадает к нулю на пределах Найквиста. Такая характеристика фильтра рассчитана на более высокую чувствительность к более низким скоростям потока, которые могут ожидаться вокруг внешней границы 106 области S принятия. Целесообразно сместить низкую чувствительность на поток низких скоростей, что происходит в результате коротких ансамблей, обычно используемых для цветового допплеровского картирования потока регургитации. Это видно по более высокому ходу кривой 150 для более низких скоростей вблизи центра графика. Несмотря на то, что наблюдается спад кривой 150 до нуля на пределах Найквиста, такая потеря чувствительности к высоким скоростям, как правило, приемлема в тех случаях, когда она образуется ценой более высокой чувствительности к потокам с более низкими скоростями.