Результат интеллектуальной деятельности: СПОСОБ СРАВНИТЕЛЬНОЙ ОЦЕНКИ КАЧЕСТВА ВОДНОЙ СРЕДЫ ПО СОДЕРЖАНИЮ ТЯЖЕЛЫХ МЕТАЛЛОВ
Вид РИД
Изобретение
Изобретение относится к области экологии и охране окружающей среды, в частности к способам контроля за качеством водной среды.
Известен способ биоиндикации загрязнения морских вод тяжелыми металлами, включающий выставление стеклянных пластин на определенной глубине в исследуемой и условно-фоновой акваториях. Через две недели обрастание с пластин снимают целиком, подсушивают до постоянного веса, минерализуют концентрированной азотной кислотой и методом атомной адсорбции определяют содержание тяжелых металлов. В качестве индикатора для исследования используется пионерное сообщество обрастания стеклянных пластин (Пат. РФ №2264465, МПК C12Q 1/01, C12Q 1/1, G01N 33/18, опубл. 20.11.2005).
Недостатком данного способа является необходимость установки искусственных объектов в море на определенной глубине, что требует значительных технических и физических усилий не только по установке стеклянных пластин, но и по сохранению этих пластин в неблагоприятных морских условиях. Кроме того, использование в качестве объекта исследования пионерного сообщества обрастания не позволяет корректно оценить загрязнение именно исследуемой акватории, так как пионерное сообщество обрастания может включать в себя значительную часть организмов, попавших на пластину из другой морской акватории за счет морских течений. Данный метод не подходит для экспресс-анализа, поскольку для формирования пионерного сообщества обрастания требуется (как указывают авторы) не менее двух недель.
Известно использование в качестве индикатора загрязнения речных систем тяжелыми металлами эпифитовзвеси. Для получения эпифитовзвеси срезанные под поверхностью воды экземпляры растений помещались в полиэтиленовые пакеты, доставлялись в полевую лабораторию, высушивались на воздухе и механическим воздействием с них отделяли находящийся на них твердый материал (эпифитовзвесь); макроскопические частицы эпифитона, присутствующие в эпифитовзвеси, удаляли пластиковым пинцетом. Затем полученную эпифитовзвесь использовали для последующего анализа на тяжелые металлы (Янин Е.П. Эпифитовзвесь - новый индикатор загрязнения речных систем тяжелыми металлами. - М.: ИМГРЭ, 2002, с. 8).
К недостаткам данного способа следует отнести:
- использование в качестве индикатора эпифитовзвеси, т.е. взвеси, осажденной на макрофитах в результате выпадения осадков из водной толщи, в частности принесенных речными течениями из различных мест, что не позволяет корректно оценить загрязнение именно исследуемой акватории;
- невозможность оценки трофического уровня остатков, входящих в состав эпифитовзвеси (остатки животного происхождения или растительного, а также минеральные остатки).
Следует подчеркнуть, что в данном способе не исследуется эпифитон.
Известен способ оценки загрязненности водной среды с помощью макроводорослей для интегрированного контроля в течение суток уровня тяжелых металлов в воде. Водоросли инкубируют в морской среде в течение суток, затем извлекают, отжимают, биомассу высушивают до постоянной массы, озоляют, фильтруют, растворяют (А.С. СССР, №1677625, МПК G01N 33/18).
Недостатками этого способа являются:
- невозможность использования макроводорослей для контроля в течение более длительного времени;
- небольшой выбор определяемых элементов (свинец, цинк, кадмий) и необходимость подбора видов-мониторов для каждого конкретного региона;
- недостаточная экспрессность для проведения массовых анализов из-за большого количества и длительности операций.
Наиболее близким по количеству существенных признаков к заявляемому решению является способ оценки качества водной среды по содержанию тяжелых металлов, включающий сбор бурых макроводорослей, подготовку проб путем высушивания и растирания водорослей в яшмовой ступке, определение в гомогенизированных пробах содержания тяжелых металлов атомно-адсорбционным методом и сравнение полученных данных с данными из условно-фонового района (Коженкова С.И., Христофорова Н.К., Чернова Е.Н., Долговременный мониторинг загрязнения морских вод Северного Приморья тяжелыми металлами с помощью бурых водорослей, Экология, 2000, №3, с. 233-237).
К недостаткам известного технического решения следует отнести:
- невысокую чувствительность метода, так как концентрации тяжелых металлов в водорослях-макрофитах из прибрежных акваторий, испытывающих значительное антропогенное воздействие, и из условно-фонового района могут быть практически одинаковы;
- необходимость предварительного подбора определенного вида макроводорослей для оценки содержания конкретного тяжелого металла, поскольку в связи с физиологическими особенностями разные макроводоросли накапливают разное количество каждого конкретного металла;
- невозможность установления конкретного периода антропогенного воздействия, вследствие того, что водоросли-макрофиты имеют длительный период индивидуального развития (от нескольких месяцев до нескольких лет).
Задачей, поставленной перед изобретением, является повышение чувствительности способа и его точности.
Поставленная задача решается тем, что в известном способе оценки качества водной среды по содержанию тяжелых металлов, включающем сбор макрофитов, подготовку проб, определение в пробах содержания тяжелых металлов, сравнение полученных данных с данными из условно-фонового района, согласно изобретению, в качестве проб используют микроводоросли эпифитона.
Микроводоросли эпифитона (от гр. «epi» на + «phyton» растение) - это сообщество микроводорослей, обитающих на других растениях - макрофитах-базифитах (макроводорослях или водных цветковых растениях), которые используют только как место прикрепления, не являясь ни паразитами, ни симбионтами.
Использование в качестве биоиндикатора микроводорослей эпифитона позволяет значительно повысить не только чувствительность метода обнаружения акваторий, имеющих различную концентрацию тяжелых металлов, но и точность способа, благодаря тому, что микроводоросли эпифитона имеют короткий период индивидуального развития. Это, в частности, позволяет установить конкретный период антропогенного воздействия.
Для повышения точности способа и качества определения содержания тяжелых металлов подготовку проб осуществляют путем тщательного смыва с талломов макрофитов микроводорослей эпифитона, с последующей фильтрацией и концентрированием их биомассы.
Фильтрация смыва микроводорослей эпифитона через фильтр, с диаметром не более 100 мкм, позволяет отделить микроводоросли эпифитона от различных загрязнений: от мелких беспозвоночных, кусочков талломов макроводорослей и других примесей. Это позволяет дополнительно повысить как чувствительность, так и точность метода.
Концентрирование биомассы микроводорослей эпифитона также способствует повышению чувствительности и точности метода.
Для реализации заявленного способа пробы макрофитов, на которых обитает сообщество микроводорослей эпифитона, отбирают непосредственно на месте их естественного произрастания с глубины 0,5-3,0 метра, помещая их под водой в одинаковые сосуды из инертного материала, например из стекла. Закрытые наполненные сосуды выносят на берег. Отбор проб в исследуемом районе и в условно-фоновом районе проводят в один день.
Далее получают пробы микроводорослей эпифитона. Для этого отобранные образцы макрофитов вместе с водой сливают в емкость наподобие кюветы и делают смывы с поверхности нескольких особей макрофитов (с макроводорослей или с высших цветковых растений типа зоостеры), тщательно потирая и ополаскивая отобранные образцы.
Для выделения более чистой фракции микроводорослей эпифитона воду со смывом пропускают через капроновый фильтр с диаметром пор не более 100 мкм. Отфильтрованную пробу отстаивают, надосадочную жидкость убирают, после чего влажный осадок, представляющий из себя сконцентрированную пробу микроводорослей эпифитона, количественно переносят в фарфоровую чашку и высушивают при температуре 85°(С), а затем гомогенизируют, растирая в яшмовой ступке. Навески (0,2-0,5 г) каждой гомогенизированной пробы в трех повторностях минерализуют в концентрированной азотной кислоте (о.с.ч.) в микроволновой печи. Раствор азотной кислоты с растворенными в нем органическими веществами количественно переносят в стеклянные стаканчики и выпаривают на плите до осадка; представляющего из себя влажные соли. Полученный осадок влажных солей растворяют в 10 мл 2% азотной кислоты.
Если есть необходимость сравнения содержания тяжелых металлов в микроводорослях эпифитона и в макрофитах-базифитах, с которых получены пробы этих микроводорослей, то образцы макрофитов после смыва с них микроводорослей эпифитона легко отжимают и высушивают, раскладывая на любой поверхности из инертного материала, например на полиэтиленовой пленке, и в последующем в них также определяют содержание тяжелых металлов, используя методику, описанную в прототипе.
Определение концентрации микроэлементов выполняют на атомно-абсорбционном спектрофотометре Shimadzu 6800 (Shimadzu, Япония) с пламенным (для Fe, Zn, Cu, Ni, Cd) и электротермическим с графитовой трубкой (для Pb) атомизаторами. Ошибка при определении содержания железа, цинка, меди, никеля и кадмия составляет менее 10%, а свинца - 11%. Точность определения концентрации металла контролируют, анализируя стандартные образцы NIES-9 (Sargasso). Загрязнение реактивов контролируют, используя холостые пробы, включенные в партию подготовленных к анализу образцов.
Для наглядности способ демонстрируется следующими фигурами:
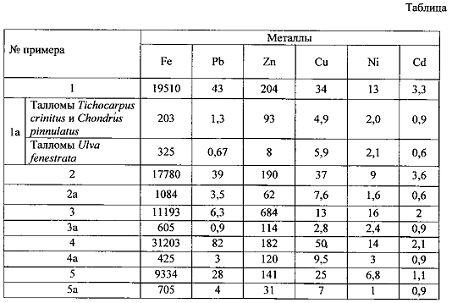
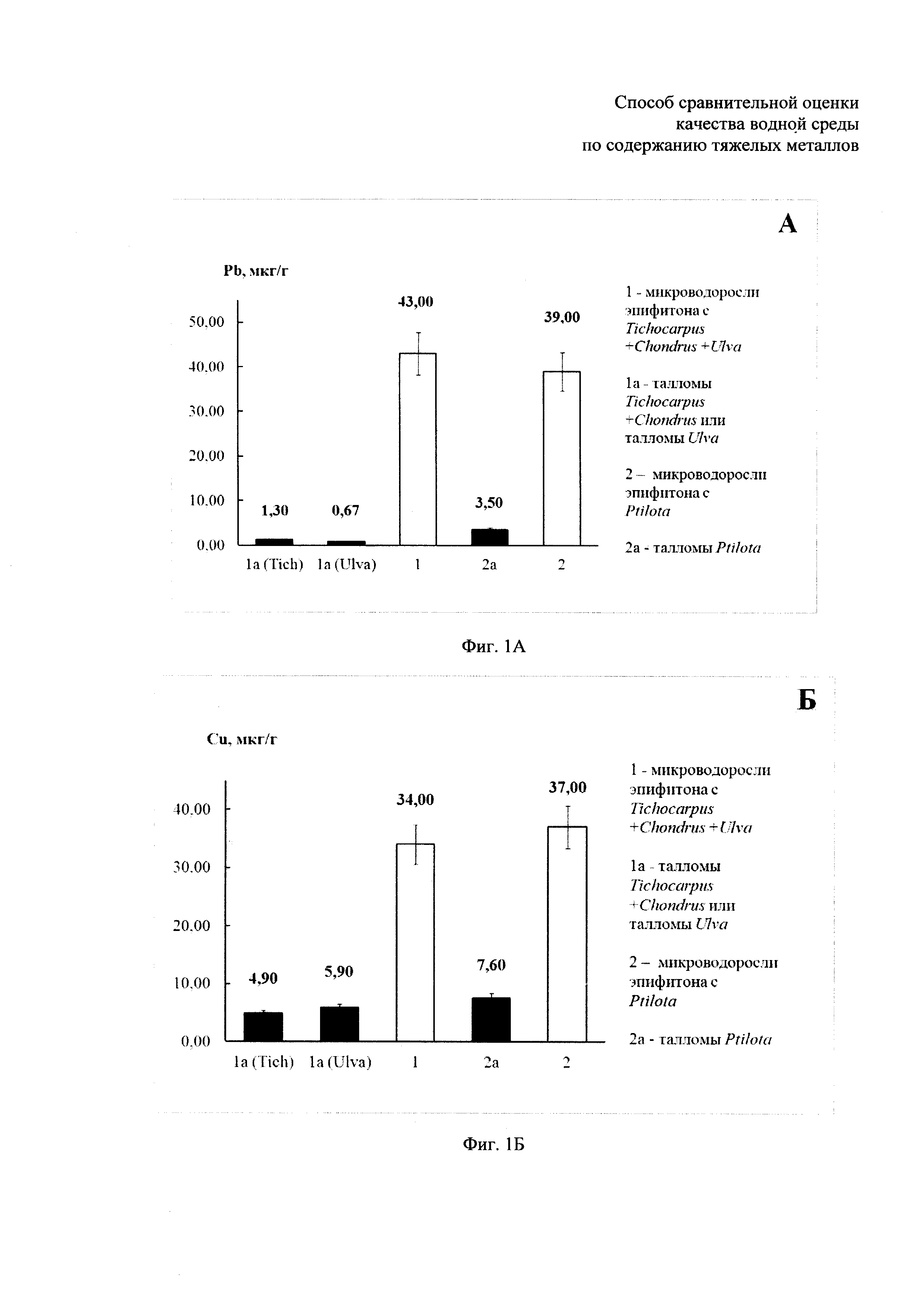
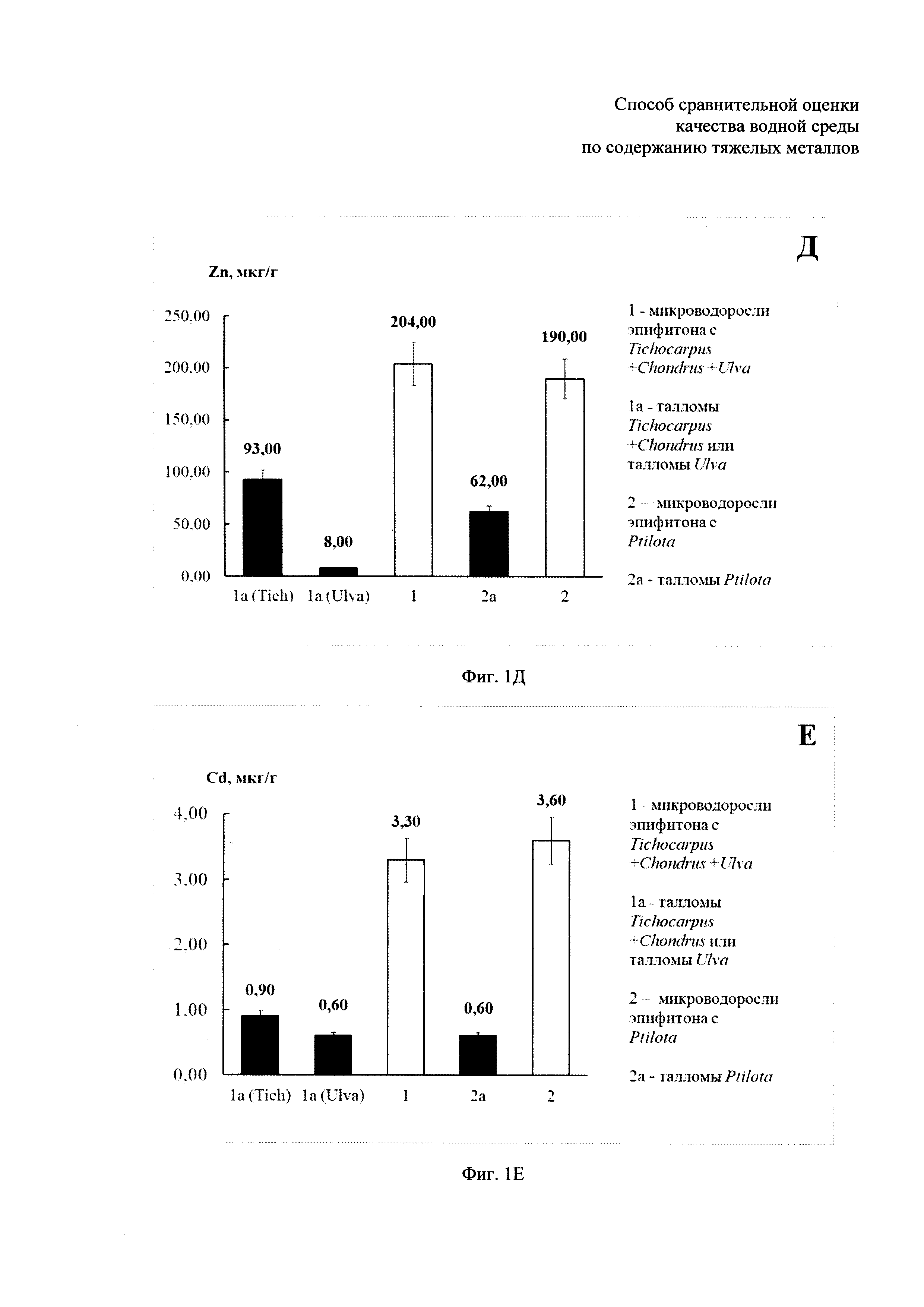
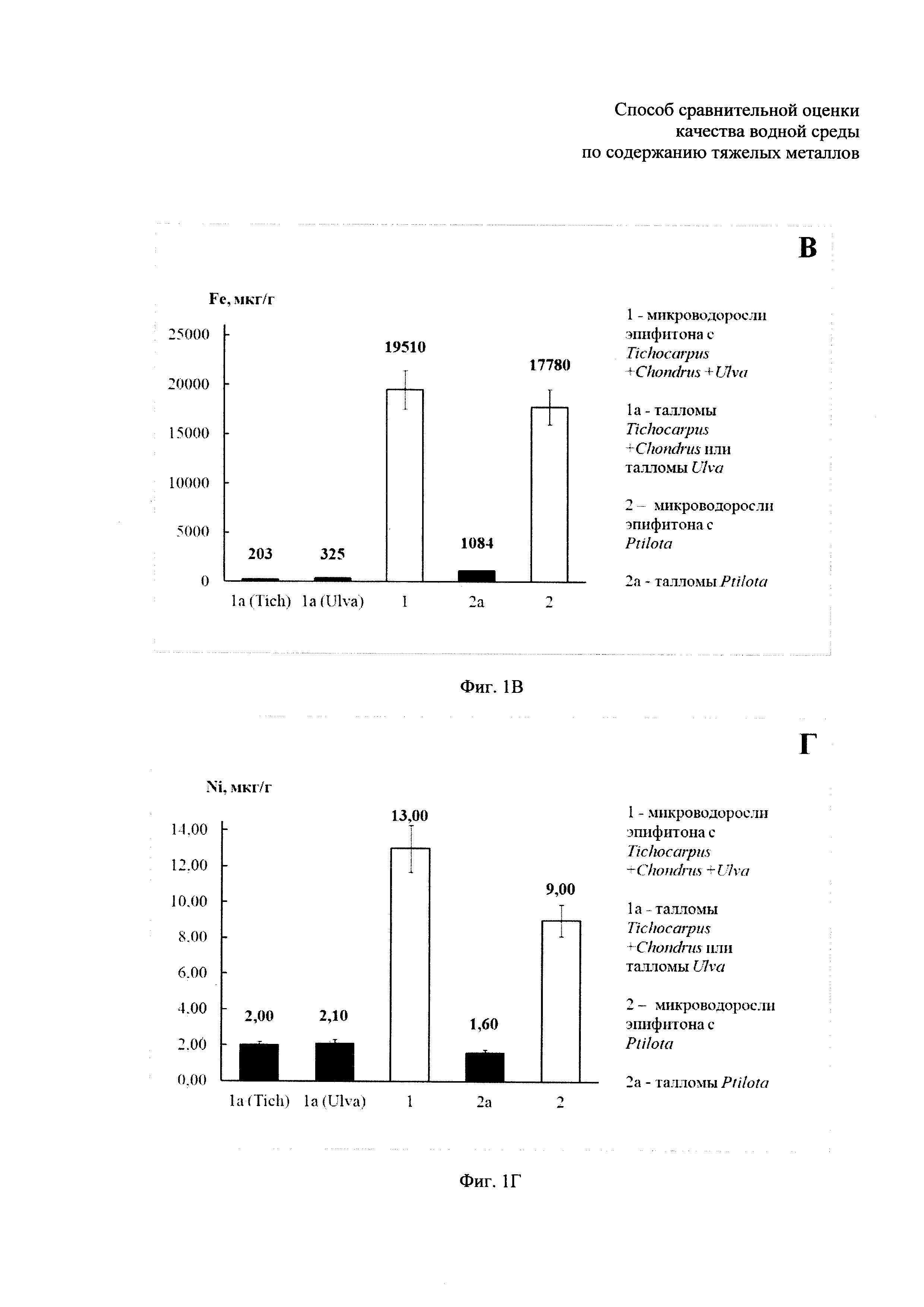
- содержание тяжелых металлов в микроводорослях эпифитона и в талломах макрофитов-базифитов Tichocarpus crinitus, Ulva fenestrata и Ptilota filicina, собранных на акватории бухты Кирпичного завода в Амурском заливе в июле 2012 г. представлено на фиг. 1А, Б, В, Г, Д, Е: где фиг. 1А - содержание свинца, фиг. 1Б - содержание меди, фиг. 1В - содержание железа, фиг. 1Г - содержание никеля, фиг. 1Д - содержание цинка и фиг. 1Е - содержание кадмия;
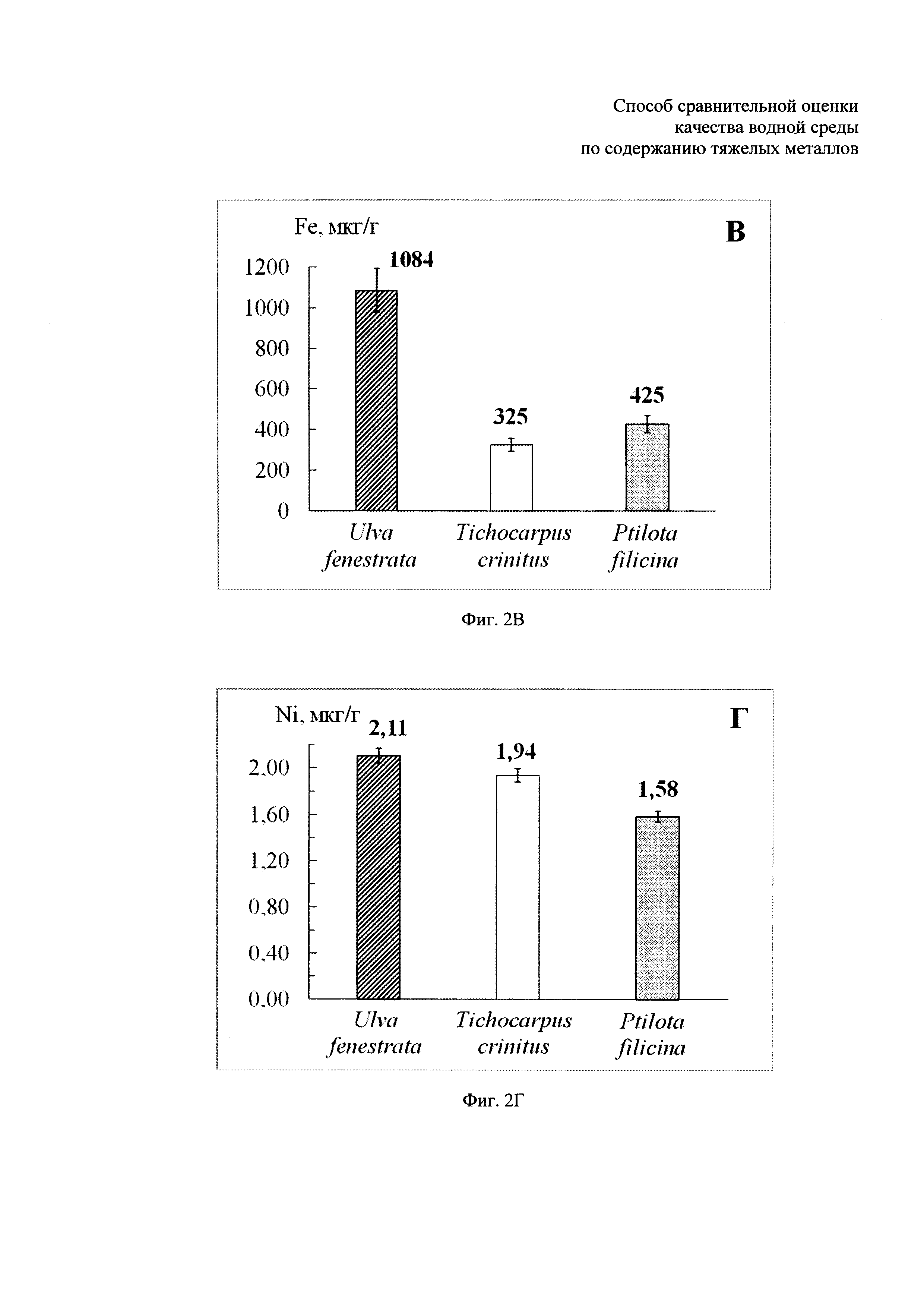
- содержание тяжелых металлов в талломах макроводорослей Ulva fenestrata, Tichocarpus crinitus и Ptilota filicina, собранных на акватории бухты Кирпичного завода в Амурском заливе в июле 2012 г. представлено на фиг. 2А, Б, В, Г, Д, Е: где фиг. 2А - содержание свинца, фиг. 2Б - содержание меди, фиг. 2В - содержание железа, фиг. 2Г - содержание никеля, фиг. 2Д - содержание цинка, фиг. 2Е - содержание кадмия.
Способ осуществляют следующим образом.
В июле 2012 года для определения предполагаемого загрязнения тяжелыми металлами прибрежной акватории г. Владивостока в Амурском заливе в бухте Кирпичного завода (район Нефтебазы), а также в условно-фоновом районе - в прибрежной со стороны острова Попова акватории пролива Старка, в один день были отобраны пробы доминирующих в исследуемых районах макроводорослей: Tichocarpus crinitus, Chondrus pinnulatus, Ptilota filicina и Ulva fenestrata.
Пример 1. Отобранные в бухте Кирпичного завода (район Нефтебазы) пробы макрофитов-базифитов Tichocarpus crinitus, Chondrus pinnulatus и Ulva fenestrata (всего 7 растений) переносили в кювету, в которой с поверхности талломов макроводорослей смывали микроводоросли эпифитона, тщательно потирая и ополаскивая отобранные образцы. Затем полученный смыв пропускали через капроновый фильтр с диаметром пор 80 мкм. Отфильтрованную пробу отстаивали, надосадочную жидкость убирали, после чего влажный осадок, представляющий из себя сконцентрированную пробу эпифитных микроводорослей, количественно переносили в фарфоровую чашку и высушивали при температуре 85°(С), а затем гомогенизировали, растирая в яшмовой ступке. Навески (0,2-0,5 г) каждой гомогенизированной пробы (три повторности) минерализовали в концентрированной азотной кислоте (о.с.ч.) в микроволновой печи. Раствор азотной кислоты с растворенными в нем минеральными веществами количественно переносили в стеклянные стаканчики и выпаривали на плите до осадка, представляющего из себя влажные соли. Полученный осадок влажных солей растворяли в 10 мл 2% азотной кислоты. Концентрацию тяжелых металлов проводили атомно-абсорбционным методом, как описано выше. Среднее содержание металлов представлено в таблице.
Пример 1а (по прототипу). Образцы макрофитов-базифитов Tichocarpus crinitus, Chondrus pinnulatus и Ulva fenestrata, отобранные в бухте Кирпичного завода (район Нефтебазы), после смыва с них микроводорослей эпифитона, легко отжимали и высушивали, раскладывая на поверхности полиэтиленовой пленки. После высушивания определяли содержание металлов в каждом виде макроводоросли, причем одна проба представляла смесь из водорослей Tichocarpus crinitus и Chondrus pinnulatus, а другая - водоросль Ulva fenestrata. Среднее содержание тяжелых металлов в талломах макрофитов-базифитов представлено в таблице.
Пример 2. Осуществляли аналогично примеру 1, только в качестве проб макрофитов-базифитов использовали отобранные в бухте Кирпичного завода (район Нефтебазы) талломы макроводоросли Ptilota filicina в количестве 7 штук. Фильтрацию смыва проводили на капроновом фильтре с диаметром пор 80 мкм. Среднее содержание тяжелых металлов в микроводорослях эпифитона представлено в таблице.
Пример 2а (по прототипу). Осуществляли аналогично примеру 1а, только в качестве проб брали отмытые талломы макроводоросли Ptilota filicina. Среднее содержание тяжелых металлов представлено в таблице.
Пример 3. Пробы макрофитов-базифитов Tichocarpus crinitus и Chondrus pinnulatus (всего 7 растений), отобранные в условно-фоновом районе - в прибрежной со стороны острова Попова акватории пролива Старка, переносили в кювету, в которой с поверхности талломов макроводорослей смывали микроводоросли эпифитона, тщательно потирая и ополаскивая отобранные образцы. Затем полученный смыв пропускали через капроновый фильтр с диаметром пор 80 мкм. Отфильтрованную пробу отстаивали, надосадочную жидкость убирали, после чего влажный осадок, представляющий из себя сконцентрированную пробу эпифитных микроводорослей, количественно переносили в фарфоровую чашку и высушивали при температуре 85°(С), а затем гомогенизировали, растирая в яшмовой ступке. Навески (0,2-0,5 г) каждой гомогенизированной пробы (три повторности) минерализовали в концентрированной азотной кислоте (о.с.ч.) в микроволновой печи. Раствор азотной кислоты с растворенными в нем минеральными веществами количественно переносили в стеклянные стаканчики и выпаривали на плите до осадка, представляющего из себя влажные соли. Полученный осадок влажных солей растворяли в 10 мл 2% азотной кислоты. Концентрацию тяжелых металлов проводили атомно-абсорбционным методом, как описано выше. Среднее содержание металлов в микроводорослях эпифитона представлено в таблице.
Пример 3а (по прототипу). Образцы макрофитов-базифитов Tichocarpus crinitus и Chondrus pinnulatus, отобранные в условно-фоновом районе - в прибрежной со стороны острова Попова акватории пролива Старка, после смыва с них микроводорослей эпифитона легко отжимали и высушивали, раскладывая на поверхности полиэтиленовой пленки. После высушивания в них определяли содержание металлов описанным выше способом. Среднее содержание металлов в талломах макрофитов-базифитов представлено в таблице.
В июле 2013 года с целью дальнейшего исследования возможности использования микроводорослей эпифитона в качестве биоиндикаторов загрязнения водной среды тяжелыми металлами вновь были в один день отобраны пробы в двух исследованных в предыдущий год прибрежных акваториях - в Амурском заливе в бухте Кирпичного завода (район Нефтебазы) и в условно-фоновом районе - в проливе Старка.
Пример 4. Способ осуществляли аналогично Примеру 1. В качестве пробы были взяты микроводоросли эпифитона, смытые с макроводоросли Tichocarpus crinitus (7 штук), талломы которой были отобраны в бухте Кирпичного завода (район Нефтебазы).
Среднее содержание металлов в микроводорослях эпифитона представлено в таблице.
Пример 4а (по прототипу). Способ осуществляли аналогично Примеру 1а. После высушивания талломов Tichocarpus crinitus, с которых были смыты микроводоросли эпифитона, в них определяли содержание металлов. Результаты представлены в таблице.
Пример 5. Способ осуществляли аналогично Примеру 4, только микроводоросли эпифитона была смыты с талломов макроводоросли Tichocarpus crinitus (7 штук), отобранных в условно-фоновом районе - в прибрежной со стороны острова Попова акватории пролива Старка.
Среднее содержание металлов в микроводорослях эпифитона представлено в таблице.
Пример 5а (по прототипу). Способ осуществляли аналогично Примеру 4а. После высушивания талломов Tichocarpus crinitus, с которых были смыты микроводоросли эпифитона, в них определяли содержание металлов. Талломы макрофита-базифита Tichocarpus crinitus (7 штук), были отобраны в условно-фоновом районе - в прибрежной со стороны острова Попова акватории пролива Старка. Результаты представлены в таблице.
Как видно из полученных данных, представленных в таблице, содержание тяжелых металлов в микроводорослях эпифитона значительно превышает содержание металлов в любых макроводорослях. В частности, при сравнении концентраций тяжелых металлов, полученных по примерам: Пример 1 и Пример 1а, Пример 2 и Пример 2а оказалось, что:
1) содержание Fe в микроводорослях эпифитона выше, чем в макрофитах-базифитах Tichocarpus crinitus и Chondrus pinnulatus в 96 раз, содержание Pb - в 33 раза, содержание Zn - в 2 раза, содержание Cu - в 7 раз, содержание Ni - в 6,5 раз, содержание Cd - в 4 раза (Примеры 1 и 1а, фиг. 1);
2) содержание Fe в микроводорослях эпифитона выше, чем в макрофите-базифите Ulva fenestrata в 60 раз, содержание Pb - в 64 раза, содержание Zn - в 25,5 раз, содержание Cu, Ni и Cd - в 6 раз (Примеры 1 и 1а, фиг. 1);
3) содержание Fe в микроводорослях эпифитона выше, чем в макрофите-базифите Ptilota filicina в 16 раз, содержание Pb - в 11 раз, содержание Zn - в 3 раза, содержание Cu - в 5 раз, содержание Ni и Cd - в 6 раз (Примеры 2 и 2а, фиг. 1).
Таким образом, следует сделать вывод, что заявленный способ обладает высокой чувствительностью по сравнению со способом прототипом.
Установлено также, что усредненные пробы микроводорослей эпифитона, вне зависимости, собраны ли они с нескольких разных макрофитов-базифитов или только с одного вида макрофита-базифита, показывают близкие по значению концентрации накопленных тяжелых металлов (Пример 1 и Пример 2), тогда как разные водоросли-макрофиты способны накапливать различные тяжелые металлы. В частности, среди исследованных водорослей-макрофитов в 2012 году (Примеры 1а, 2а) максимальные концентрации тяжелых металлов Pb и Cu обнаружены в талломах водоросли Ptilota filicina (Пример 2а, фиг. 2А, 2Б), максимальные концентрации Fe и Ni - в талломах Ulva fenestrata (Пример 1a, фиг. 2В, 2Г), а максимальные концентрации металлов Zn и Cd - в талломах Tichocarpus crinitus и Chondrus pinnulatus (Пример 1a, фиг. 2В, 2Г). Отсюда следует сделать вывод, что использование в качестве биоиндикаторов на содержание тяжелых металлов водорослей-макрофитов менее эффективно, чем использование микроводорослей эпифитона, так как для комплексной оценки накопления тяжелых металлов необходимо проводить анализ разных видов макроводорослей, причем некоторые из них в какой-то сезон могут отсутствовать в районе исследования. Использование микроводорослей эпифитона не предполагает анализа отдельных видов и не зависит от видовой сезонной изменчивости.
Из представленных результатов также видно, что микроводоросли эпифитона всегда содержат больше тяжелых металлов в случае их обитания на акватории, подверженной антропогенному влиянию по сравнению с микроводорослями эпифитона, обитавшими на акватории условно-фонового района. В частности, при сравнении концентраций тяжелых металлов, полученных по Примерам 4 и 5 видно, что в микроводорослях эпифитона из бухты Кирпичного завода (район Нефтебазы), на прибрежную акваторию которой оказывается значительное антропогенное воздействие, по сравнению с микроводорослями эпифитона из условно-фонового района (пролив Старка) содержание Fe и Pb выше в 3 раза, Zn - в 1,3 раза, Cu, Ni, Cd - в 2 раза. Тогда как по Примерам 4а и 5а в талломах макрофита-базифита Tichocarpus crinitus из бухты Кирпичного завода (район Нефтебазы) и из условно-фонового района (пролив Старка) концентрации тяжелых металлов Cd и Cu практически одинаковы, а в случае Fe и Pb - даже ниже (в 1,7 и в 1,3 раза соответственно). Следовательно, анализ концентраций тяжелых металлов в микроводорослях эпифитона выявил явное загрязнение акватории бухты Кирпичного завода в Амурском заливе железом, свинцом, медью, никелем кадмием и цинком, тогда как анализ концентраций тяжелых металлов в макроводорослях выявил загрязнение только цинком и никелем.
Следовательно, можно утверждать, что заявленный способ обладает большей чувствительностью и точностью по сравнению со способом прототипом и позволяет оперативно и качественно определить загрязнение водной акватории тяжелыми металлами.