Результат интеллектуальной деятельности: МОНОКЛОНАЛЬНОЕ АНТИТЕЛО ПРОТИВ ИНТЕРЛЕЙКИНА-31
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области рекомбинантных моноклональных антител и их применениям в клинических и научных методиках, в том числе диагностических методиках. Согласно настоящему изобретению также предложены выделенные антитела против IL-31 (интерлейкина-31) в форме ветеринарных композиций, полезных для лечения сопровождающегося зудом состояния или аллергического состояния у собак или кошек.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Атопический дерматит определен специальной комиссией Американской коллегии по ветеринарной дерматологии как "воспалительное и зудящее аллергическое кожное заболевание с генетической предрасположенностью с характерными клиническими признаками" (Olivry et al., Veterinary Immunology and Immunopathology, 2001, 81:143-146). Специальная комиссия также признала, что данное заболевание у представителей семейства псовых ассоциировано с аллерген-специфическим IgE (Olivry и др. 2001, выше; Marsella & Olivry, Clinics in Dermatology, 2003, 21:122-133). Сильный прурит наряду с вторичной алопецией и эритемой являются наиболее заметными и тревожащими симптомами для владельцев домашних животных.
Распространенность атопического дерматита точно не известна вследствие недостаточных и противоречивых эпидемиологических данных, но по оценкам составляет 10% от общей популяции представителей семейства псовых (Marsella & Olivry, 2003, выше; Scott et al., Canadian Veterinary Journal, 2002, 43:601-603; Hillier Veterinary Immunology and Immunopathology, 2001, 81:147-151). В целом, примерно 4,5 миллиона собак подвержены воздействию этого хронического и продолжающегося в течение всей жизни состояния. По всей видимости, уровень заболеваемости увеличивается. Полагали, что есть предрасположенность в отношении породы и пола, однако в зависимости от географического региона могут быть сильные различия (Hillier, 2001, выше; Picco et al., Vet. Dermatol., 2008, 19:150-155).
Возможные факторы, вовлеченные в аллергический дерматит, многочисленны и плохо изучены. Атонический дерматит могут инициировать присутствующие в пище компоненты (Picco, 2008, выше), а также аллергены из окружающей среды, такие как блохи, пылевые клещи, амброзия, растительные экстракты и т.д. Важную роль также играют генетические факторы. И хотя никаких подтверждений предрасположенности в отношении породы нет, полагают, что имеется некоторое влияние наследственности в повышении предрасположенности к атопическому дерматиту (Sousa & Marsella, Veterinary Immunology and Immunopathology, 2001, 81:153-157; Schwartzman et al., Clin. Exp. Immunol. 1971, 9:549-569).
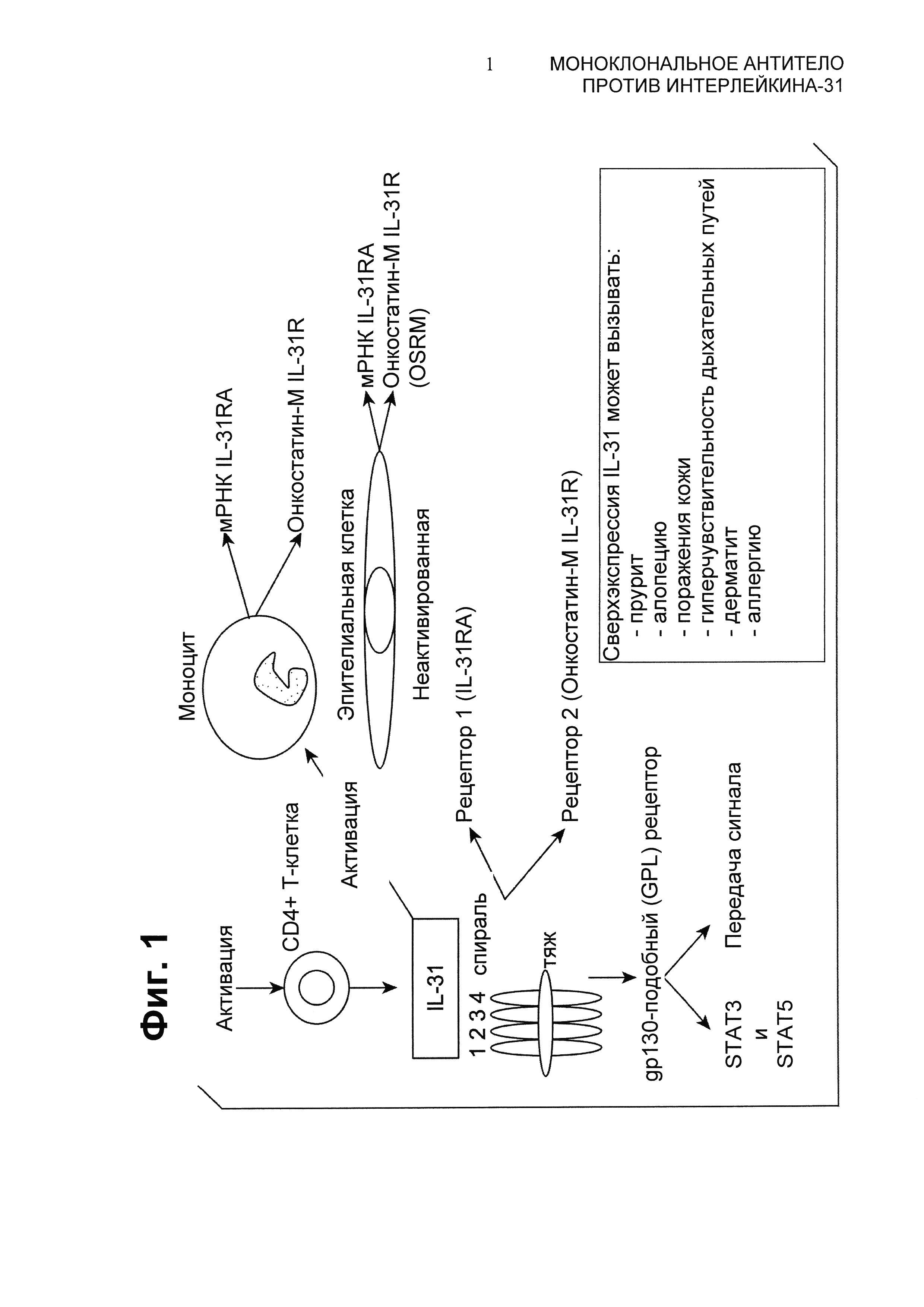
Интерлейкин-31 (IL-31) представляет собой цитокин, клонирование которого было осуществлено в 2004 году. Он продуцируется главным образом активированными Т-хелперными (Th)2-клетками (Dillon et al., Nat. Immunol., 2004, 5:752-60), однако также продуцируется в тучных клетках и макрофагах. IL-31 связывается с корецептором, состоящим из рецептора А IL-31 (IL-31RA) и рецептора онкостатина М (OSMR) (Dillon и др., 2004, выше, и Bilsborough et al., J. Allergy Clin. Immunol., 2006, 117(2):418-25). Активация рецептора вызывает фосфорилирование STAT (трансдуктор сигнала и активатора транскрипции) с участием рецептора(ов) JAK (янус-киназы). Экспрессия корецептора продемонстрирована в макрофагах, кератиноцитах и в дорсальных корешковых ганглиях. Не так давно обнаружено, что IL-31 вовлечен в дерматит, зудящие поражения кожи, аллергию и гиперчувствительность дыхательных путей. См. Фиг.1.
Стимуляция Т-клеток антителами против CD3 и против CD28 незамедлительно повышает экспрессию мРНК IL-31 (Dillon et al., 2004, выше). Посредством анализа с применением микрочипов показано, что IL-31 индуцирует некоторые гены хемотаксических агентов, таких как CXCL1 (СХС-хемокиновый лиганд 1), CCL17 (СС-хемокиновый лиганд 17) (тимусный регулируемый активацией хемокин (TARC)), CCL19 (макрофагальный воспалительный белок (MIP) 3β), CCL22 (моноцитарный хемокин (MDC)), CCL23 (MIP3) и CCL4 (MIPβ) (Dillon и др., 2004, выше).
Трансгенные мыши, которые сверхэкспрессируют IL-31, демонстрируют кожное воспаление, зуд, тяжелый дерматит и алопецию (Dillon и др., 2004, выше). Подкожная инъекция IL-31 мышам инициирует инфильтрацию под действием воспалительных клеток, нейтрофилов, эозинофилов, лимфоцитов и макрофагов и приводит к эпидермальному утолщению и акантозу кожи. У мышей NC/Nga с атопическим дерматитом (AD) вследствие естественных причин IL-31 сверхэкспрессируетя в местах поражения кожи, и его уровень коррелирует с пруритом (Takaoka et al., Eur. J. Pharmacol., 2005, 516, 180-181; Takaoka et al., Exp. Dermatol., 2006, 15, 161-167). Кроме того, на мышиных моделях показано, что IL-31 индуцирует быстронаступающий прурит (Raap et al., J. Allergy Clin. Immunol., 2008, 122(2):421-3).
В других исследованиях показано, что IL-31 ассоциирован с индуцируемым атопическим дерматитом кожным воспалением и пруритом у людей. У пациентов-людей с AD в значительно большей степени наблюдается экспрессия мРНК IL-31 в местах поражения кожи, чем в непораженных участках кожи, а экспрессия в непораженных участках кожи превышает таковую в нормальной коже здоровых пациентов (Sonkoly et al., J. Allergy Clin. Immunol., 2006, 117:411-7). В другом исследовании сообщалось, что CD45RO+ Т-клетки (клетки памяти), позитивные в отношении кожного лимфоцитарного антигена (CLA), экспрессируют мРНК и белок IL-31 в коже пациентов с AD (Bilsborough и др., 2006, выше). Также сообщалось, что сверхэкспрессия мРНК IL-31 в коже пациентов или аллергический контактный дерматит коррелируют с экспрессией мРНК IL-4 и IL-13, а не с экспрессией мРНК интерферона(IFN)-γ (Neis et al., J. Allergy Clin. Immunol., 2006, 118, 930-937). Помимо этого, показано, что уровни IL-31 в сыворотке крови пациентов-людей с хронической спонтанной крапивницей повышены и еще больше повышены у пациентов с AD (Raap et al., Exp. Dermatol., 2010, 19(5):464-6). Кроме того, у людей наблюдали корреляцию тяжести AD с уровнями IL-31 в сыворотке крови (Rapp и др., 2008, выше). Также показано, что секреция IL-31 усиливалась в тучных клетках после перекрестного связывания IgE и в ответ на стафилококковый суперантиген у индивидов с атопией. Помимо этого, показано, что IL-31 стимулирует продуцирование некоторых провоспалительных медиаторов, включая IL-6, IL-8, CXCL1, СС17 и многочисленные металлопротеиназы, в миофибробластах толстой кишки человека (Yagi et al., International Journal of Molecular Medicine, 2007, 19(6):941-946).
Считается, что гиперчувствительность I типа к аллергенам из окружающей среды представляет собой главный механизм AD у представителей семейства псовых, и уровни Th2-опосредованных цитокинов, таких как IL-4, в местах поражения кожи собак с AD повышены (Nuttall et al., Vet. Immunol. Immunopathol., 2002, 87, 379-384). Кроме того, инфильтрация под действием воспалительных клеток, лимфоцитов и нейтрофилов представляет собой важный механизм, лежащий в основе обострения кожных поражений; сверхэкспрессия генов хемотаксических агентов, таких как CCL17/TARC, CCR4 и CCL28/ассоциированный со слизистой оболочкой эпителиальный хемокин (МЕС), вносит вклад в обострение поражений кожи у собак с AD (см. Maeda et al., Vet. Immunol. Immunopathol., 2005, 103, 83-92; Maeda et al., Vet. Immunol. Immunopathol., 2002b, 90, 145-154; и Maeda et al., J. Vet. Med. Sci., 2008, 70, 51-55).
Последние данные указывают на то, что IL-31 может быть вовлечен в стимуляцию аллергического воспаления и ответную реакцию эпителия дыхательных путей, характерную для аллергической астмы (Chattopadhyay et al., J. Biol. Chem., 2007, 282: 3014-26; и Wai et al., Immunology, 2007, 122, 532-541).
Эти наблюдения подтверждают гипотезу о том, что IL-31 играет существенную роль как в сопровождающихся зудом, так и в аллергических состояниях. Было бы желательно иметь терапевтическое антитело против IL-31, полезное для лечения сопровождающегося зудом состояния и/или аллергического состояния у собак или кошек.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном из воплощений согласно настоящему изобретению предложено выделенное антитело, которое специфически связывается по меньшей мере с одним из собачьего IL-31 или кошачьего IL-31. В некоторых воплощениях антитело представляет собой моноклональное антитело. В одном из воплощений моноклональное антитело является химерным. В другом воплощении антитело является канинизированным или фелинизированным.
В некоторых воплощениях антитело снижает, ингибирует или нейтрализует активность IL-31 у собаки или кошки. В предпочтительных воплощениях антитело ослабляет, подавляет или нейтрализует сопровождающееся зудом состояние или аллергическое состояние. Сопровождающиеся зудом состояния включают, например, атопический дерматит, экзему, псориаз, склеродермию и прурит. Аллергические состояния включают, например, аллергический дерматит, летнюю экзему, крапивницу, запал, воспалительное заболевание дыхательных путей, рецидивирующую обструкцию дыхательных путей, гиперреактивность дыхательных путей, хроническую обструктивную болезнь легких и воспалительные процессы, возникающие в результате аутоиммунной реакции, такие как синдром раздраженного кишечника (IBS). В одном из воплощений согласно настоящему изобретению предложено выделенное антитело или его антигенсвязывающий участок, содержащие по меньшей мере одно из следующего:
определяющую комплементарность область (CDR) 1 вариабельного домена тяжелой (VH) цепи, имеющую аминокислотную последовательность YYDIN (SEQ ID NO:1; 11E12-VH-CDR1), SYDMS (SEQ ID NO:2; 19D07-VH-CDR1) или NYGMS (SEQ ID NO:3; 34D03-VH-CDR1);
CDR2 вариабельного домена тяжелой цепи, имеющую аминокислотную последовательность WIFPGDGGTKYNETFKG (SEQ ID NO:4; 11E12-VH-CDR2), TITSGGGYTYSADSVKG (SEQ ID NO:5; 19D07-VH-CDR2) или TISYGGSYTYYPDNIKG (SEQ ID NO:6; 34D03-VH-CDR2);
CDR3 вариабельного домена тяжелой цепи, имеющую аминокислотную последовательность ARGGTSVIRDAMDY (SEQ ID NO:7; 11E12-VH-CDR3), ARQNWWGLAY (SEQ ID NO:8; 19D07-VH-CDR3) или VRGYGYDTMDY (SEQ ID NO:9; 34D03-VH-CDR3); и
их вариант, имеющий одну или более чем одну консервативную аминокислотную замену по меньшей мере в одной из CDR1, CDR2 или CDR3.
В другом воплощении согласно изобретению предложено выделенное антитело или его антигенсвязывающий участок, содержащие по меньшей мере одно из следующей группы:
вариабельный домен легкой (VL) цепи, содержащий определяющую комплементарность область (CDR) 1, имеющую аминокислотную последовательность RASESVDNYGISFMH (SEQ ID NO:10; 11E12-VL-CDR1), KSSQSLLNSGNQKNYLA (SEQ ID NO:11; 19D07-VL-CDR1) или KASQSVSFAGTGLMH (SEQ ID NO:12; 34D03-VL-CDR1);
CDR2 вариабельного домена легкой цепи, имеющую аминокислотную последовательность RASNLES (SEQ ID NO:13; 11E12-VL-CDR2), GASTRES (SEQ ID NO:14; 19D07-VL-CDR2) или RASNLEA (SEQ ID NO:15; 34D03-VL-CDR2);
CDR3 вариабельного домена легкой цепи, имеющую аминокислотную последовательность QQSNKDPLT (SEQ ID NO:16; 11E12-VL-CDR3), QNDYSYPYT (SEQ ID NO:17;19D07-VL-CDR3) или QQSREYPWT (SEQ ID NO:18; 34D03-VL-CDR3); и
их вариант, имеющий одну или более чем одну консервативную аминокислотную замену по меньшей мере в одной из CDR1, CDR2 или CDR3.
В других воплощениях антитело, имеющее по меньшей мере одну из CDR вариабельного домена легкой цепи, описанных выше, может дополнительно содержать по меньшей мере одну из следующих CDR вариабельного домена тяжелой цепи:
определяющую комплементарность область (CDR) 1 вариабельного домена тяжелой цепи, имеющую аминокислотную последовательность YYDIN (SEQ ID NO:1; 11E12-VH-CDR1), SYDMS (SEQ ID NO:2; 19D07-VH-CDR1) или NYGMS (SEQ ID NO:3; 34D03-VH-CDR1);
CDR2 вариабельного домена тяжелой цепи, имеющую аминокислотную последовательность WIFPGDGGTKYNETFKG (SEQ ID NO:4; 11E12-VH-CDR2), TITSGGGYTYSADSVKG (SEQ ID NO:5; 19D07-VH-CDR2) или TISYGGSYTYYPDNIKG (SEQ ID NO:6; 34D03-VH-CDR2);
CDR3 вариабельного домена тяжелой цепи, имеющую аминокислотную последовательность ARGGTSVIRDAMDY (SEQ ID NO:7; 11E12-VH-CDR3), ARQNWWGLAY (SEQ ID NO:8; 19D07-VH-CDR3) или VRGYGYDTMDY (SEQ ID NO:9; 34D03-VH-CDR3); и
их вариант, имеющий одну или более чем одну консервативную аминокислотную замену по меньшей мере в одной из CDR1, CDR2 или CDR3.
В некоторых воплощениях антитело может содержать по меньшей мере одно из следующего:
а) вариабельный домен легкой цепи, содержащий


б) вариабельный домен тяжелой цепи, содержащий


в) их варианты, имеющие одну или более чем одну консервативную аминокислотную замену.
В одном из воплощений согласно настоящему изобретению предложено моноклональное антитело, которое специфически связывается с областью примерно между аминокислотными остатками 95 и 125 аминокислотной последовательности собачьего IL-31 SEQ ID NO:32 или с соответствующей областью кошачьего IL-31. В некоторых воплощениях антитело специфически связывается с областью примерно между аминокислотными остатками 102 и 122 аминокислотной последовательности собачьего IL-31 (SEQ ID NO:32) или с соответствующей областью кошачьего IL-31.
Согласно настоящему изобретению также предложена ветеринарная композиция, содержащая терапевтически эффективное количество по меньшей мере одного антитела, описанного выше.
В других воплощениях согласно изобретению предложена клетка-хозяин, которая продуцирует антитело, описанное выше.
В других воплощениях согласно изобретению предложена выделенная нуклеиновая кислота, содержащая последовательность нуклеиновой кислоты, кодирующую по меньшей мере одно из следующего:
определяющую комплементарность область (CDR) 1 вариабельного домена тяжелой (VH) цепи, имеющую аминокислотную последовательность YYDIN (SEQ ID NO:1; 11E12-VH-CDR1), SYDMS (SEQ ID NO:2; 19D07-VH-CDR1) или NYGMS (SEQ ID NO:3; 34D03-VH-CDR1);
CDR2 вариабельного домена тяжелой цепи, имеющую аминокислотную последовательность WIFPGDGGTKYNETFKG (SEQ ID NO:4; 11E12-VH-CDR2), TITSGGGYTYSADSVKG (SEQ ID NO:5; 19D07-VH-CDR2) или TISYGGSYTYYPDNIKG (SEQ ID NO:6; 34D03-VH-CDR2);
CDR3 вариабельного домена тяжелой цепи, имеющую аминокислотную последовательность ARGGTSVIRDAMDY (SEQ ID NO:7; 11E12-VH-CDR3), ARQNWWGLAY (SEQ ID NO:8; 19D07-VH-CDR3) или VRGYGYDTMDY (SEQ ID NO:9; 34D03-VH-CDR3); и
их вариант, имеющий одну или более чем одну консервативную аминокислотную замену по меньшей мере в одной из CDR1, CDR2 или CDR3.
В других воплощениях выделенная нуклеиновая кислота, описанная выше, может дополнительно содержать последовательность нуклеиновой кислоты, кодирующую по меньшей мере одно из следующего:
вариабельный домен легкой (VL) цепи, содержащий определяющую комплементарность область (CDR) 1, имеющую аминокислотную последовательность RASESVDNYGISFMH (SEQ ID NO:10; 11E12-VL-CDR1), KSSQSLLNSGNQKNYLA (SEQ ID NO:11; 19D07-VL-CDR1) или KASQSVSFAGTGLMH (SEQ ID NO:12; 34D03-VL-CDR1);
CDR2 вариабельного домена легкой цепи, имеющую аминокислотную последовательность RASNLES (SEQ ID NO:13; 11E12-VL-CDR2), GASTRES (SEQ ID NO:14; 19D07-VL-CDR2) или RASNLEA (SEQ ID NO:15; 34D03-VL-CDR2);
CDR3 вариабельного домена легкой цепи, имеющую аминокислотную последовательность QQSNKDPLT (SEQ ID NO:16; 11E12-VL-CDR3), QNDYSYPYT (SEQ ID NO:17; 19D07-VL-CDR3) или QQSREYPWT (SEQ ID NO:18; 34D03-VL-CDR3); и
их вариант, имеющий одну или более чем одну консервативную аминокислотную замену по меньшей мере в одной из CDR1, CDR2 или CDR3.
Согласно настоящему изобретению также предложен вектор, содержащий по меньшей мере одну из нуклеиновых кислот, описанных выше.
В других воплощениях согласно настоящему изобретению предложен способ продуцирования антитела, включающий культивирование клетки-хозяина, описанной выше, в условиях, которые приводят к продуцированию антитела, и выделение антитела из клетки-хозяина или культуральной среды клетки-хозяина.
Также предложен способ лечения состояния или расстройства, выбранного из сопровождающегося зудом состояния или аллергического состояния, включающий введение терапевтически эффективного количества антитела, описанного выше. В некоторых воплощениях сопровождающееся зудом состояние выбрано из атопического дерматита, экземы, псориаза, склеродермии и прурита. В других воплощениях подвергаемое лечению аллергическое состояние выбрано из аллергического дерматита, летней экземы, крапивницы, запала, воспалительного заболевания дыхательных путей, рецидивирующей обструкции дыхательных путей, гиперреактивности дыхательных путей, хронической обструктивной болезни легких и воспалительных процессов, возникающих в результате аутоиммунной реакции, таких как синдром раздраженного кишечника (IBS).
Кроме того, предложен способ ингибирования активности IL-31 у собаки или кошки, включающий введение антитела, описанного выше.
Также предложен способ обнаружения или количественного определения IL-31 в образце, включающий инкубирование клинического или биологического образца, содержащего IL-31, в присутствии антитела, описанного выше, и обнаружение антитела, которое связано с IL-31 в образце. В одном из воплощений антитело является меченым с возможностью обнаружения. В другом воплощении антитело является немеченым и используется в комбинации с вторичным антителом, которое является меченым.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг.1 представляет собой схематическое изображение IL-31-пути.
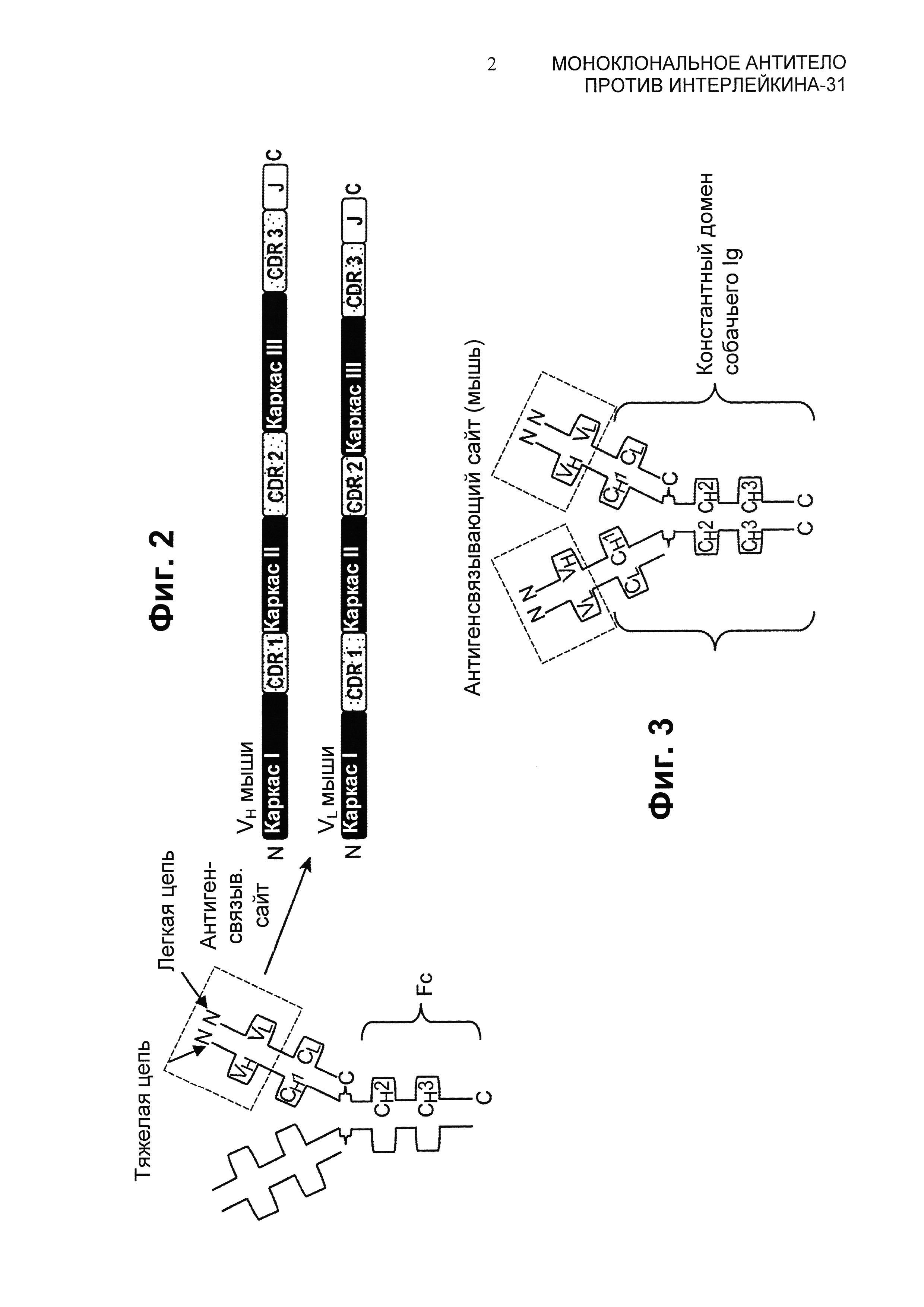
Фиг.2 представляет собой схематическое изображение общей структуры молекулы иммуноглобулина G (IgG) мыши с выделенным антигенсвязывающим сайтом.
Фиг.3 представляет собой схематическое изображение общей структуры химерного мышиного:собачьего IgG.
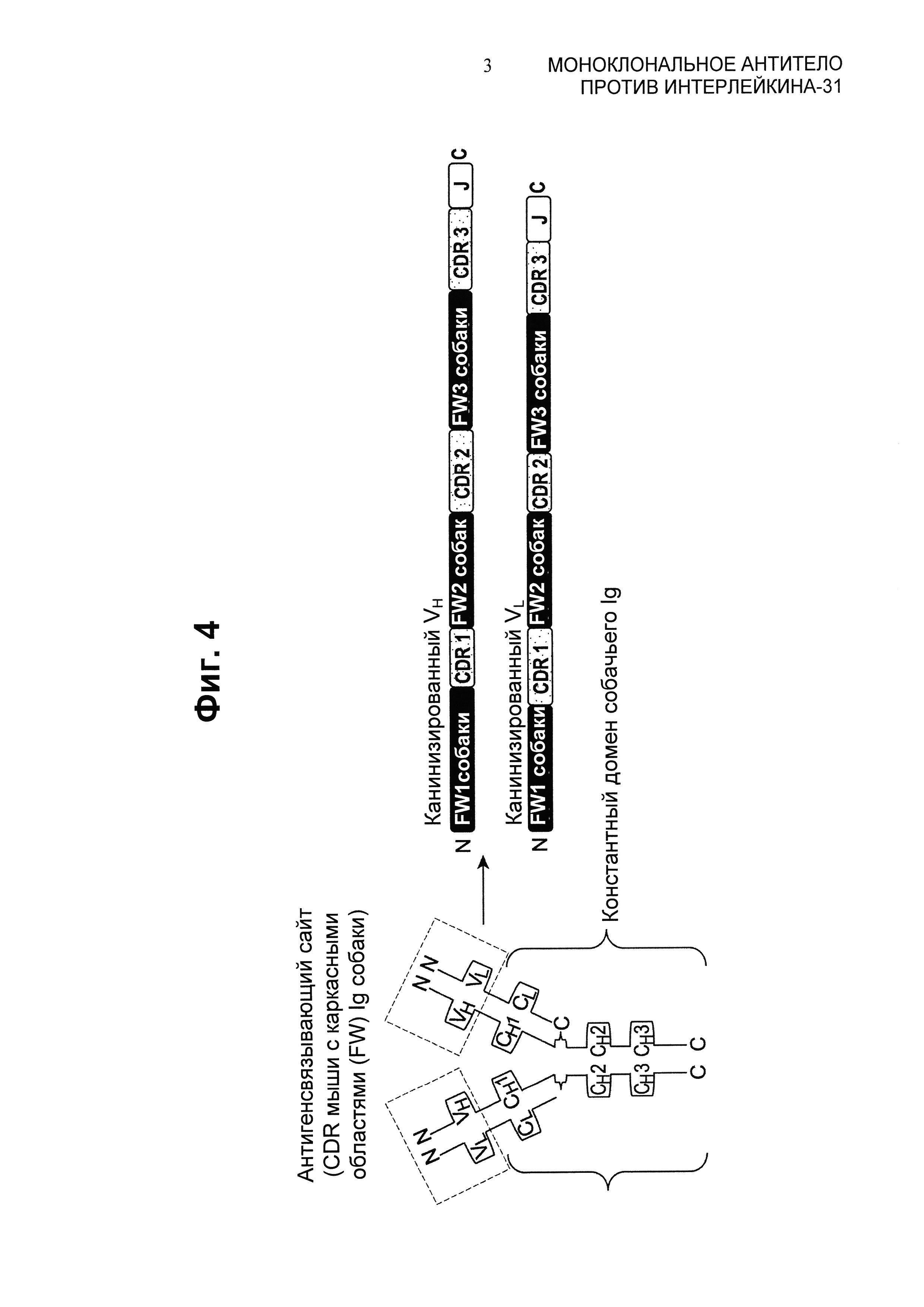
Фиг.4 представляет собой иллюстрацию, на которой показано видообразование или "канинизации" мышиного IgG; мышиные CDR прививают на каркасы собачьего Ig, идентифицированные из баз данных для последовательностей.
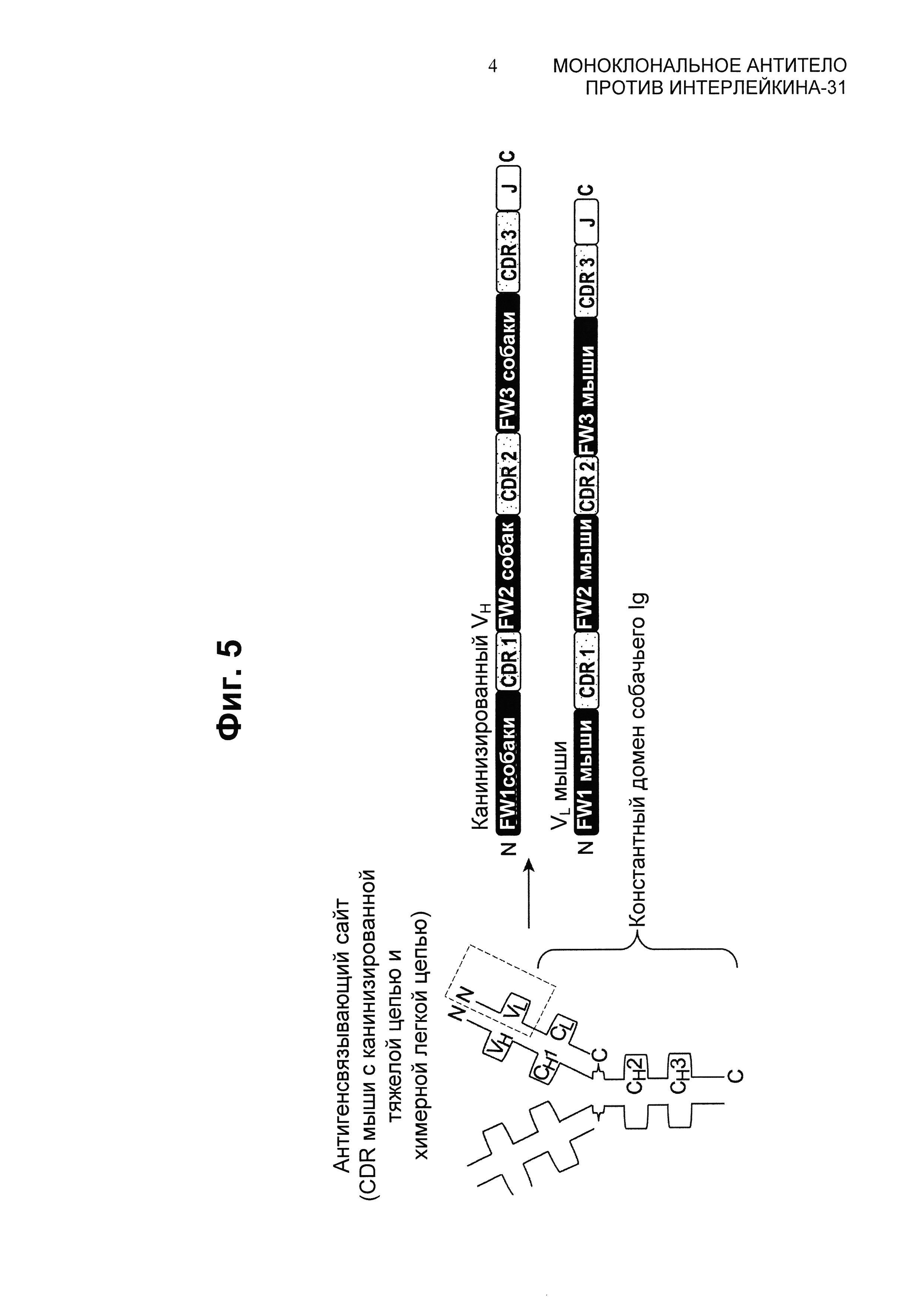
Фиг.5 представляет собой иллюстрацию "гетерохимерного" моноклонального антитела с химерной легкой цепью в паре с полностью канинизированной тяжелой цепью.
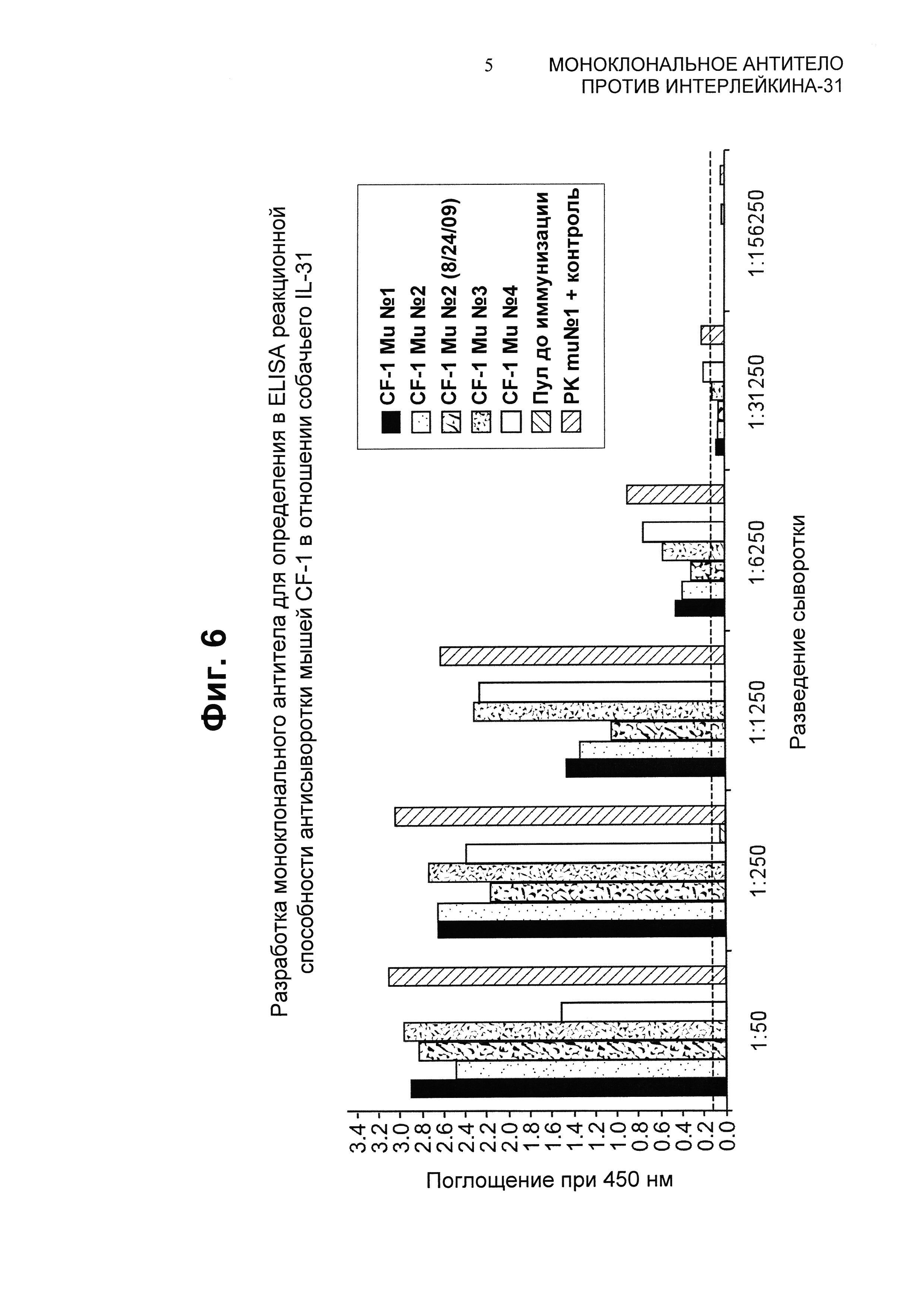
На Фиг.6 показаны ELISA-титры для IL-31-иммунизированных мышей (CF-1 MU №1-4) относительно мышей до иммунизации и мышей в качестве положительного контроля.
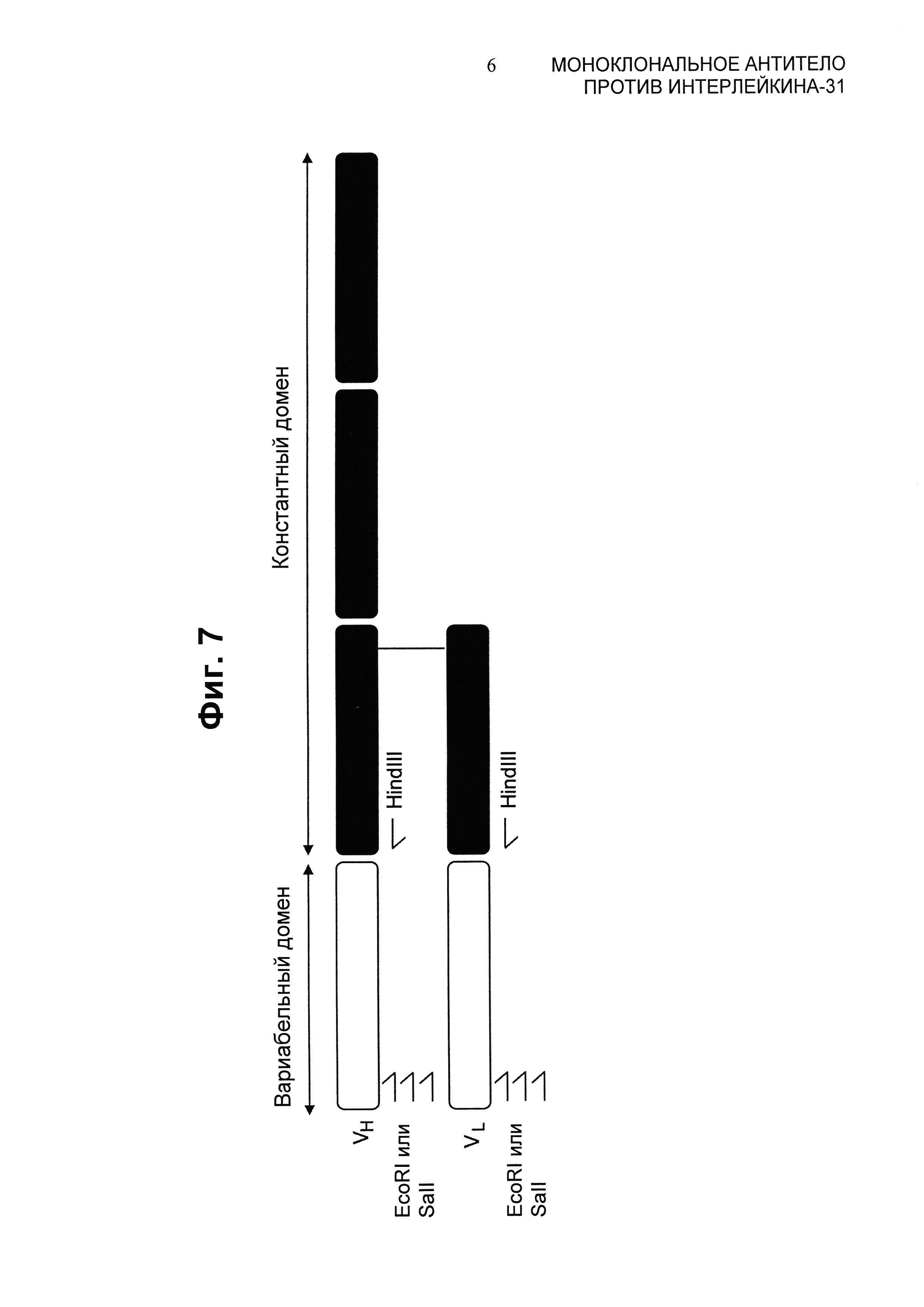
Фиг.7 представляет собой иллюстрацию вариабельных доменов цепей антитела, на которой показаны праймеры к константным областям и вырожденные праймеры в направлении вариабельных областей Ig мыши.
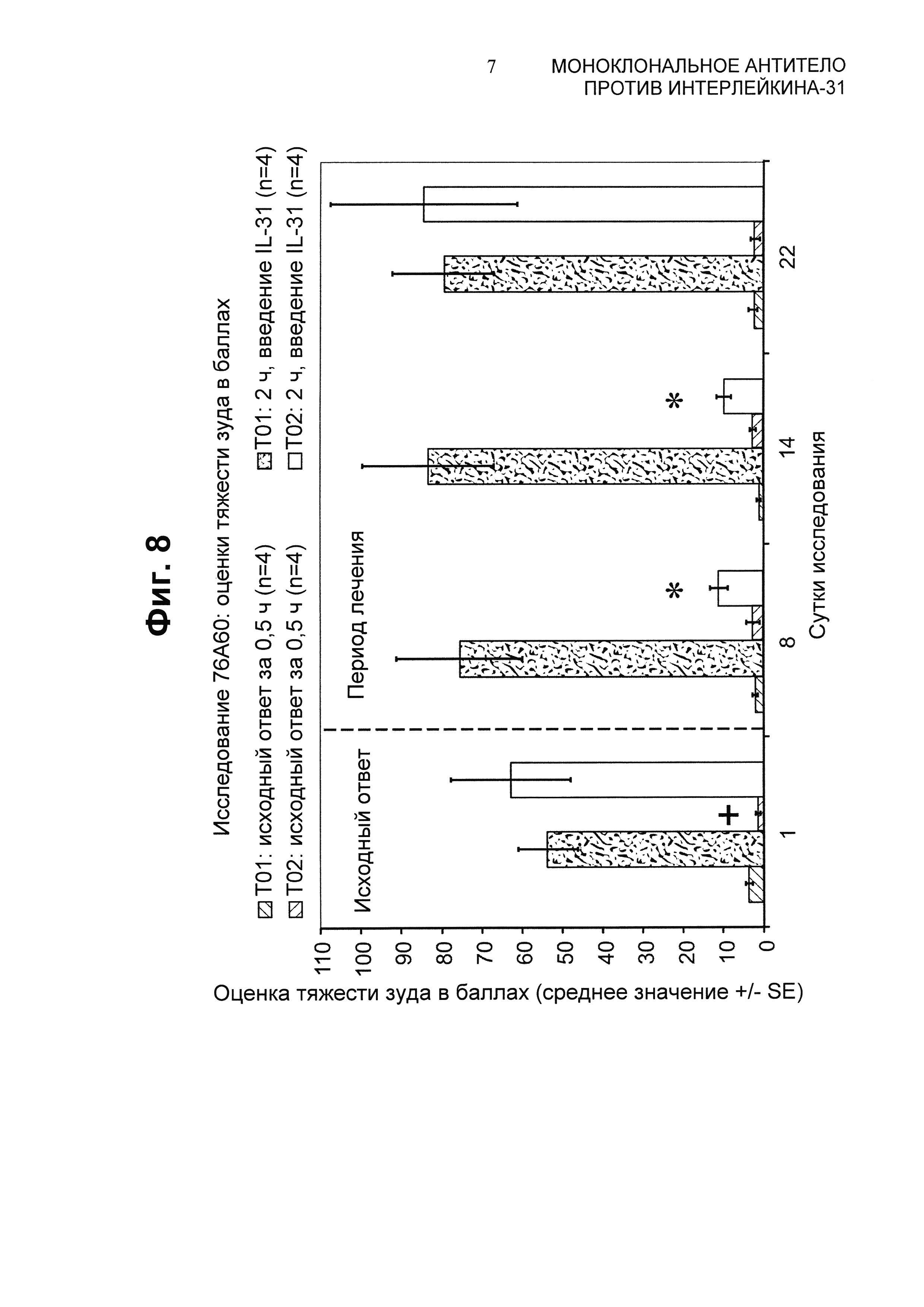
Фиг.8 представляет собой график эффективности химерного 11Е12 в пилотном плацебо-контролируемом исследовании с п/к (подкожным) введением разовой дозы (76А60).
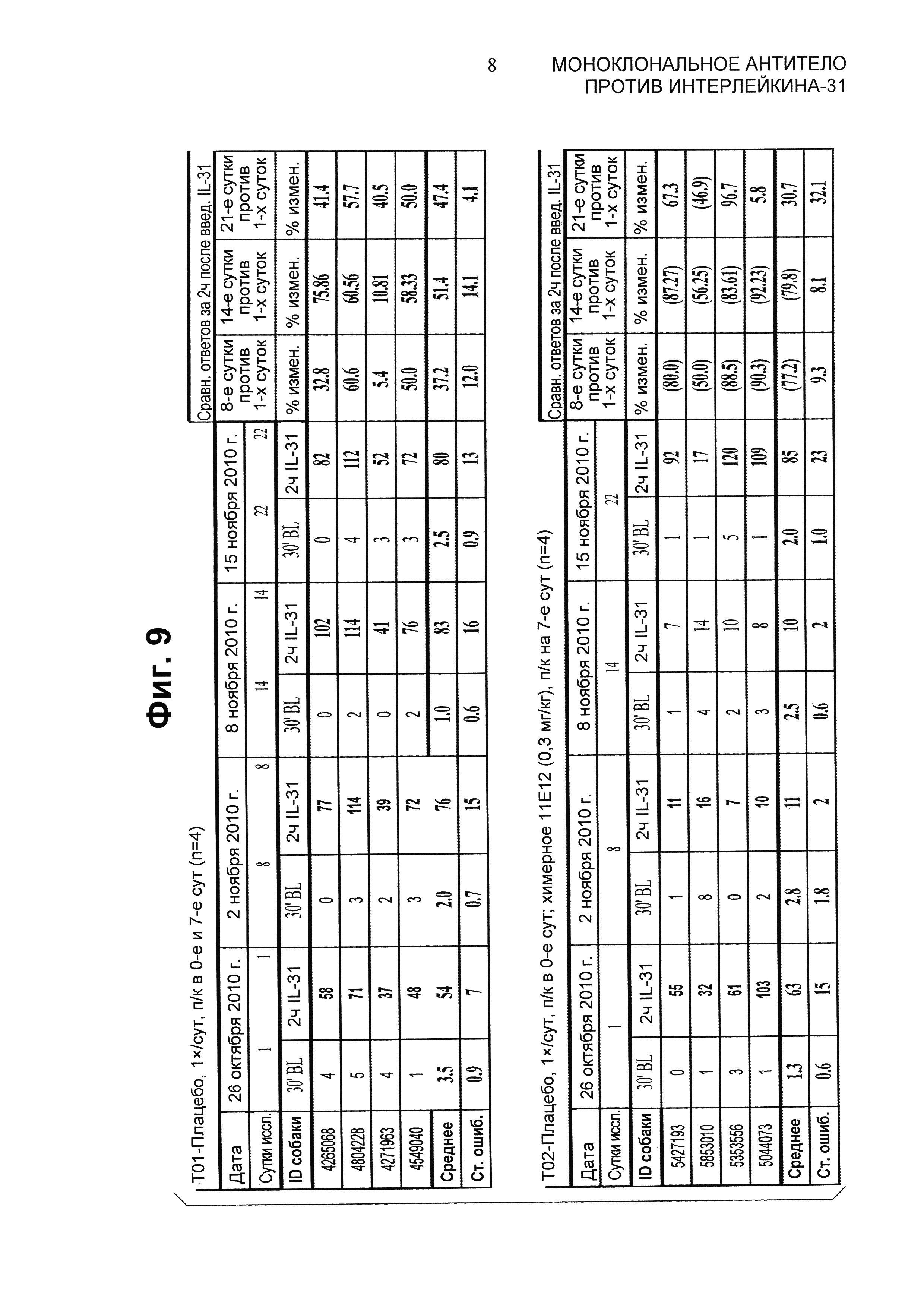
На Фиг.9 представлена таблица, показывающая индивидуальные оценки тяжести зуда в баллах у собак, зарегистрированных в исследовании 76А60.
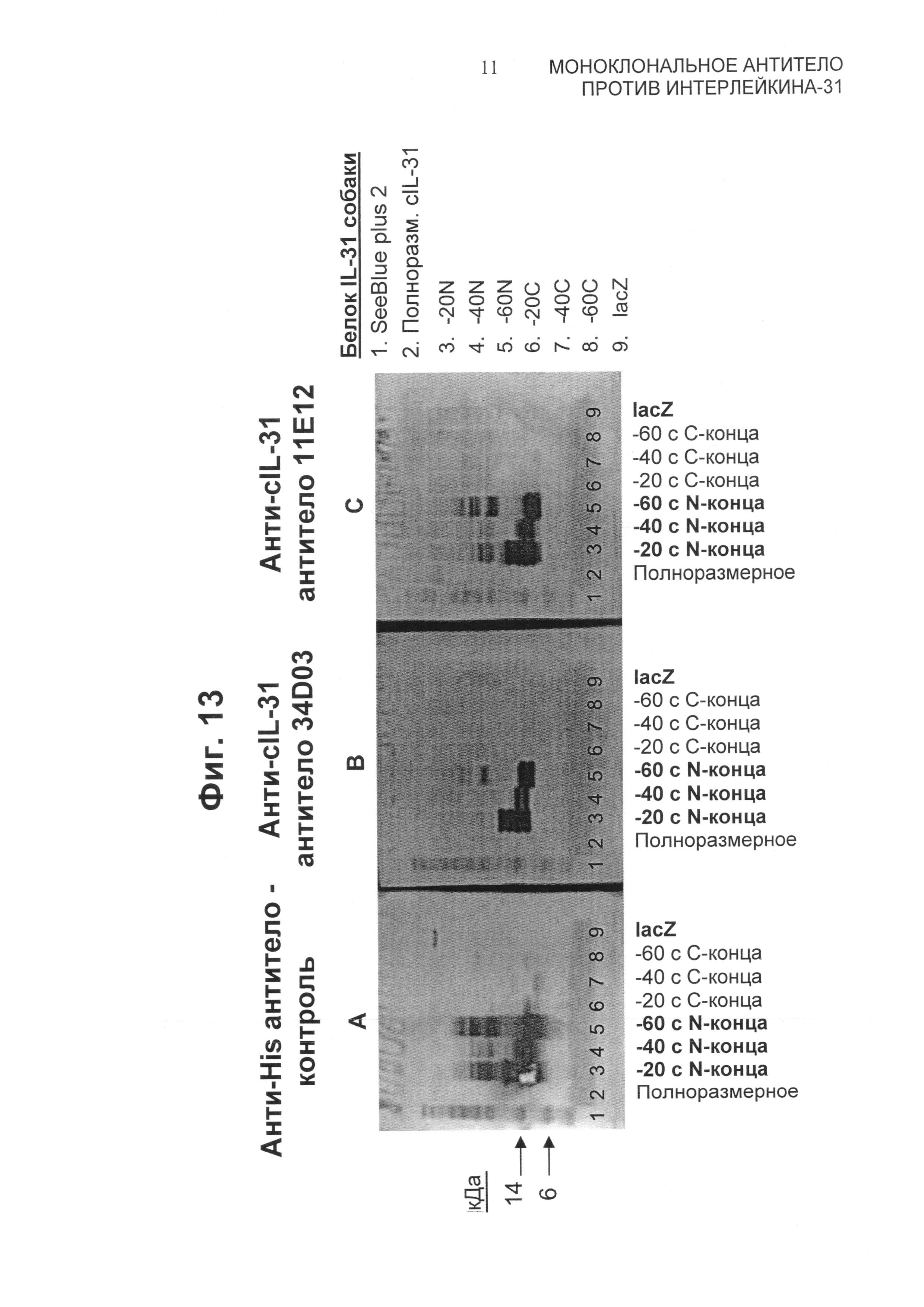
На Фиг.10 представлены вестерн-блоты, демонстрирующие связывание химерных (блот №1), канинизированных (блот №2) и гетерохимерных (блоты №3 и 4) вариантов 11Е12 с собачьим IL-31. Гетерохимера на блоте №3 имеет канинизированную легкую цепь в паре с химерной тяжелой цепью. Гетерохимера на блоте №4 имеет химерную легкую цепь в паре с канинизированной тяжелой цепью. Каждый нитроцеллюлозный блот содержит: левая дорожка - предварительно окрашенные белковые стандарты (Seeblue plus 2, Invitrogen Corp., Carlsbad, CA), и правая дорожка - 800 нг собачьего IL-31.
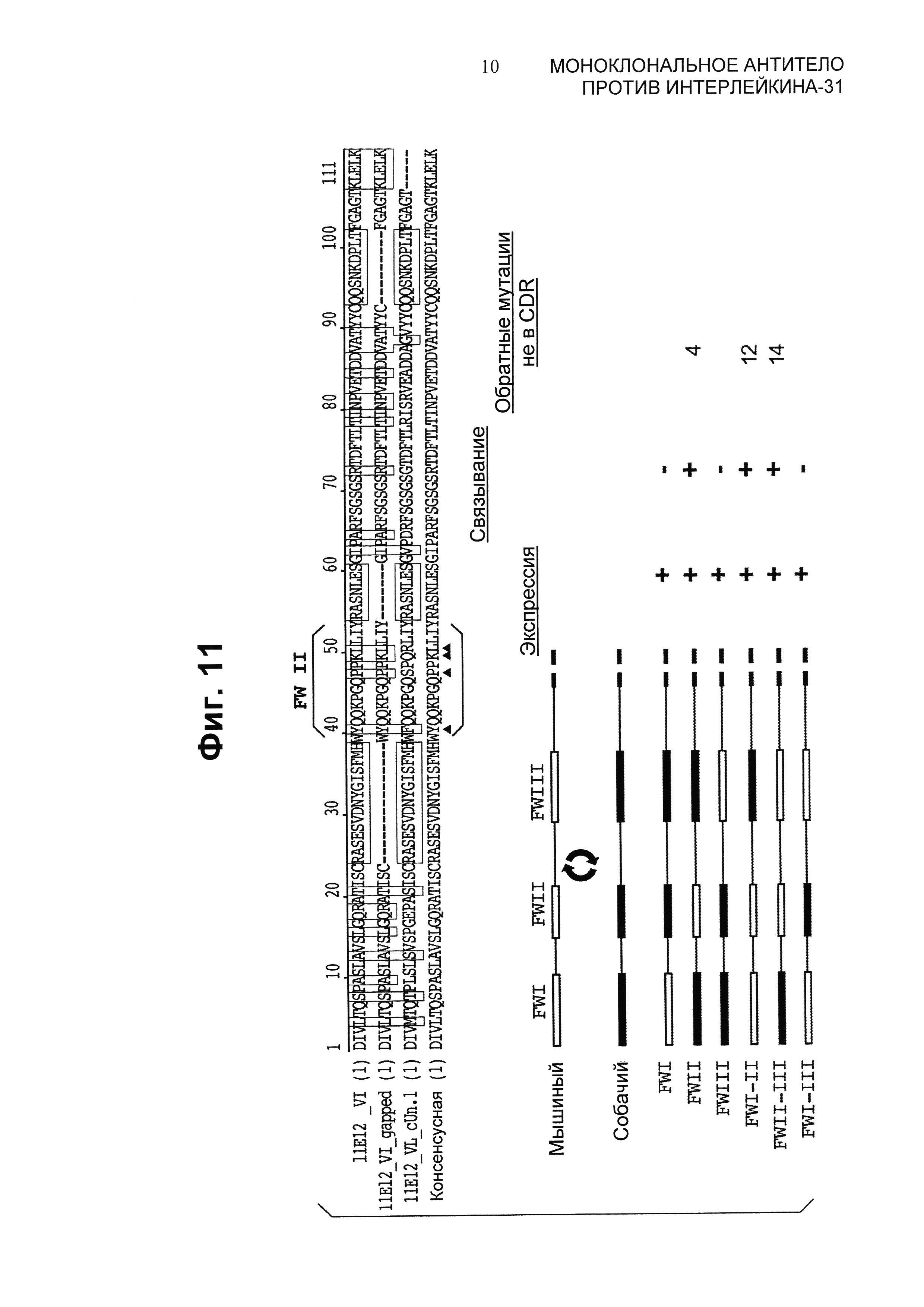
На Фиг.11 приведено схематическое представление результата замены в каркасе легкой цепи канинизированного 11Е12.
На Фиг.12 представлены вестерн-блоты, демонстрирующие связывание канинизированных вариантов 11Е12, содержащих одиночные обратные мутации в остатках каркаса 2 легкой цепи Ig мыши. Каждый нитроцеллюлозный блот содержит: левая дорожка - предварительно окрашенные белковые стандарты (Seeblue plus 2, Invitrogen Corp., Carlsbad, CA), и правая дорожка - 800 нг собачьего IL-31.
На Фиг.13 представлены вестерн-блоты с использованием полноразмерных и укороченных белков собачьего IL-31. Индивидуальные нитроцеллюлозные блоты зондировали, используя антитела А) против His, В) 34D03 и С) 11Е12. Линии 1-9 блотов соответствуют следующему: дорожка 1 - предварительно окрашенные белковые стандарты (Seeblue plus 2, Invitrogen Corp., Carlsbad, CA); дорожка 2 - полноразмерный собачий IL-31; дорожка 3 - структура, укороченная по N-концу, -20N; дорожка 4 - структура, укороченная по N-концу, -40N; дорожка 5 - структура, укороченная по N-концу, -60N; дорожка 6 - структура, укороченная по С-концу -20С; дорожка 7 - структура, укороченная по С-концу -40С; дорожка 8 - структура, укороченная по С-концу -60С; и дорожка 9 - бета-галактозидаза (lacZ). Примечание: для полноразмерного IL-31 и белков с укорочениями по С-концу (-20С, -40С и -60С) не обнаружено никакой детектируемой экспрессии в этих условиях.
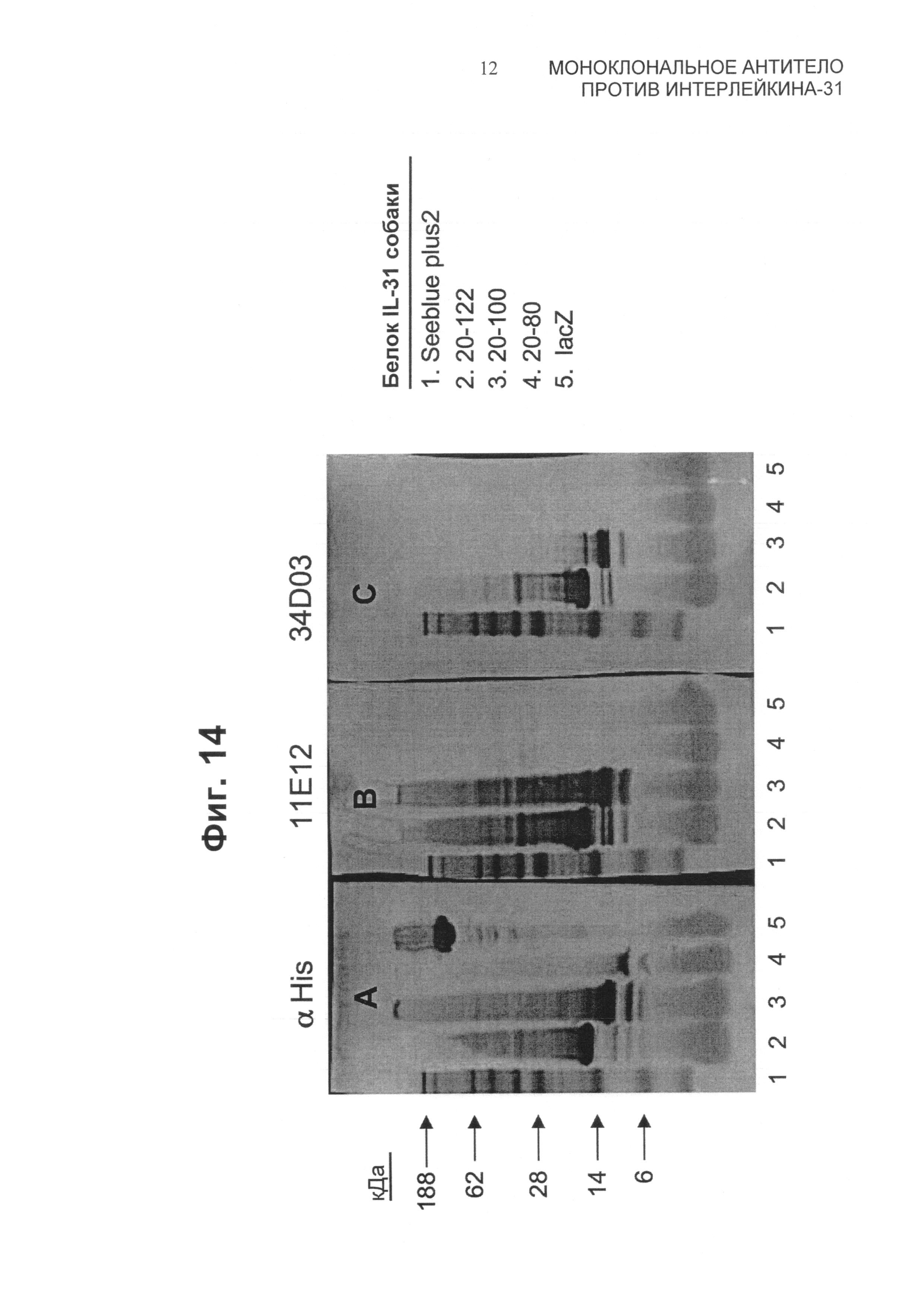
На Фиг.14 представлены вестерн-блоты для укороченных белков собачьего IL-31. Индивидуальные нитроцеллюлозные блоты зондировали, используя антитела А) против His, В) 11Е12 и С) 34D03. Линии 1-5 блотов соответствуют следующему: дорожка 1 - предварительно окрашенные белковые стандарты (Seeblue plus 2, Invitrogen Corp., Carlsbad, CA); дорожка 2 - укороченные по С-концу конструкции, соответствующие положениям 20-122; дорожка 3 - укороченные по С-концу конструкции, соответствующие положениям 20-100; дорожка 4 - укороченные по С-концу конструкции, соответствующие положениям 20-80; и дорожка 5 - бета-галактозидаза (lacZ).
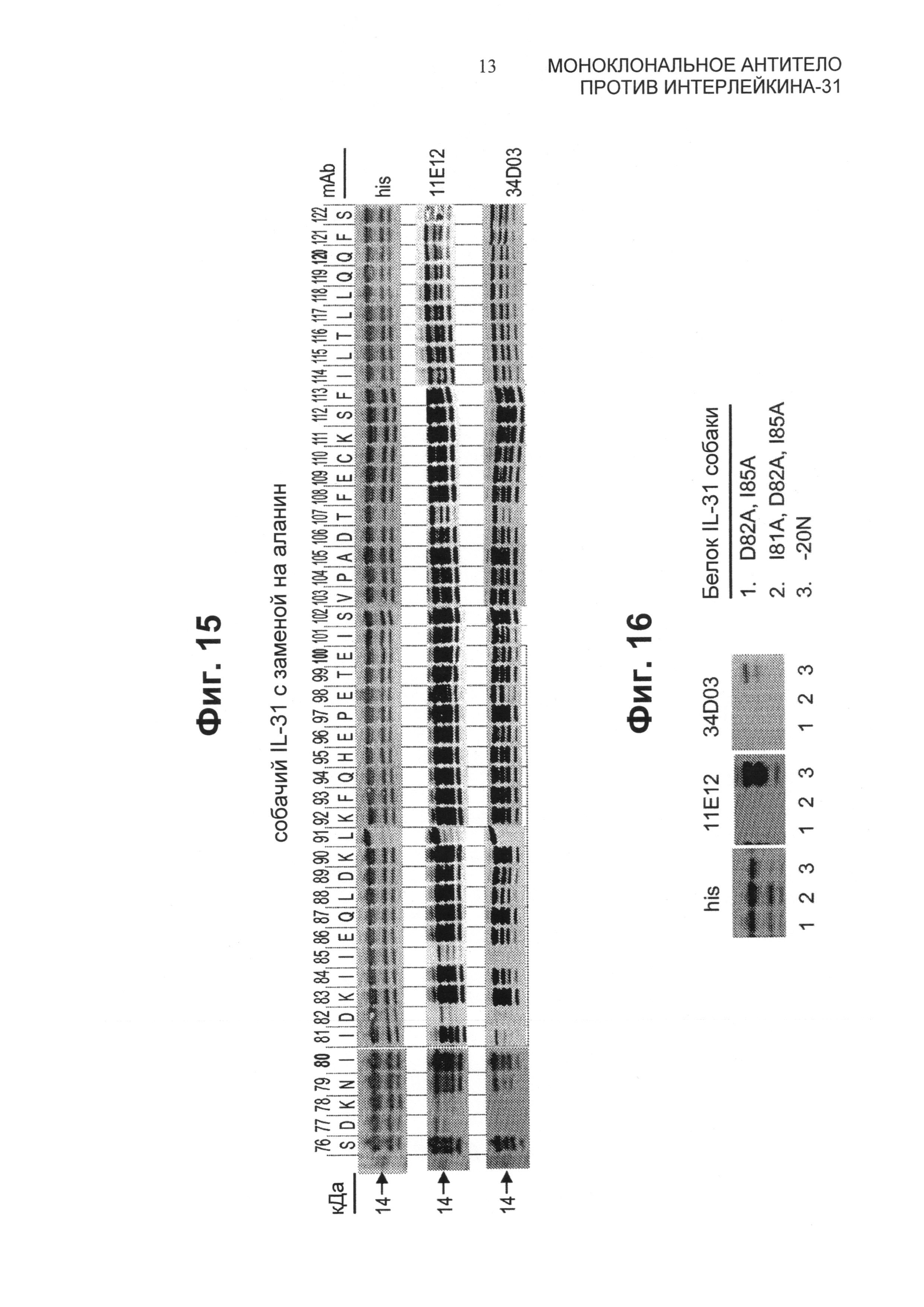
Фиг.15 представляет собой часть вестерн-блотов для лизатов штаммов Е. coli, экспрессирующих собачий IL-31 с заменой на аланин для каждого положения аминокислот (76-122). Индивидуальные нитроцеллюлозные блоты зондировали антителами против His, 11E12 и 34D03, как показано на этой Фиг.
Фиг.16 представляет собой часть вестерн-блотов для лизатов с двойными и тройными мутациями в собачьем IL-31. Белковый лизат -20N использовали в качестве положительного контроля.
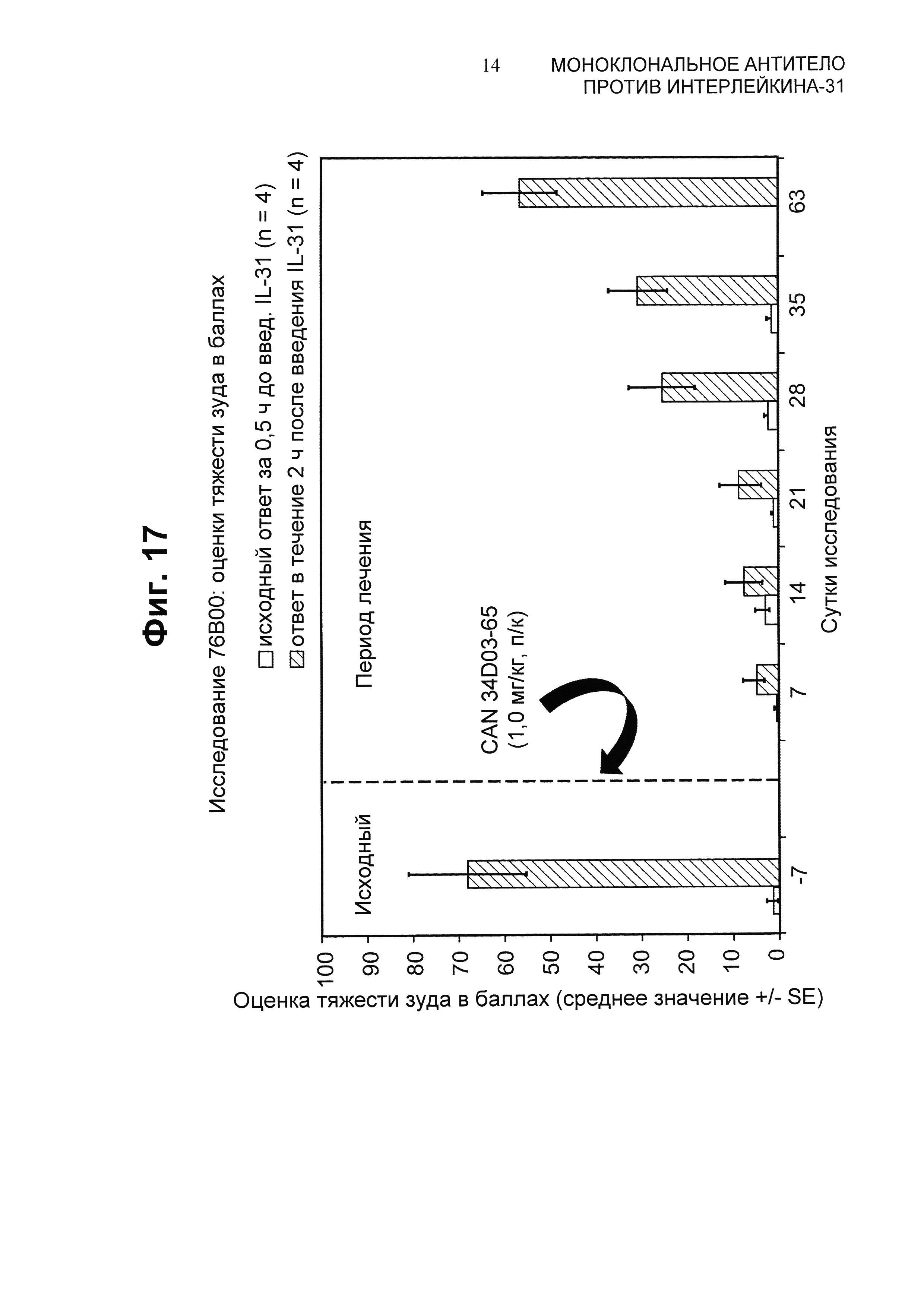
Фиг.17 представляет собой график, показывающий оценки тяжести зуда в баллах у собак, которым вводили подкожно канинизированное антитело 34D03 (1,0 мг/кг). Тяжесть зуда в баллах оценивали в каждый день исследования перед (исходный ответ) и после (ответ за период 2 ч) введения собачьего IL-31 (1,5 мкг/кг).
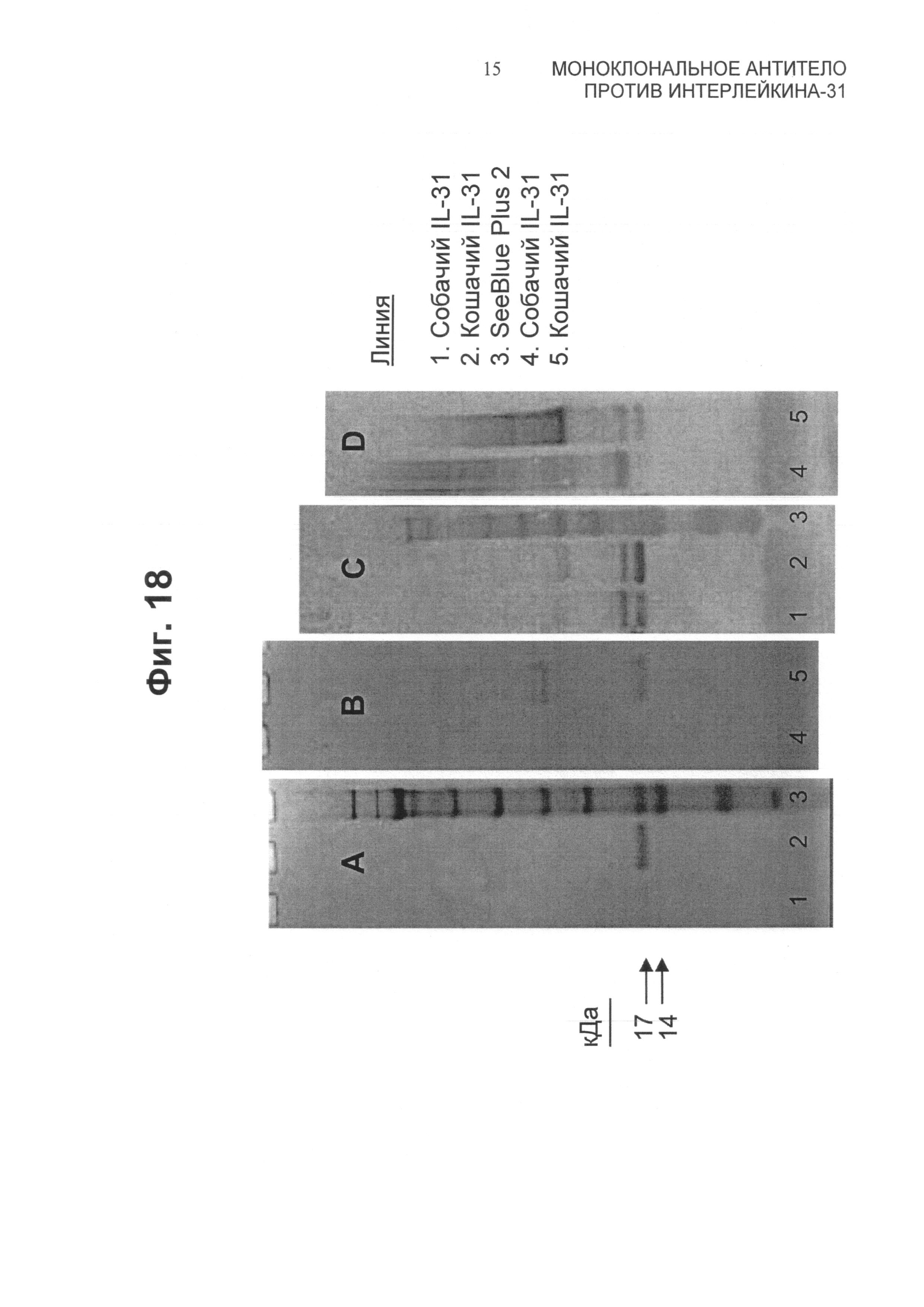
Фиг.18 представляет собой картину электрофореза в полиакриламидном 4-12%-ном геле в бис-Трис-буфере в присутствии додецилсульфата натрия (4-12% Bis-Tris SDS PAGE) для очищенных собачьих и кошачьих белков IL-31. На панели А показано окрашивание белков с использованием кумасси, анализ которых проводили в восстанавливающих условиях. На панели В показано окрашивание белков с использованием кумасси, анализ которых проводили в невосстанавливающих условиях. Панели С и D представляют собой вестерн-блоты гелей, идентичных А и В, соответственно, зондированных антителом против His. Дорожка 1 - собачий IL-31; дорожка 2 - кошачий IL-31; дорожка 3 - предварительно окрашенные белковые стандарты (Seeblue plus 2, Invitrogen Corp., Carlsbad, CA); дорожка 4 - собачий IL-31; и дорожка 5 - кошачий IL-31.
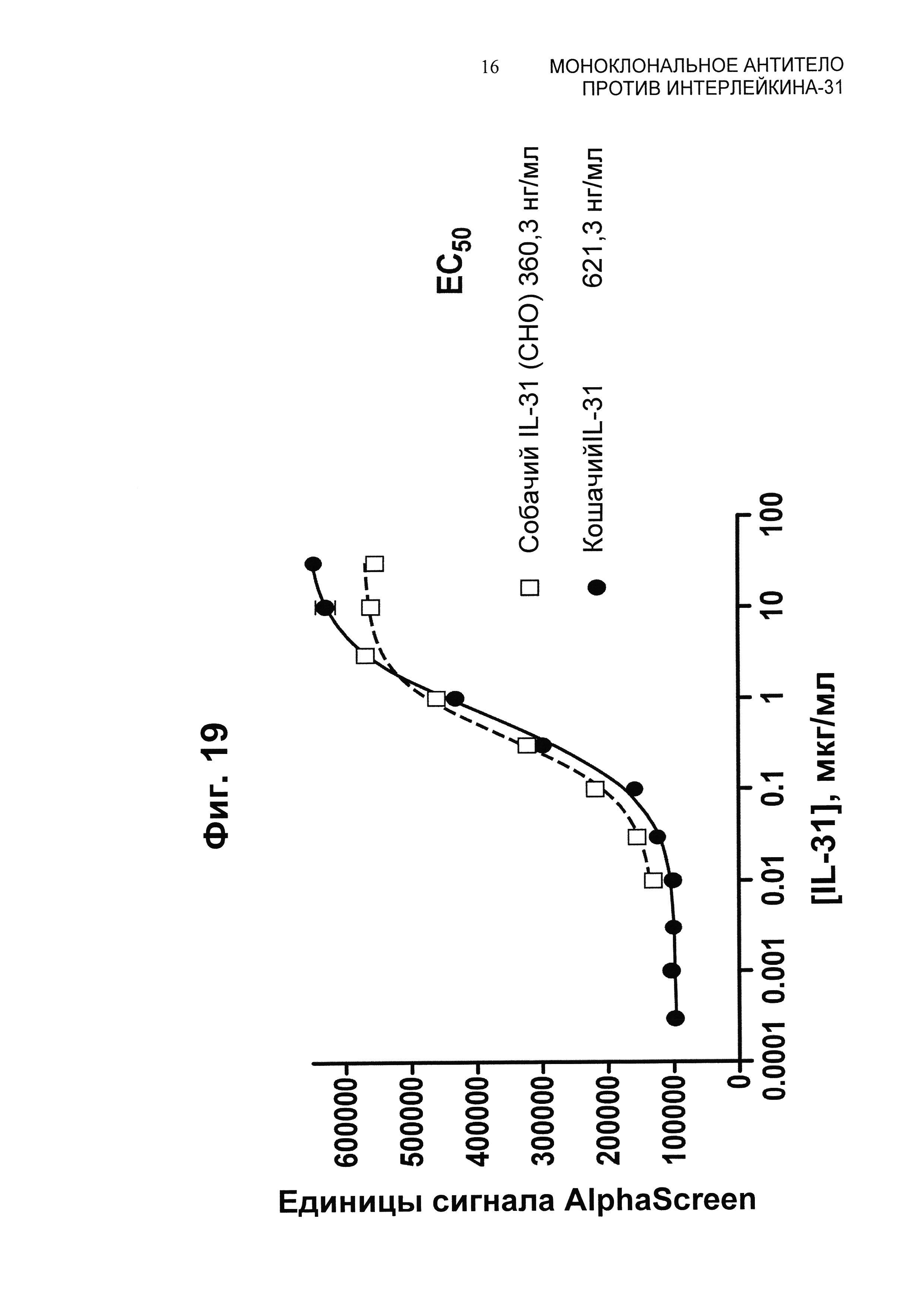
Фиг.19 представляет собой график pSTAT-передачи сигнала в собачьих моноцитах DH-82, которая индуцируется собачьим и кошачьим IL-31, продуцированным в Е. coli. Собачий IL-31 (СНО) представляет собой референсный белок, использованный для всех предыдущих анализов на основе клеток, модели прурита у собак и в качестве иммуногена для первоначальной идентификации антител.
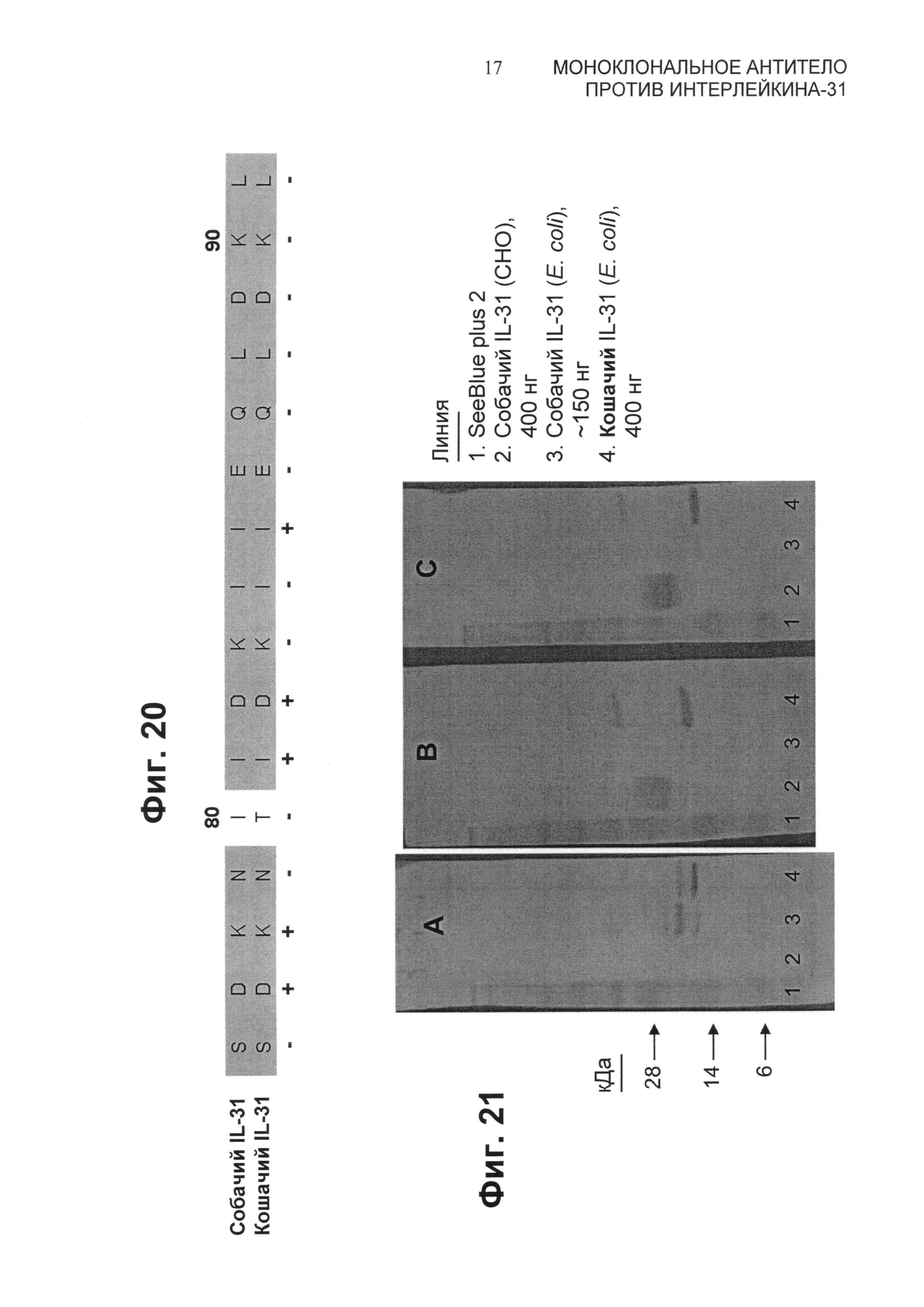
На Фиг.20 представлено выравнивание, демонстрирующее консервативность последовательностей среди кошачьих и собачьих IL-31 в области этого белка, вовлеченной в связывание антител 11Е12 и 34D03 (помечено знаком плюс).
На Фиг.21 представлены вестерн-блоты с использованием белков IL-31. Индивидуальные нитроцеллюлозные блоты зондировали антителами А) против His, В) 11Е12 и С) 34D03. Примечание: собачий IL-31 (СНО) не содержит метки 6-His.
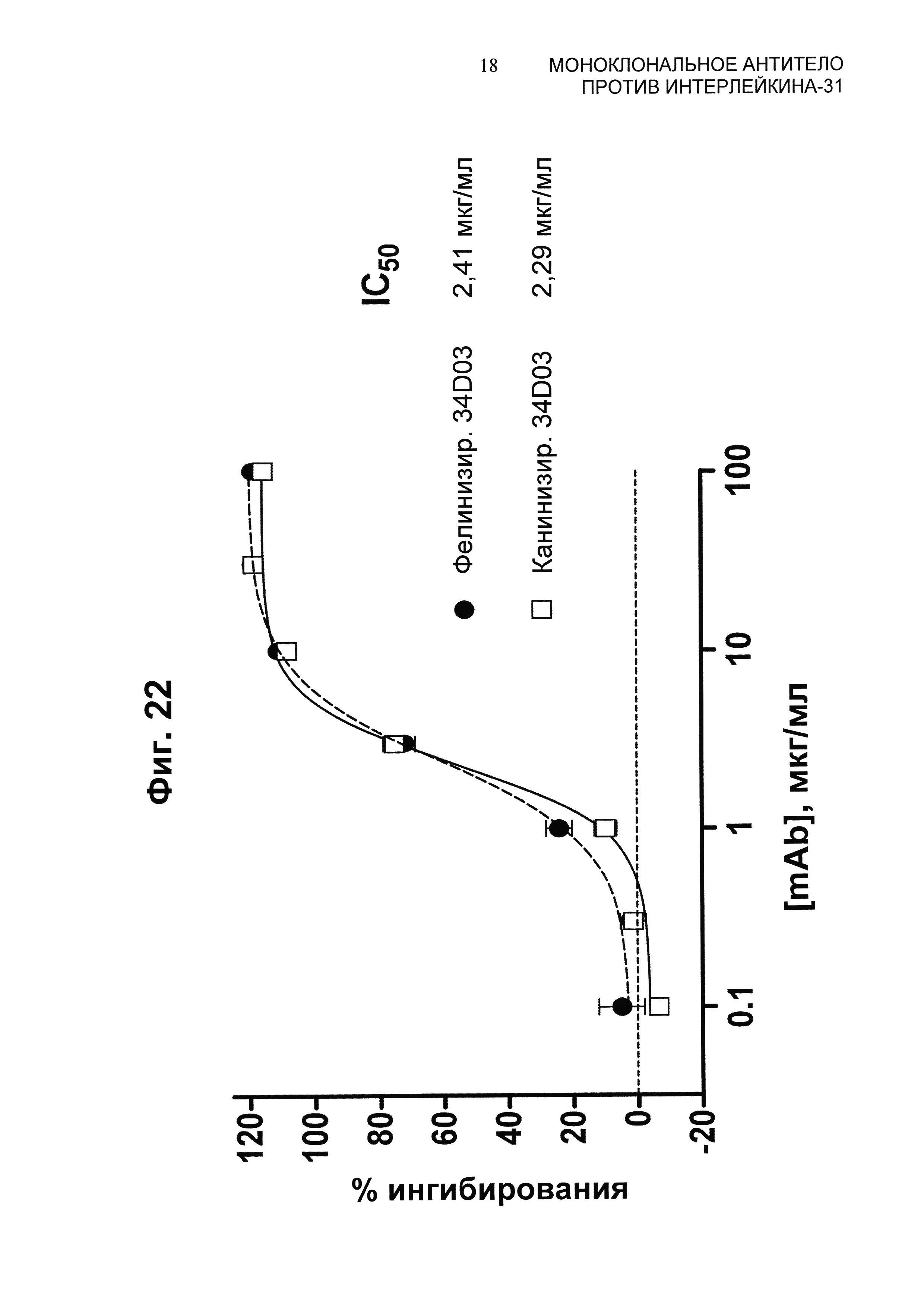
Фиг.22 представляет собой график, показывающий ингибирование pSTAT-передачи сигнала, индуцированной собачьим IL-31, в собачьих моноцитах DH82 со сравнением фелинизированного и канинизированного антитела 34D03.
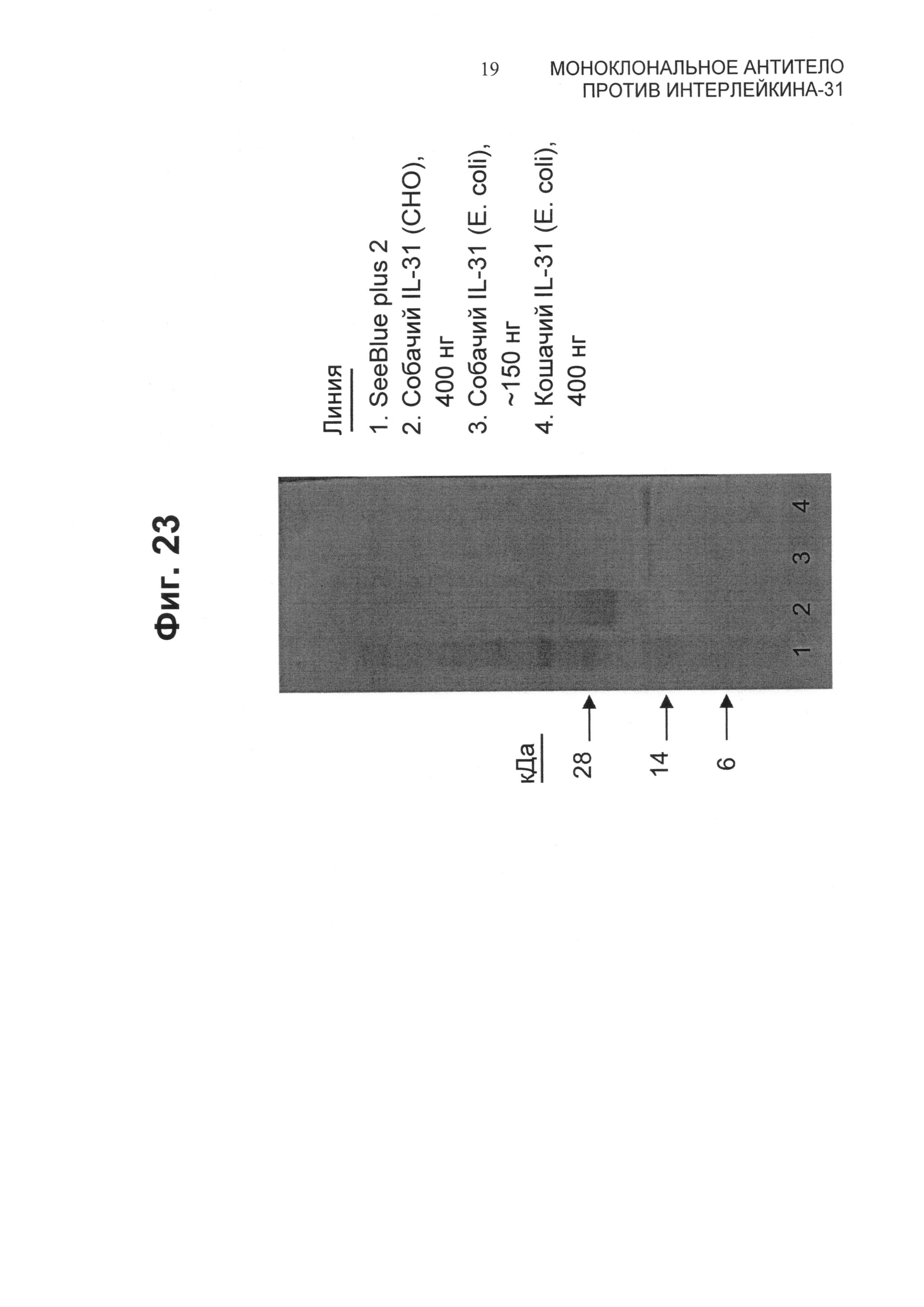
Фиг.23 представляет собой вестерн-блот кошачьего и собачьего IL-31 в восстанавливающих условиях, зондированный фелинизированным антителом 34D03.
КРАТКОЕ ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO:1 представляет собой CDR1 вариабельного домена тяжелой цепи, обозначенную в данном описании как 11E12-VH-CDR1;
SEQ ID NO:2 представляет собой CDR1 вариабельного домена тяжелой цепи, обозначенную в данном описании как 19D07-VH-CDR1;
SEQ ID NO:3 представляет собой CDR1 вариабельного домена тяжелой цепи, обозначенную в данном описании как 34D03-VH-CDR1;
SEQ ID NO:4 представляет собой CDR2 вариабельного домена тяжелой цепи, обозначенную в данном описании как 11E12-VH-CDR2;
SEQ ID NO:5 представляет собой CDR2 вариабельного домена тяжелой цепи, обозначенную в данном описании как 19D07-VH-CDR2;
SEQ ID NO:6 представляет собой CDR2 вариабельного домена тяжелой цепи, обозначенную в данном описании как 34D03-VH-CDR2;
SEQ ID NO:7 представляет собой CDR3 вариабельного домена тяжелой цепи, обозначенную в данном описании как 11E12-VH-CDR3;
SEQ ID NO:8 представляет собой CDR3 вариабельного домена тяжелой цепи, обозначенную в данном описании как 19D07-VH-CDR3;
SEQ ID NO:9 представляет собой CDR3 вариабельного домена тяжелой цепи, обозначенную в данном описании как 34D03-VH-CDR3;
SEQ ID NO:10 представляет собой CDR1 вариабельного домена легкой цепи, обозначенную в данном описании как 11E12-VL-CDR1;
SEQ ID NO:11 представляет собой CDR1 вариабельного домена легкой цепи, обозначенную в данном описании как 19D07-VL-CDR1;
SEQ ID NO:12 представляет собой CDR1 вариабельного домена легкой цепи, обозначенную в данном описании как 34D03-VL-CDR1;
SEQ ID NO:13 представляет собой CDR2 вариабельного домена легкой цепи, обозначенную в данном описании как 11E12-VL-CDR2;
SEQ ID NO:14 представляет собой CDR2 вариабельного домена легкой цепи, обозначенную в данном описании как 19D07-VL-CDR2;
SEQ ID NO:15 представляет собой CDR2 вариабельного домена легкой цепи, обозначенную в данном описании как 34D03-VL-CDR2;
SEQ ID NO:16 представляет собой CDR2 вариабельного домена легкой цепи, обозначенную в данном описании как 11E12-VL-CDR3;
SEQ ID NO:17 представляет собой CDR3 вариабельного домена легкой цепи, обозначенную в данном описании как 19D07-VL-CDR3;
SEQ ID NO:18 представляет собой CDR3 вариабельного домена легкой цепи, обозначенную в данном описании как 34D03-VL-CDR3;
SEQ ID NO:19 представляет собой последовательность вариабельного домена легкой цепи, обозначенного в данном описании как MU-11E12-VL;
SEQ ID NO:20 представляет собой последовательность вариабельного домена легкой цепи, обозначенного в данном описании как CAN-11E12-VL-cUn-FW2;
SEQ ID NO:21 представляет собой последовательность вариабельного домена легкой цепи, обозначенного в данном описании как CAN-11E12-VL-cUn-13;
SEQ ID NO:22 представляет собой последовательность вариабельного домена легкой цепи, обозначенного в данном описании как MU-19D07-VL;
SEQ ID NO:23 представляет собой последовательность вариабельного домена легкой цепи, обозначенного в данном описании как CAN-19D07-VL-998-1;
SEQ ID NO:24 представляет собой последовательность вариабельного домена легкой цепи, обозначенного в данном описании как MU-34D03-VL;
SEQ ID NO:25 представляет собой последовательность вариабельного домена легкой цепи, обозначенного в данном описании как CAN-34D03-VL-998-1;
SEQ ID NO:26 представляет собой последовательность вариабельного домена тяжелой цепи, обозначенного в данном описании как MU-11E12-VH;
SEQ ID NO:27 представляет собой последовательность вариабельного домена тяжелой цепи, обозначенного в данном описании как CAN-11E12-VH-415-1;
SEQ ID NO:28 представляет собой последовательность вариабельного домена тяжелой цепи, обозначенного в данном описании как MU-19D07-VH;
SEQ ID NO:29 представляет собой последовательность вариабельного домена тяжелой цепи, обозначенного в данном описании как CAN-19D07-VH-400-1;
SEQ ID NO:30 представляет собой последовательность вариабельного домена тяжелой цепи, обозначенного в данном описании как MU-34D03-VH;
SEQ ID NO:31 представляет собой последовательность вариабельного домена тяжелой цепи, обозначенного в данном описании как CAN-34D03-VH-568-1;
SEQ ID NO:32 представляет собой аминокислотную последовательность, соответствующую № доступа в GenBank C7GOW1, и соответствует полноразмерному белку IL-31 собаки;
SEQ ID NO:33 представляет собой нуклеотидную последовательность, соответствующую № доступа в GenBank C7G0W1, и соответствует нуклеотидной последовательности, кодирующей полноразмерный белок IL-31 собаки;
SEQ ID NO:34 представляет собой нуклеотидную последовательность, кодирующую последовательность вариабельного домена легкой цепи, обозначенного в данном описании как MU-11E12-VL;
SEQ ID NO:35 представляет собой нуклеотидную последовательность, кодирующую последовательность вариабельного домена тяжелой цепи, обозначенного в данном описании как MU-11E12-VH;
SEQ ID NO:36 представляет собой нуклеотидную последовательность, кодирующую последовательность вариабельного домена легкой цепи, обозначенного в данном описании как MU-19D07-VL;
SEQ ID NO:37 представляет собой нуклеотидную последовательность, кодирующую последовательность вариабельного домена тяжелой цепи, обозначенного в данном описании как MU-19D07-VH;
SEQ ID NO:38 представляет собой нуклеотидную последовательность, кодирующую последовательность вариабельного домена легкой цепи, обозначенного в данном описании как MU-34D03-VL;
SEQ ID NO:39 представляет собой нуклеотидную последовательность, кодирующую последовательность вариабельного домена тяжелой цепи, обозначенного в данном описании как MU-34D03-VH;
SEQ ID NO:40 представляет собой аминокислотную последовательность для константной области тяжелой цепи собачьего Ig, обозначенной в данном описании как НС-64 (№ доступа в GenBank AF354264);
SEQ ID NO:41 представляет собой нуклеотидную последовательность, кодирующую константную область тяжелой цепи собачьего Ig, обозначенной в данном описании как НС-64 (№ доступа в GenBank AF354264);
SEQ ID NO:42 представляет собой аминокислотную последовательность для константной области тяжелой цепи собачьего Ig, обозначенной в данном описании как НС-65 (№ доступа в GenBank AF354265);
SEQ ID NO:43 представляет собой нуклеотидную последовательность, кодирующую константную область тяжелой цепи собачьего Ig, обозначенную в данном описании как НС-65 (№ доступа в GenBank AF354265);
SEQ ID NO:44 представляет собой аминокислотную последовательность для константной области легкой цепи собачьего Ig, обозначенной в данном описании как каппа (№ доступа в GenBank ХР_532962);
SEQ ID NO:45 представляет собой нуклеотидную последовательность, кодирующую константную область легкой цепи собачьего Ig, обозначенную как каппа (№ доступа в GenBank ХР_532962);
SEQ ID NO:46 представляет собой нуклеотидную последовательность, кодирующую последовательность вариабельного домена легкой цепи, обозначенного в данном описании как CAN-19D07-VL-998-1;
SEQ ID NO:47 представляет собой нуклеотидную последовательность, кодирующую последовательность вариабельного домена тяжелой цепи, обозначенного в данном описании как CAN-19D07-VH-998-1;
SEQ ID NO:48 представляет собой нуклеотидную последовательность, кодирующую последовательность вариабельного домена легкой цепи, обозначенного в данном описании как CAN-34D03-VL-998-1;
SEQ ID NO:49 представляет собой нуклеотидную последовательность, кодирующую последовательность вариабельного домена тяжелой цепи, обозначенного в данном описании как CAN-34D03-VH-568-1;
SEQ ID NO:50 представляет собой нуклеотидную последовательность, кодирующую последовательность вариабельного домена легкой цепи, обозначенного в данном описании как CAN-11E12-VL-cUn-FW2;
SEQ ID NO:51 представляет собой нуклеотидную последовательность, кодирующую последовательность вариабельного домена тяжелой цепи, обозначенного в данном описании как CAN-11E12-VH-415-1;
SEQ ID NO:52 представляет собой нуклеотидную последовательность, кодирующую последовательность вариабельного домена легкой цепи, обозначенного в данном описании как CAN-11E12-VL-cUn-13;
SEQ ID NO:53 представляет собой последовательность вариабельного домена легкой цепи, обозначенного в данном описании как CAN-11E12_VL_cUn_1;
SEQ ID NO:54 представляет собой нуклеотидную последовательность, кодирующую последовательность вариабельного домена легкой цепи, обозначенного в данном описании как CAN-11E12-VL-cUn-1;
SEQ ID NO:55 соответствует аминокислотной последовательности полноразмерной конструкции собачьего IL-31, использованной в данном описании для экспрессии в E. coli;
SEQ ID NO:56 представляет собой нуклеотидную последовательность, соответствующую полноразмерной конструкции собачьего IL-31, использованной в данном описании для экспрессии в E. coli;
SEQ ID NO:57 представляет собой аминокислотную последовательность конструкции -20N собачьего IL-31 для экспрессии в Е. coli;
SEQ ID NO:58 представляет собой нуклеотидную последовательность, соответствующую конструкции -20N собачьего IL-31, для экспрессии в Е. coli;
SEQ ID NO:59 представляет собой аминокислотную последовательность конструкции -40N собачьего IL-31 для экспрессии в Е. coli;
SEQ ID NO:60 представляет собой нуклеотидную последовательность, соответствующую конструкции -40N собачьего IL-31, для экспрессии в Е. coli;
SEQ ID NO:61 представляет собой аминокислотную последовательность конструкции -60N собачьего IL-31 для экспрессии в Е. coli;
SEQ ID NO:62 представляет собой нуклеотидную последовательность, соответствующую конструкции -60N собачьего IL-31, для экспрессии в Е. coli;
SEQ ID NO:63 представляет собой аминокислотную последовательность конструкции 20-122 собачьего IL-31 для экспрессии в Е. coli;
SEQ ID NO:64 представляет собой нуклеотидную последовательность, соответствующую конструкции 20-122 собачьего IL-31, для экспрессии в Е. coli;
SEQ ID NO:65 представляет собой аминокислотную последовательность конструкции 20-100 собачьего IL-31 для экспрессии в Е. coli;
SEQ ID NO:66 представляет собой нуклеотидную последовательность, соответствующую конструкции 20-100 собачьего IL-31, для экспрессии в Е. coli;
SEQ ID NO:67 представляет собой аминокислотную последовательность конструкции 20-80 собачьего IL-31, для экспрессии в Е. coli;
SEQ ID NO:68 представляет собой нуклеотидную последовательность, соответствующую конструкции 20-80 собачьего IL-31, для экспрессии в Е. coli;
SEQ ID NO:69 представляет собой нуклеотидную последовательность, соответствующую полноразмерной конструкции кошачьего IL-31, для экспрессии в Е. coli;
SEQ ID NO:70 представляет собой аминокислотную последовательность, соответствующую полноразмерной конструкции кошачьего IL-31, для экспрессии в Е. coli;
SEQ ID NO:71 представляет собой последовательность вариабельного домена легкой цепи, обозначенного в данном описании как FEL-34D03-VL-021-1;
SEQ ID NO:72 представляет собой нуклеотидную последовательность, кодирующую последовательность вариабельного домена легкой цепи, обозначенного в данном описании как FEL-34D03-VL-021-1;
SEQ ID NO:73 представляет собой последовательность вариабельного домена тяжелой цепи, обозначенного в данном описании как FEL-34D03-VH-035-1;
SEQ ID NO:74 представляет собой нуклеотидную последовательность, кодирующую последовательность вариабельного домена тяжелой цепи, обозначенного в данном описании как FEL-34D03-VH-035-1;
SEQ ID NO:75 представляет собой аминокислотную последовательность для константной области тяжелой цепи кошачьего Ig, обозначенной в данном описании как НС-А кошек (№ доступа в GenBank AB016710.1);
SEQ ID NO:76 представляет собой нуклеотидную последовательность, кодирующую константную область тяжелой цепи кошачьего Ig, обозначенную в данном описании как НС-А кошек (№ доступа в GenBank AB016710.1);
SEQ ID NO:77 представляет собой аминокислотную последовательность для константной области легкой цепи кошачьего Ig, обозначенной в данном описании как LC-каппа кошек (№ доступа в GenBank AF198257.1);
SEQ ID NO:78 представляет собой нуклеотидную последовательность, кодирующую константную область легкой цепи кошачьего Ig, обозначенную в данном описании как LC-каппа кошек (№ доступа в GenBank AF198257.1).
ОПРЕДЕЛЕНИЯ
Перед подробным описанием настоящего изобретения будут определены некоторые термины, используемые в контексте настоящего изобретения. В дополнение к этим терминам в данном описании определены и другие термины, если это необходимо. Если в данном описании явным образом не указано иное, то принятые в данной области техники термины, которые использованы в этом описании, будут иметь свои признанные в данной области значения.
Как использовано в описании и формуле изобретения, формы единственного числа включают ссылки на множественное число, если контекст ясно не предусматривает иное. Например, ссылка на "антитело" включает множество таких антител.
Подразумевается, что использованный в данном описании термин "содержащий" означает, что композиции и способы включают перечисленные элементы, но не исключая другие элементы.
Эпитоп, как использовано в данном описании, относится к антигенной детерминанте, распознаваемой CDR антитела. Другими словами, эпитоп относится к тому участку любой молекулы, который способно распознавать и с которым может связываться антитело. Если не указано иное, термин "эпитоп", использованный в данном описании, относится к области IL-31, с которой анти-IL-31 агент вступает в реакцию.
"Антиген" представляет собой молекулу или участок молекулы, с которыми может связываться антитело, которые помимо этого способно распознавать и с которыми может связываться антитело (соответствующая область связывания антитела может быть названа паратопом). В общем случае, эпитопы состоят из химически активных поверхностных группировок молекул, например боковых цепей аминокислот или Сахаров, и имеют определенные пространственные структурные характеристики, а также определенные характеристики в отношении заряда.
Термин "специфически", применительно к связыванию с антителом, относится к высокоавидному и/или высокоаффинному связыванию антитела с конкретным антигеном, т.е. полипептидом или эпитопом. Во многих воплощениях конкретным антигеном является антиген (или фрагмент либо субфракция антигена), используемый для иммунизации животного-хозяина, из которого были выделены антитело-продуцирующие клетки. Специфическое связывание антитела с антигеном является более сильным, чем связывание того же антитела с другими антигенами. Антитела, специфически связывающиеся с полипептидом, могут обладать способностью связывать другие полипептиды на низком, однако же детектируемом уровне (например 10% или меньше от связывания, показанного в отношении представляющего интерес полипептида). Такое слабое связывание или фоновое связывание легко отличить от специфического связывания антитела с исследуемым полипептидом, например посредством использования подходящих контролей. В общем случае, специфические антитела связываются с антигеном с аффинностью связывания с KD 10-7 М или меньше, например 10-8 М или меньше (например 10-9 М или меньше, 10-10 или меньше, 10-11 или меньше, 10-12 или меньше либо 10-13 или меньше и т.д.).
Использованный в данном описании термин "антитело" относится к интактному иммуноглобулину, имеющему две легкие и две тяжелые цепи. Таким образом, единичное выделенное антитело или фрагмент может представлять собой поликлональное антитело, моноклональное антитело, синтетическое антитело, рекомбинантное антитело, химерное антитело, гетерохимерное антитело, канинизированное антитело или фелинизированное антитело. Термин "антитело" предпочтительно относится к моноклональным антителам и их фрагментам, и их иммунологически связывающимся эквивалентам, которые могут связываться с белком IL-31 и его фрагментами. Термин "антитело" используется для обозначения как гомогенной молекулярной субстанции, так и смеси, как например, сывороточного продукта, состоящего из множества различных молекулярных субстанций.
"Нативные антитела" и "нативные иммуноглобулины" обычно представляют собой гетеротетрамерные гликопротеины с молекулярной массой примерно 150000 дальтон, составленные из двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, тогда как число дисульфидных связей у тяжелых цепей разных изотипов иммуноглобулинов варьирует. Каждая тяжелая и легкая цепь также имеет правильно расположенные внутрицепочечные дисульфидные мостики. Каждая тяжелая цепь имеет на одном конце вариабельный домен (VH), за которым следует несколько константных доменов. Каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен на своем другом конце; константный домен легкой цепи выровнен относительно первого константного домена тяжелой цепи, а вариабельный домен легкой цепи выравнен относительно вариабельного домена тяжелой цепи. Считается, что определенные аминокислотные остатки образуют поверхность контакта между вариабельными доменами легкой и тяжелой цепей. Фиг.2 представляет собой пример общей структуры нативного иммуноглобулина G (IgG) мыши с выделенным антигенсвязывающим сайтом.
Термин "фрагмент антитела" относится к части структуры интактного антитела, включая, без ограничения, выделенную одиночную цепь антитела, Fv-конструкцию, Fab-конструкцию, Fc-конструкцию, последовательность вариабельного домена легкой цепи или определяющей комплементарность области (CDR) и т.д.
Термин "вариабельная" область включает каркас и CDR (известные еще как гипервариабельные области) и относится к тому факту, что некоторые участки вариабельных доменов значительно отличаются в последовательности среди антител и используются при связывании каждого конкретного антитела со своим конкретным антигеном и определяют специфичность этого антитела. Однако вариабельность не распределена равномерно по всем вариабельным доменам антител. Она сконцентрирована в трех называемых гипервариабельными областями сегментах вариабельных доменов как легкой цепи, так и тяжелой цепи. Более высококонсервативные участки вариабельных доменов называют каркасной областью (FR). Каждый из вариабельных доменов нативных тяжелых и легких цепей содержит многочисленные FR, в большинстве случаев принимающие β-складчатую конфигурацию, соединенные тремя гипервариабельными областями, которые образуют петли, соединяющие и в некоторых случаях образующие часть α-складчатой структуры. Гипервариабельные области в каждой цепи удерживаются вместе в непосредственной близости друг от друга посредством FR и вместе с гипервариабельными областями из другой цепи вносят вклад в образование антигенсвязывающего сайта антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991), pages 647-669). Константные домены непосредственно не вовлечены в связывание антитела с антигеном, однако демонстрируют различные эффекторные функции, как например участие антитела в антителозависимой клеточной токсичности.
Термин "гипервариабельная область", когда он используется в данном описании, относится к аминокислотным остаткам антитела, которые ответственны за связывание с антигеном. Гипервариабельная область содержит аминокислотные остатки из "определяющей комплементарность области" или "CDR" (Kabat и др. (1991), выше) и/или аминокислотные остатки из "гипервариабельной петли" (Chothia and Lesk, J. Mol. Biol., 196:901-917 (1987)). "Каркасные" или "FR" остатки представляют собой остатки вариабельного домена, отличные от остатков гипервариабельной области, определенной в данном описании.
В результате переваривания антител папаином образуется два идентичных антигенсвязывающих фрагмента, называемых "Fab"-фрагментами, каждый из которых имеет антигенсвязывающий сайт, и оставшийся "Fc"-фрагмент, название которого отражает его способность легко кристаллизоваться. В результате обработки пепсином получается F(ab′)2-фрагмент, имеющий два антигенсвязывающих сайта и по-прежнему способный к перекрестному связыванию с антигеном.
"Fv" представляет собой минимальный фрагмент антитела, который содержит весь антигенраспознающий и -связывающий сайт. Эта область состоит из димера вариабельного домена одной тяжелой цепи и одной легкой цепи, находящихся в плотной нековалентной ассоциации. Именно в этой конфигурации три гипервариабельные области каждого вариабельного домена взаимодействуют с установлением антигенсвязывающего сайта на поверхности димера VH-VL. Совместно шесть гипервариабельных областей придают антигенсвязывающую специфичность антителу. Однако даже один вариабельный домен (или половина Fv, содержащая только три гипервариабельных области, специфичных к антигену) обладает способностью распознавать и связывать антиген, хотя и с более низкой аффинностью, чем целый сайт связывания.
Fab-фрагмент также содержит константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. Fab′-фрагменты отличаются от Fab-фрагментов тем, что у них добавлено несколько остатков на карбоксильном конце СН1-домена тяжелой цепи, включая один или более чем один цистеин из шарнирной области антитела. Fab′-SH в данном описании представляет собой обозначение для Fab′, в котором остаток(ки) цистеина константных доменов несет(ут) свободную тиоловую группу. F(ab′)2-фрагменты антител изначально получают в виде пар Fab′-фрагментов, которые содержат между собой шарнирные цистеины. Кроме этого известны другие методы химического сочетания фрагментов антител.
"Легкие цепи" антител (иммуноглобулинов) из любого вида позвоночных могут быть отнесены к одному из двух четко различающихся типов, называемых каппа (κ) и лямбда (λ), на основании аминокислотных последовательностей их константных доменов.
На основании аминокислотной последовательности константного домена своих тяжелых цепей иммуноглобулины могут быть отнесены к разным классам. В настоящее время известны пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно подразделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA, IgA2 (как определено обозначением для мышей и людей). Константные домены тяжелой цепи, соответствующие разным классам иммуноглобулинов, обозначают как альфа, дельта, эпсилон, гамма и мю, соответственно. Субъединичные структуры и пространственные конфигурации иммуноглобулинов разных классов хорошо известны для многих видов. Распространенность индивидуальных изотипов и функциональные активности, ассоциированные с этими константными доменами, являются видоспецифичными и должны быть определены экспериментально.
"Моноклональное антитело", как оно определено в данном описании, представляет собой антитело, продуцируемое клетками одного клона (конкретно, гибридомными клетками одного клона), и поэтому относится к одному чистому гомогенному типу антитела. Все моноклональные антитела, полученные из одного и того же клона, идентичны и имеют одинаковую антигенную специфичность. Термин "моноклональный" относится к клеткам одного клона, одной клетке и потомству этой клетки.
Моноклональные антитела в данном описании включают, в частности, "химерные" антитела (иммуноглобулины), в которых участок тяжелой и/или легкой цепей идентичен или гомологичен соответствующим последовательностям в антителах, происходящих из конкретного вида, тогда как остальная часть цепи(ей) идентична или гомологична соответствующим последовательностям в антителах, происходящих из другого вида, а также фрагменты таких антител, при условии, что они демонстрируют желаемую биологическую активность. Обычно химерными антителами являются антитела, для которых были сконструированы гены легкой и тяжелой цепей, в типичном случае генно-инженерным методом, из принадлежащих разным видам генов вариабельной и константной области антитела. Например, вариабельные сегменты генов из мышиного моноклонального антитела могут быть присоединены к константным сегментам собачьего Ig. Фиг.3 представляет собой схематическое изображение общей структуры одного из воплощений мышиного:собачьего IgG. В этом воплощении антигенсвязывающий сайт происходит из мышиного Ig, тогда как FC-участок - из собачьего Ig.
"Канинизированные" формы не-собачьих (например мышиных) антител представляют собой генетически модифицированные антитела, которые содержат минимальную последовательность, происходящую из не-собачьего иммуноглобулина. Канинизированными антителами являются последовательности собачьего иммуноглобулина (реципиентного антитела), в которых остатки гипервариабельной области реципиента заменены остатками гипервариабельной области Ig из не относящегося к семейству псовых вида (донорного антитела), как например мыши, обладающего желаемой специфичностью, аффинностью и емкостью. В некоторых случаях, остатки каркасных областей (FR) последовательностей собачьего иммуноглобулина заменены соответствующими остатками не-собачьего Ig. Кроме того, канинизированные антитела могут содержать остатки, которых нет у реципиентного антитела или у донорного антитела. Эти модификации сделаны с целью дальнейшего улучшения характеристик антител. В общем случае, канинизированное антитело будет содержать по существу весь по меньшей мере один вариабельный домен и обычно два вариабельных домена, в которых все или по существу все гипервариабельные области соответствуют таковым из последовательности не-собачьего иммуноглобулина, и все или по существу все FR представляют собой таковые из последовательности собачьего иммуноглобулина. Канинизированное антитело возможно также будет содержать всю константную область иммуноглобулина (Fc) или по меньшей мере ее участок, обычно таковую из последовательности собачьего иммуноглобулина. Фиг.4 представляет собой иллюстрацию одного из воплощений, на которой показан процесс "видообразования" или "канинизации" мышиного IgG. В этом воплощении мышиные CDR прививают на каркасы собачьего Ig.
"Фелинизированные" формы не-кошачьих (например мышиных) антител представляют собой генетически модифицированные антитела, которые содержат минимальную последовательность, происходящую из не-кошачьего иммуноглобулина. Фелинизированными антителами являются последовательности кошачьего иммуноглобулина (реципиентного антитела), в которых остатки гипервариабельной области реципиента заменены остатками гипервариабельной области Ig из не относящегося к семейству кошачьих вида (донорного антитела), как например мыши, обладающего желаемой специфичностью, аффинностью и емкостью. В некоторых случаях, остатки каркасных областей (FR) последовательностей кошачьего иммуноглобулина заменены соответствующими остатками не-кошачьего Ig. Кроме того, фелинизированные антитела могут содержать остатки, которых нет у реципиентного антитела или у донорного антитела. Эти модификации сделаны с целью дальнейшего улучшения характеристик антител. В общем случае, фелинизированное антитело будет содержать по существу весь по меньшей мере один и обычно два вариабельных домена, в которых все или по существу все гипервариабельные области соответствуют таковым из последовательности не-кошачьего иммуноглобулина, и все или по существу все FR представляют собой таковые из последовательности кошачьего иммуноглобулина. Фелинизированное антитело возможно также будет содержать всю константную область иммуноглобулина (Fc) или по меньшей мере ее участок, обычно таковую из последовательности кошачьего иммуноглобулина.
Термин "гетерохимерный", как он определен в данном описании, относится к антителу, в котором одна из цепей антитела (тяжелая или легкая) является канинизированной, тогда как другая является химерной. На Фиг.5 изображено одно из воплощений гетерохимерной молекулы. В этом воплощении канинизированный вариабельный домен тяжелой цепи (где все CDR представляют собой мышиные CDR, а все FR представляют собой собачьи FR) представлены в паре с химерным вариабельным доменом легкой цепи (где все CDR представляют собой мышиные CDR, и все FR представляют собой мышиные FR). В этом воплощении и вариабельный домен тяжелой, и вариабельный домен легкой цепей слиты с константной областью собачьего Ig.
Термин "вариантное" антитело против IL-31 относится в данном описании к молекуле, которая имеет отличия в аминокислотной последовательности по сравнению с аминокислотной последовательностью "родительского " анти-IL-31 антитела, обусловленные добавлением, делецией и/или заменой одного или более чем одного аминокислотного остатка в последовательности родительского антитела, и сохраняет по меньшей мере одну желаемую активность родительского анти-IL-31 антитела. Желаемые активности могут включать способность специфически связываться с антигеном, способность снижать, ингибировать или нейтрализовать активность IL-31 у животного и способность ингибировать IL-31-опосредуемую pSTAT-передачу сигнала в анализе на основе клеток. В одном воплощении вариант содержит одну или более чем одну аминокислотную замену в одной или более чем одной гипервариабельной и/или каркасной области родительского антитела. Например, вариант может содержать по меньшей мере одну замену, например, от примерно одной до примерно десяти, и предпочтительно от примерно двух до примерно пяти, в одной или более чем одной гипервариабельной и/или каркасной области родительского антитела. Обыкновенно, вариант будет иметь аминокислотную последовательность, имеющую по меньшей мере 50%-ную идентичность аминокислотной последовательности с последовательностями вариабельных доменов тяжелой или легкой цепей родительского антитела, более предпочтительно по меньшей мере 65%-ную, более предпочтительно по меньшей мере 75%-ную, более предпочтительно по меньшей мере 80%-ную, более предпочтительно по меньшей мере 85%-ную, более предпочтительно по меньшей мере 90%-ную и наиболее предпочтительно по меньшей мере 95%-ную идентичность последовательности. Идентичность или гомология в отношении этой последовательности определяется в данном описании как процентная доля аминокислотных остатков в последовательности-кандидате, которые идентичны остаткам родительского антитела, после выравнивания последовательностей и внесения брешей, если необходимо, для достижения максимального процента идентичности последовательности. Ни одно из N-концевых, C-концевых или внутренних удлинений, делеций или вставок в последовательность антитела не следует истолковывать как влияющее на идентичность или гомологию последовательности. Вариант сохраняет способность связываться с IL-31 и предпочтительно обладает желаемыми активностями, превосходящими активности родительского антитела. Например, вариант может иметь более высокую аффинность связывания, улучшенную способность к снижению, ингибированию или нейтрализации активности IL-31 у животного, и/или улучшенную способность к ингибированию IL-31 - опосредуемой pSTAT-передачи сигнала в анализе на основе клеток.
Термин "вариантная" нуклеиновая кислота относится в данном описании к молекуле, которая имеет отличия в последовательности от "родительской" нуклеиновой кислоты. Несовпадение полинуклеотидных последовательностей может быть обусловлено мутационными изменениями, такими как делеций, замены или добавления одного или более чем одного нуклеотида. Каждое из этих изменений может происходить по отдельности или в комбинации один или более раз в заданной последовательности.
"Родительское" антитело в данном описании представляет собой антитело, которое кодируется аминокислотной последовательностью, используемой для получения варианта. Предпочтительно, родительское антитело имеет каркасную область собачьего Ig и, если она(они) присутствует(ют), имеет константную(ые) область(и) собачьего антитела. Например, родительское антитело может представлять собой канинизированное или собачье антитело. Как другой пример, родительское антитело может представлять собой фелинизированное или кошачье антитело. Как еще один пример, родительское антитело представляет собой мышиное моноклональное антитело.
Термин "выделенный" означает, что вещество (например, антитело или нуклеиновая кислота) отделено от компонента его природного окружения и/или извлечено из него. Загрязняющими компонентами его природного окружения являются вещества, которые будут мешать диагностическим или терапевтическим применениям данного вещества, и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. Что касается нуклеиновой кислоты, то выделенная нуклеиновая кислота может включать таковую, выделенную из 5′-3′-последовательностей, с которыми она обычно ассоциирована в хромосоме. В предпочтительных воплощениях данное вещество будет очищено до более чем 95% по массе этого вещества и наиболее предпочтительно до более чем 99% по массе. Выделенное вещество включает вещество in situ в рекомбинантных клетках, поскольку по меньшей мере один компонент природного окружения данного вещества не будет присутствовать. Обыкновенно, однако, выделенное вещество будет получено по меньшей мере одной стадией очистки.
Слово "метка", когда оно используется в данном описании, относится к обнаруживаемым соединению или композиции, которые конъюгированы непосредственно или опосредованно с антителом или нуклеиновой кислотой. Саму метку можно обнаруживать по ней самой (например, радиоизотопные метки или флуоресцентные метки), или, в случае ферментативной метки, она может катализировать химическое изменение являющихся субстратом соединения или композиции, которое можно обнаружить.
Термины "нуклеиновая кислота", "полинуклеотид", "молекула нуклеиновой кислоты" и им подобные в данном описании могут использоваться взаимозаменяемо и относятся к ряду нуклеотидных оснований (также называемых "нуклеотиды") в ДНК и РНК. Нуклеиновая кислота может содержать дезоксирибонуклеотиды, рибонуклеотиды и/или их аналоги. Термин "нуклеиновая кислота" включает, например, одноцепочечные и двухцепочечные молекулы. Нуклеиновой кислотой может быть, например, ген или фрагмент гена, экзоны, интроны, молекула ДНК (например кДНК), молекула РНК (например мРНК), рекомбинантные нуклеиновые кислоты, плазмиды и другие векторы, праймеры и зонды. Включены как 5′-3′- (смысловые), так и 3′-5′- (антисмысловые) полинуклеотиды.
"Субъект" или "пациент" относится к животному, нуждающемуся в лечении, на которое можно воздействовать молекулами по изобретению. Животные, которые могут быть подвергнуты лечению согласно изобретению, включают позвоночных, при этом особенно предпочтительными примерами являются такие млекопитающие, как животные семейства псовых, кошачьих и лошадиных.
"Терапевтически эффективное количество" (или "эффективное количество") относится к количеству активного ингредиента, например агента по изобретению, достаточному для достижения полезных или желаемых результатов при введении субъекту или пациенту. Эффективное количество можно вводить за одно или более чем одно введение, нанесение или в виде одной или более чем одной дозы. Терапевтически эффективное количество композиции по изобретению может быть легко определено средним специалистом в данной области. В контексте данного изобретения "терапевтически эффективное количество" представляет собой количество, которое вызывает объективно измеряемое изменение одного или более чем одного параметра, ассоциированного с лечением сопровождающегося зудом состояния или аллергического состояния, включая клиническое улучшение симптомов. Несомненно, терапевтически эффективное количество будет варьировать в зависимости от конкретного подвергаемого лечению субъекта и состояния, массы и возраста субъекта, тяжести болезненного состояния, конкретного выбранного соединения, схемы введения доз, которую необходимо соблюдать, хронометрирования введения, способа введения и тому подобного, причем все это может быть легко определено средним специалистом в данной области.
Использованный в данном описании термин "терапевтический" охватывает полный спектр лечений для заболевания или расстройства. Действие "терапевтического" агента по изобретению может быть профилактическим или превентивным, в том числе при использовании методик, предназначенных для целевых животных, которые можно определить как рискованные (фармакогенетика); или улучшающим или куративным по своей сути; или может приводить к уменьшению скорости или степени прогрессирования по меньшей мере одного симптома заболевания или расстройства, подвергаемого лечению.
Термины "лечение", "подвергание лечению" и им подобные относятся как к терапевтическому лечению, так и к профилактическим или превентивным мерам. Животные, нуждающиеся в лечении, включают животных, уже имеющих расстройство, а также тех, у которых такое расстройство должно быть предотвращено. Термин "лечение" или "подвергание лечению" заболевания или расстройства включает предотвращение или защиту от этого заболевания или расстройства (то есть, осуществление мер, не допускающих развития клинических симптомов); ингибирование заболевания или расстройства (т.е. задержка или подавление развития клинических симптомов); и/или смягчение заболевания или расстройства (т.е. осуществление мер, вызывающих регрессию клинических симптомов). Очевидно, что не всегда можно установить различие между "предотвращением" и "подавлением" заболевания или расстройства, поскольку основное(ые) вызывающее(ие) событие или события может/могут быть неизвестным(и) или скрытым(и). Соответственно, очевидно, что термин "профилактика" составляет тип "лечения", который охватывает как "предупреждение", так и "подавление". Таким образом, термин "лечение" включает "профилактику".
Термин "аллергическое состояние" определен в данном описании как расстройство или заболевание, вызываемое взаимодействием между иммунной системой и веществом, чужеродном организму. Это чужеродное вещество называют "аллергеном". Обычные аллергены включают аэроаллергены, такие как пыльца, пыль, плесени, белки пылевых клещей, слюна, впрыснутая с укусами насекомых и т.д. Примеры аллергических состояний включают, но не ограничиваются этим, следующее: аллергический дерматит, летнюю экзему, крапивницу, запал, воспалительное заболевание дыхательных путей, рецидивирующую обструкцию дыхательных путей, гиперреактивность дыхательных путей, хроническую обструктивную болезнь легких и воспалительные процессы, возникающие в результате аутоиммунной реакции, такие как синдром раздраженного кишечника (IBS).
Термин "сопровождающееся зудом состояние" определено в данном описании как заболевание или расстройство, характеризующееся интенсивным ощущением зуда, которое вызывает позыв к растиранию или расчесыванию кожи для получения облегчения. Примеры сопровождающихся зудом состояний включают, но не ограничиваются этим, следующее: атопический дерматит, экзему, псориаз, склеродермию и прурит.
Использованные в данном описании термины "клетка", "клеточная линия" и "клеточная культура" можно использовать взаимозаменяемо. Все эти термины также включают их потомство, которое представляет собой какое-либо и все последующие поколения. Понятно, что все потомство может не быть идентичным вследствие преднамеренных или случайных мутаций. Применительно к экспрессии гетерологичной последовательности нуклеиновой кислоты "клетка-хозяин" относится к прокариотической или эукариотической клетке (например бактериальным клеткам, клеткам дрожжей, клеткам млекопитающих и клеткам насекомых) независимо от того, локализованы они in vitro или in vivo. Например, клетки-хозяева могут быть локализованы в трансгенном животном. Клетка-хозяин может быть использована в качестве реципиента для векторов и может включать любой способный к трансформации организм, то есть способный реплицировать вектор и/или экспрессировать гетерологичную нуклеиновую кислоту, кодируемую вектором.
Подразумевается, что термин "композиция" означает комбинацию активного агента и других соединения или композиции, которые могут быть инертными (например метка) или активными, такими как адъювант.
Определенные в данном описании фармацевтически приемлемые носители, подходящие для применения в данном изобретении, хорошо известны специалистам в данной области. Такие носители включают, без ограничения, воду, физиологический раствор, забуференный физиологический раствор, фосфатный буфер, спиртовые/водные растворы, эмульсии или суспензии. Другие традиционно применяемые разбавители, адъюванты и эксципиенты могут быть добавлены согласно традиционным методам. Такие носители могут включать этанол, полиолы и подходящие их смеси, растительные масла и вводимые инъекцией органические сложные эфиры. Также можно использовать буферы и агенты, регулирующие рН. Буферы включают соли, полученные из органических кислоты или основания, но ими не ограничиваются. Типичные буферы включают, без ограничения, буферы на основе солей органических кислот, таких как соли лимонной кислоты, например цитраты, аскорбиновой кислоты, глюконовой кислоты, гистидина-HCl, угольной кислоты, винной кислоты, янтарной кислоты, уксусной кислоты или фталевой кислоты, Трис, трометамина гидрохлорида или фосфата. Парентеральные носители могут включать раствор хлорида натрия, декстрозу в растворе Рингера, декстрозу, трегалозу, сахарозу и хлорид натрия, лактированный раствор Рингера или нелетучие масла. Внутривенные носители могут включать жидкие и питательные наполнители, электролиты-наполнители, например, на основе декстрозы в растворе Рингера и им подобные. В фармацевтических носителях также могут присутствовать консерванты и другие вспомогательные вещества, такие как, например, антимикробные средства, антиоксиданты, хелатирующие агенты (например EDTA), инертные газы и тому подобное. Настоящее изобретение не ограничено этим выбором носителя. Изготовление таких фармацевтически приемлемых композиций из вышеописанных компонентов, имеющих подходящие рН, изотоничность, стабильность и другие традиционные характеристики, находится в компетенции специалиста в данной области. См., например, такие документы, как Remington: The Science and Practice of Pharmacy, 20th ed., Lippincott Williams & Wilkins, publ., 2000; и The Handbook of Pharmaceutical Excipients, 4th edit., eds. R.C. Rowe et al., APhA Publications, 2003.
Термин "консервативная аминокислотная замена" указывает на любую аминокислотную замену для заданного аминокислотного остатка, при которой замененный остаток настолько химически аналогичен заданному остатку, что это не вызывает никакого значительного ослабления функции полипептида (например ферментативной активности). Консервативные аминокислотные замены обычно известны в данной области техники и их примеры описаны, например, в патентах США №№6790639, 6774107, 6194167 или 5350576. В предпочтительном воплощении консервативная аминокислотная замена будет представлять собой любую замену, которая осуществляется в пределах одной из следующих шести групп:
- 1) небольшие алифатические, по существу неполярные остатки: Ala, Gly, Pro, Ser и Thr;
- 2) большие алифатические неполярные остатки: Ile, Leu и Val; Met;
- 3) полярные отрицательно заряженные остатки и их амиды: Asp и Glu;
- 4) амиды полярных отрицательно заряженных остатков: Asn и Gln; His;
- 5) полярные положительно заряженные остатки: Arg и Lys; His; и
- 6) большие ароматические остатки: Trp и Tyr; Phe.
В предпочтительном воплощении консервативная аминокислотная замена будет представлять собой любую замену из следующих, которые приведены в виде пар нативных остатков (консервативных замен): Ala (Ser); Arg (Lys); Asn (Gln; His); Asp (Glu); Gln (Asn); Glu (Asp); Gly (Pro); His (Asn; Gln); Ile (Leu; Val); Leu (Ile; Val); Lys (Arg; Gln; Glu); Met (Leu; Ile); Phe (Met; Leu; Tyr); Ser (Thr); Thr (Ser); Trp (Tyr); Tyr (Trp; Phe); и Val (Ile; Leu).
Подобно тому, как полипептид может содержать консервативную(ые) аминокислотную(ые) замену(ы), полинуклеотид по настоящему изобретению может содержать консервативную(ые) замену(ы) кодонов. Замена кодонов считается консервативной, если при экспрессии она дает консервативную аминокислотную замену, как она описана выше. Замена вырожденных кодонов, которая не приводит ни к какой аминокислотной замене, также полезна в полинуклеотидах по настоящему изобретению. Так, например, полинуклеотид, кодирующий выбранный полипептид, полезный в одном из воплощений настоящего изобретения, может быть подвергнут мутации путем замены вырожденных кодонов, чтобы приблизиться к частоте использования кодонов, показанной экспрессирующей клеткой-хозяином, которая должна быть им трансформирована, или чтобы иным образом улучшить его экспрессию.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Следует понимать, что данное изобретение не ограничено конкретными методологией, протоколами и реагентами и т.д., изложенными в данном описании, и которые, как таковые, могут варьировать. Терминология, использованная в данном описании, применяется только с целью описания конкретных воплощений и не предназначена для ограничения объема настоящего изобретения, который определен исключительно формулой изобретения.
Если не определено иное, научные и технические термины, использованные применительно к антителам, изложенным в данном описании, будут иметь значения, которые обычно понимаются средними специалистами в данной области. Кроме того, если по контексту не требуется иное, термины, использованные в единственном числе, будут подразумевать включение множественного числа, а термины во множественном числе будут включать в себя единственное число. В большинстве случаев, номенклатуры, использованные применительно к культивированию клеток и тканей, молекулярной биологии, химии белков и олиго- или полинуклеотидов и гибридизации, и методы, относящиеся ко всему перечисленному выше, изложенные в данном описании, представляют собой методы, хорошо известные и широко используемые в данной области.
Для работы с рекомбинантной ДНК, синтеза олигонуклеотидов, культивирования тканей и трансфекции используют стандартные методы (например электропорацию, липофекцию). Ферментативные реакции и методы очистки выполняют в соответствии с инструкциями изготовителя или их осуществляют как обычно принято в данной области либо как изложено в данном описании. Упомянутые выше методы и методики обычно осуществляют в соответствии с традиционными способами, хорошо известными в данной области, и как описано в различных общих и более специализированных ссылках, которые приводятся и обсуждаются по всему описанию настоящего изобретения. См., например, Sambrook et al. MOLECULAR CLONING: LAB. MANUAL (3rd ed., Cold Spring Harbor Lab. Press, Cold Spring Harbor, N.Y., 2001), и Ausubel et al., Current Protocols in Molecular Biology (New York: Greene Publishing Association/Wiley Interscience), 1993. Номенклатуры, использованные применительно к аналитической химии, синтетической органической химии и медицинской и фармацевтической химии, и лабораторные методики и методы, относящиеся ко всему перечисленному выше, изложенные в данном описании, являются хорошо известными и широко используемыми в данной области. Для проведения химических синтезов, химических анализов, получения, изготовления и доставки фармацевтических средств и лечения пациентов используют стандартные методы.
За исключением рабочих примеров или там, где не указано иное, следует понимать, что все числа, выражающие количества ингредиентов или реакционные условия, использованные в данном описании, во всех случаях скорректированы с использованием термина "примерно".
Все патенты и другие обнаруженные публикации явным образом включены в данное описание посредством ссылки с целью изложения и раскрытия, например, методологий, описанных в таких публикациях, которые могут быть использованы применительно к настоящему изобретению. Эти публикации приведены исключительно ввиду их раскрытия до даты подачи настоящей заявки.
Согласно настоящему изобретению предложены рекомбинантные моноклональные антитела и пептиды и их применения в клинических и научных методиках, включая диагностические методики.
С появлением методов молекулярной биологии и технологии рекомбинантной ДНК стало возможным получать молекулы антител и молекулы, подобные антителам, методами рекомбинантной ДНК и при этом создавать генетические последовательности, кодирующие специфические аминокислотные последовательности, обнаруженные в полипептидной структуре антител. Такие антитела могут быть получены либо посредством клонирования генетических последовательностей, кодирующих полипептидные цепи указанных антител, либо в результате непосредственного синтеза указанных полипептидных цепей со сборкой синтезированных цепей для образования активных тетрамерных (H2L2) структур с аффинностью к специфическим эпитопам и антигенным детерминантам. Это позволило легко осуществить получение антител, имеющих последовательности, характерные для нейтрализующих антител из разных видов и источников.
Независимо от источника антител или от того, получены ли они путем рекомбинантного конструирования либо путем синтеза, in vitro или in vivo, с использованием трансгенных животных, клеточных культур больших объемов лабораторного или промышленного масштаба, с использованием трансгенных растений, или путем прямого химического синтеза без применения живых организмов на любой стадии способа, все антитела имеют сходную общую пространственную структуру. Эту структуру часто приводят в виде H2L2, и это означает, что антитела обычно содержат две легкие (L) аминокислотные цепи и 2 тяжелые (Н) аминокислотные цепи. Обе цепи имеют области, способные взаимодействовать со структурно комплементарной антигенной мишенью. Области, взаимодействующие с мишенью, называют "вариабельными" или "V-областями и характеризуются различиями в аминокислотной последовательности у антител с разной антигенной специфичностью. Вариабельные области или Н-, или L-цепей содержат аминокислотные последовательности, способные к специфическому связыванию с антигенными мишенями.
Использованный в данном описании термин "антигенсвязывающая область" относится к тому участку молекулы антитела, который содержит аминокислотные остатки, взаимодействующие с антигеном и придающие антителу его специфичность и аффинность к антигену. Область связывания антитела содержит "каркасные" аминокислотные остатки, необходимые для поддержания надлежащей конформации антигенсвязывающих остатков.
В пределах вариабельных областей Н- или L-цепей, в которых предусматривается наличие антигенсвязывающих областей, имеются меньшие по размеру последовательности, получившие название "гипервариабельных" ввиду их чрезвычайной вариабельности среди антител с различной специфичностью. Такие гипервариабельные области также называются "определяющими комплементарность областями" или областями "CDR". Эти области CDR отвечают за основную специфичность антитела к структуре конкретной антигенной детерминанты.
CDR представляют собой несмежные участки аминокислот в пределах вариабельных областей, однако было обнаружено, что независимо от вида эти важные аминокислотные последовательности в пределах вариабельных областей тяжелой и легкой цепей имеют одинаковое расположение внутри аминокислотных последовательностей вариабельных доменов цепей. Каждый из вариабельных доменов тяжелой и легкой цепей у всех антител имеет три области CDR, каждая из которых является несмежной по отношению к другим.
У каждого вида млекопитающих пептиды антител содержат константные (т.е. высококонсервативные) и вариабельные области, и в последних имеются CDR и так называемые "каркасные области", составленные из аминокислотных последовательностей в пределах вариабельной области тяжелой или легкой цепи, но вне этих CDR.
Что касается антигенной детерминанты, распознаваемой областями CDR антитела, то она также именуется как "эпитоп". Другими словами, эпитоп относится к тому участку любой молекулы, который способно распознавать и с которым может связываться антитело (соответствующая область связывания антитела может быть названа паратопом).
"Антиген" представляет собой молекулу или участок молекулы, с которыми может связываться антитело, которые помимо этого способны побуждать животное продуцировать антитело, способное связываться с эпитопом этого антигена. Антиген может иметь один или более чем один эпитоп. Приведенная выше ссылка на специфичную реакцию указывает на то, что антиген будет взаимодействовать высокоселективным образом с соответствующим ему антителом, а не с множеством других антител, которые могут быть индуцированы другими антигенами.
Подразумевается, что термин "антитело" включает как интактные молекулы иммуноглобулинов, так и их участки, фрагменты, пептиды и производные, такие как, например, Fab, Fab′, F(ab′)2, Fv, Fse, области CDR, паратопы или любые участок или пептидная последовательность антитела, которые способны связываться с антигеном или эпитопом. Про антитело говорят, что оно "способно связываться" с молекулой, если оно способно специфически взаимодействовать с данной молекулой, посредством чего осуществляется связывание молекулы с антителом.
Антитело также включает химерные антитела, гетерохимерные антитела, канинизированные антитела или фелинизированные антитела, а также их фрагменты, участки, области, пептиды или производные, полученные любым известным методом, таким как, но не ограничиваясь этим, ферментативное расщепление, пептидный синтез или методы рекомбинантных ДНК. Такие антитела по настоящему изобретению способны специфически связываться по меньшей мере с одним из собачьего IL-31 или кошачьего IL-31. Фрагменты или участки антител могут не содержать Fc-фрагмента интактного антитела, более быстро выводиться из кровяного русла и могут обладать меньшим неспецифическим связыванием в тканях, чем интактное антитело. Примеры фрагментов антител можно получить из интактных антител, используя методы, хорошо известные в данной области, например путем протеолитического расщепления такими ферментами, как папаин (для получения Fab-фрагментов) или пепсин (для получения F(ab′)2-фрагментов). См., например, Wahl et al., 24, J. Nucl. Med., 316-25 (1983). Участки антител могут быть получены любым из упомянутых выше методов или могут быть получены путем экспрессии участка рекомбинантной молекулы. Например, область(и) CDR рекомбинантного антитела может(гут) быть выделена(ы) и субклонирована(ы) в подходящий экспрессирующий вектор. См., например, патент США №6680053.
Нуклеотидные и аминокислотные последовательности клонов 11Е12, 34D03 и 19D07
В некоторых воплощениях согласно настоящему изобретению предложены новые моноклональные антитела, которые специфически связываются по меньшей мере с одним из собачьего IL-31 или кошачьего IL-31. В одном из воплощений моноклональное антитело по изобретению связывается с собачьим IL-31 или кошачьим IL-31 и предотвращает его связывание со своим корецепторным комплексом, содержащим рецептор А IL-31 (IL-31Ra) и специфичный к онкостатину-М рецептор (OsmR или IL-31Rb), и активацию этого комплекса. Моноклональные антитела по настоящему изобретению идентифицированы в данном описании как "11Е12", "34D03" и "19D07", что относится к числу, присвоенному их гибридомному клону. В данном описании обозначение "11Е12", "34D03" или "19D07" также относится к участку моноклонального антитела, паратопу или CDR, которые специфически связываются с эпитопом IL-31, идентифицированным как 11Е12, 34D03 или 19D07 ввиду его способности связываться с антителами 11Е12, 34D03 или 19D07, соответственно. Различные рекомбинантные, химерные, гетерохимерные, канинизированные и/или фелинизированные формы 11Е12, 34D03 и 19D07, изложенные в данном описании, могут иметь то же самое название.
В одном из воплощений согласно настоящему изобретению предложено выделенное антитело или его антигенсвязывающий участок, содержащие по меньшей мере одно из следующего:
определяющую комплементарность область (CDR) 1 вариабельного домена тяжелой (VH) цепи, имеющую аминокислотную последовательность YYDIN (SEQ ID NO:1; 11E12-VH-CDR1), SYDMS (SEQ ID NO:2; 19D07-VH-CDR1) или NYGMS (SEQ ID NO:3; 34D03-VH-CDR1);
CDR2 вариабельного домена тяжелой цепи, имеющую аминокислотную последовательность WIFPGDGGTKYNETFKG (SEQ ID NO:4; 11E12-VH-CDR2), TITSGGGYTYSADSVKG (SEQ ID NO:5; 19D07-VH-CDR2) или TISYGGSYTYYPDNIKG (SEQ ID NO:6; 34D03-VH-CDR2);
CDR3 вариабельного домена тяжелой цепи, имеющую аминокислотную последовательность ARGGTSVIRDAMDY (SEQ ID NO:7; 11E12-VH-CDR3), ARQNWWGLAY (SEQ ID NO:8; 19D07-VH-CDR3) или VRGYGYDTMDY (SEQ ID NO:9; 34D03-VH-CDR3); и
их вариант, имеющий одну или более чем одну консервативную аминокислотную замену по меньшей мере в одной из CDR1, CDR2 или CDR3.
В другом воплощении согласно изобретению предложено выделенное антитело или его антигенсвязывающий участок, содержащие по меньшей мере одно из следующей группы:
вариабельный домен легкой (VL) цепи, содержащий определяющую комплементарность область (CDR) 1, имеющую аминокислотную последовательность RASESVDNYGISFMH (SEQ ID NO:10; 11E12-VL-CDR1), KSSQSLLNSGNQKNYLA (SEQ ID NO:11; 19D07-VL-CDR1) или KASQSVSFAGTGLMH (SEQ ID NO:12; 34D03-VL-CDR1);
CDR2 вариабельного домена легкой цепи, имеющую аминокислотную последовательность RASNLES (SEQ ID NO:13; 11E12-VL-CDR2), GASTRES (SEQ ID NO:14; 19D07-VL-CDR2) или RASNLEA (SEQ ID NO:15; 34D03-VL-CDR2);
CDR3 вариабельного домена легкой цепи, имеющую аминокислотную последовательность QQSNKDPLT (SEQ ID NO:16; 11E12-VL-CDR3), QNDYSYPYT (SEQ ID NO:17; 19D07-VL-CDR3) или QQSREYPWT (SEQ ID NO:18; 34D03-VL-CDR3); и
их вариант, имеющий одну или более чем одну консервативную аминокислотную замену по меньшей мере в одной из CDR1, CDR2 или CDR3.
В еще одном воплощении антитело, имеющее по меньшей мере одну из CDR вариабельного домена легкой цепи, описанных выше, может дополнительно содержать по меньшей мере одну из следующих CDR вариабельного домена тяжелой цепи:
определяющую комплементарность область (CDR) 1 вариабельного домена тяжелой цепи, имеющую аминокислотную последовательность YYDIN (SEQ ID NO:1; 11E12-VH-CDR1), SYDMS (SEQ ID NO:2; 19D07-VH-CDR1) или NYGMS (SEQ ID NO:3; 34D03-VH-CDR1);
CDR2 вариабельного домена тяжелой цепи, имеющую аминокислотную последовательность WIFPGDGGTKYNETFKG (SEQ ID NO:4; 11E12-VH-CDR2), TITSGGGYTYSADSVKG (SEQ ID NO:5; 19D07-VH-CDR2) или TISYGGSYTYYPDNIKG (SEQ ID NO:6; 34D03-VH-CDR2);
CDR3 вариабельного домена тяжелой цепи, имеющую аминокислотную последовательность ARGGTSVIRDAMDY (SEQ ID NO:7; 11E12-VH-CDR3), ARQNWWGLAY (SEQ ID NO:8; 19D07-VH-CDR3) или VRGYGYDTMDY (SEQ ID NO:9; 34D03-VH-CDR3); и
их вариант, имеющий одну или более чем одну консервативную аминокислотную замену по меньшей мере в одной из CDR1, CDR2 или CDR3.
В некоторых воплощениях антитело может содержать по меньшей мере одно из следующего:
а) вариабельный домен легкой цепи, содержащий

б) вариабельный домен тяжелой цепи, содержащий
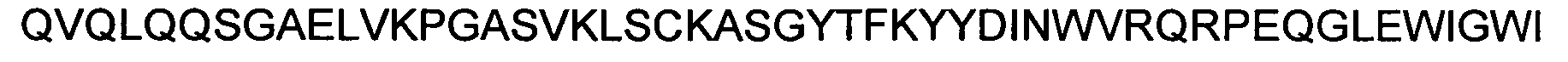

в) их варианты, имеющие одну или более чем одну консервативную аминокислотную замену.
В других воплощениях согласно изобретению предложена клетка-хозяин, которая продуцирует антитело, описанное выше.
Настоящее изобретение также включает, в пределах своего объема, нуклеотидные последовательности, кодирующие вариабельные области легкой и тяжелой цепей антитела против IL-31 по настоящему изобретению. В пределы объема изобретения также включена любая нуклеотидная последовательность, которая кодирует аминокислотную последовательность антител 11Е12, 34D03 или 19D07 или их пептидов.
В некоторых воплощениях согласно изобретению предложена выделенная нуклеиновая кислота, содержащая последовательность нуклеиновой кислоты, кодирующую по меньшей мере одно из следующего:
определяющую комплементарность область (CDR) 1 вариабельного домена тяжелой (VH) цепи, имеющую аминокислотную последовательность YYDIN (SEQ ID NO:1; 11E12-VH-CDR1), SYDMS (SEQ ID NO:2; 19D07-VH-CDR1) или NYGMS (SEQ ID NO:3; 34D03-VH-CDR1);
CDR2 вариабельного домена тяжелой цепи, имеющую аминокислотную последовательность WIFPGDGGTKYNETFKG (SEQ ID NO:4; 11E12-VH-CDR2), TITSGGGYTYSADSVKG (SEQ ID NO:5; 19D07-VH-CDR2) или TISYGGSYTYYPDNIKG (SEQ ID NO:6; 34D03-VH-CDR2);
CDR3 вариабельного домена тяжелой цепи, имеющую аминокислотную последовательность ARGGTSVIRDAMDY (SEQ ID NO:7; 11E12-VH-CDR3), ARQNWWGLAY (SEQ ID NO:8; 19D07-VH-CDR3) или VRGYGYDTMDY (SEQ ID NO:9; 34D03-VH-CDR3); и
их вариант, имеющий одну или более чем одну консервативную аминокислотную замену по меньшей мере в одной из CDR1, CDR2 или CDR3.
В других воплощениях выделенная нуклеиновая кислота, описанная выше, может дополнительно содержать последовательность нуклеиновой кислоты, кодирующую по меньшей мере одно из следующего:
вариабельный домен легкой (VL) цепи, содержащий определяющую комплементарность область (CDR) 1, имеющую аминокислотную последовательность RASESVDNYGISFMH (SEQ ID NO:10; 11E12-VL-CDR1), KSSQSLLNSGNQKNYLA (SEQ ID NO:11; 19D07-VL-CDR1) или KASQSVSFAGTGLMH (SEQ ID NO:12; 34D03-VL-CDR1);
CDR2 вариабельного домена легкой цепи, имеющую аминокислотную последовательность RASNLES (SEQ ID NO:13; 11E12-VL-CDR2), GASTRES (SEQ ID NO:14; 19D07-VL-CDR2) или RASNLEA (SEQ ID NO:15; 34D03-VL-CDR2);
CDR3 вариабельного домена легкой цепи, имеющую аминокислотную последовательность QQSNKDPLT (SEQ ID NO:16; 11E12-VL-CDR3), QNDYSYPYT (SEQ ID NO:17; 19D07-VL-CDR3) или QQSREYPWT (SEQ ID NO:18; 34D03-VL-CDR3); и
их вариант, имеющий одну или более чем одну консервативную аминокислотную замену по меньшей мере в одной из CDR1, CDR2 или CDR3.
Согласно настоящему изобретению также предложен вектор, содержащий по меньшей мере одну из нуклеиновых кислот, описанных выше.
Поскольку генетический код является вырожденным, то для кодирования конкретной аминокислоты может быть использован более чем один кодон. Используя генетический код, можно идентифицировать одну или более разных нуклеотидных последовательностей, каждая из которых будет способна кодировать данную аминокислоту. Вероятность того, что конкретный олигонуклеотид действительно будет составлять конкретную кодирующую последовательность XXX, можно оценить с учетом соотношений аномальных спариваний оснований и частоты, с которой конкретный кодон фактически используется (для кодирования конкретной аминокислоты) в эукариотических или прокариотических клетках, экспрессирующих антитело против IL-31 или участок. Такие "правила использования кодонов" описаны в Lathe et al., 183, J. Molec. Biol. 1-12 (1985). Применяя "правила использования кодонов" Lathe можно идентифицировать одиночную нуклеотидную последовательность или набор нуклеотидных последовательностей, содержащие теоретически "наиболее вероятную" нуклеотидную последовательность, способную кодировать последовательности антитела против IL-31.
Кроме этого подразумевается, что области, кодирующие антитело, для применения в настоящем изобретении, также могут быть получены путем изменения генов существующих антител с использованием стандартных методов молекулярной биологии, приводящих к получению вариантов (агонистов) антител и пептидов, изложенных в данном описании. Такие варианты содержат, но не ограничиваются этим, делеции, вставки и замены в аминокислотной последовательности антител или пептидов против IL-31.
Например, один класс замен представляют собой консервативные аминокислотные замены. Такими заменами являются замены, в результате которых заданную аминокислоту в пептиде антитела против IL-31 заменяют другой аминокислотой с похожими характеристиками. Обычно в качестве консервативных замен рассматриваются замены по типу одна на другую среди алифатических аминокислот Ala, Val, Leu и Ile, взаимозамена гидроксильных остатков Ser и Thr, перестановка кислотных остатков Asp и Glu, замена между амидными остатками Asn и Gin, перестановка основных остатков Lys и Arg, замены среди ароматических остатков Phe, Tyr и им подобные замены. Руководство, касающееся того, какие аминокислотные замены вероятно будут фенотипически молчащими, находится в Bowie et al., 247, Science, 1306-10 (1990).
Вариант или агонист антител или пептидов против IL-31 может быть полностью функциональным или у него может отсутствовать один или более чем один вид функциональной активности. Полностью функциональные варианты обычно содержат только консервативные вариации или вариации в некритичных остатках или в некритичных областях. Функциональные варианты также могут содержать замену схожих аминокислот, которая не вызывает никакого изменения или приводит к незначительному изменению функции. Альтернативно, такие замены могут до некоторой степени положительно или отрицательно воздействовать на функцию. Нефункциональные варианты обычно содержат одну или более чем одну неконсервативную аминокислотную замену, делецию, вставку, инверсию или укорочение либо замену, вставку, инверсию или делецию в критичном остатке или критичной области.
Аминокислоты, которые являются существенными для функционирования, можно идентифицировать методами, известными в данной области, такими как сайт-направленный мутагенез или аланин-сканирующий мутагенез. Cunningham et al., 244, Science, 1081-85 (1989). С использованием последней методики вводят одиночные мутации с заменой на аланин в каждый остаток в молекуле. Полученные мутантные молекулы затем тестируют на биологическую активность, такую как связывание с эпитопом или ADCC-активность in vitro. Сайты, критичные для связывания лиганд-рецептор, также можно определить структурным анализом, таким как кристаллография, ядерный магнитный резонанс или фотоаффинное мечение. Smith et al., 224, J. Mol. Biol., 899-904 (1992); de Vos et al., 255, Science, 306-12 (1992).
Помимо того, полипептиды часто содержат аминокислоты, отличающиеся от двадцати "природных" аминокислот. Кроме того, многие аминокислоты, включая концевые аминокислоты, могут подвергаться модификации в результате протекания природных процессов, таких как процессинг и другие посттрансляционые модификации, или в результате применения методов химической модификации, хорошо известных в данной области. Известные модификации включают, но не ограничиваются этим, ацетилирование, ацилирование, АДФ-рибозилирование, амидирование, ковалентное присоединение флавина, ковалентное присоединение группировки гема, ковалентное присоединение нуклеотида или нуклеотидного производного, ковалентное присоединение липида или липидного производного, ковалентное присоединение фосфатидилинозита, поперечное сшивание, циклизацию, образование дисульфидных связей, деметилирование, образование ковалентных поперечных связей, образование цистина, образование пироглутамата, формилирование, гамма-карбоксилирование, гликозилирование, образование якоря GPI (гликозилфосфатидилинозит), гидроксилирование, йодирование, метилирование, миристоилирование, окисление, протеолитическую обработку, фосфорилирование, пренилирование, рацемизацию, селеноилирование, сульфатирование, опосредуемое транспортной РНК добавление аминокислот к белкам, такое как аргинилирование, и убиквитинилирование.
Такие модификации хорошо известны специалистам в данной области и описаны очень подробно в научной литературе. Некоторые особенно распространенные модификации, гликозилирование, присоединение липидов, сульфатирование, гамма-карбоксилирование остатков глутаминовой кислоты, гидроксилирование и АДФ-рибозилирование, описаны, например, в большинстве основных документов, таких как Proteins - Structure and Molecular Properties (2nd ed., T. E. Creighton, W.H. Freeman & Co., NY, 1993). По этой теме доступны многие обзоры, такие как Wold, Posttranslational Covalent Modification of proteins, 1-12 (Johnson, ed., Academic Press, NY, 1983); Seifter et al., 182, Meth. Enzymol. 626-46 (1990); и Rattan et al., 663, Ann. NY Acad. Sci., 48-62 (1992).
Соответственно, антитела и пептиды по настоящему изобретению также охватывают производные или аналоги, в которых замененный аминокислотный остаток не является остатком, кодируемым генетическим кодом.
Аналогично, добавления и замены в аминокислотной последовательности, а также вариации и модификации, только что описанные, в равной степени могут быть применимы к аминокислотной последовательности антигена и/или эпитопа IL-31 или их пептидов, и таким образом, они охвачены настоящим изобретением. Как упомянуто выше, гены, кодирующие моноклональное антитело по настоящему изобретению, особенно эффективны в распознавании IL-31.
Производные антител
В объем данного изобретения включены производные антител. "Производное" антитела содержит дополнительные химические группировки, в норме не являющиеся частью белка. Ковалентные модификации белка включены в объем данного изобретения. Такие модификации могут быть введены в молекулу в результате взаимодействия целевых аминокислотных остатков антитела с органическим дериватизирующим агентом, способным к взаимодействию с выбранными боковыми цепями или концевыми остатками. Например, дериватизация с использованием бифункциональных агентов, хорошо известных в данной области, полезна для перекрестного сшивания антитела или фрагмента с нерастворимой в воде матрицей-подложкой или с другими макромолекулярными носителями.
Производные также включают меченные радиоактивной меткой моноклональные антитела, которые метят, например, радиоактивным йодом (125I, 131I), углеродом (14C), серой (35S), индием (111In), тритием (3H) или тому подобным; конъюгаты моноклональных антител с биотином или авидином, с такими ферментами, как пероксидаза хрена, щелочная фосфатаза, бета-D-галактозидаза, глюкозооксидаза, глюкоамилаза, карбоангидраза, ацетилхолинэстераза, лизоцим, малатдегидрогеназа или глюкозо-6-фосфатдегидрогеназа; и также конъюгаты моноклональных антител с биолюминесцентными агентами (такими как люцифераза), хемолюминесцентными агентами (такими как сложные эфиры акридина) или флуоресцентными агентами (такими как фикобилипротеины).
Другое производное бифункциональное антитело по настоящему изобретению представляет собой биспецифичное антитело, полученное комбинированием частей двух отдельных антител, распознающих две разные антигенные группы. Этого можно достичь перекрестным сшиванием или технологиями рекомбинантной ДНК. Кроме того, к антителу или его участку могут быть добавлены группировки для увеличения полупериода существования in vivo (например, путем увеличения времени выведения из кровотока). Такие методы включают, например, добавление группировок ПЭГ (полиэтиленгликоль) (также называемое пэгилированием) и хорошо известны в данной области. См. публикацию патентной заявки США №20030031671.
Рекомбинантная экспрессия антител
В некоторых воплощениях нуклеиновые кислоты, кодирующие исследуемое моноклинальное антитело, вводят непосредственно в клетку хозяина и эту клетку инкубируют в условиях, достаточных для индукции экспрессии кодируемого антитела. После введения в клетку исследуемых нуклеиновых кислот эту клетку в типичном случае инкубируют обычно при 37°С, иногда в условиях селекции, в течение примерно 1-24 часов, чтобы обеспечить осуществление экспрессии антитела. В одном из воплощений антитело секретируется в супернатант сред, в которых эта клетка растет.
Традиционно моноклональные антитела получают в виде нативных молекул в мышиных гибридомных линиях. Помимо этой технологии, согласно настоящему изобретению предложена экспрессия рекомбинантной ДНК моноклональных антител. Это позволяет получать канинизированные и фелинизированные антитела, а также спектр производных от антител и слитые белки в выбранном виде хозяина.
Последовательность нуклеиновой кислоты, кодирующая по меньшей мере одно антитело против IL-31, участок или полипептид по настоящему изобретению, может быть рекомбинирована с ДНК вектора в соответствии с традиционными методами, включающими применение тупых или "ступенчатых" концов для лигирования, переваривание рестрикционными ферментами с получением подходящих концов, при необходимости достройку липких концов, обработку щелочной фосфатазой, чтобы избежать нежелательного присоединения, и лигирование подходящими лигазами. Методы для осуществления таких манипуляций описаны, например, в Maniatis et al., MOLECULAR CLONING, LAB. MANUAL (Cold Spring Harbor Lab. Press, NY, 1982 и 1989) и Ausubel и др., 1993, выше, и могут быть использованы для конструирования последовательностей нуклеиновой кислоты, кодирующих молекулу моноклонального антитела или его антигенсвязывающую область.
О молекуле нуклеиновой кислоты, такой как ДНК, говорят, что она "способна экспрессировать" полипептид, если она содержит нуклеотидные последовательности, содержащие информацию о регуляции транскрипции и трансляции, и такие последовательности "функционально связаны" с нуклеотидными последовательностями, которые кодируют данный полипептид. Функциональная связь представляет собой связь, посредством которой регуляторные последовательности ДНК и последовательность ДНК, экспрессию которой необходимо провести, соединены таким образом, что это позволяет осуществлять генную экспрессию в виде пептидов или участков антитела против IL-31 в количествах, поддающихся извлечению. Точная природа регуляторных областей, необходимых для генной экспрессии, может варьировать от организма к организму, как хорошо известно в аналогичной области техники. См., например, Sambrook и др., 2001, выше; Ausubel и др., 1993, выше.
Соответственно, настоящее изобретение охватывает экспрессию антитела или пептида против IL-31 либо в прокариотических, либо в эукариотических клетках. Подходящие хозяева включают бактериальных или эукариотических хозяев, в том числе бактерии, дрожжи, насекомые, грибы, клетки птиц и млекопитающих, либо in vivo, либо in situ, или клетки хозяина, происходящие из млекопитающего, насекомого, птицы или дрожжей. Клетка или ткань млекопитающего может происходить из человека, примата, хомяка, кролика, грызуна, коровы, свиньи, овцы, лошади, козы, собаки или кошки, но может быть использована клетка любого другого млекопитающего.
В одном из воплощений, введенная нуклеотидная последовательность будет встроена в плазмидный или вирусный вектор, способный автономно реплицироваться в хозяине-реципиенте. Для этой цели может быть использован любой из большого разнообразия векторов. См., например, Ausubel и др., 1993, выше. Важные факторы при выборе конкретного плазмидного или вирусного вектора включают: простоту, с которой реципиентные клетки, содержащие данный вектор, могут быть распознаны и отобраны среди тех реципиентных клеток, которые не содержат этого вектора; количество копий вектора, которое необходимо для конкретного хозяина; и, когда это желательно, возможность осуществления "челночного" перемещения вектора между клетками хозяина разных видов.
Типичные прокариотические векторы, известные в данной области, включают плазмиды, такие как плазмиды, способные к репликации в E. coli (такие как, например, pBR322, ColE1, pSC101, pACYC 184, .pi.VX). Такие плазмиды описаны, например, в Maniatis и др., 1989, выше; Ausubel и др., 1993, выше. Бациллярные плазмиды включают рС194, рС221, рТ127 и т.д. Такие плазмиды описаны Gryczan в THE MOLEC. BIO. OF THE BACILLI, 307-329 (Academic Press, NY, 1982). Подходящие плазмиды для стрептомицетов включают pIJ101 (Kendall et al., 169, J. Bacteriol., 4177-83 (1987)) и бактериофаги для стрептомицетов, такие как φС31 (Chater и др. в SIXTH INT′L SYMPOSIUM ON ACTINOMYCETALES BIO. 45-54 (Akademiai Kaido, Budapest, Hungary 1986)). Обзор по плазмидам для псевдомонад приведен в John et al., 8, Rev. Infect. Dis., 693-704 (1986); Izaki, 33, Jpn. J. Bacteriol., 729-42 (1978); и Ausubel и др., 1993, выше.
Альтернативно, элементы генной экспрессии, полезные для экспрессии кДНК, кодирующей антитела или пептиды против IL-31, включают, но не ограничиваются этим, (а) вирусные промоторы транскрипции и их энхансерные элементы, такие как ранний промотор SV40 (Okayama et al., 3, Mol. Cell. Biol., 280 (1983)), LTR (длинные концевые повторы) вируса саркомы Рауса (German et al., 79, Proc. Natl. Acad. Sci., USA, 6777 (1982)) и LTR вируса мышиного лейкоза Молони (Grosschedl et al., 41, Cell, 885 (1985)); (б) области сплайсинга и сайты полиаденилирования, как например таковые, происходящие из поздней области генома SV40 (Okayarea и др., 1983), и (в) сайты полиаденилирования, такие как в SV40 (Okayama и др., 1983).
кДНК генов иммуноглобулинов может быть экспрессирована, как описано в Weidle et al., 51, Gene, 21 (1987), с использованием в качестве элементов экспрессии раннего промотора SV40 и его энхансера, энхансеров промотора Н-цепи мышиного иммуноглобулина, областей сплайсинга мРНК поздней области генома SV40, интрона S-глобина кролика, сайтов полиаденилирования иммуноглобулина и S-глобина кролика и элементов полиаденилирования SV40.
Для генов иммуноглобулинов, состоящих частично из кДНК, частично из геномной ДНК (Whittle et al., 1, Protein Engin., 499 (1987)), транскрипционным промотором может быть промотор цитомегаловируса человека, энхансерами промотора могут быть энхансеры цитомегаловируса и мышиного/человеческого иммуноглобулина, а областями сплайсинга мРНК и полиаденилирования могут быть природные хромосомные последовательности иммуноглобулинов.
В одном из воплощений для экспрессии кДНК генов в клетках грызунов транскрипционным промотором является последовательность вирусных LTR, энхансерами транскрипционного промотора являются один из двух или оба энхансера: энхансер тяжелой цепи мышиного иммуноглобулина и энхансер вирусных LTR, область сплайсинга содержит интрон размером более 31 п.о., а области полиаденилирования и терминации транскрипции происходят из природной хромосомной последовательности, соответствующей синтезируемой иммуноглобулиновой цепи. В других воплощениях последовательности кДНК, кодирующие другие белки, объединяют с перечисленными выше элементами экспрессии для осуществления экспрессии белков в клетках млекопитающих.
Каждый слитый ген может быть собран в экспрессирующем векторе или встроен в него. Реципиентные клетки, способные экспрессировать продукт гена химерной иммуноглобулиновой цепи, затем трансфицируют по отдельности геном, кодирующим анти-IL-31 пептид или химерную Н- либо химерную L-цепь, или совместно трансфицируют геном химерной Н- и химерной L-цепей. Трансфицированные реципиентные клетки культивируют в условиях, которые позволяют осуществить экспрессию встроенных генов, и из этой культуры извлекают экспрессированные иммуноглобулиновые цепи или интактные антитела или фрагменты.
В одном из воплощений слитые гены, кодирующие анти-IL-31 пептид или химерные Н- и L-цепи или их части, собирают в отдельных экспрессирующих векторах, которые далее используют для совместной трансфекции реципиентной клетки. Альтернативно, слитые гены, кодирующие химерные Н- и L-цепи, могут быть собраны в одном и том же экспрессирующем векторе.
Чтобы осуществить трансфекцию экспрессирующими векторами и получить химерное антитело, линия реципиентных клеток может представлять собой линию миеломных клеток. Миеломные клетки могут синтезировать, осуществлять сборку и секретировать иммуноглобулины, кодируемые используемыми для трансфекции генами иммуноглобулинов, и могут обладать механизмом гликозилирования иммуноглобулина. Миеломные клетки могут расти в культуре или в брюшной полости мыши, откуда секретированный иммуноглобулин может быть получен из асцитной жидкости. Другие подходящие реципиентные клетки включают лимфоидные клетки, такие как В-лимфоциты человеческого или нечеловеческого происхождения, гибридомные клетки человеческого или нечеловеческого происхождения или межвидовые гетерогибридомные клетки.
Экспрессирующий вектор, несущий химерную, канинизированную или фелинизированную конструкцию антитела или анти-IL-31 полипептид по настоящему изобретению, можно ввести в подходящую клетку хозяина любым из целого ряда подходящих способов, включая такие биохимические способы, как трансформация, трансфекция, конъюгирование, слияние протопластов, осаждение фосфатом кальция и применение поликатионов, таких как диэтиламиноэтил(DEAE)-декстран, и такие механические способы как электропорация, прямая микроинъекция и бомбардировка микрочастицами. Johnston et al., 240, Science, 1538 (1988).
Дрожжи могут дать значительные преимущества над бактериями в отношении получения Н- и L-цепей иммуноглобулинов. В дрожжах протекают посттрансляционые модификации пептидов, включая гликозилирование. В настоящее время имеется целый ряд стратегий рекомбинантной ДНК, в которых применяются последовательности сильных промоторов и высококопийные плазмиды, которые можно использовать для получения желаемых белков в дрожжах. Дрожжи распознают лидерные последовательности клонированных продуктов генов млекопитающих и секретируют пептиды, несущие лидерные последовательности (т.е. препептиды). Hitzman et al., 11th Int′l Conference on Yeast, Genetics & Molec. Biol. (Montpelier, France, 1982).
Системы генной экспрессии дрожжей можно оценить по стандартной методике на предмет уровней продуцирования, секреции и стабильности анти-IL-31 пептидов, антитела и собраных мышиных и химерных, гетерохимерных, канинизированных или фелинизированных антител, их фрагментов и областей. Может быть использована любая из ряда систем генной экспрессии дрожжей, включающая промотор и элементы терминации от активно экспрессирующихся генов, кодирующих гликолитические ферменты, продуцируемые в больших количествах тогда, когда дрожжи растят в средах, богатых глюкозой. Известные гены гликолитических ферментов также могут обуславливать очень эффективные сигналы контроля транскрипции. Например, можно использовать сигналы промотора и терминатора гена фосфоглицераткиназы (PGK). Для оценки экспрессирующих плазмид, оптимальных для экспрессии клонированных кДНК иммуноглобулина в дрожжах, можно применить ряд подходов. См. Vol. II DNA Cloning, 45-66 (Glover, ed.), IRL Press, Oxford, UK 1985.
Бактериальные штаммы также можно использовать в качестве хозяев для получения молекул антител или пептидов, описанных в данном изобретении. Вместе с этими бактериальными хозяевами используют плазмидные векторы, содержащие репликон и контрольные последовательности, происходящие из видов, совместимых с клеткой хозяина. Вектор несет сайт репликации, а также специфические гены, способные обеспечить проведение фенотипической селекции трансформированных клеток. Ряд подходов можно применить для оценки экспрессирующих плазмид в отношении получения мышиных, химерных, гетерохимерных, канинизированных или фелинизированных антител, фрагментов и областей или цепей антител, кодируемых клонированными кДНК иммуноглобулинов в бактериях (см. Glover, 1985, выше; Ausubel, 1993, выше; Sambrook, 2001, выше; Colligan et al., eds. Current Protocols in Immunology, John Wiley & Sons, NY, NY (1994-2001); Colligan et al., eds. Current Protocols in Protein Science, John Wiley & Sons, NY, NY (1997-2001)).
Клетки хозяев млекопитающих могут расти in vitro или in vivo. Клетки млекопитающих обеспечивают протекание посттрансляционных модификаций белковых молекул иммуноглобулинов, включая удаление лидерного пептида, фолдинг и сборку Н- и L-цепей, гликозилирование молекул антител и секрецию функционального белка антитела.
Клетки млекопитающих, которые могут быть полезны в качестве хозяев для получения белков антитела, помимо клеток лимфоидного происхождения, описанных выше, включают клетки, происходящие из фибробластов, такие как клетки Vero (ATCC CRL 81) или СНО-K1 (АТСС CRL 61).
Многие векторные системы доступны для экспрессии клонированных генов Н- и L-цепей анти-IL-31 пептидов в клетках млекопитающих (см. Glover, 1985, выше). Для получения полноразмерных антител H2L2 можно следовать разным подходам. Для достижения внутриклеточной ассоциации и объединения Н- и L-цепей в полноразмерные тетрамерные антитела H2L2 и/или анти-IL-31 пептиды можно осуществить совместную экспрессию Н- и L-цепей в одних и тех же клетках. Совместная экспрессия может быть осуществлена с применением или одной и той же, или разных плазмид в одном и том же хозяине. Гены для обеих Н- и L-цепей и/или анти-IL-31 пептидов могут быть помещены в одну и ту же плазмиду, которой далее трансфицируют клетки, непосредственно отбирая при этом клетки, которые экспрессируют обе цепи. Альтернативно, сначала можно осуществить трансфекцию клеток плазмидой, кодирующей одну цепь, например L-цепь, затем провести трансфекцию полученной клеточной линии, используя несущую Н-цепь плазмиду, содержащую второй селектируемый маркер. Клеточные линии, продуцирующие анти-IL-31 пептиды и/или молекулы H2L2 посредством одного из этих двух путей, могут быть трансфицированы плазмидами, кодирующими дополнительные копии пептидов, Н-, L- или Н плюс L-цепей вместе с дополнительными селектируемыми маркерами, для создания клеточных линий с улучшенными свойствами, такими как более высокий уровень продуцирования собранных H2L2 молекул антител или повышенная стабильность трансфицированных клеточных линий.
Для долговременного получения рекомбинантных антител с высоким выходом можно использовать стабильную экспрессию. Например, можно сконструировать клеточные линии, стабильно экспрессирующие молекулу антитела. Вместо использования экспрессирующих векторов, которые содержат вирусные ориджины репликации, клетки хозяина могут быть трансформированы экспрессирующими иммуноглобулины кассетами и селектируемым маркером. После введения чужеродной ДНК сконструированные клетки можно оставить расти в течение 1-2 суток на обогащенных средах и затем перевести на селективные среды. Селектируемый маркер в рекомбинантной плазмиде придает устойчивость к селекции и дает возможность клеткам стабильно интегрировать плазмиду в хромосому и расти с образованием центров, которые в свою очередь могут быть клонированы и размножены в клеточные линии. Такие сконструированные клеточные линии могут быть особенно полезны в скрининге и оценке соединений/компонентов, которые непосредственно или опосредованно взаимодействуют с молекулой антитела.
Как только антитело по изобретению получено, оно может быть подвергнуто очистке любым способом, известным в данной области для очистки молекулы иммуноглобулинов, например хроматографией (например ионообменной, аффинной, в частности, с аффинностью к специфическому антигену после очистки на основе белка А, и колоночной хроматографией с разделением по размеру), центрифугированием, способом на основе разницы в растворимости или любым другим стандартным методом, применяемым для очистки белков. Во многих воплощениях антитела секретируются из клетки в культуральную среду, и их собирают из культуральной среды.
Фармацевтические применения
Анти-IL-31 антитела или пептиды по настоящему изобретению могут быть использованы, например, в лечении сопровождающихся зудом и/или аллергических состояний у домашних животных, таких как собаки и кошки. Более конкретно, согласно изобретению также предложена фармацевтическая композиция, содержащая фармацевтически приемлемый носитель или разбавитель и, в качестве активного ингредиента, антитело или пептид по изобретению. Антитело может представлять собой химерное, гетерохимерное, канинизированное или фелинизированное антитело по настоящему изобретению. Также предусматриваются интактные иммуноглобулины или их связывающие фрагменты, такие как Fab. Антитело и на его основе фармацевтические композиции по данному изобретению полезны для парентерального введения, например подкожно, внутримышечно или внутривенно.
Анти-IL-31 антитела и/или пептиды по настоящему изобретению можно вводить или в виде отдельных терапевтических агентов, или в комбинации с другими терапевтическими агентами. Их можно вводить по отдельности, но как правило их вводят с фармацевтическим носителем, выбранным исходя из намеченного пути введения и стандартной фармацевтической практики.
Введение антител, изложенных в данном описании, может быть осуществлено любым подходящим способом, включая парентеральную инъекцию (такую как внутрибрюшинная, подкожная или внутримышечная инъекция), перорально или посредством местного введения антител (в типичном случае содержащихся в фармацевтической композиции) на поверхность дыхательных путей. Местное введение на поверхность дыхательных путей может быть осуществлено путем интраназального введения (например посредством применения капельницы, тампона или ингалятора). Местное введение антител на поверхность дыхательных путей может быть осуществлено посредством ингаляционного введения, например путем образования аэрозольной суспензии пригодных для вдыхания частиц фармацевтической композиции (включая как твердые частицы, так и частицы жидкости), содержащей антитела, и после этого инициации вдыхания субъектом этих пригодных для вдыхания частиц. Методы и устройство для введения пригодных для вдыхания частиц фармацевтических композиций хорошо известны, и можно применить любой традиционный метод. Пероральное применение может быть предписано, например, в форме, подходящей для проглатывания жидкой или твердой композиции.
В некоторых желаемых воплощениях антитела вводят парентеральной инъекцией. Что касается парентерального введения, то анти-IL-31 антитела или пептиды могут быть приготовлены в виде раствора, суспензии, эмульсии или лиофилизированного порошка вместе с фармацевтически приемлемым парентеральным наполнителем. Например, наполнитель может представлять собой раствор антитела или его смесь, растворенные в приемлемом носителе, таком как водный носитель; такими наполнителями являются вода, физиологический раствор, раствор Рингера, раствор декстрозы, раствор трегалозы или сахарозы, или 5%-ный сывороточный альбумин, 0,4%-ный физиологический раствор, 0,3%-ный глицин и им подобные. Также можно использовать липосомы и неводные наполнители, такие как нелетучие масла. Эти растворы являются стерильными и, как правило, не содержат твердых частиц. Эти композиции могут быть подвергнуты стерилизации традиционными, хорошо известными методами стерилизации. Композиции могут содержать фармацевтически приемлемые вспомогательные вещества, которые необходимы для приближения к физиологическим условиям, такие как регулирующие рН агенты и буферные агенты, агенты для корректировки токсичности и им подобные, например ацетат натрия, хлорид натрия, хлорид калия, хлорид кальция, лактат натрия и т.д. Концентрация антитела в этих композициях может варьировать в широких пределах, например от менее чем примерно 0,5%, обычно от 1% или по меньшей мере примерно 1% до 15% или 20% по массе, и будет выбрана в первую очередь с учетом объемов жидкостей, значений вязкости и т.д. в соответствии с конкретно выбранным способом введения. Наполнитель или лиофилизированный порошок может содержать вспомогательные вещества, которые поддерживают изотоничность (например хлорид натрия, маннит) и химическую стабильность (например буферы и консерванты). Композицию стерилизуют общепринятыми методами.
Существующие способы получения парентерально вводимых композиций будут известны или очевидны специалистам в данной области и описаны более подробно, например, в REMINGTON′S PHARMA. SCI. (15th ed., Mack Pub. Co., Easton, Pa., 1980).
Антитела по данному изобретению могут быть лиофилизированы с целью хранения и последующего разведения в подходящем носителе перед применением. Показано, что этот метод эффективен при использовании традиционных иммунноглобулинов. Можно использовать любые подходящие методы лиофилизации и повторного разведения. Специалистам в данной области будет очевидно, что лиофилизация и повторное разведение могут привести к потере активности антител в различной степени и что уровни при применении должны быть по возможности скорректированы, чтобы компенсировать этот факт.
Композиции, содержащие антитела по настоящему изобретению или их смесь, можно вводить для предупреждения рецидива и/или для терапевтических лечений существующего заболевания. Подходящие фармацевтические носители описаны в самом последнем издании REMINGTON′S PHARMACEUTICAL SCIENCES, стандартном документе, на который дается ссылка в данной области техники.
При терапевтическом применении композиции вводят субъекту, уже страдающему от заболевания, в количестве, достаточном для лечения или по меньшей мере частичного подавления или облегчения заболевания и его осложнений. Количество, приемлемое для такого осуществления, определяют как "терапевтически эффективная доза" или "терапевтически эффективное количество". Количества, эффективные для этого применения, будут зависеть от тяжести заболевания и общего состояния собственной иммунной системы субъекта, но обычно находятся в диапазоне от примерно 0,1 мг антитела на кг массы тела до примерно 10 мг антитела на кг массы тела, предпочтительно от примерно 0,3 мг антитела на кг массы тела до примерно 5 мг антитела на кг массы тела. Ввиду минимального содержания посторонних веществ и уменьшения вероятности отторжений "чужеродного вещества", что достигается в результате присутствия антител по данному изобретению, подобных антителам собак и кошек, имеется возможность вводить значительные избытки этих антител.
Вводимая дозировка, несомненно, будет варьировать в зависимости от известных факторов, таких как фармакодинамические характеристики конкретного агента и способ, и путь его введения; возраст, состояние здоровья и масса реципиента; характер и выраженность симптомов сопутствующего лечения, частота лечения и желаемый эффект.
Как неограничивающий пример, лечение IL-31-связанных патологий у собак или кошек может быть проведено путем введения анти-IL-31 антител по настоящему изобретению в режиме одного раза в две недели или одного раза в месяц в описанном выше диапазоне дозировок.
Примерами антител для терапевтического применения на собаках или кошках являются высокоаффинные (они также могут иметь высокую авидность) антитела и их фрагменты, области и производные, имеющие согласно настоящему изобретению высокую анти-IL-31 активность in vivo.
Могут быть выполнены однократные или многократные введения композиций, при этом уровень дозы и схему выбирает лечащий ветеринар. В любом случае фармацевтические композиции должны обеспечить поступление такого количества антител по данному изобретению, которое достаточно для эффективного лечения субъекта.
Диагностические применения
Согласно настоящему изобретению также предложены вышеупомянутые антитела и пептиды против IL-31 для применения в диагностических способах для обнаружения IL-31 у домашних животных, имеющих или предположительно имеющих сопровождающееся зудом и/или аллергическое состояние.
Анти-11-31 антитела и/или пептиды по настоящему изобретению полезны для иммуноанализов, в которых осуществляют обнаружение или количественное определение IL-31 или анти-IL-31 антител в образце. Иммуноанализ для IL-31 обычно включает инкубирование клинического или биологического образца в присутствии меченого с возможностью обнаружения высокоаффинного (или высокоавидного) антитела или полипептида против IL-31 по настоящему изобретению, способного избирательно связываться с IL-31, и обнаружение меченого пептида или антитела, которые связываются в образце. Различные методики клинических анализов хорошо известны в данной области. См., например, IMMUNOASSAYS FOR THE 80′S (Voller et al., eds., Univ. Park, 1981). Такие образцы включают полученные биопсией образцы ткани, образцы крови, сыворотки и кала или жидкости, отобранные у субъектов-животных и подвергнутые анализу с использованием ELISA, как описано ниже.
В некоторых воплощениях обнаружение связывания антигена с антителом проводят без применения твердой подложки. Например, обнаружение связывания антигена с антителом может быть проведено в формате жидкости.
В других воплощениях антитело или полипептид против IL-31 могут быть фиксированы, например, на нитроцеллюлозной или другой твердой подложке, на которой может быть проведена иммобилизация клеток, клеточных частиц или растворимых белков. Затем подложку можно промыть подходящими буферами, после чего обработать меченным с возможностью обнаружения IL-31-специфическим пептидом или антителом. Затем твердофазную подложку можно промыть буфером второй раз для удаления несвязавшегося пептида или антитела. Далее количество связанной метки на твердой подложке можно определить с использованием стадий известного способа.
"Твердофазная подложка" или "носитель" относится к подложке, обладающей способностью связывать пептид, антиген или антитело. Хорошо известные подложки или носители включают стекло, полистирол, полипропилен, полиэтилен, поливинилиденфторид (PVDF), декстран, нейлон, амилозы, природные и модифицированные целлюлозы, полиакриламиды, агарозы и магнетит. Для задач настоящего изобретения носитель по своей природе может быть либо растворимым до некоторой степени, либо нерастворимым. Материал подложки может иметь практически любую возможную структурную конфигурацию при условии, что присоединенная к нему молекула способна связываться с IL-31 или антителом против IL-31. Так, конфигурация подложки может быть сферической, как у шарика, или цилиндрической, как у внутренней поверхности пробирки или внешней поверхности стержня. Альтернативно, поверхность может быть плоской, такая как у листа, чашки для культивирования, тест-полоски и т.д. Например, подложки могут включать полистирольные шарики. Специалистам в данной области будут известны многие другие подходящие носители для связывания антитела, пептида или антигена, или их можно определить путем рутинного экспериментирования.
Используя хорошо известные стадии способа, можно определить активность связывания анти-IL-31 пептида и/или антитела из заданной серии. Специалисты в данной области техники могут определить рабочие и оптимальные условия проведения анализа путем рутинного экспериментирования.
Мечение IL-31-специфического пептида и/или антитела с возможностью обнаружения может быть осуществлено посредством связывания его с ферментом для применения в иммуноферментном анализе (EIA) или твердофазном иммуноферментном анализе (ELISA). Связанный фермент взаимодействует с доступным субстратом так, что образуется химическая группировка, обнаружение которой можно осуществить, например, спектрофотометрическими, флуориметрическими или визуальными средствами. Ферменты, которые могут быть использованы для того, чтобы пометить IL-31-специфические антитела по настоящему изобретению с возможностью обнаружения, включают, но не ограничиваются этим, малатдегидрогеназу, стафилококковую нуклеазу, дельта-5-стероид-изомеразу, дрожжевую алкогольдегидрогеназу, альфа-глицерофосфатдегидрогеназу, триозофосфатизомеразу, пероксидазу хрена, щелочную фосфатазу, аспарагиназу, глюкозооксидазу, бета-галактозидазу, рибонуклеазу, уреазу, каталазу, глюкозо-6-фосфатдегидрогеназу, глюкоамилазу и ацетилхолинэстеразу.
С помощью меченных радиоактивной меткой IL-31-специфических антител можно осуществить обнаружение IL-31, используя радиоиммуноанализ (RIA). См. Work et al., LAB. TECHNIQUES & BIOCHEM. IN MOLEC. Bio. (No. Holland Pub. Co., NY, 1978). Обнаружение радиоактивного изотопа можно осуществить, используя такие средства, как счетчик гамма-излучения или сцинтилляционный счетчик, или используя авторадиографию. Изотопы, которые являются особенно полезными для задачи настоящего изобретения, включают: 3H, 125I, 131I, 35S, 14C и 125I.
Можно также пометить IL-31-специфические антитела с помощью флуоресцентного соединения. Если меченное флуоресцентной меткой антитело подвергают воздействию света соответствующей длины волны, то его присутствие затем можно зарегистрировать по флуоресценции. Среди наиболее часто используемых для мечения флуоресцентных соединений можно назвать изотиоцианат флуоресцеина, родамин, фикоэритрин, фикоцианин, аллофикоцианин, о-фталевый альдегид и флуорескамин.
IL-31-специфические антитела также могут быть помечены с возможностью обнаружения с использованием испускающих флуоресцентное излучение металлов, таких как 125Eu или другие металлы из семейства лантанидов. Эти металлы могут быть присоединены к IL-31-специфическому антителу с использованием таких хелатирующих металлы групп, как диэтилентриаминпентауксусная кислота (DTPA) или этилендиаминтетрауксусная кислота (EDTA).
IL-31-специфические антитела также могут быть помечены с возможностью обнаружения в результате сочетания с хемилюминесцентным соединением. Присутствие меченного хемилюминесцентной меткой антитела затем определяют, осуществляя обнаружение наличия люминесценции, которая возникает при протекании химической реакции. Примерами полезных соединений для хемилюминесцентного мечения являются люминол, изолюминол, тероматический (theromatic) сложный эфир акридиния, имидазол, соль акридиния и сложный эфир щавелевой кислоты.
Аналогично, для мечения IL-31-специфического антитела, участка, фрагмента, полипептида или производного по настоящему изобретению можно использовать биолюминесцентное соединение. Биолюминесценция является разновидностью хемилюминесценции, обнаруженной в биологических системах, в которых каталитически активный белок увеличивает эффективность хемилюминесцентной реакции. Присутствие биолюминесцентного белка определяют, детектируя появление люминесценции. Важными биолюминесцентными соединениями, используемыми для введения метки, являются люциферин, люцифераза и экворин.
Обнаружение IL-31-специфического антитела, участка, фрагмента, полипептида или производного можно осуществить с использованием сцинтилляционного счетчика, например, если обнаруживаемая метка представляет собой радиоактивный гамма-излучатель, или с использованием флуориметра, например, если метка представляет собой флуоресцентное вещество. В случае ферментативной метки обнаружение можно осуществить колориметрическими методами, в которых применяют субстрат для данного фермента. Обнаружение также можно осуществить путем визуального сравнения степени протекания ферментативной реакции с субстратом относительно аналогичным образом приготовленных стандартов.
Для задач настоящего изобретения IL-31, обнаружение которого осуществляют в указанных выше анализах, может быть представлен в биологическом образце. Можно использовать любой образец, содержащий IL-31. Например, таким образцом является биологическая жидкость, такая как, например, кровь, сыворотка, лимфа, моча, кал, воспалительные экссудаты, цереброспинальная жидкость, амниотическая жидкость, экстракт или гомогенат ткани и тому подобное. Данное изобретение не ограничено анализами, в которых используются только эти образцы, однако, средний специалист в данной области, в соответствии с настоящим описанием, сможет определить подходящие условия, при которых возможно использование других образцов.
Обнаружение in situ можно провести путем извлечения гистологического образца у являющегося животным субъекта и введения комбинации меченых антител по настоящему изобретению в такой образец. Антитело (или его участок) может быть введено путем нанесения или наложения меченого антитела (или участка) на биологический образец. Посредством применения такой методики становится возможным определить не только присутствие IL-31, но и распределение IL-31 в исследуемой ткани. Используя настоящее изобретение, средние специалисты легко поймут, что любые из большого разнообразия гистологических методов (такие как методики окрашивания) могут быть модифицированы для осуществления такого обнаружения in situ.
Антитело, фрагмент или производное по настоящему изобретению могут быть адаптированы для использования в иммунометрическом анализе, известном также как "двухсайтный" или "сэндвич"-анализ. В типичном иммунометрическом анализе некоторое количество немеченого антитела (или фрагмента антитела) связывают с твердой подложкой, которая не растворима в жидкости, подлежащей тестированию, и добавляют некоторое количество меченного с возможностью обнаружения растворимого антитела, чтобы осуществить обнаружение и/или количественное определение тройного комплекса, образованного между антителом на твердой фазе, антигеном и меченым антителом.
Антитела можно использовать для количественного или качественного определения IL-31 в образце или для обнаружения наличия клеток, экспрессирующих IL-31. Это может быть выполнено иммунофлуоресцентными методами, в которых используется меченное флуоресцентной меткой антитело (см. ниже) в сочетании с флуоресцентной микроскопией, проточной цитометрической или флуориметрическим обнаружением. Для диагностических целей антитела могут быть или мечеными, или немечеными. Немеченые антитела можно использовать в комбинации с другими мечеными антителами (вторичными антителами), способными взаимодействовать с антителом, такими как антитела, обладающие специфичностью к константным областям собачьего или кошачьего иммуноглобулина. Альтернативно, антитела могут быть мечеными напрямую. Можно использовать большое разнообразие меток, таких как радионуклиды, флуоресцирующие агенты, ферменты, субстраты ферментов, кофакторы ферментов, ингибиторы ферментов, лиганды (в частности, гаптены) и т.д. Многочисленные типы иммуноанализов, как например рассмотренные ранее, доступны и хорошо известны специалистам в данной области.
В одном из воплощений диагностическим способом обнаружения IL-31 является тест, в котором используется латеральный проточный иммуноанализ. Он также известен как иммунохроматографический анализ, быстрая иммуномиграция (RIM™) или анализ на тест-полосках. Латеральные проточные иммуноанализы по существу представляют собой иммуноанализы, адаптированные для проведения вдоль одной оси в соответствии с форматом тест-полосок. Разработан целый ряд вариантов данной технологии, реализуемой в имеющихся в продаже продуктах, но все они работают по одному и тому же основному принципу. Типичная тест-полоска состоит из следующих компонентов: (1) зона для образца - абсорбирующая зона, на которую наносится тестируемый образец; (2) зона для конъюгата или реагента - она содержит антитела, специфичные к целевому аналиту, конъюгированные с окрашенными частицами (обычно частицами коллоидного золота или латексными микросферами); (3) мембрана для проведения реакции - в типичном случае мембрана из гидрофобной нитроцеллюлозы или ацетата целлюлозы, на которой иммобилизованы антитела против целевого аналита, по одной линии поперек мембраны в качестве зоны захвата или тест-линии (также может присутствовать контрольная зона, содержащая антитела, специфичные к конъюгированным антителам); и (4) тампон или резервуар для отходов - еще одна абсорбирующая зона, предназначенная для перемещения образца по мембране для проведения реакции под действием капиллярных сил и его сбора. Как правило, компоненты полоски фиксируют на инертном материале подложки, и они могут быть представлены в формате простой тест-полоски или в пластиковом корпусе с отверстием для образца и реакционным окном, показывающим зону захвата и контрольную зону.
Существуют два основных типа латерального проточного иммуноанализа, используемые в микробиологическом тестировании: сэндвич-анализы с двумя антителами и конкурентные анализы. В формате сэндвич-анализа с двумя антителами образец мигрирует из зоны для образца через зону для конъюгата, где любой присутствующий в образце целевой аналит будет связываться с конъюгатом. Образец продолжает мигрировать далее по мембране, пока не достигнет зоны захвата, где комплекс мишень/конъюгат будет связываться с иммобилизованными антителами, образуя видимую линию на мембране. Образец мигрирует еще дальше вдоль полоски, пока не достигнет контрольной зоны, где избыток конъюгата будет связываться и образовывать вторую видимую линию на мембране. Эта контрольная линия указывает на то, что образец мигрировал по мембране, как планировалось. Две отчетливые линии на мембране указывают на положительный результат. Наличие одной линии в контрольной зоне указывает на отрицательный результат. Конкурентные анализы отличаются от формата сэндвич-анализа с двумя антителами тем, что зона для конъюгата содержит антитела, которые уже связаны с целевым аналитом или с его аналогом. Если в образце присутствует целевой аналит, то вследствие этого он не будет связываться с конъюгатом и будет оставаться немеченым. После того, как образец переместится вдоль мембраны и достигнет зоны захвата, избыток немеченого аналита будет связываться с иммобилизованными антителами и блокировать захват конъюгата, поэтому никакой видимой линии не образуется. Несвязанный конъюгат затем будет связываться с антителами в контрольной зоне, образуя видимую контрольную линию. Единственная контрольная линия на мембране указывает на положительный результат. Две видимые линии в зоне захвата и контрольной зоне указывают на отрицательный результат. Однако, если избытка немеченого целевого аналита нет, в зоне захвата может образоваться слабая линия, что указывает на неопределенный результат. Имеется целый ряд вариантов латеральной проточной технологии. В зависимости от целевого аналита зона захвата на мембране может содержать иммобилизованные антигены или ферменты, а не антитела. Также возможно использование многочисленных зон захвата для проведения множественного тестирования. Например, были разработаны доступные для приобретения тест-полоски, с помощью которых можно обнаруживать оба шига-токсина ЕНЕС ST1 и ST2 по отдельности в одном и том же образце.
Важно, что антитела по настоящему изобретению могут быть полезны в диагностике зуда и/или аллергии у собак или кошек. Более конкретно, с использованием антитела по настоящему изобретению можно идентифицировать сверхэкспрессию IL-31 у домашних животных. Таким образом, антитело по настоящему изобретению может представлять важное иммуногистохимическое средство.
Антитела по настоящему изобретению можно использовать в микрочипах с антителами, исключительно подходящих для определения профилей генной экспрессии.
Наборы
В объем настоящего изобретения также включены наборы для применения на практике способов, являющихся объектом изобретения. Наборы содержат по меньшей мере одно или более чем одно антитело по настоящему изобретению, нуклеиновую кислоту, кодирующую то же самое, или клетку, содержащую то же самое. В одном из воплощений антитело по настоящему изобретению может быть предложено в контейнере, обычно в лиофилизированной форме. Антитела, которые могут быть конъюгированными с меткой или токсином или быть неконъюгированными, в типичном случае включают в наборы вместе с буферами, такими как Трис, фосфатный, карбонатный и т.д., стабилизаторами, биоцидами, инертными белками, например сывороточным альбумином, или тому подобным. Как правило, эти вещества будут присутствовать в количестве менее 5 масс.% из расчета на количество активного антитела, и обычно их общее количество составляет по меньшей мере примерно 0,001 масс.% опять из расчета на концентрацию антитела. Зачастую будет желательно включить инертный наполнитель или эксципиент для разведения активных ингредиентов, при этом эксципиент может присутствовать в количестве от примерно 1% до 99 масс.%. от всей композиции. Если в анализе используется вторичное антитело, способное связываться с первичным антителом, то обычно оно будет находиться в отдельном флаконе. Вторичное антитело, как правило, конъюгировано с меткой и приготовлено аналогично композициям антител, описанным выше. Обычно в набор также будет включен комплект инструкций по применению.
В одном из воплощений набор по настоящему изобретению представляет собой набор тест-полосок (набор для латерального проточного иммуноанализа), полезный для обнаружения белка собачьего или кошачьего IL-31 в образце. Такая тест-полоска в типичном случае будет включать зону для образца, на которую наносится тестируемый образец; зону для конъюгата или реагента, содержащую антитело, специфичное к собачьему или кошачьему IL-31, при этом антитело конъюгировано с окрашенными частицами (обычно частицами коллоидного золота); мембрану для проведения реакции, на которой иммобилизованы антитела против IL-31 по одной линии поперек мембраны в качестве зоны захвата или тест-линии (также может присутствовать контрольная зона, содержащая антитела, специфичные к конъюгированным антителам); и еще одну абсорбирующую зону, предназначенную для перемещения образца по мембране для проведения реакции под действием капиллярных сил и его сбора. Обычно набор тест-полосок также будет включать инструкции по применению.
Теперь данное изобретение будет описано далее в приведенных ниже неограничивающих примерах.
ПРИМЕРЫ
Пример 1. Идентификация мышиных моноклинальных антител, распознающих собачий интерлейкин 31 (IL-31)
Рекомбинантный собачий IL-31 создавали в клетках СНО (яичника китайского хомячка), используя систему АСЕ (экспрессии искусственных хромосом) CHROMOS (Chromos Molecular Systems, Inc., Burnaby, British Columbia) для синтеза секретируемого белка IL-31 собаки, имеющего последовательность SEQ ID NO:32. Этот белок кодируется нуклеотидной последовательностью SEQ ID NO:33. Готовили кондиционированную среду из 400 мл клеточной культуры (клеточная линия СНО) и диализовали против 10 объемов QA-буфера (20 мМ Трис рН 8,0; 20 мМ NaCl) в течение 4,5 часа. Диализованную среду фильтровали (0,2 мкм) и загружали при скорости 1 мл/мин на колонку SOURSE™ Q (GE Healthcare, Uppsala, Sweden), предварительно уравновешенную QA-буфером. Белок элюировали, используя многоступенчатый линейный градиент. Большая часть IL-31 оставалась в проточной фракции (FT), небольшое количество IL-31 элюировали в начале градиента. Идентичность белка была подтверждена ранее вестерн-иммуноблоттингом и масс-спектрометрическим (MS) анализом триптического перевара. Белок в FT-фракции концентрировали в 4-5 раз и диализовали в течение ночи против забуференного фосфатом физиологического раствора (PBS) при 4°С. Стабильность белка проверяли после диализа в PBS. Не наблюдали никакого выпадения осадка и никакого протеолиза через несколько суток выдерживания при 4°С. После проведения экспериментов по дегликозилированию с использованием N-гликозидазы F получали белок, уплотненный в одну зону, соответствующую ~15 кДа по данным SDS-PAGE. Концентрацию белка определяли, используя анализ на основе бицинхониновой кислоты (ВСА-анализ) с бычьим сывороточным альбумином (BSA) в качестве стандарта (ThermoFisher Scientific, Inc., Rockford, IL). Раствор белка разделяли на аликвоты, быстро замораживали (жидкий N2) и хранили при -80°С.
Мышиные моноклональные антитела идентифицировали, используя стандартные иммунизации самок мышей CF-1 рекомбинантным собачьим IL-31, выработанном в клетках СНО. Титры от иммунизированных мышей определяли, используя твердофазный иммуноферментный анализ (ELISA). Собачий IL-31 (50 нг/лунка) иммобилизовали на полистирольных микропланшетах и использовали в качестве антигена захвата. Сыворотку от иммунизированных мышей разбавляли в забуференном фосфатом физиологическом растворе с 0,05% твина-20 (PBST). Обнаружение присутствия мышиных антител против собачьего IL-31 осуществляли, используя конъюгированное с пероксидазой хрена (HRP) вторичное анти-мышиное антитело козы (Kirkegard & Perry Laboratories, Inc. (KPL, Inc.), Gaithersburg, MD). После добавления хромогенного субстрата (SureBlue Reserve TMB 1-Component Microwell Peroxidase Substrate, KPL, Inc., Gaithersburg, MD) и десяти минут инкубирования при комнатной температуре (КТ) реакцию останавливали, добавляя 100 мкл 0,1 н. HCl. Поглощение в каждой лунке определяли по оптической плотности (OD) при 450 нм. На Фиг.6 суммированы результаты антительного ответа отдельных мышей, иммунизированных собачьим IL-31. Пул донорных спленоцитов от мышей 3 и 4 использовали для слияния. После проведения слияния и скрининга на предмет связывания с IL-31 посредством прямого ELISA отбирали 100 лунок для размножения и вторичного скрининга по анти-IL-31 активности. Результаты вторичного скрининга подтвердили, что 81 слитая конструкция сохраняла способность продуцировать антитела против IL-31. Замороженные клеточные массы и супернатанты этих 81 кандидата хранили для дальнейшей оценки.
Чтобы идентифицировать кандидатов с ингибирующей активностью, все 81 супернатант оценивали по их способности воздействовать на IL-31-опосредованную pSTAT-передачу сигнала в анализе на основе клеток. В этом анализе на основе клеток измеряют pSTAT-передачу сигнала в моноцитарных клетках DH-82 собак, предварительно обработанных в течение 24 часов собачьим гамма-интерфероном (R&D Systems, Minneapolis, MN) в концентрации 10 нг/мл, и истощенной сывороткой в течение 2 часов перед обработкой IL-31 для усиления экспрессии рецептора IL-31. После такой предварительной обработки добавляют рекомбинантный собачий IL-31 в концентрации 1 мкг/мл в течение 5 минут и оценивают фосфорилирование STAT, используя технологию Alpha Screen (Perkin Elmer, Waltham, MA). Поскольку концентрации и чистота антител в супернатантах гибридом неизвестны, проводили качественное определение способности этих супернатантов ингибировать фосфорилирование STAT через 1 час после совместного инкубирования с IL-31 (1 мкг/мл), используя разведения супернатантов 1:2 или 1:20. В этом эксперименте идентифицирован 31 супернатант, ингибирующий фосфорилирование STAT более чем на 50% по сравнению с необработанными лунками, что явилось основанием для проведения очистки и последующего определения характеристик.
После очистки и количественной оценки каждого моноклонального антитела (mAb) оценивали величины IC50 для всех 31 антитела в анализе с применением клеток DH-82. Основываясь на полученных значениях IC50 и данных конкурентного ELISA для определения классов антител на основании семейств эпитопов (epitope bins), три описанные в Таблице 1 антитела, 11Е12, 19D07 и 34D03, были выдвинуты для дальнейшего исследования.
|
Пример 2. Последовательности ДНК. кодирующие антитела 11Е12, 19D07 и 34D03
Рибонуклеиновую кислоту (РНК) выделяли из гибридомных клеток 11Е12, 19D07 и 34D03, используя мининабор Rneasy (Qiagen, Inc., Germantown, MD), как описано производителем. Один миллион замороженных клеток каждой гибридомы собирали центрифугированием и РНК очищали из клеточных лизатов, используя спин-колонку Rneasy согласно способу, описанному в протоколе. РНК элюировали с каждой колонки и незамедлительно использовали для количественного определения и приготовления кДНК. РНК анализировали в отношении выхода и чистоты путем измерения поглощения ею при 260 нм и 280 нм, используя спектрофотометр GeneQuant pro (GE Healthcare, Uppsala, Sweden). После выделения оставшуюся РНК хранили при -80°С для дальнейшего применения.
Олигонуклеотидные праймеры, сконструированные для амплификации вариабельных доменов мышиного иммуноглобулина (Ig), использовали в соответствии с инструкциями производителя (EMD Chemicals, Inc., Gibbstown, NJ). Получали кДНК из общей гибридомной РНК посредством обратной транскрипции (RT), используя набор ThermoScript RT (Invitrogen Corp., Carlsbad, CA) в соответствии с инструкциями производителя. По 200-400 нг РНК из каждой гибридомы добавляли в отдельную реакционную пробирку, содержащую 3′-праймер для константной области Ig. Данный 3′-праймер для константного домена Ig располагается проксимально по отношению к вариабельной области Ig, и с его участием будет происходить транскрипция первой цепи кДНК, соответствующей вариабельной области мышиного антитела. Для каждой гибридомной РНК проводили индивидуальную реакцию RT, используя 3′-праймер для константного домена тяжелой цепи и 3′-праймер для константного домена легкой каппа-цепи.
кДНК из каждой гибридомы использовали в качестве матрицы в полимеразной цепной реакции (ПЦР) для амплификации кДНК вариабельного домена тяжелой цепи и легкой каппа-цепи IgG с целью определения последовательности. Для каждой ПЦР-пробы проводили множественные реакции с использованием вырожденного 5′-праймера или пулов праймеров, сконструированных для отжига с областями, кодирующими сигнальную последовательность вариабельного домена мышиного Ig. Отдельные ПЦР-реакции проводили с использованием вырожденного праймера или пулов праймеров для амплификации вариабельных областей тяжелой и легкой цепей Ig мыши (Фиг.7). ПЦР проводили для 1 мкл кДНК-содержащей реакционной смеси, используя набор с ДНК-полимеразой Expand High Fidelity (Roche Diagnostics Corp., Indianapolis, IN) согласно протоколу производителя. Для ПЦР устанавливали следующие параметры термоциклирования: 94°С в течение 2 мин, 35 циклов (94°С/15 с, 55°С/30 с, 72°С/1 мин), 72°С/7 мин. Фрагменты, амплифицированные при ПЦР, разделяли гель-электрофорезом в 1%-ном агарозном геле и очищали, используя набор для экстракции из геля от Qiagen (Qiagen, Inc., Germantown, MD). Прямые праймеры для вариабельной области тяжелой и легкой цепей содержат сайты EcoRI или Sall (New England Biolabs (NEB), Inc., Ipswich, MA), а обратные праймеры для вариабельного домена тяжелой и легкой цепей - сайт HindIII (NEB Inc., Ipswich, MA) для облегчения клонирования в плазмиду pUC19. Очищенные ПЦР-фрагменты и плазмиду pUC19 подвергали перевариванию указанными выше эндонуклеазами рестрикции при 37°С в течение 1-2 ч. После переваривания ПЦР-фрагменты очищали, используя набор для очистки Qiaquick PCR (Qiagen, Inc., Germantown, MD). Переваренную плазмиду разделяли гель-электрофорезом в 1%-ном агарозном геле и очищали, используя набор для экстракции из геля от Qiagen. Очищенные ПЦР-фрагменты, представляющие собой ДНК вариабельных доменов тяжелой цепи и легкой каппа-цепи IgG, лигировали в плазмиду pUC19, используя Т4 ДНК-лигазу и буфер для лигирования (NEB, Inc., Ipswich, MA), при 4°С в течение ночи. По 3 мкл каждой реакционной смеси после лигирования использовали для трансформации клеток E. coli ТОР10 (Invitrogen Corp., Carlsbad, CA).
Плазмиды выделяли из положительных клонов каждой гибридомы, презентирующих вариабельные области, используя набор Qiagen Miniprep (Qiagen 27106) в соответствии с протоколом производителя. Чтобы амплифицировать последовательность ДНК для каждой клонированной вставки, использовали прямой и обратный праймеры М13, применяя набор для реакции секвенирования BigDye (Applied Biosystems в лице Life Technologies Corp., Carlsbad, CA) в соответствии с протоколом производителя. Реакционные смеси после секвенирования очищали, используя набор для очистки на 96-луночных планшетах (Zymo Research, Irvine, CA) в соответствии с протоколом производителя. Образцы загружали в капиллярный секвенатор ABI-3730 и полученные записи последовательностей анализировали с использованием Sequencher (GeneCodes v. 4.2) на предмет наличия полных открытых рамок считывания. Последовательности вариабельных доменов мышиных антител против собачьего IL-31, определенные для каждого антитела, являются следующими: вариабельный домен легкой цепи 11Е12 (MU-11E12-VL с SEQ ID NO:19, соответствующей нуклеотидной последовательностью для которой является SEQ ID NO:34); вариабельный домен тяжелой цепи 11Е12 (MU-11E12-VH с SEQ ID NO:26, соответствующей нуклеотидной последовательностью для которой является SEQ ID NO:35); вариабельный домен легкой цепи 19D07 (MU-19D07-VL с SEQ ID NO:22, соответствующей нуклеотидной последовательностью для которой является SEQ ID NO:36); вариабельный домен тяжелой цепи 19D07 (MU-19D07-VH с SEQ ID NO:28, соответствующей нуклеотидной последовательностью для которой является SEQ ID NO:37); вариабельный домен легкой цепи 34D03 (MU-34D03-VL с SEQ ID NO:24, соответствующей нуклеотидной последовательностью для которой является SEQ ID NO:38) и вариабельный домен тяжелой цепи 34D03 (MU-34D03-VH с SEQ ID NO:30, соответствующей нуклеотидной последовательностью для которой является SEQ ID NO:39).
Для подтверждения правильности последовательности кДНК, соответствующей вариабельным доменам тяжелой и легкой цепей каждого антитела, проводили анализ N-концевой последовательности на очищенном белке mAb, используя деградацию по Эдману, на газофазном белковом секвенаторе модели 494, Applied Biosystems. Ниже в Таблице 2 приведены подтверждающие данные для последовательностей вариабельного домена легкой цепи для антител 11Е12 и 34D03 и последовательности вариабельного домена тяжелой цепи для 34D03. По данным трансляции последовательности кДНК было определено, что N-концевой аминокислотой вариабельного домена тяжелой цепи для антитела 11Е12 является глутамин. Глутамин в качестве аминоконцевого остатка белка может спонтанно подвергаться циклизации до пироглутаминовой кислоты, препятствуя определению последовательности с использованием деградации по Эдману (Chelius et al., Anal. Chem., 2006, 78(7):2370-6).
|
|
Пример 3. Конструирование химерных антител 11Е12, 19D07 и 34D03
Как описано выше, антитела представляют собой гомодимер, образующийся при спаривании двух гетеродимерных белков. Каждая белковая цепь (одна тяжелая и одна легкая) гетеродимера состоит из вариабельного домена и константного домена. Каждый вариабельный домен содержит три определяющих комплементарность области (CDR), вносящих вклад в связывание с антигеном. CDR разделены в вариабельном домене каркасными областями, которые обеспечивают наличие остова для надлежащего пространственного представления сайтов связывания антитела. Совместно CDR и каркасные области вносят вклад в способность антител связывать свой родственный антиген (Фиг.2).
Как также описано выше, химерное антитело состоит из последовательности вариабельного домена (как CDR, так и каркаса) мышиного антитела (по данным приведенного выше анализа последовательности), привитой на соответствующие константные области тяжелой и легкой цепей молекулы собачьего IgG (Фиг.3). Поскольку вариабельный домен отвечает за связывание с антигеном, ожидается, что привитие целиком мышиного вариабельного домена на константную область собачьего IgG окажет небольшое воздействие или не окажет никакого воздействия на способность антитела связываться с иммуногеном IL-31.
Чтобы одновременно подтвердить правильность идентификации последовательности вариабельных областей тяжелой и легкой цепи и получить рекомбинантное гомогенное вещество, были созданы экспрессирующие векторы для продуцирования химерных антител в экспрессирующих системах млекопитающих. Были сконструированы прямой и обратный праймеры для амплификации последовательности вариабельной области тяжелой и легкой цепей мышиных антител, происходящих из гибридом 11Е12, 19D07 и 34D03. В каждый прямой праймер для облегчения экспрессии и секреции рекомбинантного антитела из клеточной линии млекопитающих были введены уникальный сайт рестрикции для эндонуклеазы, консенсусная последовательность Козака и секреторная лидерная последовательность. Каждый обратный праймер конструировали для амплификации каждого соответствующего вариабельного домена тяжелой и легкой цепи и для облегчения клонирования вводили уникальный сайт рестрикции. Для амплификации каждой тяжелой и легкой цепи проводили ПЦР, используя в качестве матрицы для каждой реакции клонированную гибридомную ДНК вариабельного домена цепей антитела. Каждый ПЦР-продукт клонировали в плазмиду для экспрессии в млекопитающих, содержащую ДНК константных областей либо тяжелой цепи (обозначенной в данном описании как НС-64 или НС-65), либо легкой цепи (обозначенной в данном описании как каппа) собачьего IgG на основании последовательностей с номерами доступа в GenBank AF354264 или AF354265 и ХР_532962, соответственно. Аминокислотные и нуклеотидные последовательности НС-64 представлены посредством SEQ ID NO:40 и 41, соответственно. Аминокислотные и нуклеотидные последовательности НС-65 представлены посредством SEQ ID NO:42 и 43, соответственно. Аминокислотные и нуклеотидные последовательности каппа-цепи представлены посредством SEQ ID NO:44 и 45, соответственно. Плазмидами, кодирующими каждую тяжелую и легкую цепь под контролем CMV-промотора (цитомегаловирусного промотора), совместно трансфицировали клетки HEK 293, используя стандартные методы с липофектамином. После шести суток экспрессии химерные mAb очищали из 30 мл супернатантов временно трансфицированных клеток HEK293FS, используя смолу MabSelect SuRe на основе белка A (GE Healthcare, Uppsala, Sweden), согласно стандартным методам очистки белков. Элюированные фракции объединяли, концентрировали до ~500 мкл, используя центрифужное устройство Nanosep Omega (Pall Corp., Port Washington, NY) с номинальным отсечением по молекулярной массе (ММ), равной 10000 Да, диализовали в течение ночи при 4°С в 1×PBS (pH 7,2) и хранили при 4°С для дальнейшего использования.
Экспрессию химерного собачьего IgG оценивали, используя электрофорез в полиакриламидном геле в присутствии SDS (додецилсульфата натрия) (SDS-PAGE) в нативных и денатурирующих условиях. Моноклональные антитела (mAb) после каждой трансфекции разделяли в 4-12%-ном бис-Трис-геле, используя рабочий буфер SDS-MES согласно протоколу производителя (Invitrogen Corp., Carlsbad, CA). После проведения электрофореза белки визуализировали с использованием простого красителя кумасси голубого (Invitrogen Corp., Carlsbad, CA), чтобы убедиться в осуществлении надлежащего образования пар и дать приблизительную оценку гомогенности белка. Чтобы определить, сохраняют ли рекомбинантные mAb способность связывать собачий IL-31, проводили оценку mAb по их способности связывать собачий IL-31 с применением вестерн-блоттинга. Белковые стандарты и рекомбинантный собачий IL-31 (800 нг), подвергнутые разделению в SDS-PAGE, переносили на нитроцеллюлозную мембрану, используя устройство iBlot от Invitrogen (Invitrogen Corp., Carlsbad, CA). После переноса мембраны промывали дистиллированной деионизованной водой и блокировали 5%-ным обезжиренным сухим молоком (NFDM) в забуференном фосфатом физиологическом растворе, содержащем 0,05% твина-20 (PBST), в течение 1 часа при комнатной температуре (КТ). После проведения блокирования мембраны промывали в PBST и инкубировали или с разбавленным супернатантом, полученным после временной экспрессии, или с очищенными химерными антителами. Связывание химерных антител оценивали, используя конъюгированные с пероксидазой козьи антитела против IgG собак (Bethyl Laboratories Inc., Montgomery, TX или Rockland, Immunochemicals, Inc., Gilbertsville, PA) в разведении 1:5000 в PBST в течение 1 часа при КТ. Подтверждение связывания с IL-31 определяли по присутствию окрашенной зоны (кажущаяся молекулярная масса 15 кДа), соответствующей гликозилированной форме собачьего IL-31, после добавления к блоту субстрата ТМВ (тетраметилбензидин) (KPL, Inc., Gaithersburg, MD).
Химерные mAb, демонстрирующие экспрессию из клеток HEK 293 и связывание с рекомбинантным иммуногеном собачьего IL-31 по данным вестерн-блоттинга, далее анализировали на предмет аффинности и функциональности. Чтобы охарактеризовать аффинность, с которой mAb-кандидаты связываются с IL-31, проводили оценку с использованием поверхностного плазменного резонанса (SPR), применяя систему Biacore (Biacore Life Sciences (GE Healthcare), Uppsala, Sweden). Чтобы избежать различий в аффинности, связанных с неодинаковой подготовкой поверхности, которая может иметь место при иммобилизации антител на поверхностях, применяли стратегию, при которой осуществляли непосредственное конъюгирование IL-31 с поверхностью. Иммобилизацию осуществляли посредством аминного сочетания IL-31 (5 мкг/мл), применяя химический метод с использованием N-гидроксисукцинимида (NHS)/1-этил-3-(3-диметиламинопропил)-карбодиимида (EDC). Реакцию на чипах гасили этаноламином и оценивали аффинность, с которой все mAb-кандидаты связались с иммобилизованным IL-31. Все кривые аппроксимировали в соответствии с моделью 1:1. Аффинности <Е-11 (т.е. 10-11) лежат ниже нижнего предела количественного определения для данного прибора.
Также была проведена оценка всех mAb-кандидатов по их способности ингибировать IL-31-опосредованную передачу сигнала в анализе на основе клеток в двух независимых форматах. В формате с совместной инкубацией комплексы mAb:IL-31 предварительно инкубировали в течение одного часа, чтобы убедиться в образовании комплекса перед добавлением клеток. Чтобы повысить возможность обнаружения различий между mAb, проводили второй ряд экспериментов без совместной инкубации и mAb добавляли непосредственно к клеткам в течение 5 минут, после чего добавляли IL-31. В обоих случаях стимуляция IL-31 происходила в течение 5 минут. Как приведено ниже в Таблице 3, превращение мышиных моноклональных антител 11Е12, 19D07 и 34D03 в собачью химерную форму, оказывало слабое действие на их способность связываться с IL-31 или ингибировать клеточно-опосредованную передачу сигнала. Эти результаты также подтверждают наличие корректных последовательностей вариабельных доменов тяжелой и вариабельных доменов легкой цепей, происходящих из каждой мышиной гибридомы.
|
|
Пример 4. Оценка химерных mAb in vivo
Для подтверждения корреляции ингибирования I L-31-опосредован ной передачи сигнала клетками, наблюдаемого в анализе с DH-82, с подавлением IL-31-опосредованного прурита у собак проводили оценку химерного моноклонального антитела 11Е12, описанного выше в Таблице 3 (химерное 11Е12-64), в модели IL-31-индуцированного прурита у собак. В этой модели собачий IL-31 при его внутривенном (в/в) введении в дозе 1-1,5 мкг/кг вызывает быстрое начало устойчивого зудящего ответа, количественная оценка которого может быть выполнена в течение двухчасового периода наблюдения. Чтобы оценить зудящие ответы собак помещали в одноместные загоны и измерения интенсивности зуда проводили с использованием видеонаблюдения. После периода акклиматизации, составляющего ≥1 часа, каждой собаке выставляли исходные (BL) оценки зуда в баллах, используя видеонаблюдение в режиме реального времени с применением системы категорийной оценки в баллах. Конкретно, в течение следующих друг за другом интервалов продолжительностью 1 минута делались заключения типа "да/нет" относительно того, демонстрирует ли каждая собака поведение, характерное при зуде. Демонстрации поведения, характерного при зуде, как например, таких действий, как облизывание/покусывание лап, бока и/или участков анальной области, расчесывание боков, шеи и/или царапание подстилки, встряхивание головой и быстрое перемещение на задней части по полу клетки, было достаточно для выведения ответа "да" в установленный временной интервал. В конце этого периода число выявленных ответов "да" суммировали, получая кумулятивный показатель оценки тяжести зуда в баллах (PSI). Оценки тяжести зуда в баллах определяли дважды для каждого животного, при этом сначала выставляли исходную оценку в баллах, определяемую в течение 30 минут непосредственно перед началом периода лечения тестируемым изделием. По завершении каждого предусмотренного планом периода наблюдения собак возвращали в места их обычного размещения.
Для оценки возможности ингибирования IL-31-опосредованного прурита путем подкожного (п/к) введения химерного 11Е12-64 проводили пилотное исследование (76А03), в которое были включены как группа, получающая лечение, так и группа, получающая плацебо, (N=4/группа). В этом исследовании определяли исходные ответы для всех 8 собак, и собак рандомизировали в группы и размещали с учетом их PSI. Важно отметить, что каждая группа состояла из двух респондеров с повышенной реакцией (PSI>55) и двух респондеров с умеренной реакцией (PSI=30-55). Этим собакам далее вводили химерное 11Е12-64 на 7-е сутки, а введение IL-31 осуществляли на 8-е, 14-е и 22-е сутки. Результаты этого исследования представлены на Фиг.8. Эти результаты демонстрируют, что введение химерного 11Е12-64 приводило к снижению среднего значения PSI более чем на 75% на 8-е и 14-е сутки относительно 1-х суток для животных, получающих химерное 11Е12-64. Этот результат противоположен возрастанию значений PSI на 37-51% в случае не получающих лечение животных. PSI возвращался к исходному уровню через две недели после лечения с применением mAb, подтверждая, что продолжительность эффективности действия введенной дозы 0,3 мг/кг составляет от одной до двух недель.
Особой проблемой при оценке PSI являются суточные изменения в поведении собак, характерном при зуде. Для облегчения контроля этих изменений для каждой собаки определяли исходный PSI в каждые сутки в течение 30 минут до введения IL-31. На Фиг.9 показаны индивидуальные оценки зуда в баллах у собак, зарегистрированных в этом исследовании (76А60). Приведенные на Фиг.9 данные иллюстрируют, что на 8-е сутки и на 14-е сутки исходный PSI составлял приблизительно 25% после введения IL-31 в группе, получающей химерное 11Е12-64. Это наблюдение согласуется с полным исчезновением связанного с IL-31 прурита, поскольку временной период наблюдения исходного ответа (0,5 ч) составляет 25% от временного периода наблюдения после введения IL-31 (2 ч). В своей совокупности эти полученные in vivo данные предоставляют очень строгое доказательство того, что: 1) химерное моноклональное 11Е12 может нейтрализовать способность IL-31 вызывать прурит у собак, 2) данные по ингибированию IL-31-опосредованной передачи сигнала в анализе на основе клеток коррелируют с эффективностью in vivo и 3) параметры, необходимые для использования модели, в которой применяется IL-31, с целью оценки mAb, являются обоснованными для оценки других антител-кандидатов.
Пример 5. Стратегия канинизации
Выработка антител к лекарственному средству (ADA) может быть ассоциирована с потерей эффективности в отношении любого биотерапевтического белка, включая моноклональные антитела. Всесторонний анализ литературы показал, что процесс "видообразования" моноклональных антител может снизить способность mAb быть иммуногенными, хотя можно найти примеры иммуногенных полностью человеческих mAb и неиммуногенных химерных mAb. Чтобы снизить риски, связанные с образованием ADA, для предложенных в данном изобретении мышиных моноклональных антител против IL-31 была применена стратегия канинизации. Эта стратегия канинизации основывается на идентификации последовательности антител зародышевой линии собак, наиболее подходящей для привития CDR (Фиг.4). После проведения подробного анализа всех доступных последовательностей антител зародышевой линии собак в отношении как тяжелой, так и легкой цепи, были отобраны кандидаты-антитела зародышевой линии на основании их гомологии с мышиными mAb, и для замены собственных CDR собачьего Ig были использованы CDR из предшественников мышиных mAb. Задача заключалась в том, чтобы сохранить высокую аффинность и активность в клетках при использовании каркасов полностью собачьих Ig для сведения к минимуму иммуногенного потенциала in vivo. Канинизированные mAb экспрессировали и характеризовали по их способности связывать IL-31, применяя вестерн-блоттинг. Эти результаты описаны ниже в Примере 8. Только те mAb, которые сохраняли способность связывать IL-31 после канинизации, были предложены для дальнейшего исследования. Те mAb, которые утратили способность связывать IL-31, были методично проанализированы с целью идентификации: 1) цепи, ответственной за утрату функции, 2) каркаса, ответственного за утрату функции, и 3) аминокислот(ы), ответственных(ой) за утрату функции.
Пример 6. Канинизация антител 11Е12, 19D07 и 34D03
Готовили синтетические нуклеотидные конструкции, презентирующие канинизированные вариабельные домены тяжелой и легкой цепей mAb 11E12, 19D07 и 34D03. После субклонирования последовательности каждой вариабельной цепи в плазмиды, содержащие соответствующие последовательности константной области тяжелой или каппа-цепи собачьего Ig, плазмидами осуществляли совместную трансфекцию клеток HEK 293 для экспрессии антител. В целом, как 19D07, так и 34D03 mAb сохраняли способность к связыванию IL-31 после канинизации. Последовательности канинизированных вариабельных доменов антитела против собачьего IL-31, определенные для каждого антитела, являются следующими: вариабельный домен легкой цепи 19D07 (CAN-19D07-VL-998-1 с SEQ ID NO:23, соответствующей нуклеотидной последовательностью для которой является SEQ ID NO:46), вариабельный домен тяжелой цепи 19D07 (CAN-19D07-VH-400-1 с SEQ ID NO:29, соответствующей нуклеотидной последовательностью для которой является SEQ ID NO:47), вариабельный домен легкой цепи 34D03 (CAN-34D03-VL-998-1 с SEQ ID NO:25, соответствующей нуклеотидной последовательностью для которой является SEQ ID NO:48) и вариабельный домен тяжелой цепи 34D03 (CAN-34D03-VH-568-1 с SEQ ID NO:31, соответствующей нуклеотидной последовательностью для которой является SEQ ID NO:49).
В противоположность этому, применение последовательностей зародышевой линии, использованных в работе по канинизации 11E12, привело к получению некоторых нефункциональных mAb. Со ссылкой на Фиг.10, проводили экспрессию химерных, гетерохимерных и канинизированных вариантов mAb 11E12 и исследование с применением вестерн-блоттинга на предмет их способности связывать собачий IL-31. Эти результаты продемонстрировали, что канинизированное антитело 11E12 не связывалось с собачьим IL-31 (блот №2). Кроме того, что касается гетерохимер, то химерная тяжелая цепь в паре с канинизированной легкой цепью утратила способность связывать IL-31 (блот №3), тогда как канинизированная тяжелая цепь в паре с химерной легкой цепью сохраняла способность связывать IL-31 (блот №4). На основании результатов, полученных для гетерохимер, было сделано заключение о том, что канинизированная легкая цепь отвечает за потерю активности.
В попытке восстановить связывание канинизированных вариантов 11Е12 с собачьим IL-31 канинизированную легкую цепь модифицировали посредством перестановки каркасных последовательностей. На Фиг.11 приведено общее представление результата замены в каркасе легкой цепи 11Е12. В результате этой работы идентифицировали антитело с заменой каркаса II (FWH) собачьего Ig на каркас II мышиного Ig с восстановлением способности связываться с собачьим IL-31 (вариабельный домен легкой цепи 11Е12 (CAN-11E12-VL-cUn-FW2 с SEQ ID NO:20, соответствующей нуклеотидной последовательностью для которой является SEQ ID NO:50), вариабельный домен тяжелой цепи 11Е12 (CAN-11E12-VH-415-1 с SEQ ID NO:27, соответствующей нуклеотидной последовательностью для которой является SEQ ID NO:51)).
Благодаря дальнейшей оптимизации этих обратных мутаций идентифицировали антитело с одиночной обратной мутацией аргинина на лейцин (R50L) в каркасе II, в результате которой могла восстанавливаться способность связываться с IL-31, по данным анализа вестерн-блотов (вариабельный домен легкой цепи 11Е12 (CAN-11E12-VL-cUn-13 с SEQ ID NO:21, соответствующей нуклеотидной последовательностью для которой является SEQ ID NO:52), вариабельный домен тяжелой цепи 11Е12 (CAN-11E12-VH-415-1 с SEQ ID NO:27)) (Фиг.12). После того, как были идентифицированы "канинизированные" варианты каждого потенциального кандидата, mAb очищали и диализовали против PBS для дальнейшей оценки.
В Таблице 4 суммированы результаты как измерений аффинности, так и данные анализа по ингибированию с применением клеток. Эти данные демонстрируют, что оба канинизированных производных как 11Е12, так и 34D03 сохраняют превосходную ингибирующую активность в анализе на основе клеток и аффинность в отношении IL-31 по результатам измерений с использованием Biacore. Также достойно внимания наблюдение, что несмотря на то, что молекула исходного канинизированного 19D07 сохраняет превосходную эффективность по результатам измерений с использованием Biacore, способность ингибировать IL-31-опосредованную передачу сигнала в анализе на основе клеток, по-видимому, нарушена по сравнению с его мышиным предшественником. Имела место незначительная потеря или не происходило никакой потери аффинности при превращении mAb из их мышиного изотипа в производное собачьего Ig.
|
|
Тяжелые цепи: все канинизированные и гетерохи мерные формы 11Е12 содержали VH-последовательность CAN-11E12-VH-415-1 (SEQ ID NO:27) и константную область, называемую НС-64 (SEQ ID NO:40); канинизированное 19D07 содержало VH-последовательность CAN-19D07-VH-400-1 (SEQ ID NO:29) и НС-64; канинизированное 34D03 содержало VH-последовательность CAN-34D03-VH-568-1 (SEQ ID NO:31) и НС-64.
Легкие цепи: канинизированное 11Е12 содержало VL-последовательность CAN-11E12-VL-cUn-1 (SEQ ID NO:53) и константную область, называемую каппа (SEQ ID NO:44); гетерохимерное 11Е12 содержало VL-последовательность MU-11E12-VL (SEQ ID NO:19) и каппа; канинизированное 11E12 FW2 содержало VL-последовательность CAN-11Е12-VL-cUn-FW2 (SEQ ID NO:20) и каппа; канинизированное 11Е12 13 содержало VL-последовательность CAN-11E12-VL-cUn-13 (SEQ ID NO:21) и каппа; канинизированное 19D07 содержало VL-последовательность CAN-19D07-VL-998-1 (SEQ ID NO:23) и каппа; канинизированное 34D03 содержало VL-последовательность CAN-34D03-VL-998-1 (SEQ ID NO:25) и каппа.
Пример 7. Исследование связывания собачьего IL-31 с антителами 11Е12 и 34D03
Для определения аминокислотных остатков антител 11Е12 и 34D03, вовлеченных в связывание с собачьим IL-31, использовали стратегию с применением мутагенеза, которая включала: 1) укорочение белка IL-31 как с N-, так и с С-конца и 2) замену отдельных аминокислот на аланин (аланин-сканирование) с целью определения влияния на связывание mAb. Для амплификации гена собачьего IL-31, кодон-оптимизированного для экспрессии в хозяине E. coli, конструировали ПЦР-праймеры. Последовательность этой кодон-оптимизированной для экспрессии в Е. coli полноразмерной конструкции собачьего IL-31 представлена в SEQ ID NO:55, соответствующей нуклеотидной последовательностью для которой является SEQ ID NO:56. Конструировали праймеры для амплификации полноразмерного гена и для создания белка, укороченного на 20 аминокислот в направлении от N- и от С-конца. Для таких укорочений по N-концу положение 1 сразу после N-концевой 6-His-метки в кодон-оптимизированной конструкции соответствовало остатку глицина. Продукты ПЦР-амплификации клонировали в pET101D (Invitrogen Corp., Carlsbad, CA) согласно протоколу производителя. Применение плазмиды pET101D дает возможность осуществлять слияние рекомбинантного белка с N-концевой 6-His-эпитопной меткой, необходимой для подтверждения экспрессии. Плазмиды с подтвержденными последовательностями использовали для трансформации клеток Е. coli BL21 Star TOP10 (Invitrogen Corp., Carlsbad, CA) и экспрессию рекомбинантного белка индуцировали, используя 1 мМ изопропил-β-D-1-тиогалактопиранозид (IPTG) в стандартных условиях культивирования. После проведения индукции клетки собирали центрифугированием и лизировали, используя реагенты для экстракции бактериальных белков (сокращенно B-PER, ThermoFisher Scientific Inc., Rockford, IL). Неочищенные лизаты подвергали SDS-PAGE, и проводили вестерн-блоттинг, как описано ранее. Все вестерн-блоттинги для анализа с применением мутагенеза проводили, используя мышиные варианты 11Е12 и 34D03, ввиду доступности необходимых очищенных антител и реагентов. Каждое антитело тестировали по его способности связываться с перенесенным на этот блот неочищенным белковым лизатом, представляющим полноразмерный и укороченный IL-31. Контрольные блоты также зондировали mAb против His для подтверждения экспрессии каждого белка. Все белки, укороченные по N-концу (-20N, -40N и -60N), демонстрировали сильную экспрессию в Е. coli и обладали способностью связываться с 11Е12 и 34D03 (Фиг.13). Аминокислотные и нуклеотидные последовательности, соответствующие конструкции -20N, представляют собой SEQ ID NO:57 и 58, соответственно. Аминокислотные и нуклеотидные последовательности, соответствующие конструкции -40N, представляют собой SEQ ID NO:59 и 60, соответственно. Аминокислотные и нуклеотидные последовательности, соответствующие конструкции -60N представляют собой SEQ ID NO:61 и 62, соответственно. Однако полноразмерный IL-31 и белки, укороченные по С-концу (-20С, -40С и -60С), в этих условиях не экспрессировались.
Было отмечено, что полноразмерный белок IL-31 экспрессировался на очень низком уровне. Однако, конструкция с удаленными с N-конца первыми 20 аминокислотами (-20N) демонстрировала сильную экспрессию. Оба антитела, 11Е12 и 34D03, связывались с белком -20N. Поэтому дальнейшую работу проводили, используя эту конструкцию -20N. Готовили укороченные по С-концу конструкции, соответствующие положениям 20-122 (MM 15,3 кДа с His-меткой), 20-100 (MM 12,9кДа с His-меткой) и 20-80 (MM 10,4кДа с His-меткой), чтобы оценить связывание mAb с этими областями на белке IL-31. Аминокислотные и нуклеотидные последовательности, соответствующие конструкции 20-122, представляют собой SEQ ID NO:63 и 64, соответственно. Аминокислотные и нуклеотидные последовательности, соответствующие конструкции 20-100, представляют собой SEQ ID NO:65 и 66, соответственно. Аминокислотные и нуклеотидные последовательности, соответствующие конструкции 20-80, представляют собой SEQ ID NO:67 и 68, соответственно. На Фиг.14 показаны вестерн-блоты неочищенных белковых лизатов, содержащих эти укороченные белки, которые зондировали с использованием mAb 11E12 (блот В) и 34D03 (блот С). Как показано на этом рисунке, mAb 11E12 и 34D03 связывались с укороченными белками IL-31 20-122 и 20-100, но не связывались с 20-80. Эти результаты указывали на то, что аминокислоты между положениями 80 и 100 полноразмерной конструкции собачьего IL-31 с SEQ ID NO:55 (с "SSHMA" в качестве N-конца), были вовлечены в связывание этих антител. Эта область соответствует аминокислотным остаткам с номерами 102-122 полноразмерной белковой последовательности собачьего IL-31 с SEQ ID NO:32. На контрольном блоте, где использовали mAb против His (блот А), было показано, что экспрессировались все укороченные белки. Дополнительно, в качестве контроля для подтверждения отсутствия неспецифического связывания mAb с белками хозяина использовали белок pET101D-lacZ.
С целью дальнейшей идентификации аминокислот в собачьем IL-31, вовлеченных в связывание с mAb 11E12 и 34D03, проводили аланин-сканирующий мутагенез в соответствии с известными способами. Готовили индивидуальные конструкции (в плазмиде -20 N), проводя замену на аланин в каждом положении, от 76-го до 122-го, аминокислот собачьего IL-31. После подтверждения последовательности осуществляли экспрессию белка и неочищенные белковые лизаты подвергали анализу с использованием вестерн-блоттинга. На Фиг.15 суммированы результаты, указывающие положения в собачьем IL-31, которые, по результатам проведения в них мутации на аланин, влияют на связывание mAb 11Е12 и 34D03. Как показано на этом рисунке, все положения 77, 78, 81 и 85 в данной конструкции полноразмерного IL-31 оказывают влияние на связывание антител 11Е12 или 34D03. Они соответствуют аминокислотным остаткам 99, 100, 103 и 107, соответственно, последовательности SEQ ID NO:32 полноразмерного белка собачьего IL-31.
Для изучения влияния множественных мутаций в областях IL-31, важных для связывания с антителами 11Е12 и 34D03, были сконструированы экспрессирующие плазмиды с двойными (D82A, I85A) и тройными (181А, D82A, I85A) заменами на аланин. Лизаты Е. coli, экспрессирующей собачий IL-31 с этими двойными и тройными мутациями, наряду с контролем -20 N подвергали блоттингу с антителами 11Е12 и 34D03 (Фиг.16). Очевидно, что эти три аминокислоты собачьего IL-31 вовлечены в распознавание 11Е12 и 34D03, поскольку при их замене на аланин наблюдается полное исчезновение связывания. Эти три аминокислоты соответствуют аминокислотным остаткам 103, 104 и 107 полноразмерной белковой последовательности SEQ ID NO:32 собачьего IL-31.
Итак, анализ укороченных конструкций собачьего IL-31 выявил, что аминокислотные остатки (отмеченные на Фиг.15 между положениями 80 и 122), вовлечены в связывание антител 11Е12 и 34D03. Кроме того, уточненный анализ с применением мутагенеза с использованием аланин-сканирования выявил, что Asp77, Lys78, Ile81, Asp82 и Ile85 в данной конструкции полноразмерного IL-31 все влияют на связывание 11Е12 или 34D03, что указывает на то, что эта область с наибольшей вероятностью определяет эпитоп, ответственный за распознавание этими антителами. Интересно, что было показано, что эта область белка IL-31 человека вовлечена в связывание с GPL-субъединицей своего корецептора (Le Saux S. et al., Biol. Chem. 2010, Jan 29, 285(5):3470-7. Epub, 2009, Nov. 17). Эти наблюдения, наряду со способностью mAb 11E12 и 34D03 нейтрализовать IL-31-опосредуемую pSTAT-активность в моноцитах, подтверждают гипотезу о том, что эти mAb связываются с остатками на собачьем IL-31, которые являются существенными для связывания этого цитокина с его рецептором, ингибируя тем самым его способность индуцировать передачу сигнала.
Пример 8. Получение канинизированных антител 34D03 с использованием плазмид. несущих ген глутаминсинтетазы (GS)
Гены, кодирующие канинизированное mAb 34D03 (тяжелую и легкую цепи, Таблица 4, выше), клонировали в GS-плазмиды рЕЕ 6.4 и рЕЕ 12.4, соответственно (Lonza, Basel, Switzerland). Полученные плазмиды переваривали в соответствии с протоколом производителя и лигировали вместе с образованием одной плазмиды для экспрессии в млекопитающих. Каждую плазмиду использовали для трансфекции клеток HEK 293, и экспрессию осуществляли в 20 л культуральной среды. Из кондиционированной НЕК среды выделяли белок, используя аффинную хроматографию на белке А в соответствии со стандартными методами очистки белков. Среду загружали на хроматографическую смолу и элюировали посредством изменения рН. В растворе элюированного белка подводили рН, и его диализовали и подвергали стерилизующей фильтрации перед применением. Полученное антитело более чем на 99 процентов было мономерным, по данным аналитической гель-проникающей хроматографии, без каких-либо видимых высокомолекулярных агрегатов. Это антитело далее использовали для изучения в модели прурита у собак с целью оценки эффективности in vivo.
Пример 9. Оценка канинизированного антитела 34D03 в модели прурита у собак
Оценивали противозудящее действие канинизированного 34D03 (CAN 34D03-65, представленного SEQ ID NO:31 (VH) в паре с SEQ ID NO:25 (VL) на SEQ ID NO:42 (НС-65) и SEQ ID NO:44 (LC-каппа)), используя модель IL-31-индуцированного прурита на собаках. Согласно этой модели внутривенную провокационную дозу (1,5 мкг/кг) рекомбинантного собачьего IL-31, известного тем, что он индуцирует временный период проявления поведения, характерного при зуде у гончих собак (введение IL-31, продолжительность прурита менее 24 часов) вводили неоднократно животным до и в течение 63 суток после введения разовой п/к дозы 1,0 мг/кг CAN 34D03-65. В каждый из периодов введения IL-31 для оценки поведения, характерного при зуде, использовали видеонаблюдение в режиме реального времени в течение 0,5 часа до введения цитокина (исходный период перед введением IL-31) с последующим аналогичным измерением в течение 2 часов, начиная через 20 минут после инъекции цитокина (период продолжительностью 2 ч после введения IL-31). Оценки тяжести зуда в баллах выставляли в каждый временной период исследования, давая заключения типа "да/нет" относительно того, обнаруживалось ли поведение, характерное при зуде, в течение следующих друг за другом интервалов продолжительностью 1 минута (максимальная оценка тяжести зуда в баллах составляет: 30 для каждого исходного периода; 120 для периода после введения IL-31). На Фиг.17 суммированы оценки тяжести зуда в баллах, полученные до и после лечения с применением CAN 34 D03-65, которое было выполнено на 0-е сутки исследования. За семь суток до лечения с применением mAb среднее значение оценки тяжести зуда в баллах у собак после введения IL-31 составляло 68±13 (SE, n=4). Для сравнения, на 7-е, 14-е, 21-е сутки исследования среднее значение оценки тяжести зуда в баллах после введения IL-31 уменьшилось до 5±2, 8±4 и 9±5, соответственно. Эти изменения в оценке тяжести зуда в баллах между -7-ми и 7-21-ми сутками представляют уменьшение на ≥85% общей способности реагировать зудом на IL-31.
На самом деле, степень ингибирования IL-31-индуцируемого прурита в эти сроки может быть более близка к 100%, если учесть, что в промежутке между 0-ми и 21-ми сутками исходные оценки в баллах за период 0,5 ч до введения IL-31 в среднем составляли 1,6±0,6, - уровень который был бы экстраполирован к оценке 6-7 тяжести зуда в баллах для 2 ч периода. Через некоторое время способность получающих лечение собак реагировать зудом на экзогенный IL-31 постепенно восстанавливалась. На 63-и сутки после лечения с применением CAN D03-65 среднее значение оценки тяжести зуда в баллах за период 2 ч после введения IL-31 увеличилось до 57±8 или ориентировочно составило 84% от ответов на введение IL-31 до лечения с использованием mAb, наблюдаемых на -7-е сутки. Таким образом, в модели IL-31-индуцируемого зуда разовая п/к болюс-инъекция CAN 34D03-65 в течение нескольких недель обеспечивала защиту от прурита получающим лечение собакам.
Пример 10. Исследование кошачьего IL-31
Последовательность кошачьего IL-31 идентифицировали путем поиска сходства генома кошек с собачьим IL-31, используя геномные ресурсы NCBI (www.ncbi.nlm.nih.gov). Ген, представляющий кошачий IL-31, синтезировали для оптимальной экспрессии в E. coli. Были созданы экспрессирующие конструкции с полноразмерными генами собачьего и кошачьего IL-31, содержащие N-концевую 6-His-метку для обнаружения и очистки. Конструкция полноразмерного гена кошек, использованная для экспрессии в Е. coli, представлена нуклеотидной последовательностью SEQ ID NO:69 и белковой последовательностью SEQ ID NO:70. Плазмиды с подтвержденной последовательностью использовали для трансформации Е. coli BL21 Star™ (Invitrogen Corp., Carlsbad, CA) и экспрессию осуществляли при 30°С в течение 5 часов. После лизиса клеточных осадков после центрифугирования было обнаружено, что нерастворимый лизат сильно обогащен иммунореактивным белком. Эти клеточные осадки солюбилизировали в 6 М мочевине и очистку рекомбинантных белков осуществляли в денатурирующих условиях, используя никель-кобальтовую смолу (Thermo Fisher Scientific Inc., Rockford, IL). Объединенные после элюирования фракции, показывающие положительную реакцию на присутствие His-метки, постадийно диализовали против 0,8 М мочевины в PBS, затем против PBS и анализировали с использованием SDS-PAGE (Фиг.18). Как наблюдали ранее, выход рекомбинантного собачьего IL-31 после индукции из Е. coli был низким. Однако после очистки был получен белок, который мигрировал в SDS-PAGE в согласии с ожидаемой молекулярной массой.
Для изучения биологической активности собачьего и кошачьего IL-31, продуцированного в Е. coli, каждый белок анализировали по его способности индуцировать pSTAT-передачу сигнала в анализе с применением DH82-клеток. Поскольку рекомбинантный IL-31 из клеток млекопитающих (собачий IL-31 (СНО)) является гликозилированным в высокой степени, оставалось неясным, будет ли негликозилированная форма сохранять биологическую активность. На Фиг.19 показано, что IL-31 кошек имеет сопоставимую биологическую активность с референсным IL-31, продуцируемым в клетках СНО.
Посредством аланин-сканирующего мутагенеза собачьего IL-31 была определена область в белке, необходимая для связывания с антителами 11Е12 и 34D03. С учетом консервативности последовательностей в этой области (Фиг.20) была выдвинута гипотеза, что эти mAb будут давать перекрестную реакцию с кошачьим IL-31.
На Фиг.21 показано, что mAb 11E12 и 34D03 обладают способностью связываться с собачьим IL-31 (Е. coli) и также способны к перекрестному взаимодействию с белком IL-31 кошек. Согласно этим данным, был осуществлен процесс "видообразования" антитела 34D03 в сторону кошачьих (фелинизация).
Пример 11. Фелинизация антитела 34D03
Аналогично описанной стратегии канинизации были идентифицированы соответствующие последовательности антител зародышевой линии из всех доступных кошачьих последовательностей для привития CDR из mAb 34D03. Вариабельный домен легкой цепи (FEL-34D03-VL-021-1 с SEQ ID NO:71, соответствующей нуклеотидной последовательностью для которой является SEQ ID NO:72) и вариабельный домен тяжелой цепи (FEL-34D03-VH-035-1 с SEQ ID NO:73, соответствующей нуклеотидной последовательностью для которой является SEQ ID NO:74) были отобраны на основании наивысшей гомологии с соответствующими им каркасами собачьего Ig в канинизированном 34D03. Рекомбинантное фелинизированное 34D03 получали, используя отобранные вариабельные области, соединенные с соответствующей им последовательностью контантного домена тяжелой цепи IgG1 (HC-A кошек с SEQ ID NO:75, соответствующей нуклеотидной последовательностью для которой является SEQ ID NO:76 с № доступа в GenBank AB016710.1) и последовательностью константного домена легкой каппа-цепи (LC-каппа кошек с SEQ ID NO:77, соответствующей нуклеотидной последовательностью для которой является SEQ ID NO:78 с № доступа в GenBank AF198257.1). Антитело получали из клеток НЕК и очищали, как описано ранее. На Фиг.22 показана способность кошачьего 34D03 нейтрализовать pSTAT-передачу сигнала со сравнимым с вариантом для собачьего Ig значением IC50.
Фелинизированное 34D03 оценивали по его способности связывать как кошачий, так и собачий IL-31. На Фиг.23 показаны вестерн-блоты для фелинизированного 34D03 с применением очищенного белка как из млекопитающих, так и из Е. coli, использованных в качестве источников. Убедительное связывание наблюдали как для белков собак, так и кошек, указывающее на полную перекрестную реактивность фелинизированной формы 34D03 и являющееся подтверждением связывания с белком кошек. В своей совокупности, эти результаты подтверждают, что консервативный эпитоп кошачьего IL-31 может быть подходящей мишенью для ингибирования этого цитокина у кошек.
Пример 12. Обнаружение цитокина IL-31 у собак с природным атопическим дерматитом
В настоящем примере уровень белка IL-31 в сыворотке, собранной из популяций собак, в том числе собак с атопическим дерматитом, оценивали с использованием метода количественного иммуноанализа.
Готовили образцы сыворотки крови для следующих популяций собак и замораживали до проведения измерений IL-31 в сыворотке.
1) Двадцать четыре специально выращенных гончих (Marshall BioResourses, North Rose, NY) до и после сенсибилизации к клещевому аллергену домашней пыли (HDM) (Dermatophagoides farina, Greer Labs). Возраст всех животных составлял приблизительно 9 месяцев. Оба пола были представлены приблизительно в равной степени.
2) Тридцать собак с аллергией на блох (Youngs Veterinary Research Services, Turlock, CA) до заражения блохами или приблизительно через одну неделю после заражения взрослыми особями кошачьих блох (Ctenocephalides felis). Большинство собак в этой колонии были смешанной породы. Средний возраст составлял приблизительно 10,5 лет. Оба пола были представлены приблизительно в равной степени.
3) Восемьдесят семь принадлежащих владельцам собак с заболеванием субклиническим периодонтитом, но в другом определенных как здоровые. Образцы собирали в 18 ветеринарных клиниках США. Животные являлись типичными представителями популяция собак в США с точки зрения пола и породы, и их возраст составлял от двух до пяти лет.
4) Двести двадцать четыре принадлежащих владельцам животных с диагнозом хронического внесезонного атопического дерматита в течение по меньшей мере 1 года (поставленным на основе модифицированных критериев Виллемса и публикации Прело (Willemse Т. J. Small Anim. Pract, 1986, 27:771-778 и Prelaud et al. Revue de Medecine Veterinaire, 1998, 149:1057-1064) с минимальной оценкой "умеренного зуда" по оценке владельца и минимальной, равной 25, балльной оценкой поражения кожи согласно CADESI-02 (индекс степени тяжести и размера атопического дерматита у собак) по оценке ветеринара. Образцы собирали в 14 ветеринарных лечебницах США, имеющих опыт в ветеринарной дерматологии. Приблизительно 75% собак были чистопородными, и ~25% общей популяции составляли ретриверы (Лабрадор (17,3%) и золотистый ретривер (8,2%)). Как правило, собаки были среднего возраста (~6 лет). Оба пола были представлены приблизительно в равной степени.
Для количественного определения уровней cIL-31 (собачьего IL-31) в сыворотке крови собак использовали сэндвич-иммуноанализ. Образцы сыворотки разбавляли 1:2 в Rexxip-буфере (Gyrolab, Warren, NJ) и анализировали на Bioaffy CD (1000 нл) (Gyrolab), используя рабочую станцию Gyrolab xP. Захват cIL-31 осуществляли, используя меченное биотином моноклональное анти-IL-31 антитело по настоящему изобретению, а обнаружение проводили, используя Alexafluor 647-меченное моноклональное анти-IL-31 антитело по настоящему изобретению. Концентрации cIL-31 в образцах экстраполировали, исходя из стандартной кривой по 8 точкам с динамическим диапазоном 0,013-250 нг/мл, используя 5-параметрическую модель аппроксимации кривых с программным обеспечением Gyrolab Evaluator.
Обнаружение уровней cIL-31 смогли провести в образцах сыворотки 57% собак с природным атопическим дерматитом (≥13 пг/мл), но не смогли провести (<13 пг/мл) в образцах сыворотки от специально выращенных гончих +/- сенсибилизированных к HDM, собак смешанных пород +/- с заражением блохами или принадлежащих владельцам собак с периодонтитом, но в другом определенных как здоровые, независимо от породы. Для собак с природным атопическим дерматитом в 53% проанализированных образцов были показаны уровни IL-31 в сыворотке крови в диапазоне 13-1000 пг/мл, а в 4% были показаны уровни выше 1000 пг/мл (Таблица 5).
|
Результаты настоящего примера демонстрируют, что уровень белка IL-31 повышен у значительного количества собак с атопическим дерматитом собак. Без связи с какой-либо теорией считается, что IL-31-опосредованный путь играет роль в патобиологии сопровождающихся зудом аллергических кожных состояний, таких как, но не ограничиваясь этим, атопический дерматит собак, и представляет собой новый путь для терапевтического вмешательства с использованием антагониста IL-31, такого как, включая, но не ограничиваясь этим, олацитниб (olacitnib) и/или антитело против IL-31, которое специфически связывается с собачьим IL-31.