Результат интеллектуальной деятельности: ПРОЛЕКАРСТВА, СОДЕРЖАЩИЕ КОНЪЮГАТ ЭКСЕНДИН-ЛИНКЕР
Вид РИД
Изобретение
Настоящее изобретение относится к пролекарствам эксендина, фармацевтическим композициям, содержащим указанные пролекарства, а также к их применению в качестве лекарственного средства для лечения или профилактики заболеваний или нарушений, которые можно лечить эксендином.
Эксендин-4 представляет собой пептид из 39 аминокислот, выделенный из секретов слюнных желез ядовитой ящерицы-ядозуба (Heloderma suspectum). Он обладает некоторым сходством последовательности с рядом представителей семейства глюкагон-подобных пептидов, причем наиболее высокой гомологией, составляющей 53%, он обладает с глюкагон-подобным пептидом-1 [7-36]-амидом (GLP-1). Эксендин-4 действует в качестве агониста GLP-1 на рецептор GLP-1 и обладает подобным GLP-1 действием усиления секреции инсулина в выделенных островках крыс. Эксендин-4 представляет собой высокоэффективный агонист, и укороченный эксендин-(9-39)-амид является антагонистом рецептора глюкагон-подобного пептида 1-(7-36)-амида секретирующих инсулин бета-клеток. (см. например J. Biol. Chem. 268(26):19650-19655). Эксендин-4 ("эксенатид") недавно был одобрен в США и Евросоюзе для улучшения гликемического контроля у пациентов с диабетом 2 типа, принимающих метформин и/или сульфонилмочевину, но не достигших достаточного гликемического контроля.
Современная терапия эксенатидом требует частых инъекций (два раза в сутки), приводящих к высоким уровням в плазме после инъекции, которые коррелируют с тошнотой (см. Nauck M. A., Meier J.J. (2005), Regul Pept. 128(2):135-148), и к низким минимальным концентрациям, ведущим к неполному гликемическому контролю (см. Kim D., et al. (2007), Diabetes Care. 30(6):1487-1493). Для решения этих проблем особо желателен состав эксендина-4 более длительного действия.
В идеальном случае, пептид включают в состав, чтобы он обеспечивал постоянный уровень в плазме человека в течение, по меньшей мере, одной недели после введения в организм человека, обеспечивая частоту инъекций раз в неделю или реже. Было предложено несколько эксендинов длительного действия.
Для улучшения физико-химических или фармакокинетических свойств лекарственного средства in vivo, таких как его время полужизни, такое лекарственное средство можно конъюгировать с носителем. Если лекарственное средство временно связано с носителем и/или линкером, такие системы обычно относят к связанным с носителем пролекарствам. Согласно определениям, предоставленным IUPAC (приведенным на http://www.chem.qmul.ac.uk/iupac.medchem, доступном с 22 июля 2009 года), связанное с носителем пролекарство представляет собой пролекарство, которое содержит временную связь данного активного вещества с временной группой носителя, которая обеспечивает улучшенные физико-химические или фармакокинетические свойства и которая может быть легко удалена in vivo, обычно гидролитическим расщеплением.
Линкеры, используемые в таких связанных с носителем пролекарствах, могут быть временными, что означает, что они являются неферментативно гидролитически деградируемыми (расщепляемыми) в физиологических условиях (водный буфер при pH 7,4, 37°C) со временем полужизни в диапазоне, например, от одного часа до трех месяцев. Пригодные носители представляют собой полимеры и их можно либо прямо конъюгировать с линкером, либо через нерасщепляемый спейсер.
Временная конъюгация с полимером через бесследные линкеры пролекарств сочетает в себе преимущества длительного времени циркуляции вследствие присоединения полимера и восстановления исходной фармакологии первоначального пептида после высвобождения из конъюгата с полимером.
При использовании конъюгатов пептидов с полимером-линкером, исходный неизмененный пептид медленно высвобождается после введения пациенту, что определяется только кинетикой высвобождения линкера и фармакокинетикой полимерного носителя. В идеальном случае, кинетика высвобождения не зависит от присутствия ферментов, таких как протеазы или эстеразы, в жидкостях организма, чтобы гарантировать постоянный и однородный профиль высвобождения.
Международная патентная заявка WO-A 2009/095479 относится к пролекарствам, содержащим конъюгаты лекарственных средств с линкерами, где линкер ковалентно связан через расщепляемую связь с биологически активной частью, такой как эксендин. Биологически активная часть высвобождается из пролекарства при циклизации-активации вследствие образования циклического имида. Описано пролекарство эксендина, в котором линкер основан на L-аланине.
Тем не менее, остается потребность в разработке пролекарств эксендина длительного действия с более длительным временем полужизни. Таким образом, одной задачей настоящего изобретения является предоставление пролекарств эксендина с более длительным временем полужизни.
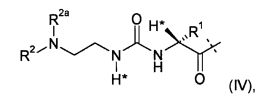
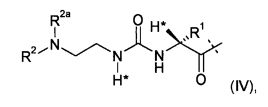
Этого достигают с помощью пролекарства или его фармацевтически приемлемой соли, содержащих ковалентно связанное пролекарство эксендина формулы D-L, где
D представляет собой часть эксендина; и
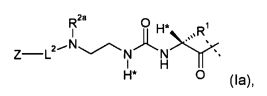
-L представляет собой биологически не активную линкерную часть, -L1 представлен формулой (I):
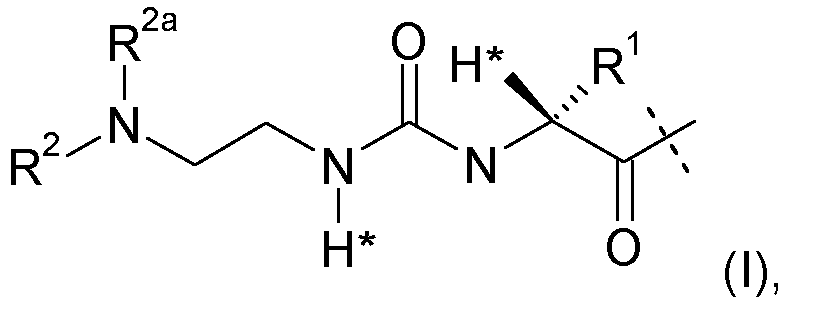
где пунктирная линия указывает на присоединение к одной из аминогрупп эксендина с образованием амидной связи;
R1 выбран из C1-4алкила, предпочтительно CH3;
R2, R2a независимо выбраны из группы, состоящей из H и C1-4алкила;
где L1 замещен одним L2-Z и необязательно дополнительно является замещенным, при условии, что атомы водорода, обозначенные звездочками в формуле (I), не заменены заместителем, и где
L2 представляет собой одинарную химическую связь или спейсер; и
Z представляет собой гидрогель.
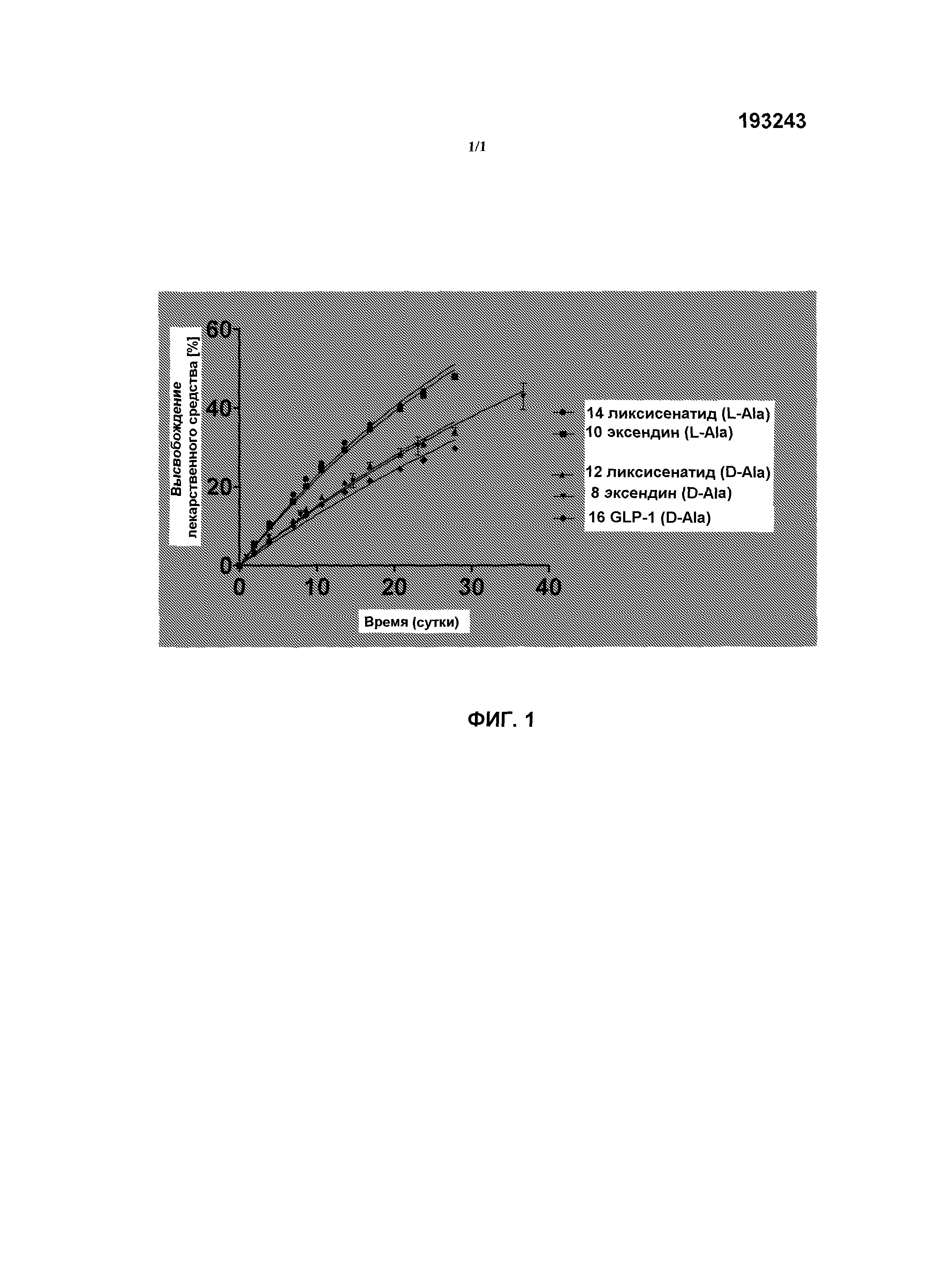
Было обнаружено, что линкеры пролекарств, основанные на стереохимии, представленной в формуле (I), т.е. с аминокислотой в ее D-форме, имеют преимущественное время полужизни по сравнению с такими линкерами пролекарств, основанными на аминокислотах в их L-форме. Кроме того, такие пролекарства могут обеспечить высвобождение эксендина из подкожного депо в структурно неизмененной форме в течение периодов времени, составляющих, по меньшей мере, 2 суток между введениями. В качестве дополнительного преимущества, структурная целостность высвобожденного эксендина может быть обеспечена с помощью высоко гидратированной полимерной матрицы, минимизирующей межмолекулярный контакт молекул эксендина, и замедленное высвобождение может быть обеспечено с помощью саморасщепляющегося линкера пролекарства между эксендином и полимерной матрицей.
Таким образом, будет возможным вводить эксендин в форме пролекарства по настоящему изобретению менее часто, чем современные эксендины длительного действия. Дополнительными преимуществами является небольшое соотношение максимального к минимальному уровней, которое значительно снижает риск побочных эффектов, таких как тошнота и желудочно-кишечные осложнения. Это может помочь снизить частоту инъекций у пациентов, при одновременной возможности поддерживать оптимальный контроль уровней эксендина в плазме и, следовательно, уровня глюкозы в крови.
Термин “эксендин”, относится к агонисту эксендина, аналогу эксендина, производному эксендина, укороченному эксендину, укороченному агонисту эксендина, укороченному производному эксендина, укороченному аналогу эксендина, удлиненному эксендину, удлиненному агонисту эксендина, удлиненному производному эксендина, удлиненному аналогу эксендина, GLP-1, аналогу GLP-1 или производному GLP-1, такому как GLP-1 или аналог GLP-1 в амидированной, укороченной или удлиненной форме. Предпочтительно, эксендин представляет собой эксендин или агонист эксендина с последовательностью ID 1-ID 21 (см. ниже), и более предпочтительно он представляет собой эксендин-3, имеющий последовательность ID 2, или эксендин-4, имеющий последовательность ID 1.
Термин “удлиненный” относится к пептидам или белкам, которые имеют дополнительные аминокислотные остатки на их N-конце или C-конце, или которые имеют внутренние вставки. Также термин относится к слитым конструкциям указанных пептидов или белков с другими пептидами или белками, например, такими как белок GST, пептид FLAG, пептид гекса-his, связывающий мальтозу белок.
Примерами агонистов эксендина, как используют в данном описании, являются агонисты эксендина-3 или эксендина-4, включая, но не ограничиваясь ими:
(i) аналоги эксендина-4 и амидированные аналоги эксендина-4, в последовательностях которых один или более аминокислотных остатков заменены отличающимися аминокислотными остатками, включая N-концевые модификации;
(ii) укороченные и удлиненные формы эксендина-4 и укороченные и удлиненные формы, которые являются амдированными;
(iii) укороченный и удлиненный эксендин-4 и укороченные и удлиненные формы, которые амидированы, в последовательностях которых один или более аминокислотных остатков заменены отличающимися аминокислотными остатками;
(iv) GLP-1 и амидированный GLP-1;
(v) аналоги GLP-1 и амидированные аналоги GLP-1, в последовательностях которых один или более аминокислотных остатков заменены отличающимися аминокислотными остатками, включая N-концевые модификации;
(vi) укороченный и удлиненный GLP-1 и укороченные и удлиненные формы, которые являются амидированными;
(vii) укороченный GLP-1 и укороченные формы, которые являются амидированными, в последовательностях которых один или более аминокислотных остатков заменены отличающимися аминокислотными остатками;
(viii) уже известные вещества AVE-0010/ZP-10/ликсисенатид (Sanofi-Aventis Zealand Pharma; последовательность ID 21), BAY-73-7977 (Bayer), TH-0318, BIM-51077 (Ipsen, Tejin, Roche), NN2211 (Novo Nordisk), LY315902.
Примерами агонистов эксендина, как описано выше, могут быть агонисты, в которых аналог эксендина-4 выбран из группы, состоящей из:
H-дезPro36-эксендин-4-Lys6-NH2,
H-дез(Pro36,37)-эксендин-4-Lys4-NH2 и
H-дез(Pro36,37)-эксендин-4-Lys5-NH2,
или их фармакологически приемлемой соли.
Дополнительными примерами агонистов эксендина, как описано выше, могут быть агонисты, в которых аналог эксендина-4 выбран из группы, состоящей из:
дезPro36 [Asp28]эксендин-4 (1-39),
дезPro36 [IsoAsp28]эксендин-4 (1-39),
дезPro36 [Met(O)14, Asp28]эксендин-4 (1-39),
дезPro36 [Met(O)14, IsoAsp28]эксендин-4 (1-39),
дезPro36 [Trp(O2)25, Asp28]эксендин-2 (1-39),
дезPro36 [Trp(O2)25, IsoAsp28]эксендин-2 (1-39),
дезPro36 [Met(O)14Trp(O2)25, Asp28]эксендин-4 (1-39) и
дезPro36 [Met(O)14Trp(O2)25, IsoAsp28]эксендин-4 (1-39),
или их фармакологически приемлемой соли.
Дополнительными примерами агонистов эксендина, как описано в предыдущем абзаце, могут быть агонисты, в которых пептид -Lys6-NH2 связан с C-концом аналогов эксендина-4.
Дополнительными примерами агонистов эксендина, как описано выше, могут быть агонисты, в которых аналог эксендина-4 выбран из группы, состоящей из:
H-(Lys)6-дезPro36 [Asp28]эксендин-4(1-39)-Lys6-NH2,
дезAsp28Pro36, Pro37, Pro38 эксендин-4(1-39)-NH2,
H-(Lys)6-дезPro36, Pro37, Pro38 [Asp28]эксендин-4(1-39)-NH2,
H-Asn-(Glu)5 дезPro36, Pro37, Pro38 [Asp28]эксендин-4(1-39)-NH2,
дезPro36, Pro37, Pro38 [Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-дезPro36, Pro37, Pro38 [Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-Asn-(Glu)5-дезPro36, Pro37, Pro38 [Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-дезPro36 [Trp(O2)25, Asp28]эксендин-4(1-39)-Lys6-NH2,
H-дезAsp28 Pro36, Pro37, Pro38 [Trp(O2)25]эксендин-4(1-39)-NH2,
H-(Lys)6-дезPro36, Pro37, Pro38 [Trp(O2)25, Asp28]эксендин-4(1-39)-NH2,
H-Asn-(Glu)5-дезPro36, Pro37, Pro38 [Trp(O2)25, Asp28]эксендин-4(1-39)-NH2,
дезPro36, Pro37, Pro38 [Trp(O2)25, Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-дезPro36, Pro37, Pro38 [Trp(O2)25, Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-Asn-(Glu)5-дезPro36, Pro37, Pro38 [Trp(O2)25, Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-дезPro36 [Met(O)14, Asp28]эксендин-4(1-39)-Lys6-NH2,
дезMet(O)14 Asp28 Pro36, Pro37, Pro38 эксендин-4(1-39)-NH2,
H-(Lys)6-дезPro36, Pro37, Pro38 [Met(O)14, Asp28]эксендин-4(1-39)-NH2,
H-Asn-(Glu)5-дезPro36, Pro37, Pro38 [Met(O)14, Asp28]эксендин-4(1-39)-NH2,
дезPro36, Pro37, Pro38 [Met(O)14, Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-дезPro36, Pro37, Pro38 [Met(O)14, Asp28]эксендин-4(1-39)-Lys6-NH2,
H-Asn-(Glu)5-дезPro36, Pro37, Pro38 [Met(O)14, Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-дезPro36 [Met(O)14, Trp(O2)25, Asp28]эксендин-4(1-39)-Lys6-NH2,
дезAsp28 Pro36, Pro37, Pro38 [Met(O)14, Trp(O2)25]эксендин-4(1-39)-NH2,
H-(Lys)6-дезPro36, Pro37, Pro38 [Met(O)14, Trp(O2)25, Asp28]эксендин-4(1-39)-NH2,
H-Asn-(Glu)5-дезPro36, Pro37, Pro38 [Met(O)14, Asp28]эксендин-4(1-39)-NH2,
дезPro36, Pro37, Pro38 [Met(O)14, Trp(O2)25, Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-дезPro36, Pro37, Pro38 [Met(O)14, Trp(O2)25, Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-Asn-(Glu)5-дезPro36, Pro37, Pro38 [Met(O)14, Trp(O2)25, Asp28]эксендин-4(1-39)-(Lys)6-NH2,
или их фармакологически приемлемой соли.
Дополнительным примером агонистов эксендина, как описано выше, является Arg34, Lys26 (Nε(γ-глутамил(Nα-гексадеканоил))) GLP-1 (7-37) [лираглутид] или его фармакологически приемлемая соль.
Агонисты эксендина имитируют активность эксендина-3 или эксендина-4 путем связывания рецептора(ов), на которые действуют эксендин-3 или эксендин-4, являющиеся полезными в качестве инсулинотропных веществ и для лечения сахарного диабета, или путем имитирования эффектов эксендина на выделение мочи, замедления опустошения желудка, индукции чувства сытости, увеличения экскреции натрия с мочой и/или снижения концентрации калия в моче, путем связывания с рецептором(ами), где эксендин вызывает эти эффекты.
В одном варианте осуществления эксендин или агонисты эксендина с последовательностями ID NO:1-22 можно использовать для получения полимерных конъюгатов длительного действия по изобретению:
[Seq ID No:1] Эксендин-4
HGEGTFTSDL SKQMEEEAVR LFIEWLKNGG PSSGAPPPS-NH2
[Seq ID No:2] Эксендин-3
HSDGTFTSDL SKQMEEEAVR LFIEWLKNGG PSSGAPPPS-NH2
[Seq ID No:3]
HGEGTFTSDL SKQMEEEAVR LFIEWLKNGG P
[Seq ID No:4]
HGEGTFTSDL SKQMEEEAVR LFIEWLKNGG Y
[Seq ID No:5]
HGEGTFTSDL SKQMEEEAVR LFIEWLKNGG
[Seq ID No:6]
HGEGTFTSDL SKQMEEEAVR LFIEWLKNGG-NH2
[Seq ID No:7]
HGEGTFTSDL SKQMEEEAVR LFIEWLKN-NH2
[Seq ID No:8]
HGEGTFTSDL SKQLEEEAVR LFIEFLKNGG PSSGAPPPS-NH2
[Seq ID No:9]
HGEGTFTSDL SKQLEEEAVR LFIEFLKN-NH2
[Seq ID No:10]
HGEGTFTSDL SKQLEEEAVR LAIEFLKN-NH2
[Seq ID No:11]
HGEGTFTSDL SKQLEEEAVR LFIEWLKNGG PSSGAPPPS-NH2
[Seq ID No:12]
HGDGTFTSDL SKQMEEEAVR LFIEWLKNGG PSSGAPPPS-NH2
[Seq ID No:13] GLP-1(7-36)амид
HAEGTFTSDV SSYLEGQAAK EFIAWLVKGR-NH2
[Seq ID No:14]
HSEGTFTSDV SSYLEGQAAK EFIAWLVKGR-NH2
[Seq ID No:15] GLP-1(7-37)
HAEGTFTSDV SSYLEGQAAK EFIAWLVKGRG
[Seq ID No:16]
HAXaaGTFTSDV SSYLEGQAAK EFIAWLVKGR-NH2
Xaa=P, F, Y
[Seq ID No:17]
HXaaEGTFTSDV SSYLEGQAAK EFIAWLVKGR-NH2
Xaa=T, a-аминомасляная кислота, D-Ala, V, Gly
[Seq ID No:18]
HaEGTFTSDV SSYLEGQAAK EFIAWLVKGG
[Seq ID No:19]
R-HAEGTFTSDV SSYLEGQAAK EFIAWLVKGR-NH2
R=ацетил, пироглутамил, N-2-гидроксибензоил, N-транс-3-гексеноил
[Seq ID No:20]
HXaaAEGTFTSDV SSYLEGQAAK EFIAWLVKGR-NH2
Xaa=6-аминогексаноил
[Seq ID No:21] AVE-0010/ZP-10/ликсисенатид
HGEGTFTSDLSKQMEEEAVRLFIEWLKNGGPSSGAPPSKKKKKK-NH2
[Seq ID No:22] Arg34, Lys26 (Nε(γ-глутамил(Nα-гексадеканоил))) GLP-1(7-37)[лираглутид]
HAEGTFTSDV SSYLEGQAAXaaEFIAWLVRGRG
Xaa=Lys(Nε(γ-глутамил(Nα-гексадеканоил)))
Предпочтительно, эксендин имеет последовательность ID 1, ID 13, ID 15, ID 21 или ID 22.
Более предпочтительно, эксендин имеет последовательность ID 1, ID 13 или ID 21.
В одном варианте осуществления эксендин представляет собой эксендин-4, имеющий последовательность ID 1.
В другом варианте осуществления эксендин представляет собой аналог, имеющий последовательность ID 13.
В другом варианте осуществления эксендин представляет собой аналог, имеющий последовательность ID 21.
Эксендин и производные агонистов эксендина по изобретению обладают любыми и всеми из видов активности, проявляемой исходной немодифицированной молекулой, но с более длительным действием.
Эксендин, связанный с биологически неактивным линкером, называют “частью эксендина”.
“Биологически неактивный линкер” означает линкер, который не обладает фармакологическими эффектами лекарственного средства, полученного из биологически активного вещества.
“Защитные группы” относятся к части, которая временно защищает химическую функциональную группу молекулы в процессе синтеза, обеспечивая хемоселективность в последующих химических реакциях. Защитными группами для спиртов являются, например, бензил и тритил, защитными группами для аминов являются, например, трет-бутилоксикарбонил, 9-флуоренилметилоксикарбонил и бензил, и для тиолов примерами защитных групп являются 2,4,6-триметоксибензил, фенилтиометил, ацетамидометил, п-метоксибензилоксикарбонил, трет-бутилтио, трифенилметил, 3-нитро-2-пиридилтио, 4-метилтритил.
“Защищенные функциональные группы” означают химическую функциональную группу, защищенную защитной группой.
“Ацилирующий агент” означает часть в виде структуры R-(C=O)-, предоставляющую ацильную группу в реакции ацилирования, необязательно соединенную с уходящей группой, такой как хлорангидрид кислоты, N-гидроксисукцинимид, пентафторфенол и паранитрофенол.
“Алкил” означает прямую или разветвленную углеродную цепь. Каждый водород на атомах углерода алкила может быть заменен заместителем.
“Арил” относится к любому заместителю, образованному из моноциклического или полициклического или конденсированного ароматического кольца, включая гетероциклические кольца, например, фенил, тиофен, индолил, нафтил, пиридил, которые необязательно могут быть дополнительно замещенными.
“Ацил” означает химическую функциональную группу структуры R-(C=O)-, где R представляет собой алкил или арил.
"C1-4алкил" означает алкильную цепь, имеющую 1-4 атома углерода, например, если она присутствует на конце молекулы: метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, или, например, -CH2-, -CH2-CH2-, -CH(CH3)-, -CH2-CH2-CH2-, -CH(C2H5)-, -C(CH3)2-, когда две части молекулы связаны алкильной группой. Каждый водород на атомах углерода C1-4алкила может быть заменен заместителем.
"C1-6алкил" означает алкильную цепь, имеющую 1-6 атомов углерода, например, если она присутствует на конце молекулы: C1-4алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил; трет-бутил, н-пентил, н-гексил или, например, -CH2-, -CH2-CH2-, -CH(CH3)-, -CH2-CH2-CH2-, -CH(C2H5)-, -C(CH3)2-, когда две части молекулы связаны алкильной группой. Каждый водород на атомах углерода C1-6алкила может быть заменен заместителем.
Таким образом, “C1-18алкил” означает алкильную цепь, имеющую 1-18 атомов углерода, и “C8-18алкил” означает алкильную цепь, имеющую 8-18 атомов углерода. Таким образом, “C1-50алкил” означает алкильную цепь, имеющую 1-50 атомов углерода.
“C2-50алкенил” означает разветвленную или неразветвленную алкенильную цепь, имеющую 2-50 атомов углерода, например, если она присутствует на конце молекулы: -CH=CH2, -CH=CH-CH3, -CH2-CH=CH2, -CH=CH-CH2-CH3, -CH=CH-CH=CH2 или, например, -CH=CH-, когда две части молекулы связаны алкенильной группой. Каждый водород на атомах углерода C2-50алкенила может быть заменен заместителем, как описано ниже. Таким образом, термин “алкенил” относится к углеродной цепи, по меньшей мере, с одной углерод-углеродной двойной связью. Необязательно, может присутствовать одна или более тройных связей.
“C2-50алкинил” означает разветвленную или неразветвленную алкинильную цепь, имеющую 2-50 атомов углерода, например, если она присутствует на конце молекулы: -C≡CH, -CH2-C≡CH, CH2-CH2-C≡CH, CH2-C≡C-CH3, или например -C≡C-, когда две части молекулы соединены алкинильной группой. Каждый водород на атомах углерода C2-50алкинила может быть заменен заместителем, как описано ниже. Таким образом, термин “алкинил” относится к углеродной цепи, по меньшей мере, с одной углерод-углеродной тройной связью. Необязательно, может присутствовать одна или более двойных связей.
"C3-7циклоалкил" или "C3-7циклоалкильное кольцо" означает циклическую алкильную цепь, имеющую 3-7 атомов углерода, которая может иметь углерод-углеродные двойные связи и является, по меньшей мере, частично насыщенной, например циклопропил, циклобутил, циклопентил, циклогексил, циклогексенил, циклогептил. Каждый водород на атомах углерода циклоалкила может быть заменен заместителем. Термин "C3-7циклоалкил" или "C3-7циклоалкильное кольцо" также включает мостиковые бициклы, такие как норбонан и нобонен. Таким образом, "C3-5циклоалкил" означает циклоалкил, имеющий 3-5 атомов углерода.
Таким образом, “C3-10циклоалкил” означает циклический алкил, имеющий 3-10 атомов углерода, например C3-7циклоалкил; циклопропил, циклобутил, циклопентил, циклогексил, циклогексенил, циклогептил, циклооктил, циклононил, циклодецил. Термин “C3-10циклоалкил” также включает, по меньшей мере, частично насыщенные карбомоно- и -бициклы.
"Галоген" означает фтор, хлор, бром или йод. Главным образом, предпочтительно, галоген представляет собой фтор или хлор.
"4-7-членный гетероциклил" или "4-7-членный гетероцикл" означает кольцо с 4, 5, 6 или 7 атомами кольца, которое может содержать вплоть до максимального количества двойных связей (ароматическое или неароматическое кольцо, которое является полностью, частично насыщенным или ненасыщенным), где, по меньшей мере, от одного атома кольца вплоть до 4 атомов кольца заменены гетероатомом, выбранным из группы, состоящей из серы (включая -S(O)-, -S(O)2-), кислорода и азота (включая=N(O)-) и где кольцо связано с остальной частью молекулы через атом углерода или азота. Примерами 4-7-членных гетероциклов являются азетидин, оксетан, тиетан, фуран, тиофен, пиррол, пирролин, имидазол, имидазолин, пиразол, пиразолин, оксазол, оксазолин, изоксазол, изоксазолин, тиазол, тиазолин, изотиазол, изиотиазолин, тиадиазол, тиадиазолин, тетрагидрофуран, тетрагидротиофен, пирролидин, имидазолидин, пиразолидин, оксазолидин, изоксазолидин, тиазолидин, изотиазолидин, тиадиазолидин, сульфолан, пиран, дигидропиран, тетрагидропиран, имидазолидин, пиридин, пиридазин, пиразин, пиримидин, пиперазин, пиперидин, морфолин, тетразол, триазол, триазолидин, тетразолидин, диазепан, азепин или гомопиперазин.
"9-11-членный гетеробициклил" или "9-11-членный гетеробицикл" означает гетероциклическую систему из двух колец с 9-11 атомами кольца, где, по меньшей мере, один атом кольца является общим для обоих колец, и которая может содержать вплоть до максимального количества двойных связей (ароматическое или неароматическое кольцо, которое является полностью, частично насыщенным или ненасыщенным), где, по меньшей мере, от одного атома кольца вплоть до 6 атомов кольца заменены гетероатомом, выбранным из группы, состоящей из серы (включая -S(O)-, -S(O)2-), кислорода и азота (включая=N(O)-), и где кольцо связано с остальной частью молекулы через атом углерода или серы. Примерами 9-11-членного гетеробицикла являются индол, индолин, бензофуран, бензотиофен, бензоксазол, бензизоксазол, бензотиазол, бензизотиазол, бензимидазол, бензимидазолин, хинолин, хиназолин, дигидрохиназолин, хинолин, дигидрохинолин, тетрагидрохинолин, декагидрохинолин, изохинолин, декагидроизохинолин, тетрагидроизохинолин, дигидроизохинолин, бензазепин, пурин или птеридин. Термин 9-11-членный гетеробицикл также включает спироструктуры из двух колец, такие как 1,4-диокса-8-азаспиро[4.5]декан, или мостиковые гетероциклы, такие как 8-азабицикло[3.2.1]октан.
В случае, когда пролекарства эксендина, содержащие соединения формулы (I), содержат одну или более кислотных или основных групп, изобретение также относится к их соответствующим фармацевтически или токсикологически приемлемым солям, в частности, к их пригодным для фармацевтического использования солям. Таким образом, пролекарства эксендина, содержащие соединения формулы (I), которые содержат кислотные группы, можно использовать в соответствии с изобретением, например, в виде солей щелочных металлов, солей щелочноземельных металлов или в виде солей аммония. Более точные примеры таких солей включают соли натрия, соли калия, соли кальция, соли магния или соли аммония или органических аминов, например, таких как этиламин, этаноламин, триэтаноламин или аминокислоты. Пролекарства эксендина, содержащие соединения формулы (I), которые содержат одну или более основных групп, т.е. группы, которые могут быть протонированы, могут присутствовать и могут быть использованы в соответствии с изобретением в форме их аддитивных солей с неорганическими или органическими кислотами. Примеры пригодных кислот включают хлористоводородную кислоту, бромистоводородную кислоту, фосфорную кислоту, серную кислоту, азотную кислоту, метансульфоновую кислоту, паратолуолсульфоновую кислоту, нафталиндисульфоновые кислоты, щавелевую кислоту, уксусную кислоту, винную кислоту, молочную кислоту, салициловую кислоту, бензойную кислоту, муравьиную кислоту, пропионовую кислоту, пивалевую кислоту, диэтилуксусную кислоту, малоновую кислоту, янтарную кислоту, пимелиновую кислоту, фумаровую кислоту, малеиновую кислоту, яблочную кислоту, сульфаминовую кислоту, фенилпропионовую кислоту, глюконовую кислоту, аскорбиновую кислоту, изоникотиновую кислоту, лимонную кислоту, адипиновую кислоту и другие кислоты, известные специалисту в данной области. Если пролекарства эксендина, содержащие соединения формулы (I), одновременно содержат кислотные и основные группы в молекуле, изобретение также включает, в дополнение к приведенным солевым формам, внутренние соли или бетаины (цвиттерионы). Соответствующие соли пролекарств эксендина формулы (I) можно получать общепринятыми способами, которые известны специалисту в данной области, например, путем их приведения в контакт с органической или неорганической кислотой или основанием в растворителе или диспергирующем веществе, или путем анионного обмена или катионного обмена с другими солями. Настоящее изобретение также относится ко всем солям пролекарств эксендина, содержащих соединения формулы (I), которые, вследствие низкой физиологической совместимости, прямо не пригодны для применения в фармацевтических препаратах, но которые можно использовать, например, в качестве промежуточных соединений для химических реакций или для получения фармацевтически приемлемых солей.
Для улучшения физико-химических или фармакокинетических свойств лекарственного средства, такого как эксендин, in vivo, такое лекарственное средство можно конъюгировать с носителем. Если лекарственное средство временно связано с носителем и/или линкером, такие системы обычно относят к связанным с носителем пролекарствам. Согласно определениям, предоставленным IUPAC (приведенным на http://www.chem.qmul.ac.uk/iupac.medchem, доступном с 22 июля 2009 года), связанное с носителем пролекарство представляет собой пролекарство, которое содержит временную связь данного активного вещества с временной группой носителя, которая обеспечивает улучшенные физико-химические или фармакокинетические свойства и которая может быть легко удалена in vivo, обычно гидролитическим расщеплением.
Линкеры, используемые в таких связанных с носителем пролекарствах, могут быть временными, что означает, что они являются неферментативно гидролитически деградируемыми (расщепляемыми) в физиологических условиях (водный буфер при pH 7,4, 37°C) со временем полужизни в диапазоне, например, от одного часа до трех месяцев.
Носители в виде гидрогелей могут быть либо прямо конъюгированы с линкером L, либо через спейсер, предпочтительно нерасщепляющийся спейсер. Термин “пролекарство эксендина с гидрогелем” относится к связанным с носителем пролекарствам эксендина, где носителем является гидрогель. Термины “пролекарство с гидрогелем” и “связанное с гидрогелем пролекарство” относятся к пролекарствам биологически активных веществ, временно связанных с гидрогелем, и используются как синонимы.
“Гидрогель” может быть определен как трехмерная гидрофильная или амфифильная полимерная сеть, способная поглощать большие количества воды. Сети состоят из гомополимеров или сополимеров и нерастворимы вследствие присутствия ковалентных химических или физических (ионные, гидрофобные взаимодействия, зацепление) сшивок. Сшивки обеспечивают структуру сети и физическую целостность. Гидрогели проявляют термодинамическую совместимость с водой, которая позволяет им набухать в водной среде. Цепи сети соединены таким образом, чтобы существовали поры, и чтобы существенная часть этих пор имела размеры от 1 нм до 1000 нм.
“Свободная форма” лекарственного средства относится к лекарственному средству, в частности эксендину, в его немодифицированной, фармакологически активной форме, как например, после высвобождения из конъюгата с полимером.
Понятно, что фармакологически активная форма эксендина также включает окисленное и дезамидированное лекарственное средство.
Термины "лекарственное средство", "биологически активная молекула", "биологически активная часть", "биологически активное вещество", "активное вещество", используют взаимозаменяемо, и они относятся к эксендину, либо в его связанной, либо в его свободной форме.
"Терапевтически эффективное количество" эксендина, как используют в данном описании, означает количество, достаточное для излечения, смягчения или частичной остановки клинических проявлений данного заболевания и его осложнений. Количество, достаточное для этого, определяют как "терапевтически эффективное количество". Эффективное количество для каждой цели зависит от тяжести заболевания или повреждения, а также от массы тела и общего состояния индивидуума. Следует понимать, что определение соответствующих дозировок можно проводить с использованием стандартного экспериментирования, путем конструирования матрицы значений и исследования различных точек матрицы, что находится в пределах обычной квалификации опытного врача.
“Стабильный” и “стабильность” означает, что в течение указанного времени хранения конъюгаты с гидрогелем остаются конъюгированными и не гидролизуются в значительной степени и проявляют приемлемый профиль примесей с точки зрения эксендина. Чтобы считаться стабильной, композиция содержит менее 5% лекарственного средства в его свободной форме.
Термин “фармацевтически приемлемый” означает одобренный органом регулирования, таким как EMEA (Европа) и/или FDA (США), и/или любым другим национальным органом регулирования для применения у животных, предпочтительно у человека.
"Фармацевтическая композиция" или “композиция” означает один или более активных ингредиентов, и один или более инертных ингредиентов, а также любой продукт, который получен в результате, прямо или косвенно, комбинирования, образования комплекса или агрегации двух или более ингредиентов, или диссоциации одного или более ингредиентов, или других типов реакций или взаимодействий одного или более ингредиентов. Таким образом, фармацевтические композиции по настоящему изобретению охватывают любую композицию, полученную смешиванием соединения по настоящему изобретению и фармацевтически приемлемого эксципиента (фармацевтически приемлемый носитель).
“Сухая композиция” означает, что композиция пролекарства эксендина с гидрогелем предоставлена в сухой форме в контейнере. Пригодными способами сушки являются распылительная сушка и лиофилизация (сублимационная сушка). Такая сухая композиция пролекарства гидрогеля с эксендином имеет остаточное содержание воды максимум 10%, предпочтительно менее 5% и более предпочтительно менее 2% (определяемое согласно Карлу Фишеру). Предпочтительным способом сушки является лиофилизация. “Лиофилизированная композиция” означает, что пролекраство эксендина с полимером гидрогеля было сначала заморожено, а затем подвергнуто снижению количества воды путем пониженного давления. Эта терминология не исключает стадий сушки, которые происходят в процессе изготовления перед заполнением композицией конечного контейнера.
“Лиофилизация” (сублимационная сушка) представляет собой процесс дегидратации, характеризующийся замораживанием композиции, а затем уменьшением окружающего давления и, необязательно, добавлением нагревания для обеспечения сублимации замороженной воды в композиции непосредственно из твердой фазы в газ. Как правило, сублимированную воду собирают десублимацией.
“Восстановление” означает добавление жидкости к сухой композиции для преобразования ее в форму жидкой или суспензионной композиции. Следует понимать, что термин “восстановление” не ограничивается добавлением воды, и относится к любой жидкости, включая, например, буферы или другие водные растворы.
“Раствор для восстановления” относится к жидкости, используемой для восстановления сухой композиции пролекарства эксендина с гидрогелем перед введением пациенту, нуждающемуся в этом.
“Контейнер” означает любой контейнер, в котором композиция пролекарства эксендина с гидрогелем содержится и может храниться до восстановления.
“Буфер” или “буферное средство” относится к химическим соединениям, которые поддерживают pH в желаемом диапазоне. Физиологически приемлемыми буферами являются, например, фосфат натрия, сукцинат, гистидин, бикарбонат, цитрат и ацетат, пируват. Также можно использовать антациды, такие как Mg(OH)2 или ZnCO3. Буферную емкость можно корректировать так, чтобы она соответствовала условиям, наиболее чувствительным к стабильности pH.
“Эксципиенты” относятся к соединениям, вводимым вместе с лекарственным средством, например, буферным средствам, модификаторам тоничности, консервантам, стабилизаторам, средствам против адсорбции, защищающим от окисления средствам или другим вспомогательным веществам. Однако в некоторых случаях один эксципиент может иметь двойные или тройные функции.
"Лиопротектор" представляет собой молекулу, которая, когда она комбинирована с представляющим интерес белком, значительно препятствует химической и/или физической нестабильности белка, или снижает ее, при сушке в целом и особенно в ходе лиофилизации и последующего хранения. Иллюстративные лиопротекторы включают сахара, такие как сахароза или трегалоза; аминокислоты, такие как аргинин, глицин, глутамат или гистидин; метиламины, такие как бетаин; лиотропные соли, такие как сульфат магния; полиолы, такие как трехатомные или высшие спирты сахаров, например, глицерин, эритрит, глицерин, арабит, ксилит, сорбит и маннит; этиленгликоль; пропиленгликоль; полиэтиленгликоль; плюроники; гидроксиалкилкрахмалы, например, гидроксиэтилкрахмал (HES) и их комбинации.
“Поверхностно-активное вещество” относится к смачивающим веществам, которые снижают поверхностное натяжение жидкости.
“Модификаторы тоничности” относятся к соединениям, которые минимизируют боль, которая может быть результатом повреждения клеток вследствие различий в осмотическом давлении в депо инъекции.
Термин “стабилизаторы” относится к соединениям, используемым для стабилизации полимерного пролекарства. Стабилизации достигают путем усиления стабилизирующих белок сил, путем дестабилизации денатурированного состояния или путем прямого связывания эксципиентов с белком.
“Средства против адсорбции” относятся в основном к ионным или неионным поверхностно-активным веществам, или другим белкам, или растворимым полимерам, используемым для покрытия или конкурентной адсорбции к внутренней поверхности контейнера композиции. Выбираемая концентрация и тип эксципиента зависят от эффекта, которого хотят избежать, но, как правило, монослой поверхностно-активного вещества образуется на поверхности контакта при величине немного выше величины CMC.
“Защищающие от окисления средства” относятся к антиоксидантам, таким как аскорбиновая кислота, эктоин, глутатион, метионин, монотиоглицерин, морин, полиэтиленимин (PEI), пропилгаллат, витамин E, хелатирующим агентам, таким как лимонная кислота, EDTA, гексафосфат, тиогликолевая кислота.
“Противомикробное средство” относится к химическому веществу, которое уничтожает или ингибирует рост микроорганизмов, таких как бактерии, грибы, дрожжи, простейшие, и/или разрушает вирусы.
“Герметизация контейнера” означает, что контейнер закрывают таким образом, чтобы он был непроницаемым для воздуха, не позволяя газообмен между внешней стороной и внутренней стороной и поддерживая содержимое стерильным.
Термин “реагент” или “предшественник” относится к промежуточному соединению или исходному веществу, используемому в процессе сборки, ведущем к пролекарству по настоящему изобретению.
Термин “химическая функциональная группа” относится к карбоновой кислоте и активированным производным, амино, малеинимиду, тиолу и производным, сульфоновой кислоте и производным, карбонату и производным, карбамату и производным, гидроксилу, альдегиду, кетону, гидразину, изоцианату, изотиоцианату, фосфорной кислоте и производным, фосфоновой кислоте и производным, галоацетилу, алкилгалогенидам, акрилоилу и другим альфа-бета ненасыщенным акцепторам Майкла, арилирующим агентам, таким как арилфториды, гидроксиламину, дисульфидам, таким как пиридилдисульфид, винилсульфону, винилкетону, диазоалканам, диазоацетильным соединениям, оксирану и азиридину.
Если химическая функциональная группа связана с другой химической функциональной группой, полученную химическую структуру называют “соединительным элементом”. Например, взаимодействие аминогруппы с карбоксильной группой приводит к амидному соединительному элементу.
“Реакционноспособные функциональные группы” представляют собой химические функциональные группы на каркасной части, которые связаны с гиперразветвленной частью.
“Функциональная группа” представляет собой общий термин, используемый для “реакционноспособной функциональной группы”, “деградируемой связывающей функциональной группы” или “функциональной группы”.
“Деградируемая связывающая функциональная группа” представляет собой соединительный элемент, содержащий биодеградируемую связь, который на одной стороне связан со спейсерной частью, соединенной с каркасной частью, а на другой стороне связан со сшивающей частью. Термины “деградируемая связывающая функциональная группа”, “биодеградируемая связывающая функциональная группа”, “связывающая биодеградируемая функциональная группа” и “связывающая функциональная группа” используют взаимозаменяемо.
Термины “блокирующая группа” или “кэп-группа” используют взаимозаменяемо и они относятся к частям, которые необратимо связаны с реакционноспособными функциональными группами, чтобы они были неспособны взаимодействовать, например, с химическими функциональными группами.
Термины “защитная группа” или “защищающая группа” относятся к части, которая обратимо связана с реакционноспособными функциональными группами, чтобы они были неспособны взаимодействовать, например, с другими химическими функциональными группами.
Термин “связывающая функциональная группа” относится к химическим функциональным группам, которые участвуют в реакции радикальной полимеризации и являются частью сшивающего реагента или каркасного реагента.
Термин “полимеризующаяся функциональная группа” относится к химическим функциональным группам, которые участвуют в реакции полимеризации по типу сшивания и являются частью сшивающего реагента и каркасного реагента.
Каркасная часть может содержать спейсерную часть, которая на одном конце связана с каркасной частью, и на другой стороне связана со сшивающей частью.
Термин “производные” относится к химическим функциональным группам, подходящим образом замещенным защитными и/или активирующими группами, или к активированным формам соответствующей химической функциональной группы, которые известны специалисту в данной области. Например, активированные формы карбоксильных групп включают, но не ограничиваются ими, активные сложные эфиры, такие как сукцинимидиловый сложный эфир, бензотриазиловый сложный эфир, нитрофениловый сложный эфир, пентафторфениловый сложный эфир, азабензотриазиловый сложный эфир, ацилгалогениды, смешанные или симметричные ангидриды, ацилимидазол.
Термин “неферментативно расщепляемый линкер” относится к линкерам, которые гидролитически деградируются в физиологических условиях без ферментативной активности.
“Биологически неактивный линкер” означает линкер, который не обладает фармакологическими эффектами лекарственного средства (D-H), происходящего из биологически активной части.
Термины “спейсер”, “спейсерная группа”, “спейсерная молекула” и “спейсерная часть” используют взаимозаменяемо и, если их используют для описания части, присутствующей в носителе на основе гидрогеля по изобретению, относятся к любой части, способной соединять две части, такой как C1-50алкил, C2-50алкенил или C2-50алкинил, и этот фрагмент необязательно прерывается одной или более группами, выбранными из -NH-, -N(C1-4алкила)-, -O-, -S-, -C(O)-, -C(O)NH-, -C(O)N(C1-4алкила)-, -O-C(O)-, -S(O)-, -S(O)2-, 4-7-членного гетероциклила, фенила или нафтила.
Термины “концевой”, “конец” или “дистальный конец” относятся к положению функциональной группы или соединительному элементу в молекуле или части, где такая функциональная группа может быть химической функциональной группой, и соединительный элемент может быть деградируемым или постоянным соединительным элементом, отличаясь тем, что они расположены рядом или в соединительном элементе между двумя частями или на конце олигомерной или полимерной цепи.
Выражения “в связанной форме” или “часть” относятся к субструктурам, которые являются частью более крупной молекулы. Выражение “в связанной форме” используют для упрощения указания на части, называя или перечисляя реагенты, исходные вещества или гипотетические исходные вещества, известные в данной области, и при этом “в связанной форме” означает, что, например, один или более водородных радикалов (-H), или одна или более активирующих или защитных групп, присутствующих в реагентах или исходных веществах, не присутствуют в части.
Следует понимать, что все реагенты и части, содержащие полимерные части, относятся к макромолекулярным структурам, известным, как проявляющим непостоянство в отношении молекулярной массы, длины цепи или степени полимеризации, или количества функциональных групп. Таким образом, структуры, показанные для каркасных реагентов, каркасных частей, сшивающих реагентов и сшивающих частей, являются только конкретными примерами.
Реагент или часть могут быть линейными или разветвленными. Если реагент или часть имеет две концевых группы, их называют линейным реагентом или частью. Если реагент или часть имеют более двух концевых групп, их считают разветвленным или мультифункциональным реагентом или частью.
Термин “полимерная цепь на основе поли(этиленгликоля)” или “цепь на основе PEG” относится к олиго- или полимерной молекулярной цепи.
Предпочтительно, такая полимерная цепь на основе поли(этиленгликоля) связана с центром ветвления и представляет собой линейную цепь поли(этиленгликоля), в которой один конец соединен с центром ветвления, и другой конец соединен с гиперразветвленной дендритной частью. Следует понимать, что цепь на основе PEG может оканчиваться или прерываться алкильными или арильными группами, необязательно замещенными гетероатомами и химическими функциональными группами.
Если термин “полимерная цепь на основе поли(этиленгликоля)” используют в отношении сшивающего реагента, он относится к сшивающей части или цепи, содержащей, по меньшей мере, 20% масс. частей этиленгликоля.
В следующих разделах изобретение описано более подробно.
Настоящее изобретение относится к пролекарству или его фармацевтически приемлемой соли, содержащим конъюгат эксендина с линкером D-L, где
D представляет собой часть эксендина; и
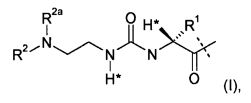
-L представляет собой биологически неактивную линкерную часть, -L1 представлен формулой (I):
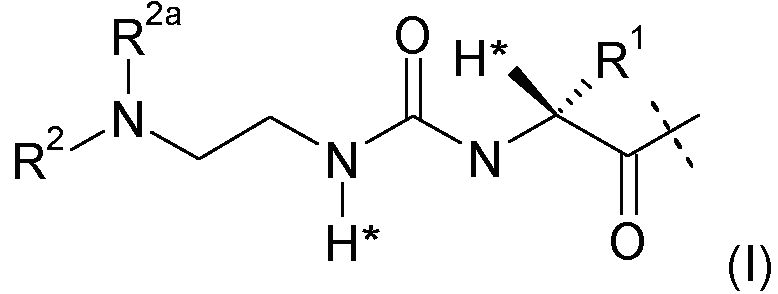 ,
,
где пунктирная линия указывает на присоединение к одной из аминогрупп части эксендина с образованием амидной связи;
R1 выбран из C1-4алкила, предпочтительно CH3;
R2, R2a независимо выбраны из группы, состоящей из H и C1-4алкила;
где L1 замещен одним L2-Z и является необязательно дополнительно замещенным, при условии, что атомы водорода, обозначенные звездочками в формуле (I), не заменены заместителем, и где
L2 представляет собой простую химическую связь или спейсер; и
Z представляет собой гидрогель.
Предпочтительно, в формуле (I) R2 заменен L2-Z.
Предпочтительно, в формуле (I) R1 представляет собой CH2-L2-Z.
Предпочтительно, L1 не является дополнительно замещенным.
Предпочтительно, часть эксендина связана с L1 через N-концевой азот или через азот боковой цепи лизина части эксендина. Наиболее предпочтительно, часть эксендина связана с L1 через N-концевой азот.
Предпочтительные пролекарства по настоящему изобретению включают конъюгаты эксендина с линкером D-L, где L представлен формулами (Ia) или (Ib):
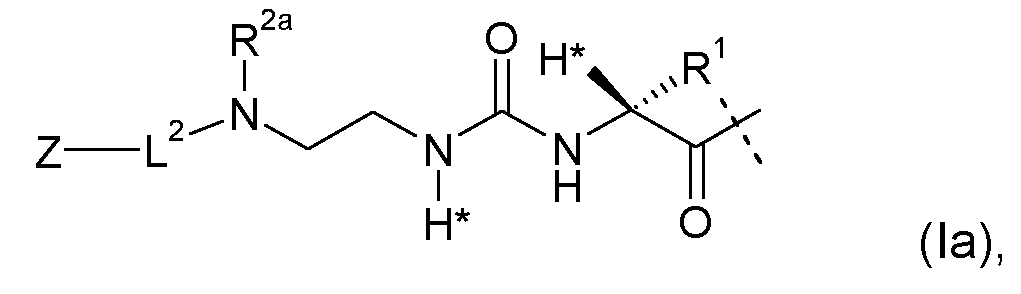
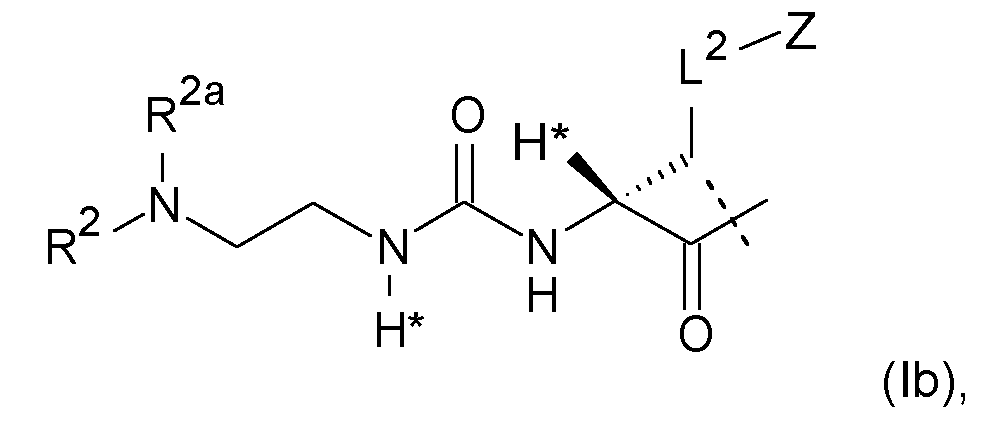
где D, R1, R2, R2a, L2, Z имеют значение и предпочтительное значение, как указано в настоящем описании, и где L является необязательно дополнительно замещенным, при условии, что атомы водорода, обозначенные звездочками в формуле (Ia) или (Ib), не заменены заместителем, однако предпочтительно L не является дополнительно замещенным (помимо обязательного заместителя L2-Z, уже показанного на (Ia) и (Ib)).
Как показано, например, в формулах (Ia) или (Ib), один атом водорода L1 формулы (I) заменен группой L2-Z.
Как правило, L2 может быть связан с L1 в формуле (I) в любом положении, помимо замены атомов водорода, обозначенных звездочками. Предпочтительно, один из атомов водорода, предоставляемых R1, R2, R2a прямо или в качестве водорода C1-4алкила или других групп, заменен L2-Z.
Более того, L1 формулы (I) может быть и необязательно дополнительно замещенным. Как правило, можно использовать любой заместитель, при условии, что это не влияет на расщепление. Однако предпочтительно, чтобы L1 не был дополнительно замещенным.
Предпочтительно, один или более дополнительных необязательных заместителей независимо выбраны из группы, состоящей из галогена; CN; COOR9; OR9; C(O)R9; C(O)N(R9R9a); S(O)2N(R9R9a); S(O)N(R9R9a); S(O)2R9; S(O)R9; N(R9)S(O)2N(R9aR9b); SR9; N(R9R9a); NO2; OC(O)R9; N(R9)C(O)R9a; N(R9)S(O)2R9a; N(R9)S(O)R9a; N(R9)C(O)OR9a; N(R9)C(O)N(R9aR9b); OC(O)N(R9R9a); T; C1-50алкила; C2-50алкенила или C2-50алкинила, где T, C1-50алкил, C2-50алкенил и C2-50алкинил необязательно замещены одним или более R10, которые являются одинаковыми или различными, и где C1-50алкил, C2-50алкенил и C2-50алкинил необязательно прерываются одной или более группами, выбранными из группы, состоящей из T, -C(O)O-; -O-; -C(O)-; -C(O)N(R11)-; -S(O)2N(R11)-; -S(O)N(R11)-; -S(O)2-; -S(O)-; -N(R11)S(O)2N(R11a)-; -S-; -N(R11)-; -OC(O)R11; -N(R11)C(O)-; -N(R11)S(O)2-; -N(R11)S(O)-; -N(R11)C(O)O-; -N(R11)C(O)N(R11a)- и -OC(O)N(R11R11a);
R9, R9a, R9b независимо выбраны из группы, состоящей из H; T и C1-50алкила; C2-50алкенила или C2-50алкинила, где T, C1-50алкил, C2-50алкенил и C2-50алкинил необязательно замещены одним или более R10, которые являются одинаковыми или различными, и где C1-50алкил, C2-50алкенил и C2-50алкинил необязательно прерываются одной или более группами, выбранными из группы, состоящей из T, -C(O)O-; -O-; -C(O)-; -C(O)N(R11)-; -S(O)2N(R11)-; -S(O)N(R11)-; -S(O)2-; -S(O)-; -N(R11)S(O)2N(R11a)-; -S-; -N(R11)-; -OC(O)R11; -N(R11)C(O)-; -N(R11)S(O)2-; -N(R11)S(O)-; -N(R11)C(O)O-; -N(R11)C(O)N(R11a)- и -OC(O)N(R11R11a);
T выбран из группы, состоящей из фенила; нафтила; инденила; инданила; тетралинила; C3-10циклоалкила; 4-7-членного гетероциклила или 9-11-членного гетеробициклила, где T необязательно замещен одним или более R10, которые являются одинаковыми или различными;
R10 представляет собой галоген; CN; оксо (=O); COOR12; OR12; C(O)R12; C(O)N(R12R12a); S(O)2N(R12R12a); S(O)N(R12R12a); S(O)2R12; S(O)R12; N(R12)S(O)2N(R12aR12b); SR12; N(R12R12a); NO2; OC(O)R12; N(R12)C(O)R12a; N(R12)S(O)2R12a; N(R12)S(O)R12a; N(R12)C(O)OR12a; N(R12)C(O)N(R12aR12b); OC(O)N(R12R12a) или C1-6алкил, где C1-6алкил необязательно замещен одним или более атомами галогена, которые являются одинаковыми или различными;
R11, R11a, R12, R12a, R12b независимо выбраны из группы, состоящей из H или C1-6алкила, где C1-6алкил необязательно замещен одним или более атомами галогена, которые являются одинаковыми или различными.
Термин “прерывается” означает, что между двумя атомами углерода или на конце углеродной цепи между углеродом и водородом встроена группа.
L2 представляет собой простую химическую связь или спейсер. В случае, когда L2 представляет собой спейсер, его предпочтительно определяют как один или более необязательных заместителей, определенных выше, при условии, что L2 замещен Z.
Таким образом, когда L2 отличается от простой химической связи, L2-Z представляет собой COOR9; OR9; C(O)R9; C(O)N(R9R9a); S(O)2N(R9R9a); S(O)N(R9R9a); S(O)2R9; S(O)R9; N(R9)S(O)2N(R9aR9b); SR9; N(R9R9a); OC(O)R9; N(R9)C(O)R9a; N(R9)S(O)2R9a; N(R9)S(O)R9a; N(R9)C(O)OR9a; N(R9)C(O)N(R9aR9b); OC(O)N(R9R9a); T; C1-50алкил; C2-50алкенил или C2-50алкинил, где T, C1-50алкил, C2-50алкенил и C2-50алкинил необязательно замещены одним или более R10, которые являются одинаковыми или различными, и где C1-50алкил, C2-50алкенил и C2-50алкинил необязательно прерываются одной или более группами, выбранными из группы, состоящей из -T-, -C(O)O-; -O-; -C(O)-; -C(O)N(R11)-; -S(O)2N(R11)-; -S(O)N(R11)-; -S(O)2-; -S(O)-; -N(R11)S(O)2N(R11a)-; -S-; -N(R11)-; -OC(O)R11; -N(R11)C(O)-; -N(R11)S(O)2-; -N(R11)S(O)-; -N(R11)C(O)O-; -N(R11)C(O)N(R11a)- и -OC(O)N(R11R11a);
R9, R9a, R9b независимо выбраны из группы, состоящей из H; Z; T и C1-50алкила; C2-50алкенила или C2-50алкинила, где T, C1-50алкил, C2-50алкенил и C2-50алкинил необязательно замещены одним или более R10, которые являются одинаковыми или различными, и где C1-50алкил, C2-50алкенил и C2-50алкинил необязательно прерываются одной или более группами, выбранными из группы, состоящей из T, -C(O)O-; -O-; -C(O)-; -C(O)N(R11)-; -S(O)2N(R11)-; -S(O)N(R11)-; -S(O)2-; -S(O)-; -N(R11)S(O)2N(R11a)-; -S-; -N(R11)-; -OC(O)R11; -N(R11)C(O)-; -N(R11)S(O)2-; -N(R11)S(O)-; -N(R11)C(O)O-; -N(R11)C(O)N(R11a)- и -OC(O)N(R11R11a);
T выбран из группы, состоящей из фенила; нафтила; инденила; инданила; тетралинила; C3-10циклоалкила; 4-7-членного гетероциклила или 9-11-членного гетеробициклила, где Т необязательно замещен одним или более R10, которые являются одинаковыми или различными;
R10 представляет собой Z; галоген; CN; оксо (=O); COOR12; OR12; C(O)R12; C(O)N(R12R12a); S(O)2N(R12R12a); S(O)N(R12R12a); S(O)2R12; S(O)R12; N(R12)S(O)2N(R12aR12b); SR12; N(R12R12a); NO2; OC(O)R12; N(R12)C(O)R12a; N(R12)S(O)2R12a; N(R12)S(O)R12a; N(R12)C(O)OR12a; N(R12)C(O)N(R12aR12b); OC(O)N(R12R12a) или C1-6алкил, где C1-6алкил необязательно замещен одним или более атомами галогена, которые являются одинаковыми или различными;
R11, R11a, R12, R12a, R12b независимо выбраны из группы, состоящей из H; Z или C1-6алкила, где C1-6алкил необязательно замещен одним или более атомами галогена, которые являются одинаковыми или различными;
при условии, что только один из R9, R9a, R9b, R10, R11, R11a, R12, R12a, R12b представляет собой Z.
Более предпочтительно, L2 представляет собой C1-20алкильную цепь, которая необязательно прерывается одной или более группами, независимо выбранными из -O- и C(O)N(R3aa); необязательно замещенную одной или более группами, независимо выбранными из OH и C(O)N(R3aaR3aaa); и где R3aa, R3aaa независимо выбраны из группы, состоящей из H и C1-4алкила.
Предпочтительно, L2 имеют молекулярную массу в диапазоне от 14 г/моль до 750 г/моль.
Предпочтительно, L2 связан с Z через концевую группу, выбранную из
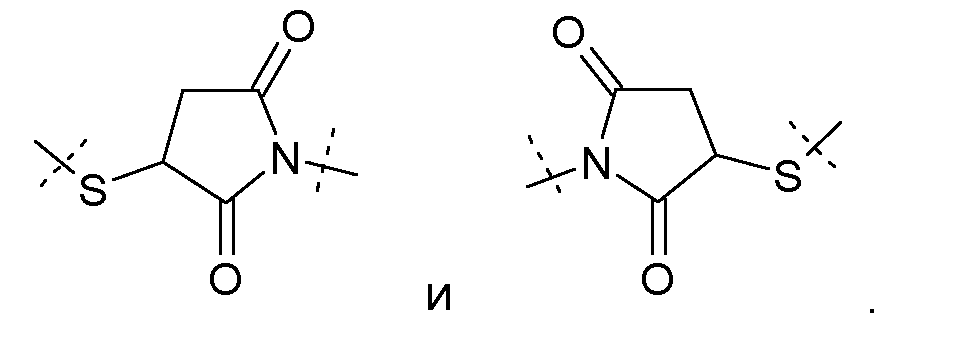
В случае, когда L2 имеет такую концевую группу, более того, предпочтительно, чтобы L2 имел молекулярную массу в диапазоне от 14 г/моль до 500 г/моль, вычисленную без такой концевой группы.
Предпочтительно, ковалентная связь, образованная между линкером и Z, является постоянной связью.
Предпочтительно, гидрогель Z представляет собой биодеградируемый нерастворимый в воде гидрогель на основе поли(этиленгликоля) (PEG). Термин “на основе PEG”, как подразумевают в данном описании, означает, что массовая доля цепей PEG в гидрогеле составляет, по меньшей мере, 10% масс., предпочтительно, по меньшей мере, 25%, в расчете на общую массу гидрогеля. Остальная часть может состоять из других спейсеров и/или олигомеров или полимеров, таких как олиго- или полилизины.
Более того, термин “нерастворимый в воде” относится к набухающей трехмерно сшитой молекулярной сети, формирующей гидрогель. Гидрогель, суспендированный в большом избытке воды или водного буфера с физиологической осмолярностью, может поглощать значительное количество воды, например, вплоть до 10 раз превышающее его массу в расчете на массу, и, таким образом, является набухающим, но после удаления избытков воды все еще сохраняет физическую стабильность геля и форму. Такая форма может иметь любую геометрию, и следует понимать, что такой отдельный объект гидрогеля рассматривают как одну молекулу, состоящую из компонентов, где каждый компонент соединен с каждым другим компонентом через химические связи.
Согласно настоящему изобретению гидрогель может состоять из каркасных частей, взаимно соединенных гидролитически деградируемыми связями. Предпочтительно, гидрогель представляет собой гидрогель на основе PEG, состоящий из каркасных частей.
Предпочтительно, L2 соединен с каркасной частью.
Предпочтительно, каркасная часть имеет молекулярную массу в диапазоне от 1 кДа до 20 кДа, более предпочтительно от 1 кДа до 15 кДа и еще более предпочтительно от 1 кДа до 10 кДа. Каркасные части предпочтительно также основаны на PEG и содержат одну или более цепей PEG.
В гидрогеле, несущем конъюгаты эксендин-линкер по изобретению, каркасная часть характеризуется количеством функциональных групп, включающих биодеградируемые связывающие функциональные группы, и связанных с гидрогелем конъюгатов лекарственное средство-линкер, и необязательно кэп-групп. Это означает, что каркасная часть характеризуется количеством связанных с гидрогелем конъюгатов лекарственное средство-линкер; функциональных групп, включающих биодеградируемые связывающие функциональные группы; и необязательно кэп-групп. Предпочтительно, сумма биодеградируемых связывающих функциональных групп и конъюгатов лекарственное средство-линкер и кэп-групп составляет 16-128, предпочтительно 20-100, более предпочтительно 24-80 и наиболее предпочтительно 30-60.
Предпочтительно, сумма связывающих функциональных групп и связанных с гидрогелем конъюгатов лекарственное средство-линкер и кэп-групп каркасной части равно делится на количество полимерных цепей на основе PEG, исходящих из центра ветвления. Например, если имеются 32 связывающие функциональные группы и связанные с гидрогелем конъюгаты лекарственное средство-линкер и кэп-групп, восемь групп могут быть предоставлены каждой из четырех полимерных цепей на основе PEG, исходящих из центра, предпочтительно, посредством дендритных частей, связанных с концом каждой из полимерных цепей на основе PEG. Альтернативно, четыре группы могут быть предоставлены каждой из восьми полимерных цепей на основе PEG, исходящих из центра, или две группы могут быть предоставлены каждой из шестнадцати полимерных цепей на основе PEG. Если количество полимерных цепей на основе PEG, исходящих из центра ветвления, не позволяет равное распределение, предпочтительно, чтобы отклонение от среднего значения суммы связывающих функциональных групп и связанных с гидрогелем конъюгатов лекарственное средство-линкер и кэп-групп на полимерную цепь на основе PEG оставалось минимальным.
В таких связанных с носителем пролекарствах по изобретению желательно, чтобы по существу все высвобождение лекарственного средства (>90%) происходило до высвобождения значительного количества каркасных частей (<10%). Этого можно достигать путем коррекции времени полужизни связанного с носителем пролекарства относительно кинетики деградации гидрогеля по изобретению.
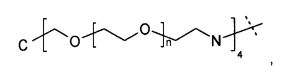
Предпочтительно, каркасная часть характеризуется наличием центра ветвления, из которого и исходит, по меньшей мере, три полимерных цепи на основе PEG. Таким образом, в предпочтительном аспекте настоящего изобретения каркасный реагент содержит центр ветвления, из которого исходит, по меньшей мере, три полимерных цепи на основе PEG. Такие центры ветвления могут состоять из поли- или олигоспиртов в связанной форме, предпочтительно пентаэритрита, трипентаэритрита, гексаглицерина, сахарозы, сорбита, фруктозы, маннита, глюкозы, целлюлозы, амилоз, крахмалов, гидроксиалкилкрахмалов, поливинилспиртов, декстранов, гиалуронанов, или центры ветвления могут состоять из поли- или олигоаминов, таких как орнитин, диаминомасляная кислота, трилизин, тетрализин, пентализин, гексализин, гептализин, октализин, нонализин, декализин, ундекализин, додекализин, тридекализин, тетрадекализин, пентадекализин или олиголизины, полиэтиленимины, поливиниламины в связанной форме.
Предпочтительно, из центра ветвления исходит от трех до шестнадцати полимерных цепей на основе PEG, более предпочтительно от четырех до восьми. Предпочтительные центры ветвления могут состоять из пентаэритрита, орнитина, диаминомасляной кислоты, трилизина, тетрализина, пентализина, гексализина, гептализина или олиголизина, низкомолекулярного PEI, гексаглицерина, трипентаэритрита в связанной форме. Предпочтительно, из центра ветвления исходит от трех до шестнадцати полимерных цепей на основе PEG, более предпочтительно от четырех до восьми. Предпочтительно, полимерная цепь на основе PEG представляет собой линейную цепь поли(этиленгликоля), один конец которой соединен с центром ветвления, и другой - с гиперразветвленной дендритной частью. Следует понимать, что полимерная цепь на основе PEG может оканчиваться или прерываться алкильной или арильной группами, необязательно замещенными гетероатомами и химическими функциональными группами.
Предпочтительно, полимерная цепь на основе PEG подходящим образом замещена производным поли(этиленгликоля) (на основе PEG).
Предпочтительными структурами для соответствующих полимерных цепей на основе PEG, исходящих из центра ветвления, содержащегося в каркасной части, являются многолучевые производные PEG, как например, подробно описано в списке продуктов JenKem Technology, США (доступен путем загрузки с www.jenkemusa.com от 28 июля 2009 года), 4-лучевые производные PEG (центр из пентаэритрита), 8-лучевые производные PEG (центр из гексаглицерина) и 8-лучевые производные PEG (центр из трипентаэритрита). Наиболее предпочтительными являются 4-лучевой PEG амин (центр из пентаэритрита) и 4-лучевой PEG карбоксил (центр из пентаэритрита), 8-лучевой PEG амин (центр из гексаглицерина), 8-лучевой PEG карбоксил (центр из гексаглицерина), 8-лучевой PEG амин (центр из трипентаэритрита) и 8-лучевой PEG карбоксил (центр из трипентаэритрита). Предпочтительные молекулярные массы для таких многолучевых производных PEG в каркасной части составляют от 1 кДа до 20 кДа, более предпочтительно от 1 кДа до 15 кДа и еще более предпочтительно от 1 кДа до 10 кДа.
Следует понимать, что концевые аминогруппы приведенных выше многолучевых молекул присутствуют в связанной форме в каркасной части, обеспечивая дополнительные связывающие функциональные группы и реакционноспособные функциональные группы каркасной части.
Предпочтительно, чтобы сумма связывающих функциональных групп и реакционноспособных функциональных групп каркасной части равно делилась на количество полимерных цепей на основе PEG, исходящих из центра ветвления. Если количество полимерных цепей на основе PEG, исходящих из центра ветвления, не позволяет равное распределение, предпочтительно, чтобы отклонение от среднего значения суммы связывающих и реакционноспособных функциональных групп на полимерную цепь на основе PEG оставалось минимальным.
Более предпочтительно, сумма связывающих и реакционноспособных функциональных групп каркасной части равно делится на количество полимерных цепей на основе PEG, исходящих из центра ветвления. Например, если имеются 32 связывающие функциональные группы и реакционноспособные функциональные группы, каждая группа может быть предоставлена каждой из четырех полимерных цепей на основе PEG, исходящих из центра, предпочтительно, посредством дендритных частей, связанных с концом каждой полимерной цепи на основе PEG. Альтернативно, четыре группы могут быть предоставлены каждой из восьми полимерных цепей на основе PEG, исходящих из центра, или две группы могут быть предоставлены каждой из шестнадцати полимерных цепей на основе PEG.
Такие дополнительные функциональные группы могут быть предоставлены дендритными частями. Предпочтительно, каждая дендритная часть имеет молекулярную массу в диапазоне от 0,4 кДа до 4 кДа, более предпочтительно от 0,4 кДа до 2 кДа. Предпочтительно, каждая дендритная часть имеет, по меньшей мере, 3 ветвления и, по меньшей мере, 4 реакционноспособные функциональные группы, и не более 63 ветвлений и 64 реакционноспособных функциональных групп, предпочтительно, по меньшей мере, 7 ветвлений и, по меньшей мере, 8 реакционноспособных функциональных групп и не более 31 ветвления и 32 реакционноспособных функциональных групп.
Примерами таких дендритных частей являются трилизин, тетрализин, пентализин, гексализин, гептализин, октализин, нонализин, декализин, ундекализин, додекализин, тридекализин, тетрадекализин, пентадекализин, гексадекализин, гептадекализин, октадекализин, нонадекализин в связанной форме. Примеры таких предпочтительных дендритных частей включают трилизин, тетрализин, пентализин, гексализин, гептализин в связанной форме, наиболее предпочтительно трилизин, пентализин или гептализин, орнитин, диаминомасляную кислоту в связанной форме.
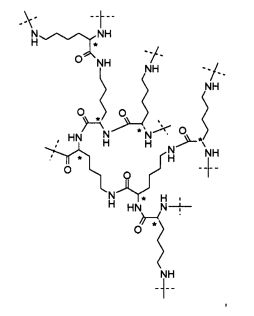
Наиболее предпочтительно, носитель на основе гидрогеля по настоящему изобретению характеризуется тем, что каркасная часть имеет четвертичный углерод формулы C(A-Hyp)4, где каждый A независимо представляет собой полимерную цепь на основе поли(этиленгликоля), связанную на конце с четвертичным углеродом постоянной ковалентной связью, и дистальный конец полимерной цепи на основе PEG представляет собой ковалентную связь с дендритной частью Hyp, причем каждая дендритная часть Hyp имеет, по меньшей мере, четыре функциональные группы, соответствующие связывающим функциональным группам и реакционноспособным функциональным группам.
Предпочтительно, каждый A независимо выбран из формулы -(CH2)n1(OCH2CH2)nX-, где n1 равно 1 или 2; n равно целому числу в диапазоне от 5 до 50; и X представляет собой химическую функциональную группу, ковалентно связывающую A и Hyp.
Предпочтительно, A и Hyp ковалентно связаны амидным связывающим элементом.
Предпочтительно, дендритная часть Hyp представляет собой гиперразветвленный полипептид. Предпочтительно, гиперразветвленный полипептид содержит лизин в связанной форме. Предпочтительно, каждая дендритная часть Hyp имеет молекулярную массу в диапазоне от 0,4 кДа до 4 кДа. Следует понимать, что каркасная часть C(A-Hyp)4 может состоять из одних и тех же или различных дендритных частей Hyp, и что каждая Hyp может быть выбрана независимо. Каждая часть Hyp состоит из от 5 до 32 остатков лизина, предпочтительно, по меньшей мере, из 7 остатков лизина, т.е. каждая часть Hyp состоит из от 5 до 32 остатков лизина в связанной форме, предпочтительно, по меньшей мере, из 7 остатков лизина в связанной форме. Наиболее предпочтительно, Hyp состоит из гептализинила.
Взаимодействие полимеризующихся функциональных групп в каркасном реагенте, более конкретно, Hyp с полимеризующимися функциональными группами сшивающих реагентов на основе поли(этиленгликоля) приводит к постоянной амидной связи.
Предпочтительно, C(A-Hyp)4 имеет молекулярную массу в диапазоне от 1 кДа до 20 кДа, более предпочтительно от 1 кДа до 15 кДа и еще более предпочтительно от 1 кДа до 10 кДа.
Ниже представлена одна из предпочтительных каркасных частей, пунктирные линии указывают на связывающие со сшивающими частями биодеградируемые соединительные элементы, и n равно целому числу от 5 до 50:
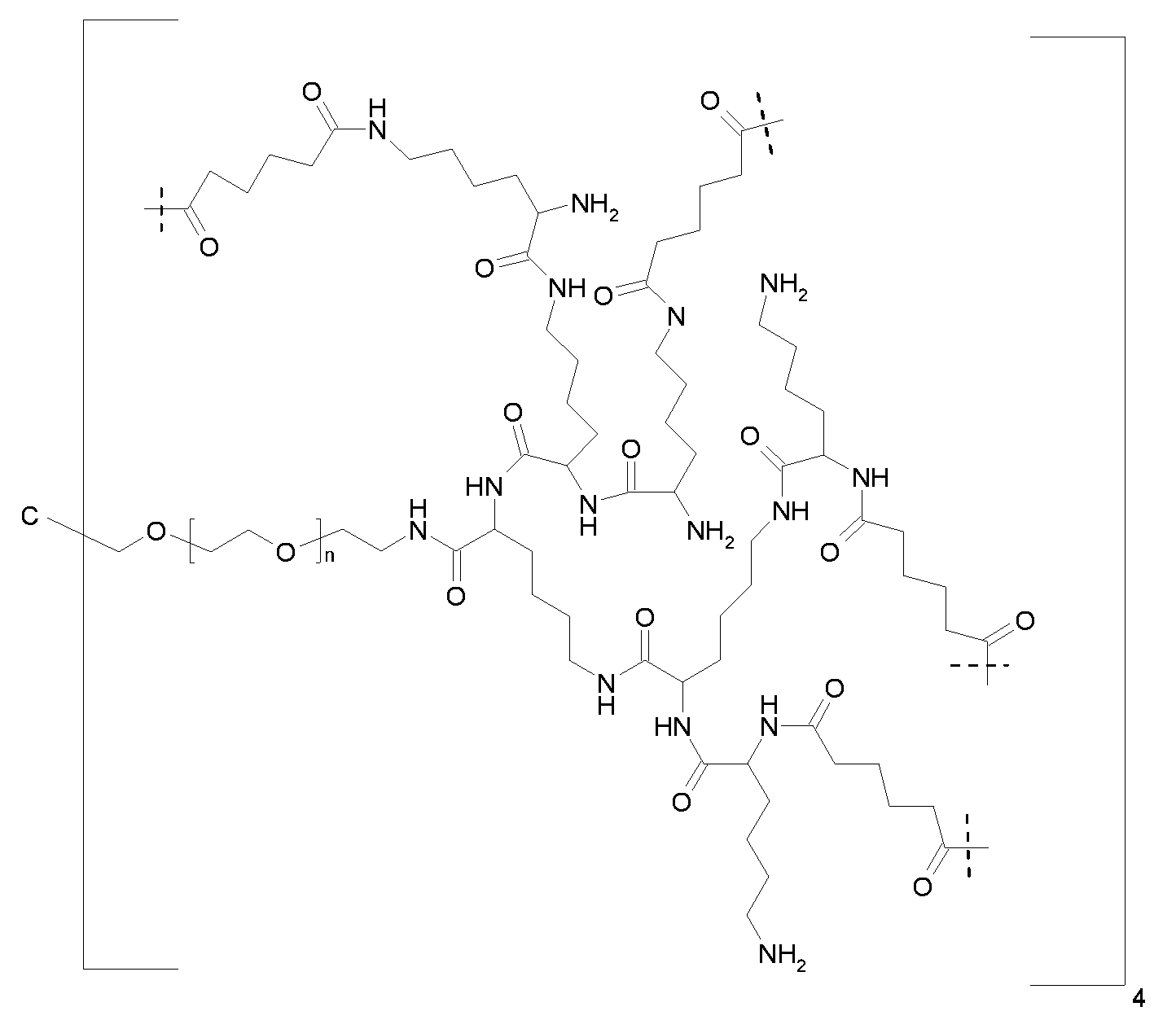
Биодеградируемости гидрогелей в соответствии с настоящим изобретением достигают путем введения гидролитически деградируемых связей.
Термины “гидролитически деградируемый”, “биодеградируемый” или “гидролитически расщепляемый”, “ауторасщепляющийся” или “саморасщепление”, “саморасщепляющийся”, “временный” или “непостоянный” относятся в контексте настоящего изобретения к связям и соединительным элементам, которые являются неферментативно гидролитически деградируемыми или расщепляемыми в физиологических условиях (водный буфер при pH 7,4, 37°C) со временем полужизни в диапазоне от одного часа до трех месяцев, включая, но, не ограничиваясь ими, аконитилы, ацетали, амиды, карбоновые ангидриды, сложные эфиры, имины, гидразоны, амиды малеаминовой кислоты, сложные ортоэфиры, фосфамиды, сложные фосфоэфиры, фосфосилиловые эфиры, силиловые эфиры, сульфоновые эфиры, ароматические карбаматы, их комбинации и т.п.
Предпочтительными биодеградируемыми соединительными элементами, если они присутствуют в гидрогеле по изобретению в качестве деградируемой связывающей функциональной группы, являются сложные эфиры карбоновых кислот, карбонаты, сложные фосфоэфиры и сложные эфиры сульфоновых кислот и наиболее предпочтительными являются сложные эфиры карбоновых кислот или карбонаты.
Постоянные соединительные элементы являются неферментативно гидролитически деградируемыми в физиологических условиях (водный буфер при pH 7,4, 37°C) со временем полужизни шесть месяцев или более, например, такие как амиды.
Для введения гидролитически расщепляемых связей в носитель на основе гидрогеля по изобретению каркасные части можно прямо связывать друг с другом посредством биодеградируемых связей.
В одном варианте осуществления каркасные части биодеградируемого носителя на основе гидрогеля могут быть связаны друг с другом прямо, т.е. без сшивающих частей. Гиперразветвленные дендритные части двух каркасных частей такого биодеградируемого гидрогеля могут быть прямо связаны через связывающую функциональную группу, которая соединяет две гиперразветвленные дендритные части. Альтернативно, две гиперразветвленные дендритные части двух различных каркасных частей могут быть связаны через две спейсерные части, соединенные с каркасной частью, и с другой стороны соединенных со сшивающей частью, разделенных связывающими функциональными группами.
Альтернативно, каркасные части могут быть связаны вместе через сшивающие части, причем каждая сшивающая часть оканчивается, по меньшей мере, двумя гидролитически деградируемыми связями. В дополнение к концевым деградируемым связям сшивающие части могут содержать дополнительные биодеградируемые связи. Таким образом, каждый конец сшивающей части, связанной с каркасной частью, содержит гидролитически деградируемую связь, и в сшивающей части могут необязательно присутствовать дополнительные биодеградируемые связи.
Предпочтительно, биодеградируемый носитель на основе гидрогеля состоит из каркасных частей, взаимно соединенных гидролитически деградируемыми связями, и каркасные части связаны через сшивающие части.
Биодеградируемый носитель на основе гидрогеля может содержать один или более различных типов сшивающих частей, предпочтительно один. Сшивающая часть может представлять собой линейную или разветвленную молекулу, и предпочтительно она представляет собой линейную молекулу. В предпочтительном варианте осуществления изобретения сшивающая часть соединена с каркасными частями, по меньшей мере, двумя биодеградируемыми связями.
Предпочтительно, сшивающие части имеют молекулярную массу в диапазоне от 60 Да до 5 кДа, более предпочтительно, от 0,5 кДа до 5 кДа, еще более предпочтительно, от 1 кДа до 4 кДа, еще более предпочтительно, от 1 кДа до 3 кДа. В одном варианте осуществления сшивающая часть состоит из полимера.
В дополнение к олигомерным или полимерным сшивающим частям можно использовать низкомолекулярные сшивающие части, особенно когда гидрофильные высокомолекулярные каркасные части используют для образования биодеградируемого гидрогеля по изобретению.
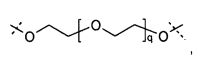
Предпочтительно, сшивающие части на основе поли(этиленгликоля) представляют собой углеводородные цепи, содержащие элементы этиленгликоля, необязательно содержащие дополнительные химические функциональные группы, где каждая из сшивающих частей на основе поли(этиленгликоля) содержит, по меньшей мере, m элементов этиленгликоля, где m равно целому числу в диапазоне от 3 до 100, предпочтительно от 10 до 70. Предпочтительно, сшивающие части на основе поли(этиленгликоля) имеют молекулярную массу в диапазоне от 0,5 кДа до 5 кДа.
При использовании в отношении сшивающей части или полимерной цепи на основе PEG, соединенной с центром ветвления, термин “на основе PEG” относится к сшивающей части или полимерной цепи на основе PEG, содержащей, по меньшей мере, 20% масс. частей этиленгликоля.
В одном варианте осуществления мономеры, составляющие полимерные сшивающие части, соединены биодеградируемыми связями. Такие полимерные сшивающие части могут содержать вплоть до 100 биодеградируемых связей или более, в зависимости от молекулярной массы сшивающей части и молекулярной массы мономерных элементов. Примерами таких сшивающих частей являются полимеры на основе поли(молочной кислоты) или поли(гликолевой кислоты). Следует понимать, что такая цепь поли(молочной кислоты) или поли(гликолевой кислоты) может оканчиваться или прерываться алкильной или арильной группами, и что они могут быть необязательно замещены гетероатомами и химическими функциональными группами.
Предпочтительно, сшивающие части основаны на PEG, предпочтительно они представлены только одной молекулярной цепью на основе PEG. Предпочтительно, сшивающие части на основе поли(этиленгликоля) представляют собой углеводородные цепи, содержащие элементы этиленгликоля, необязательно содержащие дополнительные химические функциональные группы, где каждая из сшивающих частей на основе поли(этиленгликоля) содержит, по меньшей мере, m элементов этиленгликоля, где m равно целому числу в диапазоне от 3 до 100, предпочтительно от 10 до 70. Предпочтительно, сшивающие части на основе поли(этиленгликоля) имеют молекулярную массу в диапазоне от 0,5 кДа до 5 кДа.
В предпочтительном варианте осуществления настоящего изобретения сшивающая часть состоит из PEG, который симметрично связан через сложноэфирные связи с двумя альфа,омега-алифатическими дикарбоновыми спейсерами, предоставляемыми каркасными частями, соединенными гиперразветвленной дендритной частью через постоянные амидные связи.
Дикарбоновые кислоты спейсерных частей, соединенные с каркасной частью, и на другой стороне соединенные со сшивающей частью, состоят из 3-12 атомов углерода, наиболее предпочтительно, 5-8 атомов углерода, и могут быть замещены на одном или более атомах углерода. Предпочтительными заместителями являются алкильные группы, гидроксильные группы или амидогруппы, или замещенные аминогруппы. Одна или более метиленовых групп алифатической дикарбоновой кислоты необязательно может быть замещена O или NH, или алкил-замещенным N. Предпочтительным алкилом является линейный или разветвленный алкил с 1-6 атомами углерода.
Предпочтительно, имеется постоянная амидная связь между гиперразветвленной дендритной частью и спейсерной частью, соединенной с каркасной частью, и на другой стороне соединенной со сшивающей частью.
Ниже представлена одна из предпочтительных сшивающих частей; пунктирные линии указывают на связывающие с каркасными частями биодеградируемые соединительные элементы:
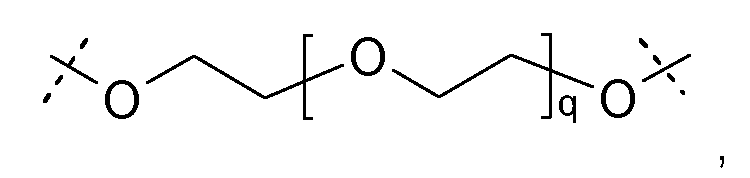
где q равно целому числу от 5 до 50.
Предпочтительно, носитель на основе гидрогеля состоит из каркасных частей, взаимно соединенных гидролитически деградируемыми связями.
Более предпочтительно, каркасные части содержат центр ветвления следующей формулы:
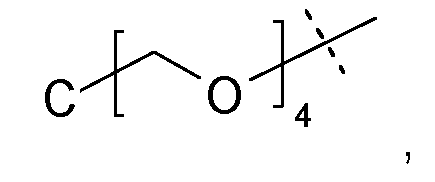
где пунктирная линия указывает на присоединение к остальной каркасной части.
Более предпочтительно, каркасные части содержат структуру следующей формулы:
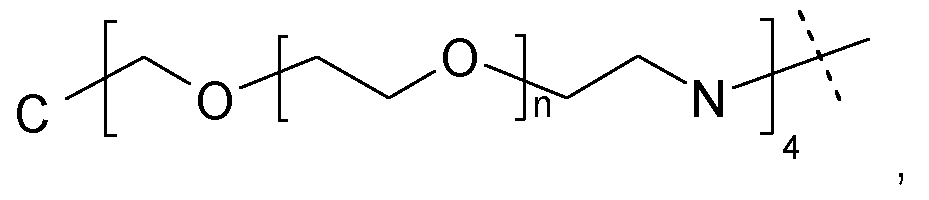
где n равно целому числу от 5 до 50 и пунктирная линия указывает на присоединение к остальной каркасной части.
Предпочтительно, каркасная часть содержит гиперразветвленную часть Hyp.
Более предпочтительно, каркасная часть содержит гиперразветвленную часть Hyp следующей формулы:
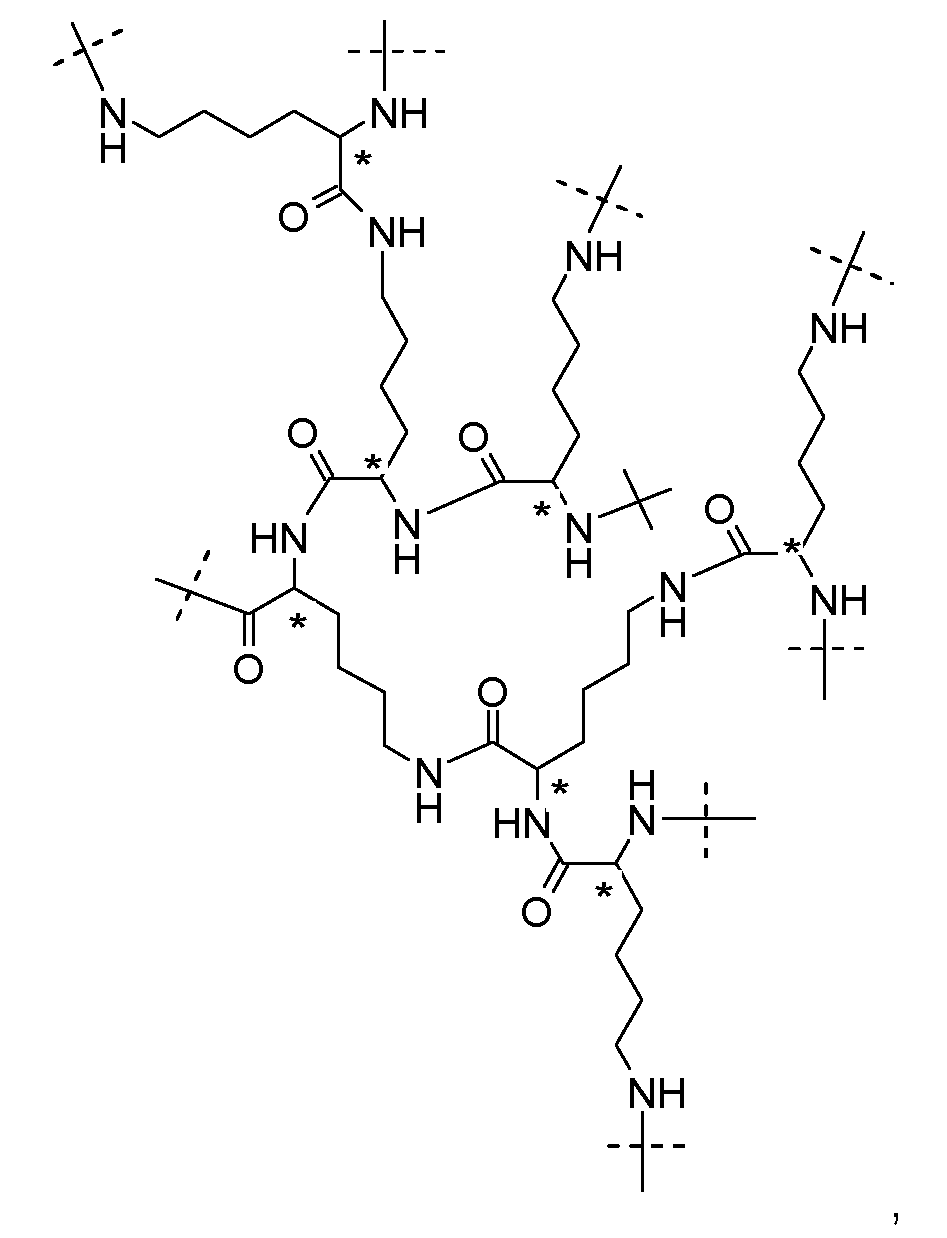
где пунктирные линии указывают на присоединение к остальной части молекулы, и атомы углерода, обозначенные звездочками, указывают на S-конфигурацию.
Предпочтительно, каркасные части связаны, по меньшей мере, с одним спейсером следующей формулы:
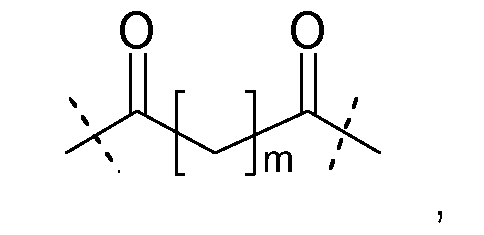
где одна из пунктирных линий указывает на присоединение к гиперразветвленной части Hyp, и вторая из пунктирных линий указывает на присоединение к остальной части молекулы; и
где m равно целому числу от 2 до 4.
Предпочтительно, каркасные части связаны друг с другом через сшивающие части, имеющие следующую структуру:
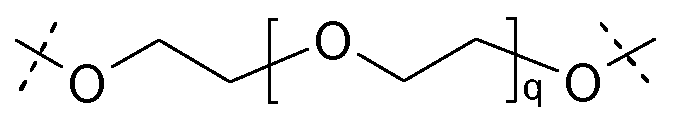
где
q равно целому числу от 3 до 100, предпочтительно от 5 до 50.
В пролекарствах с гидрогелем по изобретению, на скорость гидролиза биодеградируемых связей между каркасными частями и сшивающими частями влияет, или ее определяет, количество и тип присоединенных атомов рядом с карбоксигруппой сложного эфира PEG. Например, путем выбора из янтарной, адипиновой или глутаровой кислоты для образования сложного эфира PEG можно варьировать время полужизни до деградации биодеградируемого носителя в виде гидрогеля по изобретению.
Предпочтительно, L2 связан с Z через тиосукцинимидную группу, которая, в свою очередь, связана с каркасной частью гидрогеля через спейсер, такой как цепь олигоэтиленгликоля. Предпочтительно, соединительный элемент между этой спейсерной цепью и каркасной частью представляет собой постоянную связь, предпочтительно амидную связь.
Биодеградируемости гидрогелей в соответствии с настоящим изобретением достигают путем введения гидролитически деградируемых связей.
Для связывающих функциональных групп термин “гидролитически деградируемый” относится в контексте настоящего изобретения к соединительным элементам, которые являются неферментативно гидролитически деградируемыми в физиологических условиях (водный буфер при pH 7,4, 37°C) со временем полужизни в диапазоне от одного часа до трех месяцев, и включают, но не ограничиваются ими, аконитилы, ацетали, ангидриды карбоновых кислот, сложные эфиры, имины, гидразоны, амиды малеаминовой кислоты, сложные ортоэфиры, фосфамиды, сложные фосфоэфиры, фосфосилиловые эфиры, силиловые эфиры, сульфоновые эфиры, ароматические карбаматы, их комбинации и т.п. Предпочтительными биодеградируемыми соединительными элементами являются сложные эфиры карбоновых кислот, карбонаты, сложные фосфоэфиры и сложные эфиры сульфоновых кислот и наиболее предпочтительными являются сложные эфиры карбоновых кислот или карбонаты. Следует понимать, что для исследований in vitro для практических целей можно использовать ускоряющие условия, например, такие как pH 9, 37°C, водный буфер.
Постоянные соединительные элементы являются неферментативно гидролитически деградируемыми в физиологических условиях (водный буфер при pH 7,4, 37°C) со временем полужизни шесть месяцев или более, как например, амиды.
Деградация биодеградируемого носителя на основе гидрогеля в соответствии с изобретением представляет собой многостадийную реакцию, где происходит расщепление множества деградируемых связей, что приводит к продуктам деградации, которые могут быть растворимыми в воде или не растворимыми в воде. Однако нерастворимые в воде продукты деградации могут, кроме того, включать деградируемые связи, так чтобы они могли расщепляться с образованием растворимых в воде продуктов деградации. Эти растворимые в воде продукты деградации могут содержать одну или более каркасных частей. Следует понимать, что высвобождаемые каркасные части могут быть, например, постоянно конъюгированы со спейсером или блокирующими или линкерными группами, или аффинными группами и/или продуктами деградации пролекарства с линкером, и что также растворимые в воде продукты деградации могут содержать деградируемые связи.
Структуры центра ветвления, полимерных цепей на основе PEG, гиперразветвленных дендритных частей и частей, связанных с гиперразветвленными дендритными частями, могут быть установлены из соответствующих описаний, представленных в разделах, охватывающих носители на основе гидрогеля по настоящему изобретению. Следует понимать, что структура продукта деградации зависит от типа гидрогеля по изобретению, подвергшегося деградации.
Общее количество каркасных частей можно измерять в растворе после полной деградации гидрогеля по изобретению, и в процессе деградации фракции растворимых продуктов деградации каркаса можно отделять от нерастворимого гидрогеля по изобретению и можно количественно определять без влияния других растворимых продуктов деградации, высвобождаемых из гидрогеля по изобретению. Гидрогель по изобретению можно отделять от избытка воды или буфера с физиологической осмолярностью путем осаждения или центрифугирования. Центрифугирование можно проводить так, чтобы супернатант обеспечивал, по меньшей мере, 10% объема набухшего гидрогеля по изобретению. Растворимые продукты деградации гидрогеля остаются в водном супернатанте после такой стадии осаждения или центрифугирования, и растворимые в воде продукты деградации, содержащие одну или более каркасных частей, можно выявлять подходящими способами разделения аликвот такого супернатанта и/или аналитическими способами.
Предпочтительно, растворимые в воде продукты деградации можно отделять от нерастворимых в воде продуктов деградации фильтрованием через 0,45-мкм фильтры, после чего растворимые в воде продукты деградации могут быть найдены в проходящей жидкости. Растворимые в воде продукты деградации также можно отделять от нерастворимых в воде продуктов деградации сочетанием стадий центрифугирования и фильтрации.
Например, каркасные части могут иметь группы, которые обладают поглощением УФ-излучения при длинах волн, при которых другие продукты деградации не обладают поглощением УФ-излучения. Такие селективно поглощающие УФ-излучение группы могут быть структурными компонентами каркасной части, такими как амидные связи, или они могут быть введены в каркас присоединением к их реакционноспособным функциональным группам ароматических кольцевых систем, таких как индоильные группы.
В таких связанных с носителем пролекарствах по изобретению желательно, чтобы по существу все высвобождение лекарственного средства (>90%) происходило до высвобождения значительного количества каркасных частей (<10%). Этого можно достигать путем корректирования времени полужизни связанного с носителем пролекарства относительно кинетики деградации гидрогеля по изобретению.
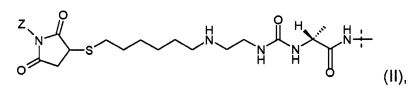
Предпочтительно, пролекарство эксендина D-L имеет структуру, где L представлен формулой (II):
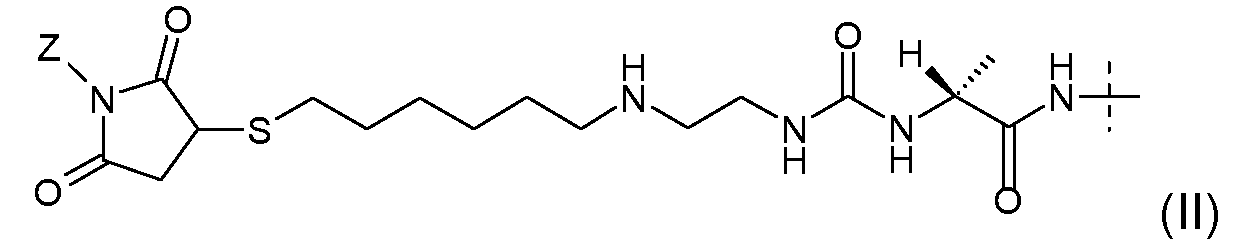
где пунктирная линя указывает на присоединение к азоту, предпочтительно N-концевому азоту эксендина с образованием амидной связи, и Z представляет собой гидрогель.
Предпочтительно, гидрогель в формуле (II) представляет собой биодерградируемый нерастворимый в воде гидрогель на основе поли(этиленгликоля) (PEG).
Предпочтительно, гидрогель в формуле (II) состоит из каркасных частей, взаимно соединенных гидролитически деградируемыми связями.
Более предпочтительно, каркасные части включают центр ветвления следующей формулы:
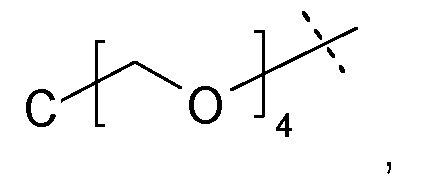
где пунктирная линия указывает на присоединения к остальной каркасной части.
Более предпочтительно, каркасные части содержат структуру следующей формулы:
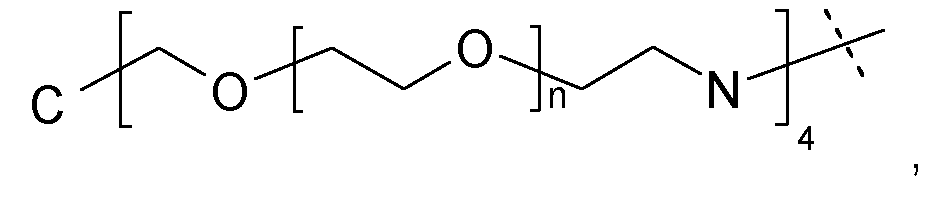
где n равно целому числу от 5 до 50, и пунктирная линия указывает на присоединение к остальной части молекулы.
Предпочтительно, каркасная часть содержит гиперразветвленную часть Hyp.
Более предпочтительно, каркасная часть содержит гиперразветвленную часть Hyp следующей формулы:
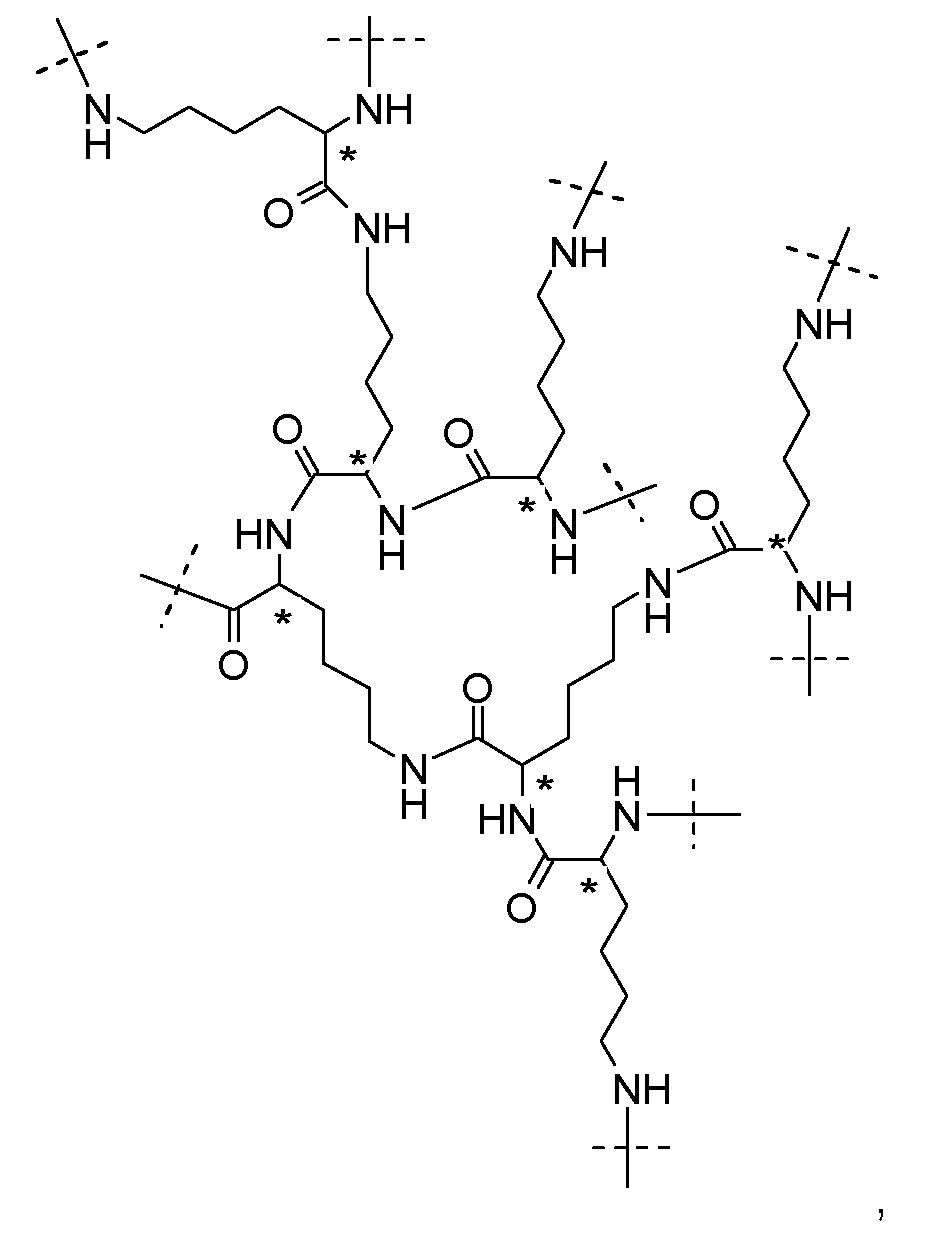
где пунктирные линии указывают на присоединение к остальной части молекулы, и атомы углерода, обозначенные звездочками, указывают на S-конфигурацию.
Предпочтительно, каркасные части связаны, по меньшей мере, с одним спейсером следующей формулы:

где одна из пунктирных линий указывает на присоединение к гиперразветвленной части Hyp, и вторая из пунктирных линий указывает на присоединение к остальной части молекулы; и где m равно целому числу от 2 до 4.
Предпочтительно, каркасные части связаны, по меньшей мере, с одним спейсером следующей формулы:
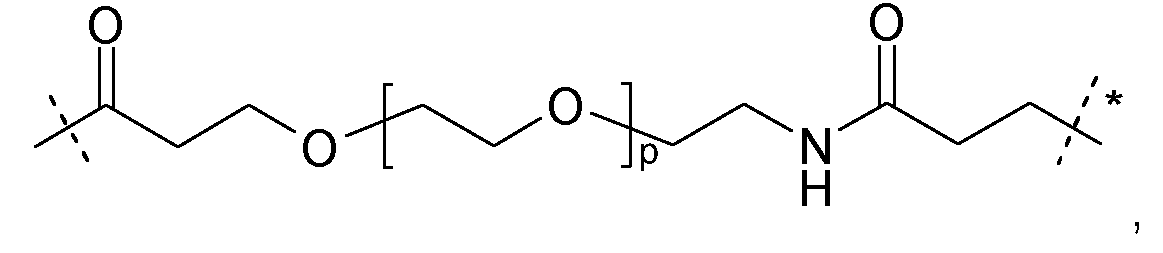
где пунктирная линия, обозначенная звездочкой, указывает на связь между гидрогелем и N тиосукцинимидной группой;
где другая пунктирная линия указывает на присоединение к Hyp; и
где p равно целому числу от 0 до 10.
Предпочтительно, каркасные части связаны друг с другом через сшивающие части, имеющие следующую структуру:
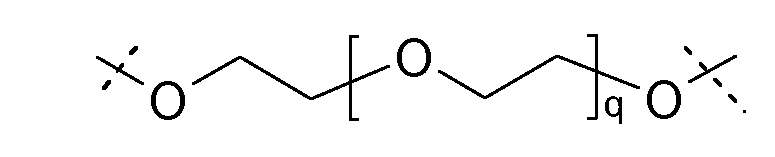
где q равно целому числу от 3 до 100.
Скорость гидролиза биодеградируемых связей между каркасом и сшивающими частями определяется количеством и типом присоединенных атомов рядом с карбоксигруппой сложного эфира PEG. Например, путем выбора из янтарной, адипиновой или глутаровой кислоты для образования сложного эфира PEG можно варьировать время полужизни сшивающей части.
Связанное с гидрогелем пролекарство эксендина по настоящему изобретению можно получать, начиная с гидрогеля по настоящему изобретению, общепринятыми способами, известными в данной области. Специалисту в данной области очевидно, что существует несколько путей. Например, линкер пролекарства, указанный выше, с которым ковалентно связана биологически активная часть, можно подвергать взаимодействию с реакционноспособными функциональными группами гидрогеля по настоящему изобретению, уже имеющими активную часть частично или целиком.
В предпочтительном способе получения гидрогель получают посредством химических реакций сшивания. Гидрогель может быть образован из двух молекулярных продуктов с взаимодополняющими функциональными группами, которые претерпевают реакцию, такую как конденсация или присоединение. Одно из этих исходных веществ представляет собой сшивающий реагент, по меньшей мере, с двумя идентичными функциональными группами, и другое исходное вещество представляет собой гомомультифункциональный каркасный реагент. Пригодные функциональные группы, присутствующие на сшивающем реагенте, включают концевой амино, карбоновую кислоту и производные, малеинимид и другие альфа,бета-ненасыщенные акцепторы Майкла, такие как винилсульфон, тиол, гидроксильные группы. Пригодные функциональные группы, присутствующие в каркасном реагенте, включают, но не ограничиваются ими, амино, карбоновую кислоту и производные, малеинимид и другие альфа,бета-ненасыщенные акцепторы Майкла, такие как винилсульфон, тиол, гидроксильные группы.
Если реакционноспособные функциональные группы сшивающего реагента используют в субстехиометрических количествах относительно каркасных реакционноспособных функциональных групп, полученный гидрогель представляет собой реакционноспособный гидрогель со свободными реакционноспособными функциональными группами, присоединенными к каркасной структуре.
Необязательно, линкер пролекарства можно сначала конъюгировать с эксендином, и затем полученный конъюгат эксендин-линкер пролекарства можно подвергнуть взаимодействию с реакционноспособными функциональными группами гидрогеля. Альтернативно, после активации одной из функциональных групп линкера пролекарства конъюгат линкер-гидрогель можно контактировать с эксендином на второй стадии реакции и избыток эксендина может быть удален фильтрованием после конъюгации эксендина со связанным с гидрогелем линкером пролекарства.
Предпочтительный способ получения пролекарства в соответствии с настоящим изобретением является следующим:
Предпочтительным исходным веществом для синтеза каркасного реагента является 4-лучевой PEG тетраамин или 8-лучевой PEG октаамин, причем реагент PEG имеет молекулярную массу в диапазоне от 2000 до 10000 Дальтон, наиболее предпочтительно от 2000 до 5000 Да. К таким многолучевым производным PEG последовательно присоединяют остатки лизина для образования гиперразветвленного каркасного реагента. Следует понимать, что остатки лизина могут быть частично или полностью защищены защитными группами в ходе стадий присоединения, а также конечный каркасный реагент может содержать защитные группы. Предпочтительным структурным элементом является бис-boc-лизин. Альтернативно, вместо последовательного присоединения остатков лизина сначала можно собрать дендритную поли-лизиновую часть, а затем связать ее с 4-лучевым PEG тетраамином или 8-лучевым PEG октаамином. Желательно получать каркасный реагент, имеющий 32 аминогруппы, следовательно, семь остатков лизина могут быть присоединены к каждому лучу 4-лучевого PEG, или пять остатков лизина могут быть присоединены к каждому лучу 8-лучевого PEG. В другом варианте осуществления многолучевое производное PEG представляет собой тетра- или октакарбокси PEG. В этом случае, дендритные части можно получать из глутаровой или аспарагиновой кислоты, и полученный каркасный реагент может иметь 32 карбоксигруппы. Следует понимать, что все или часть функциональных групп каркасного реагента могут присутствовать в свободной форме, в виде солей или конъюгированными с защитными группами. Следует понимать, что вследствие практических причин количество остатков лизина в каркасном реагенте на луч PEG составляет от шести до семи, более предпочтительно, приблизительно семь.
Предпочтительный каркасный реагент представлен ниже:
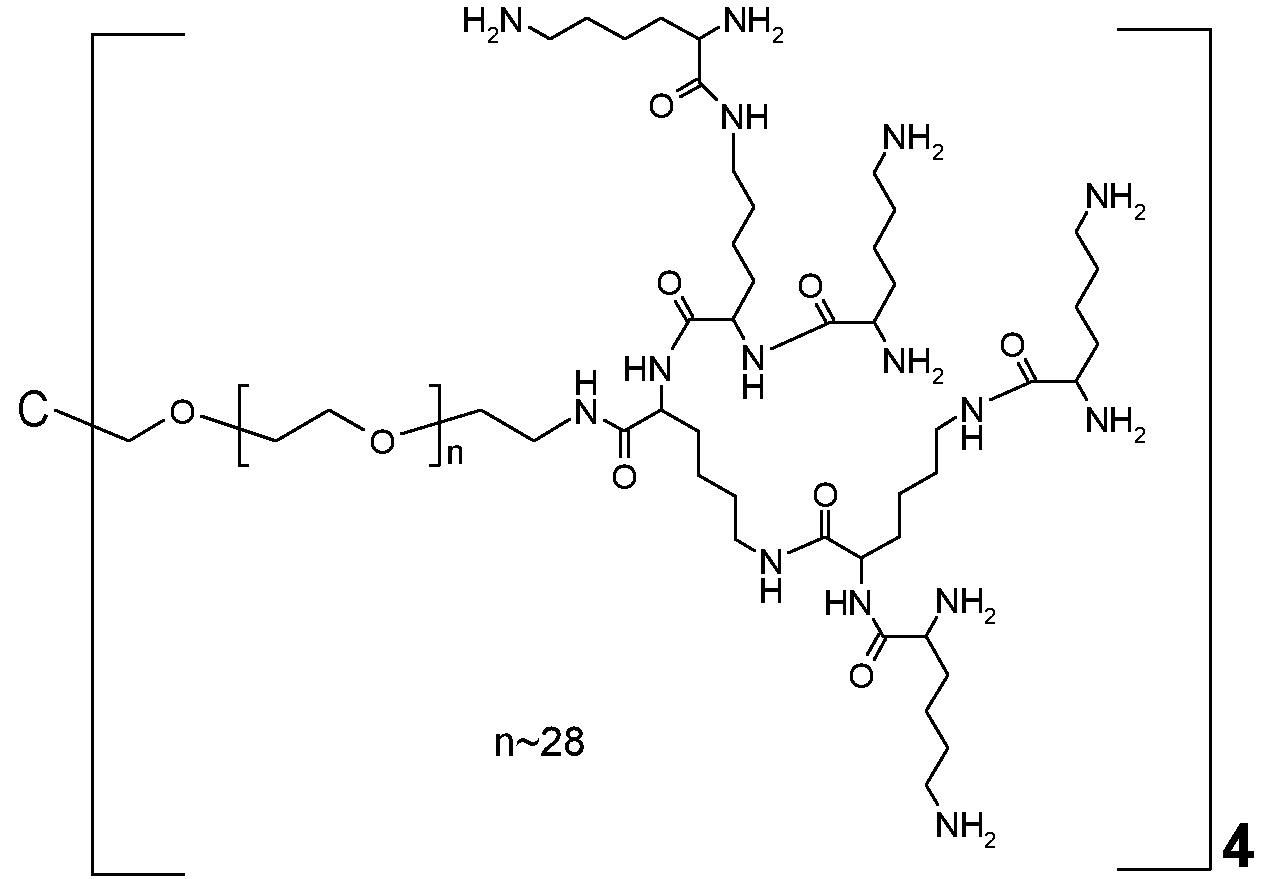
Синтез сшивающего реагента начинается с линейной цепи PEG с молекулярной массой в диапазоне от 0,2 до 5 кДа, более предпочтительно от 0,6 до 2 кДа, которую этерифицируют полуэфиром дикарбоновой кислоты, такой как адипиновая кислота или глутаровая кислота. Предпочтительной защитной группой для образования полуэфира является бензильная группа. Полученные бис-полуэфиры PEG и дикарбоновой кислоты преобразуют в более реакционноспособные карбоксисоединения, такие как ацилхлориды или активные сложные эфиры, например, пентафторфенил или N-гидроксисукцинимидные эфиры, наиболее предпочтительно N-гидроксисукцинимидные эфиры, среди которых предпочтительна выбранная структура, представленная ниже.
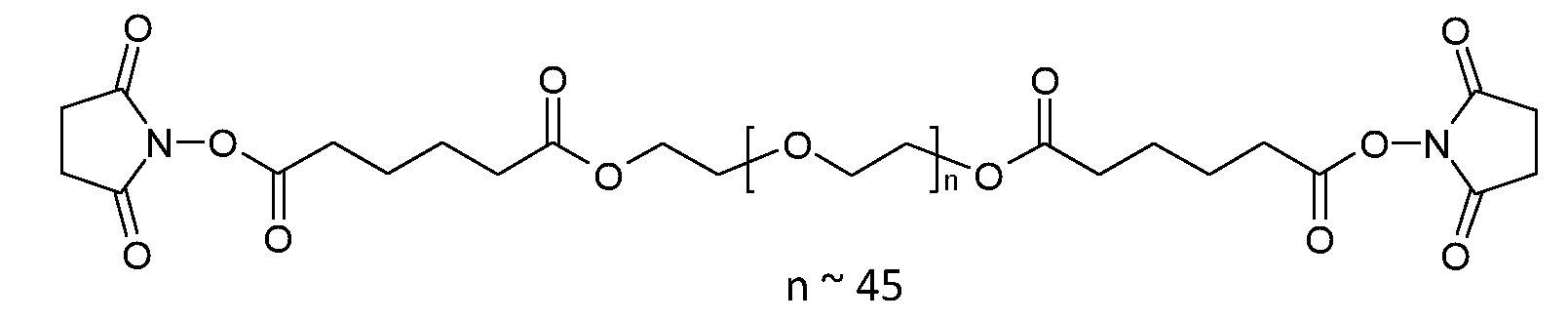
Альтернативно, полуэфиры PEG и дикарбоновой кислоты можно активировать в присутствии сшивающего агента, такого как DCC или HOBt, или PyBOP.
В альтернативном варианте осуществления каркасный реагент имеет карбоксигруппы, и соответствующий сшивающий реагент выбран из содержащих сложный эфир цепей PEG с амино на конце.
Каркасный реагент и сшивающий реагент можно полимеризовать с образованием гидрогеля по изобретению с использованием обратной эмульсионной полимеризации. После выбора желаемой стехиометрии между каркасными и сшивающими функциональными группами, каркас и сшивающий агент растворяют в ДМСО, и подходящий эмульгатор с надлежащим образом выбранной величиной HLB, предпочтительно Arlacel P135, используют для получения обратной эмульсии с использованием механической мешалки и контроля скорости перемешивания. Полимеризацию начинают добавлением подходящего основания, предпочтительно N,N,N',N'-тетраметилэтилендиамина. После перемешивания в течение подходящего периода времени, реакцию гасят добавлением кислоты, такой как уксусная кислота и вода. Гранулы собирают, промывают и фракционируют по размеру частиц путем механического просеивания. Необязательно на данной стадии защитные группы можно удалять.
Кроме того, такой гидрогель по изобретению можно функционализировать с помощью спейсера, имеющего реакционноспособную функциональную группу, отличающуюся от функциональной группы, предоставляемой гидрогелем. Например, малеинимидные реакционноспособные функциональные группы можно вводить в гидрогель путем присоединения подходящего гетеробифункционального спейсера, такого как Mal-PEG6-NHS, к гидрогелю. Такой функционализированный гидрогель можно далее конъюгировать с реагентами эксендин-линкер, несущими реакционноспособную тиольную группу на линкерной части, с образованием связанных с гидрогелем пролекарств эксендина в соответствии с настоящим изобретением.
После нагрузки конъюгатом эксендин-линкер гидрогеля, содержащего функционализированную малеимидогруппу, все остальные функциональные группы блокируют пригодным блокирующим реагентом, таким как меркаптоэтанол, для предотвращения нежелательных побочных реакций.
В другом предпочтительном варианте осуществления изобретения конъюгат эксендин-линкер, несущий свободный тиол, связанный с линкерной частью, подвергают взаимодействию с гидрогелем, функционализированным малеинимидом, при температурах от комнатной температуры до 4°C, более предпочтительно, при комнатной температуре, в забуференном водном растворе pH 5,5-8, предпочтительно pH 6,5-7,5. Затем полученный конъюгат лекарственное средство-линкер-гидрогель обрабатывают низкомолекулярным соединением, содержащим тиольную группу, предпочтительно тиолсодержащим соединением массой 34-500 Да, наиболее предпочтительно меркаптоэтанолом, при температурах от комнатной температуры до 4°C, более предпочтительно, при комнатной температуре, в забуференном водном растворе с pH 5,5-8, предпочтительно pH 6,5-7,5.
В другом предпочтительном варианте осуществления изобретения конъюгат эксендин-линкер, имеющий малеинимидную группу, подвергают взаимодействию с гидрогелем по изобретению, функционализированным тиолом, при температурах от комнатной температуры до 4°C, более предпочтительно, при комнатной температуре, в забуференном водном растворе с pH 5,5-8, предпочтительно pH 6,5-7,5. Затем соответствующий полученный конъюгат лекарственное средство-линкер-гидрогель обрабатывают низкомолекулярным соединением, содержащим малеинимидную группу, предпочтительно малеинимидсодержащим соединением массой 100-300 Да, например N-этилмалеинимидом, при температурах от комнатной температуры до 4°C, более предпочтительно, при комнатной температуре, в забуференном водном растворе с pH 5,5-8, предпочтительно 6,5-7,5.
Другим аспектом настоящего изобретения является способ, включающий стадии
(a) контакта при температурах от комнатной температуры до 4°C в забуференном водном растворе с pH 5,5-8 водной суспензии, содержащей микрочастицы гидрогеля, функционализированного малеинимидом, с раствором, содержащим реагент эксендин-линкер по настоящему изобретению, где химическая функциональная группа L2* содержит тиольную группу, с получением конъюгата эксендин-линкер-гидрогель;
(b) необязательно обработки конъюгата эксендин-линкер-гидрогель со стадии (a) тиолсодержащим соединением массой от 34 Да до 500 Да при температурах от комнатной температуры до 4°C в забуференном водном растворе с pH 5,5-8.
Другой аспект настоящего изобретения относится к способу, включающему стадии
(a) контакта при температурах от комнатной температуры до 4°C в забуференном водном растворе с pH 5,5-8 водной суспензии, содержащей микрочастицы гидрогеля, функционализированного тиолом, с раствором, содержащим реагент эксендин-линкер по настоящему изобретению, где химическая функциональная группа L2* содержит малеимидную группу, с получением конъюгата эксендин-линкер-гидрогель;
(b) необязательно обработки конъюгата эксендин-линкер-гидрогель со стадии (a) малеимидсодержащим соединением массой от 100 до 300 Да при температурах от комнатной температуры до 4°C в забуференном водном растворе с pH 5,5-8.
Особенно предпочтительный способ получения пролекарства по настоящему изобретению включает стадии:
(a) взаимодействия соединения формулы C(A'-X1)4, где A'-X1 представляет собой A до его связывания с Hyp или предшественником Hyp, и X1 представляет собой подходящую функциональную группу, с соединением формулы Hyp'-X2, где Hyp'-X2 представляет собой Hyp перед его связыванием с A или предшественник Hyp, и X2 представляет собой подходящую функциональную группу для взаимодействия с X1;
(b) необязательно взаимодействия полученного соединения со стадии (a) в одной или более дополнительных стадиях с получением соединения формулы C(A-Hyp)4, имеющего, по меньшей мере, четыре функциональных группы;
(c) взаимодействия, по меньшей мере, четырех функциональных групп полученного соединения со стадии (b) с предшественником сшивающего агента на основе поли(этиленгликоля), где активные сложноэфирные группы предшественника сшивающего агента используют в субстехиометрическом количестве по сравнению с общим количеством реакционноспособных функциональных групп C(A-Hyp)4 с получением гидрогеля;
(d) взаимодействия оставшихся не вступивших в реакцию функциональных групп (соответствующих реакционноспособным функциональным группам каркаса, содержащимся в гидрогеле) в каркасе гидрогеля со стадии (c) с ковалентным конъюгатом биологически активной части и временного линкера пролекарства, или сначала взаимодействия не вступивших в реакцию функциональных групп с временным линкером пролекарства и затем с биологически активной частью;
(e) необязательно блокирования оставшихся не вступивших в реакцию функциональных групп с получением пролекарства по настоящему изобретению.
В частности, гидрогели для пролекарств эксендина по настоящему изобретению синтезируют следующим образом:
Для объемной полимеризации каркасный реагент и сшивающий реагент смешивают в соотношении амин/активный сложный эфир от 2:1 до 1,05:1.
Как каркасный реагент, так и сшивающий реагент, растворяют в ДМСО с получением раствора с концентрацией от 5 до 50 г на 100 мл, предпочтительно от 7,5 до 20 г на 100 мл и наиболее предпочтительно от 10 до 20 г на 100 мл.
Для обеспечения полимеризации от 2 до 10% (об.) N,N,N',N'-тетраметилэтилендиамин (TMEDA) добавляют к раствору ДМСО, содержащему сшивающий реагент и каркасный реагент, и смесь встряхивают в течение 1-20 с и оставляют стоять. Смесь застывает в течение менее 1 мин.
Такой гидрогель по изобретению предпочтительно измельчают механическими способами, такими как перемешивание, дробление, нарезание, прессование или размол, и необязательно просеивание.
Для эмульсионной полимеризации реакционная смесь содержит дисперсную фазу и непрерывную фазу.
Для дисперсной фазы каркасный реагент и сшивающий реагент смешивают в соотношении амин/активный сложный эфир от 2:1 до 1,05:1 и растворяют в ДМСО с получением раствора с концентрацией от 5 до 50 г на 100 мл, предпочтительно от 7,5 до 20 г на 100 мл и наиболее предпочтительно от 10 до 20 г на 100 мл.
Непрерывная фаза представляет собой любой растворитель, который не смешивается с ДМСО, является неосновным, апротонным и обладает вязкостью менее 10 Па*c. Предпочтительно, растворитель не смешивается с ДМСО, является неосновным, апротонным, обладает вязкостью менее 2 Па*c и является нетоксичным. Более предпочтительно, растворитель представляет собой насыщенный линейный или разветвленный углеводород с 5-10 атомами углерода. Наиболее предпочтительно, растворитель представляет собой н-гептан.
Для образования эмульсии дисперсной фазы в непрерывной фазе к непрерывной фазе перед добавлением дисперсной фазы добавляют эмульгатор. Количество эмульгатора составляет от 2 до 50 мг на мл дисперсной фазы, более предпочтительно от 5 до 20 мг на мл дисперсной фазы, наиболее предпочтительно 10 мг на мл дисперсной фазы.
Эмульгатор имеет значение HLB от 3 до 8. Предпочтительно, эмульгатор представляет собой сложный триэфир сорбита и жирной кислоты или конъюгат поли(гидроксилжирная кислота)-поли(этиленгликоль). Более предпочтительно, эмульгатор представляет собой конъюгат поли(гидроксижирная кислота)-полиэтиленгликоль с линейным поли(этиленгликолем) с молекулярной массой в диапазоне от 0,5 кДа до 5 кДа и элементами поли(гидроксижирной кислоты) с молекулярной массой в диапазоне от 0,5 кДа до 3 кДа на каждом конце цепи. Наиболее предпочтительно, эмульгатор представляет собой поли(этиленгликоль)диполигидроксистеарат, Cithrol DPHS (Cithrol DPHS, ранее Arlacel P135, Croda International Plc).
Капли дисперсной фазы получают перемешиванием аксиально-поточной мешалкой с геометрией, сходной с мешалками, такими как Isojet, Intermig, Propeller (EKATO Rühr- und Mischtechnik GmbH, Германия)), наиболее предпочтительно, сходной с Isojet с диаметром от 50 до 90% диаметра реактора. Предпочтительно, перемешивание инициируют до добавления дисперсной фазы. Скорость мешалки устанавливают на 0,6-1,7 м/с. Дисперсную фазу добавляют при комнатной температуре, и концентрация дисперсной фазы составляет от 2% до 70%, предпочтительно от 5 до 50%, более предпочтительно от 10 до 40%, и наиболее предпочтительно от 20 до 35% от общего объема реакционной смеси. Смесь дисперсной фазы, эмульгатора и непрерывной фазы перемешивают в течение 5-60 мин перед добавлением основания для обеспечения полимеризации.
5-10 эквивалентов (относительно каждой образующейся амидной связи) основания добавляют к смеси дисперсной и непрерывной фазы. Основание является апротонным, ненуклеофильным и растворимым в дисперсной фазе. Предпочтительно, основание является апротонным, ненуклеофильным, хорошо растворимым как в дисперсной фазе, так и в ДМСО. Более предпочтительно, основание является апротонным, ненуклеофильным, хорошо растворимым как в дисперсной фазе, так и в ДМСО, аминным основанием и является нетоксичным. Наиболее предпочтительно, основание представляет собой N,N,N',N'-тетраметилэтилендиамин (TMEDA). Перемешивание в присутствии основания продолжают в течение от 1 до 16 ч.
В ходе перемешивания капли дисперсной фазы затвердевают, становясь гранулами сшитого гидрогеля по изобретению, которые можно собрать, и проводят фракционирование в соответствии с размером на вибрационном непрерывном просеивающем устройстве с платформой 75 мкм и 32 мкм с получением микрочастиц гидрогеля по изобретению.
Другой аспект настоящего изобретения представляет собой промежуточное соединение D-L' конъюгата эксендин-линкер, где L' имеет формулу (III):
где пунктирная линия указывает на присоединение к одной из аминогрупп части эксендина с образованием амидной связи;
Другим аспектом настоящего изобретения являются реагенты эксендин-линкер D-L*, где
D представляет собой часть эксендина; и
L* представляет собой биологически неактивный линкерный реагент, представленный формулой (IV):
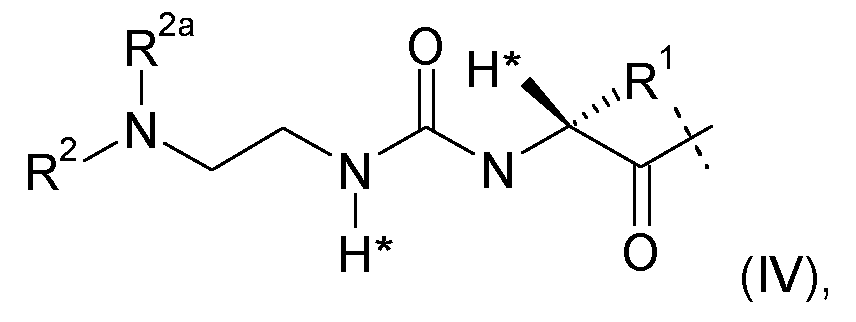
где пунктирная линия указывает на присоединение к одной из аминогрупп эксендина с образованием амидной связи;
R1 выбран из C1-4алкила, предпочтительно CH3;
R2, R2a независимо выбраны из группы, состоящей из H и C1-4алкила,
где L* замещен одним L2* и необязательно дополнительно является замещенным, при условии, что атомы водорода, обозначенные звездочками в формуле (IV), не заменены заместителем, и где
L2* представляет собой спейсер, соединенный с L* и содержащий химическую функциональную группу, предназначенную для конъюгации с гидрогелем.
Предпочтительно, R2 в формуле (IV) заменен L2*.
Предпочтительно, R1 в формуле (IV) представляет собой CH2-L2*.
Предпочтительно, L* в формуле (IV) не является замещенным дополнительно.
Предпочтительно, L2* содержит тиольную группу.
Предпочтительно, L2* содержит малеинимидную группу.
Предпочтительно, L2* представляет собой L2-H.
Гидрогель для пролекарства по настоящему изобретению можно получать способами получения в форме имеющего определенную форму изделия, такого как сетка или стент, или микрочастицы. Наиболее предпочтительно, гидрогелю придают форму гранул в виде микрочастиц, которые можно вводить в качестве подкожной или внутримышечной инъекции с помощью стандартного шприца. Такие мягкие гранулы могут иметь диаметр от 1 до 500 микрометров.
Предпочтительно, микрочастицы имеют диаметр от 10 до 100 микрометров, если они суспендированы в изотоническом водном формулирующем буфере, более предпочтительно диаметр от 20 до 100 микрометров, наиболее предпочтительно диаметр от 25 до 80 микрометров.
Предпочтительно, микрочастицы можно вводить путем инъекции через иглу с внутренним диаметром менее 0,6 мм, предпочтительно через иглу с внутренним диаметром менее 0,3 мм, более предпочтительно через иглу с внутренним диаметром менее 0,225 мм, еще более предпочтительно через иглу с внутренним диаметром менее 0,175 мм, и наиболее предпочтительно через иглу с внутренними диаметром менее 0,16 мм.
Следует понимать, что термины “можно вводить путем инъекции”, “инъецируемый” или “инъекционная способность” относятся к комбинации факторов, таких как определенная сила, применяемая к поршню шприца, содержащего биодеградируемый гидрогель по изобретению, набухший в жидкости при определенной концентрации (масс./об.) и при определенной температуре, игла с данным внутренним диаметром, подсоединенная к выходному отверстию такого шприца, и время, требуемое для выталкивания определенного объема биодеградируемого гидрогеля по изобретению из шприца через иглу.
Для обеспечения инъекционной способности, пролекарство эксендина по изобретению в объеме 1 мл, набухшее в воде до концентрации, по меньшей мере, 5% (масс./об.) и содержащееся в шприце, имеющем поршень диаметром 4,7 мм, можно вытолкнуть при комнатной температуре в течение 10 секунд, применяя силу менее 50 Ньютон.
Предпочтительно, инъекционной способности достигают для пролекарства эксендина по изобретению, набухшего в воде до концентрации приблизительно 10% (масс./об.).
Другим аспектом настоящего изобретения является способ получения инъецируемого через иглу пролекарства, включающий стадии:
(a) получения пролекарства эксендина с гидрогелем по настоящему изобретению в форме микрочастиц;
(b) просеивания микрочастиц,
(c) выбора фракции с диаметром гранул пролекарства от 25 до 80 мкм,
(d) суспендирования фракции гранул со стадии (c) в водном буферном растворе, подходящем для инъекции.
Другой аспект настоящего изобретения представляет собой инъецируемое через иглу пролекарство, полученное описанным выше способом, где инъецируемое через иглу пролекарство может быть инъецировано через иглу с внутренним диаметром менее 300 мкм, предпочтительно через иглу с внутренним диаметром менее 225 мкм, и более предпочтительно через иглу с внутренним диаметром менее 175 мкм.
Другой аспект настоящего изобретения представляет собой фармацевтическую композицию, содержащую пролекарство по настоящему изобретению или его фармацевтически приемлемую соль вместе с фармацевтически приемлемым эксципиентом. Фармацевтическая композиция дополнительно описана в последующих абзацах.
Композиция пролекарства эксендина с гидрогелем может быть предоставлена в виде суспензионной композиции или в виде сухой композиции. Предпочтительно, фармацевтическая композиция пролекарства эксендина с гидрогелем представляет собой сухую композицию. Пригодными способами сушки являются, например, распылительная сушка и лиофилизация (сублимационная сушка). Предпочтительно, фармацевтическая композиция пролекарства эксендина с гидрогелем высушена лиофилизацией.
Предпочтительно, доза пролекарства эксендина с гидрогелем является достаточной для обеспечения терапевтически эффективного количества эксендина в течение, по меньшей мере, трех суток за одно применение. Более предпочтительно, одно применение пролекарства эксендина с гидрогелем достаточно на неделю.
Фармацевтическая композиция пролекарства эксендин-гидрогель в соответствии с настоящим изобретением содержит один или более эксципиентов.
Эксципиенты, используемые в парентеральных композициях, могут быть подразделены на буферные средства, модификаторы тоничности, консерванты, стабилизаторы, средства против адсорбции, защищающие от окисления средства, загустители/повышающие вязкость средства или другие вспомогательные средства. В некоторых случаях, эти ингредиенты могут иметь двойные или тройные функции. Композиции пролекарств эксендина с гидрогелем в соответствии с настоящим изобретением содержат один или более эксципиентов, выбранных из групп состоящих из:
(i) буферных средств: физиологически приемлемые буферы для поддержания pH в желаемом диапазоне, такие как фосфат натрия, бикарбонат, сукцинат, гистидин, цитрат и ацетат, сульфат, нитрат, хлорид, пируват. Также можно использовать антациды, такие как Mg(OH)2 или ZnCO3. Буферную емкость можно корректировать так, чтобы она соответствовала условиям, наиболее чувствительным к стабильности pH;
(ii) модификаторов тоничности: для минимизации боли, которая может быть результатом повреждения клеток вследствие различий в осмотическом давлении в депо инъекции. Примерами являются глицерин и хлорид натрия. Эффективные концентрации можно определить осмометрией с использованием допустимой осмолярности 285-315 мосмоль/кг для сыворотки;
(iii) консервантов и/или противомикробных средств: в случае многодозовых парентеральных препаратов требуется добавление консервантов в достаточной концентрации для минимизации риска инфицирования пациентов после инъекции, и соответствующие нормативные требования были установлены. Конкретные консерванты включают м-крезол, фенол, метилпарабен, этилпарабен, пропилпарабен, бутилпарабен, хлорбутанол, бензиловый спирт, нитрат фенилртути, тимеросол, сорбиновую кислоту, сорбат калия, бензойную кислоту, хлоркрезол и бензалконийхлорид;
(iv) стабилизаторов: стабилизации достигают путем усиления стабилизирующих белок сил, путем дестабилизации денатурированного состояния или путем прямого связывания эксципиентов с белком. Стабилизаторы могут представлять собой аминокислоты, такие как аланин, аргинин, аспарагиновая кислота, глицин, гистидин, лизин, пролин, сахара, такие как глюкоза, сахароза, трегалоза, полиолы, такие как глицерин, маннит, сорбит, соли, такие как фосфат калия, сульфат натрия, хелатирующие агенты, такие как EDTA, гексафосфат, лиганды, такие как ионы двухвалентных металлов (цинк, кальций и т.д.), другие соли или органические молекулы, такие как фенольные производные. Кроме того, можно использовать олигомеры или полимеры, такие как циклодекстрины, декстран, дендримеры, PEG или PVP или протамин или HSA;
(v) средств против адсорбции: в основном ионные или неионные поверхностно-активные вещества или другие белки или растворимые полимеры, используемые для покрытия или конкурентной адсорбции к внутренней поверхности контейнера композиции или композиций. Например, полоксамер (Pluronic F-68), PEG додециловый эфир (Brij 35), полисорбат 20 и 80, декстран, полиэтиленгликоль, PEG-полигистидин, BSA и HSA и желатины. Выбираемая концентрация и тип эксципиента зависят от эффекта, которого хотят избежать, но, как правило, монослой поверхностно-активного вещества образуется на поверхности контакта при величине немного выше величины CMC;
(vi) лио- и/или криопротекторов: В процессе сублимационной или распылительной сушки эксципиенты могут противодействовать дестабилизирующим эффектам, вызываемым разрушением водородных связей и удалением воды. Для этой цели можно использовать сахара и полиолы, однако соответствующие положительные эффекты также наблюдают для поверхностно-активных веществ, аминокислот, неводных растворителей и других пептидов. Трегалоза является особенно эффективной для снижения индуцируемой влагой агрегации, а также повышает термическую стабильность, потенциально вызываемую воздействием воды на гидрофобные группы белков. Также можно использовать маннит и сахарозу, либо в виде единственного лио/криопротектора, либо в комбинации с друг с другом, где, как известно, более высокие соотношения маннит:сахароза повышают физическую стабильность лиофилизированной массы. Маннит также можно комбинировать с трегалозой. Трегалозу также можно комбинировать с сорбитом или сорбит можно использовать в качестве единственного протектора. Также можно использовать крахмал или производные крахмала;
(vii) защищающих от окисления средств: антиоксиданты, такие как аскорбиновая кислота, эктоин, глутатион, метионин, монотиоглицерин, морин, полиэтиленимин (PEI), пропилгаллат, витамин E, хелатирующие агенты, такие как лимонная кислота, EDTA, гексафосфат, тиогликолевая кислота;
(viii) загустителей или повышающих вязкость средств: замедляют осаждение частиц во флаконе и шприце, и их используют для облегчения смешения и ресуспендирования частиц и для облегчения инъецирования суспензии (т.е. низкое усилие на поршень шприца). Пригодными загустителями или повышающими вязкость средствами являются, например, карбомерные загустители, такие как Carbopol 940, Carbopol Ultrez 10, производные целлюлозы, такие как гидроксипропилметилцеллюлоза (гипромеллоза, HPMC) или диэтиламиноэтилцеллюлоза (DEAE или DEAE-C), коллоидный силикат магния (Veegum) или силикат натрия, гидроксиапатитный гель, гель на основе трикальцийфосфата, ксантаны, каррагенаны, такие как камедь Satia UTC 30, алифатические поли(гидроксикислоты), такие как поли(D,L- или L-молочная кислота) (PLA) и поли(гликолевая кислота) (PGA) и их сополимеры (PLGA), терполимеры D,L-лактида, гликолида и капролактона, полоксамеры, гидрофильные поли(оксиэтиленовые) блоки и гидрофобные поли(оксипропиленовые) блоки для формирования тройного блока поли(оксиэтилен)-поли(оксипропилен)-поли(оксиэтилен) (например Pluronic®), сложный полиэфирный сополимер, такой как сополимер полиэтиленгликольтерефталат/полибутилентерефталат, ацетатизобутират сахарозы (SAIB), декстран или их производные, комбинации декстранов и PEG, полидиметилсилоксан, коллаген, хитозан, поливиниловый спирт (PVA) и производные, полиалкилимиды, сополимер (акриламида и диаллилдиметиламмония (DADMA)), поливинилпирролидон (PVP), гликозаминогликаны (GAG), такие как дерматансульфат, хондроитинсульфат, кератансульфат, гепарин, гепарансульфат, гиалуронан, тройной блок ABA или блок-сополимеры AB, состоящие из гидрофобных A-блоков, таких как полилактид (PLA) или сополимер (лактида и гликолида) (PLGA), и гидрофильных B-блоков, таких как полиэтиленгликоль (PEG) или поливинилпирролидон. Такие блок-сополимеры, а также указанные выше полоксамеры, могут проявлять характеристики обратного температурного гелеобразования (жидкое состояние при комнатной температуре для облегчения введения и гелеобразное состояние при температуре выше температуры перехода золь-гель, представляющей собой температуру тела, после инъекции);
(ix) усиливающего распространение или диффузию средства: модифицирует проницаемость соединительной ткани путем гидролиза компонентов внеклеточного матрикса в интерстициальном пространстве, таких как, но, не ограничиваясь ими, гиалуроновая кислота - полисахарид, находящийся в межклеточном пространстве соединительной ткани. Усиливающее распространение средство, такое как, но, не ограничиваясь ими, гиалуронидаза, временно снижает вязкость внеклеточного матрикса и обеспечивает диффузию инъецируемых лекарственных средств;
(x) других добавок: таких как смачивающие агенты, модификаторы вязкости, антибиотики, гиалуронидаза. Кислоты и основания, такие как хлористоводородная кислота и гидроксид натрия, являются добавками, необходимыми для коррекции pH в процессе получения.
Предпочтительно, композиция пролекарства эксендина с гидрогелем содержит один или более загустителей и/или модифицирующих вязкость средств.
Термин "эксципиент" предпочтительно относится к разбавителю, адъюванту или носителю, с которыми вводят лекарственное средство. Такой фармацевтический эксципиент может представлять собой стерильные жидкости, такие как вода и масла, включая масла нефтяного, животного, растительного или синтетического происхождения, включая, но, не ограничиваясь ими, арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п. Вода является предпочтительным эксципиентом, когда фармацевтическую композицию вводят перорально. Солевой раствор и водный раствор декстрозы являются предпочтительными эксципиентами, когда фармацевтическую композицию вводят внутривенно. Солевые растворы и водные растворы декстрозы и глицерина предпочтительно используют в качестве жидких эксципиентов для инъецируемых растворов. Пригодные фармацевтические эксципиенты включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, известняк, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое снятое молоко, глицерин, пропилен, гликоль, воду, этанол и т.п. Композиция, если желательно, также может содержать небольшие количества смачивающих веществ или эмульгаторов, или pH-буферных средств. Эти композиции могут быть в форме растворов, суспензий, эмульсий, таблеток, пилюль, капсул, порошков, составов с замедленным высвобождением и т.п. Композиция может быть изготовлена в виде суппозитория с традиционными связующими веществами и эксципиентами, такими как триглицериды. Пероральный состав может включать стандартные эксципиенты, такие как маннит, лактоза, крахмал, стеарат магния, натрий сахарин, целлюлоза, карбонат магния фармацевтической категории и т.д. Примеры пригодных фармацевтических эксципиентов описаны в "Remington's Pharmaceutical Sciences" by E.W. Martin. Такие композиции содержат терапевтически эффективное количество лекарственного средства, предпочтительно в очищенной форме, вместе с подходящим количеством эксципиента, чтобы обеспечить форму для надлежащего введения пациенту. Состав должен быть соответствовать способу введения.
В основном варианте осуществления фармацевтическая композиция по настоящему изобретению, либо в сухой форме, либо в виде суспензии или в другой форме, может быть предоставлена в виде композиции однократной или многократных доз.
В одном варианте осуществления настоящего изобретения сухая композиция пролекарства эксендина с гидрогелем предоставлена в виде однократной дозы, что означает, что контейнер, в котором ее предоставляют, содержит одну фармацевтическую дозу.
Таким образом, в другом аспекте настоящего изобретения композиция предоставлена в виде композиции однократной дозы.
Предпочтительно, суспензионная композиция представляет собой многодозовую композицию, что означает, что она содержит более одной терапевтической дозы. Предпочтительно, многодозовая композиция содержит, по меньшей мере, 2 дозы. Такую многодозовую композицию эксендина с гидрогелем либо можно использовать для разных пациентов, нуждающихся в этом, либо она предназначена для применения у одного пациента, где остальные дозы хранят после применения первой дозы до тех пор, пока не потребуется.
В другом аспекте настоящего изобретения композиция содержится в контейнере. Предпочтительно контейнер представляет собой двухкамерный шприц. В частности, сухую композицию в соответствии с настоящим изобретением предоставляют в первой камере двухкамерного шприца, и раствор для восстановления предоставляют во второй камере двухкамерного шприца.
Перед применением сухой композиции пролекарства эксендина с гидрогелем у пациента, нуждающегося в этом, сухую композицию восстанавливают. Восстановление можно проводить в контейнере, в котором предоставлена сухая композиция пролекарства эксендина с гидрогелем, таком как флакон, шприц, двухкамерный шприц, ампула и кассета. Восстановление проводят добавлением заданного количества раствора для восстановления сухой композиции. Растворы для восстановления представляют собой стерильные жидкости, такие как вода или буфер, которые могут содержать другие добавки, такие как консерванты и/или противомикробные средства. Если композиция пролекарства эксендина с гидрогелем предоставлена в виде однократной дозы, раствор для восстановления может содержать один или более консервантов и/или противомикробных средств. Предпочтительно, раствором для восстановления является стерильная вода. Если композиция пролекарства эксендина с гидрогелем представляет собой многодозовую композицию, предпочтительно, чтобы раствор для восстановления содержал один или более консервантов и/или противомикробных средств, например, таких как бензиловый спирт и крезол.
Дополнительный аспект настоящего изобретения относится к способу введения восстановленной композиции пролекарства эксендина с гидрогелем. Композицию пролекарства эксендина с гидрогелем можно вводить способами инъекции или инфузии, включая внутрикожное, подкожное, внутримышечное, внутривенное, внутрикостное и внутрибрюшинное введение.
Следующим аспектом является способ получения восстановленной композиции, содержащей терапевтически эффективное количество пролекарства эксендина с гидрогелем, и необязательно один или более фармацевтически приемлемых эксципиентов, где эксендин временно связан с гидрогелем, включающий стадию:
приведения в контакт композиции по настоящему изобретению с раствором для восстановления.
Другим аспектом является восстановленная композиция, содержащая терапевтически эффективное количество пролекарства эксендина с гидрогелем, и необязательно один или более фармацевтически приемлемых эксципиентов, где эксендин временно связан с гидрогелем, полученный описанным выше способом.
Другой аспект настоящего изобретения предоставляет способ получения сухой композиции пролекарства эксендина с гидрогелем. В одном варианте осуществления такую суспензионную композицию получают путем
(i) смешения пролекарства эксендина с гидрогелем с одним или более эксципиентами,
(ii) переноса количеств, эквивалентных однократным или многократным дозам, в подходящий контейнер,
(iii) сушки композиции в указанном контейнере и
(iv) герметизации контейнера.
Подходящими контейнерами являются флаконы, шприцы, двухкамерные шприцы, ампулы и кассеты.
Другим аспектом является набор составных частей. Когда устройство для введения представляет собой просто шприц для подкожных инъекций, тогда набор может включать шприц, иглу и контейнер, содержащий сухую композицию пролекарства эксендина с гидрогелем для применения с помощью шприца, и второй контейнер, содержащий раствор для восстановления. В более предпочтительных вариантах осуществления инъекционное устройство отличается от простого шприца для подкожных инъекций и, таким образом, отдельный контейнер с восстановленным пролекарством эксендина с гидрогелем приспособлен для контакта с инъекционным устройством, чтобы жидкая композиция в контейнере находилась в жидкостном соединении с выходным отверстием инъекционного устройства. Примеры устройств для введения включают, но не ограничиваются ими, шприцы для подкожных инъекций и шприцы-ручки. В частности, предпочтительными инъекционными устройствами являются шприцы-ручки, в случае которых, контейнером является кассета, предпочтительно одноразовая кассета.
Предпочтительный набор составных частей включает иглу и контейнер, содержащий композицию в соответствии с настоящим изобретением и необязательно дополнительно содержащий раствор для восстановления, причем контейнер адаптирован для применения с иглой. Предпочтительно, контейнер представляет собой двухкамерный шприц.
В другом аспекте изобретение относится к кассете, содержащей композицию пролекарства эксендина с гидрогелем, как описано в настоящем описании, для применения со шприцом-ручкой. Кассета может содержать однократную дозу или многократные дозы эксендина.
В одном варианте осуществления настоящего изобретения суспензионная композиция пролекарства эксендина с гидрогелем не только содержит пролекарство эксендина с гидрогелем и один или более эксципиентов, но также и другие биологически активные вещества, либо в свободной форме, либо в виде пролекарств. Предпочтительно, такое дополнительное одно или более биологически активных веществ представляют собой пролекарство, более предпочтительно пролекарство с гидрогелем. Такие биологически активные вещества включают, но не ограничиваются ими, соединения следующих классов:
(i) сульфонилмочевины, например, такие как хлорпропамид, толазамид, толбутамид, глибурид, глипизид, глимепирид, глибенкламид, гликлазид и т.п.;
(ii) меглитиниды, например, такие как репаглинид, натеглинид или митиглинид;
(iii) глюкагон-подобный пептид-1 (GLP-1) и его миметики, глюкозо-инсулинотропный пептид (GIP) и его миметики, эксендин и его миметики и ингибиторы дипептилпротеазы (DPPIV);
(iv) бигуаниды, например, такие как метформин;
(v) тиазолидиндионы, например, такие как розиглитазон, пиоглитазон, троглитазон, изаглитазон (известный как MCC-555), 2-[2-[(2R)-4-гексил-3,4-дигидро-3-оксо-2H-1,4-бензоксазин-2-ил]этокси]бензолуксусная кислота, циглитазон, розиглитазон или соединения, описанные в WO 97/41097, Dr. Reddy's Research Foundation, особенно 5-[[4-[(3,4-дигидро-3-метил-4-оксо-2-хиназолинилметокси]фенил]метил]-2,4-тиазолидиндион, и т.п.;
(vi) GW2570 и т.п.;
(vii) модуляторы рецептора ретиноидов-X (RXR), например, такие как таргетин, 9-цис-ретиноевая кислота и т.п.;
(viii) другие средства, повышающие чувствительность к инсулину, например, такие как INS-1, ингибиторы PTP-1B, ингибиторы GSK3, ингибиторы гликогенфосфорилазы a, ингибиторы фруктоза-1,6-бисфосфатазы и т.п.;
(ix) инсулины, включая регулярные инсулины или инсулины короткого действия, инсулины с промежуточной длительностью действия и инсулины длительного действия, ингалируемый инсулин, производные инсулина и аналоги инсулина, такие как молекулы инсулина с небольшими различиями в природной аминокислотной последовательности;
(x) низкомолекулярные миметики инсулина, включая, но, не ограничиваясь ими, L-783281, TE-17411 и т.п.;
(xi) ингибиторы натрий-зависимого транспортера глюкозы 1 и/или 2 (SGLT1, SGLT2), например KGA-2727, T-1095, T-1095A, SGL-0010, AVE 2268, SAR 7226, SGL-5083, SGL-5085, SGL-5094, ISIS-388626, серглифлозин, дапаглифлозин или ремоглифлозин этабонат, канаглифлозин, флоризин и т.п.;
(xii) агонисты амилина, которые включают, но не ограничиваются ими, прамлитинид и т.п.;
(xiii) антагонисты глюкагона, такие как AY-279955 и т.п.
(xiv) гормоны кишечника и модуляторы активности гормонов кишечника, такие как соматостатин, оксинтомодулин, холицистокинин, инкретины, грелин PYY3-36 и т.п.
Инсулины, как описано выше, могут быть независимо выбраны из группы, состоящей из инсулинов животных семейства бычьих, инсулинов животных семейства свиных и инсулинов человека. Более предпочтительно инсулин независимо выбран из инсулинов человека. Инсулин может быть выбран из немодифицированных инсулинов, более конкретно, из инсулинов семейства бычьих, инсулинов семейства свиных и инсулинов человека.
Производные инсулина представляют собой производные встречающегося в природе инсулина и/или аналога инсулина, которые получены химической модификацией. Химическая модификация может состоять, например, в добавлении одной или более определенных химических групп на одну или более аминокислот.
Аналоги инсулина, которые описаны в EP 0214826, EP 0375437, EP 0678522, EP 0885961, EP 0419504, WO 92/00321, патентных заявках Германии 10 2008 003 568.8 и 10 2008 003 566.1 и EP-A 0368187 могут быть частью комбинаций по изобретению. Документы EP 0214826, EP 0375437, EP 0678522, EP 041 504, WO 92/00321 и EP-A 0368187 включены в настоящее описание посредством ссылок.
Один из предпочтительных аналогов инсулина может быть выбран из группы, состоящей из Gly(A21)-Arg(B31)-Arg(B32) инсулина человека (инсулин глагин, Lantus); Arg(A0)-His(A8)-Glu(A15)-Asp(A18)-Gly(A21)-Arg(B31)-Arg(B32) инсулинамида человека, Lys(B3)-Glu(B29) инсулина человека; LysB28ProB29 инсулина человека (инсулин лизпро), B28 Asp инсулина человека (инсулин аспарт), инсулина человека, в котором пролин в положении B28 заменен Asp, Lys, Leu, Val или Ala, и где Lys в положении B29 может быть заменен на Pro; AlaB26 инсулина человека; дез(B28-B30) инсулина человека; дез(B27) инсулина человека или B29Lys(ε-тетрадеканоил), дез(B30) инсулина человека (инсулин детемир).
Предпочтительное производное инсулина может быть выбрано из группы, состоящей из B29-N-миристоил-дез(B30) инсулина человека, B29-N-пальмитоил-дез(B30) инсулина человека, B29-N-миристоил инсулина человека, B29-N-пальмитоил инсулина человека, B28-N-миристоил LysB28ProB29 инсулина человека, B28-N-пальмитоил-LysB28ProB29 инсулина человека, B30-N-миристоил-ThrB29LysB30 инсулина человека, B30-N-пальмитоил-ThrB29LysB30 инсулина человека, B29-N-(N-пальмитоил-Υ-глутамил)-дез(B30) инсулина человека, B29-N-(N-литохолил-Υ-глутамил)-дез(B30) инсулина человека, B29-N-(ω-карбоксигептадеканоил)-дез(B30) инсулина человека и B29-N-(ω-карбоксигептадеканоил) инсулина человека.
Наиболее предпочтительное производное инсулина выбрано из группы, состоящей из Gly(A21)-Arg(B31)-Arg(B32) инсулина человека, LysB28ProB29 инсулина человека (инсулин лизпро), B28 Asp инсулина человека (инсулин аспарт), B29Lys(ε-тетрадеканоил),desB30 инсулина человека (инсулин детемир).
Предпочтительно, такой дополнительный один или более активных веществ представляют собой пролекарство инсулина с гидрогелем, как описано в WO2011/012718 и WO2011/012719.
В дополнение к противодиабетическим средствам, биологически активные соединения могут представлять собой средства против ожирения, такие как орлистат - ингибитор липазы поджелудочной железы, который препятствует разрушению и всасыванию жиров; или сибутамин - средство, подавляющее аппетит, и ингибитор обратного захвата серотонина, норадреналина и дофамина в головном мозге; факторы роста, увеличивающие мобилизацию жиров (например, гормон роста, IGF-1, ризилинг-фактор гормона роста), оксинтомодулина и модуляторы грелина. Другие потенциальные биологически активные средства против ожирения включают, но не ограничиваются ими, средства, подавляющие аппетит, действующие через адренергические механизмы, такие как бензфетамин, фенметразин, фентермин, диэтилпропион, мазиндол, сибутамин, фенилпропаноламин или эфедрин; средства, подавляющие аппетит, действующие через серотонинергические механизмы, такие как квипазин, флуоксетин, сертралин, фенфлурамин или дексфенфлурамин; средства, подавляющие аппетит, действующие через дофаминовые механизмы, например, апоморфин; средства, подавляющие аппетит, действующие через гистаминергические механизмы (например, миметики гистамина, модуляторы рецептора H3); средства, усиливающие расход энергии, такие как бета-3-адренергические агонисты и стимуляторы функции разобщения белков; лептин и миметики лептина (например, метрелептин); антагонисты нейропептида Y; модуляторы рецептора меланокортина-1, 3 и 4; агонисты холицистокинина; миметики и аналоги глюкагон-подобного пептида-1 (GLP-1) (например, эксендин); андрогены (например, дегидроэпиандростерон и производные, такие как этиохоландион), тестостерон, анаболические стероиды (например, оксандролон) и стероидные гормоны; антагонисты рецепторов галанина; цитокиновые агенты, такие как циллиарный нейротрофический фактор; ингибиторы амилазы; агонисты/миметики энтеростатина; антагонисты орексина/гипокретина; антагонисты урокортина; агонисты бомбезина; модуляторы протеинкиназы A; миметики рилизинг-фактора кортикотропина; миметики кокаин- и амфетамин-регулируемого транскрипта; родственные гену кальцитонина пептидные миметики и ингибиторы синтазы жирных кислот.
В альтернативном варианте осуществления композицию пролекарства эксендина с гидрогелем в соответствии с настоящим изобретением комбинируют со вторым биологически активным соединением, чтобы сначала пациенту, нуждающемуся в этом, вводили пролекарство эксендина с гидрогелем, а затем вводили второе соединение. Альтернативно, композицию эксендина с гидрогелем вводят пациенту, нуждающемуся в этом, после введения другого соединения тому же пациенту.
Другой аспект настоящего изобретения представляет собой пролекарство по настоящему изобретению или фармацевтическую композицию по настоящему изобретению для применения в качестве лекарственного средства.
Другим аспектом настоящего изобретения является пролекарство по настоящему изобретению или фармацевтическая композиция по настоящему изобретению для применения в способе лечения или профилактики заболеваний или нарушений, которые можно лечить эксендином. Указанные композиции предназначены для применения в способе лечения или профилактики заболеваний или нарушений, для которых известно использование эксендина и агонистов эксендина, например, для лечения и профилактики гипергликемии и для лечения и профилактики сахарного диабета любого типа, например, инсулинозависимого сахарного диабета, инсулиннезависимого сахарного диабета, предиабета или гестационного сахарного диабета, для профилактики и лечения метаболического синдрома и/или ожирения и/или нарушений питания, синдрома резистентности к инсулину, для снижения уровня липидов в плазме, для снижения сердечного риска, для снижения аппетита, для снижения массы тела и т.д.
Пациенты, нуждающиеся в лечении композициями эксендина длительного действия по настоящему изобретению, имеют высокий риск развития сопутствующих заболеваний. Таким образом, комбинацию эксендина длительного действия по настоящему изобретению с соответствующими биологически активными соединениями можно использовать, например, для профилактики, замедления прогрессирования или лечения заболеваний и нарушений, выбранных из группы, состоящей из гипертензии (включая, но, не ограничиваясь ими, изолированную систолическую гипертензию и семейную дислипидемическую гипертензию), застойной сердечной недостаточности, гипертрофии левого желудочка, заболевания периферических артерий, диабетической ретинопатии, дегенерации желтого пятна, катаракты, диабетической нефропатии, гломерулосклероза, хронической почечной недостаточности, диабетической невропатии, синдрома X, предменструального синдрома, коронарной болезни сердца, стенокардии, тромбоза, атеросклероза, инфаркта миокарда, транзиторных ишемических атак, инсульта, рестеноза сосудов, гипергликемии, гиперинсулинемии, гиперлипидемии, гипертриглицеридемии, резистентности к инсулину, нарушенного метаболизма глюкозы, состояний нарушенной толерантности к глюкозе, состояний нарушенных уровней глюкозы в плазме натощак, ожирения, эректильной дисфункции, нарушений кожи и соединительной ткани, изъязвлений стоп и язвенного колита, эндотелиальной дисфункции и нарушенной податливости сосудов.
Профилактики, замедления прогрессирования или лечения заболеваний и нарушений, выбранных из группы выше, можно достигать путем комбинирования композиции эксендина длительного действия по настоящему изобретению, по меньшей мере, с одним биологически активным соединением, выбранным из классов лекарственных средств, используемых для лечения указанных состояний, включая антагонисты AT1-рецепторов; ингибиторы ангиотензинпревращающих ферментов (ACE); ингибиторы ренина; блокаторы бета-адренергических рецепторов; блокаторы альфа-адренергических рецепторов; блокаторы кальциевых каналов; ингибиторы альдостеронсинтазы; антагонисты рецепторов альдостерона; ингибиторы нейтральной эндопептидазы (NEP); двойные ингибиторы ангиотензинпревращающего фермента/нейтральной эндопептидазы (ACE/NEP); антагонисты рецепторов эндотелина; диуретиков; статинов; нитраты; средства против свертывания крови; натрийуретические пептиды; соединения дигиталиса; модуляторы PPAR.
В случае, когда пролекарства биологически активных веществ, особенно пролекарства с гидрогелем, содержат одну или более кислотных или основных групп, изобретение также включает их соответствующие фармацевтически или токсикологически приемлемые соли, в частности, их фармацевтически применимые соли. Таким образом, пролекарства, которые содержат кислотные группы, можно использовать в соответствии с изобретением, например, в виде солей щелочных металлов, солей щелочноземельных металлов или солей аммония. Более точные примеры таких солей включают соли натрия, соли калия, соли кальция, соли магния или соли с аммиаком или органическим аминами, например, такими как этиламин, этаноламин, триэтаноламин или аминокислоты. Пролекарства, которые содержат одну или более основных групп, т.е. группы, которые могут быть протонированными, могут присутствовать и могут быть использованы в соответствии с изобретением в форме их аддитивных солей с неорганическими или органическими кислотами. Примеры подходящих кислот включают хлористоводородную кислоту, бромистоводородную кислоту, фосфорную кислоту, серную кислоту, азотную кислоту, метансульфоновую кислоту, п-толуолсульфоновую кислоту, нафталиндисульфоновые кислоты, щавелевую кислоту, уксусную кислоту, винную кислоту, молочную кислоту, салициловую кислоту, бензойную кислоту, муравьиную кислоту, пропионовую кислоту, пивалевую кислоту, диэтилуксусную кислоту, малоновую кислоту, янтарную кислоту, пимелиновую кислоту, фумаровую кислоту, малеиновую кислоту, яблочную кислоту, сульфаминовую кислоту, фенилпропионовую кислоту, глюконовую кислоту, аскорбиновую кислоту, изоникотиновую кислоту, лимонную кислоту, адипиновую кислоту, и другие кислоты, известные специалисту в данной области. Если пролекарства одновременно содержат кислотные и основные группы в молекуле, изобретение также включает, в дополнение к приведенным солевым формам, внутренние соли или бетаины (цвиттерионы). Соответствующие соли можно получать общепринятыми способами, которые известны специалисту в данной области, например, путем приведения в контакт с органической или неорганической кислотой или основанием в растворителе или диспергирующем веществе, или путем анионного обмена или катионного обмена с другими солями. Настоящее изобретение включает все соли пролекарств, которые, вследствие низкой физиологической совместимости, прямо не пригодны для применения в фармацевтических препаратах, но которые можно использовать, например, в качестве промежуточных соединений для химических реакций или для получения фармацевтически приемлемых солей.
Термин “фармацевтически приемлемый” означает одобренный органом регулирования, таким как EMEA (Европа) и/или FDA (США), и/или любым другим национальным органом регулирования для применения у животных, предпочтительно у человека.
Другой аспект настоящего изобретения представляет собой способ лечения, контроля, замедления развития или профилактики у пациента-млекопитающего, предпочтительно человека, нуждающегося в лечении одного или более состояний, включающий введение указанному пациенту терапевтически эффективного количества пролекарства по настоящему изобретению или фармацевтической композиции по настоящему изобретению, или его фармацевтически приемлемой соли.
На фиг.1 представлена кинетика высвобождения соединений 8, 10, 12, 14 и 16 при pH 7,4, 37°C.
ПРИМЕРЫ
Материалы и способы
Эксендин-4 [Seq ID No:1] на смоле (нагрузка приблизительно 0,1 ммоль/г), синтезированный с применением стратегии Fmoc, приобретали от CASLO Laboratory Aps, Lyngby, Дания. Ликсисенатид [Seq ID No:21] и GLP-1 [Seq ID No:13] на смоле (нагрузка приблизительно 0,1 моль/г), синтезированный с применением стратегии Fmoc, приобретали от Peptide Specialty Laboratories, Heidelberg, Германия. Боковые цепи пептидов были полностью защищены и пептиды имели N-конец.
Амино 4-лучевой PEG массой 5 кДа приобретали от JenKem Technology, Beijing, P. R. Китай.
NHS эфир N-(3-малеимидопропил)-21-амино-4,7,10,13,16,19-гексаоксагенэйкозаноевой кислоты (Mal-PEG6-NHS) приобретали от Celares GmbH, Berlin, Германия.
6-(S-тритилмеркапто)гексановую кислоту приобретали от Polypeptide, Strasbourg, Франция. Использованные аминокислоты имели L-конфигурацию, если не указано иное.
Все другие химические реагенты были от Sigma-ALDRICH Chemie GmbH, Taufkirchen, Германия.
Удаление защитной группы Fmoc:
Для удаления защитной группы Fmoc смолу встряхивали со смесью 2/2/96 (об./об./об.) пиперидин/DBU/ДМФА (два раза, по 10 мин каждый) и промывали ДМФА (десять раз).
Очистка ОФ-ВЭЖХ:
ОФ-ВЭЖХ осуществляли на колонке 100×20 мм или 100×40 мм C18 ReproSil-Pur 300 ODS-3, 5-мкм, (Dr. Maisch, Ammerbuch, Германия), соединенной с системой ВЭЖХ Waters 600 HPLC System и детектором поглощения Waters 2487 Absorbance detector, если не указано иное. Использовали линейные градиенты раствора A (0,1% TFA в H2O) и раствора B (0,1% TFA в ацетонитриле). Фракции ВЭЖХ, содержавшие продукт, объединяли и лиофилизировали.
Флэш-хроматография
Очистку флэш-хроматографией проводили на системе Isolera One от Biotage AB, Швеция, с использованием кассет с диоксидом кремния Biotage KP-Sil и н-гептана и этилацетата в качестве элюентов. Детекцию продуктов проводили при 254 нм.
Для гранул гидрогеля в качестве реакционных емкостей или для стадий промывания использовали шприцы, оборудованные полиэтиленовыми фриттами.
Аналитическую сверхэффективную ЖХ (СЭЖХ) осуществляли на системе Waters Acquity, оборудованной колонкой Waters BEH300 C18 (2,1×50 мм, размер частиц 1,7 мкм), соединенной с масс-спектрометром LTQ Orbitrap Discovery от Thermo Scientific.
МС для PEG-продуктов показывала серию частей (CH2CH2O)n вследствие полидисперсности исходных веществ PEG. Для более простой интерпретации в примерах приведен только один репрезентативный сигнал m/z.
Содержание пептида в гидрогеле: содержание пептидов выражали в виде % массы пептида относительно массы брутто гидрогеля (сумма масс функционализированного малеинимидом гидрогеля и тиола пептидного линкера). Массу тиола пептидного линкера в гидрогеле (и, таким образом, массу пептида отдельно) определяли по расходованию тиола пептидного линкера в ходе реакции конъюгации с функционализированным малеимидным гидрогелем. Расходование тиола пептидного линкера определяли с помощью испытания Ellman (Ellman, G.L. et al., Biochem. Pharmacol., 1961, 7, 88-95).
Пример 1
Синтез каркасного реагента 1g
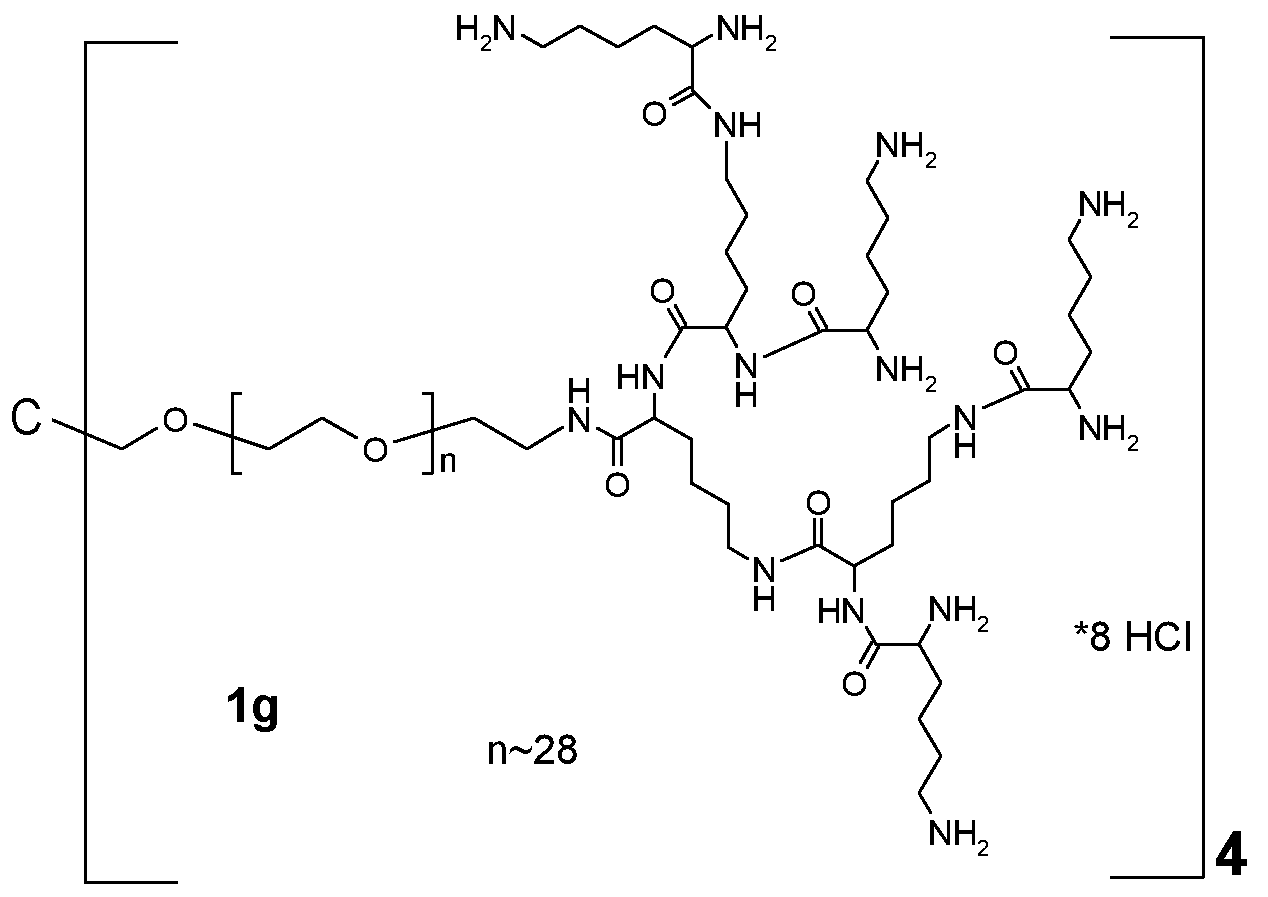
Каркасный реагент 1g синтезировали из амино 4-лучевого PEG5000 1a по следующей схеме:
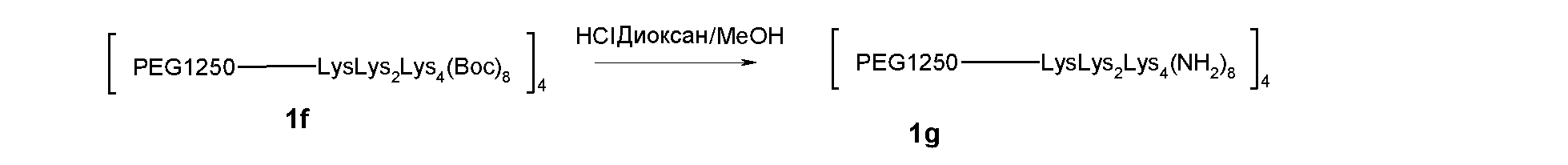
Для синтеза соединения 1b, амино 4-лучевой PEG5000 1a (ММ приблизительно 5200 г/моль, 5,20 г, 1,00 ммоль, соль HCl) растворяли в 20 мл ДМСО (безводный). Добавляли Boc-Lys(Boc)-OH (2,17 г, 6,25 ммоль) в 5 мл ДМСО (безводный), EDC HCl (1,15 г, 6,00 ммоль), HOBt·H2O (0,96 г, 6,25 ммоль) и коллидин (5,20 мл, 40 ммоль). Реакционную смесь перемешивали в течение 30 мин при к.т.
Реакционную смесь разбавляли 1200 мл DCM и промывали 600 мл 0,1н H2SO4 (2×), насыщенным раствором соли (1×), 0,1M NaOH (2×) и смесью 1/1 (об./об.) насыщенный раствор соли/вода (4×). Водные слои реэкстрагировали 500 мл DCM. Органические фазы сушили над Na2SO4, фильтровали и упаривали, с получением 6,3 г неочищенного продукта 1b в виде бесцветного масла. Соединение 1b очищали ОФ-ВЭЖХ.
Выход 3,85 г (59%) бесцветного стеклообразного продукта 1b.
МС: m/z 1294,4=[M+5H]5+ (ММ, вычисленная для [M+5H]5+=1294,6).
Соединение 1c получали перемешиванием 3,40 г соединения 1b (0,521 ммоль) в 5 мл метанола и 9 мл 4н HCl в диоксане при к.т. в течение 15 мин. Летучие вещества удаляли в вакууме. Продукт использовали на следующей стадии без дальнейшей очистки.
МС: m/z 1151,9=[M+5H]5+ (ММ, вычисленная для [M+5H]5+=1152,0).
Для синтеза соединения 1d 3,26 г соединения 1c (0,54 ммоль) растворяли в 15 мл ДМСО (безводный). Добавляли 2,99 г Boc-Lys(Boc)-OH (8,64 ммоль) в 15 мл ДМСО (безводный), 1,55 г EDC HCl (8,1 ммоль), 1,24 г HOBt·H2O (8,1 ммоль) и 5,62 мл коллидина (43 ммоль). Реакционную смесь перемешивали в течение 30 мин при к.т.
Реакционную смесь разбавляли 800 мл DCM и промывали 400 мл 0,1н H2SO4 (2×), насыщенным раствором соли (1×), 0,1M NaOH (2×) и смесью 1/1 (об./об.) насыщенный раствор соли/вода (4×). Водные слои реэкстрагировали 800 мл DCM. Органические фазы сушили над Na2SO4, фильтровали и упаривали, с получением стеклообразного неочищенного продукта.
Продукт растворяли в DCM и осаждали холодным (-18°C) диэтиловым эфиром. Это действие повторяли два раза, и осадок сушили в вакууме.
Выход: 4,01 г (89%) бесцветного стеклообразного продукта 1d, который использовали на следующей стадии без дальнейшей очистки.
МС: m/z 1405,4=[M+6H]6+ (ММ, вычисленная для [M+6H]6+=1405,4).
Соединение 1e получали перемешиванием раствора соединения 1d (3,96 г, 0,47 ммоль) в 7 мл метанола и 20 мл 4н HCl в диоксане при к.т. в течение 15 мин. Летучие вещества удаляли в вакууме. Продукт использовали на следующей стадии без дальнейшей очистки.
МС: m/z 969,6=[M+7H]7+ (ММ, вычисленная для [M+7H]7+=969,7).
Для синтеза соединения 1f, соединение 1e (3,55 г, 0,48 ммоль) растворяли в 20 мл ДМСО (безводный). Добавляли Boc-Lys(Boc)-OH (5,32 г, 15,4 ммоль) в 18,8 мл ДМСО (безводный), EDC HCl (2,76 г, 14,4 ммоль), HOBt·H2O (2,20 г, 14,4 ммоль) и 10,0 мл коллидина (76,8 ммоль). Реакционную смесь перемешивали в течение 60 мин при к.т.
Реакционную смесь разбавляли 800 мл DCM и промывали 400 мл 0,1н H2SO4 (2×), насыщенным раствором соли (1×), 0,1M NaOH (2×) и смесью 1/1 (об./об.) насыщенный раствор соли/вода (4×). Водные слои реэкстрагировали 800 мл DCM. Органические фазы сушили над Na2SO4, фильтровали и упаривали, с получением неочищенного продукта 1f в виде бесцветного масла.
Продукт растворяли в DCM и осаждали охлажденным (-18°C) диэтиловым эфиром. Эту стадию повторяли два раза и осадок сушили в вакууме.
Выход: 4,72 г (82%) бесцветного стеклообразного продукта 1f, который использовали на следующей стадии без дальнейшей очистки.
МС: m/z 1505,3=[M+8H]8+ (ММ, вычисленная для [M+8H]8+=1505,4).
Каркасный реагент 1g получали перемешиванием раствора соединения 1f (ММ приблизительно 12035 г/моль, 4,72 г, 0,39 ммоль) в 20 мл метанола и 40 мл 4н HCl в диоксане при к.т. в течение 30 мин. Летучие вещества удаляли в вакууме.
Выход: 3,91 г (100 %) каркасного реагента 1g в виде стеклообразного продукта.
МС: m/z 977,2=[M+9H]9+ (ММ, вычисленная для [M+9H]9+=977,4).
Альтернативный путь синтеза каркасного реагента 1g
Для синтеза соединения 1b к суспензии 4-лучевого PEG5000 тетраамина (1a) (50,0 г, 10,0 ммоль) в 250 мл изо-PrOH (безводный), boc-Lys(boc)-OSu (26,6 г, 60,0 ммоль) и DIEA (20,9 мл, 120 ммоль) добавляли при 45°C и смесь перемешивали в течение 30 мин.
Затем добавляли н-пропиламин (2,48 мл, 30,0 ммоль). Через 5 мин раствор разбавляли 1000 мл MTBE и хранили в течение ночи при −20°C без перемешивания. Приблизительно 500 мл супернатанта сливали и отбрасывали. Добавляли 300 мл холодного MTBE и после встряхивания в течение 1 мин продукт отделяли фильтрованием через стеклянный фильтр и промывали 500 мл холодного MTBE. Продукт сушили в вакууме в течение 16 ч.
Выход: 65,6 г (74%) соединения 1b в виде белого комковатого твердого вещества.
МС: m/z 937,4=[M+7H]7+ (ММ, вычисленная для [M+7H]7+=937,6).
Соединение 1c получали путем перемешивания соединения 1b из предыдущей стадии (48,8 г, 7,44 ммоль) в 156 мл 2-пропанола при 40°C. При перемешивании добавляли смесь 196 мл 2-пропанола и 78,3 мл ацетилхлорида в течение 1−2 мин. Раствор перемешивали при 40°C в течение 30 мин и охлаждали до −30°C в течение ночи без перемешивания. Добавляли 100 мл холодного MTBE, суспензию встряхивали в течение 1 мин и охлаждали в течение 1 ч при -30°C. Продукт отделяли фильтрованием через стеклянный фильтр и промывали 200 мл холодного MTBE. Продукт сушили в вакууме в течение 16 ч.
Выход: 38,9 г (86%) соединения 1c в виде белого порошка.
МС: m/z 960,1=[M+6H]6+ (ММ, вычисленная для [M+6H]6+=960,2).
Для синтеза соединения 1d boc-Lys(boc)-OSu (16,7 г, 37,7 ммоль) и DIPEA (13,1 мл, 75,4 ммоль) добавляли к суспензии 1c из предыдущей стадии (19,0 г, 3,14 ммоль) в 80 мл 2-пропанола при 45°C и смесь перемешивали в течение 30 мин при 45°C. Затем добавляли н-пропиламин (1,56 мл, 18,9 ммоль). Через 5 мин раствор осаждали 600 мл холодного MTBE и центрифугировали (3000 мин-1, 1 мин). Осадок сушили в вакууме в течение 1 ч и растворяли в 400 мл ТГФ. Добавляли 200 мл диэтилового эфира и продукт охлаждали до −30°C в течение 16 ч без перемешивания. Суспензию фильтровали через стеклянный фильтр и промывали 300 мл холодного MTBE. Продукт сушили в вакууме в течение 16 ч.
Выход: 21,0 г (80%) соединения 1d в виде белого твердого вещества.
МС: m/z 1405,4=[M+6H]6+ (ММ, вычисленная для [M+6H]6+=1405,4).
Соединение 1e получали растворением соединения 1d из предыдущей стадии (15,6 г, 1,86 ммоль) в 3н HCl в метаноле (81 мл, 243 ммоль) и перемешиванием в течение 90 мин при 40°C. Добавляли 200 мл MeOH и 700 мл изо-PrOH и смесь хранили в течение 2 ч при −30°C. Для завершения кристаллизации добавляли 100 мл MTBE и суспензию хранили при −30°C в течение ночи. Добавляли 250 мл холодного MTBE, суспензию встряхивали в течение 1 мин, фильтровали через стеклянный фильтр и промывали 100 мл холодного MTBE. Продукт сушили в вакууме.
Выход: 13,2 г (96%) соединения 1e в виде белого порошка.
МС: m/z 679,1=[M+10H]10+ (ММ, вычисленная для [M+10H]10+=679,1).
Для синтеза соединения 1f boc-Lys(boc)-OSu (11,9 г, 26,8 ммоль) и DIPEA (9,34 мл, 53,6 ммоль) добавляли к суспензии соединения 1e из предыдущей стадии (8,22 г, 1,12 ммоль) в 165 мл 2-пропанола при 45°C и смесь перемешивали в течение 30 мин. Затем добавляли н-пропиламин (1,47 мл, 17,9 ммоль). Через 5 мин раствор охлаждали до −18°C в течение 2 ч, затем добавляли 165 мл холодного MTBE, суспензию встряхивали в течение 1 мин и фильтровали через стеклянный фильтр. Затем осадок на фильтре промывали 4× 200 мл холодной смеси MTBE/изо-PrOH 4:1 и 1× 200 мл холодного MTBE. Продукт сушили в вакууме в течение 16 ч.
Выход: 12,8 г, ММ (90%) соединения 1f в виде светло-желтого комковатого твердого вещества.
МС: m/z 1505,3=[M+8H]8+ (ММ, вычисленная для [M+8H]8+=1505,4).
Каркасный реагент 1g получали растворением 4-лучевого PEG 5 кДа (−LysLys2Lys4(boc)8)4 (1f) (15,5 г, 1,29 ммоль) в 30 мл MeOH и охлаждением до 0°C. Добавляли 4н HCl в диоксане (120 мл, 480 ммоль, охлажденном до 0°C) в течение 3 мин и ледяную баню удаляли. Через 20 мин добавляли 3н HCl в метаноле (200 мл, 600 ммоль, охлажденном до 0°C) в течение 15 мин и раствор перемешивали в течение 10 мин при комнатной температуре. Раствор продукта осаждали 480 мл холодного MTBE и центрифугировали при 3000 об./мин в течение 1 мин. Осадок сушили в вакууме в течение 1 ч и повторно растворяли в 90 мл MeOH, осаждали 240 мл холодного MTBE и суспензию центрифугировали при 3000 об./мин в течение 1 мин. Продукт 1g сушили в вакууме.
Выход: 11,5 г (89 %) в виде светло-желтых хлопьев.
МС: m/z 1104,9=[M+8H]8+ (ММ, вычисленная для [M+8H]8+=1104,9).
Пример 2
Синтез сшивающего реагента 2d
Сшивающий реагент 2d получали из монобензилового эфира адипиновой кислоты (English, Arthur R. et al., Journal of Medicinal Chemistry, 1990, 33(1), 344-347) и PEG2000 по следующей схеме:
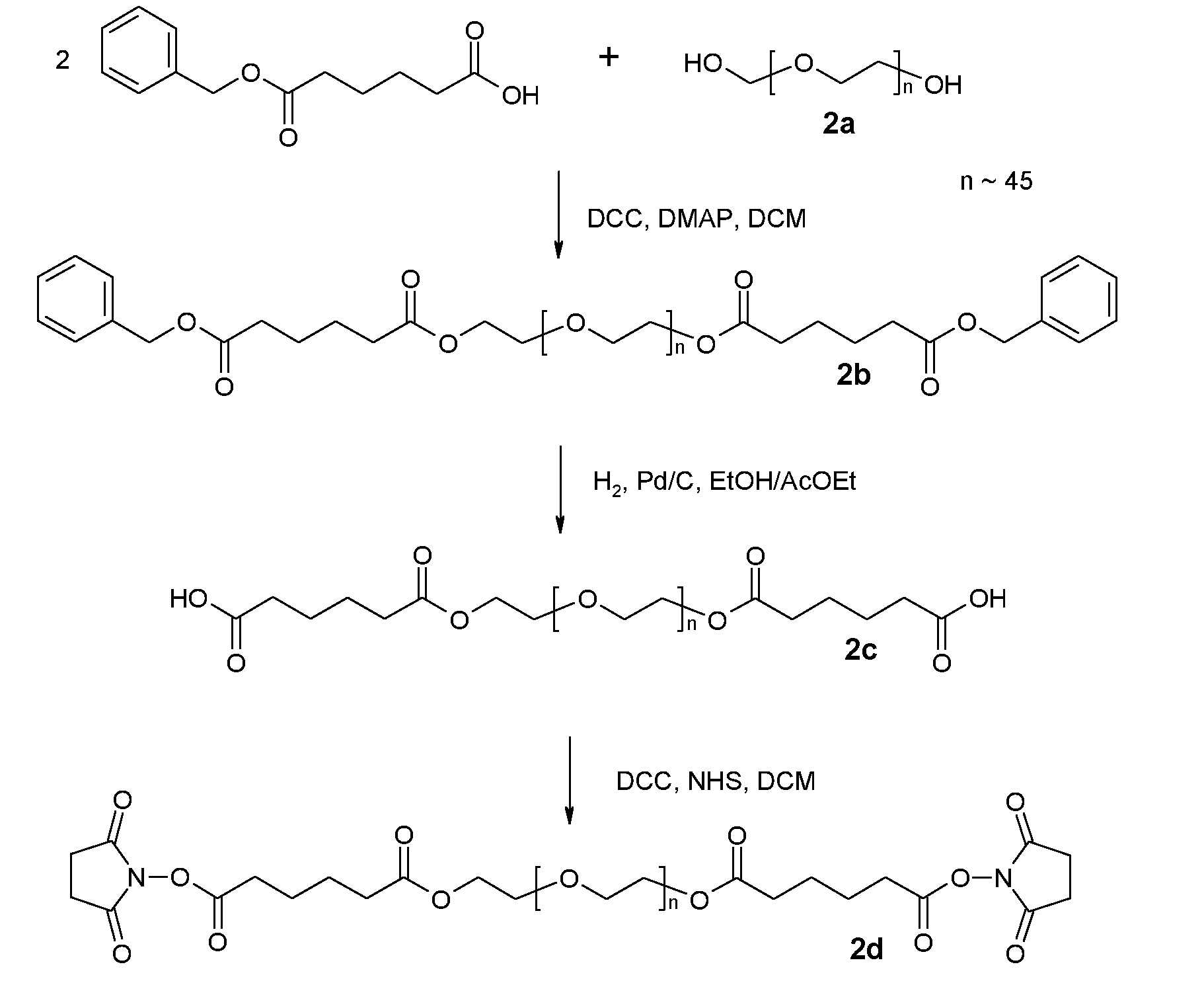
Раствор PEG 2000 (2a) (11,0 г, 5,5 ммоль) и полуэфира бензиладипата (4,8 г, 20,6 ммоль) в DCM (90,0 мл) охлаждали до 0°C. Добавляли дициклогексилкарбодиимид (4,47 г, 21,7 ммоль), затем каталитическое количество DMAP (5 мг), раствор перемешивали и давали достигнуть комнатной температуры в течение ночи (12 ч). Колбу хранили при +4°C в течение 5 ч. Твердое вещество отфильтровывали, и растворитель полностью удаляли отгонкой в вакууме. Осадок растворяли в 1000 мл смеси 1/1 (об./об.) диэтиловый эфир/этилацетат и хранили при к.т. в течение 2 часов, пока не образовывалось небольшое количество хлопьевидного твердого вещества. Твердое вещество удаляли фильтрованием через слой Celite®. Раствор хранили в плотно закрытой колбе при -30°C в морозильной камере в течение 12 ч до завершения кристаллизации. Кристаллический продукт фильтровали через стеклянную фритту и промывали холодным диэтиловым эфиром (-30°C). Осадок на фильтре сушили в вакууме.
Выход: 11,6 г (86%) соединения 2b в виде бесцветного твердого вещества. Продукт использовали на следующей стадии без дальнейшей очистки.
МС: m/z 813,1=[M+3H]3+ (ММ, вычисленная для [M+3H]3+=813,3).
В 500-мл стеклянном автоклаве растворяли PEG2000-бисбензиловый эфир бисадипиновой кислоты 2b (13,3 г, 5,5 ммоль) в этилацетате (180 мл) и добавляли 10% палладий на углероде (0,4 г). Раствор гидрогенизировали при 6 бар, 40°C, до прекращения расходования водорода (5-12 ч). Катализатор удаляли фильтрованием через слой Celite® и растворитель выпаривали в вакууме.
Выход: 12,3 г (количественный) соединения 2c в виде желтоватого масла. Продукт использовали на следующей стадии без дальнейшей очистки.
МС: m/z 753,1=[M+3H]3+ (ММ, вычисленная для [M+3H]3+=753,2).
Раствор PEG2000-полуэфира бисадипиновой кислоты 2c (9,43 г, 4,18 ммоль), N-гидроксисукцинимида (1,92 г, 16,7 ммоль) и дициклогексилкарбодиимида (3,44 г, 16,7 ммоль) в 75 мл DCM (безводный) перемешивали в течение ночи при комнатной температуре. Реакционную смесь охлаждали до 0°C и осадок отфильтровывали. DCM выпаривали и осадок перекристаллизовывали из ТГФ.
Выход: 8,73 г (85%) сшивающего реагента 2d в виде бесцветного твердого вещества.
МС: m/z 817,8=[M+3H]3+ (ММ, вычисленная для [M+3H]3+=817,9 г/моль).
Пример 3
Получение гранул гидрогеля (3), содержащих свободные аминогруппы
Раствор 1200 мг соединения 1g и 3840 мг соединения 2d в 28,6 мл ДМСО добавляли к раствору 425 мг Arlacel P135 (Croda International Plc) в 100 мл гептана. Смесь перемешивали при 650 об./мин пропеллерной мешалкой в течение 10 мин при 25°C до формирования суспензии в 250-мл реакторе, оборудованном перегородками. Для обеспечения полимеризации добавляли 4,3 мл TMEDA. Через 2 ч скорость мешалки уменьшали до 400 об./мин и смесь перемешивали в течение дополнительных 16 ч. Добавляли 6,6 мл уксусной кислоты, затем через 10 мин добавляли 50 мл воды и 50 мл насыщенного водного раствора хлорида натрия. Через 5 мин мешалку останавливали и водную фазу дренировали.
Для фракционирования гранул по размеру водную суспензию гидрогеля просеивали во влажном состоянии через стальные сита с размером ячеек 75, 50, 40, 32 и 20 мкм. Фракции гранул, которые задерживались на ситах размером 32, 40 и 50 мкм, объединяли и промывали 3 раза водой, 10 раз этанолом и сушили в течение 16 ч при 0,1 мбар, с получением соединения 3 в виде белого порошка.
Содержание аминогрупп в гидрогеле определяли путем присоединения fmoc-аминокислоты к свободным аминогруппам гидрогеля и последующего определения fmoc, как описано Gude, M., J. Ryf, et al. (2002) Letters in Peptide Science 9(4): 203-206.
Для различных партий было определено, что содержание аминогрупп в соединении 3 составляет от 0,11 и 0,16 ммоль/г.
Пример 4
Получение функционализированных малеинимидом гранул гидрогеля (4) и определение замещения малеинимидом
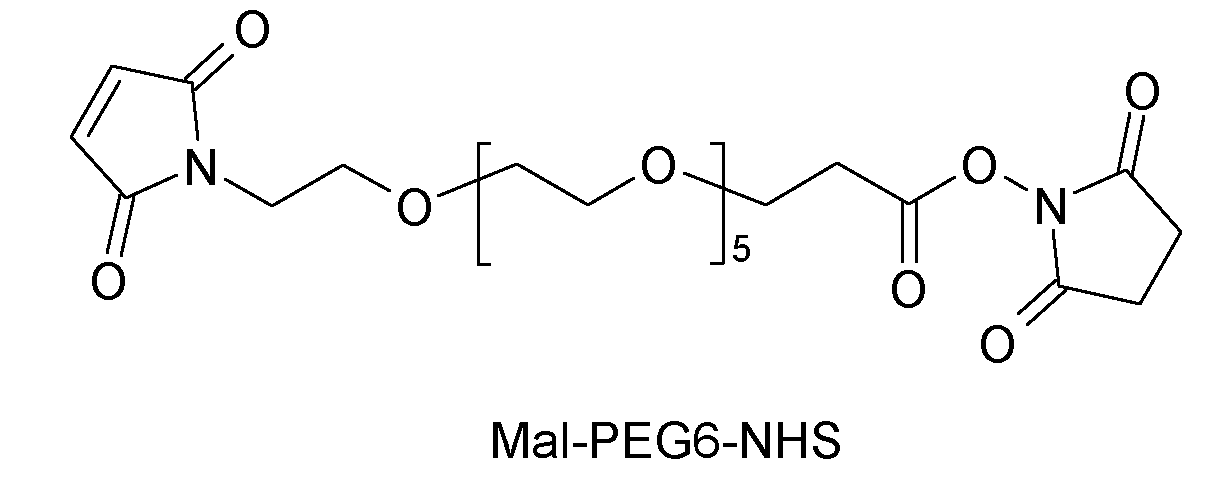
Гранулы гидрогеля 3 предварительно промывали 99/1 (об./об.) ДМСО/DIPEA, промывали ДМСО и инкубировали в течение 45 мин с раствором Mal-PEG6-NHS (2,0 экв. относительно теоретического количества аминогрупп на гидрогеле) в ДМСО. Гранулы 4 промывали пять раз ДМСО и пять раз сукцинатом, pH 3,0 (20 мМ, 1 мМ EDTA, 0,01% Tween-20). Образец промывали три раза фосфатом натрия, pH 6,0 (50 мМ, 50 мМ этаноламин, 0,01% Tween-20) и инкубировали в том же буфере в течение 1 ч при к.т. Затем гранулы промывали пять раз сукцинатом натрия, pH 3,0 (20 мМ, 1 мМ EDTA, 0,01% Tween-20).
Для определения содержания малеинимида аликвоту гранул гидрогеля 4 промывали водой и этанолом по три раза каждым. Образец лиофилизировали и взвешивали. Другую аликвоту гранул гидрогеля 4 подвергали взаимодействию с избытком меркаптоэтанола (в 50 мМ натрий-фосфатном буфере, 30 мин при к.т.), и определяли расходование меркаптоэтанола с помощью теста Ellman (Ellman, G. L. et al., Biochem. Pharmacol., 1961, 7, 88-95). Было определено, что содержание малеинимида составляет от 0,10 до 0,13 ммоль/г сухого гидрогеля.
Пример 5
Синтез линкерного реагента 5c
Линкерный реагент 5c синтезировали по следующей схеме:
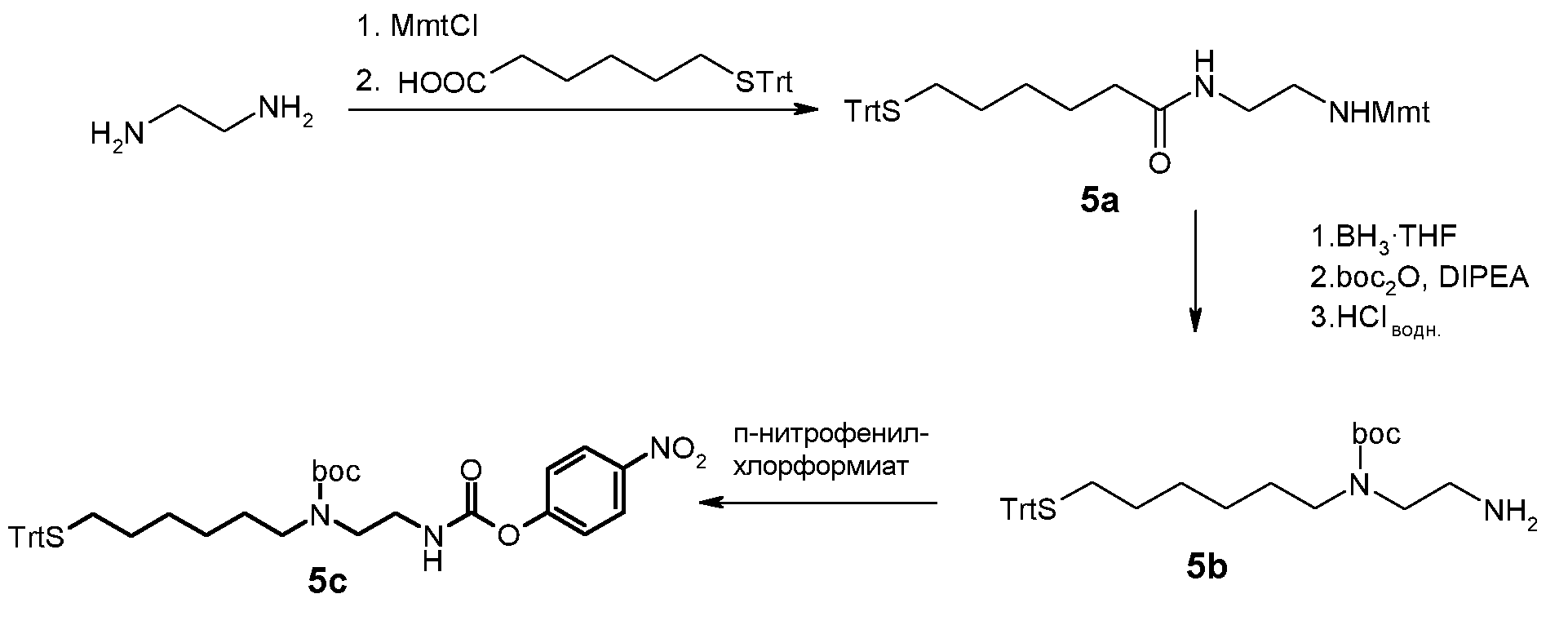
Синтез промежуточного соединения 5a для линкерного реагента
м-Метокситритилхлорид (3 г, 9,71 ммоль) растворяли в DCM (20 мл) и по каплям добавляли к раствору этилендиамина (6,5 мл, 97,1 ммоль) в DCM (20 мл). Через два часа раствор выливали в диэтиловый эфир (300 мл) и промывали три раза смесью 30/1 (об./об.) насыщенный раствор соли/0,1М раствор NaOH (по 50 мл каждый) и один раз насыщенным раствором соли (50 мл). Органическую фазу сушили над Na2SO4 и летучие вещества удаляли при пониженном давлении. Mmt-защищенное промежуточное соединение (3,18 г, 9,56 ммоль) использовали на следующей стадии без дальнейшей очистки.
Mmt-защищенное промежуточное соединение (3,18 г, 9,56 ммоль) растворяли в безводном DCM (30 мл). Добавляли 6-(S-тритилмеркапто)гексановую кислоту (4,48 г, 11,47 ммоль), PyBOP (5,67 г, 11,47 ммоль) и DIPEA (5,0 мл, 28,68 ммоль) и смесь перемешивали в течение 30 мин при к.т. Раствор разбавляли диэтиловым эфиром (250 мл) и промывали три раза смесью 30/1 (об./об.) насыщенный раствор соли/0,1М раствор NaOH (по 50 мл каждый) и один раз насыщенным раствором соли (50 мл). Органическую фазу сушили над Na2SO4 и летучие вещества удаляли при пониженном давлении. Соединение 5a очищали флэш-хроматографией.
Выход: 5,69 г (8,09 ммоль).
МС: m/z 705,4=[M+H]+ (вычисленная ММ=705,0).
Синтез промежуточного соединения 5b для линкерного реагента
К раствору соединения 5a (3,19 г, 4,53 ммоль) в безводном ТГФ (50 мл) добавляли BH3·ТГФ (1М раствор, 8,5 мл, 8,5 ммоль) и раствор перемешивали в течение 16 ч при к.т. Добавляли дополнительный BH3·ТГФ (1М раствор, 14 мл, 14 ммоль) и перемешивали в течение 16 ч при к.т. Реакционную смесь гасили добавлением метанола (8,5 мл). Добавляли N,N-диметилэтилендиамин (3 мл, 27,2 ммоль), раствор нагревали до температуры кипения с обратным холодильником и перемешивали в течение трех ч. Реакционной смеси давали остыть до к.т. и затем разбавляли этилацетатом (300 мл), промывали насыщенным водным раствором Na2CO3 (2×100 мл) и насыщенным водным раствором NaHCO3 (2×100 мл). Органическую фазу сушили над Na2SO4 и летучие вещества удаляли при пониженном давлении, с получением неочищенного промежуточного соединения в виде амина (3,22 г).
Промежуточное соединение в виде амина (3,22 г) растворяли в DCM (5 мл). Добавляли Boc2O (2,97 г, 13,69 ммоль), растворенный в DCM (5 мл) и DIPEA (3,95 мл, 22,65 ммоль), и смесь перемешивали при к.т. в течение 30 мин. Смесь очищали флэш-хроматографией, с получением неочищенного Boc- и Mmt-защищенного промежуточного соединения (3,00 г).
МС: m/z 791,4=[M+H]+, 519,3=[M-Mmt+H]+ (вычисленная ММ=791,1).
0,4М водную HCl (48 мл) добавляли к раствору Boc- и Mmt-защищенного промежуточного соединения в ацетонитриле (45 мл). Смесь разбавляли ацетонитрилом (10 мл) и перемешивали в течение 1 ч при к.т. Затем pH реакционной смеси доводили до 5,5 добавлением 5М раствора NaOH. Ацетонитрил удаляли при пониженном давлении, и водный раствор экстрагировали DCM (4×100 мл). Объединенные органические фазы сушили над Na2SO4, и летучие вещества удаляли при пониженном давлении. Неочищенное соединение 5b использовали на следующей стадии без дальнейшей очистки.
Выход: 2,52 г (3,19 ммоль).
МС: m/z 519,3=[M+H]+ (вычисленная ММ=519,8 г/моль).
Синтез линкерного реагента 5c
Промежуточное соединение 5b (985 мг, 1,9 ммоль) и п-нитрофенилхлорформиат (330 мг, 2,5 ммоль) растворяли в безводном ТГФ (10 мл). Добавляли DIPEA (0,653 мл, 3,7 ммоль) и смесь перемешивали в течение 2 ч при к.т. Раствор подкисляли добавлением уксусной кислоты (1 мл). Соединение 5c очищали ОФ-ВЭЖХ.
Выход: 776 мг, (1,13 ммоль).
МС m/z 706,3=[M+Na]+ (вычисленная ММ=706,3).
Пример 6
Синтез реагента эксендин-линкер 6d
Реагент эксендин-линкер 6d синтезировали по следующей схеме:
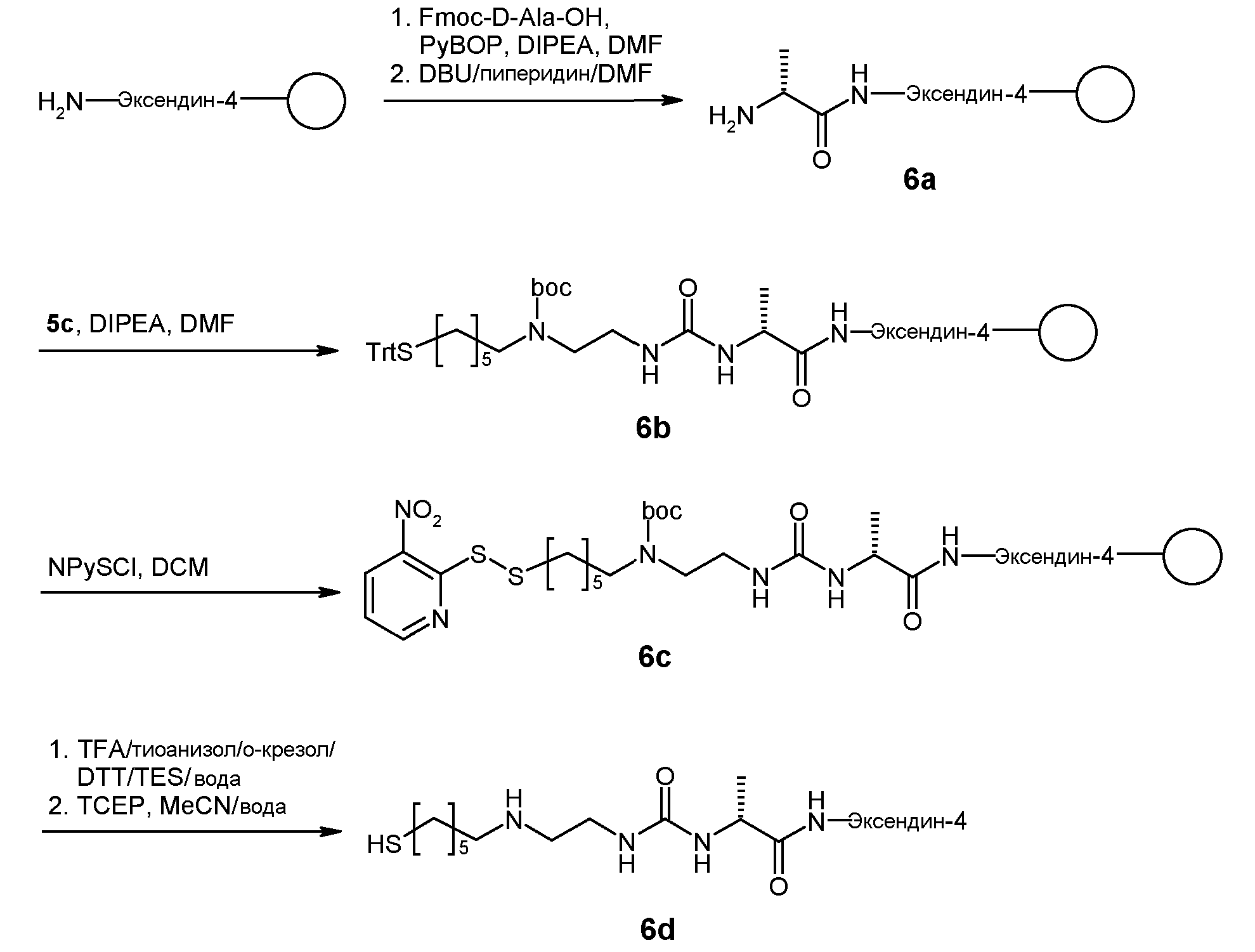
Синтез промежуточного соединения 6a для реагента эксендин-линкер
Эксендин-4 с полностью защищенными боковыми цепями со свободным N-концом на смоле (2,00 г, 0,2 ммоль, нагрузка приблизительно 0,1 ммоль/г) переносили в 20-мл шприц, оборудованный фильтрационной фриттой. 8 мл безводного ДМФА набирали в шприц и встряхивали шприц (600 об./мин) в течение 15 мин для предварительного набухания смолы. Растворитель удаляли и раствор Fmoc-D-аланин-OH (187 мг, 0,6 моль), PyBOP (312 мг, 0,6 ммоль) и DIPEA (174 мкл, 1,0 ммоль) в безводном ДМФА (4 мл) отбирали в шприц. Шприц встряхивали при к.т. и 600 об./мин в течение 60 мин. Раствор отбрасывали и смолу промывали десять раз ДМФА.
Удаление защитной группы Fmoc проводили согласно “материалам и способам”.
Синтез промежуточного соединения 6b для реагента эксендин-линкер
Раствор соединения 5c (137 мг, 0,4 ммоль) в безводном ДМФА (3 мл) добавляли к смоле 6a (0,2 ммоль), затем добавляли раствор DIPEA (80 мкл, 0,46 ммоль) в безводном ДМФА (4,5 мл) и реакционную смесь встряхивали (600 об./мин) при 22°C в течение 15 часов.
Смолу промывали десять раз ДМФА и десять раз DCM и сушили в вакууме.
Синтез промежуточного соединения 6c для реагента эксендин-линкер
3-нитро-2-пиридинсульфенилхлорид (48 мг, 0,25 ммоль) набирали в шприц, содержавший соединение 6b (0,05 ммоль, 0,5 г). В шприц набирали безводный DCM (4 мл) и смесь встряхивали (600 об./мин) при к.т. Через 2 ч раствор удаляли, смолу промывали 14 раз DCM и сушили в вакууме.
Синтез промежуточного соединения 6d для реагента эксендин-линкер
В круглодонной колбе о-крезол (1,5 мл), тиоанизол (1,5 мл), DTT (1,125 г), TES (1,125 мл) и воду (1,5 мл) растворяли в TFA (37,5 мл). К перемешиваемому раствору (250-350 об./мин) при к.т. добавляли соединение 6c (0,15 ммоль, 1,5 г) для получения однородной суспензии. Перемешивание продолжали в течение 45 мин. Раствор отделяли от гранул смолы фильтрованием, гранулы дважды промывали TFA (по 2 мл каждый) и растворы для промывания объединяли с фильтратом. TFA удаляли из объединенных растворов в токе азота.
Неочищенное соединение 6d осаждали из концентрированного раствора (приблизительно 10 мл) добавлением диэтилового эфира (30 мл) и энергичным встряхиванием. После центрифугирования (2 мин, 5000 об./мин) супернатант удаляли и осадок дважды промывали диэтиловым эфиром (по 20 мл каждый).
Высушенный осадок растворяли в растворе TCEP (114 мг, 0,39 ммоль) в 30 мл смеси 1/19 (об./об.) ацетонитрил/вода, содержащей 0,01% TFA (об./об.). Смесь инкубировали в течение 15 часов при к.т. Соединение 6d очищали ОФ-ВЭЖХ, как описано в разделе “Материалы и способы”, с использованием колонки 150×30 мм Waters XBridgeTM BEH300 C18, 10 мкм, и скорости потока 40 мл/мин.
На колонку наносили вплоть до 12 мл смеси. Элюирование осуществляли с использованием линейного градиента от 5% до 30% растворителя B (5 мин) с последующим линейным градиентом от 30% до 35% растворителя B (40 мин). Фракции, содержавшие продукт 6d, объединяли и лиофилизировали. Чистота: 86% (215 нм).
Выход: 85,2 мг (19,2 мкмоль, начиная с 2,00 г смолы).
МС m/z 1486,7=[M+3H]3+, (вычисленная ММ=4460,0 г/моль).
Пример 7
Синтез реагента эксендин-линкер 7
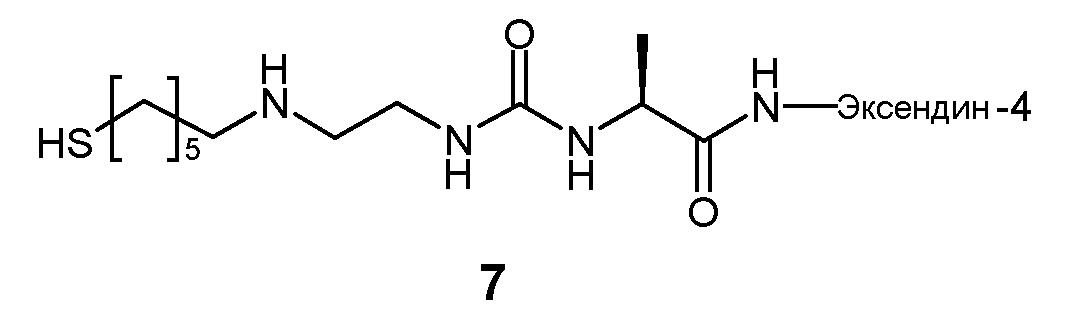
Реагент эксендин-линкер 7 синтезировали, как описано для реагента эксендин-линкер 6a-6d, начиная с эксендина-4 с полностью защищенными боковыми цепями на смоле со свободным N-концом (336 мг, 34 мколь), за исключением того, что вместо Fmoc-D-аланин-OH использовали Fmoc-L-аланин-OH. Количество реагентов подбирали соответствующим образом, для получения таких же соотношений, которые использовали в 6a-6d.
Выход: 13,4 мг
МС: m/z 1487,4=[M+3H]3+ (вычисленная ММ: 4460,0)
Пример 8
Синтез эксендин-линкер-гидрогеля 8
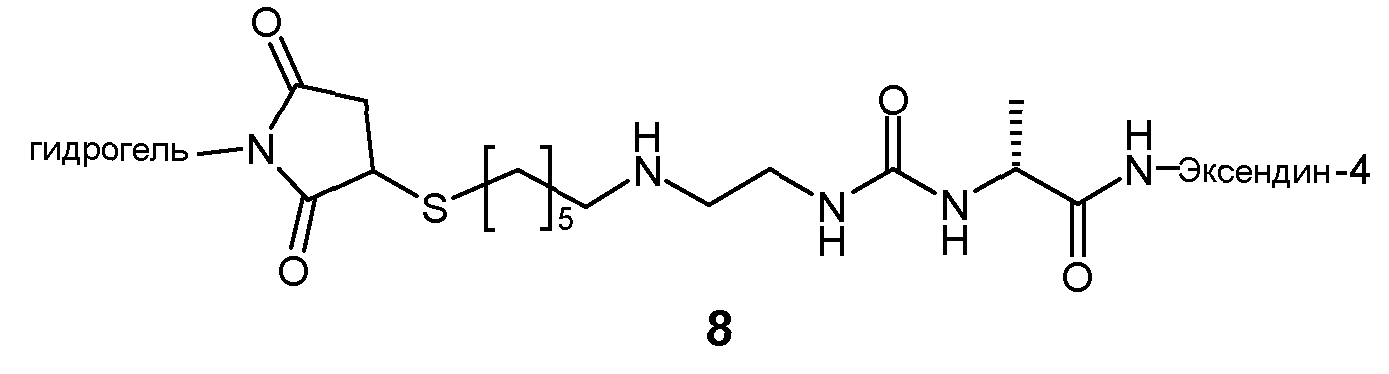
242,5 мг функционализированного малеинимидом гидрогеля 4 (25,0 мкмоль малеимидогрупп), в виде суспензии в сукцинатном буфере, pH 3,0 (20 мМ, 1 мМ EDTA, 0,01% Tween-20) заполняли в шприц, оборудованный фильтрационной фриттой. Гидрогель промывали десять раз смесью 1/1 (об./об.) ацетонитрил/вода, содержащей 0,1% TFA (об./об.). Раствор реагента эксендин-линкер 6d (122,7 мг, 27,5 мкмоль) в смеси 1/1 (об./об.) ацетонитрил/вода вместе с 0,1% TFA (3,7 мл) отбирали и встряхивали в течение 2 мин при к.т., с получением уравновешенной суспензии. Добавляли 334 мкл фосфатного буфера (pH 7,4, 0,5M) и шприц встряхивали (600 об./мин) при к.т. в течение 15 мин. Мониторинг расходования тиола проводили с помощью испытания Ellman. Гидрогель промывали 10 раз смесью 1/1 (об./об.) ацетонитрил/вода, содержащей 0,1% TFA (об./об.).
Меркаптоэтанол (47 мкл) растворяли в смеси 1/1 (об./об.) ацетонитрил/вода вместе с 0,1% TFA (3 мл) и фосфатным буфером (0,5 мл, pH 7,4, 0,5M). Раствор отбирали в шприц и образец встряхивали (600 об./мин) в течение 1 ч при к.т. Раствор удаляли и гидрогель промывали десять раз смесью 1/1 (об./об.) ацетонитрил/вода вместе с 0,1% TFA. Затем гидрогель промывали десять раз сукцинатным буфером (10 мМ сукцинат, 46 г/л маннит, 0,05% Tween-20, доведенный с помощью Tris до pH 5,0) и хранили при 4°C.
Содержание эксендина в эксендин-линкер-гидрогеле определяли в соответствии с “Материалами и способами”.
Было получено содержание эксендина 30% (масс.).
Пример 9
Кинетика высвобождения in vitro
Аликвоту эксендин-линкер-гидрогеля 8 (0,5 мг эксендина) переносили в шприц, оборудованный фильтрационной фриттой, и промывали 5 раз фосфатным буфером, pH 7,4, (60 мМ, 3 мМ EDTA, 0,01% Tween-20). Гидрогель суспендировали в том же буфере и инкубировали при 37°C. В определенные моменты времени (каждый раз после инкубации в течение 1-7 суток) супернатант заменяли и высвобожденный эксендин количественно определяли ОФ-ВЭЖХ при 215 нм. УФ-сигналы, коррелирующие с высвобожденным эксендином, интегрировали и наносили на график против времени инкубации.
Для оценки соответствующего половинного времени высвобождения применяли программу для аппроксимации кривой.
Была определена кинетика высвобождения первого порядка со временем полужизни 45 суток (см. фиг.1).
Пример 10
Синтез эксендин-линкер-гидрогеля 10
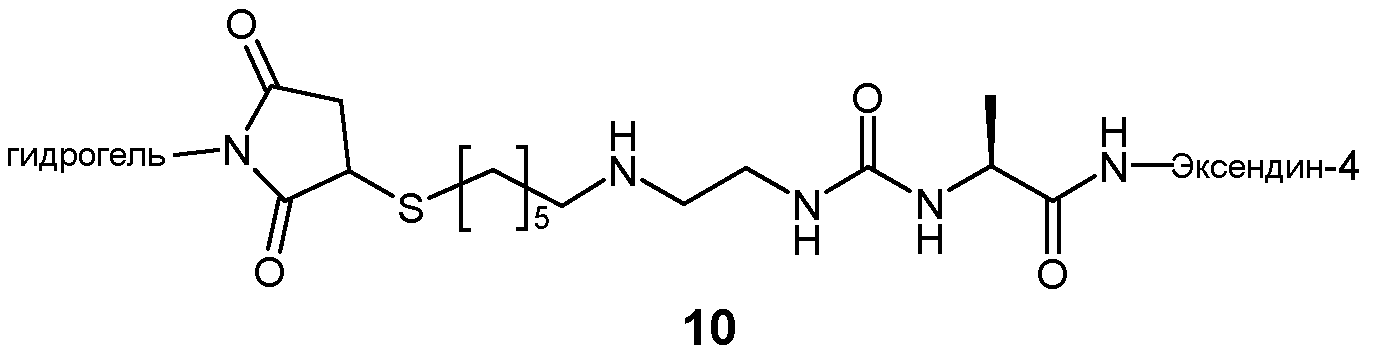
Эксендин-линкер-гидрогель 10 синтезировали, как описано для эксендин-линкер-гидрогеля 8, за исключением использования эксендин-линкер-тиола 7 вместо эксендин-линкер-тиола 6d.
Содержание эксендина в эксендин-линкер-гидрогеле определяли в соответствии с “Материалами и способами”. Было получено содержание эксендина 30,5% (масс.).
Пример 11
Синтез реагента ликсисенатид-линкер 11d
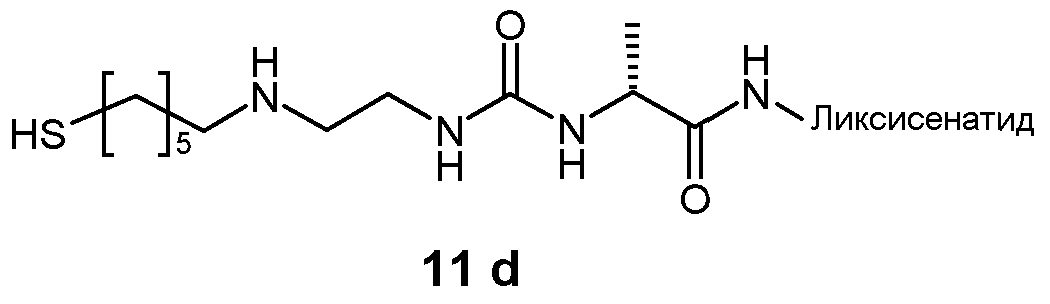
Схема синтеза
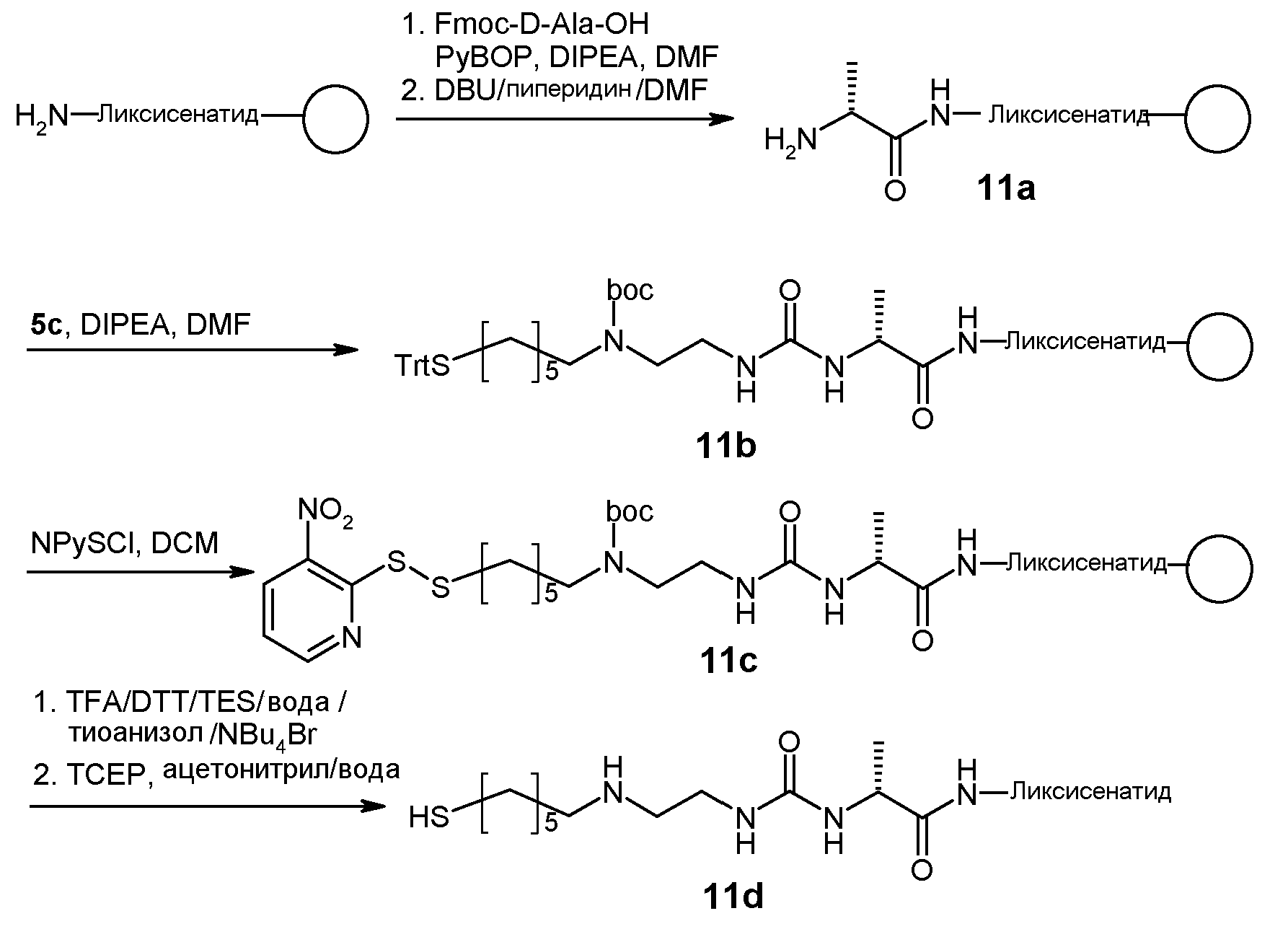
Синтез промежуточного соединения 11a для реагента ликсисенатид-линкер
Ликсисенатид с полностью защищенными боковыми цепями на смоле со свободным N-концом (300 мг, нагрузка приблизительно 0,1 ммоль/г) переносили в 5-мл шприц, оборудованный фильтрационной фриттой. 4 мл Безводного ДМФА набирали в шприц и шприц встряхивали (600 об./мин) в течение 15 мин для предварительного набухания смолы. Растворитель удаляли и раствор Fmoc-D-аланин-OH (28 мг, 90 мкмоль), PyBOP (47 мг, 90 мколь) и DIPEA (26 мкл, 150 мкмоль) в безводном ДМФА (2 мл) отбирали в шприц. Шприц встряхивали при к.т. и 600 об./мин в течение 60 мин. Раствор удаляли и смолу промывали ДМФА десять раз.
Удаление защитной группы Fmoc проводили в соответствии с “Материалами и способами”.
Синтез промежуточного соединения 11b для реагента ликсисенатид-линкер
Раствор 5c (41 мг, 60 мкмоль) в безводном ДМФА (1,5 мл) добавляли к смоле 11a (30 мкмоль), затем добавляли DIPEA (13 мкл, 75 мкмоль) и гомогенизированную реакционную смесь встряхивали (600 об./мин) при 22°C в течение 22 часов.
Смолу промывали десять раз ДМФА и десять раз DCM и сушили в вакууме.
Синтез промежуточного соединения 11c для реагента ликсисенатид-линкер
3-нитро-2-пиридинсульфенилхлорид (38 мг, 0,20 ммоль), набирали в шприц, оборудованный фильтрационной фриттой, содержавший 11b. В шприц набирали безводный DCM (2 мл) и смесь встряхивали (600 об./мин) при к.т. Через 3,5 ч раствор удаляли и смолу промывали 15 раз DCM и сушили в вакууме.
Синтез реагента ликсисенатид-линкер 11d
В 50-мл пробирке Falcon NBu4Br (2,9 мг), тиоанизол (58,3 мкл), DTT (170 мг), TES (170 мкл) и воду (113,3 мкл) растворяли в TFA (5,83 мл). К перемешиваемому раствору (200 об./мин) при к.т. добавляли соединение 11c (30 мколь) для получения однородной суспензии. Перемешивание продолжали в течение 1 ч. Гранулы отфильтровывали и два раза промывали TFA (по 1 мл каждый). Промывочные растворы объединяли с фильтратом.
Неочищенное соединение 11d осаждали из фильтрата (приблизительно 10 мл) добавлением холодного диэтилового эфира (-18°C, 40 мл) и энергичным встряхиванием. Суспензию охлаждали при -18°C в течение дополнительных 15 мин и центрифугировали (2 мин, 5000 об./мин). Супернатант удаляли, и осадок два раза промывали диэтиловым эфиром (по 20 мл каждый) и сушили при пониженном давлении. Осадок растворяли в растворе TCEP (27 мг, 0,94 мкмоль) в 2,5 мл смеси 1/1 (об./об.) ацетонитрил/вода, содержащей 0,01% TFA (об./об.). Смесь инкубировали в течение 15 часов при к.т. Добавляли 20 мл воды и соединение 11d очищали ОФ-ВЭЖХ за два прогона с использованием линейного градиента от 5% до 30% растворителя B (5 мин), затем линейного градиента от 30% до 35% растворителя B (40 мин). Использовали колонку 150×30 мм Waters XBridgeTM BEH300 C18, 10 мкм, и скорость потока 40 мл/мин. Фракции, содержавшие продукт 11d, объединяли и лиофилизировали.
Выход 6,1 мг.
МС: m/z 1284,3=[M+4H]4+ (вычисленная ММ=5131,9).
Пример 12
Синтез ликсисенатид-линкер-гидрогеля 12
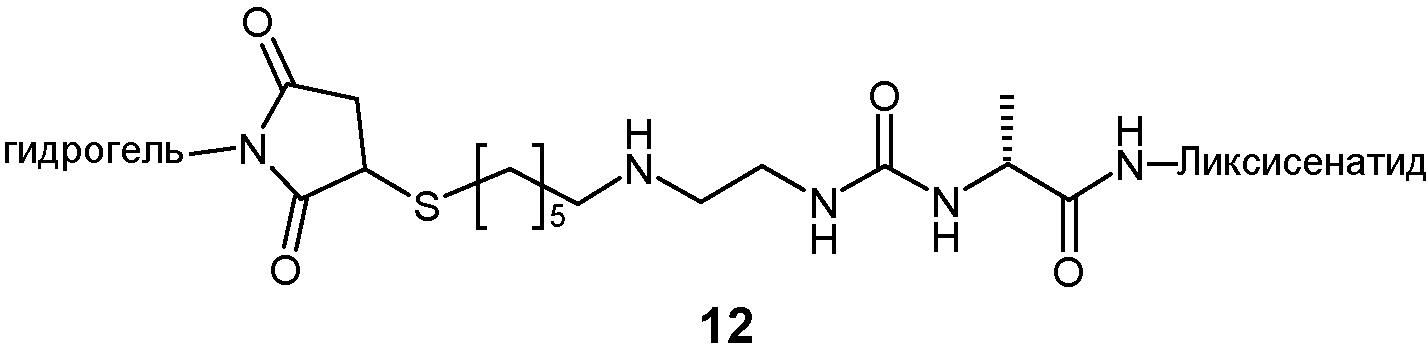
Ликсисенатид-линкер-гидрогель 12 синтезировали, как описано для эксендин-линкер-гидрогеля 8, за исключением использования ликсисенатид-линкер-тиола 11d вместо эксендин-линкер-тиола 6d.
Содержание ликсисенатида в ликсисенатид-линкер-гидрогеле определяли в соответствии с “Материалами и способами”. Было получено содержание ликсисенатида 32,4%.
Пример 13
Синтез реагента ликсисенатид-линкер 13
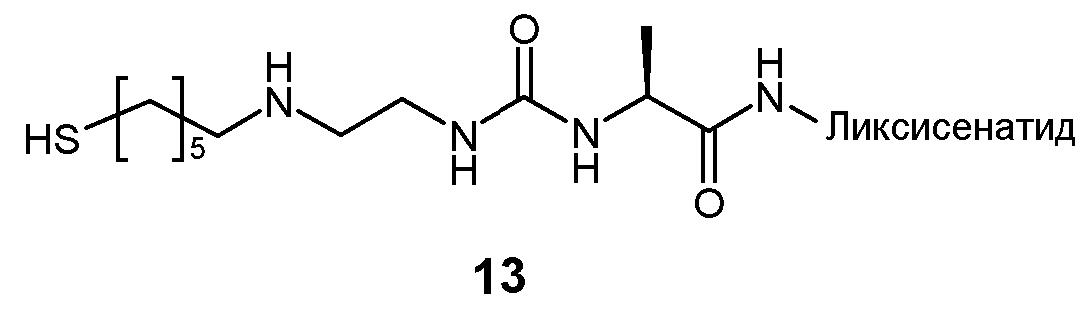
Реагент ликсисенатид-линкер 13 синтезировали, как описано для реагента ликсисенатид-линкер 11a-11d, начиная с ликсисенатид с полностью защищенными боковыми цепями на смоле со свободным N-концом (335 мг, 34 мкмоль), за исключением использования Fmoc-L-аланин-OH вместо Fmoc-D-аланин-OH. Количества реагентов подбирали соответствующим образом, чтобы получить такие же соотношения, которые использовали в 11a-11d.
Выход: 7,3 мг.
МС: m/z 1283,9=[M+4H]4+ (вычисленная ММ=5131,9).
Пример 14
Синтез ликсисенатид-линкер-гидрогеля 14
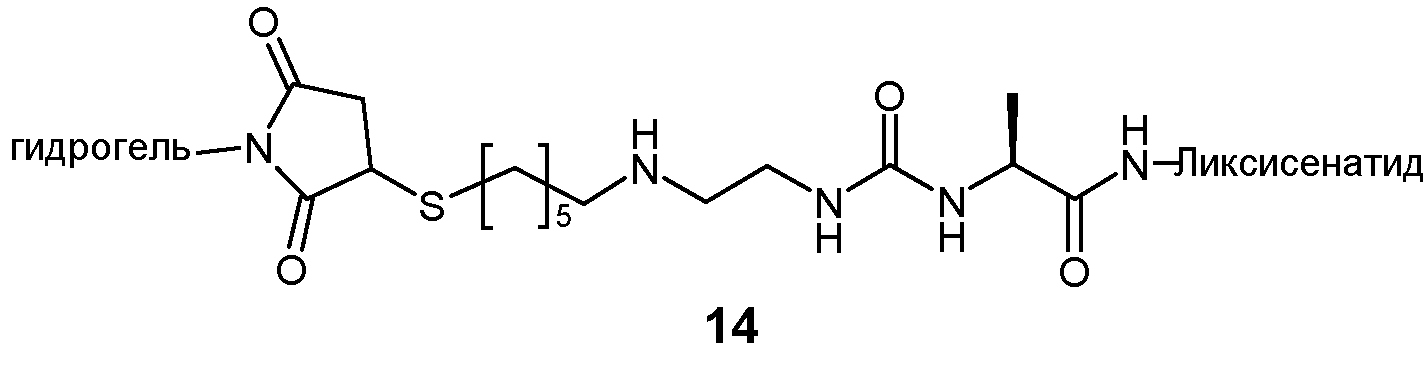
Ликсисенатид-линкер-гидрогель 14 синтезировали, как описано для эксендин-линкер-гидрогеля 8, за исключением использования ликсисенатид-линкер-тиола 13 вместо эксендин-линкер-тиола 6d.
Содержание ликсисенатида в ликсисенатид-линкер-гидрогеле определяли в соответствии с “Материалами и способами”. Было получено содержание ликсисенатида 34,5% (масс.).
Синтез реагента GLP-1-линкер 15
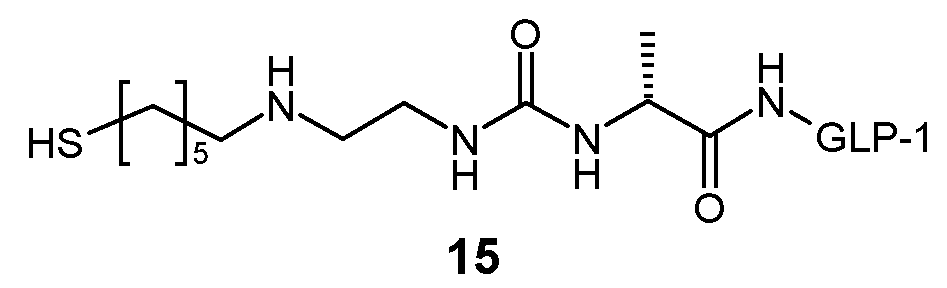
Реагент GLP-1-линкер 15 синтезировали, как описано для реагента ликсисенатид-линкер 11a-11d, за исключением того, что начинали с GLP-1 с полностью защищенными боковыми цепями на смоле со свободным N-концом (258 мг, 30 мкмоль) вместо эксендина на смоле. Количества реагентов подбирали соответствующим образом, чтобы получить такие же соотношения, которые использовали в 11a-11d.
Выход: 5,0 мг.
МС: m/z 1191,4=[M+3H]3+ (вычисленная ММ=3571,1).
Пример 16
Синтез GLP-1-линкер-гидрогеля 16
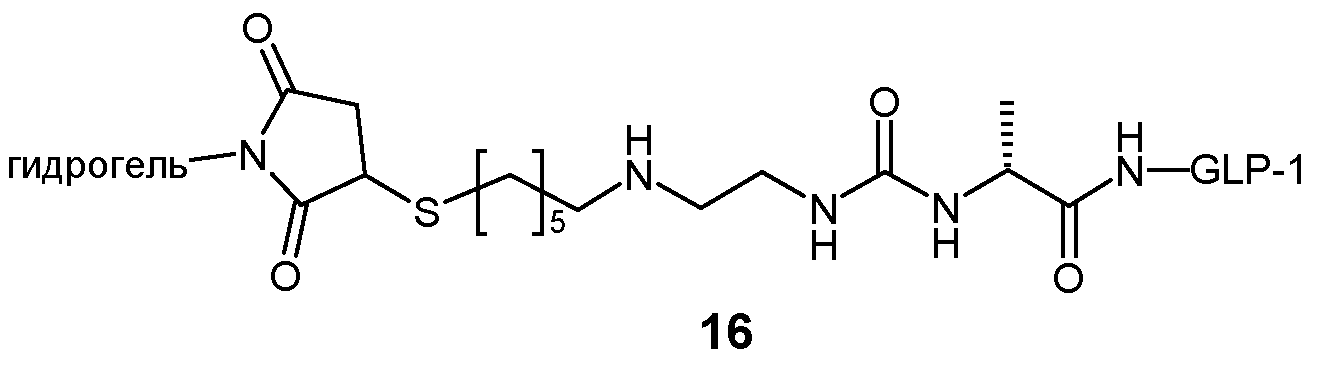
GLP-1-линкер-гидрогель 16 синтезировали, как описано для эксендин-линкер-гидрогеля 8, за исключением использования GLP-1-линкер-тиола 15 вместо эксендин-линкер-тиола 6d.
Содержание GLP-1 в GLP-1-линкер-гидрогеле определяли в соответствии с “Материалами и способами”. Было получено содержание GLP-1 26,3% (масс.).
Пример 17
Кинетика высвобождения in vitro
Половинное время высвобождения при pH 7,4, 37°C, эксендина от гидрогеля 10, ликсисенатида от гидрогелей 12 и 14, и GLP-1 от гидрогеля 16 определяли, как описано в примере 9. Кинетика высвобождения соединений 8, 10, 12, 14 и 16 представлена на фиг.1.
|
Пример 18
Синтез линкерного реагента 18e
Линкерный реагент 18e синтезировали по следующей схеме:
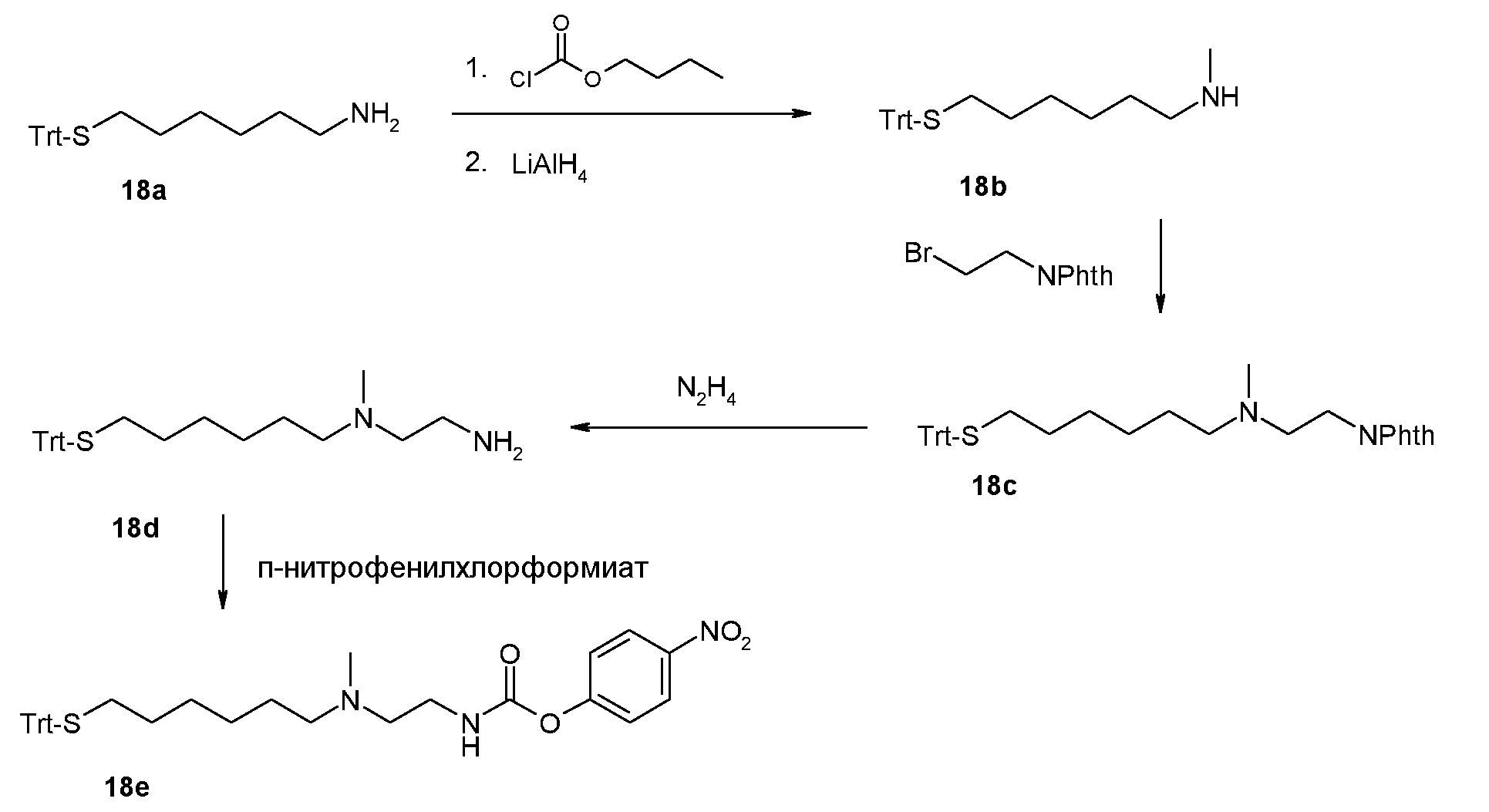
Синтез промежуточного соединения 18b для линкерного реагента проводили в атмосфере азота. Раствор амина 18a (1,69 г, 4,5 ммоль, для получения, см. WO-A 2009/133137) в 30 мл ТГФ (сухой, молекулярные сита) охлаждали до 0°C. Добавляли бутилхлорформиат (630 мкл, 4,95 ммоль) в 3 мл ТГФ (сухой, молекулярные сита) и DIPEA (980 мкл, 5,63 ммоль). Смесь перемешивали в течение 10 мин при 0°C, охлаждение прекращали и смесь перемешивали в течение дополнительных 20 мин при к.т. Добавляли 1M LiAlH4 в ТГФ (9 мл, 9 ммоль) и смесь кипятили с обратным холодильником в течение 1,5 ч. Реакцию гасили медленным добавлением метанола (11 мл) и 100 мл насыщенного раствора тартрата Na/K. Смесь экстрагировали этилацетатом, органический слой сушили над Na2SO4 и растворитель выпаривали при пониженном давлении. Неочищенный продукт 18b (1,97 г) использовали на следующей стадии без дальнейшей очистки.
МС: m/z 390,2=[M+H]+ (вычисленная ММ=389,6).
Раствор неочищенного продукта 18b (1,97 г), N-(бромэтил)фталимида (1,43 г, 5,63 ммоль) и K2CO3 (1,24 г, 9,0 ммоль) в 120 мл ацетонитрила кипятили с обратным холодильником в течение 6 ч. Добавляли 60 мл насыщенного раствора NaHCO3 и смесь экстрагировали 3× этилацетатом. Объединенные органические слои сушили (Na2SO4) и растворитель удаляли при пониженном давлении. Фталимид 18c очищали на диоксиде кремния с использованием гептана (содержащего 0,02% NEt3) и уменьшающегося количества этилацетата (содержащего 0,02% NEt3) в качестве элюентов.
Выход: 0,82 г (1,46 ммоль).
МС: m/z 563,3=[M+H]+ (вычисленная ММ=562,8).
Фталимид 18c (819 мг 1,46 ммоль) растворяли в 35 мл этанола и добавляли гидрат гидразина (176 мкл, 3,64 ммоль). Смесь кипятили с обратным холодильником в течение 3 ч. Осадок отфильтровывали. Растворитель удаляли при пониженном давлении и осадок обрабатывали 15 мл дихлорметана. Осадок отфильтровывали и дихлорметан удаляли при пониженном давлении. Осадок очищали ОФ-ВЭЖХ. Объединенные фракции ВЭЖХ доводили до pH 7 добавлением NaHCO3 и экстрагировали несколько раз дихлорметаном. Объединенные органические слои разбавляли (Na2SO4) и растворитель удаляли при пониженном давлении, с получением амина 18d.
Выход: 579 мг (1,34 ммоль).
МС: m/z 433,3=[M+H]+ (вычисленная ММ=432,7).
Паранитрофенилхлорформиат (483 мг, 2,40 ммоль) растворяли в 10 мл дихлорметана (сухой, молекулярные сита). Добавляли раствор амина 18d (1,00 г, 2,31 ммоль) в 5 мл дихлорметана (сухой, молекулярные сита) и 1,8 мл сим-коллидина и смесь перемешивали при комнатной температуре в течение 40 мин. Дихлорметан удаляли при пониженном давлении, осадок подкисляли уксусной кислотой и очищали ОФ-ВЭЖХ, с получением паранитрофенилкарбамата 18e.
Выход: 339 мг (0,57 ммоль).
МС: m/z 598,3=[M+H]+ (вычисленная ММ=597,8).
Синтез реагента GLP-1-линкер 19
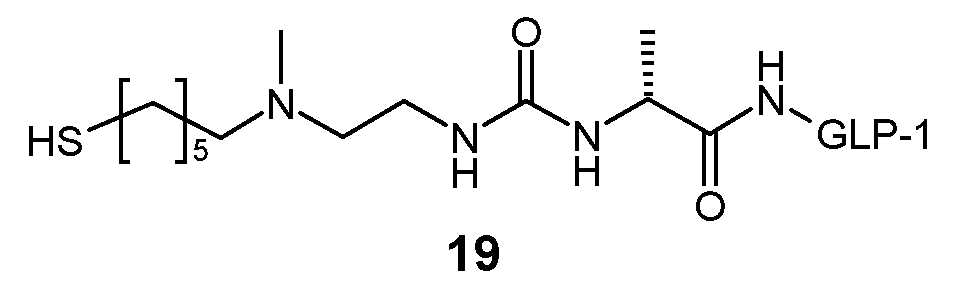
Реагент GLP-1-линкер 19 синтезировали, как описано для реагента GLP-1-линкер 15, за исключением использования линкерного реагента 18e вместо линкерного реагента 5c, начиная с GLP-1 с полностью защищенными боковыми цепями со свободным N-концом (150 мг, 16,5 мкмоль). Количество регентов подбирали соответствующим образом, для получения таких же соотношений, которые использовали в 11a-11d.
Выход 1,33 мг.
МС: m/z 1196,0=[M+3H]3+ (вычисленная ММ=3585,1).
Пример 20
Синтез GLP-1-линкер-гидрогеля 20
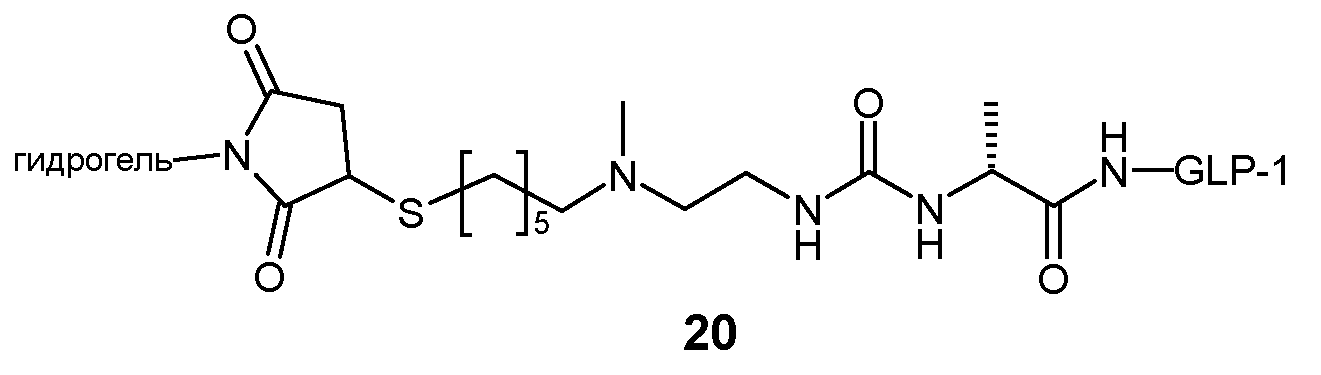
GLP-1-линкер-гидрогель 20 синтезировали, как описано для эксендин-линкер-гидрогеля 8, за исключением использования GLP-1-линкер-тиола 19 вместо эксендин-линкер-тиола 6d.
|
|