Результат интеллектуальной деятельности: МЕДИЦИНСКИЕ УСТРОЙСТВА ДЛЯ ДОСТАВКИ КИРНК
Вид РИД
Изобретение
Перекрестная ссылка на родственные заявки
Для данной заявки испрашивается приоритет по предшествующей предварительной заявке на патент США, серийный номер 61/328,723, зарегистрированной 28 апреля 2010 г. и предварительной заявке на патент США, серийный номер 61/416,057, зарегистрированной 22 ноября 2010 г., содержание которых полностью включено в настоящий документ в качестве ссылки.
Многие факторы влияют на экспрессию генов в организмах. Например, оказалось, что небольшие молекулы РНК, в основном от 20 до 25 нуклеотидов в длину, являются важными регуляторами экспрессия эукариотных генов. Одним из классов малых РНК являются короткие интерферирующие РНК (киРНК). киРНК играют важную роль в пути РНК-интерференции и особенно в РНК-сайленсинге, процессе специфичной к последовательности деградации РНК, которая запускается двухцепочечной РНК (дцРНК). киРНК являются двухцепочечными с небольшими 3'-выступающими липкими концами и происходят от более длинных дцРНК прекурсоров, которые вызывают сайленсинг. Они служат указателями для направления деструкции РНК-мишени, и подразумевается, что они являются праймерами в реакции амплификации дцРНК за счет активности клеточной РКН-зависимой РКН-полимеразы.
С момента их открытия создавали синтетические аналоги киРНК, которые могут вызывать РНК-интерференцию в клетках млекопитающих посредством сайленсинга или иного подавления транскрипции множественных генов. Однако, несмотря на многообещающие результаты, проблемы существуют до сих пор в отношении успешного использования технологии киРНК, среди которых способы доставки играют важную роль. Обычно киРНК доставляют либо прямой инъекцией, электропорацией, либо путем комплексообразования с трансфектирующим средством. Однако киРНК остается активно присутствующим в течение только нескольких часов после доставки. Чтобы добиться более длительной эффективности, следует находить улучшенные способы доставки, которые могут обеспечивать стабильную, долгосрочную доставку киРНК.
Устройства трансдермальной доставки, которые обеспечивают путь для киРНК, доставляемых в активном состоянии при эффективной, стабильной концентрации в течение некоторого периода времени, были бы чрезвычайно полезны. Для достижения этой цели необходимо преодолеть массу трудностей. Например, в организме человека выработалось множество систем для предотвращения поступления посторонних веществ, таких как ферментативное расщепление в желудочно-кишечном тракте, структурные компоненты, которые препятствуют всасыванию через эпителий, печеночный клиренс и иммунный ответ и реакция на инородное тело.
Разработаны трансдермальные устройства для длительной доставки некоторых лекарственных средств, включая средства для лечения вертиго, контрацепции и никотинозависимости. Чтобы трансдермальное устройство было успешным, оно должно доставлять препарат через эпидермис, что связано с первичной функцией вывода посторонних веществ. Внешний слой эпидермиса, роговой слой, обладает структурной прочностью, обеспечиваемой наложением рогоцитов и перекрестно-сшитых волокон кератина, удерживаемых вместе корнеодесмосомами и внедренных в липидную матрицу, которые все вместе обеспечивают превосходную барьерную функцию. Под роговым слоем находится зернистый слой, в пределах которого между кератоцитами сформированы плотные контакты. Плотные контакты представляют собой барьерные структуры, которые включают сеть трансмембранных белков, окруженных примыкающими плазменными мембранами (например, клаудины, окклюдины и молекулы адгезивного контакта), а также многочисленных белков, образующих бляшки (например, ZO-1, ZO-2, ZO-3, цингулин, симплекин). Плотные контакты обнаружены во внутреннем эпителии (например, кишечный эпителий, гематоэнцефалический барьер), а также в зернистом слое кожи. Под роговым слоем и зернистым слоем расположен средний слой кожи stratum spinosum. Средний слой кожи включает клетки Лангерганса, которые представляют собой дендритные клетки, которые могут стать полностью функциональными представляющим ангтиген клетками и могут устанавливать иммунный ответ и/или реакцию на инородное тело на поступающий препарат.
К сожалению, способы трансдермальной доставки в настоящее время ограничены препаратами с низкой молекулярной массой, которые обладают умеренной липофильностью и не имеют заряда. Даже при успешно преодолении естественного ограничения, все еще существует проблема в отношении поддержания уровня активности доставляемых препаратов и устранения их реакции на инородное тело и иммунного ответа.
Этот способ доставки улучшен за счет вспомогательных способов для облегчения трансдермальной доставки активных препаратов. Например, обнаружено, что устройства с микроиглами пригодны для транспортировки вещества в или через кожу. В основном, устройство с микроиглами содержит массив игл, которые могут проникать через роговой слой кожи и достигать лежащего ниже слоя. Примеры устройств с микроиглами описаны в патенте США №6,334,856, Allen, et al., и патенте США №7,226,439, Prausnitz, et al., которые включены в настоящий документ в качестве ссылки.
Несмотря на описанный выше прогресс в этой области, существует дальнейшая возможность для усовершенствования.
По одному варианту осуществления настоящего изобретения предлагается устройство для доставки конструкции киРНК через дермальный барьер. Устройство содержит микроиглу и множество наноструктур, изготовленных на поверхности микроиглы, наноструктуры образуют заранее определенный узор. Конструкция киРНК сообщается по потоку текучей среды с микроиглой.
По другому варианту осуществления настоящего изобретения предлагается способ доставки конструкции киРНК через дермальный барьер. Способ включает проникновение через роговой слой микроиглы. Микроигла содержит множество наноструктур, сформированных на поверхности микроиглы и скомпонованных в виде узора. Конструкция киРНК сообщается по потоку текучей среды с микроиглой, конструкция киРНК транспортируется через роговой слой после проникновения в роговой слой микроиглы.
По другим вариантам осуществления настоящего изобретения предлагается способ формирования устройства для доставки конструкции киРНК через дермальный барьер. Способ включает изготовление массива микроигл; изготовление узора из наноструктур на поверхности по меньшей мере одной из микроигл; и подсоединение конструкции киРНК к микроиглам, чтобы конструкция киРНК сообщалась по потоку текучей среды с микроиглами.
Краткое описание чертежей
Полное и всесторонне описание сущности изобретения, включая его предпочтительный режим, предназначенное для специалистов в этой области, изложено более подробно далее в описании со ссылкой на приложенные чертежи, на которых:
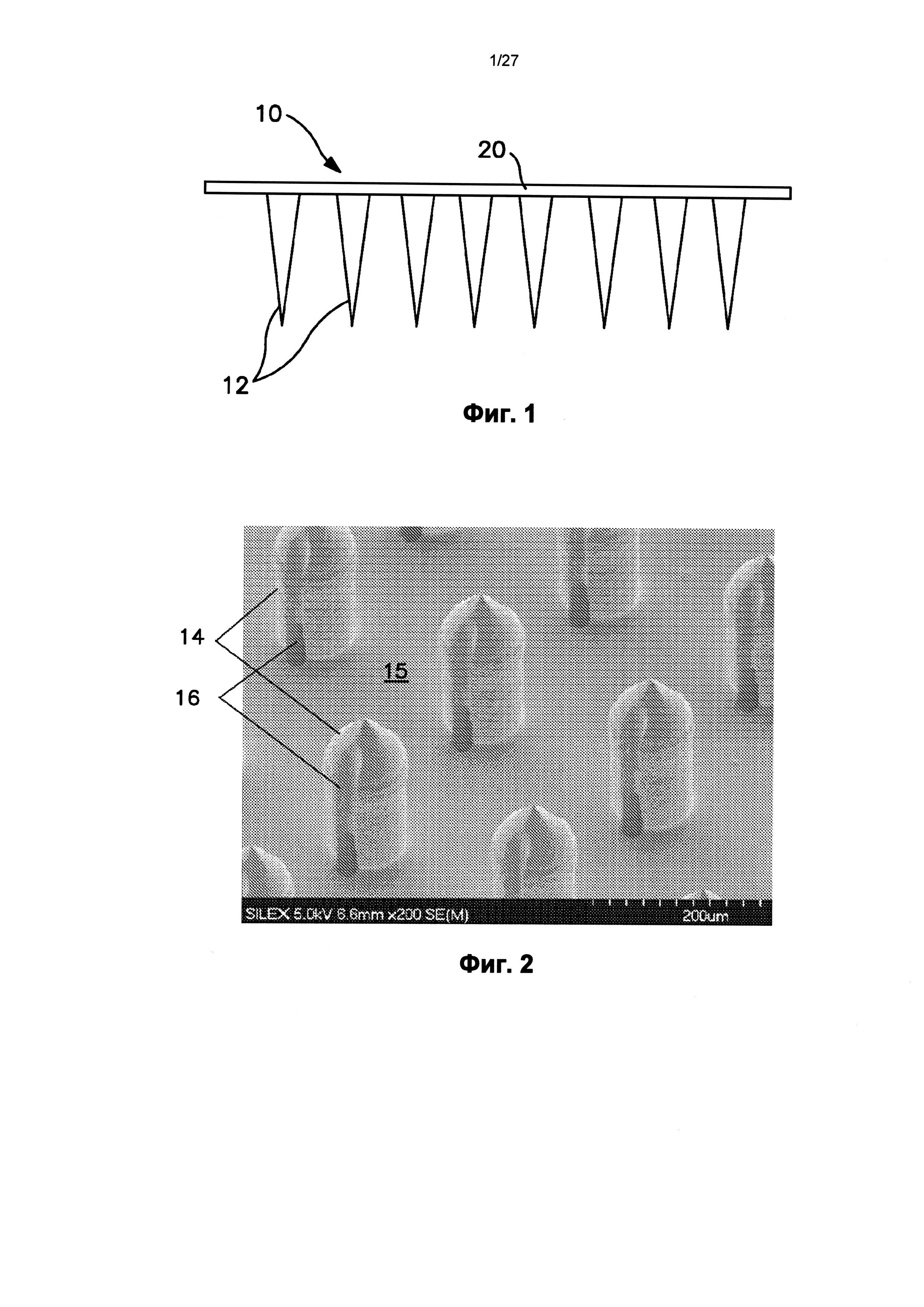
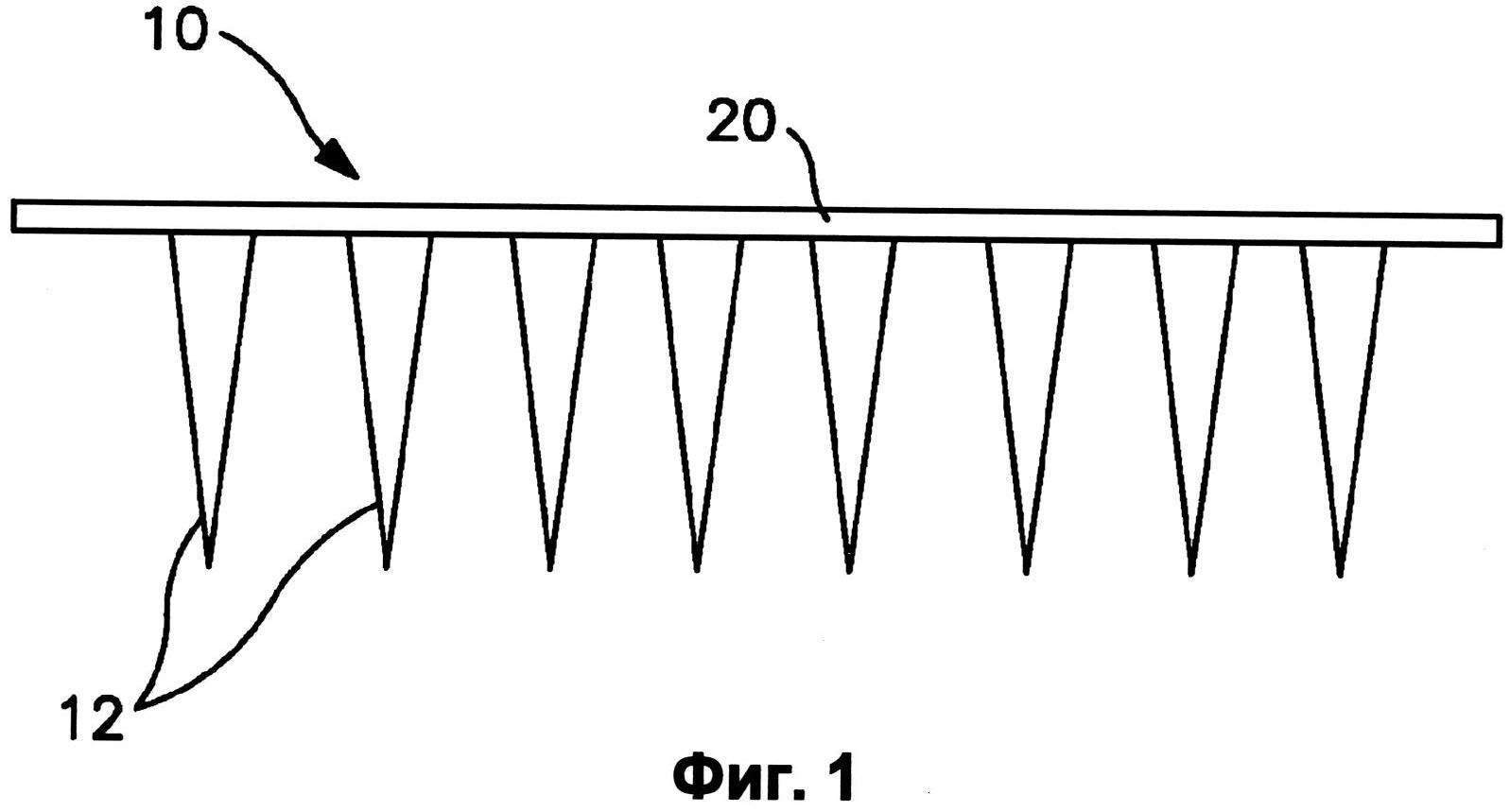
На фиг.1 показан один вариант осуществления устройства с микроиглами.
На фиг.2 показан другой вариант осуществления устройства с микроиглами.
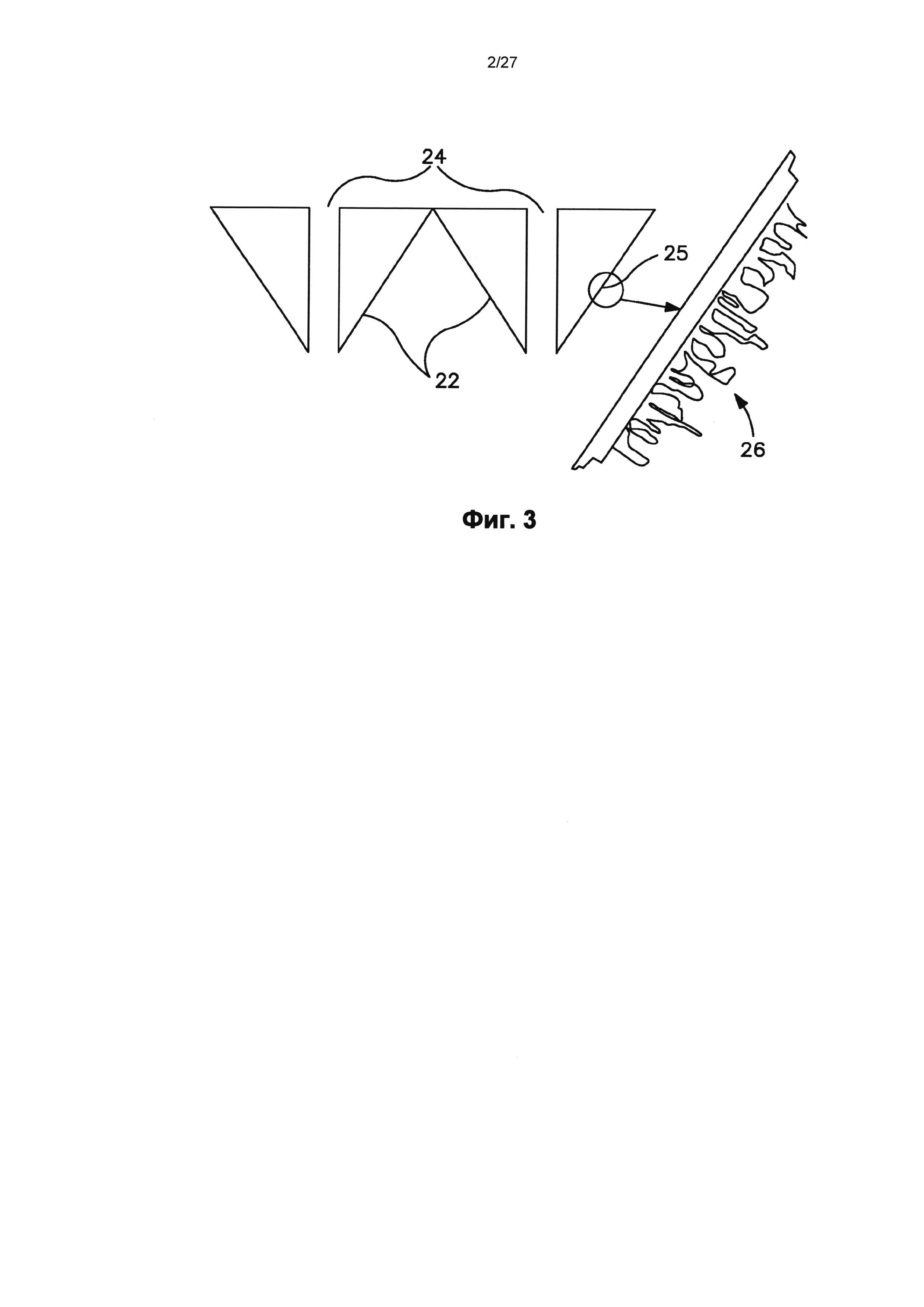
На фиг.3 показан один вариант осуществления микроиглы, содержащей поверхность, образующую нанотопографию, которая может взаимодействовать с внеклеточной матрицей (ЕСМ).
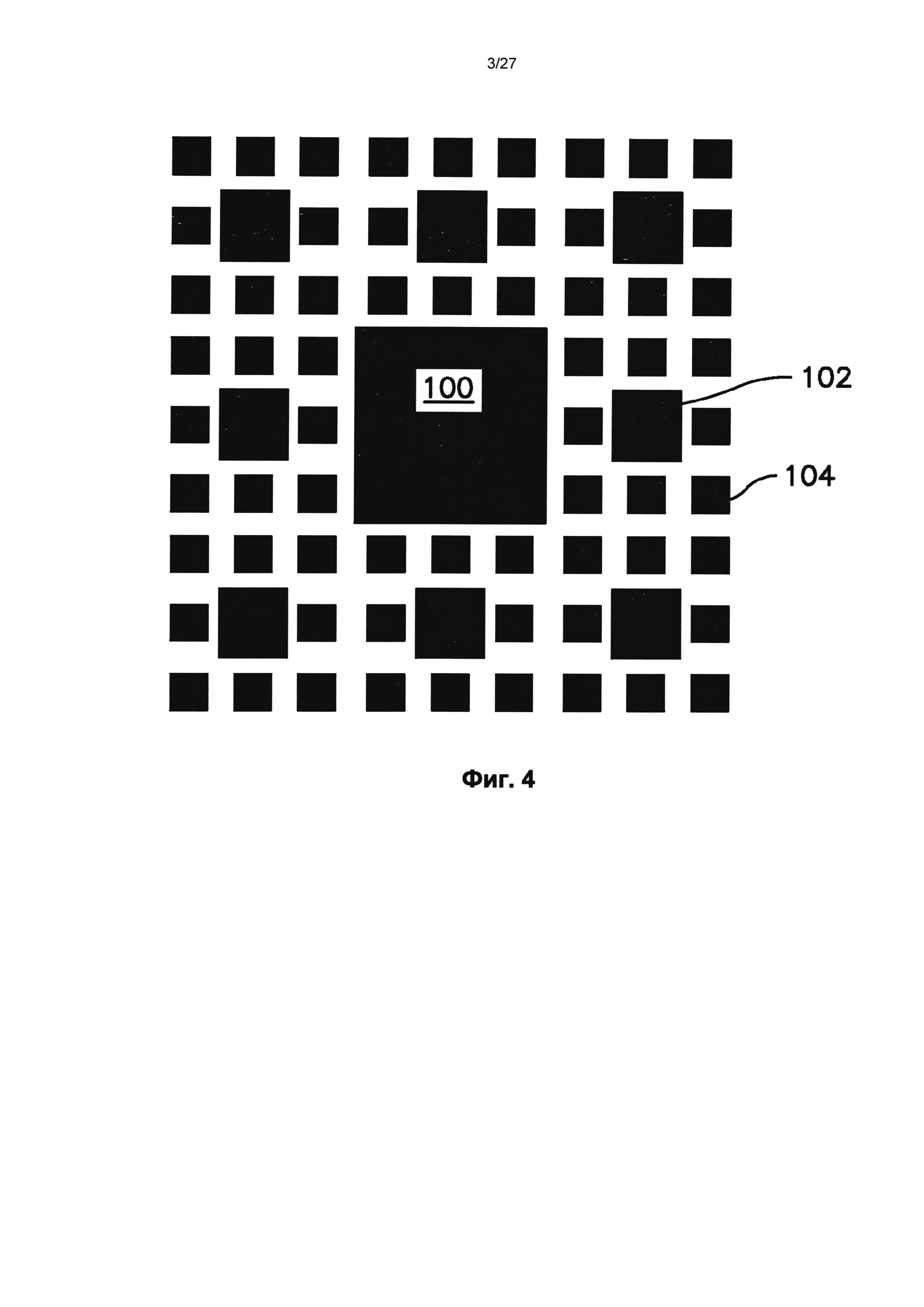
На фиг.4 показан один вариант осуществления сложного узора, который может быть сформирован на поверхности микроиглы.
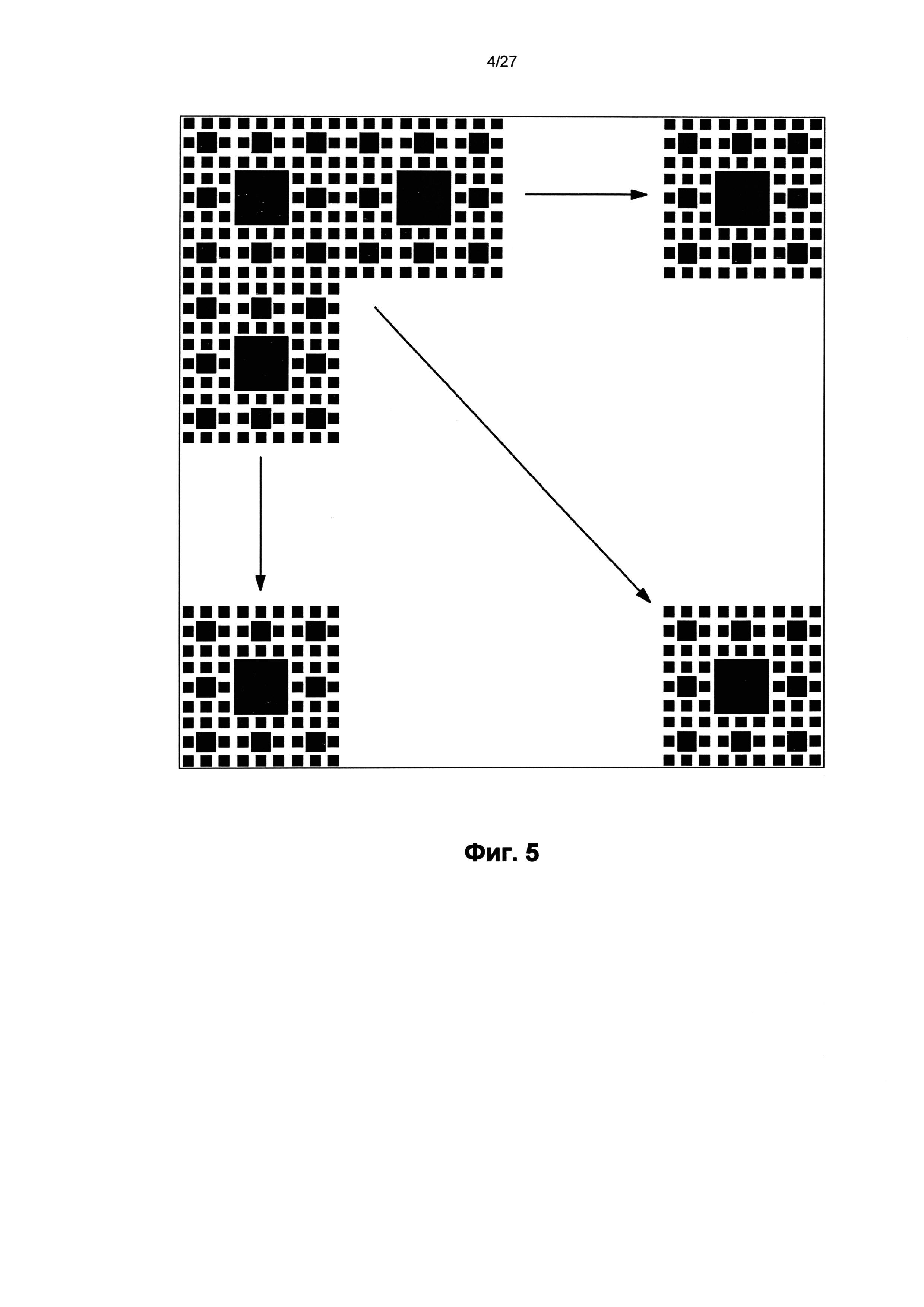
На фиг.5 показан узор, включающий несколько повторений сложного узора по фиг.4.
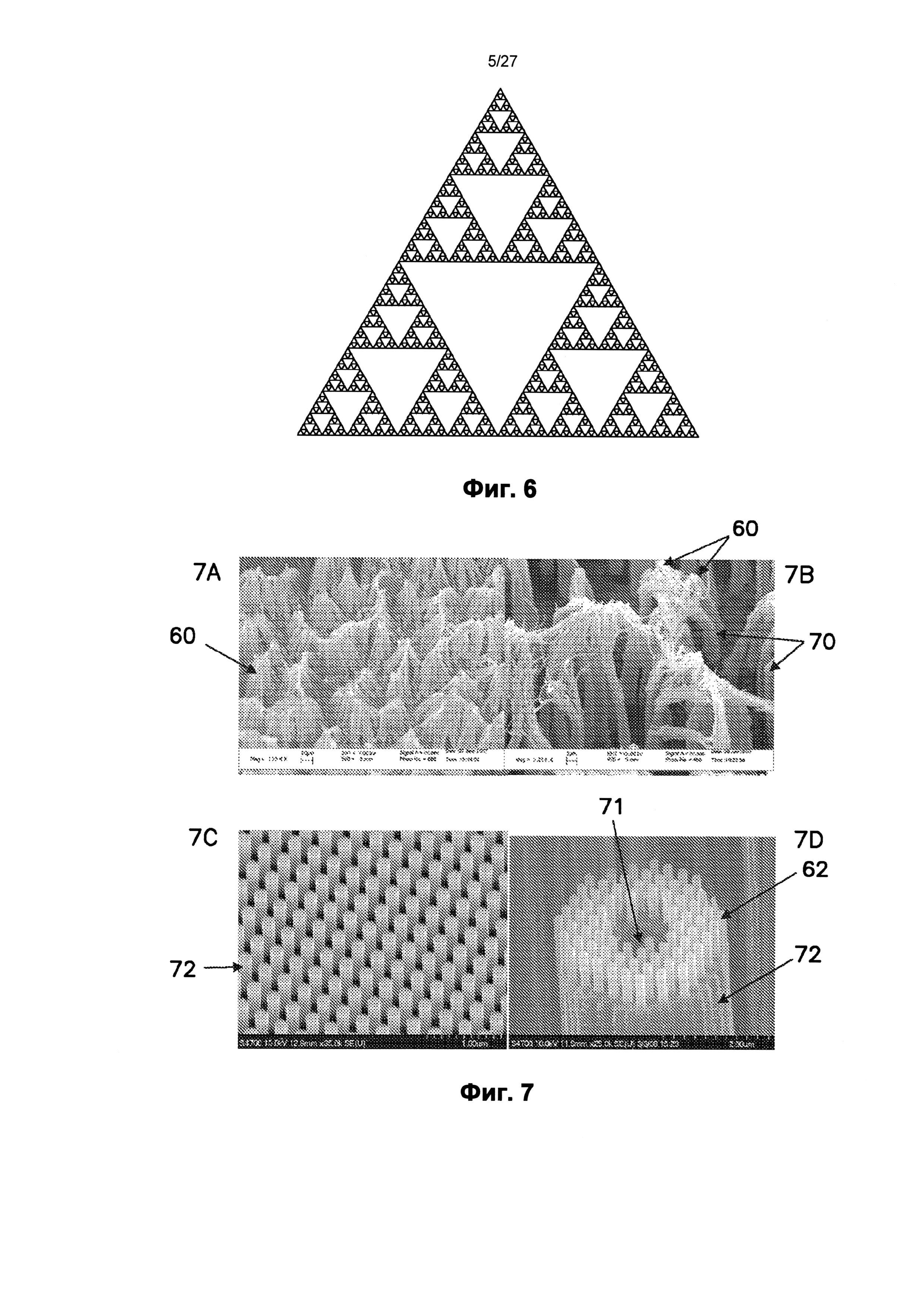
На фиг.6 показан треугольный фрактал Серпинского.
На фиг.7A-7D показаны нанотопография со сложным фракталом и фракталоподобная нанотопография.
На фиг.8 показан другой сложный узор, который может быть сформирован на поверхности микроиглы.
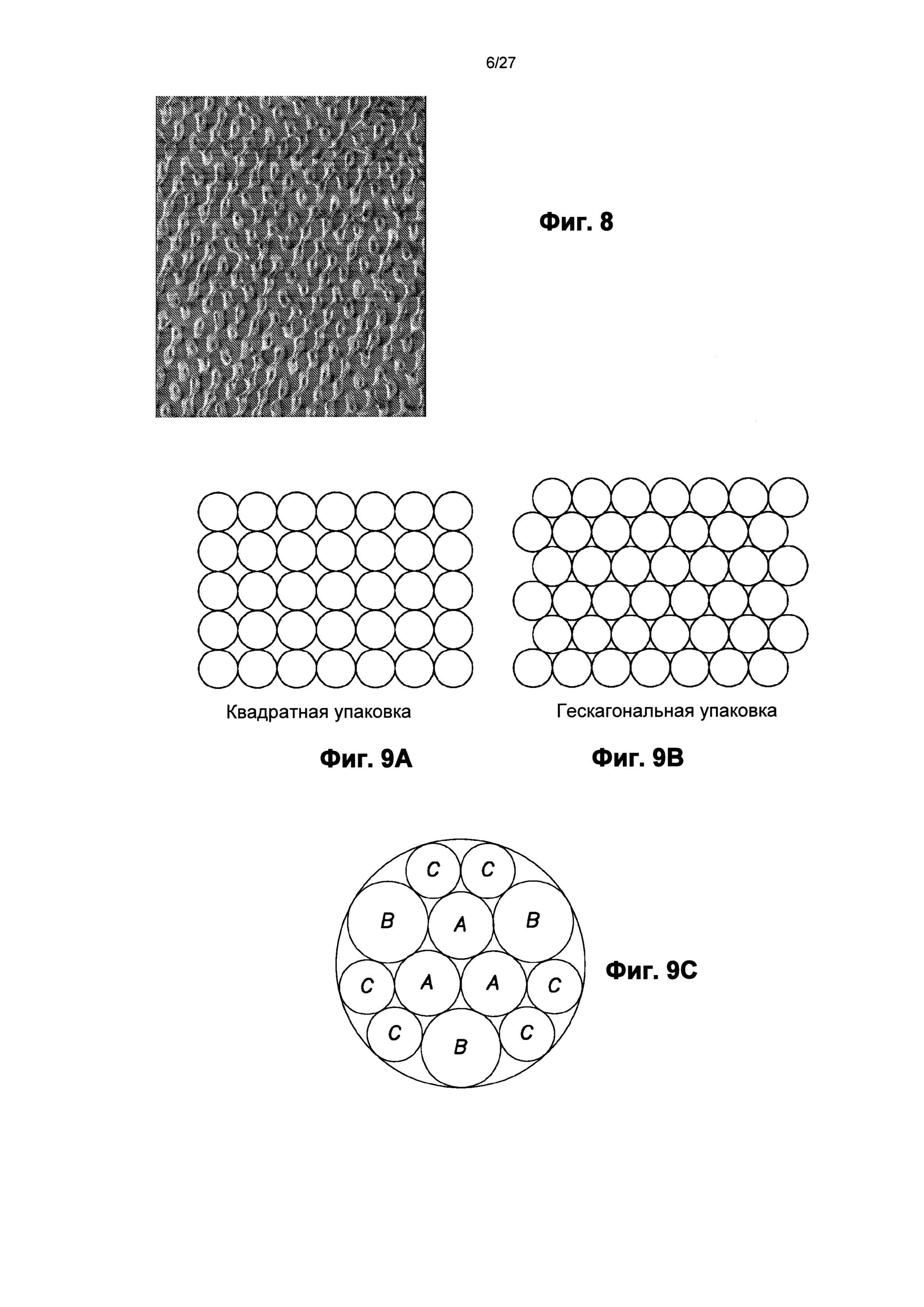
На фиг.9 показан пример плотности размещения, которое может быть использовано для структур наноразмера, описанных в настоящем документе и содержащих узор с квадратной упаковкой (фиг.9А), узор с гексагональной упаковкой (фиг.9B) и узор с круговой упаковкой (фиг.9С).
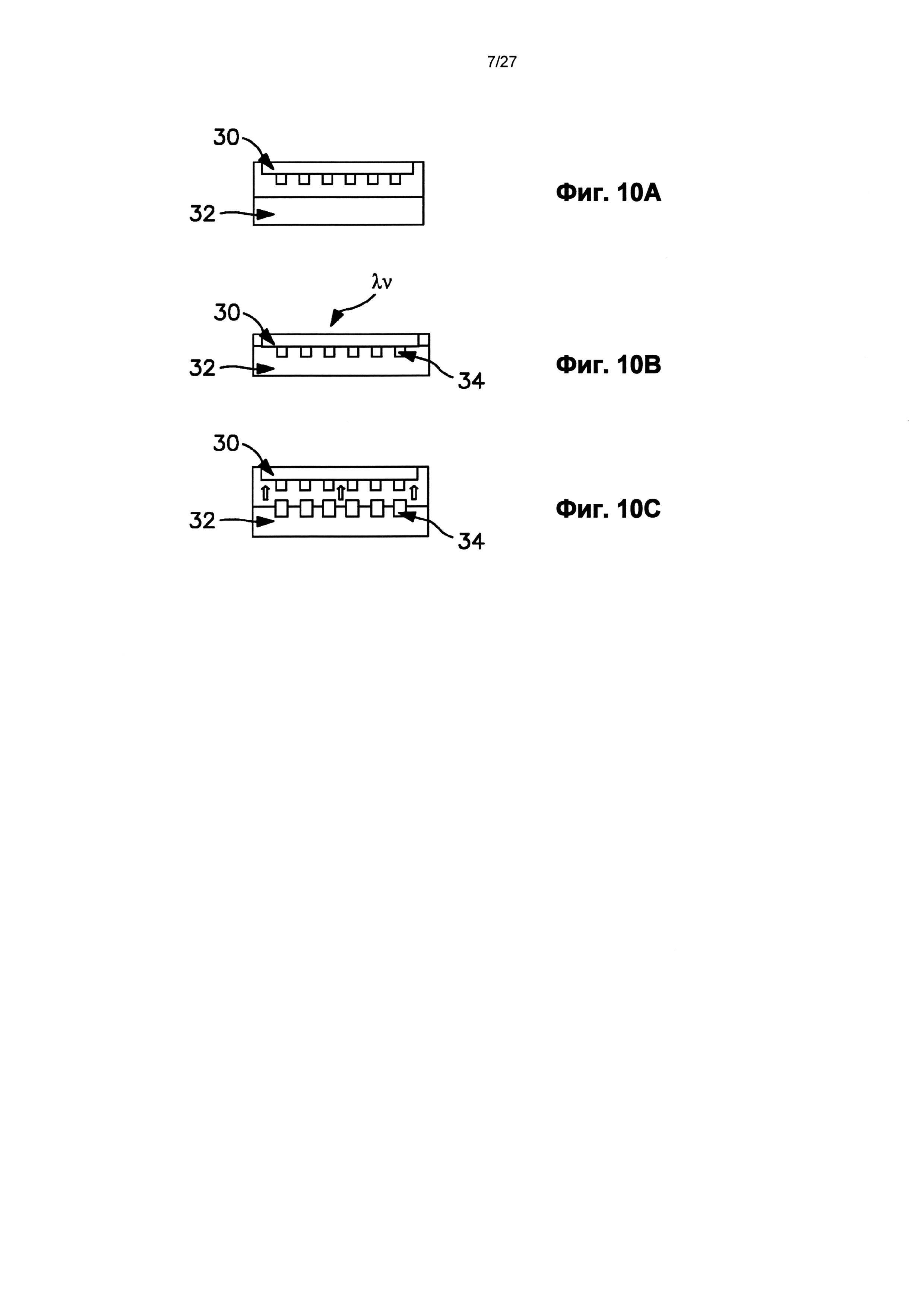
На фиг.10А-10C схематично показан способ нанесения нанорельефа давлением, который может быть использован в одном варианте осуществления при формировании устройства.
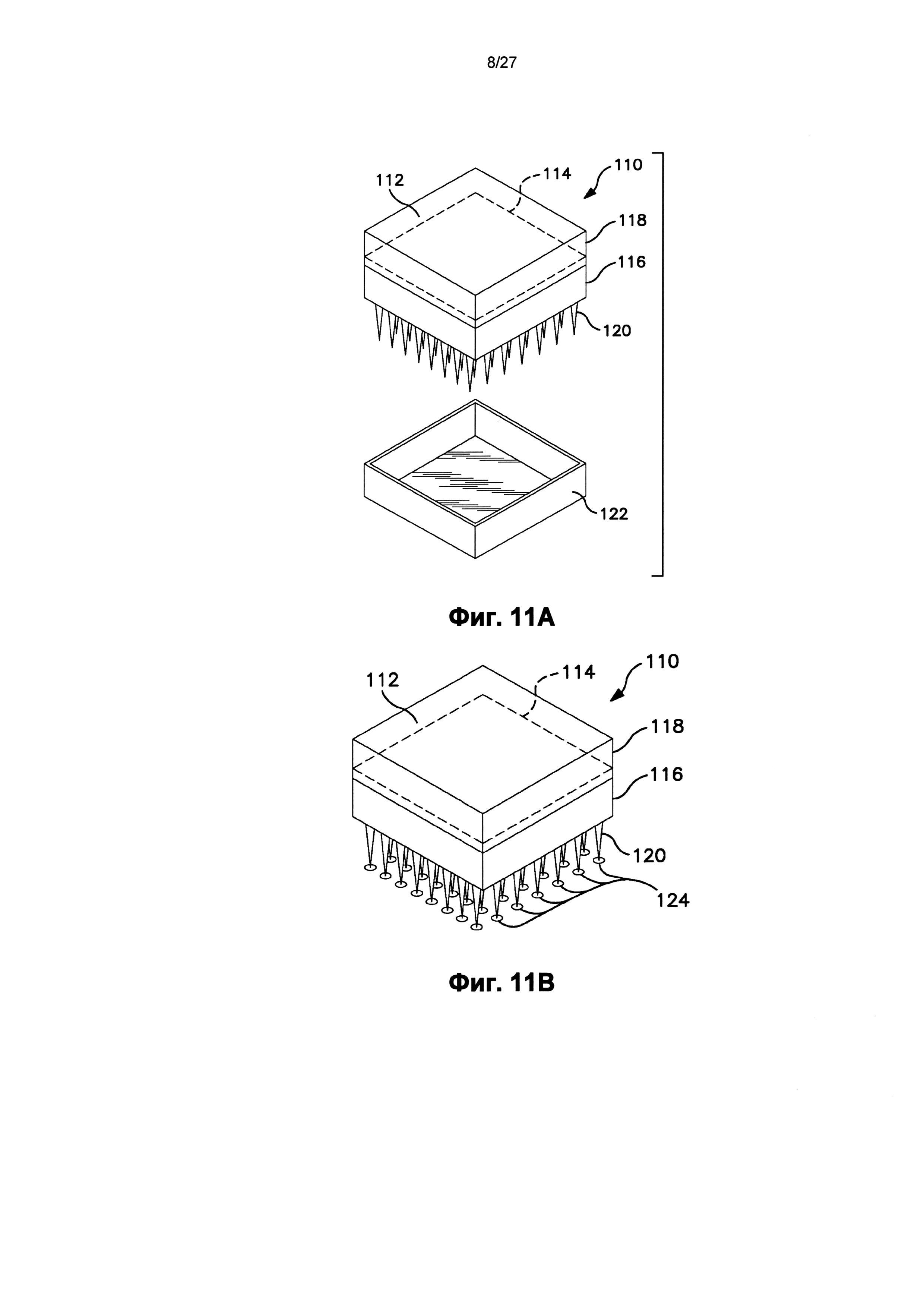
На фиг.11 схематично показан один вариант осуществления устройства.
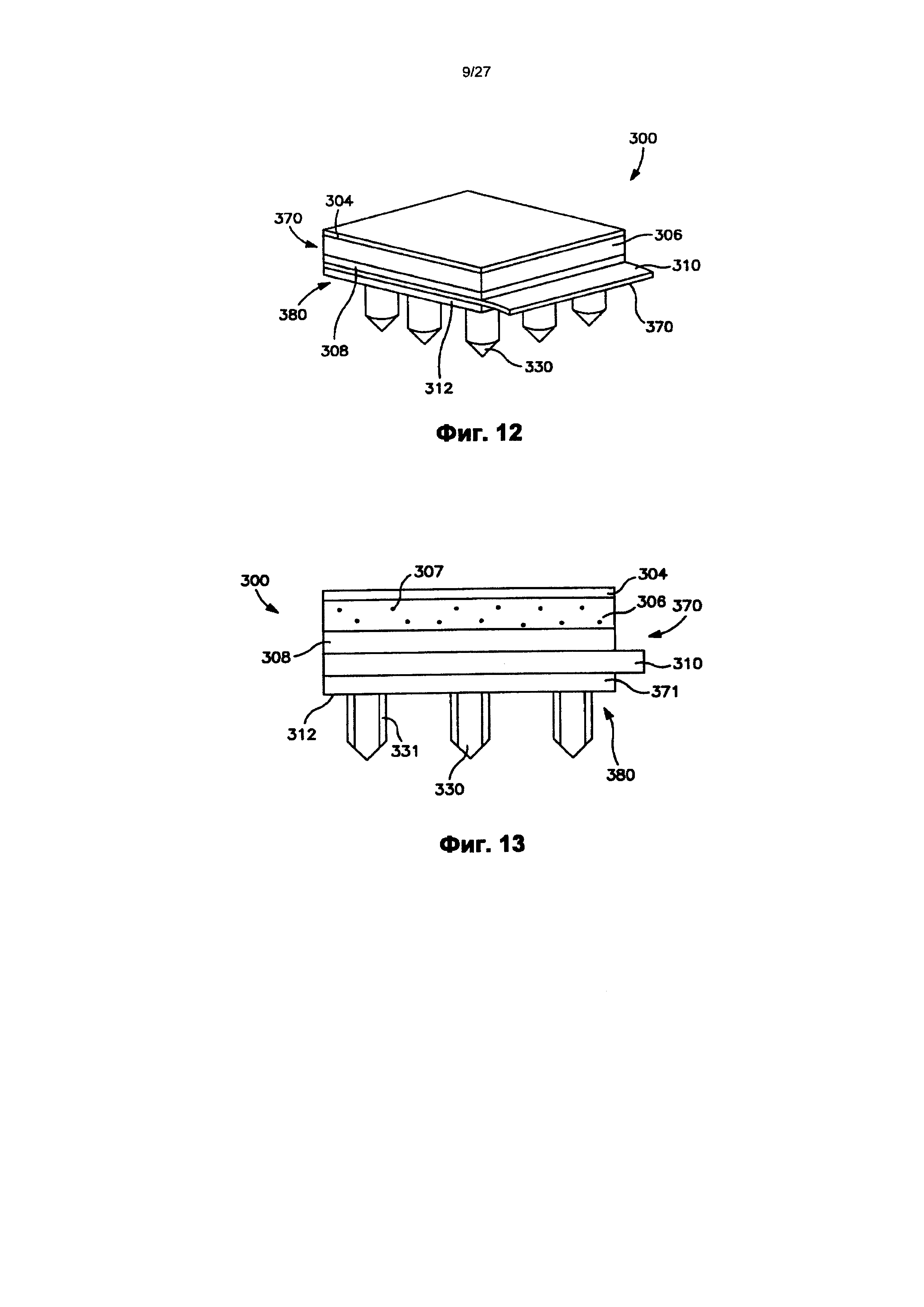
На фиг.12 показан вид в перспективе одного варианта осуществления трансдермального пластыря перед доставкой лекарственного соединения.
На фиг.13 показан вид спереди пластыря по фиг.12.
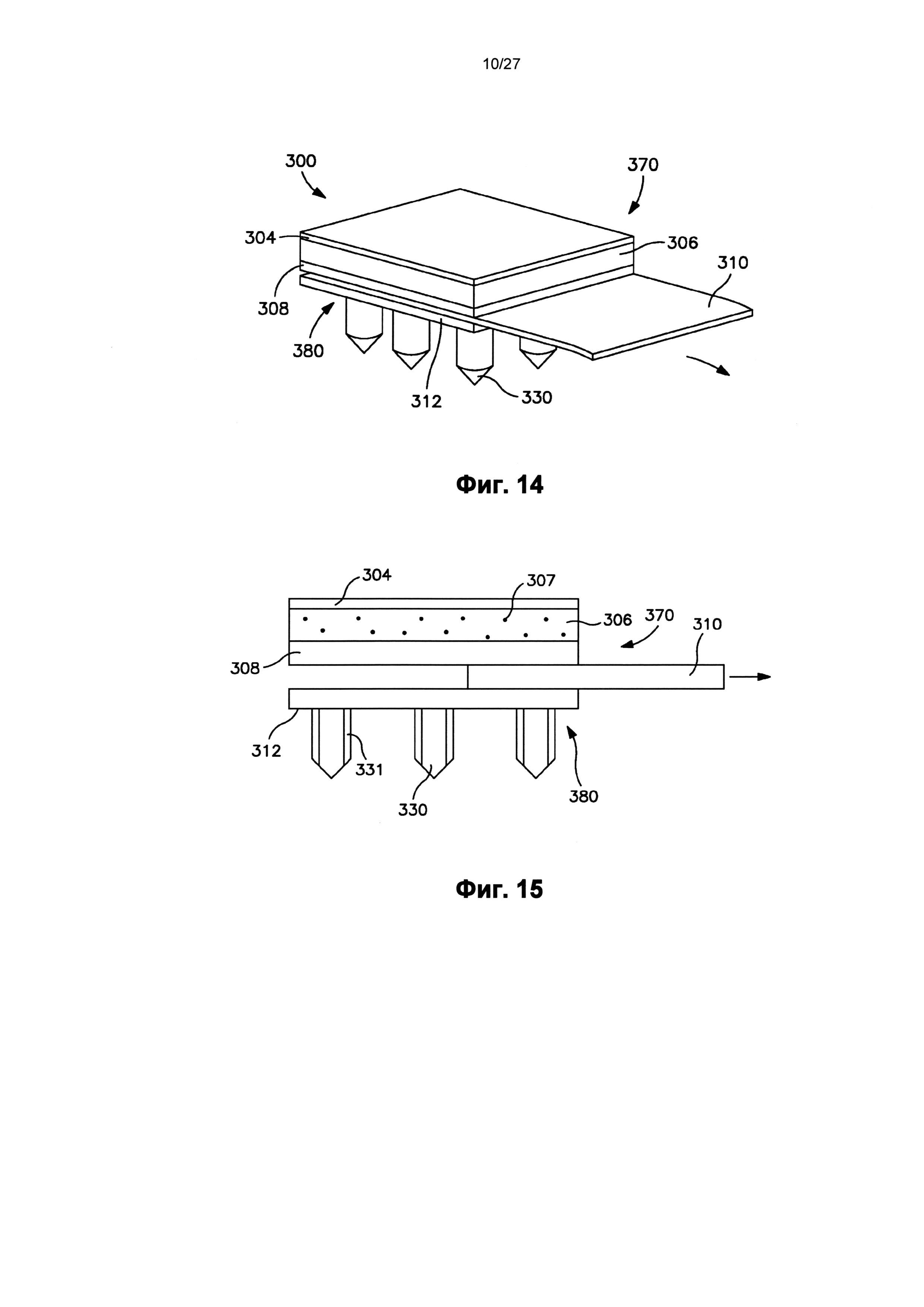
На фиг.14 показан вид в перспективе пластыря по фиг.12, в котором отсоединяемый элемент частично удален с пластыря.
На фиг.15 показан вид спереди пластыря по фиг.12.
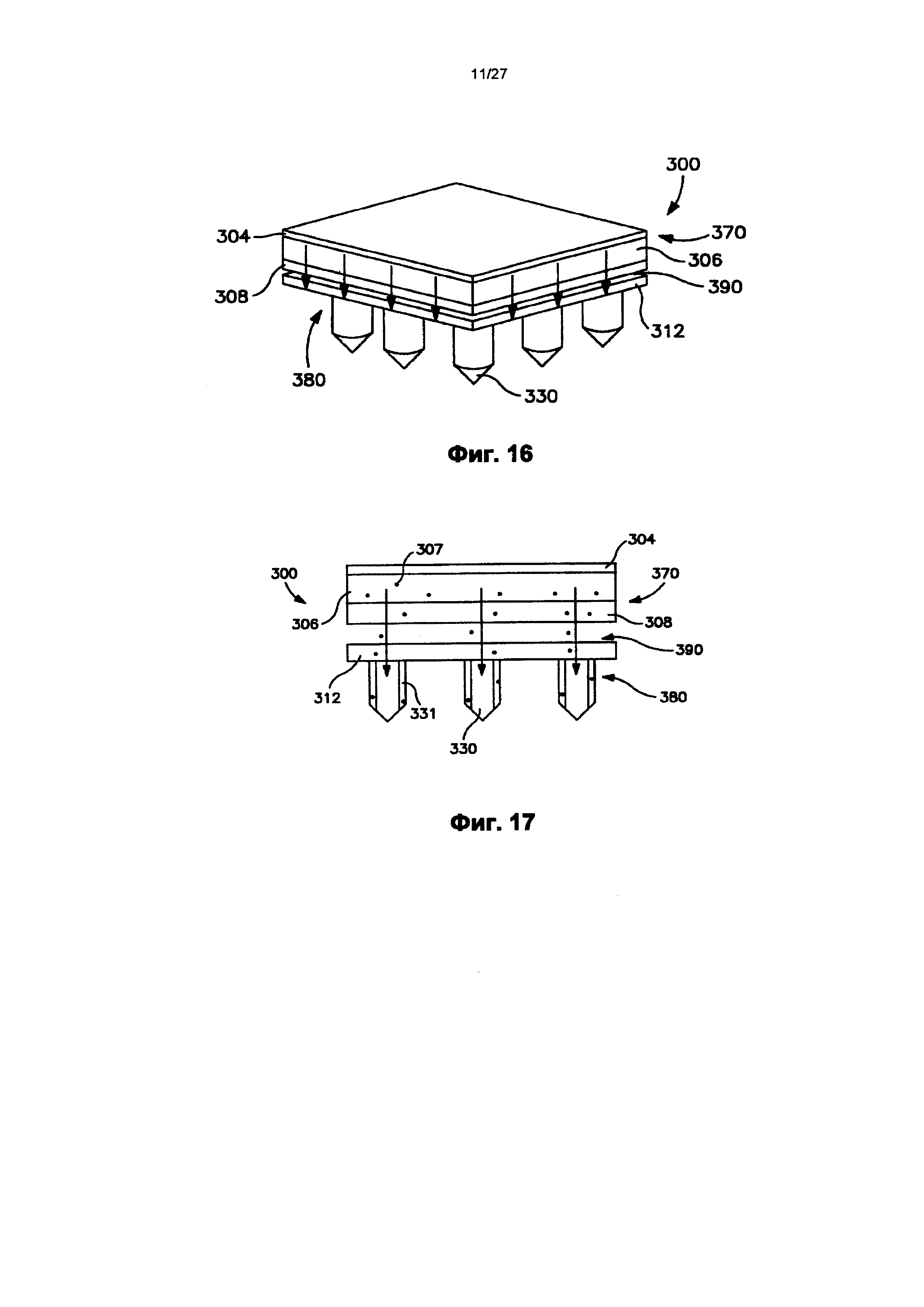
На фиг.16 показан вид в перспективе трансдермального пластыря по фиг.12 после удаления отсоединяемого элемента и во время использования.
На фиг.17 показан вид спереди пластыря по фиг.16.
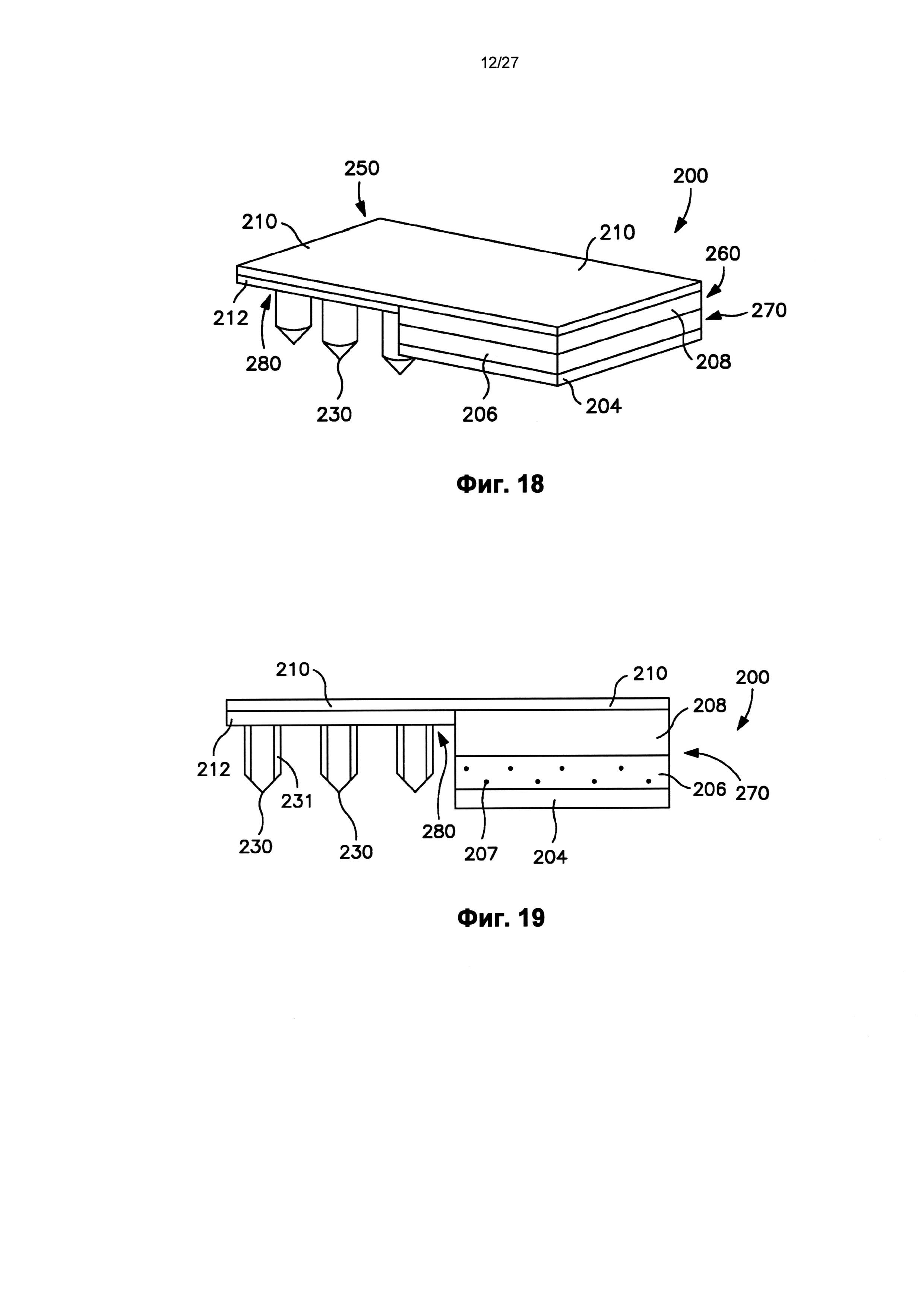
На фиг.18 показан вид в перспективе другого варианта осуществления трансдермального пластыря перед доставкой лекарственного соединения.
На фиг.19 показан вид спереди пластыря по фиг.18.
На фиг.20 показан вид в перспективе пластыря по фиг.19, в котором отсоединяемый элемент частично отодран от пластыря.
На фиг.21 показан вид спереди пластыря по фиг.20.
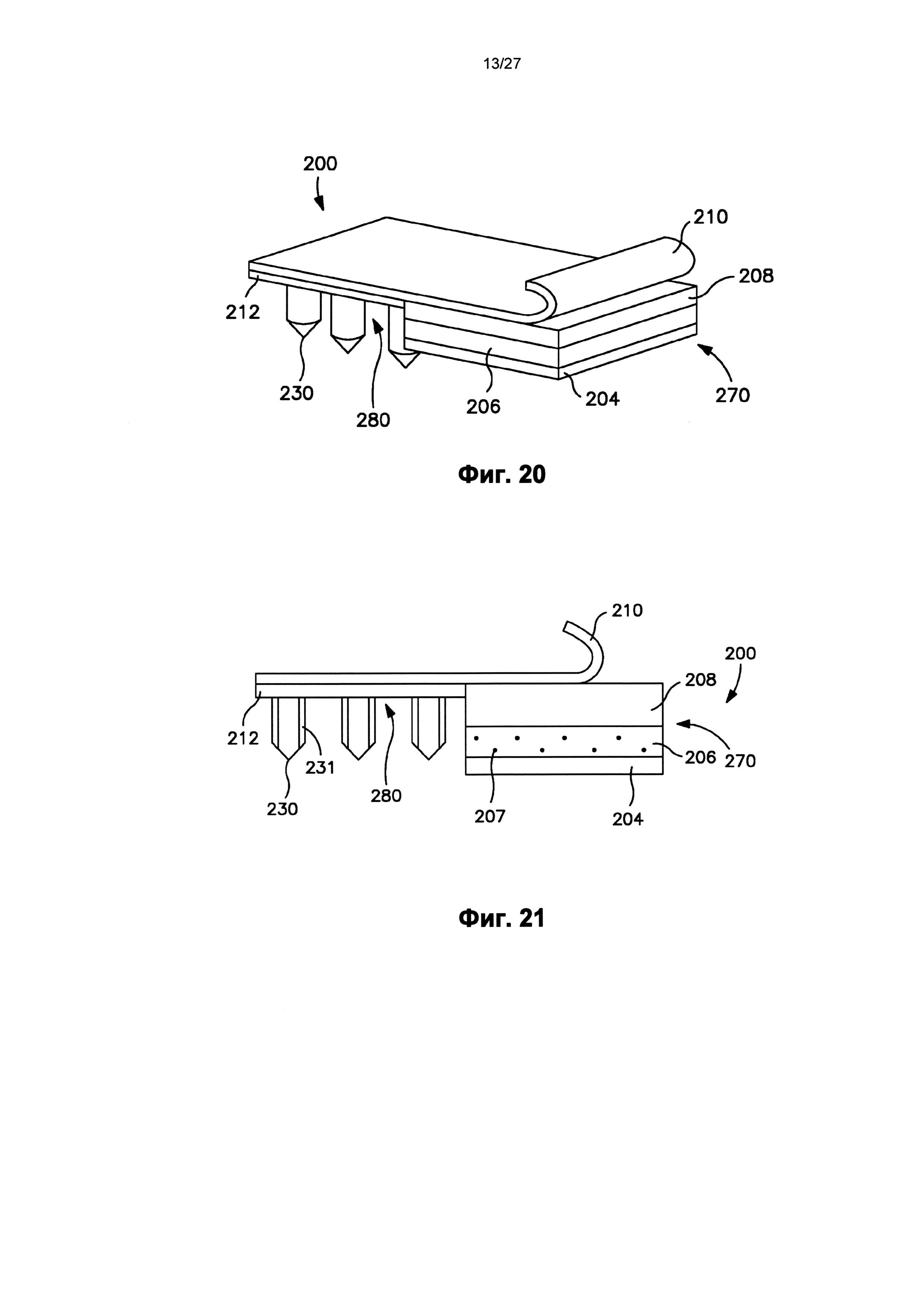
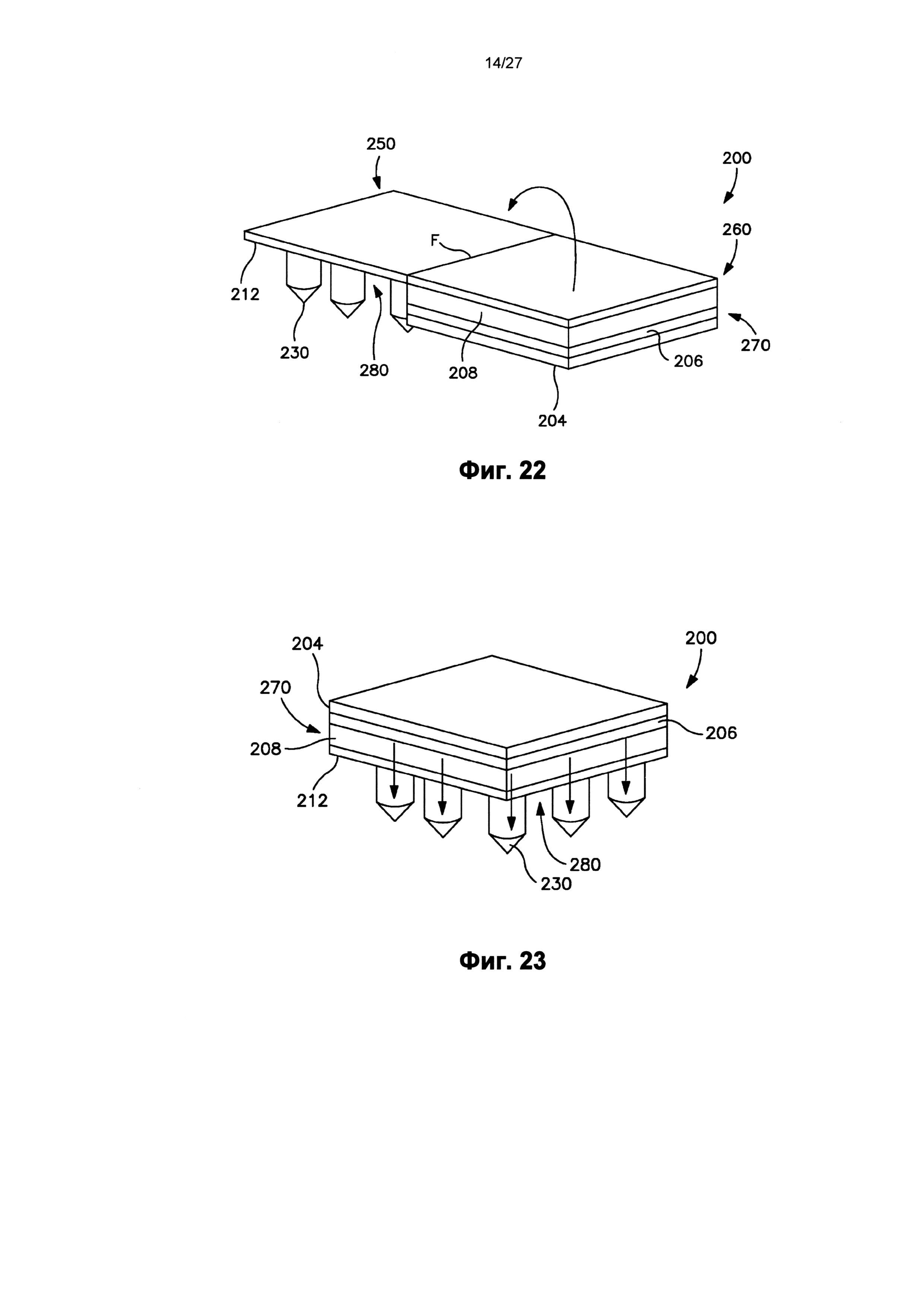
На фиг.22 показан вид в перспективе пластыря по фиг.18, в котором отсоединяемый элемент полностью отодран от пластыря.
На фиг.23 показан вид в перспективе трансдермального пластыря по фиг.18 после удаления отсоединяемого элемента и во время использования.
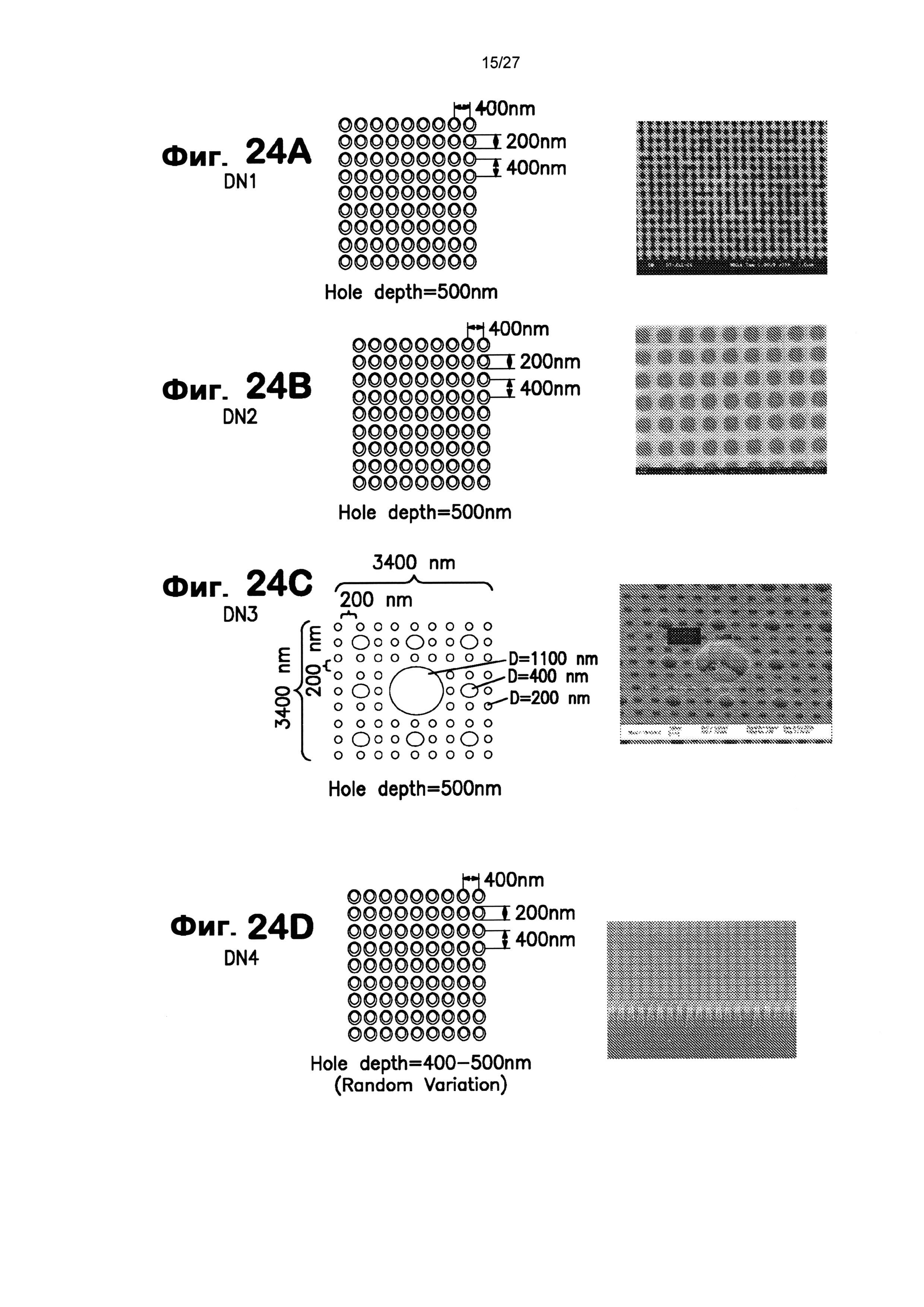
На фиг.24А-24Е показаны несколько узоров нанотопографии, описанных в настоящем документе.
На фиг.25 показано изображение сканирующего электронного микроскопа пленки, содержащей поверхность с наноузором.
На фиг.26А и 26В показаны два изображения сканирующего электронного микроскопа пленки, содержащей поверхность с другим наноузором.
На фиг.27 показано изображение сканирующего электронного микроскопа пленки, содержащей поверхность с другим наноузором.
На фиг.28 показано изображение сканирующего электронного микроскопа пленки, содержащей поверхность с другим наноузором.
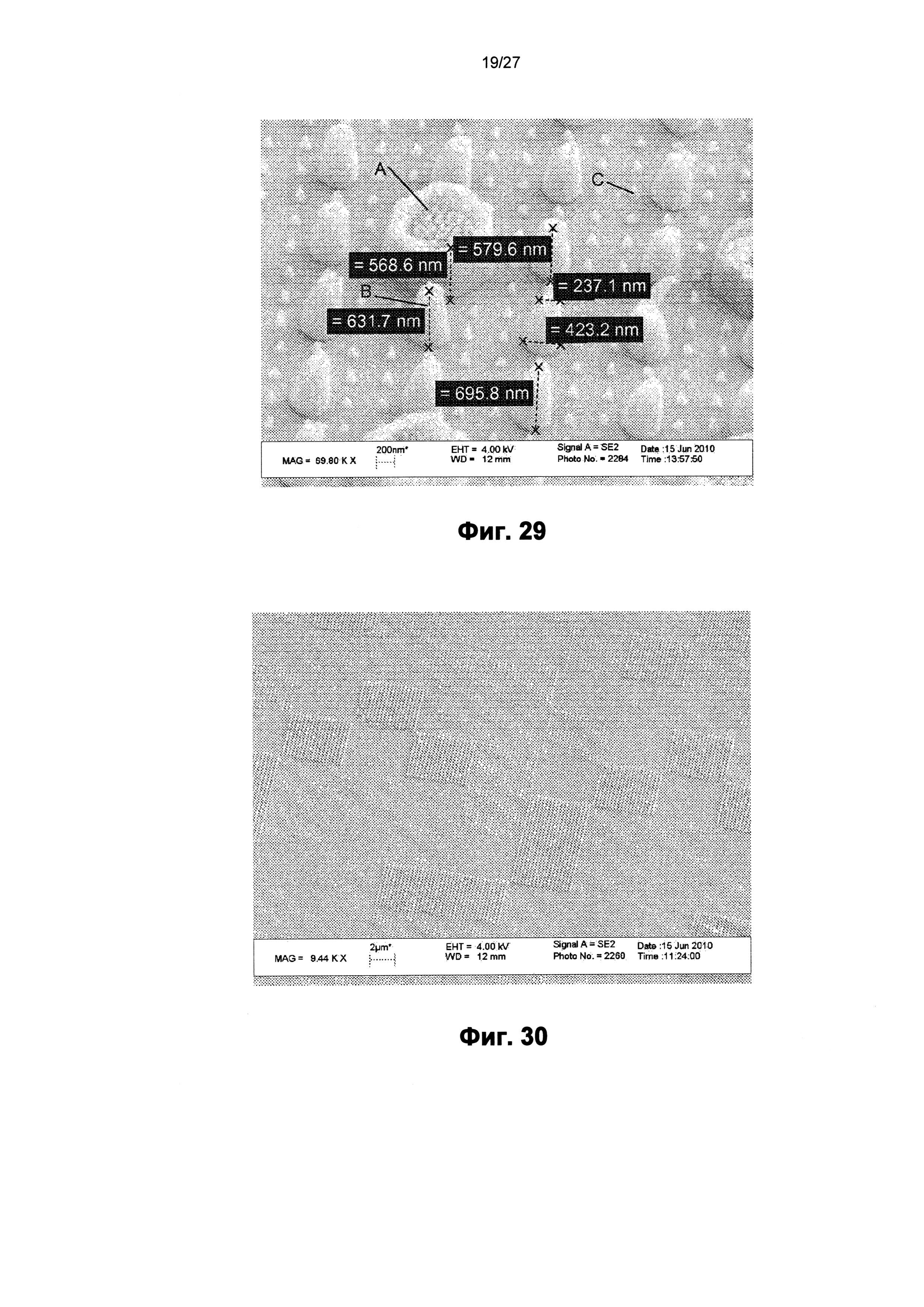
На фиг.29 показано изображение сканирующего электронного микроскопа пленки, содержащей поверхность с другим наноузором.
На фиг.30 показано изображение сканирующего электронного микроскопа пленки, содержащей поверхность с другим наноузором.
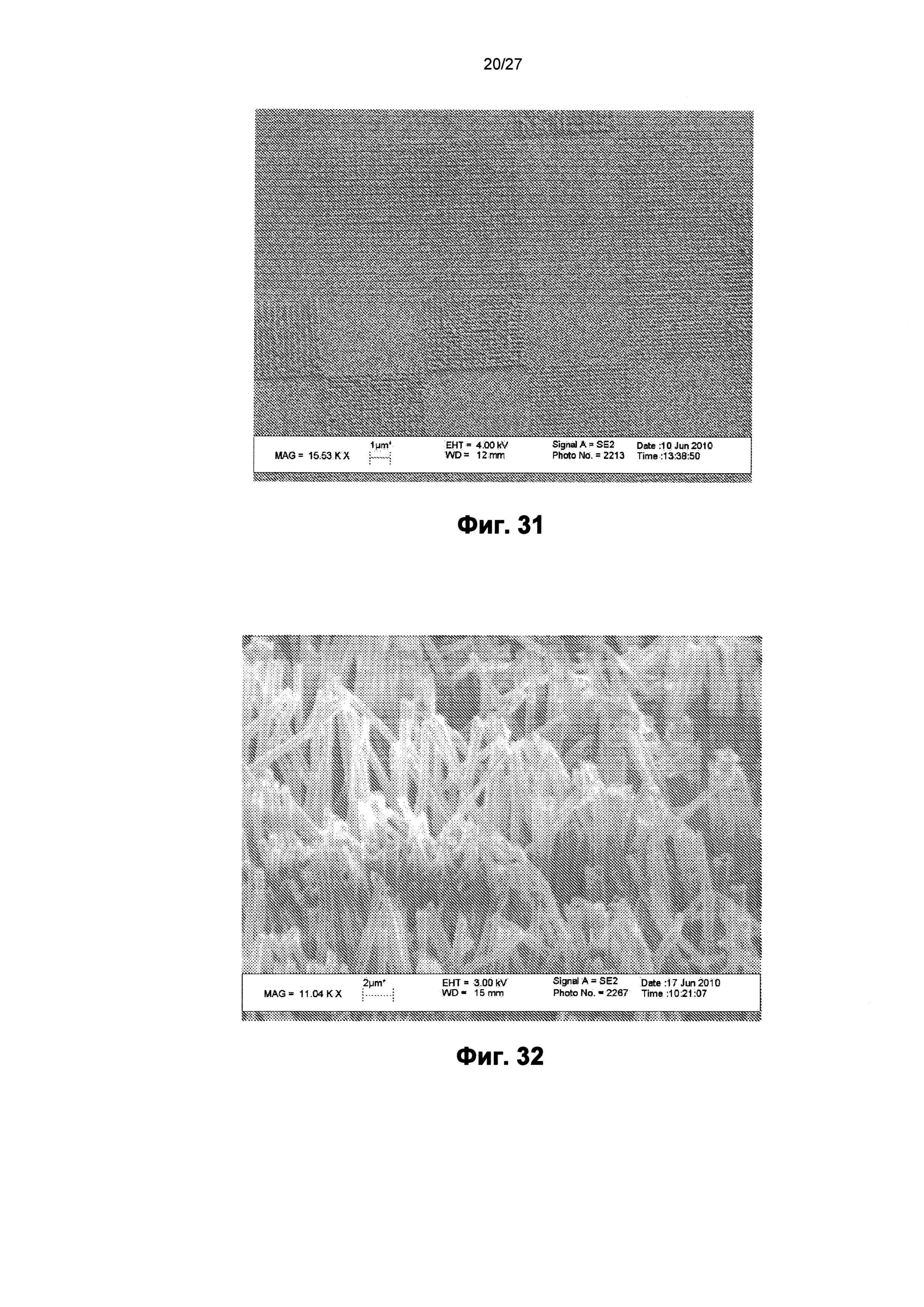
На фиг.31 показано изображение сканирующего электронного микроскопа пленки, содержащей поверхность с другим наноузором.
На фиг.32 показано изображение сканирующего электронного микроскопа пленки, содержащей поверхность с другим наноузором.
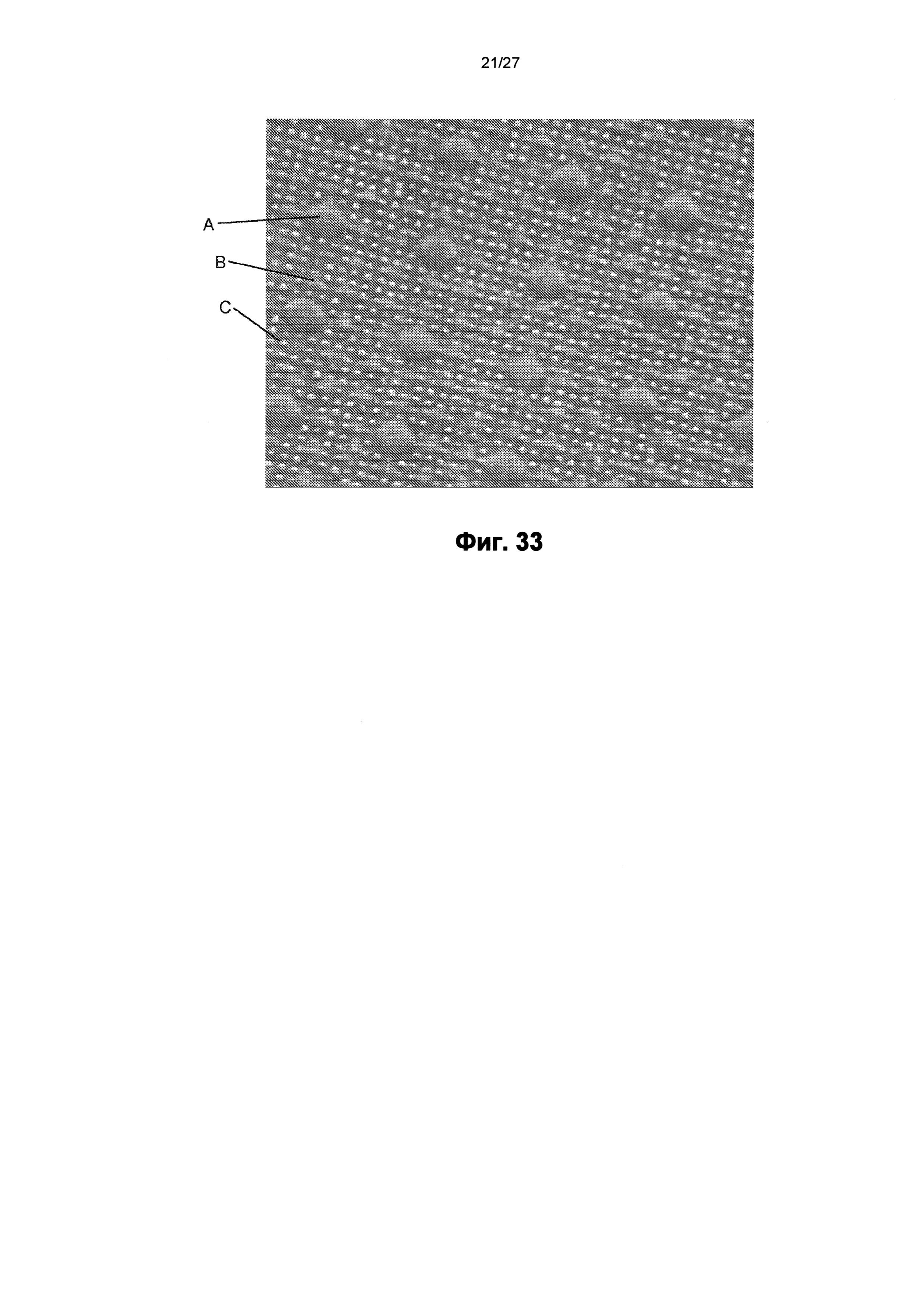
На фиг.33 показано изображение сканирующего электронного микроскопа пленки, содержащей поверхность с другим наноузором.
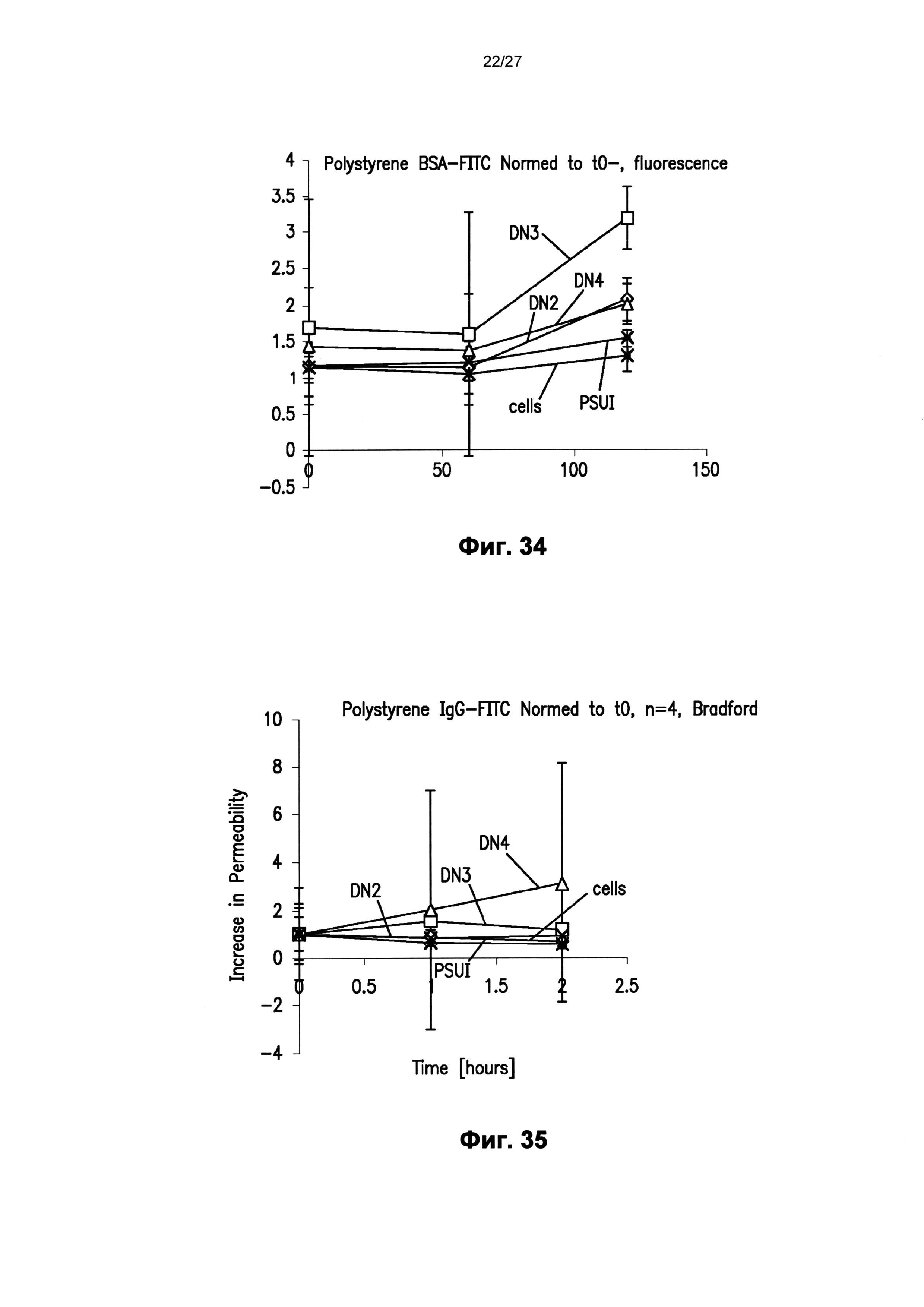
На фиг.34 графически показан эффект повышения проницаемости для альбумина бычьей сыворотки (BSA) в монослое клеток на пленках полистирола со сформированным наноузором, описанным в настоящем документе.
На фиг.35 графически показан эффект повышения проницаемости для иммуноглобулина - G (IgG) в монослое клеток на пленках полистирола со сформированным наноузором, описанным в настоящем документе.
На фиг.36А и 36В показаны 3D живые/неподвижные изображения с окрашиванием флуоресцеином, иллюстрирующие параклеточный транспорт иммуноглобулина-G через монослой клеток на поверхности пленки полистирола с узором, описанным в настоящем документе.
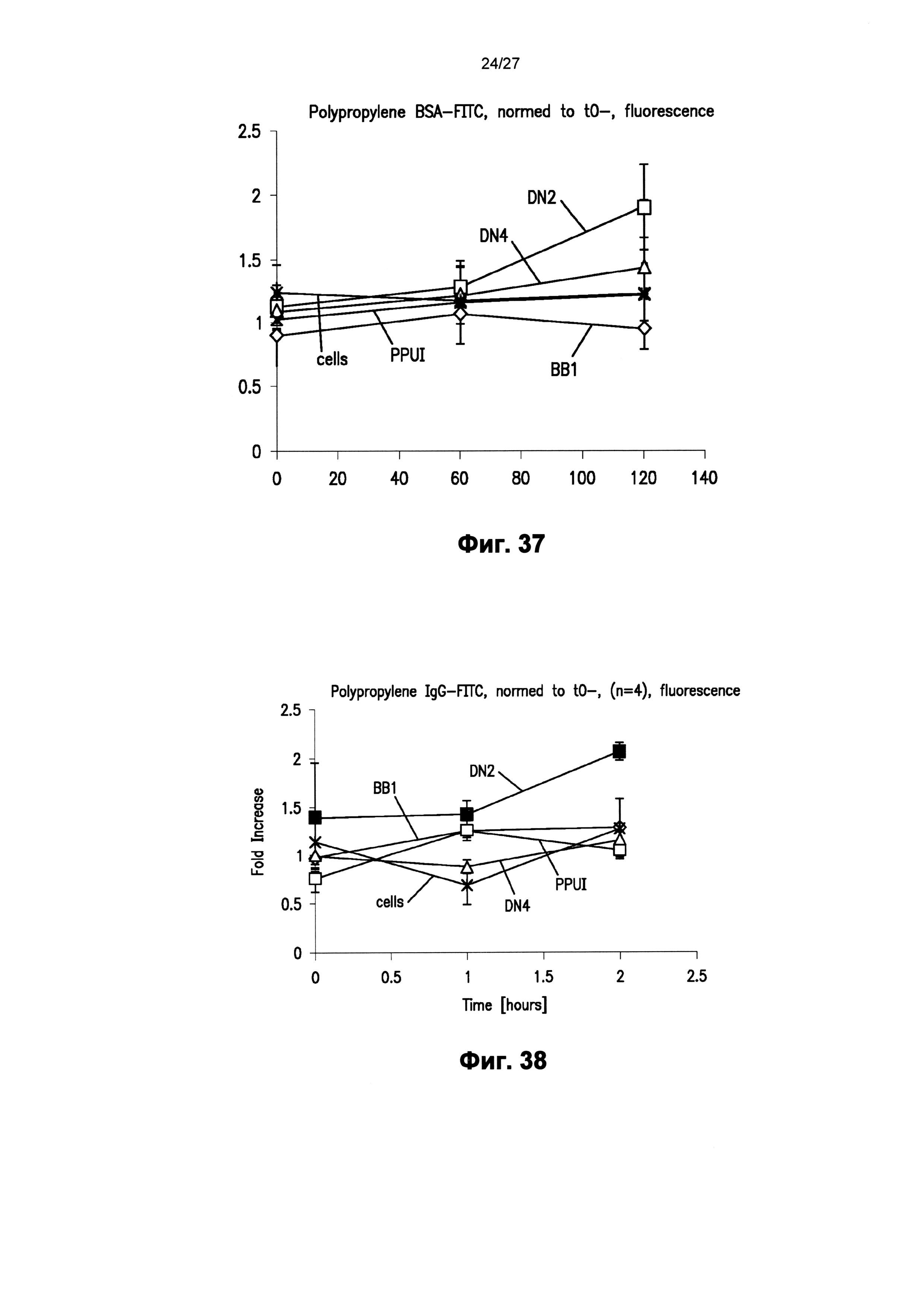
На фиг.37 графически показан эффект повышения проницаемости для BSA в монослое клеток на поверхности пленок полипропилена со сформированным наноузором, описанным в настоящем документе.
На фиг.38 графически показан эффект повышения проницаемости для иммуноглобулина-G в монослое клеток на поверхности пленок полипропилена со сформированным наноузором, описанным в настоящем документе.
На фиг.39A и 39B показаны 3D живые/неподвижные изображения с окрашиванием флуоресцеином, иллюстрирующие параклеточный транспорт иммуноглобулина-G через монослой клеток на поверхности пленок полипропилена со сформированным узором, описанным в настоящем документе.
На фиг.40A-40F показаны изображения сканирующего электронного микроскопа (SEM) культуры клеток на поверхностях с наноузором, описанным в настоящем документе.
На фиг.41 показан массив микроигл, содержащий поверхностный слой, образующий узор из наноструктур.
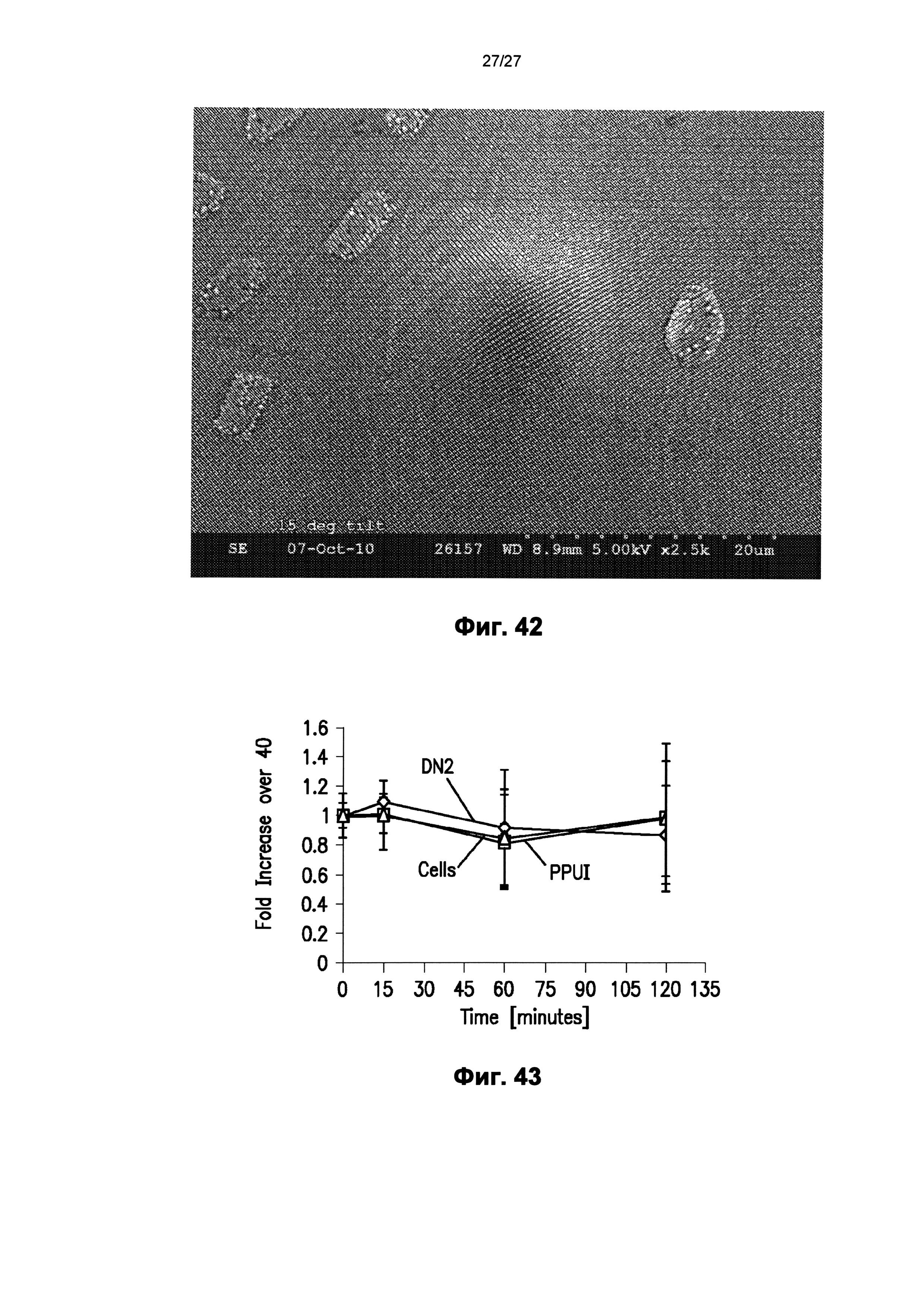
На фиг.42 показана одна микроигла массива по фиг.41.
На фиг.43 графически показан эффект повышения проницаемости для киРНК в монослое клеток на пленке полипропилена с узором, описанным в настоящем документе.
Далее подробно описаны различные варианты осуществления, раскрывающие сущность изобретения, один или более примеров которого пояснены далее.
Каждый пример подразумевает пояснение, а не ограничение. Действительно, для специалистов в этой области очевидно, что различные модификации и изменения могут быть внесены в настоящее описание без отступления от объема и сущности настоящего изобретения. Например, особенности, показанные или описанные, как часть одного варианта осуществления, могут быть использованы в другом варианте осуществления, чтобы получить еще один вариант осуществления. Таким образом, подразумевается, что настоящее изобретение охватывает такие модификации и изменения, как входящие в объем заявленной формулы изобретения и ее эквивалентов.
В основном, предлагается устройство для доставки конструкций киРНК. Более конкретно, устройство может содержать множество микроигл на поверхности и узор из структур, изготовленных на микроиглах. По меньшей мере участок структур изготовлен в масштабе нанометров. Устройство также подсоединено к одной или более конструкциям киРНК, например, в слое устройства или в емкости, которая сообщается по потоку текучей среды с поверхность, содержащей микроиглы.
Не желая ограничиваться какой-либо конкретной теорией, предполагается, что узор из наноструктур, т.е. нанотопография, устройства может улучшать доставку киРНК, при этом минимизируя реакцию на инородное тело и иммунный ответ. Посредством использования устройства киРНК можно направить для доставки на конкретный участок, например, в ткань или клетку конкретного типа в конкретной области доставки, или можно доставлять системным образом, например, через сердечнососудистую систему.
киРНК препараты устройств могут быть достаточно короткими, чтобы они не запускали разрушительный неспецифический ответ с выработкой интерферона в нормальных клетках млекопитающих. Таким образом, назначение состава, содержащего один или более препаратов киРНК, может быть использовано для воздействия на транскрипцию гена-мишени, при этом избегая ответа с выработкой интерферона, а также минимизируя реакцию на инородное тело. киРНК устройства в основном могут включать дуплексный участок менее 50, менее 40 или менее 30 пар нуклеотидов, например, от примерно 20 до примерно 25 пар. В основном, полинуклеотид киРНК содержит двухцепочечную РНК (дцРНК), но не предполагается, что это является ограничением, и он может содержать одноцепочечную РНК.
киРНК может быть получена любым известным способом. Например, киРНК может быть синтезирована синтетически или посредством транскрипции конструкции ДНК либо in vivo, либо in vitro. В основном, молекула киРНК может быть синтезирована с помощью способов, препаратов и оборудования, доступных для специалистов в этой области. Например, киРНК может быть разработана и сконструирована с помощью компьютерной программы, предлагаемой для продажи различными компаниями, например, OligoEngine (Seattle, Wash.); Dharmacon, Inc. (Lafayette, Colo.); Ambion Inc. (Austin, Тех.); и QIAGEN, Inc. (Valencia, Calif.)). См. также публикацию Elbashir et al., 2000 Genes & Development 15:188-200; Elbashir et al., 2001 Nature 411:494-98.
В соответствии с этими способами последовательность комплементарной ДНК может быть отсканирована для последовательностей-мишеней, которые содержат динуклеотиды АА. Смысловые и антисмысловые олигонуклеотиды можно получить для этих мишеней, которые содержат гуанин/цитозин (G/C) в отношении, например, примерно от 35 до 55%. Эти последовательности затем можно сравнить с другими в базе данных геномов человека, чтобы минимизировать гомологию другими известными кодирующими последовательностями (например, выполнив исследование BLAST (средство поиска основного локального выравнивания) с использованием информации, имеющейся в базе данных NCBI (Национальный центр биотехнологической информации)).
Молекула полинуклеотидов киРНК может быть получена in vitro или in vivo транскрипцией подходящих последовательностей ДНК (например, последовательности полинуклеотидов, кодирующие полипептид-мишень или нужный его участок). ДНК может быть внедрена в вектор с соответствующим промотором РНК-полимеразы (таким как, например, Т7, U6, Н1 или SP6, хотя другие промоторы могут быть полезны в той же степени). Эндогенные РНК-полимеразы внутри клетки могут медиировать транскрипцию in vivo, или для транскрипции in vivo или in vitro могут быть использованы клонированные РНК-полимеразы. Для транскрипции трансгена или экспрессирующей конструкции, может быть использована регуляторная область для транскрипции цепей киРНК.
Вектор может быть доставлен, например, путем внутривенной инфузии внутривенной инъекции, местного применения (патент США №5,328,470, Nabel, et al.) или путем стереотаксической инъекции (см., например, публикацию Chen et al., Proc. Natl. Acad. Sci. USA 91:3054-3057, 994). Шаблон ДНК может содержать две единицы транскрипции, одну, которая создает транскрипт, содержащий смысловую цепь киРНК-препарата, и вторую, которая создает транскрипт, содержащий антисмысловую цепь киРНК-препарата. При транскрипции шаблонов после доставки можно получить киРНК-препарат.
Полинуклеотиды, которые содержат киРНК, могут быть получены из одноцепочечного полинуклеотида, который содержит фрагмент одноцепочечного олигонуклеотида (например, примерно 18-30 нуклеотидов) и его противоположный комплимент, обычно разделены спейсерной областью. Расщепление спейсера может обеспечивать фрагмент одноцепочечного олигонуклеотида и его противоположный комплимент, и они могут денатурировать для формирования, необязательно с дополнительными этапами обработки, которые могут привести к добавлению или удалению одного, двух, трех или более нуклеотидов от 3' липкого конца и/или 5' липкого конца любой одной или обеих цепочек, полинуклеотида двухцепочечной киРНК. Спейсер может обладать длиной, которая позволяет фрагменту и его противоположному комплименту денатурировать и образовывать двухцепочечную структуру (например, аналогично шпилькообразному полинуклеотиду) перед расщеплением спейсера, и необязательно с этапами последующей обработки, которые могут привести к добавлению или удалению одного, двух, трех, четырех или более нуклеотидов от 3' липкого конца и/или 5' липкого конца любой одной или обеих цепочек. Поэтому, спейсерная последовательность может быть любой последовательностью полинуклеотидов, расположенной между двумя областями последовательностей комплементарных полинуклеотидов, которые, при денатурации в двухцепочечную нуклеиновую кислоту, дают в результате полинуклеотид киРНК.
Полученный полинуклеотид киРНК может обладать "тупыми" концами. Необязательно по меньшей мере одна цепочка полинуклеотида киРНК может содержать один или более нуклеотидов с 3' липким концом. Например, каждая цепочка дуплексного участка полинуклеотида киРНК может содержать двухнуклеотидный 3' липкий конец. Двухнуклеотидный липкий конец может представлять собой тимидиловый динуклеотид (TT), но также может содержать другие основания, например, динуклеотид ТС или динуклеотид TG, или любой другой динуклеотид. Динуклеотид с липким концом также может представлять собой комплементарный к двум нуклеотидам на 5' липком конце последовательности полинуклеотида, который является адресным для интерференции. Описание 3'-концов полинуклеотидов киРНК см., например, публикацию WO 01/75164, Tuschl, et al., которая включена в настоящий документ в качестве ссылки. Двухцепочечная структура киРНК может быть сформирована одной самокомплементарной цепью РНК или двумя комплементарными цепями РНК.
Полинуклеотид молекулы киРНК может содержать другие естественные, рекомбинантные или синтетические одноцепочечные или двухцепочечные полимеры нуклеотидов (рибонуклеотиды или дезоксирибонуклеотиды или комбинации обоих) и/или аналоги нуклеотидов (например, олигонуклеотид или полинуклеотид или подобный, обычно в сцеплении от 5'- до 3'-фосфодиэфиров).
Ингибирование является специфическим к последовательности в том смысле, что последовательности нуклеотидов, соответствующих дуплексному участку РНК, являются целевыми для генетического ингибирования. Соответственно киРНК, содержащая последовательности нуклеотидов, идентичные для участка гена-мишени, может быть предпочтительна для ингибирования. Однако последовательности киРНК с вставками, делениями и одноточечными мутациями относительно последовательности-мишени, также могут быть эффективны для ингибирования и охватываются настоящим документом. Например, киРНК может содержать модификации либо сахаро-фосфатного остова, либо нуклеозида.
киРНК соединение может обнаруживать разнообразие путем различий (например, путем нуклеотидной замены, включая переход или трансверсию) у одного, двух, трех или четырех нуклеотидов из конкретной последовательности. Эти различия могут возникать в любых положениях нуклеотидов отдельной киРНК в зависимости от длины молекулы, независимо от расположения в смысловой или в антисмысловой цепи двухцепочечного полинуклеотида. Различия нуклеотидов можно обнаружить на одной цепи двухцепочечного полинуклеотида, где комплементарный нуклеотид, с которым заменяющий нуклеотид обычно образует спаривание оснований водородных связей, необязательно будет заменен соответствующим образом.
Идентичность последовательностей может быть оптимизирована посредством алгоритмов выравнивания, известных в этой области, и расчета различия между нуклеотидными последовательностями в процентах.
В альтернативном варианте дуплексный участок РНК может быть образован функционально в виде последовательности нуклеотидов, которая способна создавать гибрид с участком транскрипта гена-мишени.
После образования полинуклеотид киРНК можно протестировать на способность интерференции с экспрессией полипептида-мишени в соответствии со способами, известными в этой области. Определение эффективности полинуклеотида РНК включает не только рассмотрение его способности интерферировать с экспрессией полипептида-мишени, но также того, не является ли полинуклеотид киРНК токсичным для клетки-хозяина. Например, требуемая киРНК должна обнаруживать активность интерференции РНК и должна также не обнаруживать нежелательные биологические последствия. Примером нежелательного биологического последствия является апоптоз клетки, для которой гибель клетки нежелательна в результате интродукции киРНК в клетку-хозяина.
Свойства препарата РНК, включая его фармакологические свойства, могут быть изменены и подобраны, например, путем интродукции лигандов, например, связанных лигандов, или векторов, например, вирусных векторов, в препарат киРНК. Кроме того, фармакологические свойства РНК могут быть улучшены путем введения лиганда в состав РНК, когда препарат киРНК содержит связанный лиганд.
Широкий ряд лигандов может быть связан с препаратом киРНК или использован в качестве конъюгата или добавки состава, например, к носителю мономерной субъединицы, конъюгированной лигандом. Приведенные ниже примеры описаны в контексте мономерных субъединиц, конъюгированных лигандом, но следует понимать, что лиганды могут быть присоединены к другим точкам препарата киРНК.
Лиганды могут быть присоединены, ковалентно или нековалентно, либо напрямую, либо опосредованно, посредством промежуточной связи с носителем. Лиганд или связанный лиганд может присутствовать на мономере, конъюгированном лигандом, когда мономер, конъюгированный лигандом, внедрен в растущую цепь. В одном варианте осуществления лиганд может быть внедрен в "прекурсор" мономерной субъединицы, конъюгированной лигандом, после того, как "прекурсор" мономерной субъединицы, конъюгированной лигандом внедрен в растущую цепь. Например, мономер, имеющий, например, амино-концевую связь, например, TAP-(CH2)nNH2, может быть внедрен в растущие смысловые или антисмысловые цепи. В дальнейшем, т.е. после внедрения прекурсора мономерной субъединицы в цепь, лиганд с электрофильной группой, например, пентафторфенильным эфиром или альдегидной группой, может впоследствии быть присоединен к прекурсору мономера, конъюгированного лигандом путем присоединения электрофильной группы лиганда к концевой нуклеофильной группе прекурсора связи мономерной субъединицы, конъюгированной лигандом.
Лиганд может менять распределение, направленность доставки или время жизни препарата РНК, в который он внедрен. Например, лиганд может обеспечивать повышенную аффинность для выбранной мишени, например, молекулы, клетки или типа клетки, категорию, например, категорию клетки или органа, ткани, органа или области организма. Лиганд может улучшать транспорт, свойства гибридизации и специфичности, а также может повышать сопротивление нуклеазы результирующего естественного или модифицированного олигорибонуклеотида.
Среди прочего, лиганд может действовать, как модификатор терапевтического средства, например, для улучшения поступления; диагностическое соединение или "репортерная" группа, например, для мониторинга распределения; перекрестно-сшивающий препарат; придающее нуклеазе сопротивление вещество; и/или естественное или необычное нуклеиновое основание. Неограничивающие примеры могут включать липофильные молекулы, липиды, лектины, стероиды (например, уваол, гецигенин, диосгенин), терпены (например, тритерпены, например, сарсасапогенин, фриделин, эпифриделаноловое производное литохолевой кислоты), витамины, углеводы (например, декстран, поллулан, хитин, хитозан, синтетические (например, 15-мерный олиголактат) и естественные полимеры (например, с низкой и средней молекулярной массой), инсулин, циклодекстрин или гиалуроновая кислота), белки, препараты, связывающие белки, молекулы, мишенью которых служит интегрин, поликатионные вещества, пептиды, полиамины и пептиды-имитаторы. Другие примеры включают фолиевую кислоту или лиганды рецепторов эпителиальных клеток, такое как трансферин.
Лиганд может представлять собой встречающуюся в природе или рекомбинантную или синтетическую молекулу, такую как синтетический полимер, например, синтетическую полиаминокислоту. Примеры полиаминокислот включают полилизин (PLL), поли-L-аспарагиновую кислоту, поли-L-глутаминовую кислоту, сополимер стирола и малеинового ангидрида, сополимер поли(L-лактид-ко-гликолид), сополимер дивинилового эфира и малеинового ангидрида, сополимер поли(L-лактид-ко-гликолид), сополимер дивинилового эфира и малеинового ангидрида, сополимер N-(2-гидроксипропил)метакриламида (НМРА), полиэтиленгликоль (PEG), поливиниловый спирт (PVA), полиуретан, поли(2-этилакриловую кислоту), полимеры N-изопропилакриламида или полифосфазин. Примеры полиаминов включают полиэтиленимин, полилизин (PPL), спермин, спермидин, полиамин, псевдопептид-полиамин, пептидомиметический полиамин, дендримерный полиамин, аргинин, амидин, протамин, катионные остатки, например катионный липид, катионный порфирин, четвертичную соль полиамина или альфа-спиральный пептид.
Лиганды также могут содержать группы нацеливания, например средства для нацеливания на клетку или ткань, например, тиреотропин, меланотропин, белок сурфактанта A, углевод мицина, гликозилированную полиаминокислоту, трансферрин, бисфосфонат, полиглутамат, полиаспартат или пептид Arg-Gly-Asp (RGD) или миметик пептида RGD.
Лиганды могут представлять собой белок, например, гликобелки, липобелки, например, липобелок низкой плотности (LDL), или альбумины, например, сывороточный альбумин человека (HSA), или пептиды, например, молекулы со специфической аффинностью к ко-лиганду, или антителом, например, антителом, которое связывается с клеткой заданного типа, такой как раковая клетка, эндотелиальная клетка или клетка кости. Лиганды могут содержать гормональные рецепторы или гормоны. Они также включают непептидные разновидности, такие как кофакторы, поливалентная лактоза, поливалентная галактоза, N-ацетилгалактозамин, N-ацетилглюкозамин, поливалентная манноза или поливалентная фукоза.
Лиганд может быть веществом, например лекарственным средством, которое может увеличивать поступление киРНК-препарата в клетку, например, путем разрушения цитоскелета клетки, например посредством разрушения микротрубочек, микрофиламентов, и/или промежуточных филаментов клетки. Лиганд может быть, например, таксоном, винкристином, винбластином, цитохалазином, нокодазолом, джаплакинолидом, латрункулином A, фаллоидином, свинхолидом A, инданоцином, миосервином, тетрациклином.
Лиганд может представлять собой липид или молекулу на основе липида, может связывать сывороточный белок, например, сывороточный белок человека (HSA). Лиганд, связывающий HAS, делает возможным распределение конъюгата в ткань-мишень, например ткань печени, включая паренхиматозные клетки печени. В качестве лигандов могут использоваться также другие молекулы, которые могут связываться с HSA. Например, может использоваться непроксин или аспирин. Липид или лиганд на основе липида могут (a) повышать устойчивость конъюгата к разложению, (b) улучшать нацеливание или транспортировку в клетку-мишень или клеточную мембрану, и/или (c) может использоваться для регуляции связывания с белком сыворотки, например HSA. Лиганд на основе липидов может использоваться, чтобы смодулировать, например, контролировать, связывание конъюгата с тканью-мишенью. Например, липид или лиганд на основе липидов, который связывает с HSA более прочно, будет с более низкой вероятностью нацелен на почки и, следовательно, с более низкой вероятностью будет выводиться из организма.
Вирусные и невирусные векторы могут быть использованы в качестве носителей для доставки в конструкции киРНК, как известно в этой области, любые из которых могут быть внедрены в данном контексте. Используемый в настоящем документе термин "вектор" относится к молекуле нуклеиновой кислоты, способной транспортировать другую нуклеиновую кислоту, к которой она присоединена. Одним из типов векторов является плазмида, которая относится к петле кольцевой двухцепочечной ДНК, в которой дополнительные сегменты нуклеиновой кислоты могут быть связаны лигандами. Другим типом вектора является вирусный вектор, в котором дополнительные сегменты нуклеиновой кислоты могут быть связаны лигандами в вирусном геноме. Некоторые векторы способны к автономной репликации в клетке-хозяина, в которую они интродуцированы (например, бактериальные векторы с бактериальным происхождением репликации и эписомные векторы млекопитающих). Другие векторы (например, неэписомные векторы млекопитающих) интегрированы в геном клетки-хозяина при интродукции в клетку-хозяина, и, тем самым, реплицируются вместе с геномом хозяина. Кроме того, некоторые векторы способны направлять экспрессию генов, с которыми они функционально связаны. Такие векторы называются векторами рекомбинантной экспрессии или просто векторами экспрессии. В основном, векторы экспрессии системы могут быть в форме плазмидов. В настоящем описании термины плазмид и вектор могут быть использованы взаимозаменяемо, поскольку плазмид является наиболее часто используемой формой вектора. Однако подразумевается, что описание охватывает такие другие формы векторов экспрессии, как вирусные векторы (например, дефектные ретровирусы репликации, лентивирусы, аденовирусы и аденоассоциированные вирусы), которые служат для выполнения эквивалентных функций. В одном варианте осуществления лентивирусы могут быть использованы для доставки одной или более молекул киРНК в клетку, например, макрофаг, Т-клетка, дендритная клетка или гематопоэтическая стволовая клетка.
Различные компоненты конструкции могут быть функционально связаны друг с другом в соответствии с известной практикой. В пределах вектора предполагается, что "функционально связанный" означает, что интересующая последовательность нуклеотидов связана с регуляторной последовательностью(ями) способом, который обеспечивает экспрессию последовательности нуклеотидов (например, в клетке-мишени, когда вектор интордуцирован в клетку-мишень). Термин "регуляторная последовательность" предполагает включение промоторов, энхансеры и другие элементы управления экспрессией (например, сигналы полиаденилирования). Такие регуляторные последовательности описаны, например, в публикации Goeddel; Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, Calif. (1990).
Регуляторные последовательности включают те последовательности, которые направляют конститутивную экспрессию последовательности нуклеотидов во многих типах клеток-хозяев, а также те последовательности, которые направляют экспрессию последовательности нуклеотидов только в некоторые клетки-хозяина (например, специфические для ткани регуляторные последовательности). Для специалистов в этой области очевидно, что конструкция вектора экспрессии может зависеть от таких факторов, как выбор клетки-мишени, уровень экспрессии нужной киРНК и т.д.
Конструкция киРНК может быть внедрена в носитель для доставки, например, липосому, или нано- или микрочастицу. Например, киРНК может быть заключена в капсулу в липосоме, как указано в публикации Liposome Technology, том II, Incorporation of Drugs, Proteins, and Genetic Material, CRC Press. киРНК, в зависимости от ее растворимости, может присутствовать и в водном слое, и в липидном слое, или в том, что в основном называется, липосомной суспензией. Гидрофобный слой, в основном, но не исключительно, может включать фосфолипиды, такие как лецитин и сфингомиелин, стероиды, такие как холестерин, ионные сурфактанты, такие как диацетилфосфат, стеариламин или фосфатидная кислота и/или другие вещества гидрофобной природы.
В зависимости от конкретной использованной последовательности и дозы доставляемого вещества двухцепочечной киРНК, киРНК может обеспечивать частичную или полную потерю функции для гена-мишени. Редукция или потеря экспрессии гена по меньшей мере у 99% клеток-мишени показана для генов, например, патенте США №6,506,559, Fire, et al. Более низкие дозы доставляемого вещества и более продолжительное время после назначения выбранной киРНК могут привести к ингибированию у меньшего числа клеток.
Устройство доставки может быть использовано для доставки киРНК к гену для ингибирования. Например, ген, который важен для репликации патогена, трансмиссии патогена или поддержания инфицирования может быть ингибирован с помощью устройства доставки. В качестве другого примера гены клеток с риском инфицирования патогеном или уже инфицированные клетки можно сделать мишенью. Ген-мишень может быть патогеном или геном-хозяина, ответственным за поступление патогена его хозяину, метаболизм лекарственного вещества патогеном или хозяином, репликацию или интеграцию генома патогена, закрепление или распространение инфекции у хозяина, или сборки следующего поколения аптогенов. Обращаются к способам профилактики (т.е. предотвращения или снижения риска инфекции), а также снижение частоты или тяжести симптомов, связанных с инфекцией. Устройство может быть использовано в комбинации с другими режимами лечения, включая вирусостатические и вирусотоксические препараты, антибиотики, противогрибковые препараты, противовоспалительные препараты, а также комбинации терапевтических средств и т.д.
Устройство может быть использовано для ингибирования экспрессии гена связанных с раком генов. Например, устройства с киРНК могут обеспечивать сайленсинг гена рака, включая солидные опухоли и лейкемию, а также такие как: апудома, хористома, брахиогенная опухоль, карциноидный синдром, карциноидное заболевание сердца, карцинома (например, Уокера, базальных клеток, базальная плоскоклеточная, Брауна-Пирса, протоковая, опухоль Эрлиха, in situ, Кребса 2, клеток Меркеля, слизеобразующая, немелкоклеточная карцинома легких, овсяно-клеточная, папиллярная, фиброзная, бронхиолярная, бронхогенная, сквамозная и переходно-клеточная), гистиоцитарные заболевания, лейкемия (например, В-клеточный лейкоз, смешано-клеточная, нуль-клеточная, Т-клеточный лейкоз, Т-клеточная хроническая лимфома, вирус Т-клеточного лейкоза, острый лейкоцитарный лейкоз, хронический лейкоцитарный лейкоз, тучноклеточный лейкоз и миелоидный лейкоз), злокачественный легочный гранулематоз, лимфома Ходжкина, иммунопролиферативная болезнь тонкого кишечника, лимфома неходжкина, плазмацитома, ретикулоэндотелиоз, меланома, хондробластома, хондрома, хондросаркома, фиброма, фибросаркома, гигантоклеточные опухоли, гистиоцитома, липома, липосаркома, мезотелиома, миксома, миксосаркома, остеома, остеосаркома, опухоль Юинга, синовиома, аденофиброма, аденолимфома, карциносаркома, хордома, краниофарингиома, дисгерминома, гамартома, мезенхимома, мезонефрома, миосаркома, амелобластома, цементома, одонтома, тератома, тимома, тробобластическая болезнь, аденокарцинома, аденома, холангиома, холестеатома, цилиндрома, цистаденокарцинома, цистаденома, гранулезоклеточная опухоль, гинандробластома, гепатома, аденома потовых желез, инсулома, опухоль из клеток Лейдига, папиллома, опухоль из клеток Сертоли, текаклеточная опухоль, лейомиома, лейомиосаркома, миобластома, миома, миосаркома, рабдомиома, рабдомиосаркома, эпендимома, ганглионеврома, глиома, медуллобластома, менингиома, неврилеммома, нейробластома, эпендиоглиома, нейрофиброма, неврома, параганглиома, нехромаффинная параганглиома, ангиокератома, ангиолимфоидная гиперплазия с эозинофилией, склерозирующая ангиома, ангиоматоз, гломангиома, гемангиоэндотелиома, гемангиома, гемангиоперицитома, гемангиосаркома, лимфангиома, лимфангиомиома, лимфангиосаркома, пинеалома, карцино-саркома, хондросаркома, филлоидная цистосаркома, фибросаркома, гемангиосаркома, лейомиосаркома, лейкосаркома, липосаркома, лимфангиосаркома, миосаркома, миксосаркома, карцинома яичников, рабдомиосаркома, саркома (например, Юинга, экспериментальная, Калоши и тучноклеточная саркома), неоплазии (например, кости, молочной железы, пищеварительной системы, колоректальные, печени, поджелудочной железы, гипофиза, яичек, глазничные, головы и шеи, центральной нервной системы, слуховой системы, таза, дыхательных путей и мочевых путей), нейрофиброматоз и дисплазия шейки матки, и для терапии других состояний, в которых клетки становятся иммортализованными или измененными. Устройство может быть использовано в комбинации с другими терапевтическими модальностями, такими как химиотерапия, криотерапия, гипертермия, лучевая терапия и т.п.
Устройство не ограничивается никаким типом гена-мишени или нуклеотидной последовательности. Однако следующие классы возможных генов-мишеней перечислены для целей иллюстрации в качестве генов-мишеней: гены развития (например, адгезивные молекулы, ингибиторы циклинзависимой киназы, гены семейства Wnt, гены семейства Pax, гены семейства Winged helix, гены семейства Hox, цитокины/лимфокины и их рецепторы, факторы роста/дифференциации и их рецепторы, нейротрансмиттеры и их рецепторы); онкогены (например, ABL1, BCL1, BCL2, BCL6, CBFA2, CBL, CSF1 R, ERBA, ERBB, EBRB2, ETS1, ETS1, ETV6, FGR, FOS, FYN, HCR, HRAS, JUN, KRAS, LCK, LYN, MDM2, MLL, MYB, MYC, MYCL1, MYCN, NRAS, PIM1, PML, RET, SRC, TALI, TCL3 и YES); подавляющие опухоль гены (например, АРС, BRCA1, BRCA2, MADH4, MCC, NF1, NF2, RB1, ТР53 и WT1); и биокатализаторы (например, АСС синтазы и оксидазы, АСР десатуразы и гидрокислазы, пирокфорилазы ADP-глюкозы, аденозинтрифосфатазы, алкогольдегидразы, амилазы, амилоглюкозидазы, каталазы, целлюлазы, хальконсинтазы, хитиназы, циклооксигеназы, декарбоксилазы, декстриназы, ДНК- и РНК-полимеразы, галактосидазы, глюканазы, глюкозооксидазы, крахмал-синтазы в крахмальной грануле, GTPазы, хеликазы, хемицеллюлазы, интегразы, инулиназы, инвертазы, изомеразы, киназы, лактазы, липазы, липоксигеназы, лизозимы, нопалинсинтазы, октопинсинтазы, пектинестеразы, пероксидазы, фосфатазы, фосфолипазы, фосфорилазы, фитазы, синтазы регуляторов роста растений, полигалактуроназы, протеиназы и пептидазы, пулланазы, рекомбиназы, обратные транскрипазы, рибулозо-1,5-бифосфаткарбоксилаза/оксигеназа, топоизомеразы и ксиланазы).
Устройство содержит, помимо конструкции(й) киРНК, микроиглы, на которых изготовлено множество структур наноразмера. Используемый в настоящем документе термин "изготовленный" в основном относится к структуре, которая специально разработана, создана или сконструирована для существования на поверхности устройства и не выровнена с особенностью поверхности, которая просто является случайным результатом формирования устройства. Таким образом, на поверхности микроигл существует заранее определенный узор из наноструктур.
Во время использования устройство и, в частности, структуры наноразмера на поверхности микроигл, могут взаимодействовать с тканью дермы и ее компонентами. Это взаимодействие позволяет регулировать или моделировать (т.е. менять) внутриклеточную и/или межклеточную сигнальную трансдукцию, связанную с взаимодействиями между клетками, эндоцитозом, воспалительной реакцией и т.д. Например, посредством взаимодействия между нанотопографией на поверхности и окружающими биологическими веществами или структурами, устройство может регулировать и/или модулировать трансмембранный потенциал, мембранные белки и/или межклеточные контакты (например, плотные контакты, щелевые контакты и/или десмосомы). Это может способствовать трансдермальной доставке конструкция киРНК. Кроме того, конструкции киРНК могут быть доставлены через дермальный барьер, не вызывая реакцию на инородное тело или иммунный ответ.
Устройство может быть сконструировано из различных материалов, включая металлы, керамику, полупроводники, органические вещества, полимеры и т.д., а также их композиты. Например, при формировании устройства могут быть использованы нержавеющая сталь фармацевтической категории, титан, никель, железо, золото, олово, хром, медь, сплавы этих или других металлов, кремний, диоксид кремния и полимеры. Обычно, микроиглы устройства сформированы из биологически совместимого материала, который способен поддерживать узор из структур наноразмера на поверхности. Термин "биосовместимый" в основном относится к материалу, который по существу не оказывает вредного влияния на клетки или ткани в области, в которую доставляется устройство. Также подразумевается, что при использовании устройства эти материалы не вызывают каких-либо значительных нежелательных с медицинской точки зрения эффектов в какой-либо другой области живого организма. Биосовместимые материалы могут быть синтетическими или натуральными. Некоторые примеры подходящих биосовместимых материалов, которые также являются поддающимися биологическому разложению, включают полимеры гидрокси кислот, такие как оксипропионовая кислота и полилактид гликолевой кислоты, полигликолид, полилактид-ко-гликолид, сополимеры с полиэтиленгликолем, полиангидриды, сложные поли(ортоэфиры), полиуретаны, полимасляная кислота, поливалериановая кислота и полилактид-ко-капролактон. Другие подходящие материалы могут включать, без ограничения, поликарбонат, полиметакриловую кислоту, этиленвинилацетат, политетрафторэтилен, и сложные полиэфиры. Различные компоненты устройства (например, микроиглы, основание, верхняя часть, области, контактирующие с лекарственным средством и т.д.) могут быть непористыми или пористыми по своей природе, могут быть однородными или неоднородными по всему устройству в отношении материалов, геометрии, цельности и т.д., и могут иметь жестко фиксированную или полуфиксированную форму.
На фиг.1 показано типичное трансдермальное устройство 10 с микроиглами. Как можно видеть, устройство содержит массив отдельных игл 12; каждая из которых сформирована с размером и формой, позволяющими проникать через весь или участок дермального барьера без поломки отдельных микроигл. Микроиглы могут быть сплошными, как на фиг.1, пористыми, или могут содержать полый участок. Микроигла может содержать полый участок, например, круглый канал, который может продолжаться через всю или участок иглы, продолжаясь параллельно направлению иглы или ответвляясь или выходя вбок от иглы, если это необходимо. Например, на фиг.2 показан массив микроигл 14, каждая из которых содержит канал 16 в боковой стороне иглы, которые могут быть использованы, например, для доставки конструкции РНК в субдермальную область. Например, канал 16 может быть по меньшей мере частично совмещен с отверстием в основании 15, чтобы создавать контакт между отверстием и каналом 16, обеспечивая прохождение вещества через канал 16.
Размеры канала 16, если он имеется, в частности, могут быть выбраны, чтобы инициировать течение в капилляре лекарственного соединения. Течение в капилляре в основном возникает, когда силы смачивания текучей среды со стенками канала больше, чем силы сцепления между молекулами жидкости. В частности, внутрикапиллярное давление обратно пропорционально размерам в сечении канала 16 и прямо пропорционально поверхностному натяжению жидкости, умноженному на косинус краевого угла контакта текучей среды с материалом, образующим канал. Таким образом, чтобы облегчить течение в капилляре в пластыре, размер в сечении (например, ширина, диаметр и т.д.) канала 16 можно задавать по выбору, причем меньшие размеры приводят к более высокому внутрикапиллярному давлению. Например, в некоторых вариантах осуществления размер в сечении канала обычно составляет в диапазоне от примерно 1 до примерно 100 микрометров, в некоторых вариантах осуществления от примерно 5 до примерно 50 микрометров, и в некоторых вариантах осуществления от примерно 10 до примерно 30 микрометров. Этот размер может быть постоянным, или он может меняться в зависимости от длины канала 16. Длина канала также может меняться для соответствия разным объемам, скорости потока и времени задержки для лекарственного соединения. Например, длина канала может составлять от примерно 10 до примерно 800 микрометров, в некоторых вариантах осуществления от примерно 50 до примерно 500 микрометров, и в некоторых вариантах осуществления от примерно 100 до примерно 300 микрометров. Площадь сечения канала также может быть различна. Например, площадь сечения может составлять от примерно 50 до примерно 1000 квадратных микрометров, в некоторых вариантах осуществления от примерно 100 до примерно 500 квадратных микрометров, и в некоторых вариантах осуществления от примерно 150 до примерно 350 квадратных микрометров. Кроме того, соотношение размеров (длина/размер в сечении) канала могут составлять в диапазоне от примерно 1 до примерно 50, в некоторых вариантах осуществления от примерно 5 до примерно 40, и в некоторых вариантах осуществления от примерно 10 до примерно 20. В случаях, когда размер в сечении (например, ширина, диаметр и т.д.) и/или длина меняется в зависимости от длины, отношение размеров может быть определено по средним размерам.
Следует понимать, что число микроигл, показанных на чертежах, предназначено только для целей иллюстрации. Фактическое число микроигл, используемых для сборки микроигл, может, например, составлять в диапазоне от примерно 500 до примерно 10000, в некоторых вариантах осуществления от примерно 2000 до примерно 8000, и в некоторых вариантах осуществления от примерно 4000 до примерно 6000.
Отдельная микроигла может быть прямой или с кончиком конической формы. В одном варианте осуществления диаметр микроиглы может быть максимальным у конца основания микроиглы и суженным на конус на удаленном от основания конце. Микроигла также может быть изготовлена с трубкой, которая содержит и прямой (без сужения), и конический участок.
Микроигла может быть сформирована с трубкой, которая является круглой или некруглой в сечении. Например, сечение микроиглы может быть многоугольным (например, в форме звезды, квадрата, треугольника), вытянутым или любой другой формы. Трубка может иметь одно или более отверстий или каналов.
Размер отдельных игл может быть оптимизирован в зависимости от нужной глубины конусности, требований к прочности иглы во избежание поломки в конкретном месте доставки и т.д. Например, размер в сечении трансдермальной микроиглы может составлять от примерно 10 нанометров (нм) и 1 миллиметр (мм), или от примерно 1 до примерно 200 микрометров, или от примерно 10 до примерно 100 микрометров. Наружный диаметр может составлять от примерно 10 до примерно 100 микрометров, и внутренний диаметр полой иглы может составлять от примерно 3 до примерно 80 микрометров. Кончик обычно имеет радиус меньше или равный примерно 1 микрометру.
Длина микроиглы в основном зависит от требуемого применения. Например, микроигла может составлять от примерно 1 микрометра до примерно 1 миллиметра, например, примерно 500 микрометров или меньше, или от примерно 10 до примерно 500 микрометров, или от примерно 30 до примерно 200 микрометров.
Массив микроигл необязательно содержит микроиглы, которые все идентичны друг другу. Массив может включать смесь микроигл с разной длиной, наружным диаметром, внутренним диаметром, формой в сечении, наноструктурированными поверхностями и/или промежутками между микроиглами. Например, микроиглы могут быть расположены с промежутком равномерным образом, например, в прямоугольной или квадратной сетке или концентрическими кругами. Промежуток может зависеть от большого числа факторов, включая высоту и ширину микроигл, а также количество и тип вещества, которое предполагается доставлять через микроиглы. Хотя применимо разнообразное расположение микроигл, особенно пригодно расположение микроигл с промежутком между микроиглами "от кончика до кончика" примерно 50 микрометров или больше, в некоторых вариантах осуществления примерно 100 до примерно 800 микрометров, и в некоторых вариантах осуществления от примерно 200 до примерно 600 микрометров.
Как показано на фиг.1, микроиглы могут удерживаться на подложке 20 (т.е. присоединены или составляют единое целое с подложкой), так что они ориентированы перпендикулярно или под углом к подложке. В одном варианте осуществления микроиглы могут быть ориентированы перпендикулярно подложке, и может быть обеспечена большая плотность микроигл на единицу площади подложки. Однако массив микроигл может включать смесь ориентаций микроигл, высот, материалов или других параметров. Подложка 20 может быть сконструирована из жесткого или гибкого листа металла, керамики, пластмассы или другого материала. Подложка 20 может быть разной толщины в соответствии с назначением устройства, например, примерно 1000 микрометров или меньше, в некоторых вариантах осуществления от примерно 1 до примерно 500 микрометров, и в некоторых вариантах осуществления от примерно 10 до примерно 200 микрометров.
Устройство может образовывать нанотопографию на поверхности микроиглы с произвольным или упорядоченным узором. Кроме того, устройство может образовывать нанотопографию на поверхности подложки, из которой выступают микроиглы, хотя это не является требованием. На фиг.3 схематично показаны кончики двух репрезентативных микроигл 22. Микроиглы 22 образуют центральный канал 24, который может быть использован для доставки конструкции РНК через микроиглы 22. Поверхность 25 микроиглы 22 может образовывать нанотопографию 26. В этом конкретном варианте осуществления нанотопография 26 образует произвольный узор на поверхности 25 микроиглы 22.
Микроигла может содержать множество идентичных структур, сформированных на поверхности, или может содержать различные структуры, сформированные с разным размером, формой и их комбинациями. Заранее определенный узор из структур может содержать смесь структур разной длины, диаметра, формы в сечении и/или с разными промежутками между структурами. Например, структуры могут быть расположены с промежутком равномерным образом, например, в прямоугольной или квадратной сетке или концентрическими кругами. В одном варианте осуществления структуры могут быть различны по размеру и/или форме и могут образовывать сложную нанотопографию. В одном варианте осуществления сложная нанотопография может образовывать фрактальную или фракталоподобную геометрию.
Используемый в настоящем документе термин "фрактал" в основном относится к геометрической или физической структуре с фрагментированной формой в любом масштабе измерений от максимального до минимального, так что некоторые математические или физические свойства этой структуры обладают свойствами, как если бы размеры этой структуры были больше, чем ее пространственные размеры. Интересующие математические или физические свойства могут включать, например, периметр кривой или скорость потока в пористой среде. Геометрическая форма фрактала может быть разделена на части, каждая из которых образует самоподобие. Кроме того, фрактал имеет рекурсивное определение и обладает тонкими структурами произвольно малого масштаба.
Используемый в настоящем документе термин "фракталоподобный" в основном относится к геометрической или физической структуре с одной или более, но не всеми, из характеристик фрактала. Например, фракталоподобная структура может включать геометрическую форму, которая содержит самоподобные части, но может не содержать тонких структур при произвольно малом масштабе. В другом примере фракталоподобная геометрическая форма или физическая структура может не уменьшаться (или увеличиваться) в масштабе равномерно между итерациями масштабирования, как фрактал, хотя она может увеличиваться или уменьшаться между рекурсивными итерациями геометрической формы узора. Фракталоподобный узор может быть проще, чем фрактал. Например, он может быть регулярным и относительно просто описанным на традиционном языке эвклидовой геометрии, в то время как фрактал не может.
Поверхность микроиглы, образующая сложную нанотопографию, может содержать структуры одной и той же общей формы (например, столбики), и могут быть образованы столбики разного масштаба (например, столбики наномасштаба, а также столбики микромасштаба). В другом варианте осуществления микроигла может содержать на поверхности структуры, которые меняются и по масштабу размеров, и по форме, или которые меняются только по форме, хотя они образованы в одном и том же масштабе наноразмеров. Кроме того, структуры могут быть сформированы в виде упорядоченного массива или произвольного распределения. В основном, по меньшей мере участок структур может представлять собой наноструктуры, сформированные в масштабе наноразмеров, например, составляющие размер в сечении меньше примерно 500 нм, например, меньше примерно 400 нм, меньше примерно 250 нм, или меньше примерно 100 нм. Размер наноструктуры в сечении в основном может быть больше примерно 5 нанометров, например, больше примерно 10 нанометров или больше примерно 20 нанометров. Например, наноструктуры могут обладать размером в сечении от примерно 5 до примерно 500 нанометров, от примерно 20 до примерно 400 нанометров или от примерно 100 до примерно 300 нанометров. В случаях, когда размер наноструктуры в сечении меняется в зависимости от высоты наноструктуры, размер в сечении можно определить, как среднее от основания до кончика наноструктуры, или как максимальный размер структуры в сечении, например, размер в сечении у основания конусообразной наноструктуры.
На фиг.4 показан один вариант осуществления сложной нанотопографии, которая может быть образована на поверхности. Этот конкретный узор включает большой центральный столбик 100 и окружающие столбики 102, 104, меньшего размера, предусмотренные на регулярном узоре. Как можно видеть, этот узор включает итерацию столбиков, каждый из которых имеет одну и ту же общую форму, но разных в отношении размера по горизонтали. Этот конкретный сложный узор представляет собой пример фракталоподобного узора, который не включает идентичного изменения по масштабу между последовательными рекурсивными итерациями. Например, в то время как столбики 102 являются первыми наноструктурами, которые определяют размер по горизонтали, который составляет примерно одну треть от этого размера большого столбика 100, который представляет собой микроструктуру, столбики 104 являются второй наноструктурой, которая определяет размер по горизонтали, который составляет примерно половину от этого размера столбиков 102.
Узор, который включает структуры разного размера, может включать большие структуры с размером в сечении, сформированным большего масштаба, например, микроструктуры с размером в сечении больше примерно 500 нанометров, в сочетании с меньшими наноструктурами. В одном варианте осуществления микроструктуры сложной нанотопографии могут обладать размером в сечении от примерно 500 нанометров до примерно 10 микрометров, от примерно 600 нанометров до примерно 1,5 микрометров, или от примерно 650 нанометров до примерно 1,2 микрометра. Например, сложная нанотопография по фиг.4 включает столбики 100 микроразмера с размером в сечении примерно 1,2 микрометра.
Когда узор включает одну или больше микроструктур большего размера, например, с размером в сечении больше примерно 500 нанометров, определенным либо как средний, либо как максимальный размер в сечении этой структуры, сложная нанотопография также может включать наноструктуры, например, первые наноструктуры, вторые наноструктуры другого размера и/или формы и т.д. Например, столбики 102 сложной нанотопографии по фиг.4, обладающие размером в сечении примерно 400 нанометров, и столбики 104, обладающие размером в сечении примерно 200 нанометров.
Нанотопография может быть сформирована из любого числа различных элементов. Например, узор из элементов может включать два различных элемента, три различных элемента, пример которого показан на фиг.4, четыре различных элемента или больше. Относительные пропорции повторяемости каждого из различных элементов также могут меняться. В одном варианте осуществления самые малые элементы узора представлены в большем количестве, чем более крупные элементы. Например, в узоре по фиг.4, имеется восемь столбиков 104 для каждого столбика 102, и имеется восемь столбиков 102 для центрального большого столбика 100. По мере возрастания элементов по размеру в основном может быть меньше повторений элемента в нанотопографии. Например, первый элемент, который составляет примерно 0,5, например, от примерно 0,3 до примерно 0,7 в размере в сечении относительно второго, больший элемент может присутствовать в топографии чаще примерно в пять раз или больше, чем второй элемент. Первый элемент, который составляет приблизительно 0,25 или от примерно 0,15 до примерно 0,3 в размере в сечении относительно второго, большего элемента, может присутствовать в топографии чаще примерно в 10 раз или больше, чем второй элемент.
Промежуток между отдельными элементами также может быть различен. Например, промежуток между центрами отдельных структур может составлять от примерно 50 нанометров до примерно 1 микрометра, например, от примерно 100 до примерно 500 нанометров. Например, промежуток от центра до центра между структурами может быть в масштабе наноразмеров. Например, при рассмотрении промежутка между структурами наноразмера промежуток от центра до центра структур может составлять меньше примерно 500 нанометров. Это не является требованием топографии, однако и отдельные структуры могут быть разнесены дальше. Промежуток от центра до центра структур может быть различен в зависимости от размера структур. Например, отношение среднего размеров в сечении двух соседних структур к промежутку от центра до центра между этими двумя структурами может составлять от примерно 1:1 (например, касание) до примерно 1:4, от примерно 1:1,5 до примерно 1:3,5 или от примерно 1:2 до примерно 1:3. Например, промежуток от центра до центра может составлять приблизительно удвоенное среднее размеров в сечении двух соседних структур. В одном варианте осуществления две соседние структуры с размером в сечении приблизительно 200 нанометров каждая могут обладать промежутком от центра до центра примерно 400 нанометров. Таким образом, отношение среднего диаметров к промежутку от центра до центра в этом случае составляет 1:2.
Промежуток между структурами может быть одним и тем же, т.е. они расположены с равными промежутками, или может быть различным для структур в узоре. Например, самые малые структуры узора могут быть разнесены на первое расстояние, и промежуток между этими самыми малыми структурами и большей структурой узора или между двумя большими структурами узора может быть одним и тем же или другим относительно этого первого расстояния.
Например, в узоре по фиг.4, самые малые структуры 104 расположены с промежутком от центра до центра примерно 200 нанометров. Расстояние между большими столбиками 102 и каждым из окружающих столбиков 104 меньше примерно 100 нанометров. Расстояние между самым большим столбиком 100 и каждым из окружающих столбиков 104 также меньше промежутка от центра до центра между самыми малыми столбиками 104 и составляет примерно 100 нанометров. Безусловно, это не является требованием, и все структуры могут быть расположены с равными промежутками друг от друга или с любым вариантом расстояний. В одном варианте осуществления различные структуры могут находиться в контакте друг с другом, например, одна над другой, как дополнительно описано далее, или примыкать одна к другой и соприкасаться одна с другой.
Все структуры топографии могут быть сформированы одной и той же высоты, в основном от примерно 10 нанометров до примерно 1 микрометра, но это не является требованием, и отдельные структуры узора могут быть разными по размеру в одном, двух или трех измерениях. В одном варианте осуществления некоторые или все структуры топографии могут обладать высотой меньше примерно 20 микрометров, меньше примерно 10 микрометров, или меньше примерно 1 микрометра, например, меньше примерно 750 нанометров, меньше примерно 680 нанометров или меньше примерно 500 нанометров. Например, структуры могут обладать высотой от примерно 50 нанометров до примерно 20 микрометров или от примерно 100 до примерно 700 нанометров. Например, наноструктуры или микроструктуры могут обладать высотой от примерно 20 до примерно 500 нм, от примерно 30 до примерно 300 нм, или от примерно 100 до примерно 200 нм, хотя следует понимать, что структуры могут быть наноразмера в сечении и могут обладать высотой, измеряемой в масштабе микроразмеров, например, больше примерно 500 нм. Структуры микроразмера могут обладать высотой, аналогичной или отличающейся от структур в масштабе наноразмеров одного и того же узора. Например, структуры микроразмера могут обладать высотой от примерно 500 нанометров до примерно 20 микрометров, или от примерно 1 до примерно 10 микрометров в другом варианте осуществления. Структуры микроразмера также могут обладать размером в сечении в микромасштабе больше примерно 500 нм и могут обладать высотой в масштабе наноразмеров меньше примерно 500 нм.
Отношение сторон структур (отношение высоты структуры к размеру в сечении этой структуры) может составлять от примерно 0,15 до примерно 30, от примерно 0,2 до примерно 0,5, от примерно 0,5 до примерно 3,5 или от примерно 1 до примерно 2,5. Например, наноструктуры могут обладать отношением сторон, попадающим в пределы любого из этих диапазонов.
Поверхность устройства может содержать один узор, как показано на фиг.4, или может содержать повторение одного и того же или разных узоров. Например, на фиг.5 показан узор, содержащий узор по фиг.4, при многократном повторении на поверхности.
Формирование нанотопографии на поверхности может увеличивать площадь поверхности без соответствующего увеличения объема. Считается, что увеличение отношения площади поверхности к объему повышает площадь взаимодействия с окружающими биологическими материалами. Например, считается, что увеличение отношения площади поверхности к объему улучшает механическое взаимодействие между нанотопографией и окружающими белками, например, белками внеклеточной матрицы (ЕСМ) и/или белками плазматической мембраны. Используемый в настоящем документе термин "белок" в основном относится к молекулярной цепи аминокислот, которая способна взаимодействовать структурно, ферментативным путем или иным образом с другими белками, полипептидами или любой другой органической или неорганической молекулой.
В основном, отношение площади поверхности к объему поверхности с наноузором может быть больше примерно 10000 см-1, больше примерно 150000 см-1 или больше примерно 750000 см-1. Определение отношения площади поверхности к объему может быть выполнено в соответствии с любым стандартным способом, известным в этой области. Например, удельная площадь поверхности может быть получена физическим методом газовой адсорбции (метод В.Е.Т.) с азотом в качестве адсорбирующего газа, широко известным в этой области и описанным в публикации Brunauer, Emmet и Teller (J. Amer. Chem. Soc, vol.60, Feb., 1938, pp.309-319), включенной в настоящий документ в качестве ссылки. В одном варианте осуществления площадь поверхности BET может быть меньше примерно 5 м2/г, например, от примерно 0,1 до примерно 4,5 м2/г или от примерно 0,5 до примерно 3,5 м2/г. Значения площади поверхности и объема также могут быть оценены по геометрии пресс-формы, используемой для формирования поверхности, в соответствии со стандартными геометрическими расчетами. Например, объем может быть оценен по расчетному объему для каждого элемента узора и общему числу элементов узора на заданной площади, например, на поверхности одной микроиглы.
Для устройства, которое образует фрактальный или фракталоподобный узор нанотопографии на поверхности, нанотопографию можно охарактеризовать путем определения размеров фрактала узора. Размер фрактала представляет собой статистическую величину, которая дает указание того, насколько плотно фрактал, по-видимому, заполняет пространство по мере того, как последовательные итерации становятся все меньшего и меньшего масштаба. Размер фрактала двухмерной структуры можно представить, как:
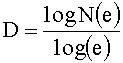
где N(e) - число самоподобных структур, необходимое для охвата всего объекта, когда объект уменьшается на 1/е в каждом пространственном направлении.
Например, при рассмотрении 2-мерного фрактала, известного как треугольник Серпинского, показанного на фиг.6, в котором срединные точки трех сторон равностороннего треугольника соединены, и полученный внутренний треугольник удален, размер фрактала рассчитывается следующим образом:
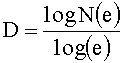
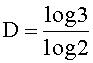
D≈1,585
Таким образом, фрактал треугольника Серпинского обнаруживает увеличение длины линий относительно исходного двухмерного равностороннего треугольника. Кроме того, этого увеличения длины линий не происходит при соответствующем увеличении площади.
Фрактальный размер узора, показанного на фиг.4, равен приблизительно 1,84. В одном варианте осуществления нанотопография поверхности устройства может обнаруживать размер фрактала больше примерно 1, например, от примерно 1,2 до примерно 5, от примерно 1,5 до примерно 3 или от примерно 1,5 до примерно 2,5.
На фиг.7А и 7В показаны с возрастающим увеличением изображения другого примера сложной нанотопографии. Нанотопография по фиг.7А и 7В включает массив напоминающих волокно столбиков 70, расположенных на подложке. На удаленном кончике каждого отдельного столбика он расщепляется на несколько меньших волокон 60. На удаленном кончике каждого из этих меньших волокон 60 каждое волокно также расщепляется на несколько нитей (не видны на фиг.7А и 7В). Структуры, сформированные на поверхности, обладающей отношением сторон больше примерно 1, могут быть гибкими, как структуры, показанные на фиг.7А и 7В, или они могут быть жесткими.
На фиг.7С и 7D показан другой пример сложной нанотопографии. В этом варианте осуществления на подложке сформировано множество столбиков 72, каждый из которых содержит кольцевое полое сквозное отверстие 71 через него. На удаленном кончике каждого полого столбика сформировано множество меньших столбиков 62. Как можно видеть, столбики по фиг.7С и 7D сохраняют свою жесткость и вертикальную ориентацию. Кроме того, и в противоположность предыдущим узорам, меньшие столбики 62 в этом варианте осуществления отличаются по форме от больших столбиков 72. В частности, меньшие столбики являются не полыми, а сплошными. Таким образом, нанотопография, содержащая структуры, сформированные разного масштаба, необязательно содержит все структуры, сформированные одной формы, и структуры могут отличаться и по размеру, и по форме от структур другого масштаба.
На фиг.8 показан другой узор, включающий структуры наноразмера, которые могут быть сформированы на поверхности микроигл. Как можно видеть, в этом варианте осуществления структуры с конкретным узором могут быть сформированы одного и того же общего размера, но с ориентацией и формой, отличающимися друг от друга.
Дополнительно или альтернативно к исследованию отношения площади поверхности к объему и/или фрактального размера, микроиглы устройств доставки киРНК могут быть охарактеризованы другими способами, включая, но, не ограничиваясь этим, шероховатость поверхности, модуль упругости и поверхностную энергию.
Способами определения шероховатости поверхности в основном являются способы, известные в этой области. Например, обработка в атомно-силовом микроскопе в контактном или бесконтактном режиме может быть использована в соответствии со стандартной практикой для определения шероховатости поверхности материала. Шероховатость поверхности, которая может быть использована, чтобы охарактеризовать микроиглу, может включать среднюю шероховатость (RA), среднеквадратичную шероховатость, асимметрию и/или коэффициент эксцесса. В основном, средняя шероховатость поверхности (т.е. арифметическое среднее высоты поверхности представляет собой параметр шероховатости, как указано в стандарте ISO 25178 серии) для поверхности, образованной изготовленной на ней нанотопографией, может составлять меньше примерно 200 нанометров, меньше примерно 190 нанометров, меньше примерно 100 нанометров или меньше примерно 50 нанометров. Например, средняя шероховатость поверхности может составлять от примерно 10 до примерно 200 нанометров или от примерно 50 до примерно 190 нанометров.
Поверхность микроигл может быть охарактеризована модулем упругости поверхности, например, изменением модуля упругости при добавлении нанотопографии на поверхности. В основном, добавление множества структур, образующих нанотопографию на поверхности микроигл, снижать модуль упругости материала, поскольку добавление структур наноразмера на поверхности может привести к снижению непрерывности поверхности и соответствующему изменению площади поверхности. По сравнению с аналогичной микроиглой, сформированной в соответствии с тем же самым способом и из тех же самых материалов, но для некоторого узора нанотопографии на поверхности, микроигла, содержащая нанотопографии на ней, может обнаруживать снижение модуля упругости от примерно 35 до примерно 99%, например, от примерно 50 до примерно 99% или от примерно 75 до примерно 80%. Например, эффективный модуль сжатия поверхности с наноузором может составлять меньше примерно 50 МПа, или меньше примерно 20 МПа. В одном варианте осуществления эффективный модуль сжатия может составлять от примерно 0,2 до примерно 50 МПа, от примерно 5 до примерно 35 МПа, или от примерно 10 до примерно 20 МПа. Эффективный модуль сдвига может составлять меньше примерно 320 МПа, или меньше примерно 220 МПа. Например, в одном варианте осуществления эффективный модуль сдвига может составлять от примерно 4 до примерно 320 МПа, или от примерно 50 до примерно 250 МПа.
Микроигла, содержащая нанотопографию на ней, также может обнаруживать увеличение поверхностной энергии по сравнению с аналогичной микроиглой, которая не обладает поверхностью, образующей на ней узор нанотопографии. Например, микроигла, содержащая сформированную на ней нанотопографию, может обнаруживать увеличение поверхностной энергии по сравнению с аналогичной микроиглой из тех же самых материалов и сформированной в соответствии теми же самыми способами, но без включения узора нанотопографии на поверхности. Например, для воды краевой угол смачивания поверхности, содержащей нанотопографию, может составлять больше примерно 80°, больше примерно 90°, больше примерно 100°, или больше примерно 110°. Например, в одном варианте осуществления для воды краевой угол смачивания поверхности может составлять от примерно 80° до примерно 150°, от примерно 90° до примерно 130° или от примерно 100° до примерно 120°.
При формировании наноструктур на поверхности устройства плотность упаковки структур может быть максимальной. Например, упаковка в квадрате (фиг.9А), гексагональная упаковка (фиг.9B) или некоторое их изменение может быть использовано для узора из элементов на микроигле. При создании узора, в котором элементы разного размера по площади сечения A, B и C примыкают друг к другу на микроигла, можно использовать упаковку в круге, как показано на фиг.9С. Безусловно, изменение плотности упаковки и определение соответствующего изменения характеристик поверхности зависят от навыка специалиста в этой области.
Микроиглы, содержащие изготовленную нанотопографию на поверхности микроигл, могут быть сформированы по одноэтапному способу, т.е. микроиглы формируют с наноструктурами на поверхности во время их формования. В альтернативном варианте может быть использован способ с несколькими этапами, в котором узор из наноструктур изготовлен на предварительно сформированной микроигле. Например, сначала может быть сформирован массив микроигл, а затем произвольный или упорядоченный узор из наноструктур может быть изготовлен на поверхности сформированных микроигл. При одноэтапном или двухэтапном способе структуры наноразмера могут быть изготовлены на поверхности микроигл или на поверхности пресс-формы по любому подходящему способу изготовления нанотопографии, включая, без ограничения, наноимпринтинг, литьевое прессование, литографскую печать, рельефное прессование и т.д.
Массив микроигл может быть сформирован по любому стандартному методу микроизготовления, без ограничения, литографскую печать; способы травления, такие как удаление жидкими реактивами, сухими реактивами и удаление фоторезиста; термическое оксидирование кремния; электроосаждение и нанесение покрытий химическим путем; диффундирование, такое как диффундирование бора, фосфора, мышьяка и сурьмы; имплантация ионным пучком; напыление пленок, такое как испарение (нити, электронным пучком, дуговым разрядом, и оттенением и сглаживанием ступеньки), металлизация напылением, химическое осаждение из паровой фазы (CVD), эптаксия (паровой фазы, жидкой фазы и молекулярного пучка), электроосаждение, трафаретная печать и наслаивание; стереолитографская печать; лазерная обработка; и удаление воздействием лазерного излучения (включая лазерную абляцию с использованием проекционной системы).
Может быть использован способ электролитического травления, в котором используется электролитическое травление твердого кремния до пористого кремния для создания чрезвычайно тонких (порядка 0,01 мкм) кремниевых сеток, которые можно использовать в качестве прокалывающих структур. В этом способе может быть использовано электролитическое анодирование кремния в водном растворе фтористоводородной кислоты, теоретически в комбинации со светом, для протравливания каналов в кремнии. Меняя концентрацию легирующей примеси кремниевой подложки для травления, электролитический потенциал при травлении, интенсивность падающего света и концентрацию электролита, можно добиться контроля над окончательной структурой пор. Не протравленный материал (т.е. оставшийся кремний) формирует микроиглы.
Также можно использовать плазменное травление, при котором выполняется глубокое плазменное травление кремния для создания микроигл диаметром порядка 0,1 микрометра или больше. Иглы могут быть изготовлены опосредованно путем управления напряжением (как при электролитическом травлении).
Способы литографской печати, включая фотолитографскую печать, электронно-лучевую литографскую печать, рентгеновскую литографскую печать, и т.д. можно использовать для определения первичного узора и формирования эталонной формы. Затем можно выполнить реплику для формирования устройства, содержащего массив микроигл. Общие способы репликации включают, без ограничения, микроформовку с использованием растворителя и литье, рельефное прессование, литьевое прессование и т.д. Технологии самосборки, включая способы расслоения полимера и блок-сополимера, разделенных на фазы, и коллоидной способы литографской печати также могут быть использованы для формирования нанотопографии на поверхности.
Как известно, могут быть использованы комбинации способов. Например, подложки с коллоидным узором можно подвергнуть реактивному ионному травлению (RIE, также известному, как сухое травление), чтобы улучшить характеристики изготовленной наноструктуры, такие как диаметр, профиль, высота, шаг и т.д. наностолбиков. Мокрое травление может быть использовано для получения альтернативных профилей для изготовленных наноструктур, первоначально сформированных различными способами, например, способами расслоения полимеров.
Диаметром, формой и шагом между структурами можно управлять путем выбора соответствующих материалов и способов. Например, травление металлов, первоначально испаряемых на подложки с узором из коллоида, с последующей взрывной литографией коллоида в основном приводит к созданию столбиков призматической формы. Затем процесс травления можно использовать для завершения создания нужных структур. Упорядоченные несферические полимерные наноструктуры также могут быть изготовлены посредством способов спекания с регулируемым нагревом, при которых образуются разнообразные упорядоченные треугольные нанометрические особенности в промежутках в коллоиде с последующим растворением полимерных наночастиц. Эти и другие подходящие способы формования в основном известны в этой области (см., например, публикацию Wood, J R Soc Interface, 2007 February 22; 4(12):1-17, включенную в настоящий документ в качестве ссылки).
Другие способы, которые могут быть использованы при формировании микроигл, включающие изготовление нанотопографии на поверхности, включают способы наноимпринт-литографии с использованием ультра-высокопрецизионных способов лазерной обработки, примеры которых указаны Hunt, et al. (патент США №6,995,336) и Guo, et al. (патент США №7,374,864), которые оба включены в настоящий документ в качестве ссылки.
Импринт-литография представляет собой способ литографской печати наноразмера, в котором используется гибридная пресс-форма, которая действует, и как пресс-форма наноимпринт-литографии, и как маска фотолитографской печати. Схема способа наноимпринт-литографии показана на фиг.10А-10В. Во время изготовления гибридная пресс-форма 30 впечатывается в подложку 32 посредством приложения давления для формирования особенностей (например, микроигл, образующих нанотопографию) на слое резиста (фиг.10А). В основном, поверхность подложки 32 может быть нагрета до сцепления с пресс-формой 30 до температуры выше ее температуры стеклования (Tg). В то время, как гибридная пресс-форма 30 сцепляется с подложкой 32, поток вязкого полимера может быть закачан в полости пресс-формы для формирования особенностей 34 (фиг.10Б). Пресс-форма и подложка затем могут быть подвергнуты воздействию ультрафиолетового излучения. Гибридная пресс-форма в основном пропускает УФ-излучение, за исключением некоторых загороженных областей. Таким образом, УФ-излучение проходит через пропускающие участки и в слой резиста. Давление сохраняется во время охлаждения пресс-формы и подложки. Гибридную пресс-форму 30 затем удаляют из охлажденной подложки 32 при температуре ниже Tg подложки и полимера (фиг.10В).
Чтобы облегчить освобождение подложки 32 с наноимпринтом, включающей изготовленные особенности 34, из пресс-формы 30, как показано на фиг.10В, предпочтительно обработать пресс-форму 30 низкоэнергетическим покрытием, чтобы уменьшить адгезию с подложкой 32, так как более низкая поверхностная энергия пресс-формы 30 и результирующая большая разность поверхностных энергий между пресс-формой 30, подложкой 32 и полимером может облегчить расцепление между этими материалами. Например, может быть использовано покрытие пресс-формы кремнием, а именно тридека-(1,1,2,2-тетрагидро)-октитрихлоросиланом (F13-TCS).
Способ наноимпринтинга является динамическим способом, который включает заполнение пресс-формы с последующим отцеплением сформованного полимера от пресс-формы. Для заполнения особенностей пресс-формы температура полимера должна быть повышена до достаточно высокого уровня, чтобы инициировать поток при приложенном давлении. Чем выше температура, тем ниже вязкость полимера, и тем быстрее и легче будет заполняться пресс-форма. Более высокое давление также повышает скорость заполнения и общее заполнение для лучшего моделирования пресс-формы. Чтобы освободить подложку с наноимпринтом из пресс-формы, температуру подложки можно снизить до точки, когда предел текучести превышает силы адгезии, испытываемые пресс-формой. Меняя температуру также можно изменить конусность особенностей полимера во время расцепления, чтобы получить различные структуры, например, структуры, показанные на фиг.8.
Наноструктуры также могут быть сформированы на микроигле способами добавления химических веществ. Например, напыление пленок, металлизация напылением, химическое осаждение из паровой фазы (CVD), эптаксия (паровой фазы, жидкой фазы, и молекулярного пучка), электроосаждение, и т.д. может быть использовано для построения структур на поверхности.
Могут быть использованы способы самосборки монослоя, известные в этой области, чтобы сформировать узор из структур на поверхности микроигл. Например, способность блок-сополимеров самоорганизовываться может быть использована для формирования узора из монослоя на поверхности. Узор затем можно использовать в качестве шаблона для выращивания нужных структур, например, коллоидов, в соответствии с узором монослоя.
Например, сеть двухмерных, перекрестно-сшитых полимеров может быть получена из монослоев с двумя или более реактивными участками. Такие перекрестно-сшитые монослои изготовлены с использованием самособирающегося монослоя (SAM) (например, система золото/алифатический радикал) или способы монослоев Ленгмюра-Блоджетта (LB) (Ahmed et al., Thin Solid Films 187: 141-153 (1990)), известные в этой области. Монослой может быть перекрестно-сшитым, что может привести к формированию более структурно прочного монослоя.
Мономеры, используемые для формирования монослоя с узором, могут содержать все структурные фрагменты, необходимые для нужного способа полимеризации и/или способа формирования монослоя, а также для влияния на такие свойства, как общая растворимость, способы диссоциации и способы литографии. Мономер может содержать по меньшей мере одну и более часто по меньшей мере две реактивные функциональные группы.
Молекула, используемая для формирования органического монослоя, может включать любые из различных органических функциональных групп, перемежающихся с цепочками метиленовых групп. Например, молекула может представлять собой углеродную структуру с длинными цепями, содержащую цепочки метилена для облегчения упаковки. Упаковка между метиленовыми группами может обеспечить ослабление возникающих сил Ван-дер-Ваальса, повысить стабильность создаваемого монослоя и нейтрализовать потери энтропии, связанные с формированием упорядоченной фазы. Кроме того, различные концевые фрагменты, например, фрагменты с водородной связью, могут присутствовать на одном конце молекул, чтобы обеспечивать рост структур на сформированном монослое, при этом полимеризуемые химические фрагменты могут быть помещены в середину цепи или на противоположные концы. Для формирования этого соединения может быть использован любой подходящий химический анализ для распознавания молекул. Например, структуры могут быть соединены на монослое на основе электростатического взаимодействия, Ван-дер-Ваальсового взаимодействия, хелатирования металлов, координационного связывания (т.е. взаимодействий кислоты по Льюису/основания), ионного связывания, ковалентного связывания или водородного связывания.
При использовании системы на основе SAM, для формирования шаблона может быть использована дополнительная молекула. Эта дополнительная молекула может обладать соответствующими функциональными группами на конце, чтобы сформировать SAM. Например, на поверхности золота может быть включена тиольная группа на конце. Для воздействия на получение реплики имеется широкое разнообразие органических молекул. Топографически полимеризуемые фрагменты, такие как диены и диацетилены, особенно предпочтительны в качестве компонентов полимеризации. Они могут быть вставлены в промежутки метиленовых линкеров разной длины. Для монослоя LB (Ленгмюра-Блоджетта), нужна только одна молекула мономера, поскольку фрагмент для молекулярного распознавания также может служить в качестве полярной функциональной группы для целей формирования монослоя LB. Литографскую печать можно выполнить на монослое LB, перенесенном на подложку, или непосредственно в ванночке. Например, монослой LB мономеров диацетилена может быть смоделирован путем воздействия УФ-излучения через маску или путем нанесения узора электронным пучком.
Формирование монослоя можно облегчить за счет использования молекул, которые претерпели топохимическую полимеризацию в фазе монослоя. Когда скомпонованная пленка подвергнута воздействию катализатора полимеризации, пленка может расти в условиях in situ, и перейти из динамического молекулярного соединения в более прочное полимеризованное соединение.
Любой из способов, известных в этой области, может быть использован для формирования узора из монослоя. Способы, используемые для создания узора из монослоя, включают, но не ограничиваются этим, фотолитографскую печать, способы электронно-лучевой обработки, способы фокусировки ионного пучка и мягкую литографию. Различные схемы защиты, такие как фоторезист, могут быть использованы для систем на основе SAM. Аналогично, узоры из блок-сополимера могут быть сформированы на золоте и выборочно протравлены для формирования узоров. Для двухкомпонентной системы нанесение узора также может быть достигнуто легко доступными способами.
Способы мягкой литографской печати могут быть использованы для создания узора, в котором для создания узора могут быть использованы ультрафиолетовое излучение и маска. Например, монослой основания без узора можно использовать в качестве платформы для сборки монослоя реактивного мономера под действием пучка УФ/частиц. На монослой мономера затем может быть нанесен узор посредством УФ фотолитографской печати, электронно-лучевой литографской печати или литографской печати ионным пучком, даже хотя основной SAM не имеет узора.
Рост структур на монослое с узором может достигаться посредством различных механизмов роста, таких как соответствующее химическое восстановление солей металлов и использование центров или зародышей кристаллизации. При использовании элементов распознавания на монослое, рост неорганических соединений можно ускорить катализатором в этом месте раздела фаз различными способами. Например, могут быть сформированы неорганические соединения в форме коллоидов, обладающие формой органического монослоя с узором. Например, структуры из карбоната кальция или кремния могут составлять узоры за счет различных карбонильных функциональных групп, таких как карбоновые кислоты и амиды. Управляя условиями роста кристаллов, можно контролировать толщину и морфологию кристаллов во время роста минеральных соединений. Также для создания узора пригоден диоксид титана. Способы создания узора путем нанесения покрытий химическим путем можно использовать для синтеза металлов с помощью существующих органических функциональных групп. В частности, путем образования хелатных соединений атомов металлов с карбонильными фрагментами узора из органического вещества, осаждение металлов способом химического восстановления можно катализировать на узоре, формируя металлические коллоиды с узором. Например, Cu, Au, Ni, Ag, Pd, Pt и многие другие металлы, фотоформа которых изготавливается путем нанесения покрытий химическим путем, могут быть использованы для формирования металлических структур в форме органического монослоя. Управляя условиями нанесения покрытий химическим путем, можно контролировать толщину металлических структур с электролитическим покрытием.
Могут быть использованы другие способы выращивания типа "вверх дном", известные в этой области, например, способ, предложенный в патенте США №7,189,435, Tuominen, et al., который включен в настоящий документ в качестве ссылки.
В этом способе проводящая или полупроводниковая подложка (например, такой металл, как золото) может контактировать с пленкой блок-сополимера (например, блок-сополимер метилметакрилата и стирола), когда один компонент сополимера образует наноскопические цилиндры в матрице другого компонента сополимера. Проводящий слой затем может быть помещен поверх сополимера, чтобы сформировать композитную структуру. При вертикальной ориентации композитной структуры часть первого компонента может быть удалена, например, посредством воздействия УФ-излучения, электронным пучком или деструкцией под действием озона или подобным для формирования наноскопических пор в этой области второго компонента.
В другом варианте осуществления, предложенном в патенте США №6,926,953, Nealey, et al., включенном в настоящий документ в качестве ссылки, структуры сополимеров могут быть сформированы путем воздействия на подложку с репродуцированным слоем на ней, например, самособранного монослоя алкилсилоксана или оксидецилтрихлорсилоксана, двумя или более пучками выбранной длины волны для формирования интерференционного узора на репродуцированном слое, чтобы изменить смачиваемость репродуцируемого слоя в соответствии с интерференционными узорами. Слой выбранного блок-сополимера, например, сополимера полистирола и поли(метилметакрилата), затем может быть осажден на внешний репродуцируемый слой и отожжен для разделения компонентов сополимера в соответствии с шаблоном смачиваемости и для получения реплики узора репродуцируемого слоя в слое сополимера. Таким образом, могут быть сформированы полосы или выделенные области разделенных компонентов с повторяющимся размером в диапазоне 100 нанометров или меньше.
Поверхность микроигл может содержать произвольное распределение изготовленных наноструктур. Необязательно поверхность микроигл может содержать дополнительные материалы вместе с изготовленными наноструктурами. Например, микроигла может содержать изготовленный на ней электроспряденный волокнистый слой, и произвольный или упорядоченный узор из наноструктур может быть изготовлен на этом электроспряденном слое.
Электропрядение включает использование устройства подачи высокого напряжения для приложения электрического поля к расплаву или раствору полимера, удерживаемого в капиллярной трубке, индуцируя заряд на отдельных молекулах полимера. При приложении электрического поля заряд и/или диполярная ориентация индуцируется на границе раздела воздух-поверхность. Индукция порождает силу, которая препятствует поверхностному натяжению. При критической напряженности поля электростатические силы преодолевают силы поверхностного натяжения, и струя полимера выбрасывается из капиллярной трубки в направлении проводящей заземленной поверхности. Струя удлиняется и ускоряется под действием внешнего электрического поля, когда она выходит из капиллярной трубки. По мере того, как струя перемещается в воздухе, часть растворителя может испариться, оставляя позади себя заряженные волокна полимера, которые могут быть собраны на поверхности. По мере получения волокон, отдельные и еще влажные волокна могут прилипнуть друг к другу, формируя нетканый материал на поверхности. Узор из наноструктур затем может быть изготовлен на электроспряденной поверхности, например, посредством способа рельефного прессования с использованием пресс-формы, образующей нужные наноструктуры. Приложение пресс-формы к поверхности микроиглы при соответствующей температуре и давлении позволяет переносить узор на поверхность микроиглы. Поверхность произвольных электроспряденных волокон наноразмера, кроме того, может улучшать нужные характеристики поверхности микроиглы, например, одно или более из отношения площади поверхности к объему, шероховатости поверхности, поверхностной энергии и т.д., и может обеспечивать соответствующие преимущества.
Поверхность микроигл может приобрести дополнительные функциональные особенности для улучшенного взаимодействия с тканями или отдельными клетками во время использования. Например, одна или более биомолекул, таких как полинуклеотиды, полипептиды, все белки, полисахариды и подобное могут быть связаны со структурированной поверхностью перед использованием.
В некоторых вариантах осуществления поверхность микроигл уже может обладать подходящей реактивностью, чтобы необходимую дополнительную функциональную особенность можно было спонтанно присоединить к поверхности без необходимости предварительной обработки поверхности. Однако в других вариантах осуществления может быть выполнена предварительная обработка структурированной поверхности перед присоединением к нужному соединению. Например, реактивность структурированной поверхности может быть увеличена за счет добавления или создания аминных, карбоновых, гидроксильных, альдегидных, тиольных или сложноэфирных групп на поверхности. В одном репрезентативном варианте осуществления поверхность микроигл, содержащая узор из сформированных на ней наноструктур, может быть аминирована посредством контакта с амин-содержащим соединением, таким как 3-аминопропилтриэтоксисилан, чтобы увеличить количество аминных функциональных групп на поверхности и связать одну или более биомолекул с поверхностью посредством добавленных аминных функциональных групп.
Вещества, которые может быть предпочтительно связать с поверхностью устройства с узором, могут включать белки ЕСМ, такие как ламинины, тропо-эластин или эластин, тропоколлаген или коллаген, фибронектин и подобные. Короткие фрагменты полипептидов могут быть связаны с поверхностью устройства с узором, например, последовательность RGD (аргинил-глицил-аспартил), которая является частью последовательности распознавания связи интегрина с многими белками ЕСМ. Таким образом, повышение функциональных возможностей поверхности микроиглы с RGD может способствовать взаимодействию устройства с белками ЕСМ и, кроме того, ограничивать реакцию на инородное тело устройства во время использования.
Конструкция киРНК для доставки через устройство может быть присоединена к нему в соответствии с любым подходящим способом. Например, трансдермальный пластырь с микроиглами может быть использован для доставки веществ ниже рогового слоя в средний слой, stratum spinosum, или ниже росткового слоя, stratum germinativum, или даже глубже в дерму. киРНК, либо в свободном состоянии в составе, либо удерживаемая в защищенном состоянии внутри состава, может быть заключена в пластыре или доставляться в пластырь при транспортировке через роговой слой вместе с микроиглой, например, внутри микроиглы или на поверхности микроиглы.
Трансдермальный пластырь с микроиглами может содержать емкость, например, сосуд, пористую матрицу и т.д., которые позволяют хранить конструкцию киРНК и обеспечивать конструкцию киРНК для доставки. Устройство может содержать емкость внутри самого устройства. Например, устройство может содержать полость или множество пор, которые могут переносить одну или более конструкций киРНК для доставки. Конструкция киРНК может выбрасываться из устройства посредством разрушения участка или всего устройства или посредством диффузии препарата из устройства.
На фиг.11А и 11В показаны виды в перспективе устройства с емкостью. Устройство 110 содержит емкость 112, образованную непроницаемым защитным слоем 114 и массивом 116 микроигл. Защитный слой и массив 116 микроигл соединены вместе около наружной части устройства, как указано выноской 118. Непроницаемый защитный слой 114 может быть присоединен адгезивом, термосваркой или подобным. Устройство 110 также содержит множество микроигл 120. Покровная пленка 122 может быть удалена перед использованием устройства, чтобы обнажить микроиглы 120.
Состав, содержащий одну или более конструкций киРНК, может быть заключен в емкость 112. Материалы, пригодные для использования в качестве непроницаемого защитного слоя 114, могут включать такие материалы, как сложные полиэфиры, полиэтилен, полипропилен и другие синтетические полимеры. Материал в основном может уплотняться теплом или иным способом относительно защитного слоя, чтобы обеспечить барьер для поперечного потока содержимого емкости.
Емкость 112, образованная пространством или зазором между непроницаемым защитным слоем 14 и массивом 16 микроигл, обеспечивает структуру для хранения, в которой удерживается суспензия назначаемых конструкций киРНК. Емкость может быть сформирована из разнообразных материалов, которые совместимы с содержащимся в них препаратом. Например, емкость может быть сформирована из натуральных и синтетических полимеров, металлов, керамики, полупроводников и их композитов.
В одном варианте осуществления емкость может быть присоединена к подложке, на которой расположены микроиглы. В другом варианте осуществления емкость может быть отделена и разъемно присоединяться к массиву микроигл или сможет сообщаться с массивом микроигл по потоку текучей среды, например, посредством соответствующих трубок, насадок Люэра и т.д.
Устройство может содержать одну или несколько емкостей для хранения доставляемых препаратов. Например, устройство может содержать одну емкость, в которой хранится состав, содержащий одну или более конструкций киРНК, или устройство может содержать несколько емкостей, в каждой из которых хранится один или более препаратов для доставки во все или на участок массива микроигл. В случае нескольких емкостей, в каждой могут храниться разные вещества, которые могут быть скомбинированы для доставки. Например, первая емкость может содержать одну конструкцию киРНК, а вторая емкость может содержать наполнитель, например, физиологический раствор или вторую конструкцию киРНК. Различные препараты могут смешиваться перед доставкой. Смешивание может быть начато любыми способами, включая, например, механическое разрушение (т.е. прокалывание, разрушение или разрыв), изменение пористости или электрохимическое разрушение стенок или мембран, разделяющих камеры. Несколько емкостей могут содержать различные активные препараты для доставки, которые можно доставлять вместе с другими или по очереди.
В одном варианте осуществления емкость может сообщаться по потоку текучей среды с одной или более микроиглами трансдермального устройства, и микроиглы могут образовывать структуру (например, центральный или боковой канал) для обеспечения транспорта доставляемых препаратов под барьерный слой.
В альтернативных вариантах осуществления устройство может содержать сборку микроигл и сборку емкости, чтобы предотвратить поток между ними до использования. Например, устройство может содержать отсоединяемый элемент, расположенный с примыканием и к емкости, и к массиву микроигл. Отсоединяемый элемент может быть отделен от устройства перед использованием, так что во время использования емкость и массив микроигл сообщаются по потоку текучей среды друг с другом. Разделение может быть осуществлено посредством частичного или полного отсоединения отсоединяемого элемента. Например, как показано на фиг.12-17, в одном варианте осуществления показан отсоединяемый элемент, который сконструирован для отсоединения от трансдермального пластыря для инициации потока лекарственного соединения. Более конкретно, На фиг.12-13 показан трансдермальный пластырь 300, который содержит сборку 370 доставки лекарственного средства и сборки 380 микроигл. Сборка 370 доставки лекарственного средства содержит емкость 306, расположенную с примыканием к мембране 308, управляющей скоростью доставки.
Мембрана, управляющая скоростью доставки, может способствовать замедлению скорости потока лекарственного соединения при его выпускании. В частности, жидкостные лекарственные соединения, проходящие из емкости с лекарственным средством в сборку микроигл через микрофлюидальные каналы, могут испытывать перепад давлений, который приводит к снижению скорости потока. Если этот перепад слишком большой, может быть создано некоторое обратное давление, которое может препятствовать потоку соединения и, возможно, преодолевать внутрикапиллярное давление текучей среды через микрофлюидальные каналы. Таким образом, использование мембраны, управляющей скоростью доставки, может повысить этот перепад давлений и обеспечить введение лекарственного соединения в микроиглу при более контролируемой скорости потока. Конкретные материалы, толщина и т.д. мембраны, управляющей скоростью доставки, могут быть различны в зависимости от многих факторов, таких как вязкость лекарственного соединения, необходимое время доставки и т.д. Мембрана, управляющая скоростью доставки, может быть изготовлена из проницаемых, полупроницаемых или микропористых материалов, известных в этой области, чтобы управлять расходом лекарственных соединений, и обладающих проницаемостью относительно усилителя проницаемости ниже, чем у емкости с лекарственным средством. Например, материал, используемый для формирования мембраны, управляющей скоростью доставки, может обладать средним размером пор от примерно 50 нанометров до примерно 5 микрометров, в некоторых вариантах осуществления от примерно 100 нанометров до примерно 2 микрометров, и в некоторых вариантах осуществления от примерно 300 нанометров до примерно 1 микрометра (например, примерно 600 нанометров). Подходящие материалы мембраны включают, например, волокнистые материалы (например, тканые или нетканые), пленки с отверстиями, пеноматериалы, губки и т.д., которые сформированы из полимеров, таких как полиэтилен, полипропилен, поливинилацетат, сополимеры этилен н-бутилацетата и этилен винилацетата. Такие материалы мембраны также указаны более детально в патентах США №3,797,494, 4,03,894, 4,201,211, 4,379,454, 4,436,741, 4,588,580, 4,615,699, 4,661,105, 4,681,584, 4,698,062, 4,725,272, 4,832,953, 4,908,027, 5,004,610, 5,310,559, 5,342,623, 5,344,656, 5,364,630 и 6,375,978, которые включены в настоящий документ во всей полноте в качестве ссылки для всех соответствующих целей. Особенно пригодным материалом для мембраны является материал, предлагаемый компанией Lohmann Therapie-Systeme.
Как показано на фиг.12-13, хотя это необязательно, сборка 370 также содержит адгезивный слой 304, расположенный с примыканием к емкости 306. Аналогично, сборка 380 микроигл содержит опору 312, из которой выступает множество микроигл 330 с каналами 331, как указано выше. Слои сборки 370 доставки лекарственного средства и/или сборки 380 микроигл могут быть соединены вместе, если это необходимо, с помощью любых известных способов присоединения, таких как адгезивное присоединение, термосварка, ультразвуковая сварка и т.д.
Несмотря на используемую конкретную конструкцию, пластырь 300 также содержит отсоединяемый элемент 310, который расположен между сборкой доставки лекарственного средства и сборкой 380 микроигл. Хотя отсоединяемый элемент 310 необязательно может быть присоединен к примыкающей опоре 312 и/или мембране 308, управляющей потоком, обычно предпочтительно, чтобы он был только слабо присоединен, если присоединен вообще, чтобы отсоединяемый элемент 310 можно было легко снять с пластыря 300. Если это необходимо, отсоединяемый элемент 310 также может содержать участок 371 язычка (фиг.12-13), который продолжается по меньшей мере частично за периметр пластыря 300, чтобы облегчить пользователю возможность захватить этот элемент и потянуть его в нужном направлении. В ее "неактивном "состоянии, как показано на фиг.12-13, сборка 370 доставки лекарственного средства пластыря 300 надежно удерживает лекарственное соединение 307, чтобы оно не вытекало до некоторой значимой степени в микроиглы 330. Пластырь может быть "активирован" простым приложением силы к отсоединяемому элементу, чтобы отсоединить его от пластыря.
Как показано на фиг.14-15, в одном варианте осуществления предложен пластырь 300, для активации которого отсоединяемый элемент 310 тянут в продольном направлении. Может быть удален весь отсоединяемый элемент 310, как показано на фиг.16-17, или он может быть просто частично отсоединен, как показано на фиг.14-15. Однако в любом случае уплотнение, сформированное ранее между отсоединяемым элементом 310 и отверстием (не показано) опоры 312, будет разрушено. Таким образом, лекарственное соединение 107 может начать вытекать из сборки 170 доставки лекарственного средства в каналы 131 микроигл 130 через опору 1 12. Примеры того, как лекарственное соединение 307 вытекает из емкости 306 в каналы 331, показаны на фиг.16-17. В частности, поток лекарственного соединения 307 инициируется пассивно и не требует каких-либо активных механизмов вытеснения (например, насосов).
В вариантах осуществления, показанных на фиг.12-17, отсоединение отсоединяемого элемента сразу же инициирует поток лекарственного соединения в микроиглы, поскольку сборка доставки лекарственного средства уже расположена с сообщением по потоку текучей среды со сборкой микроигл. Однако в некоторых вариантах осуществления может быть предпочтительно предусмотреть для пользователя большую степень управления выбором времени выпускания лекарственного соединения. Это можно осуществить путем использования компоновки пластыря, в котором сборка микроигл первоначально не сообщается по потоку текучей среды со сборкой доставки лекарственного средства. Когда нужно использовать пластырь, пользователь может физически привести две отдельные сборки в состояние сообщения по потоку текучей среды. Отсоединяемый элемент может быть отделен либо до, либо после такого физического приведения в состояние сообщения.
Как показано на фиг.18-23, например, показан один конкретный вариант осуществления пластыря 200. На фиг.18-19 показан пластырь 200 до использования, и показана первая секция 250, сформированная сборкой 280 микроигл, и вторая секция 260, сформированная сборкой 270 доставки лекарственного средства. Сборка 270 доставки лекарственного средства содержит емкость 206, расположенную с примыканием к мембране 208, управляющей потоком, как указано выше. Хотя это необязательно, сборка 270 также содержит слой 204 адгезива, который расположен с примыканием к емкости 206. Аналогично, сборка 280 микроигл содержит опору 212, из которой выступает множество микроигл 230 с каналами 231, как указано выше.
В этом варианте осуществления опора 212 и мембрана 208, управляющая скоростью доставки, исходно расположены горизонтально с примыканием друг к другу, и отсоединяемый элемент 210 выступает поверх опоры 212 и мембраны 208, управляющей скоростью доставки. В этом конкретном варианте осуществления в основном предпочтительно, чтобы отсоединяемый элемент 210 был съемно присоединен к опоре 212 и мембране 208, управляющей скоростью доставки, адгезивом (например, адгезивом, эффективным при кратковременном прижатии). В "неактивном "состоянии, как показано на фиг.18-19, сборка 270 доставки лекарственного средства пластыря 200 надежно удерживает лекарственное соединение 207, так что оно не вытекает до какой-либо значительной степени в микроиглы 230. Когда нужно "активировать" пластырь, отсоединяемый элемент 210 можно отодрать и удалить, как показано на фиг.20-21, чтобы разрушить ранее сформированное уплотнение между отсоединяемым элементом 210 и отверстием (не показано) опоры 212. Поэтому, вторая секция 260 может быть согнута по линии сгиба "F", как показано направлением стрелки на фиг.22, чтобы элемент 208 управления скоростью доставки был расположен вертикально с примыканием к опоре 212 и с сообщением по потоку текучей среды с ней. В альтернативном варианте первая секция 250 может быть согнута. Тем не менее, сгибание секций 250 и/или 260 инициирует поток лекарственного соединения 207 от сборки 270 доставки лекарственного средства в каналы 231 микроигл 230 через опору 212 (см. фиг.23).
Устройство может доставлять препарат с такой скоростью, чтобы это было полезно в лечебных целях. С этой целью трансдермальное устройство может содержать корпус с микроэлектроникой и другими микроструктурами для управления скоростью доставки либо по заранее заданному графику, либо посредством активного взаимодействия с пациентом, медицинским работником или биодатчиком. Устройство может содержать вещество на поверхности с заранее заданной скоростью разложения, чтобы управлять выпусканием конструкции РНК, содержащейся внутри устройства. Скоростью доставки можно управлять путем регулирования разнообразных факторов, включая характеристики доставляемого состава (например, вязкость, электрический заряд и/или химический состав); размеры каждого устройства (например, наружный диаметр и объем каждого из отверстий); число микроигл на трансдермальном пластыре; число отдельных устройств в матрице носителя; применения внешней силы (например, градиента концентрации, градиента напряжения, градиента давления); использования клапана; и т.д.
Транспортировкой препаратов через устройство можно управлять или контролировать с помощью, например, различных комбинаций клапанов, насосов, датчиков, приводов и микропроцессоров. Эти компоненты могут быть изготовлены с использованием стандартных способов изготовления или микрообработки. Приводы, которые могут быть удобны с устройством, могут включать микронасосы, микроклапаны и локализаторы. Например, микропроцессор может быть запрограммирован для управления насосом или клапаном, тем самым, он управляет скоростью доставки.
Поток препарата через устройство может возникать вследствие диффузии или капиллярного действия или может быть вызван с использованием обычных механических насосов или немеханических движущих сил, таких как электроосмос или электрофорез или конвекция. Например, при электроосмосе электроды расположены на биологической поверхности (например, поверхности кожи), микроигле и/или подложке, примыкающей к микроигле, чтобы создать конвекционный поток, который переносит противоположно заряженные виды ионов и/или нейтральные молекулы к или на участок доставки.
Потоком препарата можно управлять путем выбора материала, образующего поверхность микроигл. Например, одна или более канавок, примыкающих к поверхности микроигл устройства, могут быть использованы для направления прохождения конструкции киРНК. В альтернативном варианте можно воздействовать на материалы, формирующими наноструктурированную поверхность, либо, чтобы способствовать, либо, чтобы подавлять транспорт вещества вдоль поверхности, например, управляя гидрофильностью или гидрофобностью.
Поток препарата можно регулировать с помощью клапанов или затворов, известных в этой области. Клапаны могут многократно открываться и закрываться, или они могут быть одноразовыми клапанами. Например, в устройстве между емкостью и поверхностью с узором может быть установлен разрушаемый барьер или односторонний затвор. При готовности к использованию барьер разрушается, или затвор открывается, обеспечивая поток через него к поверхности микроигл. Другие клапаны или затворы, используемые в устройстве, могут быть активированы термически, электрохимически, механически или с помощью магнита для выборочной инициации, модуляции или останова потока молекул через устройство. В одном варианте осуществления потоком управляют путем использования ограничивающей поток мембраны в качестве "клапана".
В основном, любая система управления доставкой препаратов, включающей емкости, системы управления потоком, сенсорные системы и т.д., известные в этой области, может быть внедрена в устройство. Например, в патентах США №№7,250,037, 7,315,758, 7,429,258, 7,582,069 и 7,611,481 предлагается емкость и системы управления, которые могут быть внедрены в устройства.
Во время использования присутствие микроигл с наноструктурированной поверхностью внутри кожи может влиять на формирование и поддержание контактов клетка/клетка, включая плотные контакты и десмосомы. Как указано выше, плотные контакты обнаружены в зернистом слое, и размыкание плотных контактов может обеспечивать параклеточный путь для улучшенной доставки конструкций киРНК.
Настоящее изобретение можно лучше понять с учетом приведенных далее примеров.
Пример 1
Несколько различных пресс-форм подготовлены с помощью фотоспособов литографской печати, аналогичных использованным при разработке и изготовлении электрических схем. Отдельные этапы способа в основном известны в этой области и уже описаны.
Первоначально кремниевые подложки подготовлены путем чистки ацетоном, метанолом и изопропиловым спиртом, а затем покрыты слоем 258 нанометров (нм) диоксида кремния в соответствии со способом химического осаждения из паровой фазы.
Затем на каждой подложке сформирован узор по способу электроннолучевой литографской печати, известному в этой области, с использованием системы JEOL JBX-9300FS EBL. Условия обработки следующие:
Ток электронного пучка = 11 нА
Ускоряющее напряжение = 100 кВ
Шаг съемки = 14 нм
Доза = 260 мкКи/см2
Резист = ZEP520A, толщиной ~330 нм
Проявитель = н-амилацетат
Проявление = 2 мин погружение с последующим ополаскиванием в течение 30 с изопропиловым спиртом.
Затем выполняют травление диоксида кремния улучшенным травителем диоксида кремния STS (АОЕ). Время травления составляет 50 секунд с использованием 55 стандартных кубических сантиметров в минуту (см3) Не, 22 см3 CF4, 20 см3 C4F8 при 4 мТорр, катушки 400 Вт, мощности при реактивном ионном травлении (RIE) 200 Вт и смещении постоянного тока 404-411 В.
Затем выполняют травление кремния травителем диоксида кремния STS (SOE). Время травления составляет 2 минуты с использованием 20 см3 Cl2 и 5 см3 Ar при 5 мТорр, катушки 600 Вт, мощности при реактивном ионном травлении (RIE) 50 Вт и смещении постоянного тока 96-102 В. Глубина травления кремния составляет 500 нм.
Буферный травитель оксида (ВОЕ) используют для удаление оставшегося оксида, что включает три минуты погружения в ВОЕ с последующим ополаскиванием деионизированной водой.
Наноимпринтер Obducat NIL-Eitre®6 используется для формирования наноузоров на различных полимерных подложках. В качестве охладителя используется дополнительная вода. УФ-блок используется с одной импульсной лампой с длиной волны от 200 до 1000 нанометров при мощности 1,8 Вт/см2. Используется УФ-фильтр 250-400 нанометров. Область воздействия составляет 6 дюймов с максимальной температурой 200°C и давлением 80 бар. Наноимпринтер включает полупроводниковый разделительный блок и извлечение из пресс-формы с автоматическим управлением.
Чтобы легче извлечь пленки с наноимпринтом из пресс-форм, пресс-формы обрабатывают тридека-(1,1,2,2-тетрагидро)-октилтрихлорсиланом (F13-TCS). Чтобы обработать пресс-форму, кремниевую пресс-форму сначала очищают, промывая ацетоном, метанолом и изопропиловым спиртом, и высушивают в атмосфере азота. Чашку Петри кладут на горячую пластинку в атмосфере азота и добавляют в чашку Петри 1-5 мл F13-TSC. Кремниевую пресс-форму кладут в чашку Петри и накрывают на 10-15 минут, чтобы дать парам F13-TSC испариться из кремниевой пресс-формы до удаления пресс-формы.
Пять разных полимеров, указанных в Таблице 1 внизу, использовали для формирования различных узоров с нанотопографией.
|
Сформировано несколько разных узоров нанотопографии, схематичное представление которых показано на фиг.24A-24D. Узор с нанотопографией, показанный на фиг.24Е, представляет собой поверхность плоской подложки, приобретенной в компании NTT Advanced Technology of Tokyo, Япония. Узоры были обозначены DN1 (фиг.24А), DN2 (фиг.24В), DN3 (фиг.24С), DN4 (фиг.24D) и NTTAT2 (фиг.24Е). Изображения SEM пресс-форм показаны на фиг.24А, 24В и 24С, и изображения пленок показаны на фиг.24D и 24Е. На фиг.8 показана пленка с наноузором, сформированная путем использования пресс-формы по фиг.24А (DN1). На этой конкретной пленке особенности полимера нанесены путем изменения температуры, как указано выше. Шероховатость поверхности узора на фиг.24Е составляет 34 нм.
Узор, показанный на фиг.7С и 7D, также сформирован по этому способу импринтинга. Как показано, этот узор включает столбики 72 и столбики 62.
Большие столбики 72 сформированы с диаметром 3,5 микрометра (мкм) и высотой 30 мкм при расстоянии от центра до центра 6,8 мкм. Столбики 62 составляют 500 нм в высоту и 200 нм в диаметре, и расстояние от центра до центра составляет 250 нм.
Условия способа импринтинга, используемого для пленок полипропилена, приведены далее в Таблице 2.
|
Пример 2
Пленки формируют, как указано в Примере 1, включая различные узоры, либо из полистирола (PS), либо из полипропилена (РР). Лежащая внизу подложка различна по высоте. Используются узоры DN2, DN3 или DN4, сформированные с использованием способов, указанных в Примере 1. Пресс-формы узоров различаются по глубине отверстий и промежутку для формирования особенностей разного размера с заданными узорами. Образец №8 (обозначенный ВВ1) формируется путем использования микропористой поликарбонатной пленки 0,6 мкм в качестве пресс-формы. Полипропиленовую пленку толщиной 25 мкм кладут поверх фильтра, а затем нагревают до расплавления, чтобы полипропилен мог протекать в поры фильтра. Затем пресс-форму охлаждают, и поликарбонатную пресс-форму растворяют с помощью растворителя метиленхлорида.
Изображения SEM сформированных пленок показаны на фиг.25-33 и характеристики сформированных пленок сведены в Таблицу 3 внизу.
|
Чтобы охарактеризовать пленку, для каждого образца используется AFM.
Характеристики включают формирование изображений сканирующего электронного микроскопа (SEM), определение шероховатости поверхности, определение максимальной измеренной высоты особенности и определение размера фрактала.
Исследование с помощью атомно-силовой микроскопии (AFM) состоит из серии 16 проб кремния и кантилевера компании µMasch. Кантилевер обладает резонансной частотой 170 кГц, константой пружины 40 Н/м, длиной 230±5 мкм, шириной 40±3 мкм и толщиной 7,0±0,5 мкм. Наконечник датчика представляет собой кремниевый датчик, легированный фосфором n-типа, с типичным радиусом наконечника датчика 10 нм, полным углом конуса наконечника 40°, общей высотой наконечника 20-25 мкм и объемным удельным сопротивлением 0,01-0,05 Ом-см.
Значения шероховатости поверхности, приведенные в Табл.3, представляют собой среднее арифметическое высоты параметра шероховатости области поверхности (Sa), как определено в стандарте ISO 25178 серии.
Фрактальный размер рассчитывается для разных углов посредством анализа спектра Фурье амплитуд; для разных углов выделяется профиль Фурье амплитуд, и рассчитывается логарифм координат частоты и амплитуды. Фрактальный размер, D, затем рассчитывается для каждого направления, как
D=(6+s)/2,
где s - отрицательный уклон двойных логарифмических кривых. Приведенный фрактальный размер представляет собой среднее по всем направлениям.
Фрактальный размер также может быть оценен по 2D спектру Фурье путем применения двойной логарифмической функции. Если поверхность представляет собой фрактал, двойная логарифмическая кривая должна быть линейной с отрицательным уклоном (см., например, Fractal Surfaces, John С. Russ, Springer-Verlag New York, LLC, July, 2008).
Пример 3
HaCaT клетки эпителия кожи человека выращивают в DMEM (модифицированной по способу Дульбекко среде Игла), 10% эмбриональной бычьей сыворотке, 1% пенициллина/стрептомицина при температуре 37°C, 5% CO2 в течение 24 часов при концентрации 25000 клеток/см2 в 6-луночных планшетах. Планшеты либо содержат пленки полипропилена с наноузором, как указано выше в Примере 1, и обозначенные DN1, DN2 (образец 4 Табл.3), DN3, либо необработанную поверхность на дне лунки. Пленки с наноузором приклеены на месте цианоакрилатом.
Клетки отсоединяют от поверхности 1 мл трипсина на каждую лунку в течение 10 минут, охлаждают 1 мл питательной среды (как и выше), затем переносят в микроцентрифужную пробирку и осаждают центрифугируют на скорости 1200 оборотов/мин в течение 7 минут.
РНК выделяют из центрифугированных клеток с использованием предварительно подготовленного миникомплекта RNeasy компании Qiagen в соответствии с протоколом изготовителя. Вкратце, клетки лизируют, смешивают с этанолом и скручивают в столбик. Затем лизат промывают в течение 3 минут, обрабатывают ДНКазой и элюируют в объемы 40 мл.
Комплементарную ДНК получают из изолированной РНК с использованием комплекта синтеза первой цепи RT (обратной транскриптазы) компании SA Biosciences. Вкратце, РНК обрабатывают ДНКазой повторно при температуре 42°C в течение 5 минут. Добавляют случайные праймеры и фермент обратной транскриптазы и инкубируют при температуре 42°C в течение 15 минут, затем инкубируют при температуре 95°C в течение 5 минут, чтобы остановить реакцию.
Затем на образцах комплементарной ДНК выполняется количественная ПЦР с использованием специального комплекта ПЦР профилей RT компании SA Biosciences с праймерами для IL-β, IL6, IL8, IL10, IL1 R1, TNFa, TGF-1, PDGFA, GAPDH, HDGC, RTC и РРС. Вкратце, комплементарную ДНК смешивают с красителем SYBR green и водой, и затем добавляют к микропланшету для ПЦР с предварительно внедренной правильной парой смыслового и антисмыслового праймера для гена интереса. Микропланшет затем обрабатывают на аппарате компании ABI StepOnePlus для ПЦР, нагревая до температуры 95°C в течение 10 минут, затем в течение 45 циклов: 15 секунд при температуре 95°C и 1 минуту при температуре 60°C.
Анализ по методу Delta delta CT выполняют с использованием GAPDH в качестве внутреннего контроля. Уровни HDGC, RTC и РРС используются в качестве дополнительного внутреннего контроля активности и геномной контаминации ДНК.
Однофакторный дисперсионный анализ и критерий Тьюки попарного сравнения затем используют для определения статистической значимости различий между поверхностями.
Таблица 4. Ниже представлены экспрессии белка, полученные по мере изменения изгиба в экспрессии структур с наноимпринтингом, полученных на пропиленовых пленках, относительно экспрессии на неструктурированной пленке.
|
Пример 4
HaCaT клетки эпителия кожи человека выращивают в DMEM (модифицированной по способу Дульбекко среде Игла), 10% эмбриональной бычьей сыворотке, 1% пенициллина/стрептомицина при температуре 37°C, 5% CO2 в течение 24 часов при концентрации 25000 клеток/см2 в 6-луночных планшетах. Планшеты либо содержат пленки полипропилена, сформированные, как указано выше в Примере 1, и обозначены (образец 4 Табл.3), DN3, либо необработанную поверхность на дне лунки. Пленки с наноузором приклеены на месте цианоакрилатом.
Среду собирают из каждой лунки и анализируют на выработку цитокинов с набором Milliplex Map компании Millipore. Для обнаружения IL-β, IL-1ra, IL-6, IL-8, IL-10, PDGF-AA, PGGF-AB/BB и TNF-α используют частицы. Данные получают по показаниям прибора BioRad BioPlex. Вкратце, среду помещают в лунки микропланшета с фильтрами. Добавляют исходные частицы и инкубируют при комнатной температуре в течение 1 часа с шейкированием. Затем микропланшеты промывают и инкубируют с обнаружением антител в течение 30 минут при комнатной температуре с шейкированием. Добавляют стрепа-видин-фикоэртитрин и инкубируют при комнатной температуре в течение дополнительных 30 минут. Затем микропланшеты промывают, частицы перерастворяют в буфере для анализа, и выполняют анализ медианной интенсивности флюоресценции на приборе BioPlex.
Пример 5
Уровень проницаемости пленок с узором, описанных в настоящем документе, определяют на монослое клеток Сасо-2 (эпителиальные клетки человека при колоректальной аденокарциноме).
Пленки, сформированные, как указано выше в Примере 1, используют с пленками полипропилена (РР) или полистирола (PS), сформированными с узорами, обозначенными DN2, DN3, и DN4. Также используется четвертая пленка, обозначенная BB1 (описана в Примере 2 выше). Протокол выполняют с несколькими образцами пленок каждого типа.
Общий протокол для каждой пленки следующий:
Материалы
Вставки для культуры клеток из мембраны HDPET (компании BD Falcon) с размером пор 0,4 мкм
24-луночный микропланшет (компании BD Falcon)
Среда Caco-2
Наноструктурированные мембраны, как указано выше
FITC-меченый иммуноглобулин G (компания Sigma Aldrich)
FITC-меченый бычий сывороточный альбумин (BSA) (компания Sigma Aldrich)
Среда MEM (Minimum Essential Medium) без таблеток phenol red (компания Invitrogen)
Вольтметр TEER
Подогретый забуфференный фосфатом физиологический раствор
Черный 96-луночный микропланшет
Алюминиевая фольга
Протокол
1. Выполните посев клеток Caco-2 на покрытые коллагеном вставки в лунки за 2 недели до выполнения анализа. Подготовьте покрытые коллагеном микропланшеты, изготовив раствор 1:1 по объему 100% этанола к коллагену. Просушите поверхности в стерильном вытяжном шкафу с вечера, чтобы они высохли.
2. Подготовьте раствор 0,1 мг/мл представляющих интерес меченых FITC молекул (BSA, иммуноглобулин G и т.д.) в среде Alpha MEM без красителя Phenol red. Заверните в алюминиевую фольгу для защиты от света.
3. Проверьте конфлюэнтность клеток Сасо-2, измерив сопротивление. Для конфлюэнтности сопротивление должно быть выше ~600 Ом.
4. Аспирируйте старую среду из вставок в микропланшеты на апикальной и базолатеральной сторонах. Промойте PBS для удаления остатков красителя phenol red.
5. Добавьте 0,5 мл меченого FITC раствора на апикальной стороне каждой вставки.
6. В другой 24-луночный микропланшет со вставками добавьте 0,5 мл подогретого забуфференного фосфатом физиологического раствора.
7. Перенесите вставки на микропланшет с PBS. Получите реплику промоканием вставки салфеткой Kim wipe, чтобы удалить остаточный фенол красный (phenol red).
8. t=0 - временная точка: отберите 75 мкл с базолатеральной стороны вставки и перенесите на 96-луночный микропланшет с черным дном. Замените объем 75 мкл подогретым забуференным фосфатом физиологическим раствором. Запишите сопротивление каждой лунки, используя электроды-щупы.
9. Аккуратно добавьте мембрану в соответствующим образом помеченную лунку. Контролем является мембрана без импринтинга и клетки в чистом виде. Убедитесь, проверив под микроскопом, что мембрана непосредственно контактирует с клетками. Вы должны увидеть ровный круг, указывающий на контакт с клетками.
10. t=0 временная точка: повторите шаг 7, а затем поместите в термостат на 1 час
11. t=1 временная точка: повторите шаг 7, а затем поместите в термостат на 1 час
12. t=2 временная точка: повторите шаг 7
13. Измерьте сигнал флюоресценции с помощью спектрофлюориметра для прочтения планшетов FITC (возбуждение = 490 нм, эмиссия = 520 нм)
Используемые пленки и полученные результаты приведены в Таблице 5 внизу.
|
Модули определяют по стандартным способам, известным в этой области, например, предложенным Schubert, et al. (Sliding induced adhesion of stiff polymer microfiber arrays: 2. Microscale behaviour, Journal Royal Society, Interface, Jan. 22, 2008. 10.1098/rsif. 2007. 1309)
Краевые углы измеряют, поместив каплю воды на поверхность в соответствии со стандартной практикой. (См., например, Woodward, First Ten Angstroms, Portsmouth, VA).
На фиг.34 графически показан эффект повышения проницаемости для альбумин бычьей сыворотки (BSA) в монослое клеток на пленках полистирола со сформированным наноузором, описанным в настоящем документе. Как указано, узоры на пленках включают узор DN2 (образец №3), узор DN3 (образец №5) и узор DN4 (образец №6). Также показаны результаты для пленки без узоров (помечена PSUI на фиг.34) и слоя клеток без примыкающей пленки (помечено "клетки" на фиг.22).
На фиг.35 графически показан эффект повышения проницаемости для иммуноглобулина-G (IgG) в монослое клеток на пленках полистирола со сформированным наноузором, описанным в настоящем документе. Как указано, узоры на пленках включают узор DN2 (образец №3), узор DN3 (образец №5) и узор DN4 (образец №6). Также показаны результаты для пленки без узоров (помечена PSUI на фиг.35) и слоя клеток без примыкающей пленки (помечено "клетки" на фиг.35).
Сигнал BSA считывается на флюорометре, а сигнал иммуноглобулина G считывается на спектрофотометре.
На фиг.36А и 36В показаны 3D живые/неподвижные изображения с окрашиванием флуоресцеином, иллюстрирующие параклеточный транспорт иммуноглобулина-G через монослой клеток на поверхности полистирола с узором DN4 (образец №6).
На фиг.37 графически показан эффект повышения проницаемости для BSA в монослое клеток на поверхности пленок полипропилена со сформированным наноузором, описанным в настоящем документе. Как указано, узоры включают BB1 (образец №8), DN2 (образец №4) и DN4 (образец №7). Также показаны результаты для пленки без узоров (помечена PSUI на фиг.37) и слоя клеток без примыкающей пленки (помечено "клетки" на фиг.37).
На фиг.38 графически показан эффект повышения проницаемости для иммуноглобулина-G в монослое клеток на поверхности пленок полипропилена со сформированным наноузором, описанным в настоящем документе. Как указано, узоры включают BB1 (образец №8), DN2 (образец №4) и DN4 (образец №7). Также показаны результаты для пленки без узоров (помечена PSUI на фиг.38) и слоя клеток без примыкающей пленки (помечено "клетки" на фиг.38).
На фиг.39А и 39В показаны 3D живые/неподвижные изображения с окрашиванием флуоресцеином, иллюстрирующие параклеточный транспорт иммуноглобулина-G через монослой клеток на поверхности полипропилена с узором DN2 (образец №4).
На фиг.40A-40F показаны изображения сканирующего электронного микроскопа (SEM) клетки Caco-2 в культуре на поверхностях с наноузором. В частности, на фиг.40А и 40В показаны клетки Caco-2 на гладкой пленке контроля из полистирола. На фиг.40C и 40D показаны клетки Caco-2 на пленке из полистирола с узором DN2 (образец №3), как указано выше, и на фиг.40Е и 40F показаны клетки Caco-2 на пленке из полистирола с узором DN3 (образец №5), как указано выше.
Пример 6
Сформирован массив микроигл, содержащих поверхность с наноузором.
Исходно массив микроигл, показанный на фиг.2, сформирован на кремниевой пластине посредством способа фотолитографской печати. Каждая игла имеет два расположенных друг напротив друга боковых канала, совмещенных с одним сквозным отверстием в основании иглы (не видно на фиг.2).
Микроиглы сформированы в соответствии с типичным способом микрообработки на пластине на основе кремния. Пластины расположены слоями с резистом и/или слоями оксида с последующим выборочным травлением (травление оксида, Глубокое реактивно-ионное травление (DRIE), травление по ISO), отделением резиста, отделением оксида и способами литографской печати (например, литографская печать по ISO, литографская печать с контактными отверстиями, литографская печать с зазором) в соответствии со стандартными способами формирование массива микроигл.
После формирования массива микроигл 5 мкм полипропиленовую пленку со сформированным на ней узором DN2, описанным в Примере 1, характеристики которой указаны для образца 2 в Табл.3, накладывают на массив микроигл. Структура пластина/пленка удерживается в нагретой вакуумной камере (вакуум на уровне 3 дюймов водяного столба) при повышенной температуре (130°C) в течение одного часа для аккуратного наложения пленки на поверхности микроигл, сохраняя при этом поверхность пленки с наноузором.
На фиг.41 показана пленка поверх массива микроигл, и на фиг.42 показан укрупненный вид одной иглы из массива, содержащей наложенную поверх кончика иглы пленку с наноузором.
Пример 7
Способы, описанные в Примере 5, используются для определения эффекта проницаемости пленок с узорами, описанными в настоящем документе, на монослое клеток Caco-2 при рассмотрении проницаемости слоя клеток для киРНК.
Используемая киРНК представляет собой флюоресцентный олигомер Fluorescent Oligo BLOCK-iT™ компании Invitrogen. киРНК является меченым флюоресцеином олигомером дцРНК. Протокол аналогичен описанному в Примере 5. Используемая структурированная пленка содержит узор DN2 на пленке полипропилена (образец 4 Табл.3), а также пленку без узора (PPUI) и слой клеток без пленки (клетки). Результаты полученной зависимости проницаемости от времени показаны на фиг.43.
Хотя сущность изобретения подробно описана в отношении его конкретных вариантов осуществления, очевидно, что специалисты в этой области, поняв вышеизложенное, могут легко представить варианты, изменения и эквиваленты этих вариантов осуществления. Соответственно, следует оценить объем настоящего описания, как объем приложенной формулы изобретения и ее эквивалентов.