Результат интеллектуальной деятельности: ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ БЕНЗОДИОКСОЛА ИЛИ БЕНЗОДИОКСЕПИНА В КАЧЕСТВЕ ИНГИБИТОРОВ ФОСФОДИЭСТЕРАЗ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым соединениям с ингибиторной активностью по отношению к фосфодиэстеразам, а также к их применению в качестве терапевтических агентов для лечения воспалительных заболеваний и состояний.
Уровень техники
Фосфодиэстеразы представляют собой ферменты, которые катализируют гидролиз циклического AMP и/или циклического GMP в клетках 5-AMP и 5-GMP, соответственно, и как таковые, они являются критичными по отношению к клеточному регулированию уровней cAMP или cGMP. Из 11 фосфодиэстераз, идентифицированных к настоящему времени, фосфодиэстераза (PDE) 4, PDE7 и PDE8 являются селективными по отношению к cAMP. PDE4 является наиболее важным модулятором cAMP, экспрессируемых в иммунных и воспалительных клетках, таких как нейтрофилы, макрофаги и T-лимфоциты (Z. Huang and J. A. Mancini, Current Med. Chem. 13, 2006, pp. 3253-3262). Поскольку cAMP является ключевым вторым мессенджером при модулировании воспалительных реакций, PDE4, как обнаружено, регулирует воспалительные реакции воспалительных клеток посредством модулирования провоспалительных цитокинов, таких как TNFα, IL-2, IFN-γ, GM-CSF и LTB4. Ингибирование PDE4, следовательно, становится привлекательной целью для терапии воспалительных заболеваний, таких как астма, хроническое обструктивное пульмонарное заболевание (COPD), ревматоидный артрит, атопический дерматит, болезнь Крона и тому подобное (M.D. Houslay et al., Drug Discovery Today 10 (22), 2005, pp. 1503-1519). Поскольку пациенты с атопическим дерматитом (AD) имеют повышенную активность PDE, ингибирование PDE4 представляло бы также, по-видимому, жизнеспособное лечение для AD (Journal of Investigative Dermatology (1986), 87(3), 372-6).
Семейство генов PDE4 состоит, по меньшей мере, из четырех генов: A, B, C и D, которые имеют высокую степень гомологии (V. Boswell Smith and D. Spina, Curr. Opinion Investig. Drugs 6(11), 2006, pp. 1136-1141). Четыре изоформы PDE4 по-разному экспрессируются в различных типах тканей и клеток. Так, PDE4B преимущественно экспрессируется в моноцитах и нейтрофилах, но не в коре головного мозга и не в эпителиальных клетках, в то время как PDE4D экспрессируется в легких, коре головного мозга, мозжечке и T-лимфоцитах (C. Kroegel and M. Foerster, Exp. Opinion Investig. Drugs 16(1), 2007, pp. 109-124). Считается, что ингибирование PDE4D в мозгу ассоциируется с отрицательными воздействиями, обнаруженными при клиническом введении ингибиторов PDE4, прежде всего, с тошнотой и рвотой, в то время как ингибирование PDE4B ассоциируется с противовоспалительными воздействиями (B. Lipworth, Lancet 365, 2005, pp. 167-175). Однако ингибиторы PDE, разработанные к настоящему времени, как считается, не являются специфичными по отношению к любой из четырех изоформ PDE4.
Многочисленные ингибиторы PDE4 исследуют относительно их терапевтического воздействия на воспалительные заболевания, прежде всего, на астму, воспалительное заболевание кишечника и COPD. Первый из них - теофиллин, представляет собой слабый, неселективный ингибитор фосфодиэстеразы, используемый при лечении респираторных заболеваний, таких как астма и COPD. Лечение теофиллином может, однако, давать как умеренные, так и тяжелые отрицательные воздействия, например, аритмию и конвульсии, ограничивающие клиническое применение теофиллина (Kroegel and Foerster, выше). Поскольку фосфодиэстераза остается привлекательной целью для противовоспалительной терапии, несколько других, более селективных ингибиторов PDE4 разработаны и исследованы в клинических условиях. Клиническая разработка многих ингибиторов PDE4 первого поколения, таких как ролипрам, прервана из-за побочных воздействий, ограничивающих дозу, прежде всего из-за тошноты и рвоты. Ингибиторы PDE4 второго поколения со значительно менее выраженными отрицательными воздействиями находятся в настоящее время на клинических испытаниях (Houslay, выше).
Разработанные в последнее время ингибиторы PDE-4 описаны, например, в EP 0771794 и EP 0943613. WO 96/31476 описывает структурно различающиеся 4-замещенные-3,5-дихлорпиридины, которые являются ингибиторами фосфодиэстеразы циклического AMP.
WO 2008/104175 описывает 4-замещенные соединения 3,5-дихлорпиридина, где заместитель содержит спиробензодиоксольную или бензодиоксепиновую гетероциклическую кольцевую систему. Эти соединения описаны как ингибиторы PDE4 и предназначены для местного введения, поскольку они подвергаются деградации, когда вводятся перорально.
Обзор доклинических и клинических испытаний с селективными ингибиторами PDE4, включая ингибиторы, например, предназначенные для лечения атопического дерматита и псориаза, появился недавно в Inflammation & Allergy: Drug Targets, 2007, 6(1), 17-26.
Все еще имеется потребность в разработке новых ингибиторов PDE4, которые имеют более благоприятное терапевтическое окно, то есть меньшие отрицательные воздействия при пероральном введении, в то же время сохраняя свое терапевтическое противовоспалительное воздействие.
Сущность изобретения
Авторы неожиданно обнаружили, что соединения по настоящему изобретению демонстрируют ингибиторную активность по отношению к PDE4 при пероральном введении и могут быть полезными в качестве терапевтических агентов для системного лечения воспалительных аллергических заболеваний, таких как бронхиальная астма, COPD, аллергический ринит и нефрит; аутоиммунных заболеваний, таких как ревматоидный артрит, множественный склероз, болезнь Крона и системная красная волчанка; заболеваний центральной нервной системы, таких как депрессия, амнезия и деменция; патологии органов, связанной с ишемическим рефлюксом, вызываемым сердечной недостаточностью, шока и цереброваскулярных заболеваний, и тому подобное; диабета, стойкого к инсулину; ранений и других заболеваний, где воспаление играет роль в этиологии или развитии заболевания.
Соединения по настоящему изобретению могут также быть полезными при предотвращении, лечении или ослаблении различных заболеваний, таких как кожные заболевания или состояния, такие как пролиферативные и воспалительные повреждения кожи и, в частности, псориаза, воспаления эпидермиса, облысения, атрофии кожи, атрофии кожи, вызываемой стероидами, старения кожи, фотостарения кожи, акне, дерматита, атопического дерматита, себорейного дерматита, контактного дерматита, крапивницы, прурита и экземы.
Соответственно, настоящее изобретение относится к соединению общей формулы I
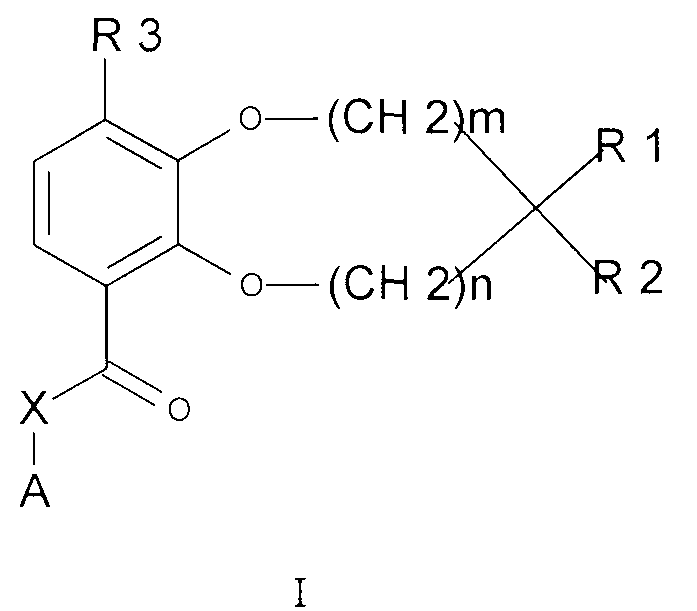
где
каждый из m и n независимо представляет собой 0 или 1;
R1 и R2 - вместе с атомом углерода, к которому они присоединены, образуют гетероциклическое кольцо, содержащее один или два гетероатома, выбранных из кислорода, серы, -S(O)- и -S(O)2-;
R3 представляет собой -CHF2, -CF3, -OCHF2, -OCF3, -SCHF2 или -SCF3;
X представляет собой связь, -CH2-, или -NH-;
A представляет собой арил, циклоалкил, циклоалкенил, арилалкил, гетероарил, гетероарилалкил, гетероциклоалкил или гетероциклоалкенил, необязательно замещенные одним или несколькими одинаковыми или различными заместителями, выбранными из R4; и
R4 представляет собой водород, амино, тиоксо, алкил, галогеналкил, гидроксиалкил, алкокси, галогеналкокси, галоген, оксо, тиа или гидрокси;
или к их фармацевтически приемлемой соли, гидрату или сольвату.
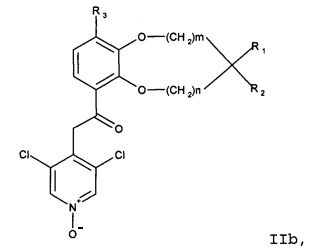
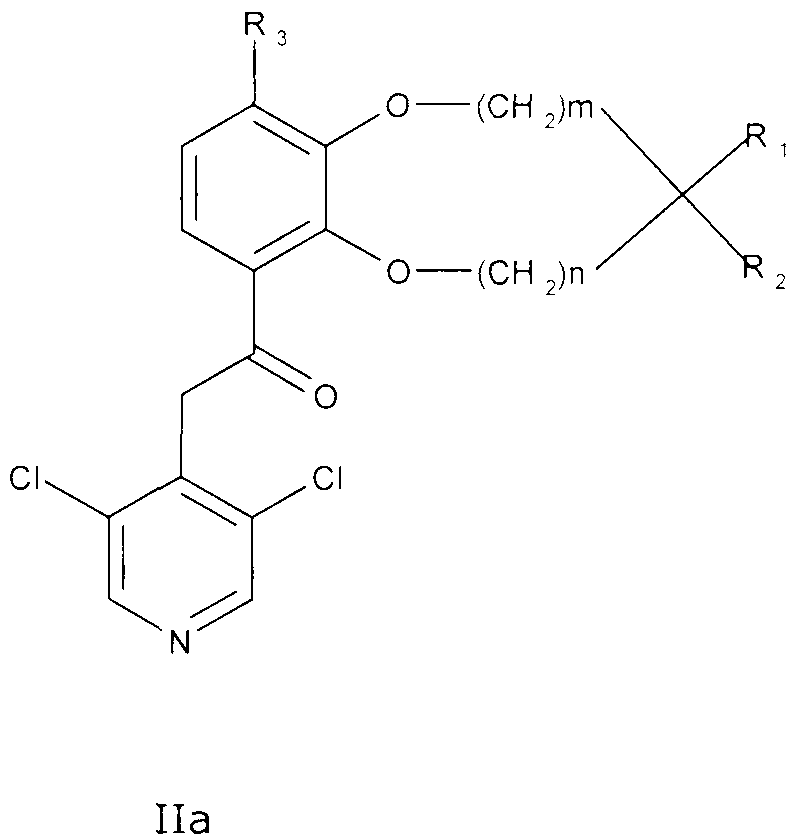
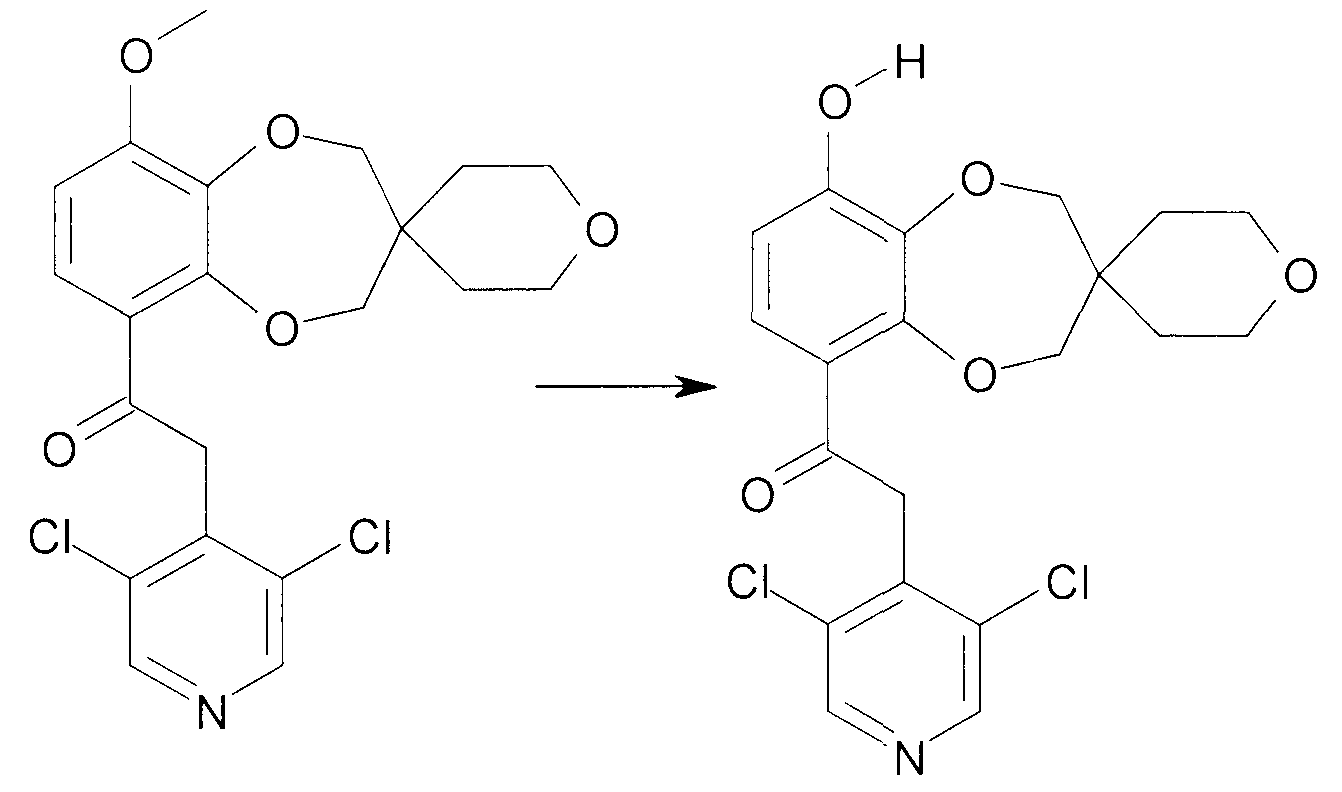
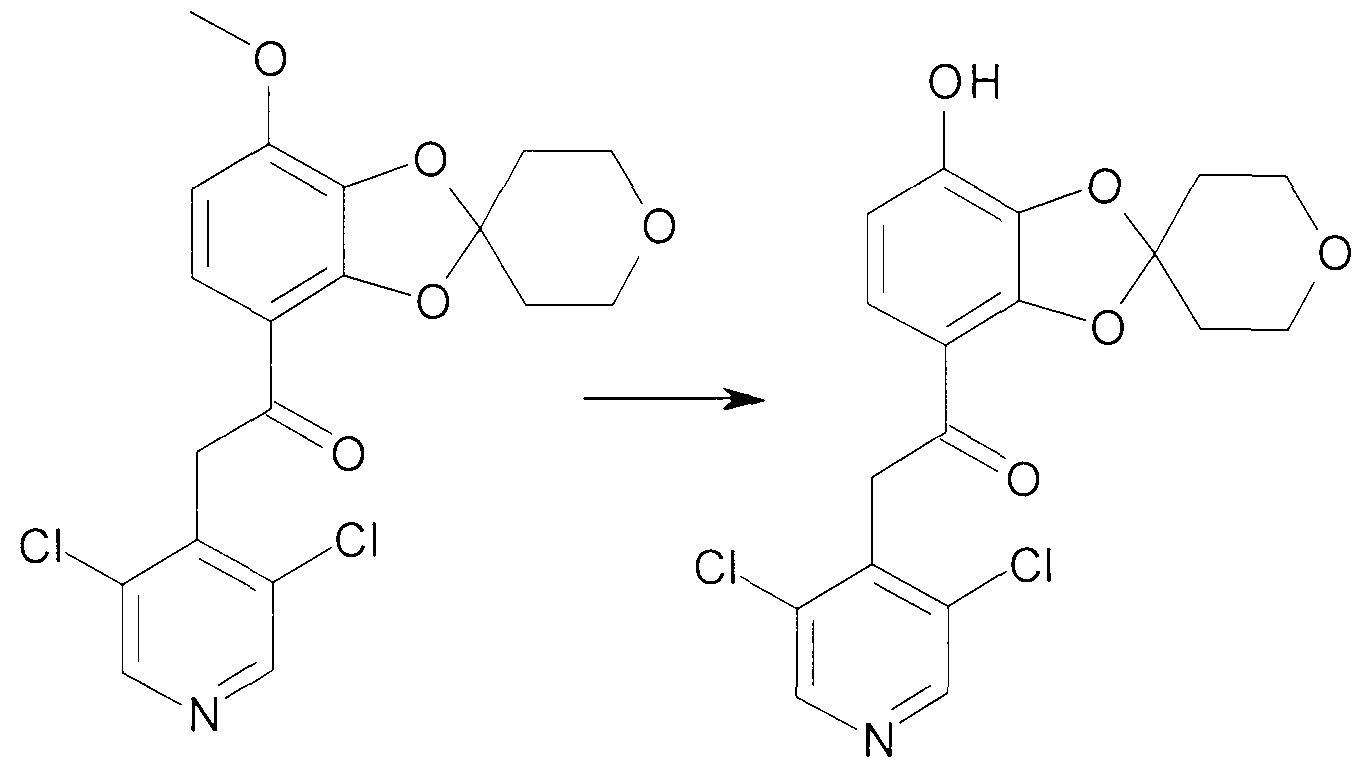
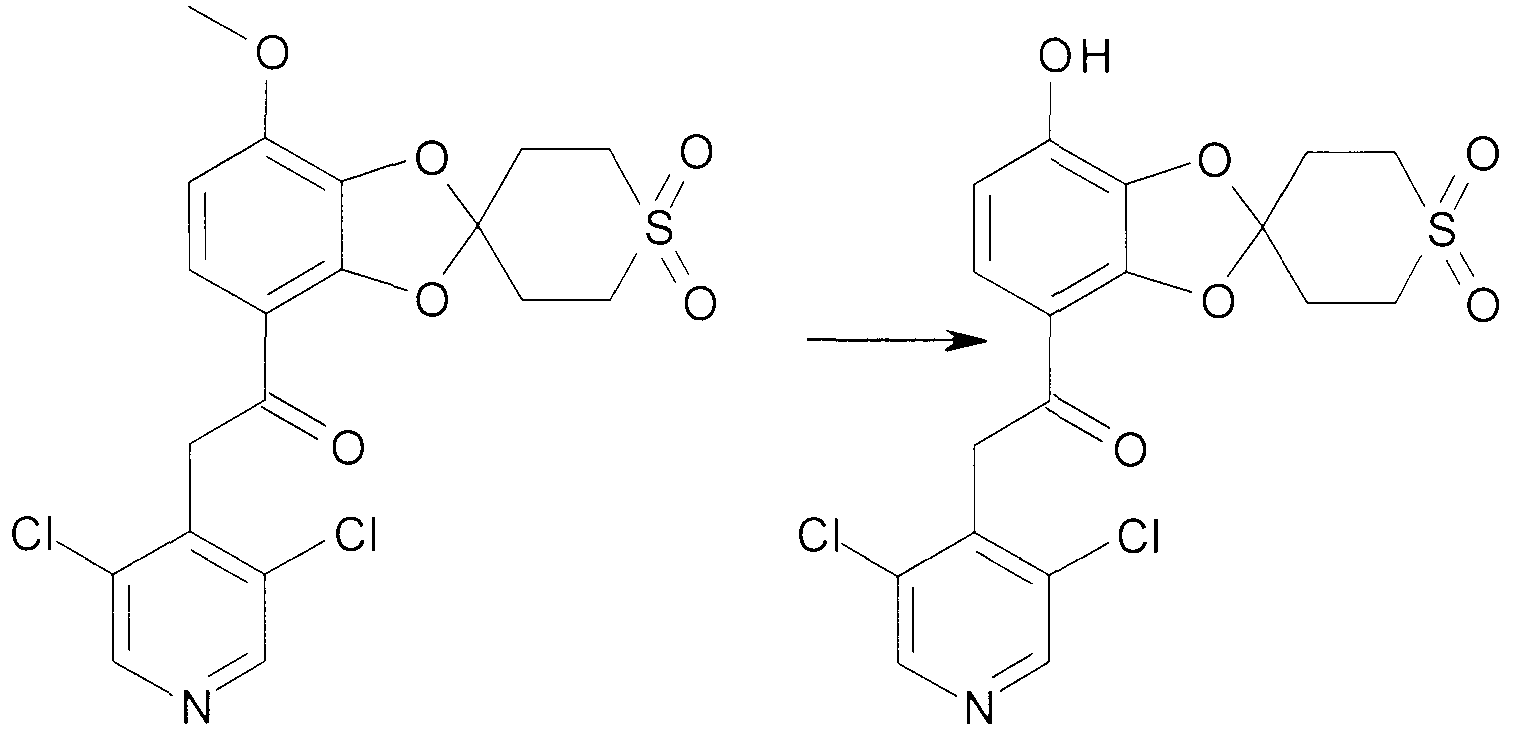
Соединения сходной химической структуры известны из WO 2008/104175. Эти соединения, как правило, известны как быстро метаболизирующиеся и дезактивирующиеся при системном/пероральном введении, поскольку метокси группа (R3=OCH3) расщепляется до гидроксильной группы (R3=OH), как показано в примере 15. Однако в соединениях по настоящему изобретению метаболизм R3 и, следовательно, дезактивация существенно замедлена. Таким образом, например, когда A представляет собой 3,5-дихлорпиридин, соединения формулы IIa метаболизируются до метаболически более стабильного и активного н-оксида (IIb), а когда A представляет собой 3,5-дихлорпиридин-N-оксид, соединения, как правило, являются метаболически стабильными, делая соединения полезными для системного, в частности, перорального введения - смотри пример 15.
В другом аспекте настоящее изобретение относится к соединениям общей формулы I для использования в терапии.
Подробное описание изобретения
Определения
Термин "углеводородный радикал" предназначен для обозначения радикала, содержащего только атомы водорода и углерода, он может содержать одну или несколько двойных и/или тройных связей углерод-углерод и он может содержать циклические остатки в сочетании с разветвленными или линейными остатками. Указанный углеводород содержит 1-20 атомов углерода, а предпочтительно, содержит 1-12, например, 1-6, например, 1-4, например, 1-3, например, 1-2 атома углерода. Термин включает алкил, алкенил, циклоалкил, циклоалкенил, алкинил и арил, арилалкил.
Термин "арил" предназначен для обозначения радикала из ароматических карбоциклических колец, содержащего 6-20 атомов углерода, например, 6-14 атомов углерода, предпочтительно 6-10 атомов углерода, в частности, из 5- или 6-членных колец, необязательно конденсированных карбоциклических колец, по меньшей мере, с одним ароматическим кольцом, таким как фенил, нафтил, инденил и инданил.
Термин "гетероарил" предназначен для обозначения радикалов из гетероциклических ароматических колец, содержащих 1-6 гетероатомов (выбранных из O, S и N) и 1-20 атомов углерода, например, 1-5 гетероатомов и 1-10 атомов углерода, например, 1-5 гетероатомов и 1-6 атомов углерода, например, 1-5 гетероатомов и 1-3 атомов углерода, в частности, из 5- или 6-членных колец с 1-4 гетероатомами, выбранными из O, S и N, или необязательно конденсированных бициклических колец с 1-4 гетероатомами, и где, по меньшей мере, одно кольцо является ароматическим, например, пиридила, хинолила, изохинолила, индолила, тетразолила, тиазолила, имидазолила, пиразолила, оксазолила, изоксазолила, тиенила, пиразинила, изотиазолила, бензимидазолила и бензофуранила.
В настоящем контексте термин "алкил" предназначен для обозначения радикала, полученного, когда один атом водорода удаляют из углеводорода. Указанный алкил содержит 1-20, предпочтительно 1-12, например, 1-6, например, 1-4 атомов углерода. Термин включает подклассы нормального алкила (н-алкил), вторичного и третичного алкила, такого как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, гексил и изогексил.
Термин "циклоалкил" предназначен для обозначения насыщенного циклоалканового радикала, содержащего 3-20 атомов углерода, предпочтительно 3-10 атомов углерода, в частности, 3-8 атомов углерода, например, 3-6 атомов углерода, включая конденсированные бициклические кольца, например, циклопропила, циклобутила, циклопентила, циклогексила или циклогептила.
Термин "гетероциклоалкил" предназначен для обозначения циклоалканового радикала, как описано выше, где один или несколько атомов углерода заменены гетероатомами, содержащего 1-19 атомов углерода, например, 2-4 атомов углерода, дополнительно содержащего 1-6 гетероатомов, предпочтительно 1, 2 или 3 гетероатома, выбранных из O, N или S, который может необязательно быть однократно или двукратно окисленным, например, [1,3]диоксола, оксетана, [1,3]диоксолана, [1,3]диоксана, тетрагидротиопирана, тетрагидротиопиран-1,1-диоксида, тетрагидротиопиран-1-оксида, пиперидина, тетрагидротиофена, [1,3]дитиана, тиетана, [1,3]дитиан-1,3-диоксида или тиетан-1-оксида, или содержащего конденсированные бициклические кольца с 1-4 гетероатомами, где, по меньшей мере, одно кольцо содержит гетероатом, и где другое кольцо может представлять собой, например, карбоциклическое кольцо, например, изоиндолил.
Термин "циклоалкенил" предназначен для обозначения моно-, ди- три- или тетраненасыщенных неароматических циклических углеводородных радикалов, содержащих 3-20 атомов углерода, включая конденсированные бициклические кольца, как правило, содержащих 3-10 атомов углерода, например, 3, 4, или 6 атомов углерода, например, циклопропенила, циклобутенила, циклопентенила, циклогексенила, циклогептенила.
Термин "гетероциклоалкенил" предназначен для обозначения циклоалкенового радикала, как описано выше, где один или несколько атомов углерода заменены гетероатомами, содержащего 1-19 атомов углерода, например, 2-4 атомов углерода, дополнительно содержащего 1-6 гетероатомов, предпочтительно 1, 2 или 3 гетероатома, выбранных из O, N, или S, включая конденсированные бициклические кольца с 1-4 гетероатомами, где, по меньшей мере, одно кольцо содержит гетероатом и где другое кольцо может представлять собой, например, карбоциклическое кольцо, например, дигидрофуранила или 2,5-дигидро-1H-пирролила.
Термин "арилалкил" предназначен для обозначения арильного радикала, как определено выше, ковалентно присоединенного к алкильной группе, например, бензила.
Термин "гетероарилалкил" предназначен для обозначения гетероарильного радикала, как определено выше, ковалентно присоединенного к алкильной группе.
Термин "галоген" предназначен для обозначения заместителя из 7-ой главной группы Периодической таблицы, такого как фтор, хлор, бром и йод.
Термин "галогеналкил" предназначен для обозначения алкильной группы, как определено выше, замещенной одним или несколькими атомами галогена, как определено выше, например, дифторметила.
Термин "гидроксиалкил" предназначен для обозначения алкильной группы, как определено выше, замещенной одной или несколькими гидроксигруппами, например, гидроксиметила, гидроксиэтила, гидроксипропила.
Термин "алкокси" предназначен для обозначения радикала формулы -OR', где R' представляет собой алкил, как показано выше, например, метокси, этокси, н-пропокси, изопропокси, бутокси и тому подобное.
Термин "алкоксикарбонил" предназначен для обозначения радикала формулы -C(O)-O-R', где R' представляет собой алкил, как показано выше, например, метоксикарбонила, этоксикарбонила, н-пропоксикарбонила, изопропоксикарбонила и тому подобное.
Термин "алкилкарбонил" предназначен для обозначения радикала формулы -C(O)-R', где R' представляет собой алкил, как показано выше, например, этаноила, ацетила.
Термин "гетероциклическое кольцо" предназначен для обозначения гетероарила, гетероциклоалкила и гетероциклоалкенила, где один или несколько атомов углерода заменены гетероатомами, содержащего 1-19 атомов углерода, например, 2-4 атомов углерода, дополнительно содержащего 1-6 гетероатомов, предпочтительно 1, 2 или 3 гетероатома, выбранных из O, N, или S, который может быть необязательно однократно или двукратно окисленным, например, [1,3]диоксола, оксетана, [1,3]диоксолана, [1,3]диоксана, тетрагидротиопирана, тетрагидротиопиран-1,1-диоксида, тетрагидротиопиран-1-оксида, пиперидина, тетрагидротиофена, [1,3]-дитиана, тиетана, [1,3]-дитиан-1,3-диоксида или тиетан-1-оксида, или включающего конденсированные бициклические кольца с 1-4 гетероатомами, где, по меньшей мере, одно кольцо содержит гетероатом и где другое кольцо может, например, представлять собой карбоциклическое кольцо, например, изоиндолила.
Термин "фармацевтически приемлемая соль" предназначен для обозначения солей, полученных посредством взаимодействия соединения формулы I с соответствующей неорганической или органической кислотой, такой как хлористоводородная, бромистоводородная, йодистоводородная, серная, азотная, фосфорная, муравьиная, уксусная, 2,2-дихлоруксусная, адипиновая, аскорбиновая, L-аспарагиновая, L-глютаминовая, галактаровая, молочная, малеиновая, L-яблочная, фталевая, лимонная, пропионовая, бензойная, глутаровая, глюконовая, D-глюкуроновая, метансульфоновая, салициловая, янтарная, малоновая, винная, бензолсульфоновая, этан-1,2-дисульфоновая, 2-гидрокси этансульфоновая кислота, толуолсульфоновая, сульфаминовая или фумаровая кислота. Фармацевтически приемлемые соли соединений формулы I могут также быть получены посредством взаимодействия с соответствующим основанием, таким как гидроксид натрия, гидроксид калия, гидроксид магния, гидроксид кальция, гидроксид серебра, аммиак или что-либо подобное, или с соответствующими нетоксичными аминами, такими как низшие алкиламины, например, триэтиламин, гидрокси-низшие алкиламины, например, 2-гидроксиэтиламин, бис-(2-гидроксиэтил)амин, циклоалкиламины, например, дициклогексиламин или бензиламины, например, N,N'-дибензилэтилендиамин и дибензиламин, или с L-аргинином или L-лизином. Соли, полученные посредством взаимодействия с соответствующим основанием, включают, но, не ограничиваясь этим, соли натрия, соли холина, соли 2-(диметиламино)этанола, соли 4-(2-гидроксиэтил)морфолина, соли L-лизина, соли н-(2-гидроксиэтил)пирролидина, соли этаноламина, соли калия, соли тетрабутиламмония, соли бензилтриметиламмония, соли цетилтриметиламмония, соли тетраметиламмония, соли тетрапропиламмония, соли трис(гидроксиметил)аминометана, соли н-метил-D-глюкамина, соли серебра, соли бензетония и соли триэтаноламина.
Термин "сольват" предназначен для обозначения частиц, полученных посредством взаимодействия между соединением, например, соединением формулы I, и растворителем, например, спиртом, глицеролом или водой, где указанные частицы находятся в твердой форме. Когда растворитель представляет собой воду, указанные частицы упоминаются как гидрат.
Варианты осуществления настоящего изобретения
В предпочтительных вариантах осуществления настоящее изобретение относится к соединениям общей формулы I, где X представляет собой -CH2- или -NH-.
В другом варианте осуществления настоящее изобретение относится к соединениям общей формулы IIa
или IIb
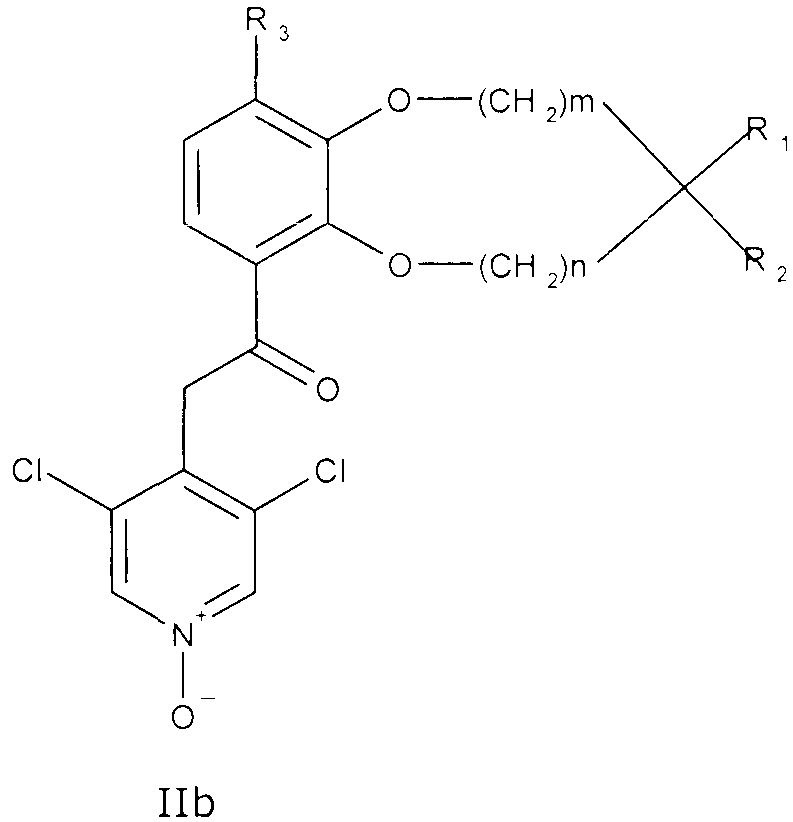
где m, n, R1, R2 и R3 являются такими, как описано выше.
В одном из вариантов осуществления как m, так и n в формуле IIa и IIb равны 0. В другом варианте осуществления как m, так и n в формуле IIa и IIb равны 1.
В одном из вариантов осуществления R3 представляет собой - OCHF2 или -OCF3, например, -OCHF2.
В другом варианте осуществления R3 представляет собой -SCHF2 или -SCF3.
В одном из вариантов осуществления R1 и R2, вместе с атомом углерода, к которому они присоединены, образуют 4-, 5- или 6-членное гетероциклическое кольцо. Гетероциклическое кольцо может содержать один гетероатом, например, выбранный из кислорода или -S(O)2. Конкретные примеры гетероциклического кольца представляют собой тетрагидропиран, оксетан, [1,3]диоксолан, [1,3]диоксан, тетрагидротиопиран, тетрагидротиопиран-1,1диоксид, тетрагидротиопиран-1-оксид, тетрагидротиофен, [1,3]дитиан, тиетан, [1,3]дитиан-1,3-диоксид, тиетан-1-оксид или тиетан-1,1-диоксид.
Конкретные примеры соединений по настоящему изобретению представляют собой:
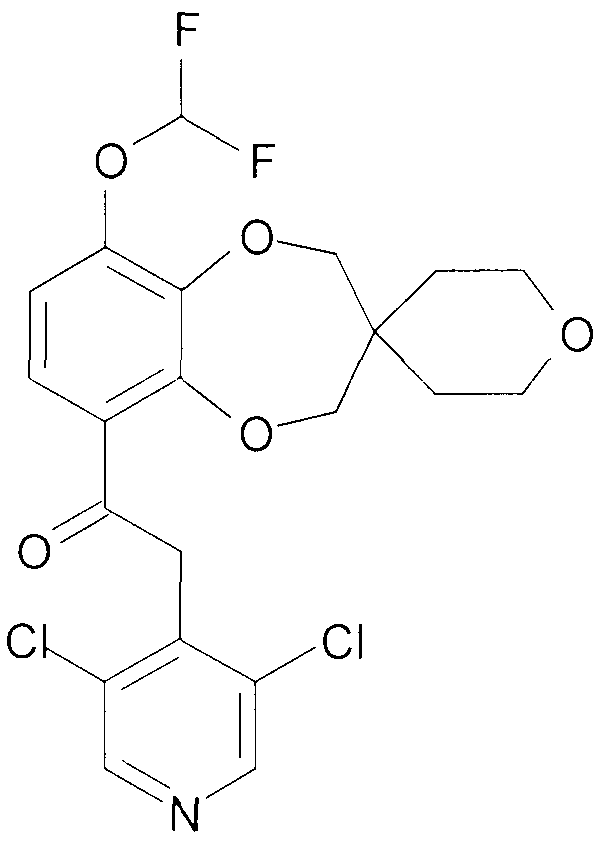
2-(3,5-Дихлорпиридин-4-ил)-1-{9-дифторметокси-спиро[2H-1,5-бензодиоксепин-3(4H),3'-оксетан]-6-ил}этанон (соединение 101)
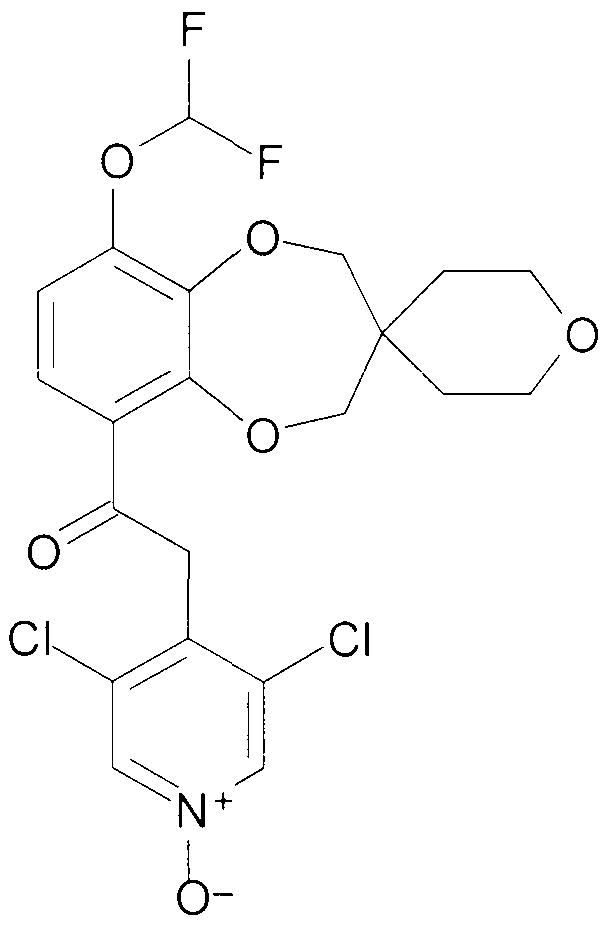
2-(3,5-Дихлор-1-оксидо-пиридин-4-ил)-1-{9-дифторметокси-спиро[2H-1,5-бензодиоксепин-3(4H),3'-оксетан]-6-ил}этанон (соединение 102)
2-(3,5-Дихлорпиридин-4-ил)-1-{9-дифторметокси-спиро[2H-1,5-бензодиоксепин-3(41-1), 4'-тетрагидропиран]-6-ил}этанон (соединение 103)
2-(3,5-Дихлор-1-оксидо-пиридин-4-ил)-1-{9-дифторметокси-спиро[2H-1,5-бензодиоксепин-3(4H),4'-тетрагидропиран]-6-ил}этанон (соединение 104)
2-(3,5-Дихлорпиридин-4-ил)-1-(7-дифторметокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-пиран]-4-ил)этанон (соединение 105)
2-(3,5-Дихлор-1-оксидо-пиридин-4-ил)-1-(7-дифторметокси-2',3',5',6'-терагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-пиран]-4-ил)этанон (соединение 106)
2-(3,5-Дихлорпиридин-4-ил)-1-(7-дифторметокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-тиопиран]-4-ил)этанон (соединение 107)
2-(3,5-Дихлор-1-оксидо-пиридин-4-ил)-1-(7-дифторметокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-тиопиран-1',1'-диоксид]-4-ил)этанон (соединение 108)
2-(3,5-Дихлорпиридин-4-ил)-1-(7-дифторметокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-тиопиран-1',1'-диоксид]-4-ил)этанон (соединение 109)
N-(3,5-Дихлор-4-пиридил)-7-дифторметокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-тиопиран]-4-карбамид (соединение 110)
N-(3,5-дихлор-1-оксо-4-пиридил)-7-(дифторметокси)-1',1'-диоксо-спиро[1,3-бензодиоксол-2,4'-тиан]-4-карбоксамид (соединение 111)
Соединения по настоящему изобретению могут, как правило, иметь молекулярную массу ниже 800 Дальтон, например, ниже 750 Дальтон, например, ниже 700 Дальтон или ниже 650, 600, 550 или 500 Дальтон.
Соединения по настоящему изобретению могут быть получены в кристаллической форме либо непосредственно посредством концентрирования из органического растворителя, либо посредством кристаллизации или перекристаллизации из органического растворителя или смеси указанного растворителя и сорастворителя, который может быть органическим или неорганическим, таким как вода. Кристаллы могут быть выделены по существу в не содержащей растворителя форме или как сольват, такой как гидрат. Настоящее изобретение охватывает все кристаллические модификации и формы, а также их смеси.
Соединения по настоящему изобретению могут содержать или не содержать асимметрично замещенные (хиральные) атомы углерода, которые приводят к существованию изомерных форм, например энантиомеров и, возможно, диастереомеров. Настоящее изобретение относится ко всем таким изомерам либо в чистой форме, либо в виде их смеси (например, рацематы). Чистые стереоизомерные формы соединений и промежуточных соединений по настоящему изобретению могут быть получены посредством применения процедур, известных в данной области. Различные изомерные формы могут быть разделены с помощью физических методов разделения, таких как селективная кристаллизация и с помощью хроматографических методик, например жидкостной хроматографии с использованием хиральных неподвижных фаз. Энантиомеры могут быть отделены друг от друга посредством селективной кристаллизации их диастереомерных солей с оптически активными аминами, такими как l-эфедрин. Альтернативно, энантиомеры могут быть отделены с помощью хроматографических технологий с использованием хиральных неподвижных фаз. Указанные чистые стереоизомерные формы могут также быть получены из соответствующих чистых стереоизомерных форм соответствующих исходных материалов, при условии, что реакция происходит стереоселективно или стереоспецифично. Является предпочтительным, если желаемым является конкретный стереоизомер, что указанное соединение будет синтезироваться с помощью стереоселективных или стереоспецифичных способов получения. Эти способы будут преимущественно использовать хиральные чистые исходные материалы.
Соединения по настоящему изобретению, необязательно, в комбинации с другими активными соединениями, могут быть полезными для лечения кожных заболеваний или состояний, или острых или хронических расстройств с повреждениями кожи, в частности для лечения пролиферативных и воспалительных расстройств кожи, псориаза, рака, воспаления эпидермиса, облысения, атрофии кожи, атрофии кожи, вызываемой стероидами, старения кожи, фотостарения кожи, акне, дерматита, атопического дерматита, себорейного дерматита, контактного дерматита, крапивницы, прурита и экземы.
Кроме того, что они полезны для лечения людей, соединения по настоящему изобретению могут быть также полезными для ветеринарного лечения животных, включая млекопитающих, таких как лошади, крупный рогатый скот, овцы, свиньи, собаки и кошки.
Для применения в терапии соединения по настоящему изобретению, как правило, находятся в форме фармацевтической композиции. Следовательно, настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы Ia или Ib, необязательно, вместе с одним или несколькими другими терапевтически активными соединениями, вместе с фармацевтически приемлемым эксципиентом или связующим. Эксципиент должен быть "приемлемым", то есть быть совместимым с другими ингредиентами композиций и не вредным для того, кто ее принимает.
Удобно, чтобы активный ингредиент составлял 0,05-99,9% масс препарата.
В виде единичной дозированной формы соединение может вводиться один или несколько раз в день через соответствующие интервалы, всегда зависящие, однако, от состояния пациента, и согласно предписанию, которое делает лечащий врач. Удобно, чтобы единичная дозированная форма препарата содержала в пределах между 0,1 мг и 1000 мг, предпочтительно, в пределах между 1 мг и 100 мг, например, 5-50 мг соединения формулы I.
Соответствующая дозировка соединения по настоящему изобретению будет зависеть, среди прочего, от возраста и состояния пациента, от тяжести заболевания, которое должно лечиться, и от других факторов, хорошо известных практикующему врачу. Соединение может вводиться либо перорально, либо парентерально, либо местным образом в соответствии с различными временными графиками дозирования, например, ежедневно или с недельными интервалами. Как правило, одна доза будет составлять в пределах от 0,01 до 400 мг/кг массы тела. Соединение может вводиться как болюс (то есть вся ежедневная доза вводится за один раз) или в разделенных дозах два или более раз в день.
В контексте местного лечения может быть более приемлемым упоминание "используемой единичной дозы", которая означает отдельную дозу, которую можно вводить пациенту и которая может быть удобной при обращении и упаковке, которая остается в виде физически и химически стабильной отдельной дозы, содержащей либо активный материал сам по себе, либо его смесь с твердыми или жидкими фармацевтическими разбавителями или носителями.
Термин "используемая единичная доза" в сочетании с местным применением означает унитарную, то есть отдельную дозу, которую можно вводить местным образом пациенту при нанесении на квадратный сантиметр инфицированной площади от 0,1 мг до 10 мг, а предпочтительно от 0,2 мг до 1 мг рассматриваемого активного ингредиента.
Предусматривается также, что в определенных режимах лечения может быть выгодным введение через более продолжительные интервалы, например через день, каждую неделю или через еще более продолжительные интервалы.
Если лечение включает введение другого терапевтически активного соединения, рекомендуется проконсультироваться с Goodman & Gilman's The Pharmacological Basis of Therapeutics, 9th Ed., J.G. Hardman and L.E. Limbird (Eds.), McGraw-Hill 1995, относительно полезных дозировок указанных соединений.
Введение соединения по настоящему изобретению вместе с одним или несколькими другими активными соединениями может осуществляться либо одновременно, либо последовательно.
Препараты включают, например препараты в форме, пригодной для перорального (включая замедленное или распределенное по времени высвобождение), ректального, парентерального (включая подкожное, внутрибрюшинное, внутримышечное, внутрисуставное и внутривенное), трансдермального, офтальмического, местного, дермального, назального или буккального введения. Местное введение заявляемого препарата является особенно пригодным для применения.
Препараты могут удобно быть представлены в стандартной дозированной форме и могут быть получены с помощью любого из способов, хорошо известных в области фармации, например, как описано в Remington, The Science and Practice of Pharmacy, 20th ed., 2000. Все способы включают стадию приведения активного ингредиента в ассоциацию с носителем, который составляет один или несколько вспомогательных ингредиентов. Как правило, препараты приготавливают с помощью приведения активного ингредиента в однородную и мелкодисперсную ассоциацию с жидким носителем или мелкодисперсным твердым носителем, или как с тем, так с другим, а затем, если это необходимо, формования продукта в виде желаемого препарата.
Препараты по настоящему изобретению, пригодные для перорального введения, могут находиться в форме отдельных единиц, таких как капсулы, саше, таблетки или пастилки, каждая из них содержит заданное количество активного ингредиента; в форме порошка или гранул; в форме раствора или суспензии в водной жидкости или неводной жидкости, такой как этанол или глицерин; или в форме эмульсии типа масло-в-воде, или эмульсии типа вода-в-масле. Такие масла могут представлять собой съедобные масла, такие, например, как хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло. Пригодные для использования диспергирующие или суспендирующие агенты для водных суспензий включают синтетические или природные смолы, такие как смола трагаканта, альгинат, смола акации, декстран, натрий карбоксиметилцеллюлоза, желатин, метилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, карбомеры и поливинилпирролидон. Активные ингредиенты также могут вводиться в форме болюса, электуария или пасты.
Таблетка может быть изготовлена посредством прессования или формования активного ингредиента необязательно вместе с одним или несколькими вспомогательными ингредиентами. Прессованные таблетки могут быть получены посредством прессования в соответствующей машине активного ингредиента (ингредиентов) в сыпучей форме, такой как порошок или гранулы, необязательно смешанного со связующим веществом, таким, например, как лактоза, глюкоза, крахмал, желатин, смола акации, смола трагаканта, альгинат натрия, карбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, полиэтиленгликоль, воски или что-либо подобное; лубрикантом, таким, например, как олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия, или что-либо подобное; с дезинтегрантом, таким, например, как крахмал, метилцеллюлоза, агар, бентонит, натрий кроскармелоза, натрий крахмал гликолят, кросповидон, или что-либо подобное, или с диспергирующим агентом, таким как полисорбат 80.
Формованные таблетки могут быть получены посредством формования, в соответствующей машине, смеси порошкообразного активного ингредиента и соответствующего носителя, увлажненного инертным жидким разбавителем.
Препараты для ректального введения могут находиться в форме суппозиториев, в которых соединение по настоящему изобретению смешивают с имеющими низкую температуру плавления водорастворимыми или нерастворимыми твердыми продуктами, такими как масло какао, гидрированные растительные масла, полиэтиленгликоль или сложные эфиры жирных кислот и полиэтиленгликолей, в то время как эликсиры могут быть получены с использованием миристилпальмитата.
Удобно, чтобы препараты, пригодные для парентерального введения, содержали стерильный масляный или водный препарат активных ингредиентов, который предпочтительно является изотоничным с кровью пациента, например изотонический солевой раствор, изотонический раствор глюкозы или буферный раствор. Препарат может быть удобным стерилизовать, например, посредством фильтрования через фильтр, удерживающий бактерии, добавления к препарату стерилизирующего агента, облучения препарата или нагрева препарата. Липосомные препараты, как описано, например, в Encyclopedia of Pharmaceutical Technology, vol.9, 1994, также являются пригодными для парентерального введения.
Альтернативно, соединения формулы I могут быть представлены как стерильный, твердый препарат, например порошок, полученный сушкой вымораживанием, который легко растворяется в стерильном растворителе непосредственно перед использованием.
Трансдермальные препараты могут находиться в форме пластыря или повязки.
Препараты, пригодные для офтальмического введения, могут находиться в форме стерильного водного препарата активных ингредиентов, который может находиться в микрокристаллической форме, например в форме водной микрокристаллической суспензии. Липосомные препараты или биодеградируемые полимерные системы, например, как описано в Encyclopedia of Pharmaceutical Technology, vol.2, 1989, также могут использоваться, чтобы представить активный ингредиент для офтальмического введения.
Препараты, пригодные для местного или офтальмического введения, включают жидкие или полужидкие препараты, такие как линименты, лосьоны, гели, спреи, пены, эмульсии типа масло-в-воде или типа вода-в-масле, такие как кремы, мази или пасты; или растворы или суспензии, такие как капли. Композиции для офтальмического лечения могут предпочтительно дополнительно содержать циклодекстрин.
Для местного введения соединение формулы I может, как правило, присутствовать в количестве от 0,01 до 20% масс. композиции, например, 0,1% примерно до 10%, но может также присутствовать в количестве примерно до 50% композиции.
Препараты, пригодные для назального или буккального введения, включают порошок, самораспыляемые и распыляемые препараты, такие как аэрозоли и атомайзеры. Такие препараты описаны более подробно, например, в Modern Pharmaceutics, 2nd ed., G.S. Banker and C.T. Rhodes (Eds.), page 427-432, Marcel Dekker, New York; Modern Pharmaceutics, 3th ed., G.S. Banker and C.T. Rhodes (Eds.), page 618-619 and 718-721, Marcel Dekker, New York и в Encyclopedia of Pharmaceutical Technology, vol. 10, J. Swarbrick and J.C. Boylan (Eds), page 191-221, Marcel Dekker, New York.
В дополнение к указанным выше ингредиентам, препараты соединения формулы I могут включать один или несколько дополнительных ингредиентов, таких как разбавители, буферы, ароматизирующие агенты, краситель, поверхностно-активные агенты, загущающие агенты, консерванты, например, метилгидроксибензоат (включая антиоксиданты), эмульгирующие агенты и тому подобное.
Когда активный ингредиент вводится в форме солей с фармацевтически приемлемыми нетоксичными кислотами или основаниями, предпочтительные соли являются, например, легко водорастворимыми или чуть растворимыми в воде для получения конкретной и соответствующей скорости поглощения.
Фармацевтическая композиция может дополнительно содержать один или несколько других активных компонентов, обычно используемых при лечении кожных заболеваний или состояний, например, выбранных из группы, состоящей из глюкокортикоидов, витамина D и аналогов витамина D, антигистаминных препаратов, антагонистов фактора активации тромбоцитов (PAF), антихолинергических агентов, метилксантинов, β-адренергических агентов, ингибиторов COX-2, салицилатов, индометацина, флуфенамата, напроксена, тимегадина, солей золота, пеницилламина, агентов, понижающих уровень холестерина в сыворотке, ретиноидов, солей цинка, салицилазосульфапиридина и ингибиторов кальцинурина.
Настоящее изобретение описывается более подробно в следующих далее примерах, которые ни в коем случае не предназначены для ограничения объема настоящего изобретения согласно формуле изобретения.
Способы получения
Соединения по настоящему изобретению могут быть получены рядом способов, хорошо известных специалистам в области синтеза. Соединения формулы I могут, например, быть получены с использованием реакций и технологий, приведенных ниже, вместе со способами, известными в области синтетической органической химии, или их вариантов, как ясно специалисту в данной области. Предпочтительные способы включают, но, не ограничиваясь этим, те, которые описаны ниже. Реакции осуществляют в растворителях, соответствующих используемым реагентам и материалам и пригодных для осуществляемых преобразований. Также необходимо понять, что в способах синтеза, описанных ниже, все предлагаемые условия реакции, включая выбор растворителя, атмосферы реакции, температуры реакции, продолжительности эксперимента и процедур извлечения осуществляют для получения условий, стандартных для этой реакции, которые должны быть очевидны специалистам в данной области. Не все соединения, попадающие в данный класс, могут быть совместимыми с некоторыми из условий реакции, необходимых в некоторых из описываемых способов. Такие ограничения на заместители, которые являются совместимыми с условиями реакции, будут легко понятны специалистам в данной области, и можно использовать альтернативные способы.
Исходные материалы либо представляют собой известные соединения, которые являются коммерчески доступными, либо они могут быть получены с помощью рутинных способов синтеза, хорошо известных специалистам в данной области.
Соединения по настоящему изобретению или любое промежуточное соединение могут быть очищены, по необходимости, с использованием стандартных способов, хорошо известных специалистам в области синтетической органической химии, например, способов, описанных в "Purification of Laboratory Chemicals", 5th ed. 2003. Исходные материалы либо представляют собой известные коммерчески доступные соединения, либо они могут быть получены с помощью рутинных способов синтеза, хорошо известных специалистам в данной области.
Общие процедуры, примеры приготовления и примеры
Спектры 1H ядерного магнитного резонанса (ЯМР) регистрируют при 300 МГц, а спектры 13C ЯМР - при 75,6 МГц. Значения химического сдвига (δ, в м.д.) приводятся в указанном растворителе по отношению к внутреннему стандарту тетраметилсилану (δ=0,00) или хлороформу (δ=7,25), или к дейтерированному хлороформу (δ=76,81 для 13C ЯМР). Приводится значение мультиплета, либо определенного дублета (д), триплета (т), квартета (кв), либо нет (м) в примерной средней точке, если не указан диапазон, (ушир. с) обозначает уширенный синглет. Используемые органические растворители обычно являются безводными. Хроматографию осуществляют на силикагеле 60 Merck (0,040-0,063 мм). Указанные отношения растворителей относятся к объем:объем, если не указано иное.
В описании используют следующие аббревиатуры:
|
Препаративная ВЭЖХ/МС
Препаративную ВЭЖХ/МС осуществляют на системе Dionex APS с двумя препаративными насосами Shimadzu PP150 и масс-спектрометром Thermo MSQ Plus. Колонка: Waters XTerra C-18, 150 мм × 19 мм, 5 мкм; система растворителей: A = вода (0,1% муравьиной кислоты) и B = ацетонитрил (0,1% муравьиной кислоты); скорость потока = 18 мл/мин; способ (10 мин): способ с линейным градиентом, изменяющимся от 10% B до 100% B за 6 минут, и с выдерживанием при 100% B в течение еще 2 минут. Фракции собирают на основе ионных следов соответствующих ионов и сигнала PDA (высокочувствительного фотоприемника) (240-400 нм).
Аналитическая ВЭЖХ/МС
Способ A: Аналитическую ВЭЖХ/МС осуществляют на системе Dionex APS с аналитическим насосом P680A и масс-спектрометром Thermo MSQ Plus. Колонка: Waters XTerra C-18, 150 мм × 4,6 мм, 5 мкм; система растворителей: A = вода (0,1% муравьиной кислоты) и B = ацетонитрил (0,1% муравьиной кислоты); скорость потока = 1,0 мл/мин; способ (10 мин): способ с линейным градиентом, изменяющимся от 10% B до 100% B за 6,6 минут, и с выдерживанием при 100% B в течение еще 1,5 минут.
Способ B: Аналитическую ВЭЖХ/МС осуществляют на системе, состоящей из Waters 2795 HPLC, масс-спектрометра Micromass ZQ, Waters 996 PDA. Колонка: Waters XTerra C-18, 50 мм × 3,0 мм, 5 мкм; система растворителей: A = вода:ацетонитрил 95:5 (0,05% муравьиной кислоты) и B = ацетонитрил (0,05% муравьиной кислоты); скорость потока = 1,0 мл/мин; способ (8 мин): способ с линейным градиентом, изменяющимся от 10% B до 100% B за 6,0 минут, и с выдерживанием при 100% B в течение 1 минуты.
Общая процедура получения
Соединения по настоящему изобретению могут, например, быть получены следующим образом. Соединения общей формулы IIa и IIb, где n, m, R1, R2 являются такими, как определено выше, и R3=OCF2H, могут быть получены следующим образом:
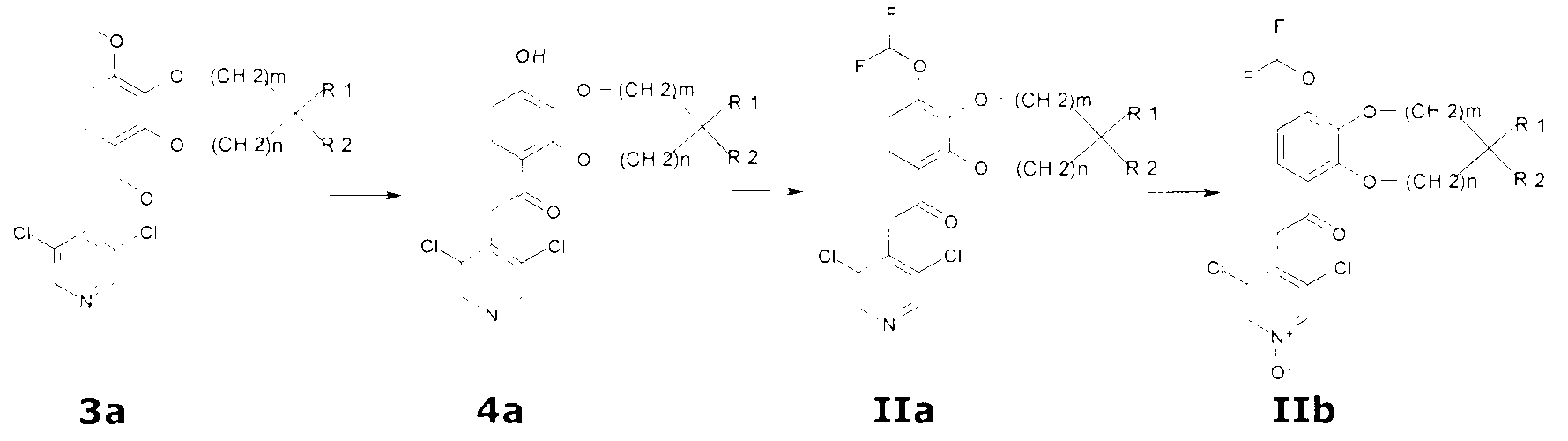
Исходные материалы формулы 3a получают в соответствии со стандартными процедурами, известными специалистам в данной области (WO 2008/104175). Селективное деалкилирование 3a с использованием сернистого нуклеофила, например трет-додецилмеркаптана, дает 4a.
Взаимодействие соединений формулы 4a с натрий хлордифторацетатом в присутствии основания, например K2CO3, в соответствующем растворителе, таком как DMF, при температурах от комнатной температуры до 140°C дает соединения формулы IIa.
Окисление IIa с помощью 3-хлорпербензойной кислоты или смеси H2O2/метилтриоксорений (VII) в соответствующем растворителе, таком как DCM, дает соединения общей формулы IIb.
Соединения общей формулы I, где X=-NH-, могут, например, быть получены, как описано в WO 2008/104175, который тем самым включается в качестве ссылки и, как описано в примере 10 и в примере 11, в настоящей заявке.
Получение 1
2-(3,5-Дихлорпиридин-4-ил)-1-{9-гидрокси-спиро[2H-1,5-бензодиоксепин-3(4H),3'-оксетан]-6-ил}этанон (соединение 401)
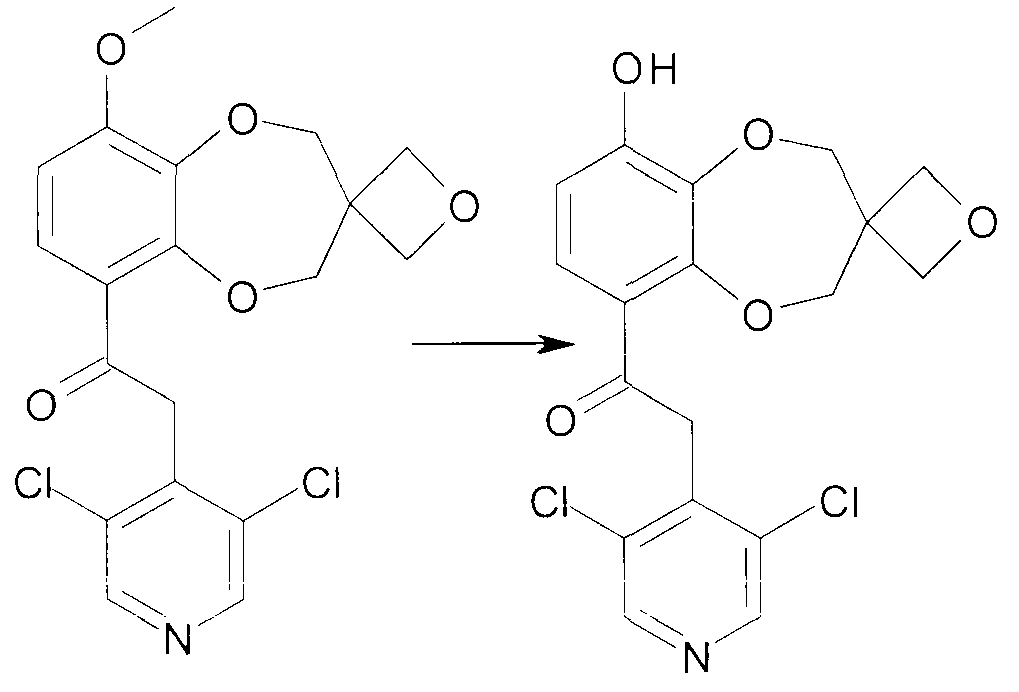
К раствору 2-(3,5-дихлорпиридин-4-ил)-1-{9-метокси-спиро[2H-1,5-бензодиоксепин-3(4H),3'-оксетан]-6-ил}этанона (272 мг, 0,7 ммоль) в безводном DMF (4 мл) добавляют K2CO3 (916 мг, 7 ммоль) и трет-додецилмеркаптан (3,12 мл, 13 ммоль). Смесь нагревают при перемешивании при 140°C в герметичной пробирке в течение 16 часов. Смеси дают возможность охладиться до комнатной температуры и добавляют воду (20 мл). После нейтрализации с помощью 4 н. HCl смесь экстрагируют DCM. Объединенную органическую фазу промывают насыщенным раствором соли, сушат над MgSO4 и выпаривают досуха при пониженном давлении. Хроматография дает продукт 401.
1Η ЯМР (300 МГц, DMSO) δ 8,65 (с, 2H), 7,36 (д, J=8,8 Гц, 1H), 6,68 (д, J=8,8 Гц, 1H), 4,64 (с, 2H), 4,54 (с, 2H), 4,53-4,42 (м, 4H), 4,33 (с, 2H).
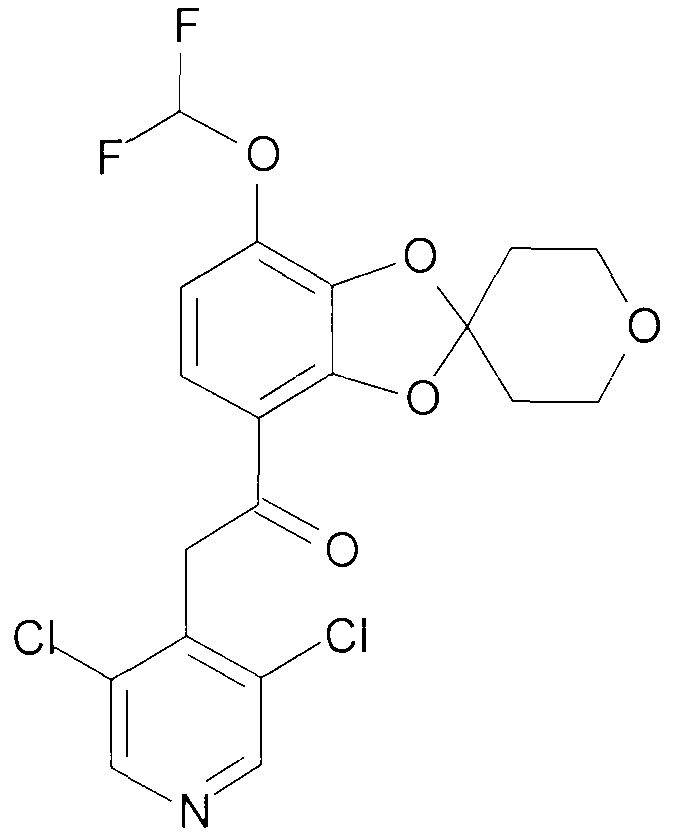
Пример 1
2-(3,5-Дихлорпиридин-4-ил)-1-{9-дифторметокси-спиро[2H-1,5-бензодиоксепин-3(4H),3'-оксетан]-6-ил}этанон (соединение 101)
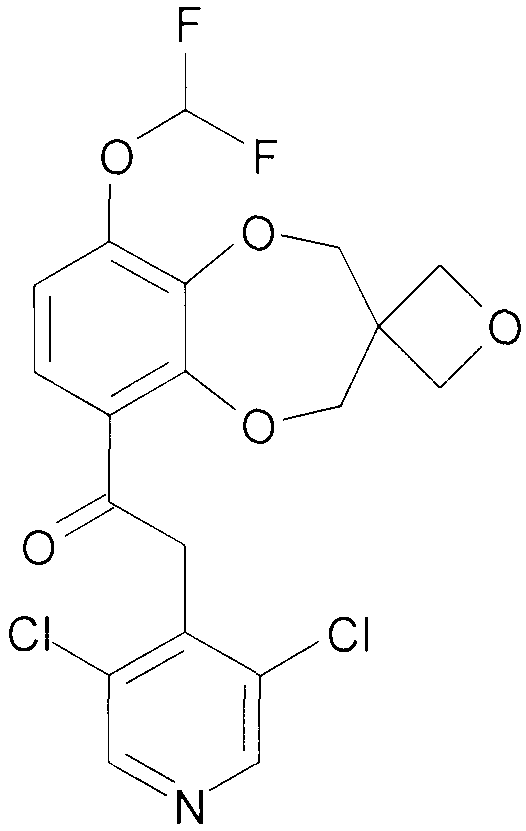
К раствору 2-(3,5-дихлорпиридин-4-ил)-1-{9-гидрокси-спиро[2H-1,5-бензодиоксепин-3(4H),3'-оксетан]-6-ил}этанона [401] (1,66 г, 4,2 ммоль) в DMF (12 мл) и воде (1,3 мл) добавляют K2CO3 (1,45 г, 10,5 ммоль) и натрий хлордифторацетат (1,28 г, 8,4 ммоль). Смесь нагревают в атмосфере аргона при перемешивании при 100°C в герметичной пробирке в течение 1,5 часа. Дополнительно добавляют 950 мг натрия хлордифторацетата, и нагрев продолжают в течение 1 часа. Дополнительно добавляют 950 мг натрия хлордифторацетата и 1,45 г K2CO3, нагрев продолжают в течение 5 часов. Дополнительно добавляют 950 мг натрия хлордифторацетата и 1,45 г K2CO3, нагрев продолжают в течение 2 часов. Смеси дают возможность охладиться до комнатной температуры, добавляют воду (200 мл) и pH доводят до 3, используя 4 н. HCl. Смесь экстрагируют DCM, и объединенную органическую фазу промывают насыщенным раствором соли, сушат над MgSO4 и выпаривают досуха при пониженном давлении. Хроматография дает 793 мг продукта 101.
1H ЯМР (300 МГц, CDCl3) δ 8,51 (с, 2H), 7,46 (д, J=8,7 Гц, 1H), 6,96 (д, J=8,7 Гц, 1H), 6,64 (т, J=74 Гц, 1H), 4,68-4,56 (м, 8H), 4,56-4,46 (ушир. с, 2H).
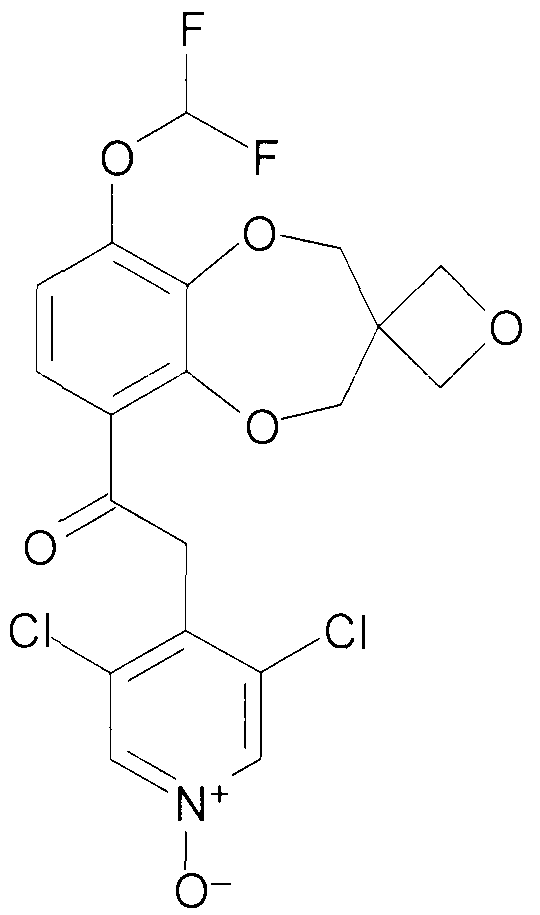
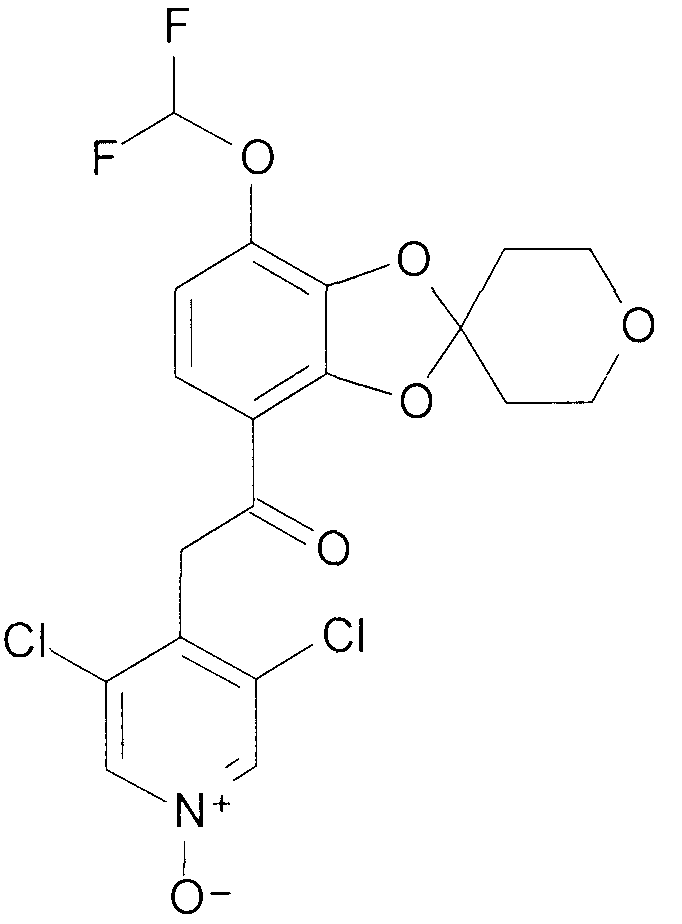
Пример 2
2-(3,5-Дихлор-1-оксидо-пиридин-4-ил)-1-{9-дифторметокси-спиро[2H-1,5-бензодиоксепин-3(4H),3'-оксетан]-6-ил}этанон (соединение 102)
К раствору 2-(3,5-дихлорпиридин-4-ил)-1-{9-дифторметокси-спиро[2H-1,5-бензодиоксепин-3(4H),3'-оксетан]-6-ил}этанона [101] (792 мг, 1,8 ммоль) в DCM (15 мл) добавляют 3-хлорпербензойную кислоту (1,2 г, 7 ммоль), и смесь перемешивают при комнатной температуре в течение 4 часов. Дополнительно добавляют 3-хлорпербензойную кислоту (0,6 г, 3,5 ммоль) и перемешивание продолжают в течение 16 часов. Реакционную смесь промывают Na2CO3 и впоследствии - насыщенным раствором соли, сушат над MgSO4 и выпаривают досуха при пониженном давлении.
Хроматография дает почти чистый продукт, который впоследствии суспендируют в EtOAc и отфильтровывают с получением 464 мг 102.
1H ЯМР (300 МГц, CDCl3) δ 8,22 (с, 2H), 7,47 (д, J=8,8 Гц, 1H), 6,97 (д, J=8,8 Гц, 1H), 6,63 (т, J=74 Гц, 1H), 4,70- 4,59 (м, 6H), 4,56 (ушир. с, 2H), 4,52 (ушир. с, 2H).
Получение 2
2-(3,5-Дихлорпиридин-4-ил)-1-{9-гидрокси-спиро[2H-1,5-бензодиоксепин-3(4H),4'-тетрагидропиран]-6-ил}этанон (соединение 402)
К раствору 2-(3,5-дихлорпиридин-4-ил)-1-{9-метокси-спиро[2H-1,5-бензодиоксепин-3(4H),4'-тетрагидропиран]-6-ил}этанона (351 мг, 0,8 ммоль) в безводном DMF (6 мл) добавляют K2CO3 (1,1 г, 8 ммоль) и трет-додецилмеркаптан (3,8 мл, 16 ммоль). Смесь нагревают при перемешивании при 140°C в герметичной пробирке в течение 22 часов. Смеси дают возможность охладиться до комнатной температуры и добавляют воду. После нейтрализации с помощью 4 н. HCl смесь экстрагируют DCM (2×50 мл). Объединенную органическую фазу экстрагируют дважды 2 н NaOH. Водную фазу дважды промывают DCM, нейтрализуют с помощью 4 н. HCl и в заключение экстрагируют DCM. Органическую фазу промывают насыщенным раствором соли, сушат над MgSO4 и выпаривают досуха при пониженном давлении. Хроматография дает продукт 402 в виде желтого порошка (118 мг)
1H ЯМР (300 МГц, CDCl3) δ 8,49 (с, 2H), 7,51 (д, J=8,8 Гц, 1H), 6,70 (д, J=8,8 Гц, 1H), 6,30 (с, 1H), 4,60 (с, 2H), 4,27 (с, 2H), 4,21 (с, 2H), 3,91-3,55 (м, 4H), 1,76 (т, J=5,5 Гц, 4H).
Пример 3
2-(3,5-Дихлорпиридин-4-ил)-1-{9-дифторметокси-спиро[2H-1,5-бензодиоксепин-3(4H),4'-тетрагидропиран]-6-ил}этанон (соединение 103)
К раствору 2-(3,5-дихлорпиридин-4-ил)-1-{9-гидрокси-спиро[2H-1,5-бензодиоксепин-3(4H),4'-тетрагидропиран]-6-ил}этанона [402] (118 мг, 0,28 ммоль) в безводном DMF (6 мл) добавляют K2CO3 (76 мг, 0,55 ммоль) и натрий хлордифторацетат (84 мг, 0,55 ммоль). Смесь нагревают в атмосфере аргона при перемешивании при 100°C в герметичной пробирке в течение 1,5 часа. Дополнительно добавляют K2CO3 (76 мг, 0,55 ммоль) и натрий хлордифторацетат (84 мг, 0,55 ммоль), и перемешивание продолжают при 80°C в течение 6 часов. Смеси дают возможность охладиться до комнатной температуры, добавляют воду, и смесь нейтрализуют, используя 4 н. HCl. Смесь экстрагируют DCM, и объединенную органическую фазу промывают насыщенным раствором соли, сушат над MgSO4 и выпаривают досуха при пониженном давлении. Хроматография дает 40 мг продукта 103.
1H ЯМР (300 МГц, CDCl3) δ 8,50 (с, 2H), 7,44 (д, J=8,7 Гц, 1H), 6,91 (д, J=8,7 Гц, 1H), 6,63 (т, J=74 Гц, 1H), 4,62 (с, 2H), 4,27 (с, 2H), 4,22 (с, 2H), 3,87-3,58 (м, 4H), 1,85-1,62 (м, 4H).
Пример 4
2-(3,5-Дихлор-1-оксидо-пиридин-4-ил)-1-{9-дифторметокси-спиро[2H-1,5-бензодиоксепин-3(4H),4'-тетрагидропиран]-6-ил}этанон (соединение 104)
К раствору 2-(3,5-дихлорпиридин-4-ил)-1-{9-дифторметокси-спиро[2H-1,5-бензодиоксепин-3(4H),4'-тетрагидропиран]-6-ил}этанона [103] (37 мг, 0,08 ммоль) в DCM (3 мл) добавляют 3-хлорпербензойную кислоту (54 мг, 0,3 ммоль), и смесь перемешивают при комнатной температуре в течение 16 часов. Дополнительно добавляют 3-хлорпербензойную кислоту (27 мг, 0,18 ммоль), и перемешивание продолжают в течение 5 часов. Реакционную смесь промывают Na2CO3, а впоследствии - насыщенным раствором соли, сушат над MgSO4 и выпаривают досуха при пониженном давлении. Хроматография дает 33 мг продукта 104.
1H ЯМР (600 МГц, CDCl3) δ 8,21 (с, 2H), 7,45 (д, J=8,8 Гц, 1H), 6,93 (д, J=8,7 Гц, 1H), 6,64 (т, J=74 Гц, 1H), 4,55 (с, 2H), 4,28 (с, 2H), 4,24 (с, 2H), 3,86-3,61 (м, 4H), 1,89-1,64 (м, 4H).
Получение 3
2-(3,5-Дихлорпиридин-4-ил)-1-(7-гидрокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-пиран]-4-ил)этанон (соединение 403)
К раствору 2-(3,5-дихлорпиридин-4-ил)-1-(7-метокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-пиран]-4-ил)этанона (325 мг, 0,8 ммоль) в безводном DMF (5 мл) добавляют K2CO3 (1,1 г, 8 ммоль) и трет-додецилмеркаптан (3,7 мл, 16 ммоль). Смесь нагревают при перемешивании при 140°C в герметичной пробирке в течение 16 часов. Смеси дают возможность охладиться до комнатной температуры и добавляют воду. После нейтрализации с помощью 4 н. HCl смесь экстрагируют DCM (2×50 мл). Объединенную органическую фазу экстрагируют дважды 2 н. NaOH. Водную фазу промывают дважды DCM, нейтрализуют с помощью 4 н. HCl и в заключение экстрагируют DCM (3×75 мл). Органическую фазу сушат над MgSO4 и выпаривают досуха при пониженном давлении. Хроматография дает продукт 403 в виде белого порошка (192 мг).
1H ЯМР (300 МГц, DMSO) δ 8,65 (с, 2H), 7,95 (с, 1H), 7,25 (д, J=9,0 Гц, 1H), 6,56 (д, J=8,9 Гц, 1H), 4,59 (с, 2H), 3,92-3,67 (м, 4H), 2,21-1,94 (м, 4H).
Пример 5
2-(3,5-Дихлорпиридин-4-ил)-1-(7-дифторметокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-пиран]-4-ил)этанон (соединение 105)
К раствору 2-(3,5-дихлорпиридин-4-ил)-1-(7-гидрокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-пиран]-4-ил)этанона [403] (188 мг, 0,47 ммоль) в безводном DMF (10 мл) добавляют K2CO3 (98 мг, 0,7 ммоль) и натрий хлордифторацетат (108,5 мг, 0,7 ммоль). Смесь нагревают в атмосфере аргона при перемешивании при 100°C в герметичной пробирке в течение 45 мин. Дополнительно добавляют K2CO3 (65 мг, 0,47 ммоль) и натрий хлордифторацетат (72 мг, 0,47 ммоль), и перемешивание продолжают при 100°C в течение 30 мин. Смеси дают возможность охладиться до комнатной температуры, фильтруют и выпаривают досуха при пониженном давлении. Очистка с помощью ВЭЖХ дает 89 мг продукта 105.
1H ЯМР (300 МГц, CDCl3) δ 8,52 (с, 2H), 7,46 (д, J=9,1 Гц, 1H), 6,81 (д, J=9,0, 1H), 6,74 (т, J=73 Гц, 1H), 4,60 (с, 2H), 4,05 - 3,83 (м, 4H), 2,21 (т, J=5,5 Гц, 4H).
Пример 6
2-(3,5-Дихлор-1-оксидо-пиридин-4-ил)-1-(7-дифторметокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-пиран]-4-ил)этанон (соединение 106)
К раствору 2-(3,5-дихлорпиридин-4-ил)-1-(7-дифторметокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-пиран]-4-ил)этанона [105] (89 мг, 0,2 ммоль) в дихлорметане (4 мл) добавляют 30% H2O2 (68 мкл, 0,6 ммоль) и метилтриоксорений (VII) (25 мг). Смесь перемешивают при комнатной температуре в течение ночи, добавляют MnO2 (5 мг) и перемешивают в течение 10 мин. После фильтрования и выпаривания досуха при пониженном давлении стандартная очистка с помощью ВЭЖХ дает 33 мг продукта 106.
1H ЯМР (300 МГц, CDCl3) δ 8,22 (с, 2H); 7,46 (д, J=9,1 Гц, 1H), 6,81 (д, J=9,1 Гц, 1H), 6,74 (т, J=73 Гц, 1H), 4,53 (с, 2H), 4,08-3,88 (м, 4H) 2,21 (т, J=5,5 Гц, 4H).
Получение 4
2-(3,5-Дихлорпиридин-4-ил)-1-(7-гидрокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-тиопиран]-4-ил)этанон (соединение 404)
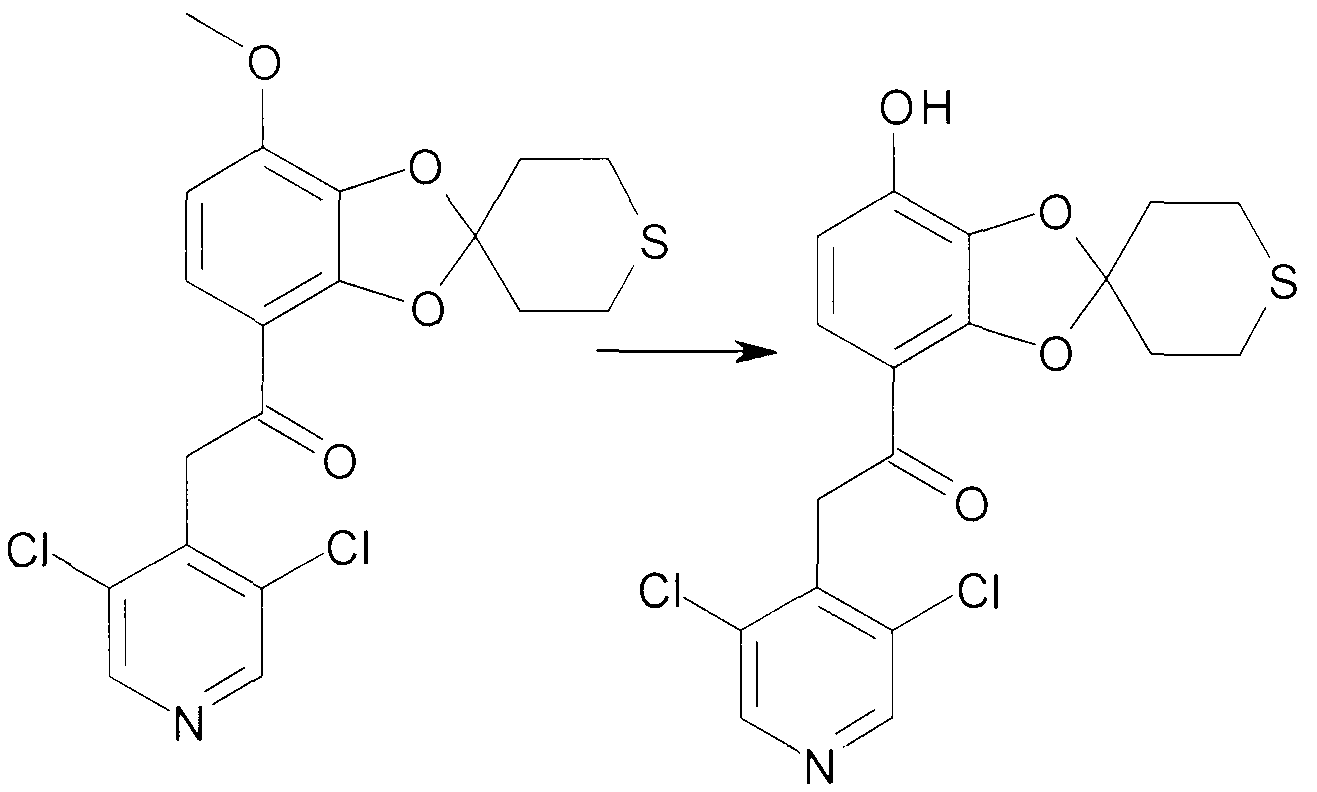
К раствору 2-(3,5-дихлорпиридин-4-ил)-1-(7-метокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-тиопиран]-4-ил)этанона (8,3g, 19,5 ммоль) в безводном DMF (80 мл) добавляют K2CO3 (27 г, 195 ммоль) и трет-додецилмеркаптан (92 мл, 390 ммоль). Смесь нагревают при перемешивании при 140°C в герметичной пробирке в течение 21 часа. Дополнительно добавляют K2CO3 (13 г) и трет-додецилмеркаптан (45 мл). Перемешивание продолжают в течение дополнительных 5 часов. Смеси дают возможность охладиться до комнатной температуры и добавляют воду. После нейтрализации с помощью 4 н. HCl смесь экстрагируют DCM (3×200 мл). Объединенную органическую фазу промывают насыщенным раствором соли, сушат над MgSO4 и выпаривают досуха при пониженном давлении. Флэш-хроматография дает сырой продукт, который повторно растворяют в DCM, а впоследствии дважды экстрагируют 2 н. NaOH. Водную фазу дважды промывают DCM, нейтрализуют с помощью 4 н. HCl, а в заключение экстрагируют DCM (3×150 мл). Органическую фазу промывают насыщенным раствором соли, сушат над MgSO4 и выпаривают досуха при пониженном давлении. Хроматография дает 2,56 г продукта 404.
1H ЯМР (300 МГц, CDCl3) δ 8,52 (с, 2H), 7,38 (д, J=9,0 Гц, 1H), 6,54 (д, J=9,0 Гц, 1H), 4,60 (с, 2H), 2,94-2,77 (м, 4H), 2,46-2,15 (м, 4H).
Пример 7
2-(3,5-Дихлорпиридин-4-ил)-1-(7-дифторметокси-2',3',5',6'-терагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-тиопиран]-4-ил)этанон (соединение 107)
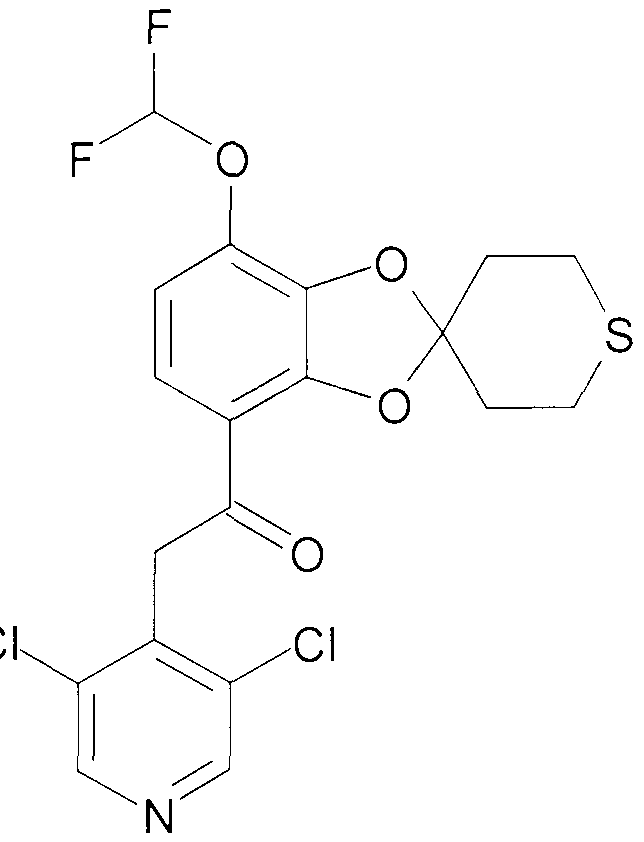
К раствору 2-(3,5-дихлорпиридин-4-ил)-1-(7-гидрокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-тиопиран]-4-ил)этанона [404] (4,27 г, 10,4 ммоль) в безводном DMF (120 мл) добавляют K2CO3 (2,16 г, 15,6 ммоль) и натрий хлордифторацетат (2,47 г, 15,6 ммоль). Смесь нагревают в атмосфере аргона при перемешивании при 100°C в течение 40 мин. Смеси дают возможность охладиться до комнатной температуры, добавляют воду (500 мл) и экстрагируют EtOAc (2×400 мл). Объединенную органическую фазу промывают водой (500 мл) и насыщенным раствором NaCl (150 мл) с последующей сушкой над Na2SO4 и выпаривают досуха при пониженном давлении. Хроматография дает 2,64 г продукта 107 желто-белого порошка.
1H ЯМР (400 МГц, DMSO) δ 8,67 (с, 2H), 7,61-7,09 (м, 2H), 6,93 (д, J=9,0 Гц, 1H), 4,67 (с, 2H), 3,05-2,74 (м, 4H), 2,42-2,16 (м, 4H).
Пример 8
2-(3,5-Дихлор-1-оксидо-пиридин-4-ил)-1-(7-дифторметокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-тиопиран-1',1'-диоксид]-4-ил)этанон (соединение 108)
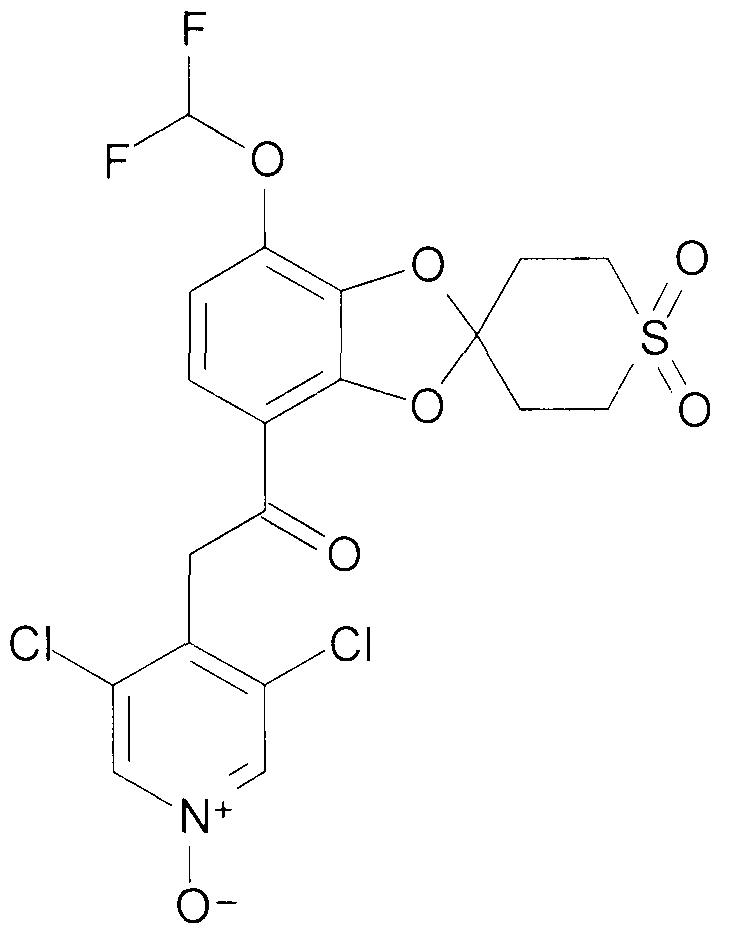
К раствору 2-(3,5-дихлорпиридин-4-ил)-1-(7-дифторметокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-тиопиран]-4-ил)этанона [107] (2,64 г, 5,7 ммоль) в хлороформе (40 мл) медленно добавляют раствор 3-хлорпербензойной кислоты (5,76 г, 25,7 ммоль) в хлороформе (50 мл), поддерживая температуру в пределах между 21°C и 24°C. Смесь перемешивают при комнатной температуре в течение 19 часов и добавляют к раствору NaHCO3 (водный раствор). Органическую фазу промывают водным раствором NaCl. Водные фазы экстрагируют DCM. Объединенные органические фазы сушат над Na2SO4 и выпаривают досуха при пониженном давлении. Хроматография дает 1,95 г продукта 108 в виде белого порошка.
1H ЯМР (300 МГц, CDCl3) δ 8,23 (с, 2H), 7,52 (д, J=9,1 Гц, 1H), 6,89 (д, J=9,1 Гц, 1H), 6,70 (т, J=72 Гц, 1H), 4,48 (с, 2H), 3,50-3,18 (м, 4H), 2,83 - 2,55 (м, 4H).
Получение 5
2-(3,5-Дихлорпиридин-4-ил)-1-(7-гидрокси-2',3',5',6'-тетрагидро-спиро[1,3-бензо-диоксол-2,4'-(4H)-тиопиран-1',1'-диоксид]-4-ил)этанон (соединение 405)
К раствору 2-(3,5-дихлорпиридин-4-ил)-1-(7-метокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-тиопиран-1',1'-диоксид]-4-ил)этанона (415 мг, 0,91 ммоль) в безводном DMF (10 мл) добавляют K2CO3 (1,25 г, 9,1 ммоль) и трет-додецилмеркаптан (4,3 мл, 18 ммоль). Смесь нагревают при перемешивании при 140°C в герметичной пробирке в течение 16 часов. Смеси дают возможность охладиться до комнатной температуры и добавляют воду. После нейтрализации с помощью 4 н. HCl смесь экстрагируют EtOAc (2×50 мл). Объединенную органическую фазу экстрагируют дважды 2 н. NaOH. Водную фазу промывают дважды EtOAc, нейтрализуют с помощью 4 н. HCl и в заключение экстрагируют EtOAc (2×100 мл). Органическую фазу промывают насыщенным раствором соли, сушат над MgSO4 и выпаривают досуха при пониженном давлении. Хроматография дает 204 мг продукта 405.
1H ЯМР (300 МГц, DMSO) δ 8,65 (с, 2H), 7,95 (с, 1H), 7,28 (д, J=9,0 Гц, 1H), 6,59 (д, J=8,9 Гц, 1H), 4,64 (с, 2H), 3,6-3,3 (м, 4H), 2,65-2,50 (м, 4H).
Пример 9
2-(3,5-Дихлорпиридин-4-ил)-1-(7-дифторметокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-тиопиран-1',1'-диоксид]-4-ил)этанон (соединение 109)
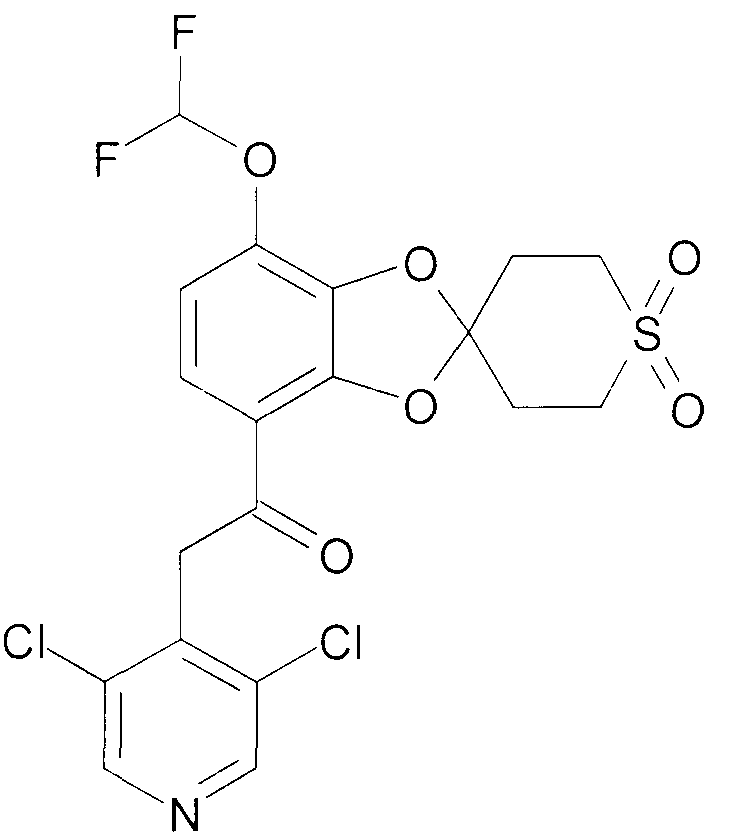
К раствору 2-(3,5-дихлорпиридин-4-ил)-1-(7-гидрокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-тиопиран-1',1'-диоксид]-4-ил)этанона [405] (202 мг, 0,45 ммоль) в безводном DMF (10 мл) добавляют K2CO3 (126 мг, 0,9 ммоль) и натрий хлордифторацетат (139 мг, 0,9 ммоль). Смесь нагревают в атмосфере аргона при перемешивании при 100°C в течение 1 часа. Дополнительно добавляют K2CO3 (63 мг, 0,45 ммоль) и натрий хлордифторацетат (69 мг, 0,45 ммоль), и реакционную смесь нагревают в течение дополнительного часа. Смеси дают возможность охладиться до комнатной температуры, фильтруют и выпаривают досуха при пониженном давлении. Хроматография дает 69 мг продукта 109.
1H ЯМР (300 МГц, CDCl3) δ 8,53 (с, 2H), 7,52 (д, J=9,1 Гц, 1H), 6,89 (д, J=9 Гц, 1H), 6,69 (т, J=72 Гц, 1H), 4,56 (с, 2H), 3,56-3,15 (м, 4H), 2,91-2,50 (м, 4H).
Получение 6
7-Дифторметокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-тиопиран]-4-карбоновая кислота
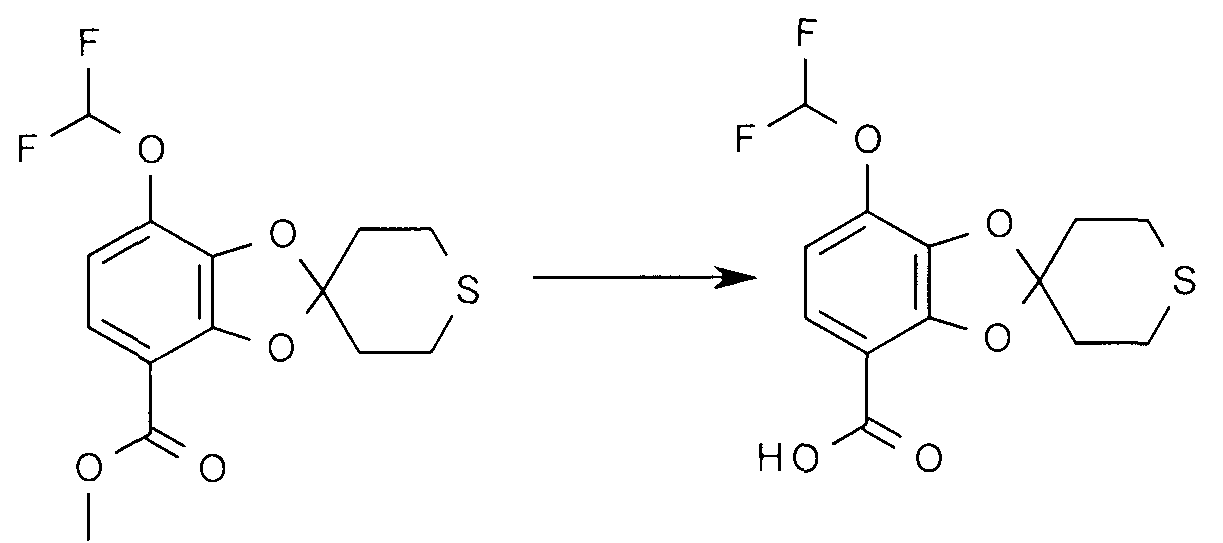
Метил 7-дифторметокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-тиопиран]-4-карбоксилат (437 мг) растворяют в смеси метанола (5 мл) и THF (5 мл) и добавляют 1 M водный раствор гидроксида лития (3,9 мл). Сложный эфир расщепляется через 1 час при 50°C. Раствор охлаждают до комнатной температуры и подкисляют с помощью 2 н. серной кислоты (1,95 мл), и продукт экстрагируют EtOAc. 7-Дифторметокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-тиопиран]-4-карбоновую кислоту получают после удаления растворителей при пониженном давлении.
Получение 7
4-Нитрофенил 7-дифторметокси-2',3,5,6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-тиопиран]-4-карбоксилат.
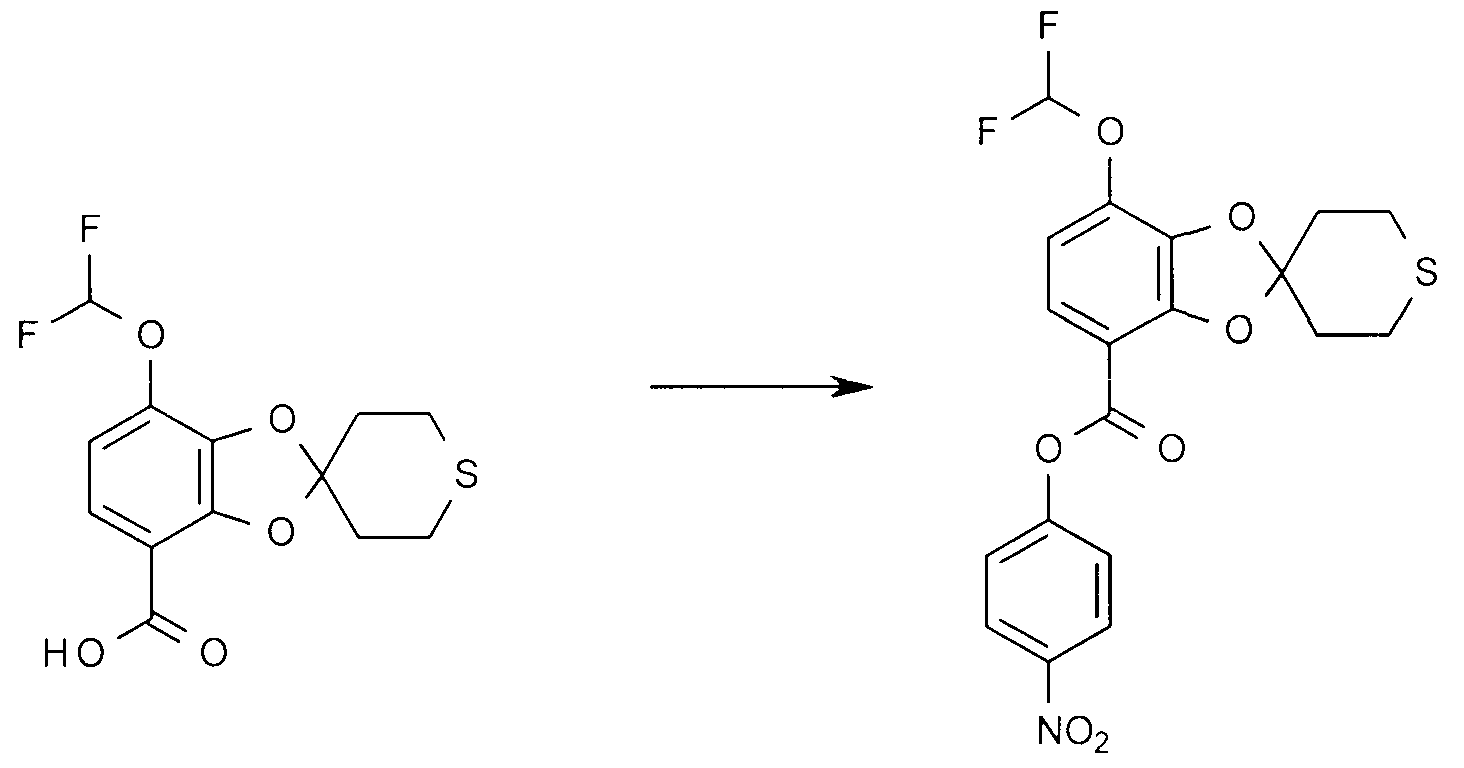
7-Дифторметокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-тиопиран]-4-карбоновую кислоту (344 мг) растворяют в сухом DMF (3 мл). Добавляют 4-нитрофенол (226 мг), этилдиметиламинопропилкарбодиимид гидрохлорид (312 мг) и N,N-диметил-4-аминопиридин (198 мг). После перемешивания при комнатной температуре в течение 20 часов выделение водного продукта реакции с помощью простого трет-бутилметилового эфира и хроматографии органических соединений при градиенте от 0 до 40% EtOAc в пентане дает указанное в заголовке соединение в виде масла.
Пример 10
N-(3,5-Дихлор-4-пиридил-7-Дифторметокси-2',3',5',6,-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-тиопиран]-4-карбамид
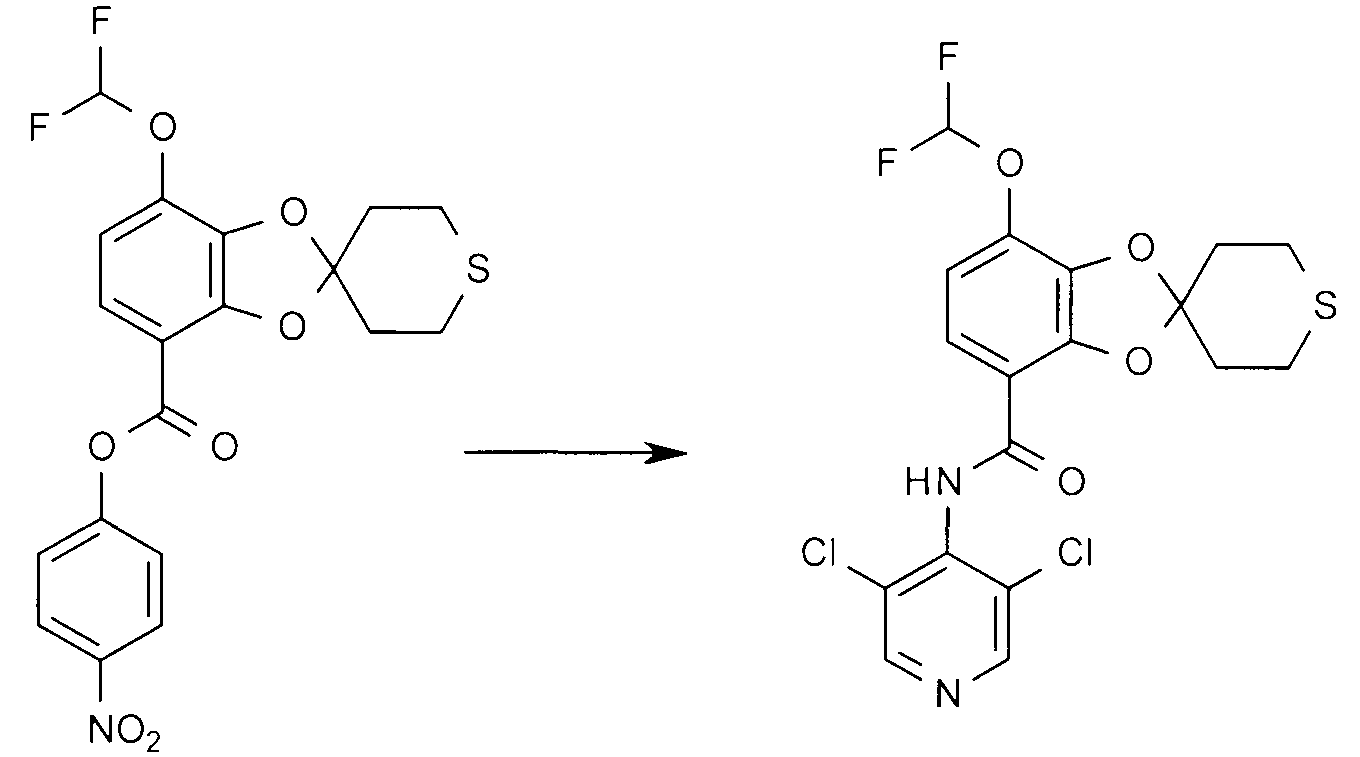
4-Нитрофенил 7-дифторметокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H)-тиопиран]-4-карбоксилат (250 мг) и 3,5-дихлор-4-аминопиридин (129 мг) растворяют в сухом THF, 5 мл, в атмосфере аргона. Добавляют гидрид натрия (50% суспензию в масле), 40 мг, и смесь оставляют при перемешивании в течение ночи. Извлечение водного продукта реакции с помощью EtOAc и хроматографии при градиенте от 0 до 60% EtOAc в пентане дают указанное в заголовке соединение.
1H ЯМР (300 МГц, CDCl3) δ 8,64 (с, 1H), 8,57 (с, 2H), 7,63 (д, J=9,0 Гц, 1H), 6,86 (д, J=9,1 Гц, 1H), 6,73 (т, J=72 Гц, 1H), 3,03-2,81 (м, 4H), 2,49-2,29 (м, 4H).
Пример 11
N-(3,5-дихлор-1-оксо-4-пиридил)-7-(дифторметокси)-1',1'-диоксо-спиро[1,3-бензодиоксол-2,4'-тиан]-4-карбоксамид
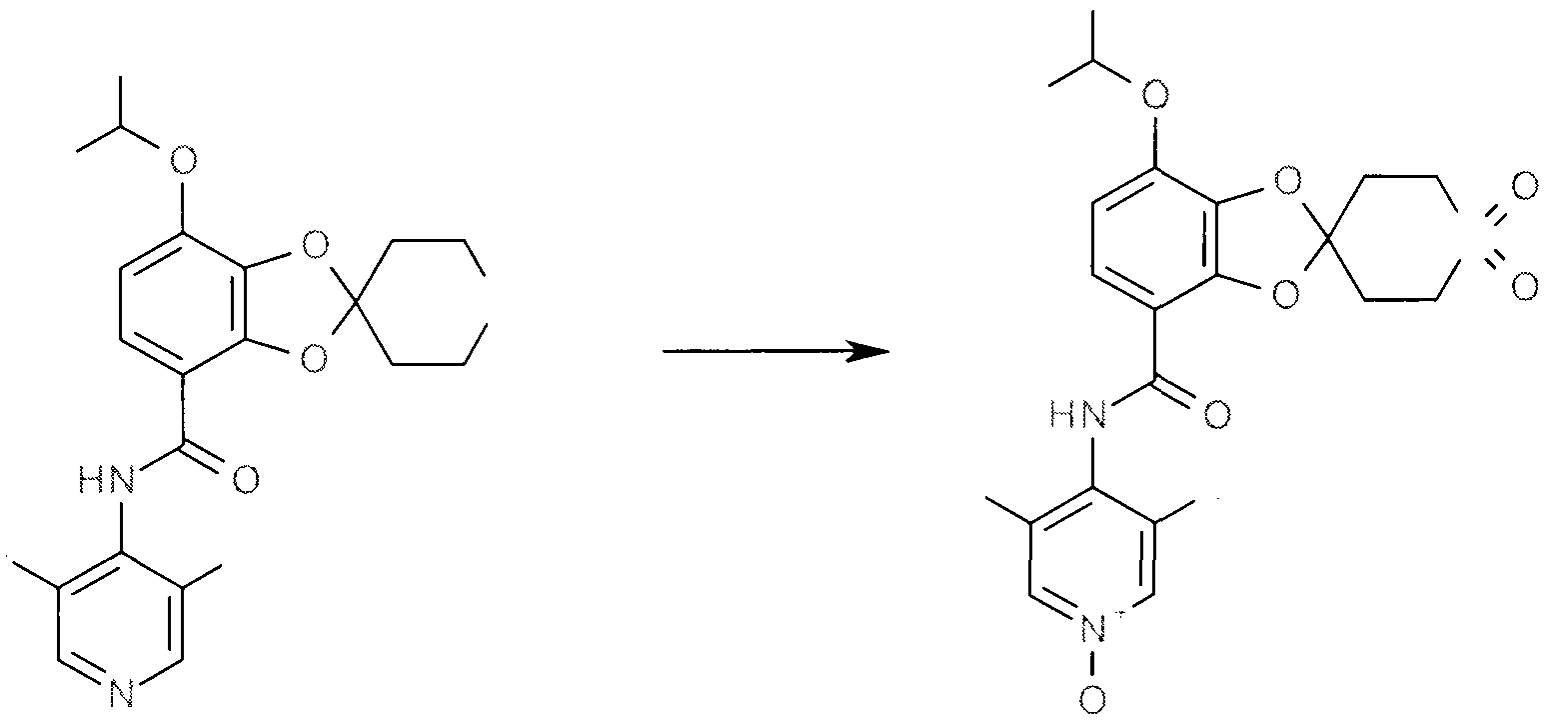
N-(3,5-Дихлор-4-пиридил)-7-дифторметокси-2',3',5',6'-тетрагидро-спиро[1,3-бензодиоксол-2,4'-(4H-тиопиран]-4-карбамид (157 мг) растворяют в муравьиной кислоте, (1 мл) и охлаждают на льду. При перемешивании по каплям добавляют перекись водорода (~50%) (0,260 мл). Полученный раствор поддерживают при комнатной температуре в течение ночи. Раствор выливают в воду и экстрагируют три раза DCM. Экстракты концентрируют при пониженном давлении и очищают с помощью хроматографии в градиенте от 0 до 10% метанола в DCM, получая указанное в заголовке соединение.
1H ЯМР (300 МГц, DMSO) δ 9,46 (с, 1H), 8,76 (с, 2H), 7,46 (д, J=8,9 Гц, 1H), 7,39 (т, J=73, 5 Гц, 1H), 6,98 (д, J=9,1 Гц, 1H), 3,76-3,56 (м, 2H), 3,34 (м, 2H), 2,75-2,53 (м, 4H).
Пример 12
Следующие далее соединения, где X=-NH-, могут, например, быть получены, как описано в WO 2008/104175 и как описано в примере 10 и примере 11 в настоящей заявке:
N-(3,5-дихлор-4-пиридил)-6-(дифторметокси)спиро[2,4-дигидро-1,5-бензодиоксепин-3,3'-оксетан]-9-карбоксамид
N-(3,5-дихлор-1-оксидо-пиридин-1-иний-4-ил)-6-(дифторметокси)спиро[2,4-дигидро-1,5-бензодиоксепин-3,3'-оксетан]-9-карбоксамид
N-(3,5-дихлор-4-пиридил)-6-(дифторметокси)спиро[2,4-дигидро-1,5-бензодиоксепин-3,4'-тетрагидропиран]-9-карбоксамид
N-(3,5-дихлор-1-оксидо-пиридин-1-иний-4-ил)-6-(дифторметокси)спиро[2,4-дигидро-1,5-бензодиоксепин-3,4'-тетрагидропиран]-9-карбоксамид
N-(3,5-дихлор-4-пиридил)-7-(дифторметокси)спиро[1,3-бензодиоксол-2,4'-тетрагидропиран]-4-карбоксамид
N-(3,5-дихлор-1-оксидо-пиридин-1-иний-4-ил)-7-(дифторметокси)спиро[1,3-бензодиоксол-2,4'-тетрагидропиран]-4-карбоксамид
N-(3,5-дихлор-4-пиридил)-7-(дифторметокси)-1',1'-диоксо-спиро[1,3-бензодиоксол-2,4'-тиан]-4-карбоксамид
N-(3,5-дихлор-1-оксидо-пиридин-1-иний-4-ил)-6-(дифторметокси)-1',1'-диоксо-спиро[2,4-дигидро-1,5-бензодиоксепин-3,3'-тиетан]-9-карбоксамид
N-(3,5-дихлор-4-пиридил)-6-(дифторметокси)-1',1'-диоксо-спиро[2,4-дигидро-1,5-бензодиоксепин-3,3'-тиетан]-9-карбоксамид
N-(3,5-дихлор-4-пиридил)-6-(дифторметокси)спиро[2,4-дигидро-1,5-бензодиоксепин-3,3'-тиетан]-9-карбоксамид
N-(3,5-дихлор-1-оксидо-пиридин-1-иний-4-ил)-6-(дифторметокси)спиро[2,4-дигидро-1,5-бензодиоксепин-3,3'-тиетан]-9-карбоксамид
N-(3,5-дихлор-4-пиридил)-6-(дифторметокси)спиро[2,4-дигидро-1,5-бензодиоксепин-3,3'-тиетан]-9-карбоксамид.
Пример 13
Следующие далее соединения могут синтезироваться, как описано в общей процедуре получения в настоящей заявке:
2-(3,5-дихлор-4-пиридил)-1-[6-(дифторметокси)спиро[2,4-дигидро-1,5-бензодиоксепин-3,3'-тиетан]-9-ил]этанон
2-(3,5-дихлор-1-оксидо-пиридин-1-иний-4-ил)-1-[6-(дифторметокси)-1',1'-диоксо-спиро[2,4-дигидро-1,5-бензодиоксепин-3,3'-тиетан]-9-ил]этанон
2-(3,5-дихлор-4-пиридил)-1-[6-(дифторметокси)-1',1'-диоксо-спиро[2,4-дигидро-1,5-бензодиоксепин-3,3'-тиетан]-9-ил]этанон
2-(3,5-дихлор-1-оксидо-пиридин-1-иний-4-ил)-1-[6-(дифторметокси)спиро[2,4-дигидро-1,5-бензодиоксепин-3,3'-тиетан]-9-ил]этанон.
Пример 14
Анализ с помощью PDE4
Рекомбинантные PDE4 человека (Genbank accession no NM_006203) инкубируют в течение 1 часа, вместе с исследуемым соединением при концентрациях до 10 мкМ, вместе с cAMP (1×10-5M), и с малым количеством (0,021 миллибеккреля) радиоактивно меченного cAMP. В конце инкубирования расщепление субстрата оценивают по связыванию продукта AMP с шариками SPA, которые генерируют хемилюминесценцию, когда связываются с радиоактивным трассером. Продукт AMP ингибирует связывание радиоактивного трассера с шариками, и люминесцентный сигнал исчезает.
Результаты вычисляют как молярные концентрации, приводящие к 50% ингибированию расщепления субстрата, по сравнению с контрольными образцами, и выражают как IC50 (M).
Результаты показаны в Таблице 1, ниже.
|
Пример 15
Фармакокинетические анализы in vivo
Одной крысе дозируют перорально (5 мг/кг, растворенного в DMSO/H2O/пропиленгликоле [1:5:4]), и образцы крови отбирают из подъязычного венозного сплетения через 30 мин, 1 час, 2 час, 4 час и 6 час. Образцы крови отбирают в пробирки для выделения сыворотки BD Vacutainer SST, сыворотку отделяют посредством центрифугирования, переносят в пробирки Micronics, а затем анализируют.
Параметры масс-спектрометра (API5000 series) оптимизируют для анализа конкретных соединений и осуществляют инжекцию исследуемых препаратов для подтверждения правомерности использования установленного общего метода хроматографии. Общий метод основан на анализе с быстрым градиентом (2,5 мин) на колонке C18, где подвижные фазы составляют метанол, ацетат аммония, муравьиная кислота и вода.
Стандарты приготавливают в сыворотке крысы, чтобы перекрыть аналитический диапазон от 0,1 до 300 нг/мл. Стандарты, контрольную сыворотку и исследуемые образцы наносят на 96-луночный планшет с глубокими лунками и осаждают посредством добавления ацетонитрила, содержащего внутренний стандарт. Образцы анализируют на системе ЖХ-МС/МС, обычно в течение ночи. Интегрирование и количественное определение осуществляют на основе соотношения между анализируемым веществом и внутренним стандартом, используя программное обеспечение Analyst version 1,5. Фармакокинетические параметры вычисляют с использованием стандартного документа Excel.
Фармакокинетический профиль соединения 101 у крыс in vivo, описанного в WO 2008/104175, и соединения 105 и 106, описанных в примерах 5 и 6, соответственно:
пероральное дозирование соединения 101 из WO 2008/104175 - 5 мг/кг: Cmax для сыворотки <3 нг/мл, для исходного соединения, однако Cmax для сыворотки ~2000 нг/мл, для метаболита (R3 = OH). Активность PDE4 для метаболита (соединение 403) составляет 5000 нМ, то есть он не активен по сравнению с исходным соединением (PDE4=20 нМ).
Пероральное дозирование соединения 105-5 мг/кг: Cmax для сыворотки <3 нг/мл, для исходного соединения, однако Cmax для сыворотки, для соединения активного метаболита 106, составляет 93 нг/мл.
Пероральное дозирование соединения 106-5 мг/кг: Cmax для сыворотки составляет 133 нг/мл, и биологическая доступность - 22%.