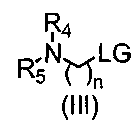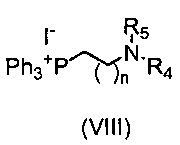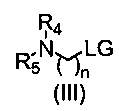Результат интеллектуальной деятельности: СОЕДИНЕНИЯ ПИРАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ СИГМА РЕЦЕПТОРОВ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к соединениям, обладающим фармакологической активностью по отношению к сигма (σ) рецепторам, и, более конкретно, к некоторым производным пиразола, способам получения таких соединений, к содержащим их фармацевтическим композициям, и к их применению в терапии и для профилактики, в частности, для лечения или профилактики заболевания или состояния, опосредованного сигма рецепторами.
Уровень техники
Поиск новых терапевтических средств в последние годы значительно помог лучшему пониманию структуры белков и других биомолекул, связанных с целевыми заболеваниями. Одним важным классом указанных белков являются сигма (σ) рецепторы, рецепторы поверхности клеток центральной нервной системы (CNS), которые могут иметь отношение к дисфорическим, галлюциногенным и сердечным стимулирующим эффектам опиоидов. При исследовании биологии и функции сигма рецепторов, были представлены доказательства того, что лиганды сигма-рецепторов могут быть использованы при лечении психозов и двигательных расстройств, таких как дистония и поздняя дискинезия, и двигательных нарушений, связанных с хореей Хантингтона или синдромом Туретта, и при болезни Паркинсона (Walker, J.M. et al., Pharmacological Reviews, 1990, 42, 355). Сообщается, что известный лиганд сигма рецепторов римказол (rimcazole) клинически проявляет эффекты при лечении психозов (Snyder, S.H., Largent, B.L. J. Neuropsychiatry 1989, 1, 7). Сайты связывания сигма-рецептора обладают преимущественной аффинностью в отношении правовращающих изомеров некоторых опиатных бензоморфанов, таких как (+)SKF 10047, (+)циклазосин и (+)пентазоцин, а также к некоторым нарколептикам, таким как галоперидол.
Сигма рецептор имеет, по меньшей мере, два подтипа, которые могут быть распознаны по стереоизбирательным изомерам этих фармакоактивных препаратов. SKF 10047 обладает наномолярной аффинностью в отношении сигма 1 (σ-1) сайта и обладает микромолярной аффинностью в отношении сигма (σ-2) сайта. Галоперидол обладает подобной аффинностью в отношении обоих подтипов. Эндогенные сигма лиганды не являются известными, хотя предполагают, что прогестерон является одним из них. Возможные сигма-сайт-опосредованные эффекты препарата включают модуляцию функции глутаматного рецептора, нейротрансмиттерный ответ, нейропротекцию, поведение и познавательную способность (Quirion, R. et al. Trends Pharmacol. Sci., 1992, 13:85-86). Большинство исследований подразумевает, что сайтами сигма связывания (рецепторов) являются элементы плазмалеммы каскада сигнальной трансдукции. Лекарственные средства, о которых сообщалось, что они являются селективными сигма лигандами, были оценены как антипсихотические препараты (Hanner, M. et al. Proc. Natl. Acad. Sci., 1996, 93:8072-8077). Существование сигма рецепторов в ЦНС, эндокринной и иммунной системах, предполагает вероятность того, что они могут служить в качестве связи между тремя системами.
С точки зрения возможного терапевтического применения агонистов или антагонистов сигма рецептора, большие усилия были направлены на поиск селективных лигандов. Таким образом, в предшествующем уровне техники описаны другие лиганды сигма рецепторов.
В Международной патентной заявке WO 91/09594 в общем описан широкий класс лигандов сигма рецепторов, некоторые из которых представляют собой производные 4-фенилпиперидина, -тетрагидропиридина или -пиперазина, имеющие необязательно замещенный арил или гетероарил, алкильный, алкенильный, алкинильный, алкокси или алкоксиалкильный заместитель на N-атоме кольца. Термины арил и гетероарил определены указанием числа таких заместителей.
В Европейской патентной заявке EP 0414289 A1 в общем описан широкий класс производных 1,2,3,4-тетрагидроспиро[нафталин-1,4'-пиперидина] и 1,4-дигидроспиро[нафталин-1,4'-пиперидина], замещенные у N-атома пиперидина углеводородной группой, указываемые как обладающие селективной активностью антагониста сигма рецептора. Термин углеводород, как определено в указанном патенте, охватывает все возможные прямоцепочечные, циклические, гетероциклические и т.д. группы. Однако конкретно описаны только соединения, имеющие бензил, фенетил, циклоалкилметил, фурил- или тиенилметил или низший алкил или алкенил в качестве углеводородного заместителя у атома азота пиперидина. Указано, что соединения способны заменять тритированный дитолилгуанидин (DTG) на сигма сайтах с улучшенной эффективностью, чем 200 нМ. 1'-бензил-1,2,3,4-тетрагидроспиро[нафталин-1,4'-пиперидин] приводится, в частности, как предпочтительное соединение.
В Европейской патентной заявке EP 0445974 A2 в общем описаны соответствующие производные спиро[индан-1,4'-пиперидина] и спиро[бензоциклогептен-5,4'-пиперидина]. При этом снова указано только, что соединения способны заменять тритированный дитолилгуанидин (DTG) на сигма сайтах с улучшенной эффективностью, чем 200 нМ.
Европейская патентная заявка EP 0431943 A относится к дальнейшему весьма широкому классу спиропиперидиновых соединений, замещенных на N-атоме пиперидина и заявленных как соединения, которые могут быть использованы в качестве антиаритмических средств и при ослабленной насосной функции сердца. В указанной заявке приведены в примерах некоторые соединения, большинство из которых содержат оксо и/или сульфониламино заместитель(ли) в спиро циклической кольцевой системе. Из оставшихся соединений основная часть имеет другой полярной заместитель, присоединенный к спиро ядру, и/или у них есть некоторый полярный заместитель на N-атоме пиперидина. Не приводится каких-либо предположений или указаний по воздействию соединений на сигма рецептор.
В патентной заявке EP 518805 A и в WO 02/102387 описаны лиганды сигма рецептора, имеющие пиперидиновую или спиропиперидиновую структуры.
С точки зрения химической структуры соединений, описанных в настоящей патентной заявке, в предшествующем уровне техники имеется несколько документов, в которых описаны производные пиразола, характеризующиеся тем, что среди прочих, они замещены аминоалкоксигруппами в различных положениях пиразольной группы.
В патенте US 4337263 описаны 1-арил-4-арилсульфонил-3-аминопропокси-1H-пиразолы, где аминогруппа может представлять собой N-циклическую группу в морфолиновой, пиперидиновой или пирролидиновой группе. Они могут быть использованы в качестве гиполипемических или гипохолестеринемических агентов.
В патенте FR 2301250 описаны соединения, подобно описанным выше, такие как 1,4-диарил-3-аминоалкоксипиразолы, где аминогруппа содержит производные пирролидина, пиперидина, гидроксипиперидина, морфолина или пиперазина.
Патентная заявка US 2003/0144309 относится к пиразолам, где положение 3 пиразолов замещено диметиламиноэтоксигруппой и имеет в положении 4 пиримидиновую группу. Они могут использоваться в качестве ингибиторов активности JNK3, Lck или Src киназы.
В Международной патентной заявке WO 02/092573 описаны замещенные производные пиразола в качестве ингибиторов SRC и других протеинкиназ.
В Международной патентной заявке WO 2004/017961 описаны производные пиразола, где положение 3 замещено алкоксигруппой, напрямую связанной с циклическим амидом, которые могут использоваться для терапевтического лечения и/или профилактики состояния, связанного с половым гормоном у пациента.
В патенте US 6492529 описаны производные пиразола, которые могут использоваться при лечении воспалительных заболеваний. Указанные соединения имеют в положении 5 карбамидную группу, присоединенную в некоторых случаях к морфолинэтоксигруппе.
Международная патентная заявка WO 04/016592 относится к соединениям пиразола для ингибирования белкового пренилирования, который содержит в положении 5, среди прочих, алкоксигруппу, напрямую присоединенную к циклическому амиду.
Однако ни в одном из указанных документов не высказано предположений о действии данных соединений на сигма рецептор.
В WO 2006/021462 и WO 2007/098964 описаны производные пиразола в качестве селективных ингибиторов сигма рецептора. Указанные соединения имеют в положении 3 алкоксигруппу.
Поэтому все еще существует потребность в соединениях, которые обладают фармакологической активностью в отношении сигма рецептора, являющихся как эффективными, так и избирательными, и обладающих хорошими «потенциально лекарственными» свойствами, то есть хорошими фармацевтическими свойствами, относящимися к введению, распределению, метаболизму и выведению.
Краткое описание настоящего изобретения
Авторы настоящего изобретения неожиданно обнаружили семейство особых по структуре производных пиразола, которые являются, в частности, селективными ингибиторами сигма рецептора. Соединения, представленные пиразольной группой, которые характеризуются замещением в положении 3 алкильной цепью, содержащей амин на ее конце, и, необязательно, промежуточную оксагруппу.
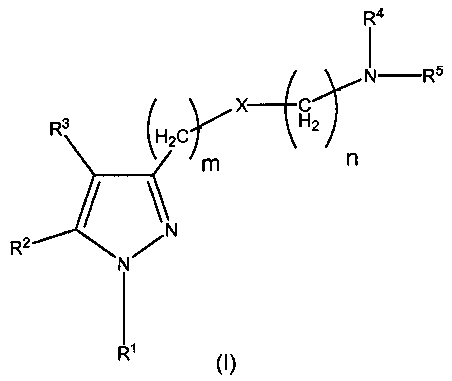
Таким образом, в одном аспекте настоящее изобретение относится к соединению общей формулы (I):
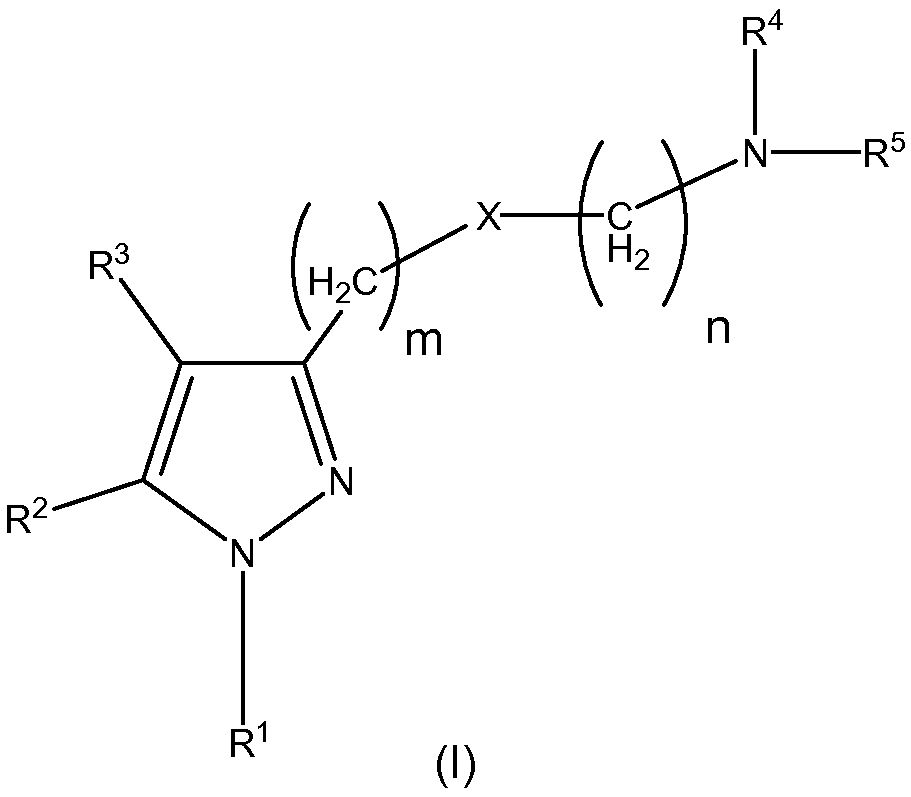
где
R1 представляет собой замещенный или незамещенный ароматический или неароматический гетероциклил; замещенный или незамещенный арил; или замещенный или незамещенный циклоалкил;
R2 и R3, одинаковые или различные, представляют собой атом водорода; F; Cl; Br; I; CF3; OH; SH; NH2; CN; замещенный или незамещенный алкил; замещенный или незамещенный алкенил; замещенный или незамещенный алкокси; замещенный или незамещенный циклоалкил; замещенный или незамещенный арил; замещенный или незамещенный, ароматический или неароматический гетероциклил; замещенный или незамещенный циклоалкилалкил; замещенный или незамещенный арилалкил; замещенный или незамещенный, ароматический или неароматический гетероциклилалкил; группу (C=O)-R7; группу (C=O)-O-R8; группу S(O)t-R9 или группу (C=O)-NR10R11;
R4 и R5, одинаковые или различные, представляют собой атом водорода; замещенный или незамещенный алкил; замещенный или незамещенный алкенил; замещенный или незамещенный алкокси; замещенный или незамещенный циклоалкил; замещенный или незамещенный арил; замещенный или незамещенный, ароматический или неароматический гетероциклил; замещенный или незамещенный циклоалкилалкил; замещенный или незамещенный арилалкил; замещенный или незамещенный, ароматический или неароматический гетероциклилалкил; группу (C=O)-R7; группу (C=O)-O-R8; группу S(O)t-R9 или группу (C=O)-NR10R11;
или
вместе с атомом азота, к которому они присоединены, образуют замещенную или незамещенную, ароматическую или неароматическую гетероциклильную группу;
X представляет собой атом кислорода или группу CH-R12, где R12 выбран из H, CH3, SH, OH, NH2, CF3, Cl, F, Br, I и CN;
m выбран из 1, 2, 3 и 4;
n выбран из 1, 2, 3 и 4;
t выбран из 1, 2 и 3;
R7, R8, R9, R10 и R11, одинаковые или различные, представляют собой атом водорода; замещенный или незамещенный C1-6алкил; замещенный или незамещенный C2-6алкенил; замещенный или незамещенный C1-6алкокси; замещенный или незамещенный циклоалкил; замещенный или незамещенный арил; замещенный или незамещенный, ароматический или неароматический гетероциклил; замещенный или незамещенный циклоалкилалкил; замещенный или незамещенный арилалкил; замещенный или незамещенный, ароматический или неароматический гетероциклилалкил;
или его фармацевтически приемлемой соли, изомеру, пролекарству или сольвату.
В другом аспекте настоящее изобретение относится к способу получения соединения формулы (I), как определено выше, или его соли, изомера или сольвата.
В другом аспекте настоящее изобретение относится к лекарственному средству или фармацевтической композиции, содержащей, по меньшей мере, одно соединение формулы (I), как определено выше, или его фармацевтически приемлемую соль, изомер, пролекарство или сольват и фармацевтически приемлемый эксципиент.
В другом аспекте настоящее изобретение относится к соединению формулы (I), как определено выше, для применения в качестве лекарственного средства, в частности, для лечения и/или профилактики заболевания или состояния, опосредованного сигма рецептором.
В другом аспекте настоящее изобретение относится к применению соединения формулы (I), как определено выше, при производстве лекарственного средства для лечения и/или профилактики заболевания или состояния, опосредованного сигма рецептором.
В другом аспекте настоящее изобретение относится к способу лечения и/или профилактики заболевания или состояния, опосредованного сигма рецептором, включающему введение субъекту, нуждающемуся в таком лечении или профилактике, терапевтически эффективного количества соединения формулы (I), как определено выше.
В одном из вариантов осуществления указанное заболевание или состояние, опосредованное сигма рецептором, выбрано из группы, состоящей из диареи; липопротеиновых расстройств; мигрени; ожирения; повышенных уровней триглицеридов; хиломикронемии; дисбеталипопротеинемии; гиперлипопротеинемии; гиперлипидемии; смешанной гиперлипидемии; гиперхолестеринемии; липопротеиновых расстройств; гипертриглицеридемии; спорадической гипертриглицеридемии; наследственной гипертриглицеридемии; артрита; гипертензии; аритмии; язвы; дефицитов обучения, памяти и внимания; когнитивных расстройств; нейродегенеративных заболеваний; демиелинизирующих заболеваний; пристрастия к наркотикам и химическим веществам, включая кокаин, амфетамин, этанол и никотин; поздней дискинезии; ишемического инсульта; эпилепсии; удара; стресса; рака; психотических состояний, в частности, депрессии, тревоги или шизофрении; воспаления и аутоиммунных заболеваний.
В другом варианте осуществления указанное заболевание или состояние, опосредованное сигма рецептором, выбрано из группы, состоящей из боли, предпочтительно невропатической боли, боли при воспалении или других болевых состояний, включая аллодинию и/или гипералгезию.
В другом варианте осуществления соединение формулы (I) используется в качестве фармакологического инструмента.
Данные аспекты и их предпочтительные варианты осуществления также дополнительно определены в формуле изобретения.
Подробное описание изобретения
В контексте настоящего изобретения следующие термины имеют значения, подробно описанные ниже.
«Алкил» относится к углеводородному радикалу с прямой или разветвленной цепью, содержащей 1-12 атомов углерода, не имеющей ненасыщенные связи, и которая присоединена к остатку молекулы одинарной связью, например, метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, н-пентил и т.д. Алкильные радикалы необязательно могут быть замещены одним или более заместителями, такими как арил, галоген, гидрокси, алкокси, карбокси, циано, карбонил, ацил, алкоксикарбонил, амино, нитро, меркапто, алкилтио и т.д. Предпочтительные алкильные радикалы содержат от 1 до 6 атомов углерода. Если заместителем является арил, то это соответствует “арилалкильному” радикалу, такому как бензил или фенетил. Если заместителем является гетероциклил, то это соответствует “гетероциклилалкильному” радикалу. Если заместителем является циклоалкил, то это соответствует “циклоалкилалкильному” радикалу.
“Алкенил” относится к углеводородному радикалу с прямой или разветвленной цепью, содержащей 2-12 атомов углерода, имеющей, по меньшей мере, одну ненасыщенную связь, и которая присоединена к остатку молекулы одинарной связью. Алкенильные радикалы необязательно могут быть замещены одним или более заместителями, такими как арил, галоген, гидрокси, алкокси, карбокси, циано, карбонил, ацил, алкоксикарбонил, амино, нитро, меркапто, алкилтио и т.д. Предпочтительные алкенильные радикалы содержат от 2 до 6 атомов углерода.
«Циклоалкил» относится к стабильному 3-10-членному моноциклическому или бициклическому радикалу, который является насыщенным или частично насыщенным, и который состоит только из атомов углерода и водорода, такому как циклогексил или адамантил. Если в описании специально не указано иное, термин “циклоалкил” подразумевает включение циклоалкильных радикалов, которые необязательно замещены одним или более заместителями, такими как алкил, галоген, гидрокси, амино, циано, нитро, алкокси, карбокси, алкоксикарбонил и т.д.
“Арил” относится к радикалам с одним и несколькими ароматическими кольцами, включая радикалы с несколькими кольцами, которые содержат отдельные и/или конденсированные арильные группы. Конкретные арильные группы содержат от 1 до 3 отдельных или конденсированных колец и от 6 до около 18 атомов углерода кольца, такие как фенильный, нафтильный, инденильный, фенантранильный или антрацильный радикал. Арильный радикал необязательно может быть замещен одним или более заместителями, такими как гидрокси, меркапто, галоген, алкил, фенил, алкокси, галогеналкил, нитро, циано, диалкиламино, аминоалкил, ацил, алкоксикарбонил и т.д.
“Гетероциклил” относится к стабильному 3-15-членному кольцевому радикалу, который состоит из атомов углерода и от одного до пяти гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, предпочтительно, 4-8-членному кольцу с одним или более гетероатомами, более предпочтительно, 5- или 6-членному кольцу с одним или более гетероатомами. Кольцо может быть ароматическим (то есть, “гетероарил”) или неароматическим. Для целей настоящего изобретения, гетероцикл может быть моноциклической, бициклической или трициклической кольцевой системой, которая может включать конденсированные кольцевые системы; и атомы азота, углерода или серы в гетероциклильном радикале могут быть необязательно окислены; атом азота может быть необязательно кватернизирован; и гетероциклильный радикал может быть частично или полностью замещенным или ароматическим. Примеры таких гетероциклов включают, но, не ограничиваясь ими, азепины, бензимидазол, бензотиазол, фуран, изотиазол, имидазол, индол, пиперидин, пиперазин, пурин, хинолин, тиадиазол, тетрагидрофуран, кумарин, морфолин; пиррол, пиразол, оксазол, изоксазол, триазол, имидазол и т.д.
“Алкокси” относится к радикалу формулы -ORa, где Ra представляет собой алкильный радикал, как определено выше, имеющий одну или более (например, 1, 2, 3 или 4) кислородных связей и от 1 до около 12 атомов углерода или, предпочтительно, от 1 до около 6 атомов углерода, например, метокси, этокси, пропокси и т.д.
“Амино” относится к радикалу формулы -NH2, -NHRa или -NRaRb, необязательно кватернизированному, например, метиламино, этиламино, диметиламино, диэтиламино, пропиламино и т.д.
“Гало”, «галоген» или “_алл” относится к брому, хлору, йоду или фтору.
Имеющиеся в данном описании указания на замещенные группы в соединениях по настоящему изобретению относятся к указанному фрагменту, который может быть замещен по одному или более (например, 1, 2, 3 или 4) доступным положениям одной или более подходящими группами, например, галогеном, таким как фтор, хлор, бром и йод; циано; гидроксилом; нитро; азидо; ацилом, таким как алканоил, например, C1-6алканоильной группой, и тому подобное; карбоксамидо; алкильными группами, включая такие группы, которые содержат от 1 до около 12 атомов углерода или от 1 до около 6 атомов углерода и, более предпочтительно, 1-3 атома углерода; алкенильными и алкинильными группами, включая группы, имеющие одну или более (например, 1, 2, 3 или 4) ненасыщенных связей и от 2 до около 12 атомов углерода или от 2 до около 6 атомов углерода; алкоксигруппами, имеющими одну или более (например, 1, 2, 3 или 4) кислородных связей и от 1 до около 12 атомов углерода или от 1 до около 6 атомов углерода; арилокси, таким как фенокси; алкилтиогруппами, включая такие группы, которые имеют одну или более (например, 1, 2, 3 или 4) тиоэфирных связей и от 1 до около 12 атомов углерода или от 1 до около 6 атомов углерода; алкилсульфинильными группами, включая такие группы, которые имеют одну или более (например, 1, 2, 3 или 4) сульфинильных связей и от 1 до около 12 атомов углерода или от 1 до около 6 атомов углерода; алкилсульфонильными группами, включая такие группы, которые имеют одну или более (например, 1, 2, 3 или 4) сульфонильных связей и от 1 до около 12 атомов углерода или от 1 до около 6 атомов углерода; аминоалкильными группами, такими как группы, имеющие один или более (например, 1, 2, 3 или 4) атомов N и от 1 до около 12 атомов углерода или от 1 до около 6 атомов углерода; карбоциклическими арилами, содержащими 6 или более атомов углерода, в частности, фенилом или нафтилом, и аралкилом, таким как бензил. Если не указано иное, необязательно замещенная группа может иметь заместитель в каждом способном к замещению положении группы, и каждый заместитель является независимым друг от друга.
Термин “соль” следует понимать как форму активного соединения, используемую согласно настоящему изобретению, в которой указанное соединение представлено в ионной форме или является заряженным и связано с противоионом (катионом или анионом) или находится в растворе. Данное определение включает также четвертичные аммониевые соли и комплексы активной молекулы с другими молекулами и ионами, в частности, комплексы, образованные посредством ионных взаимодействий. Определение включает, в частности, физиологически приемлемые соли; данный термин следует понимать как эквивалентный термину “фармакологически приемлемые соли”.
Термин “фармацевтически приемлемые соли” в контексте настоящего изобретения подразумевает соль, которая является физиологически допустимой (обычно это означает, что она нетоксична, в частности, получена с противоионом), при использовании в соответствующей форме для лечения, введения или применения, в частности, людям и/или млекопитающим. Указанные физиологически приемлемые соли могут быть образованы с анионами или кислотами и в контексте настоящего изобретения понимаются как соли, образованные, по меньшей мере, одним соединением, используемым согласно настоящему изобретению - обычно протонированные, например, в азоте - такие как катион, и, по меньшей мере, один физиологически допустимый анион, в частности, когда применяется на людях и/или млекопитающих. В контексте настоящего изобретения данное определение, в частности, включает соль, образованную физиологически допустимой кислотой, то есть соли конкретного активного соединения с физиологически допустимыми органическими или неорганическими кислотами - в частности, при применении на людях и/или млекопитающих. Примерами такого типа солей являются такие, которые образованы с: хлористоводородной кислотой, бромистоводородной кислотой, серной кислотой, метансульфоновой кислотой, муравьиной кислотой, уксусной кислота, щавелевой кислотой, янтарной кислотой, яблочной кислотой, виноградной кислотой, миндальной кислотой, фумаровой кислотой, молочной кислотой или лимонной кислотой.
Термин “сольват” согласно настоящему изобретению следует понимать как обозначающий форму активного соединения согласно изобретению, в которой указанное соединение связано нековалентной связью с другой молекулой (обычно в полярном растворителе), особенно, включая гидраты и алкоголяты, подобно, например, метаноляту. Предпочтительным сольватом является гидрат.
Соединения по настоящему изобретению могут быть в кристаллической форме либо в виде свободных соединений, или в виде сольватов и предполагается, что обе формы входят в объем настоящего изобретения. Способы сольватирования, как правило, известны в данной области. Подходящие сольваты представляют собой фармацевтически приемлемые сольваты. В конкретном варианте осуществления сольват представляет собой гидрат.
Любое соединение, которое является пролекарством соединения формулы (I), также входит в объем настоящего изобретения. Термин “пролекарство” используется в его наиболее широком смысле и охватывает такие производные, которые in vivo преобразуются в соединения по настоящему изобретению. Примеры пролекарств включают, но, не ограничиваясь ими, производные и метаболиты соединений формулы I, которые включают биогидролизуемые фрагменты, такие как биогидролизуемые амидные, биогидролизуемые сложноэфирные, биогидролизуемые карбаматные, биогидролизуемые карбонатные, биогидролизуемые уреидные и биогидролизуемые фосфатные аналоги. Предпочтительно, пролекарства соединений с карбоксильными функциональными группами представляют собой низшие алкиловые эфиры карбоновой кислоты. Эфиры карбоновых кислот удобно образуются путем этерификации групп карбоновых кислот, имеющихся на молекуле. Пролекарства обычно могут быть получены с использованием хорошо известных способов, таких как описано в обзорах Burger “Medicinal Chemistry and Drug Discovery 6th ed. (Donald J. Abraham ed., 2001, Wiley), “Design and Applications of Priodrugs” (H. Bundgaard ed., 1985, Harwood Academic Publishers) and Krogsgaard-Larsen et al. “Textbook of Drug design and Discovery” Taylor & Francis (April 2002).
Соединения по настоящему изобретению, представленные вышеописанной формулой (I), могут включать энантиомеры, в зависимости от присутствия хиральных центров, или изомеры, в зависимости от присутствия кратных связей (например, Z, E). Индивидуальные изомеры, энантиомеры или диастереоизомеры и их смеси входят в объем настоящего изобретения.
Кроме того, соединение, на которое в данном описании ссылаются, может существовать в виде таутомеров. В частности, термин таутомер относится к одному из двух или более структурным изомерам соединения, которые существуют в равновесии и легко преобразуются из одной изомерной формы в другую. Общие таутомерными парами являются амин-имин, амид-имидная кислота, кето-енол, лактам-лактим и т.д.
Если не указано иное, соединения по настоящему изобретению также подразумевают включение изотопно-меченных форм, то есть соединения, которые отличаются только присутствием одного или более изотопно-обогащенных атомов. Например, соединения, имеющие настоящие структуры, за исключением замены, по меньшей мере, одного атома водорода дейтерием или тритием, или замены, по меньшей мере, одного атома углерода 13C- или 14C-обогащенным атомом углерода, или замены, по меньшей мере, одного атома азота 15N-обогащенным атомом азота, входят в объем настоящего изобретения.
Соединения формулы (I) или их соли или сольваты находятся, предпочтительно, в фармацевтически приемлемой или по существу чистой форме. Под фармацевтически приемлемой формой подразумевают, среди прочих, имеющую фармацевтически приемлемую степень чистоты, исключая обычные фармацевтические добавки, такие как разбавители и носители, и, не включая вещество, которое рассматривается как токсичное при обычных уровнях доз. Степень чистоты для лекарственного вещества, предпочтительно, составляет выше 50%, более предпочтительно, выше 70%, наиболее предпочтительно, выше 90%. В предпочтительном варианте осуществления она составляет выше 95% соединения формулы (I) или его солей, сольватов или пролекарств.
Термин “фармацевтически приемлемые соли, сольваты, пролекарства” относится к фармацевтически приемлемой соли, сложному эфиру, сольвату или иному соединению, которое при введении реципиенту способно обеспечить (прямо или косвенно) описанное в данном описании соединение. Однако следует понимать, что нефармацевтически приемлемые соли также входят в объем настоящего изобретения, поскольку такие соли могут быть использованы при получении фармацевтически приемлемых солей. Получение солей, пролекарств и производных может быть осуществлено способами, известными в данной области.
Как используется в данном описании, термины “лечить”, “лечение” и “обработка” включают уничтожение, удаление, реверсию, ослабление, модификацию или контроль заболевания или состояния, опосредованного сигма рецептором.
Как используется в данном описании, термины «предотвращение», «предотвращающий», «предохранительный», «предотвращать» и профилактика относятся к возможности соединения формулы (I) избежать, минимизировать или затруднить начало или развитие заболевания или состояния, опосредованных сигма рецептором, до их начала.
Термин “фармакологический инструмент” относится к свойству соединений по настоящему изобретению, благодаря которым они представляют собой, в частности, селективные лиганды для сигма рецепторов, из чего вытекает, что соединение формулы (I), описанное в настоящем изобретении, может быть использовано в качестве модели для тестирования других соединений в качестве сигма лигандов, за исключением замененных радиоактивных лигандов, а также может быть использовано для моделирования физиологических действий, связанных с сигма рецепторами.
Согласно одному варианту осуществления, R1 в формуле (I) выше выбран из 5-10-членной замещенной или незамещенной, ароматической или неароматической гетероциклильной группы, которая, предпочтительно, содержит N, O или S в качестве члена кольца; 5-10-членной замещенной или незамещенной арильной группы; и 5-10-членной замещенной или незамещенной циклоалкильной группы.
В предпочтительном варианте осуществления R1 в формуле (I) выше выбран из замещенного или незамещенного циклопентила, замещенного или незамещенного циклогексила, замещенного или незамещенного фенила, замещенного или незамещенного нафтила, замещенного или незамещенного тиофена, замещенного или незамещенного бензотиофена, замещенного или незамещенного бензофурана, замещенного или незамещенного пиридина и замещенного или незамещенного хинолина.
В еще более предпочтительном варианте осуществления R1 в формуле (I) выше выбран из группы, состоящей из: 2-тиенила, 3-тиенила, 2,5-дихлор-3-тиенила, 2,3-дихлор-5-тиенила, 2,3-дихлор-4-тиенила, 2-бензотиенила, 3-бензотиенила, 4-бензотиенила, 5-бензотиенила, 7-бензотиенила, 2-бензофурила, 5-бензофурила, 2-пиридила, 3-пиридила, 4-пиридила, 2-хинолила, 3-хинолила, 5-хинолила, 6-хинолила, 3,4-дифторфенила, 3,4-дихлорфенила, циклопентила и циклогексила.
В другом предпочтительном варианте осуществления R1 в формуле (I) выше представляет собой α или β нафтил, предпочтительно выбранный из следующих α или β нафтильных групп: 7-гидрокси-2-нафтила, 6-гидрокси-2-нафтила, 5-гидрокси-2-нафтила, 6-фтор-2-нафтила, 6-метокси-2-нафтила, 6-бром-2-нафтила, 6-гидроксиметил-2-нафтила, 6-фторметил-2-нафтила, 7-гидрокси-1-нафтила, 6-гидрокси-1-нафтила, 5-гидрокси-1-нафтила, 5-фтор-1-нафтила, 5-бром-1-нафтила и 1-нафтила.
В другом варианте осуществления R2 и R3 в формуле (I) независимо выбраны из H и замещенной или незамещенной C1-6алкильной группы, предпочтительно, метила. Более конкретными вариантами осуществления являются такие, где R2 представляет собой метил, и R3 представляет собой H, или R2 и R3 одновременно представляют собой H или одновременно метил.
В предпочтительном варианте осуществления R4 и R5 вместе с атомом азота, к которому они присоединены, образуют замещенную или незамещенную гетероциклильную группу. Более предпочтительно, R4 и R5, взятые вместе, образуют морфолин-4-ильную группу, пиперидиновую группу, пирролидиновую группу или пиперазин-4-ильную группу.
Предпочтительными значениями m и n независимо являются 1 и 2.
Далее, X предпочтительно представляет собой атом кислорода или группу -CH2-.
В дополнительных предпочтительных вариантах осуществления предпочтительные значения различных заместителей, описанных выше, объединены. Настоящее изобретение также относится к таким сочетаниям предпочтительных заместителей в формуле (I) выше.
Конкретные отдельные соединения по настоящему изобретению, подпадающие под формулу (I), включают соединения, перечисленные ниже:
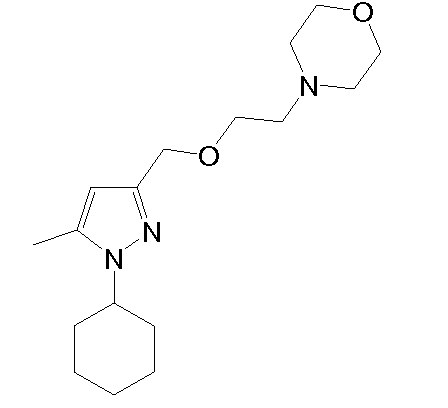
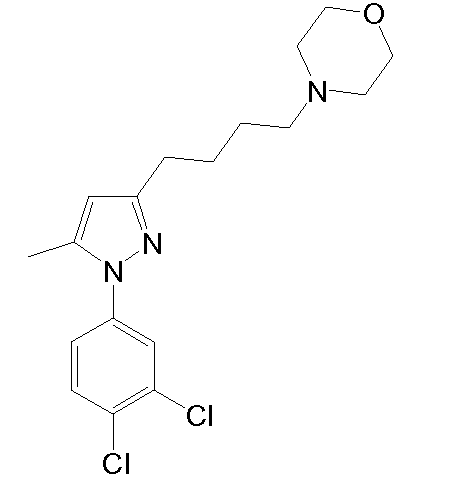
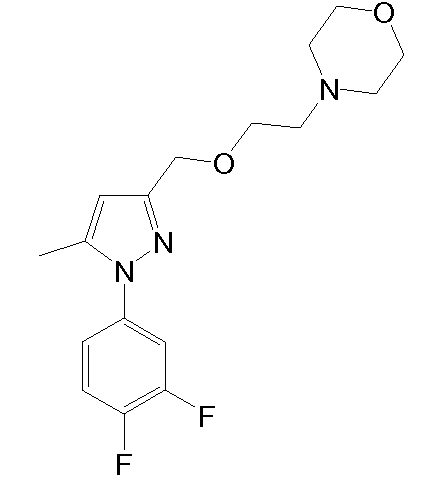
4-(2-((1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-ил)метокси)этил)морфолин,
4-(2-((5-метил-1-(нафталин-2-ил)-1H-пиразол-3-ил)метокси)этил)морфолин,
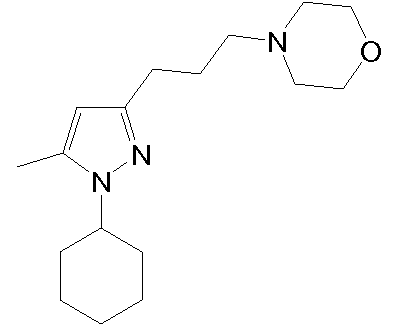
4-(3-(1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-ил)пропил)морфолин,
4-(3-(5-метил-1-(нафталин-2-ил)-1H-пиразол-3-ил)пропил)морфолин,
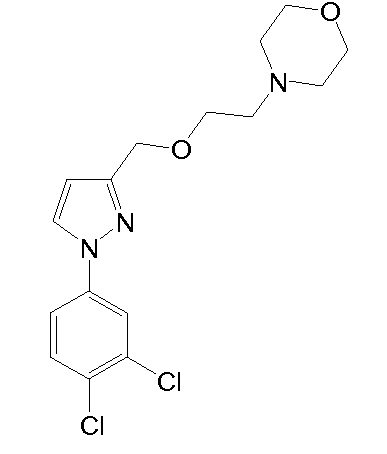
4-(2-(2-(1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-ил)этокси)этил)морфолин,
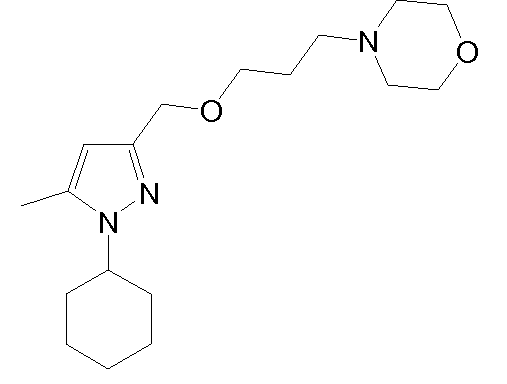
4-(2-((1-циклогексил-5-метил-1H-пиразол-3-ил)метокси)этил)морфолин,
4-(3-(1-циклогексил-5-метил-1H-пиразол-3-ил)пропил)морфолин,
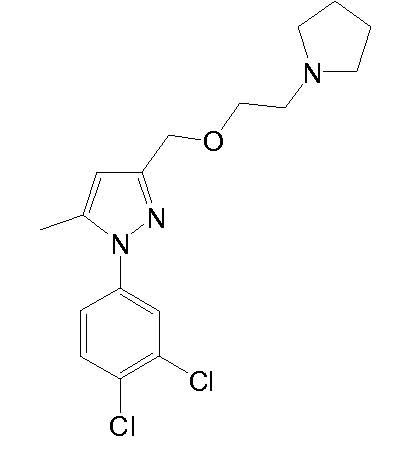
1-(3,4-дихлорфенил)-5-метил-3-((2-(пирролидин-1-ил)этокси)метил)-1H-пиразол,
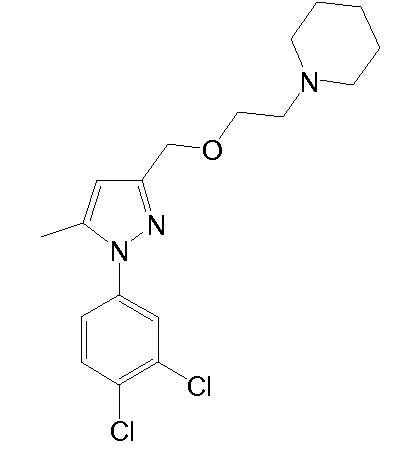
1-(2-((1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-ил)метокси)этил)пиперидин,
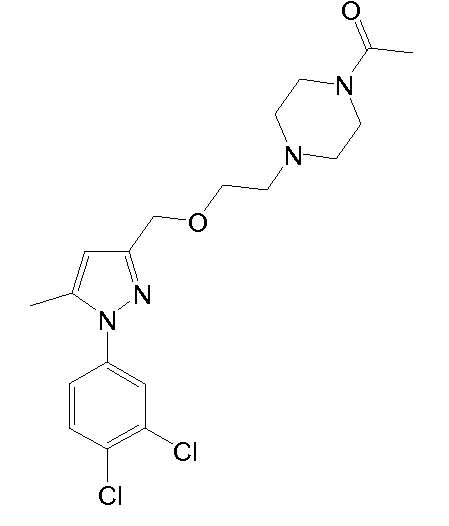
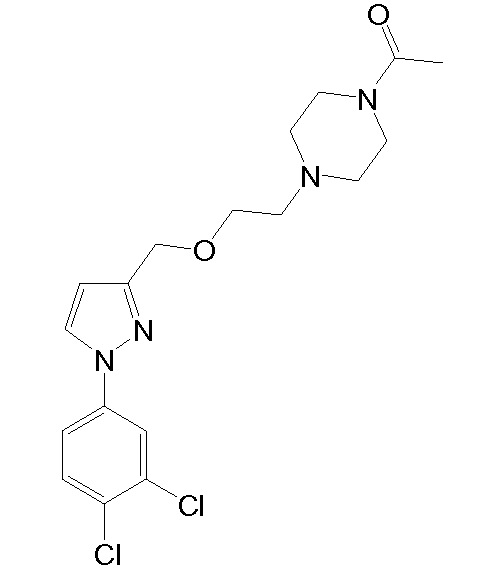
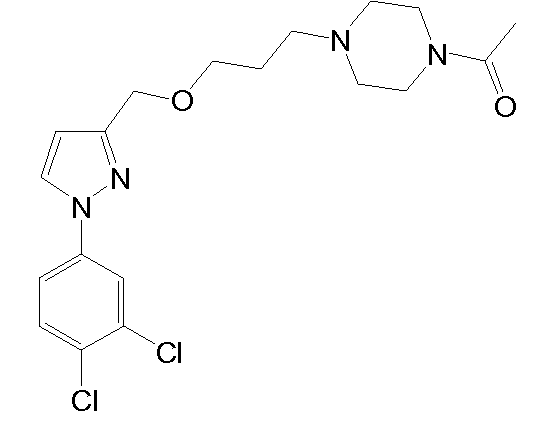
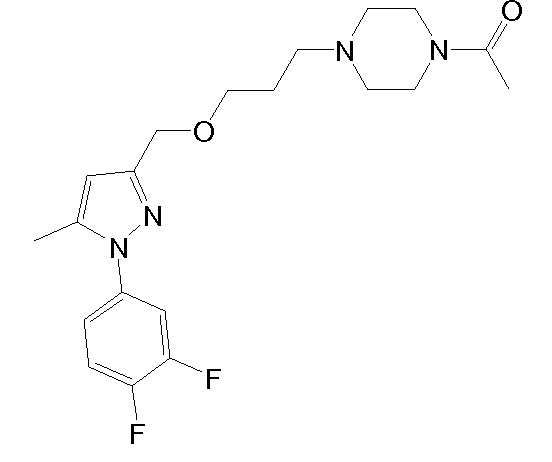
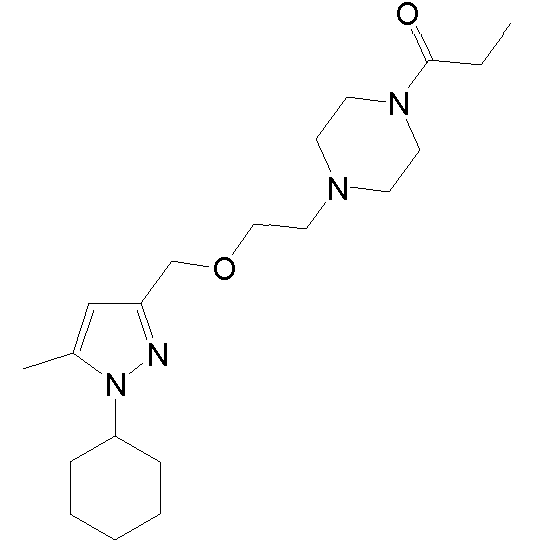
1-(4-(2-((1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-ил)метокси)этил)пиперазин-1-ил)этанон,
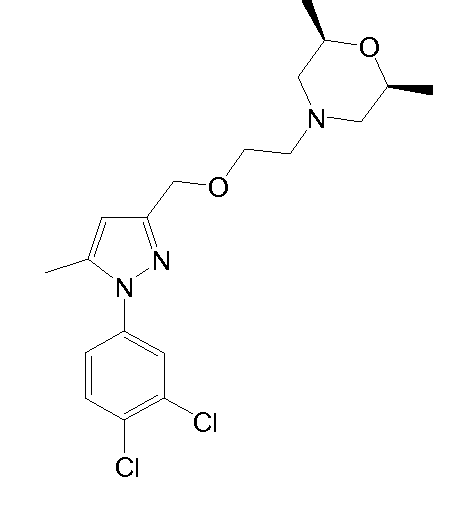
(2S,6R)-4-(2-((1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-ил)метокси)этил)-2,6-диметилморфолин,
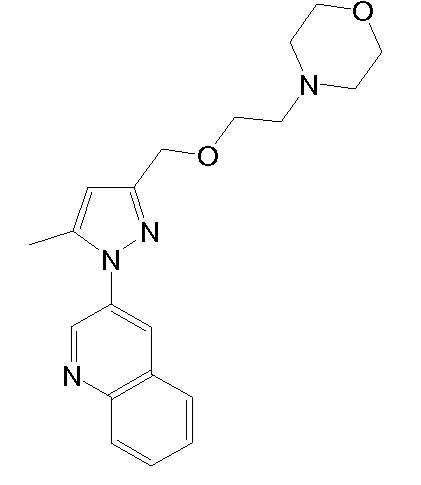
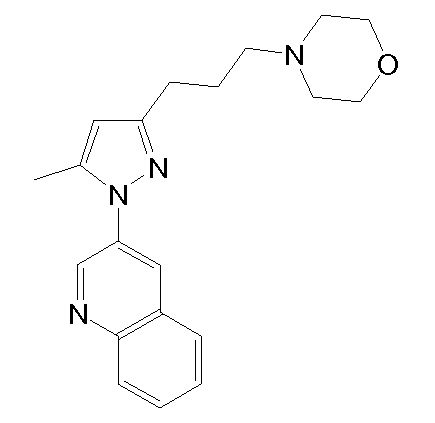
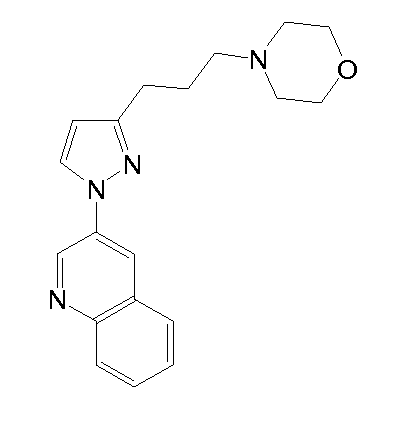
4-(2-((5-метил-1-(хинолин-3-ил)-1H-пиразол-3-ил)метокси)этил)морфолин,
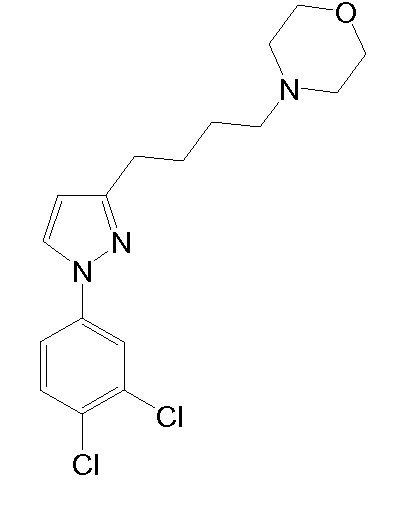
4-(4-(1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-ил)бутил)морфолин,
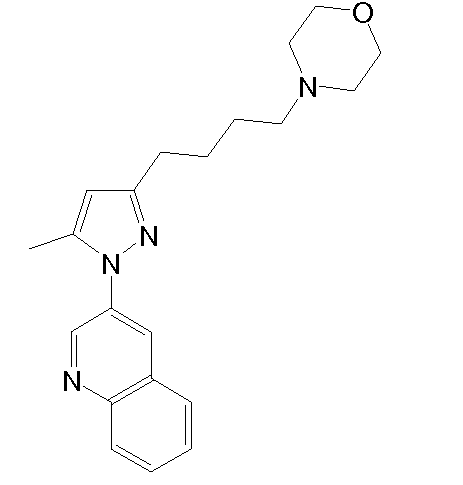
4-(3-(5-метил-1-(хинолин-3-ил)-1H-пиразол-3-ил)пропил)морфолин,
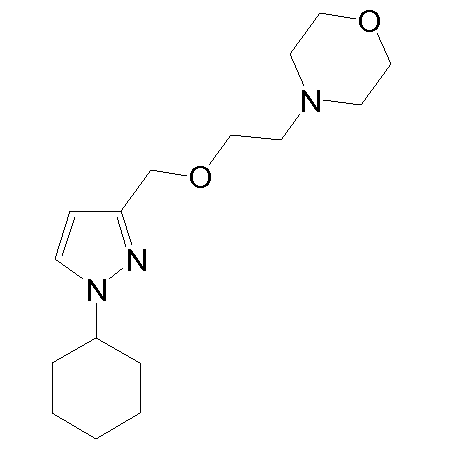
4-(2-((1-(3,4-дихлорфенил)-1H-пиразол-3-ил)метокси)этил)морфолин,
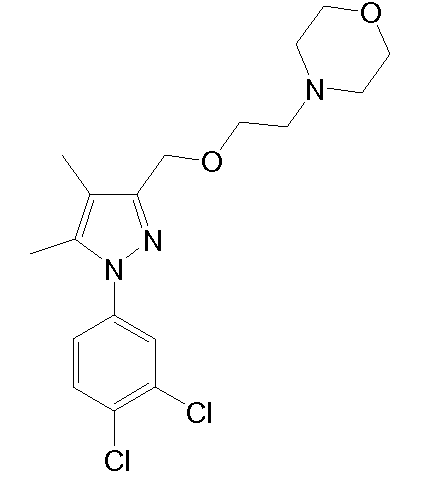
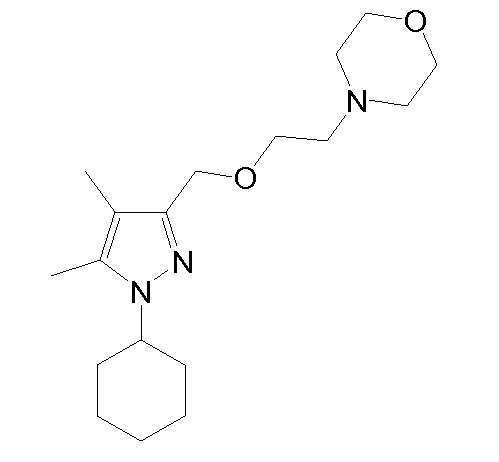
4-(2-((1-(3,4-дихлорфенил)-4,5-диметил-1H-пиразол-3-ил)метокси)этил)морфолин,
4-(3-(1-(хинолин-3-ил)-1H-пиразол-3-ил)пропил)морфолин,
4-(4-(1-(3,4-дихлорфенил)-1H-пиразол-3-ил)бутил)морфолин,
4-(4-(5-метил-1-(хинолин-3-ил)-1H-пиразол-3-ил)бутил)морфолин,
4-(3-((1-циклогексил-5-метил-1H-пиразол-3-ил)метокси)пропил)морфолин,
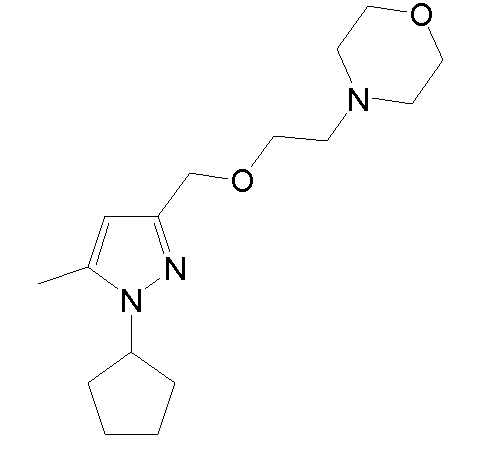
4-(2-((1-циклопентил-5-метил-1H-пиразол-3-ил)метокси)этил)морфолин,
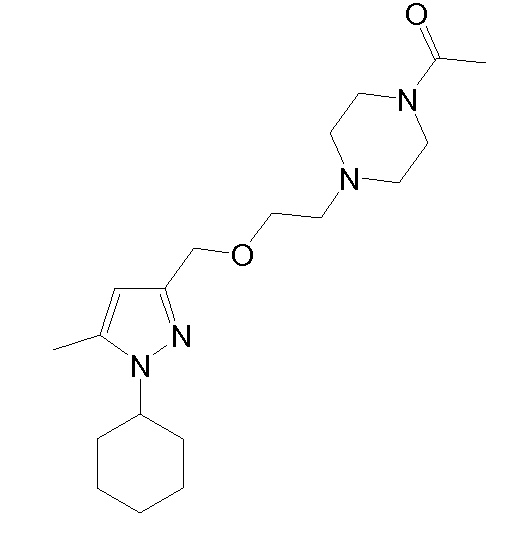
гидрохлорид 1-(4-(2-((1-циклогексил-5-метил-1H-пиразол-3-ил)метокси)этил)пиперазин-1-ил)этанона,
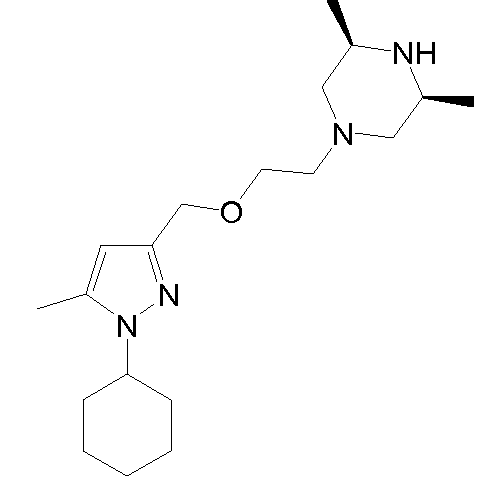
гидрохлорид (3S,5R)-1-(2-((1-циклогексил-5-метил-1H-пиразол-3-ил)метокси)этил)-3,5-диметилпиперазина,
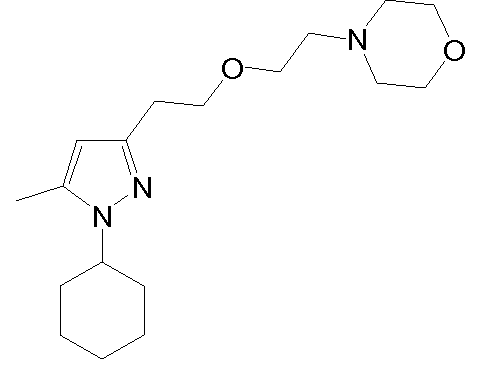
гидрохлорид 4-(2-(2-(1-циклогексил-5-метил-1H-пиразол-3-ил)этокси)этил)морфолина,
гидрохлорид 4-(2-((1-циклогексил-1H-пиразол-3-ил)метокси)этил)морфолина,
гидрохлорид 4-(2-((1-циклогексил-4,5-диметил-1H-пиразол-3-ил)метокси)этил)морфолина,
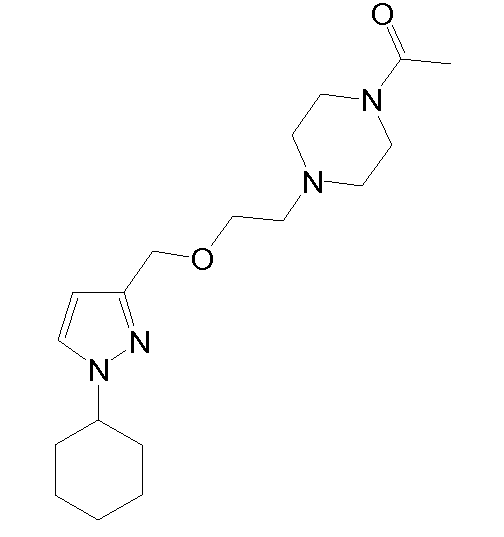
1-(4-(2-((1-циклогексил-1H-пиразол-3-ил)метокси)этил)пиперазин-1-ил)этанон,
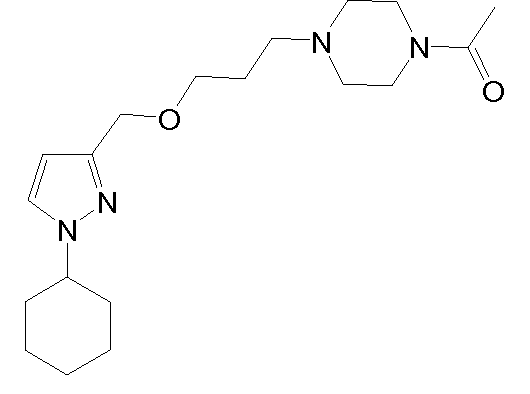
1-(4-(3-((1-циклогексил-1H-пиразол-3-ил)метокси)пропил)пиперазин-1-ил)этанон,
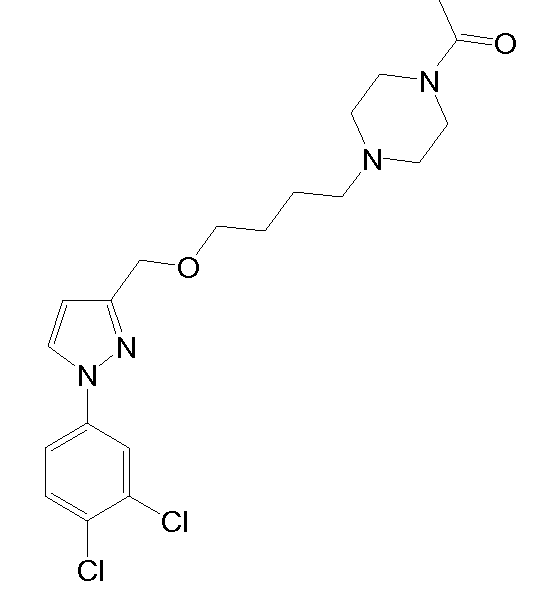
1-(4-(4-((1-циклогексил-1H-пиразол-3-ил)метокси)бутил)пиперазин-1-ил)этанон,
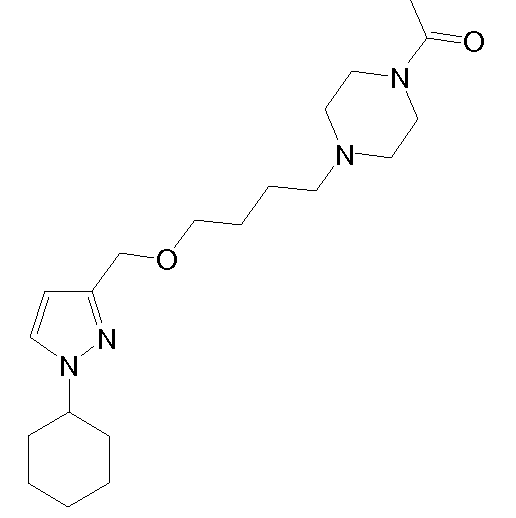
1-(4-(4-((1-циклогексил-5-метил-1H-пиразол-3-ил)метокси)бутил)пиперазин-1-ил)этанон,
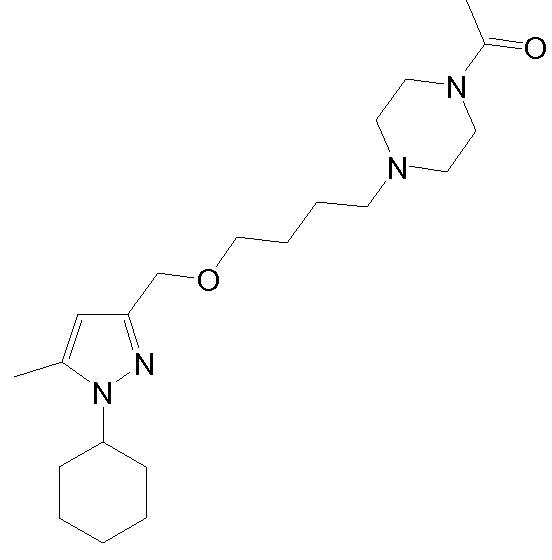
1-(4-(3-((1-циклогексил-5-метил-1H-пиразол-3-ил)метокси)пропил)пиперазин-1-ил)этанон,
1-(4-(2-((1-(3,4-дихлорфенил)-1H-пиразол-3-ил)метокси)этил)пиперазин-1-ил)этанон,
1-(4-(3-((1-(3,4-дихлорфенил)-1H-пиразол-3-ил)метокси)пропил)пиперазин-1-ил)этанон,
1-(4-(4-((1-(3,4-дихлорфенил)-1H-пиразол-3-ил)метокси)бутил)пиперазин-1-ил)этанон,
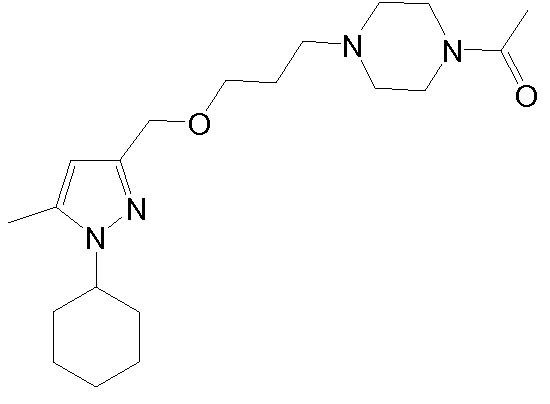
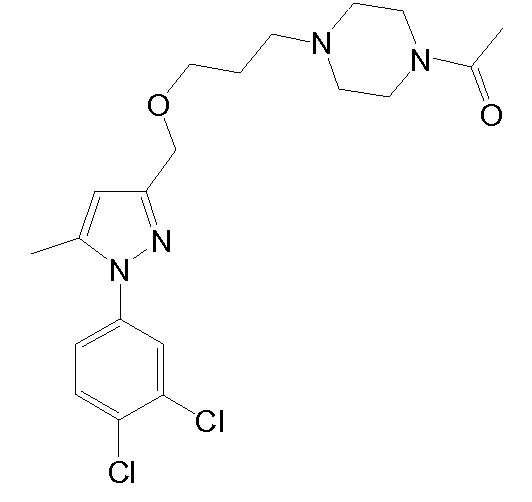
1-(4-(3-((1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-ил)метокси)пропил)пиперазин-1-ил)этанон,
1-(4-(3-((1-(3,4-дифторфенил)-1H-пиразол-3-ил)метокси)пропил)пиперазин-1-ил)этанон,
1-(4-(3-((1-(3,4-дифторфенил)-5-метил-1H-пиразол-3-ил)метокси)пропил)пиперазин-1-ил)этанон,
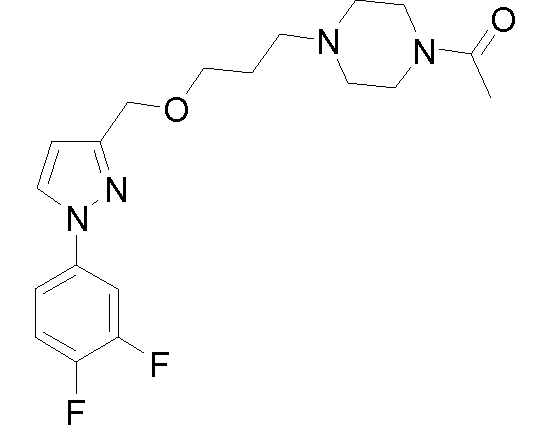
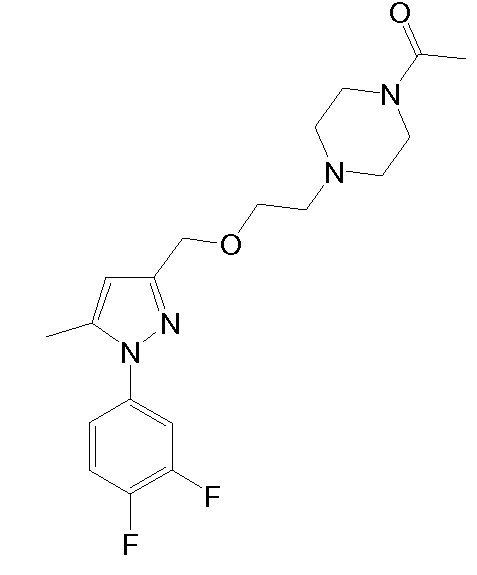
1-(4-(2-((1-(3,4-дифторфенил)-5-метил-1H-пиразол-3-ил)метокси)этил)пиперазин-1-ил)этанон,
1-(4-(2-((1-(3,4-дифторфенил)-1H-пиразол-3-ил)метокси)этил)пиперазин-1-ил)этанон,
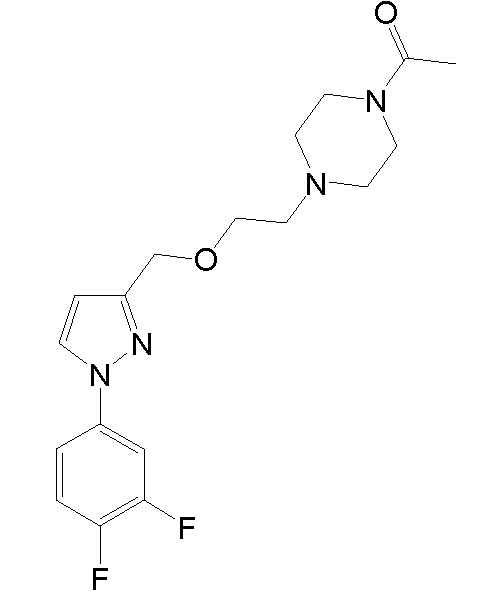
4-(2-((1-(3,4-дифторфенил)-5-метил-1H-пиразол-3-ил)метокси)этил)морфолин,
4-(2-((1-(3,4-дифторфенил)-1H-пиразол-3-ил)метокси)этил)морфолин,
4-(3-((1-(3,4-дифторфенил)-5-метил-1H-пиразол-3-ил)метокси)пропил)морфолин,
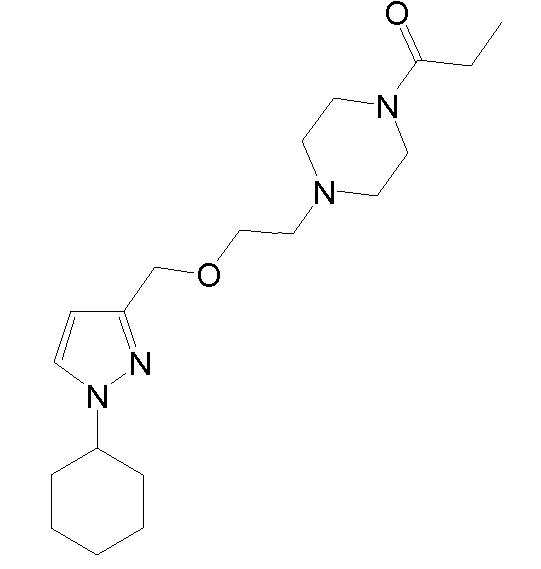
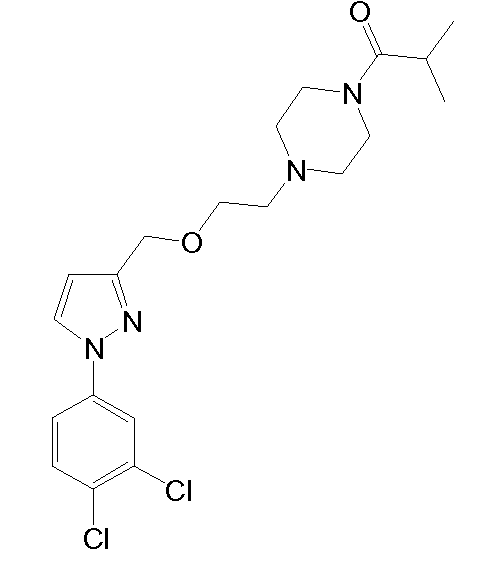
1-(4-(2-((1-циклогексил-5-метил-1H-пиразол-3-ил)метокси)этил)пиперазин-1-ил)пропан-1-он,
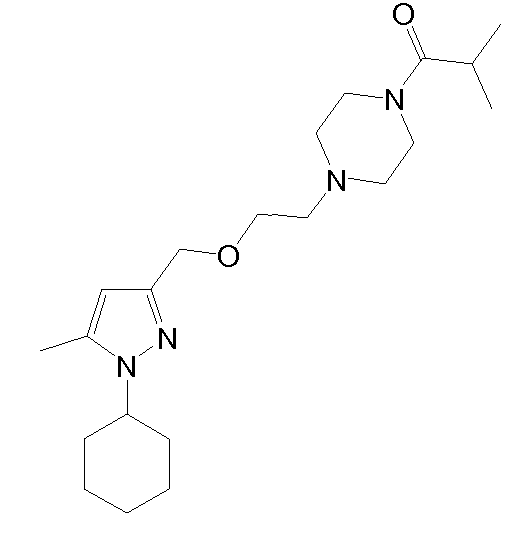
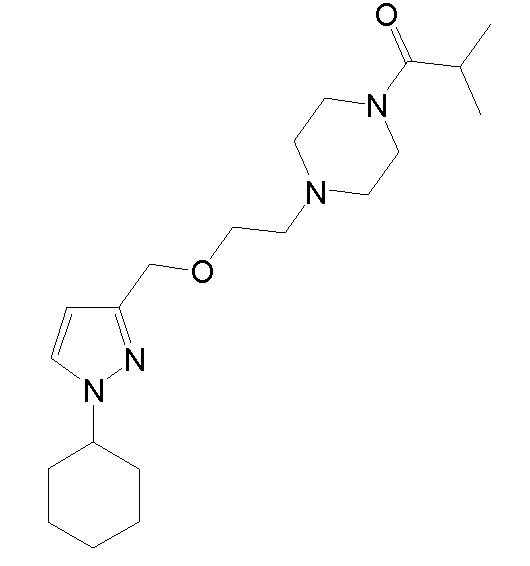
1-(4-(2-((1-циклогексил-5-метил-1H-пиразол-3-ил)метокси)этил)пиперазин-1-ил)-2-метилпропан-1-он,
1-(4-(2-((1-циклогексил-1H-пиразол-3-ил)метокси)этил)пиперазин-1-ил)пропан-1-он,
1-(4-(2-((1-циклогексил-1H-пиразол-3-ил)метокси)этил)пиперазин-1-ил)-2-метилпропан-1-он,
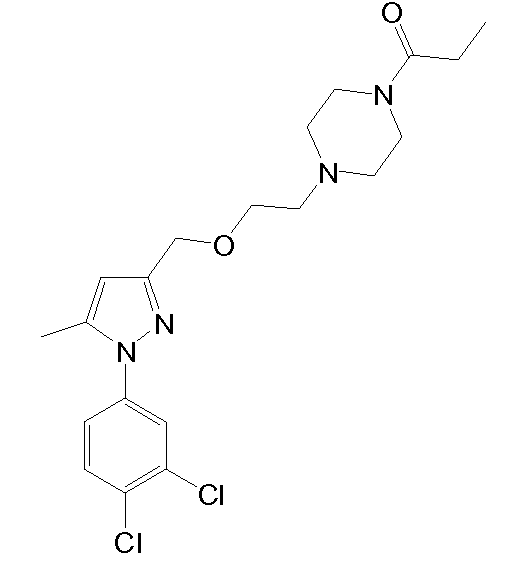
1-(4-(2-((1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-ил)метокси)этил)пиперазин-1-ил)пропан-1-он,
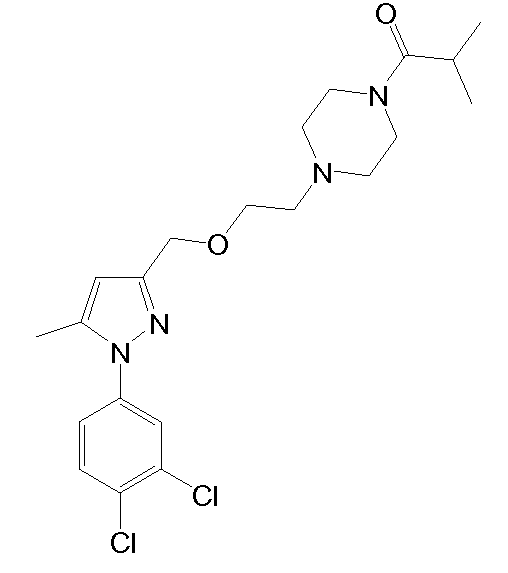
1-(4-(2-((1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-ил)метокси)этил)пиперазин-1-ил)-2-метилпропан-1-он,
1-(4-(2-((1-(3,4-дихлорфенил)-1H-пиразол-3-ил)метокси)этил)пиперазин-1-ил)пропан-1-он,
1-(4-(2-((1-(3,4-дихлорфенил)-1H-пиразол-3-ил)метокси)этил)пиперазин-1-ил)-2-метилпропан-1-он,
или их фармацевтически приемлемую соль, пролекарство или сольват.
В другом аспекте настоящее изобретение относится к способу получения соединений общей формулы (I), как описано выше.
Соединения, соответствующие предпочтительным вариантам осуществления в соответствии с общей формулой (Ia), (Ib), (Ic) и (Id) могут быть получены следующим образом:
Схема реакций (I)
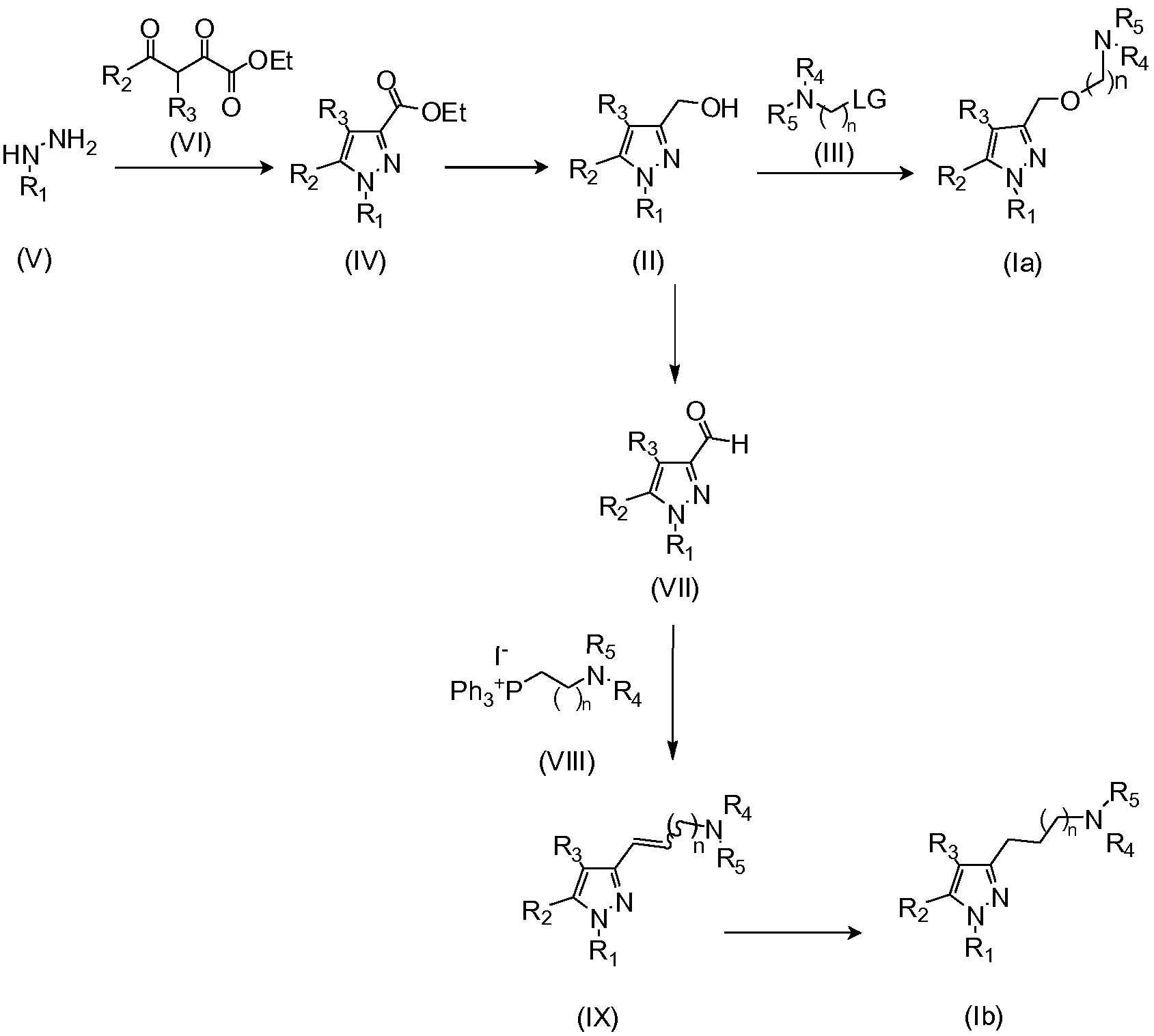
Схема реакций (II)
Способ A
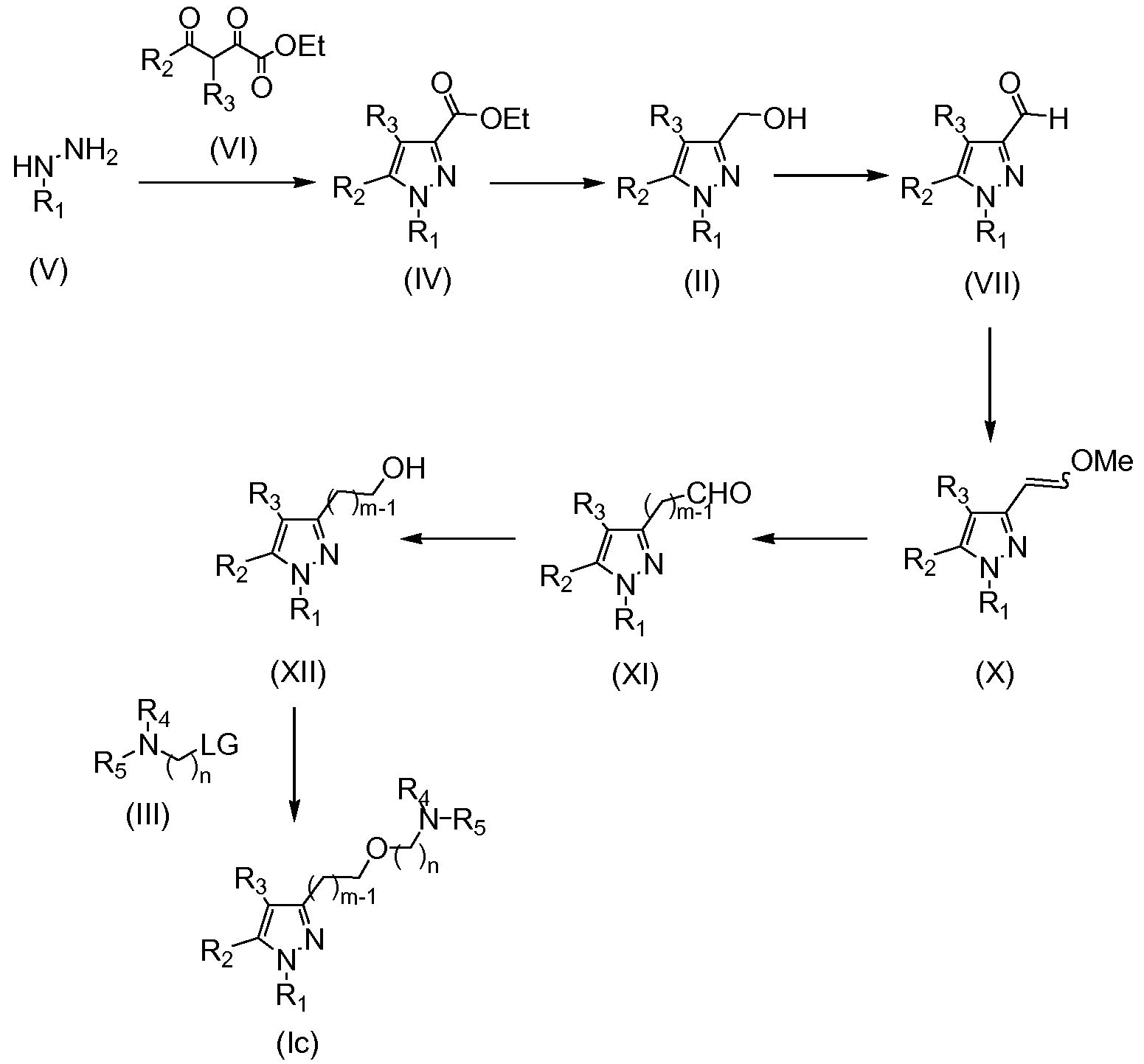
Способ B
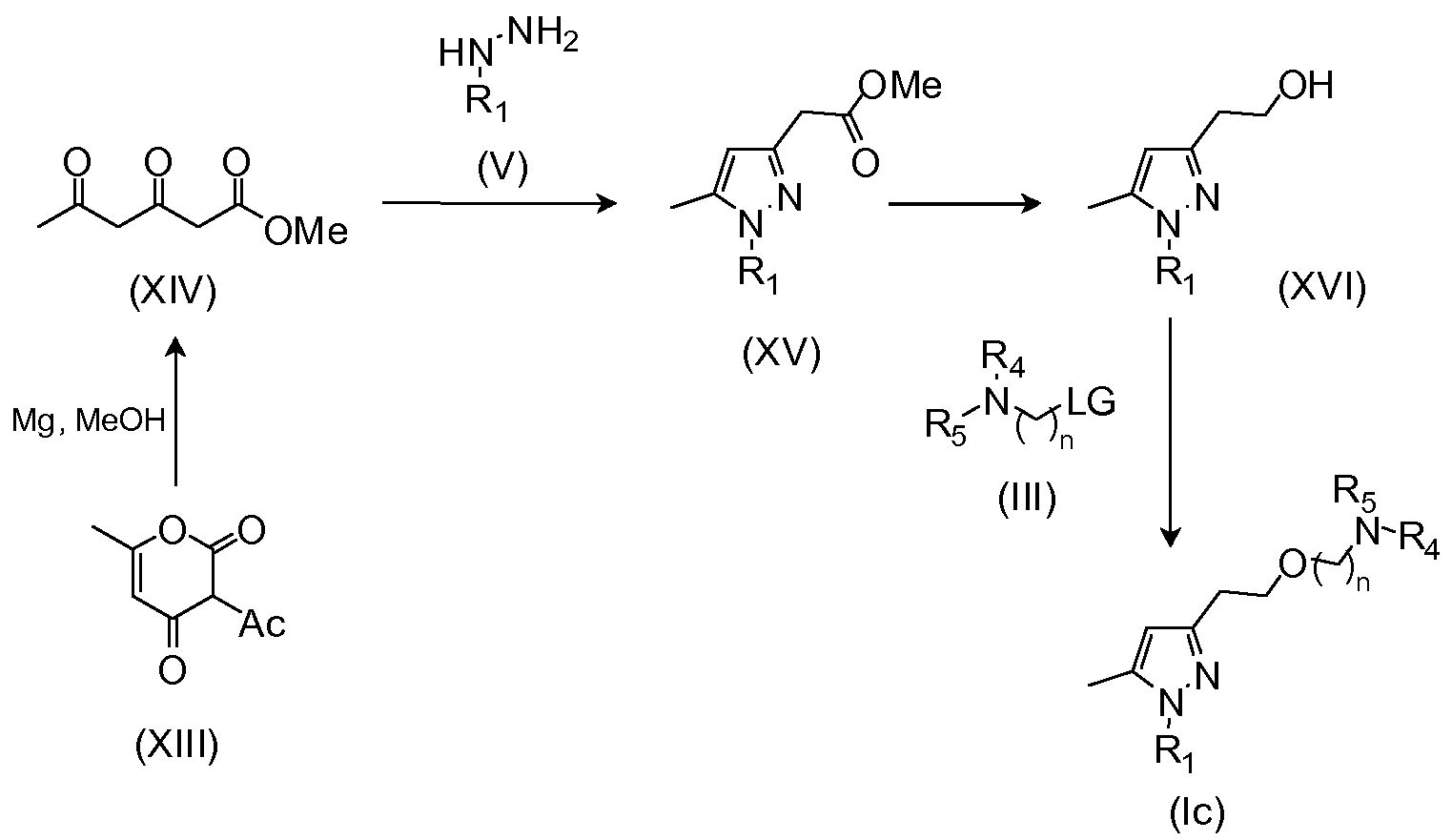
Схема реакций (III)
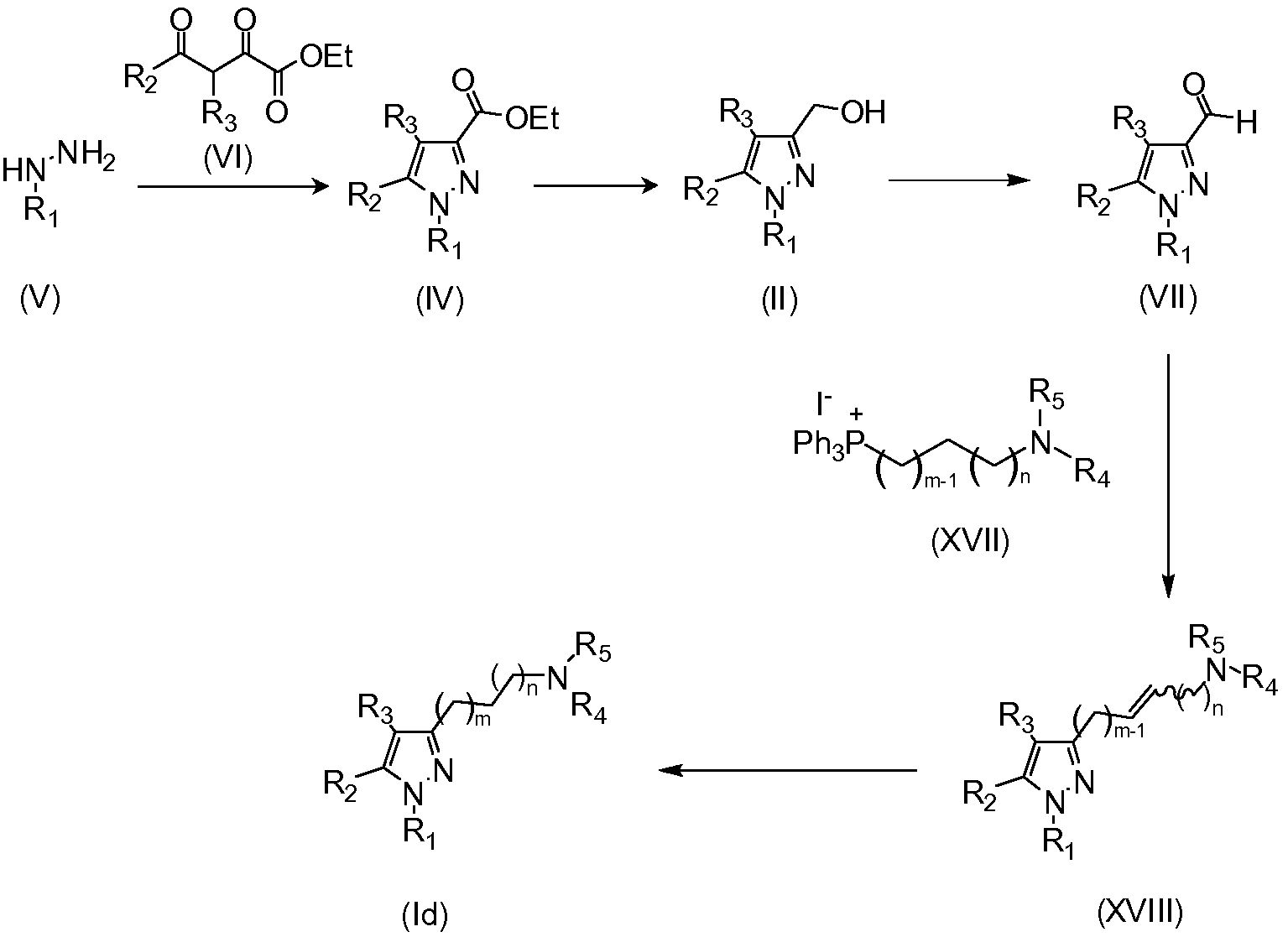
Способ получения соединения формулы (Ia)
Взаимодействие соединения формулы (II) с соединением формулы (III) в присутствии основания и подходящего растворителя; где LG представляет собой удаляемую группу, которая может быть выбрана из галогена, например, брома или хлорида, или арилсульфонильной группы, например, мезилата, трифлата или тозилата и тому подобное. Данное взаимодействие осуществляют в подходящем растворителе, который является реакционноинертным растворителем, таким как углеводороды, подобно толуолу; галогенированные углеводороды, например, дихлорметан, хлороформ; диполярные апротонные растворители, такие как ацетонитрил, N,N-диметилформамид (ДМФА), N,N-диметилацетамид (DMA), диметилсульфоксид (ДМСО), гексаметилфосфоротриамид (HMPT); простые эфиры, такие как тетрагидрофуран (ТГФ), их смеси с водой и тому подобное. Основание является достаточно сильным, чтобы удалить атом водорода из гидроксигруппы, например гидрид щелочного или щелочноземельного металла, такой как гидрид лития или гидрид натрия, или алкоксид щелочного металла, такой как метоксид или этоксид натрия или калия, трет-бутоксид калия или карбонат калия, триэтиламин, пиридин, йодид натрия, карбонат цезия и т.д.
Соединения формулы (III) являются коммерчески доступными или получены способами, известными специалистам в данной области, например, как описано в EP0529973.
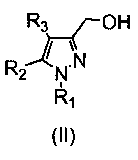
Промежуточные соединения формулы (II) могут быть получены, как описано в WO2007079086, путем восстановления соединения формулы (IV).
Пиразолкарбоксилаты формулы (IV) могут быть получены, как описано в WO2007079086, путем взаимодействия производного гидразина (V) с 1,3-дикетоном формулы (VI) в подходящем растворителе, таком как уксусная кислота.
Гидразины (V) могут быть коммерчески доступными или получены из соответствующих нитро, амино или галоген замещенных производных способами, как правило, известными специалистам в данной области. (J. Am. Chem. Soc. 1998, 120, 6621; Angew. Chem., Int. Ed. 1998, 37, 2090).
1,3-дикетоны (VI) могут быть получены путем конденсации Кляйзена алкилкетона формулы CH3COR2 с диэтилоксалатом.
Способ получения соединения формулы (Ib)
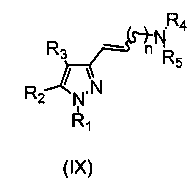
Соединения формулы (Ib) могут быть получены путем восстановления соединения формулы (IX) способами, известными специалистам в данной области (Paul N. Rylander in “Hydrogenation Methods”, Ed. Academic Press, 1990).
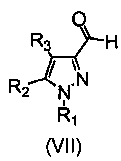
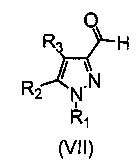
Соединение формулы (IX) может быть получено путем взаимодействия соединения формулы (VII) с фосфониевой солью формулы (VIII) в присутствии основания и подходящего растворителя. Подходящим растворителем будет реакционноинертный растворитель, такой как углеводороды, подобные толуолу; галогенированные углеводороды, например, дихлорметан, хлороформ; диполярные апротонные растворители, такие как N,N-диметилформамид (ДМФА), и тому подобное; простые эфиры, такие как тетрагидрофуран (ТГФ), и тому подобное; и основание, например, гидрид щелочного или щелочноземельного металла, такой как либо гидрид натрия, либо алкоксид щелочного металла, такой как метоксид или этоксид натрия или калия, трет-бутоксид калия или карбонат калия, бутиллитий, триэтиламин, пиридин и т.д. (Chem. Rev. 1989, 89, 863-927; Top. Stereochem. 1994, 21, 1).
Фосфониевые соли (VIII) получены способами, известными специалистам в данной области, из коммерчески доступных галогенидов путем взаимодействия с трифенилфосфином в присутствии подходящего растворителя. (I. Gosney, A. G. Rowley in “Organophosphorous Reagents in Organic Synthesis”, Ed. J. I. G. Cadogan, Academic Press, New York, 1979, Chpt 2; J Org. Chem. 1984, 49, 4293-4295 и цитируемые там ссылки).
Соединения формулы (VII) могут быть получены путем окисления вышеописанных промежуточных соединений (II) в присутствии подходящего окислительного агента, такого как оксид марганца (IV), в подходящем растворителе, таком как галогенированные углеводороды, например, дихлорметан, хлороформ. (Gabriel Tojo, Marcos Fernández in “Oxidation of Alcoholes to Aldehydes и Ketones: A Guide to Current Common Practice”, Ed. Springer, 2006, Chpt 8).
Способ получения соединения формулы (Ic)
Согласно способу A:
Взаимодействие соединения формулы (XII) с соединением формулы (III) в присутствии основания и подходящего растворителя; где LG представляет собой удаляемую группу, которая может быть выбрана из галогена, например, брома или хлорида, или арилсульфонильной группы, например, мезилата, трифлата или тозилата и тому подобное. Данное взаимодействие осуществляют в подходящем растворителе, которым будет являться реакционноинертный растворитель, такой как углеводороды, подобные толуолу; галогенированные углеводороды, например, дихлорметан, хлороформ; диполярные апротонные растворители, такие как ацетонитрил, N,N-диметилформамид (ДМФА), N,N-диметилацетамид (DMA), диметилсульфоксид (ДМСО), гексаметилфосфоротриамид (HMPT); простые эфиры, такие как тетрагидрофуран (ТГФ), их смеси с водой и тому подобное. Основание является достаточно сильным для удаления водорода у гидроксигруппы, например, гидрид щелочного или щелочноземельного металла, такой как гидрид лития или гидрид натрия, или алкоксид щелочного металла, такой как метоксид или этоксид натрия или калия, трет-бутоксид калия или карбонат калия, триэтиламин, пиридин, йодид натрия, карбонат цезия и т.д.
Соединения формулы (III) являются коммерчески доступными или получены способами, известными специалистам в данной области, например, как описано в EP0529973.
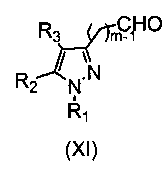
Промежуточные соединения формулы (XII) могут быть получены, как описано в WO2007079086, путем восстановления соединения формулы (XI).
Соединения формулы (XI) могут быть получены путем кислотного гидролиза способами, известными специалистам в данной области.
Соединение формулы (X) может быть получено путем взаимодействия соединения формулы (VII) с фосфониевой солью в присутствии основания и подходящего растворителя. Подходящим растворителем будет являться реакционноинертный растворитель, такой как углеводороды, подобные толуолу; галогенированные углеводороды, например, дихлорметан, хлороформ; диполярные апротонные растворители, такие как N,N-диметилформамид (ДМФА) и тому подобное; простые эфиры, такие как тетрагидрофуран (ТГФ) и тому подобное; и основание, например гидрид щелочного или щелочноземельного металла, такой как или гидрид натрия, или алкоксид щелочного металла, такой как метоксид или этоксид натрия или калия, трет-бутоксид калия или карбонат калия, бутиллитий, триэтиламин, пиридин и т.д. (Chem. Rev. 1989, 89, 863-927; Top. Stereochem. 1994, 21, 1).
Фосфониевые соли получены способами, известными специалистам в данной области, из коммерчески доступных галогенидов путем взаимодействия с трифенилфосфином в присутствии подходящего растворителя. (I. Gosney, A. G. Rowley, “Organophosphorous Reagents in Organic Synthesis”, Ed. J. I. G. Cadogan, Academic Press, New York, 1979, Chpt 2; J Org. Chem. 1984, 49, 4293-4295 и цитируемые там ссылки).
Соединения формулы (VII) могут быть получены путем окисления вышеописанных промежуточных соединений (II) в присутствии подходящего окислительного агента, такого как оксид марганца, в подходящем растворителе, таком как галогенированные углеводороды, например, дихлорметан, хлороформ. (Gabriel Tojo, Marcos Fernández, “Oxidation of Alcoholes to Aldehydes and Ketones: A Guide to Current Common Practice”, Ed. Springer, 2006, Chpt 8).
Промежуточные соединения формулы (II) могут быть получены, как описано в WO2007079086, путем восстановления соединения формулы (IV).
Пиразолкарбоксилаты формулы (IV) могут быть получены, как описано в WO2007079086, путем взаимодействия производного гидразина (V) с 1,3-дикетоном формулы (VI) в подходящем растворителе, таком как уксусная кислота.
Гидразины (V) могут быть коммерчески доступными или получены из соответствующих нитро, амино или галоген замещенных производных способами, обычно известными специалистам в данной области. (J. Am. Chem. Soc. 1998, 120, 6621; Angew. Chem., Int. Ed. 1998, 37, 2090).
1,3-дикетоны (VI) могут быть получены путем конденсации Кляйзена алкилкетона формулы CH3COR2 с диэтилоксалатом.
Согласно способу B:
Взаимодействие соединения формулы (XVI) с соединением формулы (III) в присутствии основания и подходящего растворителя; где LG представляет собой удаляемую группу, которая может быть выбрана из галогена, например, брома или хлорида, или арилсульфонильной группы, например, мезилата, трифлата или тозилата и тому подобное. Данное взаимодействие осуществляют в подходящем растворителе, которым будет являться реакционноинертный растворитель, такой как углеводороды, подобные толуолу; галогенированные углеводороды, например, дихлорметан, хлороформ; диполярные апротонные растворители, такие как ацетонитрил, N,N-диметилформамид (ДМФА), N,N-диметилацетамид (DMA), диметилсульфоксид (ДМСО), гексаметилфосфоротриамид (HMPT); простые эфиры, такие как тетрагидрофуран (ТГФ), их смеси с водой и тому подобное.
Основание является достаточно сильным для удаления водорода у гидроксигруппы, например, гидрид щелочного или щелочноземельного металла, такой как гидрид лития или гидрид натрия, или алкоксид щелочного металла, такой как метоксид или этоксид натрия или калия, трет-бутоксид калия или карбонат калия, триэтиламин, пиридин, йодид натрия, карбонат цезия и т.д.
Соединения формулы (III) являются коммерчески доступными или получены способами, известными специалистам в данной области, например, как описано в EP0529973.
Промежуточные соединения формулы (XVI) могут быть получены, как описано в WO2007079086, путем восстановления соединения формулы (XV).
Пиразолкарбоксилаты формулы (XV) могут быть получены, как описано в WO2007079086, путем взаимодействия производного гидразина (V) с метил 3,5-диоксогексаноатом формулы (XIV) в подходящем растворителе, таком как MeOH.
Гидразины (V) могут быть коммерчески доступными или получены из соответствующего нитро, амино или галоген замещенного производного способами, обычно известными специалистам в данной области. (J. Am. Chem. Soc. 1998, 120, 6621; Angew. Chem., Int. Ed. 1998, 37, 2090).
Метил 3,5-диоксогексаноат формулы (XIV) может быть получен путем взаимодействия коммерчески доступной дегидроуксусной кислоты (XIII) с магнием в MeOH (Tetrahedron Letters 2010, 51, 2741).
Способ получения соединения формулы (Id)
Способ является таким же, как описано выше для соединений формулы (Ib), используя подходящее соединение (XVII).
В процессе осуществления способов, описанных выше, может быть необходимым и/или желательным защита чувствительных групп или реагентов. Введение обычных защитных групп, а также их удаление может быть осуществлено способами, хорошо известными специалистам в данной области.
Если соединения общей формулы (I) сами получены в виде смеси стереоизомеров, в частности, энантиомеров или диастереомеров, указанные смеси могут быть разделены обычными способами, известными специалистам в данной области, например, хроматографическими способами или фракционной кристаллизацией с хиральными реагентами. Если есть хиральные центры, соединения могут быть получены в рацемической форме, или отдельные энантиомеры могут быть получены либо энантиоспецифическим синтезом, либо разделением.
Сольваты, предпочтительно гидраты, соединений общей формулы (I), их соответствующие стереоизомеры или соответствующие соли также могут быть получены стандартными способами, известными специалистам в данной области.
Очистка и выделение соединений по изобретению общей формулы (I), его соответствующего стереоизомера или их соли, или сольвата, или любого промежуточного соединения, если требуется, может быть осуществлено общеизвестными способами, известными специалистам в данной области, например, хроматографическими способами или перекристаллизацией.
Было обнаружено, что соединения общей формулы (I), их стереоизомеры, соответствующие соли и соответствующие сольваты обладают высокой аффинностью в отношении сигма рецепторов, то есть они являются селективными лигандами для сигма рецепторов и действуют в качестве модуляторов, например, антагонистов, обратных агонистов или агонистов, на эти рецепторы.
Настоящее изобретение далее относится к лекарственным средствам или фармацевтическим композициям, содержащим соединение по настоящему изобретению или его фармацевтически приемлемую соль, производное, пролекарство или стереоизомеры вместе с фармацевтически приемлемым эксципиентом, для введения пациенту, особенно человеку.
Термин “эксципиент” относится к компонентам лекарственного средства, иным чем активный ингредиент (определение, данное Европейским Агентством по лекарственным средствам European Medicines Agency - EMA). Они, предпочтительно, включают «носитель, адъювант и/или наполнитель». Носители представляют собой форму, в которую включены вещества для улучшения доставки и эффективности лекарственных средств. Носители для лекарственных средств используются в системах доставки лекарственных средств, таких как с контролируемым высвобождением для пролонгирования in vivo действия лекарственного средства, понижения метаболизма лекарственных средств и снижения токсичности лекарственного средства. Носители используются также в устройствах для повышения эффективности доставки лекарственных средств к целевым участкам фармакологического действия (U.S. National Library of Medicine. National Institutes of Health). Адъювантом является вещество, добавляемое к продукту лекарственного средства, влияющее на действие активного ингредиента предсказуемым образом. Наполнителем является эксципиент или вещество, предпочтительно, без терапевтического действия, используемое в качестве среды для придания объема при введении лекарственных средств (Stedman's Medical Spellchecker, © 2006 Lippincott Williams & Wilkins). Такие фармацевтические носители, адъюванты или наполнители могут представлять собой стерильные жидкости, такие как вода и масла, включая такие как масла из нефти, животные, растительные или синтетические, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобное, эксципиенты, дезинтегранты, увлажняющие агенты или разбавители. Подходящие фармацевтические носители описаны в обзоре «Remington's Pharmaceutical Sciences» by E.W. Martin. Выбор указанных эксципиентов и необходимых для использования количеств зависят от формы введения фармацевтической композиции.
Лекарственное средство или фармацевтическая композиция согласно настоящему изобретению могут быть в любой форме, подходящей для введения людям и/или животным, предпочтительно, людям, включая младенцев, детей и взрослых, и могут быть получены стандартными способами, известными специалистам в данной области. Таким образом, препарат согласно изобретению может быть предназначен для наружного или системного применения, в частности, для дермального, трансдермального, подкожного, внутримышечного, внутрисуставного, внутрибрюшинного, внутривенного, внутриартериального, внутрипузырного, внутрикостного, интракавернозного, легочного, буккального, подъязычного, глазного, в стекловидное тело, интраназального, чрескожного, ректального, вагинального, перорального, эпидурального, интратекального, внутрижелудочкового, внутримозгового, интрацеребровентрикулярного, интрацистернального, интраспинального, периспинального, внутричерепного, доставки через иглы или катетеры с помощью или без помощи насосных устройств, или другими путями введения.
В предпочтительном варианте осуществления фармацевтические композиции представлены в пероральной форме, в виде либо твердого продукта, либо жидкого. Подходящие дозированные формы для перорального введения могут представлять собой таблетки, пилюли, таблетки в виде капсул, гелевые капсулы, жевательные резинки, капсулы, гранулы, капли, сиропы или растворы, и могут содержать обычные эксципиенты, известные в данной области техники, такие как связующие агенты, например сироп, гуммиарабик, желатин, сорбит, трагакант или поливинилпирролидон; волокна, например лактоза, сахар, кукурузный крахмал, фосфат кальция, сорбит или глицин; лубриканты для таблетирования, например, стеарат магния; дезинтегранты, например, крахмал, поливинилпирролидон, натрий крахмал гликолят или микрокристаллическая целлюлоза; или фармацевтически приемлемые увлажняющие агенты, такие как лаурилсульфат натрия.
Твердые пероральные композиции могут быть получены обычными способами смешивания, наполнения или таблетирования. Повторные операции смешивания могут быть использованы для распределения активного агента в композициях, используя большие количества наполнителей. Такие операции являются обычными в данной области. Таблетки, например, могут быть получены путем влажного или сухого гранулирования и необязательно покрыты способами, хорошо известными в обычной фармацевтической практике, в частности, энтеросолюбильным покрытием.
Фармацевтические композиции также могут быть приспособлены для парентерального введения, такие как стерильные растворы, суспензии или восстанавливаемые сухие препараты, аэрозоли или спреи в соответствующей единичной дозированной форме. Могут быть использованы подходящие эксципиенты, такие как объемообразующий агент, буферные агенты или поверхностно-активные вещества.
Композиция по настоящему изобретению может быть составлена в виде осаждаемого осадка в растворенном виде или в виде пластырей для чрескожного применения.
Накожные аппликации включают мази, гели, кремы, лосьоны, суспензии или эмульсии.
Подходящей формой ректального применения являются суппозитории.
Указанные композиции получают с использованием стандартных способов, таких как описано или указано в Фармакопеях Испании и США и текстах подобных ссылок.
Согласно одному варианту осуществления изобретения, является предпочтительным, чтобы соединение формулы (I) использовалось в терапевтически эффективных количествах. Лечащий врач определит дозировку данных терапевтических агентов, которые будут наиболее подходящими, она будет изменяться от вида введения и конкретного выбранного соединения, и, более того, она будет изменяться в зависимости от пациента, подвергаемого лечению, возраста пациента, типа заболевания или состояния, подвергаемых лечению. Когда композиция вводится перорально, потребуется большее количество активного агента для получения того же эффекта в сравнении с меньшим количеством при парентеральном введении. Соединения могут быть использованы таким же образом, как сравниваемые терапевтические агенты, и уровень дозировки имеет тот же порядок, который обычно используется при применении других терапевтических агентов. Активные соединения обычно вводятся один или более раз в день, например 1, 2, 3 или 4 раза в день, при обычных общих дневных дозах в области от 0,1 до 1000 мг/кг/день.
Соединения и композиции по настоящему изобретению могут быть использованы с другими лекарственными средствами, чтобы обеспечить комбинированную терапию. Другие лекарственные средства могут быть частью одной и той же композиции, или быть представлены в виде отдельной композиции для введения в одно и то же время или в разное время.
Следующие примеры являются только иллюстрацией некоторых вариантов осуществления настоящего изобретения и не могут рассматриваться как ограничивающие его каким-либо образом.
ПРИМЕРЫ
Пример 1
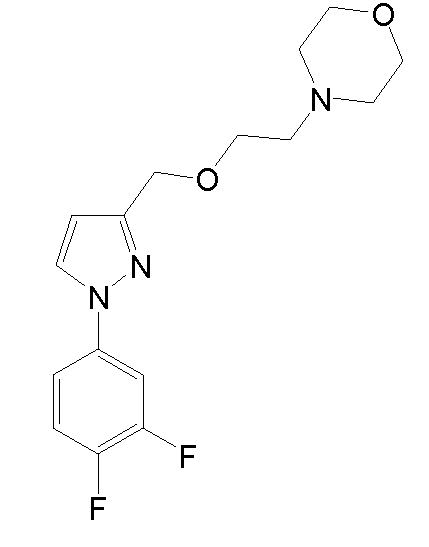
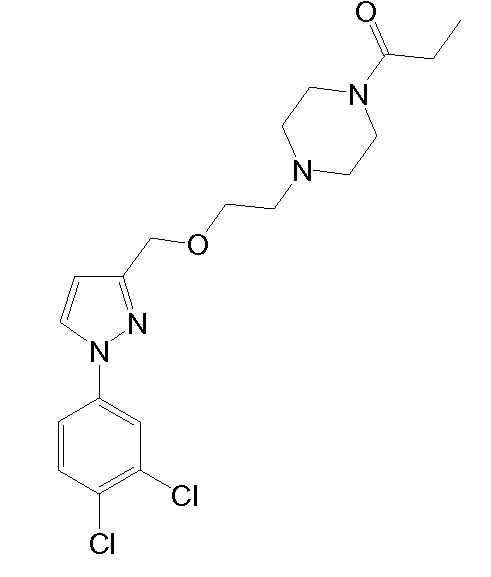
Синтез 4-(2-{[1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-ил]метокси}этил)морфолина
1.1 Синтез этил 1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-карбоксилата
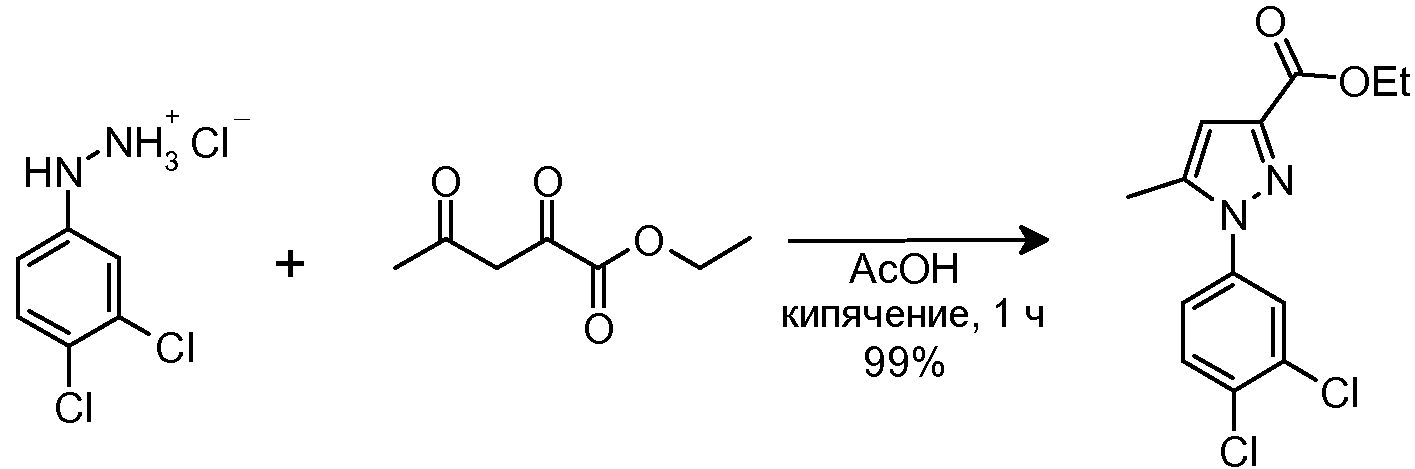
Этилацетопируват (74 мг, 0,468 ммоль) добавляли в суспензию исходного вещества (100 мг, 0,468 ммоль) в AcOH (5 мл), и смесь кипятили с обратным холодильником в течение 1 часа. Затем смеси давали остыть до комнатной температуры и разбавляли CH2Cl2 (10 мл). Органическую фазу промывали H2O (1×10 мл) и водным 10% NaOH (2×10 мл), сушили над безводным Na2SO4, фильтровали и концентрировали досуха. Остаток (171 мг) очищали флэш-хроматографией на силикагеле (21% AcOEt/гексан), с получением 139 мг желаемого продукта (Rf=0,6 (30% AcOEt/гексан), бледно-желтое твердое вещество, 99%-ный выход).
1H-ЯМР (CDCl3, 250 МГц, δ): 7,62 (д, J=2,4 Гц, 1H, ArH); 7,54 (д, J=8,3 Гц, 1H, ArH); 7,32 (дд, J=2,4 и 8,3 Гц, 1H, ArH); 6,72 (с, 1H, ArH); 4,39 (c, J=6,8 Гц, 2H, CH2); 2,34 (с, 3H, CH3); 1,39 (т, J=6,8 Гц, 3H, CH3).
MS-EI+ m/z: 300,0 (M+1).
1.2 Синтез [1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-ил]метанола
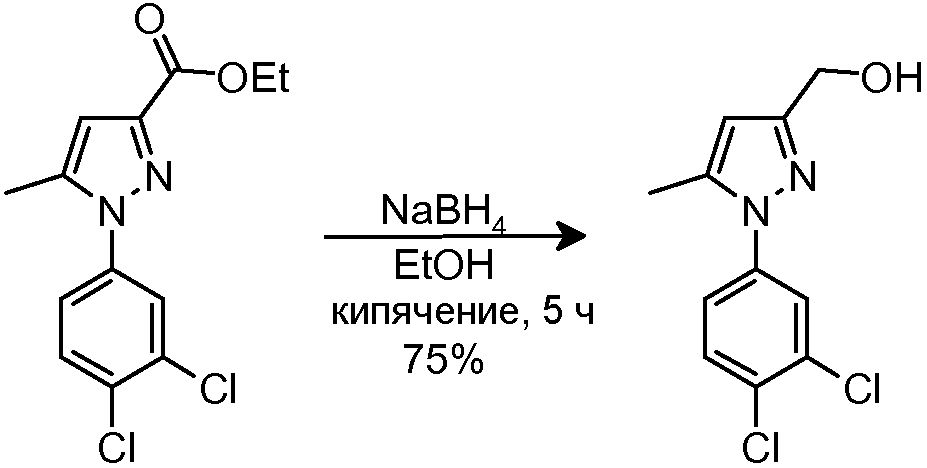
NaBH4 (104 мг, 2,76 ммоль) добавляли в суспензию исходного сложного эфира (551 мг, 1,84 ммоль) в EtOH (12 мл). Смесь кипятили с обратным холодильником (растворяется при кипячении) в течение 1 часа, и затем добавляли еще NaBH4 (104 мг, 2,76 ммоль). Смесь кипятили с обратным холодильником в течение еще 4 час и оставляли охлаждаться до комнатной температуры. Смесь выливали в H2O (10 мл), и водный слой экстрагировали CH2Cl2 (2×10 мл). Объединенные органические фазы промывали водным насыщенным NH4Cl (1×15 мл) и H2O (1×15 мл), сушили над безводным Na2SO4, фильтровали и концентрировали досуха. Остаток очищали флэш-хроматографией на силикагеле (42-60% AcOEt/гексан), с получением 354 мг желаемого продукта (Rf=0,5 (10% MeOH/CH2Cl2), желтое твердое вещество, 75%-ный выход).
1H-ЯМР (CDCl3, 250 МГц, δ): 7,82 (д, J=2,5 Гц, 1H, ArH); 7,75 (д, J=8,5 Гц, 1H, ArH); 7,52 (м, 1H, ArH); 6,43 (с, 1H, ArH); 4,91 (с, 2H, CH2); 2,57 (с, 3H, CH3).
1.3 Синтез 4-(2-йодэтил)морфолина

NaI (25,54 г, 170,40 ммоль) добавляли в суспензию исходного хлорида (8,5 г, 56,80 ммоль) в ацетоне (150 мл). Смесь кипятили с обратным холодильником в течение 17 час, затем смеси давали охладиться до комнатной температуры и фильтровали, промывая CH2Cl2 (3×100 мл). Фильтрат промывали H2O (3×250 мл), органическую фазу сушили над безводным Na2SO4, фильтровали и концентрировали досуха, с получением 7,71 г желаемого йодида (Rf=0,4 (40% AcOEt/гексан), маслянистое желтое твердое вещество, 56%-ный выход).
1H-ЯМР (CDCl3, 250 МГц, δ): 3,64 (т, J=4,7 Гц, 4H, CH2); 3,14 (т, J=7,6 Гц, 2H, CH2) 2,65 (т, J=7,6 Гц, 2H, CH2) 2,42 (т, J=4,7 Гц, 4H, CH2).
1.4 Синтез 4-(2-{[1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-ил]метокси}этил)морфолина
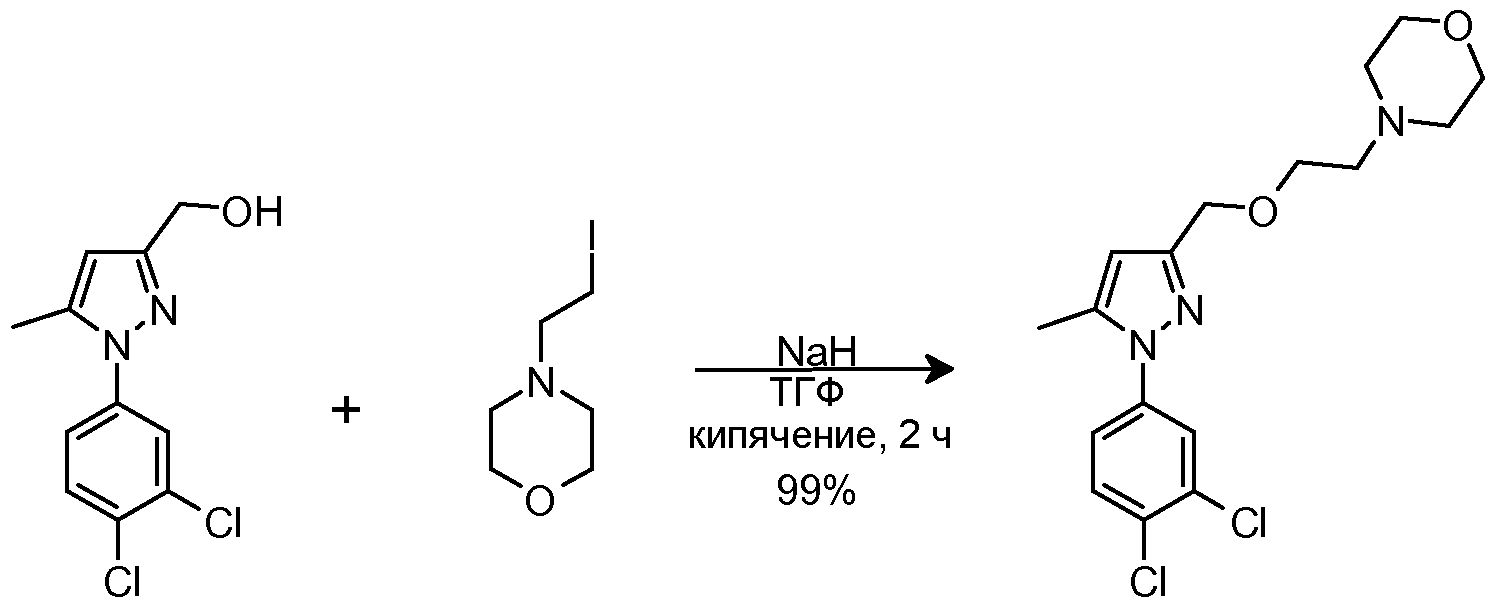
NaH (60% в минеральном масле, 25 мг, 0,622 ммоль) добавляли к раствору исходного спирта (80 мг, 0,311 ммоль) в ТГФ (3 мл). Смесь перемешивали при комнатной температуре в течение 10 мин, и добавляли исходный йодид (225 мг, 0,933 ммоль) в ТГФ (2 мл). Смесь кипятили с обратным холодильником в течение 2 час, затем смеси давали охладиться до комнатной температуры, и смесь выливали в водный насыщенный NaHCO3 (8,0 мл). Добавляли CH2Cl2 (10 мл) и органическую фазу отделяли. Водную фазу экстрагировали CH2Cl2 (2×8 мл), и объединенные органические фазы сушили над безводным Na2SO4, фильтровали и концентрировали досуха. Остаток очищали флэш-хроматографией на силикагеле (3-5,2% MeOH/CH2Cl2), с получением 114 мг желаемого продукта (Rf=0,5 (10% MeOH/CH2Cl2), твердое вещество кремового цвета, 99%-ный выход).
1H-ЯМР (CDCl3, 250 МГц, δ): 7,59 (д, J=2,5 Гц, 1H, ArH); 7,52 (д, J=8,6 Гц, 1H, ArH); 7,32-7,27 (дд, J=2,5 и 8,6 Гц, 1H, ArH); 6,24 (с, 1H, ArH); 4,54 (с, 2H, CH2); 3,73 (т, J=4,6 Гц, 4H, CH2); 3,65 (т, J=5,8 Гц, 2H, CH2); 2,62 (т, J=5,8 Гц, 2H, CH2); 2,51 (т, J=4,6 Гц, 4H, CH2); 2,35 (с, 3H, CH3).
MS-EI+ m/z: 370,3, 372,3 (M+1).
Пример 2
Синтез 4-(2-{[1-(2-нафтил)-5-метил-1H-пиразол-3-ил]метокси}этил)морфолина
2.1 Синтез гидрохлорида 2-нафтилгидразина
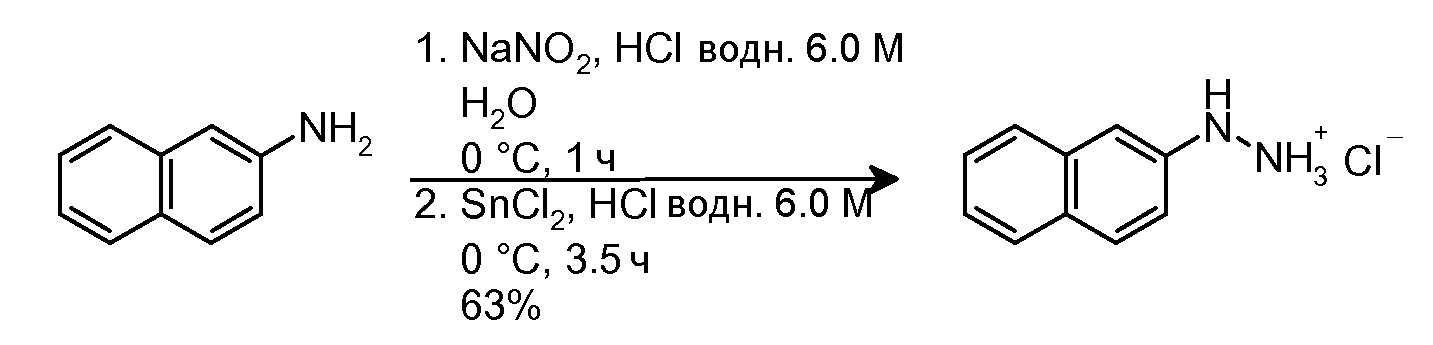
В суспензию 2-нафтиламина (800 мг, 5,59 ммоль) в водном 6,0M HCl (6 мл), охлаждаемую на бане H2O-лед, медленно добавляли NaNO2 (578 мг, 8,38 ммоль) в H2O (1,2 мл) (2 мин добавления). Полученный раствор перемешивали на бане H2O-лед в течение 1 часа, и медленно (5 мин добавления) добавляли SnCl2 (3,71 г, 19,56 моль). Полученную суспензию перемешивали на бане H2O-лед в течение 3,5 час и затем фильтровали. Твердое вещество промывали последовательно H2O при температуре 0°C (4×8 мл), H2O при комнатной температуре (1×8 мл), Et2O при температуре 0°C (2×4 мл), смесью Et2O/гексан (1:1, 2×4 мл) и гексаном (2×5 мл). Твердое вещество сушили, с получением 690 мг желаемого продукта (Rf=0,7 (40% AcOEt/гексан), твердое вещество кремового цвета, 63%-ный выход).
1H-ЯМР (ДМСО-d6, 250 МГц, δ): 7,81 (м, 2H, ArH); 7,71 (д, J=7,7 Гц, 1H, ArH); 7,49-7,19 (м, 4H, ArH).
MS-EI+ m/z: 159,1 (M-HCl+1).
2.2 Синтез этил 5-метил-1-(2-нафтил)-1H-пиразол-3-карбоксилата
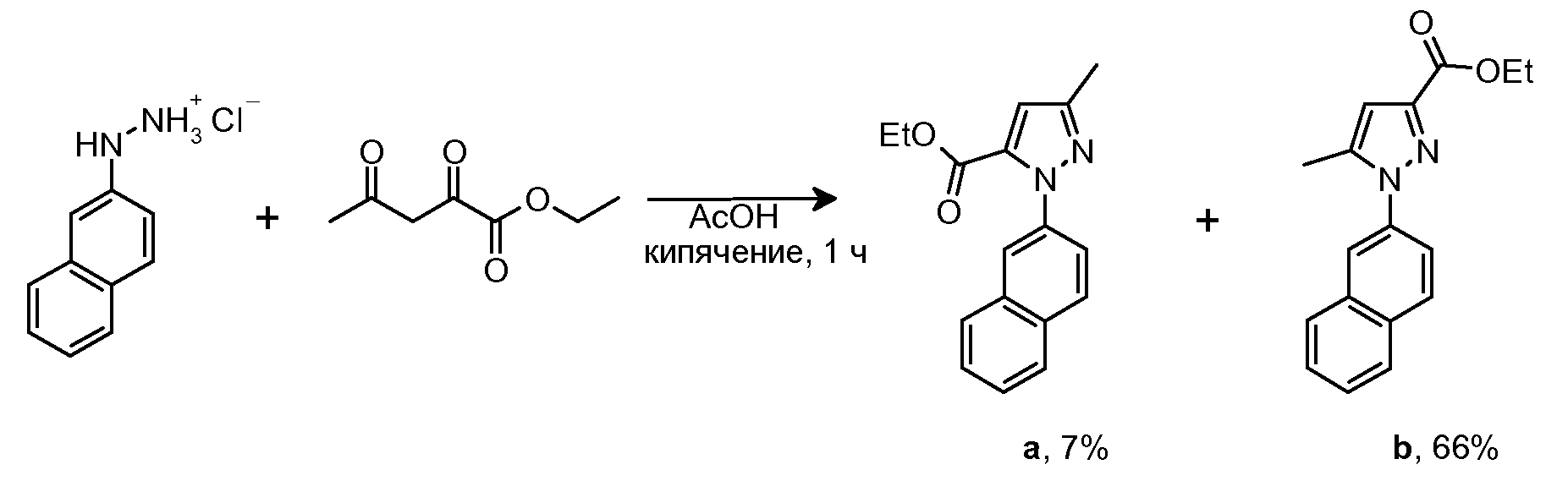
Этилацетопируват (544 мг, 3,44 ммоль) добавляли в суспензию исходного гидразина (670 мг, 3,44 ммоль) в AcOH (5 мл). Полученную суспензию кипятили с обратным холодильником в течение 1 часа, затем смеси давали охладиться до комнатной температуры и разбавляли CH2Cl2 (15 мл). Органическую фазу промывали последовательно H2O (2×20 мл), водным NaOH 10% (1×20 мл) и снова H2O (1×20 мл). Органическую фазу сушили над безводным Na2SO4, фильтровали и концентрировали досуха. Остаток очищали флэш-хроматографией на силикагеле (15-41% AcOEt/гексан), с получением 68 мг изомера a (Rf=0,8 (20% AcOEt/гексан), твердое вещество оранжевого цвета, 7%-ный выход) и 640 мг изомера b (Rf=0,6 (20% AcOEt/гексан), твердое вещество оранжевого цвета, 66%-ный выход).
1H-ЯМР изомер b (CDCl3, 250 МГц, δ): 7,95-7,84 (м, 4H, ArH); 7,60-7,51 (м, 3H, ArH); 6,78 (с, 1H, ArH); 4,43 (c, J=7,1 Гц, 2H, CH2); 2,38 (с, 3H, CH3); 1,40 (т, J=7,1 Гц, 3H, CH3).
1H-ЯМР изомер а (CDCl3, 250 МГц, δ): 7,91-7,85 (м, 4H, ArH); 7,53-7,48 (м, 3H, ArH); 6,86 (с, 1H, ArH); 4,22 (c, J=7,1 Гц, 2H, CH2); 2,39 (с, 3H, CH3); 1,20 (т, J=7,1 Гц, 3H, CH3).
2.3 Синтез [5-метил-1-(2-нафтил)-1H-пиразол-3-ил]метанола
В суспензию исходного сложного эфира (640 мг, 2,28 ммоль) в EtOH (15 мл) добавляли NaBH4 (129 мг, 3,42 ммоль). Смесь кипятили с обратным холодильником (растворяется при кипячении) в течение 1,5 час, и затем добавляли еще NaBH4 (640 мг, 2,28 ммоль). Суспензию кипятили с обратным холодильником дополнительно 4 часа, и добавляли еще NaBH4 (640 мг, 2,28 ммоль). Спустя еще 2,5 часа, добавляли дополнительное количество NaBH4 (640 мг, 2,28 ммоль) и кипятили с обратным холодильником дополнительно 16 час. Реакционной смеси давали охладиться до комнатной температуры и выливали в H2O (10 мл). Водную фазу экстрагировали CH2Cl2 (2×15 мл), и объединенные органические фазы промывали водным насыщенным NH4Cl (2×30 мл), сушили над безводным Na2SO4, фильтровали и концентрировали досуха. Остаток очищали флэш-хроматографией на силикагеле (60-70% AcOEt/гексан), с получением 309 мг желаемого продукта (Rf=0,2 (40% AcOEt/гексан), желтое твердое вещество, 57%-ный выход).
1H-ЯМР (CDCl3, 250 МГц, δ): 7,96-7,96 (м, 4H, ArH); 7,61 (д, J=1,9 Гц, 1H, ArH); 7,56 (м, 2H, ArH); 6,25 (с, 1H, ArH); 4,74 (sa, 2H, CH2); 2,39 (с, 3H, CH3).
2.4 Синтез 4-(2-{[1-(2-нафтил)-5-метил-1H-пиразол-3-ил]метокси}этил)морфолина
К раствору исходного спирта (167 мг, 0,70 ммоль) в ТГФ (6 мл) добавляли NaH (60%-ный в минеральном масле, 56 мг, 1,40 ммоль). Смесь перемешивали при комнатной температуре в течение 5 мин, и добавляли исходный йодид (354 мг, 1,47 ммоль) в ТГФ (2 мл). Реакционную смесь кипятили с обратным холодильником в течение 2 час, затем смеси давали охладиться до комнатной температуры и выливали в водный насыщенный NaHCO3 (15 мл). Водную фазу экстрагировали CH2Cl2 (2×10 мл), и объединенные органические фазы промывали водным насыщенным NaHCO3 (1×20 мл) и H2O (1×10 мл), сушили над безводным Na2SO4, фильтровали и концентрировали досуха. Остаток очищали флэш-хроматографией на силикагеле (4% MeOH/CH2Cl2), с получением 176 мг желаемого продукта (Rf=0,1 (5% MeOH/CH2Cl2), оранжевое масло, 71%-ный выход).
1H-ЯМР (CDCl3, 250 МГц, δ): 7,89 (м, 4H, ArH); 7,61-7,50 (м, 3H, ArH); 6,28 (с, 1H, ArH); 4,60 (с, 2H, CH2); 3,74 (т, J=4,7 Гц, 4H, CH2); 3,69 (т, J=5,8 Гц, 2H, CH2); 2,65 (т, J=5,8 Гц, 2H, CH2); 2,53 (м, 4H, CH2); 2,39 (с, 3H, CH3).
MS-EI+ m/z: 352,4 (M+1).
Пример 3
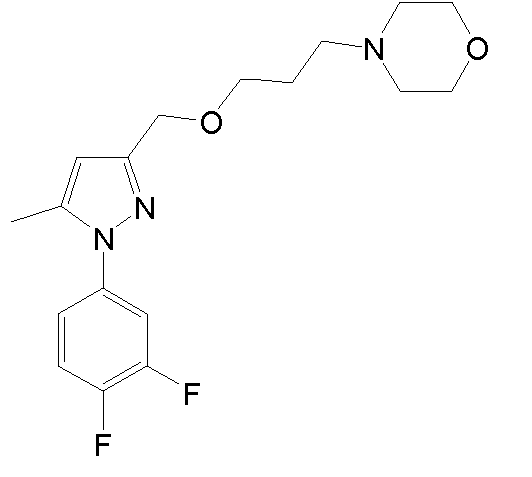
Синтез 4-{3-[1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-ил]пропил}морфолина
3.1 Синтез этил 1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-карбоксилата
Этилацетопируват (74 мг, 0,468 ммоль) добавляли в суспензию исходного вещества (100 мг, 0,468 ммоль) в AcOH (5 мл). Полученную смесь кипятили с обратным холодильником в течение 1 часа, затем смеси давали охладиться до комнатной температуры и разбавляли CH2Cl2 (10 мл). Органическую фазу промывали H2O (1×10 мл) и 10% водным NaOH (2×10 мл), сушили над безводным Na2SO4, фильтровали и концентрировали досуха. Остаток (171 мг) очищали флэш-хроматографией на силикагеле (21% AcOEt/гексан), с получением 139 мг желаемого продукта (Rf=0,6 (30% AcOEt/гексан), бледно-желтое твердое вещество, 99%-ный выход).
1H-ЯМР (CDCl3, 250 МГц, δ): 7,62 (д, J=2,4 Гц, 1H, ArH); 7,54 (д, J=8,3 Гц, 1H, ArH); 7,32 (дд, J=2,4 и 8,3 Гц, 1H, ArH); 6,72 (с, 1H, ArH); 4,39 (c, J=6,8 Гц, 2H, CH2); 2,34 (с, 3H, CH3); 1,39 (т, J=6,8 Гц, 3H, CH3).
MS-EI+ m/z: 300,0 (M+1).
3.2 Синтез [1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-ил]метанола
В суспензию исходного сложного эфира (551 мг, 1,84 ммоль) в EtOH (12 мл) добавляли NaBH4 (104 мг, 2,76 ммоль). Смесь кипятили с обратным холодильником (растворяется при кипячении) в течение 1 часа, и затем добавляли еще NaBH4 (104 мг, 2,76 ммоль). Смесь кипятили с обратным холодильником в течение еще 4 час, и затем смеси давали охладиться до комнатной температуры и выливали в H2O (10 мл). Водную фазу экстрагировали CH2Cl2 (2×10 мл), и объединенные органические фазы промывали водным насыщенным NH4Cl (1×15 мл) и H2O (1×15 мл), сушили над безводным Na2SO4, фильтровали и концентрировали досуха. Остаток очищали флэш-хроматографией на силикагеле (42-60% AcOEt/гексан), с получением 354 мг желаемого продукта (Rf=0,5 (10% MeOH/CH2Cl2), желтое твердое вещество, 75%-ный выход).
1H-ЯМР (CDCl3, 250 МГц, δ): 7,82 (д, J=2,5 Гц, 1H, ArH); 7,75 (д, J=8,5 Гц, 1H, ArH); 7,52 (м, 1H, ArH); 6,43 (с, 1H, ArH); 4,91 (с, 2H, CH2); 2,57 (с, 3H, CH3).
3.3 Синтез 1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-карбальдегида
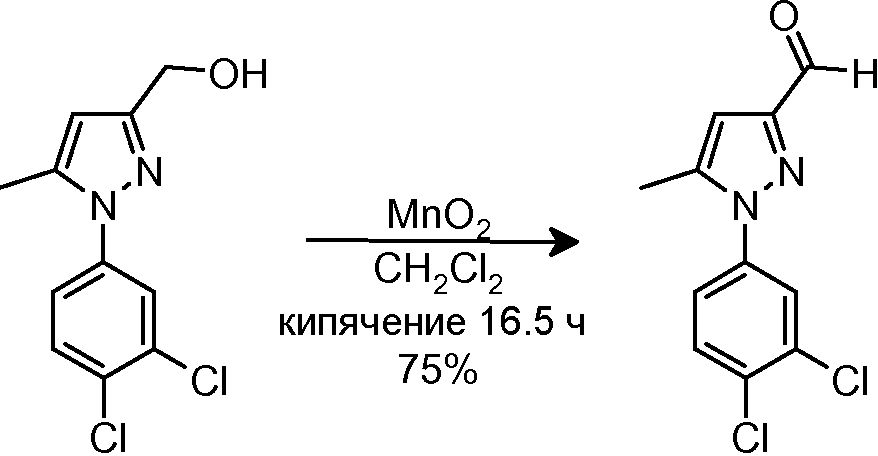
К раствору исходного спирта (542 мг, 2,11 ммоль) в CH2Cl2 (30 мл) добавляли MnO2 (85%-ная чистота, 2,16 г, 21,10 ммоль). Смесь кипятили с обратным холодильником в течение 16,5 час, и затем смеси давали охладиться до комнатной температуры и фильтровали через Целит, промывая CH2Cl2 (3×50 мл) и 5% MeOH/CH2Cl2 (1×40 мл). Фильтрат концентрировали досуха и очищали флэш-хроматографией на силикагеле (20% AcOEt/гексан), с получением 403 мг желаемого продукта (Rf=0,5 (20% AcOEt/гексан), бледно-желтое твердое вещество, 75%-ный выход).
1H-ЯМР (CDCl3, 250 МГц, δ): 9,98 (с, 1H, CHO); 7,65 (д, J=2,5 Гц, 1H, ArH); 7,61 (д, J=8,5 Гц, 1H, ArH); 7,36 (дд, J=2,5 и 8,5 Гц, 1H, ArH); 6,73 (с, 1H, ArH); 2,39 (с, 3H, CH3).
3.4 Синтез 4-(2-йодэтил)морфолина

В суспензию исходного хлорида (8,5 г, 56,80 ммоль) в ацетоне (150 мл) добавляли NaI (25,54 г, 170,40 ммоль). Смесь кипятили с обратным холодильником в течение 17 час, затем смеси давали охладиться до комнатной температуры и фильтровали, промывая CH2Cl2 (3×100 мл). Фильтрат промывали H2O (3×250 мл), органическую фазу сушили над безводным Na2SO4, фильтровали и концентрировали досуха, с получением 7,71 г желаемого йодида (Rf=0,4 (40% AcOEt/гексан), маслянистое желтое твердое вещество, 56%-ный выход).
1H-ЯМР (CDCl3, 250 МГц, δ): 3,64 (т, J=4,7 Гц, 4H, CH2); 3,14 (т, J=7,6 Гц, 2H, CH2) 2,65 (т, J=7,6 Гц, 2H, CH2) 2,42 (т, J=4,7 Гц, 4H, CH2).
3.5 Синтез (4-этилморфолин)(трифенил)фосфониййодида
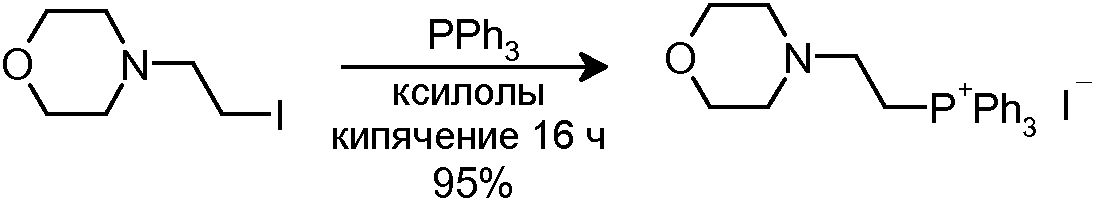
К раствору исходного йодида (2,0 г, 8,29 ммоль) в ксилоле (15 мл) добавляли PPh3 (3,26 г, 12,44 ммоль). Смесь кипятили с обратным холодильником в течение 16 час, и затем смеси давали охладиться до комнатной температуры. Добавляли толуол (8 мл) и смесь перемешивали при комнатной температуре в течение 2 час. Твердое вещество отфильтровывали в вакууме, промывали Et2O (3×10 мл) и сушили, с получением 3,96 г желаемого продукта (Rf=0,1 (10% MeOH/CH2Cl2), белое твердое вещество, 95%-ный выход).
1H-ЯМР (CDCl3, 250 МГц, δ): 7,93-7,83 (м, 15H, ArH); 3,84 (м, 2H, CH2); 3,29 (м, 4H, CH2) 2,59 (м, 2H, CH2) 2,30 (м, 4H, CH2).
MS-EI+ m/z: 376,0 (M-1).
3.6 Синтез 4-{3-[1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-ил]проп-2-енил}морфолина
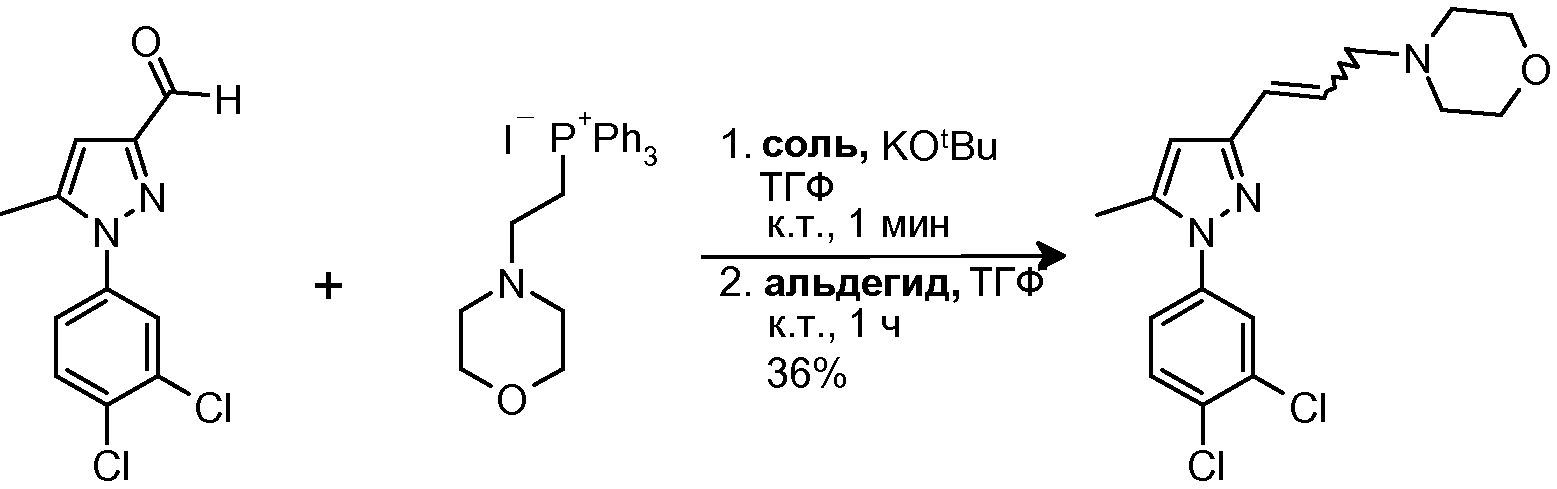
В суспензию фосфиновой соли (177 мг, 0,353 ммоль) в ТГФ (3 мл) добавляли часть KOtBu (79 мг, 0,703 ммоль). Смесь перемешивали при комнатной температуре в течение около 1 мин (суспензия ярко желтого цвета), и добавляли исходный альдегид (108 мг, 0,423 ммоль) в ТГФ (3 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа, и затем разбавляли CH2Cl2 (10 мл) и добавляли H2O (10 мл). Органическую фазу отделяли и водную фазу экстрагировали CH2Cl2 (1×10 мл). Объединенные органические фазы сушили над безводным Na2SO4, фильтровали и концентрировали досуха. Остаток очищали, осуществляя три последовательные флэш-хроматографии на силикагеле (4% MeOH/CH2Cl2, 50% ацетон/гексан и CH2Cl2/MeOH/NH4OH 98:2:1), с получением 45 мг желаемого продукта (Rf=0,5 (50% ацетон/гексан), бледно-желтое масло, 36%-ный выход).
1H-ЯМР (CDCl3, 250 МГц, δ) главный изомер: 7,62 (д, J=2,5 Гц, 1H, ArH); 7,54 (д, J=8,5 Гц, 1H, ArH); 7,33 (дд, J=2,5 и 8,5 Гц, 1H, ArH); 6,45 (д, J=11,8 Гц, 1H, CH); 6,22 (с, 1H, ArH); 5,84 (м, 1H, CH); 3,74 (м, 4H, CH2); 3,46 (дд, J=1,9 и 6,3 Гц, 2H, CH2); 2,53 (м, 4H, CH2); 2,37 (с, 3H, CH3).
MS-EI+ m/z: 352,0, 354,0 (M).
3.7 Синтез 4-{3-[1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-ил]пропил}морфолина
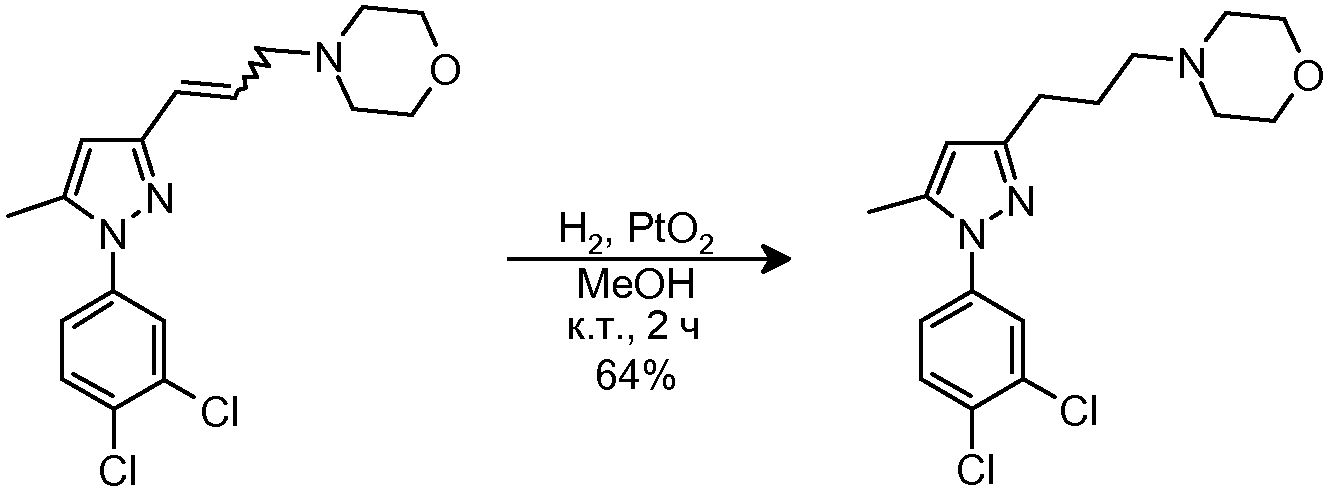
К раствору исходного вещества (123 мг, 0,349 ммоль) в MeOH (4 мл) добавляли PtO2 (4 мг, 0,017 ммоль). Суспензию перемешивали при комнатной температуре в атмосфере H2 (баллон) в течение 2 час, и затем фильтровали через целит, промывая MeOH (3×5 мл). Фильтрат концентрировали досуха и очищали флэш-хроматографией на силикагеле (40% ацетон/гексан), с получением 79 мг желаемого продукта (Rf=0,4 (50% ацетон/гексан), бледно-желтое масло, 64%-ный выход).
1H-ЯМР (CDCl3, 250 МГц, δ): 7,59 (д, J=2,5 Гц, 1H, ArH); 7,50 (д, J=8,8 Гц, 1H, ArH); 7,29 (дд, J=2,5 и 8,8 Гц, 1H, ArH); 6,02 (с, 1H, ArH); 3,72 (м, 4H, CH2); 2,64 (т, J=7,7 Гц, 2H, CH2); 2,44 (м, 6H, CH2); 2,32 (с, 3H, CH3); 1,87 (м, 2H, CH2).
MS-EI+ m/z: 351,8, 353,8 (M).
Пример 4
Синтез 4-{3-[5-метил-1-(2-нафтил)-1H-пиразол-3-ил]пропил}морфолина
4.1 Синтез гидрохлорида 2-нафтилгидразина
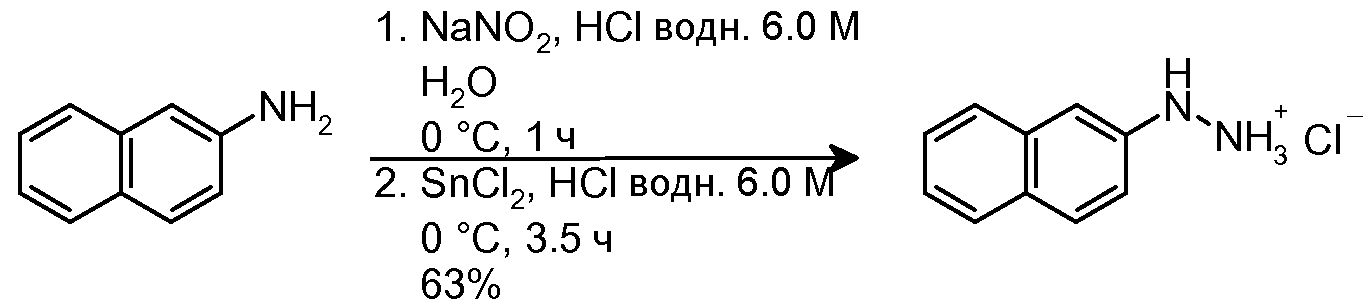
NaNO2 (578 мг, 8,38 ммоль) в H2O (1,2 мл) медленно добавляли (2 мин добавления) в суспензию 2-нафтиламина (800 мг, 5,59 ммоль) в 6,0M водном HCl (6 мл), охлажденной на бане H2O-лед. Полученный раствор перемешивали на бане H2O-лед в течение 1 часа, и медленно добавляли (5 мин добавления) SnCl2 (3,71 г, 19,56 моль). Полученную суспензию перемешивали на бане H2O-лед в течение 3,5 час и затем фильтровали. Твердое вещество промывали H2O при температуре 0°C (4×8 мл), H2O при комнатной температуре (1×8 мл), Et2O при температуре 0°C (2×4 мл), смесью Et2O/гексан (1:1, 2×4 мл) и гексаном (2×5 мл). Твердое вещество сушили, с получением 690 мг желаемого продукта (Rf=0,7 (40% AcOEt/гексан), твердое вещество кремового цвета, 63%-ный выход).
1H-ЯМР (ДМСО-d6, 250 МГц, δ): 7,81 (м, 2H, ArH); 7,71 (д, J=7,7 Гц, 1H, ArH); 7,49-7,19 (м, 4H, ArH).
MS-EI+ m/z: 159,1 (M-HCl+1).
4.2 Синтез этил 5-метил-1-(2-нафтил)-1H-пиразол-3-карбоксилата
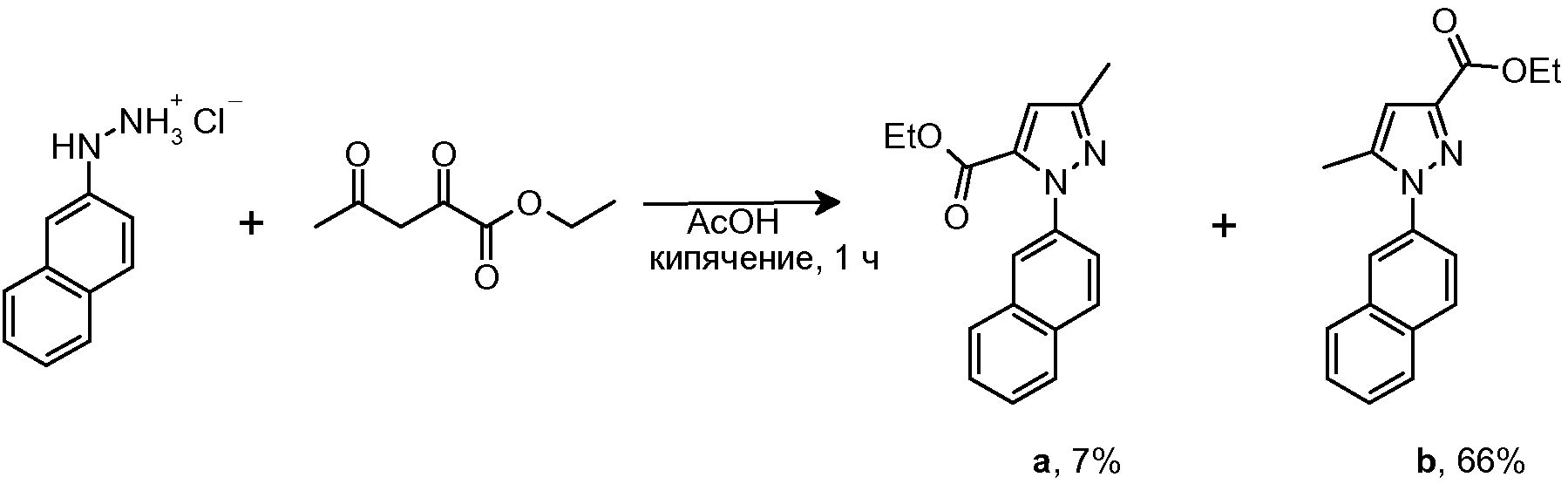
В суспензию исходного гидразина (670 мг, 3,44 ммоль) в AcOH (5 мл) добавляли этилацетопируват (544 мг, 3,44 ммоль). Полученную суспензию кипятили с обратным холодильником в течение 1 часа и затем смеси давали охладиться до комнатной температуры и разбавляли CH2Cl2 (15 мл). Органическую фазу промывали H2O (2×20 мл), 10% водным NaOH (1×20 мл) и снова H2O (1×20 мл). Органическую фазу сушили над безводным Na2SO4, фильтровали и концентрировали досуха. Неочищенный продукт очищали флэш-хроматографией на силикагеле (15-41% AcOEt/гексан), с получением 68 мг изомера a (Rf=0,8 (20% AcOEt/гексан), твердое вещество оранжевого цвета, 7%-ный выход) и 640 мг изомера b (Rf=0,6 (20% AcOEt/гексан), твердое вещество оранжевого цвета, 66%-ный выход).
1H-ЯМР изомер b (CDCl3, 250 МГц, δ): 7,95-7,84 (м, 4H, ArH); 7,60-7,51 (м, 3H, ArH); 6,78 (с, 1H, ArH); 4,43 (c, J=7,1 Гц, 2H, CH2); 2,38 (с, 3H, CH3); 1,40 (т, J=7,1 Гц, 3H, CH3).
1H-ЯМР изомер а (CDCl3, 250 МГц, δ): 7,91-7,85 (м, 4H, ArH); 7,53-7,48 (м, 3H, ArH); 6,86 (с, 1H, ArH); 4,22 (c, J=7,1 Гц, 2H, CH2); 2,39 (с, 3H, CH3); 1,20 (т, J=7,1 Гц, 3H, CH3).
4.3 Синтез [5-метил-1-(2-нафтил)-1H-пиразол-3-ил]метанола
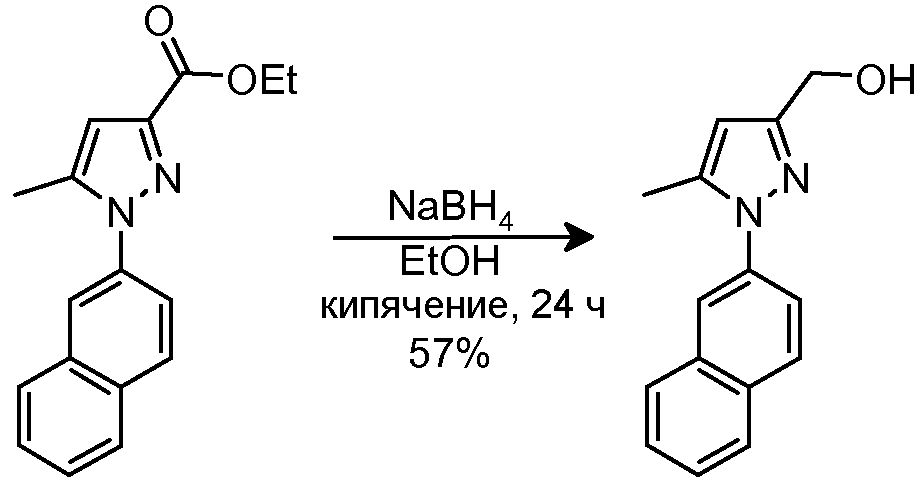
В суспензию исходного сложного эфира (640 мг, 2,28 ммоль) в EtOH (15 мл) добавляли NaBH4 (129 мг, 3,42 ммоль). Смесь кипятили с обратным холодильником (растворяется при кипячении с обратным холодильником) в течение 1,5 час, и затем добавляли еще NaBH4 (640 мг, 2,28 ммоль). Смесь кипятили с обратным холодильником в течение еще 4 час, и добавляли дополнительное количество NaBH4 (640 мг, 2,28 ммоль). Через 2,5 час добавляли дополнительное количество NaBH4 (640 мг, 2,28 ммоль), и смесь кипятили с обратным холодильником в течение еще 16 час. Реакционной смеси давали охладиться до комнатной температуры и выливали в H2O (10 мл). Водную фазу экстрагировали CH2Cl2 (2×15 мл), и объединенные органические фазы промывали водным насыщенным NH4Cl (2×30 мл), сушили над безводным Na2SO4, фильтровали и концентрировали досуха. Неочищенный продукт очищали флэш-хроматографией на силикагеле (60-70% AcOEt/гексан), с получением 309 мг желаемого продукта (Rf=0,2 (40% AcOEt/гексан), желтое твердое вещество, 57%-ный выход).
1H-ЯМР (CDCl3, 250 МГц, δ): 7,96-7,96 (м, 4H, ArH); 7,61 (д, J=1,9 Гц, 1H, ArH); 7,56 (м, 2H, ArH); 6,25 (с, 1H, ArH); 4,74 (sa, 2H, CH2); 2,39 (с, 3H, CH3).
4.4 Синтез 5-метил-1-(2-нафтил)-1H-пиразол-3-карбальдегида
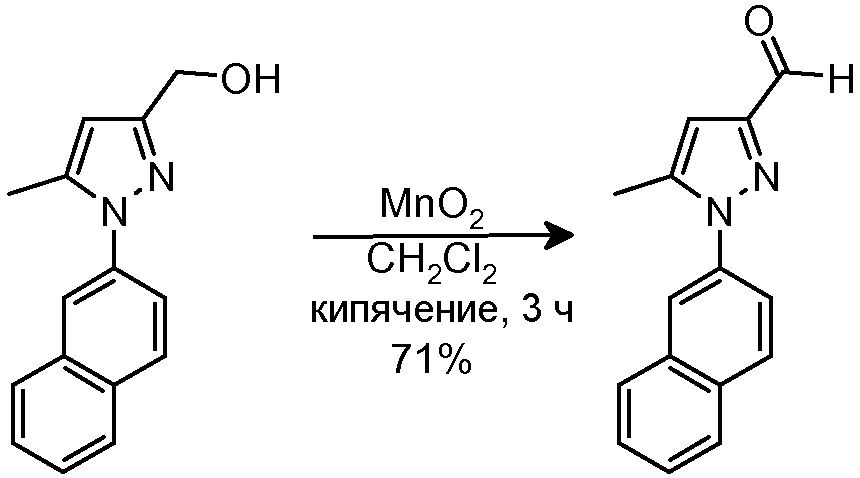
К раствору исходного спирта (309 мг, 1,29 ммоль) в CH2Cl2 (10 мл) добавляли MnO2 (85%-ный для анализа, 1,33 г, 12,97 ммоль). Смесь кипятили с обратным холодильником в течение 3 час, и затем смеси давали охладиться до комнатной температуры и фильтровали через целит, промывая CH2Cl2 (2×15 мл) и смесью 10% MeOH/CH2Cl2 (3×15 мл). Фильтрат концентрировали досуха и очищали флэш-хроматографией на силикагеле (20% AcOEt/гексан), с получением 218 мг желаемого продукта (Rf=0,8 (40% AcOEt/гексан), бледно-желтое твердое вещество, 71%-ный выход).
1H-ЯМР (CDCl3, 250 МГц, δ): 10,04 (с, 1H, CHO); 7,94 (м, 4H, ArH); 7,60 (м, 3H, ArH); 6,77 (с, 1H, ArH); 2,43 (с, 3H, CH3).
4.5 Синтез 4-{3-[5-метил-1-(2-нафтил)-1H-пиразол-3-ил]проп-2-енил}морфолина
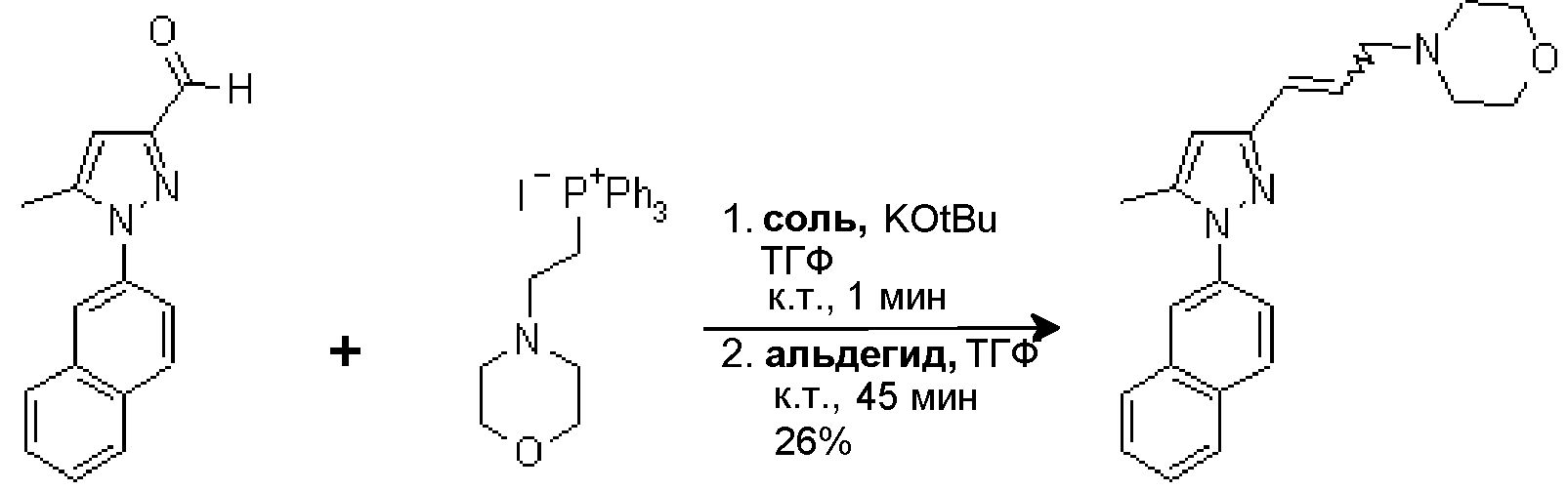
В суспензию фосфиновой соли (154 мг, 0,307 ммоль) в ТГФ (3 мл) добавляли часть KOtBu (69 мг, 0,6214 ммоль). Смесь перемешивали в течение около 1 мин (суспензия ярко желтого цвета), и в ТГФ (2 мл) добавляли исходный альдегид (87 мг, 0,368 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 45 мин, и затем добавляли водный насыщенный NH4Cl (10 мл) и экстрагировали AcOEt (1×10 мл). Органическую фазу промывали водным насыщенным NH4Cl (2×10 мл) и H2O (1×10 мл), сушили над безводным Na2SO4, фильтровали и концентрировали досуха. Неочищенный продукт очищали флэш-хроматографией на силикагеле (3% MeOH/CH2Cl2), с получением 27 мг желаемого продукта (Rf=0,2 (5% MeOH/CH2Cl2), желтое масло, 26%-ный выход).
1H-ЯМР (CDCl3, 250 МГц, δ) главный изомер: 7,88 (м, 4H, ArH); 7,62 (дд, J=2,0 и 8,6 Гц, 1H, ArH); 7,55 (м, 2H, ArH); 6,54 (д, J=11,8 Гц, 1H, CH); 6,27 (с, 1H, ArH); 5,84 (м, 1H, CH); 3,80 (м, 4H, CH2); 3,51 (м, 2H, CH2); 2,57 (м, 4H, CH2); 2,42 (с, 3H, CH3).
4.6 Синтез 4-{3-[5-метил-1-(2-нафтил)-1H-пиразол-3-ил]пропил}морфолина
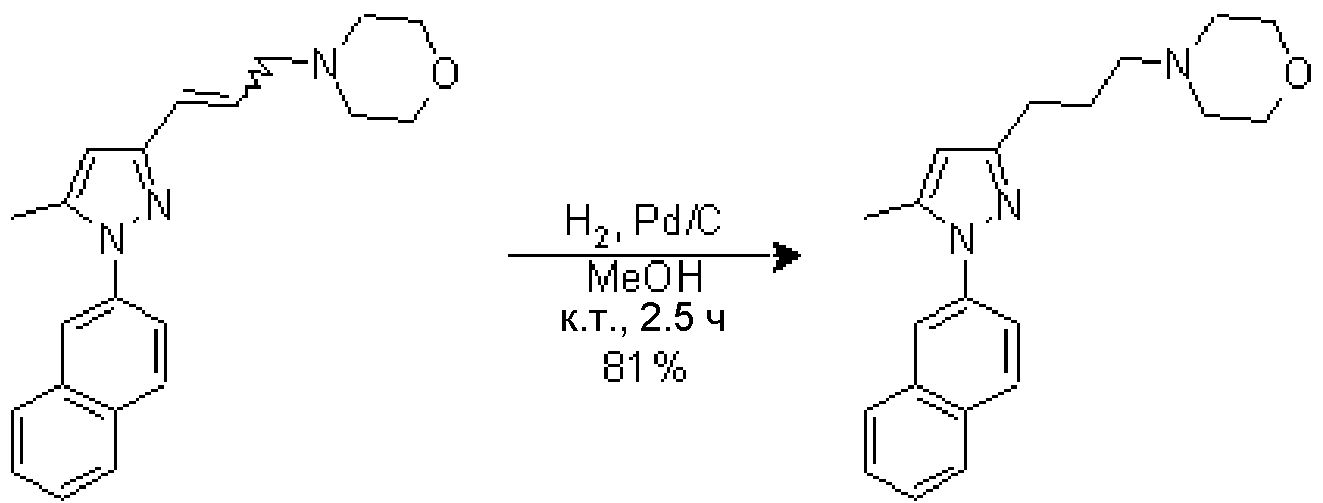
В суспензию Pd/C (10% по массе, 18 мг, 0,017 ммоль) в MeOH (4 мл) добавляли исходное вещество (57 мг, 0,171 ммоль) в MeOH (4 мл). Полученную суспензию перемешивали при комнатной температуре в атмосфере H2 (баллон) в течение 2,5 час и затем фильтровали через целит, промывая MeOH (3×5 мл). Фильтрат концентрировали досуха и очищали флэш-хроматографией на силикагеле (3% MeOH/CH2Cl2), с получением 46 мг желаемого продукта (Rf=0,15 (5% MeOH/CH2Cl2), желтое масло, 81%-ный выход).
1H-ЯМР (CDCl3, 250 МГц, δ): 7,84-7,94 (м, 4H, ArH); 7,59 (дд, J=2,2 и 8,8 Гц, 1H, ArH); 7,52 (м, 2H, ArH); 6,06 (с, 1H, ArH); 3,74 (м, 4H, CH2); 2,71 (т, J=7,7 Гц, 2H, CH2); 2,49 (м, 6H, CH2); 2,38 (с, 3H, CH3); 1,91 (м, 2H, CH2).
MS-EI+ m/z: 335,9 (M+1).
Пример 5
Синтез 4-(2-{2-[1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-ил]этокси}этил)морфолина
5.1. Синтез 1-(3,4-дихлорфенил)-3-[2-метоксивинил]-5-метил-1H-пиразола
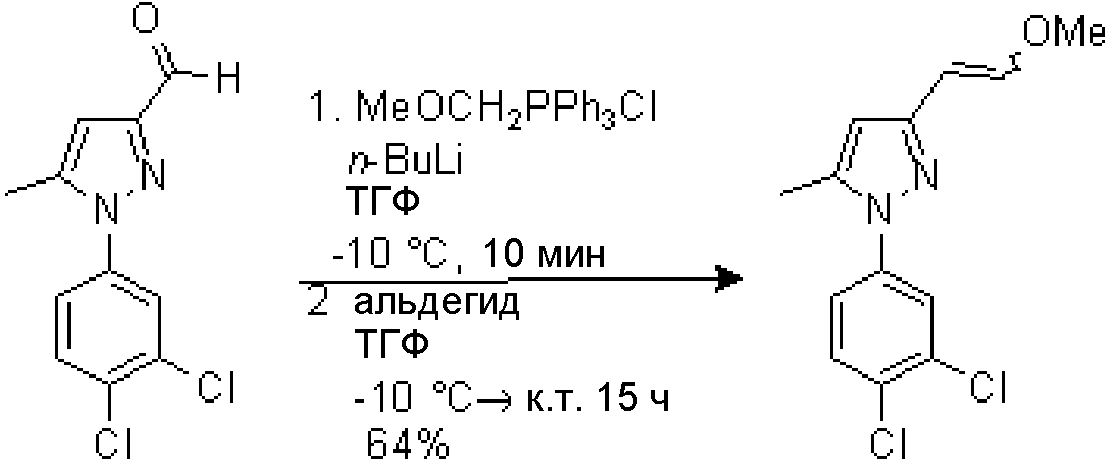
В суспензию (метоксиметил)трифенилфосфонийхлорида (2,06 г, 6,0 ммоль) в ТГФ (10 мл), охлажденную до -35°C на бане CO2-ацетон, медленно добавляли н-BuLi (2,5M в гексане, 2,4 мл, 6,0 ммоль; 20 мин добавления). Смесь перемешивали, смеси давали охладиться до -10°C в течение 10 мин, и медленно добавляли исходный альдегид (770 мг, 3,02 ммоль) в ТГФ (5,0 мл). Смеси давали охладиться до комнатной температуры и перемешивали в течение 15 час и выливали в водный насыщенный NH4Cl (30 мл). Водную фазу экстрагировали AcOEt (1×30 мл). Органические фазы промывали водным насыщенным NH4Cl (1×30 мл) и H2O (1×20 мл), сушили над безводным Na2SO4, фильтровали и концентрировали досуха. Неочищенный продукт очищали флэш-хроматографией на Biotage SP1 (0-30% AcOEt/гексан), с получением 550 мг желаемого продукта (Rf=0,5 (20% AcOEt/гексан), желтое масло, 64%-ный выход).
1H-ЯМР (CDCl3, 250 МГц, δ): 7,61 (д, J=2,5 Гц, 1H, ArH); 7,50 (д, J=8,5 Гц, 1H, ArH); 7,31 (дд, J=8,5 и 2,5 Гц, 1H, ArH); 7,17 (д, J=13,2 Гц, 0,5H, CH); 6,59 (с, 0,5H, ArH); 6,22 (д, J=6,9 Гц, 0,5H, CH); 6,13 (с, 0,5H, ArH); 5,78 (д, J=13,2 Гц, 0,5H, CH); 5,45 (д, J=6,9 Гц, 0,5H, CH); 3,80 (с, 1,5H, CH3); 3,68 (с, 1,5H, CH3); 2,35 (с, 1,5H, CH3); 2,33 (с, 1,5H, CH3).
MS-EI+ m/z: 282,6, 285,3 (M+1).
5.2 Синтез [1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-ил]ацетальдегида
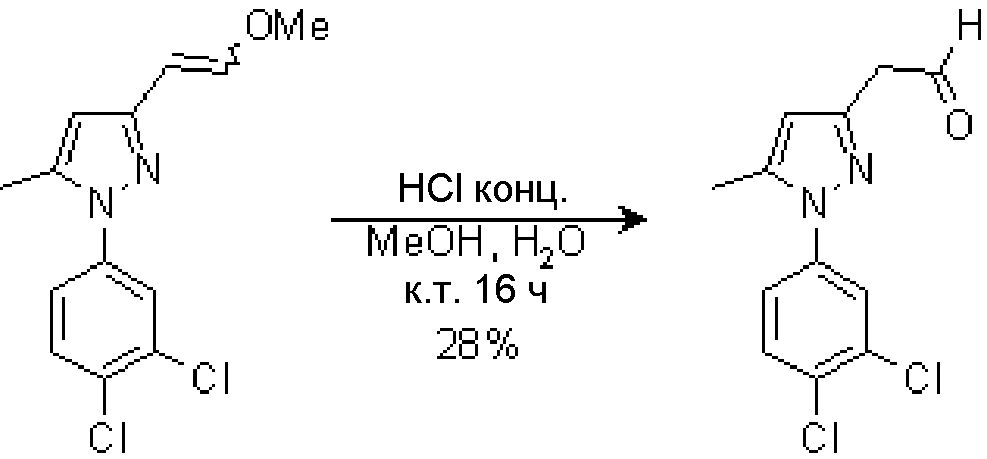
К раствору исходного сложного эфира (400 мг, 1,41 ммоль) в MeOH (4,0 мл) добавляли H2O (1,0 мл) и конц. HCl (2,3 мл). Смесь перемешивали при комнатной температуре в течение 16 час. Добавляли 50% водный NaOH до pH 7-8, и водную фазу экстрагировали AcOEt (4×15 мл). Объединенные органические фазы сушили над безводным Na2SO4, фильтровали и концентрировали досуха. Неочищенный продукт очищали на Biotage SP1 (0-30% AcOEt/гексан), с получением 106 мг желаемого продукта (Rf=0,3 (20% AcOEt/гексан), желтое масло, 28%-ный выход).
1H-ЯМР (CDCl3, 250 МГц, δ): 9,76 (т, J=1,9 Гц, 1H, CHO); 7,56 (д, J=2,5 Гц, 1H, ArH); 7,49 (д, J=8,5 Гц, 1H, ArH); 7,27 (дд, J=8,5 и 2,5 Гц, 1H, ArH); 6,11 (с, 1H, ArH); 3,68 (д, J=1,9 Гц, 2H, CH2); 2,31 (с, 3H, CH3).
5.3 Синтез 2-[1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-ил]этанола
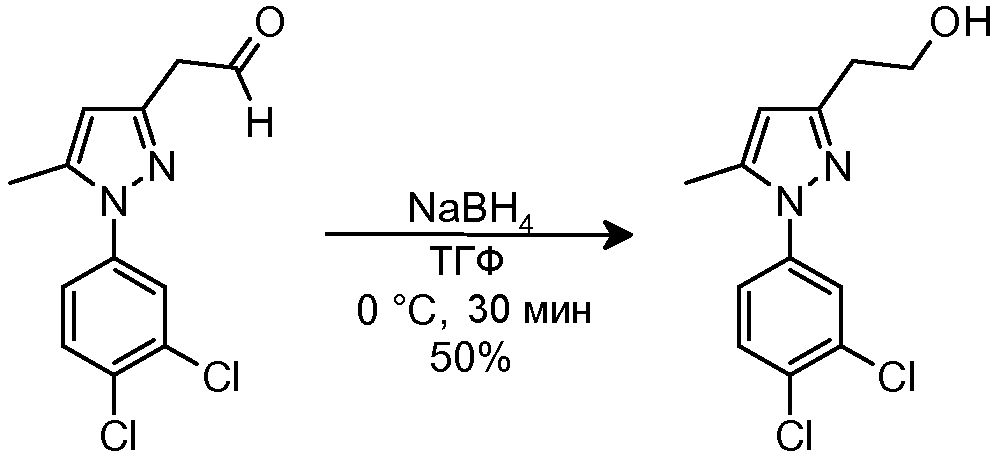
К раствору исходного альдегида (219 мг, 0,814 ммоль) в ТГФ (5,0 мл), охлаждаемому на бане H2O-лед, добавляли NaBH4 (92 мг, 2,43 ммоль). Полученный раствор перемешивали на бане H2O-лед в течение 30 мин и выливали вводный насыщенный NH4Cl (15 мл). Водную фазу экстрагировали AcOEt (2×15 мл), и объединенные органические фазы сушили над безводным Na2SO4, фильтровали и концентрировали досуха. Неочищенный продукт очищали на Biotage SP1 (0-60% AcOEt/гексан), с получением 110 мг желаемого продукта (Rf=0,3 (40% AcOEt/гексан), белое твердое вещество, 50%-ный выход).
1H-ЯМР (CDCl3, 250 МГц, δ): 7,58 (д, J=2,5 Гц, 1H, ArH); 7,52 (д, J=8,5 Гц, 1H, ArH); 7,30 (дд, J=8,5 и 2,5 Гц, 1H, ArH); 6,07 (с, 1H, ArH); 3,91 (м, 2H, CH2); 2,87 (т, J=5,9 Гц, 2H, CH2); 2,34 (с, 3H, CH3).
5.4 Синтез 4-(2-{2-[1-(3,4-дихлорфенил)-5-метил-1H-пиразол-3-ил]этокси}этил)морфолина
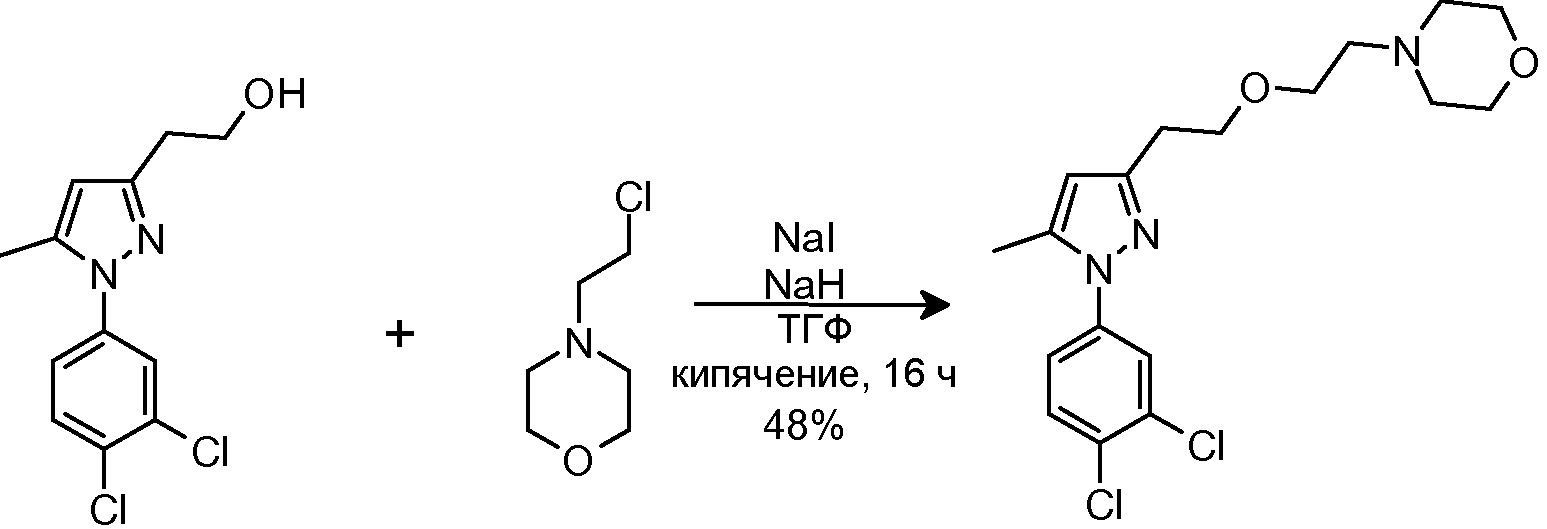
К раствору исходного спирта (104 мг, 0,383 ммоль) в ТГФ (5 мл) добавляли NaH (60% в минеральном масле, 30 мг, 0,76 ммоль). Смесь перемешивали при комнатной температуре в течение 10 мин, и добавляли 4-(2-хлорэтил)морфолин (69 мг, 0,461 ммоль) и NaI (74 мг, 0,493 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 16 час, затем смеси давали охладиться до комнатной температуры и выливали в H2O (10 мл). Водную фазу экстрагировали AcOEt (3×15 мл), и объединенные органические фазы сушили над безводным Na2SO4, фильтровали и концентрировали досуха. Остаток очищали на Biotage SP1 (4-15% MeOH/CH2Cl2), с получением 70 мг желаемого продукта (Rf=0,2 (5% MeOH/CH2Cl2), масло оранжевого цвета, 48%-ный выход).
1H-ЯМР (CDCl3, 250 МГц, δ): 7,59 (д, J=2,5 Гц, 1H, ArH); 7,51 (д, J=8,5 Гц, 1H, ArH); 7,29 (дд, J=8,5 и 2,5 Гц, 1H, ArH); 6,09 (с, 1H, ArH); 3,76-3,68 (м, 6H, CH2); 3,62 (т, J=5,8 Гц, 2H, CH2); 2,91 (т, J=7,0 Гц, 2H, CH2); 2,59 (т, J=5,8 Гц, 2H, CH2); 2,49 (м, 4H, CH2); 2,33 (с, 3H, CH3).
MS-EI+ m/z: 384,2; 386,0 (M+1).
Следующие соединения по настоящему изобретению показаны в виде примеров в следующей таблице 1
|
|
БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
Некоторые представительные соединения по настоящему изобретению были исследованы на их активность в качестве ингибиторов сигма (сигма-1). Следовали следующему протоколу:
Получение мембран мозга и анализ связывания для σ1-рецептора проводили, как описано (DeHaven-Hudkins et al., 1992), с некоторыми изменениями. Кратко, мозг морской свинки гомогенизировали в 10 объемах (масс./объем) Tris-HCl 50 мМ 0,32 M сахарозы, pH 7,4, с использованием Kinematica Polytron PT 3000 при 15000 оборотах в минуту в течение 30 сек. Гомогенат центрифугировали при 1000g в течение 10 мин при 4°C и супенатанты собирали и снова центрифугировали при 48000g в течение 15 мин при 4°C. Осадок вновь суспендировали в 10 объемах буфера Tris-HCl (50 мМ, pH 7,4), инкубировали при 37°C в течение 30 мин, и центрифугировали при 48000g в течение 20 мин при 4°C. После этого осадок вновь суспендировали в свежем буфере Tris-HCl (50 мМ, pH 7,4) и хранили на льду до использования.
Каждая пробирка для анализа содержала 10 мкл [3H](+)-пентазоцина (конечная концентрация 0,5 нМ), 900 мкл суспензии ткани до конечного анализируемого объема в 1 мл и конечной концентрации ткани приблизительно 30 мг массы чистой ткани/мл. Неспецифическое связывание определяли путем добавления конечной концентрации 1 мкМ галоперидола. Все пробирки инкубировали при температуре 37°C в течение 150 мин перед завершением взаимодействия путем быстрой фильтрации через фильтры из стекловолокна фирмы Schleicher & Schuell GF 3362 [предварительно пропитанные 0,5% раствором полиэтиленимина в течение, по меньшей мере, 1 час]. Затем фильтры промывали четыре раза 4 мл холодного буфера Tris-HCl (50 мМ, pH 7,4). После добавления сцинтилляционного коктейля образцы оставляли для уравновешивания в течение ночи. Количество связанной радиоактивности определяли с помощью жидкостной сцинтилляционной спектрометрии, используя жидкостной сцинтилляционный счетчик Wallac Winspectral 1414. Концентрацию белка определяли по способу Lowry et al. (1951).
Литература
1. DeHaven-Hudkins, D. L., L.C. Fleissner, and F. Y. Ford-Rice, 1992, “Characterization of the binding of [3H](+)pentazocine to σ recognition sites in guinea pig brain”, Eur. J. Pharmacol. 227, 371-378.
2. Lowry, O.H., N.J. Rosebrough, A.L. Farr, and R.J. Randall, 1951, Protein measurement with the Folin phenol reagent, J. Biol. Chem, 193, 265.
Некоторые из полученных результатов показаны в таблице 2.
|