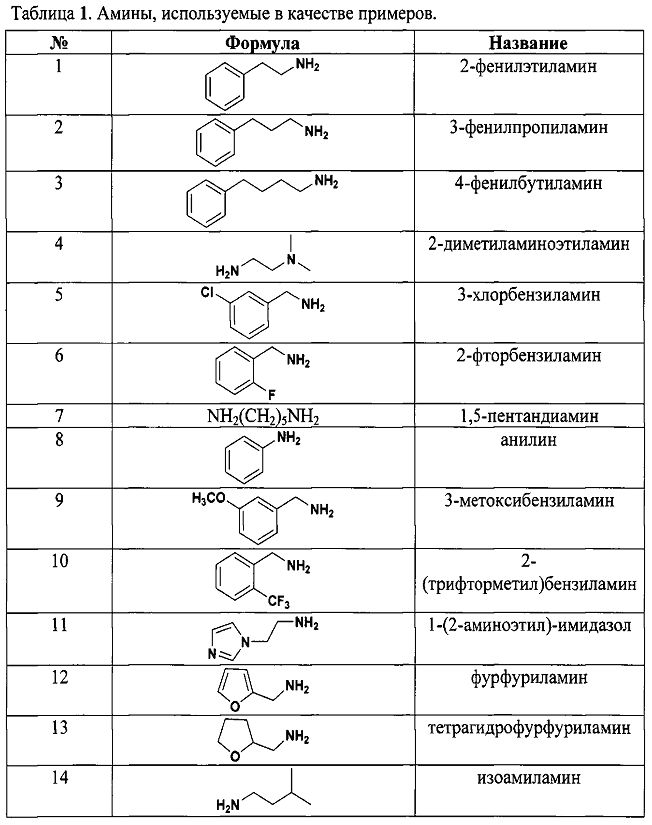
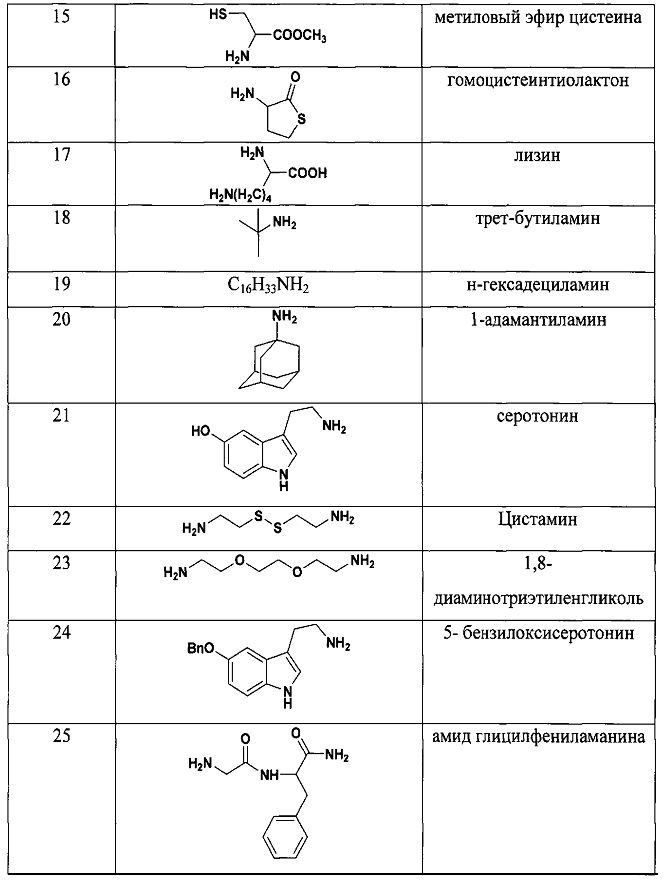
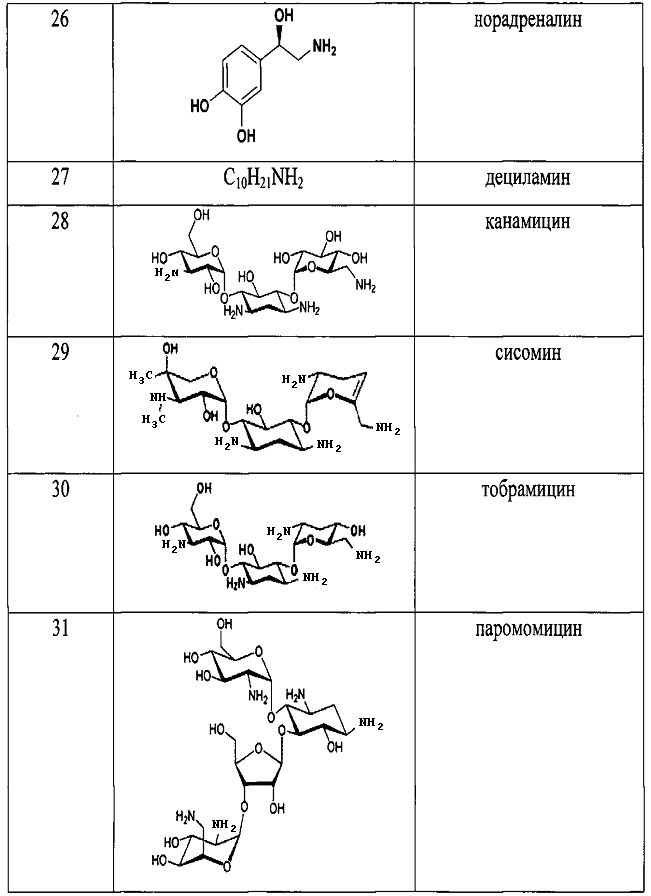
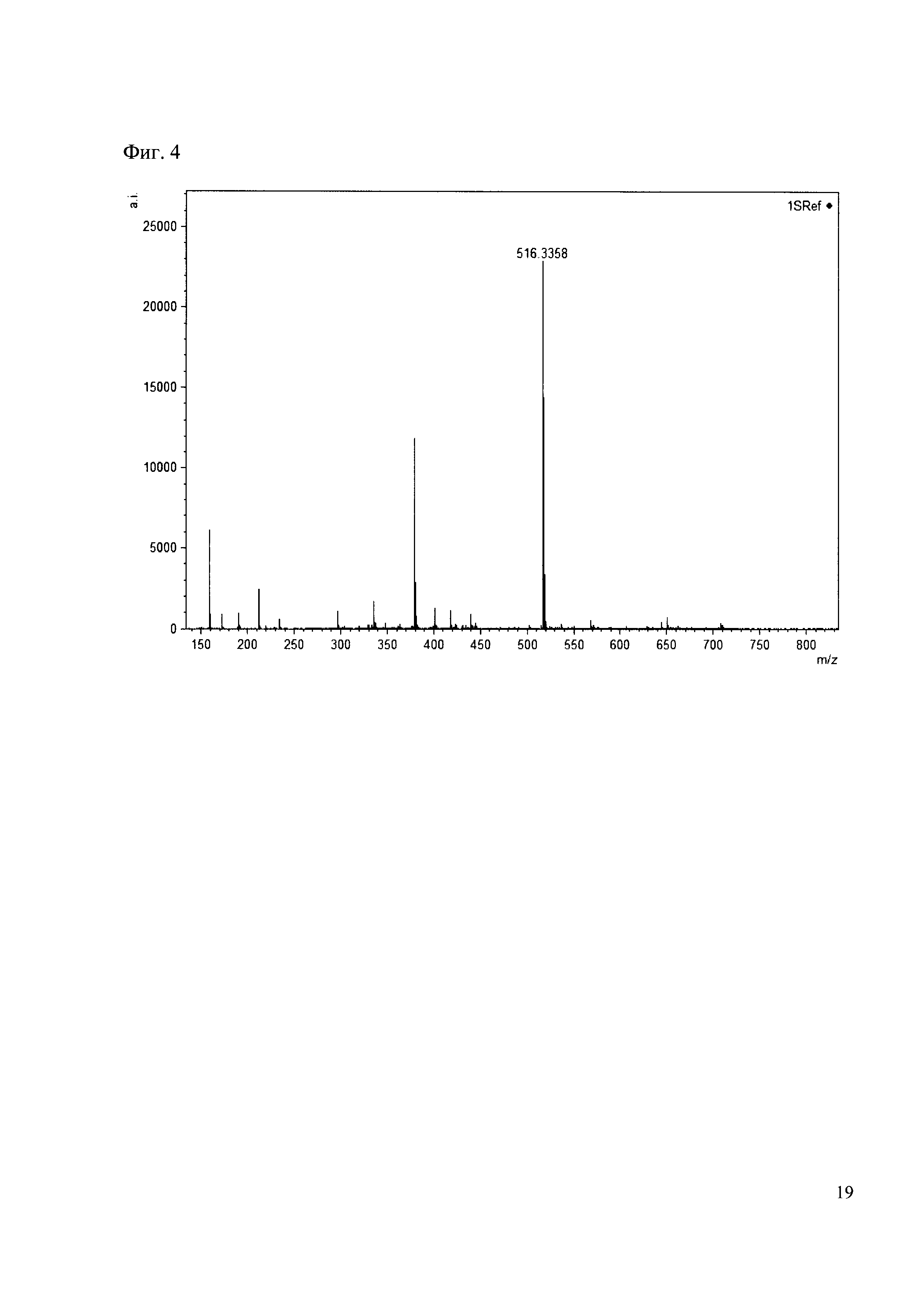Результат интеллектуальной деятельности: СПОСОБ ДЕТЕКЦИИ АМИНОВ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к области аналитической химии и касается способа детекции органических соединений, содержащих аминогруппу.
Уровень техники
Амины являются одним из важнейших классов органических соединений. Аминогруппа входит в состав многих природных соединений (белки, пептиды, аминокислоты, биогенные амины и нейромедиаторы, нуклеиновые кислоты, нуклеотиды, нуклеозиды, алкалоиды, антибиотики, токсины и другие вторичные метаболиты), лекарств, наркотических препаратов. Различные амины используются в качестве мономеров для поликонденсации, компонентов клеев и адгезивов, добавок к топливу, а также в производстве красителей и гербицидов. Токсичные ароматические амины являются загрязнителями окружающей среды.
Из-за распространенности и высокой биологической активности аминов методы их определения непрерывно совершенствуются.
Наиболее близкие способы детекции аминов рассмотрены в обзоре (Erim В.Н. Tr. Anal. Chem., 2013, 52, 239-247) в настоящее время используются почти исключительно инструментальные методы, основанные на применении высокоэффективной жидкостной хроматографии (ВЭЖХ), масс-спекрометрии с различными типами ионизации и комбинации ВЭЖХ/масс-спектрометрия
Однако анализ многих аминов методами ВЭЖХ и масс-спектрометрии затруднен. Низкомолекулярные амины летучи, поэтому их можно анализировать в вакууме в масс-спектрометрах лишь в виде солей. Метод усиливаемой матрицей лазерной ионизации (MALDI) непригоден для аминов малой массы из-за перекрывания с фоновыми сигналами матрицы. Полярные амины (аминосахара, аминогликозидные антибиотики) с трудом ионизируются в условиях масс-спектрометрии, и их детекция в смесях с другими веществами затруднена. Еще одним недостатком существующих методов является дороговизна оборудования и сложность анализа.
Увеличить чувствительность детекции в масс-спектрометрии трудно ионизирующихся соединений позволяет их модификация молекулами, содержащими постоянный заряд или легко ионизирующуюся группировку. Для дериватизации по аминогруппе пептидов с целью их дальнейшей детекции с помощью масс-спектрометрии использовали реакцию с активированными эфирами, содержащими заряженные группы - четвертичные фосфониевые соли, четвертичные аммониевый соли, тритильные соединения. Аминогруппы пептидов превращали с помощью O-метилизомочевины и ее производных в гуанидиновые, легко поддающиеся ионизации. Наконец, для дериватизации аминов в масс-спектрометрии использовали тетрафторборат трис(2,4,6-триметоксифенил)метилия; при реакции замещается одна из пара-метоксильных групп и амин превращается в постоянно заряженное тритильное производное.
Известна также реакция 2,2′,2″,6,6′,6″-гексаметокситритильного катиона с аминами с образованием производных акридина (Laursen B.W., Krebs F.C. Angew. Chem. Int. Ed., 2000, 39, 3432-3434; Laursen B.W., Krebs F.C. Chem. Eur. J., 2001, 7, 1773-1783; Laursen B.W. et al. Angew. Chem. Int. Ed., 2003, 42, 3162-3166). Однако ранее она не использовалась для дериватизации аминов в ВЭЖХ и масс-спектрометрии.
Предлагаемое изобретение решает задачу по созданию экспресс-метода анализа аминов для фармацевтической промышленности, сельхоз и пищевой индустрии. Поставленная задача решается за счет химической модификации анализируемых объектов, с последующей их детекцией масс-спектрометрическими методами.
Раскрытие изобретения
Способ детекции амина в образце включает в себя контактирование образца, содержащего амин, с раствором соли, содержащей 2,2′,2″,6,6′,6″-гексаметокситритильный карбокатион, и детекцию полученного акридинового производного в образце с помощью ВЭЖХ и/или масс-спектрометрии.
Амины, коммерчески доступные в виде гидрохлоридов, сульфатов и других солевых форм, предварительно растворяют в водном буферном растворе (pH=9.55).
Амины - органические соединения, являющиеся производными аммиака, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы.
Образец - препарат, содержащий в своем составе амин.
Соли, содержащие карбокатион - вещества, состоящие из катиона 2,2′,2″,6,6′,6″-гексаметокситритила и аниона сильной кислоты.
В заявленном способе используется реакция амина с 2,2′,2″,6,6′,6″-гексаметокситритилиевой солью: тетрафторборатом, гексафторфосфатом, нитратом, перхлоратом, хлоридом, бромидом, которая была описана в статье (Laursen B.W., Krebs F.C. Chem. Eur. J., 2001, 7, 1773-1783) и ранее не использовалась для дериватизации аминов с целью их детекции. Первая стадия, приводящая к акридиновому производному, протекает легко:
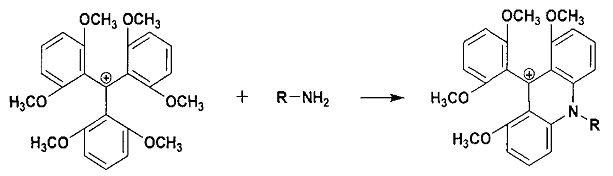
Реакция осуществляется в органической или водно-органической среде при pH>7, эффективна, ортогональна по отношению к большинству функциональных групп. В реакцию способны вступать как алифатические, так и ароматические амины R-NH2.
В качестве модельных субстратов были взяты арилалкильные амины состава Ph(CH2)nNH2, где n=2,3,4. Процедура детекции амина весьма проста: к раствору масс-спектрометрической метки в ацетонитриле добавляют амин, затем спустя 10 минут анализируют методом MALDI реакционную смесь с помощью MALDI масс-спектрометрии.
Для того, чтобы показать возможности способа, нами были проведены реакции с рядом различных по структуре и природе аминов:
Как видно из таблицы 1 предлагаемый способ охватывает широкий круг аминов среди которых есть непосредственно лекарственные препараты, антибиотики, гормоны, пептиды, аминокислоты и другие биологически-активные вещества.
Также стоит отметить, что представленный способ имеет неоспоримые преимущества для определения веществ, не поглощающих в УФ области спектра и трудноионизируемых, что делает невозможным или очень сложным определение их с помощью ВЭЖХ и масс-спектрометрии.
Предлагаемый способ, включающий использование реакции гексаметокситритильного карбокатиона с аминами, характеризуется следующими техническими результатами, являющимися улучшениями в сравнении с существующими методами экспресс-детекции аминов.
1. Высокая чувствительность и предел детекции (порядка 3*1010 молекул) в ячейке мишени для ионизации методом MALDI.
2. Упрощен процесс пробоподготовки. Анализы могут проводить люди без специальных аналитических навыков, следуя несложной инструкции.
3. Уменьшено время анализа. Время реакции как правило не превышает 30 минут, время анализа занимает порядка 5 минут.
4. Дешевизна и доступность реагентов.
5. Возможность определения легколетучих, трудноионизируемых и непоглощающих в УФ-области аминосодержащих веществ.
Основным параметром, наглядно демонстрирующим возможности метода, является интенсивность сигнала конъюгата метка-амин в масс-спектре.
Осуществление изобретения
Изобретение иллюстрируют следующие примеры:
Для проведения реакции был приготовлен 0.5*10-2 М раствор гексафторфосфата 2,2′,2″,6,6′,6″-гексаметокситритила в ацетонитриле (раствор 1).
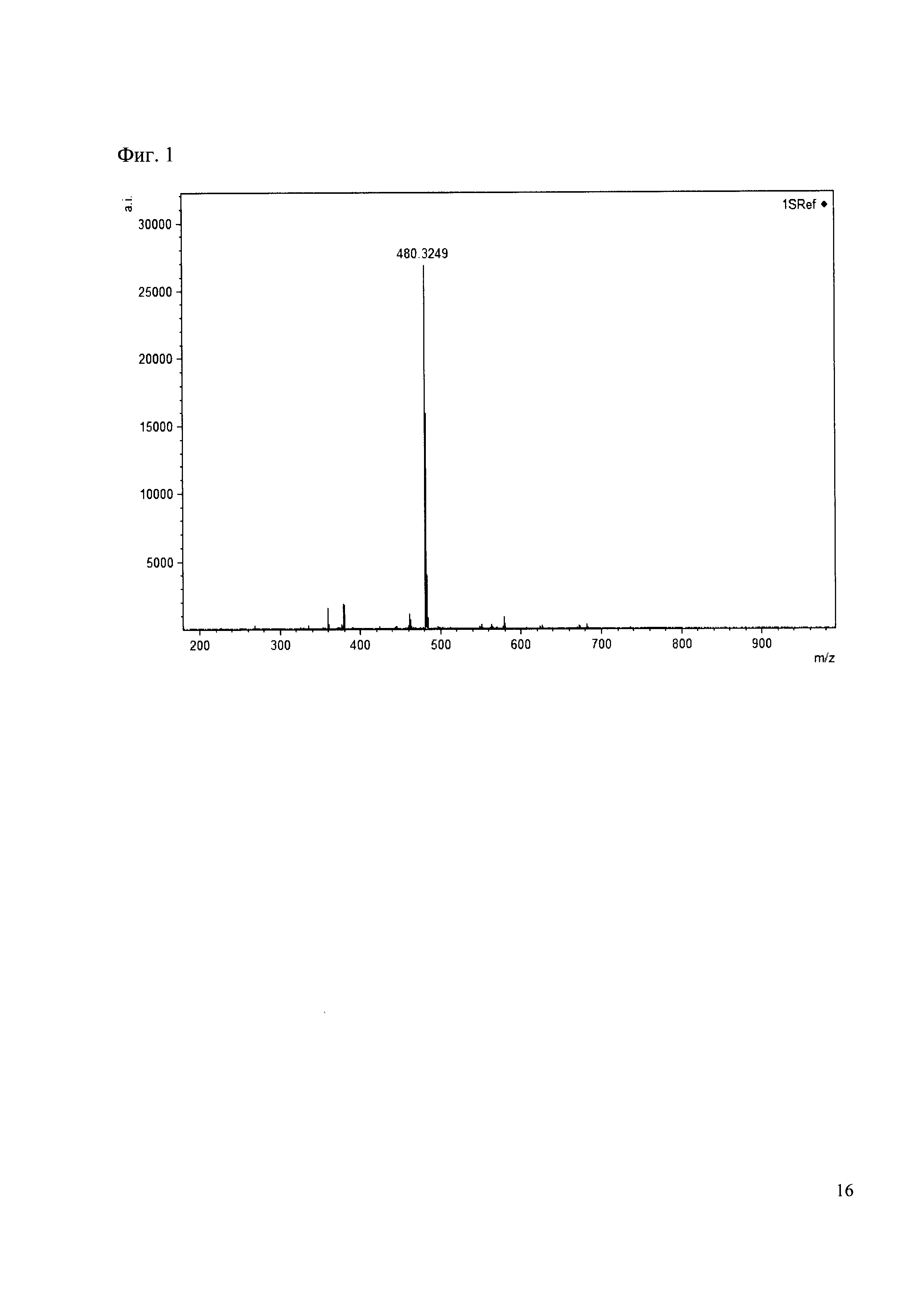
Пример 1
К 50 мкл раствора 1 метки добавляют 100 мкл ацетонитрила и 1 мг амина 1. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 1 MALDI-спектр в матрице CHCA)
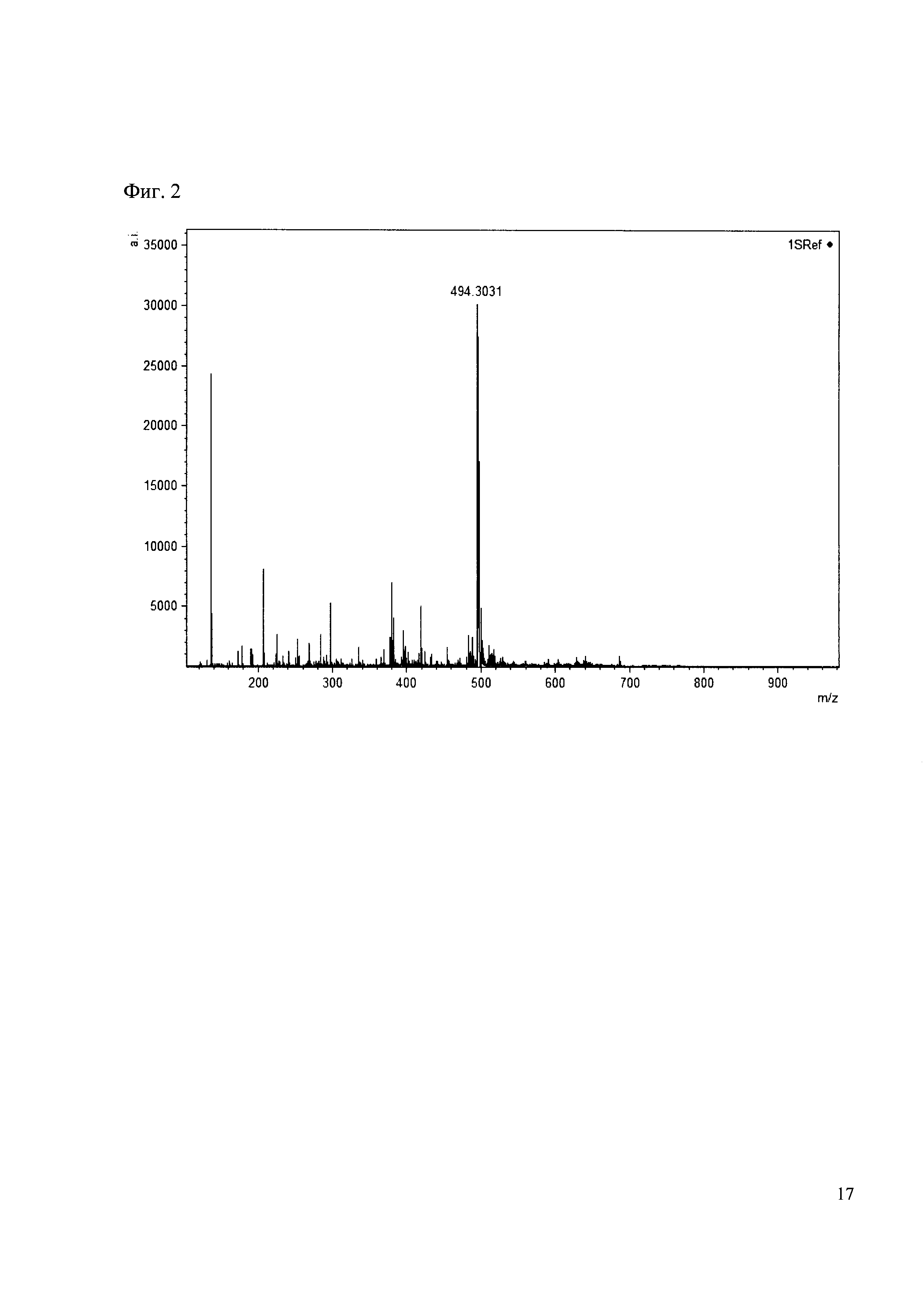
Примеры 2
К 50 мкл раствора 1 добавляют 100 мкл ацетонитрила и 1 мг амина 2. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 2 MALDI-спектр в матрице CHCA)
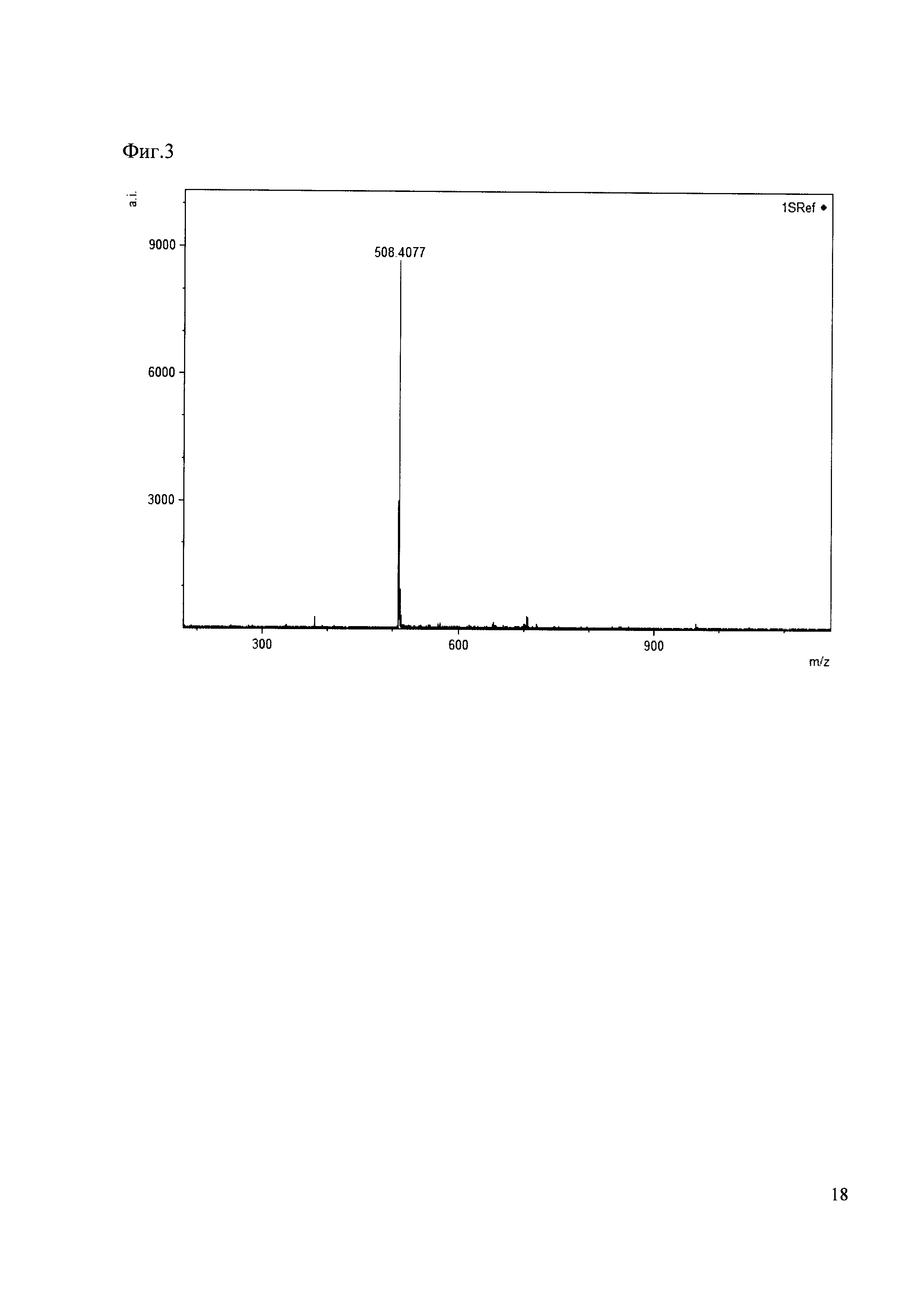
Пример 3
К 50 мкл раствора 1 добавляют 100 мкл ацетонитрила и 1 мг амина 3. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 3 MALDI-спектр в матрице CHCA)
Пример 4
К 50 мкл раствора 1 добавляют 100 мкл ацетонитрила и 1 мг амина 27. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 4 MALDI-спектр в матрице CHCA)
Пример 5
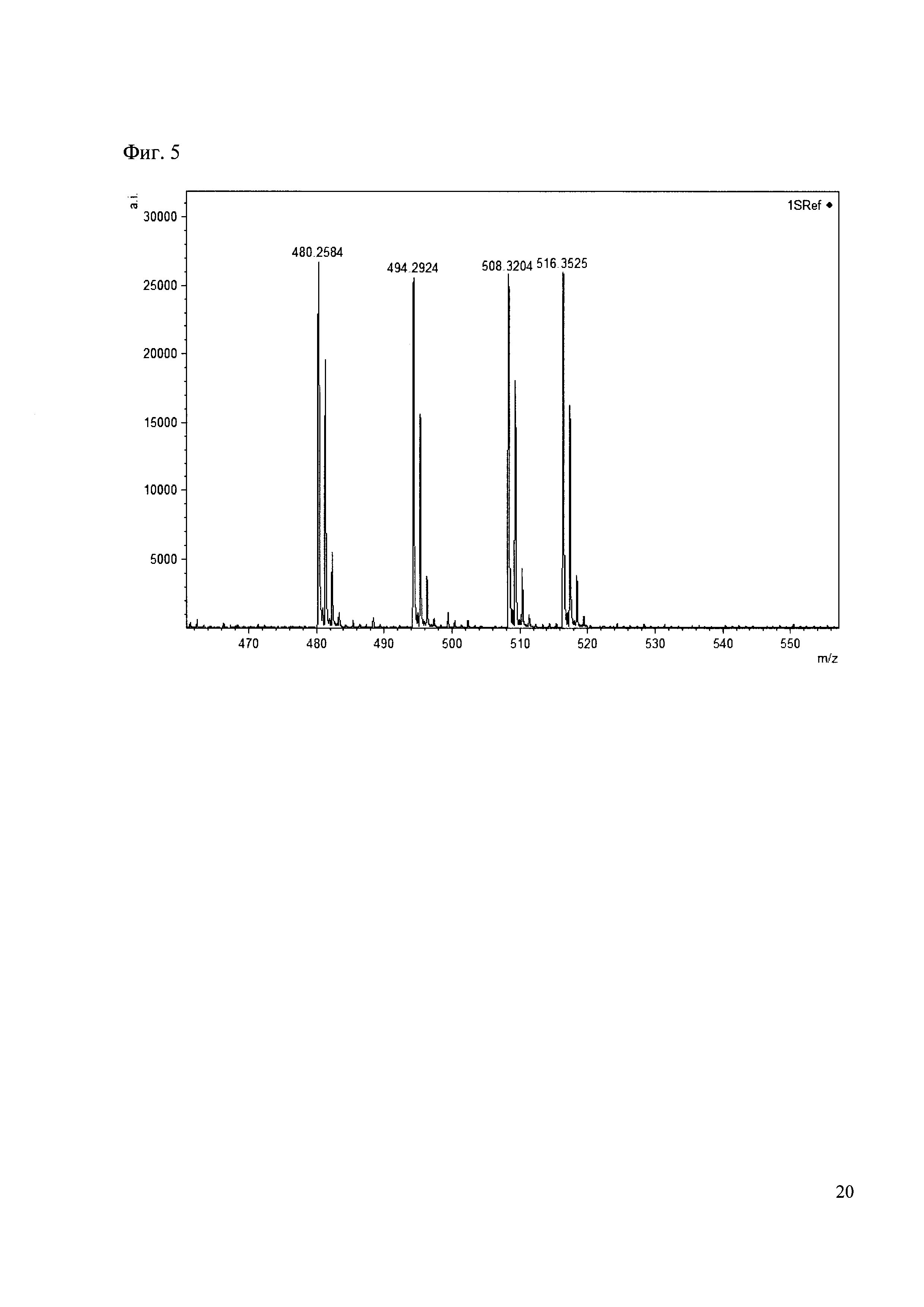
Смешивают по 10 мкл реакционных смесей из примеров 1, 2, 3, 4. Полученную реакционную смесь анализируют методом MALDI. (Фиг. 5 MALDI-спектр в матрице CHCA)
Пример 6
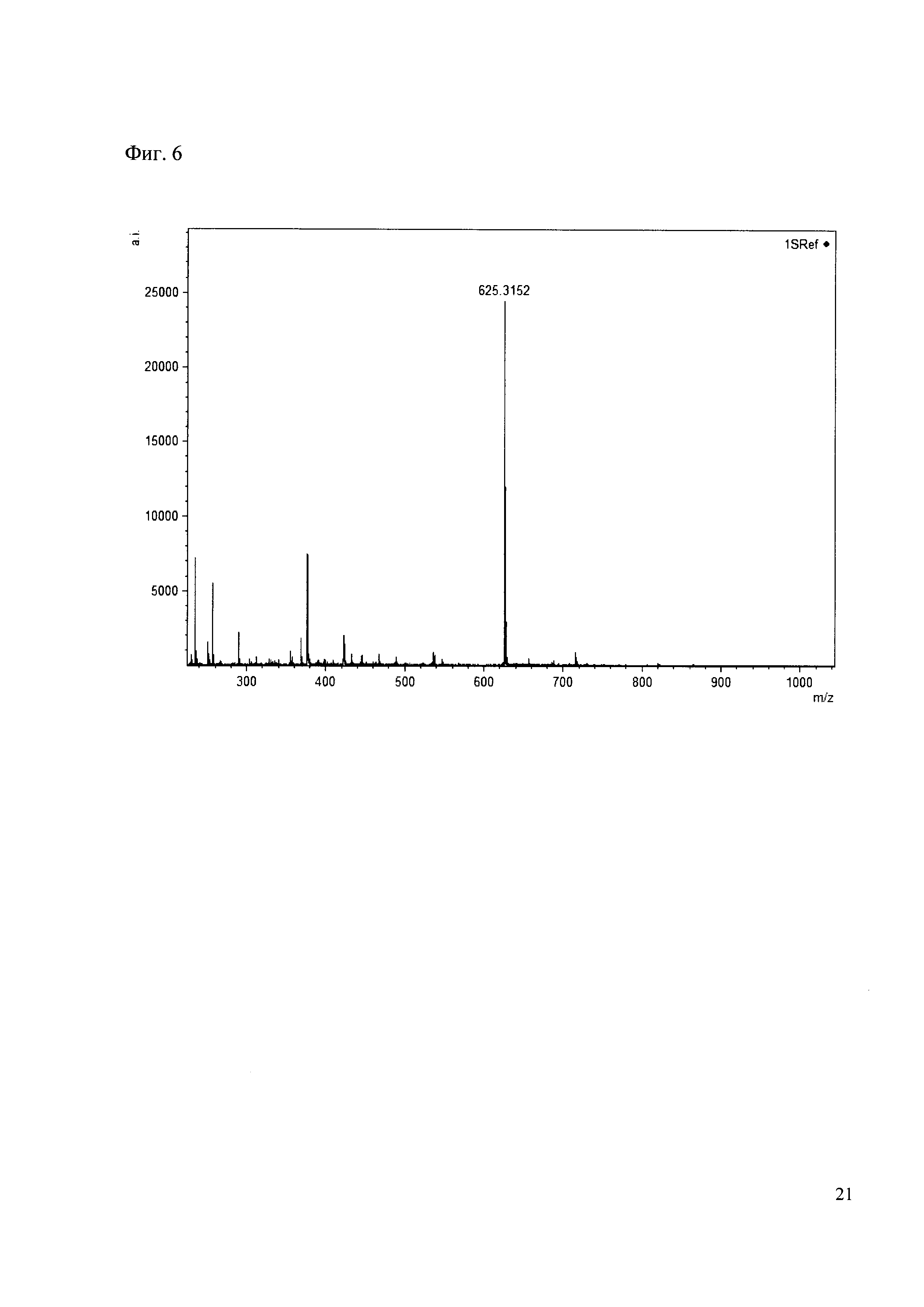
0.5 мг гидрохлорида амина 24 растворяют в 200 мкл карбонатного буфера (pH=9.55) и добавляют 50 мкл раствора 1. Реакционную смесь анализируют методом MALDI. (Фиг. 6 MALDI-спектр в матрице CHCA)
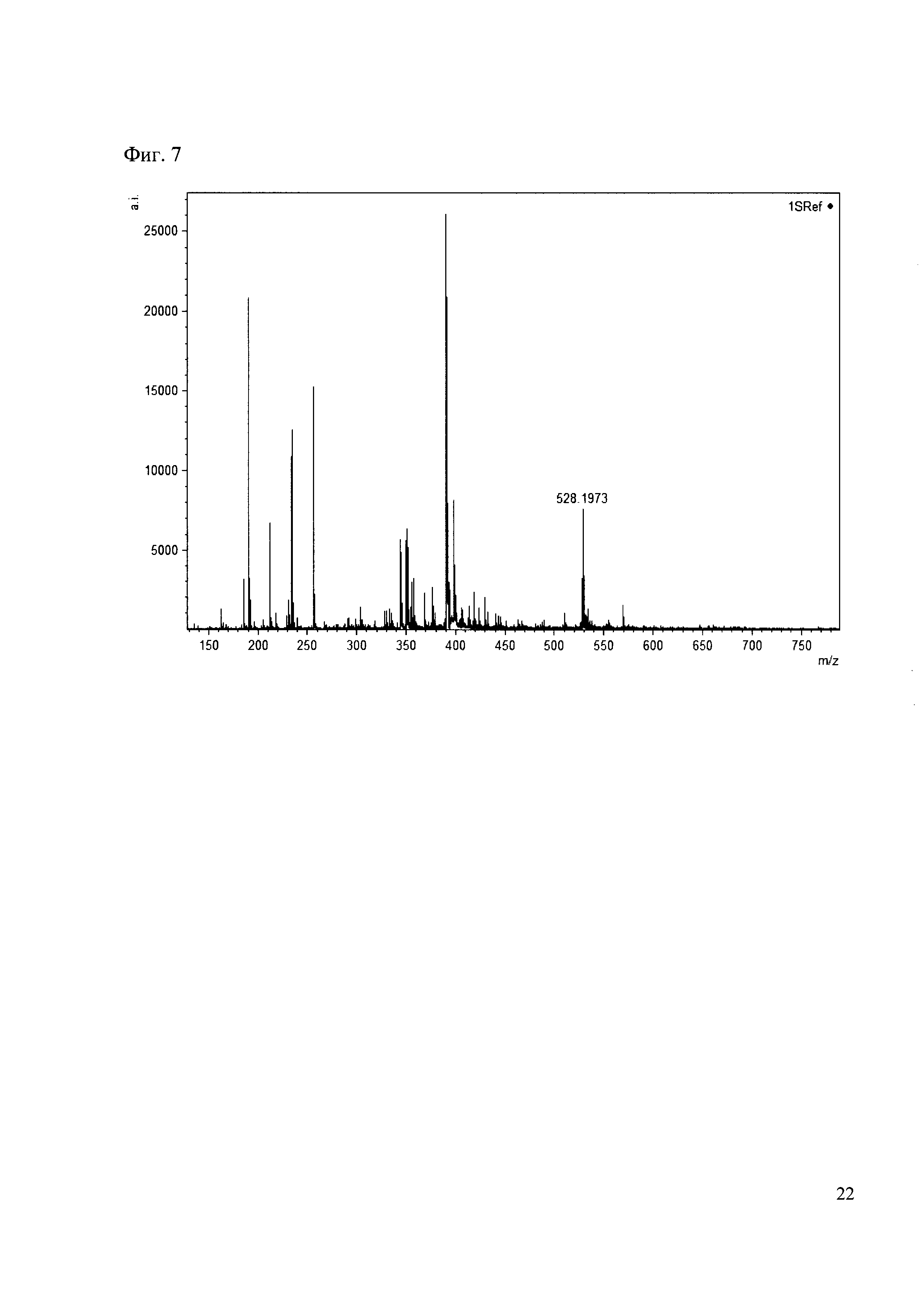
Пример 7
0.5 мг гидрохлорида амина 26 растворяют в 200 мкл карбонатного буфера (pH=9.55) и добавляют 50 мкл раствора 1. Реакционную смесь анализируют методом MALDI. (Фиг. 7 MALDI-спектр в матрице CHCA)
По 1 мг сульфатов аминогликозидных антибиотиков 28, 29, 30, 31 растворяют в 200 мкл буфера (pH=9.55)
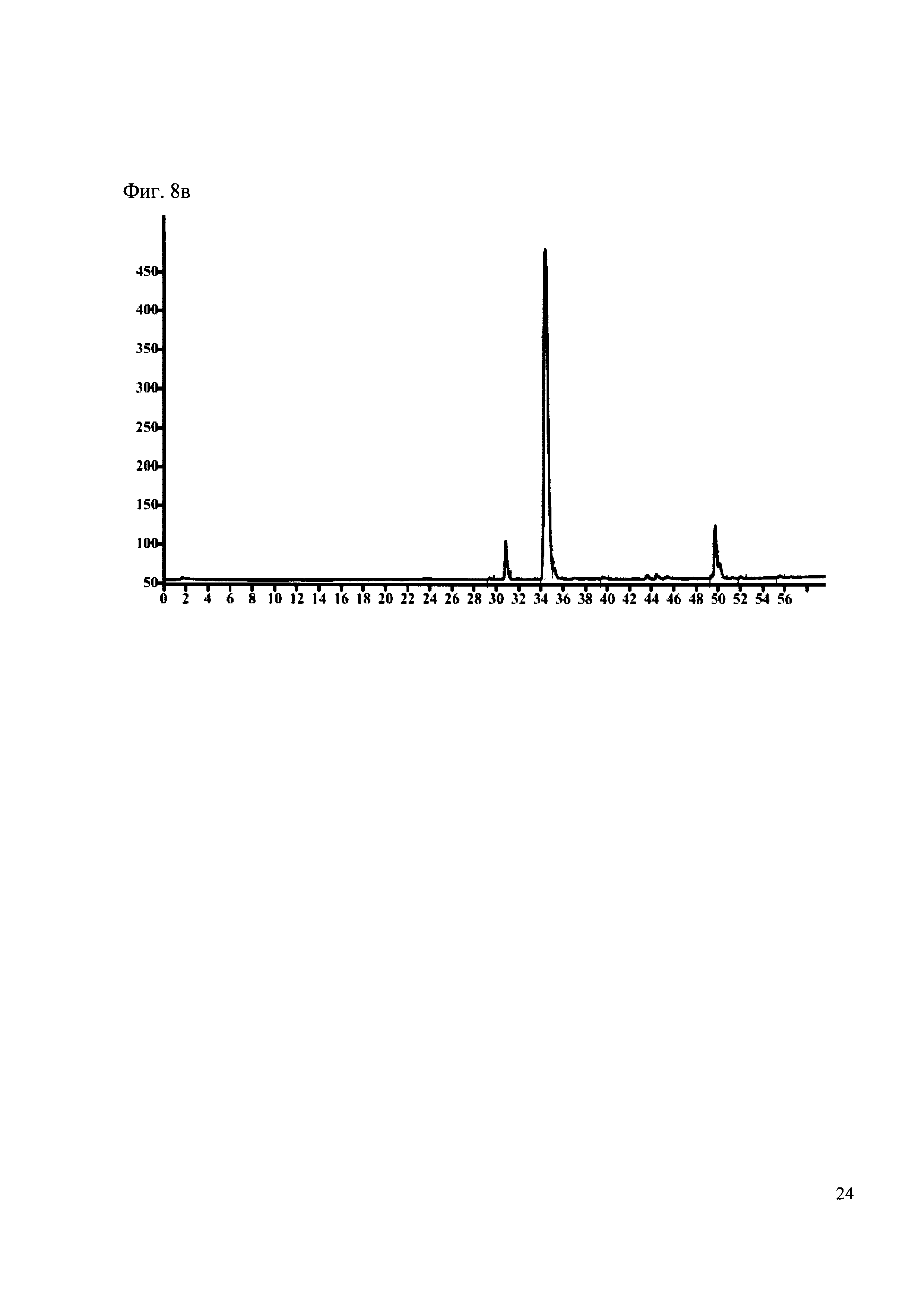
Пример 8
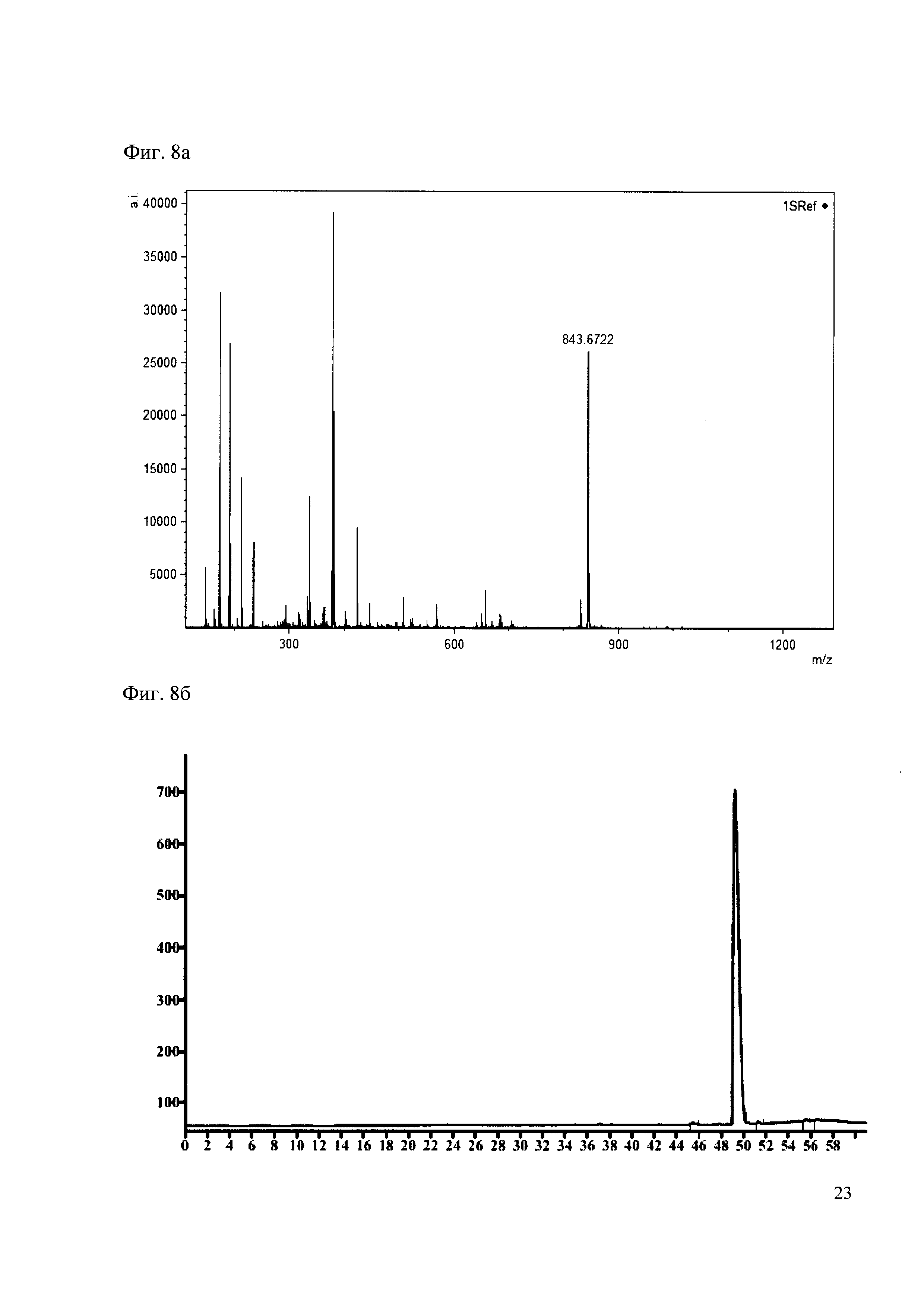
190 мкл раствора антибиотика 28 смешивают со 100 мкл раствора 1. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI и ВЭЖХ. (Фиг. 8a MALDI-спектр в матрице CHCA, Фиг. 8б ВЭЖХ 2,2′,2″,6,6′,6″-гексаметокситритил гексафторфосфата, Фиг. 8в ВЭЖХ конъгата канамициа и 2,2′,2″,6,6′,6″-гексаметокситритила)
Пример 9
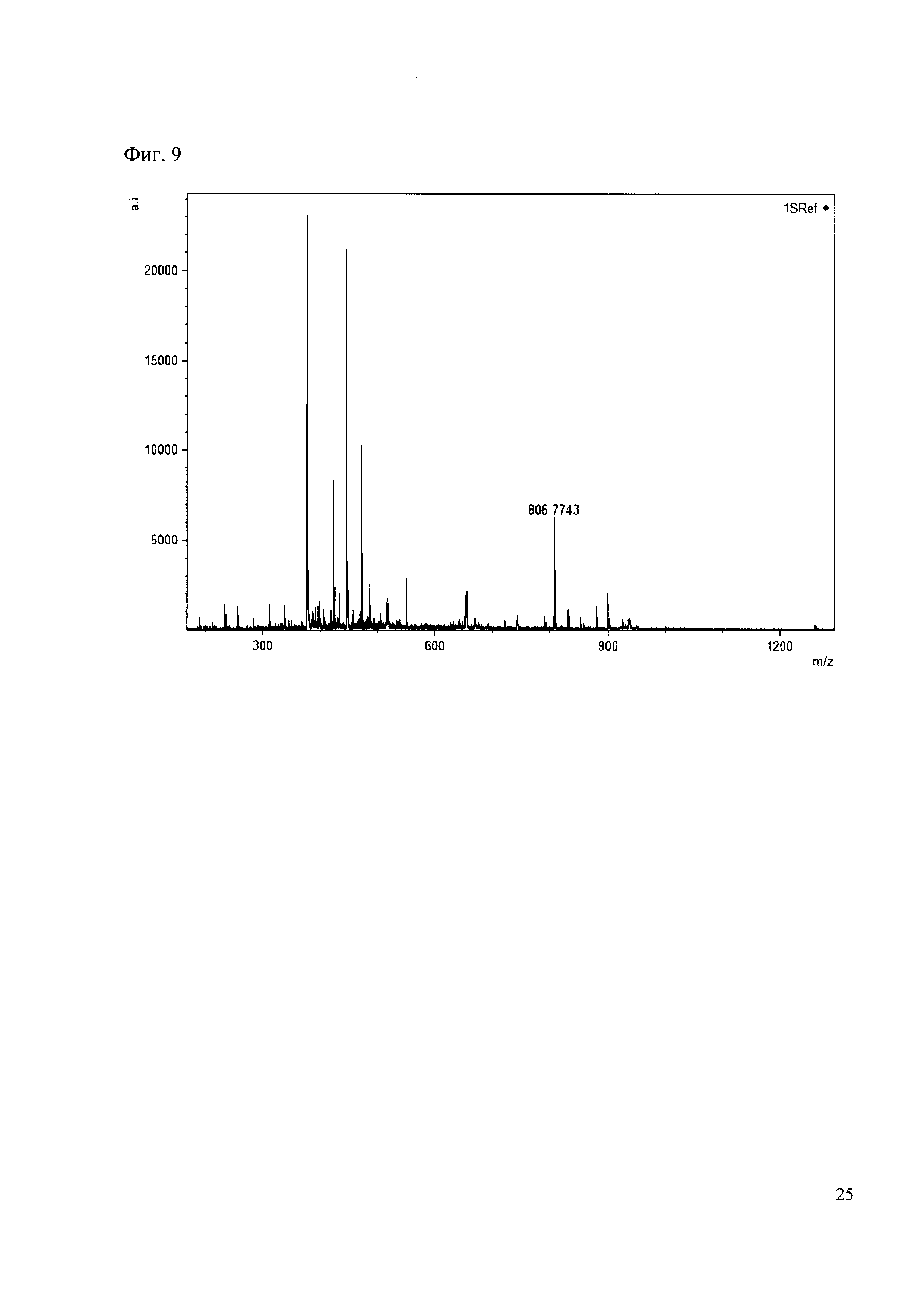
190 мкл раствора антибиотика 29 смешивают со 100 мкл раствора 1. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 9 MALDI-спектр в матрице CHCA)
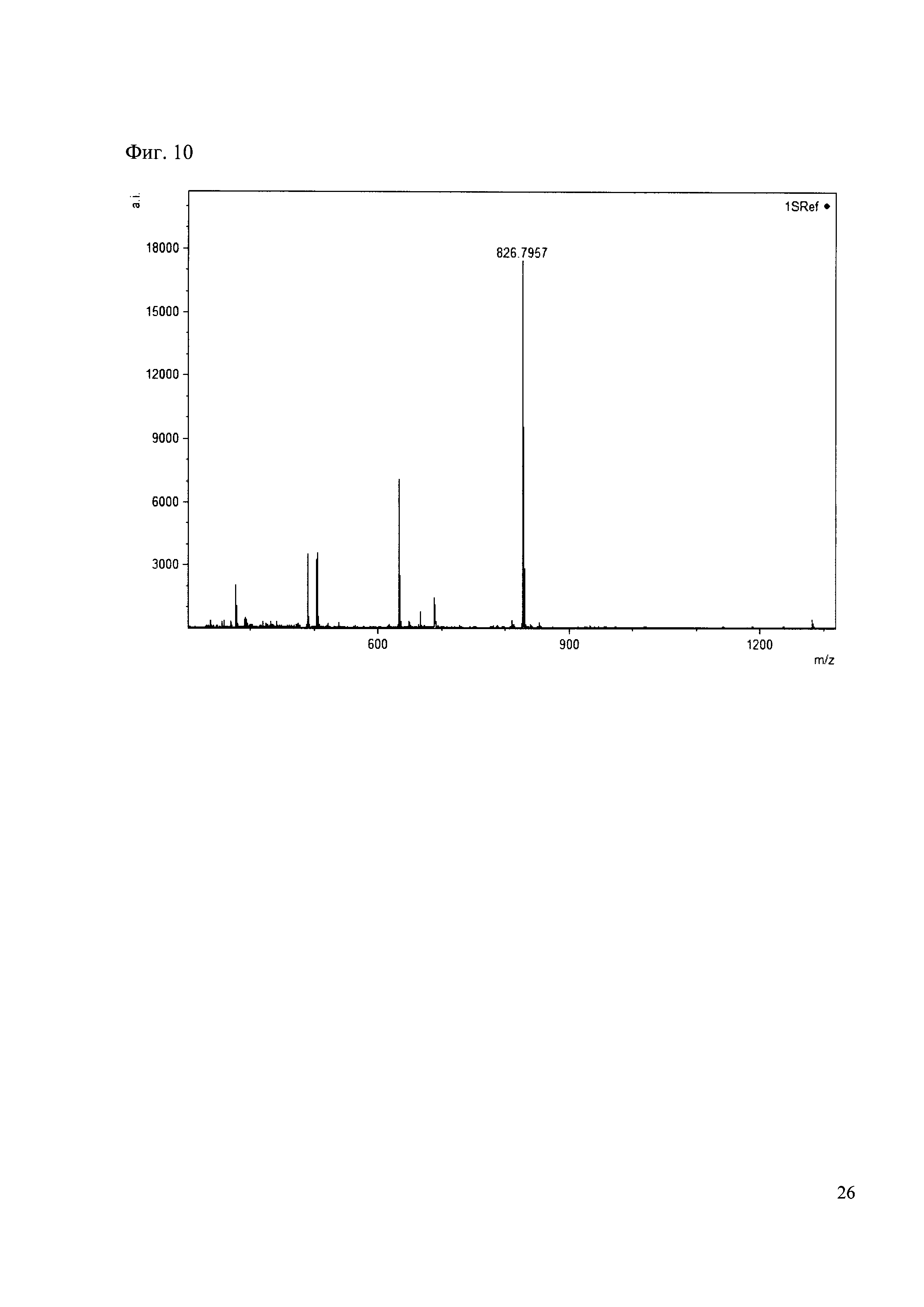
Пример 10
190 мкл раствора антибиотика 30 смешивают со 100 мкл раствора 1. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 10 MALDI-спектр в матрице CHCA)
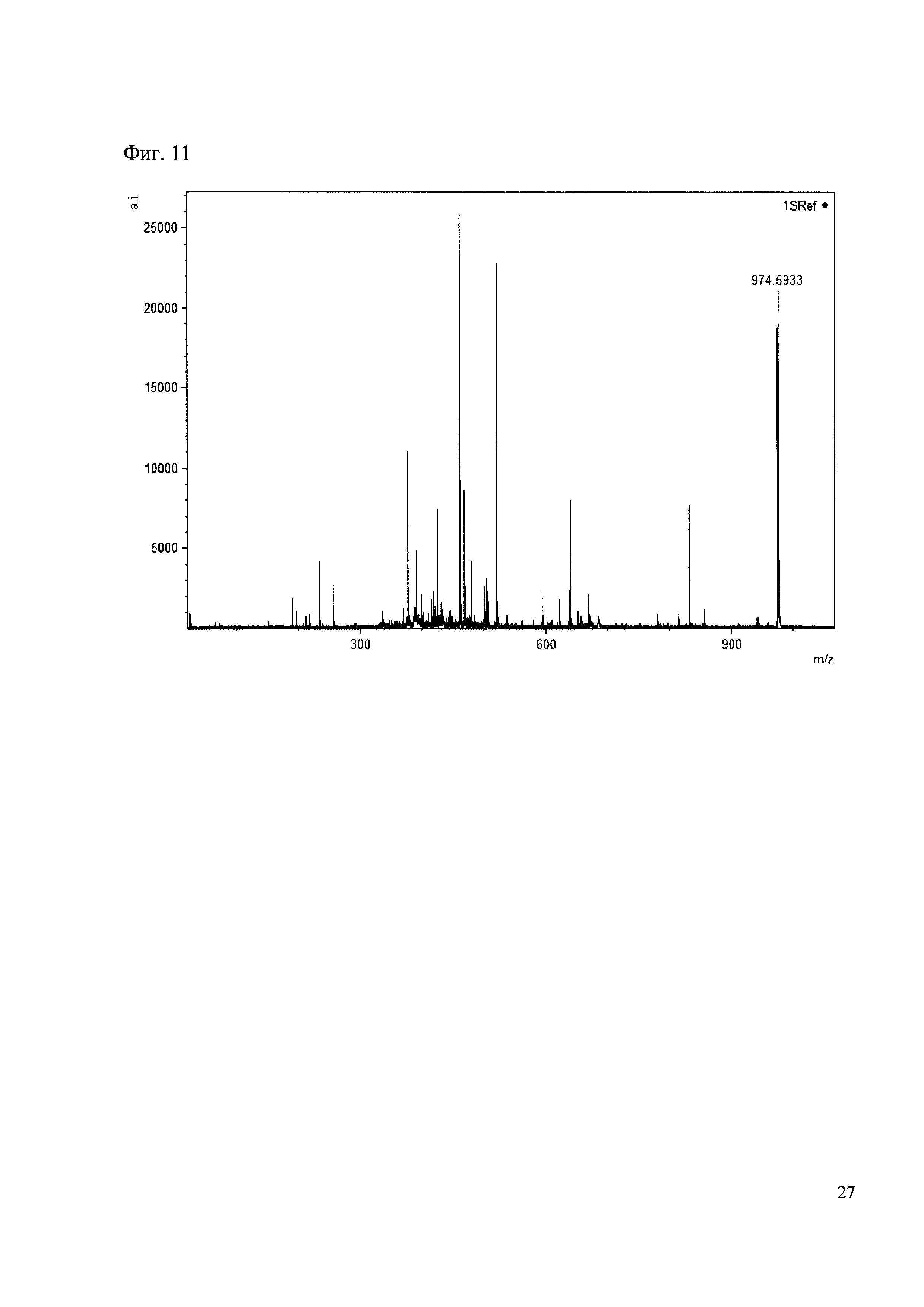
Пример 11
190 мкл раствора антибиотика 31 смешивают со 100 мкл раствора 1. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 11 MALDI-спектр в матрице CHCA)
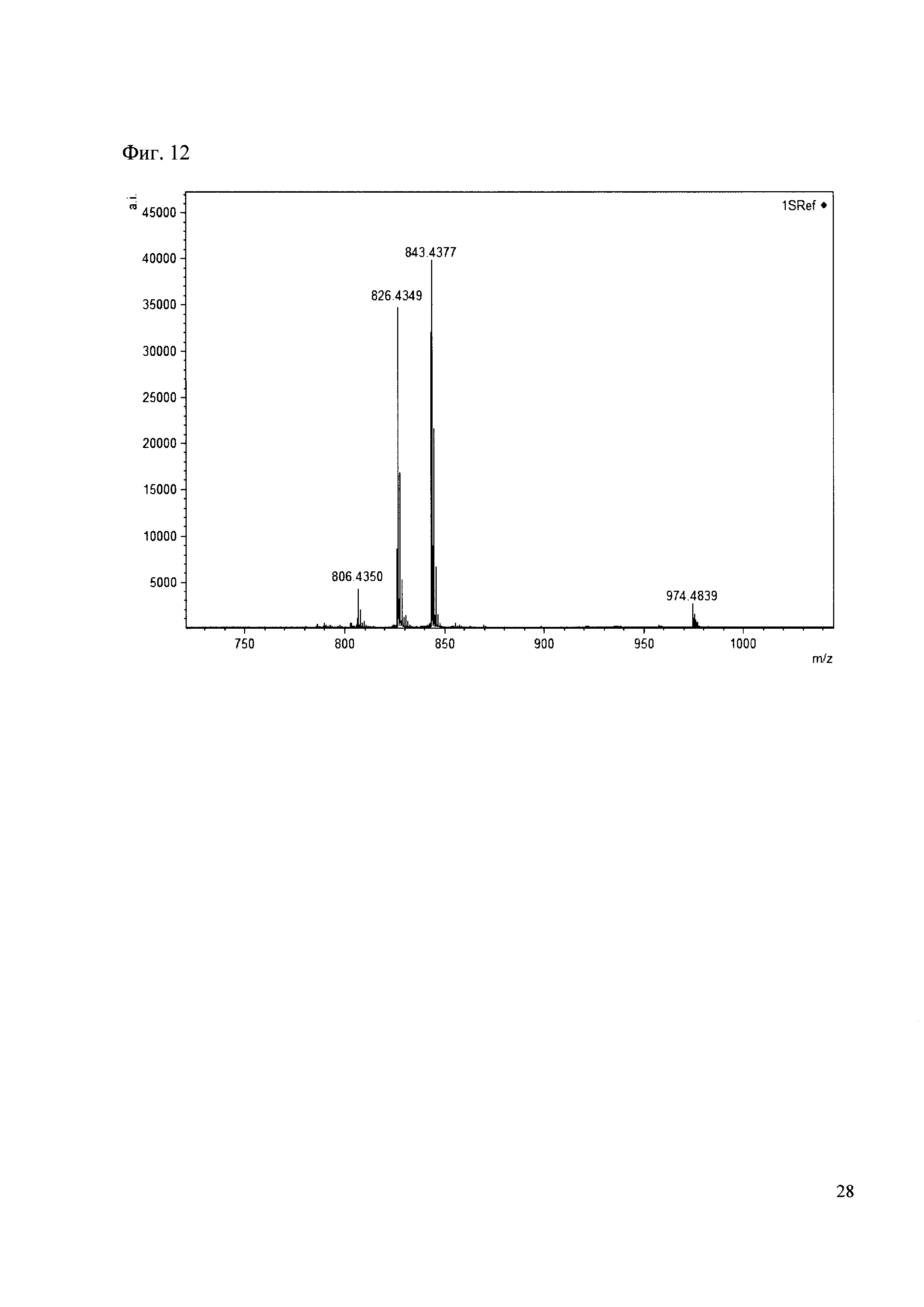
Пример 12
Смешивают по 10 мкл растворов антибиотиков 28, 29, 30, 31 и добавляют к ним 50 мкл раствора 1. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 12 MALDI-спектр в матрице CHCA)
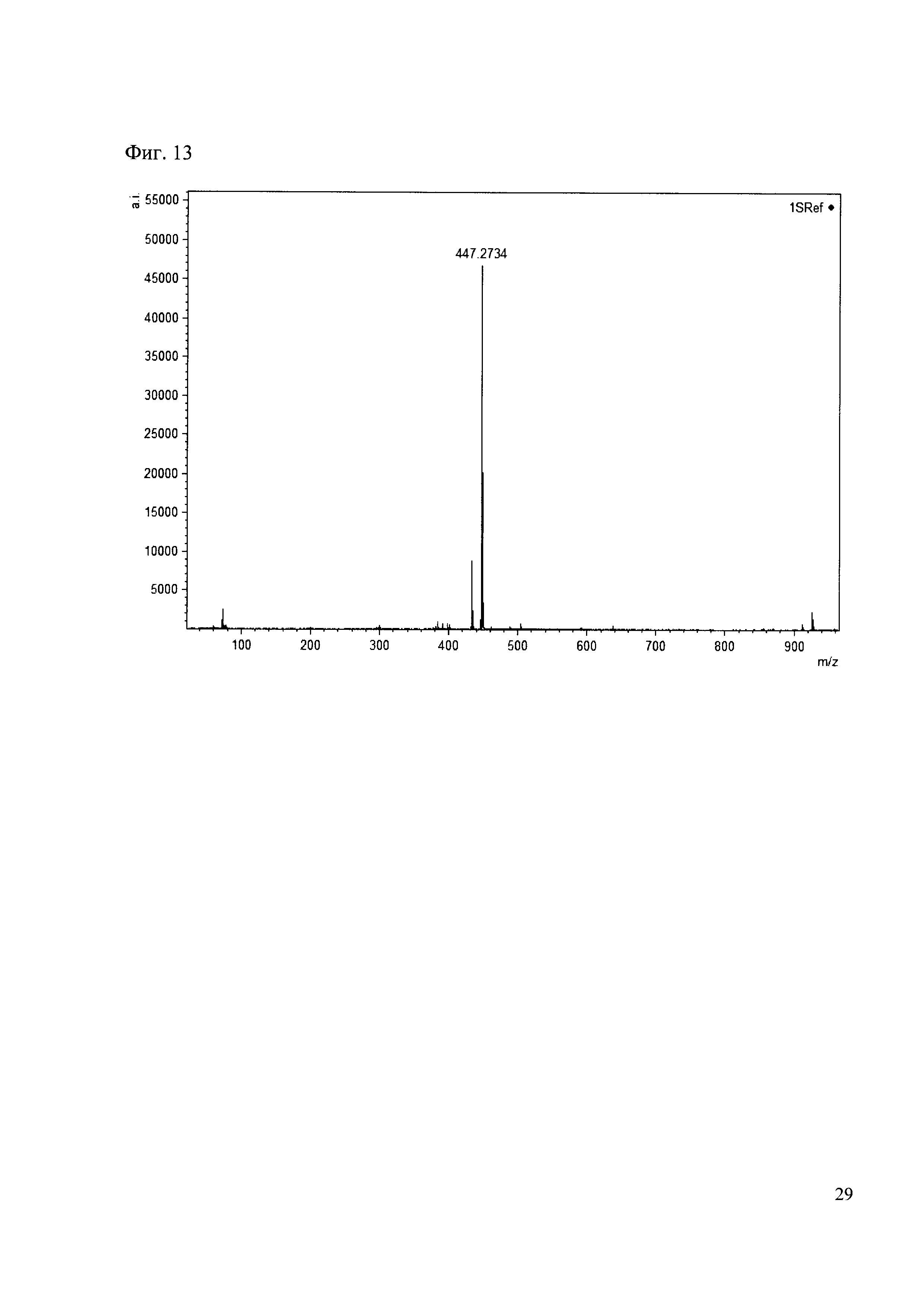
Пример 13
К 50 мкл раствора 1 добавляют 100 мкл ацетонитрила и 1 мг амина 4. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 13 MALDI-спектр в матрице CHCA)
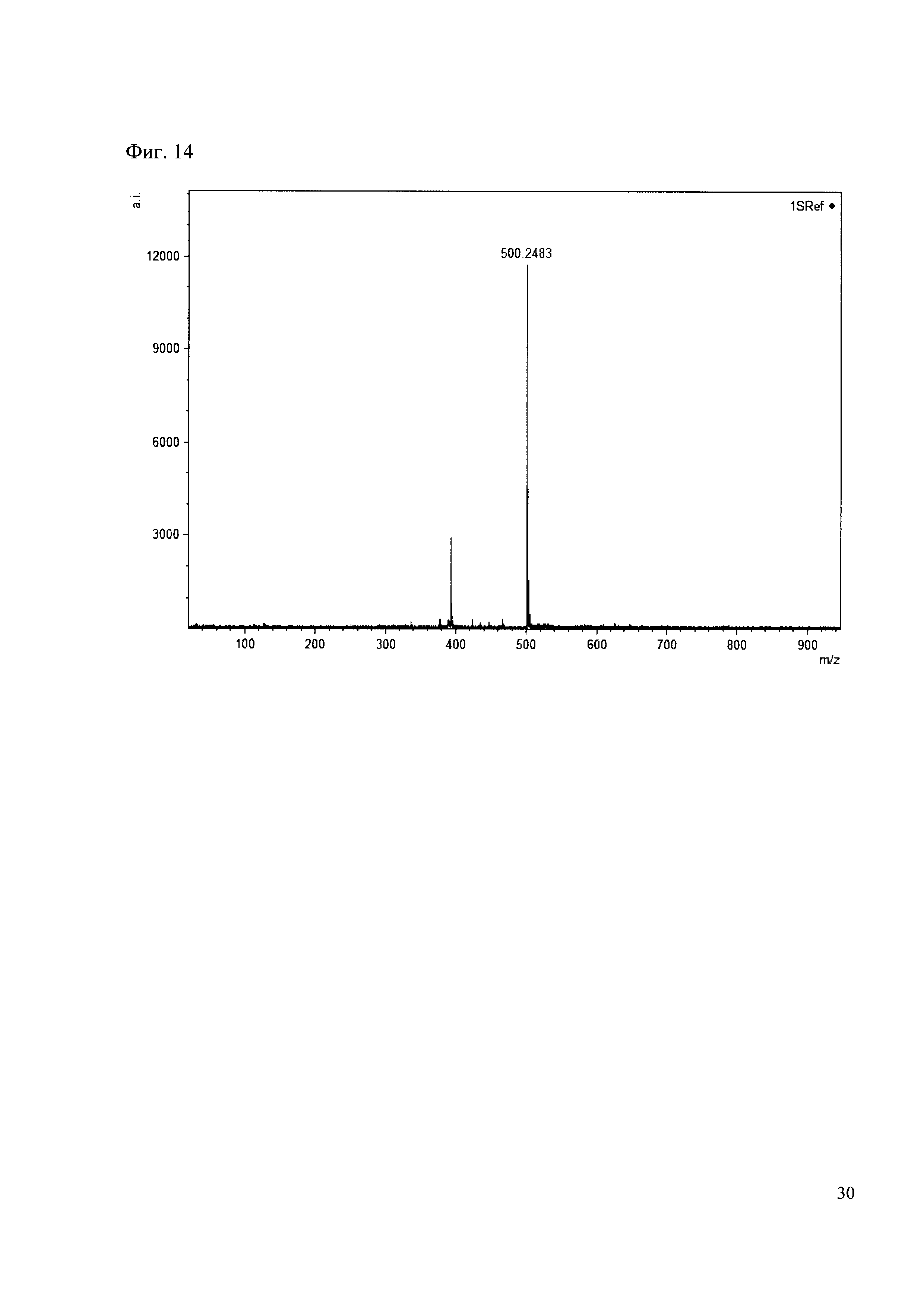
Пример 14
К 50 мкл раствора 1 добавляют 100 мкл ацетонитрила и 1 мг амина 5. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 14 MALDI-спектр в матрице CHCA)
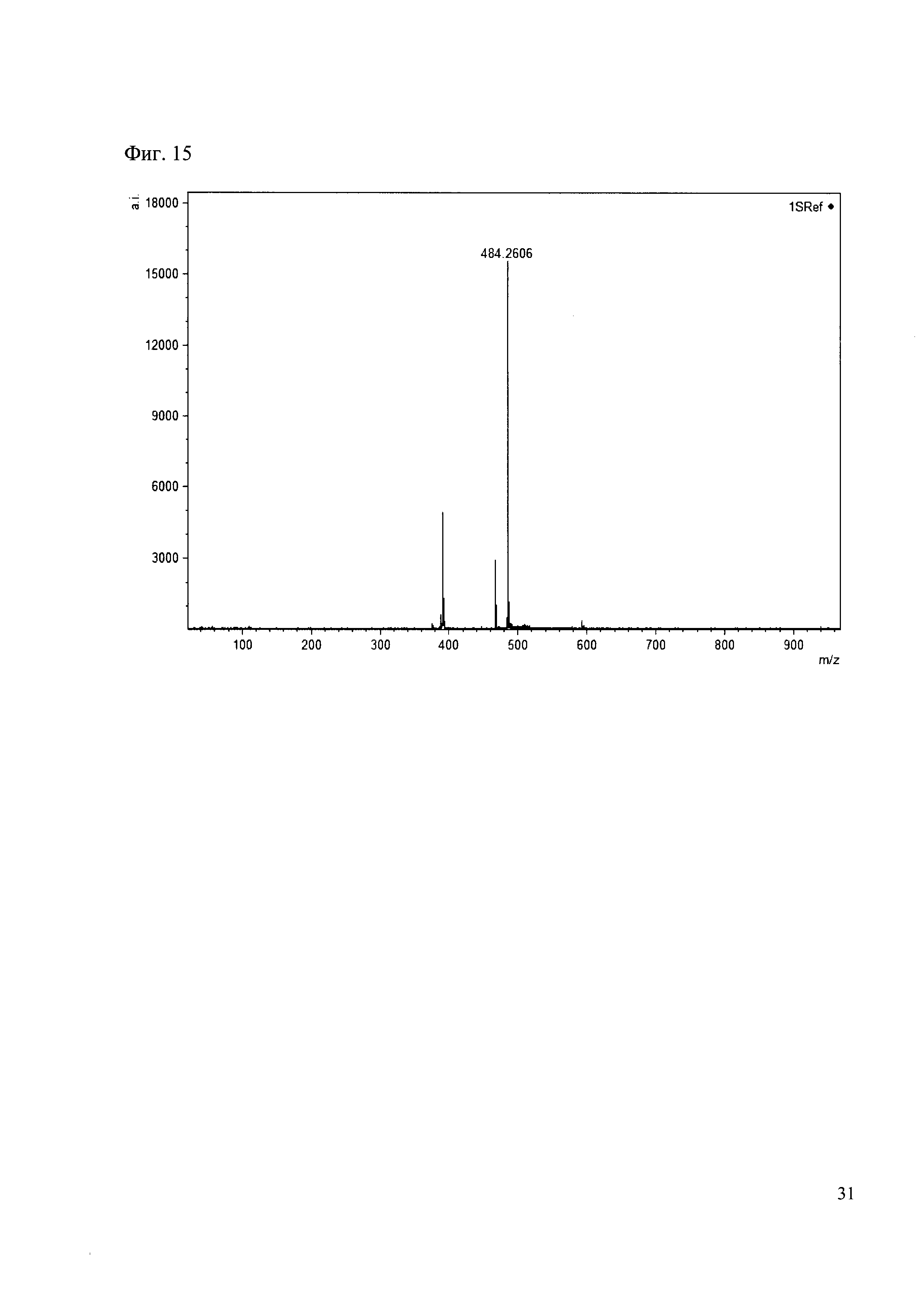
Пример 15
К 50 мкл раствора 1 добавляют 100 мкл ацетонитрила и 1 мг амина 6. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 15 MALDI-спектр в матрице CHCA)
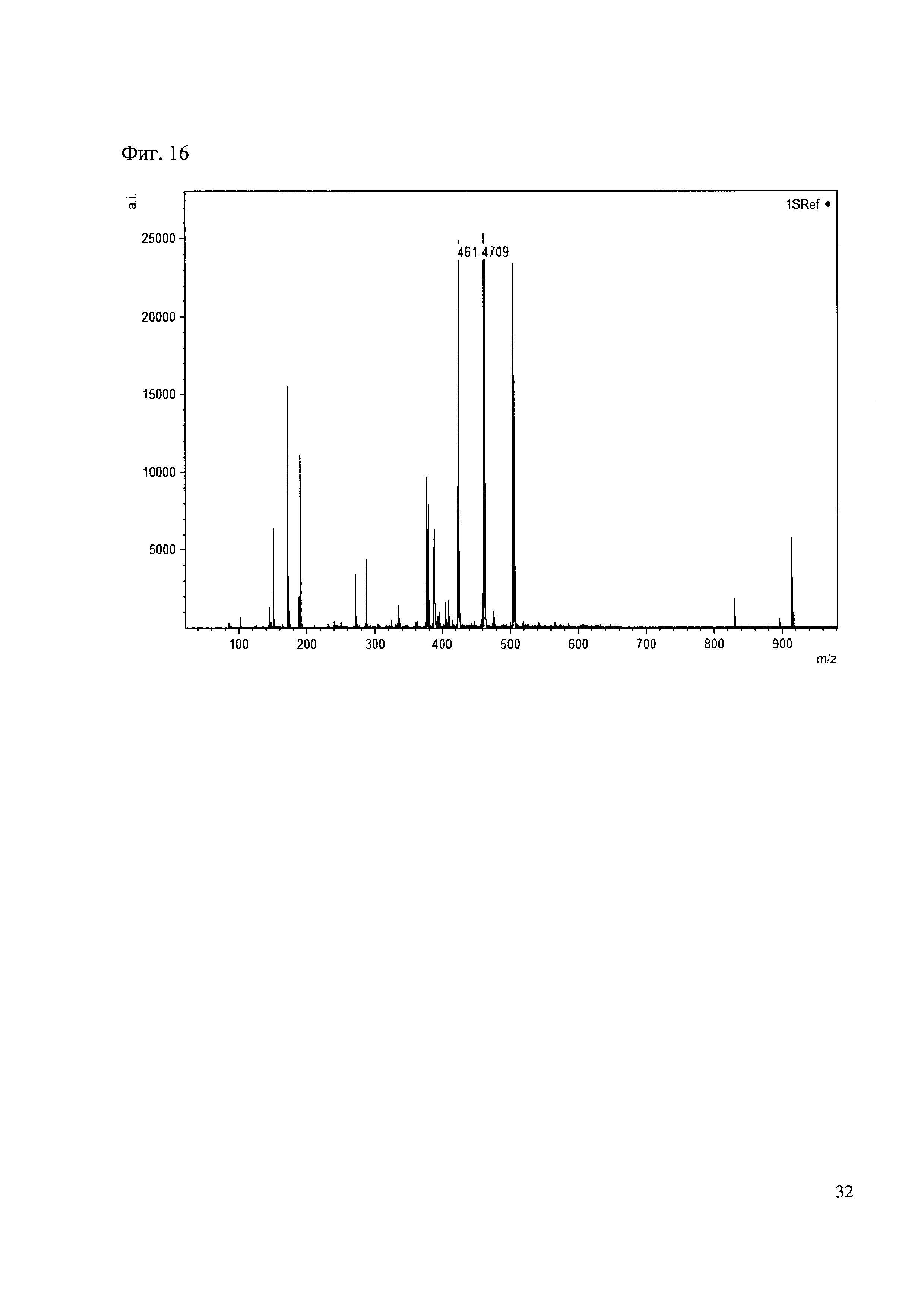
Пример 16
К 50 мкл раствора 1 добавляют 100 мкл ацетонитрила и 1 мг амина 7. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 16 MALDI-спектр в матрице CHCA)
Пример 17
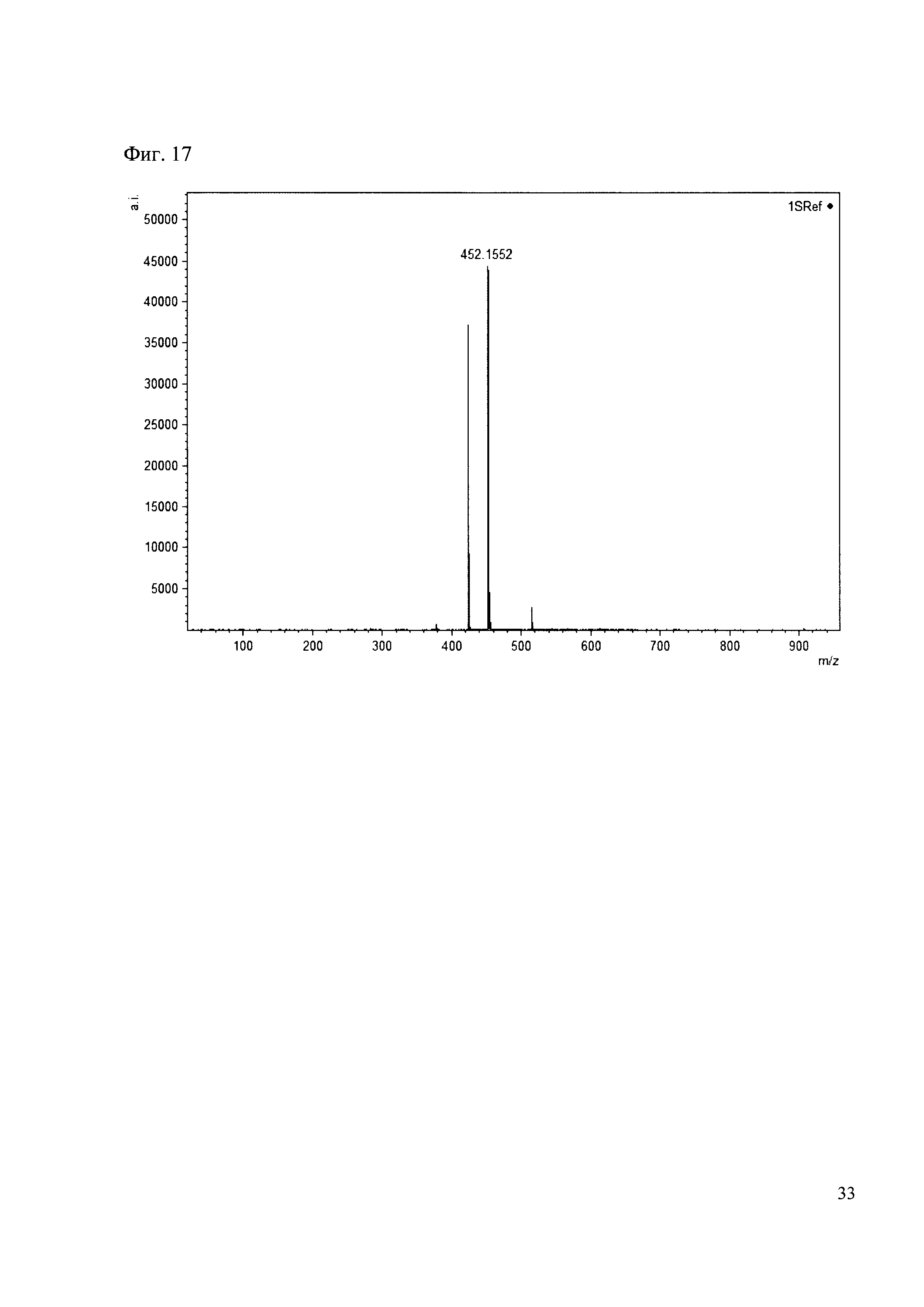
К 50 мкл раствора 1 добавляют 100 мкл ацетонитрила и 1 мг амина 8. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 17 MALDI-спектр в матрице CHCA)
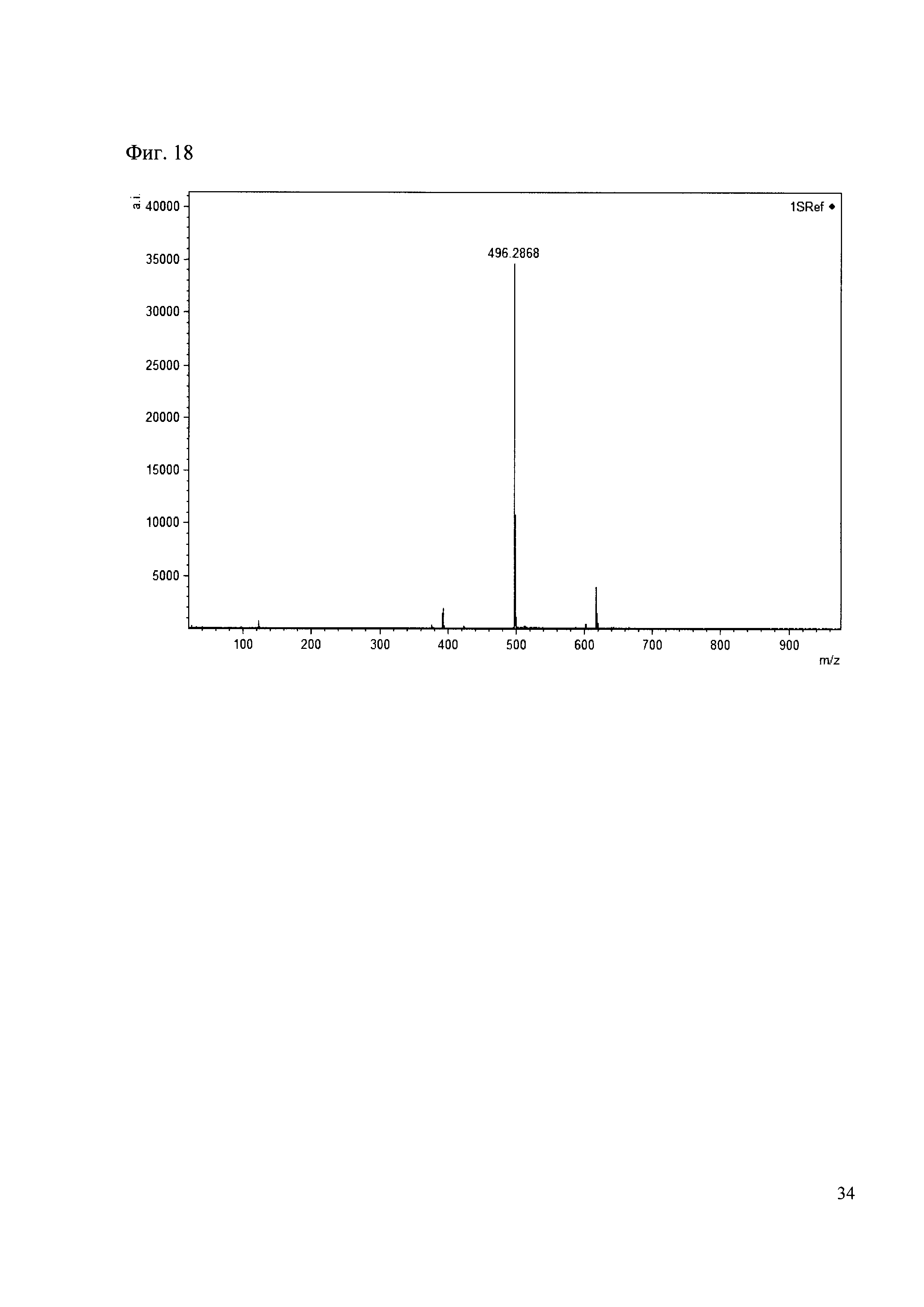
Пример 18
К 50 мкл раствора 1 добавляют 100 мкл ацетонитрила и 1 мг амина 9. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 18 MALDI-спектр в матрице CHCA)
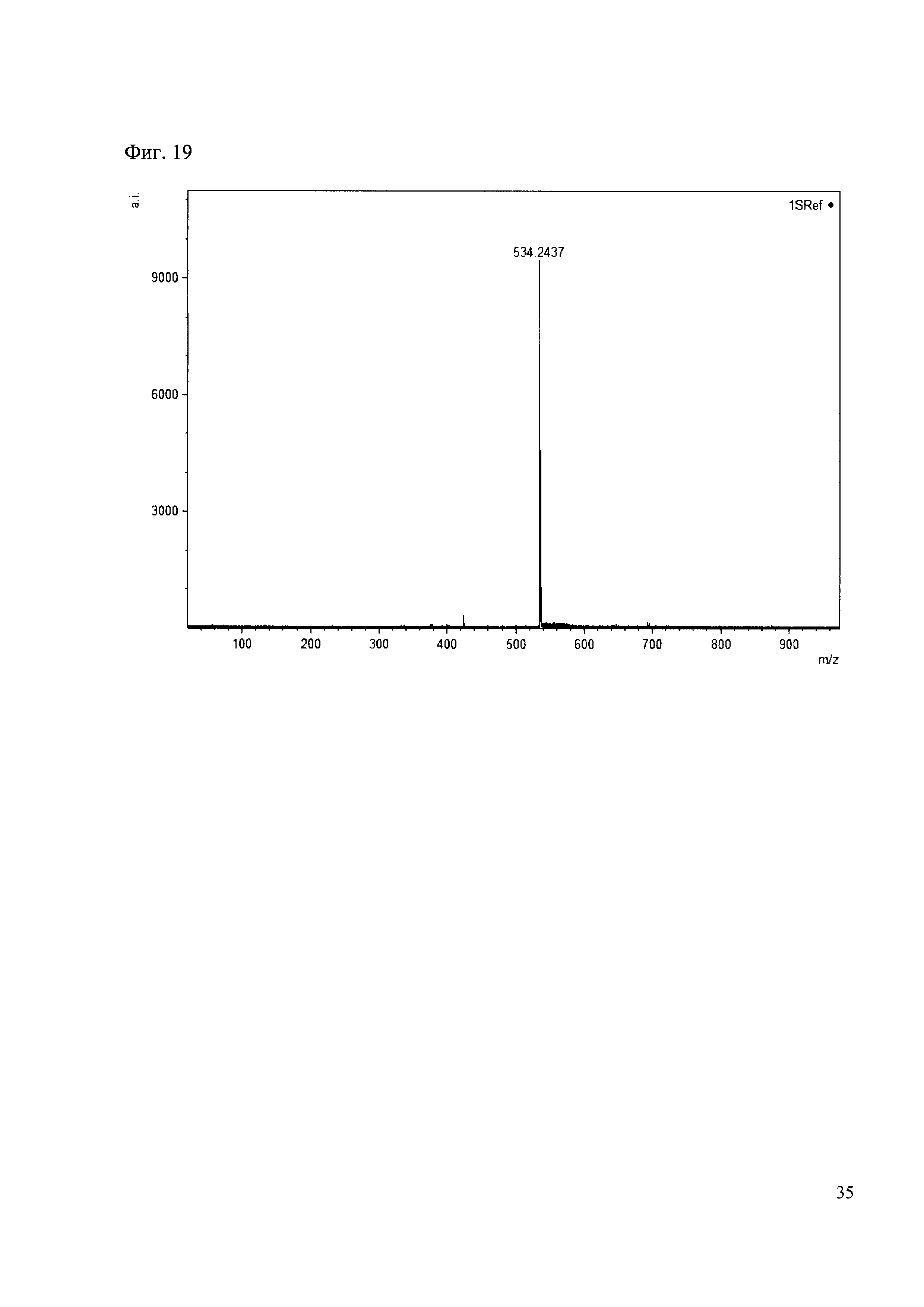
Пример 19
К 50 мкл раствора 1 добавляют 100 мкл ацетонитрила и 1 мг амина 10. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 19 MALDI-спектр в матрице CHCA)
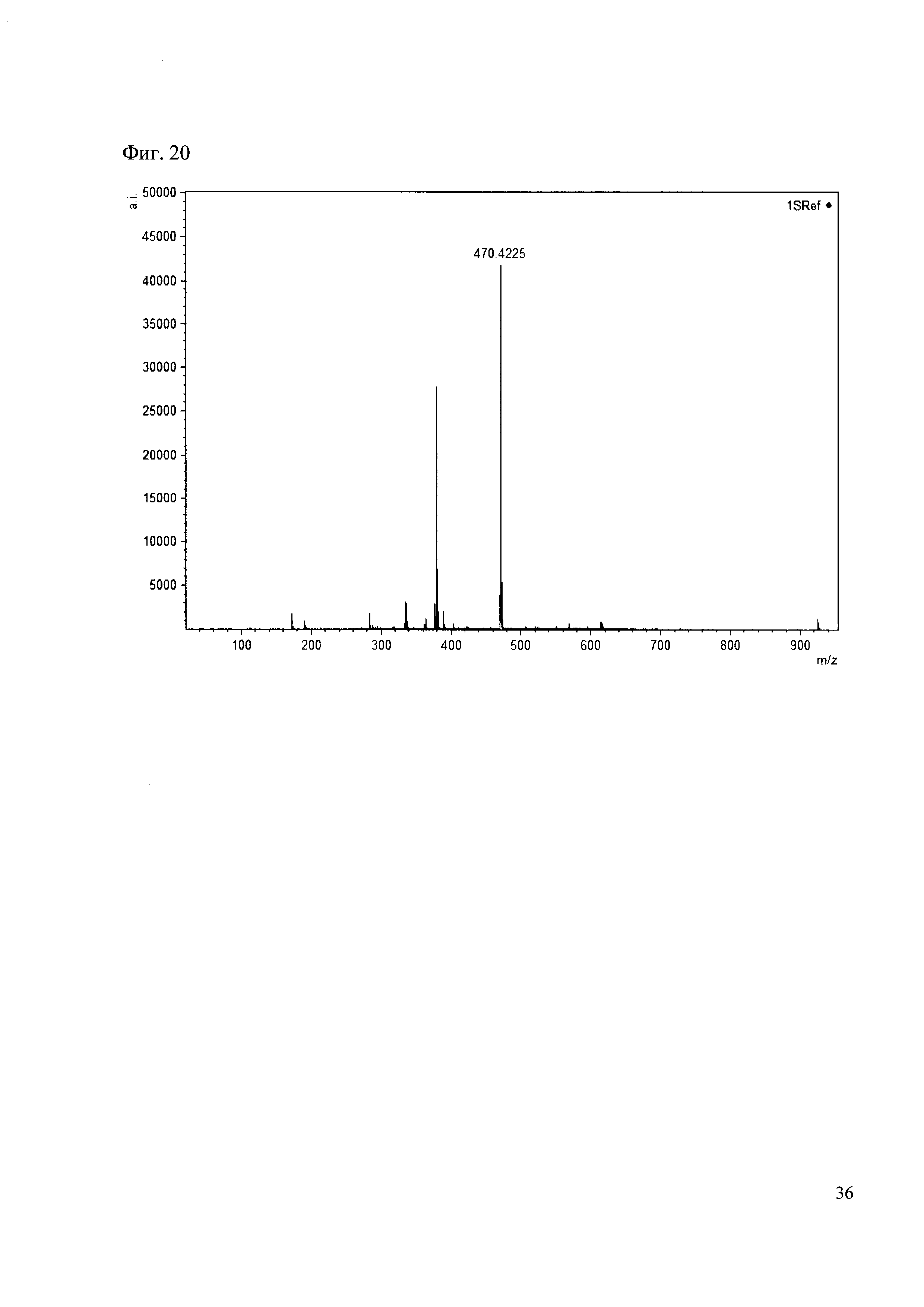
Пример 20
К 50 мкл раствора 1 добавляют 100 мкл ацетонитрила и 1 мг амина 11. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 20 MALDI-спектр в матрице CHCA)
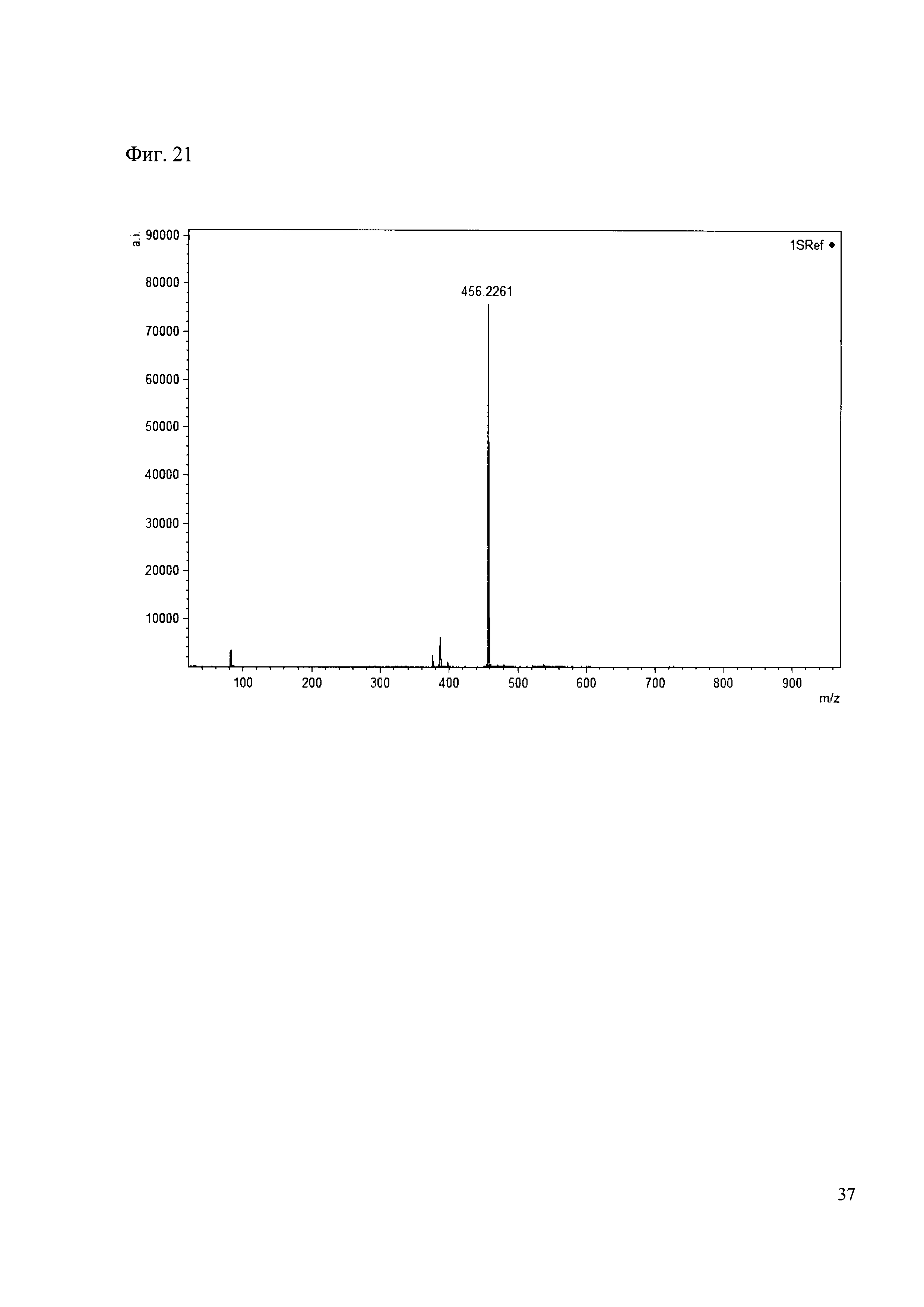
Пример 21
К 50 мкл раствора 1 добавляют 100 мкл ацетонитрила и 1 мг амина 12. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 21 MALDI-спектр в матрице CHCA)
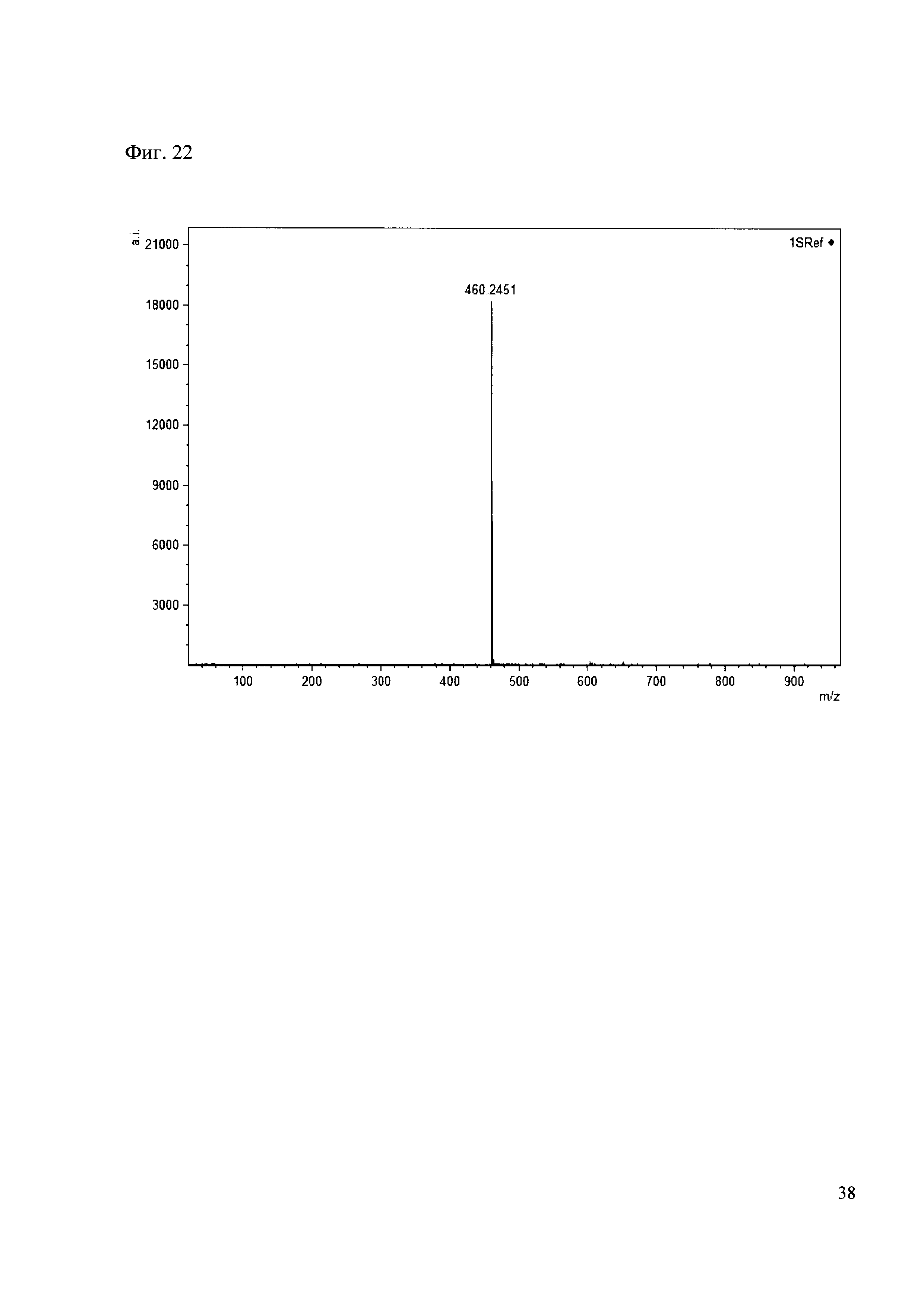
Пример 22
К 50 мкл раствора 1 добавляют 100 мкл ацетонитрила и 1 мг амина 13. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 22 MALDI-спектр в матрице CHCA)
Пример 23
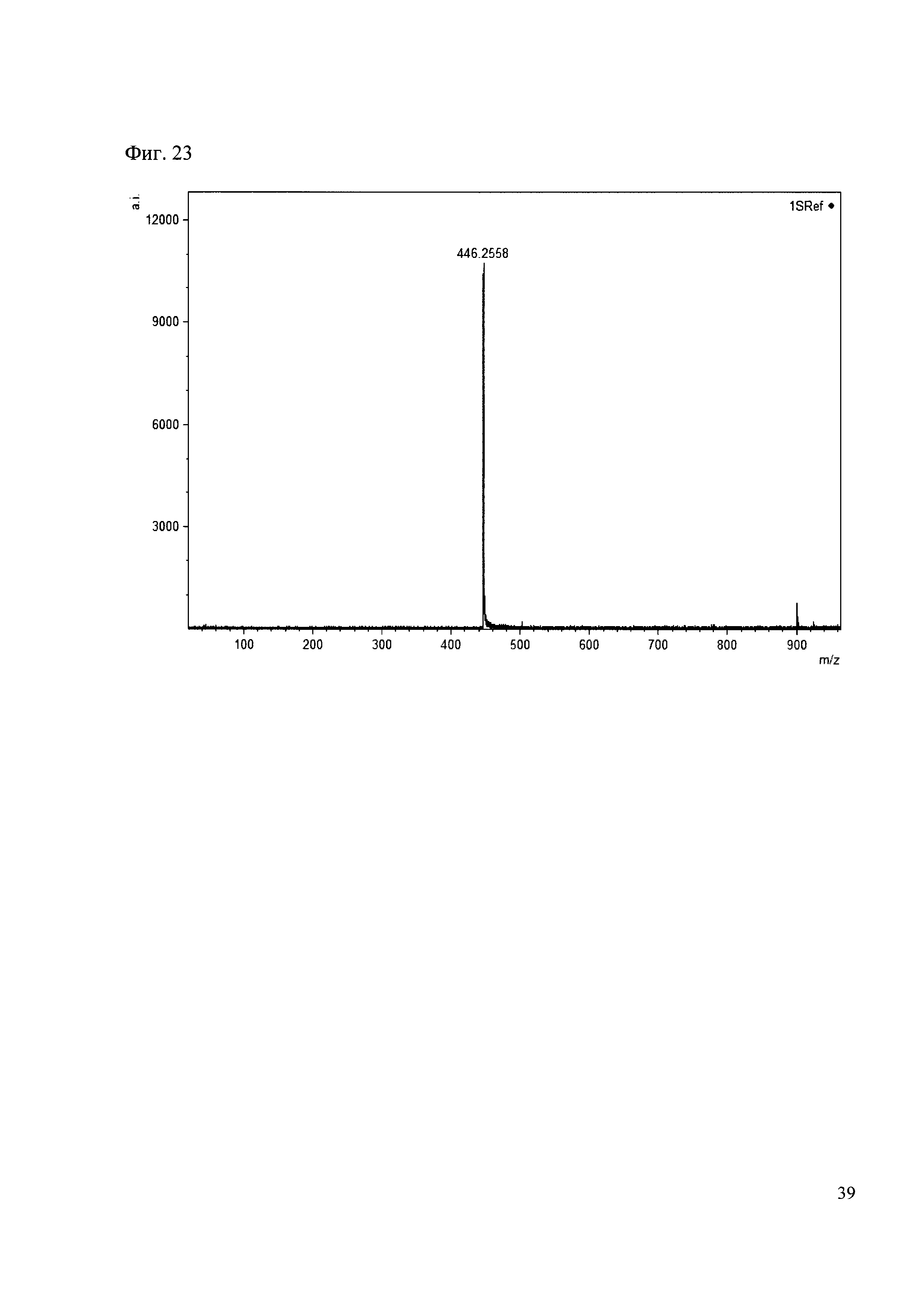
К 50 мкл раствора 1 добавляют 100 мкл ацетонитрила и 1 мг амина 14. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDL (Фиг. 23 MALDI-спектр в матрице CHCA)
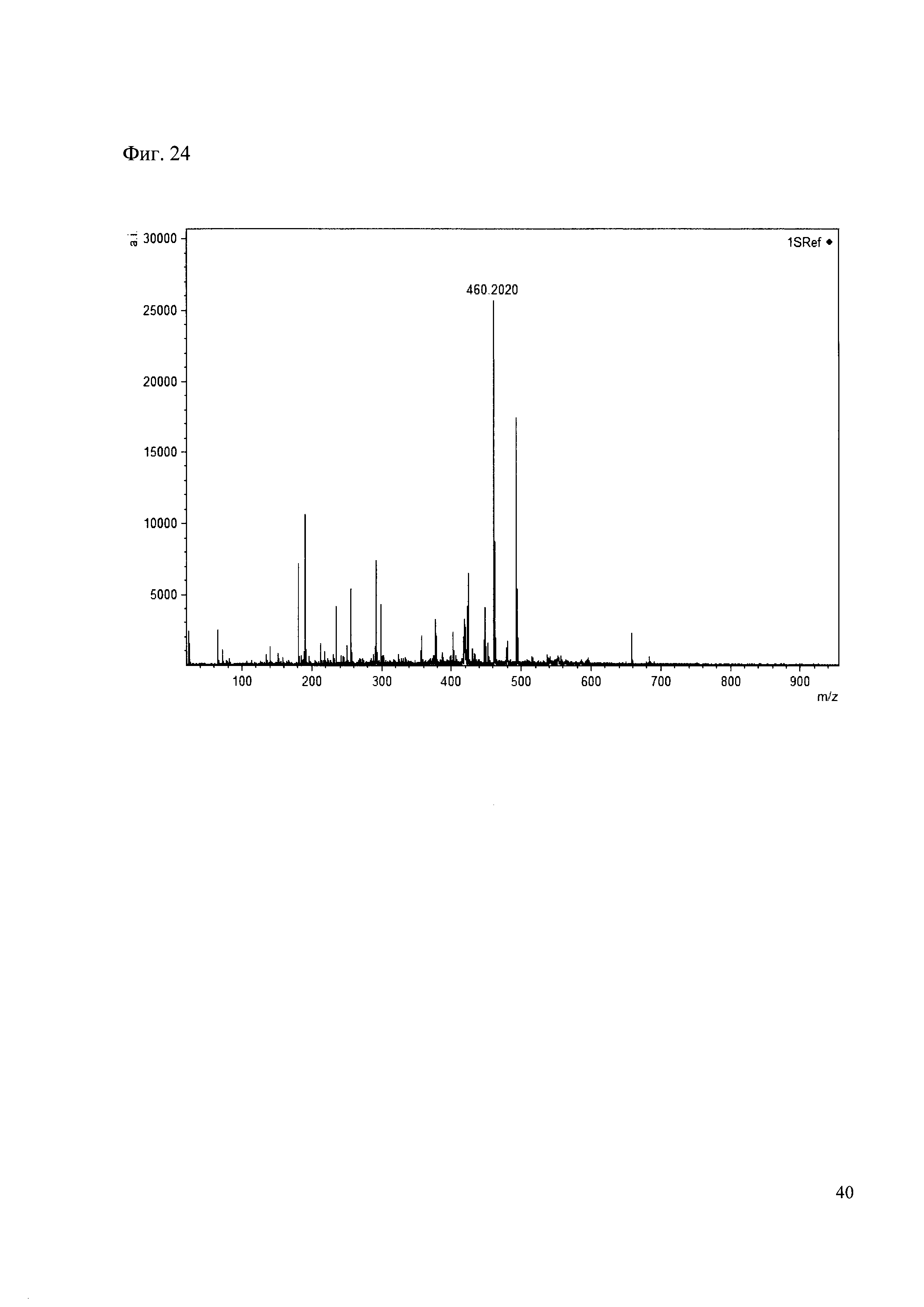
Пример 24
К 50 мкл раствора 1 добавляют 100 мкл ацетонитрила и 1 мг амина 15. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 24 MALDI-спектр в матрице CHCA)
Пример 25
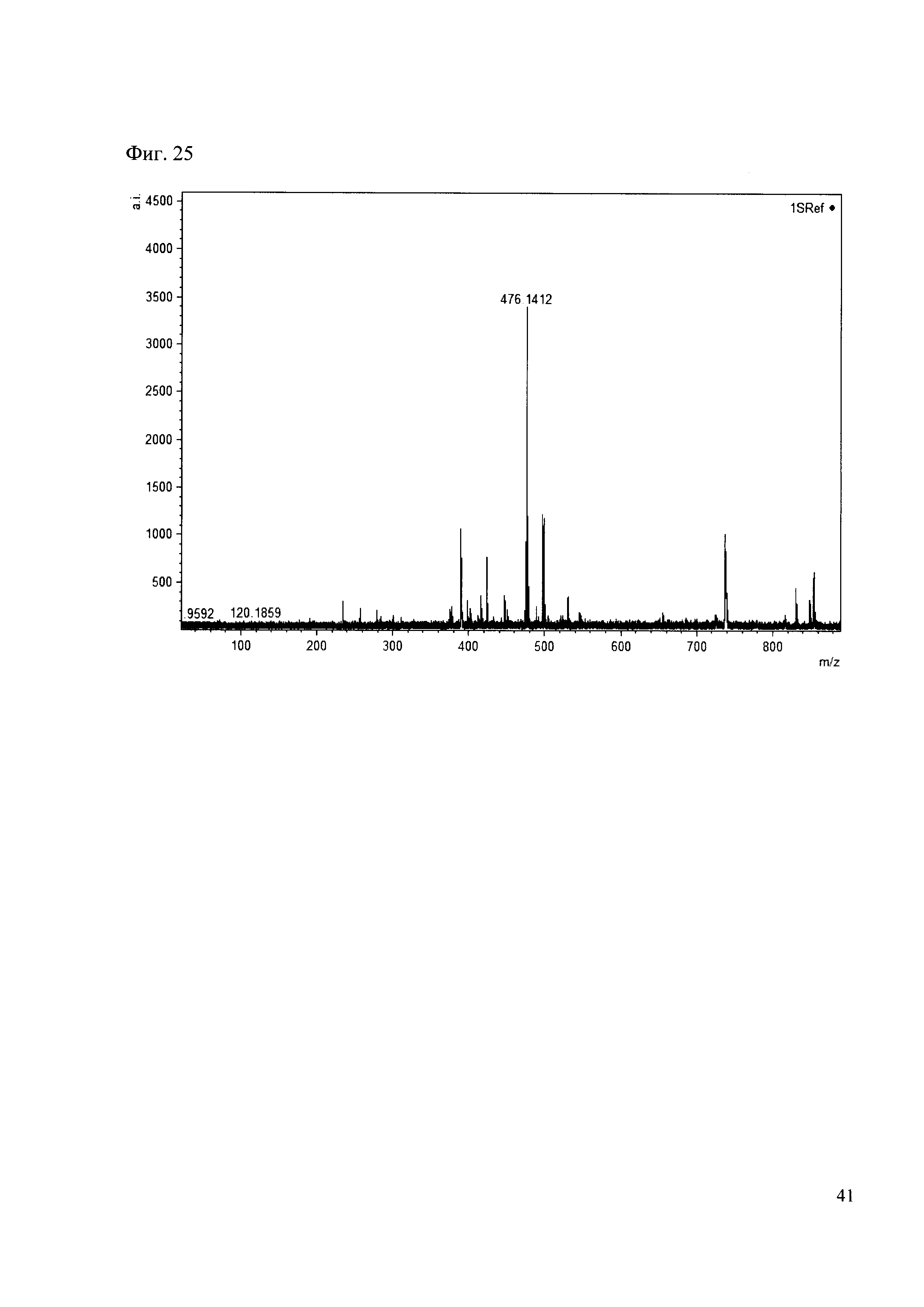
К 50 мкл раствора 1 добавляют 100 мкл ацетонитрила и 1 мг амина 16. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 25 MALDI-спектр в матрице CHCA)
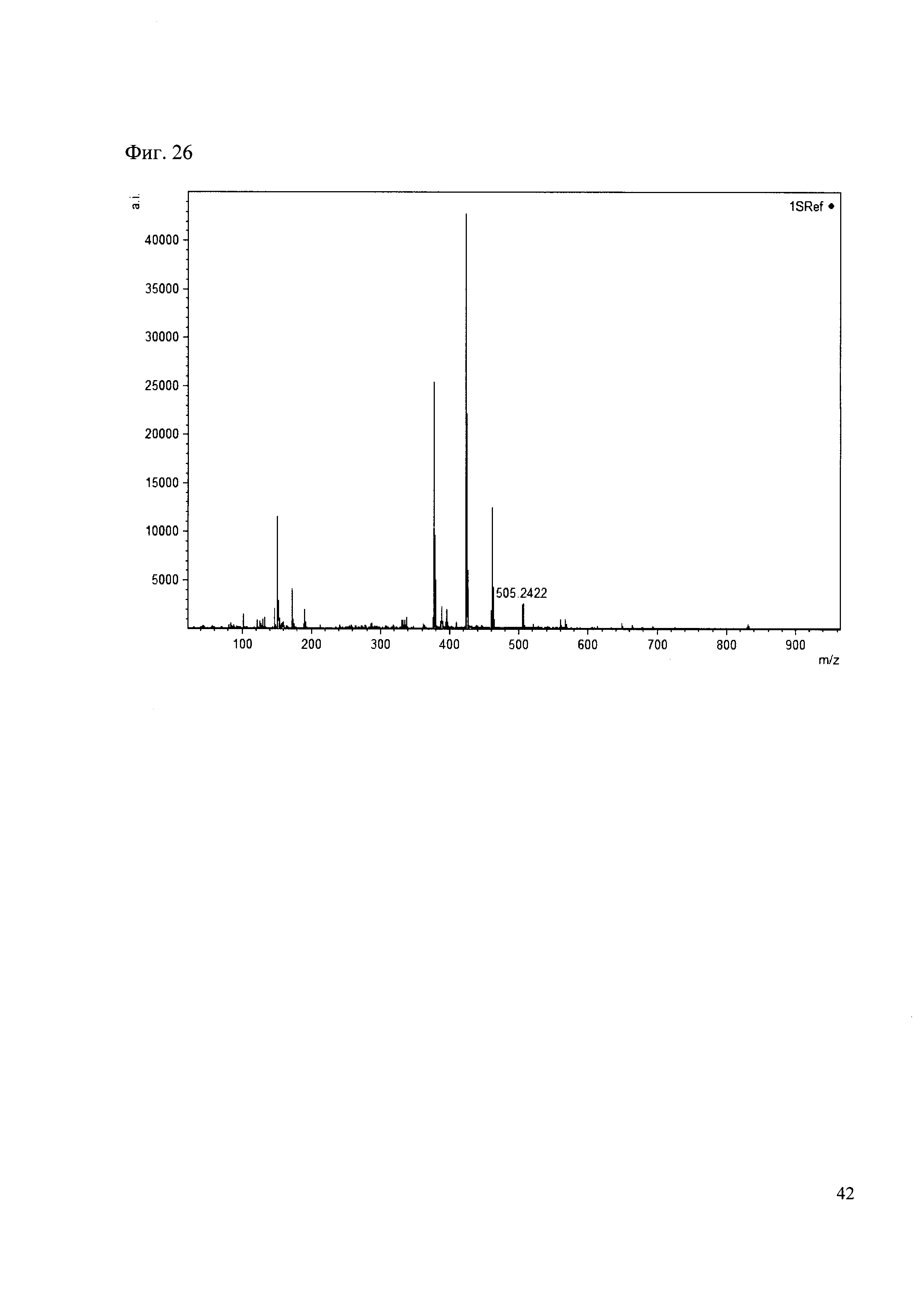
Пример 26
К 50 мкл раствора 1 добавляют 100 мкл ацетонитрила и 1 мг амина 17. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 26 MALDI-спектр в матрице CHCA)
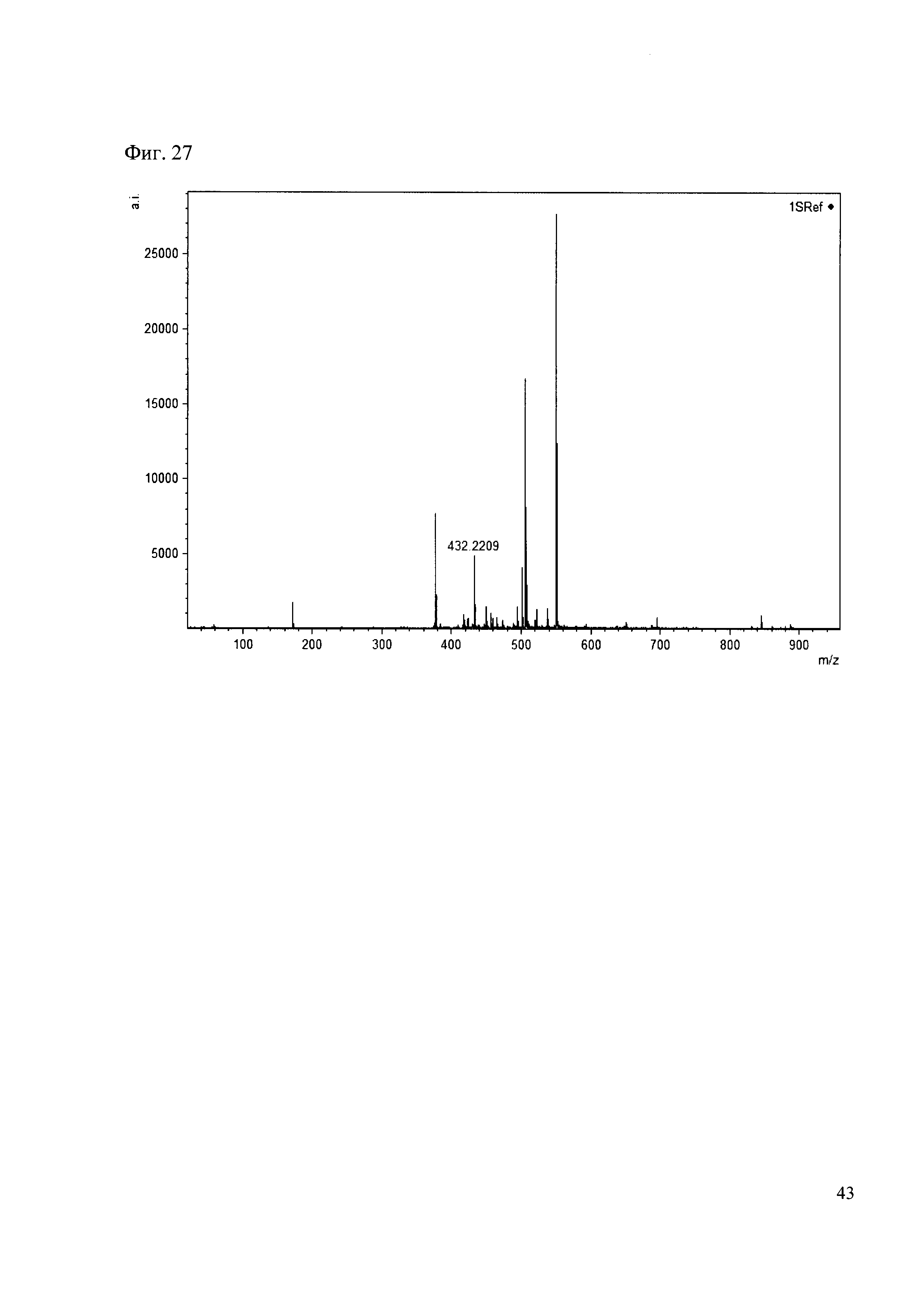
Пример 27
К 50 мкл раствора 1 добавляют 100 мкл ацетонитрила и 1 мг амина 18. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 27 MALDI-спектр в матрице CHCA)
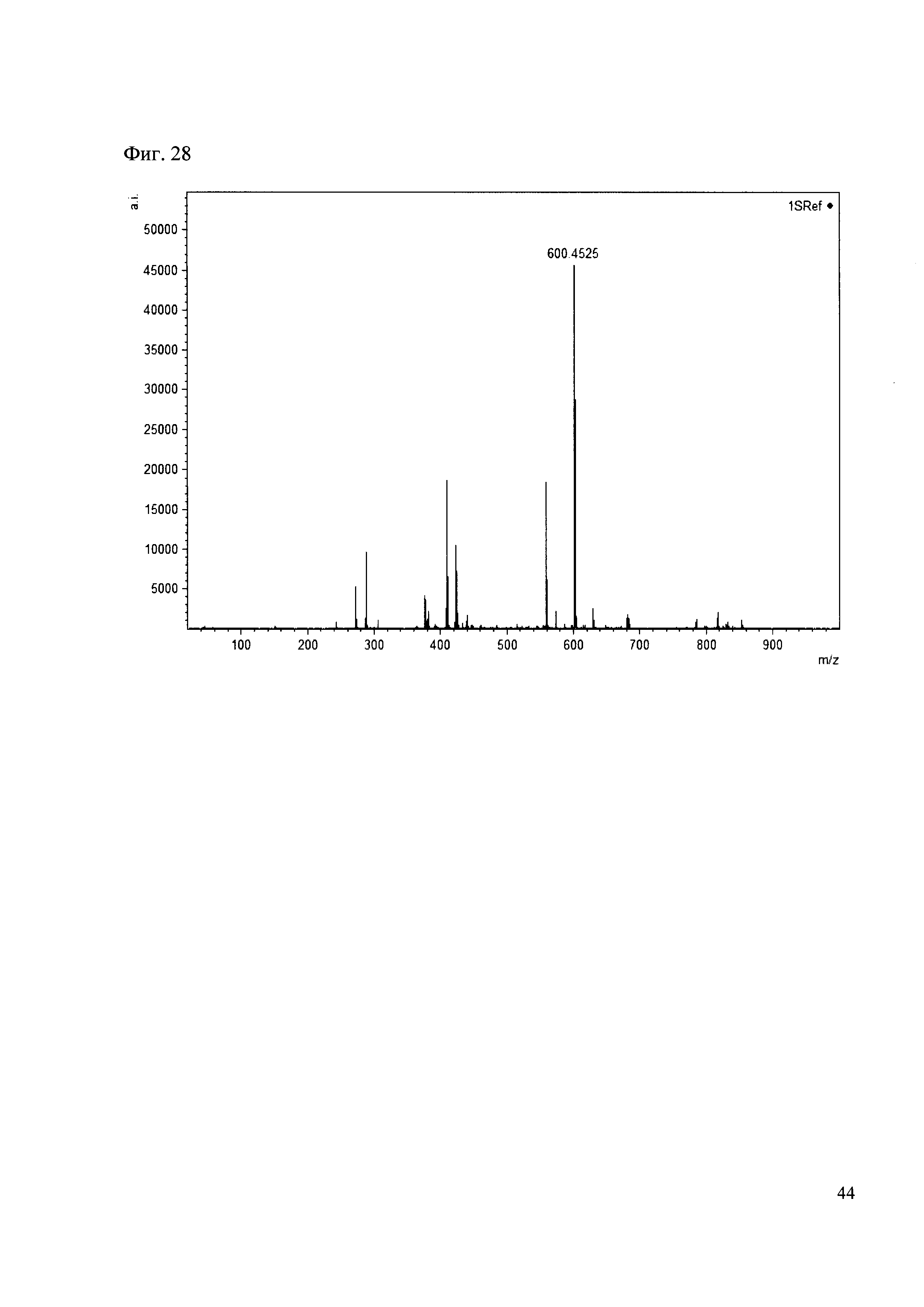
Пример 28
К 50 мкл раствора 1 добавляют 100 мкл ацетонитрила и 1 мг амина 19. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 28 MALDI-спектр в матрице CHCA)
Пример 29
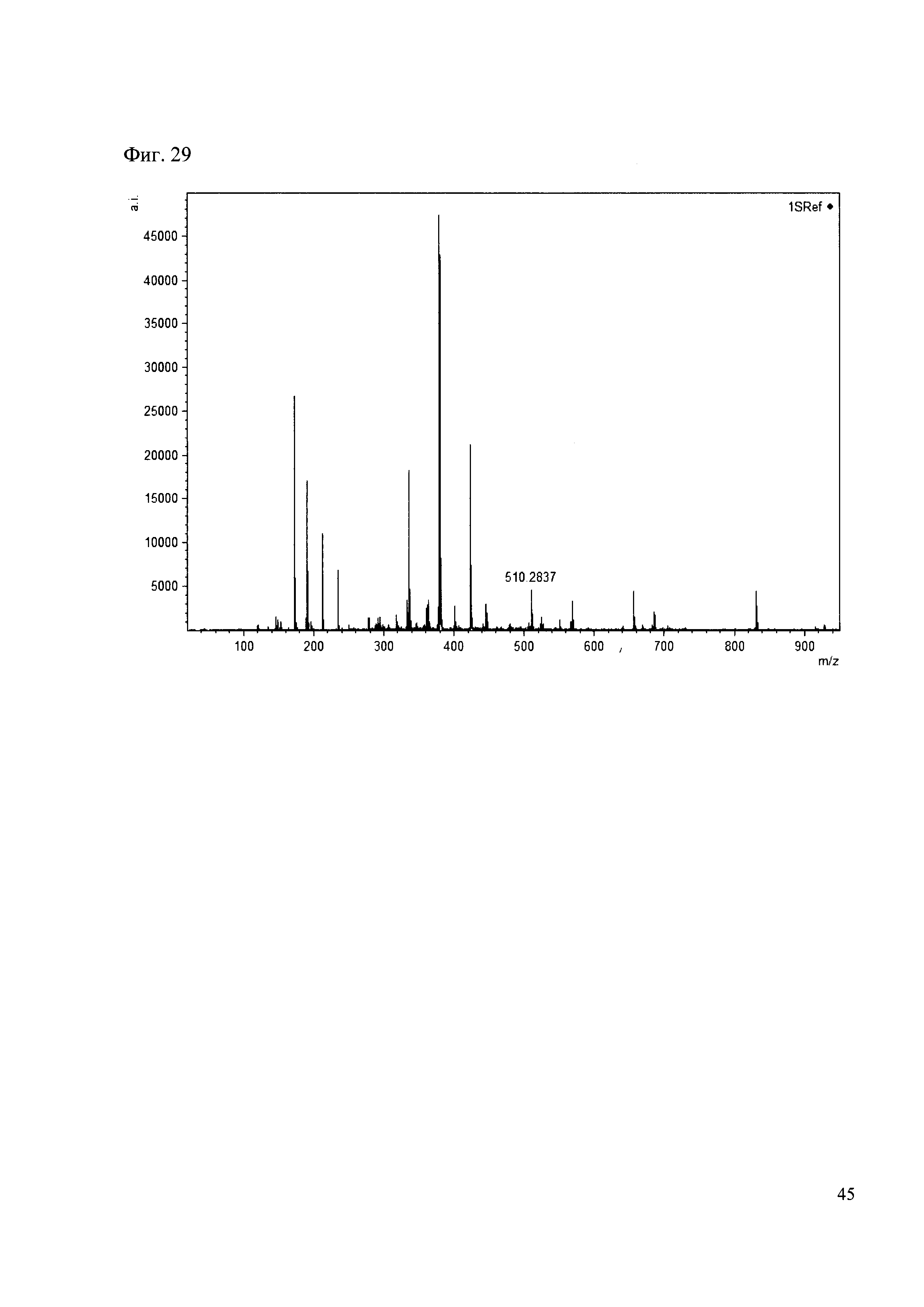
К 50 мкл раствора 1 добавляют 100 мкл ацетонитрила и 1 мг амина 20. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 29 MALDI-спектр в матрице CHCA)
Пример 30
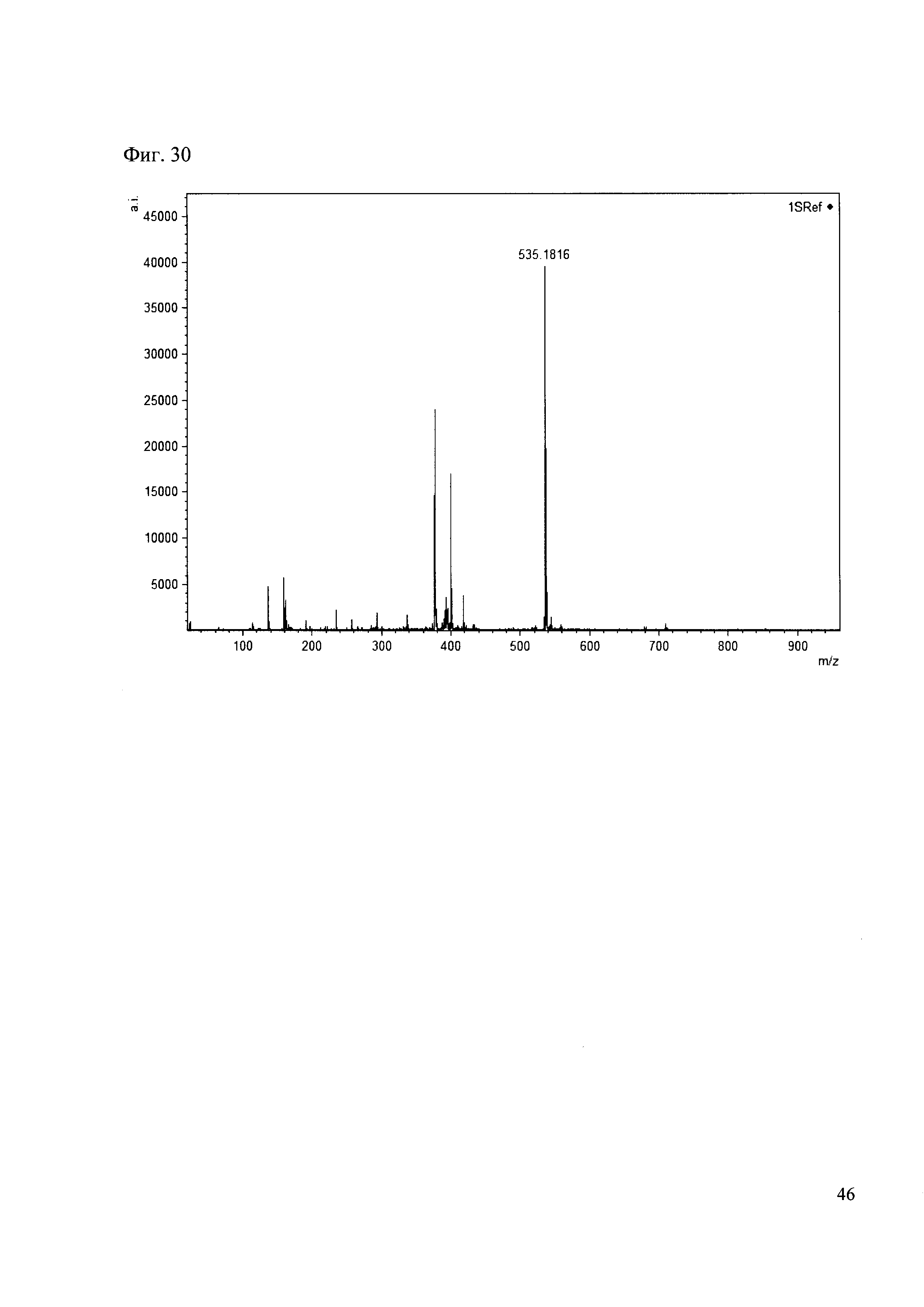
К 50 мкл раствора 1 добавляют 100 мкл ацетонитрила и 1 мг амина 21. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 30 MALDI-спектр в матрице CHCA)
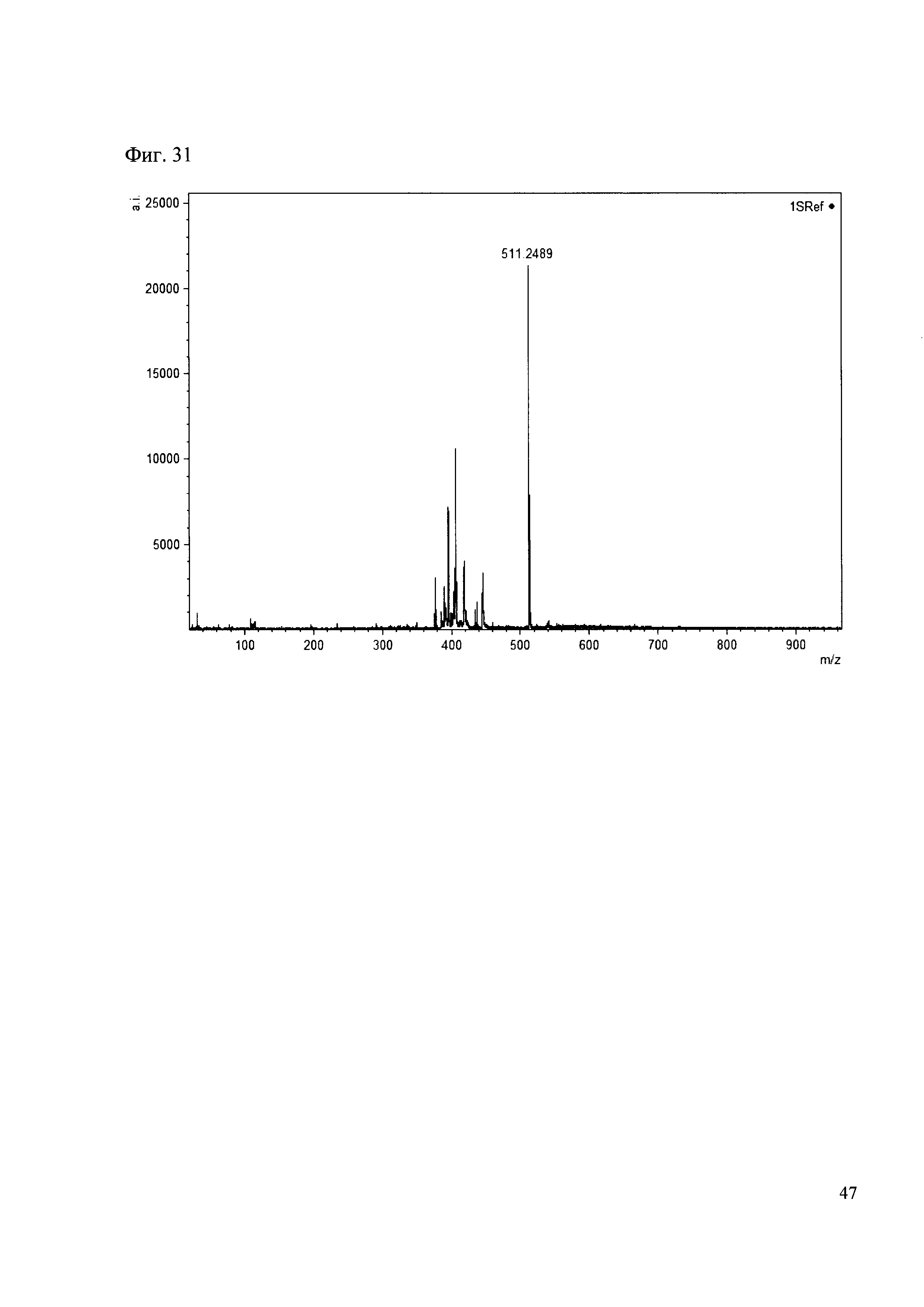
Пример 31
К 50 мкл раствора 1 добавляют 100 мкл ацетонитрила и 1 мг амина 22. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 31 MALDI-спектр в матрице CHCA)
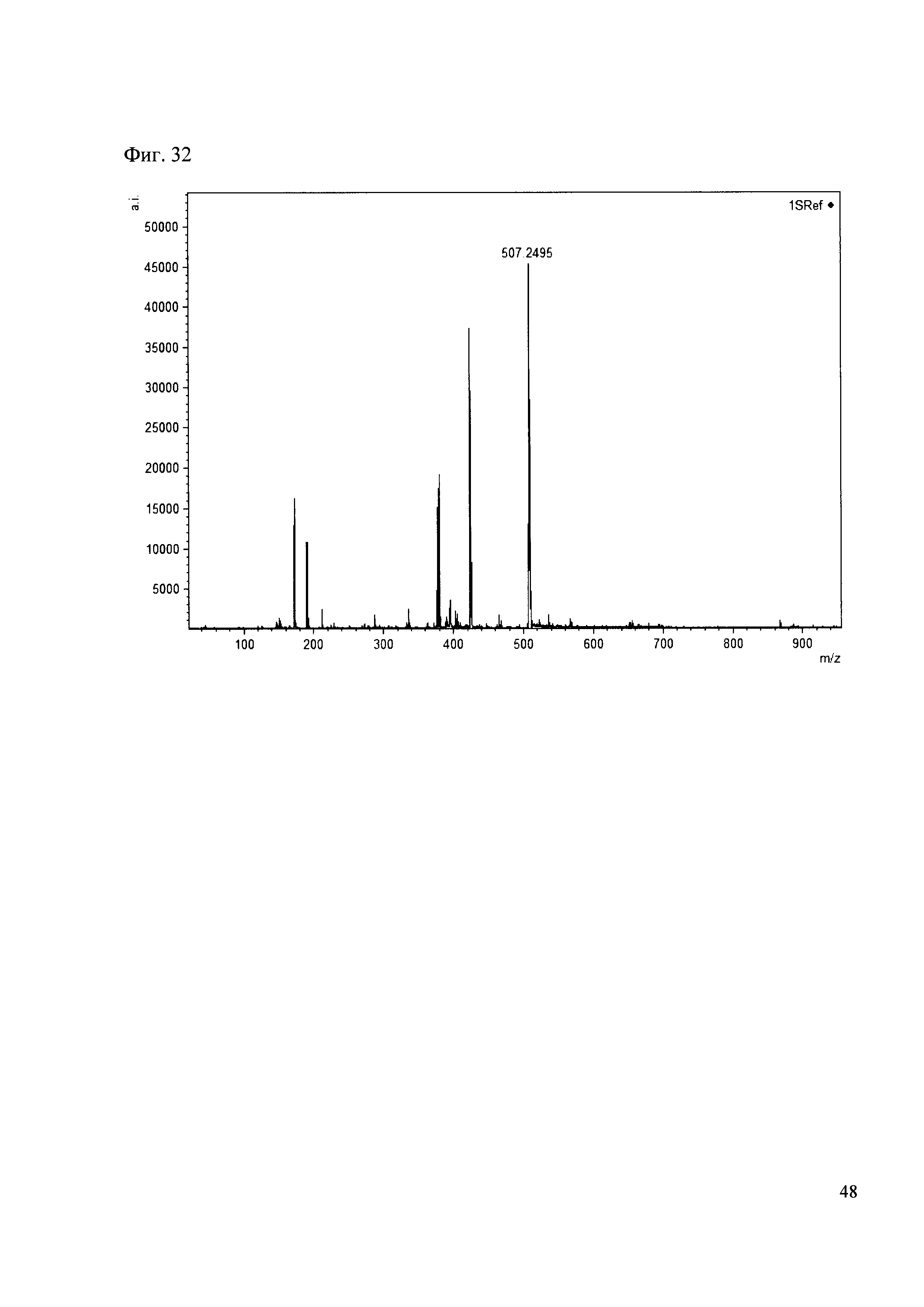
Пример 32
К 50 мкл раствора 1 добавляют 100 мкл ацетонитрила и 1 мг амина 23. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 32 MALDI-спектр в матрице CHCA)
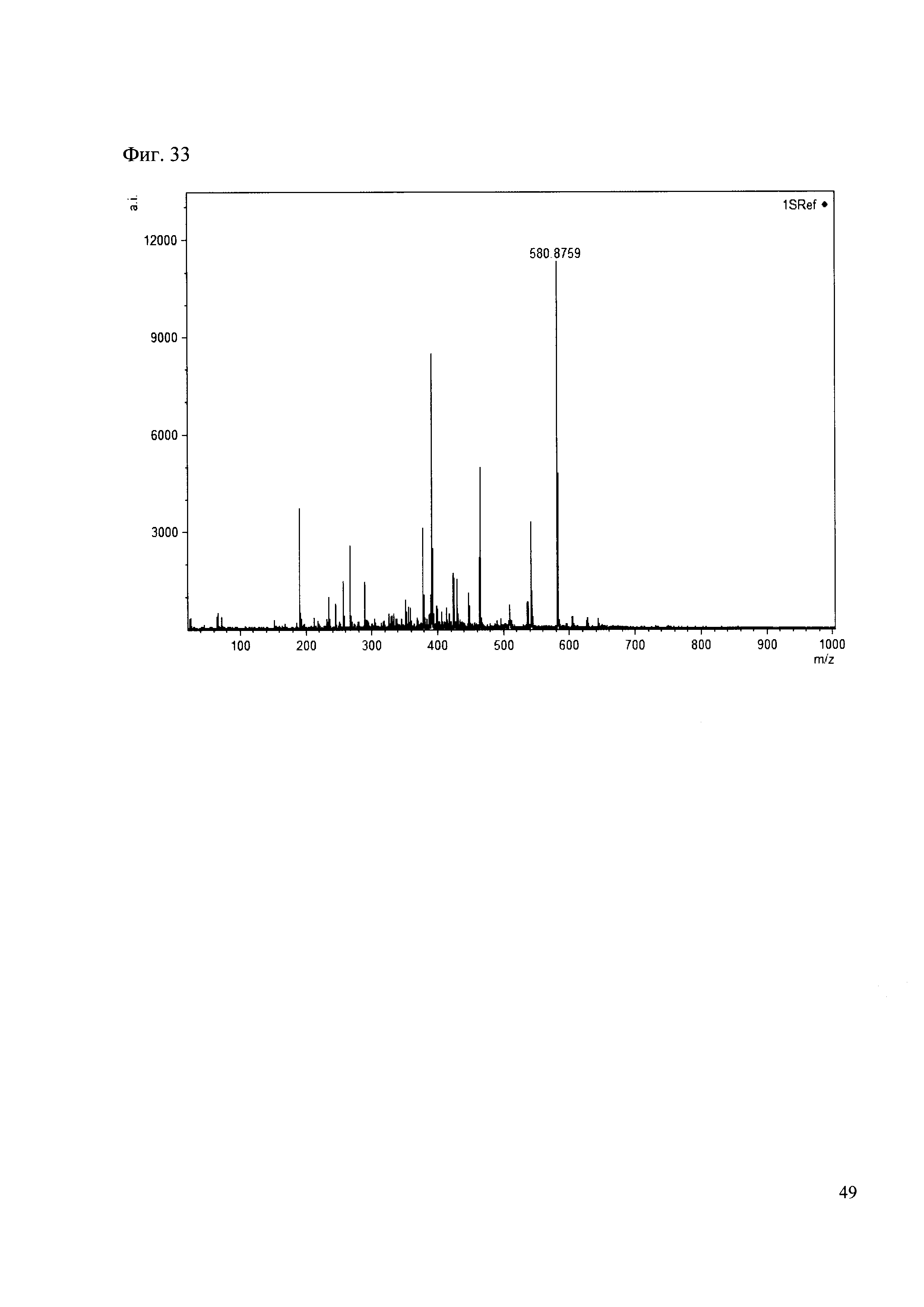
Пример 33
К 50 мкл раствора 1 добавляют 100 мкл ацетонитрила и 1 мг амина 25. Выдерживают 30 минут. Реакционную смесь анализируют методом MALDI. (Фиг. 33 MALDI-спектр в матрице CHCA)
Все реакции проводят при комнатной температуре, без использования инертной атмосферы. Масс-спектрометрическому анализу подвергались непосредственно реакционные смеси без предварительной обработки. В процессе проведения масс-спектрометрического анализа варьировалась матрицы (CHCA, 2,4,6-THAP и sinapic acid) и интенсивность лазера.
Краткое описание чертежей и фигур
Данный способ может быть проиллюстрирован следующими примерами: