Результат интеллектуальной деятельности: КАРБАМИЛИРОВАННЫЙ ДАРБЭПОЭТИН 9С-DEPO, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ЕГО В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО СРЕДСТВА С ЦИТОПРОТЕКТОРНЫМ ДЕЙСТВИЕМ
Вид РИД
Изобретение
Изобретение относится к области создания лекарственных средств с цитопротекторным действием, в частности - карбамилированного дарбэпоэтина, полученного путем карбамилирования всех аминокислотных остатков лизина, входящего в молекулу дарбэпоэтина, а также карбамилированный аминокислотный остаток аланина в N-концевой области этого белка - 9C-DEPO, представляющего собой гипергликозилированное производное рекомбинантного эритропоэтина человека.
Это соединение предназначено для использования в качестве активного компонента при изготовлении лекарственных средств для лечения или предупреждения состояния, ассоциированного с повреждением ткани вследствие некроза (непосредственном повреждением и гибели клеток), апоптоза (програмируеммой клеточной смерти) и воспалением, в частности для нейрозащиты, например лечения острого (например, инсульта) и хронического заболевания (например, амиотрофического бокового склероза) нервной системы.
Ишемический инсульт - острое нарушение мозгового кровообращения, сопровождающееся повреждением ткани мозга, является проблемой чрезвычайной медицинской и социальной значимости, влияние которой на уровень здоровья и жизни населения всего мира, по данным аналитических исследований, проведенных ВОЗ, будет последовательно нарастать (http://www.who.int/mediacentre/factsheets/fs310/ru/).
Специфическая лекарственная терапия при ишемическом инсульте проводится по двум стратегическим направлениям: реперфузия и нейрональная протекция.
Реперфузия направлена на восстановление или усиление кровотока по сосудам в области повреждения.
Нейрональная протекция направлена на предотвращение гибели слабо или почти не функционирующих, но все еще жизнеспособных нейронов, располагающихся вокруг очага инфаркта (зона «ишемической полутени»).
Гибель клеток в области «ишемической полутени» происходит по механизмам некроза и апоптоза (часть клеток гибнет в результате програмирруемой клеточной смерти в условиях недостатка кислорода - апоптоза, остальная вследствие некроза - непосредственного омертвления клеток вследствие их повреждения) и приводит к увеличению размеров инфаркта. Однако эти клетки в течение определенного времени могут сохранять свою жизнеспособность и выполнять свои функции, их гибель можно предотвратить при восстановлении кровотока в зоне «ишемической полутени» в течение 3-6 ч (Lapchak, 2010).
Гликопротеидный гормон - эритропоэтин (ЭПО), продуцируемый первично клетками капилляров почечных клубочков, хорошо охарактеризован и получил широкую известность как гормон гемопоэза (кроветворения), однако его биологическая роль этим не ограничивается. Рецепторы эритропоэтина экспрессируется не только в клетках кроветворных тканей, но и в таких тканях, как мозг. Известно, что также они есть на поверхности нейронов (Sanchis-Gomar, et al., 2013).
Продемонстрировано in vitro и in vivo, что ЭПО является сильным ингибитором нейронного апоптоза, индуцируемого ишемией и кислородной недостаточностью (Bernaudin, et al., 1999; Morishita, et al., 1997; Ruscher, et al., 2002). Добавление ЭПО к нейронным культурам защищает их против недостатка кислорода и токсичности глутаминовой кислоты (Henn and Braus, 1999; Vogeley, et al., 2001) и уменьшает неврологическую дисфункцию в моделях инсульта грызунов (Bernaudin, et al., 1999; Brines, et al., 2000).
Механизм действия эритропоэтина хорошо изучен (Livnah, et al., 1998; Middleton, et al., 1999). При связывании молекулы ЭПО с рецептором EpoR запускается каскад реакций фосфорилирования ключевых белков, таких как Ras-митогенактивирующая протеинкиназа, янусовая тирозинкиназа-2 и др. (набор протеинкиназ может изменяться, в зависимости от типа ткани), которые, в свою очередь, активируют экспрессию генов семейства bcl-xL и синтез антиапоптозных белков, подавляющих апоптотическую гибель клеток.
Природным стимулом, активирующим продукцию эритропоэтина как в кроветворных, так и некроветворных тканях является кислородная недостаточность. Таким образом, эритропоэтин способствует сохранению жизнеспособности клеток в условиях недостатка кислорода. Именно недостаток кислорода является причиной гибели нейронов при ишемических инсультах.
Кроветворная активность эритропоэтина вызывает побочный нежелательный эффект - повышение артериального давления и риск образования тромбов, что, в случае ишемического инсульта, категорически противопоказано, даже если ЭПО применялся достаточно короткий период.
В связи с этим известны попытки создания модифицированного ЭПО, у которого бы отсутствовало кроветворное действие, но при этом сохранялись цитопротекторные свойства.
Одним из таких вариантов модифицированного ЭПО является его десиалированная форма (asialo-EPO), которая обладает высокой аффиностью к классическим рецепторам EpoR, но не успевает проявить кроветворную активность in vivo в связи с коротким периодом полужизни в плазме крови.
Другой вариант модифицированного ЭПО представляет собой карбамилированный эритропоэтин (СЕРО).
Карбамилирование белков широко известно как побочный эффект применения мочевины в очистке белков и как результат высокого уровня мочевины в сыворотке. В таких случаях карбамилирование вызвано спонтанным разложением мочевины до цианата. Цианат отвечает за карбамилирование первичных аминов белка в N-концевой области и подверженных карбамилированию аминокислотных остатков лизина белка. Другие возможно подверженные карбамилированию аминокислотные остатки представляют собой аргинин, цистеин, тирозин, аспарагиновую кислоту, глутаминовую кислоту и гистидин, однако реакция зависит от pH и не протекает так быстро, как с N-концевым остатком и остатком лизина. Карбамилирование эритропоэтина по имеющимся 7 остаткам лизина замещает их на остатки гомоцитруллина, не сильно затрагивая профиль гликозилирования целой молекулы. Показано, что карбамилированный эритропоэтин не взаимодействует с классическим ЭПО рецептором, но сохраняет цитопротекторные свойства (Leist, et al., 2004). Основное преимущество СЕРО в сравнении с asialo-ЭПО в том, что карбамилирование в отличие от десиалирования не изменяет существенно кинетический профиль. Время полужизни СЕРО в плазме крови, как было показано на крысах, такое же, как и ЭПО - 3-6 ч, что обусловлено сохранением остатков сиаловых кислот (Torup and Leist, 2006).
Дарбэпоэтин представляет собой генно-модифицировнный эритропоэтин и обладает всеми свойствами природного аналога. По сравнению со стандартным эритропоэтином дарбэпоэтин имеет большую молекулярную массу (37.1 кДа, а не 30.4 кДа) и максимально возможное количество остатков сиаловой кислоты (22 против 14 у ЭПО) за счет введения дополнительных 2 сайтов гликозилирования. Результатом этого является увеличение периода полувыведения и, как следствие, снижение частоты применения препарата.
Дарбэпоэтин, гипергликозилированный вариант рекомбинантного эритропоэтина человека, являясь столь же эффективным цитопротектором, обладает втрое большим периодом полужизни (Messe, et al., 2013; Yilmaz, et al., 2012). При инсультах его эффективность на животных моделях при еженедельном применении соответствует эффективности ЭПО при ежедневном применении (Grasso, et al., 2009). Таким образом, его эффективная доза меньше, а частота применения может быть реже, чем у ЭПО, в 7 раз.
Обнаруженная в источниках информация о карбамилированном дарбэпоэтине (Ramirez, et al., 2009) является неполной и не описывает способа получения и применения карбамилированного дарбэпоэтина 9C-DEPO, содержащего карбамилированные группы по всем аминокислотным остаткам лизина и остатка аланина в N-концевой области.
В качестве ближайшего аналога лекарственного средства с цитопротекторным действием рассмотрим карбамилированный дарбэпоэтин, для которого продемонстрирована способность предохранять от апоптоза предшественники эндотелиальных клеток, изолированных из венозной крови пациентов, подвергнувшихся гемодиализу, не стимулируя их пролиферацию (Ramirez, et al., 2009).
Задача заявляемой группы изобретений:
- расширить арсенал лекарственных средств, обладающих цитопротекторным действием.
Задача решена путем
- получения карбамилированного дарбэпоэтина 9C-DEPO, содержащего карбамилированные группы всех восьми аминокислотных остатков лизина, входящего в молекулу дарбэпоэтина, а также карбамилированный аминокислотный остаток аланина в N-концевой области этого белка;
- разработки способа получения карбамилированного дарбэпоэтина 9C-DEPO путем инкубирования дарбэпоэтина в присутствии цианатов в подходящих условиях в течение 20-28 часов при pH 8,8-9,2 с последующей очисткой полученного карбамилированного дарбэпоэтина 9C-DEPO методом анионообменной хроматографии;
- применение карбамилированного дарбэпоэтина 9C-DEPO в качестве лекарственного средства с цитопротекторным действием.
Заявляемый карбамилированный дарбэпоэтин 9C-DEPO не обладает гематопоэтической активностью, но сохраняет цитопротекторные свойства.
Изобретение проиллюстрировано следующими чертежами.
Фиг.1. Последовательность дарбэпоэтина. Серым цветом выделены аминокислотные остатки, подвергающиеся карбамилированию для получения 9C-DEPO.
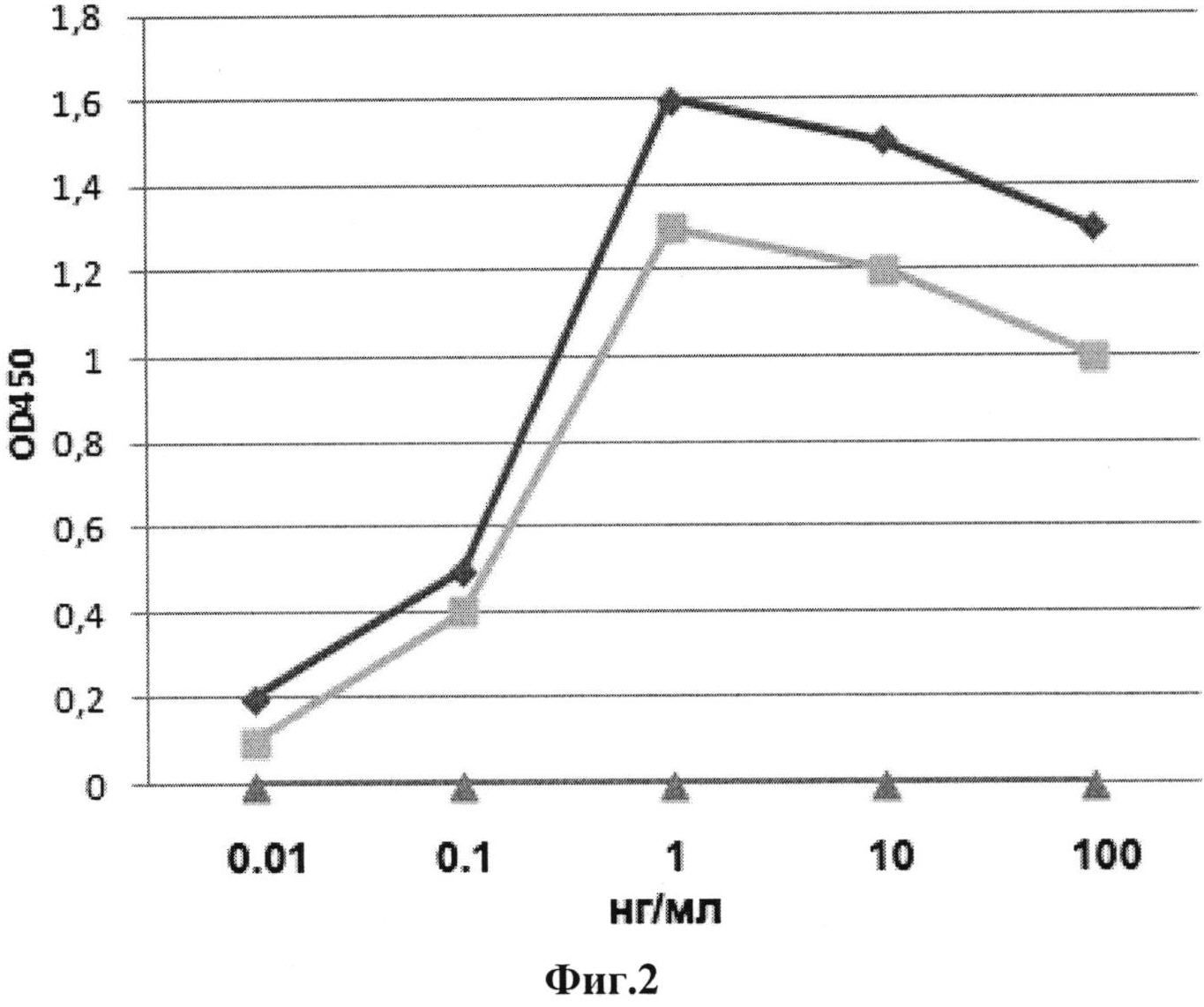
Фиг.2. Эритропоэтическая активность карбамилированного дарбэпоэтина 9C-DEPO in vitro в тесте на пролиферацию с клетками лейкемической клеточной линии TF1 (Kitamura, et al., 1989).  - карбамилированный дарбэпоэтин 9C-DEPO;
- карбамилированный дарбэпоэтин 9C-DEPO;  - Аранесп, дарбэпоэтин альфа (Amgen, США);
- Аранесп, дарбэпоэтин альфа (Amgen, США);  - фармакопейный стандарт эритроэтина BRP. По горизонтальной оси - концентрации вносимого в культуру клеток вещества, по вертикальной - оптическая плотность (OD) суспензии клеточной линии TF1 с красителем МТТ (триазоловым синим) при длине волны 450 нм.
- фармакопейный стандарт эритроэтина BRP. По горизонтальной оси - концентрации вносимого в культуру клеток вещества, по вертикальной - оптическая плотность (OD) суспензии клеточной линии TF1 с красителем МТТ (триазоловым синим) при длине волны 450 нм.
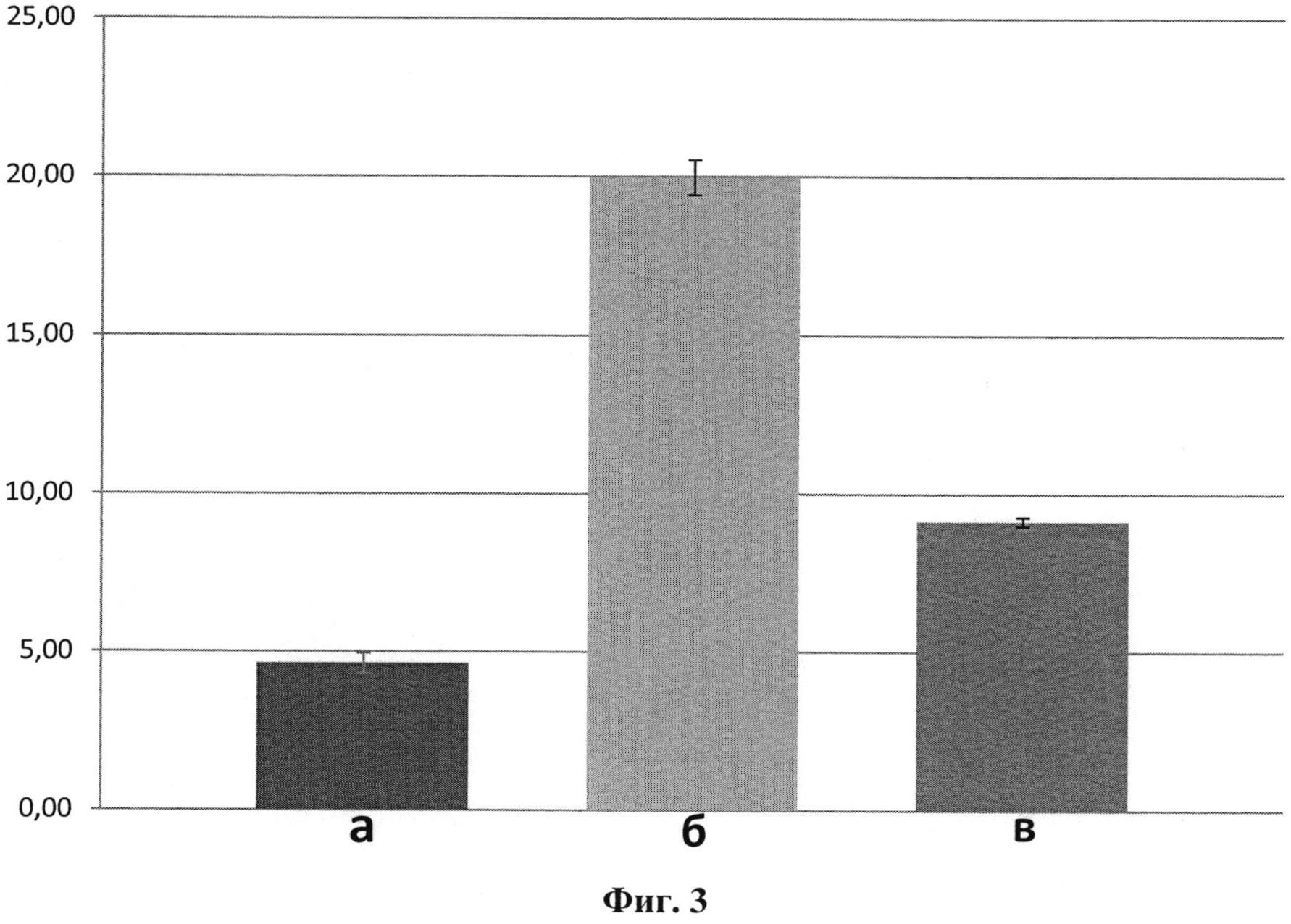
Фиг.3. Оценка цитопротекторного действия карбамилированного дарбэпоэтина 9C-DEPO. Цитопротекторное действие определялось как процент апоптотических клеток (вертикальная ось) после воздействия гипоксии с последующей оксигенацией: а) контрольная группа, не подвергавшаяся гипоксии; б) гипоксия + оксигенация; в) гипоксия + оксигенация + 9CDEPO.
Способ в общем виде
Способ получения карбамилированного дарбэпоэтина 9C-DEPO, карбамилированного по всем восьми аминокислотным остаткам лизина и остатку аланина в N-концевой области, состоит из нескольких стадий.
1. Перевод в буфер для карбамилирования диафильтрацией.
2. Модифицирование карбамилированием.
3. Обессоливание диафильтрацией.
4. Очистка с помощью анионообменной хроматографии.
5. Концентрирование и замена буфера ультра- и диафильтрацией.
6. Стерильная фильтрация.
Исходный материал представляет собой субстанцию очищенного рекомбинантного дарбэпоэтина с концентрацией около 1,5 мг/мл.
Первый шаг процесса осуществляют путем перевода дарбэпоэтина в 0,5 М боратный буфер, pH 8.8-9.2, на системе ультра- и диафильтрации Quix Stand Benchtop System с использованием кассеты UPF-10-C-3X2MA. По окончании диафильтрации к раствору дарбэпоэтина в боратном буфере добавляют сухой цианат калия до концентрации 0,25 М.
Смесь перемешивают и инкубируют при температуре 37°С в течение 20-28 часов. После инкубации смесь быстро охлаждают на льду до t +4 - +8°С. В результате получают смесь, содержащую изоформы карбамилированного дарбэпоэтина, в том числе заявляемый карбамилированный дарбэпоэтин 9C-DEPO. Заявляемый карбамилированный дарбэпоэтин 9C-DEPO содержит 9 карбамилированных остатков на молекулу - остатки лизина и N-концевой аланин. При этом в смеси после инкубации с цианатом также содержится недостаточно карбамилированный дарбэпоэтин: содержит менее 9 карбамильных остатков, т.е. карбамилированы не все из 8 лизинов и N-концевая аминокислота, например около 5 карбамильных остатков. Избыточно карбамилированный дарбэпоэтин имеет более 9 карбамильных остатков и карбамилирован по аминокислотам, отличным от восьми лизиновых остатков и N-концевой аминокислоты, и может иметь 15 карбамильных остатков.
Затем осуществляют разделение находящихся в этой смеси изоформ, а также отделение агрегатов методом анионообменной хроматографии на сорбенте Fractogel TMAE (S). Для этого смесь, содержащую карбамилированный дарбэпоэтин, переводят в буфер для анионообменной хроматографии на системе ультра- и диафильтрации Quix Stand Benchtop System с использованием кассеты UPF-10-C-3X2MA.
Буфер для анионообменной хроматографии (буфер А) содержит 20 мМ трис, 50 мМ NaCl, pH 8,3±0,2. Элюентный буфер (В) содержит 20 мМ трис, 1 М NaCl, pH 8,3±0,2. Элюцию карбамилированного дарбэпоэтина 9C-DEPO производят линейным градиентом из буфера А в буфер В от 0 до 30% за 25 колоночных объемов.
Основной пик карбамилированного дарбэпоэтина 9C-DEPO собирают, анализируют и объединяют. Карбамилированный дарбэпоэтин 9C-DEPO концентрируют и переводят в буфер, содержащий 20 мМ цитрата натрия, 100 мМ натрия хлорида, на системе ультра- и диафильтрации Quix Stand Benchtop System.
Полученный заявляемым способом карбамилированный дарбэпоэтин 9C-DEPO (фиг.1) обладает свойствами, определяющими его как приемлемый в качестве биофармацевтического. Определенное методом гель-хроматографии (Tayyab, et al., 1991) содержание полимер-агрегат составляет не более 0,5%. Определенные анализом TNBSA (Cayot and Tainturier, 1997) карбамилированные лизины составляют 100%. Выход целевого продукта от 60 до 80% от исходного количества очищенного рекомбинантного дарбэпоэтина.
Конечный продукт содержит не менее 90-95% заявляемого дарбэпоэтина 9C-DEPO, карбамилированного только по 8 лизиновым остаткам и N-концевому остатку аланина, что подтверждено методом аминокислотного анализа.
Пример 1. Получение карбамилированного дарбэпоэтина 9C-DEPO
Очищенный рекомбинантный дарбэпоэтин в количестве 40 мг в концентрации 1,5 мг на мл переводят в 0,5 М боратный буфер, pH 9,0, на системе ультра- и диафильтрации Quix Stand Benchtop System с использованием кассеты UPF-10-C-3X2MA. По окончании диафильтрации к раствору дарбэпоэтина в боратном буфере добавляют сухой цианат калия до концентрации 0,25 М. Смесь перемешивают и инкубируют при температуре 37°C в течение 23 часа. После инкубации смесь быстро охлаждают на льду до t +4°C. В результате получают смесь, содержащую карбамилированный дарбэпоэтин.
Затем методом анионообменной хроматографии на сорбенте Fractogel TMAE (S) осуществляют отделение карбамилированного дарбэпоэтина 9C-DEPO от примеси, состоящей из недокарбамилированного и перекарбамилированного дарбэпоэтина, а также образующихся при карбамилировании агрегатов. Для этого смесь, содержащую карбамилированный дарбэпоэтин 9C-DEPO, переводят в буфер для анионообменной хроматографии на системе ультра- и диафильтрации Quix Stand Benchtop System с использованием кассеты UPF-10-C-3X2MA.
Буфер для анионообменной хроматографии (буфер А) содержит 20 мМ трис, 50 мМ NaCl, pH 8,3±0,2. Элюентный буфер (В) содержит 20 мМ трис, 1 М NaCl, pH 8,3±0,2. Элюцию заявляемого карбамилированного дарбэпоэтина 9C-DEPO производят линейным градиентом из буфера А в буфер В от 0 до 30% за 25 колоночных объемов.
Основной пик карбамилированного дарбэпоэтина 9C-DEPO собирают, анализируют и объединяют. 9C-DEPO концентрируют и переводят в буфер, содержащий 20 мМ цитрата натрия, 100 мМ натрия хлорида, на системе ультра- и диафильтрации Quix Stand Benchtop System.
Конечный продукт содержит 90% заявляемого дарбэпоэтина 9C-DEPO, карбамилированного только по 8 лизиновым остаткам и N-концевому остатку аланина, что подтверждено методом аминокислотного анализа. Количество аминокислотных остатков лизина в продукте, определенное анализом TNBSA, составляет 100%. Содержание полимер-агрегатов, определенное методом гель-хроматографии, составляет 0,5%. Выход конечного продукта 28 мг, что составляет 70% от исходного продукта.
Пример 2. Определение эритропоэтической активности заявляемого карбамилированного дарбэпоэтина 9C-DEPO
Эритропоэтическую активность карбамилированного дарбэпоэтина 9C-DEPO оценивают в тесте in vitro с клетками лейкемической клеточной линии TF1 (АТСС® CRL-2003™), осуществленном по методу Kitamura, Т., et al. (1989). В качестве контроля используют стандарт эритропоэтина BRP: фармакопейный (Европейской Фармакопеи) стандарт эритропоэтина человека и дарбэпоэтин альфа Аранесп (Amgen, США). Полученные данные роста клеточной линии показывают, что 9C-DEPO в концентрациях до 100 нг в мл не стимулирует пролиферацию клеток линии TF1. Результаты (фиг.2) позволяют сделать вывод, что заявляемый карбамилированный дарбэпоэтин 9C-DEPO не проявляет эритропоэтической активности in vitro.
Пример 3. Определение цитопротекторного действия карбамилированного дарбэпоэтина 9C-DEPO
Первичную культуру кардиомиоцитов получают из новорожденных крыс, как описано (De Windt, et al., 2000). Для этого из собранных сердец удаляют предсердия. Желудочки разрезают на мелкие куски и обрабатывают трипсином 10 раз. Кардиомиоциты помещают в 6-луночные культуральные планшеты и культивируют 36 часов в среде DMEM (ПанЭко, Россия) с добавлением 10% фетальной бычьей сыворотки, пенницилин/стрептомицин 100 ед/мл и L-глутамин 2 ммоль/л. Когда слой кардиомиоцитов покрывают 80% поверхности лунки в 6 луночном планшете, их подвергают воздействию гипоксии (недостатка кислорода) 1 час (95% N2 и атмосфере 5% CO2), а затем интенсивной оксигенации (возобновление подачи кислорода), как описано (Tramontano, et al., 2003). 9C-DEPO в конечной концентрации 100 нг/мл добавляют сразу после гипоксии, перед реоксигенацией.
Эксперимент состоит из трех групп кардиомиоцитов: подвергнутые гипоксии + оксигенации; не подвергнутые воздействию гипоксии; подвергнутые гипоксии + оксигенации и обработанные заявляемым карбамилированным дарбэпоэтином 9C-DEPO. Процент апоптотических клеток определен с помощью анализа активности фермента каспазы 3 с использованием набора CaspGLOWTM fluorescein caspase-3 staining kit (Biovision, США), последующего разделения и подсчета меченых клеток на проточном цитофлуориметре (Beckman Coulter, США). Кардиомиоциты собирают через 4 часа после реоксигенации и инкубируют с флуоресцентным маркером FITC-DEVD-MK, входящего в набор CaspGLOWTM (Biovision, США) 60 минут при 37°C в атмосфере 5% CO2. Далее ресуспендированные кардиомиоциты анализируют на проточном цитофлуориметре (Beckman Coulter, США), процент неокрашенных и окрашенных флуоресцентной меткой клеток в цитофлуориметре соответствует проценту нормальных и апоптотических клеток.
Полученные результаты демонстрируют (фиг.3), что карбамилированный дарбэпоэтин 9C-DEPO уменьшает процент апоптотических кардиомиоцитов - до 54% (9.15%±0.14 vs 19.98%±0.55, n=3, #P<0.05) в сравнении с группой гипоксия + оксигенация, в которой значительно увеличен уровень апоптотических кардиомиоцитов, до 300% (19.98±0.55 vs 4.64±0.32, n=3, *P<0.05) по сравнению с группой клеток, не подвергнутых действию гипоксии.
Таким образом, внесение 100 нг/мл препарата 9C-DEPO почти наполовину уменьшает проявление апоптоза на культуре клеток кардиомиоцитов крысы в условиях гипоксии в сравнении с контрольной группой гипоксия + оксигенация, что подтверждает цитопротекторный эффект заявляемого лекарственного средства.
Таким образом, разработан способ получения карбамилированного дарбэпоэтина 9C-DEPO, карбамилированного по всем восьми остаткам лизина и остатку аланина в N-концевой области этого белка, и получен карбамилированный дарбэпоэтин 9C-DEPO, который обладает более длительным временем полужизни в сравнении с карбамилированным эритропоэтином (СЕРО), а следовательно, может быть перспективен при применении in vivo в качестве цитопротекторного лекарственного средства при заболеваниях, приводящих к гибели клеток, вызванной гипоксией. Заявляемый способ получения лекарственного средства на основе карбамилированного дарбэпоэтина 9С-DEPO требует по сравнению с ближайшим аналогом в два раза меньше времени для осуществления.
Список литературы
Bernaudin, M., et al. (1999) A potential role for erythropoietin in focal permanent cerebral ischemia in mice, J Cereb Blood Flow Metab, 19, 643-651.
Brines, M.L., et al. (2000) Erythropoietin crosses the blood-brain barrier to protect against experimental brain injury, Proc Natl Acad Sci USA, 97, 10526-10531.
Cayot, P. and Tainturier, G. (1997) The quantification of protein amino groups by the trinitrobenzenesulfonic acid method: a reexamination, Anal Biochem, 249, 184-200.
De Windt, L.J., et al. (2000) Calcineurin-mediated hypertrophy protects cardiomyocytes from apoptosis in vitro and in vivo: An apoptosis-independent model of dilated heart failure, Circ Res, 86, 255-263.
Grasso, G., et al. (2009) Neuroprotective effect of erythropoietin and darbepoetin alfa after experimental intracerebral hemorrhage, Neurosurgery, 65, 763-769; discussion 769-770.
Henn, F.A. and Braus, D.F. (1999) Structural neuroimaging in schizophrenia. An integrative view of neuromorphology, EurArch Psychiatry Clin Neurosci, 249 Suppl 4, 48-56.
Kitamura, Т., et al. (1989) Establishment and characterization of a unique human cell line that proliferates dependently on GM-CSF, IL-3, or erythropoietin, J Cell Physiol, 140, 323-334.
Lapchak, P.A. (2010) Erythropoietin molecules to treat acute ischemic stroke: a translational dilemmal, Expert Opin Investig Drugs, 19, 1179-1186.
Leist, M., et al. (2004) Derivatives of erythropoietin that are tissue protective but not erythropoietic. Science, 305, 239-242.
Livnah, O., et al. (1998) An antagonist peptide-EPO receptor complex suggests that receptor dimerization is not sufficient for activation, Nat Struct Biol, 5, 993-1004.
Messe, S.R., et al. (2013) A pilot study of darbepoetin alfa for prophylactic neuroprotection in aortic surgery, Neurocrit Care, 18, 75-80.
Middleton, S.A., et al. (1999) Shared and unique determinants of the erythropoietin (EPO) receptor are important for binding EPO and EPO mimetic peptide, J Biol Chem, 274, 14163-14169.
Morishita, E., et al. (1997) Erythropoietin receptor is expressed in rat hippocampal and cerebral cortical neurons, and erythropoietin prevents in vitro glutamate-induced neuronal death, Neuroscience, 76, 105-116.
Ramirez, R., et al. (2009) Carbamylated darbepoetin derivative prevents endothelial progenitor cell damage with no effect on angiogenesis, J Mol Cell Cardiol, 47, 781-788.
Ruscher, K., et al. (2002) Erythropoietin is a paracrine mediator of ischemic tolerance in the brain: evidence from an in vitro model, J Neurosci, 22, 10291-10301.
Sanchis-Gomar, F., Perez-Quilis, C. and Lippi, G. (2013) Erythropoietin Receptor (EpoR) Agonism Is Used to Treat a Wide Range of Disease, Mol Med, 19, 62-64.
Tayyab, S., Qamar, S. and Islam, M. (1991) Size exclusion chromatography and size exclusion HPLC of proteins, Biochemical Education, 19, 149-152.
Torup, L. and Leist, M. (2006) Development of Non-Erythropoietic Erythropoietin Variants for Neuroprotection. In Höke, A. (ed), Erythropoietin and the Nervous System. Springer US, pp.211-219.
Tramontano, A.F., et al. (2003) Erythropoietin protects cardiac myocytes from hypoxia-induced apoptosis through an Akt-dependent pathway, Biochem Biophys Res Commun, 308, 990-994.
Vogeley, K., et al. (2001) Right frontal hypergyria differentiation in affected and unaffected siblings from families multiply affected with schizophrenia: a morphometric mri study. Am J Psychiatry, 158, 494-496.
Yilmaz, E.R., et al. (2012) Effects of darbepoetin-alpha in spinal cord ischemia-reperfusion injury in the rabbit, Acta Neurochir (Wien), 154, 1037-1043; discussion 1043-1034.