Результат интеллектуальной деятельности: СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ БОЛЕЗНИ АЛЬЦГЕЙМЕРА, СОСУДИСТОЙ И СМЕШАННОЙ ДЕМЕНЦИИ
Вид РИД
Изобретение
Изобретение относится к области медицины, а именно к неврологии, и может быть использовано для дифференциальной диагностики нарушений когнитивных функций цереброваскулярного, нейродегенеративного или смешанного (сосудисто-нейродегенеративного) генеза на стадии деменции.
По данным Всемирной организации здравоохранения на 2012 год в мире насчитывается 35,6 млн больных с деменцией, а к 2030 году предполагается увеличение числа таких пациентов почти в два раза (до 56,7 млн). При этом ежегодно регистрируется до 5 миллионов новых случаев заболевания (Ferri С.Р., Prince М., Brayne С., et al. Global prevalence of dementia: a Delphi consensus study // Lancet. - 2005. - Vol. 366, №9503. - P. 2112-2117).
Болезнь Альцгеймера (БА) и сосудистая деменция (СоД) - самые частые формы когнитивных нарушений во всех странах (Skoog I., Nilsson L., Andreasson L.A., et al. A population-based study of dementia in 85-year-olds // N. England J. Med. - 1993. - Vol. 328. - P. 153-158; Захаров B.B. Всероссийская программа исследований эпидемиологии и терапии когнитивных расстройств в пожилом возрасте («Прометей») // Неврологический журнал. - 2006. - Т. 11. - С. 27-32.). При этом и у пациентов с БА, и у пациентов с СоД обнаруживаются как нейродегенеративные, так и сосудистые изменения (Zekry D., Hauw J.J., Gold G. Mixed dementia: epidemiology, diagnosis and treatment // J. Amer. Geriatr. Soc. - 2002. - Vol. 50. - P. 1431-1438). Клинически же как нейродегенерация, так и цереброваскулярная патология в значительной мере потенцируют друг друга и обусловливают развитие более тяжелых интеллектуально-мнестических нарушений (Snowdon D.A., Greiner L.H., Mortimer J.A., et al. Brain infarction and the clinical expression of Alzheimer disease: the Nun study // JAMA. - 1997. - Vol. 277. - P. 813-817). Такое сосуществование двух нозологических единиц называют смешанной деменцией (СмД).
Существующие в настоящее время диагностические критерии болезни Альцгеймера несовершенны и основываются на наличии клинического диагноза деменции. В практическом плане наиболее существенное значение имеет определение содержания амилоида в спинномозговой жидкости, а именно его различных фракций: Аβ1-40 и Аβ1-42 и их соотношения. Чувствительность и специфичность Аβ1-42 в ликворе в диагностике болезни Альцгеймера может достигать по разным данным 80-90%. Кроме того, определение повышенного содержания фосфорилированного тау-протеина в ликворе является в настоящее время наиболее достоверным маркером нейродегенерации в зарубежных научных исследованиях.
Исследование когнитивных функций у пациентов с интеллектуально-мнестическими нарушениями различного генеза - один из основных способов диагностики. Большинство методик изначально валидизированы только для диагностики БА. С данной целью широко применяются: батарея тестов для оценки лобной дисфункции (FAB), тесты на речевую активность - литеральные и категориальные ассоциации (Dubois В., Slachevsky A., Litvan I. et al. The FAB: A frontal assessment battery at bedside // Neurology. - 2000. - Vol. 55, №11. - P. 1621-1626; Kazdin A.E. Single-case research designs: methods for clinical and applied settings. - New York, NY: Oxford University Press, 1982. - 55 p.), методики оценки вербального запоминания, такие как тест 10 слов (Лурия А.Р. Высшие корковые функции человека и их нарушения при локальных поражениях мозга. - 2-е доп. изд. - М.: Изд-во МГУ, 1969. - 504 с.), тест 5 слов (Grober Е., Buschke Н.; Crystal Н. et al. Screening for dementia by memory testing // Neurology. - 1988. - Vol. 38, №6. - P. 900-903). В настоящее время существуют методики, позволяющие с более высокой достоверностью дифференцировать сосудистые и нейродегенеративные когнитивные расстройства. Одной из таких методик является тест рисования часов (Sunderland Т. Clock drawing in Alzheimer′s disease: A novel measure of dementia severity // J. Am. Geriatr. Soc. - 1989. - Vol. 37, №8. - P. 725-729). Тест позволяет оценить не только праксис и регуляторные функции, но и верифицировать зрительно-пространственные нарушения, характерные, в первую очередь, для БА. В одном из исследований, проведенных специально с целью определения дифференциально-диагностической значимости, было показано, что у пациентов с СоД по сравнению с больными БА при одинаковой тяжести деменции (подтвержденной шкалами CDR и MMSE) достоверно ниже показатели по шкалам «категориальные ассоциации» (p=0,014), «литеральные ассоциации» (p=0,043), копирование циферблата в «тесте рисование часов» (p=0,023), «отсроченное воспроизведение рисунков» (p=0,013) (Niures М., Matioli P.S.; Caramelli P. Limitations in differentiating vascular dementia from Alzheimer′s disease with brief cognitive tests // Arq. Neuro-Psiquiatr. - 2010. - Vol. 68, №2. - P. 13-19; Molinuevo J.L., Gomez-Anson В., Monte G.C. Neuropsychological profile of prodromal Alzheimer′s disease (Prd-AD) and their radiological correlates // Arch. Gerontol. Geriatr. - 2011. - Vol. 52, №2. - P. 190-196).
Комплексными методиками, направленными на быструю и в то же время полноценную оценку когнитивных функций в повседневной клинической практике являются краткое исследование психического статуса (MMSE) (Folstein M.F., Folstein S.E., McHugh P.R. Mini-Mental State: A practical method for grading the cognitive state of patients for the clinician // J. Psychiatr. Res. - 1975. - Vol. 12, №3. - P. 189-198.) и Монреальская шкала оценки когнитивных нарушений (МоСА) (Nasreddine Z.S., Phillips N.A., Bédirian V., et al. The Montreal cognitive assessment (MoCA): A brief screening tool for mild cognitive impairment // J. Amer. Geriatr. Soc. - 2005. - Vol. 53. - P. 695-699). Удобство и быстрота применения в сочетании с возможностью оценки памяти, внимания, ориентировки, речевых и зрительно-пространственных навыков обусловливают широкое практическое распространение этих двух методик. В то же время такие комплексные оценочные шкалы не позволяют уточнять генез когнитивных расстройств и лишь определяют их степень тяжести. В научных исследованиях широкое распространение получила шкала деменции Маттиса (Mattis S. Mental status examination for organic mental syndrome in the elderly patient in geriatric psychiatry // In: Bellak L., Karasu T.B., eds. Geriatric psychiatry: a hand book for psychiatrists and primary care physicians. - New York: Grune and Stratton, 1976. - P. 77-121), позволяющая оценивать отдельно различные когнитивные сферы: память, активность, праксис, внимание, однако ее проведение занимает в среднем около 60-90 минут, поэтому применяется она реже.
В патогенезе БА ведущая роль отводится отложению внеклеточного β-амилоида и развитию внутриклеточных нейрофибриллярных клубков. В огромном числе исследований показано, что уровень β-амилоида 1-42 в ликворе значительно снижен у пациентов с БА. Снижение уровня Аβ1-42 в среднем достигает 50% по сравнению со здоровыми лицами, что делает этот биомаркер наиболее специфичным в диагностике заболевания (Blennow K., Hampel Н., Weiner М. et al. Cerebrospinal fluid and plasma biomarkers in Alzheimer′s disease // Nat. rev. Neurol. - 2010. - Vol. 6. - P. 131-144). Чувствительность и специфичность уровня Аβ1-42 в ликворе в дифференциации здоровых лиц и больных БА достигает 80-90%. В многочисленных исследованиях подтверждено повышение уровня общего и фосфорилированного тау-белка при БА (Mattsson N., Zetterberg Н., Hansson О. Et al. CSF biomarkers and incipient Alzheimer disease in patients with mild cognitive impairment // JAMA. - 2009. - Vol. 302. - P. 385-393). Проведенный мета-анализ исследований по определению Аβ1-42 и тау-белка в ликворе показал, что чувствительность комбинации была 94% (для вероятной БА), 88% (для возможной БА) и 75% (для УКН), а специфичность составила 100% для всех заболеваний, сопровождающихся нарушением когнитивных функций, достигающих деменции, и 89% для недементных больных. Однако оказалось, что данными биомаркерами невозможно достоверно идентифицировать СоД при ее дифференциации от БА вследствие достаточно низкой специфичности (48%) (Andreasen N., Minthon N., Davidsson P., et al. Evaluation of CSF-tau and CSF-Aβ42 as diagnostic markers for Alzheimer disease in clinical practice // Arch. Neurology. - 2009. - Vol. 58, №3. - P. 373-379). Кроме того, крупных исследований, посвященных изучению содержания вышеуказанных белков в цереброспинальной жидкости при смешанной деменции до настоящего времени не проводилось.
Недостатками всех перечисленных выше способов диагностики является их малая информативность в определении клинической формы заболевания. Нейропсихологические методы позволяют верифицировать степень тяжести заболевания и лишь косвенно, при помощи выявления специфических интеллектуально-мнестических паттернов болезни, предположить природу болезни. Ликворологические биомаркеры, в свою очередь, наоборот, позволяют судить о предполагаемой форме заболевания, но не учитывают его степень тяжести. Таким образом, для повышения точности дифференциальной диагностики очевидна необходимость использования комплекса показателей, получаемых с помощью клинико-нейропсихологических и ликворологических методов исследования.
Известен способ дифференциальной диагностики деменций с применением высокоточного метода нейровизуализации - позитронно-эмиссионной томографии (ПЭТ) с 18-флюородезоксиглюкозой (18-ФДГ). Снижение метаболизма глюкозы в теменно-височных, лобных отделах и заднем отделе поясной извилины является высокоспецифичным признаком болезни Альцгеймера. ПЭТ с 18-ФДГ достигает 90% чувствительности в идентификации болезни Альцгеймера, хотя ее специфичность в дифференциации этой нозологической формы от других форм деменции несколько ниже (84-88%). Визуализация уровня церебрального метаболизма глюкозы с помощью 18F-ФДГ ПЭТ является высокочувствительным и специфичным методом именно для дифференциальной диагностики различных форм когнитивных нарушений. ПЭТ с флюородезоксиглюкозой позволяет диагностировать гипометаболизм в определенных отделах коры головного мозга за 10-15 лет до появления первых симптомов болезни (Mosconi L, Berti V, Glodzik L., et al. Pre-clinical detection of Alzheimer′s disease using FDG-PET with or without amyloid ligand // J Alzheimers Dis. - 2010. - Vol. 20, №3. - P. 843-854). Однако обладая высокой чувствительностью, ПЭТ не получила широкого применения в клинической практике в нашей стране из-за высокой стоимости исследования и необходимости синтеза короткоживущих радиоизотопов (Ломаков С.Ю. Организационные основы внедрения позитронной эмиссионной томографии в практику онкологической службы: дисс… канд. мед. наук: 14.00.33 / Ломаков Сергей Юрьевич [Место защиты: ГОУВПО "Санкт-Петербургский государственный медицинский университет"]. - Санкт-Петербург, 2009. - 207 с.: ил.).
Известен способ диагностики когнитивных нарушений, включающий определение в ликворе уровня амилоидного белка аβ-42 и уровня общего тау-протеина (Лобзин В.Ю. Ликворологические биомаркеры нейродегенерации в ранней диагностике когнитивных нарушений. Вестник Военно-Медицинской Академии, 4(44), 2013, с. 15-20), недостатком которого является недостаточная надежность дифференциальной диагностики болезни Альцгеймера.
В основу изобретения положена разработка способа дифференциальной диагностики болезни Альцгеймера, сосудистой и смешанной деменции при помощи математического прогнозирования на основании клинико-нейропсихологических данных и показателей уровня специфических белков в цереброспинальной жидкости, которая характеризовалась бы меньшей стоимостью, не требовала использования радиоизотопов.
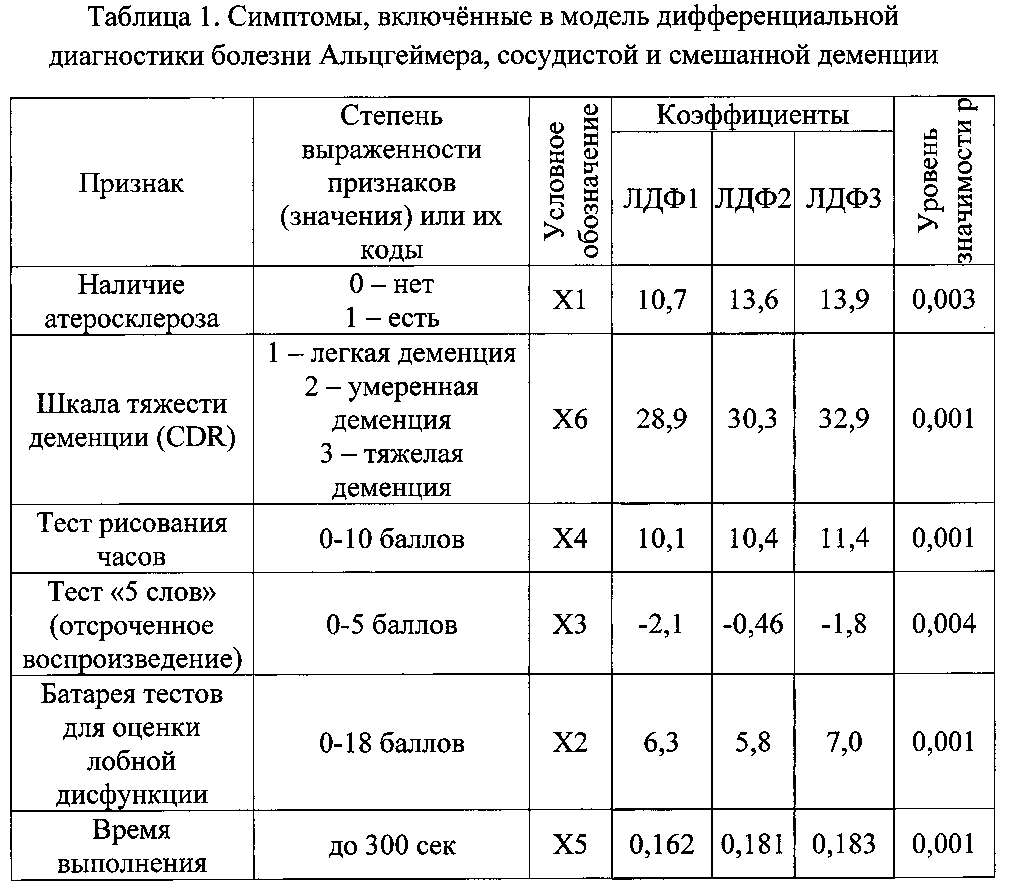
Решение поставленной технической задачи обеспечивается тем, что в способе дифференциальной диагностики болезни Альцгеймера, сосудистой и смешанной деменции на основании клинико-нейропсихологических и ликворологических данных, причем в ликворе определяют уровень амилоидного белка аβ-42 (Х7, пг/мл) и уровень общего тау-протеина (Х8, пг/мл), дополнительно определяют наличие атеросклероза (X1), оценивая 1 баллом - наличие, 0 - отсутствие атеросклероза; нейропсихологические данные оценивают по тестам «Батарея тестов для оценки лобной дисфункции», определяя общий балл (Х2), «5 слов», определяя отсроченное воспроизведение (Х3, балл), «рисования часов», определяя общий балл (Х4), «тест слежения», определяя время выполнения в части «В» (Х5, с), «клиническая рейтинговая шкала деменции», определяя степень тяжести деменции (Х6, балл), и рассчитывают линейно-дискриминантные функции (ЛДФ) по формулам:
ЛДФ1=-114,4+10,7×Х1+6,3×Х2+(-2,1×Х3)+10,1×Х4+0,162×Х5+28,9×Х6+0,013×Х7+0,002×Х8;
ЛДФ2=-129,4+13,6×Х1+5,8×Х2+(-0,46×Х3)+10,4×Х4+0,181×Х5+30,3×Х6+0,033×Х7+0,0003×Х8;
ЛДФ3=-146,7+13,9×Х1+7,0×Х2+(-1,8×Х3)+11,4×Х4+0,183×Х5+32,9×Х6+0,008×Х7+0,003×Х8; и при ЛДФ1>ЛДФ2, ЛДФ3 у больных диагностируют болезнь Альцгеймера; при ЛДФ2>ЛДФ1, ЛДФ3 у больных диагностируют сосудистую деменцию; при ЛДФ3>ЛДФ1, ЛДФ2 у больных диагностируют смешанную деменцию.
Достижение поставленной технической задачи обеспечивается тем, что применение рутинных клинических, нейропсихологических и ликворологических методов, без использования сложной инструментальной диагностики, в комплексе дает возможность осуществлять дифференциальную диагностику различных нозологических форм деменции с не менее высокой чувствительностью и специфичностью, чем при применении метода-прототипа.
Способ реализуют следующим образом. На основании клинических или инструментальных данных верифицируют у больного наличие общего или церебрального атеросклероза. Применяют комплексные оценочные нейропсихологические шкалы для выявления у пациента нарушений памяти, внимания, мышления, речи, праксиса, зрительно-пространственных и регуляторных функций. Используют батарею тестов для оценки лобной дисфункции (FAB) (Dubois В. et al., 2000), позволяющую оценить концептуализацию, литеральные ассоциации, динамический праксис, простую и усложненную реакцию выбора, наличие хватательных рефлексов. Суммарный балл по данной шкале составляет от 0 до 18, где максимальное значение соответствует норме. Тест 5 слов проводят с оценкой непосредственного воспроизведения после заучивания с категориальной подсказкой и отсроченного воспроизведения слов после интерферирующего задания (Grober Е. et al., 1988). Каждая часть теста имеет максимальную оценку в 5 баллов. В качестве интерферирующего задания выполняется тест рисования часов (ТРЧ) - круглого циферблата с цифрами от 1 до 12 и указанием пациента времени «без пятнадцати два» посредством рисования на циферблате часовой и минутной стрелок. Тест оценивается от 0 до 10 баллов (Sunderland Т. et al., 1989). Выполняется тест слежения (trail making test), состоящий из двух частей (Reitan R., 1955). В первой части больному предлагают на стандартном листе бумаги соединить цифры, расположенные в кругах, последовательно от 1 до 25. Во второй части - попеременно соединять цифры и буквы (1-А-2-Б-3-… и т.д.) до цифры «12» и буквы «М» соответственно. Оценка обеих частей методики производится в секундах, при этом за вторую часть «В» максимальное время составляет 300 секунд. Выполняется клиническая рейтинговая шкала деменции (CDR). Методика позволяет оценить сферы когнитивной деятельности и функциональную независимость больного (память, ориентировку, суждение и способность решать текущие задачи, внешнюю активность, повседневную домашнюю деятельность и увлечения), а также дает возможность охарактеризовать способность к самообслуживанию больного (Morris J.C., 1993). Общий балл теста: 0 (норма), 0,5 (умеренные когнитивные нарушения), 1 (легкая деменция), 2 (умеренная деменция), 3 (тяжелая деменция).
Для ликворологического исследования получают 2 мл цереброспинальной жидкости при выполнении люмбальной пункции. Исследование осуществляется с применением планшетов, содержащих моноклональные антитела к 1-42 аβ-амилоидному белку и к тау-белку человека при помощи твердофазного иммуноферментного анализа (ELISA) (Лобзин В.Ю. и др., 2013). Полученные концентрации белков приводятся в пг/мл.
В качестве предиктивных факторов были выбраны наиболее значимые (p<0,01) следующие признаки: наличие атеросклероза, нарушений ходьбы по лобному типу, возраст пациента, общий балл по шкале тяжести деменции (CDR), тесту рисования часов, тесту «5 слов» (за отсроченное воспроизведение), по батарее тестов для оценки лобной дисфункции, времени выполнения обеих частей (А и В) теста слежения (ТМТ), шкале краткой оценки психического статуса (MMSE), уровни аβ-амилоидного белка и тау-протеина в ликворе.
Определенные с помощью различных методик 8 специфических признаков заболевания у пациентов с когнитивными нарушениями позволяют вычислить линейно-дискриминантные функции (ЛДФ) по формулам:
ЛДФ1=-114,4+10,7×Х1+6,3×X2+(-2,1×Х3)+10,1×Х4+0,162×Х5+28,9×Х6+0,013×Х7+0,002×Х8;
ЛДФ2=-129,4+13,6×Х1+5,8×Х2+(-0,46×Х3)+10,4×Х4+0,181×Х5+30,3×Х6+0,033×Х7+0,0003×Х8;
ЛДФ3=-146,7+13,9×Х1+7,0×Х2+(-1,8×Х3)+11,4×Х4+0,183×Х5+32,9×Х6+0,008×Х7+0,003×Х8;
где
X1 - наличие атеросклероза (1 - наличие, 0 - отсутствие);
Х2 - общий балл по шкале батареи тестов для оценки лобной дисфункции (от 0 до 18);
Х3 - отсроченное воспроизведение по тесту «5 слов», баллы (от 0 до 5);
Х4 - общий балл по тесту рисования часов (от 0 до 10);
Х5 - время выполнения теста слежения, часть «В», сек (до 300);
Х6 - степень тяжести деменции по клинической рейтинговой шкале деменции, балл (от 0 до 3);
Х7 - уровень амилоидного белка аβ-42 в ликворе, пг/мл;
Х8 - уровень общего тау-протеина в ликворе, пг/мл;
и при ЛДФ1>ЛДФ2, ЛДФ3 у больных диагностируют болезнь Альцгеймера;
при ЛДФ2>ЛДФ1, ЛДФ3 у больных диагностируют сосудистую деменцию;
при ЛДФ3>ЛДФ1, ЛДФ2 у больных диагностируют смешанную деменцию.
Матрица обучающей информации создана на основе комплексного клинико-инструментального обследования 492 пациентов с сосудистыми, нейродегенеративными и сосудисто-нейродегенеративными когнитивными нарушениями. Была дана оценка различных предиктивных факторов с целью выявления наиболее значимых из них для последующего включения в модель дифференциальной диагностики деменций. На основании выявленных факторов была разработана модель этой функции.
В качестве математического аппарата моделирования избран дискриминантный анализ, основное предназначение которого - выявление предикторов, значимо влияющих на отнесение конкретного больного к одной из нозологических групп, а также вычисление коэффициента для этих признаков с целью последующего проведения дифференциального диагноза для конкретного пациента.
В результате анализа установлено, что многие клинические показатели являются статистически значимыми для верификации формы когнитивных нарушений при разной степени тяжести когнитивных расстройств. Наиболее значимыми признаками оказались: наличие атеросклероза (p<0,01), общий балл по шкале тяжести деменции (CDR) (p<0,001), тесту рисования часов (p<0,001), тесту «5 слов» (за отсроченное воспроизведение) (p<0,01), по батарее тестов для оценки лобной дисфункции (p<0,001), времени выполнения части «В» теста слежения (ТМТ) (p<0,001), уровни аβ-амилоидного белка (p<0,001) и тау-протеина в ликворе (p<0,01).
Для решения задачи выработки модели избран метод пошагового отбора наиболее прогностически значимых признаков с уровнем надежности не менее 99% (p<0,01). Для построения классификационной матрицы были использованы результаты обследования 79 человек. Уровни градаций признаков, включенных в модель, их значимость и коэффициенты приведены в Таблице 1.
Статистически значимая (p<0,01) модель дифференциальной диагностики когнитивных нарушений имеет вид:
- болезнь Альцгеймера (ЛДФ1)
ЛДФ1=-114,4+10,7×Х1+6,3×Х2+(-2,1×Х3)+10,1×Х4+0,162×Х5+28,9×Х6+0,013×Х7+0,002×Х8;
- сосудистая деменция (ЛДФ2)
ЛДФ2=-129,4+13,6×Х1+5,8×Х2+(-0,46×Х3)+10,4×Х4+0,181×Х5+30,3×Х6+0,033×Х7+0,0003×Х8;
- смешанная деменция (ЛДФ3)
ЛДФ3=-146,7+13,9×Х1+7,0×Х2+(-1,8×Х3)+11,4×Х4+0,183×Х5+32,9×Х6+0,008×Х7+0,003×Х8.
Для решения задачи дифференциальной диагностики деменции в формулы ЛДФ подставляются значения признаков, включенных в модель, полученных при обследовании конкретного больного, и производится решение уравнений. Оцениваемый пациент должен быть отнесен в ту группу, значение ЛДФ для которой является наибольшим. Так, если наибольшим оказывалось значение ЛДФ3, то для этого пациента наиболее вероятна смешанная деменция.
В группе пациентов с болезнью Альцгеймера предлагаемая модель обеспечивает совпадение прогнозируемой нозологической формы с реальным результатом в 90,5% случаев. В группе пациентов с сосудистой деменцией совпадение прогнозируемого диагноза с реальными результатами составило 85,7%. И в группе больных со смешанной деменцией предполагаемая модель обеспечивает прогнозируемое совпадение в 82,6% случаев. В группах пациентов с различным генезом деменции совпадение прогнозируемого диагноза с реальными результатами составило 87,3%, что отражало классификационную способность модели. Данные приведены в Таблице №2 - «Классификационная матрица».
Таким образом, дискриминантная модель дифференциальной диагностики деменций по данным комплексного клинико-инструментального обследования, основанная на 8 признаках: наличие атеросклероза (p<0,01), общий балл по шкале тяжести деменции (CDR) (p<0,001), тесту рисования часов (p<0,001), тесту «5 слов» (за отсроченное воспроизведение) (p<0,01), по батарее тестов для оценки лобной дисфункции (p<0,001), времени выполнения части «В» теста слежения (ТМТ) (p<0,001), уровни аβ-амилоидного белка (p<0,001) и тау-протеина в ликворе (p<0,01), обладает достаточно высокой информационной способностью (87,3%) и является статистически значимой (p<0,001).
Решение модели может быть осуществлено с помощью калькулятора, или может быть разработана программа для персонального компьютера. Разработанная модель является высокоинформативной и разработана на основании высокоспецифичных клинических и инструментальных данных.
Приводим примеры фактической реализации.
Клинический пример 1. Больная Ю., 68 лет. Поступила с жалобами на повышенную забывчивость, снижение концентрации внимания, трудность ориентировки в незнакомом месте. Со слов родственников трудности в быту и общении испытывает около года. Страдает артериальной гипертензией около 10 лет с эпизодами повышения до 160 и 100 мм рт.ст., признаков атеросклеротического поражения сосудов не выявлено.
При неврологическом обследовании очаговой неврологической симптоматики не выявлено, отмечается рассеянная органическая симптоматика. При нейропсихологическом исследовании по шкале MMSE - 22 балла, батарее тестов для оценки лобной дисфункции - 15 баллов, тесту рисования часов - 6 баллов (нарушение расположения стрелок на готовом циферблате), по тесту 5 слов - непосредственное воспроизведение - 4, отсроченное - 1 балл, время выполнения теста ТМТ, часть «В» - 128 сек. Степень тяжести деменции по шкале CDR соответствовала 1 баллу. При исследовании цереброспинальной жидкости: уровень аβ-42 амилоидного белка - 212 пг/мл, тау-протеина - 256 пг/мл.
Для определения варианта деменции решаются задачи по формулам ЛДФ, подставляются значения признаков, включенных в модель, полученных при обследовании конкретного больного, и производится решение уравнений:
ЛДФ1=-114,4+10,7×0+6,3×15+(-2,1×1)+10,1×6+0,162×128+28,9×1+0,013×212+0,002×256=92,3;
ЛДФ2=-129,4+13,6×0+5,8×15+(-0,46×1)+10,4×6+0,181×128+30,3×1+0,033×212+0,0003×256=80,4;
ЛДФ3=-146,7+13,9×0+7,0×15+(-1,8×1)+11,4×6+0,183×128+32,9×1+0,008×212+0,003×256=84,2.
Из дифференциальной задачи видно, что ЛДФ1>ЛДФ2 и ЛДФ3, что позволяет предполагать у пациентки болезнь Альцгеймера.
Выполнена ПЭТ с 18-ФДГ. Выявлены признаки гипометаболизма в проекции височных и теменных отделов коры с преимущественным снижением накопления радиофармпрепарата в проекции медио-базальных отделов височных долей с обеих сторон. Выявленные признаки патогномоничны для болезни Альцгеймера.
Таким образом, отнесенная с помощью математической модели к первой группе (с болезнью Альцгеймера) пациентка имела схожий клинический диагноз, подтвержденный при помощи метода-прототипа.
Клинический пример 2. Больной М., 58 лет. Поступил с жалобами на нарушение кратковременной памяти, трудность сосредоточения, ухудшение концентрации внимания, нарушение самообслуживания. Со слов супруги, отмечаются затруднения в выполнении привычных бытовых обязанностей в течение 3 лет. Длительно страдает артериальной гипертензией с кризовым течением, ишемической болезнью сердца, стенокардией напряжения, имеет признаки общего и церебрального атеросклероза по данным ультразвуковых методов диагностики.
При неврологическом обследовании выявлен псевдобульбарный синдром, двусторонняя пирамидно-мозжечковая симптоматика, нарушение ходьбы по лобному типу. При нейропсихологическом исследовании по шкале MMSE - 23 балла, батарее тестов для оценки лобной дисфункции - 11 баллов, тесту рисования часов - 8 баллов (нарушение расположения цифр на циферблате), по тесту 5 слов - непосредственное воспроизведение - 5, отсроченное - 4 балл, время выполнения теста ТМТ, часть «В» - 230 сек. Степень тяжести деменции по шкале CDR соответствовала 1 баллу. При исследовании цереброспинальной жидкости: уровень аβ-42 амилоидного белка - 624 пг/мл, тау-протеина - 120 пг/мл.
Для определения варианта деменции решаются задачи по формулам ЛДФ, подставляются значения признаков, включенных в модель, полученных при обследовании конкретного больного, и производится решение уравнений:
ЛДФ1=-114,4+10,7×1+6,3×11+(-2,1×4)+10,1×8+0,162×230+28,9×1+0,013×624+0,002×120=113,1;
ЛДФ2=-129,4+13,6×1+5,8×11+(-0,46×4)+10,4×8+0,181×230+30,3×1+0,033×624+0,0003×120=122,3;
ЛДФ3=-146,7+13,9×1+7,0×11+(-1,8×4)+11,4×8+0,183×230+32,9×1+0,008×624+0,003×120=108,8.
Из дифференциальной задачи видно, что ЛДФ2>ЛДФ1 и ЛДФ3, что позволяет предполагать у пациента сосудистую деменцию.
В порядке дообследования выполнена ПЭТ с 18-ФДГ. Выявлены признаки диффузного гипометаболизма в проекции подкорковых образований с обеих сторон. Выявленные признаки характерны для субкортикальной сосудистой деменции.
Таким образом, отнесенный с помощью математической модели ко второй группе (с сосудистой деменцией) пациент имел схожий клинический диагноз, подтвержденный при помощи ПЭТ с 18-ФДГ.
Клинический пример 3. Больной Е., 76 лет. Поступил с жалобами на выраженное нарушение кратковременной вербальной и зрительной памяти, замедленность мышления, невозможность выполнения привычных обязанностей, трудности в повседневной деятельности. Со слов ухаживающего лица, вышеуказанные нарушения отмечаются в течение 5 лет. Длительно страдает артериальной гипертензией с кризовым течением, ишемической болезнью сердца, сахарным диабетом, имеет признаки общего и церебрального атеросклероза по данным ультразвуковых методов диагностики.
При неврологическом обследовании выявлен псевдобульбарный синдром, двусторонний пирамидный синдром, экстрапирамидные нарушения с изменением мышечного тонуса по пластическому типу, нарушение ходьбы по типу диспраксии, зрительно-пространственные нарушения. При нейропсихологическом исследовании по шкале MMSE - 13 баллов, батарее тестов для оценки лобной дисфункции - 7 баллов, тесту рисования часов - 6 баллов (нарушение порядка расположения цифр на циферблате, стрелок на готовом циферблате), по тесту 5 слов - непосредственное воспроизведение - 2, отсроченное - 0 баллов, время выполнения теста ТМТ, часть «В» - 300 сек. Степень тяжести деменции по шкале CDR соответствовала 3 баллам. При исследовании цереброспинальной жидкости: уровень аβ-42 амилоидного белка - 224 пг/мл, тау-протеина - 1080 пг/мл.
Для определения варианта деменции решаются задачи по формулам ЛДФ, подставляются значения признаков, включенных в модель, полученных при обследовании конкретного больного, и производится решение уравнений:
ЛДФ1=-114,4+10,7×1+6,3×7+(-2,1×0)+10,1×6+0,162×300+28,9×3+0,013×224+0,002×1080=142,3;
ЛДФ2=-129,4+13,6×1+5,8×7+(-0,46×0)+10,4×6+0,181×300+30,3×3+0,033×224+0,0003×1080=139,7;
ЛДФ3=-146,7+13,9×1+7,0×7+(-1,8×4)+11,4×6+0,183×300+32,9×3+0,008×224+0,003×1080=144,0.
Из дифференциальной задачи видно, что ЛДФ3>ЛДФ1 и ЛДФ2, что позволяет предполагать у пациента смешанную деменцию.
Для подтверждения диагноза выполнена ПЭТ с 18-ФДГ. Определяются признаки диффузного церебрального гипометаболизма в глубинных отделах лобных и теменных долей, снижения накопления радиофармпрепарата в проекции медио-базальных отделов височных долей. Выявленные признаки характерны для смешанной (сосудисто-нейродегенеративной) деменции.
Таким образом, отнесенный с помощью математической модели к третьей группе (со смешанной деменцией) пациент имел схожий клинический диагноз, подтвержденный при помощи ПЭТ с 18-ФДГ.

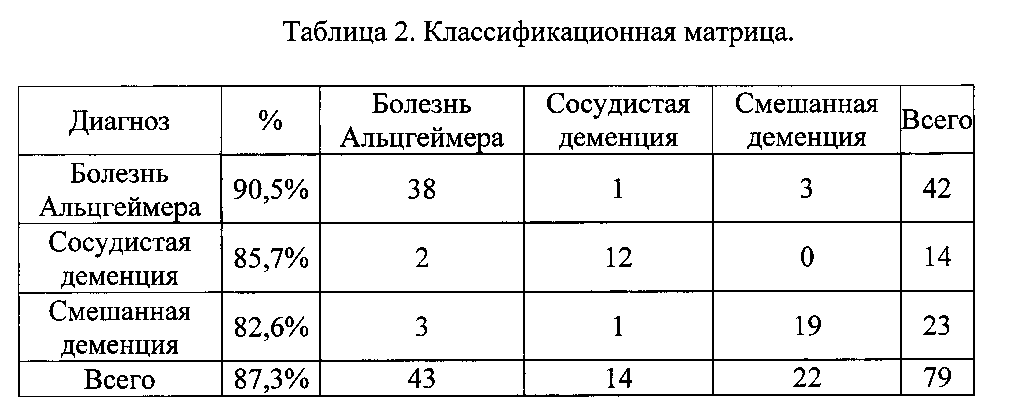
По строкам: классификация соответственно базе данных.
По столбцам: классификация соответственно прогнозу.
Способ дифференциальной диагностики болезни Альцгеймера, сосудистой и смешанной деменции на основании клинико-нейропсихологических и ликворологических данных, причем в ликворе определяют уровень амилоидного белка аβ-42 (Х7, пг/мл) и уровень общего тау-протеина (Х8, пг/мл), отличающийся тем, что дополнительно определяют наличие атеросклероза (X1), оценивая 1 баллом - наличие, 0 - отсутствие атеросклероза; нейропсихологические данные оценивают по тестам «Батарея тестов для оценки лобной дисфункции», определяя общий балл (Х2), «5 слов», определяя отсроченное воспроизведение (Х3, балл), «рисования часов», определяя общий балл (Х4), «тест слежения», определяя время выполнения в части «В» (Х5, с), «клиническая рейтинговая шкала деменции», определяя степень тяжести деменции (Х6, балл), и рассчитывают линейно-дискриминантные функции (ЛДФ) по формулам:ЛДФ1=-114,4+10,7×Х1+6,3×Х2+(-2,1×Х3)+10,1×Х4+0,162×Х5+28,9×Х6+0,013×Х7+0,002×Х8;ЛДФ2=-129,4+13,6×Х1+5,8×Х2+(-0,46×Х3)+10,4×Х4+0,181×Х5+30,3×Х6+0,033×Х7+0,0003×Х8;ЛДФ3=-146,7+13,9×Х1+7,0×Х2+(-1,8×Х3)+11,4×Х4+0,183×Х5+32,9×Х6+0,008×Х7+0,003×Х8; и при ЛДФ1>ЛДФ2, ЛДФ3 у больных диагностируют болезнь Альцгеймера; при ЛДФ2>ЛДФ1, ЛДФ3 у больных диагностируют сосудистую деменцию; при ЛДФ3>ЛДФ1, ЛДФ2 у больных диагностируют смешанную деменцию.
