Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ МОНОКЛОНАЛЬНОЙ ЛИНИИ РАСТИТЕЛЬНЫХ КЛЕТОК
Вид РИД
Изобретение
Настоящее изобретение относится к области биотехнологии растений. В частности, настоящее изобретение относится к получению нативной (дикий тип) или трансгенной моноклональной линии растительных клеток из гетерогенной популяции растительных клеток посредством проточно-цитометрического сортинга. Как будет очевидно специалисту, настоящее изобретение также включает применение моноклональной линии растительных клеток для регенерации целых плодоносящих растений.
В течение прошедших десятилетий огромные усилия были посвящены разработке и культивированию основанных на растениях систем для накопления и получения нативных или гетерологичных белков и вторичных метаболитов. Литература предоставляет обширное количество фактологического материала, который доказывает практическую ценность основанных на растениях систем для получения большого разнообразия желаемых веществ, которые или секретированы в культуральную среду, или выделены из продуцирующих клеток, тканей, органелл или даже целых растений или их частей. Подобно этому существует широкий спектр протоколов трансформации, которые обеспечивают разработку или стабильно, или транзиентно трансформированного растительного материала. Однако все еще существует потребность в надежной, стоимостно-эффективной и быстрой технологии для получения высоких выходов желаемого продукта из растительных клеток.
Неоднократно сообщалось, что трансформация популяции растительных клеток, такой как суспензионная растительная культура, часто приводит к образованию трансгенных культур, которые демонстрируют клетки с высокогетерогенными (смешанными) и несогласующимися уровнями экспрессии требуемого белка, относящимися к смеси эпигенетически различных клеток в составе первичной гетерогенной популяции клеток. В рамках рекомбинантных клеточных линий гетерогенность в экспрессии трансгена демонстрирует серьезную проблему с точки зрения скоростей продукции.
Главная проблема состоит в том, что высокопродуцирующие клоны зачастую являются редкими событиями в рамках метода трансформации, и разработка гомогенной высокопроизводительной клеточной линии занимает много времени. Поэтому постоянно существующей технической задачей является получение элитного трансгенного события и регенерация из недавно транформированной или уже трансгенной культуры растений.
Для проточного цитометрического сортинга, такого как, например, устройство FACS, единичные сферические клетки должны быть получены из обычно агрегированной популяции растительных клеток или культуры посредством ферментативного расщепления клеток, чтобы выделить протопласты. Для большинства видов растений, однако, регенерации единичных протопластов препятствует необходимость поддерживать популяцию в определенных плотностях.
Надежный и воспроизводимый способ для регенерации единичной трансгенной клетки/протопласта или для регенерации из нее целого плодоносящего растения (особенно после проточно-цитометрического сортинга) не был до настоящего времени описан.
Настоящее изобретение, таким образом, прежде всего относится к разработке основанной на растениях системы для получения высоких уровней желаемых нативных или рекомбинантных продуктов, в которой применяется нетрансформированная или трансгенная моноклональная линия растительных клеток, полученная от гетерогенной (смешанной) популяции растительных клеток, таких как суспензионная культура, и преодолевает проблемы предшествующего уровня техники, в частности, относительно быстрого разделения и последующей регенерации единичных (трансгенных) протопластов до образования микроколонии, которая может быть применена для получения моноклональной линии растительных клеток, которая предпочтительно способна к образованию и накоплению высоких количеств желаемого продукта. Специалисту ясно, что настоящее изобретение, кроме того, позволяет создавать целые плодоносящие растения, восстановленные из разработанной моноклональной линии растительных клеток.
Вопреки многим в настоящее время применяемым и разработанным системам, которые основаны на применении интактных растений или, по меньшей мере, интактной и дифференцированной растительной ткани, применение суспензионных клеток имеет преимущество в том, что гомогенный материал может быть воспроизведен в контролируемых, асептических и закрытых условиях.
В настоящее время существуют две основные стратегии получения рекомбинантных белков в растениях, а именно (i) получение стабильно трансгенных растений или суспензионных клеточных линий, или (ii) транзиентная экспрессия гетерологичного гена(ов) после инфицирования растительных экспрессионных хозяев (растений, тканей или клеток) бактериями (например, агробактерией), вирусами (например, вирусом табачной мозаики, картофельным вирусом X/Y, вирусом мозаики Cowpea и многими другими), или комбинация обоих (например, магнифекция), чтобы позволить хозяину экспрессировать гетерологичную генетическую информацию (ДНК или РНК). Альтернативно и, как известно в области техники, генетическая информация может также быть внедрена в экспрессионного растительного хозяина посредством разработанных механических способов, таких как, например, электропорация или лазерная перфорация.
Хотя настоящее изобретение предпочтительно относится к применению стабильно трансформированного материала растительных клеток, системы для транзиентной экспрессии, имеющие преимущество в скорости (время «от гена к продукту», срок внедрения, аварийное реагирование), также как в возможности достигать уровней накопления, которые сильно выше, чем те, которые могут, как правило, быть получены на стабильно трансформированных растениях или их частях, таких как клетки, могут быть также включены в способ согласно настоящему изобретению.
Согласно настоящему изобретению разработан способ получения нативной (дикий тип, нетрансформированный) или трансгенной моноклональной линии растительных клеток из гетерогенной популяции растительных клеток. Способ включает, во-первых, получение вышеуказанной популяции растительных клеток, такой как, например, суспензионные клетки растения, образующие исходный материал растительных клеток, который подвергают дальнейшим шагам, охваченных способом согласно настоящему изобретению. Обычно этот растительный клеточный материал может легко быть получен из, например, гетерогенной суспензионной растительной культуры, которую предпочтительно выращивают в контролируемых и/или асептических условиях. Исходные клетки могут быть (стабильно/транзиентно) трансформированными трансгенными клетками или клетками дикого типа (нативные, нетрансформированные), которые в состоянии продуцировать и накапливать желаемый продукт.
Поскольку в способе согласно настоящему изобретению применяют проточно-цитометрический сортинг, такой, например, как технология FACS для разделения или выделения единичных, т.е. индивидуальных протопластов, они должны быть получены из популяции растительных клеток так, как приводится выше, с применением материалов и способов, известных в области техники. Согласно предпочтительному варианту осуществления эти протопласты трансформированы и способны к (i) продукции флуоресцентного маркерного белка или полипептида, (ii) продукции желаемого продукта и/или (iii) выживанию в присутствии селектирующего вещества. Предпочтительными сортирующими критериями для проточно-цитометрического сортинга являются зернистость клетки как маркер для, например, качественных характеристик, таких как апоптоз и размер клетки. Предпочтительные критерии сортинга для FACS могут быть выбраны из группы, включающей генетический фон (например, плоидность, анеуплоидия), трансгеника мутантов, продукты генного обмена и флуоресценция (например, автофлуоресценция (хлоропласты, метаболиты), флуоресцентные белки или фермент-опосредованная флуоресценция). Нужно понимать, что применение селектирующего вещества не является обязательным. Таким образом, протопласт необязательно должен быть трансформирован последовательностью нуклеиновой кислоты, придающей подходящую устойчивость.
После разделения или выделения единичных (трансформированных) протопластов посредством проточно-цитометрического сортинга, такого как, например, FACS, каждый единичный трансформированный протопласт регенерируют до образования микроколонии (микрокаллюса) посредством совместного культивирования в присутствии фидерного клеточного материала. Происхождение исходного растения не ограничено, но сводится к тем линиям, сортам и видам, протопласты которых имеют потенциал к регенерации до образования микроколонии или микрокаллюса. Настоящее изобретение, таким образом, применимо ко всем сортам и видам растений, для которых протокол регенерации разработан или будет разработан в будущем. Ввиду аспекта настоящего изобретения относительно дальнейшей регенерации моноклональной микроколонии или линии растительных клеток в целые плодоносящие растения, нужно понимать, что этот аспект может быть выполнен со всеми сортами и видами растений, для которых протокол регенерации разработан или будет разработан в будущем.
Впоследствии микроколонию отделяют или выделяют из фидерного клеточного материала и культивируют до образования моноклональной линии растительных клеток.
Согласно предпочтительному варианту осуществления следующая стадия, входящая в состав способа по настоящему изобретению, таким образом, относится к генерации моноклональной ткани моноклонального каллюса посредством (i) переноса микроколонии или микрокаллюса на твердую среду культивирования и (ii) культивирования микроколонии или микрокаллюса в присутствии, по меньшей мере, одного селектирующего вещества до образования трансгенной ткани каллюса, из которой может быть разработана трансгенная моноклональная линия растительных клеток посредством переноса ткани каллюса в жидкую среду культивирования. Как будет оценено специалистом, микроколония может также быть удалена или отделена от материала фидерных клеток механическими способами, такими как, например, отбор клонов. В этом случае никакое селектирующее вещество не является обязательным и клетки, составляющие микроколонию, не должны проявлять устойчивость к какому-либо селектирующему веществу.
Согласно предпочтительному варианту осуществления клетки составляющие гетерогенную популяцию растительных клеток, представляют собой нативные (например, дикий тип) или нетрансгенные клетки, которые, прежде чем быть подвергнуты проточно-цитометрическому сортингу, стабильно или транзиентно трансформируются, по меньшей мере, одним вектором экспрессии, включающим, по меньшей мере, одну гетерологичную последовательность нуклеиновой кислоты, функционально связанную с функциональным промотором, в котором, как выше указано, по меньшей мере, одна гетерологичная последовательность нуклеиновой кислоты кодирует желаемый продукт. Согласно дополнительному варианту осуществления, по меньшей мере, один вектор экспрессии включает, по меньшей мере, две гетерологичные последовательности нуклеиновой кислоты, функционально связанные с (a) функциональным промотором(ами), в котором, как выше указано, по меньшей мере, две гетерологичные последовательности нуклеиновой кислоты кодируют флуоресцентный маркерный белок или полипептид и устойчивость против селектирующего вещества или желаемый продукт. При желании клетки могут дополнительно включать гетерологичную последовательность нуклеиновой кислоты, которая кодирует желаемый продукт, который будет накоплен в трансгенной моноклональной линии растительных клеток, как предусмотрено в настоящем изобретении.
Термин «гетерологичный», как применено в настоящем описании, указывает на то, что ген/последовательность рассматриваемых нуклеотидов внедряют в растительные клетки путем генной инженерии, т.е. путем человеческого вмешательства. Гетерологичная последовательность нуклеотидов может включать кодирующую последовательность для рекомбинантного белка, состоящего из рекомбинантной части, которая может быть образована, например, частично белком растения, который может быть присоединен к нерастительному белку, который можно назвать гибридным растительным-нерастительным белком в целях настоящего изобретения. Альтернативно, рекомбинантный белок может быть таким, который образован из рекомбинантных частей, которые имеют нерастительное происхождение. Гетерологичный ген может усиливать экспрессию белка, представляющего интерес, от эндогенного эквивалентного гена, т.е. того, который обычно выполняет ту же самую или подобную функцию, или вставленная последовательность может быть дополнительной к эндогенному гену или другой последовательности. Нуклеиновая кислота, гетерологичная по отношению к клетке, может быть невстречающейся естественным образом в культивируемом типе клетки, сорте или виде. Таким образом, гетерологичная нуклеиновая кислота может включать кодирующую последовательность от или происходящую от специфического типа организма, такого, как вид растений или млекопитающих, например, вид человека, овцы, быка, лошади или свиньи, помещенную в контекст культивируемой клетки, такой как клетка BY2, происходящая от табака. Дополнительная возможность заключается во внедрении последовательности нуклеиновой кислоты в культивируемую клетку-мишень, в которой она или гомолог присутствует естественным образом, но в которой последовательность нуклеиновой кислоты связана и/или является смежной с нуклеиновой кислотой, которая не встречается естественным образом в этой клетке или клетках такого типа или видах или сортах растения, такие как функционально связанные с одной или более регулирующими последовательностями, такими как последовательность промотора, для контроля экспрессии. Кроме того, синтетические (искусственные) последовательности нуклеиновой кислоты могут быть также применены.
Определение «вектор» включает, среди прочего, любую плазмиду, космиду, бактериофаг или вирусный вектор в двойной или одноцепочечной линейной или замкнутой форме, которая может или не может быть самопередающейся или мобилизируемой и которая может трансформировать прокариотического или эукариотического хозяина и существовать внехромосомным образом (например, автономная реплицирующаяся плазмида с точкой начала репликации). В частности, включены шаттл-векторы, под которыми подразумевается ДНК вектор, способный, естественным путем или посредством дизайна, к репликации в двух различных организмах хозяев, которые могут быть выбраны из актиномицетов и родственных видов, бактерий и эукариотических клеток (например, высших растений, мхов, млекопитающих, дрожжей или грибов).
«Вектор экспрессии» относится к вектору, в котором нуклеиновая кислота находится под контролем и функционально связана с подходящим промотором или другими регуляторными элементами для транскрипции в клетке-хозяине, такой как микробная или растительная клетка. Вектор может быть бифункциональным вектором экспрессии, который функционирует в многочисленных хозяевах. В случае геномной или субгеномной ДНК он может включать свой собственный промотор или другие регуляторные элементы, и в случае кДНК он может находиться под контролем подходящего промотора или других регуляторных элементов для экспрессии в клетке-хозяине.
«Промотор» представляет собой последовательность нуклеотидов, от которой может быть инициирована транскрипция ДНК, которая функционально присоединена по ходу транскрипции (т.е. в 3' направлении на кодирующей цепи двухцепочечной ДНК).
«Функционально связанный» означает присоединенный как часть той же самой молекулы нуклеиновой кислоты, помещенной и ориентированной соответственно требованиям, чтобы транскрипция была инициирована от промотора.
Термин «индуцибельный» в применении к промотору хорошо понимается специалистами в области техники. По существу, экспрессия под контролем индуцибельного промотора «включается» или возрастает в ответ на приложенный стимул. Характер стимула варьирует между промоторами. Некоторые индуцибельные промоторы обусловливают малые или неопределяемые уровни экспрессии (или отсутствие экспрессии) в отсутствие подходящего стимула. Другие индуцибельные промоторы обусловливают заметную конститутивную экспрессию в отсутствие стимула. Независимо от уровня экспрессии в отсутствие стимула экспрессия под любым индуцибельным промотором повышается в присутствии правильного стимула.
Настоящее изобретение также охватывает применение разновидности любой из этих последовательностей. Вариантный белок имеет гомологию с или идентичен со всеми или частью последовательностей, рассмотренных выше.
Для экспрессии рекомбинантных белков суспензию рекомбинантных агробактерий или вирусов (векторы), содержащую генетическую информацию о белке, представляющем интерес, применяют к суспензии растительных клеток, указанных выше, способом, известным в области техники. Вектор заражает растительные клетки и передает генетическую информацию. Предпочтительно материал растительных клеток, который будет трансформирован, применять в высокой плотности с только небольшими количествами среды, присутствующей так, чтобы суспензия вектора могла быть применена только путем капания или разбрызгивания. Этот предпочтительный вариант осуществления трансформации имеет несколько практических преимуществ относительно манипуляции, автоматизации, масштабирования, выработки и удаления отходов. В альтернативе, известные способы, такие как бомбардировка частицами, электропорация и т.п., могут быть применены, как известно в области техники.
Подходящие промоторы включают промотор вируса мозаики цветной капусты 35S (CaMV 35S). Промотор может быть выбран так, чтобы он включал один или более фрагментов последовательности или элементы, придающие связанный с развитием и/или тканеспецифичный регуляторный контроль экспрессии.
Как уже указано, по меньшей мере, один селектируемый генетический маркер, который может быть желаемым для продукции, может быть включен в конструкцию или быть представлен во второй конструкции, такой как те, которые придают селетируемые фенотипы, такие как устойчивость к антибиотикам или гербицидам (включающим, но не ограниченным ими, например, канамицин, гигромицин, фосфинотрицин, хлорсульфурон, метотрексат, гентамицин, спектиномицин, имидазолиноны и глифосат).
Альтернативно, клетки растительной суспензии, примененные для получения протопластов, также могут быть получены из уже трансгенной гетерогенной суспензионной растительной культуры, включающей трансгенные клетки.
(Трансгенную) моноклональную линию растительных клеток, полученную согласно настоящему изобретению, можно обрабатывать или культивировать в присутствии предшественников, стимуляторов, гормонов, стабилизаторов (например, совместимые растворенные вещества), ингибиторов, молекул интерферирующих РНК/малых интерферирующих РНК, сигнальных соединений, ферментов (например, пектиназ) и/или элиситоров в дополнение к или вместо векторной суспензии для получения рекомбинантных белков или метаболитов.
Согласно предпочтительному варианту осуществления желаемый продукт выбран из группы, состоящей из гетерологичных белков или полипептидов (например, препаратов крови, цитокинов, гормонов роста, терапевтических/диагностических/промышленных ферментов, вакцин, полноразмерных антител или различных производных антител), вторичных метаболитов (например, фенилпропаноидов, алкалоидов, терпеноидов, хинонов или стероидов) и маркеров для диагноза или анализа газообразных, твердых или жидких (химических) соединений и веществ.
Гены, представляющие интерес, включают такие кодируемые белки, которые самостоятельно являются естественными медикаментами, такими как фармацевтические препараты или ветеринарные продукты. Кроме того, гены, представляющие интерес, также включают любой другой рекомбинантный белок, такой как, например, технические ферменты, токсины или рекомбинантные белки, придающие новые агрономические входные и выходные признаки.
Гетерологичные нуклеиновые кислоты могут кодировать, среди прочего, гены бактериального, грибкового, растительного или нерастительного происхождения, такие как рекомбинантные белки, как указано выше в настоящем описании, или животного происхождения. Полученные полипептиды могут быть применены для получения полипептидов, которые могут быть очищены из них для применения где-либо еще. Белки, которые могут быть получены в способе по настоящему изобретению, включают гетеродимеры, такие как фолликулостимулирующий гормон гипофиза, иммуноглобулины, рекомбинантные антитела и одноцепочечные антитела. Кроме того, вышеуказанные гены могут быть изменены так, чтобы получить белки с измененными характеристиками, такими как модифицированная структура гликана. Однако настоящее изобретение также позволяет применять синтетические гены, такие как искусственные последовательности, которые как таковые не существуют в природе.
Такие белки включают, но не ограничены ими, белки ретинобластомы, p53, ангиостатин и лептин. Таким же образом способы по настоящему изобретению могут быть применены для получения регуляторных белков млекопитающих. Другие последовательности, представляющие интерес, включают белки, гормоны, такие как фолликулостимулирующий гормон, факторы роста, цитокины, сывороточный альбумин, гемоглобин, коллаген, тауматин, тауматин-подобные белки, эпидермальные факторы роста, такие как фактор роста эндотелия сосудов и т.д.
Как будет оценено специалистом, настоящее изобретение позволяет получать большое разнообразие белков и полипептидов, включающих (рекомбинантные) белки фармацевтической пригодности (такие как, например, вакцины, антитела, терапевтические ферменты, аллергены и гипоаллергены, противомикробные пептиды, структурные белки, такие как эластин и коллаген для применения в качестве биологически совместимых материалов покрытия, вирусоподобные частицы, белковые тела и т.д.), (рекомбинантные) белки пищевой ценности (пища и пищевые добавки), (рекомбинантные) белки для диагностических применений (такие как, например, ферменты, антитела и сконструированные антитела, другие ферментные или флуоресцентные рекомбинантные белки, антигены, которые будут применены как позитивный контроль, связывающие лиганды для белкового микроматричного анализа), (рекомбинантные) белки технической пригодности (такие как, например, связывающие лиганды для афинных сорбентов, ферменты большого значения, биокатализаторы) и рекомбинантные белки, улучшающие агрономические входящие или выходящие признаки.
В целом, гетерологичные нуклеиновые кислоты могут быть эксперссированы любым адекватным способом, применимым в области техники, или они могут быть транскрибированы или экспрессированы следующим образом:
(i) транзиентная экспрессия 'голой' ДНК, например, включающей промотор, функционально связанный с гетерологической последовательностью, представляющей интерес,
(ii) экспрессия с вектора экспрессии, такого как реплицируемый вектор. В целом, специалисты в области техники хорошо умеют создавать векторы и разрабатывать протоколы для транзиентной рекомбинантной экспрессии генов. Подходящие векторы могут быть выбраны или созданы, включая подходящие регуляторные последовательности, включая последовательности промотора, фрагменты терминатора, последовательности полиаденилирования, последовательности энхансера, маркерные гены и другие последовательности по необходимости. Для получения дальнейшей информации см., например, Molecular Cloning: a Laboratory Manual: 2-е издание, Sambrook et al, l989, Cold Spring Harbor Laboratory Press или Current Protocols in Molecular Biology, 2-е издание, Ausubel et al. Edc., John Wiley & Sons, 1992,
(iii) экспрессия c неинтегрируемого вектора.
Будет понятно, что эти категории не являются взаимоисключающими, поскольку, например, вектор неинтегрируемый может также быть вектором экспрессии и т.д.
Как будет оценено специалистом, по меньшей мере, две гетерологичные последовательности нуклеиновой кислоты, кодирующей флуоресцентный белковый маркер, или полипептид, или фермент, продуцирующий флуоресцентную молекулу и гетерологичный белок, представляющий интерес (желаемый продукт), могут быть представлены или (i) в полицистронной конфигурации, составленной единичной кассетой экспрессии на том же самом векторе, (ii) в тандемной конфигурации, по меньшей мере, с двумя различными кассетами экспрессии в том же самом векторе или (iii) по меньшей мере, в двух различных кассетах экспрессии на различных векторах, в которых тандемная конфигурация предпочтительна.
Согласно дополнительному аспекту настоящее изобретение, таким образом, также обеспечивает способ получения, по меньшей мере, одного желаемого продукта, предпочтительно выбранного из группы, состоящей из гетерологичных белков или полипептидов, вторичных метаболитов и маркерных генов. Способ включает применение (трансгенной) моноклональной линии растительных клеток, как разработано согласно настоящему изобретению для получения и накопления, по меньшей мере, одного желаемого продукта, который впоследствии получают или выделяют из продуцирующих клеток или из среды культивирования.
Таким образом, в одном аспекте настоящего изобретения раскрыто применение предпочтительно стабильно трансформированной моноклональной линии растительных клеток, дополнительно способной к производству мРНК, кодирующей желаемый продукт, такой как гетерологичный требуемый белок, произведенный транскрипцией с внедренной конструкции нуклеиновой кислоты, включая требуемую нуклеотидную последовательность, функционально связанную с промотором.
«Внедренная нуклеиновая кислота» будет, таким образом, включать гетерологичную последовательность нуклеиновой кислоты, как последовательность ДНК, представленную в форме конструкции, которая способна давать начало выработке и накоплению желаемого продукта.
Таким образом, в предпочтительном аспекте настоящего изобретения раскрыт способ достижения стабильной экспрессии гетерологичной нуклеотидной последовательности в моноклональной линии растительных клеток, способ, который включает стадию стабильного внедрения в клетку-мишень, по меньшей мере, первой последовательности нуклеиновой кислоты, включающей гетерологичную нуклеотидную последовательность, кодирующую желаемый продукт.
В одном варианте осуществления представлен способ получения, по меньшей мере, внеклеточного гетерологичного белка, способ, который включает стадии:
(i) стабильное внедрение в клетку-мишень, составляющую стартовую популяцию растительных клеток, первой нуклеиновой кислоты, включающей нуклеотидную последовательность, кодирующую гетерологичный белок или желаемый продукт;
(ii) получение протопластов из суспензионных клеток, полученных из указанной суспензионной растительной культуры, в которой протопласты дополнительно трансформированы и способны к (i) продукции флуоресцентного маркерного белка или полипептида и (ii) выживанию в присутствии селектирующего вещества;
(iii) разделение единичных трансформированных протопластов путем подвергания получения протопластов действию FACS;
(iv) регенерация выделенного единичного трансформированного протопласта до образования микроколонии или микрокаллюса посредством совместного культивирования в присутствии фидерного клеточного материала;
(v) производство моноклональной ткани каллюса посредством (i) переноса микроколонии или микрокаллюса на твердую среду культивирования и (ii) культивирования микроколонии или микрокаллюса в присутствии, по меньшей мере, одного селектирующего средства до образования трансгенной ткани каллюса;
(vi) разработка трансгенной моноклональной линии растительных клеток путем переноса ткани каллюса в жидкую среду культивирования и
(vii) инициация или позволение экспрессии с нуклеиновой кислоты гетерологичного белка или желаемого продукта посредством создания адекватных условий культивирования и
(viii) сбор накопленного гетерологичного белка или желаемого продукта от производящих клеток.
Выделение может быть осуществлено при помощи полностью рутинных способов и может подразумевать или не подразумевать частичную или полную очистку.
Естественно, специалист в области техники одобрит, что более чем один ген может быть применен в этой или каждой конструкции. Многочисленные векторы (каждый, включая одну или более нуклеотидных последовательностей, кодирующих гетерологичный белок выбора) могут быть внедрены в клетки-мишени, как приведено в настоящем описании или в другом месте. Это может быть полезно для получения, например, множественных субъединиц, например, фермента.
Флуоресцентный маркерный белок или полипептид может представлять собой любой белок, детектируемый посредством флуоресценции, такой как глюкоронидаза, флуоресцентные белки, такие как GFP или DsRed, люцифераза и т.д. Предпочтительно, чтобы репортер был неразрушающим маркером, таким как DsRed или GFP.
Согласно дополнительному аспекту настоящее изобретение описывает способ идентификации и выделения более высокоэкспрессирующих локусов вставки посредством сортинга клеток, включающего стадии трансформации клеток (например, как описано в Примере 1B ниже), например, конструкцией, содержащей флуоресцентный белок 1, и идентификации и выделения единичных высокопроизводящих флуоресцентный белок 1 клеток посредством FACS, включая регенерацию в микроколонию и суспензионную культуру и генный обмен, например, с флуоресцентным белком 2, и идентификацию и выделение редких продуктов генного обмена.
Настоящее изобретение будет далее дополнительно описано при помощи следующих неограничивающих иллюстраций и примеров. В свете этих вариантов другие варианты осуществления настоящего изобретения будут очевидны специалистам в области техники.
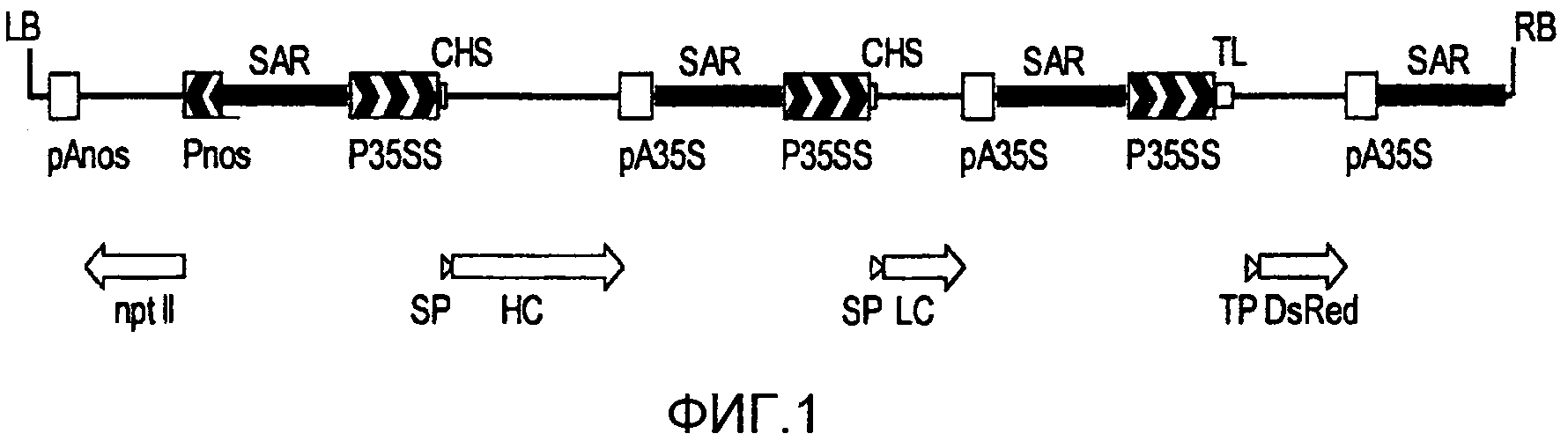
Фигура 1 представляет собой схематическое изображение, иллюстрирующее структуру кассеты экспрессии, примененной для получения трансгенной линии MTED BY-2, как приведено в настоящем описании. В частности, чертеж иллюстрирует T-ДНК растительного вектора экспрессии pTRAkc::MTED, примененного для трансформации суспензионных клеток BY-2.
LB и RB: левая и правая граница T-ДНК; Pnos и pAnos: промотор и терминатор гена нопалиновой синтазы; nptII: кодирующая последовательность гена неомицин-фосфотрансферазы; SAR: последовательности связывания с ядерным матриксом; p35SS и pA35S: промотор с дуплицированным энхансером и терминатор гена вируса мозаики цветной капусты (CaMV) 35S; CHS: 5'-нетранслируемая область хальконовой синтазы из Petroselinum crispum; SP: сигнальный пептид; HC и LC: кодирующая последовательность тяжелой и легкой цепи антитела M12; TL: 5'-нетранслируемая область вируса гравировки табака (TEV); TP: переходный пептид; DsRed: кодирующая последовательность красного флуоресцентного белка из вида Discosoma.
Примеры
Пример 1
Быстрое получение элитных моноклональных клеточных линий после события трансформации
A. Клеточная культура табака
Суспензионную культуру дикого вида из Nicotiana tabacum сорта Bright Yellow (BY-2) поддерживали в темноте в стерильных условиях в виде 50 мл аликвот в стеклянных Колбах ЭрленМейера на 100 мл при 26°C с постоянным орбитальным взбалтыванием 180 оборотов в минуту. Среда культивирования включала базальную среду MSMO (pH 5,8), дополненную сахарозой (3%, в/о) и 1 мг/л 2,4-дихлорфеноксиацетиловой кислоты. Пересев делали с интервалами в 7 дней посредством переноса 5% (о/о) клеток в 50 мл свежей среды.
Для получения протопластов суспензионную клеточную культуру пересевали путем переноса 2% (о/о) в 50 мл свежей среды.
B. Ускоренное получение трансгенных событий для последующего сортинга
Суспензионные клетки дикого типа BY-2 выращивали, как описано в секции A. Одновременно трансгенную агробактерию Agrobacterium tumefaciens, содержащую конструкцию, включающую несколько кассет экспрессии в одном и том же векторе (см. фигуру 1) культивировали в питательной среде YEB, содержащей подходящий антибиотик (0,5% питательного бульона, 0,1% дрожжевого экстракта, 0,5% пептона, 0,5% сахарозы, 2 мМ MgSO4, pH 7,4), на орбитальном шейкере при 160 оборотах в минуту и 27°C до OD600нм 1. Спустя три дня после культивирования 3 мл диких клетки типа BY-2, 200 нМ ацетосирингона и 150 мкл агробактерий (OD600нм=1) совместное культивировали в чашках Петри в темноте. После 3 дней совместного культивирования при комнатной температуре BY-2 клетки ресуспендировали в 10 мл питательной среды (для) BY-2, дополненной 200 мг/л цефотаксима. Клетки переносили в стерильную колбу на 50 мл и промывали дважды путем центрифугирования (850 г, 5 минут), чтобы удалить агробактерии. После ресуспендирования осадка клеточной культуры культивирование трансформированных клеток BY-2 происходит во встряхиваемых колбах на 100 мл с применением 20-50 мл питательной среды BY-2 с добавлением цефотаксима и подходящего селектрующего вещества (180 оборотов в минуту, 26°C). После регенерации нужной суспензии (объем осажденных клеток приблизительно 50-60%) клетки могут быть пересеяны для получения протопластов (см. секцию C). Этот способ требует 14-21 дней для получения трансгенной суспензионной культуры, которая может быть применена для последующего получения протопластов (C) и проточно-цитометрического сортинга (D).
C. Получение протопластов и регенерация клеточной оболочки
Активно растущие клеточные культуры применяли спустя 3 дня после пересева для седиментации осадка клеток путем центрифугирования при 850 г в течение 5 минут в стерильных конических пластмассовых центрифужных колбах. Надосадочную жидкость удаляли и клетки ресуспендировали в 10 мл раствора расщепления PNT (3,6 г/л базисной смеси солей Kao Michayluk (Duchefa), 0,4 М сахарозы, 0,5 мг/л NAA, 1 мг/л BAP) включая 1% (в/о) целлюлозу и 0,3% (в/о) мацерозима. Клеточно-ферментную суспензию помещали в 6-сантиметровые чашки Петри, запечатанные изоляционной лентой. Расщепление проводили в течение ночи (16-18 ч) при 26°C в темноте с небольшим взбалтыванием. Протопласты фильтровали через 100-мкм нейлонову сеть и затем добивались всплывания на поверхность во время центрифугирования (104 г в течение 8 минут). Осадок и среднюю поверхность раздела удаляли и протопласты промывали дважды раствором PNT. Протопласты ресуспендировали в растворе W5 (154 мМ NaCl, 125 мМ CaCl2, 5 мМ KCl, 5 мМ глюкозы, pH 5,6) и осаждали посредством центрифугирования при 76 г в течение 2 мин. Протопласты культивировали в модифицированной питательной среде регенерации 8p2c (см. таблицу 1 ниже; оптимизирована из питательной среды 8p) после осторожной ресуспензии. Обычно результатом описанной процедуры являлись 7x105 протопластов в мл со средним процентом жизнеспособных протопластов 74%.
Протопласты регенерировали в течение 3 дней при 26°C в темноте, чтобы инициировать регенерацию клеточной оболочки. Полученные в результате протопласты снова просеивали через 100-мкм нейлоновую сеть и затем переносили в стерильную пробирку введения образца для FAC сортинга. Единичные протопласты сортировали в отдельные лунки 96-луночного титрационного микропланшета, содержащего нетрансгенные фидерные клетки или протопласты дикого типа (см. секцию D).
Протопласты дикого типа BY-2, которые применяли как фидерные протопласты, были приспособлены приблизительно к 2x103 клеток/мл питательной среды 8p2c с применением счетной камеры Fuchs-Rosenthal. Пятьдесят микролитров этих протопластов переносили в отдельные лунки 96-луночного титрационного микропланшета так, чтобы приблизительно 100 фидерных протопластов дикого типа были перенесены в каждую лунку.
Таблица 1: Композиция питательнлой среды 8p2c (pH 5,6)
- Базисная смесь солей Kao und Michayluk (Duchefa)
- Kao и раствор витаминов Michayluk (Sigma)
0,02 мг/л p-аминобензойной кислоты
2 мг/л L-аскорбиновой кислоты
0,01 мг/л биотина
1 мг/л пантотената D-кальция
1 мг/л холинового хлорида
0,4 мг/л фолиевой кислоты
100 мг/л мио-инозитола
1 мг/л никотинамида
1 мг/л пиридоксина HCl
0,2 мг/л рибофлавина
1 мг/л тиамина HCl
0,01 мг/л витамина А
0,02 мг/л витамина B12
0,01 мг/л витамина D
- Органические кислоты (pH 5,5 с NH4OH)
20 мг/л натриевой соли пировиноградной кислоты
40 мг/л яблочной кислоты
40 мг/л лимонной кислоты
40 мг/л фумаровой кислоты
- Сахарные и сахарные спирты
0,25 г/л сахарозы
250 мг/л маннозы
68,4 г/л глюкозы
250 мг/л рамнозы
250 мг/л фруктозы
250 мг/л целлобиозы
250 мг/л рибозы
250 мг/л сорбита
250 мг/л ксилозы
250 мг/л маннитола
- Гормоны
0,2 мг/л 2-4-дихлорфеноксиуксусной кислоты
0,5 мг/л зеатина
1,0 мг/л NAA
- 2% (о/о) кокосовой воды
- 500 мг/л казаминовой кислоты
D. Проточный цитометрический анализ и сортинг
Прибор FACS Vantage (вариант DIVA, BD Bioscience) с 488 нМ/635 нМ аргоновым лазером применяли для сортинга трансгенных растительных протопластов. Проточную жидкость, фосфатно-буферный солевой раствор (pH 7,4 PBS), стерилизовали посредством автоклавирования и посредством фильтрования через 0,22 мкм фильтр. Перед сортингом пробирки для образцов очищали от остаточного этилового спирта посредством промывания проточной жидкостью. Параметры настройки системы/сортинга цитометра выверяли с применением коммерческих стандартных автофлуоресцентных частиц калибровки. Проточный сортер эксплуатировали при 488 нм с выходной мощностью лазера 175 мВт. Перед сортингом электронные сортировочные окна устанавливали на основании сигналов, полученных от прямого светорассеивателя, бокового светорассеивателя и флуоресценции образца культуры протопластов, чтобы определить популяцию с сильной флуоресценцией. Сигналы отображались в виде точечной диаграммы с применением программного обеспечения DIVA (BD Bioscience). Области для сортинга определяли путем создания границ, во-первых, вокруг популяции жизнеспособных протопластов и, во-вторых, на основе первых границ, вокруг популяции сильнофлуоресцирующих протопластов. Сортинг выполняли через 200 мкм - проточную канюлю с системным давлением канюли 4-6 фунт/кв.дюйм, частотой капель приблизительно 7 кГц и скоростью потока образца приблизительно 1000 событий/сек.
С применением описанных параметров сортинга достигали эффективности высева 20% (т.е. 20% лунок содержали интактные и жизнеспособные единичные отсортированные протопласты).
E. Регенерация единичных сортированных протопластов путем совместного культивирования с питающими/фидерными протопластами
Перед сортингом сильнофлуоресцирующих единичных протопластов каждую лунку 96-луночного микропланшета заполняли 50 мкл стерильной питательной среды регенерации 8p2c, содержащей приблизительно 100 протопластов дикого типа BY-2 сорта N. tabacum в качестве фидерных клеток. Единичные отсортированные трансгенные протопласты анализировали посредством инверсной флуоресцентной микроскопии в различные моменты времени, чтобы проверить отложение единичных клеток после процесса сортинга, а также контролировать пролиферацию и образование микроколонии трансгенных протопластов (спустя 14-20 дней после сортинга). Культивирование сортированных протопластов в 96-луночных планшетах проводили при 26°C-27°C в темноте, чашки закрывали стерильной крышкой и запечатывали изоляционной лентой.
Трансгенные микроколонии затем переносили на твердую питательную среду регенерации (0,8% (в/о) агар-агар), содержащую селективный маркерный антибиотик (например, канамицин). Таким образом, ткань микрокаллюса, включающая фидерные клетки в лунках, осторожно ресуспендировали посредством пипетирования и переносили с применением пипетки с широким концом кончика. Впоследствии лунки, а также перенесенные микрокаллюсы на твердой питательной среде регенерации анализировали посредством инверсной флуоресцентной микроскопии, чтобы проверить успешный перенос трансгенных и флуоресцентных микроколоний. При переносе трансгенные микрокаллюсы выращивали в течение 14-20 дней и переносили на свежую чашку, содержащую твердую среду регенерации, включающую селективный маркер. Ткань каллюса с размером приблизительно 2 см в диаметре применяли для получения суспензионных культур путем переноса клеточного материала в 5 мл питательной среды культивирования (описанной в секции A) в пластмассовые колбы для культивирования тканей на 50 мл. Эти колбы культивировали, как описано в секции А, пока клеточная суспензия не вырастала до объема осажденных клеток приблизительно 50-60% для переноса в стеклянные колбы ЭрленМейера на 100 мл. Культивирование трансгенной моноклональной суспензионные культуры осуществляли, как описано в секции A.
Описанная стратегия для фидерных клеток позволяет регенерацию приблизительно 50% первоначально сортированных интактных и жизнеспособных единичных протопластов (т.е. приблизительно 10% единичных протопластов, сортированных в лунки 96-луночного микропланшета, развившихся в микрокаллюс).
F. Проверка успешной элиминации выживания фидерных клеток во время регенерации отсортированных единичных протопластов
Разработали способ, который позволяет надежную регенерацию выбранных с помощью FACS единичных протопластов в моноклональные суспензионные культуры. Поскольку единичные протопласты были регенерированы после сортинга, фидерные клетки должны поддерживать регенерацию и пролиферацию сортированных единичных протопластов. Поскольку фидерные протопласты временно совместно культивируют с сортированными флуоресцентными требуемыми протопластами, нужно обязательно элиминировать выживание фидерных протопластов во время регенерации моноклональных культур.
Исследовали потенциальную контаминацию единично сортированных трансгенных и флуоресцентных клеток BY-2 фидерными протопластами. Трансгенные клетки трансформировали конструкцией, содержащей кассету экспрессии GFP-KDEL и селективный маркер AHAS (придающий устойчивость к имазетапиру). Единичные BY-2 протопласты, трансформированные этой конструкцией и включающей GFP, сортировали в 96-луночные планшеты, содержащие протопласты трансгенной клеточной линии, содержащей кассету экспрессии DsRed и селективного маркера nptII (придающего устойчивость к канамицину). Во втором эксперименте единичные протопласты BY-2, трансформированные кассетой экспрессии DsRed и селективного маркера nptII, сортировали в 96-луночные планшеты, содержащие протопласты трансгенной клеточной линии, продуцирующей GFP. После регенерации получившиеся в результате GFP- и DsRed- флуоресцентные культуры анализировали в отношении их устойчивости к имазетапиру или канамицину и их флуоресценции (зеленый против красного). Ткань каллюса от обоих подходов высевали на чашки в селективную питательную среду, содержащую или 1,5 мкМ имазетапира или 100 мг/л канамицина. Рост клеток оценивали визуально после 14 дней инкубации. Все протестированные каллюсы (всего 20) росли исключительно на средних чашках, содержащих их специфическое селективное вещество. Короче говоря, трансформированный GFP/AHAS каллюсы росли на имазетапире, но не на чашках, содержащих канамицин, тогда как трансформированный DsRed/канамицином каллюсы росли только на канамициновых чашках. Это наблюдение ясно продемонстрировало, что регенерированные трансгенные клеточные линии не были контаминированы соответствующей линией фидерных клеток. Потенциальную контаминацию фидерными клетками дополнительно оценивали посредством проточного цитометрического анализа. Регенерированные GFP и DsRed суспензионные культуры анализировали в отношении их оптических свойств, выявляемых посредством флуоресцентных белков GFP или DsRed соответственно. Это наблюдение ясно продемонстрировало, что регенерированные трансгенные клеточные линии не были контаминированы соответствующей линией фидерных клеток. Все протестированные культуры BY-2 проявляли исключительно ожидаемый тип флуоресценции. Культуры, полученные после сортинга клеток, трансформированных GFP, демонстрировали только зеленую флуоресценцию, в то время как культуры, продуцирующие DsRed, детектировали исключительно в красном канале флуоресценции. В случае контаминации фидерными клетками, ожидался бы сигнал флуоресценции в обоих каналах. Результат цитометрического анализа подтвердил эффективное удаление фидерных клеток на селективных чашках, как продемонстрировано прежде тестом на устойчивость.
G. Анализ моноклональных трансгенных суспензионных культур
Моноклональные суспензионные культуры сначала анализировали в отношении их процента высокофлуоресцирующих клеток. Поэтому протопласты получали так, как описано в секции C. Для проточно-цитометрического определения части флуоресцирующих протопластов применяли прибор FACS Calibur (BD Bioscience). На основании протопластов дикого типа BY-2 устанавливали параметры настройки (например, усиление света и усилителей рассеяния флуоресценции) и образцы измеряли. После установления границ жизнеспособной популяции распределение этой популяции применяли в канале флуоресценции, чтобы установить порог, который исключал все второстепенные сигналы, вызванные посредством автофлуоресценции дикого типа. Согласно этому порогу вычисляли процент флуоресцентных протопластов в пределах улучшенных культур протопластов, происходящих из единичного протопласта. Проточный цитометрический анализ моноклональных суспензионных культур, продуцирующих рекомбинантный белок DsRed, выявил гомогенно распределенные клетки схожей или сильной интенсивностей флуоресценции (узкие флуоресцентные пики). Результатом подсчета части клеток с DsRed флуоресценцией явились проценты, варьирующие между 78-88% сильнофлуоресцирующих клеток.
Уровни накопления рекомбинантного белка могут быть определены различными способами (например, иммуносорбентного ферментного анализа (ELISA)). Поэтому, клетки центрифугировали (850 г, 5 минут), ресуспендировали в 3-объемном буфере экстракции (PBS pH 6, 5мМ 2-меркаптоэтанол, 5 мМ EDTA, 10 мМ аскорбиновой кислоты) и блокировали при помощи обработки ультразвуком. Экстракт отделяли от клеточных остатков путем следующей стадии центрифугирования (20 минут, 16000 г) и применяли для анализа. Иммунологический анализ накопления антитела M12 в 5 dpi (точек на дюйм) клеточных экстрактов от суспензионных культур, трансформированных pTRAkc:MTED выявил до 118±20 мкг/г свежей массы (в 1,5 раз выше, чем при применении обычного способа получения, т.е. получения каллюса и скрининга).
Пример 2
Получение моноклональных клеточных линий из гетерогенной трансгенной суспензионной культуры
A. Клеточная культура табака
Трансгенную суспензионную культуру Nicotiana tabacum сорта Bright Yellow (BY-2) MTED#18, продуцирующую полноразмерное антитело человека IgG1 M12, задержанное в эндоплазматическом ретикулюме, и флуоресцентный белок DsRed, нацеленно помещенный в пластиды, поддерживали в темноте в стерильных условиях в виде 50 мл аликвот в стеклянных колбах ЭрленМейера на 100 мл при 26°C с постоянным орбитальным взбалтыванием 180 оборотов в минуту. Клетки дикого типа BY-2 выращивали в тех же условиях в качестве контроля. Среда культивирования включала основную среду MSMO с pH 5,8, дополненную сахарозой (3%, в/о) и 1 мг/л 2,4-дихлорфеноксиуксусной кислоты. Пересев делали с интервалом в 7 дней путем переноса 5% (о/о) клеток в 50 мл свежей среды.
Трансгенную суспензионную культуру получали путем агробактерио-опосредованной трансформаци клеток N. tabacum сорта BY-2 с последующей селекцией, основанной на антибиотике, и последующим разделением трансформированной ткани каллюса. Ткани каллюса скринировали согласно их продукции антитела посредством иммунологических анализов (Dotblot и ELISA), и самых лучших кандидатов применяли для получения суспензионной культуры (= клеточная линия MTED#18). Продукция специфического антитела M12 парентеральной культуры MTED#18 составляла 13 мг/г свежей клеточной массы (10 мг/л). Проточный цитометрический анализ показал, что трансгенная культура состоит из двух субпопуляций с только 24% жизнеспособной популяции, продуцирующей флуоресцентный маркерный белок DsRed.
Для получения протопластов клеточную суспензионную культуру пересевали путем переноса 2% (о/о) в 50 мл свежей среды.
B. Получение протопластов и регенерация клеточной оболочки
См. пример 1, секция C.
Обычно результатом описанного способа являлось 5x105 протопластов в мл со средним процентным содержанием 62,2 жизнеспособных трансгенных протопластов.
C. Проточный цитометрический анализ и сортинг
Настройки приборных параметров и предварительные подготовки делали, как описано в примере 1, секция D.
Единичные сильно флуоресцирующие растительные протопласты (1-2% от всех отсортированных протопластов) сортировали в устройство приема клеток (т.е. планшеты микротитратора) в режиме единичных клеток. Один протопласт на лунку, в соответствии со вторыми критериями установления границ, отсортировывали в 96-луночные планшеты, наполненные 50 мкл стерильной среды регенерации 8p2c, содержащий приблизительно 100 протопластов дикого типа в качестве фидеров. 96-луночные планшеты закрывали стерильной крышкой и запечатывали изоляционной лентой. Фактическое число регенерируемых протопластов определяли путем инверсионной флуоресцентной микроскопии. Результатом проточно-цитометрическиого сортинга протопластов в режиме единичных клеток являлась эффективность высева приблизительно 20% лунок, содержащих один интактный и жизнеспособный протопласт на лунку.
D. Регенерация отсортированных протопластов в низких плотностях
Регенерацию единичных сортированных протопластов выполняли, как описано в примере 1 секции E.
Результатом проточно-цитометрического сортинга высокофлуоресцирующих протопластов в режиме единичных клеток являлись приблизительно 20% лунок, содержащих только один отсортированный протопласт. 50% этих единичных протопластов начали пролиферацию и могли быть применены для получения суспензионных культур.
E. Анализ моноклональных трансгенных суспензионных культур
Чтобы определить процент флуоресцирующих протопластов в улучшенных суспензионных культурах, происходящих из единственного протопласта, применяли проточный цитометрический анализ, как описано ранее (эксперимент 1, секция D). Уровни накопления антитела M12 определяли путем иммуносорбентного ферментного анализа (ELISA). Таким образом, суспензионные клетки центрифугировали (850 г, 5 минут), ресуспендировали в 3-объемном буфере экстракции (PBS pH 6, 5 мМ 2-меркаптоэтанол, 5 мМ ЭДТА, 10 мМ аскорбиновой кислоты) и блокировали обработкой ультразвуком. Экстракт отделяли от клеточных остатков с помощью стадии центрифугирования (20 минут, 16000 г) и применяли для анализа. Благодаря выбранным настройкам (захват Fc и детекция LC) детектировали только полностью сформированные антитела.
После одного раунда FACS моноклональные суспензионные культуры продемонстрировали значительно улучшенные уровни накопления обоих рекомбинантных белков: 3,7-кратный обогащенный процент клеток с DsRed флуоресцией (90%) и 11-кратное увеличение антитела M12 (145 мг/г свежей массы или 9,3-кратное увеличение уровня на мг/л (93 мг/л)), когда сравнивали с парентеральной суспензионной культурой.
F. Повторное проведение улучшения суспензионной культуры
Чтобы дополнительно увеличить и стабилизировать рекомбинантную производительность белка трансгенных моноклональных суспензионных культур, могут быть повторены стадии B-E. Для получения протопластов и регенерации применяли те же самые условия сортинга, как описано ранее.
Результатом второго раунда сортинга являлось дальнейшее увеличение накопления антитела: 182 мкг/г свежей массы или 113 мг/л, что является 14-кратным и 11,3-кратным увеличением по сравнению с парентеральной культурой.
Результатом третьего раунда сортинга 2-го поколения наилучшим образом продуцирующих моноклонов являлось 3-е поколение моноклональных культур, продуцирующих схожие уровни накопления, указывающие на то, что максимальный уровень был достигнут.
G. Устойчивость элитных продуцирующих моноклональных культур с точки зрения целевого производства белка
Устойчивость полученных с помощью FACS моноклональных клеточных линий исследовали для примера для 3 моноклональных линий. Моноклональные клеточные линии пересевали в 7-дневном цикле (относится к примеру 1, секция A), в то время как оба рекомбинантных требуемых белка измеряли в 2-месячных интервалах всегда на 5 день после пересева. В течение 12-месячного периода было продемонстрировано для 1-го поколения моноклональных культур, что эти культуры все еще продуцируют высокое и стабильное количество антитела M12 на грамм свежей массы. Наблюдали только небольшие вариации в уровнях антитела в 2-месячных интервалах между отбором образцов (вызванные вариациями культивирования клеток).
Анализ 2-го поколения моноклонов подтвердил устойчивость клеточной линии посредством демонстрации схожих или немного увеличенных уровней накопления и рекомбинантных белков и антитела M12 и DsRed по сравнению с 1-м поколением моноклональной культуры, из которой они были получены. В целом, проанализированные моноклональные культуры 2-го поколения кажутся более стабильными с точки зрения выработки требуемого белка (меньше вариаций в 2-месячных интервалах между отбором образцов) по сравнению с 1-м поколением моноклональных культур. Во время 12-месячного периода было обнаружено, что две из трех проанализированных моноклональных культур были высоко стабильными в отношении процентного содержания в них DsRed-флуоресцирующих клеток в общей численности популяции, так же, как накопления антитела M12.